Біоактивні полімери
Номер патенту: 115581
Опубліковано: 27.11.2017
Автори: Нагл Міхаел, Віснер Крістоф, Бургманн Хайнц, Претч Алєксандер
Формула / Реферат
1. Продукт поліконденсації аміногуанідину і/або 1,3-діаміногуанідину із одним або декількома діамінами, тобто похідне полігуанідину наступної формули (І):
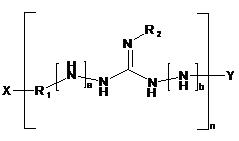 , (І)
, (І)
де
X вибирають із -NH2, аміногуанідину і 1,3-діаміногуанідину;
Y вибирають із -Н і -R1-NH2;
або X і Y разом перебувають в хімічному зв'язку, утворюючи циклічну структуру;
R1 вибирають із двовалентних органічних радикалів, які мають від 2 до 20 атомів вуглецю, у яких необов'язково один або декілька атомів вуглецю заміщені О або N;
а і b незалежно один від одного дорівнюють 0 або 1,
при цьому a+b¹2, якщо не містяться елементи 1,3-діаміногуанідину;
R2 вибирають із -Н і -NH2,
при цьому R2 являє собою -NH2, якщо а+b=0,
R2 являє собою -Н або -NH2, якщо а+b=1, і
R2 являє собою -Н, якщо а+b=2;
i n³2;
або солі зазначеної сполуки.
2. Похідне полігуанідину за п. 1, яке відрізняється тим, що R1 вибирають із алкіленових радикалів, у яких один або декілька атомів вуглецю необов'язково заміщені О або N.
3. Похідне полігуанідину за п. 2, яке відрізняється тим, що R1 вибирають із радикалів із наступними загальними формулами від (II) до (V):
![]() , (II)
, (II)
![]() , (III)
, (III)
![]() , (IV)
, (IV)
![]() , (V)
, (V)
де від Z1 до Z4 незалежно один від одного являють собою гетероатом, вибраний із О і N, а індекси із с по g незалежно один від одного являють собою таке ціле число від 1 до 12, що загальна кількість атомів радикала R1 не перевищує 20.
4. Похідне полігуанідину за п. 3, яке відрізняється тим, що усередині радикала R1 усі гетероатоми Z являють собою або О, або N.
5. Похідне полігуанідину за п. 4, яке відрізняється тим, що R1 являє собою двовалентний радикал простого поліефірдіаміну.
6. Похідне полігуанідину за одним із пп. 1-5, яке відрізняється тим, що n = від 2 до 6.
7. Похідне полігуанідину за одним із пп. 1-6, яке відрізняється тим, що воно являє собою сіль приєднання кислоти у формі гідрохлориду, гідроброміду, гідройодиду, сульфату, карбонату, борату, ціанату, тіоціанату, фосфату, мезилату, нітрату, ацетату, бензоату, лактату, тартрату, цитрату, малеату, фумарату або часткового складного ефіру зазначених кислот, якщо вони є дво- або більше функціональними, або сумішей двох або декількох даних солей і/або часткових складних ефірів.
8. Спосіб отримання похідного полігуанідину за одним із пп. 1-7 за допомогою поліконденсації похідного гуанідину або його солі із діаміном, який відрізняється тим, що аміногуанідин або 1,3-діаміногуанідин або його сіль приєднання кислоти піддають поліконденсації із щонайменше одним діаміном H2N-R-NH2 при нагріванні.
9. Спосіб за п. 8, який відрізняється тим, що щонайменше один діамін застосовують у надлишку від 3 до 5 мол. % відносно похідного гуанідину.
10. Спосіб за п. 8 або 9, який відрізняється тим, що сіль аміногуанідину або 1,3-діаміногуанідину разом із щонайменше одним діаміном спочатку нагрівають до першої, нижчої, температури, а потім до другої, вищої, температури.
11. Спосіб за п. 10, який відрізняється тим, що сіль аміногуанідину або 1,3-діаміногуанідину разом із щонайменше одним діаміном спочатку нагрівають до 110-130 °C, а потім до 160-180 °C.
12. Спосіб за п. 10 або 11, який відрізняється тим, що реакційну суміш від 1 до 3 годин витримують при першій температурі і від 1 до 8 годин при другій температурі.
13. Спосіб за одним із пп. від 8 до 12, який відрізняється тим, що отримане похідне полігуанідину очищають розчиненням у приблизно від 3 до 10-кратній кількості води.
14. Застосування похідного полігуанідину за будь-яким із пп. 1-7 в медичній і ветеринарній галузі для боротьби із бактеріальними, грибковими і вірусними інфекціями і їх наслідками як пестициду і засобу дезінфекції в аграрній галузі і навколишньому середовищі, в основному як засобу дезінфекції (біоциду) для зменшення кількості і знищення мікроорганізмів, як протипаразитарного засобу, як добавки для стабілізації (стерилізації) продуктів або також як аерозольної речовини в розчиненій формі для холодного/вологого розпилення, подрібнення і парової стерилізації.
15. Застосування за п. 14, яке відрізняється тим, що ефективна кількість похідного полігуанідину знаходиться у вигляді розчину у від 3- до 10-кратній кількості води.
Текст
Реферат: Винахід стосується нових продуктів поліконденсації аміногуанідину і/або 1,3-діаміногуанідину з одним або декількома діамінами, тобто похідних полігуанідину формули (І): де X вибирають із NH2, аміногуанідину і 1,3-діаміногуанідину; Y вибирають із -Н і -R1-NH2; або X і Y разом перебувають в хімічному зв'язку, утворюючи циклічну структуру; R1 вибирають із двовалентних органічних радикалів, які мають від 2 до 20 атомів вуглецю, у яких необов'язково один або декілька атомів вуглецю заміщені О або N; а і b незалежно один від одного дорівнюють 0 або 1, при цьому а+b2, якщо не містяться елементи 1,3-діаміногуанідину; R2 вибирають із -Н і -NH2, при цьому R2 являє собою -NH2, якщо a+b=0, R2 являє собою -Н або -NH2, якщо а+b=1 і R2 являє собою -Н, якщо а+b=2; і n2; або солі зазначеної сполуки; способу отримання, а також різних застосувань зазначених продуктів. UA 115581 C2 (12) UA 115581 C2 UA 115581 C2 Даний винахід стосується нових біоактивних полімерів, а також їх застосування як біоцидів. Рівень техніки Полігуанідин, який має наведену нижче загальну формулу, а також різні його похідні відомі вже давно. 5 10 . У патентній літературі вже в 1943 році в патенті US 2325586 описані кілька способів отримання різних полігуанідинів за допомогою поліконденсації і) гуанідину або його солей, ii) ціангалогеніду, iii) диціанаміду або iv) ізоцієніддигалогеніду із діаміном або v) двома диціандіамідами між собою (що дає ціанозаміщений полігуанідин), а також застосування в такий спосіб отриманих полігуанідинів як допоміжного засобу при фарбуванні: i) , ii) , 15 iii) , iv) , v) 20 25 30 35 . Як діаміни в реакціях із i) по iv) уже тоді розкривали як алкілен- і фенілендіаміни, так і оксіалкілендіаміни або діаміни простих поліефірів, які пізніше стали відомі як Jeffamine®. Десятиліттями пізніше такі полігуанідини почали використовувати як чудові біоциди. Група дослідників Oskar Schmidt у WO 99/54291 A1 розкриває отримання мікробіоцидів полігексаметиленгуанідинів, у WO 01/85676 A1 біоцидів полігуанідинів, які отримані конденсацією гуанідину із поліоксіалкіленами, і в WO 2006/047800 A1 діючих як біоциди, зокрема як фунгіциди похідних полігуанідину, які утворюються при поліконденсації гуанідину із сумішшю із алкілендіаміну і оксоалкілендіамін і повинні мати нижчу токсичність, ніж полімери, які містять тільки один із двох видів двовалентних радикалів R1. В WO 02/30877 A1 описаний схожий полігуанідин як засіб для дезінфекції, який додатково містить феніленові групи в ланцюзі. Група російських дослідників (Tets, Tets і Krasnov) у WO 2011/043690 A1, на основі якої були подані US 2011/0269936 A1 і EP 2520605 A1, розкривають біоциди полігуанідину наступної формули, які отримані поліконденсацією гуанідину і гексаметилендіаміну в присутності гідразингідрату: . Гідразин у ході поліконденсації, щонайменше формально, заміняє аміногрупу або тільки в одній, або в двох групах гуанідину, внаслідок чого повинні утворюватися блок-співполімери, у 1 UA 115581 C2 яких блоки полі(гексаметилен-гуанідин) чергуються з блоками полі(гексаметиленаміногуанідин) і обидва види блоків з'єднані один із одним через димери гуанідину, як показано нижче: 5 10 15 20 25 30 35 40 45 . Також дані полімери і їх солі приєднання кислоти повинні діяти як біоциди проти бактерій, вірусів і грибів. Однак, у прикладах даної заявки, у яких було отримано 7 різних полімерів, не було зазначено ніяких фізичних даних отриманих продуктів, крім зазначених у прикладі 1: "тверда, майже безбарвна, прозора речовина". Відносно можливої структури сполуки, яка може утворюватися під час поліконденсації гуанідину із діаміном, існує декілька статей дослідницької групи технічного університету міста Грац, наприклад, Albert et al., Biomacromolecules 4(6), 1811-1817 (2003), і Feiertag et al., Macromol. Rap. Comm. 24(9), 567-570 (2003). Додатково до різних можливостей формування лінійних полімерних ланцюгів із відповідних вихідних мономерів звичайно утворюються в не знехтувано малій кількості, яка, крім іншого, залежить від довжини ланцюга діаміну, також циклічні молекули наступної загальної формули: . Основні недоліки практично всіх описаних вище похідних полігуанідину полягають із одного боку в не знехтуваній токсичності даних продуктів, а також у випадку застосування високореакційноздатних компонентів, у відносно витратному способі отримання, а також у застосуванні проблематичних з токсикологічної точки зору компонентів, таких як гідразин, внаслідок чого метою даного винаходу є отримання нових, менш токсичних, але як і раніше ефективних як біоциди полігуанідинів якомога простішим і більш економічним способом, уникаючи згаданих вище недоліків. Розкриття винаходу Зазначеної мети в даному винаході досягають наданням нових продуктів поліконденсації аміногуанідину і/або 1,3-діаміногуанідину із одним або декількома діамінами, тобто похідних полігуанідину нижченаведеної формули (I): (I), де X вибирають із -NH2, аміногуанідину і 1,3-діаміногуанідину; Y вибирають із -H і -R1-NH2; або X і Y разом перебувають в хімічному зв'язку, утворюючи циклічну структуру; R1 вибирають із двовалентних органічних радикалів, які мають від 2 до 20 атомів вуглецю, у яких необов'язково один або декілька атомів вуглецю заміщені О або N; a і b незалежно один від одного дорівнюють 0 або 1, при цьому a+b 2, якщо не містяться елементи 1,3-діаміногуанідину; R2 вибирають із -H і -NH2, при цьому R2 являє собою -NH2, якщо a+b=0, R2 являє собою -H або -NH2, якщо a+b=1 і R2 являє собою -H, якщо a+b=2; і n≥2; або солей зазначеної сполуки. Нові похідні полігуанідину формули (I) в дослідженнях на активність показали себе як ефективні антимікробні речовини, які, однак, несподівано мають значно меншу токсичність, ніж полімери зі схожою структурою із процитованих вище документів WO 2011/043690 A1, US 2 UA 115581 C2 5 10 15 20 25 30 35 40 45 50 2011/0269936 A1 і EP 2520605 A1, що підтверджується наведеними пізніше прикладами здійснення даного винаходу і порівняльних прикладів. Без наміру обмежуватися однією теорією, винахідники припускають, що аміногрупи і групи діаміногуанідину краще сумісні із еукаріотичними клітинами людини, ніж групи гуанідину і зокрема, ніж ті полімери, які містять описані вище утворюючі гідразинові містки димерів гуанідину. Крім того, у способі, що розкривається, уникають застосування токсичного компонента гідразингідрату в процесі полімеризації, який у деяких полімерах, які відповідають рівню техніки, може міститися як залишковий мономер. Сполука вищезгаданої формули (I) представляє як продукт поліконденсації (моно)аміногуанідину, який далі позначається як MAG, так і продукт поліконденсації 1,3діаміногуанідину, який далі позначається як DAG. . Формула (I) пояснюється тим, що під час протікаючої із відщепленням аміаку поліконденсації, MAG- і DAG-радикали можуть брати участь у поліконденсації як своїми аміноабо таутомерними іміногрупами, так і своїми гідразо- (гідразиніл-)групами. Отже, як для MAG, так і для DAG як вихідні мономери існує три різні можливості вбудовування в ланцюг полімеру за винаходом. У випадку MAG у формулі (I) єдина гідразо-група, а у випадку DAG навпаки єдина іміно/аміно-група може бути спрямована праворуч, ліворуч або наверх. Це означає для MAG наступні параметри у формулі (I): a=1, b=0, R2 являє собою -H: гідразо-група спрямована ліворуч; a=0, b=1, R2 являє собою -H: гідразо-група спрямована праворуч; або a=0, b=0, R2 являє собою -NH2: гідразо-група спрямована наверх. Для DAG є наступні можливості комбінації параметрів: a=0, b=1, R2 являє собою -NH2: аміно-/іміно-група спрямована ліворуч; a=1, b=0, R2 являє собою -NH2: аміно-/іміно-група спрямована праворуч; або a=1, b=1, R2 являє собою -H: аміно-/іміно-група спрямована нагору. Не обмежуючись цим, NMR-спектри отриманих поліконденсатів, як описано пізніше для даного винаходу, підтверджують, що під час реакції поліконденсації майже завжди утворюються суміші деяких із трьох можливих орієнтацій, при цьому потрібно виходити з того (це з'ясувалося ще не на 100%), що навіть у межах одного ланцюга зустрічаються різні орієнтації того самого мономера. У зв'язку із вищезгаданим варто чітко вказати на те, що положення подвійного зв'язку C=Nгуанідинo-групи, також як і просторове положення R2 біля подвійного зв'язку, звичайно піддано впливу таутомерії. Це означає, що подвійний зв'язок гуанідину може знаходитися всередині ланцюга або зовні ланцюга і R2 може бути спрямований ліворуч або праворуч. Тому такі таутомери описаних вище продуктів поліконденсації формули (I) також повинні знаходитися в обсязі охорони даного винаходу. Вищезгадані варіанти для X і Y отримуються через різні можливості формування ланцюга залежно від того, чи застосовують MAG, DAG або суміш обох вихідних мономерів, включаючи можливість замикання циклу в циклічний продукт поліконденсації. Дивися також попередньо цитовані статті Albert et al. і Feiertag et al. Для кінцевих аміногуанідино- (MAG-) і 1,3діаміногуанідинo- (DAG-) груп існують звичайно такі ж можливості, як і для тих, які знаходяться всередині ланцюга, тобто з’єднання із ланцюгом може відбуватися через будь-який атом азоту. Радикал R1 відповідно до даного винаходу може являти собою лінійний, розгалужений або циклічний, насичений або ненасичений, двовалентний вуглеводневий радикал, який має від 2 до 20 атомів вуглецю, переважно від 4 до 18 атомів вуглецю, ще переважніше від 6 до 12 атомів вуглецю, у якому деякі атоми C можуть бути замінені O і/або N. Вищезгадані переваги виходили із наступних розумінь. При дуже короткому радикалі R 1 активні MAG- або DAG-групи знаходяться дуже близько одна біля одної, що може знизити активність полімеру, у випадку довгого радикала активні групи навпроти знаходяться занадто далеко один від одного. Тому радикали із більш 20 атомами хоча і можна принципово взяти до уваги, однак із економічної точки зору не виглядають переважними, тому що вони дають полімери формули (I), у яких на одиницю маси міститься відносно невелика кількість гуанідино-груп із протиінфекційною дією. 3 UA 115581 C2 Переважно радикал R1 вибирають із алкіленових радикалів, у яких необов'язково один або декілька атомів вуглецю замінені O або N, що підвищує гідрофільність ланцюга, ще переважніше вибирають із радикалів із наступними загальними формулами від (II) до (V): 5 10 15 20 25 30 35 40 де від Z1 до Z4 незалежно один від одного являють собою гетероатом, вибраний із O і N, а індекси із c по g незалежно один від одного являють собою таке ціле число від 1 до 12, що загальна кількість атомів радикала R 1 не перевищує 20. Особливо переважно, щоб усередині радикала R1 усі гетероатоми Z були або О, або N. Кращих результатів при дослідженнях біоцидної дії або токсичності досягли із тими сполуками, у яких R1 являв собою двовалентний радикал простого полідіаміну, такого як, наприклад, 4,9-діоксадодекан-1,12-діамін, поліоксіетилен- і/або -пропілендіамін, при цьому n переважно дорівнювала від 2 до 15, ще переважніше від 2 до 10, зокрема від 2 до 6. Як солі нових полігуанідинів формули (I) візьмуть до уваги будь-яку сіль приєднання кислоти із однієї або декількома неорганічними або органічними кислотами, такими як, наприклад, галогенводневі кислоти, кисневі кислоти азоту, сірки або фосфору, борна кислота, вугільна кислота, карбонові-, тіокарбонові-, карбамінові-, сульфонові-, фосфонові- або фосфінові кислоти, а також часткові складні ефіри або аміди багатовалентних представників зазначених кислот. Переважно згідно з даним винаходом застосовувати фармацевтично прийнятні солі, ще переважніше солі приєднання кислоти, такі як гідрохлорид, гідробромід, гідройодид, сульфат, метилсульфат, карбонат, борат, ціанат, тіоціанат, фосфат, мезилат, нітрат, ацетат, бензоат, лактат, тартрат, цитрат, малеат, фумарат або часткові складні ефіри зазначених кислот, якщо вони є дво- або більше функціональними. Як спиртовий компонент таких часткових складних ефірів переважно застосовувати фармацевтично прийнятні спирти, зокрема етанол. Якщо радикал R1 містить одну або декілька OH- або COOH-груп, то сіль із неорганічною або органічною основою також потрапляє в обсяг охорони даного винаходу, при цьому кращі солі із фармацевтично прийнятною основою, ще переважніше із похідним гуанідину, зокрема із аміноабо діаміногуанідином, тобто із похідним гуанідину, із якого при отриманні відбуваються нові полігуанідини за винаходом. Як правило, при отриманні утворюються внутрішні солі із кислих і основних груп всередині відповідної молекули. В другому аспекті даного винаходу надають спосіб отримання похідних полігуанідину за винаходом відповідно до першого аспекту за допомогою поліконденсації похідних гуанідину або їх солей із діаміном, який відрізняється тим, що MAG і/або DAG або їх сіль приєднання кислоти поліконденсується із щонайменше одним діаміном H2N-R1-NH2 при нагріванні. На противагу рівню техніки спосіб за винаходом включає реакцію MAG або DAG із одним або декількома діамінами, переважно тільки із одним діаміном. Внаслідок цього можна отримувати чіткіше визначені продукти, ніж у цитованих вище роботах російських дослідників, тим більше, що в отриманій відповідно до даного винаходу реакційній суміші не виявлявся вільний гідразин в жодній фазі протікання реакції, ні хроматографічно, ні хімічно. Побічні реакції із гідразином, які у визначеному рівні техніки були бажані, у даному випадку зовсім небажані, і їх можна в такий спосіб ефективно уникнути. Переважно спосіб за винаходом проводять таким чином, що сіль MAG або DAG, зокрема гідрохлорид, разом із діаміном, який переважно застосовують у незначному молярному надлишку, наприклад, від 3 до 5 мол. %, через економічність максимально 10 мол. %, відносно (ді)аміногуанідину для того, щоб забезпечити повне перетворення похідного гуанідину, спочатку 4 UA 115581 C2 5 10 15 20 25 30 35 40 45 50 55 60 нагрівають до першої, нижчої температури, переважно до приблизно 80-150ºC, ще переважніше до 110-130ºC, а потім до другий, вищої температури, переважно 150-250ºC, ще переважніше 160-180ºC, для того, щоб збільшити швидкість реакції і разом із цим виділення газу. При цьому реакційну суміш переважно від 1 до 3 год., ще переважніше приблизно 2 год. витримують при першій температурі і потім переважно від 1 до 8 год., ще переважніше від 3 до 5 год. витримують при другій температурі для того, щоб забезпечити повне проходження реакції. Реакцію переважно проводять при нормальному тиску, а також з видаленням води, що викликають, наприклад, щонайменше початковим продуванням реактора інертним газом і оснащенням реактора сушильною трубою. Однак також можна застосовувати вакуум, насамперед до кінця реакції у вигляді стадії очищення для того, щоб по можливості повністю видалити вільний аміак, а також залишкові мономери, тобто насамперед надлишковий діамін. Після закінчення реакції похідне полігуанідину, яке утворилося, переважно розчиняють у воді, наприклад, приблизно у від 3 до 10-кратній кількості води. З однієї сторони це дозволяє відокремлювати можливо наявні нерозчинні у воді компоненти, і із іншої сторони водний розчин являє собою кращу форму випуску для застосування нових полімерів, тобто їх безпосередньо можна застосовувати у вигляді розчину, необов'язково після додавання ад'ювантів. Іншою, у даний час менш переважною можливістю очищення є, наприклад, випарювання води із водного розчину і сушіння полімеру у вакуумі, або висолювання із водного розчину додаванням кислоти із наступним сушінням, для чого беруть до уваги вище згадані кислоти, зокрема описані як переважні фармацевтично прийнятні кислоти. Один варіант здійснення висолювання включає введення CO2 і висолювання полігуанідину у вигляді карбонату або гідрокарбонату. Якщо бажаний полігуанідин необхідно застосовувати не у вигляді солі, а у вигляді вільної основи, за висолюванням може йти обробка основою, яка знаходиться у вигляді водного або неводного розчину або суспензії. У третьому аспекті даний винахід стосується похідного полігуанідину відповідно до першого аспекту даного винаходу або отримання способом відповідно до другого аспекту даного винаходу для застосування в галузі медицини і ветеринарії для боротьби із бактеріальними, грибковими і вірусними інфекціями і їх наслідками, як пестициду і засобу дезінфекції в аграрній галузі і у навколишньому середовищі, в основному як засобу дезінфекції (біоциду) для зменшення кількості і знищення мікроорганізмів, як протипаразитарного засобу, як добавки для стабілізації (стерилізації) продуктів або також як аерозольної речовини в розчиненій формі для холодного/вологого розпилення, подрібнення і парової стерилізації. Далі даний винахід описується докладніше за допомогою необмежуючих прикладів здійснення разом із порівняльними прикладами. На зображенні, фіг. 1, представлені результати досліджень на токсичність. Приклади Приклади із 1 по 6 і порівняльні приклади 1 і 2 - отримання полімеру Приклад 1 23 ммоль гідрохлориду 1,3-діаміногуанідину і 24 ммоль 4,9-діоксадодекан-1,12-діаміну нагрівали в закритому сушильною трубою реакторі протягом 90 хв. при перемішуванні до 120C, потім температуру протягом 100 хв. піднімали до 180C, із цього часу наприкінці протікання реакції 45 хв. витримували при зниженому тиску (50 мбар). Після охолодження реакційної суміші до температури нижче 80C до гелеподібного реакційного продукту додавали 25 мл води. Після декількох годин виходив прозорий розчин. Від зразка отриманого водного розчину випарювали воду, і отриманий осад сушили у вакуумі, при цьому отримували червонувату, в'язку рідину. Дану рідину розчиняли в 2 мл D 2О (зі 1 ступенем дейтерування > 99,5%), і знімали спектр H-ЯМР. Положення помітних у такий спосіб груп протонів метилену в радикалі R1 у продукті було наступним: 1 H-NMR (D2О), δ (ppm): 1,54-1,67 (m, OCH2CH2CH2CH2О), 1,80-1,95 (m, NCH2CH2), 3,23-3,38 ppm (m, NCH2), 3,42-3,65 ppm (m, CH2CH2OCH2CH2). Це підтверджувало структуру застосовуваного компонента діаміну, 4,9-діоксадодекан-1,12діаміну. Приклад 2 4,6 ммоль гідрохлориду 1,3-діаміногуанідину і 4,8 ммоль 4,9-діоксадодекан-1,12-діаміну нагрівали в закритому сушильною трубою реакторі протягом 90 хв. при перемішуванні до 120ºC, потім температуру протягом 8 год. піднімали до 180ºC, із цього часу наприкінці протікання реакції 45 хв. витримували при зниженому тиску (50 мбар). Після охолодження реакційної суміші до температури нижче 80ºC до гелеподібного реакційного продукту додавали 16 мл води. Після декількох годин виходив прозорий розчин. Приклад 3 5 UA 115581 C2 5 10 15 20 25 30 35 40 45 50 55 4,6 ммоль гідрохлориду N-аміногуанідину і 4,8 ммоль 4,9-діоксадодекан-1,12-діаміну нагрівали в закритому сушильною трубою реакторі протягом 90 хв. при перемішуванні до 120ºC, потім температуру протягом 3,5 год. піднімали до 180ºC, із цього часу наприкінці протікання реакції 60 хв. витримували при зниженому тиску (50 мбар). Після охолодження реакційної суміші до температури нижче 80ºC до гелеподібного реакційного продукту додавали 16 мл води. Після декількох годин виходив прозорий розчин. Приклад 4 1,16 ммоль гідрохлориду 1,3-діаміногуанідину і 1,21 ммоль трис(2-аміноетил)аміну нагрівали в закритому сушильною трубою реакторі протягом 150 хв. при перемішуванні до 120ºC, потім температуру протягом 2,5 год. піднімали до 160ºC, із цього часу наприкінці протікання реакції 45 хв. витримували при зниженому тиску (50 мбар). Після охолодження реакційної суміші до температури нижче 80ºC до гелеподібного реакційного продукту додавали 4 мл води. Після декількох годин виходив прозорий розчин. Приклад 5 8,12 ммоль гідрохлориду 1,3-діаміногуанідину і 8,47 ммоль трис(2-аміноетил)аміну нагрівали в закритому сушильною трубою реакторі протягом 120 хв. при перемішуванні до 130ºC, потім температуру протягом 8 год. піднімали до 180ºC, із цього часу наприкінці протікання реакції 90 хв. витримували при зниженому тиску (15 мбар). Після охолодження реакційної суміші до температури нижче 80ºC до гелеподібного реакційного продукту додавали 28 мл води. Після декількох годин виходив прозорий розчин. Приклад 6 2,32 ммоль гідрохлориду 1,3-діаміногуанідину і 2,43 ммоль 3,6-діоксаоктан-1,8-діаміну нагрівали в закритому сушильною трубою реакторі протягом 60 хв. при перемішуванні до 120ºC, потім температуру протягом 4 год. піднімали до 170ºC, із цього часу наприкінці протікання реакції 60 хв. витримували при зниженому тиску (50 мбар). Після охолодження реакційної суміші до температури нижче 80ºC до гелеподібного реакційного продукту додавали 7 мл води. Після декількох годин виходив прозорий розчин. Порівняльний приклад 1 23,2 ммоль гідрохлориду гуанідину, 5,4 ммоль 3,6-діоксаоктан-1,8-діаміну і 18,1 ммоль 1,6діаміногексану нагрівали в закритому сушильною трубою реакторі протягом 90 хв. при перемішуванні до 120ºC, потім температуру протягом 8 год. піднімали до 170ºC, із цього часу наприкінці протікання реакції 90 хв. витримували при зниженому тиску (50 мбар). Після охолодження реакційної суміші до температури нижче 80ºC до гелеподібного реакційного продукту додавали 60 мл води. Після декількох годин виходив прозорий розчин. Отриманий полімер структурно відповідав тому, який розкривався в WO 2006/047800 A1. Порівняльний приклад 2 2,00 ммоль гідрохлориду гуанідину, 1,70 ммоль 1,6-гексаметилендіаміну і 0,3 ммоль гідрату гідразину нагрівали в закритому сушильною трубою реакторі протягом 90 хв. при перемішуванні до 160ºC, потім температуру протягом 3,5 год. піднімали до 180ºC, із цього часу наприкінці протікання реакції 60 хв. витримували при зниженому тиску (50 мбар). Після охолодження реакційної суміші до температури нижче 80ºC до гелеподібного реакційного продукту додавали 4 мл води. Після декількох годин виходив прозорий розчин. Отриманий полімер структурно відповідав тому, який розкривався в WO 2011/043690 A1. Приклад 7 - визначення протимікробної/протигрибкової/противірусної активності: Активність нових сполук випробували в багаторазово проведених дослідженнях у скринінгсистемах. Антибактеріальну і протигрибкову активність досліджували за допомогою MHK-тесту. MHK являє собою "мінімальну інгібуючу концентрацію" (англ. мов.: MIC fur "minimal inhibitory concentration") і позначає найнижчу концентрацію речовини, при якій неозброєним оком не виявляється ніякого розмноження мікроорганізмів. MHK визначають так званим способом титрування, при якому речовину розбавляють і потім додають збудника. Як правило, у такий спосіб визначають концентрацію антибіотика, яка ще сповільнює ріст штамів бактерій. MHK вказують у мікрограмах на мілілітр (мкг/мл) або в об. %, і розведення відбувається як правило по log2-шкалі. У даному випадку вихідну концентрацію 1% щораз розбавляли в два рази, що давало досліджувані концентрації 0,5%, 0,25%, 0,125% і т. д. Таким чином, найменше значення показує кращу активність як протиінфекційний засіб. Дослідження проводили відповідно до стандартів EUCAST (European Committee for Antimicrobial Susceptibility Testing (Європейський комітет із тестування антимікробної чутливості)) і відповідно до інструкцій AFST ("Antifungal Susceptibility Testing") European Society of Clinical Microbiology and Infectious Diseases (ESCMID). 6 UA 115581 C2 5 10 Система скринінгу для вірусів являє собою систему інфікування, у якій хазяйські клітини в лабораторних умовах інфікують і додають тестовану речовину перед або після інфікування і визначають його активність.Усі ці тести проводилися відповідно до внутрішніх стандартних інструкцій SeaLife Pharma для скринінгу лікарських засобів, при цьому аналогічні ряди розведення застосовувалися для антибактеріальних/протигрибкових досліджень. У нижченаведених таблицях із 1 по 3 наведені результати досліджень відносно антиінфекційної дії нових сполук за винаходом із прикладів 1, 3, 4 і 5 проти деяких мультирезистентних бактерій і грибів, а також вірусів. Наведені дані є середніми значеннями багаторазових вимірів. Зовсім очевидно, що нові сполуки за винаходом демонструють чудову активність як проти грампозитивних, так і проти грамнегативних збудників: Таблиця 1 Результат MНК тесту Приклад 1 Приклад 3 Приклад 4 Приклад 5 StreptoPseudoSalmoStaphyloEnterocoAcinetococcus Propionibacter Klebsiella minas Enterobac- nella MRSA coccus ccus E. coli bacter pneumoacne pneumoniae Aerugiter cloace enteepidermis faecalis baumanii niae nosa rica 0,001% 0,001% 0,004% 0,008% 0,001% 0,016% 0,02% 0,02% 0,06% 0,03% 0,03% 0,001% 0,001% 0,001% 0,008% 0,001% 0,02% 0,02% 0,02% 0,06% 0,2% 0,03% 0,001% 0,001% 0,001% 0,008% 0,001% 0,016% 0,016% 0,030% 0,02% 0,016% 0,030% 0,001% 0,001% 0,002% 0,002% 0,001% 0,020% 0,02% 0,04% 0,04% 0,13% 0,03% А також проти грибів і дріжджів: 15 Таблиця 2 Результат MНК тесту Приклад 1 Приклад 3 Приклад 4 Приклад 5 Candida Candida Candida Candida albicans papillosis glabrata kruzei AsperAlternaAsperDematigillus Fusarium Trichophy- rria Microspogillus acea fumiga- rosei ton sp. alterna- rum canis terreus sp. tus rria 0,008% 0,03% 0,02% 0,02% 0,02% 0,03% 0,03% 0,02% 0,02% 0,03% 0,02% 0,02% 0,02% 0,02% 0,02% 0,03% 0,03% 0,03% 0,02% 0,02% 0,02% 0,02% 0,008% 0,016% 0,016% 0,008% 0,125% 0,125% n.t. n.t. n.t. n.t. n.t. 0,02% n.t. n.t. n.t. n.t. n.t. 0,02% 0,02% 0,020% 0,016% 0,016% А також проти вірусів: Таблиця 3 Результати вірусологічного тесту Приклад 1 Приклад 3 Приклад 4 Приклад 5 20 25 Influenza A and B 0,008 % 0,02 % 0,04 % 0,04 % Human rhinovirus 0,008 % 0,02 % 0,02 % 0,04 % Parainfluenza virus 0,008 % 0,02 % 0,04 % 0,04 % Herpes simplex virus 0,02 % 0,02 % 0,02 % 0,02 % Таким чином, усі випробувані нові сполуки мають активність від дуже гарної до чудової проти всіляких збудників, і при значно меншій токсичності, ніж у відомих із рівня техніки похідних полігуанідину, як показали нижченаведені дослідження на токсичність. Приклад 8 - Дослідження на токсичність ® За допомогою AlamarBlue аналізу, як зазначено нижче, у 4 полімерів аналізували токсикологічний потенціал (включаючи проліферацію, загибель клітин, метаболізм клітин) і визначали значення IC50, а також нетоксичну концентрацію у вихідних кератиноцитах (HKER) і 7 UA 115581 C2 5 10 15 20 вихідних клітинах ендотелію (HUVEC). На фіг. 1 представлений токсичний ефект різних полімерів залежно від концентрації. AlamarBlue®-аналіз: 20000 кератиноцитів людини (HKER) або клітин ендотелію (HUVEC) розміщали в 96-ямковому планшеті і інкубували 24 год., перш ніж додавали нові полімери із прикладів 1 і 3 у різних концентраціях (від 5 % до 0,005 %), а також порівняльні речовини із порівняльних прикладів 1 і 2. Після 24 годин у кожну ямку (100 мкл середовища) додавали 10 ® мкл AlamarBlue , і після 3 годин інкубації оцінювали забарвлювану реакцію за допомогою спектрофотометра для зчитування планшетів, (збудження: 530 нм; емісія: 590 нм). HKER: "human primary keratinocytes", вихідні кератиноцити людини; HUVEC: "human umbilical vein endothelial cells", клітини ендотелію пуповинної вени людини. Полімери порівняльних прикладів 1 і 2 мають як для HKER, так і для HUVEC уже при дуже низьких концентраціях, тобто IC50 приблизно 0,01 % або нижче, значна токсична дія. Отримані винахідниками нові полімери із прикладів 1 і 3 показали в порівнянні із порівняльними прикладами токсичний ефект тільки при значно більш високих концентраціях: IC 50 знаходиться для прикладу 1 для обох видів клітин в області 1 % і для прикладу 3 в області від 0,05 % до 0,1 %. Токсичність порівняльних прикладів досягається полімером із приклада 3 тільки при щонайменше 5-кратної концентрації, а із полімером із прикладу 1 тільки при щонайменше 100кратній концентрації. Таким чином, у даному дослідженні похідне DAG показувало явно кращий результат, ніж полімер MAG. Таким чином, нові сполуки мають активність від дуже гарної до чудової проти всіляких збудників при значно нижчій токсичності, ніж у відомих із рівня техніки похідних полігуанідину. ФОРМУЛА ВИНАХОДУ 25 1. Продукт поліконденсації аміногуанідину і/або 1,3-діаміногуанідину із одним або декількома діамінами, тобто похідне полігуанідину наступної формули (І): N H N X R1 a N H R2 N H N H Y b n 30 35 40 45 , (І) де X вибирають із -NH2, аміногуанідину і 1,3-діаміногуанідину; Y вибирають із -Н і -R1-NH2; або X і Y разом перебувають в хімічному зв'язку, утворюючи циклічну структуру; R1 вибирають із двовалентних органічних радикалів, які мають від 2 до 20 атомів вуглецю, у яких необов'язково один або декілька атомів вуглецю заміщені О або N; а і b незалежно один від одного дорівнюють 0 або 1, при цьому a+b2, якщо не містяться елементи 1,3-діаміногуанідину; R2 вибирають із -Н і -NH2, при цьому R2 являє собою -NH2, якщо а+b=0, R2 являє собою -Н або -NH2, якщо а+b=1, і R2 являє собою -Н, якщо а+b=2; i n2; або солі зазначеної сполуки. 2. Похідне полігуанідину за п. 1, яке відрізняється тим, що R1 вибирають із алкіленових радикалів, у яких один або декілька атомів вуглецю необов'язково заміщені О або N. 3. Похідне полігуанідину за п. 2, яке відрізняється тим, що R1 вибирають із радикалів із наступними загальними формулами від (II) до (V): (CH2)c (CH2)d (CH2)c Z1 (CH2)d Z2 (CH2)e (CH2)c 50 Z1 Z1 (CH2)d Z2 (CH2)e Z3 (CH2)f (CH2)c Z1 (CH2)d Z2 (CH2)e Z3 (CH2)f , (II) , (III) 8 , (IV) Z4 (CH2)g , (V) UA 115581 C2 5 10 15 20 25 30 35 де від Z1 до Z4 незалежно один від одного являють собою гетероатом, вибраний із О і N, а індекси із с по g незалежно один від одного являють собою таке ціле число від 1 до 12, що загальна кількість атомів радикала R1 не перевищує 20. 4. Похідне полігуанідину за п. 3, яке відрізняється тим, що усередині радикала R1 усі гетероатоми Z являють собою або О, або N. 5. Похідне полігуанідину за п. 4, яке відрізняється тим, що R1 являє собою двовалентний радикал простого поліефірдіаміну. 6. Похідне полігуанідину за одним із пп. 1-5, яке відрізняється тим, що n = від 2 до 6. 7. Похідне полігуанідину за одним із пп. 1-6, яке відрізняється тим, що воно являє собою сіль приєднання кислоти у формі гідрохлориду, гідроброміду, гідройодиду, сульфату, карбонату, борату, ціанату, тіоціанату, фосфату, мезилату, нітрату, ацетату, бензоату, лактату, тартрату, цитрату, малеату, фумарату або часткового складного ефіру зазначених кислот, якщо вони є дво- або більше функціональними, або сумішей двох або декількох даних солей і/або часткових складних ефірів. 8. Спосіб отримання похідного полігуанідину за одним із пп. 1-7 за допомогою поліконденсації похідного гуанідину або його солі із діаміном, який відрізняється тим, що аміногуанідин або 1,3-діаміногуанідин або його сіль приєднання кислоти піддають поліконденсації із щонайменше одним діаміном H2N-R-NH2 при нагріванні. 9. Спосіб за п. 8, який відрізняється тим, що щонайменше один діамін застосовують у надлишку від 3 до 5 мол. % відносно похідного гуанідину. 10. Спосіб за п. 8 або 9, який відрізняється тим, що сіль аміногуанідину або 1,3діаміногуанідину разом із щонайменше одним діаміном спочатку нагрівають до першої, нижчої, температури, а потім до другої, вищої, температури. 11. Спосіб за п. 10, який відрізняється тим, що сіль аміногуанідину або 1,3-діаміногуанідину разом із щонайменше одним діаміном спочатку нагрівають до 110-130 °C, а потім до 160180 °C. 12. Спосіб за п. 10 або 11, який відрізняється тим, що реакційну суміш від 1 до 3 годин витримують при першій температурі і від 1 до 8 годин при другій температурі. 13. Спосіб за одним із пп. від 8 до 12, який відрізняється тим, що отримане похідне полігуанідину очищають розчиненням у приблизно від 3 до 10-кратній кількості води. 14. Застосування похідного полігуанідину за будь-яким із пп. 1-7 в медичній і ветеринарній галузі для боротьби із бактеріальними, грибковими і вірусними інфекціями і їх наслідками як пестициду і засобу дезінфекції в аграрній галузі і навколишньому середовищі, в основному як засобу дезінфекції (біоциду) для зменшення кількості і знищення мікроорганізмів, як протипаразитарного засобу, як добавки для стабілізації (стерилізації) продуктів або також як аерозольної речовини в розчиненій формі для холодного/вологого розпилення, подрібнення і парової стерилізації. 15. Застосування за п. 14, яке відрізняється тим, що ефективна кількість похідного полігуанідину знаходиться у вигляді розчину у від 3- до 10-кратній кількості води. 40 Комп’ютерна верстка О. Гергіль Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 9
ДивитисяДодаткова інформація
Назва патенту англійськоюNew bioactive polymers
Автори англійськоюPretsch, Alexander, Magl, Michael, Wiesner, Christoph, Burgmann, Heinz
Автори російськоюПрэтч Александер, Нагль Михаэль, Виснер Кристоф, Бургманн Хайнц
МПК / Мітки
МПК: C08G 73/02
Мітки: полімери, біоактивні
Код посилання
<a href="https://ua.patents.su/11-115581-bioaktivni-polimeri.html" target="_blank" rel="follow" title="База патентів України">Біоактивні полімери</a>
Попередній патент: Кільцевий коток для котка для культивації ґрунту
Наступний патент: Спосіб одержання вуглецевих наноматеріалів
Випадковий патент: Спосіб передопераційної оцінки ризику післяопераційних ускладнень у хворих з непухлинною обтураційною жовтяницею












