Спосіб моделювання системного аутоімунного ушкодження у мишей
Номер патенту: 120418
Опубліковано: 25.10.2017
Автори: Грушка Наталія Георгіївна, Джуран Богдан Васильович, Шепель Олена Анатоліївна, Вознесенська Тетяна Юріївна, Ступчук Марія Сергіївна, Блашків Тарас Вірославович
Формула / Реферат
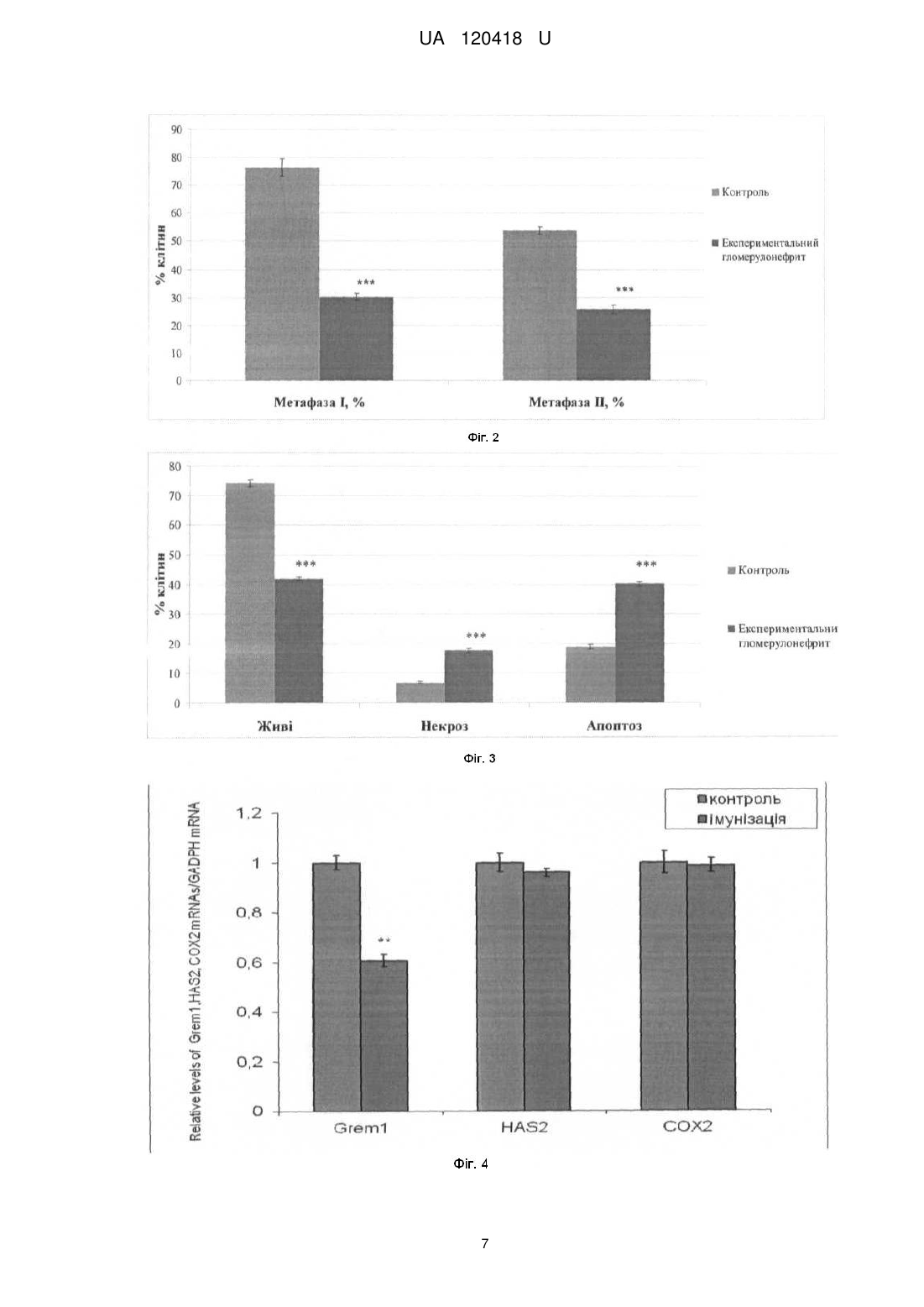
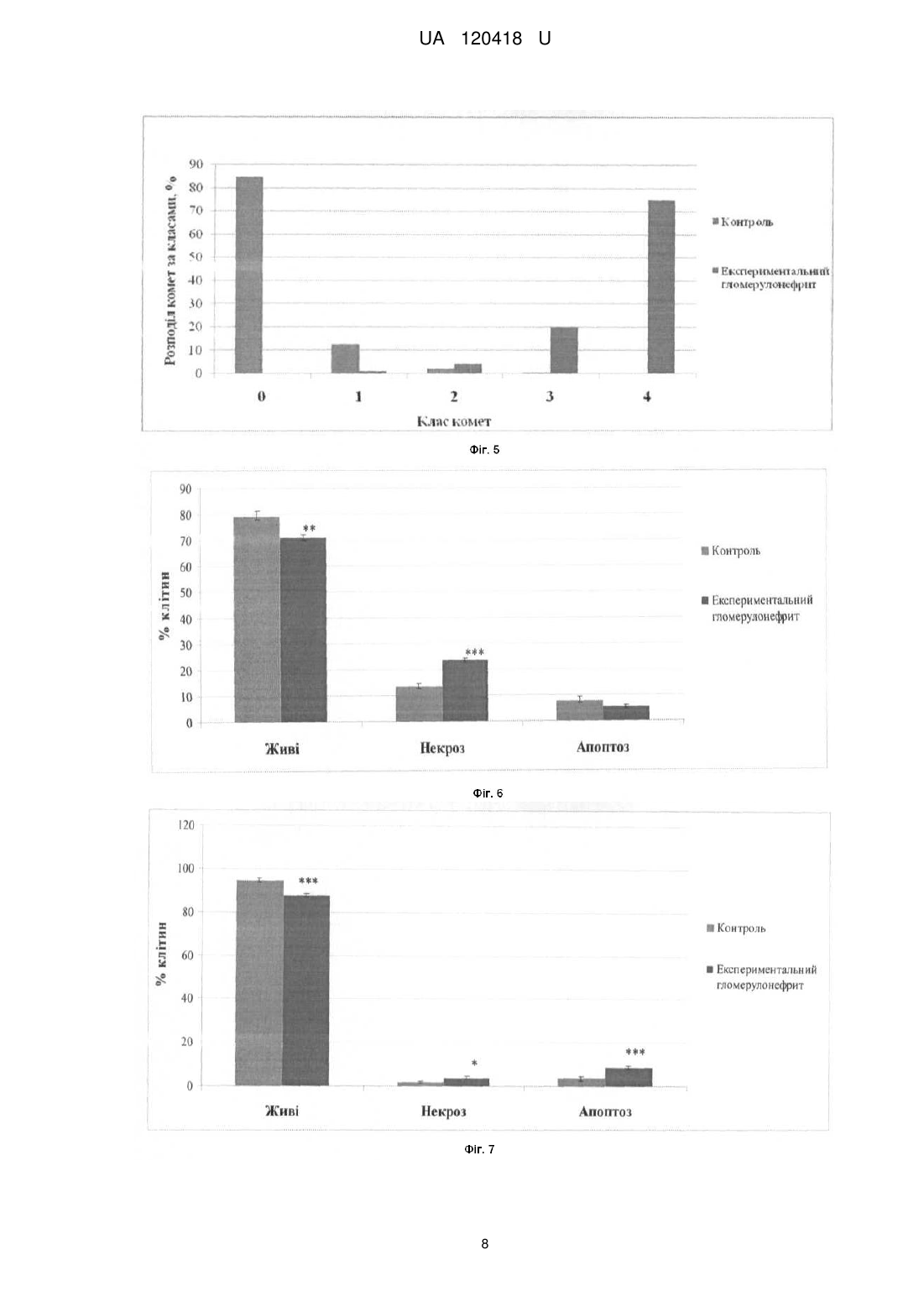
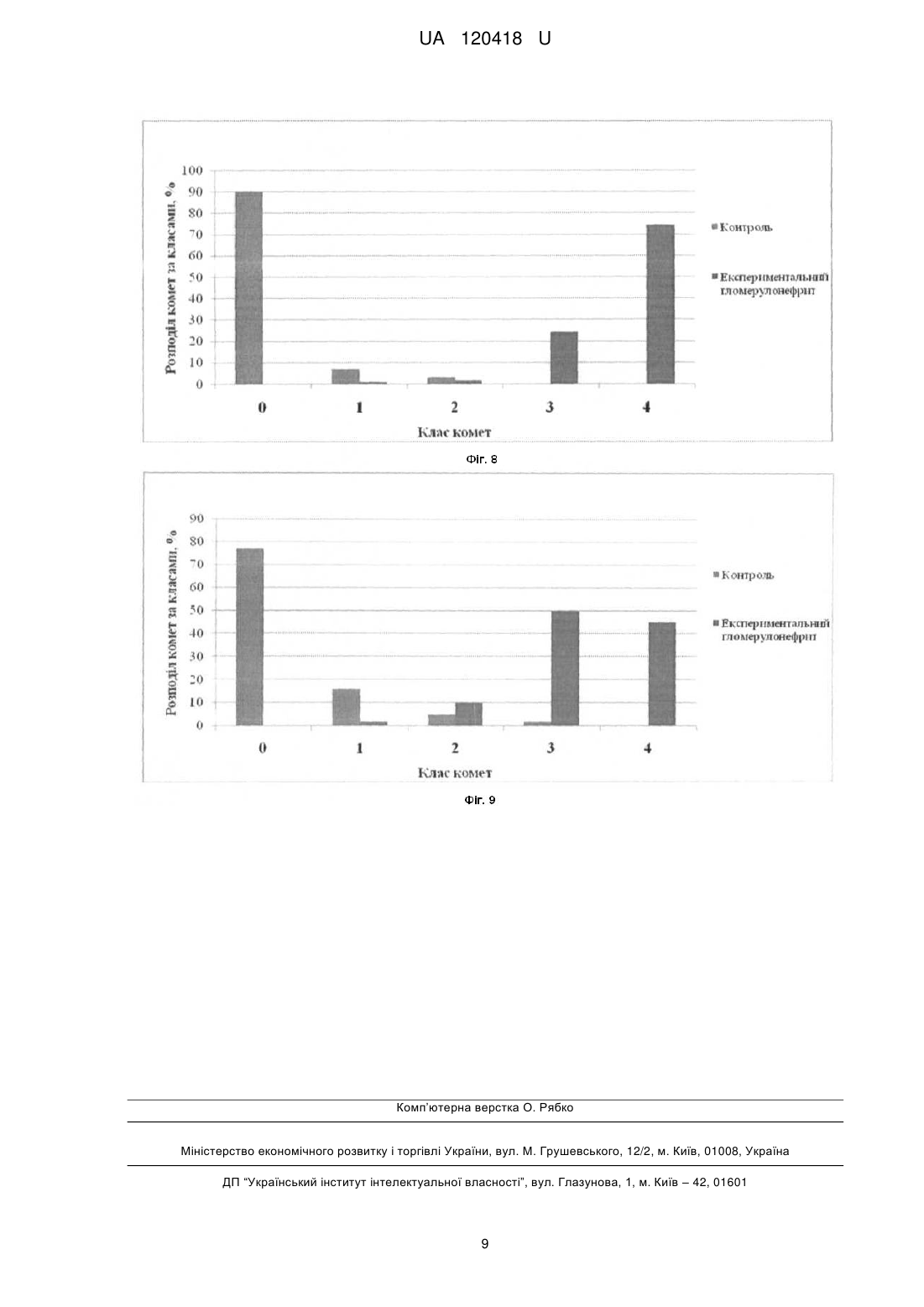
Спосіб моделювання системного аутоімунного ушкодження у мишей, що базується на імунізації тварин суспензією антигену нирки, яку проводять з розрахунку 10 мкл суспензії на 10 грамів маси тварини, та полягає в оцінюванні видільної функції нирок та біохімічних показників крові, проведенні гістологічного аналізу нирок, який відрізняється тим, що в ньому додатково визначають кількість ооцитів, виділених з яєчника, мейотичне дозрівання ооцитів, кількість живих та загиблих кумулюсних клітин, що оточують ооцити, зміну експресії генів та цілісність ДНК кумулюсних клітин, кількість живих та загиблих клітин лімфовузлів та тимусу, після чого оцінюють вплив ушкоджуючих чинників на оваріальну та імунну системи організму.
Текст
Реферат: Спосіб моделювання системного аутоімунного ушкодження у мишей базується на імунізації тварин суспензією антигену нирки, яку проводять з розрахунку 10 мкл суспензії на 10 грамів маси тварини, полягає в оцінюванні видільної функції нирок та біохімічних показників крові, проведенні гістологічного аналізу нирок. Додатково визначають кількість ооцитів, виділених з яєчника, мейотичне дозрівання ооцитів, кількість живих та загиблих кумулюсних клітин, що оточують ооцити, зміну експресії генів та цілісність ДНК кумулюсних клітин, кількість живих та загиблих клітин лімфовузлів та тимусу, після чого оцінюють вплив ушкоджуючих чинників на оваріальну та імунну системи організму. UA 120418 U (54) СПОСІБ МОДЕЛЮВАННЯ СИСТЕМНОГО АУТОІМУННОГО УШКОДЖЕННЯ У МИШЕЙ UA 120418 U UA 120418 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель стосується галузі медицини. Дана модель дає можливість вивчення механізмів розвитку хвороб у людей, що мають аутоімунні розлади, а також сприятиме розробці та визначенню ефективності терапевтичних підходів за цих патологічних процесів. У розвитку аутоімунних захворювань, на думку групи авторів, важливу роль відіграють такі фактори як спадкова схильність, несприятлива дія чинників довкілля, порушення імунітету [1]. До аутоімунних захворювань нирок відносять первинні гломерулонефрити (швидко прогресуючі, хронічні та ін.) і гломерулопатії (велика група хвороб), синдром Гудпасчера, системні васкуліти, а також інші системні аутоімунні захворювання, що супроводжуються ураженням функції нирок [2, 3]. Відомо, що серйозну проблему для репродуктивного здоров'я жінок являє собою гломерулонефрит, зокрема аутоімунної етіології. З метою дослідження аутоімунних захворювань нирок та розробки тактики їх терапії використовують експериментальні моделі. Так, у роботах ряду дослідників розглянуті механізми відтворення різноманітних експериментальних моделей аутоімунних захворювань нирок, що відображають особливості патоморфології, патогенезу різних варіантів даного захворювання, тактики доклінічних лікувальних і реабілітаційних заходів [4, 5]. В експериментальній нефрології зарубіжні дослідники найчастіше використовують модель активного і пасивного нефриту Heymanna та її різні модифікації [6]. Активний нефрит Heymanna відтворюють шляхом введення тварині антигену, отриманого з епітелію щіткової кайми проксимальних канальців нирок іншої тварини. Пасивний нефрит Heymanna дослідники відтворюють шляхом введення тваринам антимегалінових IgG як цільового антигену [7, 8, 9]. Особливостями відтворення даних експериментальних моделей аутоімунних захворювань нирок є їх висока вартість, зумовлена технічними складнощами та витратами на утримання тварин. Найбільш близьким до корисної моделі, що заявляється, є спосіб створення моделі хронічного мембранозного гломерулонефриту у щурів, що за етіопатогенезом, клінічним перебігом та морфологічною картиною є аналогічним процессу імунного запалення в тканині нирок, що спостерігається в клініці [10]. Дана модель передбачає імунізацію дослідної групи тварин антигенною суспензією коркового шару нирки та є модифікацією моделі нефриту Heymanna. Експеримент виконаний на 17 тваринах, самцях і самках щурів, масою 170 гр. яких імунізують суспензією антигену нирки. Імунізацію тварин проводять з розрахунку 10 мкл суспензії на 10 грамів маси тварини за наступною схемою: 3 - разове внутрішньочеревне 1 раз на добу з інтервалом між імунізацією в 1 день; повторно імунізацію проводять через 3 тижні внутрішньочеревне одноразово у тій самій дозі. Вищезгадані автори оцінювали об'єктивний статус тварин, видільну функцію нирок по кількості сечовипускань за добу, визначали наявність білка в разовій порції сечі, біохімічні показники крові, проводили гістологічний і морфометричний аналіз ниркових структур. Однак всі розроблені на сьогоднішній день моделі аутоімунних захворювань нирок мають обмеження і не повністю відповідають механізмам та перебігу хвороб у людини, а дані про роль ушкоджуючих чинників у ґенезі гломерулопатій на оваріальну та імунну системи організму відсутні. Досі не існує детально охарактеризованої моделі такої патології у мишей, оскільки відтворення даного ушкодження у цих тварин має певні труднощі, пов'язані з особливостями функціонування їх систем природного і адаптивного імунітету. Розробка та характеристика такої моделі будуть корисними, зважаючи на те, що фізіологія та генетика мишей детально досліджені, а для 99 % генів цих тварин встановлено аналоги у людини. Крім того, з практичної та економічної сторони є доцільним використання відносно недорогих малих тварин (мишей) для розробки та визначення ефективності терапевтичних підходів, оцінки побічних ефектів фармакологічних препаратів, їх токсичності та наслідків для наступних поколінь протягом відносно короткого часу [11]. Задачею корисної моделі, що заявляється, є створення способу моделювання системного аутоімунного ушкодження у мишей, викликаного імунізацією антигенною суспензією нирки з метою дослідження механізмів патоморфологічних змін нирок, яєчників та оцінки і визначення ролі гуморальної та клітинної ланок імунної системи за даної експериментальної патології. Технічним результатом корисної моделі, що заявляється, є висока ефективність тестування засобів лікування хвороб з наявністю аутоімунних захворювань нирок в патогенезі. Спосіб дозволяє за допомогою імунізації білих лабораторних мишей першого покоління суспензією антигену нирки, отриманої від материнської особи, спричиняти активацію імунокомпетентних клітин і утворення патологічних імунних комплексів, що викликає системне ушкодження органів. Посилення клітинних і гуморальних реакцій імунної системи призводить до патологічних змін в усіх досліджуваних органах мишей (нирки, яєчник, тимус, лімфатичні вузли). 1 UA 120418 U 5 10 15 20 25 30 35 40 45 50 55 60 Суть способу полягає в тому, що мишей імунізують суспензією антигену нирки. Далі визначають ефект введень антигену на: функціональний стан клітин імунної системи, гістоструктуру нирок мишей. Модель також надає можливість досліджувати механізми ушкодження яєчників та матки мишей. Приклад Дослідження проводилися на статевозрілих самицях мишей лінії СВА масою 20 г. При роботі дотримувались Міжнародних принципів Європейської конвенції про захист хребетних тварин. Предметом дослідження була характеристика параметрів мейотичного дозрівання ооцитів та життєздатності кумулюсних і імунокомпетентних клітин, а також визначення первинних пошкоджень ДНК в клітинах кумулюсного оточення ооцитів та імунокомпетентних клітинах мишей. Патологічний процес моделювали за допомогою імунізації мишей І покоління суспензією антигену нирки, отриманої від материнської особи. Для отримання антигенної суспензії нирки брали самку миші віком 16 тижнів масою 25 г. Відразу після декапітації (евтаназію проводили під ефірним наркозом відповідно до вимог Женевської конвенції "International Guiding principles for Biomedical Research Involving Animals", 1990) нирки перфузували in situ стерильним охолодженим середовищем DME (Dulbecco's Modified Eagle's Medium) (Sigma, США) до отримання рівномірного сіро-коричневого кольору. Після цього їх відсікали від ниркової ніжки і переносили на стерильний лоток. Усі наступні маніпуляції виконувалися при температурі +4 °C. Відокремивши від капсули, нирки суспендували в стерильному гомогенізаторі протягом 10 хвилин, потім переносили суспензію в центрифужну пробірку, додаючи охолоджений фізіологічний розчин до 5 мл і 1 мг мертіоляту як антисептик. Отриману суспензію центрифугували на холоді 3-кратно по 3 хвилини (2000 обертів на хвилину), кожен раз видаляли супернатант і доводили суспензію до 5 мл охолодженим фізіологічним розчином. Потім центрифугували ще раз, осад що утворився, обережно переносили на стерильну фольгу та зважували. Для приготування антигенної суспензії брали осад і змішували з повним ад'ювантом Фрейнда (Sigma, США) з розрахунку 1 мл на 20 мг осаду, який використовується для посилення імунної відповіді. Отриману зважену антигенну суспензію нирки миші зберігали за температури +4 °C. Імунізацію тварин проводили з розрахунку 10 мкл суспензії на 10 грамів маси тіла за наступною схемою: 3 - разове внутрішньочеревне 1 раз на добу з інтервалом між імунізацією в 1 день; повторно імунізацію проводили через 3 тижні внутрішньочеревне одноразово у тій самій дозі. Перед початком і під час експерименту оцінювали об'єктивний статус тварин (зовнішній вигляд, загальну рухову активність, потреба в їжі та воді, 2 рази на тиждень визначали масу тіла); видільну функцію нирок за кількістю спонтанних сечовиділень за добу у разовій порції сечі, використовуючи тест-смужки визначали білок (діагностичні тест-смужки Citolab для швидкого виявлення білку, "Фармаско", Україна). Після закінчення досліду тварин виводили з експерименту шляхом перерізання спинного мозку під ефірним наркозом з дотриманням правил евтаназії. Внутрішні органи (яєчники, нирки, тимус, лімфатичні вузли) забирали для проведення подальших досліджень. У тварин контрольної групи не було виявлено лабораторних і гістологічних ознак розвитку гломерулонефриту. Протягом усього експерименту в сечі тварин цієї групи білок не виявляли. У гістологічних препаратах нирок імунізованих тварин спостерігалася морфологічна картина, відповідна патоморфологічним змінам, характерним для гломерулонефриту. При проведенні імунізації у тварин II групи спостерігали зниження діурезу, дослідження сечі на вміст білка показало позитивний результат у 80 % тварин. Свідченням індукованого імунізацією запалення є зсув лейкограми крові вліво, із зростанням як загального відсотка нейтрофілів (з 11,9±2,8 % в контролі до 31,0 %±3,1; р
ДивитисяДодаткова інформація
МПК / Мітки
МПК: G01N 33/50
Мітки: системного, аутоімунного, моделювання, ушкодження, мишей, спосіб
Код посилання
<a href="https://ua.patents.su/11-120418-sposib-modelyuvannya-sistemnogo-autoimunnogo-ushkodzhennya-u-mishejj.html" target="_blank" rel="follow" title="База патентів України">Спосіб моделювання системного аутоімунного ушкодження у мишей</a>
Попередній патент: Настінний електрообігрівач
Наступний патент: Спосіб лікування хворих на злоякісні новоутворення верхніх дихальних шляхів
Випадковий патент: Цівкова передача