Фунгіцидна композиція, похідні триазолопіримідину, спосіб їх одержання та спосіб боротьби з грибками
Формула / Реферат
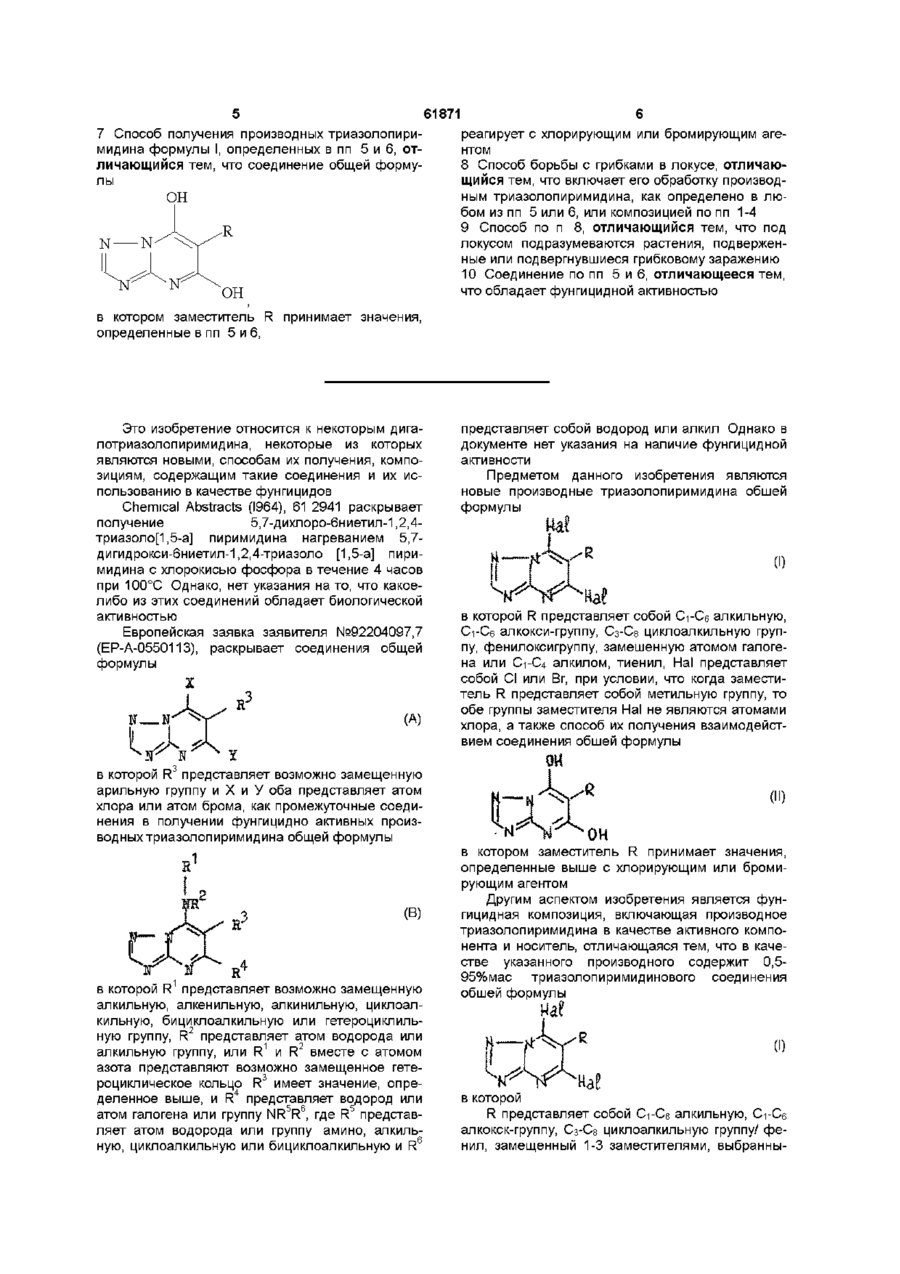
1. Фунгицидная композиция, включающая производное триазолопиримидина в качестве активного компонента и носитель, отличающаяся тем, что в качестве указанного производного содержит 0,5-95% мас. триазолопиримидинового соединения общей формулы I:
 ,
,
в которой
R представляет собой С1-С6 алкильную, С1-С6 алкоксигруппу, С3-С8 циклоалкильную группу; фенил, замещенный 1-3 заместителями, выбранными из: атомов галогена, С1-С4 алкила, С1-С4 галогеналкила, С1-С4 алкокси, С1-С4 галогеналкокси, галогенсульфонила, фенила, фенокси и бензилоксигрупп; фенилоксигруппу, замещенную атомом галогена или С1-С4 алкилом; нафтил или тиенил;
Hal представляет собой Cl или Вr.
2. Фунгицидная композиция по п. 1, отличающаяся тем, что заместитель R представляет собой пропил, бутил, этокси, циклопентил, циклогексил, фторфенил, хлорфенил, бромфенил, дихлорфенил, хлорфторфенил, метилфенил, пропилфенил, бутилфенил, диметилфенил, трифторметилфенил, метоксифенил, этоксифенил, диметоксифенил, диэтоксифенил, триметоксифенил, трифторметоксифенил, хлорсульфонилфенил, бифенилил, феноксифенил, бензилоксифенил, фторфенокси, хлорфенокси, метилфенокси, диметилфенокси, нафтил или тиенил.
3. Фунгицидная композиция по п. 1, отличающаяся тем, что триазолопиримидин представляет собой соединение формулы I, где
R представляет собой 2-хлорфенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 2-хлорфенил, а оба заместителя Hal представляют собой атом брома;
R представляет собой 4-этоксифенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 3-метоксифенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 2-метоксифенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 2-хлорсульфонилфенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 3-трифторметилфенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 4-изопропилфенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 4-трифторметоксифенил, а оба заместителя Hal представляют собой атом хлора;
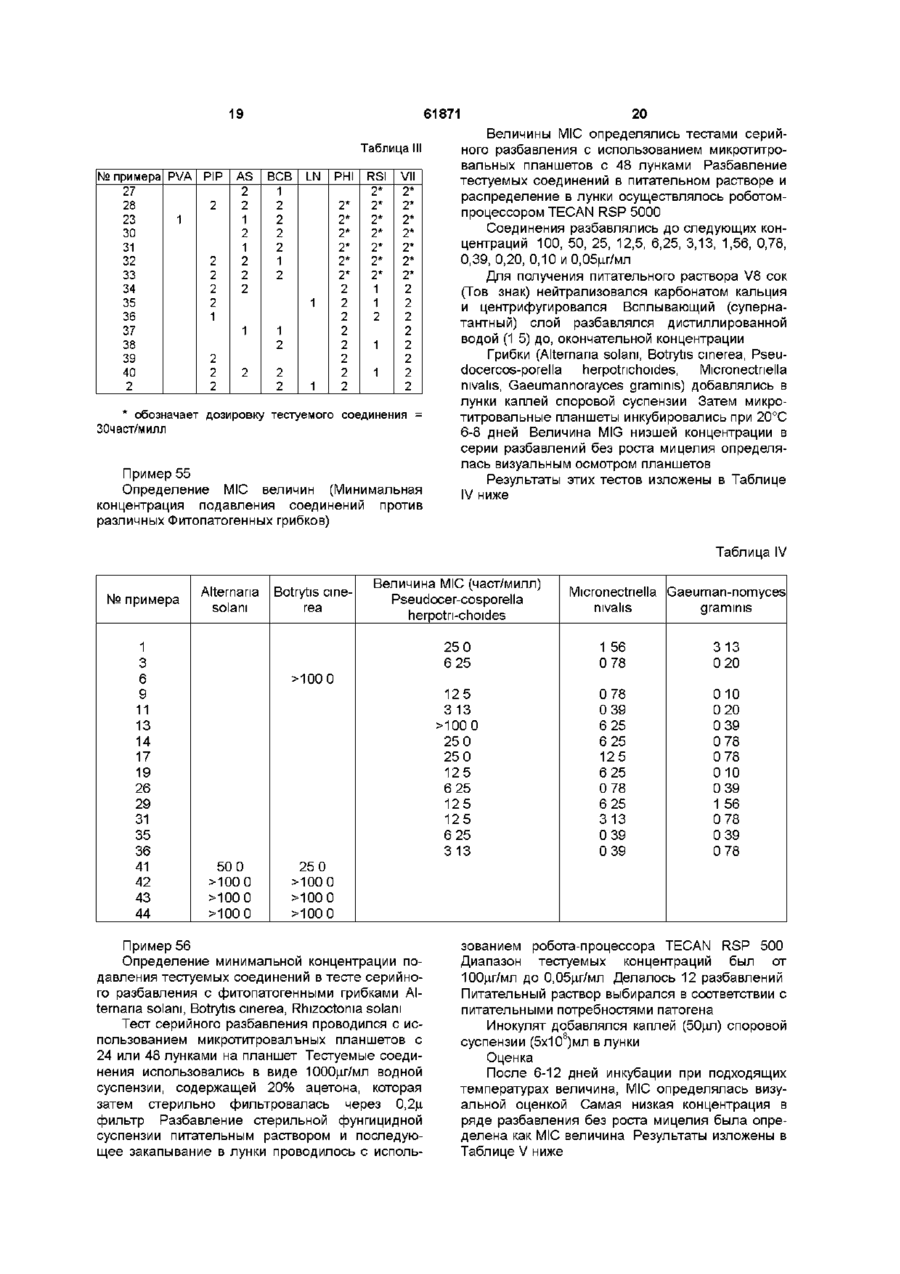
R представляет собой нафт-2-ил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 4-фторфенил, а оба заместителя Hal представляют собой атом хлора;
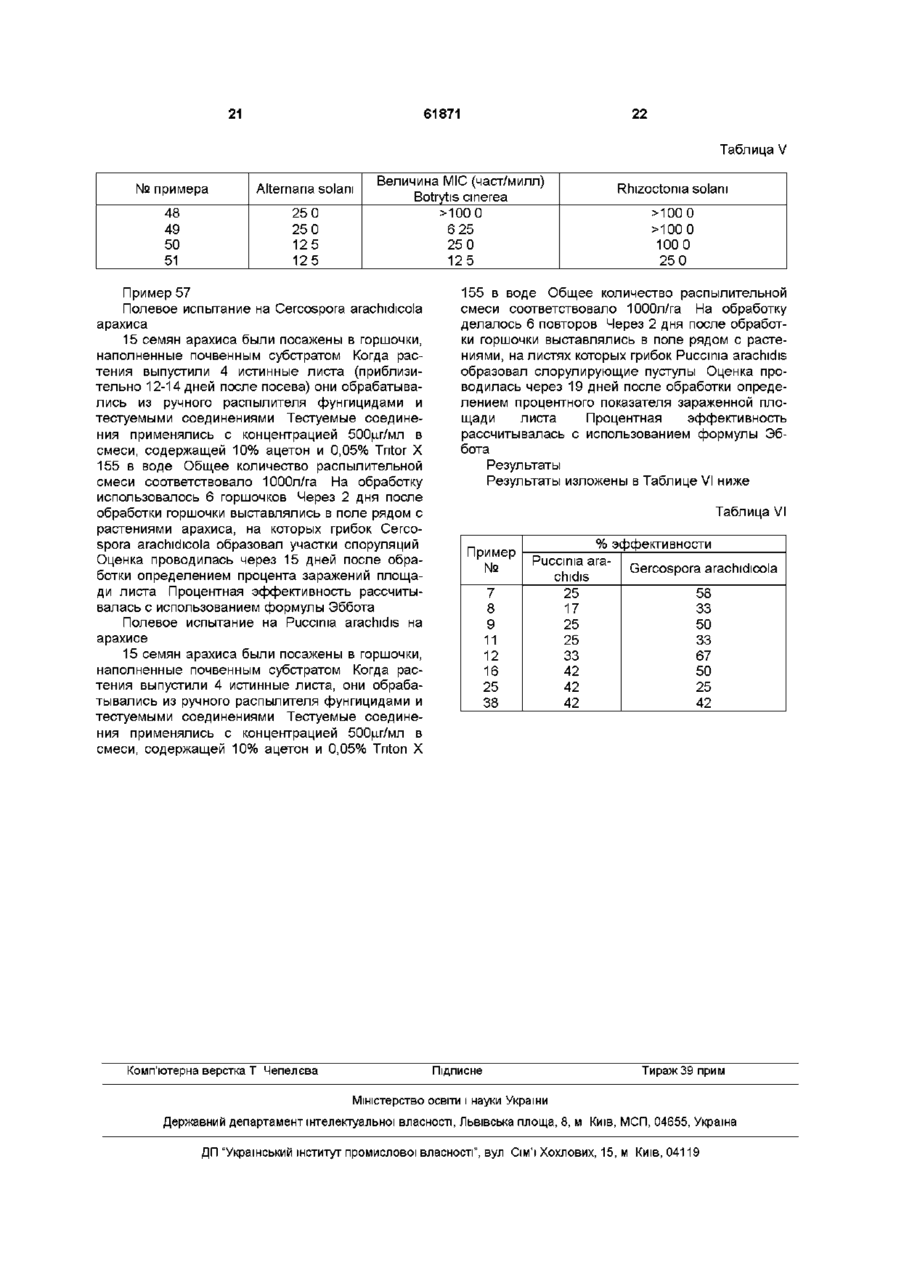
R представляет собой 4-феноксифенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 4-бифенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 3,4-диметоксифенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 4-бензилоксифенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 2-фторфенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 3-фторфенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 2-бромфенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 4-бромфенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 2-бензилоксифенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 2,3-диметоксифенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 3-бромфенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой нафт-1-ил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 2,3-диэтоксифенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 3,4-дихлорфенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой тиен-2-ил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой тиен-3-ил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 3,4,5-триметоксифенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 2-метилфенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 3-хлорфенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 3,4-диметилфенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой циклопентил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой циклогексил, а оба заместителя Наl представляют собой атом хлора;
R представляет собой 2-фторфенил, а оба заместителя Hal представляют собой атом брома;
R представляет собой 2,4-дихлорфенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 4-трет-бутилфенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 2-хлор-6-фторфенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 4-метоксифенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 2-трифторметилфенил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 4-бромфенил, а оба заместителя Hal представляют собой атом брома;
R представляет собой 2-хлор-6-фторфенил, а оба заместителя Hal представляют собой атом брома;
R представляет собой 4-трифторметилфенил, а оба заместителя Hal представляют собой атом брома;
R представляет собой 3-фторфенил, а оба заместителя Hal представляют собой атом брома;
R представляет собой 2-трифторметилфенил, а оба заместителя Hal представляют собой атом брома;
R представляет собой 2-фторфеноксигруппу, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 2-метилфеноксигруппу, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 2-хлорфеноксигруппу, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 2,6-диметилфеноксигруппу, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 3-метилфеноксигруппу, а оба заместителя Hal представляют собой атом хлора;
R представляет собой этоксигруппу, а оба заместителя Hal представляют собой атом хлора;
R представляет собой изопропил, а оба заместителя Hal представляют собой атом хлора; или
R представляет собой изобут-3-ил, а оба заместителя Hal представляют собой атом хлора.
4. Фунгицидная композиция по пп. 1-3, отличающаяся тем, что содержит по меньшей мере два носителя, по меньшей мере один из которых представляет собой поверхностно-активное вещество.
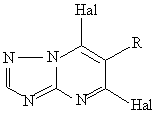
5. Производные триазолопиримидина общей формулы:
 ,
,
в которой
R представляет собой С1-С6 алкильную, С1-С6 алкоксигруппу, С3-С8 циклоалкильную группу; фенилоксигруппу, замещенную атомом галогена или C1-C4 алкилом; тиенил;
Hal представляет собой Cl или Вr, при условии, что когда заместитель R представляет собой метильную группу, то обе группы заместителя Hal не являются атомами хлора.
6. Производное триазолопиримидина по п. 5, отличающееся тем, что
R представляет собой тиен-2-ил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой тиен-3-ил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой циклопентил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой циклогексил, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 2-фторфеноксигруппу, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 2-метилфеноксигруппу, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 2-хлорфеноксигруппу, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 2,6-диметилфеноксигруппу, а оба заместителя Hal представляют собой атом хлора;
R представляет собой 3-метилфеноксигруппу, а оба заместителя Hal представляют собой атом хлора;
R представляет собой этоксигруппу, а оба заместителя Hal представляют собой атом хлора;
R представляет собой изопропил, а оба заместителя Hal представляют собой атом хлора; или
R представляет собой изобут-3-ил, а оба заместителя Hal представляют собой атом хлора.
7. Способ получения производных триазолопиримидина формулы I, определенных в пп. 5 и 6, отличающийся тем, что соединение общей формулы
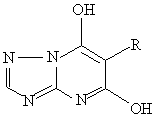 ,
,
в котором заместитель R принимает значения, определенные в пп. 5 и 6,
реагирует с хлорирующим или бромирующим агентом.
8. Способ борьбы с грибками в локусе, отличающийся тем, что включает его обработку производным триазолопиримидина, как определено в любом из пп. 5 или 6, или композицией по пп. 1-4.
9. Способ по п. 8, отличающийся тем, что под локусом подразумеваются растения, подверженные или подвергнувшиеся грибковому заражению.
10. Соединение по пп. 5 и 6, отличающееся тем, что обладает фунгицидной активностью.
Текст
1 Фунгицидная композиция, включающая производное триазолопиримидина в качестве активного компонента и носитель, о т л и ч а ю щ а я с я тем, что в качестве указанного производного содержит 0,5-95% мае триазолопиримидинового соединения общей формулы I Hal Hal в которой R представляет собой С-і-Сє алкильную, С-і-Сє алкоксигруппу, Сз-Cs циклоалкильную группу, фенил, замещенный 1-3 заместителями, выбранными из атомов галогена, С1-С4 алкила, С1-С4 галогеналкила, С1-С4 алкокси, С1-С4 галогеналкокси, галогенсульфонила, фенила, фенокси и бензилоксигрупп, фенилоксигруппу, замещенную атомом галогена или С1-С4 алкилом, нафтил или тиенил, Hal представляет собой CI или Вг 2 Фунгицидная композиция по п 1, отличающаяся тем, что заместитель R представляет собой пропил, бутил, этокси, циклопентил, циклогексил, фторфенил, хлорфенил, бромфенил, дихлорфенил, хлорфторфенил, метилфенил, пропилфенил, бутилфенил, диметилфенил, три фтор мети л фенил, метоксифенил, этоксифенил, диметоксифенил, диэтоксифенил, триметоксифенил, трифтор СПОСІБ IX ОДЕРЖАННЯ ТА метоксифенил, хлорсульфонилфенил, бифенилил, феноксифенил, бензилоксифенил, фторфенокси, хлорфенокси, метилфенокси, диметилфенокси, нафтил или тиенил 3 Фунгицидная композиция по п 1, отличающаяся тем, что триазолопиримидин представляет собой соединение формулы I, где R представляет собой 2-хлорфенил, а оба заместителя Hal представляют собой атом хлора, R представляет собой 2-хлорфенил, а оба заместителя Hal представляют собой атом брома, R представляет собой 4-этоксифенил, а оба заместителя Hal представляют собой атом хлора, R представляет собой 3-метоксифенил, а оба заместителя Hal представляют собой атом хлора, R представляет собой 2-метоксифенил, а оба заместителя Hal представляют собой атом хлора, R представляет собой 2-хлорсульфонилфенил, а оба заместителя Hal представляют собой атом хлора, R представляет собой 3-трифторметилфенил, а оба заместителя Hal представляют собой атом хлора, R представляет собой 4-изопропилфенил, а оба заместителя Hal представляют собой атом хлора, R представляет собой 4-трифторметоксифенил, а оба заместителя Hal представляют собой атом хлора, R представляет собой нафт-2-ил, а оба заместителя Hal представляют собой атом хлора, R представляет собой 4-фторфенил, а оба заместителя Hal представляют собой атом хлора, R представляет собой 4-феноксифенил, а оба заместителя Hal представляют собой атом хлора, R представляет собой 4-бифенил, а оба заместителя Hal представляют собой атом хлора, R представляет собой 3,4-диметоксифенил, а оба заместителя Hal представляют собой атом хлора, R представляет собой 4-бензилоксифенил, а оба заместителя Hal представляют собой атом хлора, R представляет собой 2-фторфенил, а оба заместителя Hal представляют собой атом хлора, R представляет собой 3-фторфенил, а оба заместителя Hal представляют собой атом хлора, R представляет собой 2-бромфенил, а оба заместителя Hal представляют собой атом хлора, О 00 (О 61871 4 R представляет собой 4-бромфенил, а оба замесR представляет собой 2,6-диметилфеноксигруппу, тителя Hal представляют собой атом хлора, а оба заместителя Hal представляют собой атом R представляет собой 2-бензилоксифенил, а оба хлора, заместителя Hal представляют собой атом хлора, R представляет собой 3-метилфеноксигруппу, а R представляет собой 2,3-диметоксифенил, а оба оба заместителя Hal представляют собой атом заместителя Hal представляют собой атом хлора, хлора, R представляет собой 3-бромфенил, а оба замесR представляет собой этоксигруппу, а оба заместителя Hal представляют собой атом хлора, тителя Hal представляют собой атом хлора, R представляет собой нафт-1-ил, а оба заместиR представляет собой изопропил, а оба заместителя Hal представляют собой атом хлора, теля Hal представляют собой атом хлора, или R представляет собой 2,3-диэтоксифенил, а оба R представляет собой изобут-3-ил, а оба заместизаместителя Hal представляют собой атом хлора, теля Hal представляют собой атом хлора R представляет собой 3,4-дихлорфенил, а оба 4 Фунгицидная композиция по пп 1-3, отличаю^ а к о г т м т о п а Hal представляют собой атом хлора, щаяся тем, что содержит по меньшей мере два oaivi^n-ucjm M a i п п о п г т а с п а ї л т n n f i n u а т п м v n n n a носителя, по меньшей мере один из которых R представляет собой тиен-2-ил, а оба заместипредставляет собой поверхностно-активное вещетеля Hal представляют собой атом хлора, ство R представляет собой тиен-3-ил, а оба заместителя Hal представляют собой атом хлора, 5 Производные триазолопиримидина общей фоR представляет собой 3,4,5-триметоксифенил, а рмулы оба заместителя Hal представляют собой атом Hal vnnna хлора, R представляет собой 2-метилфенил, а оба заместителя Hal представляют собой атом хлора, R представляет собой 3-хлорфенил, а оба з; замест п т а п п тителя 1-І'ПІ представляют собой атом хлора, Hal п п о п л т т о п п і л т г*г\Кг\Сл *ьтг\кл У П Л П О R представляет собой 3,4-диметилфенил, а оба Hal заместителя Hal представляют собой атом хлора, в которой R представляет собой циклопентил, а оба замесR представляет собой С-і-Сє алкильную, С-і-Сє алтителя Hal представляют собой атом хлора, коксигруппу, Сз-Cs циклоалкильную группу, фениR представляет собой циклогексил, а обазамеслоксигруппу, замещенную атомом галогена или тителя Hal представляют собой атом хлора, С1-С4 алкилом, тиенил, R представляет собой 2-фторфенил, а оба замесHal представляет собой CI или Вг, при условии, тителя Hal представляют собой атом брома, что когда заместитель R представляет собой меR представляет собой 2,4-дихлорфенил, а оба тильную группу, то обе группы заместителя Hal не заместителя Hal представляют собой атом хлора, являются атомами хлора R представляет собой 4-трет-бутилфенил, а оба 6 Производное триазолопиримидина по п 5, отзаместителя Hal представляют собой атом хлора, личающееся тем, что R представляет собой 2-хлор-6-фторфенил, а оба R представляет собой тиен-2-ил, а оба заместизаместителя Hal представляют собой атом хлора, теля Hal представляют собой атом хлора, R представляет собой 4-метоксифенил, а оба заR представляет собой тиен-3-ил, а оба заместиместителя Hal представляют собой атом хлора, теля Hal представляют собой атом хлора, R представляет собой 2-трифторметилфенил, а R представляет собой циклопентил, а оба замесоба заместителя Hal представляют собой атом тителя Hal представляют собой атом хлора, хлора, R представляет собой циклогексил, а оба замесR представляет собой 4-бромфенил, а оба заместителя Hal представляют собой атом хлора, тителя Hal представляют собой атом брома, R представляет собой 2-фторфеноксигруппу, а R представляет собой 2-хлор-6-фторфенил, а оба оба заместителя Hal представляют собой атом заместителя Hal представляют собой атом брома, хлора, R представляет собой 4-трифторметилфенил, а R представляет собой 2-метилфеноксигруппу, а оба заместителя Hal представляют собой атом оба заместителя Hal представляют собой атом брома, хлора, R представляет собой 3-фторфенил, а оба замесR представляет собой 2-хлорфеноксигруппу, а оба тителя Hal представляют собой атом брома, заместителя Hal представляют собой атом хлора, R представляет собой 2-трифторметилфенил, а R представляет собой 2,6-диметилфеноксигруппу, оба заместителя Hal представляют собой атом а оба заместителя Hal представляют собой атом брома, хлора, R представляет собой 2-фторфеноксигруппу, а R представляет собой 3-метилфеноксигруппу, а оба заместителя Hal представляют собой ат атом оба заместителя Hal представляют собой атом хлора, хлора, R представляет собой 2-метилфеноксигруппу, а R представляет собой этоксигруппу, а оба замесоба заместителя Hal представляют собой атом тителя Hal представляют собой атом хлора, хлора, R представляет собой изопропил, а оба заместиR представляет собой 2-хлорфеноксигруппу, а оба теля Hal представляют собой атом хлора, или заместителя Hal представляют собой атом хлора, R представляет собой изобут-3-ил, а оба заместителя Hal представляют собой атом хлора I X IIK_'4_'|[_J4_'lt*LJJI./-14_'l \j\J\J\jri ^ Л І І*_'К_"_*_'Ч_'І I VIJ I j 61871 7 Способ получения производных триазолопиримидина формулы , определенных в пп 5 и 6, отличающийся тем, что соединение общей формулы ОН он реагирует с хлорирующим или бромирующим агентом 8 Способ борьбы с грибками в локусе, отличающийся тем, что включает его обработку производным триазолопиримидина, как определено в любом из пп 5 или 6, или композицией по пп 1-4 9 Способ по п 8, отличающийся тем, что под локусом подразумеваются растения, подверженные или подвергнувшиеся грибковому заражению 10 Соединение по пп 5 и 6, отличающееся тем, что обладает фунгицидной активностью в котором заместитель R принимает значения, определенные в пп 5 и 6, Это изобретение относится к некоторым дигалотриазолопиримидина, некоторые из которых являются новыми, способам их получения, композициям, содержащим такие соединения и их использованию в качестве фунгицидов Chemical Abstracts (I964), 61 2941 раскрывает получение 5,7-дихлоро-6ниетил-1,2,4триазоло[1,5-а] пиримидина нагреванием 5,7дигидрокси-6ниетил-1,2,4-триазоло [1,5-а] пиримидина с хлорокисью фосфора в течение 4 часов при 100°С Однако, нет указания на то, что какоелибо из этих соединений обладает биологической активностью Европейская заявка заявителя №92204097,7 (ЕР-А-0550113), раскрывает соединения общей формулы X (А) в которой R представляет возможно замещенную арильную группу и X и У оба представляет атом хлора или атом брома, как промежуточные соединения в получении фунгицидно активных производных триазолопиримидина общей формулы ,1 (В) в которой R1 представляет возможно замещенную алкильную, алкенильную, алкинильную, циклоалкильную, бициклоалкильную или гетероциклильную группу, R2 представляет атом водорода или алкильную группу, или R1 и R2 вместе с атомом азота представляют возможно замещенное гете3 роциклическое кольцо R имеет значение, определенное выше, и R4 представляет водород или атом галогена или группу NR5R6, где R5 представляет атом водорода или группу амино, алкильную, циклоалкильную или бициклоалкильную и R6 представляет собой водород или алкил Однако в документе нет указания на наличие фунгицидной активности Предметом данного изобретения являются новые производные триазолопиримидина обшей формулы Hat (і) в которой R представляет собой С-і-Сє алкильную, С-і-Сб алкокси-группу, Сз-Cs циклоалкильную группу, фенилоксигруппу, замешенную атомом галогена или С1-С4 алкилом, тиенил, Hal представляет собой CI или Вг, при условии, что когда заместитель R представляет собой метильную группу, то обе группы заместителя Hal не являются атомами хлора, а также способ их получения взаимодействием соединения обшей формулы (II) в котором заместитель R принимает значения, определенные выше с хлорирующим или бромирующим агентом Другим аспектом изобретения является фунгицидная композиция, включающая производное триазолопиримидина в качестве активного компонента и носитель, отличающаяся тем, что в качестве указанного производного содержит 0,595%мас триазолопиримидинового соединения обшей формулы (і) в которой R представляет собой С-і-Сє алкильную, С-і-Сє алкокск-группу, Сз-Cs циклоалкильную группу/ фенил, замещенный 1-3 заместителями, выбранны 61871 ми из атомов галогена, С1-С4 алкила, С1-С4 галогеналкила, С1-С4 алкокси, С1-С4 галсгеналкокси, галогенсульфонила, фенила, фенокги и бензилоксигрупп, фенилоксигруппу, замещенную атомом галогена или С1-С4 алкилом, нафтил или тиенил, Hal представляет собой CI или Вг и способ борьбы с грибками в локусе, включающий его обработку производным триазолопиримидина, как определено выше, или композицией, включающей указанное производное и определенной выше Под локусом подразумеваются растения, подверженные или подвергнувшиеся грибковому заражению Носителем в композиции по изобретению может быть любой материал, с которым составляется активный ингредиент, чтобы облегчить применение в обрабатываемом очаге (локусе), который, например, является растением, семенами или почвой, или чтобы облегчить хранение, транспортировку или обращение Носитель может быть твердым или жидким, включая материал, который в обычных условиях газообразен, но может сжиматься до образования жидкости, при этом используется любой из обычно применяемых носителей в получении фунгицидных композиций Подходящие твердые носители включают природные и синтетические глины и силикаты, например, природные кремнеземы, такие, как диатомовые земли, силикаты магния, например, тальки, магний-алюминевые силикаты, например, аттацульгиты и вермикулиты, - силикаты алюминия, например, каолиниты, монтмориллониты и слюды, карбонат кальция, сульфат кальция, сульфат аммония, синтетические гидрированные оксиды кремния и синтетические силикаты кальция или алюминия, элементы, например, уголь и сера природные и синтетические смолы, например, кумароновые смолы, поливинилхлорид, и стиреновые полимеры и сополимеры, твердые полихлорфенолы, битумы, воски, например, пчелиный воск, парафиновый воск, и хлорированные минеральные воски, и твердые удобрения, например, суперфосфаты Подходящие жидкие носители включают воду, спирты, например, изопропанол и гликоли, кетоны, например, ацетон, метил-этиловый кетон, метилизобутиловый кетон и циклогексанон, эфиры, ароматические или алифатические углеводороды, например, бензол, толуол и ксилол, петролейные фракции, например, керосин и легкие минеральные масла, хлорированные углеводороды, например, тетрахлор-метан, перхлорэтилен и трихлорэтан Приемлемы также смеси различных жидкостей Фунгицидные композиции часто формируются и транспортируются в концентрированной форме, которая потом разбавляется пользователем непосредственно перед применением Наличие небольших количеств носителя, который представляет собой ПАВ, облегчает этот способ разбавления Поэтому лучше, чтобы хотя бы одним носителем в композиции по изобретению было ПАВ, Например, композиция может содержать, по меньшей мере, два носителя, по меньшей мере, один из которых является ПАВ 8 ПАВ может быть эмульгирующим, диспергирующим или смачивающим агентом, оно может быть неионным или ионным Примеры подходящих ПАВ включают натриевые или кальциевые соли полиакриловых кислот и сульфокислота лигнина, продукты конденсации жирных кислот или алифатические амиды или амины, содержащие по меньшей мере 12 атомов углерода в молекуле с этилен оксидом и/или пропилен оксидом, эфиры жирных кислот и глицерина, сорбита, сахарозы или пентаэритрита, их конденсаты этилен оксидом или/и пропилен оксидом, продукты конденсации спиртов жирного ряда или алкил фенолов, например, п-октилфенол или п-октилкрезол, этилен оксидом и/или пропилен оксидом, сульфаты или сульфонаты этих продуктов конденсации, соли щелочных или щелочноземельных металлов, предпочтительно, соли натрия, эфиры серной или сульфо-кислоты, содержащие, по меньшей мере, 10 атомов углерода в молекуле, например, натрий лаурил сульфат, вторалкил сульфаты натрия, натриевые соли сульфированного касторового масла и натрии алкилированные сульфонаты, такие, как додецилбензол сульфонат, и полимеры этилен оксида и сополимеры этиленоксида и пропилен оксида Композиции изобретения могут быть сформулированы, например, как смачиваемые порошки, дусты, гранулы, растворы, эмульгирующиеся концентраты, эмульсии, суспензионные концентраты и аэрозоли Сманиваемые порошки обычно содержат 25, 50 или 75вес% активного ингредиента и в дополнение к твердому инертному носителю содержит обычно 3-10вес% диспергирующего агента и при необходимости 0-10вес% стабилизатора или/и других добавок, таких, как пенетранты или связующие вещества Дусты обычно формируются в виде пылевого концентрата с составом, аналогичным составу смачиваемого порошка, но без дисперсанта, и могут разбавляться на поле другим твердым носителем, чтобы получить композицию, содержащую 0,5-10вес% активного ингредиента Размер гранул составляет обычно 10100 BS меш (1,676-0,152мм), и они производятся технологией аггломерации или пропитки Обычно гранулы содержат 0,5-75вес% активного ингредиента и 0-10вес% добавок, таких, как стабилизаторы, ПАВ, модификаторы медленного высвобождения и связующие агенты Так называемые сухие текучие порошки состоят из относительно небольших гранул с относительно высокой концентрацией активного ингредиента Эмульгирующиеся концентраты обычно содержат в дополнение к растворителю и при необходимости сорастворителю, 1-50вес%/об активного ингредиента, 220вес%/об , эмульгаторов и 0-20вес%/об других добавок, таких, как стабилизаторы, пенетранты и ингибиторы коррозии В состав суспензионных концентратов, чтобы получить стабильный не осаждающийся текучий продукт, входят 1075вес% активного ингредиента, 0,5-15вес% диспергирующих агентов, 0,1-10вес% суспендирующих агентов, таких, как защитные коллоиды и тиксотропные агенты, 0-10вес% других присадок, таких, как препятствующие образованию пены, ингибиторы коррозии, стабилизаторы, пенетранты 61871 и загустители, и вода или органическая жидкость, в которой активный ингредиент практически нерастворим, некоторые твердые органические вещества или неорганические соли могут присутствовать растворенными в препарате, чтобы воспрепятствовать осаждению или в качестве антифризов для воды Водные дисперсии и эмульсии, например, композиции, полученные разбавлением смачиваемого порошка или концентрата по изобретению водой, также входят в объем изобретения Указанные эмульсии могут быть типа вода-вмасле или масло-в-воде и могут иметь консистенцию майонеза Композиции изобретения могут содержать и другие ингредиенты, например, другие соединения, обладающие гербицидными, инсектицидными или фунгицидными свойствами Особый интерес в увеличении срока защитной активности соединений изобретения представляет использование носителя, который обеспечит медленное высвобождение фунгицидных соединений в среду растения, нуждающегося в защите Такие препараты с медленным высвобождением могут вводиться в почву у корней виноградной лозы или могут включать адгезивный компонент, позволяющий применять их непосредственно на стебель лозы Некоторые из соединений формулы I, как определено выше, являются новыми Соответственно, изобретение предусматривает также и соединение общей формулы I, как ранее указывалось с оговорками, что (і) если R представляет арильную группу возможно замещенную, обе группы Hal не представляют атом хлора или атом брома,и (м) если R представляет метильную группу, обе группы Hal не представляют атом хлора Далее настоящее изобретение предлагает способ получения соединения формулы I, как определено выше, который включает а) реакцию соединения общей формулы ОН (II) в которой R - как определено выше, с хлорирующим или бромирующим агентом, чтобы получить соединение форлулы І, в котором Hal представляет атом хлора или брома, b) при желании, реакцию соединения формулы I, полученного на стадии (а), с фторирующим агентом, чтобы получить соединение формулы I, в котором Hal представляет атом фтора, и c) при желании, реакцию соединения формулы I, полученного на стада (а), с ІЧНз, и затем с дийодометаном в присутствии диазотирующего агента, чтобы получить соединение формулы І, в которой, по меньшей мере, один Hal представляет атом йода Способ стадии (а) можно проводить в присутствии растворителя Подходящие растворители включают галогенированные углеводороды такие, 10 как дихлорметан Кроме того, избыток хлорирующего или бронирующего агента может служить растворителем Подходящие хлорирующие агенты включают оксихлорид, трихлорид и пентахлорид фосфора Подходящие бромирующие агенты включают оксибромид, три-бромид и пентабромид фосфора Реакция проводится при температуре в диапазоне от 0°С до температуры рефлюкса реакционной смеси, предпочтительная температура реакции составляет от 20°С до температуры рефлюкса реакционной смеси Способ стадии (Ь) проводится в присутствии растворителя Подходящие растворители включают сульфолан, диметилформамид или смесь ацетонитрила и краун-эфира Если в качестве растворителя используется сульфолан или диметилформамид, в качестве со растворителя хорошо использовать толуол, с целью дегидратирования фторирующего агента Реакция обычно проводится при температуре в диапазоне от комнатной температуры (около 15°С) до температуры флегмы реакционной смеси, предпочтительная температура реакции составляет от 40°С до температуры фяегмации реакционной смеси Подходящие фторирующие агенты включают фториды щелочных металлов, особенно фторид калия, пентафторид сурьмы и трифторид диэтиламиносеры Реакция с ІЧНз в способе стадии (с) проводится в присутствии растворителя Подходящие растворители включаютэфиры, такие, как диоксан, диэтиловый эфир и тетрагидрофуран, галогенированные углеводороды, такие, как дихлорметан, и, особенно, толуол Реакция хорошо осуществляется при температуре в диапазоне от 20°С до температуры флегмы реакционной смеси, предпочтительная температура реакции составляет от 40°С до температуры флегмы реакционной смеси Желательно также, чтобы реакция проводилась в присутствии основания и избыток ІЧНз может служить основанием Диазотирующим агентом, используемым в стадии (с) может быть любой алкиловый эфир азотистой кислоты, при этом лучше брать изопентил нитрит Если используется алкиловый эфир азотной кислоты, он может служить со растворителем с дийодометаном Эта реакция проводится при температуре от 60°С до 120°С, а лучше от 70°С до 110°С Обе стадии в способе стадии (с) можно проводить в одном реакторе Соединения форугулы II можно получить реакцией 3-амино-1,2,4-триазола с соответствующим эфиром малоновой кислоты в щелочных условиях по способу Y Makisumi, Chem Pharm Bull 9, 801, (1961) Далее изобретение предлагает использование в качестве фунгицида соединения общей формулы I, как указано выше, или композиции, как указано выше, и способ борьбы с грибками в очаге (локусе), который включает обработку очага, который может быть, например, растениями, подверженными воздействию грибков, семенами таких растений или средой, в которой растут эти растения, или будут расти, таким соединением или композицией Культуры, которые можно защищать от грибков, включают виноградную лозу, зерновые, такие, как пшеница, овес, яблони и томаты Срок защиты обычно зависит от отдельного вы 11 61871 бранного соединения и от многих внешних факторов, таких, как климат, воздействие которого обычно смягчается использованием подходящего препарата Далее изобретение иллюстрируется следующими примерами Пример 1 Получение 5,7-дихлоро-6-(2-хлорфенил)-1,2,4триазоло [1,5-а]пиримидина (Р=2-хлорфенил, Hal=CI) Смешивали 5,7-Дигидрокси-6-(2-хлорфенил)1,2,4-триазоло [1,5а]-пиримидина (6,2г, 0.026М) и 30мл оксихлорида фосфора и полученная суспензия выдерживалась при t° флегмы 3 часа Избыток оксихлорида фосфора отгоняли от полученного чистого раствора, и полученное вязкое масло растворяли в 50мл дихлорметана Для разложения следовых примесей оксихлорида фосфора в растворе дихлорметана медленно добавляли 50мл ледяной водыо Затем органический слой отделяли, высушивали сульфатом натрия и растворитель отгоняли в вакууме с получением 6,62г 5,7дихлоро-6-(2-хлорфенил)-1,2,4-триазоло-[1, 5а]пиримидина, в виде желтоватых кристаллов, т пл 153°С Выход 35% от теоретического Пример 2 Получение 5,7-дибромо-6-(2-хлорфенил)1,2,4-триазоло [1,5-а]пиримидина (Р=2-хлорфенил, Hal=Br) 5,7-Дигидрокси-6-(2-хлорфенил)-1,2,4триазоло[1,5а]-пиримидин (15г, 0.057М) добавляйся небольшими порциями при температуре около 110°С к расплавленному оксибромиду фосфора (избыток, 40г) После энергичной первоначальной реакции получалось чистое очень вязкое масло, которое оставляли при 120°С на 2 часа Смесь охлаждали до комнатной температуры и полученное "стекло" порциями добавляли к смеси воды и дихлорметана Органический слои отделяли сульфатом натрия и растворитель отгоняли в вакууме с получением 19,93г 5,7-дибромо-6-(2хлорфенил)-1,2,4-триазоло [1,5а]-пиримидина в виде желтоватых кристаллов, т пл 212°С Выход 90% от теоретического Примеры 3-52 Способами, аналогичными описанным в Примере I выше, были получены другие соединения по изобретению, указанные в Таблице I ниже В этой таблице соединения указаны со ссылкой на формулу I Таблица I Пример № 1 3 4 5 6 7 8 9 10 R 2 4-ОС2Н5 фенил 3-ОСНз фенил 2-ОСНз фенил 2-SO2CI фенил 3-CF3 фенил 4-СН(СНз)2 фенил 4-OOF3 фенил нафт-2-ил Hal Т пл (°С) 3 СІ 4 138 151 143 234 160 122 194 192 11 11 11 11 11 11 11 12 Продолжение таблицы 1 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 2 4-F фенил 4-ОС6Н5 фенил 4-бифенилил 3,4-(ОСНз)2 фенил 4-ОСН2С6Н5 фенил 2-F феніл 3-F фенил 2-Вг фенил 4-Вг фенил 2-ОСН2С6Н5 фенил 2,3-(ОСН3)2 фенил З-Вг фенил нафт-1 -ил 2,3-(ОС2Н5)2 фенил 3,4-СІ2 фенил Тиен-2-ил Тиен-3-ил 3,4,5-(ОСН3)з фенил 2-СНз фенил 3-СІ фенил 3,4-(СН3)2 фенил Циклопентил Циклогексил 2-F фенил 2,4-СІ2 фенил 4-С(СН3)з фенил 2-СІ, 6-F фенил 4-ОСНз фенил 2-CF3- фенил 4-Вг фенил 2-СІ, 6-F фенил 4-CF3 фенил 3-F фенил 2-CF3 фенил 2-F фенокси 2-СНз фенокси 2-СІ фенокси 2,6-(СН3)2 фенокси 3-СНз фенокси Этокси Изопропил Изобутил-3-ил 3 11 11 11 11 СІ 11 11 11 11 11 11 11 11 11 11 11 11 11 11 11 11 11 11 Вг СІ 11 11 11 11 Вг Вг 11 11 11 СІ " " " 4 206 160 170 185 170 173 227 176 190 аморфный 150 205 202 63 205 160 130 180 160 220 185 150 205-209 195 160 147 115 138 128 228-230 170 246 254 192 145 152 178-182 144-146 135-137 102-105 135-137 120-122 Пример 53 Фунгицидная активность соединений по изобретению исследовалась следующими тестами (а) Антиспорулянтная активность против ложной мучнистой росы винограда (Plasmopara viticola, PVA) Тест на непосредственное уничтожение спор с использованием распыления на листья Нижняя поверхность листьев всей виноградной лозы (Cabernet Sauvignon) инокулировали распылением водной суспензии, содержащей 2,5x104зооспорангий/мл за два дня до обработки испытуемым соединением Инокулированные растения выдерживались 24 часа в помещении с высокой влажность, затем 24 часа при тепличной температуре и влажности На нижние поверхности инфицированных листьев распыляли раствор активного материала в воде/ацетоне 1 1, содержащем 0,04% 'TWEEN 20" (Тов знак, ПАВ - полиоксиэтиленовый эфир сорбитана) Растения 61871 14 13 обрабатывали с использованием автоматической через 4 дня после инокуляции на основе процентлинии распыления и сопла Концентрация соединого показателя площади поверхности листа, охнения составила ЮООчаст/милл в объем распываченного поражением ления - 700л/га После распыления растения воз(e) Прямая защитная активность против серой вращали в нормальные тепличные условия на 96 плесени бобов (Botrytis omerea, BOB) часов и затем переносили в помещение с высокой Тест определяет прямую защиту распылением влажностью на 24 часа для инциирования споруна листья Верхние поверхности листьев растений ляции до оценки результатов Оценка проводибобов (The Sutton) подвергались распылению теслась на основе процентного показателя площади туемым соединением с дозировкой листа, покрытого спорами в сравнении с конЮООчаст/милл с использованием автоматической трольными растениями распылительной установки, как описано в (а) Через 24 часа после распыления листья инокулиро(b) Прямая защита против фитофтороза томавались водной суспензией, содержащей тов (Phytophthora mfestansi PIP) 105конидий/мл 4 дня после инокуляции растения Тест на прямую защиту с распылением на ливыдерживались влажными во влажном помещестья На верхние поверхности листьев томатов с нии при температуре 21 °С Заболевание оценивадвумя выпущенными листочками распылялось лось через 4 дня после инокуляции на основе испытуемое соединение с дозировкой процентного показателя площади поверхности ЮООчаст/милл с использованием распылителя, листа, охваченного поражением как описано в (а) После соответствующего периода в 24 часа в нормальных тепличных условиях (f) Активность противпятнистости пшеницы верхние поверхности листьев инокулпровались (beptosphaena nodorum, LN) распылением водной суспензии, содержащей Тест является прямым терапевтическим тес2х105зооспор/мл Инокулированные растения вытом, применяющим распыление на листья Листья держивались 24 часа в помещении с высокой пшеницы (Norman) на стадии одного листа инокувлажностью и 5 дней в условиях помещения для лировались распылением водной суспензии, сороста Оценка основывалась на процентном покадержащей 1хЮ6спор/мл Инокулированные растезателе пораженной площади листа в сравнении с ния выдерживались 24 часа в помещении с контрольными листьями высокой влажностью до обработки На растения распылялся раствор тестуемого соединения с (c) Прямая защита против ложной мучнистой дозировкой ЮООчаст/милл, с использованием авросы винограда (Plasmopara vitieola PVP) томатизированной распыляющей установки, как Тест является прямым тестом с использоваописано в (а) После высыхания растения выдернием распыления на листья На нижнюю поверхживались 6-8 дней при 22°С и умеренной влажноность листьев всего растения винограда (Cabernet сти, затем оценивались Оценка основывалась на Sauvignon) распылялось тестуемое соединение с плотности поражений на лист в сравнении с лидозировкой ЮООчаст/милл с использованием австьями контрольных растений томатической линии распыления, как описано в (а), и после последующего периода в 24 часа в (д) Активность против бурой ржавчины пшенинормальных тепличных условиях нижние поверхцы (Puccmia recondita, PR) ности листьев инокул провались распылением Тест является прямым защитным с распылеводной суспензии, содержащей нием на листья Ростки пшеницы (Avalon) выращивались до стадии 1-1,5 листа Затем на расте2,5хЮ4зооспорангий/мл Инокулированные растения распыляли тестуемое соединение с ния выдерживались 24 часа в помещении с высодозировкой ЮООчаст/милл с использованием авкой влажностью, 5 дней в нормальных тепличных томатической распылительной установки, как опиусловиях, и затем возвращались на 24 часа в уссано в (а) Тестуемые соединения применяли как ловия высокой влажности Оценка проводилась по растворы или суспензии в смеси ацетона и воды процентному показателю площади листа, покры(50 50об/об)» содержащей 0.04ПАВ ('TWEEN 20" той спорами в сравнении с площадью на кон- Тов знак) Через 18-24 часа после обработки трольных листьях ростки инокулировались распылением на расте(d) Активность против ранней гнили томатов ния со всех сторон водной споровой суспензией, (Alternana solam, AS) содержащей около 10 спор/мл 18 часов после Этот тест определяет контактную профилакинокуляции растения выдерживались в условиях тическую активность тестуемого соединения, привысокой влажности при температуре 20-22°С Поменяемого в форме распыления на листья Ростки сле этого растения содержались в тепличных устоматов (Outdoor Girl) выращивались до стадии, ловиях, близких к окружающей среде, то есть в на которой распускается второй истинный лист умеренной относительной влажности и при темРастения обрабатывали с использованием автопературе 20°С Заболевание оценивалось через матической линии распыления, как описано в (а) 10 дней после инокуляции на основе процентного Тестуемые соединения применялись как растворы показателя площади растения, покрытого споруили суспензии в смеси ацетона и воды ляционными пустулами, в сравнении с контроль(50 50об/об), содержащей 0,04% ПАВ ('TWEEN ными растениями 20" - Тов знак) Через день после -обработки ростки инокулировались распылением на верхние (h) Активность против настоящей мучнистой поверхности листьев суспензии A Solam comdia, росы овса (Erysiphe grammis f sp hordei, EG) 4 содержащей 10 спор/мл 4 дня после инокуляции Тест является прямым терапевтическим тесрастения выдерживались влажными во влажном том, применяющим распыление на листья Листья помещении при 21 °С Заболевание оценивалось ростков овса (Golden Promise) инокулировались 61871 16 15 нанесением пыли конидий мучнистой росы за показателе в сравнении либо с необработанными день до обработки тестуемым соединением Иноконтрольными объектами, либо контрольными кулированные растения выдерживались всю ночь объектами, с распылением разбавителем по крипри обычной тепличной температуре и влажности териям до проведения обработки На растения распыля0 - подавление заболевания менее, чем на лось тестуемое соединение с дозировкой 50%, ЮООчаст/милл с использованием автоматической 1 - подавление заболевания на 50-80%, распыляющей установки, как описано в (а) После 2 - подавление заболевания более, чем на высыхания растения возвращались в помещение 80% при 20-25°С и умеренной влажности на срок до 7 Результаты этих тестов изложены в Таблице II дней, затем проводилась оценка Оценка основыниже валась на процентном показателе площади листа, покрытого слоруляцией в сравнении с листьями Таблица I I на контрольных растениях (і) Активность против пиржуляриоза риса (Pynculana oryzae, PO) Это прямой терапевтический тест с применением распыления на листья На листья рисовых ростков (Aichiaishi - около - 30 ростков на горшочек) распылялась водная суспензия, содержащая 10спор/мл за 20-24 часа до обработки тестуемым соединением Инокулированные растения выдерживались всю ночь в высокой влажности и затем им давали высохнуть до распыления тестуемого соединения с дозировкой 10ООчаст/милл с использованием автоматической распылительной установки, как описано в (а) После обработки растения выдерживались в помещении, специальном для выращивания риса при 25-30°С и высокой влажности Оценка проводилась спустя 4-5 дней после обработки и основывалась на плотности некротических поражений на лист в сравнении с контрольными растениями 0) Активность против глазковой пятнистости пшеницы in vitro (Pseudocercosporella herpotnchoides, PHI) Этот тест определяет in vitro активность соединений против грибка, вызывающего пятнистость пшеницы Тестуемое соединение растворяется или суспендируется в ацетоне и добавляется в 4мл аликвоты разбавленного наполовину бульона картофельной декстрозы, помещенные в чашки Петри с 25 клетками с получением окончательной концентрации в 50част/милл соединения и 2,5% ацетона Каждая клетка инокулировалась кусочком агара/мицелия диаметром в 6мм, взятого из 14-дневной культуры Р herpotnchoides Чашки инкубировались при 20°С 12 дней до определения мицелиального роста (к) АКТИВНОСТЬ против Fusanum m-vitro (Fusanum culmorum, FSI) Этот тест определяет in vitro активность соединений против видов Fusanum, которые вызывают гниение стебля и корней Тестуемое соединение растворялось или суспендировалось в ацетоне и добавлялось к расплавленному агару картофельной декстрозы в половинной концентрации с получением окончательной концентрации в 50част/милл соединения и 2,5% ацетона После застывания агара чашки инокулировались кусочками агара и мицелия диаметром в 6мм, взятыми от 7-дневной культуры Fusanum ар Чашки инкубировались при 20°С 5 дней, и определялся радиальный рост от кусочков Степень подавления заболевания во всех вышеописанных тестах выражалась в процентном Пример Фунгицидная активность № PVA PIP PVP AS ВСВ LN PR EG PO PHI FSI 1 1 1 2 2 2 2 4 1 1 2 1 2 2 5 2 2 2 1 2 2 7 1 1 2 2 2 8 2 2 2 1 2 2 9 1 2 2 2 2 2 10 2 2 2 2 1 11 2 2 2 2 2 12 2 2 2 1 13 2 2 14 2 1 15 2 1 2 1 1 16 2 2 1 2 2 17 2 2 2 2 2 18 2 2 2 2 2 19 2 2 2 2 20 2 2 2 1 21 2 2 2 2 23 2 2 1 1 24 2 2 1 2 2 25 1 1 1 1 26 1 2 1 2 2 Пример 54 (a) Антиспорулянтная активность против мучнистой росы винограда (Plasmopara viticola, PVA) Тест является прямым антиспорулянтным тестом с применением распыления на листья Нижняя поверхность листа виноградных лоз (Cabernet Suavignon) высотой приблизительно в 8см инокулируется водной суспензией, содержащей 5x10 зооспорангий/мл Инокулированные растения выдерживаются 24 часа при 21 °С в помещении с высокой влажностью, затем 24 часа в теплице при 20°С и относительной влажности 40% На нижнюю поверхность инфицированных листьев распыляется раствор тестуемого соединения в 1 1 воде/ацетоне, содержащий 0,04% " TWEEN 20" Растения распыляются из разбрызгивателя с двумя соплами Концентрация соединения составляет 600част/милл и объем распыления - 750л/га После высыхания растения возвращаются в таблицу при 20°С и 40% относительной влажности на 96 часов и затем переносятся в помещение с высокой влажностью на 24 часа для индуцирования споруляции Оценка основывается на процентном показателе площади листа, покрытого спорами в сравнении со спорами на контрольных листьях (b) Прямая защитная активность против фитофтороза томатов (Phytophthora mfestans, PIP) Это прямой защитный тест, использующий распыление на листья На растения томатов с двумя распустившимися листами (First in the Field) 18 17 61871 распыляется тестуемое соединение с дозировкой PHI) 600част/милл , как описано в (а) После высыхаЭтот тест определяет in vitro активность сония растения выдерживаются 24 часа в теплице единений против грибка, вызывающего глазковую при 20°С и 40% относительной влажности Затем пятнистость пшеницы Тестуемое соединение расверхние поверхности листьев инокулируются водтворяется или суспендируется в ацетоне и добавляется в 4-х миллилитровые аликвоты бульона ной суспензией, содержащей картофельной декстрозы с половинной концен2х105зооспорангий/мл Инокулированные растетрацией, помещенные в чашки Петри с 25 секцияния выдерживаются 24 часа при 18°С в помещеми с получением окончательной концентрации нии с высокой влажностью и затем 5 дней в каметестуемого соединения с Ючаст/милл и ацетона ре роста при 15°С и 80% относительной 0,825 Грибковый инокулят состоит из фрагментов влажности с 14 часами светового дня Оценка осмицелия, Р herpotnchoides , выращенного в бульонована на процентном показателе пораженной не картофельной декстрозы с половинной конценплощади листа в сравнении с площадью на контрацией во встряхиваемых колбах, и он добавлялтрольных листьях ся к бульону в количестве 5x104 фрагментов (c) Активность против раннего фитофтороза мицелия/мл бульона Чашки Петри инкубироватоматов (Alternana solam, AS) лись при 20°С 10 дней до оценки мицелиального Это прямой профилактический тест, примероста няющий распыление на листву Ростки томатов (Outdoor Girl) на стадии развертывания второго (д) Активность против Rhizoctoma in vitro листка подвергаются распылению тестуемым со(Rhizoctoma solam RSI) единением с дозировкой 600част/милл , как опиТест определяет in vitro активность соединесано в (а) После высыхания растения выдержиний против Rhizoctoma solam, которое вызывает ваются 24 часа в теплице при 20°С и 40% гниение корня и стеблей Тестуемое соединение относительной влажности с последующей инокурастворяется или суспендируется в ацетоне и ляцией верхних поверхностей листьев водной добавляется в 4 миллилитровые аликвоты бульосуспензией конидий A solam, содержащей на картофельной декстрозы с половинной концен1х104конидий/мл После 4 дней нахождения в потрацией, разлитые в чашки Петри с 25 секциями с мещении с высокой влажностью при 21 °С провополучением окончательной концентрации соедидится оценка заболевания по процентному поканения в Ючаст/милл и ацетона 0,825%,, Грибковый зателю площади поверхности листа, охваченной инокулят состоит из мицелиальных фрагментов R поражением в сравнении с контрольными растеsolam, выращенных в бульоне картофельной декниями строзы с половинной концентрацией в колбах для культур, и добавляется к бульону в количестве (d) Прямая защитная активность против серой 5x104 фрагментов/мл бульона Чашки Петри инкуплесени бобов (Botrytis cmerea, BCB) бируются при 20°С 10 дней до определения роста Это прямой защитный тест с использованием мицелия распыления на листву Растения бобов (The Sutton) с двумя парами листьев подвергались распы(h) Активность против парии яблони in vitro лению тестуемым соединением с дозировкой (Ventuna maequahs, VII) 600част/милл , как описано в (а) После высыхаЭтот тест определяет in vitro активность сония растения выдерживались 24 часа в теплице единений против Ventuna maequahs, которая выпри 20°С и 40% относительной влажности Затем зывает паршу яблонь Тестуемое соединение расверхняя поверхность листьев инокулировалась творяется или суспендируется в ацетоне и водной суспензией, содержащей 1x10 конидий/мл добавляется в 4-миллилитровые аликвоты бульоРастения выдерживались 4 дня при 20°С в помена картофельной декстрозы с половинной конценщении с высокой влажностью Оценка проводитрацией, разлитые в чашки Петри с 25 секциями с лась по процентному показателю площади листа, получением окончательной концентрации соедизатронутой заболеванием в сравнении с площанения в Ючаст/милл и ацетона 0,825% Грибкодью на контрольных листьях вый инокулят состоит из мицелиальных фрагментов и спор V maequahs, выращенных на (e) Активность против пятнистости пшеницы солодовом агаре и добавленных к бульону в коли(Leptosphaena nodorum, LN) честве 5x104стадий/мл бульона Чашки Петри инЭто прямой терапевтический тесте применекубируются при 20°С 20 дней до оценки роста, нием распыления на листву Ростки пшеницы мицелия Степень подавления заболевания во (Norman) на стадии одного листа инокулируются всех вышеуказанных тестах выражена как показаводной суспензией, содержащей тель в сравнении с необработанными контроль1,5х106конидий/мл Инокулированные растения ными объектами или с контрольными объектами, выдерживаются 24 часа при 20°С в помещении с обработанными разбавителем, в соответствии с высокой влажностью с последующим распыленикритериями ем тестуемого соединения, как описано в (а) После высыхания растения содержатся 6-8 дней в теплице при 22°С и 70% относительной влажности Оценка проводится по плотности поражений на лист в сравнении с поражениями листьев контрольных растений (f) Активность против глазковой пятнистости in vitro пшеницы (Pseudocercosporella herpotnchoides, 0 = подавление заболевания меньше, чем на 50%, 1 = подавление заболевания на 50-80%, 2 = подавление заболевания более, чем на 89% Результаты эти тестов изложены в Таблице III ниже 19 61871 Таблица I № примера PVA 27 28 23 1 30 31 32 33 34 35 36 37 38 39 40 2 PIP 2 2 2 2 2 1 AS 2 2 1 2 1 2 2 2 LN 1 1 2 2 2 ВСВ 1 2 2 2 2 1 22 1 2 2 2 1 PHI 2* 2* 2* 2* 2* 2* 2 2 2 2 2 2 2 2 RSI 2* 2* 2* 2* 2* 2* 2* 1 1 2 1 1 VII 2* 2* 2* 2* 2* 2* 2* 2 2 2 2 2 2 2 2 * обозначает дозировку тестуемого соединения ЗОчаст/милл Пример 55 Определение MIC величин (Минимальная концентрация подавления соединений против различных Фитопатогенных грибков) 20 Величины MIC определялись тестами серийного разбавления с использованием микротитровальных планшетов с 48 лунками Разбавление тестуемых соединений в питательном растворе и распределение в лунки осуществлялось роботомпроцессором TECAN RSP 5000 Соединения разбавлялись до следующих концентраций 100, 50, 25, 12,5, 6,25, 3,13, 1,56, 0,78, 0,39, 0,20, 0,10 и 0,05ш7мл Для получения питательного раствора V8 сок (Тов знак) нейтрализовался карбонатом кальция и центрифугировался Всплывающий (супернатантный) слой разбавлялся дистиллированной водой (1 5) до, окончательной концентрации Грибки (Alternana solani, Botrytis cmerea, Pseudocercos-porella herpotnchoides, Micronectnella mvahs, Gaeumannorayces gramims) добавлялись в лунки каплей споровой суспензии Затем микротитровальные планшеты инкубировались при 20°С 6-8 дней Величина MIG низшей концентрации в серии разбавлений без роста мицелия определялась визуальным осмотром планшетов Результаты этих тестов изложены в Таблице IV ниже Таблица IV № примера 1 3 6 9 11 13 14 17 19 26 29 31 35 36 41 42 43 44 Alternana solani Botrytis cmerea Величина MIC (част/милл) Pseudocer-cosporella herpotn-choides Micronectnella Gaeuman-nomyces mvahs gramims 25 0 6 25 1 56 0 78 313 0 20 125 313 >100 0 25 0 25 0 125 6 25 125 125 6 25 313 0 78 0 39 6 25 6 25 125 6 25 0 78 6 25 313 0 39 0 39 010 0 20 0 39 0 78 0 78 010 0 39 1 56 0 78 0 39 0 78 >100 0 50 0 >100 0 >100 0 >100 0 25 0 >100 0 >100 0 >100 0 Пример 56 Определение минимальной концентрации подавления тестуемых соединений в тесте серийного разбавления с фитопатогенными грибками AIternana solani, Botrytis cmerea, Rhizoctoma solani Тест серийного разбавления проводился с использованием микротитровалъных планшетов с 24 или 48 лунками на планшет Тестуемые соединения использовались в виде 1000цг/мл водной суспензии, содержащей 20% ацетона, которая затем стерильно фильтровалась через 0,2ц фильтр Разбавление стерильной фунгицид ной суспензии питательным раствором и последующее закапывание в лунки проводилось с исполь зованием робота-процессора TECAN RSP 500 Диапазон тестуемых концентраций был от 100цг/мл до 0,05цг/мл Делалось 12 разбавлений Питательный раствор выбирался в соответствии с питательными потребностями патогена Инокулят добавлялся каплей (50шп) споровой суспензии (5х108)мл в лунки Оценка После 6-12 дней инкубации при подходящих температурах величина, МІС определялась визуальной оценкой Самая низкая концентрация в ряде разбавления без роста мицелия была определена как МІС величина Результаты изложены в Таблице V ниже 21 22 61871 Таблица V № примера Alternana solani 48 49 50 51 25 0 25 0 125 125 Величина МІС (част/милл) Botrytis cmerea >100 0 6 25 25 0 125 Пример 57 Полевое испытание на Cercospora arachidicola арахиса 15 семян арахиса были посажены в горшочки, наполненные почвенным субстратом Когда растения выпустили 4 истинные листа (приблизительно 12-14 дней после посева) они обрабатывались из ручного распылителя фунгицидами и тестуемыми соединениями Тестуемые соединения применялись с концентрацией 500цг/мл в смеси, содержащей 10% ацетон и 0,05% Tntor X 155 в воде Общее количество распылительной смеси соответствовало 1000л/га На обработку использовалось 6 горшочков Через 2 дня после обработки горшочки выставлялись в поле рядом с растениями арахиса, на которых грибок Cercospora arachidicola образовал участки споруляций Оценка проводилась через 15 дней после обработки определением процента заражений площади листа Процентная эффективность рассчитывалась с использованием формулы Эббота >100 0 >100 0 100 0 25 0 155 в воде Общее количество распылительной смеси соответствовало 1000л/га На обработку делалось 6 повторов Через 2 дня после обработки горшочки выставлялись в поле рядом с растениями, на листях которых грибок Puccima arachidis образовал слорулирующие пустулы Оценка проводилась через 19 дней после обработки определением процентного показателя зараженной площади листа Процентная эффективность рассчитывалась с использованием формулы Эббота Результаты Результаты изложены в Таблице VI ниже Таблица VI Пример № 7 8 9 11 12 16 25 38 Полевое испытание на Puccima arachidis на арахисе 15 семян арахиса были посажены в горшочки, наполненные почвенным субстратом Когда растения выпустили 4 истинные листа, они обрабатывались из ручного распылителя фунгицидами и тестуемыми соединениями Тестуемые соединения применялись с концентрацией 500цг/мл в смеси, содержащей 10% ацетон и 0,05% Triton X Комп'ютерна верстка Т Чепелєва Rhizoctoma solani % эффективности Puccima araGercospora arachidicola chidis 25 58 17 33 25 50 25 33 33 67 42 50 42 25 42 42 Підписне Тираж39 прим Міністерство освіти і науки України Державний департаментінтелектуальної власності, Львівська площа, 8, м Київ, МСП, 04655, Україна ДП "Український інститут промислової власності", вул Сім'ї Хохлових, 15, м Київ, 04119
ДивитисяДодаткова інформація
Назва патенту англійськоюFungicidal composition, dihalotriazolopyrimidine derivatives, method for preparation thereof and method for fungus control
Назва патенту російськоюФунгицидная композиция, производные триазолопиримидина, способ их получения и способ борьбы с грибками
МПК / Мітки
МПК: A01P 3/00, A01N 43/90, C07D 487/04
Мітки: триазолопіримідину, фунгіцидна, боротьби, композиція, грибками, спосіб, похідні, одержання
Код посилання
<a href="https://ua.patents.su/11-61871-fungicidna-kompoziciya-pokhidni-triazolopirimidinu-sposib-kh-oderzhannya-ta-sposib-borotbi-z-gribkami.html" target="_blank" rel="follow" title="База патентів України">Фунгіцидна композиція, похідні триазолопіримідину, спосіб їх одержання та спосіб боротьби з грибками</a>
Попередній патент: Прохідницький комбайн “mir”
Випадковий патент: Перетворювач температури