Спосіб одержання фармацевтичних проміжних сполук
Номер патенту: 98023
Опубліковано: 10.04.2012
Автори: Лукаш Дьюла, Волк Балаж, Мезей Тібор, Вайон Марія, БАРКОЦІ Йожеф, Порч-Маккай Марта, Молнар Еніко, Суладій Янош
Формула / Реферат
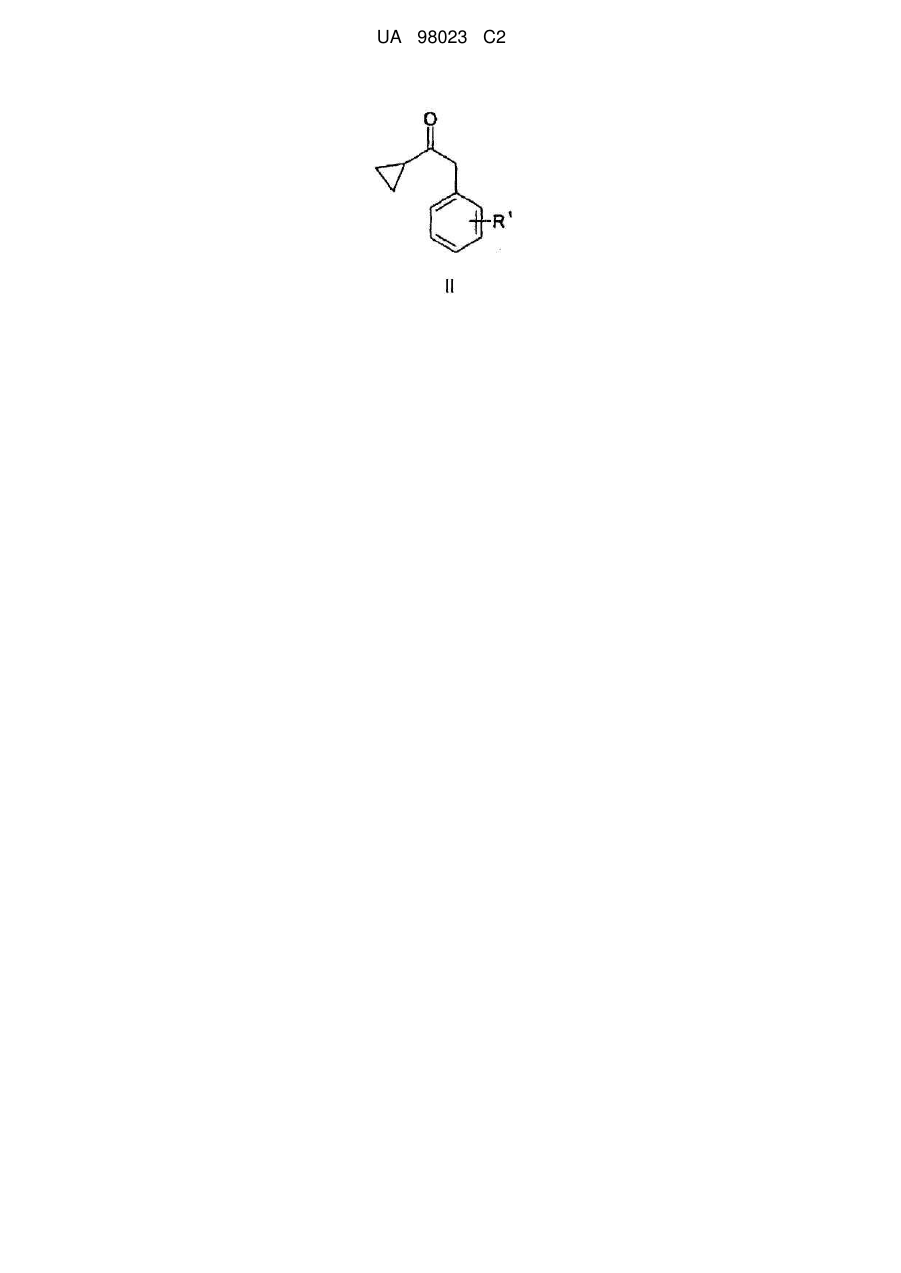
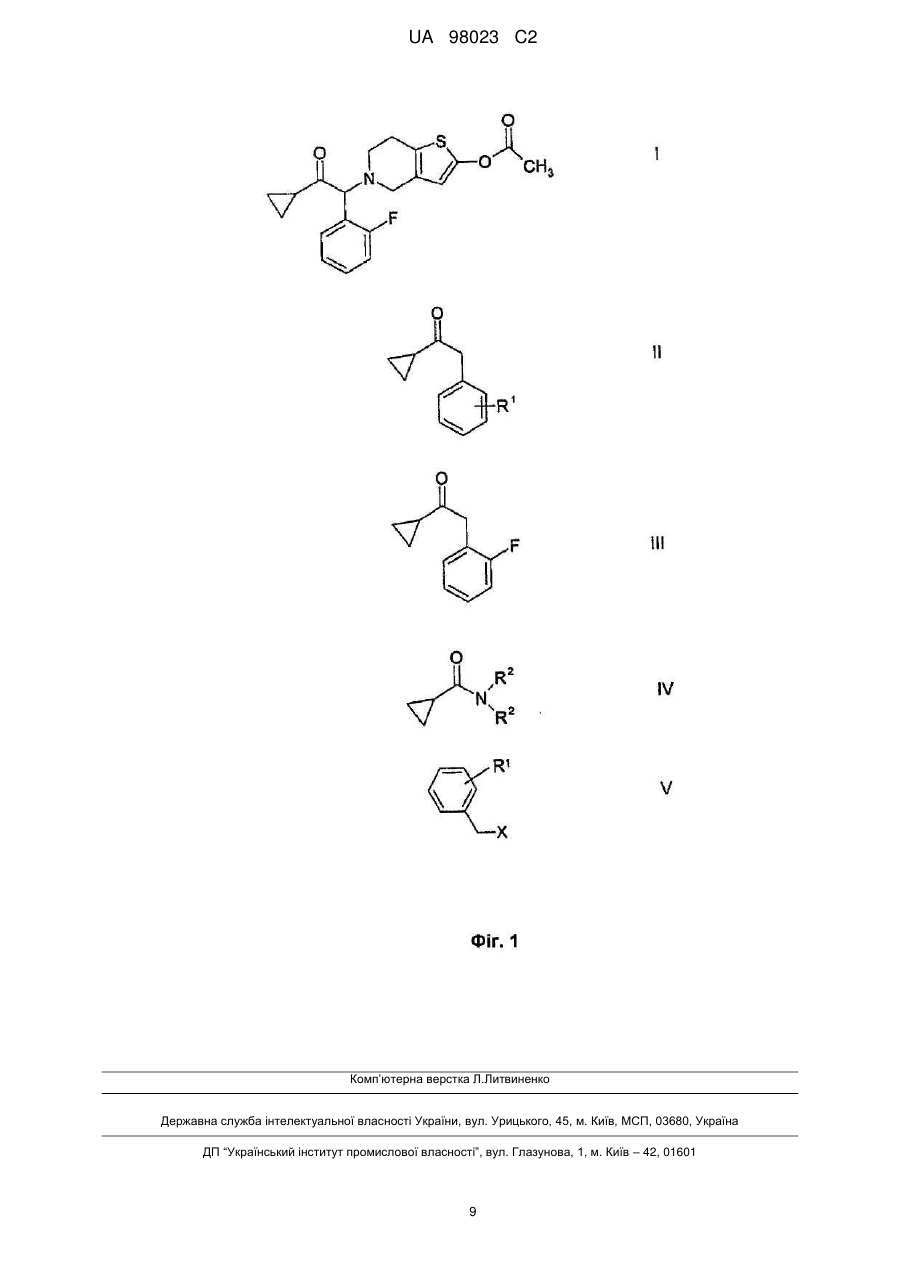
1. Спосіб одержання сполук загальної формули (II)
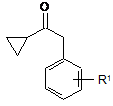 , II
, II
де R1 є атомом фтору, хлору або С1-4алкоксигрупою, де реактив Гриньяра, одержаний із сполуки загальної формули (V)
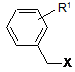 , V
, V
де X є атомом хлору, піддають взаємодії із сполукою загальної формули (IV)
 , IV
, IV
де R2 є С1-4алкільною групою з нерозгалуженим або розгалуженим ланцюгом.
2. Спосіб за п. 1, який відрізняється тим, що для одержання реактиву Гриньяра використовують 1,0-1,5 моль еквівалента, переважно 1,0-1,3 моль еквівалента, магнію, з розрахунку на сполуку формули (V).
3. Спосіб за п. 2, який відрізняється тим, що використовують 1,0-1,3 моль еквівалента магнію.
4. Спосіб за п. 1, який відрізняється тим, що в сполуці формули (IV) R2 є метильною групою.
5. Спосіб за п. 1, який відрізняється тим, що реактив Гриньяра піддають взаємодії з 0,7-1,1 моль еквівалента сполуки формули (IV).
6. Спосіб за п. 1, який відрізняється тим, що реакцію проводять в розчиннику типу простого ефіру, переважно в діетиловому ефірі, трет-бутилметиловому ефірі, діізопропіловому ефірі, дибутиловому ефірі, тетрагідрофурані або діоксані.
7. Спосіб за п. 6, який відрізняється тим, що реакцію проводять в діетиловому ефірі, трет-бутилметиловому ефірі, діізопропіловому ефірі, дибутиловому ефірі, тетрагідрофурані або діоксані.
8. Спосіб за п. 1, який відрізняється тим, що реакцію проводять в діетиловому ефірі, трет-бутилметиловому ефірі або діізопропіловому ефірі.
9. Спосіб за п. 1, який відрізняється тим, що реакцію проводять при температурі 20-100 °С.
10. Спосіб за п. 9, який відрізняється тим, що реакцію проводять при температурі кипіння розчинника типу простого ефіру.
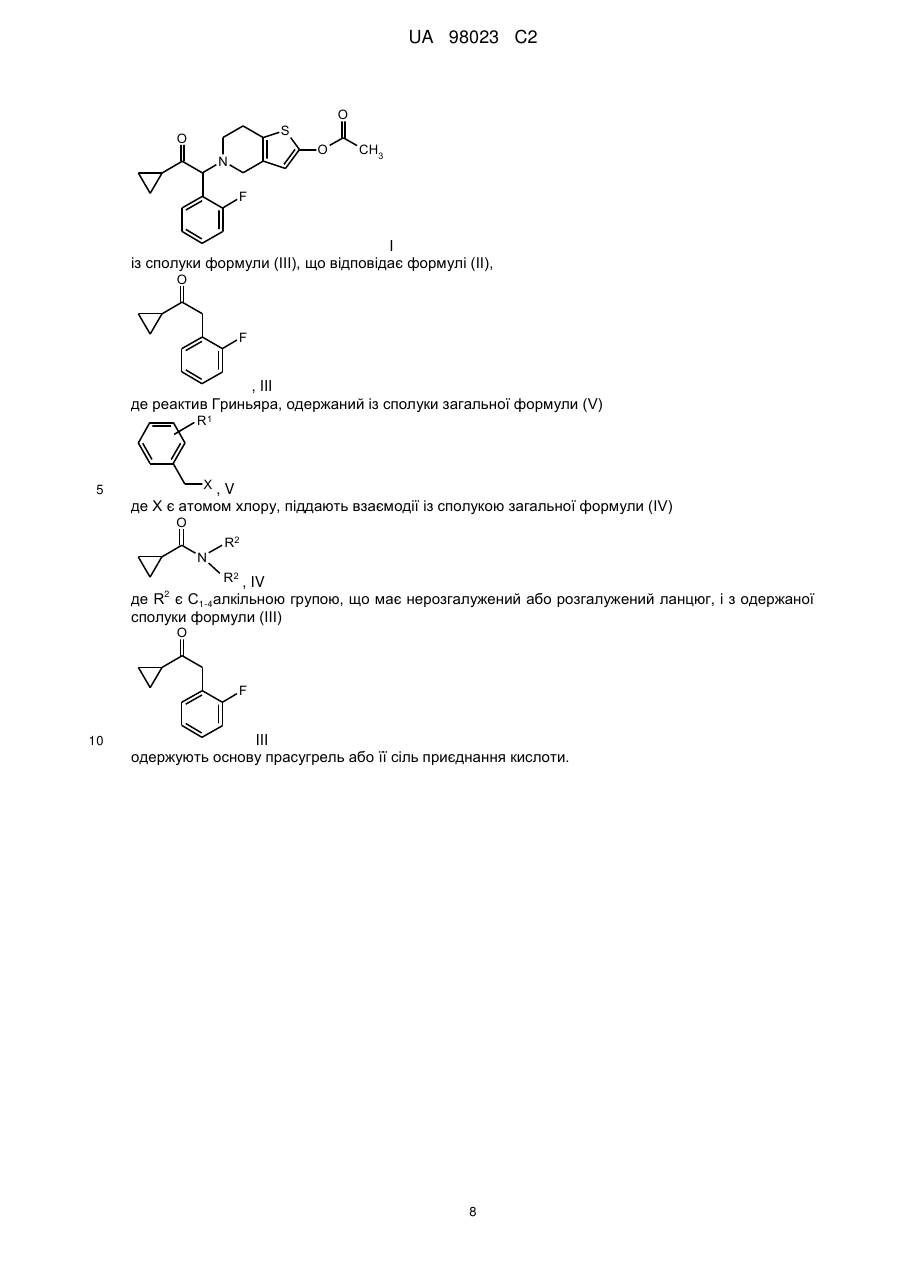
11. Спосіб за п. 1 одержання сполуки формули (І)
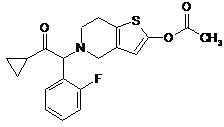 I
I
із сполуки формули (III), що відповідає формулі (II),
 , III
, III
де реактив Гриньяра, одержаний із сполуки загальної формули (V)
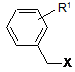 , V
, V
де X є атомом хлору, піддають взаємодії із сполукою загальної формули (IV)
 , IV
, IV
де R2 є С1-4алкільною групою, що має нерозгалужений або розгалужений ланцюг, і з одержаної сполуки формули (III)
 III
III
одержують основу прасугрель або її сіль приєднання кислоти.
Текст
Реферат: 1 Винахід стосується способу одержання сполук циклопропілбензилкетону формули (II), де R є атомом фтору або хлору, або С1-4алкоксигрупи, шляхом взаємодії реактиву Гриньяра, одержаного реакцією сполуки формули (V), де X є атомом хлору або фтору, із сполукою 2 формули (IV), де R представляє С1-4алкільну групу з нерозгалуженим або розгалуженим ланцюгом. Спосіб можна переважно здійснювати в промисловому масштабі. Сполука формули 1 (II), де R є атомом фтору в положенні 2, є проміжною сполукою в процесі одержання прасугрелю, що є інгібітором тромбоцитів, використовуваного в терапії. UA 98023 C2 (12) UA 98023 C2 UA 98023 C2 5 10 15 20 25 30 35 40 45 50 55 Винахід відноситься до способу одержання сполук циклопропілбензилкетону загальної формули (II) взаємодією з реактивом Гриньяра, одержаного із сполук формули (V) і диалкіламідних сполук циклопропанкарбонової кислоти формули (IV), що застосовується переважно в промисловому масштабі. Передумови створення винаходу Сполуки циклопропілбензилкетону загальної формули (II) є важливими початковими речовинами похідних тетрагідротіенопіридіну, що використовуються в терапії. Одним з найбільш важливих представників похідних тетрагідротіенопіридіну є сполука формули (І), а саме 5-[2-циклопропіл-1-(2-фторфеніл)-2-оксоетил]-4,5,6,7-тетрагідротіено[3,2-с]-піридін-2ілацетат, що має міжнародну непатентовану назву прасугрель, який застосовується для запобігання і лікування тромбозу і тромбоемболії. Інгібітор тромбоцитів прасугрель, його похідні і спосіб їх одержання описаний вперше в патенті Угорщини № 218 785 і патенті Угорщини № 211876. Мета даного винаходу полягає у одержанні сполук циклопропілбензилкетону формули (II) з високим ступенем чистоти, що складають дуже важливу структурну частину вказаних вище сполук. Спосіб добре застосовується в промисловому масштабі. В процесі одержання прасугреля, а також сполук - ефективних інгібіторів тромбоцитів, що мають схожу структуру, ключовими проміжними сполуками є кетонові сполуки загальної формули (II), які можуть містити різні замінники в ароматичному кільці. Найбільш важливими представниками даних сполук є галогензаміщені похідні, особливо хлор- або фтор-заміщені. З літератури відомо тільки декілька способів одержання даних похідних і дані способи вельми віддалено відносяться до промислових масштабів виробництва. Згідно способу одержання, описаному в патенті Угорщини № 218 785 і патенті Угорщини № 211 876, сполуки циклопропілбензилкетону формули (II) одержують реакцією 2фторбензилмагнію броміду або 2-хлорбензилмагнію броміду і циклопропанкарбонітрилу. Реакцію проводять при температурі кипіння діетилового ефіру, і одержаний комплекс гасять водним розчином хлориду амонію, продукт екстрагують і очищають колоночною хроматографією. Вихід способу складає 70 % або 69 %, відповідно. У патенті Угорщини № 211 876 також описані інші способи, де сполуки 2-фторбензилмагнію галогенід піддають взаємодії, замість циклопропанкарбонітрилом, з хлорунгідридом, наприклад циклобутанкарбонілхлоридом. Реакцію виконують при дуже низькій температурі (-70 °C) і неочищений продукт одержують екстракцією і очищають колоночною хроматографією. Вихід способу дуже низький і складає 39 %. У вказаній вище реакції Гриньяра для одержання сполук формули (II) можлива взаємодія ефіру, нітрилу або хлорунгідриду з двома еквівалентами реактиву Гриньяра замість одного. Такі реакції знижують вихід способу одержання, і в результаті можуть утворюватися деякі побічні продукти, що містять гідроксильну групу. У способі одержання, описаному в патенті Угорщини № 218785 і 211 876, реактив Гриньяра одержують з бромопохідних. Згідно даного винаходу, в способі одержання сполук циклопропілбензилкетону формули (II) реактив Гриньяра одержують з більш відповідного і дешевого 2-фторбензилхлориду замість 2-фторбензилброміду. Серед галогенових похідних, використання хлорпохідних економічніше, оскільки вони є дешевшими і для реакції потрібна менша кількість, оскільки вони мають меншу молекулярну вагу в порівнянні з похідними брому. Спосіб одержання, описаний в патенті Угорщини № 211 876 не підходить для одержання ліків в промислових масштабах, оскільки очищення виконується колоночною хроматографією, і даний спосіб не застосовується для одержання великих кількостей кінцевого продукту. Для очищення необхідна велика кількість реагентів, тому спосіб є дорожчим, і, крім того, шкідливим для навколишнього середовища. Іншим недоліком реакцій, відомих з літератури, є те, що кислі хлориди і ангідриди - див. опис патенту Угорщини № 211876 - взаємодіють з бензилмагнію бромідом при дуже низьких температурах, від -70 до -50 °C. Тому ці способи, окрім труднощів, викликаних очищенням шляхом колоночної хроматографії, є непридатними для виробництва в промислових масштабах, і, крім того, є енерговитратними і дорогими. У патенті США № 5874581 описаний спосіб одержання сполук формули (II), де два еквіваленти 2-пропілмагнію хлориду взаємодіють з 2-фтороцетовою кислотою в тетрагідрофурані, при температурі кипіння розчинника. Одержаний комплекс реагує при температурі 5 °C з етил- або метилциклопропанкарбоксилатом. Реакційну суміш перемішують протягом трьох годин і додають соляну кислоту, далі суміш нейтралізують, екстрагують, упарюють, і, вкінці фракції одержують у вакуумі. 1 UA 98023 C2 5 10 Недоліком способу описаного в патенті США № 5874581 є використання дуже дорогих початкових матеріалів, і більше двох еквівалентів реактиву Гриньяра для синтезу. Вихід реакції складає 56 %, чистота одержуваного продукту не вказана. Мета даного винаходу - уникнути недоліки способів, описаних вище, і розробити економічний, простий спосіб одержання з хорошим виходом, який дозволятиме уникнути стадії очищення колоночною хроматографією і який можна буде з успіхом використовувати для одержання в промислових масштабах. Вказані вище цілі можна досягти за допомогою способу згідно даного винаходу. Короткий опис винаходу Метою даного винаходу є спосіб одержання сполук загальної формули (II) 1 де R є атомом фтору, хлору або С1-4алкоксигрупи, де реактив Гриньяра, одержаний із сполуки загальної формули (V) 15 де X є атомом хлору, взаємодіє із сполуками загальної формули (IV) 2 де R є С1-4 алкільною групою з нерозгалуженим або розгалуженим ланцюгом. Згідно даного винаходу, для одержання реактиву Гриньяра переважно використовувати сполуки формули (V) 20 25 30 35 де X є атомом хлору, і 1,0-1,5 моль еквівалента, переважно 1,0-1,3 моль еквівалентів, магнію, з розрахунку на сполуки формули (V), далі реактив Гриньяра взаємодіє з 0,7-1,1 моль еквівалентами сполуки формули (IV). "С1-4 алкоксигрупа" тут означає таку функціональну алкільну розгалужену або нерозгалужену групу, що містить від 1 до 4 атомів вуглецю, яка пов'язана з атомом кисню. 2 У способі як похідні диметиламіду переважно використовувати сполуки формули (IV), де R є метильною групою. Згідно даного винаходу, реакцію проводять в розчиннику типу простого ефіру, наприклад діетиловому ефірі, трет-бутилметиловому ефірі або диізопропіловому ефірі, при температурі між 20 °C і 100 °C, переважно при температурі кипіння (у точці кипіння) розчинника типу простого ефіру. Докладний опис винаходу Реакція реактивів Гриньяра з похідними карбонової кислоти добре відома і є часто використовуваним способом одержання похідної кетону. Реакція Гриньяра протікає по радикальному механізму, тому під час реакції утворюється велика кількість побічних продуктів, 2 UA 98023 C2 5 10 15 20 25 30 35 40 45 50 55 60 наприклад похідних дібензилу, і зазвичай деякі інші продукти (толуол, похідні спирту і так далі) також утворюються в результаті відновлення. Згідно рівня техніки, існує вірогідність взаємодії складного ефіру, нітрилу або хлорунгідридних реагентів з двома еквівалентами реактиву Гриньяра замість одного. Це істотно знижує вихід реакції, і приводить до одержання побічних продуктів з гідроксильною групою. Несподівано було виявлено, що при взаємодії диметиламіду циклопропанкарбонової 2 кислоти формули (IV), де R є метильную групою, з 2-фторбензилмагнію хлоридом, кількість побічних продуктів, що утворюються в результаті реакції з другим реагентом Гриньяра, істотно знижується. Реакцію виконують при кімнатній температурі і сполуку формули (II) можна одержати і практично з кількісним виходом. Згідно даного винаходу, реактив Гриньяра одержують з дешевших похідних 2фторбензилхлор-похідних, замість бромовмісних похідних і даного реактиву забезпечує добрий вихід реакції з діалкіламідами циклопропанкарбонової кислоти. Згідно експериментів авторів винаходу, проведених з іншими похідними циклопропанкарбонової кислоти, продукт взаємодії можна одержати тільки з виходом 5-17 %. При відтворенні реакції за патентом Угорщини № 218 785 і 211 876 (описаною в Прикладі 10), де реагент 2-фторбензилмагнію бром замінений 2фторбензилмагнію хлоридом, було виявлено, що взаємодія реактиву Гриньяра в ефірі з циклопропанкарбонілхлоридом при температурі -70 °C приводить до одержання тільки 5 % продукту, згідно даних Гх/мс. У Прикладі 11 взаємодія з циклопропанкарбонітрилом за тих же умов, але при вищій температурі, дає 16,5 % продукту, окрім великої кількості побічних продуктів. Іншою перевагою заявленого способу одержання сполук формули (II) з диалкіламіду циклопропанкарбонових кислот формули (IV) є одержання реактиву Гриньяра з дешевшого хлорвмісного бензильної похідної. Одержуючи реактив Гриньяра з відповідного бензилхлориду формули (V), викликаючого реакцію реактиву Гриньяра з даним диалкіламідом циклопропан карбонової кислоти, вихід реакції був удвічі вищий в порівнянні з реакцією, що проводилася з бромовмісною похідною реактиву Гриньяра. Якщо реактив Гриньяра одержують з 2-фторбензилхлориду, то можна добитися найбільшого виходу з диалкіламідом циклопропанкарбонової кислоти серед всіх похідних діалкіламідів циклопропанкарбонових кислот формули (IV). Автори винаходу вивчали, чи мають місце схожі реакції найбільш відповідних диметиламідів циклопропанкарбонових кислот з різними замінниками в ароматичному кільці з бензилмагнію хлоридами. Було виявлено, що реакцію можна здійснювати з дуже високим виходом зі всіма 2 вивченими заміщеними бензилхлоридів загальної формули (V) [X=Cl, R =F, СІ або ОМе], незалежно від положення замінника (орто-, мета- або пара). Вихід способу одержання згідно даного винаходу для синтезу сполук загальної формули складає приблизно 80 %. Реакцію виконували в розчиннику типу простого ефіру. Таким розчинником може бути діетиловий ефір, трет-бутилметиловий ефір, диізопропіловий ефір, дибутиловий ефір, тетрагідрофуран або діоксан. Було виявлено, що найбільш відповідним розчинником є діетиловий ефір. Реакцію також можна легко виконувати в трет-бутилметиловому ефірі, диізопропіловому ефірі і дибутиловому ефірі, які є менш займистими. Спосіб згідно даного винаходу можна легко виконувати в промислових масштабах, дозволяє легко збільшити обсяги виробництва і не вимагає використання спеціальних умов або устаткування. Спосіб одержання згідно даного винаходу оптимально виконувати в промислових масштабах, умови реакції не є екстремальними. Іншою перевагою заявленого винаходу є відсутність необхідності використання токсичних, шкідливих для навколишнього середовища, корозійних реагентів, а також технологій, що вимагають великих кількостей розчинника (наприклад, колоночної хроматографії) або дуже низьких температур (наприклад -78 °C). Кінцевий продукт згідно даного винаходу, сполука формули (III), який входить в об'єм загальної формули (II), є важлива початкова сполука для використовуваних у фармацевтиці похідних тетрагідротіенопіридіну. Прасугрель, сполука формули (І), одержують із сполуки формули (III), синтезованого за способом згідно даного винаходу, хлоруванням або бромуванням сполуки формули (III) і одержану сполуку потім піддають реакції з 4,5,6,7-тетрагідро-тіено[2,3-с]піридином, згідно способу виробництва, описаному в патенті Угорщини № HU 211 786. У положенні 2 тіофенового кільця, оксогрупу одержують способами, відомими з рівня техніки і зрештою одержують прасугрель формули (І) шляхом О-ацетилування в лужних умовах, і, якщо бажано, переводять в сіль приєднання кислоти. 3 UA 98023 C2 5 10 15 20 25 30 35 Приклади Далі винахід ілюструється Прикладами, приведеними нижче, без обмеження об'єму даного винаходу. Приклад 1 2 Одержання диметиламіду циклопропанкарбонової кислоти [сполука формули (IV). R =Me] У круглодонну колбу об'ємом 250 мл додавали тіонилхлорид (110 мл, 1,5 моль) і диметилформамід (1,5 мл) і при перемішуванні при 25-30 °C по краплях додавали протягом 1,5 годин циклопропанкарбонілхлорид (90 мл, 1,14 моль). Реакційну суміш кип'ятили із зворотним холодильником протягом 2 годин до повного припинення утворення газу. Без подальшої обробки і очищення по краплях додавали протягом 1,5 годин хлорунгідрид в суміш подрібненого льоду (300 г), водного розчину гідроксиду натрію (300 мл, 40 мас. %) і диметиламіну гідрохлорид (186 г, 2,3 моль). Реакційну суміш перемішували протягом 1 години при 25 °C. Одержаний продукт екстрагували дихлорметаном (2 200 мл) і органічний шар сушили над сульфатом магнію, перегоняли і залишок відокремлювали у вакуумі при тиску 10 мм рт.ст. (1333 Па). 44 °C/10мм рт. ст. Точка кипіння: (1333 Па) 104,9 г (81,4 %) Вихід: безбарвного масла Вміст (дані ГХ): 98,4 % Показник 20 [nD ]=1,4708 заломлення: IK (плівка): 3529, 3011, 2935, 1645, 1501, 1420, 1337, 1265, 1204, 1140, 1060. 1 Н-ЯМР (CDCI3, 500 МГц): 3,18 (s, 3Н), 2,97 (s, 3Н), 1,75 (m, 1Н), 0,96 (m, 2Н), 0,75 (m, 2H). 13 С-ЯМР (CDCI3, 125 МГц): 173,3, 37,0, 35,7, 10,9, 7,2. Приклад 2 2 Одержання диетиламіду циклопропанкарбонової кислоти [сполука формули (IV), R =Et] Одержання виконували способом, аналогічним Прикладу 1, з тією різницею, що замість диметиламінгідрохлориду в реакційну суміш додавалидиетиламінгідрохлорид (252,1 г, 2,3 моль). 54 °C /5 мм рт. ст. Точка кипіння: (666,5 Па) 54,5 г (33,9 %) Вихід: безбарвного масла Вміст (дані ГХ): 97,4 % Показник 20 [nD ]=1,4593 заломлення: Приклад 3 2 Одержання диізопропіламіду циклопропанкарбонової кислоти [сполуки формули (IV), R =iPr] Одержання виконували способом, аналогічним Прикладу 1, з тією різницею, що замість диметиламінгідрохлорида в реакційну суміш додавали диізопропіламінгідрохлорид (252,1 г, 2,3 моль). 60 °C /2,5 мм рт. ст. Точка кипіння: (333,3 Па) 71,5 г (37,1 %) Вихід: безбарвного масла Вміст (дані ГХ): 98,2 % Точка кипіння: 18-20 °C Приклад 4 і Одержання циклопропіл-2-фторбензилкетону [сполуки формули (III)] Круглодонну колбу об'ємом 1000 мл заповнювали магнієм (10,7 г, 0,44 моль). До магнію додавали йод (0,2 г), потім діетиловий ефір (240 мл) і при кип'яченні із зворотним холодильником в реакційну суміш додавали розчин 2-фторбензилхлориду (47,8 мл, 0,4 моль) і діетиловий ефір (80 мл). Суміш кип'ятили із зворотним холодильником протягом 2 годин і при цій температурі додавали розчин диметиламіду циклопропанкарбонової кислоти (36,2 г, 0,32 моль), одержаний за прикладом 1, і тетрагідрофуран (200 мл). Реакційну суміш кип'ятили протягом півгодини і при охолоджуванні по краплях в суміш додавали водний розчин соляної кислоти (160 мл, 1:1). Органічний шар сушили, залишок перегоняли у вакуумі. Точка кипіння: 61 °C/0,2 мм рт. ст. 4 UA 98023 C2 Вихід: 5 10 15 20 25 30 35 (26,6 Па) 46,6 г (79,8 %) безбарвного масла 97,7 % Вміст (дані ГХ): Показник 20 [nD ]=1,5169 заломлення: IK (плівка): 3010, 1704, 1587, 1494, 1457, 1384, 1234, 1072, 1025. 1 Н-ЯМР (CDCI3, 500 МГц): 7,25 (dd, 1Н), 7,20 (t, 1Н), 7,10 (t, 1Н), 7,06 (t, 1Н), 3,87 (s, 2H), 1,99 (m, 1H), 1,06 (m, 2H), 0,87 (m, 2H). 13 С-ЯМР (CDCI3, 125 МГц): 206,9 (d, J=1,0 Гц), 161,0 (d, J=246,1 Гц), 131,6 (d, J=4,4 Гц), 128,8 (d, J=8,3 Гц), 124,1 (d, J=3,4 Гц), 121,8 (d, J=16,6 Гц), 115,3 (d, J=21,5 Гц), 43,5 (d, J=2,4 Гц), 20,0 (d, J=1,0 Гц), 11,2. Приклад 5 Одержання циклопропіл-2-фторбензилкетону [сполуки Формули (ІІІ)] Круглодонну колбу об'ємом 1000 мл заповнювали магнієм (10,7 г, 0,44 моль). До магнію додавали йод (0,2 г), потім трет-бутилметиловий ефір (240 мл) і при кип'яченні в реакційну суміш додавали розчин 2-фторбензилхлориду (47,8 мл, 0,4 моль) і трет-бутилметиловий ефір (80 мл). Суміш кип'ятили із зворотним холодильником протягом 2 годин і при цій температурі додавали розчин диметиламіду циклопропанкарбонової кислоти (36,2 г, 0,32 моль), одержаний за прикладом 1, і тетрагідрофуран (200 мл). Реакційну суміш кип'ятили протягом півгодини і при охолоджуванні по краплях до суміші додавали водний розчин соляної кислоти (160 мл, 1:1). Органічний шар сушили, залишок перегоняли у вакуумі. 35,6 г (60,9 %) Вихід: безбарвного масла Вміст (дані ГХ): 97,7 % Показник 20 [nD ]=1,5167 заломлення: Приклад 6 Одержання циклопропіл-2-фторбензилкетону [сполуки формули (ІІІ)] У круглодонну колбу об'ємом 250 мл, заповнену магнієм (2,67 г, 0,11 моль) додавали йод (0,1 г), потім діетиловий ефір (60 мл) і при кип'яченні в реакційну суміш додавали розчин 2фторбензилхлориду (11,9 мл, 0,1 моль) і діетиловий ефір (20 мл). Суміш кип'ятили із зворотним холодильником протягом 2 годин і при цій температурі додавали розчин диетиламіду циклопропанкарбонової кислоти (11,3 г, 80 ммоль), одержаний за прикладом 2, і тетрагідрофуран (50 мл). Реакційну суміш кип'ятили протягом півгодини і при охолоджуванні по краплях в суміш додавали водний розчин соляної кислоти (40 мл, 1:1). Органічний шар сушили, залишок перегоняли у вакуумі. 6,94 г (48,7 %) Вихід: безбарвного масла 60 °C/0,2 мм рт.ст. Точка кипіння: (26,6 Па) Вміст (дані ГХ): 96,9 % Показник 20 [nD ]=1,5165 заломлення: Приклад 7 Одержання циклопропіл-2-фторбензилкетону [сполуки формули (ІІІ)] Одержання здійснювали за прикладом 6 з тією різницею, що реактив Гриньяра одержували за прикладом 3 з розчином диізопропіламіду циклопропанкарбонової кислоти (13,5 г, 80 моль) і тетрагідрофураном (50 мл) замість диетиламіду циклопропанкарбонової кислоти. Реакційну суміш перемішували протягом двох годин і при охолоджуванні до суміші по краплях додавали водний розчин соляної кислоти (40 мл, 1:1). Органічний шар сушили, залишок перегоняли у вакуумі. 3,2 г (22,5 %) Вихід: безбарвного масла Вміст (дані ГХ): 90,9 % Показник 20 [nD ]=1,5169 заломлення: Приклад 8 1 Одержання циклопропіл-4-хлорбензилкетону [сполуки формули (II), R =4-Cl] 5 UA 98023 C2 5 10 15 20 25 30 35 У круглодонну колбу об'ємом 500 мл, заповнену магнієм (5,8 г, 0,24 моль), додавали йод (0,1 г), потім діетиловий ефір (120 мл) і при кип'яченні в реакційну суміш додавали розчин 4хлорбензилхлориду (32,2 г, 0,20 моль) і діетиловий ефір (40 мл). Суміш кип'ятили протягом 1 години і при цій температурі додавали розчин диметиламіду циклопропанкарбонової кислоти (18,1 г, 0,16 моль) і тетрагідрофуран (80 мл). Реакційну суміш перемішували протягом півгодини і при охолоджуванні по краплях в суміш додавали водний розчин соляної кислоти (80 мл, 1:1). Органічний шар сушили, залишок (32 г) перегоняли у вакуумі. 96 °C/0,2 мм рт.ст. Точка кипіння: (26,6 Па) 25,2 г безбарвного Вихід: масла (76,0 %) 97,2 %, кристалізація з Вміст (дані ГХ): н-гексану Точка 38-40 °C, білі кристали плавлення: Аналіз С11Н11СІО (194,7): Обчислено: 3 67,87 Η СІ 5,70 18,21 Знайдено: 3 67,41 Η СІ 5,72 17,95 ІK (KВr): 3442, 3011, 1693, 1492, 1378, 1073, 1015. 1 Н-ЯМР (CDCI3, 500 МГц): 7,29 (d, 2Н, J=8,2Гц), 7,15 (d, 2H, J=8,2Гц), 3,87 (s, 2H), 1,95 (m, 1H), 1,04 (m, 2H), 0,87 (m, 2H). 13 С-ЯМР (CDCI3, 125 МГц): 207,7, 132,8, 132,8, 130,8, 128,7, 49,7, 20,2 11,4. Приклад 9 1 Одержання циклопропіл-4-хлорбензилкетону [сполуки формули (II), R =3-МеО] У круглодонну колбу об'ємом 250 мл, заповнену магнієм (4,9 г, 0,20 моль), додавали йод (0,1 г), потім діетиловий ефір (100 мл) і при кип'яченні в реакційну суміш додавали розчин 3метиоксибензилхлориду (11,9 мл, 0,1 моль) і діетиловий ефір (40 мл). Суміш кип'ятили протягом 1 години і при цій температурі додавали розчин диметиламіду циклопропанкарбонової кислоти (16,6 г, 0,15 моль) і тетрагідрофуран (70 мл). Реакційну суміш перемішували протягом півгодини і при охолоджуванні по краплях в суміш додавали водний розчин соляної кислоти (80 мл, 1:1). Органічний шар сушили, залишок (32 г) перегоняли у вакуумі. 20,6 г (72,2 %) Вихід: безбарвного масла 103 °C/0,2 мм рт.ст. Точка кипіння: (26,6 Па) Показник 20 [nD ]=1,5369 заломлення: Аналіз С12Н14О2 (190,2): Обчислено: 3 75,76 Η 7,42 Знайдено: 3 75,23 Η 7,51 IK (плівка):3539, 3008, 2940, 2836, 1695, 1600, 1491, 1438, 1491, 1438, 1491, 1454, 1383, 1259, 1151, 1071. 1 Н-ЯМР (CDCI3, 200 МГц): 7,23 (t, 1Н), 6,82 (m, 1Н), 6,80 (m, 2Н), 3,77 (m, 5Н), 1,96 (m, 1H), 1,02 (m, 2H), 0,85 (m, 2H). Порівняльні приклади Приклад 10 Одержання циклопропіл-2-фторбензилкетон [сполуки формули (ІІІ)] У круглодонну колбу об'ємом 250 мл, заповнену магнієм (2,67 г, 0,11 моль) додавали йод (0,1 г), потім діетиловий ефір (60 мл) і при кип'яченні в реакційну суміш додавали розчин 2фторбензилхлориду (11,9 мл, 0,1 моль) і діетиловий ефір (20 мл). Суміш кип'ятили протягом 2 годин, потім охолоджували до -70 °C і додавали розчин циклопропанкарбонілхлориду (8,36 г, 80 моль), і тетрагідрофуран (50 мл), реакційну суміш залишали нагріватися до кімнатної температури. З реакційного середовища відбирали зразки, промивали водним розчином хлориду амонію і досліджували способом Гх/мс. Вміст реакційної суміші був наступним: циклопропанкарбонова 11,5 % кислота 10,8 % 2-фторбензиловий спирт 6 UA 98023 C2 5 10 25,2 % 2-фтортолуол 4,8 % сполука формули (III). Приклад 11 Одержання циклопропіл-2-фторбензилкетон [сполуки формули (III)] У круглодонну колбу об'ємом 250 мл, заповнену магнієм (2,67 г, 0,11 моль) додавали йод (0,1 г), потім діетиловий ефір (60 мл) і при кип'яченні в реакційну суміш додавали розчин 2фторбензилхлориду (11,9 мл, 0,1 моль) і діетиловий ефір (20 мл). Суміш кип'ятили протягом 2 годин, потім охолоджували до -50 °C і додавали розчин циклопропанкарбонітрила (5,4 г, 80 ммоль), і тетрагідрофуран (50 мл), реакційну суміш залишали нагріватися до кімнатної температури. З реакційного середовища відбирали зразки, промивали водним розчином хлориду амонію і досліджували способом Гх/мс. Вміст реакційної суміші був наступним: 14,6 % 2-фтортолуол 2-фторбензиловий 24,4 % спирт 16,5 % сполука формули (III). ФОРМУЛА ВИНАХОДУ 15 1. Спосіб одержання сполук загальної формули (II) O R1 , II 1 де R є атомом фтору, хлору або С1-4алкоксигрупою, де реактив Гриньяра, одержаний із сполуки загальної формули (V) R1 X,V 20 де X є атомом хлору, піддають взаємодії із сполукою загальної формули (IV) O N 2 25 30 35 40 R2 R2 , IV де R є С1-4алкільною групою з нерозгалуженим або розгалуженим ланцюгом. 2. Спосіб за п. 1, який відрізняється тим, що для одержання реактиву Гриньяра використовують 1,0-1,5 моль еквівалента, переважно 1,0-1,3 моль еквівалента, магнію, з розрахунку на сполуку формули (V). 3. Спосіб за п. 2, який відрізняється тим, що використовують 1,0-1,3 моль еквівалента магнію. 2 4. Спосіб за п. 1, який відрізняється тим, що в сполуці формули (IV) R є метильною групою. 5. Спосіб за п. 1, який відрізняється тим, що реактив Гриньяра піддають взаємодії з 0,7-1,1 моль еквівалента сполуки формули (IV). 6. Спосіб за п. 1, який відрізняється тим, що реакцію проводять в розчиннику типу простого ефіру, переважно в діетиловому ефірі, трет-бутилметиловому ефірі, діізопропіловому ефірі, дибутиловому ефірі, тетрагідрофурані або діоксані. 7. Спосіб за п. 6, який відрізняється тим, що реакцію проводять в діетиловому ефірі, третбутилметиловому ефірі, діізопропіловому ефірі, дибутиловому ефірі, тетрагідрофурані або діоксані. 8. Спосіб за п. 1, який відрізняється тим, що реакцію проводять в діетиловому ефірі, третбутилметиловому ефірі або діізопропіловому ефірі. 9. Спосіб за п. 1, який відрізняється тим, що реакцію проводять при температурі 20-100 °С. 10. Спосіб за п. 9, який відрізняється тим, що реакцію проводять при температурі кипіння розчинника типу простого ефіру. 11. Спосіб за п. 1 одержання сполуки формули (І) 7 UA 98023 C2 O S O O N CH3 F I із сполуки формули (III), що відповідає формулі (II), O F , III де реактив Гриньяра, одержаний із сполуки загальної формули (V) R1 X,V 5 де X є атомом хлору, піддають взаємодії із сполукою загальної формули (IV) O N R2 R2 , IV 2 де R є С1-4алкільною групою, що має нерозгалужений або розгалужений ланцюг, і з одержаної сполуки формули (III) O F 10 III одержують основу прасугрель або її сіль приєднання кислоти. 8 UA 98023 C2 Комп’ютерна верстка Л.Литвиненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 9
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of pharmaceutical intermediates
Автори англійськоюMezei Tibor, Lukacs, Gyula, Molnar, Eniko, Barkoczy, Jozsef, Volk, Balazs, Porcs-Makkay, Marta, Szulagyi, Janos, Vajjon, Maria
Назва патенту російськоюСпособ получения фармацевтических промежуточных соединений
Автори російськоюМезей Тибор, Лукаш Дьюла, Молнар Энико, Баркоци Йожеф, Волк Балаж, Порч-Маккай Марта, Суладий Янош, Вайон Мария
МПК / Мітки
МПК: C07C 45/68, C07C 49/577
Мітки: одержання, спосіб, сполук, проміжних, фармацевтичних
Код посилання
<a href="https://ua.patents.su/11-98023-sposib-oderzhannya-farmacevtichnikh-promizhnikh-spoluk.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання фармацевтичних проміжних сполук</a>
Попередній патент: Вузол для відділення кришок фільтруючого елемента масляного фільтра
Наступний патент: Тепловий спусковий механізм зі скляною ампулою для генератора вогнегасного аерозолю та спосіб приведення в дію генератора вогнегасного аерозолю
Випадковий патент: Спосіб створення футерівки в індукційній печі для плавки вторинного фероалюмінію