Спосіб одержання 3-(3-фторо-4-гідроксифеніл)-7-гідроксинафтонітрилу, способи одержання проміжних сполук, а також проміжна сполука
Номер патенту: 84166
Опубліковано: 25.09.2008
Автори: Рен Жянксін, Равеендранат Паноліл, Левент Махмут, Сузерленд Карен Вігінз, Ву Янжонг, Геуш Моузумі
Формула / Реферат
1. Спосіб одержання сполуки формули V
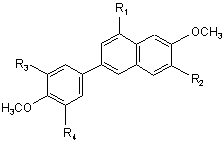 , V
, V
де R1 являє собою CN, F або Сl;
R2 являє собою Н або Вr;
a R3 й R4 незалежно являють собою Н або F,
який відрізняється тим, що включає реакцію сполуки формули (II)
 , II
, II
де R1 й R2 - як визначені вище, зі сполукою формули (IV)
 , IV
, IV
де R3 й R4 - як визначені вище, у присутності Рd(РРh3)2Сl2.
2. Спосіб за п. 1, який відрізняється тим, що реакцію проводять у суміші диметоксіетану й води в присутності Nа2СО3.
3. Спосіб за п. 1 або п. 2, який відрізняється тим, що R1 являє собою CN.
4. Спосіб за пп. 1-3, який відрізняється тим, що R2 являє собою Н.
5. Спосіб за пп. 1-4, який відрізняється тим, що одержана сполука формули (V) надалі може бути використана для одержання сполуки формули (І)
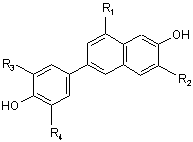 , I
, I
де R1, R2, R3 й R4 визначені в п. 1.
6. Спосіб за п. 5, який відрізняється тим, що одержану сполуку формули (V) можна перетворити у сполуку формули (І) шляхом реакції з ВВr3.
7. Спосіб за п. 5 або п. 6, який відрізняється тим, що одержану сполуку формули (V) можна перетворити у сполуку формули (І) шляхом реакції з ВВr3 в СlСН2СН2Сl з наступною обробкою ЕtOН/Н2O/С.
8. Спосіб за пп. 5-7, який відрізняється тим, що одержану сполуку формули (І) можна перетворити у форму її фармацевтично допустимої солі або складного ефіру.
9. Спосіб за пп. 1-8, який відрізняється тим, що включає також одержання сполуки формули II за допомогою нагрівання сполуки формули III
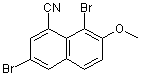 III
III
з хлоридом олова (II) у суміші оцтової кислоти й концентрованої соляної кислоти.
10. Спосіб за п. 9, який відрізняється тим, що включає також одержання сполуки формули III шляхом дибромування 7-метокси-1-нафтонітрилу з використанням приблизно 2-6 еквівалентів брому в оцтовій кислоті при температурі приблизно 40-70 °С.
11. Спосіб за п. 10, який відрізняється тим, що додатково включає одержання 7-метокси-1-нафтонітрилу в результаті наступних операцій:
а) змішування розчину 7-метокси-1-тетралону та йодиду цинку із триметилсилілціанідом з одержанням реакційної суміші,
б) додавання оксихлориду фосфору й піридину в реакційну суміш із одержанням ненасиченого нітрилу, і
в) реакція ненасиченого нітрилу з 2,3-дихлоро-5,6-диціано-1,4-бензохіноном.
12. Спосіб за п. 1, який відрізняється тим, що R3 являє собою F.
13. Спосіб за п. 12, який відрізняється тим, що R4 являє собою Н.
14. Спосіб за п. 12, який відрізняється тим, що R1 являє собою CN, a R2 являє собою Н.
15. Спосіб одержання 7-метокси-1-нафтонітрилу, який відрізняється тим, що включає:
а) змішування розчину 7-метокси-1-тетралону та йодиду цинку із триметилсилілціанідом з одержанням реакційної суміші,
б) додавання оксихлориду фосфору й піридину в реакційну суміш із одержанням ненасиченого нітрилу, і
в) реакцію ненасиченого нітрилу з 2,3-дихлоро-5,6-диціано-1,4-бензохіноном.
16. Спосіб за п. 15, який відрізняється тим, що операцію в) виконують у толуолі при температурі близько 60 °С.
17. Спосіб за п. 15, який відрізняється тим, що одержаний 7-метокси-1-нафтонітрил можна ввести в реакцію дибромування з одержанням сполуки формули III
 III.
III.
18. Сполука формули III
 III.
III.
19. Спосіб одержання сполуки формули І, який відрізняється тим, що включає наступну послідовність реакцій:
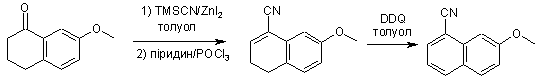
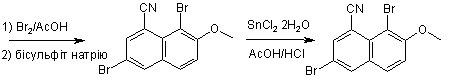 , II
, II
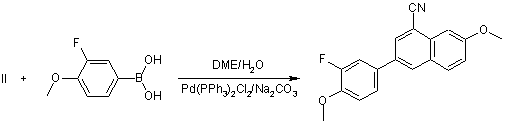
 ,
,
де DME означає 1,2-диметоксіетан, TMSCN означає триметилсилілціанід, a DDQ означає 2,3-дихлоро-5,6-диціано-1,4-бензохінон.
Текст
1. Спосіб одержання сполуки формули V 2 3 84166 у форму її фармацевтично допустимої солі або складного ефіру. 9. Спосіб за пп. 1-8, який відрізняється тим, що включає також одержання сполуки формули II за допомогою нагрівання сполуки формули III CN Br O Br III з хлоридом олова (II) у суміші оцтової кислоти й концентрованої соляної кислоти. 10. Спосіб за п. 9, який відрізняється тим, що включає також одержання сполуки формули III шляхом дибромування 7-метокси-1-нафтонітрилу з використанням приблизно 2-6 еквівалентів брому в оцтовій кислоті при температурі приблизно 40-70 °С. 11. Спосіб за п. 10, який відрізняється тим, що додатково включає одержання 7-метокси-1нафтонітрилу в результаті наступних операцій: а) змішування розчину 7-метокси-1-тетралону та йодиду цинку із триметилсилілціанідом з одержанням реакційної суміші, б) додавання оксихлориду фосфору й піридину в реакційну суміш із одержанням ненасиченого нітрилу, і в) реакція ненасиченого нітрилу з 2,3-дихлоро-5,6диціано-1,4-бензохіноном. 12. Спосіб за п. 1, який відрізняє ться тим, що R3 являє собою F. 13. Спосіб за п. 12, який відрізняється тим, що R4 являє собою Н. 14. Спосіб за п. 12, який відрізняється тим, що R1 являє собою CN, a R 2 являє собою Н. 15. Спосіб одержання 7-метокси-1-нафтонітрилу, який відрізняється тим, що включає: а) змішування розчину 7-метокси-1-тетралону та йодиду цинку із триметилсилілціанідом з одержанням реакційної суміші, б) додавання оксихлориду фосфору й піридину в реакційну суміш із одержанням ненасиченого нітрилу, і Даний винахід відноситься до способу отримання 3-(3-фторо-4-гідроксифеніл)-7гідроксинафтонітрилу, селективного ліганда естрогенного бета-рецептора, а також споріднених йому аналогів і проміжних сполук Естрогени впливають на багато систем органів й, отже можуть відігравати певну роль при ряді станів і захворювань Естрогенні рецептори являють собою активовані лігандами транскрипційні фактори й відносяться до надсімейства нуклеарних гормональних рецепторів, що включає прогестероны андрогенні глюкокортикоїдні й мінералокортикоїдні рецептори Після зв'язування ліганда w рецептори димеризуються й можуть активува ти генну транскрипцію шляхом безпосереднього зв'язування зі специфічними послідовностями ДНК 4 в) реакцію ненасиченого нітрилу з 2,3-дихлоро-5,6диціано-1,4-бензохіноном. 16. Спосіб за п. 15, який відрізняється тим, що операцію в) виконують у толуолі при температурі близько 60 °С. 17. Спосіб за п. 15, який відрізняється тим, що одержаний 7-метокси-1-нафтонітрил можна ввести в реакцію дибромування з одержанням сполуки формули III CN Br O Br III. 18. Сполука формули III CN Br O Br III. 19. Спосіб одержання сполуки формули І, який відрізняє ться тим, що включає наступн у послідовність реакцій: O O 1 ) TMSC N/ZnI 2 толуол CN D DQ то луол O CN O 2) пі ридин/POCl 3 CN Br 1) Br 2/AcOH CN O Br SnCl2 2H2 O O AcOH/HCl 2) бісульфіт натрію Br , II Br CN O F OH II + O B OH DME/H2 O Pd(PPh 3) 2Cl2 /Na2 CO3 F O CN OH 1) BBr3/ClCH2CH2 Cl 2) EtOH/H2O/C F HO , де DME означає 1,2-диметоксіетан, TMSCN означає триметилсилілціанід, a DDQ означає 2,3дихлоро-5,6-диціано-1,4-бензохінон. або взаємодії з іншими транскрипційними факторами. Певний клас білків також може взаємодіяти з рецепторами й модулювати їхню транскрипційну активність Найбільш сильним ендогенним естрогеном є 17(3-естрадюл при цьому активність цього естрогена можна імітувати або заблокувати безліччю сполук Деякі сполуки можуть мати змішану активність, діючи як агоністи в одній тканині і як антагоністи - в іншій. їх називають селективними естрогенними рецепторними модуляторами, і вони являють собою потенційно корисні терапевтичні агенти Виявлення таких терапевтично корисних сполук і розробка ефективних способів їхнього отримання є важливим завданням фармацевтичної промисловості 5 84166 Відповідно до[ роботи David C. Pryde, et al , Synthesis of 2-Tetralons Via A Novel 1.2-Carbonvl Transposition of 1-Tetralones, Tetrahedron Lett (1996) 37(19) 3243-3246], сс-тетралони А можна перетворити в нітрили В за допомогою реакції із триметил-SiCN у присутності каталізатора Zn2 з наступним додаванням POCl3 піридину: Інший багатоступінчастий спосіб перетворення 7-метокси-1-тетралону в 7-метокси-1-нафтонітрил описаний [T Hayashi, et al , Preparation And Binding Affinity of New Porphyrin Host Molecule for Ubiquinone Analogs, Chem Lett (1994) (9) 1749-52]: Описано реакцію з'єднання різних арильних галоїдів з фенілборною кислотою при відсутності розчинника з використанням каталізатора Pd(PPh3)4 в умовах помолу в к ульовому млині. У реакційні суміші додали інертний NaCI, щоб зробити їх досить сипучими. Порядок реакції був комплементарним стосовно нормальної реакції Судзукі. [S. F. Nielsen, et al, The Suzuki Reaction Under Solvent-Free Conditions, Den. Synthetic Communications (2000), 30(19), 3501-3509] Даний винахід включає спосіб отримання сполуки формули І де R1 являє собою CN, F або Cl, R2 являє собою H або Br; a R3 й R4 незалежно являють собою H або F, при цьому зазначений спосіб включає наступні стадії реакції Переважно R1 являє собою CN, R2 являє собою H, R3 являє собою F й/або R4 являє собою H. Винахід включає також спосіб отримання сполуки формули Il у якому R1 являє собою CN, a R2 являє собою H, при цьому зазначений спосіб включає нагрівання сполуки формули III 6 з хлоридом олова (II) у суміші з оцтовою кислотою й концентрованою соляною кислотою. Цей спосіб реалізують переважно при температурі близько 100°C Відповідно до винаходу також отримано нову сполуку формули III і запропоновано спосіб її отримання шляхом дибромування 7-метокси-1нафтонітрилу, використовуючи приблизно 2-6 еквівалентів брому в оцтовій кислоті при температурі приблизно 40-70°C , переважно - приблизно при 65°C Для відновлення надлишкового брому наприкінці реакції можна додати бісульфіт натрію. Запропоновано також новий спосіб отримання 7метокси-1-нафтонітрилу що включає; а) змішування розчину 7-метокси-1-тетралону та йодиду цинку із триметилсилілцианідом з отриманням реакційної суміші, переважно з використанням толуолу як розчинника приблизно при 60°C, б) додавання оксихлориду фосфору й піридину в реакційну суміш переважно - при нагріванні зі зворотнім холодильником протягом приблизно 6 9 годин із отриманням ненасиченого нітрилу, і в) реакцію ненасиченого нітрилу з 2,3дихлоро-5,6-дициано-1 A-бензохіноном, переважно в толуолі приблизно при 60°C з отриманням 7метокси-1-нафтонітрилу. Різні задачі й переваги винаходу стан уть очевидні для фахівців у даній області техніки з наведеного нижче опису й прикладеної формули винаходу. Відповідно до переважного аспекту даного винаходу, показаного на схемі 1, запропоновано новий поліпшений спосіб виробництва 3-(3-фторо-4гідроксифеніл)-7-гідрокси-1-нафтонітрилу (1) у широкому масштабі Комерційно доступний 3,4дигідро-7-метокси-1 (2Н)-нафталенон (7-метокси-1 -тетралон) можна перетворити в ненасичений нітрил (3), як показано на схемі 1 Реакцію проводять у розчині толуолу. Після закінчення реакції реакційну суміш гасять - лужним розчином. Потім проводять екстракцію реакційної суміші толуолом Після промивання розчином толуолу, сирий ненасичений нітрил (3) піддають ароматизації безпосередньо в цьому розчині толуолу шля хом перемішування з 2,3-дихлоро-5,6-дициано-1,4бензохіноном (DDQ) при 60°C впродовж 2 годин Тверду фазу видаляють фільтрацією, а фільтрат промивають розчином гідроксиду натрію й соляним розчином, відповідно Основну частину розчинника видаляють перегонкою й додають гептан для осадження продукту Виділяють 7-метокси-1нафтонітрил (4). Очікуваний вихід на цих двох стадіях становить щонайменше 70-75%. Шляхом проведення двох реакцій у тому самому розчиннику можна виключити виділення проміжної сполуки (3) з низькою температурою плавлення, підвищивши продуктивність і вихід 7 84166 Бромування 7-метокси-1-нафтонітрилу (4) бромом в оцтовій кислоті являє собою реакцію досить чутливу до температури. Сполука 8-бромо7-метокси-1-нафтонітрилу швидко утворюється при кімнатній температурі при взаємодії із двома еквівалентами брому. Якщо температура перевищує 70°С, утворюється велика кількість полібромованих домішок. У способі згідно із даним винаходом проводять дибромування 7-метокси-1нафтонітрилу (4) при 40-70°C використовуючи від 2 до 6 еквівалентів брому в оцтовій кислоті Після закінчення реакції реакційну суміш гасять надлишком бісульфіту натрію, щоб відновити надлишок брому, а продукт високої чистоти осаджують і виділяють із очікуваним виходом близько 90-95%. Отриманий дибромід без додаткового очищення нагрівають із хлоридом олова (II) у суміші оцтової кислоти й концентрованої соляної кислоти при 100°C. Бром в 8 позиції селективно відновлюють Продукт 3-бромо-7-метокси-1-нафтонітрил (6) відфільтровують з реакційної суміші після закінчення реакції. Типовий вихід після 2 стадій становить 7080% із чистотою 95% і вище, відповідно до аналізу способом високоефективної рідинної хроматографії (ВЕРХ). Особливо переважний варіант реалізації способу згідно із даним винаходом включає реакцію з'єднання 3-бромо-7-метокси-1-нафтонітрилу (6) з комерційно доступною З-фторо-4метоксифенілборною кислотою в добре відомих умовах С удз укі з використанням бікарбонату натрію й каталітичної кількості дихлоробіс(трифенілфосфін) паладію (II) у суміші води й 1,2-диметоксиетану для отримання 3-(3фторометоксифеніл)-7-метокси-1-нафтонітрилу (8). Типовий вихід становить близько 73% із чистотою 99% і вище відповіднодо аналізу способом ВЕРХ Схема 1 У більш широкому аспекті даний винахід забезпечує спосіб отримання сполуки формули І 8 5 де R1 являє собою CN, F або Cl; R2 являє собою H або Br; a R3 й R4 незалежно являють собою H або F1 при цьому зазначений спосіб включає наступні стадії реакції Сполука формули 1 є активним селективним лігандом естрогенного бета-рецептора для перорального введення. Вона може бути використана для лікування хронічних запальних захворювань при відсутності типових побічних ефектів застосування естрогенів Ревматоїдний артрит є основним терапевтичним показанням для прийому цієї сполуки. Відповідно до іншого переважного аспекту даного винаходу запропонований спосіб отримання сполуки формули Il шляхом нагрівання сполуки формули III з хлоридом олова (II) у суміші оцтової кислоти й концентрованої соляної кислоти, найбільше переважно при температурі близько 100°C до закінчення реакції. Сполука формули III є новою, а застосування цієї сполуки в процесі згідно даного винаходу забезпечує ефективний спосіб отримання сполук із формулами І й II, де Ri = CN1 a R2 = H, з відносно високою чистотою в порівнянні з відомими методами синтезу. Відповідно до переважного способу згідно із даним винаходом сполука формули III одержується дибромуваням 7-метокси-1-нафтонітрилу, переважно використовуючи бром в оцтовій кислоті при температурі, що не перевищує приблизно 70°C, переважно - при температурі в межах приблизно 40-70°С, найбільше переважно - приблизно при 65°C. Після закінчення реакції реакційну суміш гасять бісульфітом натрію для відновлення брому, що не прореагував Сполука формули III утворює осад з разюче високим виходом (звичайно близько 90-95%) і чистотою (звичайно близько 93-95%). Завдяки такій високій чистоті цю сполуку можна використати для отримання сполук формули Il без додаткового очищення. 9 84166 Іншим новим аспектом даного винаходу є високоефективний спосіб отримання сполук 7метокси-1-нафтонітрилу з 7-метокси-1-тетралону (3,4-дигідро-7-метокси-1(2Н)-нафталенону) без виділення проміжного ненасиченого нітрилу. Зокрема, новим аспектом цього процесу є застосування DDQ, переважно в толуолі при температурі в межах приблизно 40-80°C, більш переважно приблизно при 50-70°C та найбільше переважно приблизно при 60°C для перетворення ненасиченої нітрильної проміжної сполуки в 7-метокси-1нафтонітрил з відносно високим виходом. Фармацевтично припустимі солі можна одержати за допомогою органічних і неорганічних кислот, наприклад, з оцтової, пропіоновой, молочної, лимонної. винної, бурштинової, фумарової, малеїнової, малонової, мигдальної, яблучної фталевої, соляної, бромистоводневої, фосфорної, азотної, сірчаної метансульфонової, нафталінсульфонової, бензолсульфонової толуолсуль фонової, камфарсульфонової й аналогічних відомих припустимих засобів, якщо сполука згідно із даним винаходом містить основну груп у Солі можна також одержати за допомогою органічних і неорганічних основ, якщо сполука, згідно із даним винаходом, містить кислотну групу, зокрема можуть бути отримані солі лужних металів, (наприклад, натрію, літію або калію), солі лужноземельних металів, амонієві солі, алкіламонієві солі, що містять 1-6 атомів вуглецю, ордіалкіламонієві солі, що містять 1-6 атомів вуглецю в кожній алкільній групі, і триалкіламонієві солі, що містять 1-6 атомів вуглецю в кожній алкільній групі. Фармацевтично припустимі складні ефіри включають складні ефіри отримані в результаті реакції з алкановими кислотами C1-C6 Нижче представлені приклади, що ілюстр ують деякі варіанти реалізації даного винаходу, які, однак, не слід розуміти як обмеження області застосування цього винаходу. Приклад 1 7-метокси-1 -нафтонітрил У розчин 3,4-дигідро-7-метокси-1(2Н)нафталінону (200г, 1,14моль) і йодиду цинку (9,09г, 0,0285моль) у толуолі (600мл) при 45°С додали триметилсульфідцианід (120г, 1,21моль) протягом 20хв Суміш нагріли до 60°C и перемішували протягом 2 годин. Потім суміш остудили до 35°С і додали піридин (79,1г, 1,71 моль) і оксихлорид фосфору (262г, 1,71моль), відповідно Суміш нагріли до 100°C і перемішували протягом 6 годин Потім реакційну суміш остудили до 50°C і додали протягом 15хв у попередньо охолоджений розчин гідроксиду натрію (3N, 2л, 3°С ). Додали толуол (1,2л) і остудили суміш до кімнатної температури. Відокремили органічну фазу й промили розчином гідроксиду натрію (1N, 2 х 1 л), водою (1л), соляною кислотою (З N, 3 х 1 л) водою (1 л), насиченим розчином бікарбонату натрію (1л) і сольовим розчином (1 л), відповідно. Органічний шар нагріли до 45°C і додали порціями 2 З-дихлоро-5 6-дициано-1,4-бензохінон (DDQ) (207г, 0,912моль) протягом 20хв Суміш нагріли до 60°C, перемішали протягом 2 годин, а потім остудили до кімнатної температури. Тверду фазу відокремили на фільтрі й промили фільтрат 10 розчином гідроксиду натрію (2 х 0,8л) і соляним розчином (0,8л), відповідно Видалили основну частину розчинника за допомогою перегонки й додали гептан (1л) Відфільтрували тверду фазу при 0°C і висушили з отриманням зазначеної в заголовку сполуки (білий порошок, 130 г, 73%). 1H ЯМР (CDCI3) й 8,00 (d 1HJ = 8,2 Гц), 7,94 (dd, 1 H, J= 1,1 Гц, 7,3 Гц), 7,81 (d, 1 H, J= 8,9 Гц), 6 7,47 (d, 1 H J = 2,4 Гц), 7,38 (dd, 1 H, J = 7,9 Гц, 8,0 Гц), 7,26 (dd, 1H1J= 2,4 Гц 8,9 Гц) 4 00 (s 3H). Приклад 2,3,8 дибромо-7-метокси-1нафтонітрил У суспензію 7-метокси-1-нафтонітрилу (500г, 2,73моль) в оцтовій кислоті (5л) протягом 15хв при температурі 40-55°C додали бром (2,55кг, 16 0моль) Потім суміш нагріли до 65°C і перемішували протягом 3 годин Остудили суміш до кімнатної температури. Протягом 60хв додали розчин бісульфіту натрію (1,3кг) у воді (3,0л), підтримуючи температуру реакції нижче 40°C Тверду фазу відфільтрували й промили водою (4 х 25л) Невелику кількість зразка висушили й проаналізували. Залишок вологого продукту безпосередньо використали для реакції прикладе 3, як описано нижче Висушена сполука являла собою білий порошок 1H ЯМР (CDCI3): 5 8,15 (d, 1 H, J = 2,1 Гц), 8,10 (d, 1 H J = 2 1 Гц) 7 81 (d, 1 H, J = 9,1 Гц), 7,38 (d, 1 H1 J = 9,1 Гц), 4,06 (s, 3H) Пртиклад 3 3-бромо-7-метокси-1 -нафтонітрил У суспензію 3,8-дибромо-7-метокси-1нафтонітрилу (1,62кг) і дигідрату хлориду олова (II) (1,24кг, 5,50моль) в оцтовій кислоті (5л) додали концентровану соляну кислоту (37% по масі, 2,5л) через краплинну лійку при 100°C впродовж 2 годин. Суміш перемішували при 100°C протягом 4 годин Потім остудили суміш до кімнатної температури Тверду фаз у відфільтрували промили 1% по масі HCI (2 х 1,00л), водою (1,00л) і висушили з отриманням зазначеної в заголовку сполуки у формі білого порошку (524м, 73%) 1H ЯМР (CDCI3). 5 8,13 (d, 1 H1J= 1,8 Гц), 7,93 (d, 1H1J= 1,9 Гц), 7 72 (d 1 H J = 9 0 Гц) 7,41 (d, 1H1J = 2,4 Гц), 7,28 (dd, 1H1J= 2,4 Гц, 9,0 Гц), 3,99 (s 3H) Приклад 4 3-(3-фторо-4-метоксифеніл)-7метокси-1 -нафтонітрил Суміш 3-бромо-7-метокси-1-нафтонпгрилу (100г, 0,383моль), карбонату натрію (121г, 1,15моль), дихлоробіс(трифенілфосфін) паладію (II) (0 27г, 0 0004моль), 3-фторо-4метоксифенілборної кислоти (71,3г, 0,420моль), води (600мл) і 1,2 метоксиетану (1000мл) нагріли до 800C та перемішували впродовж 2 годин а потім додали воду (600мл). Суміш остудили до кімнатної температури Тверду фазу відфільтрували, промили водою (2 х 200мл) і висушили з отриманням зазначеної в заголовку сполуки у формі білого порошку (118г, 98%) 1H ЯМР (CDCI3): 5 8,10 (d, 1 H1 J = 1 ,6 Гц), 8,06 (d, 1 H, J= 1,9 Гц), 7,84 (d, 1 H, J =9,0 Гц), 7,27 - 7,47 (т, 4 H), 7,08 (t, 1H1J= 8,4 Гц), 4,01 (s, 3H), 3,96 (s, 3H) Приклад 5 3-(3-фторо-4-гідроксифеніл)-7гідрокси-1-нафтонітрил У суспензію 3-(3-фторо-4-метоксифеніл)-7метокси-1-нафтонітрилу (200г 0,651моль) в 1,2дихлоретані (2000мл) протягом 20хв додали BBr3 11 84166 (511г 2 04моль), підтримуючи температур у реакції нижче 40°C Суміш нагріли до 83°С і перемішували протягом 4 годин. Реакційну суміш остудили до 3°C та впродовж 20хв додали холодну воду (2000мл). Відфільтрували тверду фазу й промили 0,5 N HCI (4 х 1000мл), водою (1000мл) і холодним етанолом (400мл), а потім висушили з отриманням сирого продукту, який можна рекристалізувати із етанолу й води й одержати зазначену в заголовку сполуку у формі світло-жовтого порошку (174г, 96%). 1H ЯМР (DMSO. d6, диметилсульфоксид). 5 10,48 (s, 1H), 10,10(S1 1H)1 8,44 (S, 1H)1 8,37 (d, 1 Комп’ютерна в ерстка В. Клюкін 12 H1 J= 1,8 Гц), 8,01 (d, 1 H, J =9,0 Гц), 7,71 (dd 1 H 1 J = 2,1 Гц, 10,8 Гц), 7,52 (dd, 1 H, J = 2,1 Гц, 8,4 Гц), 7,36 (d, 1 H, J = 2 1 Гц) 7,26 (dd, 1 H1 J = 2,1 Гц, 8,7 Гц), 7,07 (t, 1H 1J= 9,0 Гц) Для фа хівців у даній області техніки очевидна безліч варіантів даного винаходу, не ілюстрованих прикладами в даному описі. Даний винахід не обмежений варіантами реалізації, які описані тут й ілюстровані прикладами, але включає всю область поширення відповідно до прикладеної формули винаходу. Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the synthesis of 3-(3-fluoro-4-hydroxyphenyl)-7-hydroxynaphthonitrile, process for the preparation of intermediates, and intermediate
Автори англійськоюWu Yanzhong, Ren Jianxin, Ghosh Mousumi, Levent Mahmut, Sutherland Karen Wiggins, Raveendranath Panolil
Назва патенту російськоюСпособ получения 3-(3-фторо-4-гидроксифенил)-7-гидроксинафтонитрила, способы получения промежуточных соединений, а также промежуточное соединение
Автори російськоюВу Янжонг, Рен Жянксин, Геуш Моузуми, Левент Махмут, Сузерленд Карен Вигинз, Равеендранат Панолил
МПК / Мітки
МПК: C07C 255/00, C07C 41/00, C07C 253/30, C07C 255/54, C07C 39/00, C07C 255/53, C07C 37/00
Мітки: сполук, спосіб, одержання, проміжних, сполука, способи, проміжна, також, 3-(3-фторо-4-гідроксифеніл)-7-гідроксинафтонітрилу
Код посилання
<a href="https://ua.patents.su/6-84166-sposib-oderzhannya-3-3-ftoro-4-gidroksifenil-7-gidroksinaftonitrilu-sposobi-oderzhannya-promizhnikh-spoluk-a-takozh-promizhna-spoluka.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 3-(3-фторо-4-гідроксифеніл)-7-гідроксинафтонітрилу, способи одержання проміжних сполук, а також проміжна сполука</a>
Попередній патент: Двоступінчастий вакуумний шприц
Наступний патент: Похідні хіназоліну як інгібітори тирозинкінази, спосіб їх одержання (варіанти), фармацевтична композиція на їх основі
Випадковий патент: Гідрогелева композиція на основі кополімерів хітозану, полівінілового спирту та декстрану для лікування ран










