Похідні гетероциклічних амінів
Номер патенту: 113167
Опубліковано: 26.12.2016
Автори: Норкросс Роджер, Пфлігер Філіпп, Галлей Гуідо
Формула / Реферат
1. Сполука формули
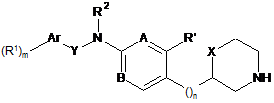 , I
, I
де
R1 означає водень, С1-7-алкіл, галоген, C1-7-алкіл, заміщений галогеном, C1-7-алкокси, C1-7-алкокси, заміщений галогеном, ціано, нітро, С3-6-циклоалкіл, -СН2-С3-6-циклоалкіл, -О-СН2-С3-6-циклоалкіл, -О-(СН2)2-О-С1-7-алкіл, S(O)2CH3, SF5, -С(О)NH-С1-7-алкіл, феніл, -О-піримідиніл, можливо заміщений С1-7-алкокси, заміщеним галогеном, або означає бензил, оксетаніл чи фураніл;
m означає 1 або 2;
Аr означає арил або гетероарил, вибраний з групи, що складається з фенілу, нафтилу, піримідинілу, піридинілу, бензотіазолілу, хінолінілу, хіназолінілу, бензо[d][1.3]діоксолілу, 5,6,7,8-тетрагідрохіназолінілу, піразолілу, піразинілу, піридазинілу або 1,3,4-оксадіазолілу;
Y означає зв'язок, -СН2-, -СН2СН2-, -CH(CF3)- або -СН(СН3)-;
R2 означає водень або С1-7-алкіл;
А означає CR або N; і R означає водень, ціано, галоген або С1-7-алкіл;
R' означає водень або галоген; за умови, що коли R' означає галоген, тоді А означає СН;
В означає СН або N;
n означає 0, 1 або 2;
X означає зв'язок, -СН2- або -О-;
або їх фармацевтично активні кислотно-адитивні солі, за винятком таких сполук:
(2,6-дихлорбензил)-(4-морфолін-2-ілфеніл)амін,
N-(4-((2S)-морфолін-2-іл)феніл)піридин-2-амін,
N-метил-N-(4-((2S)-морфолін-2-іл)феніл)тридин-2-амін і
(2,6-дихлорфеніл)-(4-морфолін-2-ілфеніл)амін.
2. Сполука формули ІА за п. 1
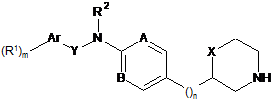 , IA
, IA
де
R1 означає водень, С1-7-алкіл, галоген, С1-7-алкіл, заміщений галогеном, C1-7-алкокси, С1-7-алкокси, заміщений галогеном, ціано, нітро, С3-6-циклоалкіл, S(O)2CH3 або феніл;
m означає 1 або 2;
Аr означає арил або гетероарил, вибраний з групи, що складається з фенілу, нафтилу, піримідинілу, піридинілу, бензотіазолілу, хінолінілу, хіназолінілу, бензо[d][1.3]діоксолілу, 5,6,7,8-тетрагідрохіназолінілу, піразолілу або 1,3,4-оксадіазолілу;
Y означає зв'язок, -СН2-, -СН2СН2-, -CH(CF3)- або -СН(СН3)-;
R2 означає водень або C1-7-алкіл;
А означає CR або N; і R означає водень, ціано, галоген або С1-7-алкіл;
В означає СН або N;
n означає 0, 1 або 2;
X означає зв'язок, -СН2- або -О-;
або їх фармацевтично активні кислотно-адитивні солі, за винятком таких сполук:
(2,6-дихлорбензил)-(4-морфолін-2-ілфеніл)амін,
N-(4-((2S)-морфолін-2-іл)феніл)піридин-2-амін,
N-метил-N-(4-((2S)-морфолін-2-іл)феніл)піридин-2-амін і
(2,6-дихлорфеніл)-(4-морфолін-2-ілфеніл)амін.
3. Сполука формули І, де А означає CR і В означає СН, за винятком таких сполук:
(2,6-дихлорбензил)-(4-морфолін-2-ілфеніл)амін,
N-(4-((2S)-морфолін-2-іл)феніл)піридин-2-амін,
N-метил-N-(4-((2S)-морфолін-2-іл)феніл)піридин-2-амін і
(2,6-дихлорфеніл)-(4-морфолін-2-ілфеніл)амін.
4. Сполука формули І за п. 3, де Y означає зв'язок і Аr означає феніл або нафтил, за винятком (2,6-дихлорфеніл)-(4-морфолін-2-ілфеніл)аміну.
5. Сполука формули І за п. 4, де сполукою є:
(RS)-(4-хлорфеніл)-(4-морфолін-2-ілфеніл)амін,
((S)-4-морфолін-2-ілфеніл)нафталін-2-іламін,
(S)-4-хлор-2-фтор-N-(4-(морфолін-2-іл)феніл)анілін,
(4-хлорфеніл)метил-((S)-4-морфолін-2-ілфеніл)амін,
(RS)-(4-хлорфеніл)-(2-метил-4-морфолін-2-ілфеніл)амін,
[5-(3,4-диметоксифеніл)піримідин-2-іл]-((S)-4-морфолін-2-ілфеніл)амін або
[5-(3,4-диметоксифеніл)піримідин-2-іл]-((R)-4-морфолін-2-ілфеніл)амін.
6. Сполука формули І за п. 3, де Y означає зв'язок і Аr означає піридиніл, піримідиніл, піразоліл, бензотіазоліл, хінолініл, хіназолініл, бензо[d][1.3]діоксоліл, 5,6,7,8-тетрагідрохіназолініл, піразиніл, піридазиніл або 1,3,4-оксадіазоліл, за винятком
N-(4-((2S)-морфолін-2-іл)феніл)піридин-2-аміну та
N-метил-N-(4-((2S)-морфолін-2-іл)феніл)піридин-2-аміну.
7. Сполука формули І за п. 6, де сполукою є:
(RS)-(4,6-диметилпіримідин-2-іл)-(4-піролідин-3-ілфеніл)аміну гідрохлорид,
(RS)-(5-хлортридин-2-іл)-(4-морфолін-2-ілфеніл)амін,
(RS)-(5-хлорпіримідин-2-іл)-(4-морфолін-2-ілфеніл)амін,
(RS)-(5-бромпіримідин-2-іл)-(4-морфолін-2-ілфеніл)амін,
(S)-5-бром-N-(4-(морфолін-2-іл)феніл)піридин-2-амін,
(S)-N-(4-(морфолін-2-іл)феніл)-5-(трифторметил)піридин-2-амін,
(5-метоксипіримідин-2-іл)-((S)-4-морфолін-2-ілфеніл)амін,
(5-фторпіримідин-2-іл)-((S)-4-морфолін-2-ілфеніл)амін,
(5-етилпіримідин-2-іл)-((S)-4-морфолін-2-ілфеніл)амін,
2-((S)-4-морфолін-2-ілфеніламіно)піримідин-5-карбонітрил,
(5-циклопропілпіримідин-2-іл)-((S)-4-морфолін-2-ілфеніл)амін,
(5-метилпіримідин-2-іл)-((S)-4-морфолін-2-ілфеніл)амін,
((S)-4-морфолін-2-ілфеніл)-(5-трифторметилпіримідин-2-іл)амін,
((S)-4-морфолін-2-ілфеніл)-(5-пропілпіримідин-2-іл)амін,
(6-хлорбензотіазол-2-іл)-((S)-4-морфолін-2-ілфеніл)амін,
(5-етоксипіримідин-2-іл)-((S)-4-морфолін-2-ілфеніл)амін,
(5-хлорпіридин-2-іл)-((S)-4-морфолін-2-ілфеніл)амін,
(S)-4-метокси-N-(4-(морфолін-2-іл)феніл)піридин-2-амін,
(S)-6-хлор-5-фтор-N-(4-(морфолін-2-іл)феніл)піридин-3-амін,
(S)-N-(4-(морфолін-2-іл)феніл)-3-(трифторметил)піридин-2-амін,
(S)-N-(4-(морфолін-2-іл)феніл)-4-(трифторметил)піридин-2-амін,
(S)-5-фтор-N-(4-(морфолін-2-іл)феніл)піридин-3-амін,
((S)-4-морфолін-2-ілфеніл)хінолін-2-іламін,
(S)-6-хлор-N-(4-(морфолін-2-іл)феніл)хінолін-2-амін,
(S)-2-метил-N-(4-(морфолін-2-іл)феніл)хінолін-8-амін,
(S)-N-(4-(морфолін-2-іл)феніл)-2,8-біс(трифторметил)хінолін-4-амін,
(S)-6-хлор-N-(4-(морфолін-2-іл)феніл)хіназолін-4-амін,
(S)-8-хлор-N-(4-(морфолін-2-іл)феніл)хінолін-2-амін,
(S)-5-бром-N-(4-(морфолін-2-іл)феніл)хінолін-2-амін,
(S)-4-хлор-N-(4-(морфолін-2-іл)феніл)хінолін-2-амін,
(2-фторпіридин-3-іл)-((S)-4-морфолін-2-ілфеніл)амін,
(S)-5-бром-3-метил-N-(4-(морфолін-2-іл)феніл)піридин-2-амін,
(S)-5-бром-3-фтор-N-(4-(морфолін-24л)феніл)піридин-2-амін,
(S)-3,5-дихлор-N-(4-(морфолін-2-іл)феніл)піридин-2-амін,
(S)-3,5-дибром-N-(4-(морфолін-2-іл)феніл)піридин-2-амін,
(S)-5-бром-4-метил-N-(4-(морфолін-2-іл)феніл)піридин-2-амін,
(S)-2,5-дихлор-N-(4-(морфолін-2-іл)феніл)піридин-4-амін,
(S)-4-бром-5-метил-N-(4-(морфолін-2-іл)феніл)піридин-2-амін,
(S)-N-(4-(морфолін-2-іл)феніл)бензо[d][1,3]діоксол-5-амін,
(S)-5-бром-N-(4-(морфолін-2-іл)феніл)хінолін-8-амін,
(R)-6-хлор-N-(4-(морфолін-2-іл)феніл)піридин-3-амін,
(R)-5-етил-N-(4-(морфолін-2-іл)феніл)піримідин-2-амін,
(R)-5-хлор-N-(4-(морфолін-2-іл)феніл)піридин-2-амін,
(S)-6-хлор-5-етокси-N-(4-(морфолін-2-іл)феніл)піридин-3-амін,
(5-етил-4-метилпіримідин-2-іл)-((S)-4-морфолін-2-ілфеніл)амін,
(5-ізопропіл-4-метилпіримідин-2-іл)-((S)-4-морфолін-2-ілфеніл)амін,
((S)-4-морфолін-2-ілфеніл)-(5,6,7,8-тетрагідрохіназолін-2-іл)амін,
((S)-4-морфолін-2-ілфеніл)-(5-нітропіримідин-2-іл)амін,
(RS)-5-бром-N-(2-метил-4-(морфолін-2-іл)феніл)піридин-2-амін,
(S)-5-хлор-3-фтор-N-(4-(морфолін-2-іл)феніл)піридин-2-амін,
(5-метансульфонілпіримідин-2-іл)-((S)-4-морфолін-2-ілфеніл)амін,
(RS)-(5-хлорпіридин-2-іл)-(2-метил-4-морфолін-2-ілфеніл)амін,
(RS)-(5-хлорпіримідин-2-іл)-(2-метил-4-морфолін-2-ілфеніл)амін,
(S)-5-хлор-N-(4-(морфолін-2-іл)феніл)-4-(трифторметил)піридин-2-амін,
(S)-5-хлор-4-метил-N-(4-(морфолін-2-іл)феніл)піридин-2-амін,
(RS)-5-хлор-4-метил-N-(2-метил-4-(морфолін-2-іл)феніл)піридин-2-амін,
(RS)-5-бром-4-метил-N-(2-метил-4-(морфолін-2-іл)феніл)піридин-2-амін,
(5-циклопропілпіримідин-2-іл)-((R)-4-морфолін-2-ілфеніл)амін,
(RS)-5-циклопропіл-N-(2-метил-4-(морфолін-2-іл)феніл)піримідин-2-амін,
(RS)-5-етил-N-(2-метил-4-(морфолін-2-іл)феніл)піримідин-2-амін,
(RS)-5-бром-N-(2-метил-4-(морфолін-2-іл)феніл)піримідин-2-амін,
((R)-4-морфолін-2-ілфеніл)-(5-пропілпіримідин-2-іл)амін,
(5-бромпіримідин-2-іл)-((R)-4-морфолін-2-ілфеніл)амін,
((R)-4-морфолін-2-ілфеніл)-(5-трифторметилпіримідин-2-іл)амін,
(RS)-5-хлор-N-(2-фтор-4-(морфолін-2-іл)феніл)піримідин-2-амін,
(RS)-5-етил-N-(2-фтор-4-(морфолін-2-іл)феніл)піримідин-2-амін,
(RS)-5-циклопропіл-N-(2-фтор-4-(морфолін-2-іл)феніл)піримідин-2-амін,
(RS)-5-хлор-N-(2-фтор-4-(морфолін-2-іл)феніл)піридин-2-амін,
(RS)-(5-етоксипіримідин-2-іл)-(2-фтор-4-морфолін-2-ілфеніл)амін,
(RS)-(2-фтор-4-морфолін-2-ілфеніл)-(5-пропілпіримідин-2-іл)амін,
(RS)-(5-бромпіримідин-2-іл)-(2-фтор-4-морфолін-2-ілфеніл)амін,
(R)-5-хлор-N-(4-(морфолін-2-іл)феніл)піримідин-2-амін,
(S)-5-хлор-N-(4-(морфолін-2-іл)феніл)піримідин-2-амін,
(5-етоксипіримідин-2-іл)-((R)-4-морфолін-2-ілфеніл)амін,
(5-етилпіримідин-2-іл)-((R)-2-метил-4-морфолін-2-ілфеніл)амін,
(5-етилпіримідин-2-іл)-((S)-2-метил-4-морфолін-2-ілфеніл)амін,
(5-циклопропілпіримідин-2-іл)-((R)-2-метил-4-морфолін-2-ілфеніл)амін,
(5-циклопропілпіримідин-2-іл)-((S)-2-метил-4-морфолін-2-ілфеніл)амін,
(5-етилпіримідин-2-іл)-((S)-4-піперидин-3-ілфеніл)амін,
(S)-N-(4-(морфолін-2-іл)феніл)-5-феніл-1Н-піразол-3-амін,
(5-етоксипіримідин-2-іл)-((S)-4-піперидин-3-ілфеніл)амін,
(S)-N-(4-(морфолін-2-іл)феніл)-5-феніл-1,3,4-оксадіазол-2-амін,
(5-етилпіримідин-2-іл)-((R)-2-фтор-4-морфолін-2-ілфеніл)амін,
(5-етилпіримідин-2-іл)-((S)-2-фтор-4-морфолін-2-ілфеніл)амін,
(5-циклопропілпіримідин-2-іл)-((R)-2-фтор-4-морфолін-2-ілфеніл)амін,
(5-циклопропілпіримідин-2-іл)-((S)-2-фтор-4-морфолін-2-ілфеніл)амін,
(RS)-(2-фтор-4-морфолін-2-ілфеніл)-(5-трифторметилпіримідин-2-іл)амін,
(5-ізопропоксипіримідин-2-іл)-((S)-4-морфолін-2-ілфеніл)амін,
(5-ізопропоксипіримідин-2-іл)-((R)-4-морфолін-2-ілфеніл)амін,
(S)-5-(циклопропілметокси)-N-(4-(морфолін-2-іл)феніл)піримідин-2-амін,
(R)-5-(циклопропілметокси)-N-(4-(морфолін-2-іл)феніл)піримідин-2-амін,
(5-бромпіримідин-2-іл)-((R)-2-фтор-4-морфолін-2-ілфеніл)амін,
(5-бромпіримідин-2-іл)-((S)-2-фтор-4-морфолін-2-ілфеніл)амін,
((R)-2-фтор-4-морфолін-2-ілфеніл)-(5-пропілпіримідин-2-іл)амін,
((S)-2-фтор-4-морфолін-2-ілфеніл)-(5-пропілпіримідин-2-іл)амін,
(5-хлорпіримідин-2-іл)-((R)-2-фтор-4-морфолін-2-ілфеніл)амін,
(5-хлорпіримідин-2-іл)-((S)-2-фтор-4-морфолін-2-ілфеніл)амін,
(5-етоксипіримідин-2-іл)-((R)-2-фтор-4-морфолін-2-ілфеніл)амін,
(5-етоксипіримідин-2-іл)-((S)-2-фтор-4-морфолін-2-ілфеніл)амін,
((R)-2-фтор-4-морфолін-2-ілфеніл)-(5-трифторметилпіримідин-2-іл)амін,
((S)-2-фтор-4-морфолін-2-ілфеніл)-(5-трифторметилпіримідин-2-іл)амін,
((S)-4-морфолін-2-ілфеніл)-[5-(2,2,2-трифторетокси)піримідин-2-іл]амін,
((R)-4-морфолін-2-ілфеніл)-[5-(2,2,2-трифторетокси)піримідин-2-іл]амін,
[5-(2-метоксіетокси)піримідин-2-іл]-((S)-4-морфолін-2-ілфеніл)амін,
[5-(2-метоксіетокси)піримідин-2-іл]-((R)-4-морфолін-2-ілфеніл)амін,
(RS)-(1-метил-1Н-піразол-3-іл)-(4-морфолін-2-ілфеніл)амін,
(RS)-(4-бром-1-метил-1Н-піразол-3-іл)-(4-морфолін-2-ілфеніл)амін,
((R)-2-фтор-4-морфолін-2-ілфеніл)-[5-(2,2,2-трифторетокси)піримідин-2-іл]амін,
((S)-2-фтор-4-морфолін-2-ілфеніл)-[5-(2,2,2-трифторетокси)піримідин-2-іл]амін,
(RS)-(1-циклопропілметил-1Н-піразол-3-іл)-(4-морфолін-2-ілфеніл)амін,
(5-фуран-2-ілпіримідин-2-іл)-((S)-4-морфолін-2-ілфеніл)амін,
(5-фуран-2-ілпіримідин-2-іл)-((R)-4-морфолін-2-ілфеніл)амін,
(RS)-N-(2-хлор-4-(морфолін-2-іл)феніл)-5-циклопропілпіримідин-2-амін,
(RS)-[1-(2,2-дифторетил)-1Н-піразол-3-іл]-(4-морфолін-2-ілфеніл)амін,
((R)-2-фтор-4-морфолін-2-ілфеніл)-[5-(2-метоксіетокси)піримідин-2-іл]амін,
((S)-2-фтор-4-морфолін-2-ілфеніл)-[5-(2-метоксіетокси)піримідин-2-іл]амін,
((S)-4-морфолін-2-ілфеніл)-(2-трифторметилпіримідин-5-іл)амін,
((R)-4-морфолін-2-ілфеніл)-(2-трифторметилпіримідин-5-іл)амін,
(RS)-(4-морфолін-2-ілфеніл)-(1Н-піразол-3-іл)амін,
(5-метилпіразин-2-іл)-((S)-4-морфолін-2-ілфеніл)амін,
(5-метилпіразин-2-іл)-((R)-4-морфолін-2-ілфеніл)амін,
метиламід 2-((S)-4-морфолін-2-ілфеніламіно)піримідин-5-карбонової кислоти,
метиламід 2-((R)-4-морфолін-2-ілфеніламіно)піримідин-5-карбонової кислоти,
(6-метилпіридазин-3-іл)-((S)-4-морфолін-2-ілфеніл)амін,
(1-бензил-1Н-піразол-3-іл)-((S)-4-морфолін-2-ілфеніл)амін,
(1-бензил-1Н-піразол-3-іл)-((R)-4-морфолін-2-ілфеніл)амін,
((S)-4-морфолін-2-ілфеніл)-(1-феніл-1Н-піразол-3-іл)амін,
((R)-4-морфолін-2-ілфеніл)-(1-феніл-1Н-піразол-3-іл)амін,
((S)-4-морфолін-2-ілфеніл)-(5-оксетан-3-ілпіридин-2-іл)амін,
((R)-2-метил-4-морфолін-2-ілфеніл)-(5-трифторметилпіримідин-2-іл)амін,
((S)-2-метил-4-морфолін-2-ілфеніл)-(5-трифторметилпіримідин-2-іл)амін,
((R)-2-хлор-4-морфолін-2-ілфеніл)-(5-трифторметилпіримідин-2-іл)амін,
((S)-2-хлор-4-морфолін-2-ілфеніл)-(5-трифторметилпіримідин-2-іл)амін,
(R)-N-(2-хлор-4-(морфолін-2-іл)феніл)-5-циклопропілпіримідин-2-амін,
(S)-N-(2-хлор-4-(морфолін-2-іл)феніл)-5-циклопропілпіримідин-2-амін,
((R)-4-морфолін-2-ілфеніл)-[4-(2,2,2-трифторетокси)піримідин-2-іл]амін,
(R)-N-(4-(морфолін-2-іл)феніл)-4-(трифторметил)піримідин-2-амін,
(R)-5-(5-(дифторметокси)піримідин-2-ілокси)-N-(4-(морфолін-2-іл)феніл)піримідин-2-амін,
(R)-N-(2-хлор-4-(морфолін-2-іл)феніл)-5-(5-(дифторметокси)піримідин-2-ілокси)-піримідин-2-амін,
(R)-N-(4-(морфолін-2-іл)феніл)піримідин-2-амін,
((R)-4-морфолін-2-ілфеніл)хіназолін-2-іламін,
(4-метил-6-трифторметилпіримідин-2-іл)-((R)-4-морфолін-2-ілфеніл)амін,
(R)-5-(дифторметокси)-N-(4-(морфолін-2-іл)феніл)піримідин-2-амін,
(4-хлор-6-метоксипіримідин-2-іл)-((R)-4-морфолін-2-ілфеніл)амін,
2-((R)-4-морфолін-2-ілфеніламіно)піримідин-4-карбонітрил,
(4,6-диметилпіримідин-2-іл)-((R)-4-морфолін-2-ілфеніл)амін,
(4,6-диметоксипіримідин-2-іл)-((R)-4-морфолін-2-ілфеніл)амін,
((R)-2-хлор-4-морфолін-2-ілфеніл)-[5-(2,2,2-трифторетокси)піримідин-2-іл]амін,
(R)-3-хлор-N-(4-(морфолін-2-іл)феніл)-5-(трифторметил)піридин-2-амін,
(S)-2,5-дихлор-N-(4-(морфолін-2-іл)феніл)піримідин-4-амін,
((S)-4-морфолін-2-ілфеніл)-[4-(2,2,2-трифторетокси)піримідин-2-іл]амін,
[5-фтор-4-(2,2,2-трифторетокси)піримідин-2-іл]-((R)-4-морфолін-2-ілфеніл)амін,
(4-циклопропілпіримідин-2-іл)-((R)-4-морфолін-2-ілфеніл)амін,
(4-циклопропіл-5-фторпіримідин-2-іл)-((R)-4-морфолін-2-ілфеніл)амін,
(4-пентафторсульфанілфеніл)-((R)-4-морфолін-2-ілфеніл)амін,
(R)-5-циклопропіл-N-(3-фтор-4-(морфолін-2-іл)феніл)піримідин-2-амін,
((S)-3-хлор-4-морфолін-2-ілфеніл)-(5-циклопропілпіримідин-2-іл)амін,
((R)-3-хлор-4-морфолін-2-ілфеніл)-(5-циклопропілпіримідин-2-іл)амін,
(S)-5-циклопропіл-N-(3-фтор-4-(морфолін-2-іл)феніл)піримідин-2-амін,
(R)-N-(3-фтор-4-(морфолін-2-іл)феніл)-5-(трифторметил)піримідин-2-амін,
(S)-N-(3-фтор-4-(морфолін-2-іл)феніл)-5-(трифторметил)піримідин-2-амін,
(R)-N-(4-(морфолін-2-іл)феніл)-6-(трифторметил)піримідин-4-амін,
(R)-6-хлор-N-(4-(морфолін-2-іл)феніл)піримідин-4-амін,
(R)-N-(4-(морфолін-2-іл)феніл)-2-(трифторметил)піримідин-4-амін,
(R)-N-(4-(морфолін-2-іл)феніл)-5-(трифторметил)піразин-2-амін,
((R)-3-хлор-4-морфолін-2-ілфеніл)-(5-хлорпіримідин-2-іл)амін,
((R)-3-хлор-4-морфолін-2-ілфеніл)-[5-(2,2,2-трифторетокси)піримідин-2-іл]амін,
((R)-3-хлор-4-морфолін-2-ілфеніл)-(5-трифторметилпіримідин-2-іл)амін,
(R)-5-хлор-N-(4-(морфолін-2-іл)феніл)піразин-2-амін,
(R)-6-хлор-N-(4-(морфолін-2-іл)феніл)піразин-2-амін,
(R)-N-(3-фтор-4-(морфолін-2-іл)феніл)-5-(2,2,2-трифторетокси)піримідин-2-амін,
(R)-N-(3-фтор-4-(морфолін-2-іл)феніл)-4-(2,2,2-трифторетокси)піримідин-2-амін,
(R)-5-фтор-N-(3-фтор-4-(морфолін-2-іл)феніл)-4-(2,2,2-трифторетокси)піримідин-2-амін,
(R)-5-хлор-N-(3-фтор-4-(морфолін-2-іл)феніл)піримідин-2-амін або
((R)-3-хлор-4-морфолін-2-ілфеніл)-[4-(2,2,2-трифторетокси)піримідин-2-іл]амін.
8. Сполука формули І за п. 3, де Y означає -СН2-, -CH2CH2-, -СН(СF3)- або -СН(СН3)- і Аr означає феніл або нафтил, за винятком (2,6-дихлорбензил)-(4-морфолін-2-ілфеніл)аміну.
9. Сполука формули І за п. 8, де сполукою є:
[(RS)-1-(4-хлорфеніл)-2,2,2-трифторетил]-[(RS)-4-(2-піролідин-3-ілетил)феніл]амін,
(RS)-[1-(4-хлорфеніл)-2,2,2-трифторетил]-[(RS)-4-(2-піперидин-3-ілетил)феніл]амін,
(RS)-(4-хлорбензил)-(4-морфолін-2-ілфеніл)амін,
((S)-4-морфолін-2-ілфеніл)фенетиламін,
(4-метоксибензил)-((S)-4-морфолін-2-ілфеніл)амін,
(4-метилбензил)-((S)-4-морфолін-2-ілфеніл)амін,
4-[((S)-4-морфолін-2-ілфеніламіно)метил]бензонітрил,
((S)-4-морфолін-2-ілфеніл)-(4-трифторметилбензил)амін,
((S)-4-морфолін-2-ілфеніл)-(4-трифторметоксибензил)амін,
(3,4-дихлорбензил)-((S)-4-морфолін-2-ілфеніл)амін,
(4-фторбензил)-((S)-4-морфолін-2-ілфеніл)амін,
[2-(4-хлорфеніл)етил]-((S)-4-морфолін-2-ілфеніл)амін,
(4-хлор-2-фторбензил)-((S)-4-морфолін-2-ілфеніл)амін,
(4-етилбензил)-((S)-4-морфолін-2-ілфеніл)амін,
(4-бромбензил)-((S)-4-морфолін-2-ілфеніл)амін або
[(RS)-1-(4-хлорфеніл)етил]-((S)-4-морфолін-2-ілфеніл)амін.
10. Сполука формули І за п. 3, де Y означає -СН2-, -CH2CH2-, -СН(СF3)- або -СН(СН3)- і Аr означає фурил, піридиніл, піримідиніл, піразоліл, бензотіазоліл, хінолініл, хіназолініл, бензо[d][1.3]діоксоліл, 5,6,7,8-тетрагідрохіназолініл або 1,3,4-оксадіазоліл.
11. Сполука формули І за п. 10, де сполукою є:
[(RS)-1-(5-бромпіридин-2-іл)-2,2,2-трифторетил]-((RS)-4-піролідин-3-ілфеніл)амін,
(5-бромпіридин-2-ілметил)-((S)-4-морфолін-2-ілфеніл)амін,
(6-метоксипіридин-2-ілметил)-((S)-4-морфолін-2-ілфеніл)амін,
(S)-N-((6-хлорпіридин-3-іл)метил)-4-(морфолін-2-іл)анілін,
(S)-4-(морфолін-2-іл)-N-((6-(трифторметил)піридин-3-іл)метил)анілін,
(5-фторпіридин-2-ілметил)-((S)-4-морфолін-2-ілфеніл)амін або
(S)-N-((2-хлорхінолін-3-іл)метил)-4-(морфолін-2-іл)анілін.
12. Сполука формули І за п. 1, де А означає N, В означає СН, Y означає зв'язок і Аr означає піридиніл, піримідиніл.
13. Сполука формули І за п. 12, де сполукою є:
(RS)-5-хлор-N-(5-(морфолін-2-іл)піридин-2-іл)піридин-2-амін,
(RS)-5-бром-N-(5-(морфолін-2-іл)піридин-2-іл)піридин-2-амін,
(RS)-5-циклопропіл-N-(5-(морфолін-2-іл)піридин-2-іл)піримідин-2-амін,
(R)-5-бром-N-(5-(морфолін-2-іл)піридин-2-іл)піридин-2-амін або
(S)-5-бром-N-(5-(морфолін-2-іл)піридин-2-іл)піридин-2-амін.
14. Сполука формули І за п. 1, де А означає CR, В означає N, Y означає зв'язок і Аr означає піридиніл.
15. Сполука формули І за п. 14, де сполука означає (RS)-N-(5-бромпіридин-2-іл)-3-метил-5 -(морфолін-2-іл)піридин-2-амін.
16. Спосіб одержання сполуки формули І за будь-яким з пп. 1-15, згідно з яким:
а) відщеплюють N-захисну групу від сполуки формули
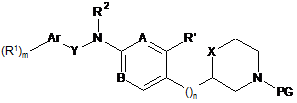
до сполуки формули
 , I
, I
де PG означає N-захисну групу, вибрану з -С(О)О-трет-бутилу, і
якщо бажано, перетворюють одержану сполуку на фармацевтично прийнятні кислотно-адитивні солі.
17. Фармацевтична композиція, що включає сполуку за будь-яким з пп. 1-15 і фармацевтично прийнятний носій та/або ад'ювант.
18. Фармацевтична композиція, що включає сполуку за будь-яким з пп. 1-15 і фармацевтично прийнятний носій та/або ад'ювант, для застосування в лікуванні депресії, тривожних розладів, біполярного розладу, синдрому дефіциту уваги з гіперактивністю (СДУГ), розладів, обумовлених стресом, психотичних розладів, шизофренії, неврологічних захворювань, хвороби Паркінсона, нейродегенеративних розладів, хвороби Альцгеймера, епілепсії, мігрені, гіпертонії, наркотичної залежності, метаболічних розладів, розладів приймання їжі, діабету, діабетичних ускладнень, ожиріння, дисліпідемії, розладів витрачання та поглинання енергії, розладів та порушення гомеостазу температури тіла, розладів сну та циркадного ритму і серцево-судинних розладів.
19. Сполука за будь-яким з пп. 1-15 для застосування як терапевтично активної речовини.
20. Сполука за будь-яким з пп. 1-15 для застосування як терапевтично активні речовини в лікуванні депресії, тривожних розладів, біполярного розладу, синдрому дефіциту уваги з гіперактивністю (СДУГ), розладів, обумовлених стресом, психотичних розладів, шизофренії, неврологічних захворювань, хвороби Паркінсона, нейродегенеративних розладів, хвороби Альцгеймера, епілепсії, мігрені, наркотичної залежності, метаболічних розладів, розладів приймання їжі, діабету, діабетичних ускладнень, ожиріння, дисліпідемії, розладів витрачання та поглинання енергії, розладів та порушення гомеостазу температури тіла, розладів сну та циркадного ритму і серцево-судинних розладів.
21. Сполука за будь-яким з пп. 1-15 для застосування як терапевтично активні речовини в лікуванні захворювань ЦНС, вибраних з депресії, тривожних розладів, біполярного розладу, синдрому дефіциту уваги з гіперактивністю (СДУГ), розладів, обумовлених стресом, психотичних розладів, шизофренії, неврологічних захворювань, хвороби Паркінсона, нейродегенеративних розладів, хвороби Альцгеймера, епілепсії, наркотичної залежності або мігрені.
22. Сполука за будь-яким з пп. 1-15 для застосування як терапевтично активної речовини в лікуванні метаболічних розладів, вибраних з розладів приймання їжі, діабету, діабетичних ускладнень або ожиріння.
23. Застосування сполуки за будь-яким з пп. 1-15 для виготовлення ліків для терапевтичного та/або профілактичного лікування депресії, тривожних розладів, біполярного розладу, синдрому дефіциту уваги з гіперактивністю (СДУГ), розладів, обумовлених стресом, психотичних розладів, шизофренії, неврологічних захворювань, хвороби Паркінсона, нейродегенеративних розладів, хвороби Альцгеймера, епілепсії, мігрені, наркотичної залежності, метаболічних розладів, розладів приймання їжі, діабету, діабетичних ускладнень, ожиріння, дисліпідемії, розладів витрачання та поглинання енергії, розладів та порушення гомеостазу температури тіла, розладів сну та циркадного ритму і серцево-судинних розладів.
Текст
Реферат: Винахід стосується сполук формули (І) R (R1)m Ar Y 2 A N R' B ()n де X NH ,I UA 113167 C2 (12) UA 113167 C2 1 R позначає водень, нижчий алкіл, галоген, нижчий алкіл, заміщений галогеном, нижчий алкокси, нижчий алкокси, заміщений галогеном, ціано, нітро, С 3-6-циклоалкіл, -СН2-С3-6циклоалкіл, -О-СН2-С3-6-циклоалкіл, -О-(СН2)2-О-нижчий алкіл, S(O)2CH3, SF5, -С(О)NH-нижчий алкіл, феніл, -О-піримідиніл, можливо заміщений нижчим алкокси, заміщеним галогеном, або позначає бензил, оксетаніл чи фураніл; m позначає 1 або 2; Аr позначає арил або гетероарил, вибраний з групи, що складається з фенілу, нафтилу, піримідинілу, піридинілу, бензотіазолілу, хінолінілу, хіназолінілу, бензо[d][1.3]діоксолілу, 5,6,7,8тетрагідрохіназолінілу, піразолілу, піразинілу, піридазинілу або 1,3,4-оксадіазолілу; Y позначає зв'язок, -СН2-, -СН2СН2-, -CH(CF3)- або -СН(СН3)-; 2 R позначає водень або нижчий алкіл; А позначає CR або N; і R позначає водень, ціано, галоген або нижчий алкіл; R' позначає водень або галоген; за умови, що коли R' позначає галоген, тоді А позначає СН; В позначає СН або N; n позначає 0, 1 або 2; X позначає зв'язок, -СН2- або -О-; або їх фармацевтично активних кислотно-адитивних солей, які мають гарну спорідненість до рецепторів, асоційованих зі слідовими амінами (TAAR), особливо до TAAR1 та можуть бути використані для лікування депресії, тривожних розладів, біполярного розладу, синдрому дефіциту уваги з гіперактивністю (СДУГ), розладів, обумовлених стресом, психотичних розладів, таких як шизофренія, неврологічних захворювань, таких як хвороба Паркінсона, нейродегенеративних розладів, таких як хвороба Альцгеймера, епілепсії, мігрені, гіпертонії, наркотичної залежності та метаболічних розладів, таких як розлади приймання їжі, діабет, діабетичні ускладнення, ожиріння, дисліпідемія, розлади витрачання та поглинання енергії, розлади та порушення гомеостазу температури тіла, розладів сну та циркадного ритму та серцево-судинних розладів. R (R1)m Ar Y 2 A N R' B ()n X NH UA 113167 C2 Даний винахід стосується сполук формули 2 R 1 (R )m Ar Y A N B 5 10 15 20 25 30 35 40 45 50 55 R' X ( )n NH I де 1 R позначає водень, нижчий алкіл, галоген, нижчий алкіл, заміщений галогеном, нижчий алкокси, нижчий алкокси, заміщений галогеном, ціано, нітро, C 3-6-циклоалкіл, -CH2-C3-6циклоалкіл, -O-CH2-C3-6-циклоалкіл, -O-(CH2)2-O-нижчий алкіл, S(O)2CH3, SF5, -C(O)NH-нижчий алкіл, феніл, -O-піримідиніл, можливо заміщений нижчим алкокси, заміщеним галогеном, або позначає бензил, оксетаніл чи фураніл; m позначає 1 або 2; Ar позначає арил або гетероарил, вибраний з групи, що складається з фенілу, нафтилу, піримідинілу, піридинілу, бензотіазолілу, хінолинілу, хіназолінілу, бензо[d][1.3]діоксолілу, 5,6,7,8тетрагідрохіназолінілу, піразолілу, піразинілу, піридазинілу або 1,3,4-оксадиазолілу; Y позначає зв'язок, -CH2-, -CH2CH2-, -CH(CF3)- або -CH(CH3)-; 2 R позначає водень або нижчий алкіл; A позначає CR або N; і R позначає водень, ціано, галоген або нижчий алкіл; R' позначає водень або галоген; за умови, що коли R' позначає галоген, тоді A позначає CH; B позначає CH або N; n позначає 0, 1 або 2; X позначає зв'язок, -CH2- або –O-; або їх фармацевтично активних кислотно-адитивних солей. Винахід включає усі рацемічні суміші, усі відповідні енантіомери та/або оптичні ізомери. Крім того, даний винахід також охоплює усі таутомерні форми сполук формули I. Встановлено, що сполуки формули I мають гарну спорідненість до рецепторів, асоційованих зі слідовими амінами (TAAR від trace amine associated receptors), особливо до TAAR1. Сполуки можуть бути використані для лікування депресії, тривожних розладів, біполярного розладу, синдрому дефіциту уваги з гіперактивністю (СДУГ), розладів, обумовлених стресом, психотичних розладів, таких як шизофренія, неврологічних захворювань, таких як хвороба Паркінсона, нейродегенеративних розладів, таких як хвороба Альцгеймера, епілепсії, мігрені, гіпертонії, наркотичної залежності та метаболічних розладів, таких як розлади приймання їжі, діабет, діабетичні ускладнення, ожиріння, дисліпідемія, розлади витрачання та поглинання енергії, розлади та порушення гомеостазу температури тіла, розладів сну та циркадного ритму та серцево-судинних розладів. Деякі з фізіологічних ефектів (тобто серцево-судинні ефекти, гіпотонія, індукція седативного ефекту), про які повідомлялося по відношенню до сполук, що можуть бути зв'язані з адренергічними рецепторами (WO02/076950, WO97/12874 або EP 0717037), можуть розглядатися як небажані побічні ефекти у випадку ліків, націлених на лікування захворювань центральної нервової системи, як описано вище. Отже, бажано одержати ліки, що мають селективність до рецептора TAAR1 порівняно з адренергічними рецепторами. Об'єкти даного винаходу демонструють вибірковість до рецептора TAAR1 відносно адренергічних рецепторів, зокрема гарну селективність порівняно з адренергічними рецепторами альфа1 та альфа2 людини і пацюка. Класичні біогенні аміни (серотонін, норепінефрин, епінефрин, дофамін, гістамін) виконують важливі функції як нейромедіатори у центральній та периферичній нервовій системі [1]. Їх синтез та зберігання, а також їх руйнування та повторне поглинання після вивільнення суворо регламентовані. Відомо, що дисбаланс у рівнях біогенних амінів відповідає за змінену функцію головного мозку при багатьох патологічних станах [2-5]. Другий клас ендогенних амінних сполук, так званих слідових амінів (TA від trace amines), у значному ступені співпадає з класичними біогенними амінами по відношенню до структури, метаболізму та субклітинної локалізації. TA включають п-тирамін, β-фенілетиламін, триптамін та октопамін, і вони присутні в нервовій системі ссавців, як правило, на більш низьких рівнях, ніж класичні біогенні аміни [6]. Їх дисрегуляція зв'язана з різними психіатричними захворюваннями, подібними до шизофренії та депресії [7], та іншими станами, подібними до синдрому дефіциту уваги з гіперактивністю, мігрені, хвороби Паркінсона, наркотичної залежності та розладів приймання їжі 1 UA 113167 C2 5 10 15 20 25 30 35 40 45 50 55 60 [8,9]. Протягом тривалого часу існування TA-специфічних рецепторів лише припускалося, виходячи з анатомічно дискретних сайтів зв'язування з високою спорідненістю до ТА в ЦНС людей та інших ссавців [10,11]. Відповідно, вважалося, що фармакологічні ефекти TA опосередковані широко відомим механізмом класичних біогенних амінів, чи то ініціюванням їх вивільнення, чи то інгібуванням їх зворотного захоплення, чи то "крос-взаємодією" з їх системами рецепторів [9,12,13]. Ця точка зору зазнала значних змін, зв'язаних з визначенням декількох членів нового сімейства GPCR - рецепторів, асоційованих зі слідовими амінами (TAAR) [7,14]. Існує 9 генів TAAR у людини (включаючи 3 псевдогени) та 16 генів у миші (включаючи 1 псевдоген). Гени TAAR не містять інтронів (за одним винятком - TAAR2 містить 1 інтрон) та розташовані поряд один з одним на одній й тій самій хромосомній ділянці. Порівняння філогенетичного взаємозв'язку генів рецепторів відповідно до глибокої схожості з фармакофором GPCR та фармакологічні дані вказують на те, що ці рецептори утворюють три чітких підсімейства [7,14]. TAAR1 входить до першого підкласу чотирьох генів (TAAR1-4), висококонсервативних між людиною та гризунами. TA активують TAAR1 через Gαs. Показано, що дисрегуляція TA впливає на етіологію різних захворювань, подібних до депресії, психозу, синдрому дефіциту уваги з гіперактивністю, наркотичної залежності, хвороби Паркінсона, мігрені, розладів приймання їжі, метаболічних розладів і, отже, ліганди TAAR1 мають високий потенціал в лікуванні цих захворювань. Отже, існує великий інтерес до збільшення знань про рецептори, асоційовані зі слідовими амінами. Використані посилання: nd 1. Deutch, A.Y. and Roth, R.H. (1999) Neurotransmitters. In Fundamental Neuroscience (2 edn) (Zigmond, M.J., Bloom, F.E., Landis, S.C., Roberts, J.L, and Squire, L.R., eds.), pp. 193-234, Academic Press; 2. Wong, M.L. and Licinio, J. (2001) Research and treatment approaches to depression. Nat. Rev. Neurosci. 2, 343-351; 3. Carlsson, A. et al. (2001) Interactions between monoamines, glutamate, and GABA in schizophrenia: new evidence. Annu. Rev. Pharmacol. Toxicol. 41, 237-260; 4. Tuite, P. and Riss, J. (2003) Recent developments in the pharmacological treatment of Parkinson's disease. Expert Opin. Investig. Drugs 12, 1335-1352, 5. Castellanos, F.X. and Tannock, R. (2002) Neuroscience of attention-deficit/hyperactivity disorder: the search for endophenotypes. Nat. Rev. Neurosci. 3, 617-628; 6. Usdin, Earl; Sandler, Merton; Editors. Psychopharmacology Series, Vol. 1: Trace Amines and the Brain. [Proceedings of a Study Group at the 14th Annual Meeting of the American College of Neuropsychoparmacology, San Juan, Puerto Rico] (1976); 7. Lindemann, L. and Hoener, M. (2005) A renaissance in trace amines inspired by a novel GPCR family. Trends in Pharmacol. Sci. 26, 274-281; 8. Branchek, T.A. and Blackburn, T.P. (2003) Trace amine receptors as targets for novel therapeutics: legend, myth and fact. Curr. Opin. Pharmacol. 3, 90-97; 9. Premont, R.T. et al. (2001) Following the trace of elusive amines. Proc. Natl. Acad. Sci. U. S. A. 98, 9474-9475; 10. Mousseau, D.D. and Butterworth, R.F. (1995) A high-affinity [3H] tryptamine binding site in human brain. Prog. Brain Res. 106, 285-291; 11. McCormack, J.K. et al. (1986) Autoradiographic localization of tryptamine binding sites in the rat and dog central nervous system. J. Neurosci. 6, 94-101; 12. Dyck, L.E. (1989) Release of some endogenous trace amines from rat striatal slices in the presence and absence of a monoamine oxidase inhibitor. Life Sci. 44, 1149-1156; 13. Parker, E.M. and Cubeddu, L.X. (1988) Comparative effects of amphetamine, phenylethylamine and related drugs on dopamine efflux, dopamine uptake and mazindol binding. J. Pharmacol. Exp. Ther. 245, 199-210; 14. Lindemann, L. et al. (2005) Trace amine associated receptors form structurally and functionally distinct subfamilies of novel G protein-coupled receptors. Genomics 85, 372-385. Предметами даного винаходу є нові сполуки формули I та їх фармацевтично прийнятні солі, їх застосування для виготовлення ліків для лікування захворювань, зв'язаних з біологічною функцією рецепторів, асоційованих зі слідовими амінами, їх виготовлення та ліки на основі сполуки за даним винаходом при регулюванні або запобіганні захворювань, таких як депресія, тривожні розлади, біполярний розлад, синдром дефіциту уваги з гіперактивністю, розлади, обумовлені стресом, психотичні розлади, такі як шизофренія, неврологічні захворювання, такі як хвороба Паркінсона, нейродегенеративні розлади, такі як хвороба Альцгеймера, епілепсія, 2 UA 113167 C2 5 10 15 20 25 30 мігрень, наркотична залежність та метаболічні розлади, такі як розлади приймання їжі, діабет, діабетичні ускладнення, ожиріння, дисліпідемія, розлади витрачання та поглинання енергії, розлади та порушення гомеостазу температури тіла, розлади сну та циркадного ритму та серцево-судинні розлади. Кращими показаннями застосування сполук за даним винаходом є депресія, психоз, хвороба Паркінсона, діабет, тривога та синдром дефіциту уваги з гіперактивністю (СДУГ). У використовуваному тут значенні, термін "нижчий алкіл" позначає насичену нерозгалужену або розгалужену групу, що містить від 1 до 7 атомів вуглецю, наприклад, метил, етил, пропіл, ізопропіл, н-бутил, ізобутил, 2-бутил, трет-бутил тощо. Кращими алкільними групами є групи з 14 атомами вуглецю. У використовуваному тут значенні, термін "нижчий алкокси", позначає групу, де алкільний залишок є таким, як визначено вище, та який приєднаний через атом кисню. У використовуваному тут значенні, термін "нижчий алкіл, заміщений галогеном", позначає алкільну групу, як визначено вище, де принаймні один атом водню заміщений галогеном, наприклад, CF3, CHF2, CH2F, CH2CF3, CH2CH2CF3, CH2CF2CF3 тощо. У використовуваному тут значенні, термін "нижчий алкокси, заміщений галогеном", позначає групу, де алкільний залишок є таким, як визначено вище, який приєднаний через атом кисню, і де принаймні один атом водню заміщений галогеном. Термін "галоген" позначає хлор, йод, фтор та бром. Термін "циклоалкіл" позначає алкіленове кільце, що містить від 3 до 6 кільцевих атомів вуглецю. Термін "арил" стосується ароматичного вуглецевого кільця, такого як фенільне або нафтильне кільце, краще, фенільне кільце. Термін "гетероарил" стосується ароматичного 5–6-членного моноциклічного кільця або 9– 10-членного біциклічного кільця, яке може включати 1, 2 або 3 гетероатоми, вибраних з азоту, кисню та/або сірки, такого як піримідиніл, піридиніл, бензотіазоліл, хінолініл, хіназолініл, бензо[d][1.3]діоксоліл, 5,6,7,8-тетрагідразолініл, піразоліл, піразиніл, піридазиніл або 1,3,4оксадіазоліл. Термін "фармацевтично прийнятні кислотно-адитивні соли" охоплює солі з неорганічними та органічними кислотами, такими як соляна кислота, азотна кислота, сірчана кислота, фосфорна кислота, лимонна кислота, мурашина кислота, фумарова кислота, малеїнова кислота, оцтова кислота, бурштинова кислота, винна кислота, метансульфонова кислота, п-толуолсульфонова кислота тощо. Одним втіленням даного винаходу є сполуки формули 35 2 R 1 (R )m Ar Y A N B ( )n 1 40 45 50 55 X NH IA де R позначає водень, нижчий алкіл, галоген, нижчий алкіл, заміщений галогеном, нижчий алкокси, нижчий алкокси, заміщений галогеном, ціано, нітро, C 3-6-циклоалкіл, S(O)2CH3 або феніл; m позначає 1 або 2; Ar позначає арил або гетероарил, вибраний з групи, що складається з фенілу, нафтилу, піримідинілу, піридинілу, бензотіазолілу, хінолінілу, хіназолінілу, бензо[d][1.3]діоксолілу, 5,6,7,8тетрагідрохіназолінілу, піразолілу або 1,3,4-оксадіазолілу; Y позначає зв'язок, -CH2-, -CH2CH2-, -CH(CF3)- або -CH(CH3)-; 2 R позначає водень або нижчий алкіл; A позначає CR або N; і R позначає водень, ціано, галоген або нижчий алкіл; B позначає CH або N; n позначає 0, 1 або 2; X позначає зв'язок, -CH2- або –O-; або їх фармацевтично активні кислотно-адитивні солі. Одним додатковим втіленням винаходу є сполуки формули I, де A позначає CR і B позначає CH. Втіленням даної групи є сполуки формули I, де Y позначає зв'язок і Ar позначає феніл або нафтил, наприклад, такі сполуки: (RS)-(4-хлорфеніл)-(4-морфолін-2-ілфеніл)амін 3 UA 113167 C2 5 10 15 20 25 30 35 40 45 50 55 60 ((S)-4-морфолін-2-ілфеніл)нафталін-2-іламін (S)-4-хлор-2-фтор-N-(4-(морфолін-2-іл)феніл)анілін (4-хлорфеніл)метил-((S)-4-морфолін-2-ілфеніл)амін (RS)-(4-хлорфеніл)-(2-метил-4-морфолін-2-ілфеніл)амін [5-(3,4-диметоксифеніл)піримідин-2-іл]-((S)-4-морфолін-2-ілфеніл)амін або [5-(3,4-диметоксифеніл)піримідин-2-іл]-((R)-4-морфолін-2-ілфеніл)амін. Втіленням даної групи, крім того, є сполуки формули I, де Y позначає зв'язок і Ar позначає піридиніл, піримідиніл, піразоліл, бензотіазоліл, хінолініл, хіназолініл, бензо[d][1.3]діоксоліл, 5,6,7,8-тетрагідрохіназолініл, піразиніл, піридазиніл або 1,3,4-оксадіазоліл, наприклад, такі сполуки: (RS)-(4,6-диметилпіримідин-2-іл)-(4-піролідин-3-ілфеніл)аміну гідрохлорид (RS)-(5-хлорпіридин-2-іл)-(4-морфолін-2-ілфеніл)амін (RS)-(5-хлорпіримідин-2-іл)-(4-морфолін-2-ілфеніл)амін (RS)-(5-бромпіримідин-2-іл)-(4-морфолін-2-ілфеніл)амін (S)-5-бром-N-(4-(морфолін-2-іл)феніл)піридин-2-амін (S)-N-(4-(морфолін-2-іл)феніл)-5-(трифторметил)піридин-2-амін (5-метоксипіримідин-2-іл)-((S)-4-морфолін-2-ілфеніл)амін (5-фторпіримідин-2-іл)-((S)-4-морфолін-2-ілфеніл)амін (5-етилпіримідин-2-іл)-((S)-4-морфолін-2-ілфеніл)амін 2-((S)-4-морфолін-2-ілфеніламіно)піримідин-5-карбонітрил (5-циклопропілпіримідин-2-іл)-((S)-4-морфолін-2-ілфеніл)амін (5-метилпіримідин-2-іл)-((S)-4-морфолін-2-ілфеніл)амін ((S)-4-морфолін-2-ілфеніл)-(5-трифторметилпіримідин-2-іл)амін ((S)-4-морфолін-2-ілфеніл)-(5-пропілпіримідин-2-іл)амін (6-хлорбензотіазол-2-іл)-((S)-4-морфолін-2-ілфеніл)амін (5-етоксипіримідин-2-іл)-((S)-4-морфолін-2-ілфеніл)амін (5-хлорпіридин-2-іл)-((S)-4-морфолін-2-ілфеніл)амін (S)-4-метокси-N-(4-(морфолін-2-іл)феніл)піридин-2-амін (S)-6-хлор-5-фтор-N-(4-(морфолін-2-іл)феніл)піридин-3-амін (S)-N-(4-(морфолін-2-іл)феніл)-3-(трифторметил)піридин-2-амін (S)-N-(4-(морфолін-2-іл)феніл)-4-(трифторметил)піридин-2-амін (S)-5-фтор-N-(4-(морфолін-2-іл)феніл)піридин-3-амін ((S)-4-морфолін-2-ілфеніл)хінолін-2-іламін (S)-6-хлор-N-(4-(морфолін-2-іл)феніл)хінолін-2-амін (S)-2-метил-N-(4-(морфолін-2-іл)феніл)хінолін-8-амін (S)-N-(4-(морфолін-2-іл)феніл)-2,8-біс(трифторметил)хінолін-4-амін (S)-6-хлор-N-(4-(морфолін-2-іл)феніл)хіназолін-4-амін (S)-8-хлор-N-(4-(морфолін-2-іл)феніл)хінолін-2-амін (S)-5-бром-N-(4-(морфолін-2-іл)феніл)хінолін-2-амін (S)-4-хлор-N-(4-(морфолін-2-іл)феніл)хінолін-2-амін (2-фторпіридин-3-іл)-((S)-4-морфолін-2-ілфеніл)амін (S)-5-бром-3-метил-N-(4-(морфолін-2-іл)феніл)піридин-2-амін (S)-5-бром-3-фтор-N-(4-(морфолін-2-іл)феніл)піридин-2-амін (S)-3,5-дихлор-N-(4-(морфолін-2-іл)феніл)піридин-2-амін (S)-3,5-дибром-N-(4-(морфолін-2-іл)феніл)піридин-2-амін (S)-5-бром-4-метил-N-(4-(морфолін-2-іл)феніл)піридин-2-амін (S)-2,5-дихлор-N-(4-(морфолін-2-іл)феніл)піридин-4-амін (S)-4-бром-5-метил-N-(4-(морфолін-2-іл)феніл)піридин-2-амін (S)-N-(4-(морфолін-2-іл)феніл)бензо[d][1,3]діоксол-5-амін (S)-5-бром-N-(4-(морфолін-2-іл)феніл)хінолін-8-амін (R)-6-хлор-N-(4-(морфолін-2-іл)феніл)піридин-3-амін (R)-5-етил-N-(4-(морфолін-2-іл)феніл)піримідин-2-амін (R)-5-хлор-N-(4-(морфолін-2-іл)феніл)піридин-2-амін (S)-6-хлор-5-етокси-N-(4-(морфолін-2-іл)феніл)піридин-3-амін (5-етил-4-метилпіримідин-2-іл)-((S)-4-морфолін-2-ілфеніл)амін (5-ізопропіл-4-метилпіримідин-2-іл)-((S)-4-морфолін-2-ілфеніл)амін ((S)-4-морфолін-2-ілфеніл)-(5,6,7,8-тетрагідрохіназолін-2-іл)амін ((S)-4-морфолін-2-ілфеніл)-(5-нітропіримідин-2-іл)амін (RS)-5-бром-N-(2-метил-4-(морфолін-2-іл)феніл)піридин-2-амін (S)-5-хлор-3-фтор-N-(4-(морфолін-2-іл)феніл)піридин-2-амін 4 UA 113167 C2 5 10 15 20 25 30 35 40 45 50 55 60 (5-метансульфонілпіримідин-2-іл)-((S)-4-морфолін-2-ілфеніл)амін (RS)-(5-хлорпіридин-2-іл)-(2-метил-4-морфолін-2-ілфеніл)амін (RS)-(5-хлорпіримідин-2-іл)-(2-метил-4-морфолін-2-ілфеніл)амін (S)-5-хлор-N-(4-(морфолін-2-іл)феніл)-4-(трифторметил)піридин-2-амін (S)-5-хлор-4-метил-N-(4-(морфолін-2-іл)феніл)піридин-2-амін (RS)-5-хлор-4-метил-N-(2-метил-4-(морфолін-2-іл)феніл)піридин-2-амін (RS)-5-бром-4-метил-N-(2-метил-4-(морфолін-2-іл)феніл)піридин-2-амін (5-циклопропілпіримідин-2-іл)-((R)-4-морфолін-2-ілфеніл)амін (RS)-5-циклопропіл-N-(2-метил-4-(морфолін-2-іл)феніл)піримідин-2-амін (RS)-5-етил-N-(2-метил-4-(морфолін-2-іл)феніл)піримідин-2-амін (RS)-5-бром-N-(2-метил-4-(морфолін-2-іл)феніл)піримідин-2-амін ((R)-4-морфолін-2-ілфеніл)-(5-пропілпіримідин-2-іл)амін (5-бромпіримідин-2-іл)-((R)-4-морфолін-2-ілфеніл)амін ((R)-4-морфолін-2-ілфеніл)-(5-трифторметилпіримідин-2-іл)амін (RS)-5-хлор-N-(2-фтор-4-(морфолін-2-іл)феніл)піримідин-2-амін (RS)-5-етил-N-(2-фтор-4-(морфолін-2-іл)феніл)піримідин-2-амін (RS)-5-циклопропіл-N-(2-фтор-4-(морфолін-2-іл)феніл)піримідин-2-амін (RS)-5-хлор-N-(2-фтор-4-(морфолін-2-іл)феніл)піридин-2-амін (RS)-(5-етоксипіримідин-2-іл)-(2-фтор-4-морфолін-2-ілфеніл)амін (RS)-(2-фтор-4-морфолін-2-ілфеніл)-(5-пропілпіримідин-2-іл)амін (RS)-(5-бромпіримідин-2-іл)-(2-фтор-4-морфолін-2-ілфеніл)амін (R)-5-хлор-N-(4-(морфолін-2-іл)феніл)піримідин-2-амін (S)-5-хлор-N-(4-(морфолін-2-іл)феніл)піримідин-2-амін (5-етоксипіримідин-2-іл)-((R)-4-морфолін-2-ілфеніл)амін (5-етилпіримідин-2-іл)-((R)-2-метил-4-морфолін-2-ілфеніл)амін (5-етилпіримідин-2-іл)-((S)-2-метил-4-морфолін-2-ілфеніл)амін (5-циклопропілпіримідин-2-іл)-((R)-2-метил-4-морфолін-2-ілфеніл)амін (5-циклопропілпіримідин-2-іл)-((S)-2-метил-4-морфолін-2-ілфеніл)амін (5-етилпіримідин-2-іл)-((S)-4-пиперидин-3-ілфеніл)амін (S)-N-(4-(морфолін-2-іл)феніл)-5-феніл-1H-піразол-3-амін (5-етоксипіримідин-2-іл)-((S)-4-пиперидин-3-ілфеніл)амін (S)-N-(4-(морфолін-2-іл)феніл)-5-феніл-1,3,4-оксадіазол-2-амін (5-етилпіримідин-2-іл)-((R)-2-фтор-4-морфолін-2-ілфеніл)амін (5-етилпіримідин-2-іл)-((S)-2-фтор-4-морфолін-2-ілфеніл)амін (5-циклопропілпіримідин-2-іл)-((R)-2-фтор-4-морфолін-2-ілфеніл)амін (5-циклопропілпіримідин-2-іл)-((S)-2-фтор-4-морфолін-2-ілфеніл)амін (RS)-(2-фтор-4-морфолін-2-ілфеніл)-(5-трифторметилпіримідин-2-іл)амін (5-ізопропоксипіримідин-2-іл)-((S)-4-морфолін-2-ілфеніл)амін (5-ізопропоксипіримідин-2-іл)-((R)-4-морфолін-2-ілфеніл)амін (S)-5-(циклопропілметокси)-N-(4-(морфолін-2-іл)феніл)піримідин-2-амін (R)-5-(циклопропілметокси)-N-(4-(морфолін-2-іл)феніл)піримідин-2-амін (5-бромпіримідин-2-іл)-((R)-2-фтор-4-морфолін-2-ілфеніл)амін (5-бромпіримідин-2-іл)-((S)-2-фтор-4-морфолін-2-ілфеніл)амін ((R)-2-фтор-4-морфолін-2-ілфеніл)-(5-пропілпіримідин-2-іл)амін ((S)-2-фтор-4-морфолін-2-ілфеніл)-(5-пропілпіримідин-2-іл)амін (5-хлорпіримідин-2-іл)-((R)-2-фтор-4-морфолін-2-ілфеніл)амін (5-хлорпіримідин-2-іл)-((S)-2-фтор-4-морфолін-2-ілфеніл)амін (5-етоксипіримідин-2-іл)-((R)-2-фтор-4-морфолін-2-ілфеніл)амін (5-етоксипіримідин-2-іл)-((S)-2-фтор-4-морфолін-2-ілфеніл)амін ((R)-2-фтор-4-морфолін-2-ілфеніл)-(5-трифторметилпіримідин-2-іл)амін ((S)-2-фтор-4-морфолін-2-ілфеніл)-(5-трифторметилпіримідин-2-іл)амін ((S)-4-морфолін-2-ілфеніл)-[5-(2,2,2-трифторетокси)піримідин-2-іл]амін ((R)-4-морфолін-2-ілфеніл)-[5-(2,2,2-трифторетокси)піримідин-2-іл]амін [5-(2-метоксіетокси)піримідин-2-іл]-((S)-4-морфолін-2-ілфеніл)амін [5-(2-метоксіетокси)піримідин-2-іл]-((R)-4-морфолін-2-ілфеніл)амін (RS)-(1-метил-1H-піразол-3-іл)-(4-морфолін-2-ілфеніл)амін (RS)-(4-бром-1-метил-1H-піразол-3-іл)-(4-морфолін-2-ілфеніл)амін ((R)-2-фтор-4-морфолін-2-ілфеніл)-[5-(2,2,2-трифторетокси)піримідин-2-іл]амін ((S)-2-фтор-4-морфолін-2-ілфеніл)-[5-(2,2,2-трифторетокси)піримідин-2-іл]амін (RS)-(1-циклопропілметил-1H-піразол-3-іл)-(4-морфолін-2-ілфеніл)амін 5 UA 113167 C2 5 10 15 20 25 30 35 40 45 50 55 60 (5-фуран-2-ілпіримідин-2-іл)-((S)-4-морфолін-2-ілфеніл)амін (5-фуран-2-ілпіримідин-2-іл)-((R)-4-морфолін-2-ілфеніл)амін (RS)-N-(2-хлор-4-(морфолін-2-іл)феніл)-5-циклопропілпіримідин-2-амін (RS)-[1-(2,2-дифторетил)-1H-піразол-3-іл]-(4-морфолін-2-ілфеніл)амін ((R)-2-фтор-4-морфолін-2-ілфеніл)-[5-(2-метоксіетокси)піримідин-2-іл]амін ((S)-2-фтор-4-морфолін-2-ілфеніл)-[5-(2-метоксіетокси)піримідин-2-іл]амін ((S)-4-морфолін-2-ілфеніл)-(2-трифторметилпіримідин-5-іл)амін ((R)-4-морфолін-2-ілфеніл)-(2-трифторметилпіримідин-5-іл)амін (RS)-(4-морфолін-2-ілфеніл)-(1H-піразол-3-іл)амін (5-метилпіразин-2-іл)-((S)-4-морфолін-2-ілфеніл)амін (5-метилпіразин-2-іл)-((R)-4-морфолін-2-ілфеніл)амін метиламід 2-((S)-4-морфолін-2-ілфеніламіно)піримідин-5-карбонової кислоти метиламід 2-((R)-4-морфолін-2-ілфеніламіно)піримідин-5-карбонової кислоти (6-метилпіридазин-3-іл)-((S)-4-морфолін-2-ілфеніл)амін (1-бензил-1H-піразол-3-іл)-((S)-4-морфолін-2-ілфеніл)амін (1-бензил-1H-піразол-3-іл)-((R)-4-морфолін-2-ілфеніл)амін ((S)-4-морфолін-2-ілфеніл)-(1-феніл-1H-піразол-3-іл)амін ((R)-4-морфолін-2-ілфеніл)-(1-феніл-1H-піразол-3-іл)амін ((S)-4-морфолін-2-ілфеніл)-(5-оксетан-3-ілпіридин-2-іл)амін ((R)-2-метил-4-морфолін-2-ілфеніл)-(5-трифторметилпіримідин-2-іл)амін ((S)-2-метил-4-морфолін-2-ілфеніл)-(5-трифторметилпіримідин-2-іл)амін ((R)-2-хлор-4-морфолін-2-ілфеніл)-(5-трифторметилпіримідин-2-іл)амін ((S)-2-хлор-4-морфолін-2-ілфеніл)-(5-трифторметилпіримідин-2-іл)амін (R)-N-(2-хлор-4-(морфолін-2-іл)феніл)-5-циклопропілпіримідин-2-амін (S)-N-(2-хлор-4-(морфолін-2-іл)феніл)-5-циклопропілпіримідин-2-амін ((R)-4-морфолін-2-ілфеніл)-[4-(2,2,2-трифторетокси)піримідин-2-іл]амін (R)-N-(4-(морфолін-2-іл)феніл)-4-(трифторметил)піримідин-2-амін (R)-5-(5-(дифторметокси)піримідин-2-ілокси)-N-(4-(морфолін-2-іл)феніл)піримідин-2-амін (R)-N-(2-хлор-4-(морфолін-2-іл)феніл)-5-(5-(дифторметокси)піримідин-2-ілокси)піримідин-2амін (R)-N-(4-(морфолін-2-іл)феніл)піримідин-2-амін ((R)-4-морфолін-2-ілфеніл)хіназолін-2-іламін (4-метил-6-трифторметилпіримідин-2-іл)-((R)-4-морфолін-2-ілфеніл)амін (R)-5-(дифторметокси)-N-(4-(морфолін-2-іл)феніл)піримідин-2-амін (4-хлор-6-метоксипіримідин-2-іл)-((R)-4-морфолін-2-ілфеніл)амін 2-((R)-4-морфолін-2-ілфеніламіно)піримідин-4-карбонітрил (4,6-диметилпіримідин-2-іл)-((R)-4-морфолін-2-ілфеніл)амін (4,6-диметоксипіримідин-2-іл)-((R)-4-морфолін-2-ілфеніл)амін ((R)-2-хлор-4-морфолін-2-ілфеніл)-[5-(2,2,2-трифторетокси)піримідин-2-іл]амін (R)-3-хлор-N-(4-(морфолін-2-іл)феніл)-5-(трифторметил)піридин-2-амін (S)-2,5-дихлор-N-(4-(морфолін-2-іл)феніл)піримідин-4-амін ((S)-4-морфолін-2-ілфеніл)-[4-(2,2,2-трифторетокси)піримідин-2-іл]амін [5-фтор-4-(2,2,2-трифторетокси)піримідин-2-іл]-((R)-4-морфолін-2-ілфеніл)амін (4-циклопропілпіримідин-2-іл)-((R)-4-морфолін-2-ілфеніл)амін (4-циклопропіл-5-фторпіримідин-2-іл)-((R)-4-морфолін-2-ілфеніл)амін (4-пентафторсульфанілфеніл)-((R)-4-морфолін-2-ілфеніл)амін (R)-5-циклопропіл-N-(3-фтор-4-(морфолін-2-іл)феніл)піримідин-2-амін ((S)-3-хлор-4-морфолін-2-ілфеніл)-(5-циклопропілпіримідин-2-іл)амін ((R)-3-хлор-4-морфолін-2-ілфеніл)-(5-циклопропілпіримідин-2-іл)амін (S)-5-циклопропіл-N-(3-фтор-4-(морфолін-2-іл)феніл)піримідин-2-амін (R)-N-(3-фтор-4-(морфолін-2-іл)феніл)-5-(трифторметил)піримідин-2-амін (S)-N-(3-фтор-4-(морфолін-2-іл)феніл)-5-(трифторметил)піримідин-2-амін (R)-N-(4-(морфолін-2-іл)феніл)-6-(трифторметил)піримідин-4-амін (R)-6-хлор-N-(4-(морфолін-2-іл)феніл)піримідин-4-амін (R)-N-(4-(морфолін-2-іл)феніл)-2-(трифторметил)піримідин-4-амін (R)-N-(4-(морфолін-2-іл)феніл)-5-(трифторметил)піразин-2-амін ((R)-3-хлор-4-морфолін-2-ілфеніл)-(5-хлорпіримідин-2-іл)амін ((R)-3-хлор-4-морфолін-2-ілфеніл)-[5-(2,2,2-трифторетокси)піримідин-2-іл]амін ((R)-3-хлор-4-морфолін-2-ілфеніл)-(5-трифторметилпіримідин-2-іл)амін (R)-5-хлор-N-(4-(морфолін-2-іл)феніл)піразин-2-амін 6 UA 113167 C2 5 10 15 20 25 30 35 40 45 (R)-6-хлор-N-(4-(морфолін-2-іл)феніл)піразин-2-амін (R)-N-(3-фтор-4-(морфолін-2-іл)феніл)-5-(2,2,2-трифторетокси)піримідин-2-амін (R)-N-(3-фтор-4-(морфолін-2-іл)феніл)-4-(2,2,2-трифторетокси)піримідин-2-амін (R)-5-фтор-N-(3-фтор-4-(морфолін-2-іл)феніл)-4-(2,2,2-трифторетокси)піримідин-2-амін (R)-5-хлор-N-(3-фтор-4-(морфолін-2-іл)феніл)піримідин-2-амін або ((R)-3-хлор-4-морфолін-2-ілфеніл)-[4-(2,2,2-трифторетокси)піримідин-2-іл]амін. Втіленням даної групи є сполуки формули I, де Y позначає -CH2-, -CH2CH2-, -CH(CF3)- або CH(CH3)- і Ar позначає феніл або нафтил, наприклад, такі сполуки: [(RS)-1-(4-хлорфеніл)-2,2,2-трифторетил]-[(RS)-4-(2-піролідин-3-ілетил)феніл]амін (RS)-[1-(4-хлорфеніл)-2,2,2-трифторетил]-[(RS)-4-(2-пиперидин-3-ілетил)феніл]амін (RS)-(4-хлорбензил)-(4-морфолін-2-ілфеніл)амін ((S)-4-морфолін-2-ілфеніл)фенетиламін (4-метоксибензил)-((S)-4-морфолін-2-ілфеніл)амін (4-метилбензил)-((S)-4-морфолін-2-ілфеніл)амін 4-[((S)-4-морфолін-2-ілфеніламіно)метил]бензонітрил ((S)-4-морфолін-2-ілфеніл)-(4-трифторметилбензил)амін ((S)-4-морфолін-2-ілфеніл)-(4-трифторметоксибензил)амін (3,4-дихлорбензил)-((S)-4-морфолін-2-ілфеніл)амін (4-фторбензил)-((S)-4-морфолін-2-ілфеніл)амін [2-(4-хлорфеніл)етил]-((S)-4-морфолін-2-ілфеніл)амін (4-хлор-2-фторбензил)-((S)-4-морфолін-2-ілфеніл)амін (4-етилбензил)-((S)-4-морфолін-2-ілфеніл)амін (4-бромбензил)-((S)-4-морфолін-2-ілфеніл)амін або [(RS)-1-(4-хлорфеніл)етил]-((S)-4-морфолін-2-ілфеніл)амін. Додатковим втіленням даної групи є, крім того, сполуки формули I, де Y позначає -CH2-, CH2CH2-, -CH(CF3)- або -CH(CH3)- і Ar позначає фурил, піридиніл, піримідиніл, піразоліл, бензотіазоліл, хінолініл, хіназолініл, бензо[d][1.3]діоксоліл, 5,6,7,8-тетрагідрохіназолініл або 1,3,4-оксадіазоліл, наприклад, такі сполуки: [(RS)-1-(5-бромпіридин-2-іл)-2,2,2-трифторетил]-((RS)-4-піролідин-3-ілфеніл)амін (5-бромпіридин-2-ілметил)-((S)-4-морфолін-2-ілфеніл)амін (6-метоксипіридин-2-ілметил)-((S)-4-морфолін-2-ілфеніл)амін (S)-N-((6-хлорпіридин-3-іл)метил)-4-(морфолін-2-іл)анілін (S)-4-(морфолін-2-іл)-N-((6-(трифторметил)піридин-3-іл)метил)анілін (5-фторпіридин-2-ілметил)-((S)-4-морфолін-2-ілфеніл)амін або (S)-N-((2-хлорхінолін-3-іл)метил)-4-(морфолін-2-іл)анілін. Одним додатковим втіленням винаходу є сполуки формули I, де A позначає N, B позначає CH, Y позначає зв'язок і Ar позначає піридиніл, піримідиніл, наприклад, такі сполуки: (RS)-5-хлор-N-(5-(морфолін-2-іл)піридин-2-іл)піридин-2-амін (RS)-5-бром-N-(5-(морфолін-2-іл)піридин-2-іл)піридин-2-амін (RS)-5-циклопропіл-N-(5-(морфолін-2-іл)піридин-2-іл)піримідин-2-амін (R)-5-бром-N-(5-(морфолін-2-іл)піридин-2-іл)піридин-2-амін або (S)-5-бром-N-(5-(морфолін-2-іл)піридин-2-іл)піридин-2-амін. Одним додатковим втіленням винаходу є сполуки формули I, де A позначає CR, B позначає N, Y позначає зв'язок і Ar позначає піридиніл, наприклад, така сполука: (RS)-N-(5-бромпіридин-2-іл)-3-метил-5-(морфолін-2-іл)піридин-2-амін. Такі сполуки формули I та їх фармацевтично прийнятні солі можуть бути одержані відомими в даній області техніки способами, наприклад, шляхом проведення описаних нижче процесів, згідно з якими: a) відщеплюють N-захисну групу від сполук формули 50 2 R 1 (R )m Ar Y A N B R' X ( )n до сполуки формули 7 N PG UA 113167 C2 2 R 1 (R )m Ar Y A N B 5 10 15 20 R' X ( )n NH I PG позначає N-захисну групу, вибрану з –C(O)O-трет-бутилу, і якщо бажано, перетворюють одержані сполуки на фармацевтично прийнятні кислотноадитивні солі. Одержання сполук формули I за даним винаходом може бути здійснене за допомогою послідовних або збіжних синтетичних підходів. Синтези сполук за винаходом показані на схемах 1–11 та в описі 211 конкретних прикладів. Знання, необхідні для проведення реакцій та очистки одержаних в результаті продуктів, відомі кваліфікованим фахівцям в даній області техніки. Замісники та індекси, використовувані в наведеному далі описі способів, мають вказані вище значення, якщо не зазначене інше. Більш детально сполуки формули I можна одержати способами, наведеними нижче, способами, наведеними в прикладах, або аналогічними способами. Відповідні реакційні умови для окремих стадій реакцій відомі кваліфікованому фахівцю в даній області техніки. Послідовність реакцій не обмежується зображеною на схемах 1–11, однак, в залежності від вихідних речовин та їх відповідної реакційної здатності послідовність стадій реакцій може бути вільно змінена. Вихідні речовини чи то є у продажу, чи то можуть бути одержані способами, аналогічними способам, приведеним нижче, чи то способами, описаними в посиланнях, наведених в описі або в прикладах, чи то способами, відомими в даній області техніки. ЗАГАЛЬНА МЕТОДИКА Схема 1 8 UA 113167 C2 5 10 15 20 25 30 Замісники є такими, як описано вище, і Y позначає –CH(CF3)-. Стадія A: Додавання трифторметильної групи до ароматичного альдегіду 2 може бути здійснене шляхом обробки (трифторметил)триметилсиланом у присутності джерела фторидіонів, такого як тетрабутиламонію фторид. Кращими умовами є застосування ТГФ як розчинника при 0 °C протягом 30 хвилин і потім при кімнатній температурі протягом 2 годин. Стадія B: Перетворення спирту 3 на відповідний трифлат 4 може бути здійснене шляхом депротонування з основою, такою як NaH, KOtBu, н-BuLi, LiHMDS, NaHMDS, KHMDS або LDA, в непротонних органічних розчинниках, таких як ТГФ, діоксан, 1,2-диметоксіетан, ДМФА, бензол, толуол, або їх суміші, при температурах від -78 °C до 80 °C протягом від 15 хвилин до 2 годин з подальшою обробкою трифторметансульфонілхлоридом. Кращими умовами є депротонування при кімнатній температурі протягом 30 хвилин з використанням гідриду натрію як основи та діетилового ефіру як розчинника з подальшою обробкою трифторметансульфонілхлоридом при кімнатній температурі протягом 15 хвилин. Стадія C: Утворення зв'язку C-N може бути здійснене шляхом обробки трифлату 4 ариламіном 5 у присутності основи, такої як NaH, KOtBu, н-BuLi, LiHMDS, NaHMDS, KHMDS або LDA, в непротонних органічних розчинниках, таких як ТГФ, діоксан, 1,2-диметоксіетан, ДМФА, бензол, толуол, або їх суміші, при температурах від -78 °C до 80 °C протягом 15 хвилин – 24 годин. Приклади придатних амінів 5 включають N-захищені похідні піролідину, такі як 5-a [CAS 908334-28-1] або 5-d [Приклад 3(b)], похідні піперидину, такі як 5-b [CAS 875798-79-1] або 5-e [Приклад 4], або похідні морфоліну, такі як 5-c [CAS 1002726-96-6]. Кращими умовами є депротонування аміну 5 при кімнатній температурі протягом 15 хвилин з використанням гідриду натрію як основи та ТГФ як розчинника з подальшою обробкою трифлатом 4 при кімнатній температурі протягом ночі. Стадія D: Видалення N-захисної групи BOC може бути здійснене з неорганічними кислотами, такими як HCl, H2SO4 або H3PO4, або органічними кислотами, такими як CF3COOH, CHCl2COOH, HOAc або п-толуолсульфонова кислота, в розчинниках, таких як CH 2Cl2, CHCl3, ТГФ, MeOH, EtOH або H2O, при температурі від 0 до 80 °C. Кращими умовами є CF3COOH у водному ацетонітрилі при 80 °C протягом 2 годин або 4н HCl в діоксані та ТГФ при 60 °C протягом 4 годин. Схема 2 35 9 UA 113167 C2 5 10 15 20 25 Замісники є такими, як описано вище, і Y позначає зв'язок. Стадія A: Утворення зв'язку C-N може бути здійснене шляхом обробки арилгаліду 7 або гетероарилгаліду 7 ариламіном 5 у присутності паладієвого або мідного каталізатора, ліганду та основи в розчинниках, таких як діоксан, ДМЕ, ТГФ, толуол, ДМФА та ДМСО, при підвищених температурах, наприклад, використовуючи каталізовану паладієм реакцію Бухвальда-Хартвіга. Приклади придатних амінів 5 включають N-захищені похідні піролідину, такі як 5-a [CAS 908334-28-1], похідні піперидину, такі як 5-b [CAS 875798-79-1], або похідні морфоліну, такі як 5c [CAS 1002726-96-6]. Кращими умовами є каталітичний комплекс трис(дибензиліденацетон)дипаладійхлороформ, каталітичний 9,9-диметил-4,5-біс(дифенілфосфіно)ксантен (ксантфос) та карбонат цезію в діоксані в закритій пробірці, нагрітій при 100 °C протягом ночі, згідно з модификацією процедури van Leeuwen зі співробітниками (Tetrahedron Lett. 1999, 40, 3789-3790). У випадку, якщо арилгалід 7 або гетероарилгалід 7 активують, піддаючи нуклеофільному заміщенню у присутності електроноакцепторних замісників, краще, у присутності трифторметильної групи, сполучення з ариламіном 5 може бути здійснене шляхом проведення реакції цих сполук у присутності основи, такої як діізопропілетиламін, триетиламін, карбонат калію або гідрид натрію, в розчиннику, такому як ізопропанол, діоксан, диметилацетамід або диметилформамід, при температурі від 50 °C до 140 °C протягом часу від 1 години до 24 годин. Кращими умовами є нагрівання суміші 5 та 7 з діізопропілетиламіном в ізопропанолі або диметилацетаміді при 80 °C протягом 18 годин. Стадія B: Видалення N-захисної групи BOC може бути здійснене з неорганічними кислотами, такими як HCl, H2SO4 чи H3PO4, або органічними кислотами, такими як CF3COOH, CHCl2COOH, HOAc чи п-толуолсульфонова кислота, в розчинниках, таких як CH 2Cl2, CHCl3, ТГФ, MeOH, EtOH або H2O, при температурі від 0 до 80 °C. Кращими умовами є CF3COOH у водному ацетонітрилі при 80 °C протягом 2 годин або 4н. HCl в діоксані та ТГФ при 60 °C протягом 16 годин. Схема 3 30 Замісники є такими, як описано вище, і Y позначає -СН2- або -СН2СН2-. Стадія A: Утворення зв'язку C-N може бути здійснене шляхом проведення реакції відновного 10 UA 113167 C2 5 10 15 амінування, включаючи обробку альдегіду 9 ариламіном 5 у присутності відновника, такого як NaBH4, LiBH4, NaBH(OAc)3 або Na(CN)BH3, в розчиннику, такому як MeOH, EtOH, дихлорметан, 1,2-дихлоретан, ТГФ, діоксан, або їх суміші, у присутності активованої протонвмісної кислоти, такої як HCl або карбонова кислота, або активованої кислоти Льюїса, такої як ZnCl 2 або Ti(OiPr)4, при температурі від -10 до 60 °C протягом 1-40 годин. Приклади придатних амінів 5 включають N-захищені похідні піролідину, такі як 5-a [CAS 908334-28-1], похідні піперидину, такі як 5-b [CAS 875798-79-1], або похідні морфоліну, такі як 5c [CAS 1002726-96-6]. Кращими умовами є триацетоксиборгідрид натрію в оцтовій кислоті та ТГФ при 60 °C протягом 3 годин. Стадія B: Видалення N-захисної групи BOC може бути здійснене з неорганічними кислотами, такими як HCl, H2SO4 або H3PO4, або органічними кислотами, такими як CF3COOH, CHCl2COOH, HOAc або п-толуолсульфонова кислота, в розчинниках, таких як CH 2Cl2, CHCl3, ТГФ, MeOH, EtOH або H2O, при температурі від 0 до 80 °C. Кращими умовами є CF3COOH у водному ацетонітрилі при 80 °C протягом 2 годин або 4н. HCl в діоксані та ТГФ при 60 °C протягом 16 годин. Для Y = зв'язок, -СН2-, -СН2СН2- або -СН(СН3)Схема 4 20 25 30 Замісники є такими, як описано вище, і Y позначає зв'язок, -СН2-, -СН2СН2- або -CH(CH3)-. Стадія A: Утворення зв'язку C-N може бути здійснене шляхом обробки аміну 11 арилгалідом 12 у присутності паладієвого або мідного каталізатора, ліганду та основи в розчинниках, таких як діоксан, ДМЕ, ТГФ, толуол, ДМФА та ДМСО, при підвищених температурах, наприклад, використовуючи каталізовану паладієм реакцію Бухвальда-Хартвіга. Приклади придатних арилгалідів 12 включають N-захищені похідні піролідину, такі як 12-a [CAS 328546-99-2], похідні піперидину, такі як 12-b [CAS 769944-73-2], або похідні морфоліну, такі як 12-c [CAS 1131220-82-0]. Кращими умовами є каталітичний трис(дибензиліденацетон)дипаладій(0), каталітичний 2ди-трет-бутилфосфіно-2',4',6'-триізопропілбіфеніл та трет-бутилат натрію в діоксані в закритій 11 UA 113167 C2 5 пробірці, нагрітій при 120 °C протягом ночі. Стадія B: Видалення N-захисної групи BOC може бути здійснене з неорганічними кислотами, такими як HCl, H2SO4 чи H3PO4, або органічними кислотами, такими як CF3COOH, CHCl2COOH, HOAc чи п-толуолсульфонова кислота, в розчинниках, таких як CH 2Cl2, CHCl3, ТГФ, MeOH, EtOH або H2O, при температурі від 0 до 80 °C. Кращими умовами є CF3COOH у водному ацетонітрилі при 80 °C протягом 2 годин або 4н. HCl в діоксані та ТГФ при 60 °C протягом 16 годин. Схема 5 10 15 Замісники є такими, як описано вище, і X позначає O, Y позначає зв'язок, A позначає Cнижчий алкіл, B позначає CH, R' позначає водень та n дорівнює 0. Стадія A: Альфа-галоїдкетони 15 можуть бути одержані шляхом проведення реакції гомологізації ацилгаліду 14 [наприклад, hal" = хлор і алкіл = метил, CAS 35675-46-8], включаючи послідовну обробку спочатку (триметилсиліл)діазометаном і потім обробку концентрованою бромистоводневою кислотою або хлористоводневою кислотою. Реакцію проводять, використовуючи суміш ацетонітрилу, ТГФ та гексану як розчинник при температурах між 0 °C та кімнатною температурою. 12 UA 113167 C2 5 10 15 20 25 30 35 40 45 50 55 Кращими умовами є змішування реагентів при 0-5 °C з подальшою взаємодією протягом 1 години при кімнатній температурі для першої стадії, та змішування реагентів при 0-5 °C з подальшою взаємодією протягом 30 хвилин при кімнатній температурі для другої стадії. Стадія B: Утворення епоксиду можна провести за допомогою постадійного способу, який включає відновлення альфа-галоїдкетонів 15 шляхом обробки відновником, таким як NaBH4 або LiBH4, в розчиннику, такому як MeOH, EtOH, ТГФ, діоксан, з подальшою циклізацією майбутнього альфа-галоїдспирту шляхом обробки основою, такою як метилат натрію, етилат натрію, трет-бутилат калію або карбонат цезію, в тому самому розчиннику. Кращими умовами є NaBH4 в етанолі при температурі від 5 °C до кімнатної температури протягом 1 години з подальшою обробкою метилатом натрію при кімнатній температурі протягом 16 годин. Стадія C: Нуклеофільне розкриття кільця може бути здійснене обробкою епоксиду 16 2аміноетанолом, можливо, у присутності органічної основи, такої як триетиламін, N, Nдіізопропілетиламін або N-метилморфолін, в непротонному полярному органічному розчиннику, такому як ефір, ТГФ, діоксан або ТБМЕ. Кращими умовами є використання надлишку 2-аміноетанолу як основи в ТГФ при кімнатній температурі протягом 16 годин. Стадія D: Вибірковий захист аміногрупи аміноспирту 17 може бути виконаний шляхом обробки ди-трет-бутилкарбонатом, можливо, у присутності органічної основи, такої як триетиламін, N, N-діізопропілетиламін або N-метилморфолін, в галогензаміщених розчинниках, таких як дихлорметан або 1,2-дихлоретан, або ефірних розчинниках, таких як діетиловий ефір, діоксан, ТГФ або ТБМЕ. Кращими умовами є ТГФ без використання основи при кімнатній температурі протягом 16 годин. Стадія E: Циклізацію можна провести шляхом постадійного процесу, який включає утворення сульфонату шляхом обробки діолу 18 одним еквівалентом метансульфонілхлориду в присутності органічної основи, такої як триетиламін, N, N-діізопропілетиламін або Nметилморфолін, в ефірних розчинниках, таких як діетиловий ефір, діоксан, ТГФ або ТБМЕ, з подальшою циклізацією шляхом обробки ненуклеофільною основою, такою як трет-бутилат калію або 2-метил-2-бутилат калію, в ефірних розчинниках, таких як діетиловий ефір, діоксан, ТГФ або ТБМЕ. Кращими умовами для першої стадії є триетиламін в ТГФ, змішаному з реагентами при 05 °C, і потім взаємодія протягом 1 години при кімнатній температурі, потім видалення побічного продукту гідрохлориду триетиламіну шляхом фільтрації. Кращими умовами для другої стадії є 2-метил-2-бутилат калію в ТГФ, змішаному з реагентами при 0-5 °C, і потім взаємодія протягом 30 хвилин при кімнатній температурі. Стадія F: Відновлення нітрогрупи 19 можна провести шляхом гідрування воднем при нормальному або підвищеному тиску або шляхом трансферного гідрування, використовуючи форміат амонію або циклогексадієн як джерело водню, з каталізатором, таким як PtO 2, Pd-C або нікель Ренея, в розчинниках, таких як MeOH, EtOH, H2O, діоксан, ТГФ, HOAc, EtOAc CH2Cl2, CHCl3, ДМФА, або їх суміші. Кращими умовами є форміат амонію у присутності паладію на вугіллі в MeOH при 60 °C протягом 1 години. Стадія G: Утворення зв'язку C-N може бути здійснене шляхом обробки арилгаліду 7 ариламіном 20 у присутності паладієвого або мідного каталізатора, ліганду та основи в розчинниках, таких як діоксан, ДМЕ, ТГФ, толуол, ДМФА та ДМСО, при підвищених температурах, наприклад, використовуючи каталізовану паладієм реакцію Бухвальда-Хартвіга. Кращими умовами є каталітичний комплекс трис(дибензиліденацетон)дипаладійхлороформ, каталітичний 9,9-диметил-4,5-біс(дифенілфосфіно)ксантен (ксантфос) та карбонат цезію в діоксані в закритій пробірці, нагрітій при 80 °C протягом 1 години, згідно з модификацією процедури van Leeuwen зі співробітниками (Tetrahedron Lett. 1999, 40, 3789-3790). Стадія H: Видалення N-захисної групи BOC може бути здійснене з неорганічними кислотами, такими як HCl, H2SO4 або H3PO4, або органічними кислотами, такими як CF3COOH, CHCl2COOH, HOAc або п-толуолсульфонова кислота, в розчинниках, таких як CH 2Cl2, CHCl3, ТГФ, MeOH, EtOH або H2O, при температурі від 0 до 80 °C. Кращими умовами є CF3COOH у водному ацетонітрилі при 80 °C протягом 2 годин або 4н. HCl в діоксані та ТГФ при 60 °C протягом 16 годин. 13 UA 113167 C2 Схема 6 5 10 15 Замісники є такими, як описано вище, і X позначає O, Y позначає зв'язок, A позначає N, B позначає CH, R' позначає водень та n дорівнює 0. Стадія A: Альфа-галоїдкетони 23 можуть бути одержані шляхом проведення реакції гомологізації ацилхлориду 22 [CAS 58757-38-3], включаючи послідовну обробку спочатку (триметилсиліл)діазометаном і потім обробку концентрованою бромистоводневою кислотою або хлористоводневою кислотою. Реакцію проводять, використовуючи суміш ацетонітрилу, ТГФ та гексану як розчинник при температурах між 0 °C та кімнатною температурою. Кращими умовами є змішування реагентів при 0-5 °C з подальшою взаємодією протягом 1 години при кімнатній температурі для першої стадії, та змішування реагентів при 0-5 °C з подальшою взаємодією протягом 30 хвилин при кімнатній температурі для другої стадії. Стадія B: Утворення епоксиду можна провести за допомогою постадійного способу, який включає відновлення альфа-галоїдкетонів 23 шляхом обробки відновником, таким як NaBH4 або LiBH4, в розчиннику, такому як MeOH, EtOH, ТГФ, діоксан, з подальшою циклізацією майбутнього альфа-галоїдспирту шляхом обробки основою, такою як метилат натрію, етилат 14 UA 113167 C2 5 10 15 20 25 30 35 40 45 50 55 60 натрію, трет-бутилат калію або карбонат цезію, в тому самому розчиннику. Кращими умовами є NaBH4 в етанолі при температурі від 5 °C до кімнатної температури протягом 1 години з подальшою обробкою метилатом натрію при кімнатній температурі протягом 16 годин. Стадія C: Нуклеофільне розкриття кільця може бути здійснене обробкою епоксиду 24 2аміноетанолом, можливо, у присутності органічної основи, такої як триетиламін, N, Nдіізопропілетиламін або N-метилморфолін, в непротонному полярному органічному розчиннику, такому як ефір, ТГФ, діоксан або ТБМЕ. Кращими умовами є використання надлишку 2-аміноетанолу як основи в ТГФ при кімнатній температурі протягом 16 годин. Стадія D: Вибірковий захист аміногрупи аміноспирту 25 може бути здійснений шляхом обробки ди-трет-бутилкарбонатом, можливо, у присутності органічної основи, такої як триетиламін, N, N-діізопропілетиламін або N-метилморфолін, в галогензаміщених розчинниках, таких як дихлорметан або 1,2-дихлоретан, або ефірних розчинниках, таких як діетиловий ефір, діоксан, ТГФ або ТБМЕ. Кращими умовами є ТГФ без використання основи при кімнатній температурі протягом 16 годин. Стадія E: Циклізацію можна провести за допомогою постадійного процесу, який включає утворення сульфонату шляхом обробки діолу 26 одним еквівалентом метансульфонілхлориду в присутності органічної основи, такої як триетиламін, N, N-діізопропілетиламін або Nметилморфолін, в ефірних розчинниках, таких як діетиловий ефір, діоксан, ТГФ або ТБМЕ, з подальшою циклізацією шляхом обробки ненуклеофільною основою, такою як трет-бутилат калію або 2-метил-2-бутилат калію, в ефірних розчинниках, таких як діетиловий ефір, діоксан, ТГФ або ТБМЕ. Кращими умовами для першої стадії є триетиламін в ТГФ, змішаному з реагентами при 05 °C, і потім взаємодія протягом 2,5 годин при кімнатній температурі, потім видалення побічного продукту гідрохлориду триетиламіну шляхом фільтрації. Кращими умовами для другої стадії є 2-метил-2-бутилат калію в ТГФ, змішаному з реагентами при 0-5 °C, і потім взаємодія протягом 15 хвилин при кімнатній температурі. Стадія F: Утворення зв'язку C-N може бути здійснене шляхом обробки 27 бензофеноніміном у присутності паладієвого або мідного каталізатора, ліганду та основи в розчинниках, таких як діоксан, ДМЕ, ТГФ, толуол, ДМФА та ДМСО, при підвищених температурах, наприклад, використовуючи каталізовану паладієм реакцію Бухвальда-Хартвіга. Кращими умовами є каталітичний трис(дибензиліденацетон)дипаладій(0), каталітичний (R)(+)-2,2'-біс(дифенілфосфіно)-1,1'-бінафтил та трет-бутилат натрію в діоксані при 100 °C протягом 16 годин. Стадія G: Видалення азот-захисної групи 28 можна провести шляхом гідрування воднем при нормальному або підвищеному тиску або шляхом трансферного гідрування, використовуючи форміат амонію або циклогексадієн як джерело водню, з каталізатором, таким як PtO 2, Pd-C або нікель Ренея, в розчинниках, таких як MeOH, EtOH, H2O, діоксан, ТГФ, HOAc, EtOAc, CH2Cl2, CHCl3, ДМФА, або їх суміші. Кращими умовами є форміат амонію у присутності паладію на вугіллі в MeOH при 60 °C протягом 1 години. Стадія H: Утворення зв'язку C-N може бути здійснене шляхом обробки арилгаліду 7 ариламіном 29 у присутності паладієвого або мідного каталізатора, ліганду та основи в розчинниках, таких як діоксан, ДМЕ, ТГФ, толуол, ДМФА та ДМСО, при підвищених температурах, наприклад, використовуючи каталізовану паладієм реакцію Бухвальда-Хартвіга. Кращими умовами є каталітичний комплекс трис(дибензиліденацетон)дипаладійхлороформ, каталітичний 9,9-диметил-4,5-біс(дифенілфосфіно)ксантен (ксантфос) та карбонат цезію в діоксані у закритій пробірці, нагрітій при 100 °C протягом 16 годин, згідно з модификацією процедури van Leeuwen зі співробітниками (Tetrahedron Lett. 1999, 40, 37893790). Стадія I: Видалення N-захисної групи BOC може бути здійснене з неорганічними кислотами, такими як HCl, H2SO4 або H3PO4, або органічними кислотами, такими як CF3COOH, CHCl2COOH, HOAc або п-толуолсульфонова кислота, в розчинниках, таких як CH 2Cl2, CHCl3, ТГФ, MeOH, EtOH або H2O, при температурі від 0 до 80 °C. Кращими умовами є CF3COOH у водному ацетонітрилі при 80 °C протягом 2 годин або 4н. HCl в діоксані та ТГФ при 60 °C протягом 16 годин. Схема 7 15 UA 113167 C2 5 10 15 Замісники є такими, як описано вище, і X позначає O, Y позначає зв'язок, A позначає Салкіл, B позначає N, R' позначає водень і n позначає 0. Стадія A: Утворення епоксиду може бути здійснене шляхом проведення реакції КоріЧайковського альдегідів 31 [наприклад, алкіл = метил, CAS 885167-81-7] шляхом обробки йодидом триметилсульфонію у присутності основи, такої як гідрид натрію, в непротонному полярному органічному розчиннику, такому як ДМСО або ДМФА. Кращими умовами є гідрид натрію в ДМСО при 0 °C протягом 30 хвилин і потім при кімнатній температурі протягом 16 годин. Стадія B: Нуклеофільне розкриття кільця може бути здійснене обробкою епоксиду 32 2аміноетанолом, можливо, у присутності органічної основи, такої як триетиламін, N, Nдіізопропілетиламін або N-метилморфолін, в непротонному полярному органічному розчиннику, такому як ефір, ТГФ, діоксан або ТБМЕ. Кращими умовами є використання надлишку 2-аміноетанолу як основи в ТГФ при кімнатній температурі протягом 16 годин. Стадія C: Вибірковий захист аміногрупи аміноспирту 33 може бути здійснений шляхом обробки ди-трет-бутилкарбонатом, можливо, у присутності органічної основи, такої як 16 UA 113167 C2 5 10 15 20 25 30 35 40 45 триетиламін, N, N-діізопропілетиламін або N-метилморфолін, в галогензаміщених розчинниках, таких як дихлорметан або 1,2-дихлоретан, або ефірних розчинниках, таких як діетиловий ефір, діоксан, ТГФ або ТБМЕ. Кращими умовами є ТГФ без використання основи при кімнатній температурі протягом 7 годин. Стадія D: Циклізацію можна провести за допомогою постадійного процесу, який включає утворення сульфонату шляхом обробки діолу 34 одним еквівалентом метансульфонілхлориду в присутності органічної основи, такої як триетиламін, N, N-діізопропілетиламін або Nметилморфолін, в ефірних розчинниках, таких як діетиловий ефір, діоксан, ТГФ або ТБМЕ, з подальшою циклізацією шляхом обробки ненуклеофільною основою, такою як трет-бутилат калію або 2-метил-2-бутилат калію, в ефірних розчинниках, таких як діетиловий ефір, діоксан, ТГФ або ТБМЕ. Кращими умовами для першої стадії є триетиламін в ТГФ, змішаному з реагентами при 05 °C, і потім взаємодія протягом 15 хвилин при кімнатній температурі, потім видалення побічного продукту гідрохлориду триетиламіну шляхом фільтрації. Кращими умовами для другої стадії є 2-метил-2-бутилат калію в ТГФ, змішаному з реагентами при 0-5 °C, і потім взаємодія протягом 10 хвилин при кімнатній температурі. Стадія E: Утворення зв'язку C-N може бути здійснене шляхом обробки 35 бензофеноніміном у присутності паладієвого або мідного каталізатора, ліганду та основи в розчинниках, таких як діоксан, ДМЕ, ТГФ, толуол, ДМФА та ДМСО, при підвищених температурах, наприклад, використовуючи каталізовану паладієм реакцію Бухвальда-Хартвіга. Кращими умовами є каталітичний трис(дибензиліденацетон)дипаладій(0), каталітичний (R)(+)-2,2'-біс(дифенілфосфіно)-1,1'-бінафтил та трет-бутилат натрію в діоксані при 100 °C протягом 16 годин. Стадія F: Видалення азот-захисної групи 36 можна провести шляхом гідрування воднем при нормальному або підвищеному тиску або шляхом трансферного гідрування, використовуючи форміат амонію або циклогексадієн як джерело водню, з каталізатором, таким як PtO 2, Pd-C або нікель Ренея, в розчинниках, таких як MeOH, EtOH, H2O, діоксан, ТГФ, HOAc, EtOAc, CH2Cl2, CHCl3, ДМФА, або їх суміші. Кращими умовами є форміат амонію у присутності паладію на вугіллі в MeOH при 80 °C протягом 2 годин. Стадія G: Утворення зв'язку C-N може бути здійснене шляхом обробки арилгаліду 7 ариламіном 37 у присутності паладієвого або мідного каталізатора, ліганду та основи в розчинниках, таких як діоксан, ДМЕ, ТГФ, толуол, ДМФА та ДМСО, при підвищених температурах, наприклад, використовуючи каталізовану паладієм реакцію Бухвальда-Хартвіга. Кращими умовами є каталітичний комплекс трис(дибензиліденацетон)дипаладійхлороформ, каталітичний 9,9-диметил-4,5-біс(дифенілфосфіно)ксантен (ксантфос) та карбонат цезію в діоксані у закритій пробірці, нагрітій при 100 °C протягом 16 годин, згідно з модификацією процедури van Leeuwen зі співробітниками (Tetrahedron Lett. 1999, 40, 37893790). Стадія H: Видалення N-захисної групи BOC може бути здійснене з неорганічними кислотами, такими як HCl, H2SO4 або H3PO4, або органічними кислотами, такими як CF3COOH, CHCl2COOH, HOAc або п-толуолсульфонова кислота, в розчинниках, таких як CH 2Cl2, CHCl3, ТГФ, MeOH, EtOH або H2O, при температурі від 0 до 80 °C. Кращими умовами є CF3COOH у водному ацетонітрилі при 80 °C протягом 3 годин або 4н. HCl в діоксані та ТГФ при 60 °C протягом 16 годин. 17 UA 113167 C2 Схема 8 5 10 15 Замісники є такими, як описано вище, і X позначає O, Y позначає зв'язок, A позначає С-F, B позначає СН, R' позначає водень та n позначає 0. Стадія A: Альфа-галоїдкетони 40 можуть бути одержані шляхом проведення реакції гомологізації ацилхлориду 39 [CAS 695188-21-7], включаючи послідовну обробку спочатку (триметилсиліл)діазометаном і потім обробку концентрованою бромистоводневою кислотою або хлористоводневою кислотою. Реакцію проводять, використовуючи суміш ацетонітрилу, ТГФ та гексану як розчинник при температурах між 0 °C та кімнатною температурою. Кращими умовами є змішування реагентів при 0-5 °C з подальшою взаємодією протягом 30 хвилин при кімнатній температурі для першої стадії, та змішування реагентів при 0-5 °C з подальшою взаємодією протягом 1 години при кімнатній температурі для другої стадії. Стадія B: Утворення епоксиду можна провести за допомогою постадійного способу, який включає відновлення альфа-галоїдкетонів 40 шляхом обробки відновником, таким як NaBH4 або LiBH4, в розчиннику, такому як MeOH, EtOH, ТГФ, діоксан, з подальшою циклізацією майбутнього альфа-галоїдспирту шляхом обробки основою, такою як метилат натрію, етилат натрію, трет-бутилат калію або карбонат цезію, в тому самому розчиннику. 18 UA 113167 C2 5 10 15 20 25 30 35 40 45 50 55 60 Кращими умовами є NaBH4 в етанолі при температурі від 5 °C до кімнатної температури протягом 1 години з подальшою обробкою метилатом натрію при кімнатній температурі протягом 16 годин і потім при 40 °C протягом 1 години. Стадія C: Нуклеофільне розкриття кільця може бути здійснене обробкою епоксиду 41 2аміноетанолом, можливо, у присутності органічної основи, такої як триетиламін, N, Nдіізопропілетиламін або N-метилморфолін, в непротонному полярному органічному розчиннику, такому як ефір, ТГФ, діоксан або ТБМЕ. Кращими умовами є використання надлишку 2-аміноетанолу як основи в ТГФ при кімнатній температурі протягом 16 годин. Стадія D: Вибірковий захист аміногрупи аміноспирту 42 може бути проведений шляхом обробки ди-трет-бутилкарбонатом, можливо, у присутності органічної основи, такої як триетиламін, N, N-діізопропілетиламін або N-метилморфолін, в галогензаміщених розчинниках, таких як дихлорметан або 1,2-дихлоретан, або ефірних розчинниках, таких як діетиловий ефір, діоксан, ТГФ або ТБМЕ. Кращими умовами є дихлорметан без використання основи при кімнатній температурі протягом 16 годин. Стадія E: Циклізацію можна провести за допомогою постадійного процесу, який включає утворення сульфонату шляхом обробки діолу 43 одним еквівалентом метансульфонілхлориду в присутності органічної основи, такої як триетиламін, N, N-діізопропілетиламін або Nметилморфолін, в ефірних розчинниках, таких як діетиловий ефір, діоксан, ТГФ або ТБМЕ, з подальшою циклізацією шляхом обробки ненуклеофільною основою, такою як трет-бутилат калію або 2-метил-2-бутилат калію, в ефірних розчинниках, таких як діетиловий ефір, діоксан, ТГФ або ТБМЕ. Кращими умовами для першої стадії є триетиламін в ТГФ, змішаному з реагентами при 05 °C, і потім взаємодія протягом 30 хвилин при кімнатній температурі, потім видалення побічного продукту гідрохлориду триетиламіну шляхом фільтрації. Кращими умовами для другої стадії є 2-метил-2-бутилат калію в ТГФ, змішаному з реагентами при 0-5 °C, і потім взаємодія протягом 1 години при кімнатній температурі. Стадія F: Утворення зв'язку C-N може бути здійснене шляхом обробки 44 бензофеноніміном у присутності паладієвого або мідного каталізатора, ліганду та основи в розчинниках, таких як діоксан, ДМЕ, ТГФ, толуол, ДМФА та ДМСО, при підвищених температурах, наприклад, використовуючи каталізовану паладієм реакцію Бухвальда-Хартвіга. Кращими умовами є каталітичний трис(дибензиліденацетон)дипаладій(0), каталітичний (R)(+)-2,2'-біс(дифенілфосфіно)-1,1'-бінафтил та трет-бутилат натрію в діоксані при 100 °C протягом 1 години. Стадія G: Видалення азот-захисної групи 45 можна провести шляхом гідрування воднем при нормальному або підвищеному тиску або шляхом трансферного гідрування, використовуючи форміат амонію або циклогексадієн як джерело водню, з каталізатором, таким як PtO 2, Pd-C або нікель Ренея, в розчинниках, таких як MeOH, EtOH, H2O, діоксан, ТГФ, HOAc, EtOAc, CH2Cl2, CHCl3, ДМФА, або їх суміші. Кращими умовами є форміат амонію в присутності паладію на вугіллі в MeOH при 60 °C протягом 1 години. Стадія H: Утворення зв'язку C-N може бути здійснене шляхом обробки арилгаліду 7 ариламіном 46 у присутності паладієвого або мідного каталізатора, ліганду та основи в розчинниках, таких як діоксан, ДМЕ, ТГФ, толуол, ДМФА та ДМСО, при підвищених температурах, наприклад, використовуючи каталізовану паладієм реакцію Бухвальда-Хартвіга. Кращими умовами є каталітичний комплекс трис(дибензиліденацетон)дипаладійхлороформ, каталітичний 9,9-диметил-4,5-біс(дифенілфосфіно)ксантен (ксантфос) та карбонат цезію в діоксані в закритій пробірці, нагрітій при 120 °C протягом 2 годин, згідно з модификацією процедури van Leeuwen зі співробітниками (Tetrahedron Lett. 1999, 40, 3789-3790). Стадія H': Утворення C-N зв'язку, що дає біариламін 47, альтернативно може бути здійснене безпосередньо з арилброміду 44 шляхом обробки арилброміду 44 ариламіном 11" у присутності паладієвого або мідного каталізатора, ліганду та основи в розчинниках, таких як діоксан, ДМЕ, ТГФ, толуол, ДМФА та ДМСО, при підвищених температурах, наприклад, використовуючи каталізовану паладієм реакцію Бухвальда-Хартвіга. Кращими умовами є каталітичний трис(дибензиліденацетон)дипаладій(0), каталітичний 2ди-трет-бутилфосфіно-2',4',6'-триізопропілбіфеніл та трет-бутилат натрію в діоксані при 120 °C протягом 16 годин. Стадія I: Видалення N-захисної групи BOC може бути здійснене з неорганічними кислотами, такими як HCl, H2SO4 чи H3PO4, або органічними кислотами, такими як CF3COOH, CHCl2COOH, 19 UA 113167 C2 HOAc чи п-толуолсульфонова кислота, в розчинниках, такихяк CH 2Cl2, CHCl3, ТГФ, MeOH, EtOH або H2O, при температурі від 0 до 80 °C. Кращими умовами є CF3COOH у водному ацетонітрилі при 80 °C протягом 3 годин або 4н. HCl в діоксані та ТГФ при 60 °C протягом 16 годин. 5 Схема 9 10 15 Замісники є такими, як описано вище, і X позначає O, Y позначає зв'язок, A позначає С-Cl, B позначає СН, R' позначає водень та n позначає 0. Стадія A: Альфа-галоїдкетони 49 можуть бути одержані шляхом проведення реакції гомологізації ацилхлориду 48 [CAS 21900-32-3], включаючи послідовну обробку спочатку (триметилсиліл)діазометаном і потім обробку концентрованою бромистоводневою кислотою або хлористоводневою кислотою. Реакцію проводять, використовуючи суміш ацетонітрилу, ТГФ та гексану як розчинник при температурах між 0 °C та кімнатною температурою. Кращими умовами є змішування реагентів при 0-5 °C з подальшою взаємодією протягом 30 хвилин при кімнатній температурі для першої стадії, та змішування реагентів при 0-5 °C з 20 UA 113167 C2 5 10 15 20 25 30 35 40 45 50 55 60 подальшою взаємодією протягом 30 хвилин при кімнатній температурі для другої стадії. Стадія B: Утворення епоксиду можна провести за допомогою постадійного способу, який включає відновлення альфа-галоїдкетонів 49 шляхом обробки відновником, таким як NaBH4 або LiBH4, в розчиннику, такому як MeOH, EtOH, ТГФ, діоксан, з подальшою циклізацією майбутнього альфа-галоїдспирту шляхом обробки основою, такою як метилат натрію, етилат натрію, трет-бутилат калію або карбонат цезію, в тому самому розчиннику. Кращими умовами є NaBH4 в етанолі при температурі від 5 °C до кімнатної температури протягом 90 хвилин з подальшою обробкою метилатом натрію при 50 °C протягом 4 годин. Стадія C: Нуклеофільне розкриття кільця може бути здійснене обробкою епоксиду 50 2аміноетанолом, можливо, у присутності органічної основи, такої як триетиламін, N, Nдіізопропілетиламін або N-метилморфолін, в непротонному полярному органічному розчиннику, такому як ефір, ТГФ, діоксан або ТБМЕ. Кращими умовами є використання надлишку 2-аміноетанолу як основи в ТГФ при кімнатній температурі протягом 7 годин. Стадія D: Вибірковий захист аміногрупи аміноспирту 51 може бути проведений шляхом обробки ди-трет-бутилкарбонатом, можливо, у присутності органічної основи, такої як триетиламін, N, N-діізопропілетиламін або N-метилморфолін, в галогензаміщених розчинниках, таких як дихлорметан або 1,2-дихлоретан, або ефірних розчинниках, таких як діетиловий ефір, діоксан, ТГФ або ТБМЕ. Кращими умовами є дихлорметан без використання основи при кімнатній температурі протягом 16 годин. Стадія E: Циклізацію можна провести за допомогою постадійного процесу, який включає утворення сульфонату шляхом обробки діолу 52 одним еквівалентом метансульфонілхлориду в присутності органічної основи, такої як триетиламін, N, N-діізопропілетиламін або Nметилморфолін, в ефірних розчинниках, таких як діетиловий ефір, діоксан, ТГФ або ТБМЕ, з подальшою циклізацією шляхом обробки ненуклеофільною основою, такою як трет-бутилат калію або 2-метил-2-бутилат калію, в ефірних розчинниках, таких як діетиловий ефір, діоксан, ТГФ або ТБМЕ. Кращими умовами для першої стадії є триетиламін в ТГФ, змішаному з реагентами при 05 °C, і потім взаємодія протягом 1 години при кімнатній температурі, потім видалення побічного продукту гідрохлориду триетиламіну шляхом фільтрації. Кращими умовами для другої стадії є 2-метил-2-бутилат калію в ТГФ, змішаному з реагентами при 0-5 °C, і потім взаємодія протягом 30 хвилин при кімнатній температурі. Стадія F: Утворення зв'язку C-N може бути здійснене шляхом обробки 53 бензофеноніміном у присутності паладієвого або мідного каталізатора, ліганду та основи в розчинниках, таких як діоксан, ДМЕ, ТГФ, толуол, ДМФА та ДМСО, при підвищених температурах, наприклад, використовуючи каталізовану паладієм реакцію Бухвальда-Хартвіга. Кращими умовами є каталітичний трис(дибензиліденацетон)дипаладій(0), каталітичний (R)(+)-2,2'-біс(дифенілфосфіно)-1,1'-бінафтил та трет-бутилат натрію в діоксані при 90 °C протягом 16 годин. Стадія G: Видалення азот-захисної групи 54 можна провести шляхом обробки гідрохлоридом гідроксиламіну в присутності основи, такої як ацетат натрію або метилат натрію, в розчинниках, таких як MeOH, EtOH, H2O, діоксан, ТГФ, HOAc, EtOAc, CH 2Cl2, CHCl3, ДМФА, або їх суміші. Кращими умовами є гідрохлорид гідроксиламіну в присутності ацетату натрію в MeOH при 60 °C протягом 1 години. Стадія H: Утворення зв'язку C-N може бути здійснене шляхом обробки арилгаліду 7 ариламіном 55 у присутності паладієвого або мідного каталізатора, ліганду та основи в розчинниках, таких як діоксан, ДМЕ, ТГФ, толуол, ДМФА та ДМСО, при підвищених температурах, наприклад, використовуючи каталізовану паладієм реакцію Бухвальда-Хартвіга. Кращими умовами є каталітичний комплекс трис(дибензиліденацетон)дипаладійхлороформ, каталітичний 9,9-диметил-4,5-біс(дифенілфосфіно)ксантен (ксантфос) та карбонат цезію в діоксані в закритій пробірці, нагрітій при 120 °C протягом 16 годин, згідно з модификацією процедури van Leeuwen зі співробітниками (Tetrahedron Lett. 1999, 40, 37893790). Стадія H': Утворення C-N зв'язку, що дає біариламін 56, альтернативно може бути здійснене безпосередньо з арилброміду 53 шляхом обробки арилброміду 53 ариламіном 11" у присутності паладієвого або мідного каталізатора, ліганду та основи в розчинниках, таких як діоксан, ДМЕ, ТГФ, толуол, ДМФА та ДМСО, при підвищених температурах, наприклад, використовуючи каталізовану паладієм реакцію Бухвальда-Хартвіга. 21 UA 113167 C2 5 Кращими умовами є каталітичний трис(дибензиліденацетон)дипаладій(0), каталітичний 2ди-трет-бутилфосфіно-2',4',6'-триізопропілбіфеніл та трет-бутилат натрію в діоксані при 120 °C протягом 16 годин. Стадія I: Видалення N-захисної групи BOC може бути здійснене з неорганічними кислотами, такими як HCl, H2SO4 чи H3PO4, або органічними кислотами, такими як CF3COOH, CHCl2COOH, HOAc чи п-толуолсульфонова кислота, в розчинниках, таких як CH 2Cl2, CHCl3, ТГФ, MeOH, EtOH або H2O, при температурі від 0 до 80 °C. Кращими умовами є CF3COOH у водному ацетонітрилі при 80 °C протягом 3 годин або 4н. HCl в діоксані та ТГФ при 60 °C протягом 16 годин. 10 Схема 10 15 Замісники є такими, як описано вище, і X позначає O, Y позначає зв'язок, A позначає СН, R' позначає F, В позначає СН та n позначає 0. Стадія A: Альфа-галоїдкетони 58 можуть бути одержані шляхом проведення реакції гомологізації ацилхлориду 57 [CAS 151982-51-3], включаючи послідовну обробку спочатку 22 UA 113167 C2 5 10 15 20 25 30 35 40 45 50 55 60 (триметилсиліл)діазометаном і потім обробку концентрованою бромистоводневою кислотою або хлористоводневою кислотою. Реакцію проводять, використовуючи суміш ацетонітрилу, ТГФ та гексану як розчинник при температурах між 0 °C та кімнатною температурою. Кращими умовами є змішування реагентів при 0-5 °C з подальшою взаємодією протягом 30 хвилин при кімнатній температурі для першої стадії, та змішування реагентів при 0-5 °C з подальшою взаємодією протягом 1 години при кімнатній температурі для другої стадії. Стадія B: Утворення епоксиду можна провести за допомогою постадійного способу, який включає відновлення альфа-галоїдкетонів 58 шляхом обробки відновником, таким як NaBH4 або LiBH4, в розчиннику, такому як MeOH, EtOH, ТГФ, діоксан, з подальшою циклізацією майбутнього альфа-галоїдспирту шляхом обробки основою, такою як метилат натрію, етилат натрію, трет-бутилат калію або карбонат цезію, в тому самому розчиннику. Кращими умовами є NaBH4 в етанолі при температурах від 5 °C до кімнатної температури протягом 1 години з подальшою обробкою метилатом натрію при кімнатній температурі протягом 16 годин. Стадія C: Нуклеофільне розкриття кільця може бути здійснене шляхом обробки епоксиду 59 2-аміноетанолом, можливо, у присутності органічної основи, такої як триетиламін, N, Nдіізопропілетиламін або N-метилморфолін, в непротонному полярному органічному розчиннику, такому як ефір, ТГФ, діоксан або ТБМЕ. Кращими умовами є використання надлишку 2-аміноетанолу як основи в ТГФ при кімнатній температурі протягом 16 годин. Стадія D: Вибірковий захист аміногрупи аміноспирту 60 може бути проведений шляхом обробки ди-трет-бутилкарбонатом, можливо, у присутності органічної основи, такої як триетиламін, N, N-діізопропілетиламін або N-метилморфолін, в галогензаміщених розчинниках, таких як дихлорметан або 1,2-дихлоретан, або ефірних розчинниках, таких як діетиловий ефір, діоксан, ТГФ або ТБМЕ. Кращими умовами є дихлорметан без використання основи при кімнатній температурі протягом 16 годин. Стадія E: Циклізацію можна провести за допомогою постадійного процесу, який включає утворення сульфонату шляхом обробки діолу 61 одним еквівалентом метансульфонілхлориду в присутності органічної основи, такої як триетиламін, N, N-діізопропілетиламін або Nметилморфолін, в ефірних розчинниках, таких як діетиловий ефір, діоксан, ТГФ або ТБМЕ, з подальшою циклізацією шляхом обробки ненуклеофільною основою, такою як трет-бутилат калію або 2-метил-2-бутилат калію, в ефірних розчинниках, таких як діетиловий ефір, діоксан, ТГФ або ТБМЕ. Кращими умовами для першої стадії є триетиламін в ТГФ, змішаному з реагентами при 05 °C, і потім взаємодія протягом 1 години при кімнатній температурі, потім видалення побічного продукту гідрохлориду триетиламіну шляхом фільтрації. Кращими умовами для другої стадії є 2-метил-2-бутилат калію в ТГФ, змішаному з реагентами при 0-5 °C, і потім взаємодія протягом 20 хвилин при кімнатній температурі. Стадія F: Утворення зв'язку C-N може бути здійснене шляхом обробки 62 бензофеноніміном у присутності паладієвого або мідного каталізатора, ліганду та основи в розчинниках, таких як діоксан, ДМЕ, ТГФ, толуол, ДМФА та ДМСО, при підвищених температурах, наприклад, використовуючи каталізовану паладієм реакцію Бухвальда-Хартвіга. Кращими умовами є каталітичний трис(дибензиліденацетон)дипаладій(0), каталітичний (R)(+)-2,2'-біс(дифенілфосфіно)-1,1'-бінафтил та трет-бутилат натрію в діоксані при 90 °C протягом 90 хвилин. Стадія G: Видалення азот-захисної групи 63 можна провести шляхом обробки гідрохлоридом гідроксиламіну в присутності основи, такої як ацетат натрію або метилат натрію, в розчинниках, таких як MeOH, EtOH, H2O, діоксан, ТГФ, HOAc, EtOAc, CH 2Cl2, CHCl3, ДМФА, або їх суміші. Кращими умовами є гідрохлорид гідроксиламіну в присутності ацетату натрію в MeOH при 50 °C протягом 16 годин. Стадія H: Утворення зв'язку C-N може бути здійснене шляхом обробки арилгаліду 7 ариламіном 64 в присутності паладієвого або мідного каталізатора, ліганду та основи в розчинниках, таких як діоксан, ДМЕ, ТГФ, толуол, ДМФА та ДМСО, при підвищених температурах, наприклад, використовуючи каталізовану паладієм реакцію Бухвальда-Хартвіга. Кращими умовами є каталітичний комплекс трис(дибензиліденацетон)дипаладійхлороформ, каталітичний 9,9-диметил-4,5-біс(дифенілфосфіно)ксантен (ксантфос) та карбонат цезію в діоксані в закритій пробірці, нагрітій при 120 °C протягом 3 годин, згідно з модификацією процедури van Leeuwen зі співробітниками (Tetrahedron Lett. 1999, 40, 3789-3790). 23 UA 113167 C2 5 10 Стадія H': Утворення C-N зв'язку, що дає біариламін 56, альтернативно може бути здійснене безпосередньо з арилброміду 53 шляхом обробки арилброміду 53 ариламіном 11" у присутності паладієвого або мідного каталізатора, ліганду та основи в розчинниках, таких як діоксан, ДМЕ, ТГФ, толуол, ДМФА та ДМСО, при підвищених температурах, наприклад, використовуючи каталізовану паладієм реакцію Бухвальда-Хартвіга. Кращими умовами є каталітичний трис(дибензиліденацетон)дипаладій(0), каталітичний 2ди-трет-бутилфосфіно-2',4',6'-триізопропілбіфеніл та трет-бутилат натрію в діоксані при 100 °C протягом 2 годин. Стадія I: Видалення N-захисної групи BOC може бути здійснене з неорганічними кислотами, такими як HCl, H2SO4 чи H3PO4, або органічними кислотами, такими як CF3COOH, CHCl2COOH, HOAc чи п-толуолсульфонова кислота, в розчинниках, таких як CH 2Cl2, CHCl3, ТГФ, MeOH, EtOH або H2O, при температурі від 0 до 80 °C. Кращими умовами є CF3COOH у водному ацетонітрилі при 80 °C протягом 16 годин або 4н. HCl в діоксані та ТГФ при 60 °C протягом 16 годин. 15 Схема 11 24 UA 113167 C2 5 10 15 20 25 30 35 40 45 50 55 60 Замісники є такими, як описано вище, і X позначає O, Y позначає зв'язок, A позначає СН, R' позначає Сl, В позначає СН та n позначає 0. Стадія A: Альфа-галоїдкетони 67 можуть бути одержані шляхом проведення реакції гомологізації ацилхлориду 66 [CAS 21900-55-0], включаючи послідовну обробку спочатку (триметилсиліл)діазометаном і потім обробку концентрованою бромистоводневою кислотою або хлористоводневою кислотою. Реакцію проводять, використовуючи суміш ацетонітрилу, ТГФ та гексану як розчинник при температурах між 0 °C та кімнатною температурою. Кращими умовами є змішування реагентів при 0-5 °C з подальшою взаємодією протягом 30 хвилин при кімнатній температурі для першої стадії, та змішування реагентів при 0-5 °C з подальшою взаємодією протягом 30 хвилин при кімнатній температурі для другої стадії. Стадія B: Утворення епоксиду можна провести за допомогою постадійного способу, який включає відновлення альфа-галоїдкетонів 67 шляхом обробки відновником, таким як NaBH4 або LiBH4, в розчиннику, такому як MeOH, EtOH, ТГФ, діоксан, з подальшою циклізацією майбутнього альфа-галоїдспирту шляхом обробки основою, такою як метилат натрію, етилат натрію, трет-бутилат калію або карбонат цезію, в тому самому розчиннику. Кращими умовами є NaBH4 в етанолі при температурі від 5 °C до кімнатної температури протягом 90 хвилин з подальшою обробкою метилатом натрію при 50 °C протягом 4 годин. Стадія C: Нуклеофільне розкриття кільця може бути здійснене обробкою епоксиду 68 2аміноетанолом, можливо, у присутності органічної основи, такої як триетиламін, N, Nдіізопропілетиламін або N-метилморфолін, в непротонному полярному органічному розчиннику, такому як ефір, ТГФ, діоксан або ТБМЕ. Кращими умовами є використання надлишку 2-аміноетанолу як основи в ТГФ при кімнатній температурі протягом 7 годин. Стадія D: Вибірковий захист аміногрупи аміноспирту 69 може бути проведений шляхом обробки ди-трет-бутилкарбонатом, можливо, у присутності органічної основи, такої як триетиламін, N, N-діізопропілетиламін або N-метилморфолін, в галогензаміщених розчинниках, таких як дихлорметан або 1,2-дихлоретан, або ефірних розчинниках, таких як діетиловий ефір, діоксан, ТГФ або ТБМЕ. Кращими умовами є дихлорметан без використання основи при кімнатній температурі протягом 16 годин. Стадія E: Циклізацію можна провести за допомогою постадійного процесу, який включає утворення сульфонату шляхом обробки діолу 70 одним еквівалентом метансульфонілхлориду в присутності органічної основи, такої як триетиламін, N, N-діізопропілетиламін або Nметилморфолін, в ефірних розчинниках, таких як діетиловий ефір, діоксан, ТГФ або ТБМЕ, з подальшою циклізацією шляхом обробки ненуклеофільною основою, такою як трет-бутилат калію або 2-метил-2-бутилат калію, в ефірних розчинниках, таких як діетиловий ефір, діоксан, ТГФ або ТБМЕ. Кращими умовами для першої стадії є триетиламін в ТГФ, змішаному з реагентами при 05 °C, і потім взаємодія протягом 1 години при кімнатній температурі, потім видалення побічного продукту гідрохлориду триетиламіну шляхом фільтрації. Кращими умовами для другої стадії є 2-метил-2-бутилат калію в ТГФ, змішаному з реагентами при 0-5 °C, і потім взаємодія протягом 30 хвилин при кімнатній температурі. Стадія F: Утворення зв'язку C-N може бути здійснене шляхом обробки 71 бензофеноніміном у присутності паладієвого або мідного каталізатора, ліганду та основи в розчинниках, таких як діоксан, ДМЕ, ТГФ, толуол, ДМФА та ДМСО, при підвищених температурах, наприклад, використовуючи каталізовану паладієм реакцію Бухвальда-Хартвіга. Кращими умовами є каталітичний трис(дибензиліденацетон)дипаладій(0), каталітичний (R)(+)-2,2'-біс(дифенілфосфіно)-1,1'-бінафтил та трет-бутилат натрію в діоксані при 90 °C протягом 16 годин. Стадія G: Видалення азот-захисної групи 72 можна провести шляхом обробки гідрохлоридом гідроксиламіну в присутності основи, такої як ацетат натрію або метилат натрію, в розчинниках, таких як MeOH, EtOH, H2O, діоксан, ТГФ, HOAc, EtOAc, CH 2Cl2, CHCl3, ДМФА, або їх суміші. Кращими умовами є гідрохлорид гідроксиламіну в присутності ацетату натрію в MeOH при 60 °C протягом 1 години. Стадія H: Утворення зв'язку C-N може бути здійснене шляхом обробки арилгаліду 7 ариламіном 73 у присутності паладієвого або мідного каталізатора, ліганду та основи в розчинниках, таких як діоксан, ДМЕ, ТГФ, толуол, ДМФА та ДМСО, при підвищених температурах, наприклад, використовуючи каталізовану паладієм реакцію Бухвальда-Хартвіга. 25 UA 113167 C2 5 10 15 20 25 30 35 40 45 Кращими умовами є каталітичний комплекс трис(дибензиліденацетон)дипаладійхлороформ, каталітичний 9,9-диметил-4,5-біс(дифенілфосфіно)ксантен (ксантфос) та карбонат цезію в діоксані у закритій пробірці, нагрітій при 120 °C, протягом 16 годин, згідно з модификацією процедури van Leeuwen зі співробітниками (Tetrahedron Lett. 1999, 40, 37893790). Стадія H': Утворення C-N зв'язку, що дає біариламін 74, альтернативно може бути здійснене безпосередньо з арилброміду 71 шляхом обробки арилброміду 71 ариламіном 11" в присутності паладієвого або мідного каталізатора, ліганду та основи в розчинниках, таких як діоксан, ДМЕ, ТГФ, толуол, ДМФА та ДМСО, при підвищених температурах, наприклад, використовуючи каталізовану паладієм реакцію Бухвальда-Хартвіга. Кращими умовами є каталітичний трис(дибензиліденацетон)дипаладій(0), каталітичний 2ди-трет-бутилфосфіно-2',4',6'-триізопропілбіфеніл та трет-бутилат натрію в діоксані при 100 °C протягом 2 годин. Стадія I: Видалення N-захисної групи BOC може бути здійснене з неорганічними кислотами, такими як HCl, H2SO4 чи H3PO4, або органічними кислотами, такими як CF3COOH, CHCl2COOH, HOAc чи п-толуолсульфонова кислота, в розчинниках, таких як CH2Cl2, CHCl3, ТГФ, MeOH, EtOH або H2O, при температурі від 0 до 80 °C. Кращими умовами є CF3COOH у водному ацетонітрилі при 80 °C протягом 3 годин або 4н. HCl в діоксані та ТГФ при 60 °C протягом 16 годин. Виділення та очистка сполук Виділення та очищення сполук та проміжних сполук, описаних тут, можна провести, при необхідності, за допомогою будь-якої придатної процедури розділення або очищення, такої як, наприклад, фільтрація, екстракція, кристалізація, колонкова хроматографія, тонкошарова хроматографія, хроматографія в товстому шарі, препаративна рідинна хроматографія при низькому або високому тиску, або комбінації цих процедур. Конкретні ілюстрації придатних процесів розділення та виділення можуть бути проведені відповідно до синтезів та прикладів нижче. Однак, звичайно, також можна використовувати інші еквівалетні процедури розділення або виділення. Рацемічні суміші хіральних сполук формули I можуть бути розділені з використанням хіральної ВЕРХ. Солі сполук формули I Сполуки формули I є основними і можуть бути перетворені на відповідні кислотно-адитивні солі. Перетворення проводять шляхом обробки принаймні стехіометричною кількістю придатної кислоти, такої як хлористоводнева кислота, бромистоводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота тощо, та органічних кислот, таких як оцтова кислота, пропіонова кислота, гліколева кислота, піровиноградна кислота, щавелева кислота, яблучна кислота, малонова кислота, бурштинова кислота, малеїнова кислота, фумарова кислота, винна кислота, лимонна кислота, бензойна кислота, корична кислота, мигдалева кислота, метансульфонова кислота, етансульфонова кислота, п-толуолсульфонова кислота, саліцилова кислота тощо. Звичайно вільну основу розчиняють в інертному органічному розчиннику, такому як діетиловий ефір, етилацетат, хлороформ, етанол або метанол тощо, та додають кислоту в цьому самому розчиннику. Температуру підтримують між 0 °C та 50 °C. Одержана в результаті сіль осаджується спонтанно або може бути виділена з розчину за допомогою менш полярного розчинника. Кислотно-адитивні солі основних сполук формули I можуть бути перетворені на відповідні вільні основи шляхом обробки принаймні стехіометричним еквівалентом придатної основи, такої як гідроксид натрію або калію, карбонат калію, гідрокарбонат натрію, аміак тощо. Приклад 1 (RS)-(4,6-Диметилпіримідин-2-іл)-(4-піролідин-3-ілфеніл)аміну гідрохлорид H N N N N H 50 55 Зазначену в заголовку сполуку одержували за аналогією з прикладом 5, використовуючи трет-бутиловий ефір (RS)-3-(4-амінофеніл)піролідин-1-карбонової кислоти (CAS 908334-28-1) замість трет-бутилового ефіру (RS)-2-(4-амінофеніл)морфолін-4-карбонової кислоти та 2-хлор4,6-диметилпіримідин (CAS 4472-44-0) замість 2,5-дихлорпіридину на стадії (a). Світло37 + коричнева тверда речовина. МС (ІР (іонне розпилювання)): 271,3 ([{ Cl}M+H] ), 269,4 26 UA 113167 C2 35 + ([{ Cl}M+H] ). Приклад 2 [(RS)-1-(5-Бромпіридин-2-іл)-2,2,2-трифторетил]-((RS)-4-піролідин-3-ілфеніл)амін Br N H N F F F N H 5 10 15 20 25 30 35 40 45 50 55 a) (RS)-1-(5-Бромпіридин-2-іл)-2,2,2-трифторетанол До охолодженого перемішуваного розчину 5-бромпіридин-2-карбальдегіду (3,72 г, CAS 31181-90-5) та (трифторметил)триметилсилану (3,56 мл) в ТГФ (30 мл) при 0 °C додавали по краплях розчин тетрабутиламонію фториду (1,0 мл, 1 M розчин в ТГФ). Реакційну суміш перемішували при 0 °C протягом 30 хвилин і потім при кімнатній температурі протягом 2 годин. Суміш потім розбавляли 1н. водн. HCl (20 мл) та продовжували перемішувати протягом додаткових 2 годин. Суміш розбавляли водою та екстрагували двічі етилацетатом. Об'єднані органічні фази сушили над сульфатом натрію та концентрували у вакуумі. Залишок очищали за допомогою колонкової хроматографії (SiO2; градієнт: гептан/EtOAc), що давало (RS)-1-(5бромпіридин-2-іл)-2,2,2-трифторетанол у вигляді світло-жовтої твердої речовини (3,35 г, 65 %). 81 + 79 + МС (ІР): 258,0 ([{ Br}M+H] ), 256,1 ([{ Br}M+H] ). b) (RS)-1-(5-Бромпіридин-2-іл)-2,2,2-трифторетиловий ефір трифторметансульфонової кислоти До перемішуваної суспензії гідриду натрію (765 мг, 60 % дисперсія в мінеральному маслі) в безводному діетиловому ефірі (20 мл) в атмосфері аргону при 0 °C додавали по краплях розчин (RS)-1-(5-бромпіридин-2-іл)-2,2,2-трифторетанолу (3,06 г) в діетиловому ефірі (10 мл) і одержану в результаті суміш перемішували при кімнатній температурі протягом 30 хвилин. Трифторметансульфонілхлорид (1,4 мл) додавали та продовжували перемішувати протягом додаткових 15 хвилин при кімнатній температурі. Реакційну суміш гасили, додаючи 10 % водн. розчин гідрокарбонату натрію, і суміш екстрагували діетиловим ефіром. Фази розділяли та органічну фазу промивали насиченим сольовим розчином. Органічну фазу відокремлювали, сушили над сульфатом натрію та концентрували у вакуумі. Залишок очищали шляхом дистиляції за допомогою Kugelrohr (температура печі 60 °C, 0,3 мбар), що давало (RS)-1-(5бромпіридин-2-іл)-2,2,2-трифторетиловий ефір трифторметансульфонової кислоти (3,6 г, 78 %) 81 + 79 + 81 + у вигляді білої твердої речовини. МС (ЕІ): 389 ([{ Br}M] ), 387 ([{ Br}M] ), 320 ([{ Br}M-CF3] ), 79 + 81 + 79 + 81 + 318 ([{ Br}M-CF3] ), 256 ([{ Br}M-CF3-SO2] ), 254 ([{ Br}M-CF3-SO2] ), 240 ([{ Br}M-OSO2CF3] ), 79 + 238 ([{ Br}M-OSO2CF3] ). c) трет-Бутиловий ефір (RS)-3-{4-[(RS)-1-(5-бромпіридин-2-іл)-2,2,2трифторетиламіно]феніл}піролідин-1-карбонової кислоти До перемішуваного розчину трет-бутилового ефіру (RS)-3-(4-амінофеніл)піролідин-1карбонової кислоти (50 мг, CAS 908334-28-1) в безводному ТГФ (0,1 мл) в атмосфері аргону додавали гідрид натрію (14 мг, 60 % дисперсія в мінеральному маслі) та продовжували перемішувати протягом 15 хвилин. Потім додавали 1-(5-бромпіридин-2-іл)-2,2,2трифторетиловий ефір трифторметансульфонової кислоти (74 мг) та суміш перемішували протягом ночі при кімнатній температурі. Реакційну суміш розбавляли етилацетатом та промивали послідовно водою та насиченим сольовим розчином. Органічну фазу відокремлювали, сушили над сульфатом натрію та концентрували у вакуумі. Залишок очищали за допомогою колонкової флеш-хроматографії (силікагель; градієнт: гептан/EtOAc), що давало трет-бутиловий ефір (RS)-3-{4-[(RS)-1-(5-бромпіридин-2-іл)-2,2,2трифторетиламіно]феніл}піролідин-1-карбонової кислоти (34 мг, 36 %) у вигляді жовтого масла. 81 + 79 + 81 + 79 МС (ІР): 501,9 ([{ Br}M+H] ), 500,2 ([{ Br}M+H] ), 446,2 ([{ Br}M+H-C4H8] ), 444,1 ([{ Br}M+H+ C4H8] ). d) [(RS)-1-(5-Бромпіридин-2-іл)-2,2,2-трифторетил]-((RS)-4-піролідин-3-ілфеніл)амін До перемішуваного розчину трет-бутилового ефіру (RS)-3-{4-[(RS)-1-(5-бромпіридин-2-іл)2,2,2-трифторетиламіно]феніл}піролідин-1-карбонової кислоти (27 мг) в ТГФ (1 мл) додавали по краплях розчин хлороводню в діоксані (0,20 мл, 4 M розчин) та суміш нагрівали при 60 °C протягом 4 годин. Потім суміш охолоджували до кімнатної температури, розбавляли етилацетатом/ТГФ (1:1) та промивали послідовно 2н. водн. розчином гідроксиду натрію та насиченим сольовим розчином. Органічну фазу відокремлювали, сушили над сульфатом натрію 27 UA 113167 C2 5 та концентрували у вакуумі. Залишок очищали за допомогою колонкової флеш-хроматографії (силікагель; градієнт: гептан/дихлорметан/метанол), що давало [(RS)-1-(5-бромпіридин-2-іл)2,2,2-трифторетил]-((RS)-4-піролідин-3-ілфеніл)амін (12 мг, 56 %) у вигляді жовтого аморфної 81 + 79 + твердої речовини. МС (ІР): 402,1 ([{ Br}M+H] ), 400,1 ([{ Br}M+H] ). Приклад 3 [(RS)-1-(4-Хлорфеніл)-2,2,2-трифторетил]-[(RS)-4-(2-піролідин-3-ілетил)феніл]амін Cl H N F F F N H 10 15 20 25 30 35 40 45 a) трет-Бутиловий ефір (RS)-3-[(E)-2-(4-нітрофеніл)вініл]піролідин-1-карбонової кислоти До перемішуваного розчину N, N-діізопропіламіну (3,36 мл) в тетрагідрофурані (20 мл) при 78 °C додавали по краплях розчин н-бутиллітію (14,9 мл, 1,6 M в гексані) та реакційну суміш потім нагрівали до 0 °C протягом 15 хвилин. Після повторного охолодження до -78 °C додавали по краплях розчин діетил-(4-нітробензил)фосфонату (5,00 г, CAS 2609-49-6) в тетрагідрофурані (10 мл). Суміш перемішували при -78 °C протягом 60 хвилин і потім додавали по краплях розчин трет-бутилового ефіру (RS)-3-формілпіролідин-1-карбонової кислоти (4,01 г, CAS 59379-02-1) в тетрагідрофурані (10 мл) протягом 30 хвилин. Потім суміш нагрівали до кімнатної температури та продовжували перемішувати при кімнатній температурі протягом 18 годин. Потім суміш розбавляли етилацетатом та підкислювали до pH 6, додаючи водну соляну кислоту (1н.). Суміш промивали послідовно водою та насиченим сольовим розчином, сушили над Na 2SO4 та концентрували у вакуумі. Залишок очищали за допомогою колонкової флеш-хроматографії (силікагель, градієнт: гептан/EtOAc), що давало трет-бутиловий ефір (RS)-3-[(E)-2-(4нітрофеніл)вініл]піролідин-1-карбонової кислоти (3,39 г, 58 %) у вигляді жовтого масла. b) трет-Бутиловий ефір (RS)-3-[2-(4-амінофеніл)етил]піролідин-1-карбонової кислоти До розчину трет-бутилового ефіру (RS)-3-формілпіролідин-1-карбонової кислоти (3,39 г) в метанолі (250 мл) додавали паладій на вугіллі (10 %, 340 мг). Суміш енергійно перемішували в атмосфері водню протягом 7 годин. Каталізатор відфільтровували та фільтрат випарювали. Неочищений продукт очищали за допомогою колонкової флеш-хроматографії (силікагель; градієнт: гептан/EtOAc), що давало трет-бутиловий ефір (RS)-3-[2-(4-амінофеніл)етил]піролідин+ 1-карбонової кислоти (2,44 г, 79 %) у вигляді жовтого масла. МС (ИСП): 291,2 ([M+H] ). c) трет-Бутиловий ефір (RS)-3-(2-{4-[(RS)-1-(4-хлорфеніл)-2,2,2трифторетиламіно]феніл}етил)піролідин-1-карбонової кислоти Зазначену в заголовку сполуку одержували за аналогією зі стадією (c) прикладу 2, використовуючи трет-бутиловий ефір (RS)-3-[2-(4-амінофеніл)етил]піролідин-1-карбонової кислоти замість трет-бутилового ефіру (RS)-3-(4-амінофеніл)піролідин-1-карбонової кислоти та (RS)-1-(4-хлорфеніл)-2,2,2-трифторетиловий ефір трифторметансульфонової кислоти (CAS 1202576-95-1) замість (RS)-1-(5-бромпіридин-2-іл)-2,2,2-трифторетилового ефіру 37 + трифторметансульфонової кислоти. Жовте масло. МС (ІР): 429,2 ([{ Cl}M+H-C4H8] ), 427,1 35 + ([{ Cl}M+H-C4H8] ). d) [(RS)-1-(4-Хлорфеніл)-2,2,2-трифторетил]-[(RS)-4-(2-піролідин-3-ілетил)феніл]амін Зазначену в заголовку сполуку одержували за аналогією зі стадією (d) прикладу 2, використовуючи трет-бутиловий ефір (RS)-3-(2-{4-[(RS)-1-(4-хлорфеніл)-2,2,2трифторетиламіно]феніл}етил)піролідин-1-карбонової кислоти замість трет-бутилового ефіру (RS)-3-{4-[(RS)-1-(5-бромпіридин-2-іл)-2,2,2-трифторетиламіно]феніл}піролідин-1-карбонової 37 + 35 + кислоти. Тверда речовина білого відтінку. МС (ІР): 385,2 ([{ Cl}M+H] ), 383,2 ([{ Cl}M+H] ). Приклад 4 (RS)-[1-(4-Хлорфеніл)-2,2,2-трифторетил]-[(RS)-4-(2-піперидин-3-ілетил)феніл]амін 28
ДивитисяДодаткова інформація
Назва патенту англійськоюHeterocyclic amine derivatives
Автори англійськоюGalley, Guido, Norcross, Roger, Pflieger, Philippe
Автори російськоюГаллей Гуидо, Норкросс Роджер, Пфлигер Филипп
МПК / Мітки
МПК: C07D 207/09, C07D 401/12, C07D 417/12, C07D 413/12, C07D 211/26, C07D 265/30, C07D 403/12, C07D 413/14
Мітки: гетероциклічних, похідні, амінів
Код посилання
<a href="https://ua.patents.su/113-113167-pokhidni-geterociklichnikh-aminiv.html" target="_blank" rel="follow" title="База патентів України">Похідні гетероциклічних амінів</a>
Попередній патент: Півсфера для розширення сечового міхура у пацієнтів з низьким рівнем розтягування
Випадковий патент: Спосіб моніторингу популяцій склівок (lepidoptera, aegeriidae)





















































































































