Гетероцикло-циклічні похідні амінів або їх фармацевтично прийнятні солі, проміжні сполуки, фармацевтична композиція, спосіб інгібування холінестерази, спосіб одержання гетероцикло-циклічних похідних амінів
Номер патенту: 45944
Опубліковано: 15.05.2002
Автори: Чен Юпанг Ліанг, Нейджел Артур Адам, Віллалобос Анабелла
Формула / Реферат
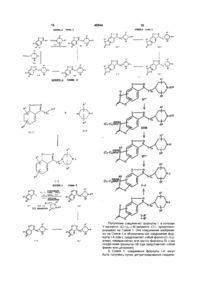
1. Гетероцикло-циклические производные аминов общей формулы (I):
(I)
где R1 и R2 независимо выбирают из водорода, (С1-С6)алкокси, бензилокси, фенокси, гидрокси, фенила, бензила, галогена, нитро, циано, COR5, COOR5, CONHR5, NR5R6, -NR5OR6, OCON5R6, -NHCOOR5, (С1-С6)алкила, необязательно замещенного 1-3 атомами фтора, SOpCH2-фенила или SOр(С1-С6)алкила, где р = 0, 1 или 2, пиридилметилокси, тиенилметилокси, 2-оксазолила, 2-тиазолила и бензолсульфонамида, где фенильные части указанных фенокси, бензилокси, фенильной, бензильной и бензолсульфонамидной групп; пиридильные и тиенильные части указанных пиридилметокси или тиенилметокси-групп и оксазолильные и тиазолильные части указанных 2-оксазолильной и 2-тиазолильной групп, могут быть, необязательно, замещены 1 или 2 заместителями, независимо выбранными из галогена, (С1-С4)алкила, трифторметила, (С1-С4)алкокси, циано, нитро или гидрокси;
либо R1 и R2, если они связаны с соседними атомами углерода, и если Х является кислородом, серой или NR4, где R4 является водородом или (С1-С4)алкилом, могут образовывать вместе с атомом углерода, с которым они связаны, группу формулы:
A
или
B,
где J является водородом, серой или NR4, "а" = 1 или 2, R3 является водородом или (С1-С6)алкилом, a Q является кислородом, серой, NH, СНСН3, С(СН3)3, -СН=СН- или (СН2)і, где і является целым числом от 1 до 3;
Х представляет собой кислород, серу, -СН=СН-, -CH=N-, -N=CH-, -N=N- или NR4, где R4 является водородом или (С1-С4)алкилом;
Y представляет собой -(СH2)m-, -CH=CH(CH2)n-, -NR4(CH2)m- или -O(СН2)m-, где R4 определен выше, n является целым числом от 0 до 3, m является целым числом от 1 до 3;
каждый R5 и R6 независимо выбирают из водорода, (С1-С6)алкила, фенила или бензила, где фенильные части указанных фенильных и бензильных групп, могут быть, но необязательно, замещенными одним или двумя заместителями, независимо выбранными из фтора, хлора, брома, йода, (С1-С4)алкила, трифторметила, (С1-С4)алкокси, циано, нитро и гидрокси; или NR5R6 вместе образуют кольцо с 4-8 членами, в котором один атом является азотом, а другие являются атомами углерода, кислорода или азота, либо NR5COR6 вместе образуют циклическое лактамное кольцо с 4-8 членами;
М представляет собой -СН- или азот;
L представляет собой фенил, фенил-(С1-С6)алкил, циннамил или пиридилметил, где фенильные части указанных фенильной и фенил-(С1-С6)алкильной групп могут быть, необязательно, замещены 1-3 заместителями, независимо выбранными из (С1-С6)алкила, (С1-С6)алкокси, (С1-С4)алкоксикарбонила, (C1-C4)aлкoкcикapбoнил-OCONR5Rб, NHCOOR5 или галогена; либо L представляет собой группу формулы (К):
(K),
где b является целым числом от 1 до 4, R13 и R14 независимо выбирают из водорода, (С1-С4)алкила, галогена и фенила, Е и F независимо выбирают из -СН- и азота, G является кислородом, серой или NR4, где R4 определен выше, при условии, что если Е и F оба являются азотом, то один из R13 и R14 отсутствует;
R7 и R8 независимо выбирают из водорода, (С1-С6)алкила, (С1-С6)алкоксикарбонила, (С1-С6)алкилкарбонила и (С1-С6)алкокси, при условии, что указанная (С1-С6)алкоксигруппа не связана с атомом углерода, который является соседним с атомом азота,
при условии, что М является -СН-, если Y является -(СН2)3-; Х является кислородом; R' является фтором; а R2 является водородом;
или фармацевтически приемлемые соли указанных соединений.
2. Гетероцикло-циклические производные аминов по п. 1, где Х представляет собой серу или кислород, Y представляет собой -СН2-СН2- или –СН2-; М представляет собой - СН-, а L представляет собой бензил; R1 и R2 представляют собой (С1-С6)алкил, (С1-С6)алкокси, NR5R6 или NR5COR6; где R3 представляет собой водород или (С1-С6)алкил; J представляет собой кислород или серу, a Q представляет собой СН(СН3), СН(СН3)2, -СН=СН- или (СН2)i.
3. Гетероцикло-циклические производные аминов по п. 1, выбранные из группы, которая включает в себя:
3-[2-[1-(фенилметил)-4-пиперидинил]этил]-1,2-бензизоксазол;
5-метил-3-[2-[1-(фенилметил)-4-пиперидинил]этил]-1,2-бензизоксазол;
5,6-диметил-3-[2-[1-(фенилметил)-4-пиперидинил]этил]-1,2-бензизоксазол;
5-метокси-3-[2-[1-(фенилметил)-4-пиперидинил]этил]-1,2-бензизоксазол;
6-метокси-З- [2- [ 1 -(фенилметил)-4-пиперидинил]этил]-1,2-бензизоксазол;
7-метокси-3-[2-[ 1 -(фенилметил)-4-пиперидинил]этил]-1,2-бензизоксазол;
6-ацетамидо-3-[2-[1-(фенилметил)-4-пиперидинил]этил]-1,2-бензизоксазол;
6-амино-3-[2-[1-(фенилметил)-4-пиперидинил]этил]-1,2-бензизоксазол;
6-бензамид-3-[2-[ 1 -(фенилметил)-4-пиперидинил]этил]-1,2-бензизоксазол;
6-бензолсульфонамид-3-[2-[1-(фенилметил)-4-пиперидинил]этил]-1,2-бензизоксазол;
6-(морфолинил) -3-[2-[1-(фенилметил)-4-пиперидинил]этил]-1,2-бензизоксазол;
5,7-дигидро-3-[2-[1-(фенилметил)-4-пиперидинил]этил]-6Н-пирроло[4,5-f]-1,2-бензизоксазол-6-он;
1 - [2- [ 1 -(фенилметил)-4-пиперидинил] этил]изохинолин;
3-[2-[1-(фенилметил)-4-пиперидинил]этил]-1,2-бензизотиазол;
4-[2-[1-(фенилметил)-4-пиперидинил]этил]-1,3-хиназолин;
6-гидрокси-3- [2- [ 1 -(фенилметил)-4-пиперидил]этил]-1,2-бензизоксазол;
6-бромо-3-[2-[1-(фенилметил)-4-пиперидил]этил]-1,2-бензизоксазол;
6-циано-3-[2-[ 1 -(фенилметил)-4-пиперидил]этил]-1,2-бензизоксазол;
6-карбоксамид-3-[2-[1-(фенилметил)-4-пиперидил]этил]-1,2-бензизоксазол;
3-[( 1 -фенилметил-4-пиперидил)метокси]-1,2-бензизоксазол;
3-[( 1 -фенилметил-4-пиперидил)метиламино]-1,2-бензизоксазол;
3-[(1-фенилметил-4-пиперидил)этиламино]-1,2-бензизоксазол;
3-[3-[1-(фенилметил)-4-пиперидил]пропил]-1,2-бензизоксазол;
транс-3-[2-[1-(фенилметил)-4-пиперидил]этенил]-1,2-бензизоксазол;
3-[2-[ 1 -(фенилметил)-4-пиперазинил]этил]-1,2-бензизоксазол;
5,7-дигидро-7-метил-3-[2-[1-(фенилметил)-4-пиперидинил]этил]-6Н-пирроло[4,5-f]-1,2-бензизоксазол-6-он;
5,7-дигидро-7-этил-3-[2-[1-(фенилметил)-4-пиперидинил]этил]-6Н-пирроло[4,5-f]-1,2-бензизоксазол-6-он;
5,7-дигидро-3-[2-[1-(2-хлор-5-тиофенметил)-4-пиперидинил]этил]-6Н-пирроло[4,5-f]-1,2-бензизоксазол-6-он;
5,7-дигидро-3-[2-[1-(2-метил-4-тиазолметил)-4-пиперидинил]этил]-6Н-пирроло[4,5-f]-1,2-бензизоксазол-6-он;
3-[2-[1-(3-бромфенилметил)-4-пиперидинил]этил]-5,7-дигидро-6Н-пирроло[4,5-f]-1,2-бензизоксазол-6-он;
3-[2-[1-(4-бромфенилметил)-4-пиперидинил]этил]-5,7-дигидро-6Н-пирроло[4,5-f]-1,2-бензизоксазол-6-он;
5,7-дигидро-3-[3-[1-(фенилметил)-4-пиперидинил]пропил]-6Н-пирроло[4,5-f]-1,2-бензизоксазол-6-он;
3-[2-[1-(фенилметил)-4-пиперидинил]этил]-5,6,8-тригидро-7Н-изоксазоло[4,5-g]хинолин-7-он;
6,8-дигидpo-3-[2-[1-(фeнилмeтил)-4-пипepидинил]этил]-7H-пиppoлo[5,4-g]-l,2-бензизоксазол-6-он;
5,7-дигидро-3-[2-[1-(фенилметил)-4-пиперидинил]этил]-6Н-пирроло[5,4-f]-1,2-бензизоксазол-6-он;
3-[2-( 1 -(фенилметил)-4-пиперидинил)этил]-1 Н-индазол;
и фармацевтически приемлемые соли таких соединений.
4. Гетероцикло-циклические производные аминов по п. 1, которые выбирают из группы, включающей в себя;
3-[2-[1-(фенилметил)-4-пиперидинил]этил]-1,2-бензизоксазол малеат;
5,6-диметил-3-[2-[1-(фенилметил)-4-пиперидинил]этил]-1,2-бензизоксазол малеат;
5-метокси-3-[2-[1-(фенилметил)-4-пиперидинил]этил]-1,2-бензизоксазолмалеат;
7-метокси-3-[2-[ 1 -(фенилметил)-4-пиперидинил]этил]-1,2-бензизоксазол фумарат;
6-бензамид-3-[2-[ 1 -(фенилметил)-4-пиперидинил]этил]-1,2-бензизоксазол малеат;
6-бензолсульфонамид-3-[2-[1-(фенилметил)-4-пиперидинил]этил]-1,2-бензизоксазол фумарат; и
1 -[2-[ 1 -(фенилметил)-4-пиперидинил]этил]изохинолин малеат.
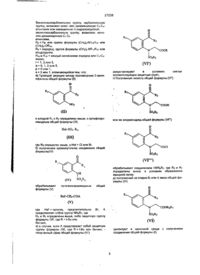
5. Соединения формулы:
где W является уходящей группой; j является целым числом от 0 до 2; R10 представляет собой азотзащитную группу; и R7 и R8 независимо выбирают из водорода, (С1-С6)алкила, (С1-С6)алкоксикарбонила, (С1-С6)алкилкарбонила и (С1-С6)алкокси, при условии, что указанная (С1-С6)алкоксигруппа не связана с атомом углерода, который является соседним с атомом азота,
в качестве промежуточных соединений.
6. Гетероцикло-циклические производные аминов по п. 1 формулы:
,
где R1, R2, R7, R8, X, Y и М определены в п. 1, а R11 представляет собой, водород или азотзащитную группу.
7. Соединения формулы:
,
где R1, R2, R7, R8 и L определены в п. 1, а Y' представляет собой -СН=СН-(СН2)n- или -(СН2)m-,
в качестве промежуточных соединений.
8. Фармацевтическая композиция, отличающаяся тем, что содержит эффективное количество соединения формулы (I) по п. 1 и фармацевтически приемлемый носитель, и предназначена для улучшения памяти или лечения и предупреждения болезни Альцгеймера.
9. Фармацевтическая композиция по п. 8, отличающаяся тем, что предназначена для ингибирования холинэстеразы у млекопитающего.
10. Способ ингибирования холинэстеразы у млекопитающего, отличающийся тем, что этому млекопитающему вводят ингибирующее холинэстеразу количество соединения формулы (I) по п. 1.
11. Способ улучшения памяти или лечения, или предупреждения болезни Альцгеймера, отличающийся тем, что пациенту вводят эффективное для улучшения памяти количество соединения формулы (I) по п. 1.
12. Способ получения гетероцикло-циклических производных аминов общей формулы (I-А):
(I-A),
где R1 и R2 независимо выбирают из водорода, (С1-С6)алкокси, бензилокси, фенокси, гидрокси, фенила, бензила, галогена, нитро, циано, COR5, COOR5, CONHR5, NR5R6, -NR5COR6, OCONR5R6, -NHCOOR5, (С1-С6)алкила, необязательно замещенного 1-3 атомами фтора, SОрСН2-фенила или SOр(С1-С6)алкила, где р = 0, 1 или 2, пиридилметилокси, тиенилметилокси, 2-оксазолила, 2-тиазолила и бензолсульфонамида, где фенильные части указанных фенокси, бензилокси, фенильной, бензильной и бензолсульфонамидной групп; пиридильные и тиенильные части указанных пиридилметокси- или тиенилметокси-групп и оксазолильные и тиазолильные части указанных 2-оксазолильной и 2-тиазолильной групп могут быть, необязательно, замещены 1 или 2 заместителями, независимо выбранными из галогена, (С1-С4)алкила, трифторметила, (С1-С4)алкокси, циано, нитро или гидрокси;
либо R1 и R2 , если они связаны с соседними атомами углерода, и если Х является кислородом, серой или NR4, где R4 является водородом или (С1-С4)алкилом, могут образовывать вместе с атомом углерода, с которым они связаны, группу формулы:
A
или
B,
где J является водородом, серой или NR4, "а" = 1 или 2, R3 является водородом или (С1-С6)алкилом, a Q является кислородом, серой, NH, СНСН3, С(СН3)2, -СН=СН- или (СН2)I, где I является целым числом от 1 до 3;
Х представляет собой кислород, серу, -СН=СН-, -CH=N-, -N=CH-, -N=N- или NR4, где R4 является водородом или (С1-С4)алкилом;
m является целым числом от 1 до 3;
R7 и R8 независимо выбирают из водорода, (С1-С6)алкила, (С1-С6)алкоксикарбонила, (С1-С6)алкилкарбонила и (С1-С6)алкокси, при условии, что указанная (С1-С6)алкокси-группа не связана с атомом углерода, который является соседним с атомом азота,
L представляет собой фенил-(С1-С6)-алкил, пиридилметил или группу формулы (К):
(K),
где b является целым числом от 1 до 4, R13 и R14 независимо выбирают из водорода, (С1-С4)алкила, галогена и фенила, Е и F независимо выбирают из -СН- и азота, G является кислородом, серой или NR4, где R4 определен выше, при условии, что если Е и F оба являются азотом, то один из R13 и R14 отсутствует;
или их фармацевтически приемлемых кислотно-аддитивных солей, причем указанный способ заключается в том, что:
(а) соединение формулы (VI):
(VI),
где R1, R2, X, m, R7 и R8 являются такими, как они определены выше, подвергают реакции с соединением формулы WL, где W является уходящей группой, а L является таким, как он определен выше; и
(b) необязательно, соединение формулы (I-А), полученное данным способом, подвергают реакции с фармацевтически приемлемой солью.
Текст
1 Гетероцикло-циклические производные аминов общей формулы (I) R' Y—M і FT 1 ? (I) где R и R независимо выбирают из водорода, (Сі-Сє)алкокси, бензилокси, фенокси, гидрокси, 5 фенила, бензила, галогена, нитро, циано, COR , 5 5 5 6 5 6 5 6 COOR , CONHR , NR R , -NR OR , OCON R , NHCOOR5, (Сі-Сє)алкила, необязательно замещенного 1-3 атомами фтора, ЭОрСЬЬ-фенила или ЗОр(Сі-Сб)алкила, где р = 0, 1 или 2, пиридилметилокси, тиенилметилокси, 2-оксазолила, 2тиазолила и бензолсульфонамида, где фенильные части указанных фенокси, бензилокси, фенильной, бензильной и бензолсульфонамидной групп, пиридильные и тиенильные части указанных пиридилметокси или тиенилметокси-групп и оксазолильные и тиазолильные части указанных 2-оксазолильной и 2-тиазолильной групп, могут быть, необязательно, замещены 1 или 2 заместителями, независимо выбранными из галогена, ( d С^алкила, трифторметила, (СгС^алкокси, циано, нитро или гидрокси, либо R1 и R , если они связаны с соседними атомами углерода, и если X является кислородом, серой или NR4, где R4 является водородом или (Cretanкилом, могут образовывать вместе с атомом углерода, с которым они связаны, группу формулы R или О. •(CH2)a в, где J является водородом, серой или NR , "а" = 1 или 2, R3 является водородом или (С-і-Сб)алкилом, a Q является кислородом, серой, NH, СНСНз, С(СНз)з, -СН=СН- или (СНг):, где і является целым числом от 1 до 3, X представляет собой кислород, серу, -СН=СН-, CH=N-, -N=CH-, -N=N- или NR , где R4 является водородом или (Cretanкилом, Y представляет собой -(Cbbjm-, -СН=СН(СН2)П-, NR4(CH2)m- или -О(СН2)т-, где R4определен выше, п является целым числом от 0 до 3, m является целым числом от 1 до 3, каждый R5 и R6 независимо выбирают из водорода, (С-і-Сб)алкила, фенила или бензила, где фенильные части указанных фенильных и бензильных групп, могут быть, но необязательно, замещенными одним или двумя заместителями, независимо выбранными из фтора, хлора, брома, йода, (СгС4)алкила, трифторметила, (dС4)алкокси, циано, нитро и гидрокси, или NR5R6 вместе образуют кольцо с 4-8 членами, в котором один атом является азотом, а другие являются атомами углерода, кислорода или азота, либо NR5COR6 вместе образуют циклическое лактамное кольцо с 4-8 членами, М представляет собой -СН- или азот, L представляет собой фенил, фенил-(Сі-Сб)алкил, циннамил или пиридилметил, где фенильные части указанных фенил ьной и фенил-(Сг О ю 45944 Сє)алкильной групп могут быть, необязательно, пиперидинил]этил]-6Н-пирроло[4,5-т]-1,2замещены 1-3 заместителями, независимо выбензизоксазол-6-он, бранными из (С-і-Сб)алкила, (Сі-Сє)алкокси, ( d 1 - [2- [ 1 -(фенил метил)-4-пиперидинил] С^алкоксикарбонила, (Сі-С^алкокси карбон и лэтил]изохинолин, 5 6 5 OCONR R , NHCOOR или галогена, либо L пред3-[2-[1-(фенилметил)-4-пиперидинил]этил]-1,2ставляет собой группу формулы (К) бензизотиазол, 4-[2-[1-(фенилметил)-4-пиперидинил]этил]-1,313 хиназолин, 6-гидрокси-З[2[ 1 -(фенил метил)-4•(CH2)b пиперидил]этил]-1,2-бензизоксазол, 6-бромо-3-[2-[1-(фенил метил)-4-пиперидил]этил](К), 1,2-бензизоксазол, где b является целым числом от 1 до 4, R и R 6-циано-3-[2-[ 1 -(фенилметил)-4-пиперидил]этил]независимо выбирают из водорода, (СгС^алкила, 1,2-бензизоксазол, галогена и фенила, Е и F независимо выбирают из 6-карбоксамид-3-[2-[1-(фенил метил)-4-СН- и азота, G является кислородом, серой или пиперидил]этил]-1,2-бензизоксазол, NR4, где R4 определен выше, при условии, что 3-[( 1 -фенилметил-4-пиперидил)метокси]-1,213 если Е и F оба являются азотом, то один из R и бензизоксазол, _ 14 3-[( 1 -фенилметил-4-пиперидил)метиламино]-1,2R отсутствует, бензизоксазол, R7 и R независимо выбирают из водорода, ( d 3-[(1-фенилметил-4-пиперидил)этиламино]-1,2Сб)алкила, (С1-Сб)алкоксикарбонила, (dбензизоксазол, Сб)алкилкарбонила и (Сі-Сє)алкокси, при условии, 3-[3-[1 -(фенилметил)-4-пиперидил]пропил]-1,2что указанная (Сі-Сє)алкоксигруппа не связана с бензизоксазол, атомом углерода, который является соседним с транс-3-[2-[1-(фенил метил)-4-пиперидил]этенил]атомом азота, 1,2-бензизоксазол, при условии, что М является -СН-, если Y является -(СНгіз-, X является кислородом, R' является 3-[2-[ 1 -(фенилметил)-4-пиперазинил]этил]-1,2фтором, a R2 является водородом, бензизоксазол, или фармацевтически приемлемые соли указан5,7-дигидро-7-метил-3-[2-[1-(фенилметил)-4ных соединений пиперидинил]этил]-6Н-пирроло[4,5-т]-1,22 Гетероцикло-циклические производные аминов бензизоксазол-6-он, по п 1, где X представляет собой серу или кисло5,7-дигидро-7-этил-3-[2-[1-(фенилметил)-4род, Y представляет собой -СН2-СН2- или -СН2-, M пиперидинил]этил]-6Н-пирроло[4,5-т]-1,2представляет собой - СН-, a L представляет собой бензизоксазол-6-он, бензил, R1 и R2 представляют собой (Сі-Сє)алкил, 5,7-дигидро-3-[2-[1-(2-хлор-5-тиофенметил)-4(Сі-С6)алкокси, NR5R6 или NR5COR6, где R предпиперидинил]этил]-6Н-пирроло[4,5-т]-1,2ставляет собой водород или (С-і-Сб)алкил, J предбензизоксазол-6-он, ставляет собой кислород или серу, a Q представ5,7-дигидро-3-[2-[1-(2-метил-4-тиазолметил)-4ляет собой СН(СНз), СН(СНз)2, -СН=СН- или пиперидинил]этил]-6Н-пирроло[4,5-т]-1,2(СН2), бензизоксазол-6-он, 3 Гетероцикло-циклические производные аминов 3-[2-[1-(3-бромфенилметил)-4-пиперидинил]этил]по п 1, выбранные из группы, которая включает в 5,7-дигидро-6Н-пирроло[4,5-т]-1,2-бензизоксазолсебя 6-он, 3-[2-[1-(фенилметил)-4-пиперидинил]этил]-1,23-[2-[1-(4-бромфенилметил)-4-пиперидинил]этил]бензизоксазол, 5,7-дигидро-6Н-пирроло[4,5-т]-1,2-бензизоксазол5-метил-3-[2-[1-(фенилметил)-46-он, пиперидинил]этил]-1,2-бензизоксазол, 5,7-дигидро-3-[3-[1-(фенилметил)-45,6-диметил-3-[2-[1-(фенилметил)-4пиперидинил]пропил]-6Н-пирроло[4,5-т]-1,2пиперидинил]этил]-1,2-бензизоксазол, бензизоксазол-6-он, 5-мето кс и-3-[2-[1 -(фенил метил)-43-[2-[1-(фенилметил)-4-пиперидинил]этил]-5,6,8пиперидинил]этил]-1,2-бензизоксазол, тригидро-7Н-изоксазоло[4,5-д]хинолин-7-он, 6-метокси-З[2[ 1 -(фенил метил)-46,8-дигидро-3-[2-[1-(фенилметил)-4пиперидинил]этил]-1,2-бензизоксазол, пиперидинил]этил]-7Н-пирроло[5,4-д]-1,27-метокси-3-[2-[ 1 -(фенил метил)-4бензизоксазол-6-он, пиперидинил]этил]-1,2-бензизоксазол, 5,7-дигидро-3-[2-[1-(фенилметил)-46-ацетамидо-3-[2-[1-(фенил метил)-4пиперидинил]этил]-6Н-пирроло[5,4-т]-1,2пиперидинил]этил]-1,2-бензизоксазол, бензизоксазол-6-он, 6-амино-3-[2-[1 -(фенилметил)-43-[2-( 1 -(фенил метил)-4-пиперидинил)этил]-1 Нпиперидинил]этил]-1,2-бензизоксазол, индазол, 6-бензамид-3-[2-[ 1 -(фенил метил)-4и фармацевтически приемлемые соли таких сопиперидинил]этил]-1,2-бензизоксазол, единений 6-бензолсульфонамид-3-[2-[1-(фенил метил)-44 Гетероцикло-циклические производные аминов пиперидинил]этил]-1,2-бензизоксазол, по п 1, которые выбирают из группы, включающей б-(морфолинил) -3-[2-[1-(фенил метил)-4в себя, пиперидинил]этил]-1,2-бензизоксазол, 3-[2-[1-(фенилметил)-4-пиперидинил]этил]-1,25,7-дигидро-3-[2-[1-(фенилметил)-4бензизоксазол малеат, 45944 предупреждения болезни Альцгеймера, отли5,6-диметил-3-[2-[1-(фенилметил)-4пиперидинил]этил]-1,2-бензизоксазол малеат, 5чающийся тем, что пациенту вводят эффективметокси-3-[2-[1-(фенилметил)-4ное для улучшения памяти количество соединепиперидинил]этил]-1,2-бензизоксазол малеат, ния формулы (I) по п 1 7-метокси-3-[2-[ 1 -(фенил метил)-412 Способ получения гетероцикло-циклических пиперидинил]этил]-1,2-бензизоксазол фумарат, производных аминов общей формулы (1-А) 6-бензамид-3-[2-[ 1 -(фенил метил)-4пиперидинил]этил]-1,2-бензизоксазол малеат, 6-бензолсульфонамид-3-[2-[1-(фенил метил)-4пиперидинил]этил]-1,2-бензизоксазол фумарат, и 1 -[2-[ 1 -(фенилметил)-4пиперидинил]этил]изохинолин малеат R' 5 Соединения формулы 1-А), где R1 и R2 независимо выбирают из водорода, (С-і-Сб)алкокси, бензилокси, фенокси, гидрокси, фенила, бензила, галогена, нитро циано, COR5, COOR5, CONHR5, NR5R6, -NR5COR6, OCONR5R6, NHCOOR5, (Сі-Сє)алкила, необязательно замещенного 1-3 атомами фтора, БОрСЬ^-фенила или где W является уходящей группой, j является цеЗОр(Сі-Сб)алкила, где р = 0, 1 или 2, пиридилме10 лым числом от 0 до 2, R представляет собой тилокси, тиенилметилокси, 2-оксазолила, 2азотзащитную группу, и R7 и R независимо выбитиазолила и бензолсульфонамида, где фенильрают из водорода, (С-і-Сб)алкила, (Сг ные части указанных фенокси, бензилокси, фениСб)алкоксикарбонила, (Сі-Сє)алкилкарбонила и льной, бензильной и бензолсульфонамидной (С-і-Сб)алкокси, при условии, что указанная ( d групп, пиридильные и тиенильные части указанСб)алкоксигруппа не связана с атомом углерода, ных пиридилметокси- или тиенилметокси-групп и который является соседним с атомом азота, оксазолильные и тиазолильные части указанных в качестве промежуточных соединений 2-оксазолильной и 2-тиазолильной групп могут 6 Гетероцикло-циклические производные аминов быть, необязательно, замещены 1 или 2 заместипо п 1 формулы телями, независимо выбранными из галогена, ( d С^алкила, трифторметила, (СгС^алкокси, циано, R7 нитро или гидрокси, (), R ' N-R" ^-Y-M Rl где R1, R2, R7, R8, Х , У и М определены в п 1, a R11 представляет собой, водород или азотзащитную группу 7 Соединения формулы R7 либо R1 и R , если они связаны с соседними атомами углерода, и если X является кислородом, серой или NR4, где R4 является водородом или (Cretanкилом, могут образовывать вместе с атомом углерода, с которым они связаны, группу формулы VT R ИЛИ . ОN где R1, R2, R7, R8 и L определены в п 1, a Y' представляет собой -СН=СН-(СН2)п- или -(Cbhjm-, в качестве промежуточных соединений 8 Фармацевтическая композиция, отличающаяся тем, что содержит эффективное количество соединения формулы (І) по п 1 и фармацевтически приемлемый носитель, и предназначена для улучшения памяти или лечения и предупреждения болезни Альцгеймера 9 Фармацевтическая композиция по п 8, отличающаяся тем, что предназначена для ингибирования холинэстеразы у млекопитающего 10 Способ ингибирования холинэстеразы у млекопитающего, отличающийся тем, что этому млекопитающему вводят ингибирующее холинэстеразу количество соединения формулы (I) по п 1 11 Способ улучшения памяти или лечения, или ,0 (СН2)а В, где J является водородом, серой или NR , "а" = 1 или 2, R3 является водородом или (С-і-Сб)алкилом, a Q является кислородом, серой, NH, СНСНз, С(СНз)2, -СН=СН- или (СЬІ2)і, где I является целым числом от 1 до 3, X представляет собой кислород, серу, -СН=СН-, CH=N-, -N=CH-, -N=N- или NR , где R4 является водородом или (Cretanкилом, m является целым числом от 1 до 3, R7 и R8 независимо выбирают из водорода, ( d Сб)алкила, (С-і-Сбіалкоксикарбонила, (dСб)алкилкарбонила и (С-і-Сб)алкокси, при условии, что указанная (Сі-Сє)алкокси-группа не связана с атомом углерода, который является соседним с атомом азота, L представляет собой фенил-(Сі-Сб)-алкил, пири 45944 дилметил или группу формулы (К) —(CH 2 )b (К), где b является целым числом от 1 до 4, R и R независимо выбирают из водорода, (СгС^алкила, галогена и фенила, Е и F независимо выбирают из -СН- и азота, G является кислородом, серой или NR4, где R4 определен выше, при условии, что если Е и F оба являются азотом, то один из R13 и •1 О А А _ 14 R отсутствует, или их фармацевтически приемлемых кислотноаддитивных солей, причем указанный способ заключается втом, что (а) соединение формулы (VI) Настоящее изобретение относится к гетероцикло-циклическим аминным производным формулы I и к их фармацевтически приемлемым солям Соеденения формулы I являются ингибиторами холинэстеразы и могут быть использованы для улучшения памяти у пациентов, страдающих деменциеи и болезнью Альцгеимера Болезнь Альцгеимера обусловлена перерождением холинергических нейронов в базальном переднем мозге, которые играют фундаментальную роль в познавательных функциях мозга, включая память См , Becker и др , Drug Development Reseach, 12, 163-195 (1988) В результате такой дегенерации, у пациентов страдающих этим заболеванием, обнаруживается заметное снижение синтеза ацетилхолина, холинацетилтрансферазной активности, ацетилхолинэстеразной активности и поглощения холина Известно, ингибиторы ацетилхолинэстеразы являются эффективными средствами для повышения холинергической активности, и могут быть использованы для улучшения памяти у пациентов, страдающих болезнью Альцгеимера Посредством ингибировання ацетилхолинэстеразы, эти соединения способствуют повышению уровня нейротрансмиттера ацетилхолина в мозге, и тем самым способствуют улучшению памяти В вышеупомянутой работе Becker и др , указывается, что поведенческие изменения, имеющие место после ингибирования холинэстеразы, очевидно, соответствуют предсказанным пиковым уровням ацетилхолина в мозге В этой работе также обсуждается эффективность трех известных ингибиторов ацетилхолинэстеразы, а именно, физостигнина, метрифоната и тетрагидроаминоакридина Европейская патентная заявка ЕР А 0 229 391 относится к пиперидиновым производным формулы R1-X-A-R2 Европейская патентная заявка ЕР А 296560 откосится к циклическому аминовому соединению формулы R0 (VI), где R , R , X, m, R и R являются такими, как они определены выше, подвергают реакции с соединением формулы WL, где W является уходящей группой, a L является таким, как он определен выше, и (Ь) необязательно, соединение формулы (1-А), полученное данным способом, подвергают реакции с фармацевтически приемлемой солью О— &— г Q-K Настоящее изобретение относится к соединениям формулы н-ь /1/ где R1 и R2 независимо выбирают из водорода, (Сі-Сє)-алкокси, бензилокси, фенокси, гидрокси, фенила, бензила, галогена, нитро, циано, COR5, -COOR5, -CONHR5, -NR5COR6, -OCONR5R6, -NR5R, -NHCOOR5, (С1-С6)-алкила, необязательно замещенного 1-3 атомами фтора, БОрСНг-фенила или ЗОр(Сі-Сб)-алкила, где р = 0, 1 или 2, пиридилметилокси илитиенилметилокси, 2-оксазолила, 2-тиазолила, и бензолсульфонамида, где фенильные части указанных фенокси-, бензилокси-, фенильной, бензильной и бензолсульфонамидной групп, пиридинильные и тиенильные части указанных пиридилметилокси- или тиенилметилоксигрупп, и оксазолильные и тиазолильные части указанных 2-оксазол ильной и 2-тиазол ильной групп могут быть, но необязательно, замещенными 1 или 2 заместителями, независимо выбранными из галогено-, (Сі-С4)-алкила, трифторметила, (СгС4)-алкокси, циано, нитро, и гидрокси, либо R1 и R2, если они связаны с соседними атомами углерода, и если X является кислородом, серой или NR4, где R4 является водородом или (СгС4)-алкилом, могут образовывать вместе с атомами углерода, с которыми они связаны, группу формулы 45944 10 соседним с атомом азота Настоящее изобретение также относится к фармацевтически приемлемым кислым аддитивным солям соединений формулы I Примерами о таких фармацевтически приемлемых кислых аддитивных солей являются соли кислоты, птолуолсульфоновой кислоты, малеиновой кислоты, фумаровой кислоты, лимонной кислоты, янтарной кислоты, салициловой кислоты, щавелевой кислоты, бромистоводородной кислоты, фосфоргде J является кислородом, серой иле NR , "а" ной кислоты, метасулъфоновой кислоты, винной 3 = 1 или 2, R является водородом или (С-і-Сб)кислоты, ди-п-толуоилвинной кислоты, и миндальалкилом, a Q является кислородом, серой, NH, ной кислоты СНСНз, С(СНз)2, -СН=СН-, или (СН2)і, где L являНастоящее изобретение также относится к ется целым числом от 1 до 3, фармацевтической композиции, предназначенной X представляет собой кислород серу, для ингибирования холинэстеразы, и содержащей 4 4 СН=СН-, -CH=N-, -N=N-, или NR , где R является соединений формулы I или его фармацевтически водородом или (СгС4)-алкилом, приемлемую кислую аддитивную соль, и фармаY представляет собой -(СН2)т-, -СН=СН(СН2)Пцевтически приемлемый носитель 4 4 , -NR (CH2)n или -О(СН2)т-, где R определен выНастоящее изобретение также относится к ше, п является целым числом от 0 до 3, a m являспособу ингибирования холинэстеразы у млекопиется целым числом от 1 до 3, тающих, заключающемуся в том, что млекопиR и R6 независимо выбирают из водорода, тающему вводят определенное количество соеди(С-і-Сб)-алкила, фенила или бензила, где фенильнения формулы I или его фармацевтически ные части указанных фенильной и бензильной приемлемой кислой аддитивной соли, являющеегрупп могут быть, но необязательно, замещеннся эффективным для ингибирования холинэстераными одним или двумя заместителями, независизы мо выбранными из фторо-, хлоро-, бромо-, иодо-, Настоящее изобретение также относится к (Сі-С4)-алкила, трифторметила, (Сі-С4)-алкокси, 5 6 способу улучшения памяти, либо лечения или циано и гидрокси, либо NR R вместе образуют предупреждения болезни Альцгеймера у млекопикольцо с 4-8 членами, в котором один атом являтающих, заключающемуся в том, что млекопиется азотом, а другие атомы являются атомами тающему вводят определенное количество соедиуглерода, кислорода или азота (например, пирронения формулы I или его фармацевтически лидинил, пиперидинил, морфолино, пиперазинил, приемлемой кислой аддитивной соли, являющееили N-метилпиперазинил), либо NR5COR вместе ся эффективным для улучшения памяти, или для образуют циклической лактамовое кольцо с 4-8 лечения или предупреждения болезни Альцгейчленами, мера М представляет собой -СН- или азот, Настоящее изобретение также относится к соL представляет собой фенил, фенил-(Сі-Сє)единениям формулы алкил, циннамил, или пиридилметил, где фенильV ные части указанных фенильной и фенил-(Сі-Сє)алкильной групп могут быть, но необязательно, замещенными 1-3 заместителями, независимо выбранными из (Сі-Сє)-алкила, (Сі-Сб)-алкокси, (СгС4)-алкокси карбон ила, (С1-С4)алкилкарбонила, -OCONR5R6, -NRCOOR5 или галогено-группы, либо L представляет собой группу где W является уходящей группой, j равно цеформулы лому числу от 0 до 2, R ° является азот7 8 блокирующей группой, a R и R независимо выбирают из водорода, (С-і-Сб)-алкила, (С-і-Сє)алкокси карбон ила, (Сі-Сє)-алкилкарбонила и ( d Сб)-алкокси, при условии, что указанная (С-і-Сб)алкокси-группа не связана с атомом углерода, соседним с атомом углерода, который является где b является целым числом от 1 до 4, R и соседним с атомом азота Эти соединения могут R14 независимо выбирают из водорода, (С1-С4)быть использованы в качестве промежуточных алкила, галогено-группы, и фенила, Е и F независоединений в синтезе соединений формулы I симо выбирают из -СН- и азота, a G представляет Настоящее изобретение также относится к сособой кислород, серу или NR4, где R4 определен единениям формулы выше, при условии, что если Е и F оба являются азотом, то один из R и R отсутствует, R7 и R8 независимо выбирают из водорода, (С-і-Сб)-алкила, (Сі-Сб)-алкоксикарбонила, (С-і-Сє)алкилкарбонила, и (Сі-Сє)-( Сі-Сб)-алкокси, при условии, что указанная (Сі-Сє)-алкокси-группа не связана с углеродом, который является атомом, '«у. 12 45944 a Q является СН(СНз), слородом или серой, и их формацевтичеСН(СНз)2, -СН=СН или ски приемлемые соли 3-[2-[1-(Фенилметил)-4-пиперидинил]этил]-1,2бензизоксазол, 5-Метил-3-[2-[1 -(Фенилметил)-4пиперидинил]этил]-1,2-бензизоксазол, 5,6-Диметил-3-[2-[1-(фенилметил)-4пиперидинид]этил]-1,2-бензизоксазол, 5-Мето кс и-3-[2-[1 -(фенил метил)-4пиперидинил]этил]-1,2-бензизоксазол, 1 2 7 8 где R , R , R , R , X, и Y и М определены вы6-Мето кс и-3-[2-[1 -(фенил метил)-411 ше, a R является водородом или азотной защитпиперидинил]этил]-1,2-бензизоксазол, ной группой Эти соединения могут быть исполь7-Мето кс и-3-[2-[1 -(фенил метил)-4зованы в качестве промежуточных соединений в пиперидинил]этил]-1,2-бензизоксазол, синтезе соединений формулы I 6-Ацетамидо-3-[2-[1-(фенил метил)-4Настоящее изобретение также относится к сопиперидинил]этил]-1,2-бензизоксазол, единениям формулы 6-Амино-3-[2-[1 -(фенилметил)-4пиперидинил]этил]-1,2-бензизоксазол, /г? 6-Бензамид-3-[2-[1-(фенил метил)-4пиперидинил]этил]-1,2-бензизоксазол, 6-Бензолсульфонамид-3-[2-[1-(фенил метил)-4пиперидинил]этил]-1,2-бензизоксазол, 6-(4-Морфолинил)-3- [2- [1-(фенил метил)-4пиперидинил]-этил]-1,2-бензизоксазол, 5,7-Дигидро-3-[2-[1-(фенилметил)-4пиперидинил]этил]-6Н-пирроло [4,5-f]-1,2бензизоксазол-6-он, где R1, R2, R7, R8 и L определены выше, a Y' 1 -[2-[1 -(Фенилметил)-4является -СН=СН-(СН2)п- или -(-Cbhjm- Эти сопиперидинил]этил]изохинолин, единения могут быть использованы в качестве 3-[2-[1-(Фенилметил)-4-пиперидинил]этил]-1,2промежуточных соединений в синтезе соединений бензизотиазол, формулы I 4-[2-[1-(Фенилметил)-4-пиперидинил]этил]-1,3хиназолин, Используемый в настоящем описании термин "млекопитающее" включает в себя человека 6-Гидрокси-3-[2-[1-(фенил метил)-4Используемый в настоящем изобретениии пиперидил]этил]-1,2-бензизоксазол, термин "галогено" означает хлоро, бромо, иодо, 6-Бромо-3-[2-[1 -(фенилметил)-4или фторо пиперидил]этил]-1,2-бензизоксазол, Термин "алкил", используемый в настоящем 6-Циано-3-[2-[1 -(фенилметил)-4описании означает, если это не оговорено особо, пиперидил]этил]-1,2-бензизоксазол, насыщенные моновалентные углеводородные 6-Карбоксамид-3-[2-[1-(фенил метил)-4радикалы, имеющие разветвленные, прямые или пиперидил]этил]-1,2-бензизоксазол, циклические части или их комбинации 3-[(1-Фенилметил-4-пиперидил)метокси)]-1,2Термин "( СгС4)-алкилкарбонил" относится к бензизоксазол, 3-[(1-Фенил метил-4-пиперидил)метиламино]заместителю формулы 1,2-бензизоксазол, О 3-[2-[1-фенил метил)-4-пиперидил]этиламино]/V/ 1,2-бензизоксазол, С 3-[3-[1 -(Фенилметил)4-пиперидил]пропил]-1,2бензизоксазол, где R является (СгС4)-алкилом) транс-3-[2-[1 -(Фенилметил)-4Термин "(С-і-С^-алкоксикарбонил" относится к пиперидил]этенил]-1,2-бензизоксазол, заместителю формулы V, указанной выше, где R15 является (СгС4)-алкокси-группой 3-[2-[1-(Фенилметил)-4-пиперазинид]этил]-1,2бензизоксазол, Термин "(СгСб)-алкоксикарбонил" относится к заместителю формулы V, указанной выше, где R15 5,7-Дигидро-7-метил-3-[2-[1-(фенилметил)-4является (Сі-Сє)-алкокси-группой пиперадинил]-этил]-6Н-пирроло[4,5-1]-1,2бензизоксазол-6-он, Термин "(СгСб)-алкилкарбонил" относится к заместителю формулы V, указанной выше, где R15 5,7-Дигидро-7-зтил-3-[2[1-(фенилметил)-4является (С-і-Сб)-алкилом пиперидинил]этил]-6Н-пирроло[4,5-1]-1,2бензизоксазол-6-он, Предпочтительными соединениями настоящего изобретения являются соединения формулы I, 5,7-Дигидро-3-[2-[1-(2-хлоро-5-тиофенметил)в которых X является кислородом или серой, Y 4-пиперидинил]зтил]-6Н-пирррло-[4,5-ґ]-1,2является -СН2-, -СН2-СН2-, M является -СН-, являбензизоксазол-6-он, ется бензилом, R1 и R2 являются (СгСб)-алкилом, 5,7-Дигидро-3-[2-[1-(2-метил-4-тиазолметил)-45 6 5 6 (Сі-С6)-алкокси, NR R , или NR COR ,R является пиперидинил]этил]-6Н-пирроло[4,5-1]-1,2водородом или (С-і-Сб)-алкилом, J является кибензизоксазол-6-он, 11 о /г 13 45944 14 3-[2-[1 -(3-Бромофенилметил)-4нии, вводятся в настоящее описание посредством пиперидинил]5,7-дигидро-6Н-пирроло[4,5-1]-1,2ссылки SCHEME і Схема 1 бензизоксазол-6-он, 3-[2-[1 -(4-Бромофенилметил)-4пиперидинил]этил]-5,7-дигидро-6Н-пирроло[4,5-1]1,2-бензизоксазол-6-он, 5,7-Дигидро-3-[3[1-(фенилметил)-4пиперидинид]пропил]-6Н-пирроло[4,5-1]-1,2бензизоксазол-6-он, 3-[2-[1 -(Фенил метил)-4-пипперид инил]этил]5,6,8-тригидро-7Н-изоксазоло[4,5-д]хинолин-7-он, * prolet Ung 3t-oup 6,8-Дигидро-3-[2-[1-(фенилметил)-4защитная группа пиперидинил]этил]-7Н-пирроло[5,4-д]-1,27 К бензизоксазол-7-он, 5,7-Дигидро-3-[2-[1-(фенилметил)-4пипперидинил]этил]-6Н-пирроло[5,4-1]-1,2бензизоксазол-6-он, 3-[2-[1-(Фенилметил)-4-пиперидинил]этил]-1Ниндазол, и фармацевтически приемлемые соли указанных соединений Примерами других соединений Формулы I являются 6-Фениламино-3-[2-[1-(фенил метил)-4пиперидинил]этил]-1,2-бензизоксазол, 6-(2-Тиазолил)-3-[2-[1-(фенил метил)-4пиперидинил]-этил]-1,2-бензизоксазол, 6-(2-Оксазолил)-3-[2-[1-(Фенил метил)-4L is other than , пиперидинил]-этил]-1,2-бензизоксазол, pbeiiy I or с і ппая/І 6-Пиррол ид инил-3-[2-[1-(фенил метил)-4не является фенилом пиперидинил]-этил]-1,2-бензизоксазолил, или цшшамилом 6-Пиперидинил-3-[2-[1-(фенил метил)-4SCHEME 2 Схема 2 пиперидинил]этил-1,2-бензизоксазол, 5,7-Дигидро-5,5-диметил-3-[2-[1(фенилметил)-4-пиперидинил]этил]-6Нпирроло[4,5-1]-1,2-бензизоксазол-6-он, 5,7-Дигидро-3-[2-[1-(фенлметил)-4N-L пиперидинил]этил]-7-н-пропил-6Н-пирроло[4,5-1]онс 1,2-бензизоксазол-6-он, 5,7-Дигидро-3-[2-[1-(фенилметил)-4пиперидинил]этил]-7-пропил-6Н-пирроло[4,5-1]1,2бензизоксазол-6-он, 5,6-Дигидро-3-[2-[1-(фенилметил)-4пиперидинил]этил-6Н-пирроло[4,5-1]1,2бензизоксазол-6-он, 3[2-[1-(фенил метил)-4-пиперид инил]этил]-6фенилметилсульфон-1,2-бензизоксазол, 1 -Метил-3-[2-[1 -(фенилметил)-4X Н 1пиперидинил]этил]-1Н-индазол, и 3-[1-Фенил метил-4-пиперид инил)метил]1,2бензизоксазол N-L •си-сн Соединения формулы I могут иметь оптические центры, а поэтому могут существовать в виде различных изомерных форм В объем настоящего изобретения входят все стереоизомеры соединений формулы I, включая их смеси [-С Получение соединений формулы I и некоторых исходных материалов, используемых для синтеза этих соединений, проиллюстрировано в нижеприведенных реакционных схемах В этих реакционных схемах и в последующем их обсуждении R1, R2, R3, R4, R5, R6, R7, FT, R1J, R14, E, G, X, Y, M, L , a, b, I, m, n, p, и структуры I, А, В, и К являются такими, как они были определена выше, если это не оговорено особо Все статьи, монографии, патенты и патентные заявки, цитируемые в нижеприведенном обсужде 45944 15 16 Схема З Ш-£ N-R" Схема Ё . J I н-к '•Y И S S.CHEHE 4. ї-1 Схема 4 M_RtO HN , N-L M-R1Q XIV XI [I ы-н -L N-L основание l.l. b a s e , ТП£С1 и-о III N-L IS 111 является Получение соединений формулы I, в которых Y является -(Cbbjm и М является -СН-, проиллюстрировано на Схеме 1 Эти соединения изображены на Схеме 1 и обозначены как соединения формулы 1-А (где L представляет собой фенил-(Сі-Сє)алкил, пиридилметил или группу формулы К) и как соединения формулы 1-В (где представляет собой фенил или циннамил) В Схеме 1, соединения формулы 1А могут быть получены путем депротонирования соедине 17 45944 18 ния формулы II с использованием основания в нол и вода Температуры могут варьироваться в присутствии или с последующим добавлением пределах от около - 20°С и приб до температуры алкилирующего агента формулы III, где R10 предперегонки Предпочтительно использовать трифставляет собой азотзащитную группу, a W предторуксусную кислоту в метиленхлориде в отсутстставляет собой уходящую группу Если R10 являвие или в присутствии тиоанизола при около 0°С ется азот-защищающей группой, то в результате Альтернативно, если R10 является ВОС, то этой реакции образуется промежуточное соединеона может быть удалена с использованием триалние формулы IV Это промежуточное соединение кил сили лтрифторометансульфонатного произзатем подвергают разблокированию с получением водного, такого, как триметиленлил-, триэтилсивторичного пиперидина формулы VI в виде сволил-, или т-бутилдиметилсилилбодного основания или соли свободного основатрифторметансульфонат, в присутствии ароматиния, после чего указанное свободное основание ческого или третичного амилового основания, таили его соль алкилируют с использованием сокого, как 2,6-лутидин или триэтиламин Подходяединения формулы WL , где W определен выше, а щими растворителями для данной реакции L представляет собой фенил(Сі-Сб)-алкил, пириявляются неполярные растворители, такие, как дилметил или группу формулы К метиленхлорид, и полярные растворители, такие, как ТГФ, диэтиловый эфир или ДМФ ТемператуПримерами подходящих уходящих групп (W) ры могут варьироваться в пределах от около являются мезилат, тозилат, хлорид, иод ид или 20°С до комнатной температуры Для осуществбромид Примерами подходящих азот-защитных ления данной реакции предпочтительно испольгрупп (R10) являются амиды, такие, как N-фтормил зовать триметилсилилтрифторметан-сульфонат и и N-ацетил, и карбоматы, такие, как т2,6-лутидин в метиленхлориде при температуре бутоксикарбомат (ВОС) Предпочтительными от около 0°С и примерно до комнатной температуазот-защитными группами являются ВОС Подхоры дящими основаниями, используемыми для получения соединений формулы IV, являются сильные Промежуточный вторичный пиперидин фороснования, такие, как диизопропиламид лития мулы VI, полученный в виде свободного основа(LDA), н-бутиллитий, S-бутиллитий, и гексаметилния или соли, как описано выше, подвергают редисилазид лития или натрия, или калия (LiHMDS, акции с 2 - 10 эквивалентами основания, а затем с NaHMDS или KHMDS) Предпочтительными являалкилирующими агентом формулы WL , где W ются LDA и S-бутил-литий является группой, определенной выше, a L является фенил-(Сі-Сб)-алкилом, пиридилметилом иле Реакцию соединения формулы II с соединенигруппой формулы К Подходящими основаниями ем формулы III в основном, осуществляют в появляются третичные амины, такие, как триэтилалярном апротоном растворителе, таком, как димин и диизоцропилэтиламин, ароматические амиэтиловый эфир, 1,2-диметоксиэтан, или ны, такие, как пиридин и диметиламинопиридин, и тетрагидрофуран (ТГФ) Температура реакции карбонаты металлов, такие, как бикарбонат наможет варьироваться от около - 70°С до около трия, или карбонат натрия, калия или цезия Если 30°С Предпочтительно, если указанную реакцию W является хлоридом, то в качестве катализатора проводят в ТГФ при около - 70°С может быть добавлен йодид (йодид калия или В основном, соединения формулы II подвериодид тетра-н-бутиламмония) Подходящими расгают депротонированию в присутствии соединетворителями являются неполярные растворители, ния формулы III Однако, в случае, если соединетакие, как метиленхлорид, и полярные раствориние формулы II имеет более одного протона тели, такие, как диметилформамид, ТГФ, ацетокислоты, то предпочтительно сначала осуществнитрил, ацетон, диоксан, и спирты, такие, как мелять стадию депротонирования с последующим танол или этанол Реакцию алкилирования немедленным и быстрым добавлением алкилипредпочтительно проводить в присутствии трирующего агента формулы III этиламина в метиленхлориде при комнатной темЗащитная группа (R10) может быть удалена из пературе или в присутствии карбоната натрия в соединений формулы IV с образованием соответдиметилформамиде при комнатной температуре ствующих соединений формулы VI традиционными способами, хорошо известными специалистам Альтернативно, промежуточный вторичный Например, если R10 является ВОС или другим пиперидин формулы VI, в случае, если он был карбоматом, то эта группа может быть удалена с получен в виде соли после удаления защитной использованием кислоты, такой как бромоводород группы, может быть подвергнут депротонирова(газообразный или жидкий), хлороводород (газонию с получением свободного амина путем его образный или жидкий), или три фтору ксусная кирастворения или суспенднрования в соответстслота В случае использования трифторуксусной вующем растворителе (например, в метиленхлокислоты, может быть добавлен акцептор т-бутилриде или этиленацетате), смешивания с водным катионов, например, такой, как тиоанизол Если в бикарбонатом натрия или водным гидроксидом качестве разблокирующего агента используется натрия или калия, и выделения свободного амина кислота, то в результате будет продуцироваться из органического слоя с использованием станне свободное основание соединения формулы VI, дартной техники экстрагирования Полученный а его кислая аддитивная соль Подходящими рассвободный амин может быть затем подвергнут творителями являются неполярные расторители, алкилированию с использованием соответствуютакие, как метиленхлорид, а также полярные расщего алкилирующего агента формулы WL в услоторители, такие, как диэтиловый эфир, этилацевиях, описанных выше, и с использованием 1-2 тат, диоксан, спирты, например, метанол или этаэквивалентов соответствующего основания 19 45944 20 Исходные материалы формулы II могут быть ствующие оксимы, и замыкание кольца осуществполучены способами, хорошо известными специаляют непосредственно путем реакции с соответлистам Если X является кислородом, то исходные ствующим ацилирующим агентом, таким, как 3-метил-1,2-бензоизоксазолы могут быть получеуксусный ангидрид в основании, таком, как пирины способами, аналогичными описанным Wunsch дин Температура реакции может быть примерно и др Adv Heterocycl Chem , 1967, 8, 277, Smalley от комнатной температуры до около 130°С, а P К Adv Heterocycl Chem , 1981, 29, 2, и Тпакаг и предпочтительно около 120°С др , Indian J, Chem, 1977, 15B 1058 СоответстЕсли X является NR4, где R4 является водоровующие b-гидроксиацетофеноны могут быть предом, то исходные 3-метил-1Н-индазолы могут вращены в соответствующие оксимы с помощью быть получены в соответствии с методами, опиреакции с гидрохлоридом гидроксиламина в присанными Behr и др , "Pyrazoles, Purazolmes, Pyraсутствии соответствующего основания, такого, как zohdmes, Indazoles, and Condensed Ring", Heteroгидроксид калия или натрия, ацетат натрия или cychc Compounds, R H Wiley, Ed , 1967, 289, Barch пиридин, предпочтительно водный гидроксид каи др , J Heterocycl Chem , 1984, 21, 1063, Hannig и лия или водный ацетат натрия, в полярном расдр , Pharmazie 1976, 31, 534, Barton и др J Chem творителе, таком, как метанол, этанол, или вода, а Soc Chem Comm , 1982, 450, Ruechardi и др , Lieпредпочтительно, в этаноле, при температуре bigs Ann Chem , 1980, 908, и Ress и др, J Chem примерно от комнатной температуры до окло Soc D, 1971, 827 N-алкилирование 3-метил-1Н120°С Затем оксим превращают в соответствуюиндазолов (X = NR4, R4 = (СгС4-алкил) может щий оксимацетат путем ацетилирования с испольбыть осуществлено в соответствии с описанием зованием подходящего ацетилирующего агента, Behr и др , "Pyrazoles, Purazolmes,Pyrazohdmes, такого, как уксусный ангидрид Эта реакция может Indazoles, and Condensed Rinds", Heterocychc быть проведена при температурах примерно от Compounds, R H Wiley, Ed , I967, 309, Palmer и комнатной температуры до температуры перегондр , J Chem Soc Perktn Trans 11, 1975, 1695, и ки растворителя Предпочтительными являются Claramunt и др , Heterocycles 1985, 23, 2895 температуры 80 - 130°С Если Х является -СН=СН-, то исходные 1метилизохинолины могут быть получены методаРеакция замыкания кольца с образованием ми Bischler-Napieralksi или Pictet spengler (см , "Orбензизоксазолового кольца может быть проведена ganic Reactions", vol VI, главы 2 м 3, стр , 74-190, путем нагревания чистого оксим ацетата при темJohn Wilay & Sons Нью-Йорк, 1951) пературе от около 125°С до около 200°С при атмосферном давлении или пониженном давлении Если -N=CH-, то исходные 4-метилхиназолины например, от около 0,01мм рт ст (1,33 х 105бар) могут быть получены методами, описанными Byдо около 760мм рт ст (1,01 бар) Реакцию замыford и др , Indian J Chem, 1988, 27В, 396, Higaкания кольца предпочтительно проводить путем shmo T , Chem Pharm Bull, 1962, 10, 1043, и Uff и нагревания оксимацетата при температуре передр J Chem Soc Perkm Trans 1, 1986, 2295 гонки в соответствующем основании, таком, как Если X является -CH=N-, то исходные 1пиридин, или путем нагревания оксимацетата при метилфталазины могут быть получены методами, температуре около 130°С в полярном растворитеописанными Kant и др , J Heterocycl Chem , 1985, ле, таком, как ДМФ или ДМСО (диметилсульфок22, 1065 и работы, цитированные в настоящем сид) в присутствии нескольких эквивалентов соотописании, Acheson и др , J Chem Soc С, 1966, ветствуюего основания, такого, как пиридин или 2218, и Gabriel и др , Chem Вег 1987, 30, 3022 2,6-лутидин Если X является -N=N-, то исходные 4-метил1,2,3-бензотриазины могут быть получены метоАльтернативно, замыкание кольца может быть дами, описанными Adger и др , J Chem Soc Perkm осуществлено непосредственно из оксима с поTrans 1, 1975, 31, Boulton и др, Ibid, 1988, 1509, и мощью его реакции с ацил- или сульфонилхлориRees и др , J Chem Soc, D, 1971, 828 дом, таким, как оксалил- или тионилхлорид, в присутствии ароматического амина, такого, как Если R1 и R2 оба являются NH2, то исходный пиридин (см , Kalkate и др , Aust J Chem , 1977, материал формулы II может быть получен из соЗО, 1847) Подходящими растворителями являютответствующего NH Ac-предшественника (Ас = ся полярные растворители, такие, как диэтиловый ацетил) с помощью кислотного гидролиза Кислотэфир или ТГФ Температуры могут варьироваться ный гидролиз может быть осуществлен с испольв пределах от около 0°С и примерно до комнатной зованием соляной кислоты при температурах от температуры Другим способом замыкания кольца окло 50°С до около 120°С Однако, предпочтиявляется обработка оксима одним или менее эктельным является нагревание до температуры вивалентами основания, такого, как гидроксид перегонки (около 120°С) в Ін НСІ Соответствуюкалия, в полярном растворителе, таком , как метащие соединения NHBZ (BZ = бензоил) или нол, при температурах в пределах примерно от NHSO2C6H5 могут быть получены из соответсткомнатной температуры до около 100°С (Crabbe и вующих амино-производных с помощью реакции с др , J Chem Soc Perkm Trans 1, 1973, 2220) подходящим бензоилом или бензосульфонилхлоридом в присутствии основания, такого, как триЕсли Х является серой, то исходные 3-метилэтиламин, пиридин, или диметиламинопиридин 1,2-бензизотиазолы могут быть получены из оПодходящими растворителями являются метиметилтиоацетофенонов в соответствии с процеленхлорид, ТГФ, диэтиловый эфир, или диметилдурами, описанными выше для бензизоксазолов формамид Температуры реакции могут состав(см , McKinnon и др , Can J Chem , 1988, 66, 1405 лять от около - 20°С до около 80°С Если один или и работы, цитированные в настоящем описании) оба R1 и R2 являются NHBZ , то предпочтительно b-Метилтиоацетофеноны превращают в соответ 21 45944 использовать триэтиламин/диметиламинопиридин в метиленхлориде при комнатной температуре Если один или оба R1 и R2 являются NHSC^Ph, то предпочтительно использовать пиридин в метиленхлориде при 0°С Циклические диалкиламино-соединения формулы II (те соединения, в которых один или оба R и R2 являются NR5R6, где NR5R6 вместе образуют кольцо) могут быть также получены из соответствующего амино-производного путем алкилиСначала получают соединение формулы рования с использованием соответствующего бисгде X является гидрокси, тиолом или метилсульгалоенидного реагента формулы фидом, путем ацилирования Фриделя-Крафта, соответствуоцего соединения формулы VII, где X является метокси или метилсульфидом, с помогде каждый А независимо является бромидом щью ацилирущего агента, такого, как ацетилхлоили хлоридом, а В является кислородом или рид или уксусный ангидрид, а предпочтительно (CH2)q, где О = 0, 1 или 2, в присутствии соответацетилхлорид, в присутствии кислоты Льюиса, ствующего основания, такого, как триэтиламин такой, как хлорид алюминия, террахлорид титана или диизопропилэтиламин (основание Хьюнига), в или трифторидэтеарат бора, а предпочтительно подходящем неполярном растворителе, таком, как хлорид алюминия Подходящими растворителями толуол или ксилол Алкилирование обычно осуявляются сероуглерод, 1,2-дихлорэтан, и нитроществляют при температуре примерно от комнатбензол Предпочтительными являются сероугленой температуры до около 150°С Предпочтительрод и 1,2-дихлорэтан В основном, эту реакцию но, если реакция протекает в присутствии осуществляют при температуре примерно от комоснования Хьюнига в толуоле при около 120°С натной температуры до около 200°С, а предпочти(температура перегонки) (См Verboom и др J тельно от около 50°С до около 100°С OrgChem 1984, 49, 269) Альтернативно, соединение формулы VIII, где Альтернативно, эти циклические диалкиламиX является гидрокси-группой, может быть также но-производные могут быть получены путем нукполучено путем перегруппировки Фриса, которой леофильного замещения ароматического фторида подвергают соответствующее соединение формусоответствующим циклическим амином Подхолы VII, где VII является ацетилокси-группой дящими для этой реакции растворителями являСмесь соединения VII и кислоты Льюиса, такой, ются полярные апротонные растворители, такие, как хлорид алюминия, трифторидэтерат бора или как д и мети л сульфоксид ДМСО), диметилформатетрахлорид титана, нагревают при температуре мид (ДМФ), ацетонитрил, пиридин, и гексаметилот около 80°С до 200°С в отсутствие или в присутфосфорамид Предпочтительными являются ацествии растворителя, такого, как нитробензол или тонитрил и пиридин Реакция может протекать в 1,2-дихлоратн Предпочтительно, если перегрупприсутствии основания, такого, как третичные или пировку Фриса проводят без растворителя с исароматические амины (например, триэтиламин, пользованием хлорида алюминия при 170 - 190°С диизоцропилэтиламин, пиридин или диметиламиСоединения формулы VIII, полученные вышенопиридин), а предпочтительно пиридин или триуказанным способом, могут быть превращены в этиламин Реакция может быть осуществлена при соответствующие исходные соединения формулы температуре примерно от комнатной и до около II с помощью процедуры, описанной выше для 1,2160°С, а предпочтительно от около 80°С до около бензизоксазолов и 1,2-бензизотиазолов 160°С В Схеме I, соединения формулы III могут быть Если R1 и R2 вместе с атомами углерода, с кополучены из соответствующих соединений, в которыми они связаны, образуют группу формулы торых W является гидроксигруппой, стандартными способами Например, соединения формулы III, где W является йодидом, могут быть получены с помощью реакции гидрокси-противочасти с йодидом и трифенилфосфином в присутствии основания, такого, как пиридин или имидазол в неполярном растворителе, таком, как бензол или толуол, при температуре примерно от комнатной до около 130°С Предпочтительно, если реакция протекает в бензоле в присутствии пиридина при около 90°С (температура перегонки) а X является кислородом или серой, то исходные соединение формулы II может быть получено с помощью процедуры, показанной ниже, и проиллюстрированной лишь для случаев, когда R и R2 образуют группу формулы А Соединения формулы І-В могут быть получены путем депротонирования соединения формулы II с использованием основания в присутствии или с последующим добавлением алкилирущего агента формулы III, где R10 является фенилом или циннамилом, a W является таким, как он был определен выше Подходящие и предпочтительные основания, растворители и условия являются такими же, как были описаны выше для получения 23 45944 24 соединений формулы IV фосфониевую соль путем обработки трифенилфосфином в неполярном растворителе, таком, как На схеме 2 проиллюстрировано получение бензол, толуол или ксилол, а предпочтительно в соединений формулы I, где Y является толуоле, при температуре примерно от комнатной СН=СН(СН2)п-, путем альдольной конденсации температуры до около 150°С, а предпочтительно Эти соединения обозначены на Схеме 2 как соот около 80°С до около 120°С Фосфониевая соль единения формулы 1С Согласно этой схеме, соможет быть затем подвергнута депротонированию единение формулы IX, где R9 является водорос использованием сильного основания, такого, как дом, подвергают депротонированию с гидрид натрия, т-бутоксид калия, гидрид калия, использованием основания и с последующим неили н-бутиллитий, в подходящем растворителе, медленным и быстрым добавлением альдегидах таком, как диэтилрвый эфир или ТГФ, при темпеПодходящими основаниями и растворителями ратуре от около 0°С до около 80°С Предпочтиявляются основания и растворители, описанные тельно, если депротонирование протекает в привыше для первой реакции, проиллюстрированной сутствии гидрида натрия в ТГФ примерно при на Схеме I Реакция может протекать при темпекомнатной температуре ратуре от около - 78°С и примерно до комнатной температуры Предпочтительно, если данную реСхема 2 иллюстрирует альтернативное полуакцию проводят с использованием диизопропилачение соединений формулы I, где X является кимида лития в ТГФ при около - 78°С с последуюслородом или NR , Y является (СН2)т или щим назреванием до комнатной температуры СН=СН(СН2)п, а М является углеродом (те , -СН) Если в процессе реакции образуется промеНа схеме 2 эти соединения обозначены как сожуточный спирт, то он может быть дегидрирован с единения формулы 1-F ( т е , соединения в котополучением олефина в стандартных кислотных рых Y является -СН=СН(СН2)п а п' представляет условиях при помощи кислоты, такой, как разбавсобой целое число от 0 до 3), и как соединения ленная соляная кислота, п-толуолсульфоновая формулы I-G (т е , соединения, в которых Y являкислота, или п-толуолсулъфонат пиридиния, а ется (СН2)т, а п' представляет собой целое число предпочтительно, при помощи пот 0 до 1) В Схеме 2, соединения формулы I-F могут быть получены путем депротонировання толуолсульфоновой кислоты, в растворителе, тасоединения формулы XV с использованием соотком, как бензол, толол, ТГФ, или метиленхлорид, ветствующего основания и с последующим допри температуре от около 0°С до около 130°С бавлением альдегида формулы XVI, и в результаПредпочтительно, если гидрирование проводят в те этой реакции образуется промежуточное бензоле при около 80°С (температура перегонки) с соединение формулы XVII Это промежуточное азетропным удалением воды Дегидрирование соединение затем превращают в соединения, может быть также осуществлено посредством формулы I-F с помощью реакции с соответствуюобработки реагентом Берджесса (Et3+NSO2 щим амином NCC^Me) в метиленхлориде или бензоле примерно при температуре от комнатной до около 80°С Подходящими основаниями для использования в получении соединений формулы XVII являАльтернативно, промежуточный спирт может ются диизопропиламид лития, гексаметилдисилабыть превращен в хорошую уходящую группу, зид лития, натрия или калия, или н-бутиллитий, а такую, как мезилат или тозилат, с последующим предпочтительными основаниями являются дииэлиминированием с помощью соответствующего зопропиламид лития или гексаметилдисилазид основания Мезилат или тозилат могут быть полулития Реакцию соединения формулы XV с соедичены в стандартных условиях путем осуществленением формулы XVI, в основном, осуществляют ния реакции между спиртом и метил сул ьфон илв полярном апротонном растворителе, таком, как хлоридом или п-толуолсульфонилхлоридом в диэтиловый эфир, 1,2-диметоксиэтан, или тетраприсутствии основания, такого, как триэтиламин, гидрофуран Температуры реакции могут составдиизоцропиламин, или пиридин Подходящими лять от - 78°С до 80°С Предпочтительно, если растворителями являются метиленхлорид и ТГФ, данная реакция протекает в ТГФ при - 78°С с попричем, из них предпочтительным является метиследующим нагреванием до комнатной темпераленхлорид Реакция может быть проведена при туры температуре от около 0°С до около 60°С, а предпочтительно от около 0°С и примерно до комнатСоединение форглулы I-F затем получают из ной температуры Затем может быть осуществлепромежуточного соединения формулы XVII при но элиминирование с образованием олефина, помощи реакции с амином, таким, как гидразин которое проводят с использованием основания, или гидроксиламин, в присутствии основания, татакого, как диазабициклоундекан или диазабицикого как гидроксид натрия или калия, карбонат клононан, в соответствующем растворителе, атанатрия или калия, или алкоксид натрия или калия ком, как бензол, метиленхлорид, или ТГФ, а пред(метоксид или этоксид), а предпочтительно гидропочтительно в бензоле или метиленхлориде, при ксида натрия или калия В некоторых случаях, температуре от около 0°С до около 100°С, а предесли амином является гидразин, добавление оспочтительно примерно от комнатной температуры нования не является обязательным Подходящии до около 100°С ми для этой реакции растворителями являются Соединения формулы І-С могут быть также получены с помощью реакции Виттигаиз соединений формулы IX, где R9 является бромом, хлором или йодом Согласно этой процедуре, соединение формулы IX превращают в его метанол, этанол, і -пропанол, вода, либо, если амин является гидразином, то растворителем может быть сам гидразин, температурный диапазон составляет от около 50°С до 120°С Однако, предпочтительно, чтобы соединение XVII подвергалось 25 45944 26 реакции с гидразином при 120°С (температура ванию с использованием соответствующего осноперегонки), либо с гидроксиламином и гидроксивания, после чего добавляют соответствующее дом калия в ЕЮН/воде при 100°С (тем-pa пересоединение формулы XI, и полученную смесь нагонки) После реакции с гидроксиламином, полугревают Примерами подходящих оснований явченный промежуточный оксим может быть ляется натрий, гидрид натрия, и гидрид калия, выделен, а затем циклизован с получением сопричем, предпочтительным является гидрид наединения формулы I-F в соответствии с подходятрия Подходящими растворителями являются щими и предпочтительными условиями, описанТГФ, ДМФ и ДМСО, при этом, предпочтительными ными выше для получения исходных соединений являются ТГФ и ДМФ Эту реакцию, в основном, З-метил-1,2-бензизоксазолов проводят при температуре от около 40°С до около 160°С Предпочтительными температурами являСоединения формулы 1-G могут быть получеются от около 60°С до около 160°С ны путем восстановления промежуточного соединения формулы XVII с получением соединения Альтернативно, соединения формулы I-D моформулы XVIII Затем, промежуточное соединение гут быть получены с помощью реакции соединеформулы XVII может быть подвергнуто реакции с ния формулы XI с нуклеофилом формулы XIX, где амином с получением соединения формулы I-G Z и R10 определены выше В результате этой реПромежуточное соединение формулы XVII восакции образуется промежуточное соединение станавливают до промежуточного соединения формулы XXX, которое затем подвергают разблоформулы XVIII с использованием газообразного кированию и получают вторичный пиперидин водорода в присутствии катализатора, такого, как формулы XXI в виде свободного основания или палладированный уголь, оксид платины, или соли свободного основания, после чего это своуголь, покрытый родием, а предпочтительно, в бодное основание или его соль алкилируют с исприсутствии окиси платины в полярном растворипользованием соединения формулы WL, где W теле, таком, как этилацетат, тетрагидрофуран, является таким, как он был определен выше, a L этанол, или уксусная кислота, а предпочтительно, является фенил-(Сі-Сє)-ал килом, пирид ил метив ЕЮН Давление может варьироваться от атмолом, или группой формулы К сферного до 50фунт/кв дюйм (3,45бар), а предПодходящими и предпочтительными основапочтительно 40 - 50фунт/кн дюйм (2,76 - 3,45бар), ниями, растворителями и условиями для реакции а температура может варьироваться в пределах соединения формулы XI с нуклеофилом формулы от комнатной температуры до 80°С, а предпочтиXIX являются основания, растворители и условия, тельной температурой является комнатная аналогичные тем, которые были описаны для реСоединения формулы I-G могут быть затем получены из промежуточного соединения формулы XVIII при подходящих и предпочтительных условиях, описанных выше для получения соединения формулы I-F из промежуточного соединения формулы XVII На Схеме 3 проиллюстрировано получение соединений формулы І, в которых Y является О(СН2)т- или -NR (Cbbjm Эти соединения в Схеме 3 обозначены формулой I-D В Схеме 3, соединения формулы I-D могут быть получены с помощью реакции соединения формулы XI, где R12 является хлоро- или бромо-группой, с нуклеофилом формулы XII, где Z является -NHR 4 или -ОН Если Y является NR4(CH2)m (т е , Z является NHR4), то амин формулы XII обычно подвергают реакции с соответвующим соединением формулы XI либо в отсутствие растворителя, либо в полярном растворителе, таком, как диметилформамид (ДМФ), д и мети л сульфоксид (ДМСО), ТГФ или пиридин Предпочтительными растворителями являются ДМСО и ДМФ Может быть также добавлен акцептор кислоты, такой, как диазабициклоундекан, пиридин, лутидин, триэтиламин, или карбонаты металлов, такие, как карбонат калия, натрия или цезия Предпочтительными являются карбонаты металлов, например, карбонат цезия Реакция может быть осуществлена при температуре примерно от комнатной до около 160°С, а предпочтительно от около 100°С до около 160°С Если Y является О(СН2)т (т е , Z является ОН), то образуется анион алкоксида, который реагирует с соединением формулы XI Согласно этой процедуре, спирт (XII) подвергают депротониро акции соединения формулы XI с нуклеофилом формулы XII для получения соединений формулы I-D Подходящими и предпочтительными основаниями, растворителями, и условиями для превращения соединений формул XX и XXI в соединения формул I-D являются основания, растворители и условия, аналогичные тем, которые были описаны в Схеме I для реакции соединений формул IV в VI с получением соединений формулы 1А В Схеме 4 проиллюстрировано получение соединений формулы I, где Y является -(СН2)т - и М является азотом Эти соединения в Схеме 4 в далее обозначаются как соединения формулы 1-Е В этой Схеме 4, соединение формулы XIII, где R12 является хлоро-, бромо- или иодо-группой, подвергают реакции с соединением формулы XIV Эта реакция может быть осуществлена в присутствии акцептора кислоты, такого, как пиридин, 2,6лутидин или карбонат металла (например, бикарбонат натрия или карбонат натрия и калия) Если R12 является хлоро- или бромо-группой, то может быть добавлено каталитическое количество активатора замещения Примерами подходящих активаторов замещения являются иодид натрия, иодид калия, или иодид тетра-н-бутиламмония В основном, эту реакцию проводят в неполярном растворителе, таком, как толуол или ксилол, или в полярном растворителе, таком, как ТГФ, ДМФ или ДМСО, а предпочтительно в ксилоле или ДМФ, при температуре примерно от комнатной до около 160°С, а предпочтительно от около 90°С до около 160°С На Схеме 5 проиллюстрировано получение соединений формулы I, где X является -N=CH-, a М является углеродом ( т е , -СН) На Схеме 5 и 27 45944 28 далее эти соединения обозначены как соединения пользованием соединения формулы WL, где W формулы 1Н На этой схеме, соединения формуопределен выше, a L представляет собой фелы II могут быть депротонированы с использованил (С-і-Сб)-алкил, пиридилиетил, или группу форнием одного эквивалента основания и с послемулы К дующим добавлением одного эквивалента Превращение соединения формулы IV" в прооснования и с последующим добавлением силимежуточное соединение формулы XXII осуществлирующего депротонирования с использованием ляют с использованием сульфида фосфора, таковторого эквивалента того же основания и послего, как пентасульфид фосфора (P2S10 или реагент дующего добавления алкилирующего агента форІ_а\л/е55оп[2,4-бис(4-метоксифенил)-1,3-дитиа-2,4мулы III с соответствующей обработкой получают дифосфенат-2,4-дисульфид] в неполярном распромежуточное соединение формулы IV Это протворителе, таком, как бензол, толуол, или ксилол межуточное соединение затем подвергают разТемпературы реакции могут составлять 50 блокированию как описано в Схеме I, и получают 160°С Предпочтительно, если реакция протекает вторичный пиперидин формулы VI в виде свободв присутствии реагента Lawesson в толуоле при ного основания или его соли, после чего это сво80°С Подходящими и предпочтительными услободное основание или его соль подвергают алкивиями для трансформации промежуточных соедилированию с использованием соединения нений формулы XXII в соединения формулы 1І формулы WL, где W определен выше, a L предявляются условия, аналогичные тем, которые быставляет собой фенил (С-і-Сб)-алкил, пиридилмели описаны в Схеме I для получения соединений тил, или группу формулы К формулы 1А Подходящими основаниями, растворителями и температурами для депротонирования соединения формулы II являются основания, растворители и температуры, аналогичные тем, которые были описаны выше для первой реакции Схемы І, а предпочтительно LDA в ТГФ при температуре от 0°С до комнатной температуры После добавления первого эквивалента основания, добавляют силилирующий агент, такой, как триметилсилилили триэтилсилилхлорид, а предпочтительно триметилсилилхлорид Затем добавляют второй эквивалент того же самого основания с последующим добавлением алкилирующего агента формулы III Триметилсилильную группу затем удаляют в кислотных условиях путем размешивания сырой реакционной смеси с разбавленной соляной кислотой при комнатной температуре в течение 30 - 60 минут После этого, сырую реакционную смесь подщелачивают водным карбонатом натрия, или водным гидроксидом натрия или калия, а предпочтительно водным гидроксидом натрия, и промежуточное соединение формулы IV экстрагируют органическим растворителем с помощью стандартной техники экстрагирования Подходящими и предпочтительными условиями для трансформации промежуточных соединений формулы IV в соединения формулы 1-Н являются условия, аналогичные тем, которые были описаны в Схеме I для получения соединений формулы 1А Схема 6 иллюстрирует получение соединений (формулы I, где, Y является (СНгіт, М является углеродом (т е -СН-), J является серой, a Q является СНСНз, С(СНз)2, -СН=СН или (СН2)і На Схеме 6 эти соединения обозначены как соединения формулы 1І В Схеме 6, соединение формулы 1І может быть получено из соответствующего соединения формулы IV", где J" является кислородом, при помощи реакции этого соединения с сульфидом фосфора, в результате которой образуется промежуточное соединение формулы XXII Затем это промежуточное соединение подвергают разблокированию, как описано в Схеме I, и получают вторичный пиперидин формулы VI" в виде свободного основания или соли свободного основания, после чего указанное свободное основание или его соль подвергают алкилированиго с ис Схема 7 иллюстрирует получение соединений формулы I, где Y является (СНгіт, М является углеродом (т е , -СН-), a R3 является (С-і-Сє)алкилом На Схеме 7, эти соединения обозначены как соединения формулы I-J На этой Схеме, соединение формулы I-J моежт быть получено из соответствующих соединений формулы IV", где R3 является водородом, путем депротонирования с помощью основания, и с последующим добавлением соответствующего алкилирующего агента (предпочтительно (СгСб)-акилхлорида, бромида или иодида), в результате чего получают помежуточное соединение формулы XXIII Это промежуточное соединение затем подвергают разблокированию как описано в Схеме I, и получают вторичный пиперидин формулы VI в виде свободного основания или соли свободного основания, после чего это основание или соль подвергают алкилированию с помощью соединения, формулы WL, где W определен выше, a L представляет собой фенил-(Сі-Сб)-алкил, пирид ил метил, или группу формулы К Подходящими основаниями для превращения соединения формулы IV в соединение формулы XXIII являются гидрид натрия, гидрид калия, диизопропиламид лития, или н-бутиллитий, а предпочтительным основанием является гидрид натрия Обычно, реакцию осуществляют в полярном растворителе, таком, как тетрагидрофуран, диметилформамид, или 1,2-диметоксиэтан, при температуре в пределах - 78° - 80°С Предпочтительно, если эта реакция протекает в диметилформамиде при комнатной температуре Подходящими и предпочтительными условиями для превращения промежуточных соединений формулы XXIII в соединения формулы I-J являются условия, аналогичные тем, которые были описаны в Схеме I для получения соединений формулы 1А Альтернативно, соединение формулы I-J может быть получено непосредственно из соответствующего соединения формулы 1А , где L предсобой фенил-(Сі-Сб)-алкил, ставляет пиридилметил, или группу формулы К, a R является водородом или І-В', где L является фенилом или циннамилом, a R3 является водородом Соединения формулы 1-А' и 1-В' получают способами, 29 45944 30 описанными в Схеме I для получения соединений формулам І-А-І-могут быть получены способами, 1А и 1-В Подходящими и предпочтительными сонепосредственно вытекающими из вышеописанединениями, растворителями и условиями для ных процедур, или другими хорошо известными трансформации соединений формулы 1А и 1-В в способами соединения формулы I-J являются основания, В каждой из вышеописанных реакций, давлерастворители и условия аналогичные тем, котоние не является критическим параметром Обычрые описаны выше для получения соединений но, давление составляет в пределах от около 0,5 формулы XXIII Затм (0,5 - Збар), и для удобства предпочтительно использовать давление окружающей среды Если один или оба R1 и R2 являются ОН, то ( т е , около 1атм) Кроме того, для тех реакций, соединения формулы I могут быть получены из где предпочтительная температура колеблется в соответствующего -ОМе-предшественника путем зависимости от конкретных реагентов, нельзя укадеалкилирования с использованием кислоты зать какую-либо предпочтительную температуру Льюиса, такой, как трихлорид алюминия, трихлоДля таких реакций, предпочтительные температурид бора, трибромид бора, или протонной кислоры для конкретных реагентов могут быть опредеты, такой, как водная хлористоводородная или лены путем контролирования реакции с помощью бромистоводородная кислота Для реакции с истонкослойной хроматографии пользованием кислот Льюиса, подходящими растворителями являются неполярные растворители, Соединения формулы I и их фармацевтически такие, как бензол, толуол, дихлорметан, или 1,2приемлемые соли (называемые далее "активными дихлорэтан Температуры могут составлять от соединениями настоящего изобретения") могут 78° до 120°С Предпочтительно, если реакция быть введены пациенту различными способами, протекает в присутствии водной бромистоводонапример, перорально в виде капсул или таблеродной кислоты (48%) при 100 - 120°С (тем-ра ток, парентерально в виде стерильных растворов перегонки) или суспензии, и в некоторых случаях, внутривенно в виде раствора Соединения настоящего изоЕсли один или оба R1 и R2 являются Nbb, то бретения в виде свободных оснований могут быть соединения формулы I могут быть получены из введены в виде их фармецевтически приемлемых соответствующего NHAc-предшественника (Ас = кислых аддитивных солей ацетил) путем кислого гидролиза в подходящих и предпочтительных условиях, описанных выше для Суточная доза активных соединений настояполучения исходных материалов формулы II, в щего изобретения обычно варьируется в пределах 1 2 которых один или оба R и R являются Nbb Соот около 1 до ЗООмг/день для среднего взрослого ответствующие нитриловые (-CN) соединения мочеловека, и может быть введена в виде разовой гут быть получены из соответствующих аминоили разделенной дозы соединений посредством образования диазониеПри парентеральном введении в виде раствовой соли с помощью реакции амино-соединения с ра или суспензии активные соединения настоящеазотистой кислотой (полученной из водной соляго изобретения присутствуют в концентрации, по ной кислоты и нитрита натрия) с последующей крайней мере, 1 масс %, а предпочтительно от нейтрализацией и добавлением к С и CN Подхооколо 4 до 70масс % (по полной массе стандартдящими растворителями являются полярные проной формы) Парентеральная стандартная форма тонные растворители, такие, как вода или двухобычно содержит от около 5 до 100мг активного фазные смеси с неполярными растворителями, соединения (или соединений) такими, как бензол, толуол, или ксилол НейтралиАктивные соединения настоящего изобзация может быть осуществлена путем добавлеретения могут быть введены перорально в сочения основания, такого, как карбонат натрия, картании с инертным разбавителем или съедобным бонат калия, гидроксид натрия или гидроксид носителем, либо они могут быть заключены в жекалия, до тех пор, пока рН не будет равен 7 Темлатиновые капсулы или спрессованы в таблетки пературы реакции могут составлять от - 20°С до Такие препараты должны содержать, по крайней 60°С При этом, предпочтительно, чтобы образомере, 0 5% активного соединения, но эта концентвание диазониевой соли протекало в воде при рация может варьироваться в зависимости от кон0°С, с последующей нейтрализацией при помощи кретной формы, и может составлять от 4 до карбоната натрия, и добавлением полученной 70%масс (по полной массе стандартной формы) диазониевой соли к двухфазной смеси водного Пероральная стандартная форма обычно содерCuCN и толуола при 0°С с последующим нагреважит 1,0 - 300мг активного носителя соединения нием до 50°С Способность активных соединений настоящего изобретения ингибировать холинэстеразу моЕсли одни или оба R1 и R2 являются карбокжет быть определена рядом стандартных биолосамидом (-CONH2) то соединения формулы I могут гических или фармакологических тестов Один из быть получены из соответствующего нитрилового таких методов определения ингибирования холи(-СІ\І)-предшественника при помощи его реакции с нэстеразы описан Ellman и др , "A New and Rapid основанием, таким, как гидроксид натрия, гидроColonmetric Determination of Acetychohnesterase ксид калия или гидроксид тетраметиламмония, в Activity", Biochem, Pharm , 1, 88 (1961) полярном растворителе, таком, как вода, метанол, этанол или т-бутанол Реакция может протекать Настоящее изобретение проиллюстрировано при температурах от комнатной до 120°С Предпримерами, приведенными ниже При этом следупочтительно, если реакцию осуществляют с гидет указать, что эти примеры не ограничивают изороксидом калия вт-бутаноле при 85 - 100°С бретения до конкретных деталей Приведенные точки плавления не скорректированы Спектры Соединения формулы I, не относящиеся к 31 45944 32 протонного магнитного резонанса ('Н-ЯМР) и спекслота, 1-(1,1-диметидэтил) сложный эфир тры С13-ядерного магнитного резонанса (С13-ЯМР) Трифенилфосфин (31,Ог, 0,119М) добавляли к измеряли для растворов в дейтерохлороформе смеси иода (29,Ог, 0,114М) в бензоле (1л) Через 5 (СВСІз) если только это не указано особо, а пикоминут добавляли пиридин (18,5мл, 0.228М), а завые положения выражали в миллионных долях тем спирт, полученный в стадия (Ь) (20,5г, (м д ) Формы пиков обозначали следующим обра0.095М) Полученную смесь нагревали с обратным зом с (синглет), д (дублет), т (триплет), кв (квархолодильником в течение 1,5 часов Затем смесь тет), м (мультиплет), шир (широкий) Все частоты охлаждали, фильтровали, а фильтрат промывай выражали в Герцах IM-растворы диизопропиланасыщенным тиосульфатом натрия (ЫагЗгОз) и мида лития были свежеприготовлены путем досолевым раствором, осушали сульфатом магния, бавления н-бутиллития (1,6 - 2,5М в гексанах) к фильтровали и концентрировали После очистки с раствору диизопропиламина в терагидрофуране помощью хроматографии на силикагеле (10% -> при 0°С 20% этилацетата/гексана) получали целевой иодид (28,5г, 92%) в виде прозрачного маслообразПример 1 ного продукта Этот продукт охлаждали и получа3-[2-[1-(Фенилметил)-4-пиперидинил]этил]-1,2ли белое твердое вещество Т пл 58 - 59°С бензизоксазол-малеат —й 'Н-ЯРМ (CDCI3) 5 4,09(ширд, 2Н, J = 13,1 Гц), 3,08(д, 2Н, J = 6,5Гц), 2,66(ширт, 2Н, J = 13,1 Гц), 1,80(ширд, 2Н, J = 12,9Гц), 1,52 - 1,64(м, 1Н), 1,43(с, 9Н), 1,11(ддд, 2Н, J = 24,7Гц), J = 12,7Гц, J = 4,3Гц) a) 1,4-Пиперидиндикарбоновая кислота, 1d) 4-[2-[1,2-Бензизоксазол-3-ил]этил]-1 (1,1диметидэтил) сложный эфир, 4-этиловый пиперидинкарбоновая кислота 1 -(1,1 сложный эфир диметилэтил) сложный эфир Раствор этилизонипекотата (20,Or, 0.127M) и Смесь З-метил-1,2-бензизоксазола (0,41 Ог, триэтиламина (17,8мл, 0.127М) в 1 1 -смеси диок3,08мМ) и иодида, полученного в стадии (с), (1,05г, сана и НгО (1,2л) охлаждали до 0°С Через 15 ми3,23мМ) в сухом ТГФ (3,2мл) охлаждали до - 78°С нут добавляли т-ВОС-акгидрид (35,2г, 0.161М) и Затем по капле добавляли свежеприготовленный полученную смесь оставляли на ночь для нагреIM диизопропиламид лития (LDA) (3,1мл, 3,1 мМ) и вания до комнатной температуры Затем смесь полученный желто-оранжевый раствор размешваэкстрагировали этилацетатом (4 раза) и объедили 25 минут при - 78°С После этого добавляли ненные органические слои промывали 1 н солянасыщенный хлорид аммония, и смесь экстрагиной кислотой, водой и солевым раствором, а заровали 3 раза этилацетатом Объединенный ортем осушали сульфатом магния, фильтровали и ганический слой промывали солевым раствором, концентрировали, в результате чего получали а затеи осушали сульфатом магния, фильтровали светло-оранжевое маслообразное вещество, А и концентрировали После очистки с помощью После дистилляции Kugelrohr (0,5торр (6,67бар), флеш-хроматографии на силикагеле (10% -> 20% 80 - 90°С) получали целевой карбамат (30,69г, этил ацетат/гексан) получали целевое соединение 94%) в виде бесцветного маслообразного продук(0,430г, 42%) в виде бесцветного маслообразного та вещества 1 Р-ЯМР (CDCI3) 5 4,11 (кв, 2Н, J = 7,2Гц), 3,97 - 4,05(м, 2Н), 2,80(шир ,т, 2Н, J = 11,6Гц), 2,40(тт, 1Н, J = 22,0Гц, J = 3,9Гц), 1,81 - 1,86(м, 2Н), 1,52 - 1,66(м, 2Н), 1,43(с, 9Н), 1,23(т, ЗН, J = 7,2Гц) b) 4-Гидроксиметид-1пиперидинкарбоновая кислота 1-1,1-диметилэтил сложный эфир Алюмогидрид лития (4,3г, 0.114М) добавляли к холодному (0°С) раствору карбомата, полученного в стадии а) (26,57г, 0,1 ОЗМ) в тетрагидрофуране ГГГФ) (1л) Через 30 минут, ледяную баню удаляли, и реакционную смесь размешивали в течение ночи при комнатной температуре Затем к смеси осторожно добавляли сульфатдекагидрат натрия до тех пор, пока не прекратиться выделение газа После 1-часового размешивания, смесь фильтровали через слой Целита™, а фильтрат концентрировали После перекристаллизации (из этилацетата/гексана) получали целевой спирт (20,67г, 93%) в виде белого твердого продукта 'Н-ЯРМ (CDCI3) 5 4,04 - 4,26(м, 2Н), 3,49(д, 2Н, J = 6,4Гц), 2,70(ширс, 2Н, J = 12,0Гц), 1,6 1,73(м, ЗН), 1,47(с, 9Н), 1,15(ддд, 2Н, J = 23,2Гц, J = 12,0Гц, и = 4,ЗГц) c) 4-Иодометил-1-пиперидинкарбоновая ки 'Н-ЯРМ (CDCI3) 5 7,62(д, 1Н, J = 8,0Гц), 7,49 7,55(м,2Н), 7,25 - 7,31 (м, 1Н), 4,09(м, 2Н), 3,00(т, 2Н, J = 7,8Гц), 2,66 (ширт, 2Н, J = 13,0Гц), 1,71 1,84(м, 4Н), 1,47 - 1,53(м, 1Н), 1,43(с, 9Н), 1,14(ддд, 2Н, и = 24,5Гц, J = 12,1 Гц, J = 4,1Гц) e) 3-[2-[1-(Фенил метил)-4-пиперидинил]этил]1,2-бензизоксазол-матеат Трифторуксусную кислоту (ТФК) (7мл) по капле добавляли к холодному (0°С) раствору пиперидина, полученного в стадии (d) (0,50г, 1,51мМ) в метиленхлориде (7мл) Полученный раствор размешивали 30 минут при 0°С Летучие вещества удаляли при пониженном давлении, а избыток ТФК удаляли путем кон-центрирования (2 раза) из толуола Сырой продукт снова растворяли в метиленхлориде (10мл), а затем добавляли триэтиламин (0,42мл, 3,01мМ) и бензилбромид (0,18мл, 1,51мМ) Полученную смесь размешивали в течение ночи (15 часов) при комнатной температуре Смесь промывали водой и солевым раствором, а затем осушали сульфатом магния, фильтровали и концентрировали После флеш-хроматографии на силикагеле (50% этил ацетат/гексан) получали целевое соединение свободное основание (0 350г, 73%) в виде бесцветного маслообразного продукта 33 45944 34 Малеат (соль) получали путем добавления и промывали этиловым эфиром Выход 0,70г, раствора малеиновой кислоты (0,108г, 0,930мМ) в 93% Т пл 149-151 °С этиловом эфире (20мл) к раствору свободного 'Н-ЯРМ (CDCI3) 5 7,27 - 7,43 (м, 8Н), 6,32(с, основания (0,297г, 0,926мМ) в этиловом эфире 2Н), 4,17(с, 2Н), 3,51(ширд, J = 11,6Гц, 2Н), 2,96(т, (20мл) Полученное твердое белое вещество соJ = 7,3Гц, 2Н), 2,66(ширт, J = 10,8Гц, 2Н), 2,45(с, бирали и промывали этиловым эфиром Выход ЗН), 1,60-1,97( 7Н) 13 0,35г, 87% Т пл 146,4-147,6°С С-ЯМР 5 169,4, 161,6, 157,3, 135,7, 133,2, EIMS (эмиссионная масс-спектроскопия) (не 131,6, 131,0, 130,1, 129,3, 128,4, 121,4, 120,2, 60,6, исходный) 319,1, 303,1, 185,2, 172,1, 91,1 52,0, 32,8, 32,7, 28,7, 22,0, 21,1 'Н-ЯРМ (CDCI3) 5 7,60(д, J = 8, 1Н), 7,51 ИК (КВг) 2934, 2848, 2499, 2362, 1701, 1617, 1 7,52(м, 2Н), 7,37 - 7,49(м, 5Н), 7,25 - 7,32 (м, 1Н), 1572, 1487, 1454, 1357 с м 6,30 (С, 2Н), 4,16(с, 2Н), 3,45-3,51 (м, 2Н), 2,98(т, J EIMS (не исходный) 333,1, 317,2, 185,1, 172,1, = 7,4), (2Н), 2,60 - 2,70(м, 2Н), 1,84 - 1,95(м, 4Н), 91,1 (основание) 1,60-1,82(м, ЗН) Анализ для C22H26N2O C4H4O4 13 С-ЯМР 5 169,5, 163,0, 157,7, 135,8, 131,1, Вычислено С 69,32, Н 6,71, N 6,22 130,1, 130,0, 129,3, 128,5, 123,5, 121,3, 121,1, Найдено С 69,18, Н 6,48, N 6,08 110,0, 60,6, 52,1,32,8, 28,8,22,1 Пример 3 ИК (КВг) 2944, 2927, 2921, 2499-2518 (шир), 5,6-Диметил-3-[2-[1-(фенилметил)-42329-2388 (шир), 1583, 1517, 1473, 1458, пиперидинил]этил]-1,2-бензизоксазол малеат 1445,1438, 1383, 1360, 782см Анализ для C21H24N2O C4H4O4 Вычислено С 68,79, Н 6,47, N 6,42 Найдено С 68,80, Н 6,35, N 6,27 Пример 2 5-Метил-3-[2-[1 -(Фенилметил)-4пиперидинил]этил]1,2-бензизоксазол малеат а) 4-[2-[5-Метил-1,2-бензизоксазол-3ил]этил]-2-пиперидинкарбоновая кислота, 1-1,1диметилэтил сложный эфир Повторяли процедуру, описанную в Примере Id, с использованием 3,5-диметил-1,2бензизоксазола (0,500г, 3,40мМ), 4-иодометил-1пиперидинкарбоновой кислоты, 1 -(1,1 диметилэтил -сложного эфира (1,20г, 3,74мМ), и IM диизопропиламида лития (LDA) (3,74мл, 3,74мМ) в сухом ТГФ (5мл) После очистки получали целевое соединение (0,91 Ог, 78%) в виде прозрачного маслообразного продукта 'Н-ЯРМ (CDCI3) 5 7,28 - 7,40(м, ЗН), 4,04 4,11(м, 2Н), 2,94(т, 2Н, J = 7,8Гц), 2,64(ширт, 2Н, J = 12,3Гц), 2,43(с, ЗН), 1,70 - 1,99(м, 4Н), 1,42(с, 9Н), 1,41 - 1,55(м, 1Н), 1,13(ддд, 2Н, J = 24,4Гц), J = 12,0Гц), J = 4,1Гц) о) 5-Метил-3-[2-[1-(Фенилметил)-4пиперидинил]этил]-1,2-бензизоксазол малеат Повторяли процедуру, описанную в Примере le с использованием пиперидина, полученного в стадии (а) (0,91 Ог, 2,64мМ и ТФК (13мл) в метиленхлориде (СН2СІ2) (13мл), и триетиламина (3,7мл, 26,4мМ) и бензилбромида (0,32мл, 2,69мМ) в метиленхлориде (СН2СІ2) (20мл) После очистки получали целевое соединение свободное основание в виде прозрачного маслообразного продукта (0,56г, 63%) Малеат (соль) получали путем добавления раствора малеиновой кислоты (0,20г, 1,72мМ) в этиловом эфире (Et20) (10мл) к раствору свободного основания (0,56г, 1,67мМ) в Et2O (40мл) Образовавшееся белое твердое вещество собирали а) 4-[2-[5,6-Диметил-1,2-бензизоксазол-3ил]этил]-1-пиперидинкарбоновая кислота, 1-(1,1диметилэтил/сложный эфир) Повторяли процедуру, описанную в Примере Id, с использованием 3,5,6-триметил-1,2бензизоксазола (0,600г, 3,73мМ), 4-иодометил-1пиперидинкарбоновой кислоты, 1 -(1,1 диметилэтил)- сложного эфира (1,30, 4,10мМ), и IM LDA (4,10мл, 4,10мМ) в сухом ТГФ (10мл) После очистки получали целевое соединение (1,04г, 78%) в виде прозрачного маслообразного вещества 'Н-ЯРМ (CDCI3) 5 7,32(с, 1Н), 7,27(с, 1Н), 4,04 4,10(м, 2Н), 2,93(т, 2Н, J = 7,8Гц), 2,64(ширт 2Н, J = 11,8Гц), 2,35(с, ЗН), 2,32(с, ЗН), 1,70 - 1,80(м, 4Н), 1,43(с, 9Н), 1,43 - 1,51(м, 1Н), 1,13(ддд, 2Н, J = 24,3Гц), J = 12,3Гц, J = 4,2Гц) о) 5,6-Диметил-3-[2-[1-(фенилметил)-4пиперидинил]этил]-1,2-бензизоксазол малеат Повторяли процедуру, описанную в Примере 1е, с использованием пиперидина, полученного в стадии (А) (1,04г, 2,90м, и ТФК (16мл) в CH2CI2 (16мл), и триэтиламина (4,2мл, 29,СмМ) и бензилбромида (0,36мл, З.ОЗмМ) в СН2СІ2(20мл) После очистки получали целевое соединение (свободное основание) (0,53г, 52%) в виде прозрачного маслообразного продукта Малеат (соль) получали путем добавления раствора малеиновой кислоты (0,18г, 1,55мМ) в Et2 50% ЕЮАс/СН 2 С1 2 ) получали целевое соединение (1,56г, 76%) в виде белого твердого продукта Т пл 1 4 2 - 1 4 3 ° С 'Н-ЯРМ (CDCI 3 ) 5 8,76(с, 1Н), 8,05(с, 1Н), 7,48(д, 1Н, J = 8,5Гц), 7,32(дд, 1Н, J = 8,6Гц, J = 1,5Гц), 4,06(ширт, 2Н, J = 11,5Гц), 2,94 (т, 2Н, J = 7,8Гц), 2,66(ширт, 2Н, J = 11,8Гц), 2,20(с, ЗН), 1,69 - 1,80(м, 4Н), 1,41 - 1,47(м, 1Н), 1,44(с, 9Н), 1,12(ддд, 2Н, и = 23,8Гц, J = 12,0Гц, J = 3,9Гц) Ь) 6-Ацетамидо-3-[2-[1-(фенил метил)-4пиперидинил]этил]-1,2-бензизоксазол-фумарат Трифторуксусную кислоту (ТФК) (4мл) по капле добавляли к холодному (0°С) раствору пиперидина, полученного в стадии (а) (0,40г, 1,03мМ) в CH 2 CI 2 (8мл) Полученный раствор размешивали 30 минут при 0°С Летучие вещества удаляли при пониженном давлении, а избыток ТФК удаляли путем концентрирования (2 раза) из толуола Неочищенный продукт скова растворяли в метиленхлориде (10мл) и добавляли триэтиламин (1,44мл, 10,ЗмМ) и бензилбромид (0,184мл, 1,55мМ) Полученную смесь размешивали 6 часов при комнатной температуре Затем смесь промывали водой и солевым раствором, и осушали сульфатом магния, фильтровали и концентрировали После очистки с помощью флеш-хроматографии на силикагеле (CH 2 CI 2 -» 10% MeOH/CH 2 CI 2 ) получали целевое соединение (свободное основание) (0,270г, 69%) в виде белого твердого вещества Фумаратную соль получали путем добавления раствора фумаровой кислоты (0,091 г, 0,788мМ) в этаноле (ЕЮН) (5мл) к раствору свободного основания (0,270г, 0,716мМ) в CH 2 CI 2 (20мл) После концентрирования, полученный твердый продута перекристаллизовывали из этанола и получали белые игольчатые кристаллы Выход 0,17г, 48% Т пл 225 - 226°С 'Н-ЯМР (ДМСО-de) 5 10,37(с, 1Н), 8,13(с, 1Н), 7,76(д, 1Н J = 8,5), 7,25 - 7,36(м, 6Н), 6,59(с, 2Н), 3,54(с, 2Н), 2,83 - 2,96(м, 4Н), 2,10(с, ЗН), 2,01 (шир т, 2Н, J = 11,1), 1,69 - 1,73(м, 4Н), 1,20 1,28(м, ЗН) Анализ для C 2 3 H 2 7 N 3 O 2 1/2 С 4 Н 4 О 4 1/4 Н 2 О Вычислено С 68,24, Н 6,76, N 9,55 Найдено С 68,35, Н 6,63, N 9,35 Пример 8 6-АМИНО-3-[2-[1 -(фенилметил)-4пиперидинил]этил]-1,2-бензизоксазол-малеат /СОгН Смесь 6-ацетато-3-[2-[1-(фенил метил)-4пиперидинил]этил]-1,2-бензизоксазола (0,30г, 0,79мМ) в Ін НСІ (10мл) нагревали с обратным холодильником в течение 30 минут Охлажденную реакционную смесь подщелачивали путем добавления 10% NaOH экстрагировали 2 раза этилацетатом Объединенный органический слой промывали солевым раствором и осушали сульфатом 39 45944 40 магния затем фильтровали, концентрировали, и хроматографии (30% -> 50% ЕЮАс/гексан полуполучали целевое соединение свободное основачали целевое соединение (1,54г, 87%) в виде ние (0,259г, 98%) в виде маслообраз-ного вещестбледно-желтого твердого вещества Небольшой ва образец очищали путем перекристаллизации Мономалеатную соль получали путем добав(СНгСЬ/ЕігО) и получали белое твердое вещестления раствора малеиновой кислоты (0,099г, во Т пл 177-178,5°С 0,85мМ) в ЕЮН (5мл) к раствору свободного осно'Н-ЯМР (flMCO-d6) 5 8,61 (с, 1Н), 8,15(с, 1Н), вания (0,26г, 0,77мМ) в СН2С12 (Змл) После кон7,86(д, 2Н, J = 7,4Гц), 7,39 - 7,53(м, 5Н), центрирования, остаток растирали с этиловым 4,03(ширд, 2Н, J = 12,7Гц 2,92(т, 2Н, J = 8,0Гц), эфиром получали белы порошок Выход 0,29г, 2,50 - 2,73(м, 2Н), 1,60 - 1,80(м, 4Н), 1,40 - 1,45(м, 64% Т пл 173,0-173,5°С 1Н), 1,41 (с, 9Н), 1,13(ддд, 2Н J = 24,0Гц), J = 'Н-ЯМР (ДМСО-de) 5 7,41 - 7,47 (м, 6н), 6,58 12,2Гц, J = 3,8Гц) 6,63(м, 2Н), 6,06(с, 2Н), 5,87(ширс, 2Н), 4,26(с, с) 6-Бензамид-3-[2-[1-(фенил метил)-42Н), 3,29 - 3,38(м, 2Н), 2,80 - 2,95(м, 4Н), пиперидинил]этил]-1,2-бензизоксазолмалеат 1,90(ширд, J = 12,5, 2Н), 1,25-1,80(м, 5Н) Трифторуксусную кислоту (ТФК) (8,4мл) по ка^С-ЯМР (ДМСО-de) 167,4, 164,8, 157,4, 151,9, пле добавляли к холодному раствору (0°С) пипе136,0, 131,2, 130,1, 129,5, 128,9, 121,9, 112,8, ридина, полученного в стадии (Ь) (0,70г, 1,56мМ) в 110,7, 90,0, 59,3,51,5, 32,6, 32,6, 28,6, 21,6 CH2CI2 (10мл) Полученный раствор размешивали 30 минут при 0°С Летучие вещества удаляли при EIMS (не исходи) 289, 268, 218, 190 (основапониженном давлении, а избыток ТФК удаляли ние) путем концентрирования (2 раза) из толуола СыИК (КВг) 3483, 3384, 2929, 2526, 1633, 1619, рой продукт растворяли в ТГФ 10мл и добавляли 1582, 1515, 1474,1459, 1438, 1389, 1379, 1359, 977, триэтиламин (2,1мл, 15,1мМ), а затем бензилбро702см 1 мид (0,21мл, 1,77мМ) Полученную смесь разбавАнализ для C21H25N2O C4H4O4 ляли этилацетатом и размешивали при комнатной Вычислено С 66,50, Н 6,47, N 9,31 температуре в течение ночи Затем смесь промыНайдено С 66,49, Н 6,43, N 9,22 вали водой и солевым раствором, осушали сульПример 9 фатом магния, фильтровали, и концентрировали 6-Бензамид-3-[2-]1-(фенил метил)-4После очистки с помощью флеш-хроматографии пиперидинил]этил]-1,2-бензизоксазол-малеат на силикагеле (30% ЕЮАс/СН2СІ2 100% ЕЮАс) получали целевое соединение свободное основание (0,280г, 41%) в виде бледно-желтого твердого вещества a) 6-Бензамид-3-метил-1,2-бензизоксазол Бензоилхлорид (0,56мл, 4,82мМ) добавляли к раствору 6-амино-3-[2-[1-(фенил метил)-4пиперидинил]этил]-1,2-бензизоксазола (0,70г, 4,72мМ, триэтиламина (1,35, 9,69мМ), и 4диметиламинопиридина (0,07г, 0,57мМ) в СН2СІ2 (30мл) Полученную смесь размешивали при комнатной температуре в течение ночи Эту гетерогенную смесь концентрировали, а полученный твердый остаток собирали, промывали водой и эфиром, и осушали, воздухом, в результате чего получали целевое соединение (1,02г, 86%) в виде беловатого твердого вещества Небольшой образец очищали путем перекристаллизации из этанола, и получали чистый хлопьевидный продукт Т пл 213-214°С 'Н-ЯМР (ДМСО-de) 5 10,6 (с, 1Н), 8,30(с, 1Н), 7,98(д, 2Н J = 6,9Гц), 7,80 (д, 1Н, J = 8,6Гц), 7,68(д, 1Н, J = 8,8Гц 7,52 - 7,63(м, ЗН), 2,53(с, ЗН) b) 4-[2-[6-Бензамид-1,2-бензизоксазол-3ил]зтил]-1 -перидинкарбоновая кислота 1 -(1,1 диметил)этил)сложный эфир Повторяли процедуру, описанную в Примере 7а, используя бензамид, полученный в стадии (а) (1,0г, 3,96мМ), ІМ LDA (7,95мл, 7,95мМ), и 4иодометил-1-пиперидинкарбоновой кислоты 1(1,1-диметилзтил) сложный эфир (1,30г, 4,00мМ) в сухом ТГФ (50мл), за исключением того, что после добавления реагентов, смесь размешивали при 78°С втечение 1,5 часов После очистки путем Малеат (соль) получали путем добавления раствора малеиновой кислоты (0,081 г, 0,702мМ) в ЕЮН (5мл) к раствору свободного основания (0,280г, 0,638мМ) в СН2СІ2 (20мл) После концентрирования, полученный твердый продукт перекристалл изовывали из ЕЮН/СН2СІ2 и получали белое твердое вещество Выход 0,208г, 59% Т пл 181,5-183,0°С 'Н-ЯМР (flMCO-d6) 5 10,65(с, 1Н), 8,31 (с, 1Н), 7,98(д, J = 7,2, 2Н, 7,85(д, J = 8,6, 1Н), 7,48 7,71 (м, 9Н), 6,03(с, 2Н), 4,25(шир с, 2Н), 3,20 3,60(м, 4Н), 2,89 - 3,02(т, при 2,99 J = 7,5 и м, 4Н), 1,40-1,97(м, 7Н) 13 С-ЯМР (flMCO-d6) 5 167,2, 166,2, 163,0, 158,1, 141,5, 135,9, 134,6, 132,0, 131,2, 129,5, 128,9, 128,5, 127,8, 121,9, 117,01, 116,8, 99,9, 59,15, 51,7, 32,8, 32,5, 28,8, 21,7 EIMS 439,2, 422,2 100, 383, 348, 293, 185 ИК (КВг) 2934, 2919, 1657, 1610, 1579, 1536, 1499, 1491, 1462, 1453, 1352см 1 Анализ для C28H29N3O2 C4H4O4 Вычислено С 69,17, Н 5,99, N 7,56 Наїдено С 68,81, Н 5,90, N 7,49 Пример 10 6-Бензосульфонамид-3-[2-[1-(фенил метил)-4пиперидинил]этил]-1,2-бензизоксазол-фумарат -Н 6-Бензосудьфонамид-3-метил-1,2 41 45944 42 бензизоксазол раствором, осушали сульфатом магния, фильтровали, и концентрировали После очистки с помоБензолсульфонилхлорид (0,528мл, 4,14мМ) щью флеш-хроматографии на силикагеле (СН2СІ2 добавляли к холодному (0°С) раствору 6-амино-З-> 5% МеОН/ СН2СІ2) получали целевое соедине[2-[1-(фенилметил)-4-пиперидинил]этил]-1,2ние (свободное основание) (0,334г, 49%) в виде бензизоксазола (0,61 Зг, 4,14мМ) и пиридина белого пенистого вещества (0,670мл, 8,28мМ) в СН2СІ2 (30мл) Через 1,3 часов добавляли насыщенный бикарбонат натрия Фумарат (соль) получали путем добавления (Nah-ІСОз), и полученную смесь размешивали при раствора фумаровой кислоты (0,040г, 0,345мМ) в комнатной температуре в течение ночи ОрганиЕЮН (Змл) к раствору свободного основания ческий слой отделяли, и промывали водой и соле(0,150г, 0,315мМ) в СНіСІ 2 (6мл) После конценвым раствором, осушали сульфатом магния, трирования, остаток растирали с этиловым эфифильтровали, и концентрировали После очистки ром и получали белое твердое вещество Выход с помощью флеш-хроматографии на силикагеле 0,151г, 8 1 % (5% ЕЮАс/СНгСЬ) получали целевое соединение 'Н-ЯМР (ДМСО-de) 5 7,82(д, 1Н, J = 7,0), 7,70(д, (0,867г, 83%) в виде белого твердого вещества Т 1Н, J = 8,6) 7,51 - 7,60(м, ЗН), 7,27 - 7,32(м, 6Н), пл 183-184°С 7,07(дд, 1Н, J = 8,6, J = 1,6) 6,59(с, 2Н), 5,55(с, 2Н), 'Н-ЯМР (CDCI3) 5 10,9(ширс, 1Н), 7,84(д, 2Н, J 2,82 - 2,90(м, 4Н), 2,03(шир,т, 2Н, J = 11,5), 1,61 = 6,7Гц), 7,68(д, 1Н, J = 8,5Гц), 7,52 - 7,63(м, ЗН), 1,70(м, 4Н), 1,20-1,25(м, ЗН) 7,34(д, 1Н, J = 1,5Гц), 7,11(дд, 1Н, J = 8,5Гц, J = Пример 11 1,7Гц), 2,52(с, ЗН) 6-(4-морфолинид)-3-[2-[1-(фенил метил)-4b) 4-2-6-Бензодсульфонамид-1,2пиперидинил]этил]-1,2-бензизоксазол бензизоксазол-3-ил этил-1-пиперидинкарбоновая кислота, 1-1,1-диметидэтил сложный эфир Повторяли процедуру, описанную в Примере 7а, используя бензосульфонамид, полученный в стадии (а) (0,60г, 2,08мМ) ІМ LDA (4,58мл, 4,58мМ), и 1-(1-диметилэтил) сложный эфир 4иодометил-1-пиперидинкарбоновой кислоты (0,81 Зг, 2,50мМ) в сухом ТГФ (70мл), за исключением того, что после добавления реагентов,смесь a) 3-Метил-6-(4-морфолинил)-1,2размешивали при - 78°С в течение 10 - 15 минут бензизоксазол После очистки с помощью хроматографии (20% -> Смесь 6-амино-3-[2-[1-(фенил метил)-440% ЕЮАс/гексаны) получали целевое соединепиперидинил]этил]-1,2-бензизоксазола (0,230г, ние (0,997г, 99%) в виде белого пенистого веще1,55мМ), р, [З'/дибромодиэтилового эфира (0,397г, ства Т пл 66 - 67°С 1,71 мМ), и диизопропилэтиламина (основания Хюнига, 0,648мл, 3,71 мМ) в толуоле (2,5мл) на'Н-ЯМР (CDCI3) 5 7,85(дд, 2Н, J = 8,3Гц, J = гревали 15 часов при 120°С Охлажденную смесь 1,6Гц), 7,35(-7,57(м, 6Н), 7,02(дд, 1Н, J = 8,5Гц, J = разбавляли етилацетатом и промывали водой и 1,6Гц), 4,11 (ширд, 2Н, J = 13,2Гц), 2,94(т, 2Н, J = солевым раствором, затем осушали сульфатом 7,4Гц), 2,68(ширт, 2Н, J = 12,8Гц), 1,71 - 1,77(м, магния, фильтровали, и концентрировали После 4Н), 1,46(с, 9Н), 1,46 - 1,55(м, 1Н), 1,15(ддд, 2Н, J этого осуществляли таким же способом еще две = 23,6Гц, J = 11,7Гц, и = 3,9Гц) отдельные реакции с использованием 6-амино-Зc) 6-бензолсульфонамид-3-[2-[1 [2-[1-(фенилметил)-4-пиперидинил]этил]-1,2(фенилметил)-4-пиперидинил]этил]-1,2бензизоксазола (0,050г, 0,34мМ, и 0,150г, 1,01мМ) бензизоксазол-фумарат Неочищенный продукт, полученный из трех реакТриметилсилилтрифторометансульфонат ций, объединяли и очищали с помощью флеш(1,30мл, 6,76мМ) по капле добавляли к холодному хроматографии на силикагеле (1% МеОН/СНгСЬ), (0°С) раствору пиперидина, полученного в стадии в результате чего получали целевое соединение (Ь) (0,819г, 1,69мМ) и 2,6-лутидина (0,590мл, (0,499г, 79%) полный выход в виде бледно5,07мМ) в CH2CI2 (17мл) Через полтора часа дожелтого твердого вещества Затем очищали небавляли насыщенный бикарбонат натрия большой образец путем перекристаллизации (Nah-ІСОз) и полученную смесь размешивали 15 (ЕЮАс/гексаны) и получали белое твердое вещеминут при комнатной температуре Образовавство Т пл 138,5- 139,5°С шийся, белый осадок собирали путем фильтрации и снова растворяли в воде при рН 2 Этот кислый 'Н-ЯМР (CDCI3) 5 7,46(д, 1Н, J = 8,7Гц), водный слой экстрагировали 2 раза метиленхло6,95(дц, 1Н, J = 8,7Гц), J = 2,0Гц), 6,90(д, 1Н, J = ридом и 1 раз этилацетатом Все органические 1,9Гц), 3,88(т, 4Н, J = 4,9Гц), 3,27(т, 4Н, J = 4,8Гц), слои объединяли, осушали сульфатом магния, 2,52(с, ЗН) фильтровали, и концентрировали Полученный b) 4-[2-[6-(4-Морфрлинил)-1,2-бензизоксазолбелый остаток суспендировали в ТГФ (30мл) и 3-ил]этил]-1-пиперидинкарбоновая кислота 1-(1,1ДМФ (50мл), и добавляли триэтиламин (0,40мл, диметилэтил) сложный эфир 2,86мМ) и бензилбромид (0,22мл, 1,86мМ) ПолуПовторяли процедуру, описанную в Примере ченную гетерогенную смесь размешивали при 7а, используя морфолино-производное, полученкомнатной температуре в течение 24 часов (время ное в стадии (а) (0,369г, 1,69мМ), ІМ LDA (1,86мл, получения более гомогенной смеси) Эту смесь 1,86мМ), и 4-иодометил-1-пиперидинкарбоновой концентрировали, и к остатку добавляли СН2СІ2 кислоты 1-(1,1-диметилэтил) сложный эфир Органический слой промывали водой и солевым (0,605г, 1,86мМ) в сухом ТГФ (8мл) Осуществляли 43 45944 АА также еще одну реакцию с вышеуказанным мор2-он фол ино-производным (0,100г, 0,46Мм) Сырой Ацетилхлорид (4,09мл, 0.0575М) добавляли к суспензии трихлорнда алюминия (АІСІз) (35,36г, продукт, подученный из этих двух реакций, объе0.265М) в сероуглероде (CS2) (250мл) Через 2 - 3 диняли и после очистки путем хроматографии (5% минуты добавляли 6-метоксиоксиндол (7,22г, -> 40% ЕЮАс/гексаны) получали целевое соеди0.0442М) Полученную смесь нагревали с обратнение (0,477г, 53%) в виде белого твердого проным холодильником в течение 2,5 часов (Со вредукта Затем небольшой образец очищали путем менем смесь становилас в виде черного дегтя) перекристаллизации (ЕЮАс/гексаны) и получали Избыток растворителя декантировали, и к остатку белое твердое вещество Т пл 164-165°С осторожно добавляли ледяную воду Полученную 'Н-ЯМР (CDCI3) 5 7,46(д, 1Н, J = 8,6Гц), 6,92 смесь рамешивали в течение ночи Полученное 6,97(м, 2Н), 4,02 - 4,15(м, 1Н), 3,89(т, 4Н, J = твердое бледно-желтое вещество собирали, про4,9Гц), 3,27(т 4Н, J = 4,9Гц), 2,95(т, 2Н, J = 7,8Гц), мывали водой, осушали в высоком вакууме, и по2,7(ширт, 2Н, J = 12,1 Гц), 1,74- 1,80(м, 4Н), 1,46лучали целевое соединение (7,32г, 87%) 1,56(м, 1Н), 1,46(с, 9Н), 1,10-1,22(м, 2Н) с) 6-(4-Морофолинил)-3-[2-[1-(фенил метил)-4пиперидинил]этил]-1,2-бензизоксазол Трифторуксусную кислоту ГГФК) (5мл) добавляли к холодному (0°С) раствору пиперидина, полученного в стадии (Ь) (0,40г 0,86мМ) и тианизола (1,13мл, 9,60мМ) в CH 2 CI 2 (10мл) Полученную смесь размешивали 30 минут при 0°С Летучие вещества удаляли при пониженном давлении, и к остатку добавляли 1н NaOH Водный слой экстрагировали етилацетатом (2 раза), и объединенный органический слой промывали водой и солевым раствором, осушали сульфатом магния, фильтровали и концентрировали Полученное желтое маслообразное вещество снова растворяли в метиленхлориде (10мл), и к растовру добавляли триэтиламин (0,267мл, 1,92мМ) и бензилбромид (0,148мл, 1,25мМ) Полученную смесь размешивали при комнатной температуре в течение ночи После этого смесь промывали водой и солевым раствором, осушали сульфатом магния, фильтровали и концентрировали После очистки с помощью флеш-хроматографии на силикагеле (СН2СІ2 -> 10% МеОН/СНгСЬ), получали целевое соединение (0,285г, 73%) в виде белого твердого продукта Затем небольшой образец очищали путем перекристаллизации из этанола и получали белое твердое вещество Т пл 129-130°С 'Н-ЯМР (CDCI3) 5 7,44(д, J = 8,7, 1Н), 7,23 7,30(м, 5Н), 6,89 - 6,93(м, 2Н), 3,87(т, J = 4,8, З 4Н), 3,47(с, 2Н), 3,25 (т, J = 4,8, 4Н), 2,85 - 2,94(м, 4Н), 1,92(ширт, J = 10,8, 2Н), 1,72 - 1,79(м, 4Н), 1,21 1,31(м, ЗН) 13 С-ЯМР 165, 158, 153,4, 138,8, 129,2, 128,1, 126,9, 121,3, 113,3, 94,5, 66,7, 63,5, 53,7, 49,1, 35,3, 34,4, 32,1, 22,7 ИК (КВг) 3020, 2920, 1950, 1895, 1815, 1722, 1620, 1450, 1250, 1122, 738см 1 Анализ для C25H31N3O2 Вычислено С 74,04, Н 7,70, N 10,36 Найдено С 73,75, Н 7,69, N 10,36 Пример 12 5,7-Дигидро-3-[2-[1-(фенилметил)-4пиперидинил]этил]-6Н-пирродо[4,5-1]-1,2бензизоксазол-6-он-мадеат а) 5-Ацетил-1,3-дигидро-6-гидрокси-2Н-индол 'Н-ЯМР (ДМСО-de) 5 13,0(с, 1Н), 10,8(с, 1Н), 7,70(с, 1Н), 6,30(с, 1Н), 3,40(с, 2Н), 2,54(с, ЗН) b) 5-Ацетил-1,3-дигидро-6-гидрокси-2Н-индол2-он, 5-оксим Водный раствор гидроксиламинагидрохлорида (8,26г, 0,119М) и тригидрат ацетата натрия (16,9г, 0.124М) добавляли к смеси кетона, полученного в стадии (а) (9,88г, 0,0517М) в ЕЮН(бООмл) Полученную смесь нагревали с обратным холодильником в течение 20 часов Горячую реакционную смесь фильтровали, а твердый остаток собирали и промывали этанолом После осушки получали целевое соединение (10,11г, 95%) в виде бледно-желтого вещества Ґ Н-ЯМР (ДМСО-de) 5 12,0(С, 1Н), 11,4(с, 1Н), 10,5(с, 1Н), 7,29(с, 1Н), 6,35(с, 1Н), 3,38(с, 2Н), 2,20(с, ЗН) c) 5-Ацетил-1,3-дигидро-6-гидрокси-2Н-индод2-он, 5-оксим-ацетат Гетерогенную смесь оксшла, полученного в стадии (Ь) (7,15г, 34,7мМ), в уксусном ангидриде (55мл) нагревали в течение 2 часов при 80°С Охлажденную реакционную смесь фильтровали, а собранное твердое вещество промывали водой После осушки получали целевое соединение (4,67г, 54%) в виде бледно-желтого твердого вещества 'Н-ЯМР (flMCO-d6) 5 11,3(С, 1Н), 10,6(с, 1Н), 7,35(с, 1Н), 6,44(с, 1Н), 3,41 (с, 2Н), 2,37(с, ЗН), 2,21 (с, ЗН) d) 5,7-Дигидро-3-метил-6Н-пирроло[4,5-1]-1,2бензизоксазол-6-он Смесь оксимацетата, подученного в стадии с (4,48г, 18,0мМ) и пиридина (14,6мл, 180мМ) в диметилформамиде (ДМФ) (660мл) нагревали 4 часа при 125 - 130°С Охлажденную реакциюнную смесь выливали на воду и экстрагировали 4 раза етилацетатом Объединенный органический слой промывали водой и солевым раствором, осушали сульфатом магния, фильтровали и концентрировали После очистки с помощью флешхроматографии на силикагеле (50% ЕЮАс/гексаны -> 100% ЕЮАс) получали целевое соединение (2,20г, 65%) в виде бледно-желтооранжевого твердого продукта Т пл ЕЮАс 264 265°С (разл) 'Н-ЯМР (ДМСО-de) 5 10,8(с, 1Н), 7,60(с, 1Н), 6,98(с, 1Н), 3,57(с, 2Н), 2,47(с, ЗН) e) 4-[2-[5,7-Дигидро-6Н-пирроло[4,5-Г]-1,2бензизоксазол-6-он-3-ил]этил]-1пиперидинкарбоновая кислота 1 -(1,1 диметилэтил) сложный эфир 45 45944 46 Повторяли процедуру, описанную в Примере Повторяли процедуру, описанную в Примере 7а, используя бензизоксазол, полученный в ста7а, используя 1-метилизохинолин (0,50г, 3,49мМ), дии d (2,33г, 12,4мМ), ІМ LDA (40,9мл, 40,9мМ), и IM LDA (4,2мл, 4,2мМ) и 1-(1,1-диметилэтил) 4-иодометил-1 -пиперидин-карбоновой кислоты 1 СЛОЖНЫЙ Эфир 4-ИОДОМЄТИЛ-1(1,1-диметилэтил)сложный эфир (4,42г, 13,6мМ) в пиперидинкарбоновой кислоты (1,2г, 3,84мМ) в сухом ТГФ (500мл), за исключением того, что посухом ТГФ (45мл), за исключением того, что после сле добавления реагентов, смесь размешивали 4 добавления реагентов, смесь размешивали 1,75 часа при - 78°С После очистки с помощью хромачаса при - 78°С После очистки с помощью хроматографии (20% -» 30% ЕЮАс/СН2СІ2) получали тографии (30% -Ї ЕЮДо^олуол) получали целеисходный материал (0,210г, 9%) и целевое соедивое соединение (0,784г, 66%) в виде желтого маснение (2,75г, 58%) в виде беловатого твердого лообразного вещества вещества 'Н-ЯМР (CDCI ) 5 8,38(д, 1Н, J = 5,8Гц), 8,08(д, 'Н-ЯМР (CDCI3) 5 8,48(с, 1Н), 7,44(с, 1Н), 7, 03(с, 1Н), 4,08 - 4,14(м, 2Н), 3,63(с, 2Н), 2,97(т, 2Н, J = 7,8Гц), 2,69 (ширт, 2Н, J = 12,8Гц), 1,74 1,84(м, 4Н), 1,46 - 1,55(м, 1Н), 1,46(с, 9Н), 1,18(ддд, 2Н, и = 24,4Гц, J = 12,1 Гц, J = 4,3Гц) f) 5,7-Дигидро-3[2-[1-(фенилметил)-4nHnepHflHHHn]3THn]-6H-nHppono[4,5-f]-1,2бензизоксазол-6-он-малеат Трифторуксусную кислоту (ТФК) (3,3мл) по капле добавляли к холодному раствору (0°С) пиперидина, полученного в стадии (є] (0,50г, 1,30мМ) в CH2CI2 (13мл) Через 30 минут, смесь концентрировали, и избыток ТФК удаляли путем концентрировался из толуола (2 - 3 раза) Неочищенный остаток растворяли в ДМФ (12,5мл), и добавляли карбонат натрия (Na2CO3) (0,689г, 6,50мМ) и бензилхлорид (0,186мл, 1,56мМ) Подученную смесь размешивали 4 часа при комнатной температуре Реакционную смесь фильтровали, и фильтрат концентрировали в вакууме Остаток растворяли с метиленхлориде, промывали солевым раствором, осушали сульфатом магния, фильтровали, и концентрировали После очистки с помощью хроматографии на силикагеле (СН2СІ2 10% МеОН/ СН2СІ2) получали целевое соединение (свободное основание) (0,343г, 70%) в виде белого твердого вещества Малеат (соль) получали путем добавления раствора малеиновой кислоты (0,061, 0,528мМ) в этаноле (ЕЮН) (1мл) к раствору свободного основания (0,180г, 0,48мМ) в СН2СІ2 (10мл) После концентрирования, соль очищали путем перекристаллизации из изопропанола, в результате чего получали беловатое твердое вещество Выход 0,173г, 73% Т пл 194-195°С 'Н-ЯМР (ДМСО-de) 5 10,82(с, 1Н), 7,65(с, 1Н), 7,48(с, 5Н) 7,00(с, 1Н), 6,03(с, 1Н), 4,24(шир с, 2Н), 3,58(с, 2Н), 3,25 - 3,38(м, 2Н), 2,94(т, 2Н, J = 7,6), 2,82 - 2,97(м, 2Н), 1,86 - 1,96 (м, 2Н), 1,62 - 1,76(м, 2Н), 1,30-1,60(м, ЗН) Анализ для C23H25N3O2 C4H4O4 Вычислено С 65,97, Н 5,95, N 8,55 Найдено С 65,98, Н 6,04, N 8,54 Пример 13 1 -[2-Й -(фенилметил)-4пиперидинил]изохинолинмалеат \ -Изонинолин]этил]-1 кислота 1 -(1,1 пиперидинкарбоновая диметилэтил)сложный эфир 3 1Н, J = 8,3Гц), 7,77(д, 1Н, J = 8,0Гц), 7,62(т, 1Н, J = 7,1 Гц), 7,54(т, 1Н, J = 7,1 Гц), 7,46(д, 1Н, J = 5,7Гц), 4,08(ширс, 2Н), 3,25 - 3,30(м, 2Н), 2,67(ширт, 2Н, J = 12,3Гц), 1,73 - 1,81(м, 4Н), 1,49 - 1,63(м, 1Н), 1,42(с, 9Н), 1,17(ддд, 2Н, J = 24,6Гц, J = 12,1Гц, J = 3,8 Гц) Ь) 1 -[2-[1 -(фенилметил)-4пиперидинил]этил]изохинолднмалеат Повторяли процедуру, описанную в Примере 1е, используя пиперидин, пилученный в стадии (а) (0,713г, 2,10мМ) и ТФК (7мл) в CH 2 CI 2 (14мл), и триэтиламин (2,9мл, 21,0мМ) и бензилбромид (0,275мл, 2,31 мМ) в CH 2 CI 2 (60мл) После очистки (СН 2 СІ 2 -» 5% MeOH/CH 2 CI 2 ) получали целевое соединение (свободное основание) (0,26г, 38%) в виде бледно-желтого маслообразного вещества Малеат (соль) получали путем добавления раствора малеиновой кислоты (0,1 Ог, 0,867мМ) в ЕЮН (Змл) к раствору свободного основания (0,26г, 0,788мМ) в СН 2 СІ 2 (7мл) После концентрирования, соль очищали путем перкристаллизации (их холодного (0°С) этилацетата) и получали беловатое твердое вещество Выход 0,195г, 56% 'Н-ЯМР (ДМСО-de) 5 8,39(д, 1Н, J = 5,7), 8,26(д, 1Н, J = 8,3), 7,97(д, 1Н, J = 8,1), 7,77(т, 1Н, J = 7,4Гц), 7,66 - 7,71 (м, 2Н), 7,49(с, 5Н), 6,05(с, 2Н), 4,28(ширс, 2Н), 3,27 - 3,32(м, 2Н), 2,87 2,90(м, 2Н), 1,76 - 2,03(м, 6Н), 1,55 - 1,69(м, 1Н), 1,33-1,46(м, 2Н) Пример 14 3-[2-[1 -(Фенилметил)-4-пиперидинил]зтил]-1,2бензизотиазол-малеат сад а) 4-[2-[1,2-Бензизотиазол-3-ил]этил]-1 пиперидинкарбоновая кислота 1 -(1,1 диметилэтил) сложный эфир Повторили процедуру, описанную в Примере 1о, используя 3-метил-1,2-бензизотиазол (0,50г, 3,35мМ), 1-(1,1-диметилэтил) сложный эфир 4иодометил-2-пиперидинкарбоновой кислоты (1,20г, 3,69мМ), и IM диизопропиламид лития (LDA) (3,35мл, 3,35мМ) в сухом ТГФ (100мл) После очистки получали целевое соединение (0,582г, 50%) в виде желтоватого маслообразного вещесвва 'Н-ЯМР (CDCI3) 5 7,91 - 7,96(м, 2Н), 7,43 7,52(м, 2Н), 4,05 - 4,14(м, 2Н), 3,15(т, 2Н, J = 7,9Гц), 2,69(ширт, 2Н, J = 12,1 Гц), 1,74 - 1,88(м, 4Н), 1,46 - 1,60(м, 1Н), 1,46(с, 9Н), 1,29 - 1,10(м, 2Н) 47 45944 48 b) 3-[2-[1 -(Фенил метил)-4-пипеоидинил]этил]на силикагеле (20 -> 50% ЕЮАс-гексаны) получа1,2-бензизотиазол-малеат ли целевое соединение (0,466г, 33%) в виде маслообразного вещества Повторяли процедуру, описанную в Примере le, используя пиперидин, полученный в стадии (а) 'Н-ЯМР (CDCI3) 5 9,21(с, 1Н), 8,12(д, 1Н, J = (0,102г, 0,29мМ) и трифтороуксусную кислоту 7,7Гц), 8,05(д, 1Н, J = 8,4Гц), 7,90(т, 1Н, J = 7,8Гц), (ТФК) (0,75мл) в метиленхлориде (Змл), и триэти7,65(т, 1Н, J = 7,7Гц), 4,08 - 4,17(м, 2Н), 3,32(т, 2Н, ламин (0,202мг, 1,45мМ) и бензилбромид J = 8,3Гц), 2,72(ширт, 2Н, J = 12,1 Гц), 1,78 (0,038мл, 0,32мМ) в метиленхлориде (Змл) После 1,90(м, 4Н), 1,57 - 1,59(м, 1Н), 1,47(с, 9Н), 1,18 очистки получали целевое соединение (свободное 1,29(м, 2Н) основание) (0,058г, 62%) в виде прозрачного масЬ) 4-[2-[1-(фенилметил)-4-пиперилил]этил]-1,3лообразного вещества хиназолин-малеат Малеат (соль) получали путем добавления Повторяли процедуру, описанную в Примере раствора малеиновой кислоты (0,020г, 0,17мм) в 1е, используя пиперидин, полученный в стадии (а) этаноле (Змл) к раствору свободного основания (0,429г, 1,26мМ), и ТФК (3,5мл) в CH 2 CI 2 (13мл), и (0,058г, 0,17мМ) в метиленхлориде (З мл) Полутриэтиламин (0,88мл, 6,ЗмМ) и бензилбромид ченную смесь концентрировали, и остаток расти(0,17мл, 1,39мМ) в СН2СІ2 (22мл) После очистки с рали с Et20 Полученное белое твердое вещество помощью хроматографии (СЬЬСЬ -> 10% МеОНфильтровали, и фильтрат собирали, в результате CH2CI2) получали целевое соединение (свободное чего получали целевое соединение (0,077г, 86%) основание) (0,179г, 43%) в виде бесцветного масТ пл 175-176°С лообразного продукта 'Н-ЯМР (CDCI3) 5 8,14 - 8,21 (м, 2Н), 7,63(т, J = Малеат (соль) получали путем добавления 7,4, 1Н), 7,50-7,55(м, 6Н), 6,04(с, 2Н), 4,26(ширс, раствора малеиновой кислоты (0,052г, 0,45мМ) в 2Н), 3,35(ширс, 2Н), 3,15(т, J = 7,6, 2Н), 2,80 этиловом эфире (10мл) к расзвору свободного 2,92(м, 2Н), 1,92 - 2,00(м, 2Н), 1,78 - 1,88(м, 2Н), основания (0,135г, 0,41 мМ) в Et2O (200мл) Полу1,54 -1,65(м, 1Н), 1,35 -1,45(и, 2Н), ченное белое твердое вещество собирали путем 13 фильтрации, в результате чего получали целевое С-ЯМР (ДМСО-de) 5 167,3, 166,2, 151,6, соединение (0,103г, 56%) Т пл 121 -122°С 136.0, 134,2, 131,3, 130,1, 129,5, 128,9, 127,9, 124,9, 123,6, 120,6, 59,4, 51,6, 32,5, 33,5, 28,9, 27,8 'Н-ЯМР (flMCO-d6) 5 9,16(с, 1Н), 8,33(д, 1Н, J = ИК (КВг) 3030, 2910, 2350, 1700, 1575, 1445, 8,4Гц), 7,98 - 8,01 (м, 2Н), 7,72 - 7,78(м, 1Н), 7,43(с, 1350 см 1 5Н), 6,02(с, 2Н), 4,08(ширс, 2Н), 3,32(т, 2Н, J = HIMS 336,2(М+, свободное основание), 319,1, 7,7Гц), 3,15 - 3,35(м, 2Н), 2,60 - 2,80(м, 2Н), 1,89 245.1, 185,1, 172,1, 91,0 (основаше) 1,94(м, 2Н), 1,76 -1,79(м, 2Н), 1,30 -1,60(м, ЗН) Анализ для C21H24N2S C4H4O4 ИК(КВг) 3037, 2923, 1705, 1571, 1386см 1 Вычислено С 66,35, Н 6,24, N 6,19 EIMS 331 (М + , свободное основание), 318, 248, Найдено С 66,21, Н 5,93, N 6,03 143, 77 (основание) Пример 15 Анализ для C22H25N3 C4H4O4 4-[2-[1-(Фенилметил)-4-пиперидил]этил]-1,3Вычислено С 69,78, Н 6,53, N 9,39 хиназолинмалеат Найдено С 69,46, Н 6,61, N 9,26 Пример 16 6-Гидрокси-3-[2-[1-(фенил метил)-4пиперидил]этил]-1,2-бензизоксазол СО И О— а) 4-[2-[1,3-Хиназол-4-ил]этил]-1 пиперидинкарбоновая кислота 1 -(1,1 диметилэтил) сложный эфир Свежеприготовленный ІМ LDA (4,2мл, 4,2мМ) добавляли к раствору 4-метил-1,3-хиназолина Смесь 6-мето кс и-3-[2-[1 -(фенил метил)-4(0,60г, 4,2мМ) в ТГФ (35мл) при 0°С К полученнопиперидинил]этил]-1,2-бензизоксазол (0,11 г, му желтому раствору добавляли чистый триме0,288мМ) в 48% водном НВг(Юмл) нагревали 16 тилсилилхлорид (0,53мл, 4,2мМ) Затем ледяную часов при 110°С Затем смесь подщелачивали баню удаляли, и реакционную смесь размешивали путем добавления насыщенного ЫаНСОз и экстра3 минуты После этого смесь снова охлаждали до гировали метиленхлоридом Органический слой 0°С, и добавляли второй эквивалент IM LDA осушали сульфатом магния, фильтровали и кон(4,2мл, 4,2мМ) Затем добавляли раствор 1-(1,1центрировали После очистки с помощью флешДИМеТИЛЭТИЛ)СЛОЖНЫЙ Эфир 4-ИОДОМЄТИЛ-1хроматографии на силикагеле (3 -> 6% МеОНпиперидинкарбоновой кислоты (1,49г, 4,6мМ) в СН2СІ2) получали целевое соединение (0,055г, ТГФ (10мл), и размешивали в течение 1 часа при 57%) в виде белого твердого вещества Т пл 148 0°С После этого добавляли разбавленную НСІ (I -149°С н ), и смесь размешивали при комнатной темпера'Н-ЯМР (CDCI3) 5 7,70(шир с, 1Н), 7,27 - 7,37(м, туре 30 минут Затем реакционную смесь подще6Н), 6,74 - 6,80(м, 2Н), 3,63(с, 2Н), 3,04(шир д, 2Н, лачивали путем добавления І н NaOH и экстрагиJ = 10,8Гц), 2,88 (т, 2Н, J = 7,7Гц), 2,05 - 2,20(м, ровали этилацетатом Органический слой 2Н), 1,65 -1,95(м, 4Н), 1,30 -1,60(м, ЗН) промывали солевым раствором, осушали сульфатом магния, фильтровали, и концентрировали ИК (КВг) 3080, 3040, 2945, 1624, 1437, 1384см 1 После очистки с помощью флеш-хроматографии EIMS 336,2 (М+), 319,2, 255,0, 185,1, 91,1 (ос2 49 нование) ВРМС (высоко разреш 45944 масс-сп є ісгрометрия) 50 6-Циано-3-[2-[1 -(фенилметил)-4пиперидил]этил]-1,2-бензизоксазол ДЛЯ C21H24N2O2 Вычислено 336,18382, найдено 336,18187 Пример 17 6-Бромо-3-[2-[1 -(фенилметил)-4пиперидил]этил]-1,2бензизоксазолмалеат a) 4-[2-[6-Бромо-1,2-бензизоксазол-3-ил]этил]пиперидинкарбрновая кислота 1 -(1,1 диметилэтил) сложный эфир Повторяли процедуру, описанную в Примере 1d, используя 6-бромо-3-метил-1,2-бензизоксазол (1,02г, 4,81 мМ), 4-ИОДОМЄТИЛ-1пиперидинкарбоновой кислоты 1 -(1,1 диметилэтил)сложный эфир (1,72г, 5,29мМ) и IM LDA (5,30мл, 5,30мМ) в сухом ТГФ (40мл) , за исключением того, что после добавления реагентов, смесь резмешивали полтора часа при - 78°С После очистки получали целевое соединение (0,697г, 35%) в виде бледно-желтого твердого вещества 'Н-ЯМР (CDCI3) 5 7,77(с, 1Н), 7,52(д, 1Н, J = 7,2Гц), 7,45(д, 1Н, J = 7,2Гц), 4,11 (шир д, 2Н, J = 14,3Гц), 3,02(т, 2Н, J = 7,2Гц), 4,11 (шир д, 2Н, J = 14,3Гц), 3,02(т, 2Н, J = 7,2Гц), 2,70(дт, 2Н, J = 12,9Гц, J = 3,6Гц), 1,7 - 1,85 (м, 4Н), 1,49(с, 9Н), 1,45 -1,55(м, 1Н), 1,09 -1,29(и, 2Н) b) 6-Бромо-3-[2-[1-(фенил метил)-4пиперилинил]этил]-1,2-бензизоксазолмалеат Повторяли процедуру, описанную в Примере 1е, используя пиперидин, подученный в стадии (а), (0,398г, 0,972мМ) и ТФК (4мл) с CH2CI2 (26мл), и триэтиламин (1,6мл, 11,8мМ) и бензилбромид (0,155мл, 1,ЗмМ) в CH2CI2 (12мл) Осуществляли также другую реакцию с вышеуказанным пиперидином (0,102г, 0,249мМ) Сырой продукт, полученный от этих двух реакций, объединяли, и после очистки получали целевое соединение (свободное основание) (0,021г, 4%) в виде твердого желтовато-коричневатого продукта Малеат (соль) получали путем добавления раствора малеиновой кислоты (0,023г, 0,198мМ) в этаноле (5мл) к раствору свободного основания (0,072г, 0,18мМ) в метиленхлориде (6мл) После концентрации, остаток перекристаллизовывали из этанола и получали целевое соединение (0,035г, 38%) в виде белого твердого продукта Т пл 156,8 -157,5°С 'Н-ЯМР (ДМСО-de) 5 8,08(6, 1Н), 7,87(д, 1Н, J = 8,4Гц), 7,58(д, 1Н, J = 8,5Гц), 7,47(с, 5Н), 6,03(с, 2Н), 4,23(шир с, 2Н), 3,25 - 3,40(м, 2Н), 3,02(т, 2Н, J = 7,5Гц), 2,80 - 2,95(м, 2Н), 1,88 - 2,00(м, 2Н), 1,70 -1,80(м, 2Н), 1,30 -1,60(м, ЗН) 13 С-ЯМР (ДМСО-de) 5 167,2, 162,8, 158,6, 136,0, 131,1, 129,5, 128,9, 127,0, 124,0, 123,7, 120,6, 113,1, 59,6, 51,9, 32,7, 28,9, 21,6, EIMS 398 (М+), 381, 309, 252, 200, 185 (основание), 172, 91 ВРМС для С2іН2зВп\І2О вычислено 398,0994 Найдено 398,0941 Пример 18 Раствор NaNO2 (0,112г, 1,62мМ) в воде (4мл) добавляли к раствору 6-амино-3-[2-[1 (фенил метил)-4-пиперидинил]этил] 1,2бензизоксазола (0,534г, 1,59Мм) в 28% НСІ (20мл) выдерживавшемуся при 0°С Полученную смесь нейтрализовали до рН 7 путем осторожного добавления твердого ЫагСОз Затем нейтральную смесь порциями добавляли к хорошо размешанной смеси толуола (75мл), льда, и свежеприготовленного раствора CuCN (Organic Synthesis, Coll Vol 1, стр514, C11SO4 0,318г 1,99мМ) Подученную свесь выдерживали 30 минут при 0°С, а затем 2 часа при комнатной температуре, а затем нагревали 5 минут при 50°С После этого смесь экстрагировали этилацетатом, а органическую фазу промывали водой, солевым раствором, осушали сульфатом магния, фильтровали, и концентрировали После очистки с помощью флешхроматографии на силикагеле (3% МеОН-СЬЬСЬ) получали-целевое соединение (0,236г, 43%) в виде бледно-оранжевого твердого продукта После перекристаллизации небольшого образца (этанолгексан) получали целевое соединение в виде беловатого твердого вещества Т пл 113-114,5°С 'Н-ЯМР (CDCI3) 5 7,89(с, 1Н), 7,77(д, 1Н, J = 8,4Гц), 7,57(д, 1Н, J = 8,7Гц), 7,24 - 7,33(м, 5Н), 3,51 (с, 2Н), 3,04(т, 2Н, J = 7,9Гц), 2,92(шир д, 2Н, J = 11,2Гц), 1,97(ширт, 2Н, J = 10,7Гц), 1,74-1,85(м, 4Н), 1,26-1,40(м, ЗН) 13 С-ЯМР (CDCI3) 5 161,7, 158,8, 129,2, 128,2, 127,0, 126,3, 125,1, 122,5, 118,1, 114,5, 113,2, 63,4, 53,6, 35,2, 34,0, 32,0, 22,6 ИК (СНСІз) 2830, 2720, 2160, 1600, 1425, 1385 см 1 FAB-MC (масс-спектроскопия путем бамбардировки быстрыми атомами) 346 (М+ + 1), 309, 275, 239, 155, 119 (основание) ВРМС для C22H23N3O вычислено 345,1842, найдено 345,1836 Пример 19 6-Карбоксамид-3-[2-[1-(фенил метил)-4пиперидил]этил]1,2-бензизоксазол Измельченный в порошок гидроксида калия (КОН) (0,150г, 2,68мМ) добавляли к смеси 6циано-3-[2-[1 -(фенилметил)-4-пиперидил]этил]-1,2бензизоксазола (0,250г, 0,724мМ) в т-ВиОН (10мл) Полученную смесь нагревали 20 минут при 85°С Затем охлажденную реакционную смесь выливали поверх солевого раствора, и экстрагировали метиленхлоридом Органическую фазу 51 45944 52 промывали 10% NaOH, солевым раствором, осусмесь промывали водой, солевым раствором, шали сульфатом магния, фильтровали, и конценосушали сульфатом магния, фильтровали, и контрировали Сырой продукт очищали путем перецентрировали После очистки с помощью флешкристаллизации (из EtOAc- гексан а) и получали хроматографии на силикагеле (5% МеОН-СНгСЬ) целевое соединение (0,114г, 43%) в виде белого получали целевое соединение (свободное оснотвердого вещества Т пл 181 -182°С вание) (0,199г, 25%) в виде беловатого твердого вещества 'Н-ЯМР (ДМСО-de) 5 8,20(шир,с, 1Н, -NH), Фумарат (соль) получали путем добавления 8,15(с, 1Н),7,97(д, 1Н, J = 8,4Гц), 7,87(д, 1Н, J = фумаровой кислоты (0,074г, О.бЗЗмМ) растворен8,1 Гц), 7,64(ширс, 1Н - -NH), 7,22 - 7,31 (м, 5Н), ной в минимальном количестве ЕЮН, к раствору 3,42(с, 2Н), 13,02(т, 2Н, J = 7,8Гц), 2,78(шир д, 2Н, свободного основания (0,186г, 0,58мМ) в метиленJ = 11,5Гц), 1,87(ширт, 2Н, J = 10,9Гц), 1,69 хлориде (6мл) После концентрации, сырую соль 1,73(м, 4Н), 1,22-1,26(м, ЗН) 13 очищали путем перекристаллизации (EtOH-Et2O), С-ЯМР (ДМСО-de) 5 167,1, 162,0, 158,9, получали целевое соединение (0,134г, 53%) в ви138,9, 136,3, 128,7, 126,3, 126,8, 123,3, 122,0, де беловатого твердого вещества Т пл 163 108,7, 62,5, 53,2, 34,9, 33,7, 31,6, 22,0 164°С FAB-MC 346 (М+ + I), (основание), 321, 272, 'Н-ЯМР (ДМСО-de) 5 7,74(д, 1Н, J = 7,8Гц), 185, 172 7,61 - 7,69 (м, 2Н), 7,26 - 7,41 (м, 6Н), 6,60(с, 2Н), Ппимер 20 4,28(д, 2Н, J = 6,4Гц) 3,65(с, 2Н), 2,07(шир д, 2Н, J 3-[(1-Фенилметил-4-пипеоидил)метокси)-1,2= 11,4Гц), 2,20(шир т, 2Н, J = 11,7Гц), 1,90 - 2,05(м, бензизоксазололфумарат 1Н), 1,81 (шир д, 2Н, J = 12,8Гц), 1,38-1,49(м, 2Н) 13 С-ЯМР (flMCO-d6) 5 166,5, 166,1, 163,3, 137,0, 134,3, 131,1, 129,3, 128,3, 127,3, 123,6, 120,8, 113,5, 110,3, 74,2, 61,7, 52,2, 34,7, 27,6 ИК (КВг) 2980, 2550, 1706, 1650, 1616, 1573, a) 4-[(1,2-Бензизоксазол-3-ил)оксиметил]1447, 1374 с м 1 Іпиперидинкарбнновая кислота, 1 -(1,1 EIMC 305, 185, 172, 91 (основание) диметилэтил)сложный эфир ВРМС для C20H22N2O2 (свободное основание) NaH (60% дисперсия в минеральном масле, Вычислено 322,1682 Найдено 322,1719 0,941г, 23,53Мм) добавляли порциями к раствору Анализ для C20H22N2O2 С 4 Н 4 О 4 0,75 Н2О 1 -(1,1 диметилэтил)сложного эфира 4вычислено С 63,78, Н 6,13, N 6,20 гидроксиметил-1-пиперидинкарбоновой кислоты найдено С 63,88, Н 5,85, N 6,14 (4,82г, 22,41 мМ) в ДМФ (220мл) при 0°С Через 10 Пример 21 минут, реакционную смесь нагревали до комнат3-[(1-Фенил метил-4-пиперид ил)метиламино]ной температуры, и добавляли З-хлоро-1,21,2бензизаксазол бензизоксазол (3,44г, 22,41 мМ) Полученную, 0— смесь напревали 16 часов при 115°С Затем реакционную смесъ разбавляли этилацетатом и промывали водой (4х), солевым раствором, осушали сульфатом магния, фильтровали, и концентрировали После очистки с помощью флешхроматографии на силикагеле (10% ЕЮАс-гексан) Смесь 3-хлоро-1,2-Бензизаксазола (0,238г, получали целевое соединение (4,16г, 56%) в виде 1,55мМ), 4-аминометил-1-фенил метил пиперидина белого твердого вещества Т пл 103-104,5°С (0,316г. 1,55мМ) и К 2 СО 3 (0,214г, 1,55мМ) в ДМ СО 'Н-ЯМР (CDCI3) 5 7,61 (Д, 1Н, J = 7,0Гц), 7,48 (10мл) нагревали при 150 в течение 20 часов Ох7,54(м, 1Н), 7,41 (д, 1Н, J = 8,5Гц), 7,22 - 7,27(м, лажденную реакционную смесь разбавляли этил1Н), 4,28(д, 2Н, J = 6,5Гц), 4,16(ширд, 2Н, J = ацетатом (75мл) и выливали в воду (200мл) Ор13,3Гц), 2,75(дт, 2Н, J = 13,2Гц), J = 2,6Гц), 2,04 ганическую фазу отделяли и промывали солевым 2,13(м, 1Н), 1,83(ширд, 2Н, J = 13,7Гц) ,1,45(с, раствором, осушали сульфатом магния, фильтро9Н), 1,30(ддд, 2Н, и = 24,9Гц, J = 12,5Гц, J = 4,2Гц) вали, и концентрировали Полученный коричнеb) 3-[(1-Феннлметил-4-пиперидил)метокси]вый маслообразный продукт очищали с помощью 1,2-бензизоксазол-фумарат флеш-хроматографии на силикагеле (4% МеОНТрифторуксусную кислоту (ТФК) (10мл) по каCH2CI2) и получали целевое соединение (0,084г, пле добавляли к раствору пиперидина, полученно17%) светло-желтого маслообразного вещества го в стадии (а) (0,827г, 2,49мМ) в СН 2 СІ 2 (25мл) Ґ Н-ЯМР (CDCI3) 5 7,44 - 7,50(м, 2Н), 7,38(д, 1Н, при 0°С Полученную смесь размешивали 20 мии = 8,8Гц), 7,16-7,31(м, 6Н), 4,35 - 4,42(м, 1Н, -NHнут при 0°С Затем смесь концентрировали, а из), 3,51 (с, 2Н), 3,33(т, 2Н, J = 6,2Гц), 2,92(шир д, 2Н, быток ТФК удаляли путем концентрирования из J = 11,5Гц), 1,99 (т, 2Н, J = 11,6Гц), 1,77(шир д, 2Н, толуола Остаток распределеяли между метиленJ = 12,7 Гц), 1,75-1,80(м, 1Н), 1,33-1,45(м, 2Н) хлоридом и насыщенным /ІЧНСОз Органический 13 С-ЯМР (CDCI3) 5 162,8, 158,6, 137,8, 129,8, слой осушали сульфатом манния, фильтровали, и 129,3, 128,2, 127,2, 122,1, 119,7, 116,2, 110,1, 63,2, концентрировали Сырой продукт (0,192г, 53,3, 49,4, 35,2, 29,9, 29,7 0,827мМ) растворяли этиленхлориде (8мл) и доИК (КВг) 3290, 2924, 2852, 1614, 1564, 1450, бавляли триэтиламин (0,58мл, 4,13мМ), а затем 1365 см 1 бензилбромид (0,128мл, 1,07мМ) Полученную смесь размешивали в течение ночи (18 часов) при EIMS 321 (М+) ,230, 201, 185, 172, 91 (основакомнатной температуре Затем реакционную ние) 53 ВРМС для C20H23N3O 45944 вычислено 321,1842, Найдено 321,1825 Пример 22 3-[2-[(1-Фенил метил)-4-пиперид ил)этиламино]1,2бензизоксазол О / Повторяли процедуру, описанную в Примере 21, используя 3-хлоро-1,2-бензизоксазол (0,682г, 4,44мМ), 4-аминоэтил-1-фенил метил пиперидин (0,970г, 4,44мМ), и К2СО3(0,614г, 4,44мМ) в ДМ СО (30мл) После очистки получали целевое соединение (0,231г, 15%) в виде бледно-желтого маслообразного продукта 'Н-ЯМР (CDCI3) 5 7,45 - 7,54(м, 2Н), 7,24 7,40(м, 6Н) , 7,19(т, 1Н, J = 7,8Гц), 4,40(ширт, 1Н, J = 5,5Гц), 3, 52(с, 2Н), 3,45(дт, 2Н, J = 7,4Гц, J = 6,0Гц), 2,91 (шир д, 2Н, J = 11,8Гц), 1,99(ширт, 2Н, J = 11,2Гц), 1,62 -1,73(м, 4Н), 1,37 -1,52(м, ЗН) 13 С-ЯМР (CDCI3) 5 162,7, 158,6, 137,8, 129,8, 129,4, 128,2, 127,1, 122,1, 119,8, 116,3, 110,0, 63,3, 53,6, 41,5, 36,1, 33,4, 32,0 EIMS 335 (М+), 244, 199, 186, 172, 91 (основание) ВРМС для C21H25N3O вычислено 335,1998, найдено 335,1909 Пример 23 3-[3-[1-(Фенил метил)-4-пиперидил]пропил]1,2бензизоксазол-малеат a) 4-[2-Этокси-2-лксоэтилидин]-1пиперидинкарбоновая] кислота 1 -(1,1 диметилэтил)сложный эфир Раствор три этил фосфоноацетата (3,1мл, 15,69мМ) в свежедистиллированном 1,2диметоксиэтана (ДМЭ , 12,5мл) добавляли к суспензии NaH (60% дисперсии в минеральном масле, 0,75г, 18,18мМ) в ДМЭ (6,5мл)Полученную смесь размешивали в течение 1 часа при комнатной температуре, и добавляли раствор 1-(1,1диметилэтил)сложного эфира 4-кето-1пиперидинкарбоновой кислоты (2,5г, 12,55мМ) в ДМЭ (12,5мл) После размешивания в течение ночи (15 часов), смесь концентрировали Остаток очищали с помощью флеш-хроматографии на селикагеле (5 -> 20% ЕЮАо-гексаны) и получали целевое соединнние (3,06г, 91%) в виде белого твердого вещества 'Н-ЯМР (CDCI3) 5 5,71 (с, 1Н), 4,16(кв , 2Н, J = 7,1 Гц), 3,45 - 3,53 (м, 4Н), 2,94(т, 2Н, J = 5,7Гц), 1,28(т, 2Н, J = 5,6Гц), 1,48(с, 9Н), 1,28(т, ЗН, J = 7,1 Гц) b) 4-Этоксикарбонилметил-1пиперидинкарбоновая кислота, 1 -(1,1 диметилэтил)сложный эфир Смесь олефина, полученного в стадии (а) (3,05г, 11,ЗмМ) и 10% Pd/C (1,2г, 1,13мМ) в ЕЮН (50мл) гидрировали в шейкере Парра при давле 54 нии 50фунт/кв дюйм (3,45бар) в течение полутора часов Полученную смесь фильтровали через прокладку из Целита ™, а фильтрат концентрировали, в результате чего получали целевое соединение (3,07г, количественный выход) в виде бесцветного маслообразного продукта 'Н-ЯМР (CDCI3) 5 4,14(кв , 2Н, J = 7,0Гц), 4,05 4,12(м, 2Н), 2,72(ширдт, 2Н, J = 12,1Гц, J = 2,8Гц), 2,23(д, 2Н, J = 7,2Гц), 1,85 - 1,95(м, 1Н), 1,61 1,66(м, 2Н), 1,45(с, 9Н), 1,26(т, ЗН, J = 7,0Гц), 1,05 1,23(м, 2Н) c) 4-Гидроксизтил-1-пипеиидинкарбоновая кислота 1-(1,1-диметилэтил) сложный эфир Повторяли процедуру, описанную в Примере 1Ь, используя слолный эфир, полученный в стадии (Ь) (3,06г, 11,ЗмЛ) и алюмогидрид лития (0,47г, 12,4мМ) в ТГФ (105мл) После очистки с помощью флеш-хроматографии на силикагеле (50%ЕЮАсгексаны) получали непрореагировавший исходный материал (0,73г, 24%) и целевое соединение (1,74г, 68%) в виде бесцветного маслообразного продукта 'Н-ЯМР (CDCI3) 4,07(ширд, 2Н, J = 14,1 Гц), 3,71 Сг, 2Н, J = 6,5Гц), 2,69(ширт, 2Н, J = 12,5Гц), 1,50-1,70 (м, 6Н), 1,45(с, 9Н), I, = 5-1,15(м, 2Н) d) 4-Иодоэтил-1-пиперидинкарбоновая кислота, 1-(1,1 -диметилэтил)сложный эфир Повторяли процедуру, описанную в Примере 1с, используя спирт, полученный в стадии (с) (1,74г, 7,59мМ), трифенилфосфин (2,49г, 9,49мМ), йод (2,31г, 9,11мМ), и пиридин (1,5мл, 18,2мМ) в бензоле (50мл) После очистки получали целевое соединение (2,27г, 98%) в виде бесцветного маслообразного продукта 'Н-ЯМР (CDCI3) 5 4,09(ширд, 2Н, J = 11,4Гц), 3,22(т, 2Н, J = 7,3Гц), 2,70(ширт, 2Н, J = 12,5Гц), 1,78(кв, 2Н, J = 6,9Гц), 1,47 - 1,68(м, ЗН), 1,46(с, 9Н), 1,12(ддд, 2Н, J = 24,2Гц), J = 12,9Гц, J = 4,3Гц) e) 4-[3-[1,2-Бензиксазол-3-ил)пропил]-1 пиперидинкарбоновая кислота, 1 -(1,1 диметилэтил)сложный эфир Повторяли процедуру, описанную в Примере 1в, используя 3-метил-1,2-бензизоксазол (0,412г, 3,09мМ), иодид, полученный в стадии о (1,15г, 3,4мМ), и IM LDA (3,4мл, З.ЗмМ) в ТГФ (8мл) После очистки получали целевое соединение (0,694г, 65%) в виде бледно-желтого маслообразного продукта 'Н-ЯМР (CDCI3) 5 7,65(д, 1Н, J = 8,0Гц), 7,54 7,57(м, 2Н), 7,27 - 7,34(м, 1Н), 4,08(шир д, 2Н, J = 12,5Гц), 2,99(т, 2Н, J = 7.6ГЦ), 2,66(ширт, 2Н, J = 12,0Гц), 1,86-1,92(м, 2Н), 1,63-1,68(м, 4Н),1,45(с, 9Н), 1,36-1,45(м, 1Н), 1,06-1,12(м, 2Н) f) 3-[2-[1-(фенил метил)-4-пиперидил]пропил]1,2-бензизоксазол-малеат Повторяли процедуру, описанную в Примере 1е, используя пиперидин, полученный в стадии (е) (0,544г, 1,58мМ) и ТФК (4мл) в метиленхлориде (16мл), и триэтиламин (1,1мл, 7,9мМ) и бензилбромид (0,21 мл, 1,74мМ) в метиленхлориде (10мл) После очистки с помощью хроматографии (2 -> 5%МеОН-СН2СЬ) получали целевое соединение (свободное основание) (0,285г, 54%) в виде бледно-желтого маслообразного продукта Малеат (соль) получали путем добавления 55 45944 56 1 малеиновой кислоты (0,109г, 0,94мМ), растворенной в минимальном количестве этанола, к раствоEIMS 3,18 (М+, свободное основание), ру свободного основания (0,285г, 0,85мМ) в мети201,227, 172, 91 (основание) ленхлориде (10мл) После кон центри ро вал ия, Анализ для C21H22N2O C4H4O4 остаток очищали путем перекристаллизации Вычислено С 69,11, Н 6,03, N 6,45 (ЕЮАо) и получали целевое соединение (0,292г, Найдено С 69,04, Н 6,27, N 6,38 76%) в виде беловатого твердого вещества Т пл Пример 25 134,5-135,5°С 3-[2-[1-(фенилметил)-4-пиперазинил]этил]-1,2бензизоксазол, дигидрохлоридная соль 'Н-ЯМР (ДМСО-de) 5 7,90(д, 1Н, J = 7,9Гц), 7,61 - 7,72(м, 2Н) 7,47(с, 5Н), 7,38(т, 1Н, J = 7,3Гц), 6,04(с, 2Н), 4,26(ширс, 2Н), 3,22/3,45(м, 2Н), 2,99(т, 2Н, J = 7,4Гц), 2,70 - 2,96(м, 2Н), 1,70 . 2НСІ 1,90(м, 4Н), 1,40 -1,65(м, 1Н), 1,20 -1,40(м, 4Н) 13 С-ЯМР (ДМСО-de) 5 167,2, 162,2, 158,4, 135,8, 131,2, 130,3, 129,5, 128,9, 123,5, 122,1, Смесь 3-[2-хлорэтил]-1,2-бензизоксазола 121,2, 109,7, 59,3, 51,7, 34,8, 32,6, 28,9, 24,5, 24,1 1 (0,55г, З.ОЗмМ) и N-бензилпиперазина (1,06мл, ИК(КВг) 2942, 1705, 1581, 1460, 1359см 6,06мМ) в ксилоле (4мл) нагревали в течение 4,75 EIMS 334 (М+, свободное основание), часов при 150°С Охлажденную смесь разбавляли 243,202,173 (основание), 91 этиленхлоридом и промывали водой ОрганичеАнализ для C22H26N2O C4H4O4 ский слой осушали сульфатом магния, фильтроВычислено С 69,31, Н 6,71, N 6,22 вали и концентрировали После очистки с помоНайдено С 69,11, Н 6,64, N6,46 щью флеш-хроматографии на силикагеле (50% Пример 24 ЕЮАс-гексан) (100% ЕЮАс) получали целевое Транс-3-[2-[1 -(фенилметил)-4соединение (свободное основание) (0,337г, 35%) в пиперидил]этенил]-1,2-бензиксазол-малеат виде бледно-желтого маслообразного продукта СОгН NaH (60% дисперсия в минеральном масле, 0, Юг, 2,51 мМ) добавляли к смеси 3трифенилфосфонийметил-1,2бензизоксазолбромида (1,19г, 2,51 мМ) в ТГФ (10мл) После 1-часового размешивания при комнатной температуре добавляли раствор 4карбоксальдегид-1-фенилметилпиперидина (0,51 г, 2,51 мМ) в ТГФ (2мл) Полученную смесь размешивали 4 часа и фильтровали Фильтрат концентрировали, а остаток распределяли между диэтиловым эфиром и водой Отделенный органический слой осушали сульфатом магния, фильтровали и концентрировали После очистки с помощью флеш-хроматографии на силикагеле (40% EtOAc-гексан) получали целевое соединение (свободное основание) (0,483г, 60%) в виде бесцветного маслообразного продукта Малеат (соль) получали путем добавления малеиновой кислоты (0,194г, 1,67мМ), растворенной в минимальном количестве этанола, к раствору свободного основания (0,483г, 1,52мМ) в Et2 50мл) Реакционную смесь экстра 57 45944 58 пировали метиленхлоридом, а органический слой Пример 28 осушали сульфатом магния, фильтровали и концентрировали После очистки с помощью флэшхроматографни на силикагеле (СН2СІ2 -> 3% МеОН-СНгСЬ) получали целевое соединение (свободное основание) (0,056г, 14%) в виде беловатого пенистого продукта Мезилат (соль) получали путем добавления метансульфоновой кислоты (0,009мл, 0,144мМ) к раствору свободного основания (0,056г, 0,044мМ) 5,7-Дигидро-3-[2-[1-(2-хлоро-5-тиофенметил)в метиленхлориде (5мл) После концентрирова4-пиперидинил]этил]-6Н-пирроло[4,5-1]-1,2лия, остаток растирали с этиловым эфиром и побензизоксазол-6-он лучали целевое соединение (0,049г, 70%) в виде Повторяли процедуру, описанную в примере беловатого твердого вещества Т пл 164 - 165°С 12f, используя 4-[2-[5,7-дигидро-6Н-пирроло[4,5-1](разлож) 1,2-бензизоксазол-6-он-3-ил]этил]-1 'Н-ЯМР (ДМСО-de) 5 7,69(с, 1Н), 7,49(С, 5Н), пиперидинкарбоновой кислоты 1 -(1,1 7,32(с, 1Н), 4,28 (с, 2Н), 3,64(с, 2Н), 3,35(шир д, диметилэтил) сложный эфир (0,328г, 0,851 мМ) и 2Н J = 11,6Гц), 3,18(с, ЗН), 2,85 - 2,99(м, 4Н), ТФК (2мл) в CH2CI2 (8мл) В стадии алкилирования 2,30(с, ЗН), 1,95(ширд, 2Н, J = 12,9Гц, 1,66 использовали лишь часть неочищенной соли 1,80(м, 2Н, 1,45 - 1,60(м, 1Н), 1,35 - 1,44(м, 2Н) Na2CO3 (0,175г, 1,66мМ) и 2-хлоро-5EIMS 389 (М + , свободное основание), 298, 217, хлорометилтиофен (0,048мл, 0,40мМ) в ДМФ 200, 185 (основание), 172 (Змл) После очистки (2 - 4% МеОН-СН2СІ2), полуВРМС для C24H27N3O2 CH3SO3H вычислено чали целевое соединение (0,0514г, 43%) в виде 389,2104, найдено 389,2075 белого твердого вещества Т пл 202 - 204°С Пример 27 (разлож) 5,7-Дигидро-7-этил-3-[2-[1-(Фенилметил)-4'Н-ЯМР (ДМСО-de) 5 10,8(с, 1Н), 7,62(с, 1Н), пиперидинил]этил]-6Н-пирроло[4,5-1]-1,26,97(с, 1Н) 6,92(д, 1Н, J = 3,7Гц), 6,80(д, 1Н, J = бензизоксазол-6-она мезилат 3,7Гц), 3,57(с, 2Н), 3,55(с, 2Н), 2,81 - 2,93(м, 4Н), Q1,91 (шир т, 2Н, J = 10,7Гц), 1,61 - 1,71(м, 4Н), 1,11 -1,23(м, ЗН) си І $0BtJ 13 С-ЯМР (ДМСО-de) 5 176,7, 162,9, 158,3, 146,5, 142,8, 127,0, 126,1, 125,1, 123,2, 117,1, 115,1, 90,1, 57,0, 53,0, 35,0, 34,8, 33,9, 31,6, 21,9, ИК (КВг) 3174, 2950, 1702, 1631, 1453, 1330см 1 Повторяли процедуру, описанную в Примере EIMS 398, 382, 350, 322, 236, 172, 91, 81 (ос26, используя 5,7-дигидро-3-[2-[1-(фенилметил)-4нование) пиперидинил]этил]-6Н-пирроло[4,5-1]-1,2бензизоксазол-6-он (0,374г, 1,0мМ), NaH (0,068г, ВРМС для C21H22CIN3O2S вычислено 1,7мМ), и этилиодид (0,16мл, 2,0мМ) в ДМФ 415,1122, найдено 415,1085 (10мл) После очистки получали целевое соедиАнализ для C21H22CIN3O2S 0,5Н2О нение (свободное основание) (0,076г, 19%) в виде Вычислено С 59,36, Н 5,46, N 9,89 бледно-желтого маслообразвого продукта Найдено С 59,21, Н 5,12, N 9,65 Мезилат (соль) получали путем добавления Пример 29 метансульфоновой кислоты (0,007мл, 0,112мМ) к 5,7-Дигидро-3-[2-[1-(2-метил-4-тиазолометил)раствору свободного основания (0,045г, 0,112мМ), 4-пиперидинил]зтил]-6Н-пирроло[4,5-1]-1,2в CH2CI2 (5мл) После концентрирования, остаток бензизоксазол-6-он растирали с Et2 60°С) 'Н-ЯМР (ДМСО-de) 5 7,69(с, 1Н), 7,48(с, 5Н), 7,39(с, 1Н), 4,27(с, 2Н), 3,77(шир кв , 2Н, J = 7,1 Гц), 3,64(с, 2Н), 3,34 - 3,39(м, 2Н), 2,92 - 2,98(м, 4Н), 2,30(с, ЗН), 1,94(ширд, 2Н, J = 12,8), 1,66- 1,78(м, 2Н), 1,30-1,60(м, ЗН), 1,16(т, ЗН, J = 7,1Гц) 13 С-ЯМР (ДМСО-de) 174,5, 163,2, 158,1, 147,0, Повторяли процедуру, описанную в Примере 131,4, 131,0, 129,8, 129,6, 128,9, 121,2, 117,0, 12f, используя 4-[2-[5,7-дигидро-6Н-пирроло[4,5-1]115,2, 90,0, 59,3, 51,6, 34,5, 34,4, 33,0, 32,6, 28,5, 1,2-бензизоксазол-6-он-3-ил]этил]-1 21,6, 12,3 пиперидинкарбоновой кислоты 1 -(1,1 ИК (КВг) 2934, 1716, 1630, 1605, 1466, 1330см диметилэтил) сложный эфир (0,367г, 0,952мМ), и 1 ТФК (2,5мл) в метиленхлориде (10мл) , и ЫагСОз EIMS 403 (М + , свободное основание), 386, 312, (1,01 г, 9,52мМ) и 4-хлорометил-2-метилтиазола 185 (основание), 172 гидрохлоридную соль (0,210г, 1,142мМ) в ДМФ (10мл) После очистки с помощью хроматографии ВРМС для C25H29N3O2 CH3SO3H (4% МеОН-ЕЮАс) с последующей перекристаллиВычислено 403,22605, найдено 403,22761 59 45944 60 зацией (ЕЮАс-гексан) получали целевое соедипиперидинкарбоновой кислоты 1 -(1,1 нение (0,074г, 20%) в виде белого твердого вещедиметилэтил) сложный эфир (0,50г, 1,ЗмМ) и ТФК ства Т пл 172 - 173°С (разлож) (Змл) в CH2CI2 (12мл), и Na2CO3 (0,689г, 6,5мМ ) и 'Н-ЯМР (CDCI3) 5 9,40(ширс, 1Н), 7,41 (с, 1Н), 4-бромобензилбромид (0,39г, 1,56мМ) в ДМФ 7,05(с, 1Н), 7,02(с, 1Н), 3,72(с, 2Н), 3,61 (с, 2Н), (15мл) После очистки с помощью хроматографии 3,07(ширд, 2Н, J = 11,3Гц), 2,93(т, 2Н, J = 7,8Гц), (CH2CI2 -» 5% MeOH-CH2CI2) получали целевое 2,69(с, ЗН), 2,15(шир т, 2Н, J = 10,8Гц), 1,76 соединение (0,415г, 70%) в виде беловатого твер1,85(и, 4Н), 1,42-1,55(м, ЗН) дого вещества Т пл 177-178°С 13 С-ЯМР (CDCI3) 5 177,4, 166,0, 163,6, 158,3, 'Н-ЯМР (CDCI3) 5 9,98(шир с, 1Н), 7,37 - 7,40(м, 151,7, 145,1, 122,2, 116,8, 116,3, 91,5, 57,9, 53,4, ЗН), 7,16 (д, 2Н, J = 8,2Гц), 6,99(с, 1Н), 3,60(с, 2Н), 35,4, 34,8, 34,0, 31,2, 22,5, 19,2 3,42(с, 2Н), 2,87 - 2,94(м, 4Н), 1,94(ширт, 2Н, J = ИК (КВг) 3101, 3015, 2938, 2924, 1713, 1633, 10,5Гц), 1,65-1,80(м, 4Н), 1,20-1,35(м, ЗН) 1 13 1456, 1328см С-ЯМР (CDCI3) 5 178,1, 163,5, 158,4, 145,2, EIMS 396 (М+), 379, 284, 267, 206 (основание) 137,3, 131,2, 130,8, 122,2, 120,7, 116,7, 116,3, 91,5, ВРМС для C21H24N4O2S вычислено 396,1621, 62,5, 53,5, 35,5, 35,2, 34,2, 31,9, 22,5 найдено 396,1631 Пример 32 Пример 30 5,7-Дигидро-3-[3-[1-(фенилметил)-43-[2-[1 -(3-Бромофенилметил)-4пиперидинил]пропил]-6Н-пирроло[4,5-1]-1,2пиперидинил]этил]-5,7-дигидро-6Н-пирроло[4,5-1]бензизоксазол-6-он 1,2-бензизоксазол-6-он Повторяли процедуру, описанную в Примере 12f, используя 1-[1,1-диметилэтил)сложный эфир 4-[2-[5,7-дигидро-6Н-пирроло-[4,5-1]-1,2бензизоксазол-6-он-3-ил]этил]-1пиперидинкарбоновой кислоты (0,50г, 1,30мМ) и ТФК (Змл) в метиленхлориде (12мл), и Ыа2СОз (0,689г, 6,5мМ) и 3-бромобензилбромид (0,46г, 1,84мМ) в ДМФ (20мл) После очистки с помощью хроматографии (СН2СІ2 -» 5% МеОЕ-СН2СІ2) получали целевое соединение (0,314г, 53%) в виде бледно-желтого твердого вещества После перекристаллизации (ЕЮАс, два раза) получали белый твррдый продукт (0,076г, 13%) Т пл 173-174°С 'Н-ЯМР (CDCI3) 5 8,77(с, 1Н), 7,47(с, 1Н), 7,41 (с, 1Н), 7,36(д, 1Н, J = 7,7Гц), 7,23(д, 1Н, J = 7,9Гц), 7,16(т, 1Н, J = 7,7Гц), 7,00(с, 1Н), 3,61 (с, 2Н), 3,46(с, 2Н), 2,86 - 2,96 (м, 4Н), 1,90 - 2,02(м, 2Н), 1,70 -1,85(м, 4Н), 1,30 -1,42(м, ЗН) 13 С-ЯМР (CDCI3) 5 177,1, 163,5, 158, 4, 144,7, 132,0, 130,1, 129,8, 127,8, 122,3, 122,0, 116,5, 91,5, 62,6, 53,6, 35,3, 35,2, 34,3, 31,9, 22,6 Пример 31 3-[2-[1 -(4-Бромофенилметил)-4пиперидинил]этил]-5,7-дигидро-6Н-пирроло[4,5-1]1,2-бензизоксазол-6-он Повторяли процедуру, описанную в Примере 12f, используя 4-[2-[5,7-дигидро-6Н-пирроло[4,5-1]1,2-бензизоксазол-6-он-3-ил]этил]-1 а) 4-[3-[5,7-Дигидро-6Н-пирроло[4,5-Г]-1,2бензизоксазол-6-он-3-ил]пропил]-1пиперидинкарбоновая кислота, 1 -(1,1 диметилэтил)сложный эфир Повторяли процедуру, описанную в Примере 7а, используя 5,7-дигидро-3-метил-6Нпирроло[4,5-1]-1,2-бензизоксазол-6-он (0,1 Зг, 0,69мМ), IM LDA (2,8мл, 2,8мМ), и 4-одоэтил-1пиперидинкарбоновой кислоты 1 -(1,1 диметилэтил)сложный эфир (0,233г, 0,69мМ) в сухом ТГФ (14мл), за исключением того, что после добавления реагентов, смесь размешивали при 78°С в течение 4 часов После очистки с помощью хроиатографии (10% -» 50% ЕЮАс-СН2СІ2) получали восстановленный исходный материал (0,031г, 24%) и целевое соединение (0,129г, 47% в виде бесцветного маслообразного продукта 'Н-ЯМР (CDCI3) 5 9,50(с, 1Н), 7,42(с, 1Н), 7,04(с, 1Н), 4,06(ширд, 2Н, J = 14,5Гц), 3,62(с, 2Н), 2,91 Сг, 2Н, J = 7,5Гц), 2,66(дт, 2Н, J = 13,0Гц, J = 2,0Гц), 1,81 - 1,87 (м, 2Н), 1,65(ширд, 2Н, J = 12,3Гц), 1,44(с, 9Н), 1,34 - 1,43 (м, ЗН), 1,09 1,20(М, 2Н) о) 5,7-Дигидро-3-[3-[3-[1-(фенилметил)-4пиперидил]пропил]-6Н-пирроло[4,5-1]-1,2бензизоксазол-6-он Повторяли процедуру, описанную в Примере 12f, используя пиперидин, полученный в стадии (а), (0,114г, 0,29мМ) и ТФК (1,5мл) в CH2CI2 (6мл), и Na2CO3 (0,154г, 1.45ММ) и бензилбромид (0,042мл, 0,35мМ) в ДМФ (5мл) После очистки с помощью хроматографии (CH2CI2 -> 5% МеОНCH2CI2) получали целевое соединение (0,070г, 62%) ввиде белого пенистого твердого продукта Этот продукт перекристаллизовывали (CH2CI2) и получали белое твердое вещество (0,054г, 48%) Т пл 164-166°С 'Н-ЯМР (CDCI3) 5 9,73(ширс, 1Н), 7,41 (с, 1Н),
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61K 31/47, A61K 31/517, A61P 43/00, A61K 31/451, C07D 211/24, C07D 413/06, C07D 217/14, C07D 241/42, A61P 25/28, C07D 211/60, C07D 261/20, A61K 31/472, C07D 491/056, C12N 9/99, A61K 31/41, C07D 239/74, C07D 417/06, C07D 253/00, C07D 401/06, C07D 413/14, A61K 31/445, C07D 231/56, A61P 25/02, A61K 31/496, C07D 211/32, C07D 498/04, C07D 211/38, A61K 31/4427, A61K 31/415, A61K 31/425, C07D 211/30, C07D 413/12, A61K 31/505, C07D 513/04
Мітки: сполуки, фармацевтично, одержання, інгібування, солі, гетероцикло-циклічні, похідні, проміжні, спосіб, гетероцикло-циклічних, фармацевтична, прийнятні, амінів, похідних, холінестерази, композиція
Код посилання
<a href="https://ua.patents.su/35-45944-geterociklo-ciklichni-pokhidni-aminiv-abo-kh-farmacevtichno-prijjnyatni-soli-promizhni-spoluki-farmacevtichna-kompoziciya-sposib-ingibuvannya-kholinesterazi-sposib-oderzhannya-gete.html" target="_blank" rel="follow" title="База патентів України">Гетероцикло-циклічні похідні амінів або їх фармацевтично прийнятні солі, проміжні сполуки, фармацевтична композиція, спосіб інгібування холінестерази, спосіб одержання гетероцикло-циклічних похідних амінів</a>
Попередній патент: Похідні 4-бензоїлізокcазолу, спосіб їх одержання (варіанти), гербіцидна композиція та спосіб боротьби з бур’янами
Наступний патент: Похідні піперазинілпентаміду, спосіб їх отримання та фармацевтична композиція для інгібування віл-протеази
Випадковий патент: Процес лікування гострого травматичного ушкодження легенів