Карбенові комплекси паладію
Номер патенту: 112395
Опубліковано: 25.08.2016
Автори: Коротких Микола Іванович, Швайка Олексій Павлович, Попов Анатолій Федорович, Сабєров Вагіз Шамільйович
Формула / Реферат
1. Карбенові комплекси паладію загальної формули (LnPdX2)p,
де L означає карбеновий ліганд (І):
1,3-дизаміщений імідазол-2-іліден загальної формули
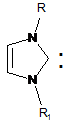 , (І)
, (І)
де R, R1 означають арильні замісники, що містять в 2- і 6-положеннях ароматичного ядра бензгідрильну (CHPh2)-групу, а в 4-положенні - алкільні групи;
X означає некарбеновий ліганд - галогенід;
n дорівнює 1, 2;
p дорівнює 1, 2,
за умови, якщо p дорівнює 2, то Х не є хлором, а алкіл в 4-положенні не є метилом.
2. Карбенові комплекси паладію за п. 1, які відрізняються тим, що як алкіл в 4-положенні містить метильну або етильну групи, як X - хлорид або йодид.
Текст
Реферат: Карбенові комплекси паладію належать до органічної хімії і можуть застосовуватись як каталізатори реакції відновного дегалогенування галогенароматичних сполук. Заявлено нові карбенові комплекси паладію загальної формули (LnPdX2)p, де L означає карбеновий ліганд (І): 1,3-дизаміщений імідазол-2-іліден, а кожний з n, p дорівнює 1, 2. Заявлені карбенові комплекси паладію проявляють високу каталітичну активність при короткій тривалості процесу, низьких витратах каталізатора та високому виході продукту каталітичної реакції відновлення галогенароматичних сполук. Вони є економічними, виходи продуктів каталітичної реакції сягають 100 %, показники TON і TOF для найкращих варіантів нових каталізаторів досягають -1 -1 значень 318000-330000 і 13250-13750 год. відповідно (за прототипом 88000 і 3667 год. ), витрати каталізатора при кількісних конверсіях n-дихлорбензену та гексахлорбензену в 3,57 і 3,33 разу нижчі, ніж за прототипом (0,00112 і 0,003 моль % проти 0,004 і 0,01 моль %). 0 UA 112395 C2 5 10 15 Винахід належить до органічної хімії, точніше - до нових карбенових комплексів паладію, що можуть застосуватись як каталізатори реакції відновного дегалогенування (гідродегалогенування) галогенароматичних сполук (галогенаренів). Карбени - це сполуки двовалентного вуглецю загальної формули R 1R2C:, де R1, R2 - алкільні, арильні або гетероциклічні радикали. R 1, R2 також можуть складати карбо- та гетероцикли. Карбени дають з атомами металів координаційні зв'язки, утворюючи карбенові комплекси металів. Карбенові комплекси металів можуть застосовуватися як каталізатори органічних реакцій, в т.ч. реакцій відновлення. Останнім часом став розвиватися один з найпростіших промислово перспективних способів відновлення галогенароматичних сполук, в якому галоген замінюється на водень (гідродегалогенування) і який полягає у взаємодії ароматичної сполуки (субстрату), що містить галоген (хлор, бром, йод, флуор), з основою (алкоксидом або гідроксидом металу) в спиртах в присутності карбенокомплексного каталізатора реакції гідродегалогенування (N-Heterocyclic Carbenes in Synthesis / Ed. by S. P. Nolan. Weinheim: Wiley VCH Verlag GmbH & Co KgaA., 2006. p. 68). ROH + i-PrOM ROM + i-PrOH R = H, Alk ; M = Li, Na, K 2 i- PrOM Cl Cl cat., i-PrOH -2 MCl -2 Me2CO 20 25 30 Ефективність каталізу оцінюється за максимальними значеннями показників TON і TOF (TON (turnover number) - число каталітичних циклів, що дорівнює числу моль продукту реакції на моль каталізатора; TOF (turnover frequency) - число каталітичних циклів за годину, тобто, відношення кількості каталітичних циклів до тривалості реакції (Poyatos M., Mas-Marza E., Mata J.A. et al. Eur. J. Inorg. Chem. 2003. - № 6-P. 1215). Відомі карбенові комплекси паладію, які синтезують in situ на основі дибензиліденацетонового комплексу паладію Pd2(dba)3 й 1,3-дизаміщених імідазолін-2-іліденів і використовують як каталізатори реакції гідродегалогенування. Вони дають можливість отримувати високі виходи продуктів гідродегалогенування при температурі 100 °C в діоксані [Viciu Μ.S., Grasa G.Α., Nolan S.P. Organometallics. - 2001.- Vol. 20, № 16.- P. 3607]. Але -1 каталітична ефективність комплексів невисока (TON до 28-50, TOF до 28-50 год. ). Відомий карбеновий комплекс паладію структури A [Davies С.J. E., Page Μ.J., Ellul С.Ε., Mahon Μ. F., Whittlesey M.К. Chem. Commun. - 2010. - Vol. 46.-P. 5151]. N N Mes Mes Ni Br PPh3 A 35 40 Відомий комплекс А показує в реакції дебромування n-бромфлуоробензену та дехлорування -1 n-хлорфлуоробензену невисоку каталітичну ефективність при 25 °C (TON 15-22 і TOF 4-44 год. і концентрації каталізатора 4,5 моль %), не зважаючи на те, що вказані субстрати є активованими (електроноакцепторний вплив атомів флуору). Відомий карбеновий комплекс паладію формули В забезпечує помірну ефективність каталізу в реакціях гідродегалогенування монохлорбензенів при кімнатній температурі (TON -1 100, TOF 200 год. ) [Navarro О., Marion Ν., Oonishi Υ., Kelly R. Α., Nolan S. P. J. Org. Chem. 2006. - Vol. 71, № 2. - P. 685]. 1 UA 112395 C2 N Cl Pb N NMe B 5 Але відома сполука В не дозволяє досягти високої ефективності каталізу для ди- і полізаміщених хлорбензенів. Відомий карбеновий комплекс паладію С дозволяє проводити гідродегалогенування дигалогензаміщених аренів, наприклад, n-дихлорбензену [Navarro О., Kaur Н., Mahjoor P., Nolan S. P. J. Org. Chem. - 2004. - Vol. 69, № 9. - P. 3173]. N All Pb N C 10 15 20 Cl Недоліком відомої сполуки С є недостатня ефективність каталізу (при 60 °C TON 200, TOF -1 110 год. ). В цій же роботі наведено ще один варіант виконання каталізу комплексом С при застосуванні мікрохвильового опромінювання при 120 °C, що дає найвищу швидкість реакції, причому майже кількісний вихід продукту досягається всього за 2 хв. (TON 4000, TOF 120000 -1 -1 год. для N-хлортолуену; TON 1900, TOF 57000 год. для N-дихлорбензену). Але наведений варіант застосування відомого карбенового комплексу паладію С є енергоємним і пов'язаний з поки що нетехнологічним мікрохвильовим обладнанням. Тому така технологія на сьогодні не може бути промисловою. Відомий карбеновий комплекс паладію D [Akzinnay S., Bisaro F., Cazin С. S. J. Chem. Commun-2009. - Vol. 45. - P. 5752] застосовано як каталізатор в реакції гідродегалогенування поліхлорбіфенілів при 80 °C в ізопропанолі. 2 UA 112395 C2 N Cl N Cl Pb N Cl Pb Cl N D -1 5 10 Каталізатор D дозволяє досягти високих TON і TOF у вказаних умовах (10000 і 417 год. відповідно), вищих за такі для структур А - С. За нашими даними у дехлоруванні ядихлорбензену в присутності відомого комплексу-прототипу D значення TON і TOF складають -1 -1 6400 і 266 год. (реагент - трет-бутоксид натрію), 17600 і 734 год. (реагент - трет-бутоксид -1 калію), 19200 і 800 год. (реагент - гідроксид натрію). Недоліком відомого комплексу D є недостатньо висока ефективність й економічність використання як каталізатора (довготривалість процесу - до 24 год., що позначається на показникові TOF, знижуючи його). Найближчим за суттю та досягнутим результатом до пропонованого є вибраний за найближчий аналог відомий карбеновий комплекс паладію структури Ε [Пат. 77420 (Україна) / М.І. Короткіх, В.Ш. Сабєров, Н.В. Глиняна, А.В. Кисельов, А.Ф. Попов, О.П. Швайка. - Заявл. 21.08.12; № u 2012 10042; опубл. 11.02.13]. 15 I N Pb N I I N Pb I N E 20 25 30 35 Каталізатор Е дозволяє досягти високих TON і TOF, вищих за такі для структур А - D. Так, у гідродехлоруванні n-дихлорбензену в присутності відомого комплексу-прототипу Ε значення -1 -1 TON і TOF складають 60000 і 2500 год. (реагент - трет-бутоксид натрію), 62000 і 2583 год. -1 (реагент - трет-бутоксид калію), 42000 і 1750 год. (реагент - гідроксид натрію), у -1 гідродихлоруванні гексахлорбензену 88000 і 3667 год. (реагент - трет-бутоксид калію). Недоліком відомого комплексу-найближчого аналогу Е є недостатньо висока ефективність й економічність використання як каталізатора. В основу винаходу поставлено задачу запропонувати нові карбенові комплекси паладію, які проявляють високу каталітичну активність при низьких витратах каталізатора та високому виході продукту каталітичної реакції відновлення галогенароматичних сполук. Запропоновані нові карбенові комплекси є економічними, виходи продуктів каталітичної реакції сягають 100 %, показники TON і TOF для найкращих варіантів нових каталізаторів в гідродегалогенуванні -1 гексахлорбензену досягають значень 318000-330000 і 13250-13750 год. відповідно (за -1 найближчим аналогом 88000 і 3667 год. ), витрати каталізатора при кількісних конверсіях nдихлорбензену та гексахлорбензену в 3,57 та 3,33 разу нижчі, ніж за найближчим аналогом (0,00112, 0,003 моль % проти 0,004, 0,01 моль %). 1. Поставлена задача вирішується тим, що створено карбенові комплекси паладію загальної формули (LnPdX2)p, 3 UA 112395 C2 де L означає карбеновий ліганд (І): 1,3-дизаміщений імідазол-2-іліден загальної формули R N : N R1 5 10 15 20 25 , (I) де R, R1 означають арильні замісники, що містять в 2- і 6-положеннях ароматичного ядра бензгідрильну (CHPh2) групу, а в 4-положенні - алкільні групи; X означає некарбеновий ліганд - галогенід; n дорівнює 1, 2; p дорівнює 1, 2, за умови, якщо p дорівнює 2, то Х не є хлором, а алкіл в 4-положенні не є метилом. Ще однією відмінністю винаходу, що заявляється, є те, що карбенові комплекси паладію за п. 1, що відрізняються тим, що як алкіл в 4-положенні застосовують метильну або етильну групи, як X - хлорид або йодид. Між сукупністю ознак винаходу та технічним результатом, якого можна досягти при його реалізації, існує причинно-наслідковий зв'язок. Запропоновані нові карбенові комплекси мають переваги перед відомим (прототипом) карбенопаладієвим комплексом Е: -1 - вища каталітична ефективність (в оптимальному варіанті TON 180000 і TOF 7500 год. -1 проти 62000 і 2167 год. відповідно в реакції n-дихлорбензену з ізопропанолом в присутності трет-бутоксиду калію); - можливість використовувати каталізатор для ефективного гідродегалогенування полігалогенаренів, зокрема, стійкого органічного забруднювача гексахлорбензену, що дозволяє досягти найвищого рівня ефективності каталізу на сьогодні (в оптимальному варіанті TON -1 -1 318000-330000 і TOF 13250-13750 год. проти 88000 і 3667 год. для комплексу Е; - вища економічність каталізу через в 3,57 разу нижчі витрати каталізатора (0,00112 моль % проти 0,004 моль %) при кількісних конверсіях n-дихлорбензену) та в 3,33 разу нижчі витрати каталізатора (0,003 моль % проти 0,01 моль %) при кількісних конверсіях гексахлорбензену). Результати оцінки каталітичної ефективності синтезованих сполук (LnPdX2)p (1) - (4) наведено в таблицях 1 і 2. 30 R' R' R'' R'' R N N R R'' Pb R'' R' X X (1) - (4) 4 R' UA 112395 C2 Таблиця 1 Каталітична ефективність карбенових комплексів паладію (1)-(4) (пор. №№ 1-5) у реакціях гідродегалогенування n-дихлорбензену під дією трет-бутоксиду калію в ізопропанолі при 80 °C*. № п/п Каталізатор 1 2 3 4 5 6 7 5 10 (1) (2) (3) (4) (4) Е** Е** X Сl І Сl І І R СН3 СН3 С2Н5 С2Н5 С2Н5 R' Ph Ph Ph Ph Ph R" Ph Ph Ph Ph Ph Кількість каталізатора, моль % 0,001 0,001 0,001 0,001 0,00112 0.001 0.004 Конверсія, % TON нa 1Cl TOF, год. * 70 53 70 90 100 31 100 140000 104000 140000 180000 178570 62000 50000 5833 4333 5833 7500 7440 2583 2083 -1 Примітки. * Тривалість реакції у всіх експериментах - 24 год.; ** найближчий аналог. Як видно з даних таблиць 1 і 2, каталітична ефективність ряду запропонованих карбенових комплексів паладію (1)-(4) в реакції гідродегалогенування n-дихлорбензену та гексахлорбензену ізопропанолом у присутності основ виявилася значно вищою, ніж у відомого карбенопаладієвого комплексу комплексу-прототипу Ε. Найвищу каталітичну ефективність у гідродегалогенуванні n-дихлорбензену виявлено для комплексів паладію формул (1)-(4) (графа табл. 1 "Каталізатор"). В оптимальних умовах, при застосуванні 0,001 моль % цих каталізаторів в реакції гідродегалогенування n-дихлорбензену -1 значення TON і TOF досягають 104000-180000 і 4333-7500 год. (пор. №№ 1-5 табл. 1) відповідно, помітно перевищуючи максимальні показники відомого карбенопаладієвого -1 комплексу-прототипу Ε (TON 62000, TOF 2583 год. ) (пор. №№ 6, табл. 1). 15 Cl Cl 6 i- PrOM Cl Cl Cl Cl cat., i-PrOH -6 MCl -6 Me2CO Таблиця 2 Каталітична ефективність карбенових комплексів паладію (1) - (4), (пор. №№ 1-5) у реакції гідродегалогенування гексахлорбензену під дією трет-бутоксиду калію в ізопропанолі при 80 °C*. № п/п 1 2 3 4 5 6 7 8 20 Каталізатор (1) (2) (2) (3) (4) (4) Е** Е** Кількість каталізатора, моль % 0,001 0,001 0,003 0,001 0,001 0,003 0,003 0,01 Конверсія, % TON на 1С1 21 126000 55 330000 100 200000 35 210000 53 318000 100 200000 44 88000 100 60000 TOF, год. 5250 13750 8333 8750 13250 8333 3667 2500 -1 Примітки. * Тривалість реакції у всіх експериментах - 24 год.; ** найближчий аналог. У реакції гідродегалогенування гексахлорбензену (табл. 2) каталізатори 0Н4) (TON 126000-1 330000, TOF 5250-13750 год. ) також суттєво перевищують рівень ефективності прототипу Ε -1 (TON 88000, TOF 3667 год. ) (пор. №№ 1-6 і 7, табл. 2). 5 UA 112395 C2 5 10 15 20 25 30 35 Економічність процесу із запропонованими каталізаторами (1)-(4) вища, ніж із найближчим аналогом Е. Для досягнення кількісної конверсії n-дихлорбензену при 80 °C необхідна в 3,57 разу менша концентрація каталізатора (4) (0,00112 моль % проти 0,004 моль %) у разі застосування каталізатора-найближчого аналогу (пор. №№ 5 і 7, табл. 1). Для досягнення кількісної конверсії гексахлорбензену при 80 °C необхідна в 3,33 разу менша концентрація каталізатора (4) (0,003 моль % проти 0,01 моль %) у разі застосування каталізаторанайближчого аналогу Ε (пор. №№ 6 і 8 табл. 2). Механізм каталізу карбеновими комплексами паладію реакції гідродегалогенування галогенаренів точно не встановлено. Однак, на основі спостережень утворення в ході реакції сполук паладію(0) та їхніх каталітичних властивостей у реакції можна передбачити, що реакція перебігає через проміжні карбенові комплекси паладію(0) (схема каталізу): Схема каталізу У випадку карбенових комплексів паладію спочатку, ймовірно, відбувається відновлення комплексу паладію(П) (LnPdX2)p алкоксид-аніоном до комплексу паладію(0) LPd. Далі, перебігає приєднання галогенарену до паладію(0) з утворенням активованого аддукту галогенарену та сполуки паладію LPd(Ar)X, обмін галогену на ізопропоксид-аніон з утворенням комплексу LPd(Ar)(O-i-Pr) і розкладання останнього на аддукт паладію та Н-арену LPd(ArH) з відщепленням ацетону. Розпад останнього на арен АrН і комплекс паладію(0) LPd регенерує каталізатор у вигляді комплексу паладію(0). Таким чином, запропоновані карбеновi комплекси перехідних металів загальної формули (LnPdX2)p з лігандами загальної структури І є ефективними каталізаторами реакції гідродегалогенування галогенароматичних сполук. В оптимальному варіанті використання карбенопаладієвого комплексів (2), (4) концентрацію каталізатора можна обирати на рівні -1 тисячних мольного відсотка (TON до 180000, TOF до 7500 год. в гідродегалогенуванні n-1 дихлорбензену та TON до 330000, TOF до 13750 год. в гідродегалогенуванні гексахлорбензену) при високих ступенях конверсії галогенароматичних сполук, що свідчить про високу ефективність каталізу та дає можливість застосування каталізаторів в промисловості. Способи одержання сполук відповідно до пропонованого винаходу. Запропоновані сполуки одержують за новими методиками з використанням вихідних речовин, що є у продажу, які отримують відповідно до звичайних хімічних способів. Так, монокарбенові комплекси (1)-(4) отримано шляхом взаємодії 1,3-дiарилiмідазол-2іліденів В-1-В2, що генеруються або отримуються в індивідуальному вигляді з відповідних солей - 1,3-діарилімідазолію хлоридів А-1, А-2 - дією трет-бутоксидом калію, гідридом натрію або гексаметилдисилазанідом калію, з солями паладію у мольному співвідношенні 1:1 у тетрагідрофурані згідно зі схемою 1 (див. методики одержання сполук відповідно до винаходу, приклади 1-4). 6 UA 112395 C2 5 Сполуки А-1,2 отримували за відомими методиками синтезу імідазолієвих солей в три стадії (схема 2): 1) шляхом реакції Фриделя-Крафтса стерично відкритих амінів С-1,2 з бензгідролом (дифенілкарбінолом) в присутності хлоридної кислоти та хлориду цинку синтезовано відповідні стерично ускладнені аміни D-1,2; 2) дією на стерично ускладнені аміни D-1,2 гліоксалем (СНО)2 отримано відповідні гліоксальдііміни Е-1,2; 3) циклізацією гліоксальдіімінів Е-1,2 з формальдегідом (або його замінниками - параформом, метилалем) в присутності хлориду цинку та хлоридної кислоти (або хлориду цинку та триметилсилілхлориду) синтезовано імідазолієві солі Α-1,2. Схема 1 R R R R' R' R' R' R'' N t-BuOM або MH або MN(SiMe3)2 R'' Cl N R'' R'' - MCl M=Na, K R'' : N N R'' R'' N PdX2 X R'' Pd R'' N R'' R' R' R' X R'' R'' R' R' R' R 10 R' R' R R A - 1,2 (1) - (4) B - 1,2 А-1, B-1, (1), (2) R = СН3, R' - R" = Ph; А-2, В-2, (3), (4) R = С2Н5, R' = R" = Ph;(1),(3)X=Cl;(2),(4)X=I. Схема 2 R R R R R' O R' R' R' R'R''CHOH ZnCl2/HCl NH2 R' R' R'' O HCO2H/PrOH R'' NH2 R'' R'' N N R'' R'' (CH2O)n R'' N+ R'' Cl ZnCl2/HCl N R'' R'' R' R' R' R C - 1,2 E - 1,2 D - 1,2 R' R A - 1,2 15 20 25 А-1, С-1, D-1 R = СН3, R' = R" - Ph; А-2, С-2, D-2 R = С2Н5, R' = R" = Ph. Приклади одержання сполук відповідно до винаходу. 1 13 Спектри Н ЯМР (400 МГц) та спектри С ЯМР (100 МГц) знімали на спектрометрі Bruker Avance II 400 з використанням стандарту Me4Si ( 0,00). Позначення в спектрах ЯМР: с синглет, д - дублет, м - мультиплет. Приклад 1. [1,3-Біс(2,6-дибензгідрил-4-метилфеніл)імідазол-2-іліден]паладію хлорид (1) Стадія 1. 4-Метил-2,6-дибензгідриланілін D-1 отримували за відомою методикою роботи [Berthon-Gelloz G., Siegler Μ. Α., Spek A. L., Tinant В., Reek J. Ν. Η., Marko I. E. Dalton Trans, 2010, 39, 1444] з n-толуїдину С-1 та бензгідролу в присутності хлориду цинку та хлоридної кислоти при 160 °C. 7 UA 112395 C2 5 10 15 20 25 30 35 40 45 50 55 60 Стадія 2. 1,4-Біс-(2,6-дибензгідрил-4-метилфеніл)діазабутадієн Е-1 отримували згідно з методикою роботи [Berthon-Gelloz G., Siegler M. A, Spek A. L., Tinant В., Reek J. Ν. Η, Marko I. E. Dalton Trans., 2010, 39, 1444] з 4-метил-2,6-дибензгідриланіліну D-1 та гліоксалю в н-пропанолі присутності форміатної кислоти. Стадія 3. 1,3-Ди(2,6-дибензгідрил-4-метилфеніл)імідазолію хлорид А-1 отримували згідно з методикою роботи [Berthon-Gelloz G., Siegler Μ. Α., Spek Α. L., Tinant В., Reek J. Ν. Η., Marko I. E. Dalton Trans., 2010, 39, 1444] з 1,4-біс-(2,6-дибензгідрил-4-метилфеніл)діазабутадієну Е-1 та параформу в присутності хлориду цинку та хлоридної кислоти. Стадія 4. [1,3-Біс(2,6-дибензгідрил-4-метилфеніл)імідазол-2-іліден]паладію хлорид (1). До розчину 0,94 г (0,5 ммоль) імідазолієвої солі А-1 в 12 мл абсолютного тетрагідрофурану в атмосфері аргону додавали 1,1 ммоль розчину гексаметилдисилазаніду калію в толуені та перемішували протягом 2 год. Далі додавали 0,19 г (0,5 ммоль) біс(бензонітріл)паладію хлориду Pd(PhCN)2Cl2 та перемішували протягом 5 год. Розчинник випаровували, отриманий комплекс розчиняли в дихлорметані, розчин фільтрували через тонкий шар силікагелю (70/230 мкм), упарювали. Вихід 1,01 г (93 %). Тпл > 250 °C (ацетонітрил). Знайдено, %: С - 75,8; Η - 4,8; Сl-6,8; 1 N-2,6; Pd-10,0. C67H52Cl2N2Pd. Обчислено, %: С - 75,8; Η - 4,9; Сl-6,7; Ν - 2,6; Pd-10,0. Спектр Н 4,5 ЯМР (CDCl3), , мл.: 2,21 (с, 3Н, СН3С), 4,92 (с, 4Н, CHPh), 6,76 (с, 2Н, C HN), 6,85 (м, 8Н), 6,77 13 (м, 8Н), 6,97 (м, 12Н), 7,07 (м, 2Н), 7,27 (м, 12Н) (Аr). Спектр С ЯМР (CDCl3), , м.ч.: 21,0 (СН3С), 50,6 (CHPh), 125,0, 125,9, 126,9, 127,0, 127,9, 128,4, 128,5, 128,7, 128,9, 129,3, 129,6 (Аr), 2 139,7, 141,0, 141,1, 141,3, 142,5 (ipso-C), 156,1 (C -Pd). Приклад 2. [1,3-Біс(2,6-дибензгідрил-4-метилфеніл)імідазол-2-іліден]паладію йодид (1). До розчину 0,94 г (1,0 ммоль) солі А-1 в 16 мл безводного тетрагідрофурану додавали 1,1 моль розчину гексаметилдисилазаніду калію в толуені та перемішували протягом 2 год. Далі до реакційної суміші додавали 0,36 г (1,0 ммоль) йодиду паладію, перемішували протягом 22 год. Розчинник випаровували, отриманий комплекс розчиняли в дихлорметані і розчин фільтрували через тонкий шар силікагелю (70/230 мкм), упарювали. Вихід 1,0 г (80 %). Тпл. > 300 °C 1 4,5 (ацетонітрил). Н ЯМР (CDCl3), , м. ч.: 2,17 (с, 3Н, СН3С), 5,20 (с, 2Н, C HN), 5,56 (с, 4Н, 13 CHPh), 6,79 (м, 12Н), 7,21 (м, 24Н), 7,31 (м, 8Н) (Аr). С ЯМР (CDCl3), , м. ч.: 21,9 (СН3С), 51,3 (CHPh), 123,7, 126,4, 127,0, 127,1, 128,0, 128,3, 128,6, 128,7, 129,0, 129,5, 129,6, 129,6, 130,0 2 (Аr), 139,3, 140,3, 141,4, 141,7, 142,3 (ipso-C), 149,6 (C -Pd). Приклад 3. [1,3-Біс-(2,6-дибензгідрил-4-етилфеніл)імідазол-2-іліден]паладію хлорид (3). Стадія 1. Отримання 2,6-дибензгідрил-4-етиланіліну D-2. Розчин 2,71 г (20,4 ммоль) хлориду цинку в 3,4 мл (40,7 ммоль) 36 % хлоридної кислоти додавали по краплях до суміші 4,92 г (40,7 ммоль) n-етиланіліну С-2 і 15,00 г (81,4 ммоль) бензгідролу при 160 °C до повного затвердіння суміші (біля 3 год.). Залишок розчиняли в 100 мл дихлорметану, розчин промивали насиченим водним розчином хлориду амонію та водою. Органічний шар сушили сульфатом магнію та упарювали. Сухий залишок, що утворився, промивали 50 мл етилацетату до тих пір, поки фільтрат становився безбарвним. Твердий продукт сушили. Вихід 13,5 г (73 %). Тпл. 211-212 °C. 1 Знайдено, %: С - 90,1, Η - 6,8, Ν 3,1. C34H31N. Обчислено, %: С - 90,0, Η - 6,9, Ν - 3,1. Спектр Н ЯМР (CDCl3), , м.ч.: 0,92 т (3Н, J7,6 Гц, СН3С), 2,29 кв (2Н, J7,6 Гц, СН2С), 3,27 с (2Н, ΝΗ2), 5,45 3,5 с (2Н, СНС), 6,42 с (2Н, С Н), 7,08 д (8Н, J6,8 Гц, Аr), 7,18 д (4Н, J6,8 Гц, Аr), 7,24 м (8Н, Аr). 13 3,5 4 Спектр С ЯМР (CDCl3), , м.ч.: 15,8 (СН3С), 28,1 (СН2С), 52,4 (СНС), 126,5(С , Аr), 127,8 (С , 3,5 2,6 4 1 2,6 Ph), 128,3 (С , Ph), 129,1 (ipso-C ), 129,4 (С , Аr), 133,1 (С , Аr), 139,8 (С , Аr), 142,7 (ipsoCPh). Стадія 2. Отримання 1,4-біс-(2,6-дибензгідрил-4-етилфеніл)діазабутадієну Е-2. Розчин 1,2 мл (10 ммоль) 40 % водного гліоксалю з двома краплинами (0,06 мл) форміатної кислоти додавали по краплях до суспензії 9,06 г (20 ммоль) 4-етил-2,6-дибензгідриланіліну (D-2) в 60 мл н-пропанолу та кип'ятили протягом 3 год. Після охолодження осад, що утворився, відфільтровували, промивали 30 мл н-пропанолу, сушили. Вихід 7,65 г (82 %). Тпл. > 300 °C (хлороформ). Знайдено, %: С - 90,4, Η - 6,5, Ν - 3,1. C71H62N2. Обчислено, %: С - 90,5, Η - 6,5, Ν 1 1 3,0. Спектр Н ЯМР (CDCl3), , м. ч.: Н ЯМР (CDCl3), , м.д.: 1,05 (т, 6Η, J7,2 Гц, СН3С), 2,45 (кв, 3,5 2Н) (J7,2 Гц, СН2С), 5,29 (s, 4Н, CHPh), 6,73 (с, 4Н, С Н), 7,03 (м, 16Н, Аr), 7,24 (м, 26Н, 13 4 Ar+CHN). С ЯМР (CDCl3, , м. ч.: 15,6 (СН3С), 28,5 (СН2С), 51,2 (CHPh), 126,4 (С , Ph), 128,0 3,5 3,5 2,6 2,6 1 (С , Аr), 128,3 (С , Ph), 129,6 (С , Ph), 132,0 (С , Аr), 140,0 (С , Аr), 143,9 (ipso-C-Ph), 146,9 4 (С , Аr), 163,9 (CHN). Стадія 3. Отримання 1,3-біс-(2,6-дибензгідрил-4-етилфеніл)імідазолію хлориду А-2. Розчин 0,32 г (10,67 ммоль) параформу, 1,45 г (10,67 ммоль) хлориду цинку та 1,5 мл (17,3 ммоль) 36 % хлоридної кислоти додавали по краплях до розчину 7,64 г (8,2 ммоль) 1,4-біс-(2,6-дибензгідрил4-етилфеніл)діазабутадіену Е-2 в 60 мл хлороформу при 60 °C і перемішували протягом 4 год. До реакційної суміші додавали 50 мл 2М хлоридної кислоти, перемішували, органічний шар 8 UA 112395 C2 5 10 15 20 25 30 35 40 45 промивали водою, сушили сульфатом магнію, розчинник випаровували. Твердий залишок розтирали з 50 мл діетилового етеру, осад відфільтровували, сушили. Вихід 6,00 г (75 %). Тпл > 300 °C (бензен). Знайдено, %: С - 87,1, Η - 6,3, Сl 3,7, N-2,9. C71H61ClN2. Обчислено, %: С - 87,2, 1 Η 6,3, Сl 3,6, Ν 2,9. Спектр Н ЯМР (CDCl3), , м. ч.: 0,99 (τ, 6Η, J7,6 Гц, СН3С), 2,45 (кв, 4Н, J7,6 4,5 3,5 Гц, СН2С), 5,29 (с, 4Н, CHPh), 5,52, (с, 2Н, С Н-im), 6,78 (м, 12Н, С Н), 7,12 (м, 16Н), 7,23 (м, 13 16Н) (Аr), 12,83 (с, 1Н, CHN). Спектр С ЯМР (CDCl3), , мл: 14,9 (СН3С), 28,8 (СН2С), 51,5 4,5 (CHPh), 123,5 (C Im), 126,9, 127,1, 128,71, 128,74, 127,9, 129,3, 129,7, 130,2 (СН, Аr), 142,7 2 (C HN), 130,3, 140,8, 142,1, 142,6 (ipso-C, Ar, Ph), 147,5 (ipso-C2,6, Ar). Стадія 4. Отримання 1,3-біс(2,6-дибензгідрил-4-етилфеніл)імідазол-2-ілі-дену (сольвату з циклогексаном) В-2. Суспензію 0,04 г (0,6 ммоль), 1,5 екв. 37 %-ї дисперсії гідриду натрію в парафіновій олії додавали до розчину 0,39 г (0,4 ммоль) солі А-2 в 7 мл безводного тетрагідрофурану та перемішували протягом 24 год. Розчин фільтрували, упарювали та отримували твердий продукт. Вихід 0,30 г (79 %). Тпл. 182-183 °C (циклогексан). Знайдено, %: С 1 - 90,3, Η - 7,1, Ν - 2,6. C77H72N2. Обчислено, %: С - 90,2, Η - 7,1, Ν 2,7. Спектр Н ЯМР(C6D6), , 4,5 м.ч.: 0,87 (м, 6Η, СН3С), 1,42 (с, 12Н, СуН), 2,22 (м, 4Н, СН2С), 5,81 (с, 2Н, C HN), 6,04 (с, 4Н, 13 CHPh), 6,99-7,17 (м, 36Н), 7,38 (м, 8Н) (Аr). Спектр С ЯМР (CDCl3): 15,4 (СН3С), 27,2 (СуН, 4,5 3,5 3,5 4 СН2С), 28,9 (СН2С), 51,5 (CHPh), 122,5 (С , Im), 126,5 (С , Аr), 128,5, 128,6 (С , Ph), 128,8 (С , 2,6 1 1 4 Ph), 129,9, 130,2 (С , Ph), 138,3 (ipso-C Ar), 141,9, 143,9 (С , Ph), 144,5 (ipso-C , Ar), 145,0 (ipso2,6 2 C , Ar), 218,6 (C N). Стадія 5. Отримання [1,3-біс-(2,6-дибензгідрил-4-етилфеніл)імідазол-2-іліден]паладію хлориду (3). До розчину 0,49 г (0,5 ммоль) імідазолієвої солі А-2 в 6 мл абсолютного тетрагідрофурану додавали в атмосфері аргону 0,05 г (0,75 ммоль, 1,5 екв.) 37 % дисперсії гідриду натрію в парафіновій олії та перемішували протягом 24 год. Далі додавали 0,19 г (0,5 ммоль) біс(бензо-нітріл)паладію хлориду Pd(PhCN) 2Cl2 та перемішували протягом 5 год. Розчин фільтрували та упарювали досуха. Залишок розчиняли в дихлорметані, фільтрували через тонкий шар силікагелю (70/230 мкм) та упарювали. Новий залишок промивали 40 мл гарячого петролейного етеру, сушили. Вихід 0,43 г (77 %). Тпл. 251-252 °C (ацетонітрил). Знайдено, %: С 1 76,3, Η - 5,2, Сl-6,4, N 2,6. C71H60Cl2N2Pd. Обчислено, %: С - 76,2, Η - 5,4, Сl-6,3, Ν 2,5. Спектр Н ЯМР (CDCl3), , м. ч.: 0,66 (t, 3Η, J7,6 Hz, CH3C), 0,97 (тт, 3Η, J7,2 Гц, СН3С), 2,01 (кв, 2Н, J7,6 Гц, СН2С), 2,32 (квкв, 2Н, J7,2 Гц, СН2С), 4,14 (с, 1H, CHPh), 4;32 (с, 1H, CHPh), 5,42 (с, 1H, 4,5 CHPh), 6,11 (с, 2Н, C HN), 6,32 (с, 1Н, CHPh), 6,49 (с, 2Н, Ar), 6,76 (м, 7H, Ar), 6,92 (м, 4Н, Ar), 13 7,01-7,06 (м, 7Н, Ar), 7,16-7,29 (м, 20H, Ar), 7,58 (м, 4H, Ar). Спектр C ЯМР (CDCД3), , мл.: 14,0 4,5 15,0, 15,6 (CH3C), 28,1, 28;5 (CH2C), 51,3, 51,7 (CHPh), 126,0, 126,1 (С , Im), 123,2, 125,8, 127;1, 127.4, 127,6, 127,9, 128,1, 128,4, 128,6, 128,9, 129,5, 129,8, 130,1, 131,2 (CH, Ar), 133,7, 133,8, 4 134,8, 136,1, 138,6, 140,8, 141,1, 141,5, 142,7 (ipso-C, Ar), 143,2, 144,7 (ipso-C Ar), 143,4, 145,7 2 (ipso-C, Ph), 156,4 (C -Pd). Приклад 4. [1,3-Біс(2,6-дибензгідрил-4-етилфеніл)імідазол-2-іліден]паладію йодид (4). До розчину 0,49 г (0,5 ммоль) солі А-2 в 8 мл безводного тетрагідрофурану додавали 0,55 моль) розчину гексаметилдисилазаніду калію в толуені та перемішували протягом 2 год. Далі до реакційної суміші додавали 0,18 г (0,5 ммоль) йодиду паладію, перемішували протягом 22 год., отриманий розчин фільтрували та упарювали. Залишок розчиняли в дихлорметані, розчин фільтрували через тонкий шар силікагелю (70/235 мкм) та упарювали. Вихід 0,50 г (77 %), Тпл > 300 °C (ацетонітрил). Знайдено, %: С - 65,6, Η - 4,7, І - 19,4, Ν - 2,2. C7,H60І2N2Pd. Обчислено, %: 1 С 65,5, Η 4,7, І 19,5, Ν 2,2. Спектр Н ЯМР (CDCl3), , м.ч.: 0,96 (с, ш, 6Н, СН3С), 2,44 (с, ш., 4Н, 4,5 13 СН2С), 5,06 (с, ш., 4Н, CHPh), 5,75, 5,93 (с, ш., 2Н, C HN), 6,78, 7,17 (м, 44Н, Аr). Спектр С 4,5 ЯМР (CDCl3, , м. ч.): 16,1 (СН3С), 29,8 (СН2С), 52,6 (CHPh), 128,3, 128;6 (С , Im), 125,4, 129,3, 2 130,0, 130,9, 132,0 (CH, Ar), 138,2, 141,4, 142,2, 143,1 (ipso-C, Ar), 149,1 (C Pd). ФОРМУЛА ВИНАХОДУ 50 1. Карбенові комплекси паладію загальної формули (L nPdX2)p, де L означає карбеновий ліганд (І): 1,3-дизаміщений імідазол-2-іліден загальної формули 9 UA 112395 C2 R N : N R1 5 , (І) де R, R1 означають арильні замісники, що містять в 2- і 6-положеннях ароматичного ядра бензгідрильну (CHPh2)-групу, а в 4-положенні - алкільні групи; X означає некарбеновий ліганд - галогенід; n дорівнює 1, 2; p дорівнює 1, 2, за умови, якщо p дорівнює 2, то Х не є хлором, а алкіл в 4-положенні не є метилом. 2. Карбенові комплекси паладію за п. 1, які відрізняються тим, що як алкіл в 4-положенні містить метильну або етильну групи, як X - хлорид або йодид. 10 Комп’ютерна верстка О. Рябко Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 10
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C01G 55/00, B01J 23/44, C07D 233/04, B01J 31/28, B01J 31/30
Мітки: паладію, карбенові, комплекси
Код посилання
<a href="https://ua.patents.su/12-112395-karbenovi-kompleksi-paladiyu.html" target="_blank" rel="follow" title="База патентів України">Карбенові комплекси паладію</a>
Попередній патент: Спосіб отримання відновленого заліза
Наступний патент: Спосіб управління автономною електроенергетичною системою
Випадковий патент: Пристрій для знімання та встановлення кришок завантажувальних люків коксової печі












