3-індолілпіперидини, спосіб їх одержання, фармацевтична композиція та спосіб її одержання
Номер патенту: 41333
Опубліковано: 17.09.2001
Автори: Мерц Йоахім, Бьоттхер Хеннінг, Бартошік Герд, Грайнер Хартмут, Зейфрід Крістоф
Формула / Реферат
1.З - индолилпиперидины формулы (I)
где R1, R2, R3 и R4 каждый независимо друг от друга обозначает Н, А, ОН, ОА, F, Cl, Br, I, CN, СFз, СООН, CONH2, CONHA, CONA2 или СООА, или R1 и R2, a также R3 и R4 соответственно вместе также обозначают метилендиоксигруппу,
R5 обозначает Н или ОН,
R6 обозначает Н, или
R5 и R6 вместе также обозначают связь,
А обозначает алкил с 1 - 6 С - атомами,
n обозначает 2, 3, 4, 5 или 6, а также их физиологически приемлемые соли.
2. З - индолилпиперидины формулы (I) по п.1, представляющие: а) 3-(1-(3-(5-карбамоил-3-индолил)- пропил)- пиперид-4-ил)- андол-5-карбоксамид, б)3-(1-(3-(5-карбамоил-3-индолил) -пропил) -пиперид-4-ил) -индол-5-карбонитрил, в) 3-(1-(4-(5-метоксикарбонил-3-индолил) -бутил) -пиперид-4-ил) -5-метокси-индол, г) 3-(1-(3-(5-этоксикарбонил-3-индолил) -пропил) -пиперид-4-ил)-индол-5-карбоксамид, д) 3-(1-((4-(5-циан-3-индолил)-бутил)-пиперид-4-ил)-индол-5-карбонитрил, а также их физиологически приемлемые соли.
3. Способ получения 3-индолилпиперидинов формулы (I) или их физиологически приемлемых солей, отличающийся тем, что соединение формулы (I) или их физиологически приемлемых солей, отличающийся тем, что соединение формулы (II)
где X1 обозначает Х или NH2,
Х обозначает С1, Вг, I, ОН или реакционноспособную, функционально измененную ОН - группу,
R1, R2 и n имеют указанные в п.1 значения, подвергают взаимодействию с соединением формулы (III)
где Х2 и Х3 могут быть одинаковыми или разными и обозначают Х при Х1 = NH2, в случае, если Х обозначает X, Х2 и Х3 обозначают вместе NH-группу,
R3 и R4 имеют указанные в п.1 значения, с последующим, в случае необходимости, омылением образующегося продукта и переводом, в случае необходимости, полученных основания или кислоты с помощью Кислоты или основания в одну из их солей.
4. Фармацевтическая композиция, обладающая серототин - агонистической и/или серотонин-антагонистической активностью, отличающаяся тем, что она содержит в качестве активного вещества, по меньшей мере, одно соединение формулы (I) по п.1 и/или одну из его физиологически приемлемых солей в эффективном количестве, при необходимости, вместе с обычными добавками.
5. Способ получения фармацевтической композиции, отличающийся тем, что соединение формулы (I) по п. 1 и/или одну из его физиологически приемлемых солей вместе по меньшей мере с одним твердым, жидким, или полужидким носителем, или вспомогательным веществом доводят до пригодной дозировочной формы.
Текст
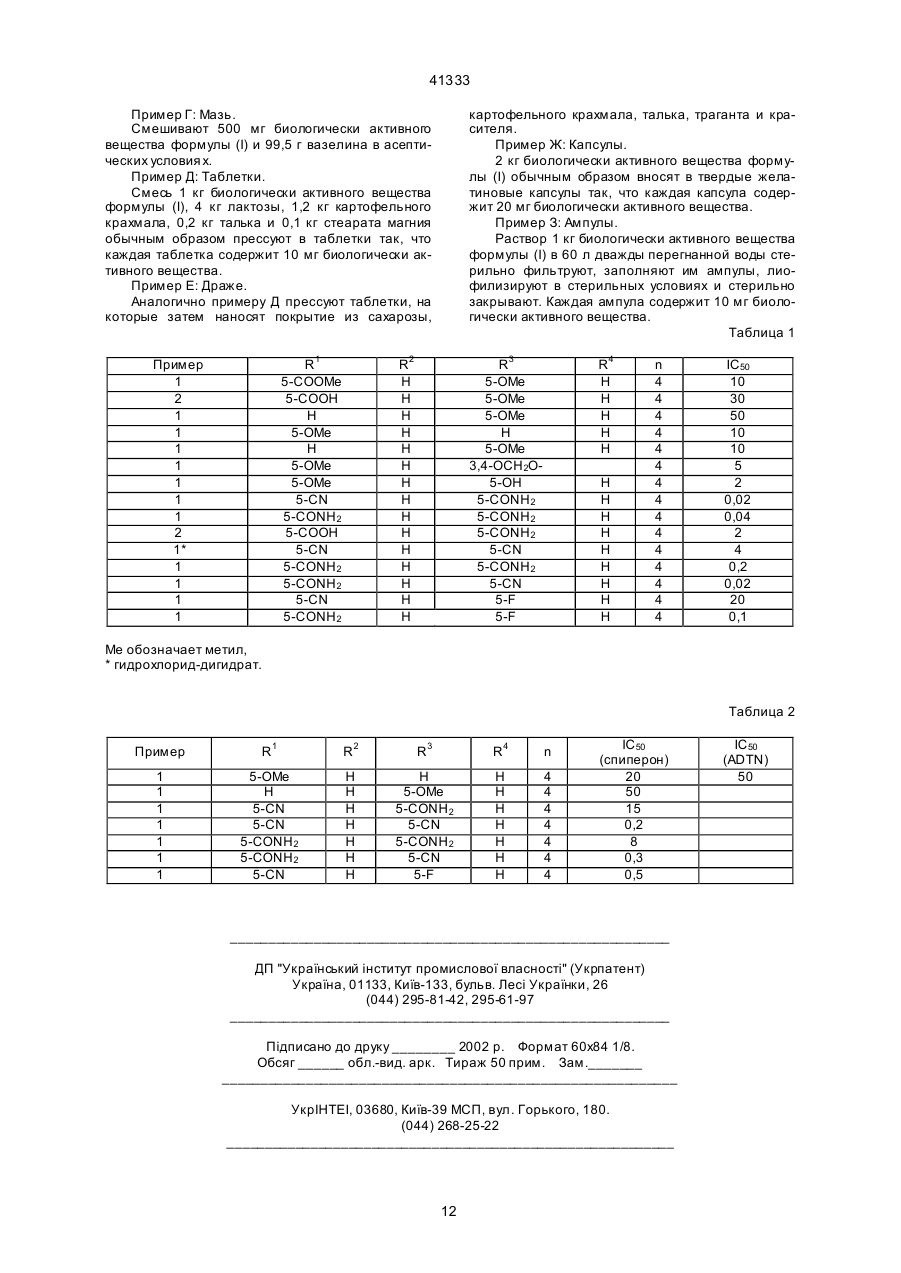
1. 3-индолилпиперидины формулы (I) 41333 по п. 1 и/или одну из его физиологически приемлемых солей в эффективном количестве, при необходимости, вместе с обычными добавками. 5. Способ получения фармацевтической композиции, отличающийся тем, что соединение форму лы (I) по п. 1 и/или одну из его физиологически приемлемых солей вместе по меньшей мере с одним твердым, жидким или полужидким носителем или вспомогательным веществом доводят до пригодной дозировочной формы. Изобретение относится ридинам формулы (I): могут применяться в качестве биологически активных веществ для таких лекарственных средств, как анксиолитические, антидепрессивные и/или антигипертонические средства, и также в качестве промежуточных продуктов для получения других биологически активных веществ для лекарственных средств. Объектом изобретения являются производные индола формулы (I), а также их физиологически приемлемые соли присоединения кислот. Остаток "А" обозначает алкил с 1, 2, 3, 4, 5 или 6, в особенности с 1 или 2 С-атомами, предпочтительно метил, далее также этил, н/пропил, изопропил, н-бутил, изобутил, втор.-бутил или трет.-бутил-; "ОА" предпочтительно обозначает метокси-группу, далее также этокси-, н-пропокси-, изопропокси-, н-бутокси-, изобутокси-, втор.-бутокси- или трет.-бутокси-группу; "NH A" предпочтительно обозначает метиламино-группу, далее этиламино-, н-пропиламино-, изопропиламино-, н-бутиламино-, изобутиламино-, втор.бутиламино- или трет.-бутиламино-группу. "NA2" предпочтительно обозначает диметиламино-группу, далее N-этилN-метиламино-, диэтиламино-, ди-н-пропиламино-, ди-изопропиламино- или ди-н-бутиламиногруппу. Отсюда следует, что CO-NHA особенно предпочтительно обозначает N-метилкарбамоил или N-этилкарбамоил и CO-NA2 предпочтительно обозначает N,N-диметилкарбамоил или N,N-диэтилкарбамоил. Индольные остатки не замещены или одноили двукратно замещены. Предпочтительно однократное замещение, причем заместители предпочтительно находятся в положении 5, далее однако, также могут быть в 2-, 4-, 6- или 7 положении. Если оба индол-3-ильных остатка замещены, то соответствующие заместители могут быть одинаковыми или разными. Точно также число заместителей обоих индольных остатков может отличаться друг от др уга. Предпочтительными заместителями R1, R2, R3 4 и R в индольных остатках являются, например, СO2Н, СO2СН3, ОСН3 , ОН, O-СН2-O, F, CN или CONH2. Если индольная система замещена в положении 2, то там особенно предпочтительно замещение с помощью "А". Параметр "n" может обозначать 2, 3, 4, 5 или 6, предпочтительно он обозначает 3 или 4. R5 и R6 каждый предпочтительно означает водород, однако, также вместе могут обозначать связь. Соответственно этому предметом изобретения, в частности, являются такие соединения формулы (І), в которых по меньшей мере один из указанных остатков имеет одно из вышеуказанных предпочтительных значений. Некоторые предпочтительные группы соединений также могут быть к 3-индолилпипе R R R 2 C n H2 n 1 N H 5 NH N R R 4 6 R 3 I где: R1, R2 , R3 и R4 каждый независимо друг от друга обозначает Н, А, ОН, ОА, F, C1, Вг, I, CN, CF3, COOH, CONH 2, CONH A, CON A2 или СООА; или R1 и R2, а также R3 и R4 соответственно вместе также обозначают метилендиокси-группу; R5 обозначает Н или ОН; R6 обозначает Н; или R5 и R6 вместе также обозначают связь; А обозначает алкил с 1-6 С-атомами; и "n" обозначает 2, 3, 4, 5 или 6, а также к их физиологически приемлемым солям. В основу изобретения положена задача получения новых соединений, которые можно применять для приготовления лекарственных средств. Найдено, что соединения формулы (I) и и х физиологически приемлемые соли присоединения кислот обладают ценными фармакологическими свойствами. Так, в особенности они оказывают воздействия на центральную нервную систему, прежде всего обладают серотонин-агонистической и серотонин-антагонистической активностью. Они подавляют связывание тритиированных серо-тониновых лигандов с гиппокамфальными рецепторами (Cossery и др., European J. Pharmacol. 140 (1987), 143-155). Кроме того, наступают изменения DOPA-аккумуляции в полосатом теле и 5-НТРаккумуляции в N. raphe (Seyfried и др., European J. Pharmacol. 160 (1989), 31-41). Далее имеют место анальгетическая и снижающая кровяное давление активности; так, в случае, содержащих катетер, бодрствующи х, самопроизвольно больных гипертонией крыс (Род SHR/Okamoto/NIH-MO-CHBKisslegg; метод см. Weeks и Jones, Proc. Soc. Exptl. Biol. Med. 104 (1960), 646-648), прямо измеряемое кровяное давление снижается после перорального введения соединений. Точно также эти соединения пригодны для профилактики и для борьбы с последствиями церебрального инфаркта (Apoplexia cerebri), как инсульт и церебральные ишемии, атакже для лечения экстрапирамидально-моторных побочных действий нейролептических средств и болезни Паркинсона. Соединения формулы (I) и их физиологически приемлемые соли присоединения кислот поэтому 2 41333 выражены нижеследующими формулами (Iа) - (Ih), которые соответствуют формуле (I) и где не указанные подробнее остатки имеют указанное для формулы (I) значение, где, однако: в la: R2 и R4 обозначают Н, и R1 и R3 являются одинаковыми и каждый находится в положении 5 индольных остатков; в Ib: R2 и R4 обозначают Н и R1 и R3, каждый обозначает СООН, СООА, СОNH2, CONHA, CONH2 или CN и каждый находится в положении 5 индольных остатков; в Ic: R2 и R4 обозначают Н и R1 и R3, каждый обозначает ОН, ОА, F, Cl, Br, I или СF3 , и каждый находится в положении 5 индольных остатков; в Id: R1 и R2 , а также R3 и R4 каждый вместе обозначает метилендиокси-группу; в Ie: R 2, R4 , R5 и R 6 каждый обозначает Н; в If: R2 и R4 обозначают Н, и R5 и R6 вместе обозначают связь; в Ig: R2, R4, R5 и R6 каждый обозначает Н, и R1, а также R3 являются одинаковыми и обозначают F, CN, OA или CONH2; в Ih: R2, R4, R5 и R6 каждый обозначает Н, и R1, а также R3 отличны друг от др уга и каждый обозначает Н, СООН, СООА, ОСН3, ОН, CN, CONH2, CONA или CONHA; в Ii: R1 и/или R3 обозначают А, в частности метил, и находятся в положении 2 индольных остатков. В особенности, однако, предпочтительны такие соединения частичных формул Ik, a также lak - Ihk, которые соответствуют частичным формулам la - Ik и формуле (I), где, однако, дополнительно "n" обозначает 2, 3 или 4. Предметом изобретения далее является способ получения пиперидиновых производных формул (I), а также их солей, отличающийся тем, что соединение формулы (II): R R 2 C n H2 n X R R R R N H R IV 4 3 N H V где: R3 и R4 имеют указанные значения; или соединение формулы (І), в которой R5 обозначает ОН и R6 обозначает Н; путем дегидратации превращают в др угое соединение формулы (I); или соответствующее формуле (I) соединение, которое, однако, вместо одного или нескольких атомов водорода содержит одну или несколько восстанавливаемых групп и/или одну или несколько дополнительных С-С- и/или C-N-связей, обрабатывают восстановителем; или соответствующее формуле (I) соединение, которое, однако, вместо одного или нескольких атомов водорода содержит одну или несколько сольволизируемых групп, обрабатывают сольволизирующим средством; и/или остаток R1, R2, R3 и/или R4 путем этерификации до сложного эфира, омыления, образования простого эфира, расщепления простого эфира, полного или частичного гидролиза или путем алкилирования превращают в др угой (другие) остаток (остатки) R1, R2, R3и/или R4; и/или полученное основание или кислоту формулы (I) путем обработки кислотой или основанием превращают в одну из их солей. Получение соединений формулы (I), впрочем, осуществляют само по себе известными способами, которые описаны в литературе (например, в стандартных работах, как Губен-Вейл, Методы органической химии, изд. Georg-Thieme, Штутгарт, Органические реакции, John Wiley and Sons, Inc. New York; J. March. Adv. Org. Chem., 3-е изд., J. Wiley and Sons, (1985), а именно при реакционных условиях, которые известны и пригодны для указанных взаимодействий. При этом также можно использовать сами по себе известные, здесь подробнее не упомянутые варианты. Исходные вещества в случае заявляемого способа в желательном случае получать также in situ таким образом, что их не выделяют из реакционной смеси, а тотчас вводят во взаимодействие далее до получения соединений формулы (I). В индольных производных формулы (II) "X1 " обозначает предпочтительно "X"; соответственно этому, в соединениях формулы (II) X2 и X3 предпочтительно вместе представляют собой NH. Остаток X предпочтительно обозначает хлор или бром; однако, он может обозначать также иод, 1 II 2 X 4 O 1 R где: X1 обозначает X или NH2; и X обозначает СІ, Вг, I, ОН или реакционноспособную, функционально превращенную ОН-группу; и R1, R2 и "n" имеют указанные значения вводят во взаимодействие с соединением формулы (III) X N где: R1, R2 и "n" имеют указанные значения, вводят во взаимодействие с индолом формулы (V): 1 N H C n H2 n 2 3 3 N H III где: X2 и X3 могут быть одинаковыми или разными и, если X1=NH2, каждый обозначает X; в противном случае вместе обозначают NH; и R3 и R4 имеют указанные значения; или соединение формулы (IV): 3 41333 гидроксил или реакционноспособную, функционально измененную ОН-гр уппу, в особенности алкилсульфонилокси-группу с 1-6 (например, метансульфонилокси-группу) или арилсульфонилоксигруппу с 6-10 С-атомами (например, бензолсульфонилокси-, п-толуолсульфонилокси-, 1- или 2нафталинсульфонилокси-группу). Соответственно этому индольные производные формулы (I) получают, в частности, путем взаимодействия 3- (хлоралкил) - или 3-(бромалкил) - индолов с 3-пиперид-4-ил-индолами, где соответственно X2 и X3 вместе обозначают NH-группу (ниже обозначаются как соединения формулы (IlIa). Соединения формул (II) и в особенности (III) отчасти известны: неизвестные соединения формулы (II) и (III) легко можно получать аналогично известным соединениям. Первичные спирты формулы Ind-СnH2n-ОН, причем всегда обозначает замещенный с помощью R1 и R 2 соответственно R3 и R4 индол-3ильный остаток, получают, например, путем восстановления соответствующи х карбоновых кислот или их сложных эфиров. Обработка с помощью тионилхлорида, бромоводорода, трибромида фосфора и подобных галоидных соединений дает соответствующие галогениды формулы Ind-СnH2nГал (Гал обозначает Вг, Сl). Соответствующие суль-фонилокси-соединения получают из спиртов формулы Ind-СnH2n-ОН путем введения во взаимодействие с соответствующими хлорангидридами сульфокислот. Иодсодержащие соединения формулы (I) IndСnH2n-I получают, например, путем воздействия иодида калия на соответствующий сложный эфир п-толуолсуль фокислоты. Амины формулы IndСnH2n-NH2 получают, например, из галогенидов с фталимидкалием или путем восстановления соответствующи х нитрилов. Производные пиперидина формулы (IlIa) большей частью известны и получаются, например, путем взаимодействия защищенного в положении 1 обычными, само по себе известными защитными для амино-группы группами 4-пиперидинона с индолами, которые в случае необходимости защищены остатками R3 и/или R4. Предпочтительно эти реакции проводят при воздействии катализатора, например, кислоты. Образовавшийся продукт затем после удаления защитной группы можно прямо вводить во взаимодействие с соединением формулы (II) или, однако, прежде дегидратировать до 1,2,5,6-тетрагидропири-динового производного, соответственно затем еще гидрировать. Взаимодействие соединений формулы (II) и (III) протекает по способам, которые известны из литературы для электрофильного замещения индолов. Компоненты можно вводить во взаимодействие друг с др угом без наличия растворителя, в случае необходимости в закрытой трубке или в автоклаве. Однако, предпочтительно соединения вводить во взаимодействие в присутствии индифферентного растворителя. В качестве растворителей пригодны, например, углеводороды, как бензол, толуол, ксилол; кетоны, как ацетон, бутанон; спирты, как метанол, этанол, изопропанол, н-бутанол; простые эфиры, как тетрагидрофуран (ТГФ) или диоксан; амиды, как диметилформамид (ДМФ) или Н-метил-пирролидон; нитрилы, как ацетонитрил; в случае необходимости также смеси этих растворителей друг с другом или смеси с водой. Время реакции в зависимости от применяемых условий составляет от нескольких минут до 14 дней; температура реакции составляет 0-150°С, обычно 20-130°С. В некоторых случаях реакции может благоприятствовать добавка кислотосвязующего средства, например гидроксида, карбоната или бикарбоната щелочного или щелочноземельного металла, или другой соли слабой кислоты щелочного или щелочноземельного металла, предпочтительно калия, натрия или кальция, или добавка органического основания, как триэтиламин, диметиланилин, пиридин или хинолин. В других случаях благоприятна добавка каталитических количеств кислоты, предпочтительно неорганической кислоты, как, например, НСl. Далее соединение формулы (I) можно получать тем, что соединение формулы (IV) вводят во взаимодействие с индольным производным формулы (V). Соединения формулы (IV) и в особенности формулы (V) о тчасти известны; неизвестные соединения легко можно получать по аналогии с известными. Так, соединения формулы (IV) легко можно получать путем взаимодействия Ind-СnH2nNH2 с 1,5-дигалоген-пентан-3-оном, причем галогеном предпочтительно является хлор или бром. Точно также можно получать соединения типа (IV) путем взаимодействия Ind-СnH2n-Cl, Ind-СnH2n-Вг или Ind-СnH2n-I с 4-пиперидином. Индолы формулы (V) можно получать путем различных, само по себе известных вариантов синтеза индола, например путем индольного синтеза по Фишеру. Взаимодействие соединений формул (IV) и (V) протекает по способам, которые известны из литературы для реакций енаминов с электрофильными компонентами реакции. Компоненты можно вводить во взаимодействие друг с другом непосредственно, без наличия растворителя, в случае необходимости в закрытой трубке или в автоклаве, при нормальном или при повышенном давлении, причем для повышения давления подается инертный газ, как, например, азот. Однако, также можно вводить во взаимодействие соединения в присутствии инертного растворителя. В качестве растворителей пригодны вышеуказанные в случае взаимодействия соединений формул (II) и (III). Оптимальное время реакции в зависимости от выбранных реакционных условий составляет от нескольких минут до 14 дней; температура реакции составляет 0-150°С, обычно 20-130°С. Далее можно получать соединение формулы (I) тем, что форпродукт, который вместо атомов водорода содержит одну или несколько восстанавливаемых групп и/или одну или несколько дополнительных С-С-и/или C-N-связей, обрабатывают с помощью восстановителя, предпочтительно при температурах от -80°С до +250°С, в присутствии по меньшей мере инертного растворителя. Восстанавливаемые (заменяемые водородом) группы представляют собой в особенности кислород в карбонильной группе, гидроксил, арилсуль 4 41333 фонилокси (например п-толуолсульфонилокси), N-бензолсульфонил, N-бензил или О-бензил. Принципиально можно соединения, которые содержат только одну, или такие, которые наряду друг с другом содержат две или более вышеуказанные группы соответственно, дополнительные связи путем восстановления переводить в соединение формулы (I); при этом одновременно могут восстанавливаться заместители в индольных остатках, которые содержатся в исходном соединении. Предпочтительно для этой цели используют атомарный водород или комплексные гидриды металлов, далее проводят восстановление по Вольфу-Кижнеру, а также восстановления с помощью газообразного водорода при катализе с помощью переходных металлов. Предпочтительные исходные вещества для восстановления соответствуют формуле (VI): R R R 2 щелочи или железа с уксусной кислотой. Также пригодно применение натрия или другого щелочного металла в спирте, как этанол, изопропанол, бутанол, амиловый или изоамиловый спирт или фенол. Далее можно применять сплав никеля с алюминием в водно-щелочном растворе, в случае необходимости при добавке этанола. Для получения атомарного водорода также пригодны амальгамы натрия или алюминия в водно-спиртовом или водном растворе. Взаимодействие также можно осуществлять в гетерогенной фазе, причем целесообразно применяют водную и бензольную или толуольную фазу. В качестве восстановителя далее особенно предпочтительно можно использовать комплексные гидриды металлов, как LiAlH4, NаВH4, диизобутилалюминийгидрид или NаАl(ОСН2СН2OСН3)2Н2, а также диборан, если желательно при добавке катализаторов, как ВF3, АІСІ 3 или LiBr. В качестве растворителей для этой цели пригодны в особенности простые эфиры, как диэтиловый эфир, ди-н-бутиловый эфир, ТГФ, диоксан, диглимы или 1,2-диметоксиэтан, а также углеводороды, как бензол. Для восстановления с помощью NaBH4 пригодны в первую очередь спирты, как метанол или этанол, далее, вода, а также водные спирты в качестве растворителей. Согласно этим способам восстанавливают предпочтительно при температурах от -80°С до +150°С, в особенности примерно при 0-100°С. Особенно предпочтительно можно восстанавливать -СО-группы в амидах кислот (например, таковые формулы (VI), где L обозначает группу (СН2)n-1 с помощью LiAlH4 в ТГФ при температурах примерно 0-66°С в СН 2-группы. При этом одновременно могут восстановительно отщепляться находящиеся в положении 1 индольного кольца защитные арилсульфонильные группы. N-Бензильные группы можно отщеплять путем восстановления с помощью натрия в жидком аммиаке. Далее одну или несколько карбонильных групп можно восстанавливать до СН 2-групп по методу Вольфа-Кижнера, например, путем обработки с помощью безводного гидразина в абсолютном этаноле под давлением при температурах примерно 150-250°С. В качестве катализатора предпочтительно применяют алкоголят натрия. Восстановление также можно варьировать по методу Huang-Minlon, тем, что проводят взаимодействие с гидразингидратом в высококипящем, смешивающемся с водой растворителе, как диэтиленгликоль или триэтиленгликоль, в присутствии щелочи, как гидроксид натрия. Реакционную смесь, как правило, кипятят примерно 3-4 ч. Затем воду отгоняют и образовавшийся гидразон разлагают при температурах примерно вплоть до 200°С. Восстановление по Вольфу-Кижнеру можно осуществлять также при комнатной температуре в диметилсульфоксиде с помощью гидразина. Сверх того определенные восстановления можно осуществлять путем применения газообразного водорода при каталитическом воздействии переходных металлов, как, например, никель Ренея или палладий. Таким образом, например, Cl, Br, I, SH или в определенных случаях также ОН-группы можно заменять на водород. Точно также нитро-группы путем каталитического гидри 5 N R 8 R 4 N L 1 N R R 6 7 R 3 VI где: R7 и R8 обозначают Н или, например, арилсульфониловые группы и/или бензильные группы; L обозначает СnH2n или соответствующую этому остатку цепь, где, однако, одна или несколько -СH2-групп заменены на -СО-; и R1, R2, R3, R4, R5 и R6 имеют указанные значения; где, однако, R7 и R8 одновременно не могут обозначать Н и L -СnH2n. В соединениях формулы (VI) L предпочтительно обозначает: -СО-(СН2)n-2-СО- [в особенности -СОСО-; -СОСH2СО-; -СО-(СН2)2-СО-; -СО(СН2)3-СО]; -(СН2)n- 1-СО [в особенности -СH2-СО-; -СН2СН2-СО-; -(СН2)3-СО или -(СН2)4-СО-]; далее, например, -СО-СН2СН2-; -СО-(СН2)3-; -СН-СОСН2СН2-; -СН2СН2-СО-СН2-; -СО-(СН2)4-; -СН-СО(СН2)3-; -СН2СН2-СО-СН2СН2-; или -(СН2)3-СОСН2-. Соединения формулы (VI) получают, например, путем взаимодействия соединений формулы (III), которые в случае необходимости прежде замещаются в положении 1, с соединением формулы (VII): R R 2 L X 1 1 N R 7 VII где: R1, R2, R7, L и X1 имеют вышеуказанные значения, в условиях, которые указаны выше для взаимодействия соединений формул (II) и (III). Если в качестве восстановителя применяют атомарный водород, то его можно получать, например, путем обработки металлов с помощью слабых кислот или оснований. Так, например, можно применять смесь цинка с раствором едкой 5 41333 рования с помощью Pd/H2 в метаноле можно превращать в NН2-гр уппы. Соединения, которые иначе соответствуют формуле (I), однако, вместо одного или нескольких Н-атомов содержат одну или несколько сольволизируемых групп, можно сольволизировать, в особенности гидролизовать до соединений формулы (I). Исходные вещества для сольволиза получают, например, путем взаимодействия соединения формулы (IlIa) с соединениями, которые соответствуют формуле (II) (X1=X), однако вместо одного или нескольких Н-атомов содержат одну или несколько сольволизируемых групп. Так, в особенности 1-ацилиндольные производные (соответствующие формуле (I), однако содержащие в положении 1 индольного остатка ацильную группу, предпочтительно алканоильную, алкилсульфонильную или арилсульфонильную группу, каждую с количеством атомов углерода вплоть до 10, как метан-, бензол- или п-толуол-сульфонил) можно гидролизовать до соответствующих, незамещенных в положении 1 индольного кольца, индольных производных, например, в кислой, лучше в нейтральной или щелочной среде, при температурах 0-200°С. В качестве оснований целесообразно применять гидроксид натрия, калия или кальция; карбонат натрия или калия; или аммиак. В качестве растворителя предпочтительно применяют воду; низшие спирты, как метанол, этанол; простые эфиры, как ТГФ, диоксан; сульфоны, как тетраметиленсульфон; или их смеси, особенно содержащие воду смеси. Гидролиз также может протекать уже при обработке одной водой, в особенности при температуре кипения. Далее соединение формулы (I) само по себе известными способами можно превращать в другое соединение формулы (I). Соединения формулы (I), где индольная система замещена, например, с помощью СООА, CONH2, CONH2, можно получать путем дериватизации соответствующих карбокси-индол-3-ильных соединений. Кислоты или их реакционноспособные производные, как, например, их галоидангидриды или ангидриды, можно, например, этерифицировать до сложных эфиров с помощью соответствующих спиртов или алкоголятов, при применении само по себе известных методов или одного из многочисленных вариантов. Далее кислоты, галоидангидриды кислот или сложные эфиры можно амидировать с помощью первичных или вторичных, алифатических или циклических аминов. Предпочтительно взаимодействие свободной карбоновой кислоты с амином в условиях пептидного синтеза. Эту реакцию проводят предпочтительно в присутствии дегидратирующе го средства, например карбодиимида, как дициклогексилкарбодиимид или N-(3-диметиламинопропил)-N-этил-карбодиимид, далее ангидрид пропанфосфоновой кислоты (см. Angew. Сhemіе., 92, 129 (1980)), дифенилфосфорилазид или 2-этокси-N-этоксикарбонил-1,2-дигидрохинолин, в инертном растворителе, например в галогенированном углеводороде, как дихлорметан; простом эфире, как ТГФ или диоксан; амиде, как ДМФ или диметилцетамид, нитриле, как ацетонитрил; при температурах примерно от -10°С до 40°С, предпочтительно при 0-30°С. Вместо кислоты, соответственно амида, также можно использовать в реакции реакционноспособные производные этих веществ, например, такие, в которых реакционноспособные группы промежуточно блокированы защитными группами. Кислоты можно применять также в форме их активированных сложных эфиров, которые целесообразно получают in situ, например, путем добавки 1-гидроксибензтриазола или N-гидроксисукцинимида. Далее циан-замещенные индол-3-ильные остатки можно гидролизовать до карбокси-индол-3ильных или карбамидо-индол-3-ильных остатков. Соединения формулы (І), в которых индольные остатки одно- или двукратно замещены О-алкилом, можно подвергать реакции расщепления простого эфира, причем образуются соответствующие гидрокси-производные. Например, простые эфирные группы можно расщеплять путем обработки с помощью комплекса диметилсульфида с трибромидом бора, например, в толуоле, простых эфирах, как ТГФ, или диметилсульфоксиде; или путем расплавления вместе с пиридин- или анилингидрогалогенидами, предпочтительно с пиридингидрохлоридом, примерно при 150-250°С. Соединения формулы (І) в случае необходимости могут содержать асимметрический центр. Поэтому при их получении они могут образовываться в виде рацемата или, если применяются оптически активные исходные вещества, также в оптически активной форме. Полученные рацематы, если желательно, само по себе известными методами, механически или химически, можно разделять на их оптические антиподы. Предпочтительно из рацемата путем взаимодействия с оптически активным разделительным средством образуются диастереомеры. В качестве разделительных средств пригодны, например, оптически активные кислоты, как D- или L-формы винных кислот, дибензоилвинной кислоты, диацетилвинной кислоты, камфорсульфокислот, миндальной кислоты, яблочной кислоты или молочной кислоты. Различные формы диастереомеров можно разделять само по себе известным образом, например, путем фракционной кристаллизации, и оптически активные соединения формулы (I) само по себе известным образом можно высвобождать из диастереомеров. Полученное основание формулы (I) с помощью кислоты можно переводить в соответствующую соль присоединения кислоты. Для этого превращения пригодны кислоты, которые дают физиологически приемлемые соли. Так, можно применять неорганические кислоты, например, серную кислоту; галогенводородные кислоты, как соляная кислота или бромоводородная кислота; фосфорные кислоты, как ортофосфорная кислота, азотную кислоту, сульфаминовую кислоту; далее органические кислоты, в особенности алифатические, алициклические, аралифатические, ароматические или гетероциклические одно- или многоосновные карбоновые, сульфоновые или серные кислоты, как муравьиная кислота, уксусная кислота, пропионовая кислота, пивалиновая кислота, диэтилуксусная кислота, малоновая кислота, янтарная кислота, пимелиновая кислота, фумаровая кислота, малеиновая кислота, молочная кислота, 6 41333 винная кислота, яблочная кислота, бензойная кислота, салициловая кислота, 2-фенилпропионовая кислота, лимонная кислота, глюконовая кислота, аскорбиновая кислота, никотиновая кислота, изоникотиновая кислота, метан- или этансульфокислота, этандисульфокислота, 2-гидроксиэтансульфокислота, бензолсульфокислота, п-толуолсульфокислота, нафталин-моно- или -дисульфокислота, ла урилсерная кислота. Свободные основания формулы (I), если желательно, можно высвобождать из их солей путем обработки с помощью сильных оснований, как гидроксид натрия или калия, карбонат натрия или калия, если в молекуле не содержится никаких других кислотных гр упп. В те х случаях, где соединения формулы (I) содержат свободные кислотные группы, путем обработки с помощью оснований также можно достигать солеобразования. В качестве оснований пригодны гидроксиды щелочных металлов, гидроксиды щелочноземельных металлов, или органические основания в форме первичных, вторичных или третичных аминов. Предметом изобретения далее является применение соединений формулы (I) и их физиологически приемлемых солей для приготовления фармацевтических композиций, в особенности нехимическим путем. При этом их вместе по меньшей мере с одним носителем или вспомогательным веществом и в случае необходимости в комбинации с одним или несколькими другими биологически активными веществами доводят до пригодной дозировочной формы. Предметом изобретения далее являются средства, в особенности фармацевтические композиции, содержащие, по меньшей мере одно соединение формулы (I) и/или одну из его физиологически приемлемых солей. Эти композиции можно применять в качестве лекарственных средств в медицине человека и ветеринарии. В качестве носителей принимают во внимание органические или неорганические вещества, которые пригодны для кишечного (например, орального), парентерального или топического введения и не реагируют с новыми соединениями, например, как вода, растительные масла, бензиловые спирты, полиэтиленгликоли, желатина; углеводы, как лактоза или крахмалы; стеарат магния, тальк, вазелин. Для кишечного применения служат в особенности таблетки, драже, капсулы, сиропы, соки, капли или свечи; для парентерального применения служат растворы, предпочтительно масляные или водные растворы, далее суспензии, эмульсии или имплантаты; для топического применения служат мази, кремы или пудры. Новые соединения можно также лиофилизировать и полученные лиофилизаты можно использовать, например, для приготовления препаратов для инъекций. Указанные композиции могут быть стерилизованы и/или могут содержать вспомогательные вещества , как придающие скользкость вещества, консерванты, стабилизаторы, и/или смачиватели, эмульгаторы, соли для влияния на осмотическое давление, буферные вещества, красители, вкусовые и/или ароматизирующие ве щества. Если желательно, они могут содержать также одно или несколько других биологически активных веществ, например один или несколько витаминов. Соединения формулы (I) и их физиологически приемлемые соли можно применять в медицине или ветеринарии. Они пригодны для лечения экстрапирамидально-моторных побочных действий нейролептических средств, заболеваний центральной нервной системы, как состояния напряженности, депрессии и/или психозы, и побочных действий при лечении гипертонии (например, с помощью α-Метил-dopa). Далее соединения могут найти применение в эндокринологии и гинекологии, например, для терапии акромегалии, недоразвития половых желез, вторичной аменореи, предменструального синдрома, нежелательной послеродовой лактации; далее для профилактики и терапии церебральных нарушений (например, мигрени), в особенности в гериатрии, подобно как известные Ergot-алкалоиды, и для борьбы с последствиями церебральных инфарктов (Apoplexia cerebri), как инсульт и церебральные ишемии. При этом предлагаемые согласно изобретению вещества, как правило, вводят по аналогии с известными, находящимися в продаже препаратами, например, как Бромкриптин, Дигидроэргокорнин, предпочтительно в дозах примерно 0,2-500 мг, в особенности 0,2-50 мг, на дозировочную единицу. Суточная доза предпочтительно составляет примерно 0,001-10 мг/кг веса тела. Низкие дозировки (примерно 0,2-1 мг на дозировочную единицу, примерно 0,001-0,005 мг/кг веса тела) при этом применяют в особенности в качестве средства от мигрени; для остальных показаний предпочтительны дозировки 10-50 мг на дозировочную единицу. Специальная доза для каждого определенного пациента, однако, зависит от самых различных факторов, например от эффективности используемого специального соединения, от возраста, веса тела, общего состояния здоровья, пола, стоимости, момента и пути введения, скорости выделения, комбинации лекарственных средств и тяжести соответствующего заболевания, которое имеет значение для терапии. Предпочтительно оральное применение. В нижеприведенных примерах "обычная обработка" обозначает: добавляют, если необходимо, воду, экстрагируют ди хлорметаном, разделяют, органическую фазу сушат над сульфа том натрия, отфильтровывают, выпаривают и очищают п утем хроматографии на силикагеле и/или путем кристаллизации. Температуры указаны в °С. Пример 1 1,2 г 3-(4-Хлорбутил)-5-метоксииндола (получается путем взаимодействия 5-метоксииндола с 4-хлорбутирилхлоридом с образованием 3-(4хлорбутирил)-5-метоксииндола и последующего восстановления с помощью диборана), а также 1,0 г 4-(индол-3-ил)-пиперидина (получается путем взаимодействия П-ВОС-4-пиперидона с индолом с последующей дегидратацией и гидрированием образующейся двойной связи, а также путем отщепления защитной группы) растворяют в 200 мл ацетонитрила и перемешивают 8 ч при комнатной температуре. После обычной обработки получают 3-/1-(4-(5-метоксииндол-3-ил)-бутил)-4-пиперидил) /-индол, гидрохлорид. Т. пл.=138-141°С (разложение). Аналогичным образом, путем взаимодействия метилового эфира 3-(4-хлорбутил)-индол-5-карбо 7 41333 новой кислоты с 4-(5-метоксииндол-3-ил)-пиперидином получают 3-/1-(4-(5-метоксикарбо-нилиндол-3-ил)-бутил)-4-пиперидил)/-5-метоксииндол, гидрохлорид; т. пл.=222-224°С; 3-(4-хлорбутил)-индола с 4-(5-метоксииндол-3ил)-пиперидином получают 3-/1-4-индол-3-ил)бутил)-4-пиперидил)/-5-метоксииндол, гидрохлрид; т. пл.=213-216°С; (3-(4-хлорбутил)-5-метоксииндола с 4-(5,6метилендиоксииндол-3-ил)-пиперидином получают 3-/1-(4-(5-метоксииндол-3-ил)-бутил)-4-пиперидил/-5,6-метилендиоксииндол, гидрохлорид; т. пл.=144-146°С; (3-(4-хлорбутил)-5-метоксииндола с 4-(5метоксииндол-3-ил)-пиперидином получают 3-/1(4-(5-метоксииндол-3-ил)-бутил-4-пиперидил/-5метоксииндол; (3-(4-хлорбутил)-индола с 4-(3-индолил)пиперидином получают 3-/1-(индол-3-ил)-бутил)-4пиперидил/-индол; (3-(4-хлорбутил)-5-метоксииндола с 4-(5гидроксииндол-3-ил)-пиперидином получают 3-/1(4-(5-метоксииндол-3-ил)-бутил)-4-пиперидил/-5гидроксииндол; т. пл.=203-204°С; (3-(4-хлорбутил)-5-цианиндола с 4-(5-карбамоилиндол-3-ил)-пиперидином получают 3-/1-(4цианиндол-3-ил)-бутил)-4-пиперидил/-индол-5карбоксамид, полугидрат; т. пл.=227-228°С; (3-(4-хлорбутил)-5-цианиндола с 4-(5-цианиндол-3-ил)-пиперидином получают 3-/1-(4-(5цианиндол-3-ил)-бутил)-4-пиперидил/-5-цианиндол, дигидрат; т. пл.=95-101°С; (3-(4-хлорбутил)-5-метоксикарбонилиндола с 4-(5-карбамоил-индол-3-ил)-бутил)-4-пиперидил/индол-5-карбоксамид, гидрат: т. пл.=228-231°С; (3-(4-хлорбутил)-индол-5-карбоксамида с 4-(5карбамоилиндол-3-ил)-пиперидином получают 3-/1-(4-(5-карбамоилиндол-3-ил)-бутил)-4-пиперидил/-индол-5-карбоксамид, тригидрохлрид, т. пл.=202-203°С; (3-(4-хлорбутил)-5-фториндола с 4-(5-фториндол-3-ил)-пиперидином получают 3-/1-(4-(5фториндол-3-ил)-бутил)-4-пиперидил/-5-фториндол; метилового эфира 3-(4-хлорбутил)-индол-5карбоновой кислоты: с 4-(5-метоксикарбонилиндол-3-ил)-пиперидином получают метиловый эфир 3-/1-(4-(5-метоксикарбонил-индол-3-ил)-бутил)-пиперидил/-индол-карбоновой кислоты; (3-(4-хлорбутил)-индол-5-карбоксамида с 4-(5цианиндол-3-ил)-пиперидином получают 3-/1-(4-(5карбамоил-индол-3-ил)-бутил)-4-пиперидил/-5цианиндол. Пример 2 0,8 г Метилового эфира 3-/1-(4-(5-метоксикарбонил-индол-3-ил)-бутил)-4-пиперидил /-индол5-карбоновой кислоты (получается согласно примеру 1) кипятят в течение 0,5 ч со 100 мл 2н. этанольного раствора КОН, обрабатывают как обычно и получают 3-/1-(4-(5-карбокси-индол-3-ил)бутил)-4-пиперидил/-индол-5-карбоновую кислоту. Аналогичным образом, путем омыления соответствующего сложного эфира, исходя из 3-/1-(4(5-метоксикарбонилиндол-3-ил)-бутил)-4-пиперидил/-5-метокси-индола получают 3-/1-(4-(5карбоксииндол-3-ил)-бутил)-4-пиперидил/-5-меток си-индол, гидрохлорид-гидрат; т. пл. 248°С (разложение); из 3-/1-(4-(5-метоксикарбонил-индол-3-ил)-бутил)-4-пиперидил/-индол-5-карбоксамида получают 3-/1-(4-(5-карбокси-индол-3-ил)-бутил)-4-пиперидил/-5-карбоксамид, гидрохлорид; т. пл. 282-285°С. Пример 3 Аналогично примеру 1, исходя из 3-(3-хлорпропил)-5-метоксииндола (получается путем взаимодействия 5-метоксииндола с 3-хлор-пропионилхлоридом с получением 3-(3-хлорпропионил)-5-метоксииндола и последующего восстановления с помощью диборана), а также 1,0 г 4-(индол-3-ил)-пиперидина (получается путем взаимодействия N-BOC-4-пиперидона с индолом, последующей дегидратации и гидрирования образовавшейся двойной связи, а также отщепления защитной группы), после обычной обработки получают 3-/1-(3-(5-метокси-индол-3-ил)-пропил)-4пиперидил/-индол. Аналогичным образом, путем взаимодействия метилового эфира 3-(3-хлорпропил)-индол-5-карбоновой кислоты с 4-(5-метокси-индол-3-ил)-пиперидином получают 3-/1-(3-(5-метоксикарбонилиндол-3-ил)-пропил)-4-пиперидил/-5-метоксииндол; 3-(3-хлорпропил)-индола с 4-(5-метоксииндол-3-ил)-пиперидином получают 3-/1-(3-(индол3-ил)-пропил)-4-пиперидил/-5-метоксииндол, гидрохлорид; 3-(3-хлорпропил)-5-метоксииндола с 4-(5,6метилендиоксииндол-3-ил)-пиперидином получают 3-/1-(3-(5-метоксииндол-3-ил)-пропил)-4-пиперидил/-5,6-метилендиокси-индол; 3-(3-хлорпропил)-5-метоксииндола с 4-(5-метоксииндол-3-ил)-пиперидином получают 3-/1-3(5-метокси-индол-3-ил)-пропил)-4-пиперидил/-5метоксииндол; 3-(3-хлорпропил)-индола с 4-(3-индолил)-пиперидином получают 3-/1-(3-(индол-3-ил)-пропил)4-пиперидил/-индол; 3-(3-хлорпропил)-5-метоксииндола с 4-(5-гидроксииндол-3-ил)-пиперидином получают 3/1-(3-(5метокси-индол-3-ил)-пропил)-4-пиперидил/-5-гидроксииндол; 3-(3-хлорпропил)-5-цианиндола с 4-(5-карбамоилиндол-3-ил)-пиперидином получают 3-/1-(3(5-циан-индол-3-ил)-пропил)-4-пиперидил/-индол5-карбоксамид; 3-(3-хлорпропил)-5-цианиндола с 4-(5-цианиндол-3-ил)-пиперидином получают 3-/1-(3-(5-циан-индол-3-ил)-пропил)-4-пиперидил/-5цианиндол; 3-(3-хлорпропил)-5-метоксикарбонилиндола с 4-(5-карбамоил-индол-3-ил)-пиперидином получают 3-/1-(3-(5-метоксикарбонил-индол-3-ил)-пропил)-4-пиперидил/-индол-5-карбоксамид; т. пл.=195-196°С; 3-(3-хлорпропил)-индол-5-карбоксамида с 4-(5-карбамоилиндол-3-ил)-пиперидином получают 3-/1-(3-(5-карбамоил-индол-3-ил)-пропил)-4-пиперидил/-индол-5-карбоксамид, сесквигидрохлорид-изопропанолят, т. пл.=102-105°C (разложение); 3-(3-хлорпропил)-5-фториндола с 4-(5-фториндол-3-ил)-пиперидином получают 3-/1-(3-(5 8 41333 фтор-индол-3-ил)-пропил)-4-пиперидил/-5фториндол, гидрохлорид-полугидрат, т. пл. 164-165°С; 3-(3-хлорпропил)-5-фториндола с 4-(6-фториндол-3-ил)-пиперидином получают 3-/1-(3-(5фтор-индол-3-ил)-пропил)-4-пиперидил/-6-фториндол, гидрохлорид-гидрат, т. пл. 174-178°С; 3-(3-хлорпропил)-5-фториндола с 4-(4-фториндол-3-ил)-пиперидином получают 3-/1-(3-(5фтор-индол-3-ил)-пропил)-4-пиперидил/-4-фториндол, гидрохлорид, т. пл. 269-270°С; метилового эфира 3-(3-хлорпропил)-индол-5карбоновой кислоты с 4-(5-метоксикар-бонилиндол-3-ил)-пиперидином получают метиловый эфир 3-/1-(3-(5-метоксикарбонил-индол-3-ил)-пропил)-4-пиперидил/-индол-5-карбоновой кислоты; 3-(3-хлорпропил)-индол-5-карбоксамида с 4-(5-цианиндол-3-ил)-пиперидином получают 3-/1(3-(5-карбамоил-индол-3-ил)-пропил)-4-пиперидил/-5-цианиндол, гидрат, т. пл. 102-104°С (разложение); Пример 4 Аналогично примеру 2, путем омыления метилового эфира 3-/1-(3-(5-метоксикарбонил-индол-3ил)-пропил)-4-пиперидил/-индол-3-ил)-пропил)-4пиперидил/-индол-5-карбоновой кислоты, получают 3-/1-(3-(5-карбокси-индол-3-ил)-пропил)-4-пиперидил/-индол-5-карбоновую кислоту. Аналогичным образом, путем омыления соответствующего сложного эфира исходя из: 3-/1-(3-(5-метоксикарбонилиндол-3-ил)-пропил)-4-пиперидил/-5-метокси-индола получают 3/1-(3-(5-карбоксииндол-3-ил)-пропил)-4-пиперидил/-5-метокси-индол; из метилового эфира 3-/1-(3-(5-метокси-индол3-ил)-пропил)-4-пиперидил/-индол-5-карбоновой кислоты получают 3-/1-(3-(5-метоксииндол-3-ил)пропил)-4-пиперидил/-индол-5-карбоновую кислоту; из метилового эфира 3-/1-(3-(6-метокси-индол3-ил)-пропил)-4-пиперидил/-индол-5-карбоновой кислоты получают 3-/1-(3-(6-метоксииндол-3-ил)пропил)-4-пиперидил/-индол-5-карбоновую кислоту; из метилового эфира 3-/1-(3-(4-метоксииндол3-ил)-пропил)-4-пиперидил/-индол-5-карбоновой кислоты получают 3-/1-(3-(4-метоксииндол-3-ил)пропил)-4-пиперидил/-индол-5-карбоновую кислоту; из 3-/1-(3-(5-метоксикарбонил-индол-3-ил)пропил)-4-пиперидил/-индол-5-карбоксамида получают 3-/1-(3-(5-карбокси-индол-3-ил)-пропил)-4пиперидил/-индол-5-карбоксамид, гидрохлорид, т. пл. 278-280°С. Пример 5 2,1 г 3-/1-(5-Метокси-индол-3-ил)-бутил)-4-пиперидил/-индол-5-карбоновой кислоты суспендируют в 100 мл N-метилпирролидина. Затем добавляют 3,2 г 2-хлор-1-метил-пиридинийметансульфоната и перемешивают при комнатной температуре в течение 12 ч. В образовавшийся раствор пропускают вплоть до насыщения высушенный газообразный NH3 и снова перемешивают в течение 10 ч. После обычной обработки получают 3-/1-(4-(5-метокси-индол-3-ил)-бутил)-4-иперидил/индол-5-карбоксамид. Аналогичным образом, путем амидирования нижеследующих карбоновых кислот с помощью 2-хлор-1-метил-пиридинийметансульфоната: из 3-/1-(4-(6-метоксииндол-3-ил)-бутил)-4-пиперидил/-индол-5-карбоновой кислоты получают 3-/1-(4-(6-метоксииндол-3-ил)-бутил)-4-пиперидил/-индол-5-карбоксамид; из 3-/1-(4-(4-метоксииндол-3-ил)-бутил)-4-пиперидил/-индол-5-карбоновой кислоты получают 3-/1-(4-(4-метоксииндол-3-ил)-бутил)-4-пиперидил/-индол-5-карбоксамид; из 3-/1-(3-5-карбокси-индол-3-ил)-пропил)-4пиперидил/-индол-5-карбоновой кислоты получают 3-/1-(3-(5-карбамоил-индол-3-ил)-пропил)-4-пиперидил/-индол-5-карбоксамид; из 3-/1-(3-карбокси-индол-3-ил)-пропил)-4-пиперидил/-5-метоксииндола получают 3-/1-(3-(5карбамоилиндол-3-ил)-пропил)-4-пиперидил/-5-метокси-индол; из 3-/1-(3-(5-метоксииндол-3-ил)-пропил)-4-пиперидил/-индол-5-карбоновой кислоты получают 3-/1-(3-(5-метоксииндол-3-ил)-пропил)-4-пиперидил/-индол-5-карбоксамид; из 3-/1-(3-(6-метоксииндол-3-ил-пропил)-4-пиперидил/-индол-5-карбоновой кислоты получают 3-/1-(3-(6-метоксииндол-3-ил)-пропил)-4-пиперидил/-индол-5-карбоксамид; из 3-/1-(3-(4-метоксииндол-3-ил)-пропил)-4-пиперидил/-индол-5-карбоновой кислоты получают 3-/1-(3-(4-метоксииндол-3-ил)-пропил)-4-пиперидил/-индол-5-карбоксамид. Пример 6 Раствор 3,9 г 3-/1-(4-(5-карбокси-индол-3-ил)бутил)-4-пиперидил/-индол-5-карбоновой кислоты в 250 мл ДМФ смешивают с 1 г N-метилморфолина. При перемешивании добавляют раствор двух эквивалентов трет.-бутиламина в 5 мл ДМФ, 1,3 г 1-гидроксибензотриазола, а также раствор 1,9 г N-(3-диметиламинопропил)N'-этилкарбодиимид-гидрохлорида в 20 мл ДМФ. Перемешивают 16 ч при комнатной температуре и фильтрат выпаривают. После обычной обработки получают 3-/1-(4-(5-N-трет.-бутилкарбамоил-индол-3-ил)бутил)-4-пиперидил/-индол-5-N-трет.бутилкарбоксамид. Аналогичным образом, путем взаимодействия с трет.-бутиламином, исходя из 3-/1-(4-(5-карбоксииндол-3-ил)-бутил)-4-пиперидил/-5-метоксииндола получают 3-/1-(4-(5-Nтрет.-бутилкарбамоилиндол-3-ил-бутил)-4-пиперидил/-5-метокси-индол; из 3-/1-(4-(5-карбокси-индол-3-ил)-бутил)-4-пиперидил/-индол-5-карбоксамида получают 3-/1-(4(5-N-трет.-бутилкарбамоилиндол-3-ил)-бутил)-4пиперидил/-индол-5-карбоксамид; из 3-/1-(3-(5-карбокси-индол-3-ил)-пропил)-4пиперидил/-5-метоксииндола получают 3-/1-(3-(5N-трет.-бутилкарбамоилиндол-3-ил)-пропил)-4-пиперидил/-5-метокси-индол. Пример 7 Смесь из 1,6 г 3-/1-(4-(индол-3-ил)-бутил)-4пиперидил/-5-метоксииндола (получается согласно примеру 1), 1,8 г пиридингидрохлорида, а также 50 мл пиридина кипятят 3 ч. Охлаждают, обрабатывают как обычно и получают 3-/1-(4-индол-3-ил)бутил)-4-пиперидил/-5-гидроксииндол; т. пл. 178-180°С. 9 41333 Аналогичным образом: из 3-/1-(4-(5-метокси-индол-3-ил)-бутил)-4-пиперидил/-индола получают 3-/1-(4-(5-гидроксииндол-3-ил)-бутил)-4-пиперидил/-индол; из 3-/1-(4-(5-метокси-индол-3-ил)-бутил)-4-пиперидил/-5-метоксииндола получают 3-/1-(4-(5гидрокси-индол-3-ил)-бутил)-4-пиперидил/-5-гидроксииндол; из 3-/1-(4-(6-метокси-индол-3-ил)-бутил)-4-пиперидил/-5-гидроксииндола получают 3-/1-(4-(6гидрокси-индол-3-ил)-бутил)-4-пиперидил/-5-гидроксииндол; из 3-/1-(3-(индол-3-ил)-пропил)-4-пиперидил/5-метоксииндола получают 3-/1-(3-(индол-3-ил)пропил)-4-пиперидил/-5-гидроксииндол; из 3-/1-(3-(5-метокси-индол-3-ил)-пропил)-4пиперидил/-5-метоксииндола получают 3-/1-(3-(5гидрокси-индол-3-ил)-пропил)-4-пиперидил/-5-гидроксииндол. Пример 8 К суспензии из 0,6 г литийалюминийгидрида в 20 мл ТГФ, при перемешивании и при комнатной температуре прикатывают раствор 3,6 г 3-/1-(4-(5метоксикарбонил-индол-3-ил)-бутил)-4-пиперидил/-индола в 40 мл ТГФ. Затем перемешивают следующий час при 25°С, добавляют 20 мл разбавленного раствора гидроксида натрия, отфильтровывают и фильтрат обрабатывают как обычно. Получают 3-/1-(4-(5-гидроксиметилиндол-3-ил)-бутил)-4-пиперидил/-индол. Аналогичным образом путем восстановления: 3-/1-(4-(5-метоксикарбонилиндол-3-ил)-бутил)4-пиперидил/-5-метокси-индола получают 3-/1-(4(5-гидроксиметилиндол-3-ил)-бутил)-4-пиперидил/5-метокси-индол; метилового эфира 3-/1-(4-(5-метоксикарбонилиндол-3-ил)-бутил)-4-пиперидил/-5-карбоновой кислоты получают 3-/1-(4-(5-гидроксиметил-индол-3ил)-бутил)-4-пиперидил/-5-гидроксиметилиндол; 3-/1-(3-(5-метоксикарбонилиндол-3-ил)-пропил)-4-пиперидил/-5-метоксииндола получают 3/1-(3-(5-гидроксиметилиндол-3-ил)-пропил)-4пиперидил/-5-метокси-индол; 3-/1-(3-(5-метоксикарбонил-индол-3-ил)пропил)-4-пиперидил/-индол-5-карбоксамида получают 3-/1-(3-(5-гидроксиметилиндол-3ил)пропил)-4-пиперидил/-индол-5-карбоксамид. Пример 9 В кипящий раствор 2,5 г 3-/1-(4-(5-карбоксииндол-3-ил)-бутил)-4-пиперидил/-5-фториндола в 50 мл абсолютного метанола в течение 2 ч пропускают газообразный хлороводород. Затем кипятят следующий час, обрабатывают как обычно и получают 3-/1-(4-(5-метокси-карбонилиндол-3-ил)бутил)-4-пиперидил/-5-фтор-индол. Пример 10 Аналогично примеру 1, путем взаимодействия 3-(4-хлорбутил)-индола (получается путем взаимодействия индола с 4-хлорбутирил-хлоридом с образованием 3-(4-хлорбутирил)-индола и последующего восстановления с помощью диборана)фиг с 4-(индол-3-ил)-1,2,5,6-тетрагидропиридином (получается путем взаимодействия NBOC-4-пиперидона с индолом и последующей дегидратации, а также отщепления защитной группы) в 200 мл ацетонитрила, после обычной обработки получают 3-/1-(4-(индол-3-ил)-бутил) (1,2,5,6-тетрагидропирид-4-ил)-/индол, гидрохлорид, т. пл. 190-192°С. Аналогичным образом, путем взаимодействия метилового эфира 3-(4-хлорбутил)-индол-5карбоновой кислоты с 4-(5-метокси-индол-3-ил)1,2,5,6-тетрагидропиридином получают 3-/1-(4-(5метоксикарбонилиндол-3-ил)-бутил)-(1,2,5,6-тетрагидропирид-4-ил)/-5-метоксииндол; 3-(4-хлорбутил)-индола с 4-(5-метокси-индол3-ил)-1,2,5,6-тетрагидропиридином получают 3-/1(4-(индол-3-ил)-бутил)-(1,2,5,6-тетрагидропирид-4ил)/-5-метоксииндол; 3-(4-хлорбутил)-5-метоксииндола с 4-(5,6-метилендиоксииндол-3-ил)-1,2,5,6тетрагидропиридином получают 3-/1-(4-(5метоксииндол-3-ил)-бутил)-(1,2,5,6тетрагидропирид-4-ил)/-5,6-мети-лендиоксииндол; 3-(4-хлорбутил)-5-метоксииндола с 4-(5-метоксииндол-3-ил)-1,2,5,6-тетрагидропиридином получают 3-/1-(4-(5-метоксииндол-3-ил)-бутил)(1,2,5,6-тетрагидропирид-4-ил)/-5-метоксииндол; 3-(4-хлорбутил)-индола с 4-(3-индолил)1,2,5,6-тетрагидропиридином получают 3-/1-(4(индол-3-ил)-бутил)-(1,2,5,6-тетрагидропирид-4ил)/-индол; 3-(4-хлорбутил)-5-метоксииндола с 4-(5-гидроксииндол-3-ил)-1,2,5,6-тетрагидропиридином получают 3-/1-(4-(5-метокси-индол-3-ил)-бутил)(1,2,5,6-тетрагидропирид-4-ил)/-5-гидроксииндол; 3-(4-хлорбутил)-5-цианиндола с 4-(5-кар-бамоилиндол-3-ил)-1,2,5,6-тетрагидропиридином получают 3-/1-(4-(5-циан-индол-3-ил)-бутил)(1,2,5,6-тетрагидропирид-4-ил)/-индол-5-карбоксамид; 3-(4-хлорбутил)-5-цианиндола с 4-(5-ци-аниндол-3-ил)-1,2,5.6-тетрагидропиридином получают 3-/1-(4-(5-цианиндол-3-ил)-бутил)-(1,2,5,6-тетрагидропирид-4-ил)/-5-цианиндол; 3-(4-хлорбутил)-5-метоксикарбонилиндола с 4-(5-карбамоил-индол-3-ил)-1,2,5,6-тетрагидропиридином получают 3-/1-(4-(5-метоксикарбонилиндол-3-ил)-бутил)-(1,2,5,6-тетрагидропирид-4ил)/-индол-5-карбоксамид; 3-(4-хлорбутил)-индол-5-карбоксамида с 4-(5карбамоил-индол-3-ил)-1,2,5,6-тетрагидропирдином получают 3-/1-(4-(5-карбамоил-индол-3-ил)бутил)-(1,2,5,6-тетрагидропирид-4-ил)/-индол-5карбоксамид; 3-(4-хлорбутил)-5-фториндола с 4-(5-фториндол-3-ил)-1,2,5,6-тетрагидропиридином получают 3-/1-(4-(5-фтор-индол-3-ил)-бутил)-(1,2,5,6-тетрагидропирид-4-ил)/-5-фтор-индол; метилового эфира 3-(4-хлорбутил)-индол-5карбоновой кислоты с 4-(5-метоксикарбонилиндол-3-ил)-1,2,5,6-тетрагидропиридином получают метиловый эфир 3-/1-(4-(5-метоксикарбонил-индол-3-ил)-бутил)-(1,2,5,6-тетрагидропирид-4-ил)/-индол-5-карбоновой кислоты; 3-(4-хлорбутил)-индол-5-карбоксамида с 4-(5цианиндол-3-ил)-1,2,5,6-тетрагидропиридином получают 3-/1-(4-(5-карбамоил-индол-3-ил)-бутил)(1,2,5,6-тетрагидропирид-4-ил)/-5-циан-индол. Пример 11 Аналогично примеру 1, исходя из 3-(2хлорэтил)-2-метил-5-метоксииндола (получается путем взаимодействия 2-метил-5-метоксииндола с 2-хлорацетилхлоридом с образованием 3-(2 10 41333 H хлорацетил)-2-метил-5-метоксииндола и последующего восстановления с помощью диборана), а также 1,0 г 4-(5-фториндол-3-ил)-пиперидина (получается путем взаимодействия N-BOC-4-пиперидона с 5-фториндолом, последующей дегидратации и гидрирования образовавшейся двойной связи, а также отщепления защитной группы) после обычной обработки получают 3-/1-(2-(2-метил-5метокси-индол-3-ил)-этил)-4-пиперидил/-5фториндол, гидрохлорид. Rf = 0,31. Аналогичным образом, путем взаимодействия 3-(2-хлорэтил)-индола с 4-(5-фтор-индол-3ил)-пиперидином получают 3-/1-(2-(индол-3-ил)этил)-4-пиперидил/-5-фториндол, гидрохлорид, Rf = 0,20; 3-(2-хлорэтил)-индола с 4-(4-фтор-индол-3ил)-пиперидином получают 3-/1-(2-(индол-3-ил)этил)-4-пиперидил/-4-фториндол, гидрохлорид, т. пл. 297°С; 3-(2-хлорэтил)-2-метил-5-метоксииндола с 4(4-фтор-индол-3-ил)-пиперидином получают 3-/1(2-(2-метил-5-метокси-индол-3-ил)-этил)-4-пиперидил/-4-фториндол, гидрохлорид, т. пл. 215°С; 3-(2-хлорэтил)-индола с 4-(5-метокси-индол-3ил)-пиперидином получают 3-/1-(2-(индол-3-ил)этил)-4-пиперидил/-5-метокси-индол; 3-(2-хлорэтил)-2-метил-5-метоксииндола с 4-(4-метокси-индол-3-ил)-пиперидином получают 3-/1-(2-метил-5-метокси-индол-3-ил)-этил)-4пиперидил/-4-метокси-индол. Пример 12 0,4 г 3-/1-((5-фтор-индол-3-индол-3-ил)метилкарбонил)-4-пиперидил/-5-фториндола (получается путем взаимодействия 5-фториндола с 2-хлорацетилхлоридом с образованием 3-(2хлорацетил)-5-метоксииндола и последующей реакции с 4-(5-фтор-индол-3-ил)-пиперидином) растворяют в 30 мл ТГФ и при комнатной температуре по каплям смешивают с 1,3 эквивалентами NaAl(ОСН2СН2OСН3)2Н2, растворенными в 10 мл толуола. Перемешивают 2 ч при комнатной температуре, затем обрабатывают как обычно и получают 3-/1-(2-(5-фтор-индол-3-ил)-этил)-4-пиперидил/-5-фториндол, гидрохлорид, Rf = 0,27. Аналогичным образом, путем восстановления с помощью NaAl(ОСН2СН2OСН3)2Н2; из 3-/1-(2-(5-фтор-индол-3-ил)-этилкарбонил)4-пиперидил/-4-фтор-индола получают 3-/1-(3-(5фтор-индол-3-ил)-пропил)-4-пиперидил/-4-фториндол; из 3-/1-(5-фтор-индол-3-ил)-метилкарбонил)-4пиперидил/-4-фториндола получают 3-/1-(2-(5фтор-индол-3-ил)-этил)-4-пиперидил/-4-фториндол, гидрохлорид; т. пл. 260°С. Фармакологические данные. Определяли связывание тритиированных лигандов гиппокамфальными рецепторами серотонина-1А по методу, описанному Cossery с сотруд. в журнале European J. Pharmacol., 140, стр. 143-155 (1987) в присутствии некоторых соединений формулы I. Данные IC50 приведены в табл. 1, значение IC50 приведено в нМ/л. R R 2 C n H 2n NH N H 1 NH R R 4 3 I Приведенные в табл. 1 данные свидетельствуют о сродстве соединений согласно изобретению к рецепторам центральной нервной системы, что отражает потенциал влияния к серотонинэргической трансмиссии (агонистической и/ил и антагонистической), вызванной серототин-1А-рецепторами. Ингибирование связывания тритиированных антагонистов допамина и агонистов, а также связывание спиперона и ADTN к D2-рецептору в стриатуме крысы определяли по методу, описанному Schwarcz с сотруд. в журнале Neuro-Chemistry, 34, 772-778 (1980) и Cossery с сотруд. в журнале European J. Pharmacol., 46, стр. 337-381 (1977). Определяли величину IC50 некоторых соединений формулы I, значения IC50 в нМоль/л данные приведены в табл. 2. H R R 2 C n H 2n NH N H 1 NH R R 4 3 I Нижеследующие примеры относятся к фармацевтическим композициям: Пример А: Препарат для инъекции. В растворе из 100 г биологически активного вещества формулы (I) и 5 г динатрийгидрофосфата в 3 л дважды перегнанной воды устанавливают рН 6,5 с помощью 2Н соляной кислоты, раствор стерильно фильтруют, разливают в стеклянные емкости для препаратов для инъекции, лиофилизируют в стерильных условиях и стерильно закрывают. Каждая стеклянная емкость с препаратом для инъекции содержит 5 мг биологически активного вещества. Пример Б: Свечи. Расплавляют смесь 20 г биологически активного вещества формулы (I) и 100 г соевого лецитина и 1400 г масла какао, разливают в формы и охлаждают. Каждая свеча содержит 20 мг биологически активного вещества. Пример В: Раствор. Готовят раствор 1 г биологически активного вещества формулы (I), 9,38 г NaH2PO 4·2H2O, 28,48 г NaHPO4·12H2O и 0,1 г бензальконийхлорида в 940 мл дважды перегнанной воды. Устанавливают рН 6,8, доливают до общего объема 1 л и стерилизуют путем облучения. Этот раствор можно применять в виде глазных капель. 11 41333 Пример Г: Мазь. Смешивают 500 мг биологически активного вещества формулы (I) и 99,5 г вазелина в асептических условия х. Пример Д: Таблетки. Смесь 1 кг биологически активного вещества формулы (I), 4 кг лактозы, 1,2 кг картофельного крахмала, 0,2 кг талька и 0,1 кг стеарата магния обычным образом прессуют в таблетки так, что каждая таблетка содержит 10 мг биологически активного вещества. Пример Е: Драже. Аналогично примеру Д прессуют таблетки, на которые затем наносят покрытие из сахарозы, R1 5-СООМе 5-СООН Н 5-ОМе Н 5-ОМе 5-ОМе 5-CN 5-CONH2 5-СООН 5-CN 5-CONH2 5-CONH2 5-CN 5-CONH2 Пример 1 2 1 1 1 1 1 1 1 2 1* 1 1 1 1 картофельного крахмала, талька, траганта и красителя. Пример Ж: Капсулы. 2 кг биологически активного вещества формулы (I) обычным образом вносят в твердые желатиновые капсулы так, что каждая капсула содержит 20 мг биологически активного вещества. Пример З: Ампулы. Раствор 1 кг биологически активного вещества формулы (I) в 60 л дважды перегнанной воды стерильно фильтруют, заполняют им ампулы, лиофилизируют в стерильных условиях и стерильно закрывают. Каждая ампула содержит 10 мг биологически активного вещества. Таблица 1 R2 H H H H H H H H H H H H H H H R3 5-OMe 5-OMe 5-OMe H 5-OMe 3,4-OCH 2O5-OH 5-CONH2 5-CONH2 5-CONH2 5-CN 5-CONH2 5-CN 5-F 5-F R4 H H H H H H H H H H H H H H n 4 4 4 4 4 4 4 4 4 4 4 4 4 4 4 ІС50 10 30 50 10 10 5 2 0,02 0,04 2 4 0,2 0,02 20 0,1 Me обозначает метил, * гидрохлорид-дигидрат. Таблица 2 Пример R1 R2 R3 R4 n 1 1 1 1 1 1 1 5-ОМе Н 5-CN 5-CN 5-CONH2 5-CONH2 5-CN H H H H H H H H 5-OMe 5-CONH2 5-CN 5-CONH2 5-CN 5-F H H H H H H Н 4 4 4 4 4 4 4 IC50 (спиперон) 20 50 15 0,2 8 0,3 0,5 __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2002 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 12 IC50 (ADTN) 50
ДивитисяДодаткова інформація
Назва патенту англійською3-indolpiperidines, a process for the preparation thereof, a pharmaceutical composition and a process for the preparation thereof
Автори англійськоюBytther Henning, Merz Joachim, Seifried Christophe, Grainer Hartmut, Bartoshyk Gerd
Назва патенту російською3-индолилпиперидины, способ их получения, фармацевтическая композиция и способ ее получения
Автори російськоюБеттхер Хеннинг, Мерц Йоахим, Зейфрид Кристоф, Грайнер Хартмут, Бартошик Герд
МПК / Мітки
МПК: A61K 31/4427, C07D 491/056, C07D 491/04, C07D 401/14, A61K 31/445, A61P 9/10, A61P 25/04, A61P 43/00, A61P 25/20
Мітки: композиція, фармацевтична, спосіб, 3-індолілпіперидини, одержання
Код посилання
<a href="https://ua.patents.su/12-41333-3-indolilpiperidini-sposib-kh-oderzhannya-farmacevtichna-kompoziciya-ta-sposib-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">3-індолілпіперидини, спосіб їх одержання, фармацевтична композиція та спосіб її одержання</a>
Наступний патент: Композиційний матеріал для захисного одягу
Випадковий патент: Спосіб корекції процесу мікроциркуляції крові людини