Кристалічні форми i, ii, iv кислої кальцієвої солі [r-(rr)]-2-(4-фторфеніл)-b, d-дигідрокси-5-(1-метилетил)-3-феніл-4-[(феніламіно)карбоніл]-1н-пірол-1-гептанової кислоти (аторвастатин) та фармацевтична композиція на їх основі
Номер патенту: 51661
Опубліковано: 16.12.2002
Автори: Мінохара Казуо, Вейд Роберт А., ХАРАСАВА Кікуко, Дженнінгс Рекс Ален, Бріггс Крістофер А., Накагава Шінсуке, Ічікава Шігеру
Формула / Реферат
1. Кристалічна форма І аторвастатину або його гідрату, для якої значення ![]() для основного піку дифракції рентгенівського випромінювання на порошку, виміряного з використанням випромінювання
для основного піку дифракції рентгенівського випромінювання на порошку, виміряного з використанням випромінювання ![]() , становить 21,6.
, становить 21,6.
2. Кристалічна форма І аторвастатину або його гідрату згідно з пунктом 1, що характеризується такими значеннями ![]() , виміряними з використанням випромінювання
, виміряними з використанням випромінювання ![]() : 17,1, 19,5 та 23,7.
: 17,1, 19,5 та 23,7.
3. Кристалічна форма І аторвастатину або його гідрату згідно з пунктом 2, що характеризується такими значеннями ![]() , виміряними з використанням випромінювання
, виміряними з використанням випромінювання ![]() : 9,2, 9,5, 10,3, 11,9, 22,0, 22,7 та 23,3.
: 9,2, 9,5, 10,3, 11,9, 22,0, 22,7 та 23,3.
4. Кристалічна форма І аторвастатину або його гідрату, що має значення ![]() дифракції рентгенівського випромінювання на порошку, виміряні з використанням випромінювання
дифракції рентгенівського випромінювання на порошку, виміряні з використанням випромінювання ![]() : 9,2, 9,5, 10,3, 10,6, 11,9, 12,2, 17,1, 19,5, 21,6, 22,0, 22,7, 23,3, 23,7, 24,4, 28,9 та 29,2.
: 9,2, 9,5, 10,3, 10,6, 11,9, 12,2, 17,1, 19,5, 21,6, 22,0, 22,7, 23,3, 23,7, 24,4, 28,9 та 29,2.
5. Кристалічна форма І аторвастатину або його гідрату, що має, принаймні, такі значення ![]() дифракції рентгенівського випромінювання на порошку, виміряні з використанням випромінювання
дифракції рентгенівського випромінювання на порошку, виміряні з використанням випромінювання ![]() : 11,9 або 22,0.
: 11,9 або 22,0.
6. Кристалічна форма І аторвастатину або його гідрату, що має наступні значення хімічного зсуву твердотільного ядерного магнітного резонансу 13С: 21,3, 25,2, 26,4, 40,2, 41,9, 47,4, 64,9, 68,1, 70,5, 73,1, 113,8, 118,2, 120,9, 123,5, 127,6, 129,5, 131,1, 134,9, 137,0, 159,3, 166,7 (широкий), 178,4 та 182,8 м.ч.
7. Кристалічна форма І аторвастатину згідно з будь-яким з попередніх пунктів, що містить від 1 до 8 молів води.
8. Кристалічна форма І аторвастатину згідно з будь-яким з попередніх пунктів, що містить 3 молі води.
9. Кристалічна форма II аторвастатину або його гідрату, для якої значення ![]() для основного піку дифракції рентгенівського випромінювання на порошку, виміряного з використанням випромінювання
для основного піку дифракції рентгенівського випромінювання на порошку, виміряного з використанням випромінювання ![]() , становить 8,5.
, становить 8,5.
10. Кристалічна форма II аторвастатину або його гідрату згідно з пунктом 9, що також характеризується наступними значеннями ![]() дифракції рентгенівського випромінювання на порошку, виміряними з використанням випромінювання
дифракції рентгенівського випромінювання на порошку, виміряними з використанням випромінювання ![]() : 9,0 та 20,5.
: 9,0 та 20,5.
11. Кристалічна форма II аторвастатину або його гідрату згідно з пунктом 10, що також характеризується наступними значеннями ![]() , виміряними з використанням випромінювання
, виміряними з використанням випромінювання ![]() : 5,6, 17,1-17,4 (широкий), 19,5 та 22,7-23,2 (широкий).
: 5,6, 17,1-17,4 (широкий), 19,5 та 22,7-23,2 (широкий).
12. Кристалічна форма II аторвастатину або його гідрату, що характеризується наступними значеннями ![]() дифракції рентгенівського випромінювання на порошку, виміряними з використанням випромінювання
дифракції рентгенівського випромінювання на порошку, виміряними з використанням випромінювання ![]() : 5,6, 7,4, 8,5, 9,0, 12,4 (широкий), 15,8 (широкий), 17,1-17,4 (широкий), 19,5, 20,5, 22,7-23,2 (широкий), 25,7 (широкий) та 29,5.
: 5,6, 7,4, 8,5, 9,0, 12,4 (широкий), 15,8 (широкий), 17,1-17,4 (широкий), 19,5, 20,5, 22,7-23,2 (широкий), 25,7 (широкий) та 29,5.
13. Кристалічна форма II аторвастатину або його гідрату, що характеризується такими значеннями ![]() , виміряними з використанням випромінювання
, виміряними з використанням випромінювання ![]() : 9,0 та 20,5.
: 9,0 та 20,5.
14. Кристалічна форма II аторвастатину або його гідрату, що має наступні значення хімічного зсуву твердотільного ядерного магнітного резонансу 13С: 22,8 (широкий), 27,5, 40,2, 41,7, 42,3, 43,4, 67,3, 68,0, 69,0, 70,6, 114,7, 115,7, 117,1, 119,0, 120,3, 121,4, 122,9, 129,0, 133,3, 134,8, 140,5, 161 (широкий), 163 (широкий) та 181 (широкий) м.ч.
15. Кристалічна форма IV аторвастатину або його гідрату, для якої значення ![]() для основного піку дифракції рентгенівського випромінювання на порошку, виміряного з використанням випромінювання
для основного піку дифракції рентгенівського випромінювання на порошку, виміряного з використанням випромінювання ![]() , становить 8,0.
, становить 8,0.
16. Кристалічна форма IV аторвастатину або його гідрату згідно з пунктом 15, що також характеризується наступним значенням ![]() , виміряним з використанням випромінювання
, виміряним з використанням випромінювання ![]() : 9,7.
: 9,7.
17. Кристалічна форма IV аторвастатину або його гідрату згідно з пунктом 16, що також характеризується наступним значенням ![]() , виміряним з використанням випромінювання
, виміряним з використанням випромінювання ![]() : 19,6.
: 19,6.
18. Кристалічна форма IV аторвастатину або його гідрату, що характеризується наступними значеннями ![]() дифракції рентгенівського випромінювання на порошку, виміряними з використанням випромінювання
дифракції рентгенівського випромінювання на порошку, виміряними з використанням випромінювання ![]() : 4,9, 5,4, 5,9, 8,0, 9,7, 10,4, 12,4, 17,7, 18,4, 19,2, 19,6, 21,7, 23,0, 23,7 та 24,1.
: 4,9, 5,4, 5,9, 8,0, 9,7, 10,4, 12,4, 17,7, 18,4, 19,2, 19,6, 21,7, 23,0, 23,7 та 24,1.
19. Кристалічна форма IV аторвастатину або його гідрату, що характеризується, принаймні, одним з значень ![]() дифракції рентгенівського випромінювання на порошку, виміряних з використанням випромінювання
дифракції рентгенівського випромінювання на порошку, виміряних з використанням випромінювання ![]() : 8,0 або 9,7.
: 8,0 або 9,7.
20. Кристалічна форма IV аторвастатину або його гідрату, що має наступні значення хімічного зсуву твердотільного ядерного магнітного резонансу 13С: 17,9, 19,4, 20,3, 25,9, 40,0, 42,1, 43,4, 46,1, 63,5, 66,3, 67,9, 71,5, 115,7, 119,8, 122,7, 127,1, 129,2, 134,7, 138,1 (широкий), 159,0 (широкий), 166,1 (широкий), 179,3, 181,4, 184,9 та 186,4 м.ч.
21. Фармацевтична композиція, що містить кристалічну форму І, форму II або форму IV аторвастатину або його гідрату, згідно з будь-яким з попередніх пунктів, і, принаймні, один фармацевтично прийнятний наповнювач, розчинник або носій.
22. Фармацевтична композиція згідно з пунктом 21 у вигляді таблеток, пілюль, гранул, що диспергуються, крохмальних капсул, капсул, порошків, лозенгів, супозиторіїв або клізм, що утримуються.
Текст
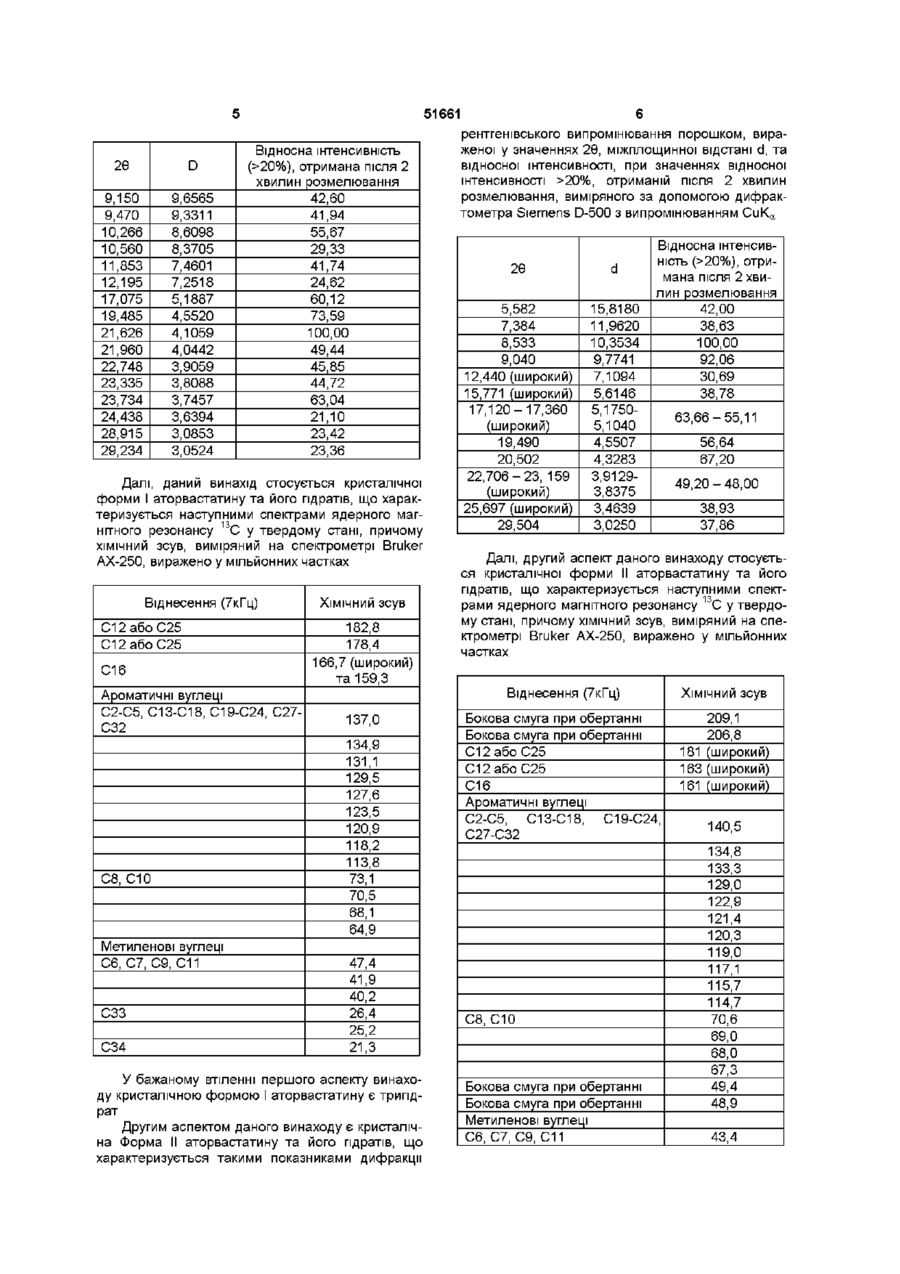
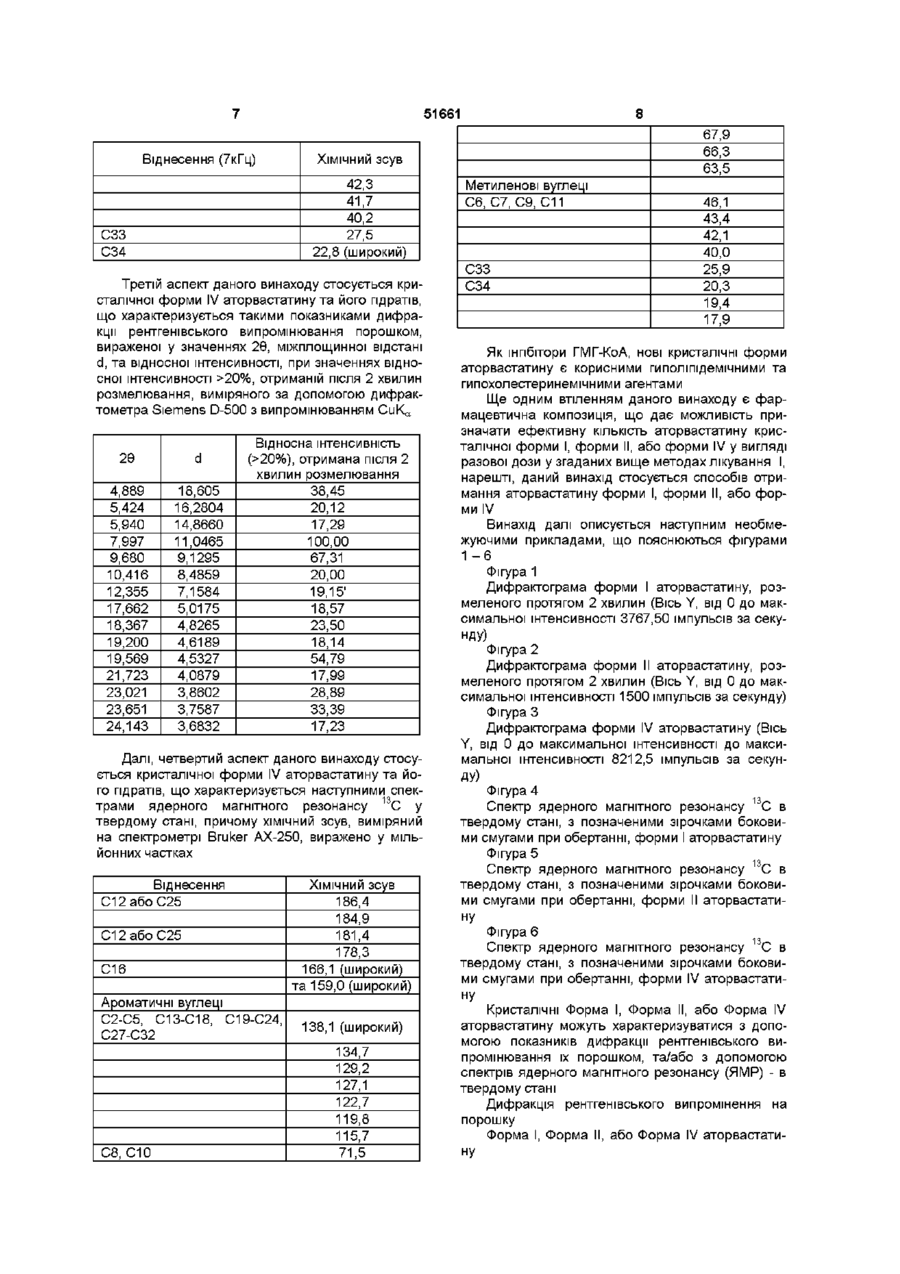
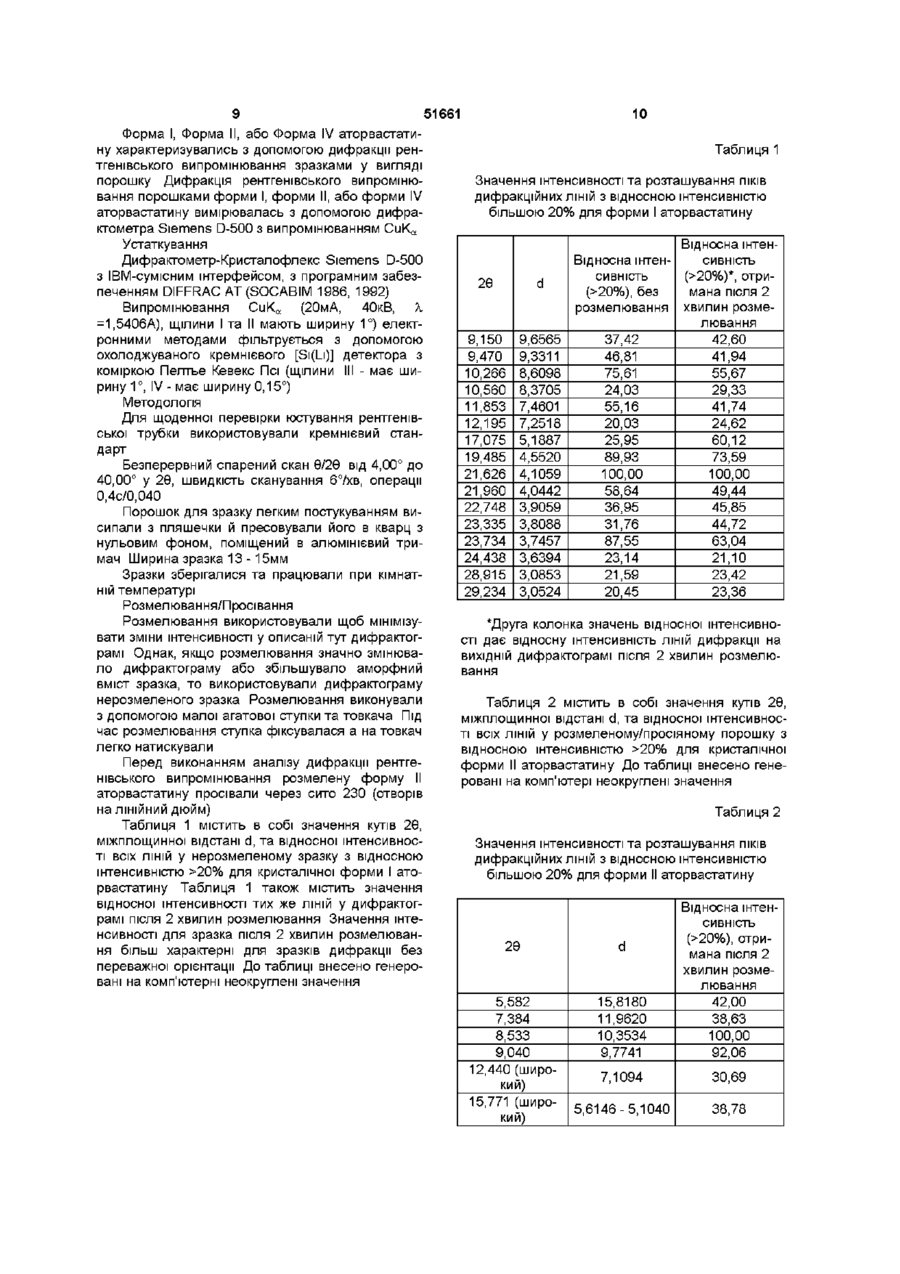
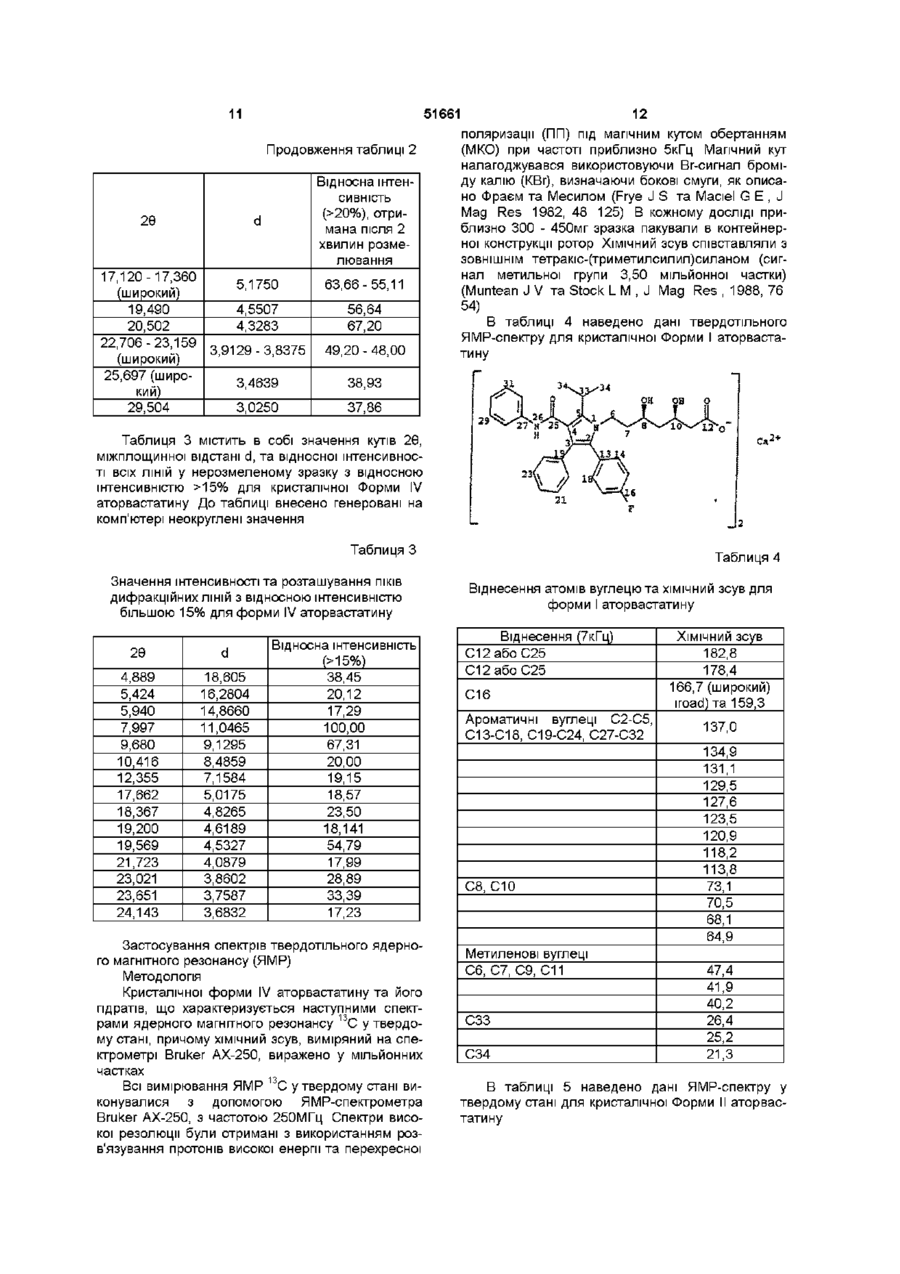
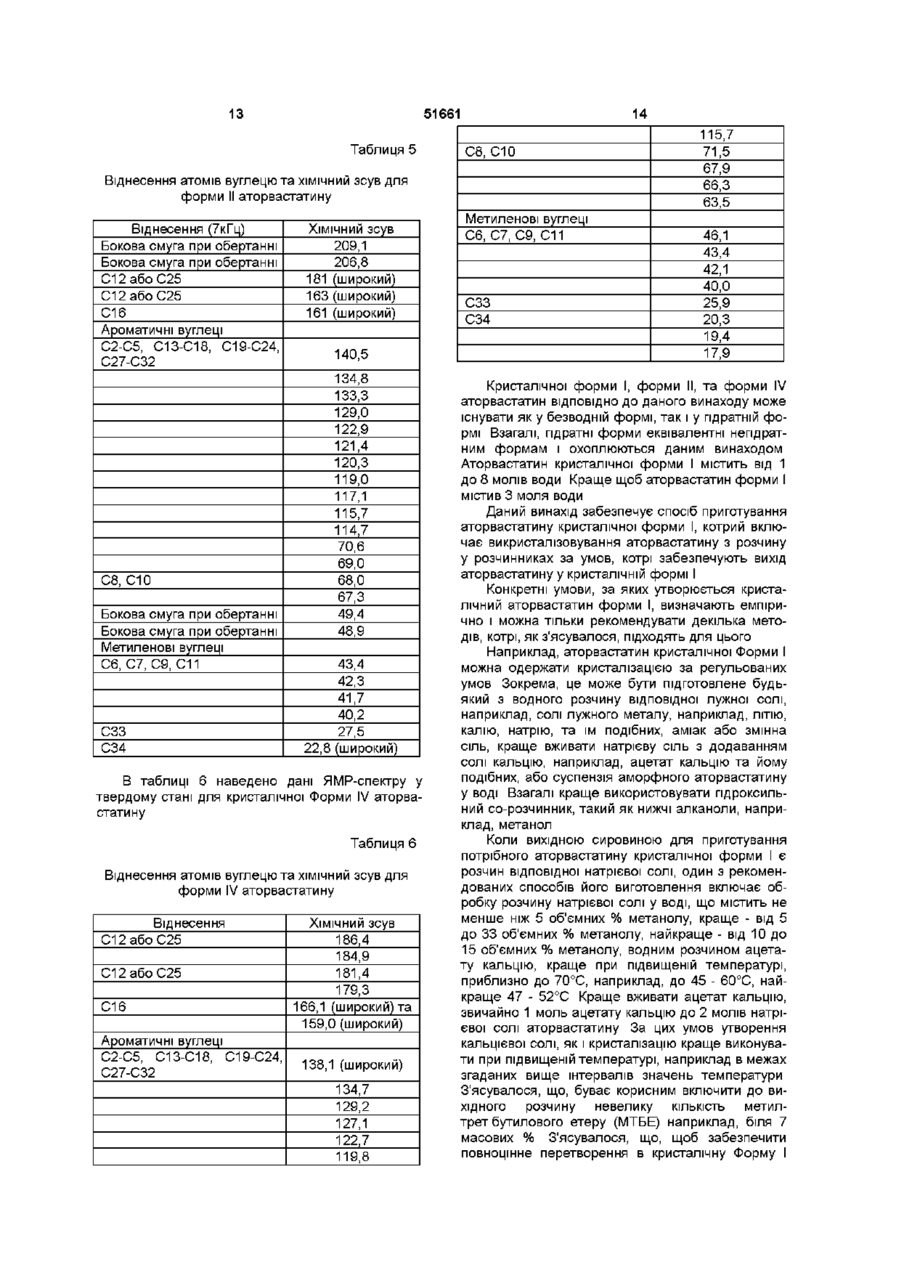
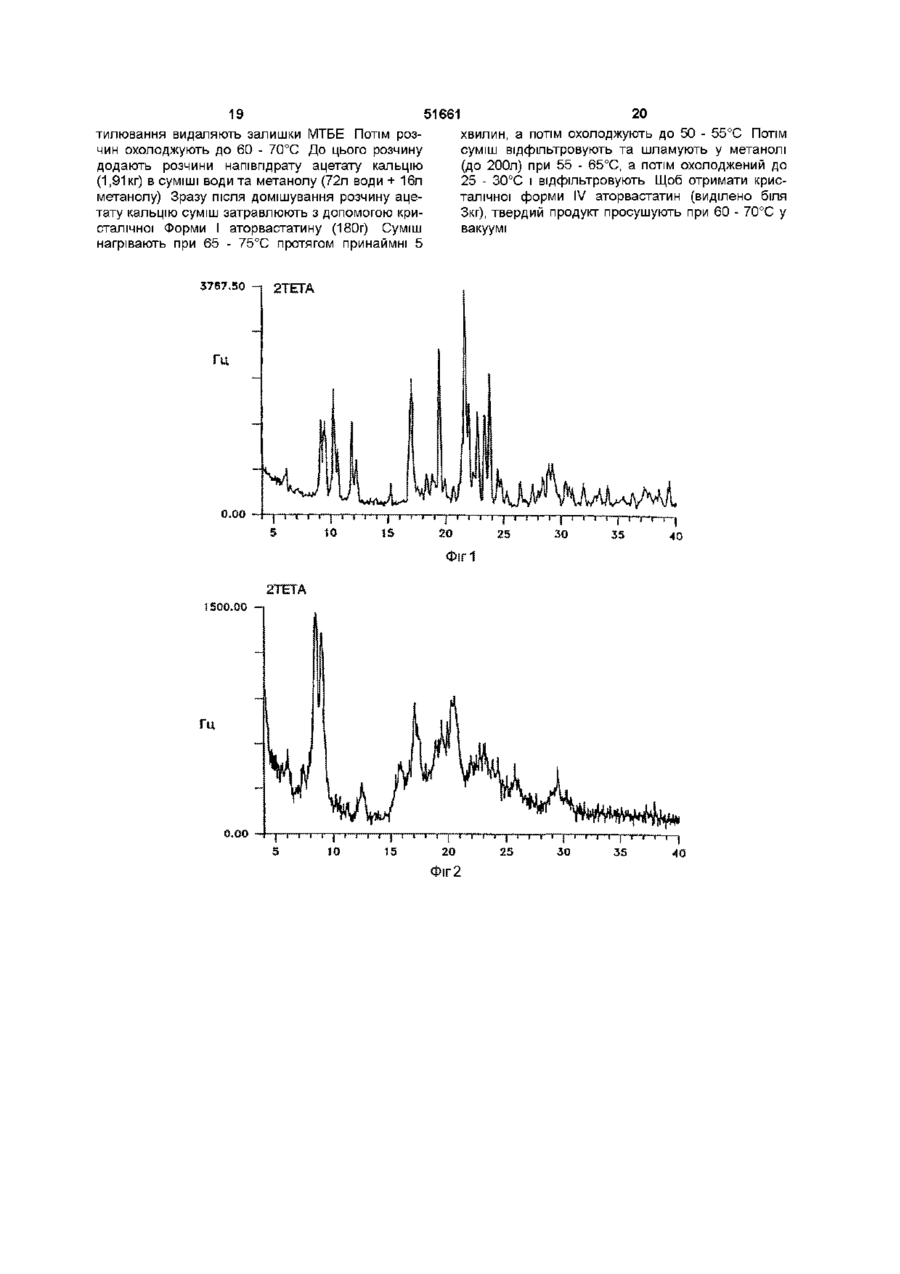
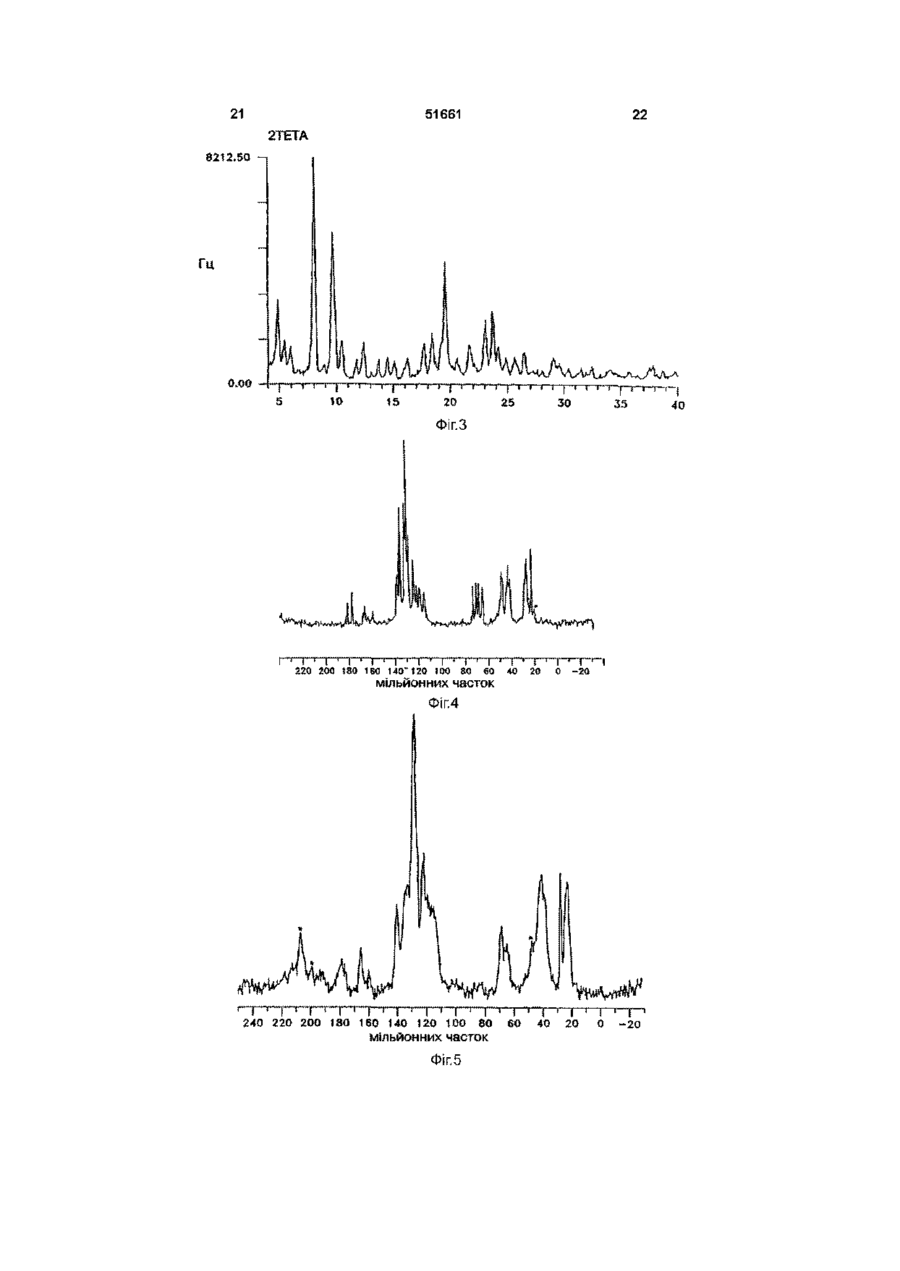
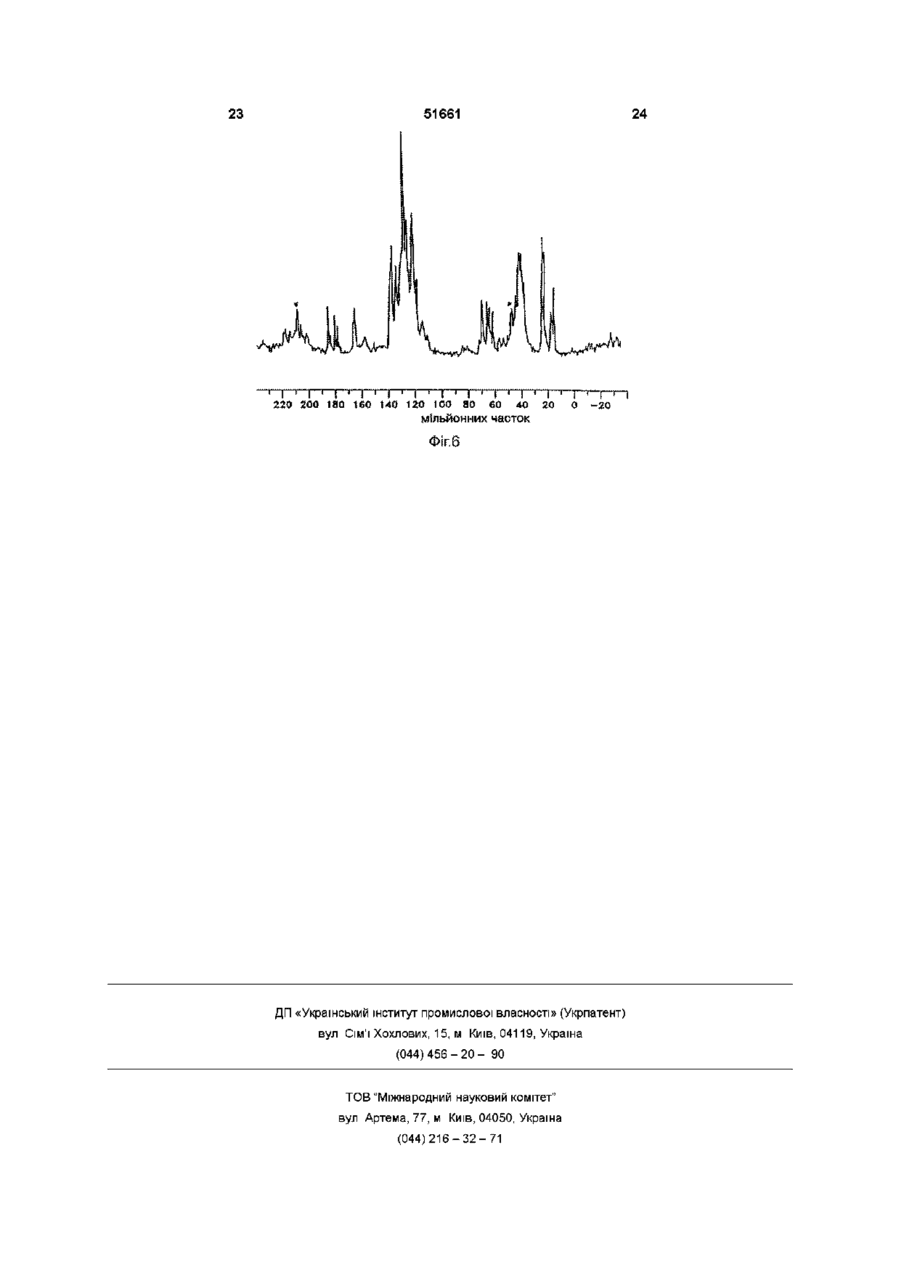
УКРАЇНА МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ UA (11)51661 (із)С2 (5i)6C07D207/34,A61K31/40 ОПИС ДО ПАТЕНТУ НА ВИНАХІД (54) КРИСТАЛІЧНІ ФОРМИ І, II, IV КИСЛОЇ КАЛЬЦІЄВОЇ СОЛІ [R-(R*,R*)]-2-(4-OTOPOEHm)-D, ПДИПДРОКСИ-5-(1-МЕТИЛЕТИЛ)-3-ФЕНІЛ-4-[(ФЕНІЛАМІНО)КАРБОНІЛ]-1Н-ПІРОЛ-1-ГЕПТАНОВОЇ КИСЛОТИ (АТОРВАСТАТИН) ТА ФАРМАЦЕВТИЧНА КОМПОЗИЦІЯ НА ЇХ ОСНОВІ 1 (21)98020824 (22)08 07 1996 (24)16 12 2002 (86) PCT/US96/11368, 08 07 1996 (31)60/001,452 (32)17 07 1995 (33) US (46) 16 12 2002, Бюл № 12, 2002 р (72) Бріггс Крістофер А , US, Дженнінгс Рекс Ален, US, Вейд Роберт А , US, Харасава Кікуко , JP, Ічікава Шігеру , JP, Мінохара Казуо , JP, Накагава Шінсуке , JP (73) Варнер-Ламберт Компані, US (56) ЕР, А, 0 409 281, 23 01 1991, кл C07D 207/327 US, А, 5 316 765, 31 05 1994, кл А61К 45/00 WO, A, 94/16693, 04 08 1994, кл А61К 31 /40 (57) 1 Кристалічна форма І аторвастатину або його гідрату, для якої значення 26 для основного піку дифракції рентгенівського випромінювання на порошку, виміряного з використанням випромінювання СиКа, становить 21,6 2 Кристалічна форма І аторвастатину або його гідрату згідно з пунктом 1, що характеризується такими значеннями 26, виміряними з використанням випромінювання СиК а 17,1, 19,5 та 23,7 3 Кристалічна форма І аторвастатину або його гідрату згідно з пунктом 2, що характеризується такими значеннями 26, виміряними з використанням випромінювання СиКа 9,2, 9,5, 10,3, 11,9, 22,0, 22,7 та 23,3 4 Кристалічна форма І аторвастатину або його гідрату, що має значення 26 дифракції рентгенівського випромінювання на порошку, виміряні з використанням випромінювання СиК а 9,2, 9,5, 10,3, 10,6, 11,9, 12,2, 17,1, 19,5, 21,6, 22,0, 22,7, 23,3, 23,7, 24,4, 28,9 та 29,2 5 Кристалічна форма І аторвастатину або його гідрату, що має, принаймні, такі значення 26 дифракції рентгенівського випромінювання на порошку, виміряні з використанням випромінювання СиК а 11,9 або 22,0 6 Кристалічна форма І аторвастатину або його гідрату, що має наступні значення ХІМІЧНОГО зсуву твердотільного ядерного магнітного резонансу 3С 21,3, 25,2, 26,4, 40,2, 41,9, 47,4, 64,9, 68,1, 70,5, 73,1, 113,8, 118,2, 120,9, 123,5, 127,6, 129,5, 131,1, 134,9, 137,0, 159,3, 166,7 (широкий), 178,4та 182,8 мч 7 Кристалічна форма І аторвастатину згідно з будь-яким з попередніх пунктів, що містить від 1 до 8 молів води 8 Кристалічна форма І аторвастатину згідно з будь-яким з попередніх пунктів, що містить 3 молі води 9 Кристалічна форма II аторвастатину або його гідрату, для якої значення 26 для основного піку дифракції рентгенівського випромінювання на порошку, виміряного з використанням випромінювання СиКа, становить 8,5 10 Кристалічна форма II аторвастатину або його гідрату згідно з пунктом 9, що також характеризується наступними значеннями 26 дифракції рентгенівського випромінювання на порошку, виміряними з використанням випромінювання СиК а 9,0 та 20,5 11 Кристалічна форма II аторвастатину або його гідрату згідно з пунктом 10, що також характеризується наступними значеннями 26, виміряними з використанням випромінювання СиКа 5,6, 17,117,4 (широкий), 19,5та 22,7-23,2 (широкий) 12 Кристалічна форма II аторвастатину або його гідрату, що характеризується наступними значеннями 26 дифракції рентгенівського випромінювання на порошку, виміряними з використанням випромінювання СиКа 5,6, 7,4, 8,5, 9,0, 12,4 (широкий), 15,8 (широкий), 17,1-17,4 (широкий), 19,5, 20,5, 22,7-23,2 (широкий), 25,7 (широкий) та 29,5 13 Кристалічна форма II аторвастатину або його гідрату, що характеризується такими значеннями 26, виміряними з використанням випромінювання СиКа 9,0 та 20,5 14 Кристалічна форма II аторвастатину або його гідрату, що має наступні значення ХІМІЧНОГО зсуву твердотільного ядерного магнітного резонансу 3С 22,8 (широкий), 27,5, 40,2, 41,7, 42,3, 43,4, 67,3, 68,0, 69,0, 70,6, 114,7, 115,7, 117,1, 119,0, 120,3, 121,4, 122,9, 129,0, 133,3, 134,8, 140,5, 161 (широкий), 163 (широкий) та 181 (широкий) м ч 15 Кристалічна форма IV аторвастатину або його О (О (О ю 51661 гідрату, для якої значення 26 для основного піку дифракції рентгенівського випромінювання на порошку, виміряного з використанням випромінювання СиКа, становить 8,0 16 Кристалічна форма IV аторвастатину або його гідрату згідно з пунктом 15, що також характеризується наступним значенням 26, виміряним з використанням випромінювання СиК^ 9,7 17 Кристалічна форма IV аторвастатину або його гідрату згідно з пунктом 16, що також характеризується наступним значенням 26, виміряним з використанням випромінювання СиКа 19,6 18 Кристалічна форма IV аторвастатину або його гідрату, що характеризується наступними значеннями 26 дифракції рентгенівського випромінювання на порошку, виміряними з використанням випромінювання СиК а 4,9, 5,4, 5,9, 8,0, 9,7, 10,4, 12,4, 17,7, 18,4, 19,2, 19,6, 21,7, 23,0, 23,7 та 24,1 19 Кристалічна форма IV аторвастатину або його гідрату, що характеризується, принаймні, одним з значень 26 дифракції рентгенівського випромінювання на порошку, виміряних з використанням випромінювання СиК^ 8,0 або 9,7 20 Кристалічна форма IV аторвастатину або його гідрату, що має наступні значення ХІМІЧНОГО зсуву твердотільного ядерного магнітного резонансу 3С 17,9, 19,4, 20,3, 25,9, 40,0, 42,1, 43,4, 46,1, 63,5, 66,3, 67,9, 71,5, 115,7, 119,8, 122,7, 127,1, 129,2, 134,7, 138,1 (широкий), 159,0 (широкий), 166,1 (широкий), 179,3, 181,4, 184,9та 186,4 м ч 21 Фармацевтична композиція, що містить кристалічну форму І, форму II або форму IV аторвастатину або його гідрату, згідно з будь-яким з попередніх пунктів, і, принаймні, один фармацевтично прийнятний наповнювач, розчинник або носій 22 Фармацевтична композиція згідно з пунктом 21 у вигляді таблеток, пілюль, гранул, що диспергуються, крохмальних капсул, капсул, порошків, лозенпв, супозиторіїв або клізм, що утримуються Даний винахід пов'язаний з новими кристалічними формами аторвастатину, котрий відомий під ХІМІЧНОЮ назвою кисла кальцієва сіль [R-(R*,R*)]-2(4-фторфеніл)-[3,5-дипдрокси-5-(1-метилетил)-3феніл-4-[(феніламшо)карбоніл]-1Н-пірол-1гептанової кислоти, і котрі можна використовувати як фармацевтичні агенти, з методами їх виробництва та ізоляції, з фармацевтичними композиціями, котрі включають ці сполуки, з фармацевтично прийнятними носіями, та з фармацевтичними методами обробки Нові кристалічні сполуки ВІДПОВІДНО до даного винаходу можна використовувати як інгібітори ферменту З-пдрокси-3-метилглутарилкоензим А редуктази (HMG-COA редуктази) та, таким чином, як гиполіпідемічний та гіпохолестеринемічний агенти перевага, бо вона дає можливість зручно готувати ліки у вигляді, наприклад, таблеток, капсул, тістечок, і тому подібного для орального вживання Додатково, є потреба виробляти аторвастатин у чистій та кристалічній формі, яка б повністю відповідала фармацевтичний вимогам та стандартам До того ж, спосіб, котрим виробляється аторвастатин, повинен відповідати вимозі забезпечення великих обсягів виробництва Також бажано щоб продукт вироблявся у формі що легко фільтрується та просушується Нарешті, економічно бажано щоб продукт був стійким протягом довгого часу без потреби в спеціалізованих умовах зберігання Способи, описані у вищезгаданих патентах США, дозволяють отримати аморфний аторвастатин, котрий має погані характеристики фільтрування та висушування, що не відповідають вимогам великомасштабного виробництва, та має захищатися від впливу тепла, світла, кисню, та вологи Несподівано з'ясувалося що аторвастатин можна отримати у кристалічній формі Отже, цей винахід забезпечує отримання аторвастатину у незвичних кристалічних формах, що позначаються як Форма І, Форма II та Форма IV Форма І аторвастатину складається з більш малих частинок та має більш однорідний розподіл щодо їх розміру, порівняно з попереднім аморфним продуктом, та має більш прийнятні характеристики фільтрування та висушування На додаток до цього, Форма І аторвастатину, порівняно з аморфним продуктом, - більш чистий та більш стійкий продукт Таким чином, даний винахід стосується кристалічної форми І аторвастатину та його гідратів, що характеризується такими показниками дифракції рентгенівського випромінювання порошком, вираженої у значеннях 26, міжплощинної відстані d, та відносної інтенсивності, при значеннях відносної інтенсивності >20%, отриманій після 2 хвилин розмелювання, виміряного за допомогою дифрактометра Siemens D-500 з випромінюванням СиК а Патент США № 4681893, котрий вжито тут для довідки, описує певний транс-6-[2-(3-або 4карбоксиамідозаміщений-пірол-1-іл)алкіл]-4пдроксипіран-2-ону тому числі транс (±)-5-(4фторофеніл)-2-(1-метилетил)-І\І,4-дифеніл-1-[(2тетрапдро-4-пдрокси-6-оксо-2Н-піран-2-іл)етил]-1 Н-пірол-3-карбоксамід Патент США № 5273995, котрий вжито тут для довідки, описує енантюмер, що має R-форму кислоти, отриманої розкриванням циклу транс-5-(4фторофеніл)-2-(1-метилетил)-І\І,4-дифеніл-1-[(2тетрапдро-4-пдрокси-6-оксо-2Н-піран-2-іл)етил]1Н-пірол-3-карбоксамід, тобто, [R-(R*,R*)]-2-(4фторофеніл)-3,5-дипдрокси-5-(1-метилетил)-3феніл-4-((феніламіно)карбоніл]-1 Н-пірол-1 гептанову кислоту Патенти США №№ 5003080, 5097045, 5103024, 5124482, 5149837, 5155251, 5216174, 5245047, 5248793, 5280126, 5397792, та 5342952, котрі тут вжито тут для довідок, описують різноманітні способи та ключові проміжні сполуки для отримання аторвастатину Аторвастатин отримують у вигляді його кальцієвої солі, тобто, кальцієвої солі [R-(R*,R*)]-2-(4фторофеніл)-[3,5-дипдрокси-5-(1-метилетил)-3феніл-4-[(феніламшо)-карбоніл]-1 Н-пірол-1 гептанової кислоти (2 1) Кальцієвій солі надається 51661 2Є D 9,150 9,470 10,266 10,560 11,853 12,195 17,075 19,485 21,626 21,960 22,748 23,335 23,734 24,438 28,915 29,234 9,6565 9,3311 8,6098 8,3705 7,4601 7,2518 5,1887 4,5520 4,1059 4,0442 3,9059 3,8088 3,7457 3,6394 3,0853 3,0524 Відносна інтенсивність (>20%), отримана після 2 хвилин розмелювання 42,60 41,94 55,67 29,33 41,74 24,62 60,12 73,59 100,00 49,44 45,85 44,72 63,04 21,10 23,42 23,36 Далі, даний винахід стосується кристалічної форми І аторвастатину та його гідратів, що характеризується наступними спектрами ядерного магнітного резонансу 13С у твердому стані, причому ХІМІЧНИЙ зсув, виміряний на спектрометрі Bruker АХ-250, виражено у мільйонних частках Віднесення (7кГц) С12абоС25 С12абоС25 С16 Ароматичні вуглеці С2-С5, С13-С18, С19-С24, С27С32 С8, СЮ Метиленові вуглеці С6, С7, С9, С11 СЗЗ С34 ХІМІЧНИЙ зсув 182,8 178,4 166,7 (широкий) та 159,3 137,0 134,9 131,1 129,5 127,6 123,5 120,9 118,2 113,8 73,1 70,5 68,1 64,9 47,4 41,9 40,2 26,4 25,2 21,3 У бажаному втіленні першого аспекту винаходу кристалічною формою І аторвастатину є трипдрат Другим аспектом даного винаходу є кристалічна Форма II аторвастатину та його гідратів, що характеризується такими показниками дифракції рентгенівського випромінювання порошком, вираженої у значеннях 26, міжплощинної відстані d, та відносної інтенсивності, при значеннях відносної інтенсивності >20%, отриманій після 2 хвилин розмелювання, виміряного за допомогою дифрактометра Siemens D-500 з випромінюванням СиК а 2Є d 5,582 7,384 8,533 9,040 12,440 (широкий) 15,771 (широкий) 17,120-17,360 (широкий) 19,490 20,502 22,706-23, 159 (широкий) 25,697 (широкий) 29,504 15,8180 11,9620 10,3534 9,7741 7,1094 5,6146 5,17505,1040 4,5507 4,3283 3,91293,8375 3,4639 3,0250 Відносна інтенсивність (>20%), отримана ПІСЛЯ 2 ХВИЛИН розмелювання 42,00 38,63 100,00 92,06 30,69 38,78 63,66-55,11 56,64 67,20 49,20-48,00 38,93 37,86 Далі, другий аспект даного винаходу стосується кристалічної форми II аторвастатину та його гідратів, що характеризується наступними спектрами ядерного магнітного резонансу 13С у твердому стані, причому ХІМІЧНИЙ зсув, виміряний на спектрометрі Bruker АХ-250, виражено у мільйонних частках Віднесення (7кГц) ХІМІЧНИЙ зсув Бокова смуга при обертанні Бокова смуга при обертанні С12абоС25 С12абоС25 С16 Ароматичні вуглеці С2-С5, С13-С18, С19-С24, С27-С32 209,1 206,8 181 (широкий) 163 (широкий) 161 (широкий) С8, СЮ Бокова смуга при обертанні Бокова смуга при обертанні Метиленові вуглеці С6, С7, С9, С11 140,5 134,8 133,3 129,0 122,9 121,4 120,3 119,0 117,1 115,7 114,7 70,6 69,0 68,0 67,3 49,4 48,9 43,4 51661 Віднесення (7кГц) ХІМІЧНИЙ зсув 42,3 41,7 40,2 27,5 22,8 (широкий) СЗЗ С34 Третій аспект даного винаходу стосується кристалічної форми IV аторвастатину та його гідратів, що характеризується такими показниками дифракції рентгенівського випромінювання порошком, вираженої у значеннях 26, міжплощинної відстані d, та відносної інтенсивності, при значеннях відносної інтенсивності >20%, отриманій після 2 хвилин розмелювання, виміряного за допомогою дифрактометра Siemens D-500 з випромінюванням СиК а 2Є d 4,889 5,424 5,940 7,997 9,680 10,416 12,355 17,662 18,367 19,200 19,569 21,723 23,021 23,651 24,143 18,605 16,2804 14,8660 11,0465 9,1295 8,4859 7,1584 5,0175 4,8265 4,6189 4,5327 4,0879 3,8602 3,7587 3,6832 Відносна інтенсивність (>20%), отримана після 2 хвилин розмелювання 38,45 20,12 17,29 100,00 67,31 20,00 19,15і 18,57 23,50 18,14 54,79 17,99 28,89 33,39 17,23 Далі, четвертий аспект даного винаходу стосується кристалічної форми IV аторвастатину та його гідратів, що характеризується наступними спектрами ядерного магнітного резонансу 13С у твердому стані, причому ХІМІЧНИЙ зсув, виміряний на спектрометрі Bruker AX-250, виражено у мільйонних частках Віднесення С12абоС25 С12абоС25 С16 Ароматичні вуглеці С2-С5, С13-С18, С19-С24, С27-С32 С8, СЮ 67,9 66,3 63,5 ХІМІЧНИЙ зсув 186,4 184,9 181,4 178,3 166,1 (широкий) та 159,0 (широкий) 138,1 (широкий) 134,7 129,2 127,1 122,7 119,8 115,7 71,5 Метиленові вуглеці С6, С7, С9, С11 СЗЗ С34 46,1 43,4 42,1 40,0 25,9 20,3 19,4 17,9 Як інгібітори ГМГ-КоА, нові кристалічні форми аторвастатину є корисними гиполіпідемічними та гипохолестеринемічними агентами Ще одним втіленням даного винаходу є фармацевтична композиція, що дає можливість призначати ефективну КІЛЬКІСТЬ аторвастатину кристалічної форми І, форми II, або форми IV у вигляді разової дози у згаданих вище методах лікування І, нарешті, даний винахід стосується способів отримання аторвастатину форми І, форми II, або форми IV Винахід далі описується наступним необмежуючими прикладами, що пояснюються фігурами 1 -6 Фігура 1 Дифрактограма форми І аторвастатину, розмеленого протягом 2 хвилин (Вісь Y, від 0 до максимальної інтенсивності 3767,50 імпульсів за секунду) Фігура 2 Дифрактограма форми II аторвастатину, розмеленого протягом 2 хвилин (Вісь Y, від 0 до максимальної інтенсивності 1500 імпульсів за секунду) Фігура З Дифрактограма форми IV аторвастатину (Вісь Y, від 0 до максимальної інтенсивності до максимальної інтенсивності 8212,5 імпульсів за секунДУ) Фігура 4 Спектр ядерного магнітного резонансу 13С в твердому стані, з позначеними зірочками боковими смугами при обертанні, форми І аторвастатину Фігура 5 Спектр ядерного магнітного резонансу 13С в твердому стані, з позначеними зірочками боковими смугами при обертанні, форми II аторвастатину Фігура 6 Спектр ядерного магнітного резонансу 13С в твердому стані, з позначеними зірочками боковими смугами при обертанні, форми IV аторвастатину Кристалічні Форма І, Форма II, або Форма IV аторвастатину можуть характеризуватися з допомогою показників дифракції рентгенівського випромінювання їх порошком, та/або з допомогою спектрів ядерного магнітного резонансу (ЯМР) - в твердому стані Дифракція рентгенівського випромшення на порошку Форма І, Форма II, або Форма IV аторвастатину 51661 Форма I, Форма II, або Форма IV аторвастатину характеризувались з допомогою дифракції рентгенівського випромінювання зразками у вигляді порошку Дифракція рентгенівського випромінювання порошками форми І, форми II, або форми IV аторвастатину вимірювалась з допомогою дифрактометра Siemens D-500 з випромінюванням СиК а Устаткування Дифрактометр-Кристалофлекс Siemens D-500 з IBM-сумісним інтерфейсом, з програмним забезпеченням DIFFRAC AT (SOCABIM 1986, 1992) Випромінювання СиК а (20м А, 40кВ, X =1,5406А), щілини І та II мають ширину 1°) електронними методами фільтрується з допомогою охолоджуваного кремнієвого [SI(LI)] детектора з коміркою Пелтье Кевекс Псі (ЩІЛИНИ III - має ширину 1°, IV - має ширину 0,15°) Методологія Для щоденної перевірки юстування рентгенівської трубки використовували кремнієвий стандарт Безперервний спарений скан Э/2Э від 4,00° до 40,00° у 26, швидкість сканування 67хв, операції 0,4с/0,040 Порошок для зразку легким постукуванням висипали з пляшечки й пресовували його в кварц з нульовим фоном, поміщений в алюмінієвий тримач Ширина зразка 13 - 15мм Зразки зберігалися та працювали при кімнатній температурі Розмелювання/Просівання Розмелювання використовували щоб мінімізувати зміни інтенсивності у описаній тут дифрактограмі Однак, якщо розмелювання значно змінювало дифрактограму або збільшувало аморфний вміст зразка, то використовували дифрактограму нерозмеленого зразка Розмелювання виконували з допомогою малої агатової ступки та товкача Під час розмелювання ступка фіксувалася а на товкач легко натискували Перед виконанням аналізу дифракції рентгенівського випромінювання розмелену форму II аторвастатину просівали через сито 230 (отворів 10 Таблиця 1 Значення інтенсивності та розташування ПІКІВ дифракційних ЛІНІЙ з відносною інтенсивністю більшою 20% для форми І аторвастатину 26 d 9,150 9,470 10,266 10,560 11,853 12,195 17,075 19,485 21,626 21,960 22,748 23,335 23,734 24,438 28,915 29,234 9,6565 9,3311 8,6098 8,3705 7,4601 7,2518 5,1887 4,5520 4,1059 4,0442 3,9059 3,8088 3,7457 3,6394 3,0853 3,0524 Відносна інтенсивність Відносна інтен(>20%)*, отрисивність мана після 2 (>20%), без розмелювання хвилин розмелювання 37,42 42,60 46,81 41,94 75,61 55,67 24,03 29,33 55,16 41,74 20,03 24,62 25,95 60,12 89,93 73,59 100,00 100,00 58,64 49,44 36,95 45,85 31,76 44,72 87,55 63,04 23,14 21,10 21,59 23,42 20,45 23,36 *Друга колонка значень відносної інтенсивності дає відносну інтенсивність ЛІНІЙ дифракції на ВИХІДНІЙ дифрактограмі після 2 хвилин розмелювання Таблиця 2 містить в собі значення кутів 26, міжплощинної відстані d, та відносної інтенсивності всіх ЛІНІЙ у розмеленому/просіяному порошку з відносною інтенсивністю >20% для кристалічної форми II аторвастатину До таблиці внесено генеровані на комп'ютері неокруглені значення на ЛІНІЙНИЙ дюйм) Таблиця 1 містить в собі значення кутів 26, міжплощинної відстані d, та відносної інтенсивності всіх ЛІНІЙ у нерозмеленому зразку з відносною інтенсивністю >20% для кристалічної форми І аторвастатину Таблиця 1 також містить значення відносної інтенсивності тих же ЛІНІЙ у дифрактограмі після 2 хвилин розмелювання Значення інтенсивності для зразка після 2 хвилин розмелювання більш характерні для зразків дифракції без переважної орієнтації До таблиці внесено генеровані на комп'ютерні неокруглені значення Таблиця 2 Значення інтенсивності та розташування ПІКІВ дифракційних ЛІНІЙ з відносною інтенсивністю більшою 20% для форми II аторвастатину 26 d 5,582 7,384 8,533 9,040 12,440 (широкий) 15,771 (широкий) 15,8180 11,9620 10,3534 9,7741 Відносна інтенсивність (>20%), отримана після 2 хвилин розмелювання 42,00 38,63 100,00 92,06 7,1094 30,69 5,6146-5,1040 38,78 51661 11 Продовження таблиці 2 2Є 17,120-17,360 (широкий) 19,490 20,502 22,706-23,159 (широкий) 25,697 (широкий) 29,504 Відносна інтенсивність (>20%), отримана після 2 хвилин розмелювання d 5,1750 63,66-55,11 4,5507 4,3283 56,64 67,20 3,9129-3,8375 49,20 - 48,00 3,4639 Mag Res 1982, 48 125) В кожному ДОСЛІДІ при близно 300 - 450мг зразка пакували в контейнерної конструкції ротор ХІМІЧНИЙ зсув співставляли з ЗОВНІШНІМ тетракіс-(триметилсилил)силаном (сиг нал метильної групи 3,50 мільйонної частки) (Muntean J V та Stock L M , J Mag Res , 1988, 76 54) 38,93 3,0250 12 поляризації (ПП) під магічним кутом обертанням (МКО) при частоті приблизно 5кГц Магічний кут налагоджувався використовуючи Вг-сигнал броміду калію (КВг), визначаючи бокові смуги, як описано Фраєм та Месилом (Frye J S та Maciel G Е , J 37,86 В таблиці 4 наведено дані твердотільного ЯМР-спектру для кристалічної Форми І аторвастатину Л 3V-,_,34 Са 2+ Таблиця 3 містить в собі значення кутів 26, міжплощинної відстані d, та відносної інтенсивності всіх ЛІНІЙ у нерозмеленому зразку з відносною інтенсивністю >15% для кристалічної Форми IV аторвастатину До таблиці внесено генеровані на комп'ютері неокруглені значення Таблиця З Значення інтенсивності та розташування ПІКІВ дифракційних ЛІНІЙ з відносною інтенсивністю більшою 15% для форми IV аторвастатину 2Є d 4,889 5,424 5,940 7,997 9,680 10,416 12,355 17,662 18,367 19,200 19,569 21,723 23,021 23,651 24,143 18,605 16,2804 14,8660 11,0465 9,1295 8,4859 7,1584 5,0175 4,8265 4,6189 4,5327 4,0879 3,8602 3,7587 3,6832 Відносна інтенсивність (>15%) 38,45 20,12 17,29 100,00 67,31 20,00 19,15 18,57 23,50 18,141 54,79 17,99 28,89 33,39 17,23 Застосування спектрів твердотільного ядерного магнітного резонансу (ЯМР) Методологія Кристалічної форми IV аторвастатину та його гідратів, що характеризується наступними спектрами ядерного магнітного резонансу 13С у твердому стані, причому ХІМІЧНИЙ зсув, виміряний на спектрометрі Bruker AX-250, виражено у мільйонних частках Всі вимірювання ЯМР 13С у твердому стані виконувалися з допомогою ЯМР-спектрометра Bruker AX-250, з частотою 250МГц Спектри високої резолюції були отримані з використанням розв'язування протонів високої енергії та перехресної Таблиця 4 Віднесення атомів вуглецю та ХІМІЧНИЙ зсув для форми І аторвастатину Віднесення (7кГц) С12абоС25 С12абоС25 С16 Ароматичні вуглеці С2-С5, С13-С18, С19-С24, С27-С32 С8, СЮ Метиленові вуглеці С6, С7, С9, С11 СЗЗ С34 ХІМІЧНИЙ зсув 182,8 178,4 166,7 (широкий) iroad)Ta 159,3 137,0 134,9 131,1 129,5 127,6 123,5 120,9 118,2 113,8 73,1 70,5 68,1 64,9 47,4 41,9 40,2 26,4 25,2 21,3 В таблиці 5 наведено дані ЯМР-спектру у твердому стані для кристалічної Форми II аторвастатину 13 51661 Таблиця 5 14 С8, СЮ Віднесення атомів вуглецю та ХІМІЧНИЙ зсув для форми II аторвастатину Віднесення (7кГц) Бокова смуга при обертанні Бокова смуга при обертанні С12абоС25 С12абоС25 С16 Ароматичні вуглеці С2-С5, С13-С18, С19-С24, С27-С32 С8, СЮ Бокова смуга при обертанні Бокова смуга при обертанні Метиленові вуглеці С6, С7, С9, С11 СЗЗ С34 ХІМІЧНИЙ зсув 209,1 206,8 181 (широкий) 163 (широкий) 161 (широкий) 140,5 134,8 133,3 129,0 122,9 121,4 120,3 119,0 117,1 115,7 114,7 70,6 69,0 68,0 67,3 49,4 48,9 43,4 42,3 41,7 40,2 27,5 22,8 (широкий) В таблиці 6 наведено дані ЯМР-спектру у твердому стані для кристалічної Форми IV аторвастатину Таблиця 6 Віднесення атомів вуглецю та ХІМІЧНИЙ зсув для форми IV аторвастатину Віднесення С12абоС25 С12абоС25 С16 Ароматичні вуглеці С2-С5, С13-С18, С19-С24, С27-С32 ХІМІЧНИЙ зсув 186,4 184,9 181,4 179,3 166,1 (широкий) та 159,0 (широкий) 138,1 (широкий) 134,7 129,2 127,1 122,7 119,8 Метиленові вуглеці С6, С7, С9, С11 СЗЗ С34 115,7 71,5 67,9 66,3 63,5 46,1 43,4 42,1 40,0 25,9 20,3 19,4 17,9 Кристалічної форми І, форми II, та форми IV аторвастатин ВІДПОВІДНО ДО даного винаходу може існувати як у безводній формі, так і у гідратній формі Взагалі, гідратні форми еквівалентні непдратним формам і охоплюються даним винаходом Аторвастатин кристалічної форми І містить від 1 до 8 молів води Краще щоб аторвастатин форми І містив 3 моля води Даний винахід забезпечує спосіб приготування аторвастатину кристалічної форми І, котрий включає викристалізовування аторвастатину з розчину у розчинниках за умов, котрі забезпечують вихід аторвастатину у кристалічній формі І Конкретні умови, за яких утворюється кристалічний аторвастатин форми І, визначають емпірично і можна тільки рекомендувати декілька методів, котрі, як з'ясувалося, підходять для цього Наприклад, аторвастатин кристалічної Форми І можна одержати кристалізацією за регульованих умов Зокрема, це може бути підготовлене будьякий з водного розчину відповідної лужної солі, наприклад, солі лужного металу, наприклад, ЛІТІЮ, калію, натрію, та їм подібних, аміак або змінна сіль, краще вживати натрієву сіль з додаванням солі кальцію, наприклад, ацетат кальцію та йому подібних, або суспензія аморфного аторвастатину у воді Взагалі краще використовувати гідроксильний со-розчинник, такий як нижчі алканоли, наприклад, метанол Коли вихідною сировиною для приготування потрібного аторвастатину кристалічної форми І є розчин відповідної натрієвої солі, один з рекомендованих способів його виготовлення включає обробку розчину натрієвої солі у воді, що містить не менше ніж 5 об'ємних % метанолу, краще - від 5 до 33 об'ємних % метанолу, найкраще - від 10 до 15 об'ємних % метанолу, водним розчином ацетату кальцію, краще при підвищеній температурі, приблизно до 70°С, наприклад, до 45 - 60°С, найкраще 47 - 52°С Краще вживати ацетат кальцію, звичайно 1 моль ацетату кальцію до 2 молів натрієвої солі аторвастатину За цих умов утворення кальцієвої солі, як і кристалізацію краще виконувати при підвищеній температурі, наприклад в межах згаданих вище інтервалів значень температури З'ясувалося, що, буває корисним включити до вихідного розчину невелику КІЛЬКІСТЬ метилтрет бутилового етеру (МТБЕ) наприклад, біля 7 масових % З'ясувалося, що, щоб забезпечити повноцінне перетворення в кристалічну Форму І 51661 15 аторвастатину, часто бажано додати до розчину кристалізації затравку з аторвастатину кристалічної форми І Коли вихідною сировиною є аморфний аторвастатин або комбінація аморфної та кристалічної форми І аторвастатину, потрібну кристалічну Форму І аторвастатину можна отримати суспендуванням названих твердих речовин у воді, що містить до 40 об'ємних % (краще - від 0 до 20 об'ємних %, найкраще - від 0 до 15 об'ємних %) співрозчинника, наприклад, метанолу, етанолу, 2пропанолу, ацетону, та їм подібних, до завершення перетворення на потрібну форму, після чого виконується фільтрування Щоб забезпечити повноцінне перетворення в кристалічну Форму І аторвастатину, часто бажано додати до цієї суспензії затравку з аторвастатину кристалічної форми І аторвастатину В іншому випадку зволожену водою грудку, що складається, в основному, з аморфного аторвастатину, можна нагріти, наприклад, до 70°С, найкраще - до 65 - 70°С, поки не утвориться значна КІЛЬКІСТЬ кристалічної Форми І аторвастатину, після чого цю суміш аморфної та кристалічної форми І аторвастатину можна шламувати, як описано вище Кристалічної форми І аторвастатин значно легше виділити ніж аморфний аторвастатин, після охолодження його можна відфільтрувати з середовища кристалізації, промити та просушити Наприклад, фільтрування 50мл шламу кристалічної форми І аторвастатину виконується протягом 10 секунд Фільтрування подібного розміру зразка аморфного аторвастатину потребує більше години Даний винахід також забезпечує спосіб приготування аторвастатину кристалічної форми II, котрий включає суспендування аторвастатину в розчинниках за умов, котрі забезпечують вихід аторвастатину у кристалічній формі II Конкретні умови, за яких утворюється кристалічний аторвастатин форми II, визначають емпірично і можна тільки рекомендувати декілька методів, котрі, як з'ясувалося, підходять для цього Наприклад, коли вихідною сировиною є аморфний аторвастатин або комбінація аморфної та кристалічної форми І аторвастатину, потрібну кристалічну Форму II аторвастатину можна отримати суспендуванням названих твердих речовин у метанолі, що містить від 40 до 50% води, до завершення перетворення на потрібну форму, після чого виконується фільтрування Даний винахід також забезпечує спосіб приготування аторвастатину кристалічної форми IV, котрий включає кристалізацію аторвастатину з розчину в розчинниках за умов, котрі забезпечують вихід аторвастатину у кристалічній формі IV Конкретні умови, за яких утворюється кристалічний аторвастатин форми IV, визначають емпірично і можна тільки рекомендувати декілька методів, котрі, як з'ясувалося, підходять для цього Наприклад, коли вихідною сировиною є аторвастатин кристалічної форми І, потрібну кристалічну форму IV аторвастатину можна отримати розчиненням названої твердої речовини у метанолі, після чого осаджується аторвастатин кристалічної форми IV 16 Сполуки даного винаходу можуть готуватися та призначатися в широкому спектрі форм дозування для орального та парентерального застосування Наприклад, сполуки даного винаходу можуть призначатися у вигляді ІН'ЄКЦІЙ внутрішньовенних, внутрішньом'язових, внутрішньошкірних, підшкірних, внутрішньокишкових або внутрішньочеревних Сполуки даного винаходу можуть також призначатися у вигляді інгаляцій, наприклад, в ніс Додатково, сполуки даного винаходу можуть бути призначені для вживання через шкіру Таким чином, зрозуміло що наступні форми дозування можуть містити в собі, в якості активних компонентів, або сполуки, або відповідну фармацевтично прийнятну сіль сполуки даного винаходу Фармацевтично прийнятні носи, що вживаються для приготування фармацевтичних композицій зі сполук даного винаходу, можуть бути або твердими речовинами, або рідинами До препаратів у твердій формі належать порошки, таблетки, ПІЛЮЛІ, капсули, крохмальні капсули, супозиторії, та гранули, що диспергуються Твердим носієм може бути одна або більше речовин, котрі можуть також діяти як розчинники, ароматичні речовини, розчинники, мастильні речовини, суспендуючі речовини, в'яжучі речовини, консерванти, речовини, що полегшують розщеплення таблеток, або капсулюючі матеріали У порошках носій - це добре подрібнена тверда речовина, що утворює суміш з добре подрібненим активним компонентом У таблетках активний компонент змішаний з носієм, що має необхідні в'яжучі властивості, у потрібних співвідношеннях, формі та розмірах Бажано щоб порошки та таблетки містили від двох або десяти до семидесяти процентів активної сполуки Придатні носи карбонат магнію, стеарат магнію, тальк, цукор, лактоза, пектин, декстрин, крохмаль, желатин, трагакант, метилцелюлоза, натрієва карбоксиметилцелюлоза, легкоплавкий віск, масло какао, та їм подібні Термін "приготування" передбачає технологію приготування лікарського засобу з активної сполуки, що використовує капсулюючий матеріал як носій, що формує капсулу, в котрій цей активний компонент, з іншими носіями, або без них, охоплюється одним з носіїв, котрий, таким чином, об'єднується з ним Це стосується також крохмальних капсул та плюшок Таблетки, порошки, капсули, ПІЛЮЛІ, крохмальні капсули, та плюшки можуть бути використані як тверді форми дозування, придатні для орального призначання Для приготування супозиторіїв легкоплавкий віск, наприклад, суміш гліцеридів жирних кислот або масло какао, спочатку розплавляють а потім гомогенно диспергують в них, наприклад, збовтуванням, розплавлену гомогенну суміш потім наливають в потрібного розміру форми, де вона охолоджується та затверджується До препаратів рідкої форми належать розчини, суспензії, стримувальні клізми, та емульсії, наприклад, водні або водно-пропіленгликольні розчини Для парентеральних ІН'ЄКЦІЙ рідкі препарати можна готувати у вигляді водного поліетиленглікольного розчину 51661 17 Водні розчини, придатні для орального застосування, можна приготувати, розчинивши аісгивний компонент у воді та додавши потрібні барвники, ароматизатори, стабілізуючі речовини та речовини для загуснення Водні суспензії, придатні для орального застосування, можна приготувати, диспергуючи тонко подрібнений активний компонент у воді з в'язким матеріалом, наприклад природними або синтетичними камедями, смолами, метилцелюлозою, натрієвою карбоксиметилцелюлозою, та іншими добре ВІДОМІ суспендуючими речовинами До винаходу також належать препарати у твердій формі, котрі, безпосередньо перед використанням, перетворюються в препарати рідкої форми, що призначаються для орального застосування Такі рідкі форми включають розчини, суспензії, та емульсії Ці препарати можуть містити, крім активного компонента, барвники, ароматизатори, стабілізатори, буфери, штучні та природні підсолоджувачі, дисперганти, загусники, речовини, що покращують розчинність, та їм подібні Фармацевтичний препарат краще мати у формі разових доз У такій формі, препарати ділять на разові дози, що містить відповідну КІЛЬКІСТЬ активного компонента Форма разових доз може передбачати пакування препаратів, що містить окремі порції препарату, наприклад, пакування таблеток, капсул, та порошків у пляшечки або ампули Також, форма разових доз може бути капсулою, таблеткою, крохмальною капсулою, або цілою плюшкою, або це може бути відповідне число будь-якого з цих елементів в упакованій формі КІЛЬКІСТЬ активного компонента у разовій дозі препарату може змінюватися або регулюватися в діапазоні від 0,5мг до ЮОмг, краще - від 2,5мг до 80мг, ВІДПОВІДНО до конкретного застосуванням та ДІЄВОСТІ активного компонента Композиція може, якщо потрібно, містити також ІНШІ сумісні терапевтичні речовини У терапевтичному використанні як гиполіпідеМІЧНІ та/або гипохолестеринемічні речовини, кристалічні форми І, II, та IV аторвастатину, застосовані у фармацевтичному методі ВІДПОВІДНО ДО даного винаходу, призначаються при початковій дозі від 2,5мг до 80мг щоденній Краще використовувати діапазон щоденних доз від 2,5мг до 20мг Дози, однак, можуть змінюватися, залежно від стану конкретного пацієнта, умов лікування та застосованої речовини Визначення правильної дози для конкретної ситуації - є в межах кваліфікації лікаря Звичайно лікування починають з дозами, меншими за оптимальну дозу сполуки Потім дозу потроху збільшують до досягання оптимального ефекту, залежно від обставин лікування Для зручності, загальна щоденна доза може бути розділена, і може призначатися у частинах протягом дня, якщо потрібно Наступні приклади, якими не обмежується застосування даного винаходу, ілюструють методи приготування сполук ВІДПОВІДНО ДО даного винаходу, застосовані винахідниками Приклад 1 Кисла кальцієва сіль [R-(R*,R*)]-2-(4фторофеніл)-[3,5-дипдрокси-5-(1-метилетил)-3 18 феніл-4-[(феніламшо) карбоніл]-1 Н-пірол-1 гептанової кислоти (Форма І аторвастатину) Спосіб А Суміш (2Р-транс)-5-(4-фторофеніл)-2-(метилетил)-г\І,4-дифенілу-1-[2-(тетрапдро-4пдрокси-6-оксо-2Н-піран-2-іл)етил]-1Н-пірол-3карбоксиаміду (лактон аторвастатину) (патент США № 5273995) (75кг), метилтретбутилового етеру (МТБЕ) (308кг), метанолу (190л) реагувала з водним розчином гідроксиду натрію (5,72кг у 950л) при 48 - 58°С протягом 40 - 60 хвилин, з метою утворення натрієвої солі з розкриванням циклу Після охолодження до 25 - 35°С органічний шар відокремлюють, а водяний шар знов екстрагують МТБЕ (230кг) Органічний шар відокремлюють, а насичений МТБЕ водний розчин натрієвої солі нагрівають до 47 - 52°С Через, принаймні, ЗО хвилин до цього розчину додають розчин напівпдрату ацетату кальцію (11,94кг) у воді (410л) Зразу після домішування розчину ацетату кальцію суміш затравлюють з допомогою шламу кристалічної форми І аторвастатину (1,1кг в 11л води та 5л метанолу) Потім суміш нагрівають до 51 - 57°С, протягом принаймні 10 хвилин, а потім охолоджують до 15 40°С Суміш відфільтровують, промивають розчином метанолу (150л) у воді (300л) а потім водою (450л) Щоб отримати кристалічної форми 1 аторвастатину (72,2кг), твердий продукт просушують при 60 - 70°С у вакуумі протягом 3 - 4 діб Спосіб Б Аморфний аторвастатин (9г) та кристалічної форми І аторвастатин (1г) збовтують при 40°С у суміші води (170мл) та метанолу (ЗОмл) загалом 17 годин Щоб отримати кристалічної форми І аторвастатин (9,7г), суміш відфільтровують, промивають водою та просушують при 70°С під зменшеним тиском Приклад 2 Кисла кальцієва сіль [R-(R*,R*)]-2-(4фторофеніл)-[3,5-дипдрокси-5-(1-метилетил)-3феніл-4-[(феніламшо) карбоніл]-1 Н-пірол-1гептанової кислоти (Форма II аторвастатину) Суміш аморфної та кристалічної форми І аторвастатину (100г) суспендують у суміші метанолу (1200мл) та води (800мл) та збовтують протягом З діб Щоб отримати кристалічну форму II аторвастатину, отриманий матеріал відфільтровують, просушують при 70°С під зменшеним тиском Приклад З Кисла кальцієва сіль [R-(R*,R*)]-2-(4фторофеніл)-[3,5-дипдрокси-5-(1-метилетил)-3феніл-4-[(феніламшо)карбоніл]-1Н-пірол-1гептанової кислоти (форма VI аторвастатину) Суміш (2R-тpaнc)-5-(4-фтopoфeнlл)-2-(1метилетил)-І\І,4-дифеніл-1-[2-(тетрапдро-4пдрокси-6-оксо-2Н-піран-2-іл)етил]-1Н-пірол-3карбоксамід (лактон аторвастатину) (патент США № 5273995) (12кг), МТБЕ (50кг), метанол (30л) реагують з водним розчином гідроксиду натрію (1,83кг у 150л) при 50 - 55°С протягом ЗО - 45 хвилин, з метою утворення натрієвої солі з розкриванням циклу Після охолодження до 20 - 25°С, органічний шар відокремлюють, а водяний шар знов екстрагують МТБЕ (37кг) Органічний шар знов відокремлюють, а водний розчин натрієвої солі нагрівають до 70 - 80°С й за допомогою дис 51661 20 19 хвилин, а потім охолоджують до 50 - 55°С Потім тилювання видаляють залишки МТБЕ Потім розчин охолоджують до 60 - 70°С До цього розчину суміш відфільтровують та шламують у метанолі додають розчини напівпдрату ацетату кальцію (до 200л) при 55 - 65°С, а потім охолоджений до (1,91кг) в суміші води та метанолу (72л води + 16л 25 - 30°С і відфільтровують Щоб отримати крисметанолу) Зразу після домішування розчину ацеталічної форми IV аторвастатин (виділено біля тату кальцію суміш затравлюють з допомогою криЗкг), твердий продукт просушують при 60 - 70°С у сталічної Форми І аторвастатину (180г) Суміш вакуумі нагрівають при 65 - 75°С протягом принаймні 5 3767.50 - і 2ТЕГА Гц 0.00 "' r r q 5 ІО і r т - і і т 1-т—т—j-тч • ч - j г~г~г г [ - т - г т -І J ) 15 20 25 ЗО ФіГ 1 2ТЕТА 1500.00 - і ГЦ 0.00 10 15 ЗО Фіг 2 35 t і І г-і 40 21 22 51661 2ТЄТА 8212.50 ГЦ 0.00 I ' і ' і ' r r r ' " I 1 1 ' ! ' I ' і ' І .-y-r-p-i—|—г-, 220 200 ISO 160 140-120 100 80 60 40 20 0 -20 мільйонних часток Фіґ.4 Ч ' I Ч Ч ' I ' I Т Т ^ 240 220 200 180 160 140 120 100 80 60 40 мільйонних часток Фіг 5 j , , *—і—. 20 0 -20 23 51661 1 I ' I ' ! ' ! ' і ' I ' I ' I ' ! ("t ' і l I « 220 200 180 160 140 120 100 80 60 40 20 0 -20 мільйонних часток ФІГ.6 ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна ( 0 4 4 ) 4 5 6 - 2 0 - 90 ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)216-32-71 24
ДивитисяДодаткова інформація
Назва патенту англійськоюCrystalline forms of acid calcium salt [r-(rr)]-2-(4-fluorophenyl)-0100090000039d00000002001c00000000000500000009020000000005000000020101000000050000000102ffffff00050000002e0118000000050000000b0200000000050000000c02000240011200000026060f001a00ffffffff000010000000c0ffffffc6ffffff00010000c60100000b00000026060f000c004d61746854797065000050001c000000fb0280fe0000000000009001000000020002001053796d626f6c00774000000081040a878f49f5779849f5770100000000003000040000002d01000008000000320a600128000100000062790a00000026060f000a00ffffffff0100000000001c000000fb021000070000000000bc02000000cc0102022253797374656d000000000a000000040000000000ffffffff0100000000003000040000002d01010004000000f001000003000000000000000000000000000000,0100090000039d00000002001c00000000000500000009020000000005000000020101000000050000000102ffffff00050000002e0118000000050000000b0200000000050000000c02c00140011200000026060f001a00ffffffff000010000000c0ffffffc6ffffff00010000860100000b00000026060f000c004d61746854797065000030001c000000fb0280fe0000000000009001000000020002001053796d626f6c00774000000084040abb8f49f5779849f5770100000000003000040000002d01000008000000320a600134000100000064790a00000026060f000a00ffffffff0100000000001c000000fb021000070000000000bc02000000cc0102022253797374656d000000000a000000040000000000ffffffff0100000000003000040000002d01010004000000f001000003000000000000000000000000000000-dihydroxy-5-(l-methylethyl)-3-phenyl-4-[(phenylamino)carbonyl]-lh-pyrrole-1-heptanoic acid (atorvastatin) and a pharmaceutical composition on their base
МПК / Мітки
МПК: A61P 3/06, A61K 31/40, C07D 207/34, C07C 51/06
Мітки: форми, аторвастатин, кислоти, композиція, кристалічні, кальцієвої, фармацевтична, кислої, r-(rr)]-2-(4-фторфеніл)-b, солі, основі, d-дигідрокси-5-(1-метилетил)-3-феніл-4-[(феніламіно)карбоніл]-1н-пірол-1-гептанової
Код посилання
<a href="https://ua.patents.su/12-51661-kristalichni-formi-i-ii-iv-kislo-kalciehvo-soli-r-rr-2-4-ftorfenil-b-d-digidroksi-5-1-metiletil-3-fenil-4-fenilaminokarbonil-1n-pirol-1-geptanovo-kisloti-atorvastatin-ta-farmacevti.html" target="_blank" rel="follow" title="База патентів України">Кристалічні форми i, ii, iv кислої кальцієвої солі [r-(rr)]-2-(4-фторфеніл)-b, d-дигідрокси-5-(1-метилетил)-3-феніл-4-[(феніламіно)карбоніл]-1н-пірол-1-гептанової кислоти (аторвастатин) та фармацевтична композиція на їх основі</a>
Попередній патент: Спосіб перевантажування твердої речовини, що має високий вміст вологи (варіанти), та поплавець для його здійснення
Наступний патент: Спосіб нанесення припою для паяння або зварювання-паяння деталей металевих конструкцій
Випадковий патент: Спосіб запобігання випиранню підошви гірничих виробок