Полівалентна імуногенна композиція, спосіб її виготовлення, застосування у виробництві лікарського засобу для лікування або попередження захворювань, викликаних інфекцією haemophilus influenzae типу в та спос
Номер патенту: 76952
Опубліковано: 16.10.2006
Автори: Бутрьо Доменік, Капьо Карін, Лемуен Доменік, Демон П'єр Мішель, Полман Ян
Формула / Реферат
1. Полівалентна імуногенна композиція, яка містить кон'югат білка-носія і капсульного полісахариду або олігосахариду Н. influenzae типу В і в якій кількість полісахаридів або олігосахаридів складає 1-5 мкг, а як білок-носій використані ТТ, DT або CRM197, причому зазначена композиція додатково містить 2 або більше ніж два додаткових бактеріальних полісахариди або олігосахариди, здатних забезпечити захист для організму хазяїна від інфікування бактеріями, від яких вони отримані, і причому кон'югат капсульного полісахариду або олігосахариду Н. influenzae типу В та всі додаткові полісахариди або олігосахариди не адсорбовані на ад'ювантній солі алюмінію.
2. Полівалентна імуногенна композиція за п. 1, в якій кон'югат капсульного полісахариду або олігосахариду Н. influenzae типу В та всі додаткові полісахариди або олігосахариди не адсорбовані на ад'юванті.
3. Полівалентна імуногенна композиція за п. 1 або 2, де додаткові бактеріальні полісахариди або олігосахариди кон'юговані з білком-носієм.
4. Полівалентна імуногенна композиція за п. 1, де 2 або більше додаткових бактеріальних полісахаридів або олігосахаридів включають капсульний полісахарид або олігосахарид N. meningitidis серогрупи А, кон'юговані з білком-носієм, та капсульний полісахарид або олігосахарид N. meningitidis серогрупи С, кон'юговані з білком-носієм.
5. Полівалентна імуногенна композиція за п. 1, де 2 або більше додаткових бактеріальних полісахаридів або олігосахаридів включають капсульний полісахарид або олігосахарид N. meningitidis серогрупи С, кон'юговані з білком-носієм, а також капсульний полісахарид або олігосахарид N. meningitidis серогрупи Y, кон'юговані з білком-носієм.
6. Полівалентна імуногенна композиція, що складається з кон'югату білка-носія та капсульного полісахариду Н. influenzae типу В і в якій кількість полісахариду складає 1-5 мкг, а як білок-носій використані ТТ, DT або CRM197, де зазначена композиція додатково складається з 1 або більше додаткових бактеріальних полісахаридів, здатних забезпечити захист для організму хазяїна від інфікування бактеріями, від яких вони отримані, де 1 або більше додаткових бактеріальних полісахаридів включають капсульний полісахарид N. meningitidis серогрупи С, кон'югований з ТТ, DT або CRM197 як білком-носієм, і де кон'югат капсульного полісахариду Н. influenzae типу В та всі полісахариди не адсорбовані на ад'юванті.
7. Полівалентна імуногенна композиція за будь-яким з пп. 1 - 3, що складається з більше ніж 7 додаткових бактеріальних полісахаридів або олігосахаридів.
8. Полівалентна імуногенна композиція за п. 7, де додаткові бактеріальні полісахариди або олігосахариди є пневмококовими капсульними полісахаридами або олігосахаридами.
9. Полівалентна імуногенна композиція за пп. 1-8, де додаткові бактеріальні полісахариди або олігосахариди вибрані з групи, що складається з капсульного полісахариду N. meningitidis серогрупи А, капсульного полісахариду N. meningitidis серогрупи С, капсульного полісахариду N. meningitidis серогрупи Y, капсульного полісахариду N. meningitidis серогрупи W, капсульного полісахариду Streptococcus pneumoniae серотипу 1, капсульного полісахариду S. pneumoniae серотипу 2, капсульного полісахариду S. pneumoniae серотипу 3, капсульного полісахариду S. pneumoniae серотипу 4, капсульного полісахариду S. pneumoniae серотипу 5, капсульного полісахариду S. pneumoniae серотипу 6А, капсульного полісахариду S. pneumoniae серотипу 6В, капсульного полісахариду S. pneumoniae серотипу 7F, капсульного полісахариду S. pneumoniae серотипу 8, капсульного полісахариду S. pneumoniae серотипу 9N, капсульного полісахариду S. pneumoniae серотипу 9V, капсульного полісахариду S. pneumoniae серотипу 10А, капсульного полісахариду S. pneumoniae серотипу 11А, капсульного полісахариду S. pneumoniae серотипу 12F, капсульного полісахариду S. pneumoniae серотипу 14, капсульного полісахариду S. pneumoniae серотипу 15В, капсульного полісахариду S. pneumoniae серотипа 17F, капсульного полісахариду S. pneumoniae серотипу 18С, капсульного полісахариду S. pneumoniae серотипу 19А, капсульного полісахариду S. pneumoniae серотипу 19F, капсульного полісахариду S. pneumoniae серотипу 20, капсульного полісахариду S. pneumoniae серотипу 22F, капсульного полісахариду S. pneumoniae серотипу 23F, капсульного полісахариду S. pneumoniae серотипу 33F, капсульного полісахариду групи І стрептокока групи В, капсульного полісахариду групи II стрептокока групи В, капсульного полісахариду групи III стрептокока групи В, капсульного полісахариду групи IV стрептокока групи В, капсульного полісахариду групи V стрептокока групи В, капсульного полісахариду Staphylococcus aureus типу 5, капсульного полісахариду Staphylococcus aureus типу 8, Vi полісахариду з Salmonella typhi, ліпополісахариду (LPS) N. meningitidis, LPS M. catarrhalis і LPS H. Influenzae або їх олігосахаридів.
10. Полівалентна імуногенна композиція за пп. 1-9, де використовуваний (і) білок-носій (білки-носії) вибраний(і) з групи, яка містить: правцевий анатоксин, дифтерійний анатоксин, CRM197, рекомбінантний дифтерійний токсин, ОМРС з N. meningitidis, пневмолізин з S. pneumoniae і білок D з H. influenzae.
11. Полівалентна імуногенна композиція за пп. 1-9, де як білок-носій використовується правцевий анатоксин.
12. Полівалентна імуногенна композиція за п. 10, де капсульний полісахарид або олігосахарид H. influenzae типу В та додаткові полісахариди або олігосахариди не кон'юговані з тим самим носієм.
13. Полівалентна імуногенна композиція за п. 12, де капсульний полісахарид або олігосахарид Н. influenzae типу В та додаткові полісахариди або олігосахариди не всі кон'юговані з CRM197.
14. Полівалентна імуногенна композиція за пп. 1-13, де для синтезу кон’югатів полісахаридів або олігосахаридів з білком-носієм використовується СDAP.
15. Полівалентна імуногенна композиція за пп. 1-14, що містить 0,1-10 мкг кожного полісахариду або олігосахариду.
16. Застосування полівалентної імуногенної композиції за пп. 1-15 у виробництві лікарського засобу для лікування або попередження захворювань, викликаних інфекцією Haemophilus influenzae типу В.
17. Спосіб імунізації людини-хазяїна від захворювання, викликаного Haemophilus influenzae типу В, при якому в організм хазяїна вводять імунопротективну дозу полівалентної імуногенної композиції за пп. 1-15.
18. Полівалентна імуногенна композиція за пп. 1-15 для застосування в лікарському засобі.
19. Спосіб виготовлення полівалентної імуногенної композиції за пп. 1-15, який включає стадію, на якій змішують разом індивідуальні компоненти.
Текст
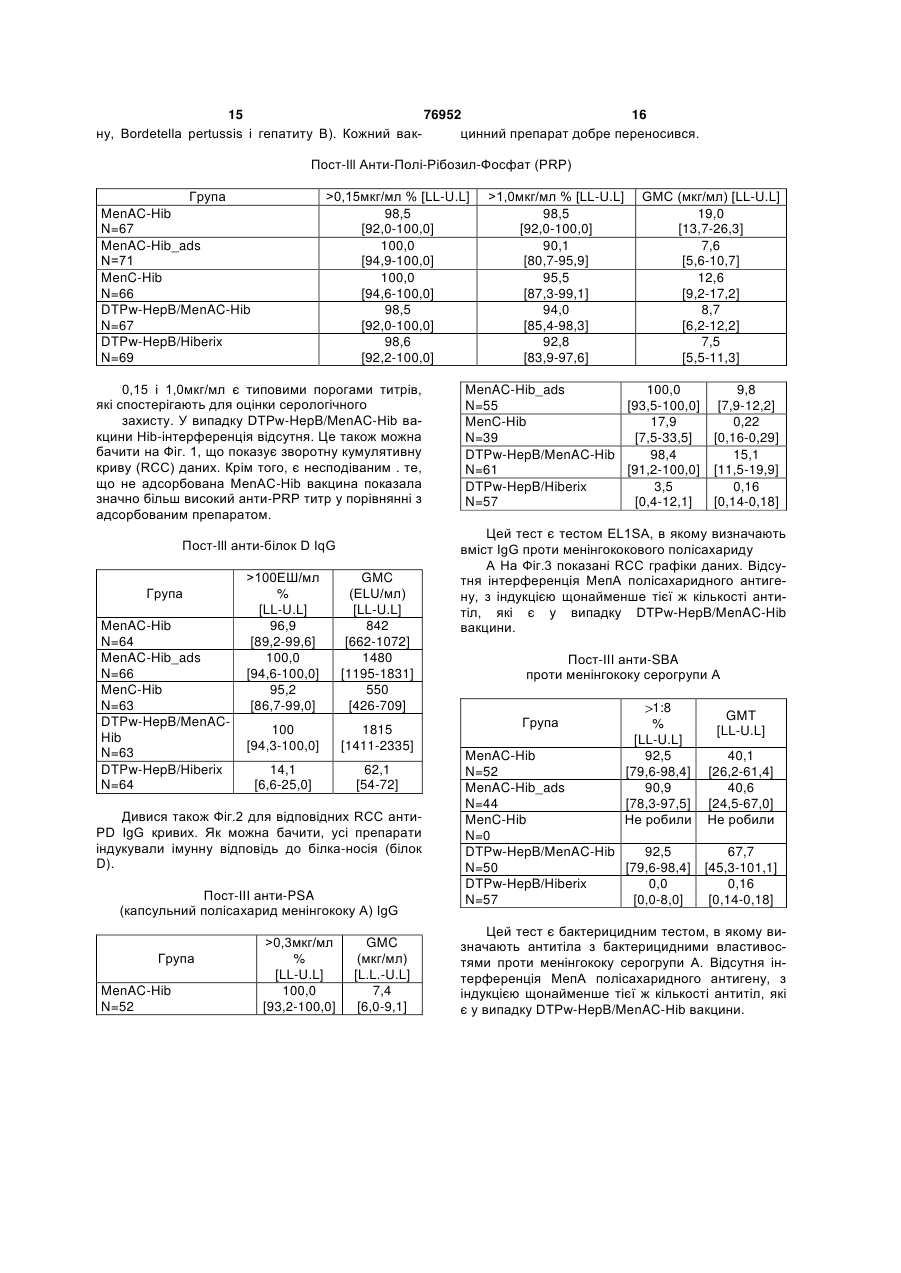
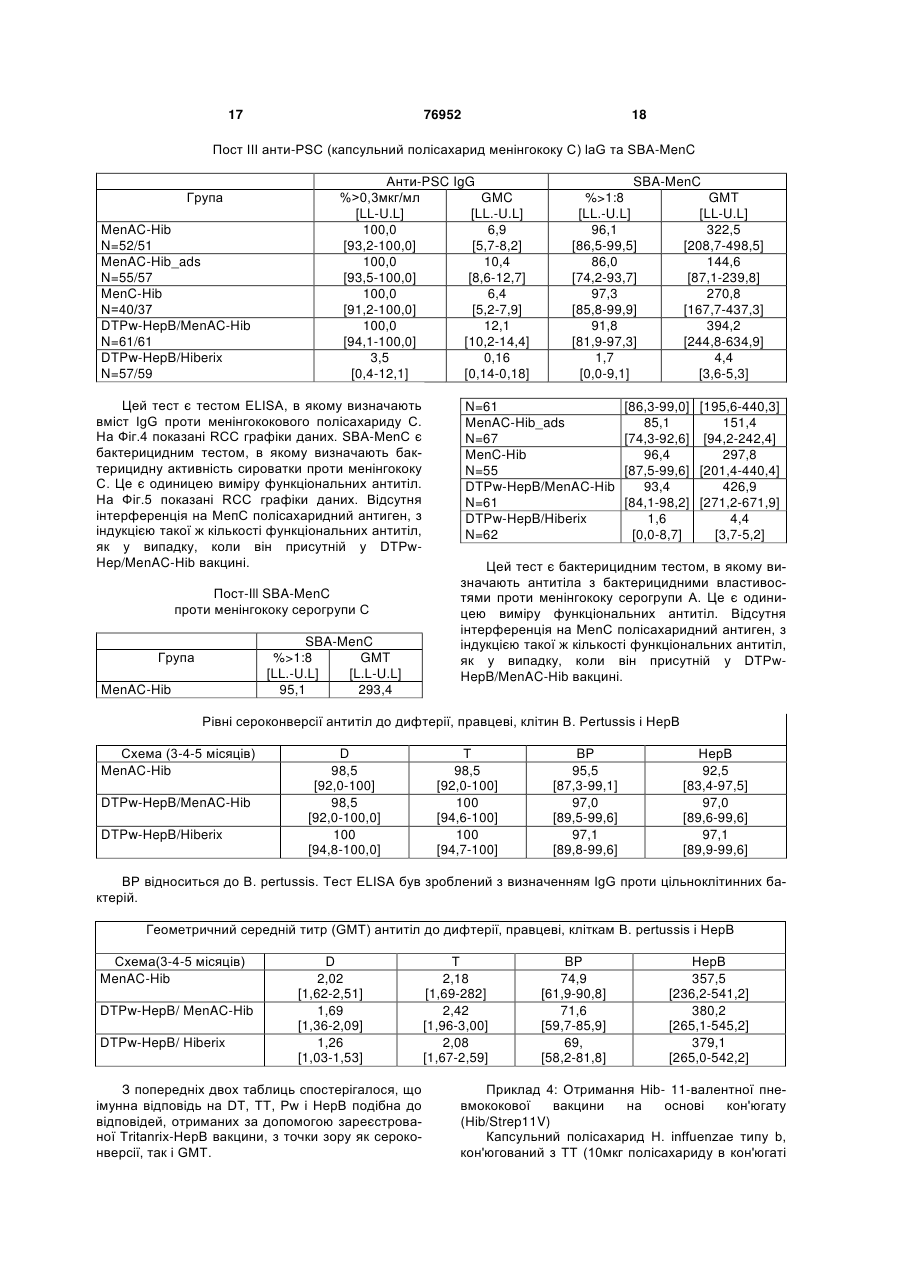
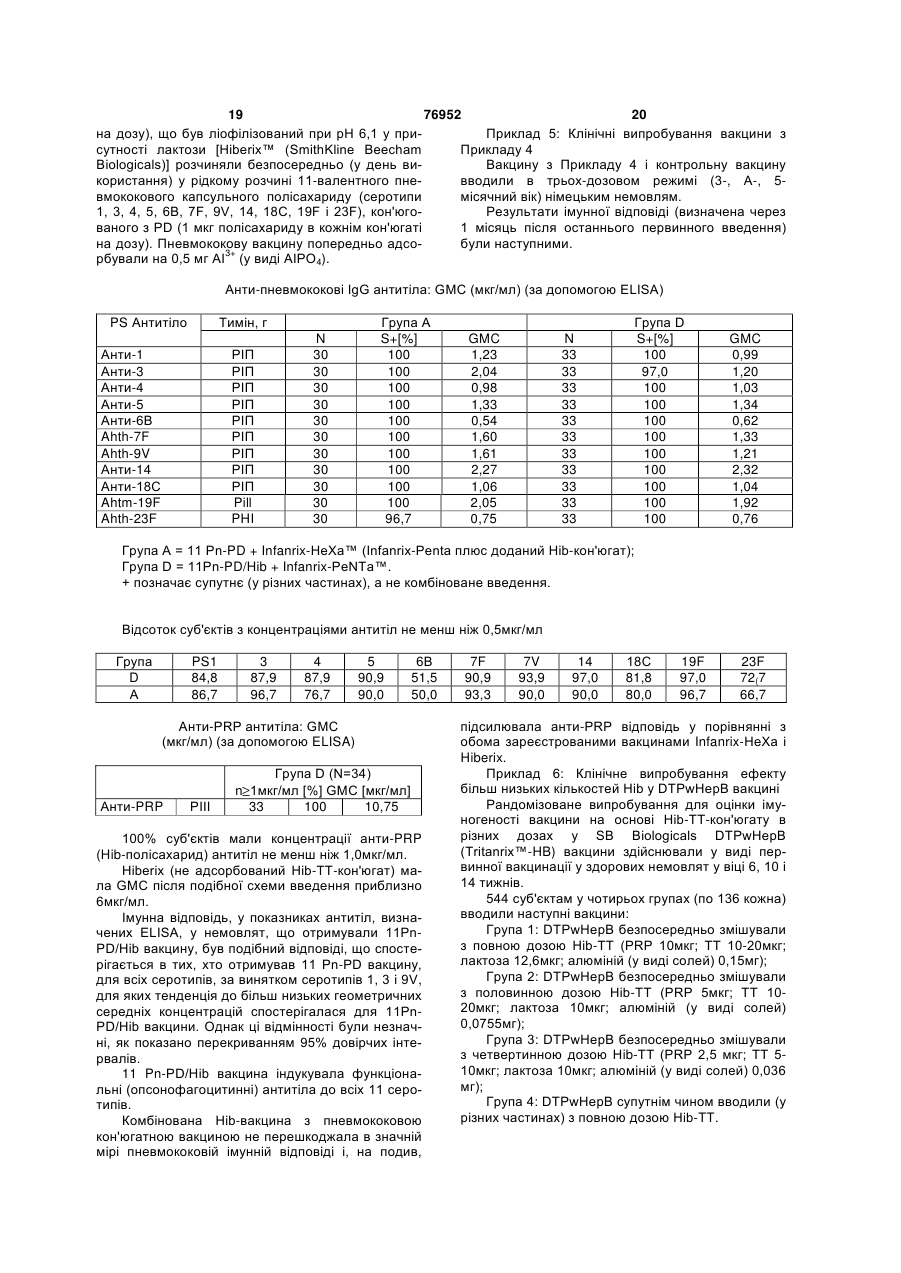
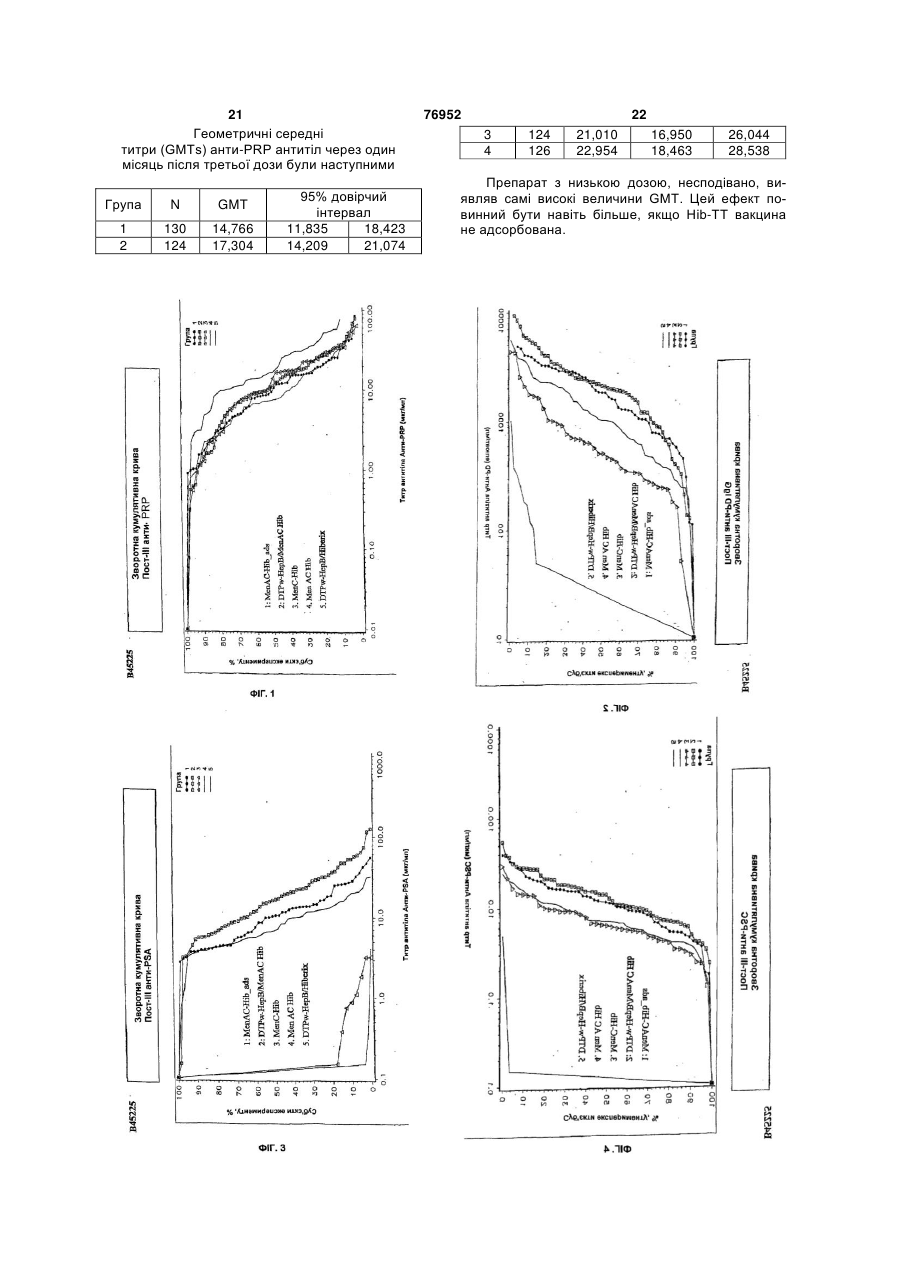
1. Полівалентна імуногенна композиція, яка містить кон'югат білка-носія і капсульного полісахариду або олігосахариду Н. influenzae типу В і в якій кількість полісахаридів або олігосахаридів складає 1-5мкг, а як білок-носій використані ТТ, DT або CRM197, причому зазначена композиція додатково містить 2 або більше ніж два додаткових бактеріальних полісахариди або олігосахариди, здатних забезпечити захист для організму хазяїна від інфікування бактеріями, від яких вони отримані, і причому кон'югат капсульного полісахариду або олігосахариду Н. influenzae типу В та всі додаткові полісахариди або олігосахариди не адсорбовані на ад'ювантній солі алюмінію. 2. Полівалентна імуногенна композиція за п.1, в якій кон'югат капсульного полісахариду або олігосахариду Н. influenzae типу В та всі додаткові полісахариди або олігосахариди не адсорбовані на ад'юванті. 3. Полівалентна імуногенна композиція за п.1 або 2, де додаткові бактеріальні полісахариди або олігосахариди кон'юговані з білком-носієм. 4. Полівалентна імуногенна композиція за п.1, де 2 UA (21) 20021210397 (22) 27.06.2001 (24) 16.10.2006 (86) PCT/EP01/07288, 27.06.2001 (31) 0015999.6 (32) 29.06.2000 (33) GB (31) 0108363.3 (32) 03.04.2001 (33) GB (31) 0108364.1 (32) 03.04.2001 (33) GB (46) 16.10.2006, Бюл. № 10, 2006 р. (72) Бутрьо Доменік , BE, Капьо Карін , BE, Демон П'єр Мішель, BE, Лемуен Доменік , BE, Полман Ян , BE (73) ГЛАКСОСМІТКЛАЙН БАЙОЛОДЖІКАЛЗ С.А., BE (56) Paradiso P.R. et al.: "Glycoconjugate vaccines: future combinations", Dev. Biol. Stand. Basel, Karger, 1996, vol. 87, pp. 269-275. CHOO S. et al.: "Immunogenicity and reactogenicity of a pneumococcal conjugate vaccine administered combined with a Haemophilus influenzae type b conjugate vaccine in United Kingdom infants", Pediatr Infect Dis. J., 2000, vol. 19, pages 854-862. Granoff D. Et al.: "MF59 adjuvant enhances antibody responses of infant baboons immunized with haemophilus influenzae type b and Neisseria meningitides group C oligosaccharide-CRM197 conjugate vaccine", Infection and Immunology, May 1997, p. 1710-1715. Zepp F.et al.:" Evidence for induction of polisaccharide specific B-cell-memory in the 1st year of life: plain haemophillus influenzae type b - PRP (Hib) boosters children primed with a tetanusconjugate Hib-DTPa-HBV combined vaccine", Eur. J. Pediatr, 1997, v.156, p. 18-24. WO A1 9942130, 26.08.1999. 2 (19) 1 3 76952 4 або більше додаткових бактеріальних полісахарилісахариду S. pneumoniae серотипу 15В, капсульдів або олігосахаридів включають капсульний поного полісахариду S. pneumoniae серотипа 17F, лісахарид або олігосахарид N. meningitidis серогкапсульного полісахариду S. pneumoniae серотипу рупи А, кон'юговані з білком-носієм, та капсульний 18С, капсульного полісахариду S. pneumoniae сеполісахарид або олігосахарид N. meningitidis сероротипу 19А, капсульного полісахариду S. групи С, кон'юговані з білком-носієм. pneumoniae серотипу 19F, капсульного полісаха5. Полівалентна імуногенна композиція за п.1, де 2 риду S. pneumoniae серотипу 20, капсульного поабо більше додаткових бактеріальних полісахарилісахариду S. pneumoniae серотипу 22F, капсульдів або олігосахаридів включають капсульний поного полісахариду S. pneumoniae серотипу 23F, лісахарид або олігосахарид N. meningitidis серогкапсульного полісахариду S. pneumoniae серотипу рупи С, кон'юговані з білком-носієм, а також 33F, капсульного полісахариду групи І стрептокока капсульний полісахарид або олігосахарид N. групи В, капсульного полісахариду групи II стрепmeningitidis серогрупи Y, кон'юговані з білкомтокока групи В, капсульного полісахариду групи III носієм. стрептокока групи В, капсульного полісахариду 6. Полівалентна імуногенна композиція, що склагрупи IV стрептокока групи В, капсульного полісадається з кон'югату білка-носія та капсульного похариду групи V стрептокока групи В, капсульного лісахариду Н. influenzae типу В і в якій кількість полісахариду Staphylococcus aureus типу 5, капсуполісахариду складає 1-5 мкг, а як білок-носій вильного полісахариду Staphylococcus aureus типу 8, користані ТТ, DT або CRM197, де зазначена комVi полісахариду з Salmonella typhi, ліпополісахарипозиція додатково складається з 1 або більше доду (LPS) N. meningitidis, LPS M. catarrhalis і LPS H. даткових бактеріальних полісахаридів, здатних Influenzae або їх олігосахаридів. забезпечити захист для організму хазяїна від інфі10. Полівалентна імуногенна композиція за пп.1-9, кування бактеріями, від яких вони отримані, де 1 де використовуваний (і) білок-носій (білки-носії) або більше додаткових бактеріальних полісахаривибраний(і) з групи, яка містить: правцевий анатодів включають капсульний полісахарид N. ксин, дифтерійний анатоксин, CRM197, рекомбінаmeningitidis серогрупи С, кон'югований з ТТ, DT нтний дифтерійний токсин, ОМРС з N. meningitidis, або CRM197 як білком-носієм, і де кон'югат капсупневмолізин з S. pneumoniae і білок D з H. льного полісахариду Н. influenzae типу В та всі influenzae. полісахариди не адсорбовані на ад'юванті. 11. Полівалентна імуногенна композиція за пп.1-9, 7. Полівалентна імуногенна композиція за будьде як білок-носій використовується правцевий яким з пп.1-3, що складається з більше ніж 7 додаанатоксин. ткових бактеріальних полісахаридів або олігосаха12. Полівалентна імуногенна композиція за п.10, ридів. де капсульний полісахарид або олігосахарид H. 8. Полівалентна імуногенна композиція за п.7, де influenzae типу В та додаткові полісахариди або додаткові бактеріальні полісахариди або олігосаолігосахариди не кон'юговані з тим самим носієм. хариди є пневмококовими капсульними полісаха13. Полівалентна імуногенна композиція за п.12, ридами або олігосахаридами. де капсульний полісахарид або олігосахарид Н. 9. Полівалентна імуногенна композиція за пп.1-8, influenzae типу В та додаткові полісахариди або де додаткові бактеріальні полісахариди або олігоолігосахариди не всі кон'юговані з CRM197. сахариди вибрані з групи, що складається з капсу14. Полівалентна імуногенна композиція за пп.1льного полісахариду N. meningitidis серогрупи А, 13, де для синтезу кон’югатів полісахаридів або капсульного полісахариду N. meningitidis серогруолігосахаридів з білком-носієм використовується пи С, капсульного полісахариду N. meningitidis сеСDAP. рогрупи Y, капсульного полісахариду N. 15. Полівалентна імуногенна композиція за пп.1meningitidis серогрупи W, капсульного полісахари14, що містить 0,1-10мкг кожного полісахариду або ду Streptococcus pneumoniae серотипу 1, капсульолігосахариду. ного полісахариду S. pneumoniae серотипу 2, кап16. Застосування полівалентної імуногенної комсульного полісахариду S. pneumoniae серотипу 3, позиції за пп.1-15 у виробництві лікарського засобу капсульного полісахариду S. pneumoniae серотипу для лікування або попередження захворювань, 4, капсульного полісахариду S. pneumoniae серовикликаних інфекцією Haemophilus influenzae типу типу 5, капсульного полісахариду S. pneumoniae В. серотипу 6А, капсульного полісахариду S. 17. Спосіб імунізації людини-хазяїна від захворюpneumoniae серотипу 6В, капсульного полісахаривання, викликаного Haemophilus influenzae типу В, ду S. pneumoniae серотипу 7F, капсульного поліпри якому в організм хазяїна вводять імунопротексахариду S. pneumoniae серотипу 8, капсульного тивну дозу полівалентної імуногенної композиції за полісахариду S. pneumoniae серотипу 9N, капсупп.1-15. льного полісахариду S. pneumoniae серотипу 9V, 18. Полівалентна імуногенна композиція за пп.1-15 капсульного полісахариду S. pneumoniae серотипу для застосування в лікарському засобі. 10А, капсульного полісахариду S. pneumoniae се19. Спосіб виготовлення полівалентної імуногенної ротипу 11А, капсульного полісахариду S. композиції за пп.1-15, який включає стадію, на якій pneumoniae серотипу 12F, капсульного полісахазмішують разом індивідуальні компоненти. риду S. pneumoniae серотипу 14, капсульного по 5 Винахід стосується нових комбінованих вакцинних препаратів. Комбіновані вакцини (які забезпечують захист від декількох патогенів) дуже бажані для зменшення числа імунізацій, необхідних для забезпечення захисту від декількох патогенів, для зниження витрат на введення і для збільшення прийняття і ступенів охоплення. Добре відоме явище антигенної конкуренції (або інтерференції) ускладнює розробку багатокомпонентних вакцин. Антигенна інтерференція відноситься до спостереження того факту, що введення декількох антигенів часто призводить до ослабленої відповіді на деякі антигени в порівнянні з імунною відповіддю, яка спостерігається, коли такі антигени вводять окремо. Відомі комбіновані вакцини, які можуть запобігати Bordetella pertussis, Clostridium tetani, Corynebacterium diphtheriae і, можливо, вірус гепатиту В та/або Haemophiius influenzae типу b [див., наприклад, WO 93/24148 і WO 97/00697]. Винахід стосується виробництва найбільш активних на сьогодні полівалентних вакцин, введення яких може запобігати або лікувати інфекцію Bordetella pertussis, Clostridium tetani, Corynebacterium diphtheriae, вірусу гепатиту В, Haemophiius influenzae і N. meningitidis, і переважно також вірусу гепатиту А та/або вірусу поліомієліту, причому компоненти вакцини не перешкоджають у значній мірі імунологічній дії кожного з компонентів вакцини. Відповідно, в одному аспекті винаходу запропонована полівалентна імуногенна композиція для забезпечення захисту в організмі хазяїна проти захворювання, викликаного Bordetella pertussis, Clostridium tetani, Corynebacterium diphtheriae, вірусом гепатиту В, Haemophiius influenzae і N. meningitidis, яка містить: (а) або вбиту цільноклітинну Bordetella pertussis (Pw), або два або більш ніж два безкліткових коклюшних компоненти (Ра) (переважно, перше), (б) правцевий анатоксин (ТТ), (в) дифтерійний анатоксин (DT), (г) поверхневий антиген вірусу гепатиту В (НерВ), (д) кон'югат білка-носія та капсульного полісахариду Н. influenzae типу В (Hib), і (є) один або більш ніж один кон'югат білканосія і капсульного полісахариду бактерії, вибраної з групи N. meningitidis типу A (Men А) і N. meningitidis типу С (Men С). Способи отримання правцевого анатоксину (ТТ) добре відомі в даній галузі техніки. Наприклад, ТТ переважно отримують шляхом очищення токсину з культури Clostridium tetani з наступною хімічною детоксифікацією, однак альтернативно отримують шляхом очищення рекомбінантного, або генетично детоксифікованого аналога токсину [наприклад, як описано в ЕР 209281]. "Правцевий анатоксин" також містить імуногенні фрагменти повнорозмірного білку [наприклад Фрагмент С див. ЕР 478602]. Способи отримання дифтерійного анатоксину (DT) також добре відомі в даній галузі техніки. Наприклад, DT переважно отримують шляхом очи 76952 6 щення токсину з культури Corynebacterium diphtheriae з наступною хімічною детоксифікацією, однак альтернативно отримують шляхом очищення рекомбінантного, або генетично детоксифікованого аналога токсину [наприклад, CRM197 або інші мутанти, як описано в US 4709017, US 5843711, US 5601827 і US 5917017]. Безклітинні коклюшні компоненти (Ра) добре відомі в даній галузі техніки. Приклади містять коклюшний анатоксин (РТ), філаментний гемаглютинін (FHA), пертактин (PRN) та аглютиногени 2 і 3. Ці антигени є частково очищеними або високоочищеними. Переважно 2 або більш ніж два безклітинних коклюшних компоненти використовують у вакцині. Найбільш переважно 2, 3, 4 або всі 5 з вищевказаних прикладів безклітинних коклюшних компонентів включені у вакцину. Найпереважніше включені РТ, FHA і PRN. PT можна отримувати різними способами, наприклад шляхом очищення токсину з культури В. pertussis з наступною хімічною детоксифікацією, або, альтернативно, шляхом очищення генетично детоксифікованого аналога РТ (наприклад, як описано в US 5085862). Способи отримання вбитої цільноклітинної Bordetella pertussis (Pw), яка придатна для даного винаходу, розкриті в [WO 93/24148], що є придатними способами приготування лікарського засобу для отримання DT-TT-Pw-HepB і DT-TT-PA-HepB вакцин. Кон'югати бактеріального капсульного полісахариду можуть містити будь-який пептид-, поліпептид- або білок-носій, який містить щонайменше один Т-хелперний епітоп.Переважно, використовуваний(і) білок-носій(білки-носії) вибраний(і) із групи, яка містить: правцевий анатоксин, дифтерійний анатоксин, CRM197, рекомбінантний дифтерійний токсин [як описаний у будь-якому з US 4709017, WO 93/25210, WO 95/33481 або WO 00/48638], пневмолізин (переважно хімічно детоксифікований, або детоксифікований мутант) з S, рпеитопіае, ОМРС з N. meningitidis і білок D (PD) з Н. influenzae (ЕР 594610). Внаслідок відомого ефекту індукованого носієм супресії, є переважним, якщо в кожній з композицій за винаходом полісахаридні антигени, які містяться в ній ("п" антигени), кон'юговані з більш ніж одним носієм. Таким чином, (п-1) полісахаридів може бути нанесене (окремо) на один тип носія і 1 - на інший носій, або (n-2) - на один і 2 - на два інших носія, і так далі. Наприклад, у вакцині, що містить 4 бактеріальних полісахаридних кон'югата, 1, 2 або всі чотири можуть бути кон'юговані з різними носіями). Білок D, однак, переважно використовують як носій в композиціях за винаходом, тому що він може бути використаний для різних (2, 3, 4 або більш) полісахаридів у композиції без помітного ефекту індукованої носієм супресії. Найпереважніше, Hib присутній у виді ТТ-кон'югату, a MenA, MenC, MenY і MenW є або ТТ-, або PD-кон'югати. Білок D також є корисним носієм, оскільки він забезпечує додатковий антиген, який може забезпечити захист від Н. influenzae. Полісахарид може бути зв'язаний з білкомносієм за допомогою будь-якого відомого способу [наприклад, Likhite, патент США 4372945 і Armor 7 76952 8 etal., патент США 4474757]. Переважно здійснюпохідні полісахаридів, або поліфосфазени. ють CDAP-кон'югацію [WO 95/08348]. Ад'ювант може також бути вибраний таким чиПри CDAP ціануючий реагент 1-ціаноном, щоб бути кращим індуктором відповіді Τh1диметиламінопіридинію тетрафторборат (CDAP) типу, для того щоб сприяти розвиткові клітиннопереважно використовують для синтезу полісахаопосередкованій гілці імунної відповіді. рид-білкових кон'югатів. Реакцію ціанування можна 4 Високі рівні цитокінів Тh1-типу сприяють інздійснювати у відносно м'яких умовах, щоб уникдукції клітинно-опосередкованих імунних відповінути гідролізу полісахаридів, чуттєвих до лугу. Цей дей на даний антиген, у той час як високі рівні цисинтез дає можливість прямого зв'язування з білтокінів Тп2-типу сприяють індукції гуморальних ком-носієм. імунних відповідей на даний антиген. Вищевказана імуногенна композиція може доПридатні системи ад'ювантів, які стимулюють датково містити один, два, три, чотири, п'ять, шість переважно ТМ-відповідь, містять монофосфорил або сім компонентів, вибраних з наступного списліпід А або його похідне, зокрема 3-дез-Оку: полісахарид N. meningitidis типу Υ [Men Υ] (пеацильований монофосфорил ліпід А, і комбінацію реважно кон'югований), полісахарид N. meningitidis монофосфорил ліпіду А, переважно 3-дез-Отипу W [Men W] (переважно кон'югований), Vi поліацильованого монофосфорил ліпіду А (3D-MPL), сахарид Salmonella typhi, везикули зовнішньої разом із сіллю алюмінію. Посилена система місмембрани N. meningitidis (переважно серотипу В), тить комбінацію монофосфорил ліпіду А та похідодин або більш ніж один білок (поверхневоного сапоніну, зокрема комбінацію QS21 і 3D-MPL, експонований) зовнішньої мембрани N. як розкрито в WO 94/00153, або менш реактогенну meningitidis (переважно серотипу В), вбитий атекомпозицію, де QS21 блокований холестерином, нуйований вірус гепатиту А (НерА - переважно як розкрито в WO 96/33739. Особливо сильнодіюпродукт, відомий як «Havrix™» [SmithKline чий ад'ювантний препарат, який містить QS21, 3DBeecham Biologicals]), та інактивований вірус поліMPL і токоферол в емульсії типу «олія у воді», омієліту (IPV - який переважно містить типи 1, 2 і описаний у WO 95/17210. Вакцина може додатково 3, які є стандартними в технології вакцин, найпемістити сапонін, більш переважно QS21. Препарат реважніше вакцина Солка від поліомієліту), без може також містити емульсію типу «олія у воді» та суттєвих проблем інтерференції для будь-якого з токоферол (WO 95/17210). Неметиловані CpGантигенів даної композиції. вмісні олігонуклеотиди (WO 96/02555) також є Імуногенні композиції за винаходом переважно кращими індукторами Th1-відповіді і є придатними готують у виді вакцини для введення in vivo в ордля застосування за винаходом. ганізм хазяїна, так що індивідуальні компоненти Солі алюмінію є кращими ад'ювантами у викомпозиції включені в препарат таким чином, щоб щевказаних імуногенних композиціях. Зокрема, імуногенність індивідуальних компонентів не була НерВ слід переважно адсорбувати на фосфаті суттєво знижена іншими індивідуальними компоалюмінію перед змішуванням з іншими компоненнентами цієї композиції. «Не суттєво знижена» тами. Для того щоб зменшити рівні ад'юванту (зокозначає, що при імунізації отримують титр антитіл рема солей алюмінію) у композиціях за винахопроти кожного компонента, який складає більш ніж дом, полісахаридні кон'югати можуть бути без 60%, переважно більш ніж 70%, більш переважно ад'ювантів. більш ніж 80%, ще більш переважно більш ніж За винаходом також запропонований спосіб 90%, і найпереважніше більш ніж 95-100% титру, приготування вакцинного препарату, який містить отриманого, коли антиген вводять окремо. стадію, на якій компоненти вакцини змішують раІмуногенні композиції за винаходом переважно зом з фармацевтично прийнятним ексципіентом. готують у виді вакцини для введення in vivo в орОсобливо краща DTPw композиція за винахоганізм хазяїна, так що вони забезпечують титр дом містить: ТТ, DT, Pw, Hep (переважно адсорбоантитіл, який перевищує критерій для серологічнований на фосфаті алюмінію), Ніb (переважно кон'го захисту для кожного антигенного компонента югований з ТТ та/або не адсорбований), МеnА для прийнятного відсотка суб'єктів людей. Це є (переважно кон'югований з білком D) і МеnС (певажливим тестом при оцінці ефективності вакцини реважно кон'югований з білком D). Переважно вав популяції. Антигени з титром зв'язаних антитіл, кцину можна поставляти в двох контейнерах, привище якого вважається, що в організмі хазяїна чому перший містить DTPw-Hep у рідкій формі, а спостерігається сероконверсія проти антигену, другий містить Hib-MenA-MenC у ліофілізованій добре відомі, і такі титри опубліковані організаціяформі. Вміст контейнерів можна змішувати безпоми, такими як Всесвітня Організація Охорони здосередньо перед введенням в організм хазяїна у ров'я (ВООЗ). Переважно у більш ніж 80% статисвиді однієї ін'єкції. тично значимої вибірки суб'єктів спостерігається У додатковому аспекті винаходу запропоновасероконверсія, більш переважно у більш ніж 90%, на імуногенна композиція або вакцина, як вона ще більш переважно у більш ніж 93%, і найпереописана тут, для застосування як ліки. важніше у 96-100%. У ще одному додатковому аспекті даного виІмуногенна композиція за винаходом переважнаходу запропоноване використання імуногенних но містить ад'юванти. Підходящі ад'юванти містять композицій за винаходом у виробництві ліків для сіль алюмінію, таку як гель гідроксиду алюмінію лікування або попередження захворювань, викли(галуни) або фосфат алюмінію, але можуть також каних інфекцією Bordetella pertussis, Clostridtum бути сіллю кальцію, заліза або цинку, або можуть tetani, Corynebacterium diphtheriae, вірусу гепатиту бути нерозчинною суспензію ацильованого тироВ, Haemophilus influenzae і N. meningitidis. зину або ацильованих цукрів, катіонні або аніонні Крім того, також запропонований спосіб імуні 9 76952 10 зації людини-хазяїна від захворювання, викликаDTPw вакциною. ного Bordetella pertussis, Cfostridium tetani, Ще одне спостереження, яке зробили автори Corynebacterium diphtheriae, вірусом гепатиту В, винаходу, є той факт, що комбіновані вакцини, що Haemophilus infiuenzae і N. meningitidis, при якому містять Hib-кон'югат, викликають значно більш в організм хазяїна вводять імунопротективну дозу високі титри анти-Hib антитіл в організмі хазяїна (у імуногенної композиції за винаходом. порівнянні з моновалентною вакциною на основі Вакцинні препарати за винаходом можна занеадсорбованого Hib-кон'югату), якщо Hib-кон'югат стосовувати для захисту або лікування ссавця, вводять у виді вакцини, яка додатково містить 1, підданого інфекції, за допомогою введення зазнаале особливо 2 або більш ніж два додаткових бакченої вакцини системним шляхом введення або теріальних полісахаридів, і Hib-полісахарид (і печерез слизові оболонки. Такі введення можуть реважно всі полісахариди) вакцини не адсорбовані містити ін'єкцію за допомогою внутрішньом'язовона ад'юванті (зокрема солях алюмінію). го, внутрішньочеревного, інтрадермального або Додатковий, незалежний аспект даного винапідшкірного шляхів введення; або за допомогою ходу, таким чином, полягає в тім, що запропоновведення через слизові оболонки в пероральвано полівалентну імуногенну композицію, яка ний/травний, дихальний, сечостатевий тракт. містить кон'югат білка-носія і капсульного полісаКількість антигену в кожній вакцинній дозі вибхариду Н. influenzae типу В (Hib), причому зазнарано як кількість, яка індукує імунопротективну чена композиція додатково містить 1, але особливідповідь без значних несприятливих побічних во 2 або більш ніж два додаткових бактеріальних ефектів при типових вакцинах. полісахаридів (переважно більш ніж 2, 3, 4, 5, 6, 7, Така кількість буде варіювати в залежності від 8, 9, 10, 11, 12 або 13), здатних забезпечити затого, який конкретно імуноген використовують і як хист для організму хазяїна проти інфікування баквін представлений. Звичайно очікується, що кожна теріями, від яких вони отримані, І причому Hibдоза буде містити 0,1-100мкг полісахариду, переполісахарид (і переважно жоден із зазначених поважно 0,1-50мкг, переважно 0,1-10мкг, з яких 1лісахаридів) у композиції не адсорбовані на ад'ю5мкг є найбільш кращим діапазоном. вантній солі алюмінію. Найпереважніше, щоб Вміст білкових антигенів у вакцині буде звиад'ювантна сіль алюмінію не була присутня в комчайно знаходитися в діапазоні 1-100мкг, переважпозиції. но 5-50мкг, найбільш типово в діапазоні 5-25мкг. Під антигеном, що не «адсорбований на ад'юПісля первинної вакцинації суб'єкти можуть вантній солі алюмінію» мають на увазі, що ніяка отримувати одну або декілька бустерних імунізацій особлива або спеціально призначена стадія адсоз достатніми проміжками часу. рбції для антигену на додатковій ад'ювантній солі Отримання вакцини в цілому описано в алюмінію, не входить у процес приготування даної Vaccine Design [«The subunit and adjuvant композиції. approach» (eds Powell M.F. & Newman M.J. (1995) Hib може бути кон'югований з будь-яким носіPlenum Press New York). Інкапсуляція у ліпосоми єм, який може забезпечити щонайменше один Тописана Fullerton, патент США 4235877]. хелперний епітоп (приклади яких описані вище), і Цікаво, що автори винаходу крім того знайшпереважно правцевим анатоксином. ли, що для вакцин, які містять ТТ, DT, Pw і Hib, Переважно, додаткові бактеріальні полісаханесподіваним є той факт, що по суті більш низька риди також кон'юговані з білком-носієм (приклади доза Hib може бути використана в комбінованій яких описані вище). У конкретних втіленнях капсувакцині (у порівнянні зі стандартною дозою, що льний полісахарид Н. influenzae т\лпу В та додатскладає 10мкг на 0,5мл дози) для отримання щокові полісахариди не кон'юговані з тим самим носінайменше еквівалентних титрів антитіл від капсуєм (Hib і жоден з додаткових полісахаридів не льного полісахаридного антигену Н. influenzae тивикористовують спільно той самий носій), особлипу b. Це протилежно тому, що можна було во коли носієм є CRM197. У кращих втіленнях приочікувати. кладів щонайменше один з полісахаридів даної Відповідно, у додатковому втіленні даного викомпозиції кон'югований з білком D, однак це не находу запропонована полівалентна імуногенна суттєво для здійснення винаходу - у дійсності, ні композиція, яка містить вбиту цільноклітинну Hib, ні будь-який інший полісахарид, не обов'язкоBordetella pertussis (Pw), правцевий анатоксин во повинний бути кон'югований з білком D. (ТТ), дифтерійний анатоксин (DT) і кон'югат білкаУ конкретному втіленні винаходу, тільки Hib і носія і капсульного полісахариду Н. influenzae типу додаткові бактеріальні полісахариди (та їх кон'югаВ (Hib - переважно кон'югований з ТТ, DT або ти) є антигенами, які присутні у композиції. CRM197), де кількість кон'югату на 0,5мл дози від Кількість полісахариду, що здатна забезпечити маси вакцини складає 1-8мкг, а Імуногенність захист для організму хазяїна (ефективна кількість) кон'югату є еквівалентною або - поліпшеною в поможе легко визначити фахівець у даній галузі техрівнянні з такими композиціями, що містять великі ніки. Звичайно очікується, що кожна доза буде кількості кон'югату. Можливо, поверхневий антиген містити 0,1-100мкг полісахариду, переважно 0,1гепатиту В також може бути включений. 50мкг, переважно 0,1-10мкг, з яких 1-5мкг є найКраща кількість кон'югату на 0,5мл дози від більш кращим діапазоном. Hib-кон'югат переважно маси вакцини складає менш ніж 10мкг (полісахає присутнім у кількості 3-16мкг (полісахариду в риду в кон'югаті), більш переважно 1-7 або 2-6мкг, кон'югаті), більш переважно 4-12мкг, і найпереваі найпереважніше приблизно 2.5, 3, 4 або 5мкг. жніше 5-10мкг. У кращому втіленні сумарно не Найпереважніше Hib-кон'югат не адсорбований на менш ніж 2мкг додаткового полісахариду (особлиад'ювантній солі алюмінію перед змішуванням з во, коли він кон'югований) присутні у композиції на 11 76952 12 0,5 мл дози, і, переважно, включено не менш ніж 3, тить 11 капсульних полісахаридів, отриманих від 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 17, 20, 25, 30, серотипів 1, 3, 4, 5, 6В, 7F, 9V, 14, 18С, 19F і 23F 35, 40, 45 або 50мкг. Переважно не більш ніж 100 (переважно кон'югованих). У кращому втіленні мкг додаткового полісахариду включено на 0,5мл даного винаходу щонайменше 13 полісахаридних дози. антигенів (переважно кон'югованих) включені, хоча Переважно додаткові бактеріальні полісахадодаткові полісахаридні антигени, наприклад 23риди вибрані з групи, що складає з: капсульного валентні (такі як серотипи 1, 2, 3, 4, 5, 6В, 7F, 8, полісахариду N. meningitidis серогрупи A (Men А), 9N, 9V, 10А, 11А, 12F, 14, 15В, 17F, 18С, 19А, 19F, капсульного полісахариду N. meningitidis серогру20, 22F, 23F і 33F) також включені у винахід. пи С (Men С), капсульного полісахариду N. Для вакцинації людей похилого віку (наприmeningitidis серогрупи Υ (Men Y), капсульного поліклад для попередження пневмонії) краще включисахариду N. meningitidis серогрупи W (Men W), ти серотипи 8 і 12F (і найпереважніше 15 і 22 такапсульного полісахариду групи І стрептокока грукож) у кращу 11-валентну антигенну композицію, пи В, капсульного полісахариду групи II стрептокоописану вище, з утворенням 13/15-валентної вакка групи В, капсульного полісахариду групи IIІ цини, тоді як для немовлят або дітей раннього віку стрептокока групи В, капсульного полісахариду (коли велике значення має отит середнього вуха) групи IV стрептокока групи В, капсульного полісасеротипи 6А та 19А переважно включені з отрихариду групи V стрептокока групи В, капсульного манням 13-валентної вакцини. полісахариду Staphyiococcus aureus типу 5, капсуПневмококові полісахариди можуть бути адсольного полісахариду Staphyiococcus aureus типу 8, рбовані або можуть не бути адсорбовані на ад'юVi полісахариду з Salmonella typhi, ліпополісахаривантних солях алюмінію. ду (LPS) N. meningitidis, LPS M. catarrhalis і LPS H. Hib (переважно ліофілізований) і пневмококові inffuenzae. Під LPS розуміють або нативний ліпополісахариди (переважно в рідкій формі) можна полісахарид (або ліпоолігосахарид), або ліпополізмішувати безпосередньо перед введенням в орсахарид, де ділянка ліпіду А детоксифікована ганізм хазяїна в одному введенні/ін'єкції. За допобудь-яким з більшості відомих способів [див. намогою такого препарату можливо, при імунізації, приклад, WO 97/18837 або WO 98/33923], або отримати титри антитіл проти Hib капсульного побудь-яку молекулу, що містить О-полісахарид, лісахариду понад 100% титру, отриманого, коли отриманий із зазначеного LPS. Під LPS N Hib-кон'югат вводять окремо. У кращих втіленнях meningitidis мають на увазі один або більш ніж ніякого (значного) несприятливого ефекту не виниодин з 12 відомих імунотипів (L1, L2, L3, L4, L5, L6, кає по відношенню до пневмококових полісахариL7, L8, L9, L10, L11 або L12). дних кон'югатів (як захисної ефективності) у комбіОсобливо кращими комбінаціями є композиції, нації, у порівнянні з їхнім введенням окремо. Це які містять: 1) кон'югований Hib, кон'югований можна оцінити в одиницях виміру пост-первинних МеnА і кон'югований МеnС; 2) кон'югований Hib, геометричних середніх концентрацій (GMC) антикон'югований МеnУ і кон'югований МеnС; і 3) кон'тіла проти полісахариду через 1 місяць після югований Hib і кон'югований МеnС. Кількість PS у останньої праймінг-дози (праймінг-дози є первинкожнім з вищевказаних кон'югатів може складати 5 ними введеннями - звичайно 3-у перший рік житабо 10мкг кожного на 0,5мл дози для людини. Мотя). GMC (у мкг/мл) для вакцини за даним винахожливо, вищевказані композиції можуть також місдом повинна бути переважно вище 55% (більш тити везикули зовнішніх мембран N. meningitidis переважно вище 60, 70, 80 або 90%) від GMC, косеротипу В, або один або більш ніж один білок ли пневмококові полісахариди вводять без Ніb(поверхностно-экспонированный) зовнішньої мемкон'югату. Іншим зазначенням на те, що ніякого брани N. meningitidis серотипа В, або один або несприятливого ефекту не виникає, є те, що % більш ніж один LPS (як він визначений вище) N. суб'єктів з концентраціями антитіла не менш ніж meningitidis для створення загальної вакцини про0,5мкг/мл відрізняється не більш, ніж на 10% (пети менінгіту. Переважно МеnА, МеnС і MenY є або реважно менш ніж 9, 7, 5, 3 або 1%), при порівнянТТ-, або PD-кон'югати. ні 1-місячних пост-первинних введень вакцини за Додаткові бактеріальні полісахариди можуть винаходом проти вакцини без Ніb-кон'югату. також бути вибрані з будь-якого з капсульних пнеХоча вищевказане відноситься до Hib і додатвмококових полісахаридів (переважно більш ніж 7, ковим бактеріальним «полісахаридам» (краще більш переважно 11 або більш, і найпереважніше втілення), передбачено, що даний винахід може 13 або більш), таких як від серотипу: 1, 2, 3, 4, 5, бути розширений до Hib і додаткових бактеріаль6А, 6В, 7F, 8, 9N, 9V, 10А, 11 А, 12F, 14, 15В, 17F, них «олігосахаридів» (які в природі мають низьке 18С, 19А, 19F, 20, 22F, 23F або 33F. Переважно число повторюваних одиниць, або які є полісахапневмококові полісахариди кон'юговані (найпереридами, зменшені в розмірі для здійснення, але які важніше PD-кон'югати). усе ще здатні до індукції захисної імунної відповіді Наприклад, пневмококові полісахариди, отрив організмі хазяїна), які добре відомі в технології мані від щонайменше чотирьох серотипів (вклювакцин. чаючи 6В, 14, 19F і 23F, наприклад), або від щоПереважно, полівалентну імуногенну композинайменше 7 серотипів (включаючи 4, 6В, 9V, 14, цію за цим аспектом винаходу, готують у виді вак18С, 19F і 23F, наприклад) можуть бути вибрані зі цини для введення in vivo в організм хазяїна, присписку, зазначеного вище. Більш переважно, полічому індивідуальні компоненти композиції готують сахариди від більш ніж 7 серотипів включені в таким чином, щоб імуногеність індивідуальних композицію, наприклад, щонайменше 11 серотикомпонентів не була знижена іншими індивідуальпів. Наприклад, композиція в одному втіленні місними компонентами цієї композиції (див. вищевка 13 76952 14 зане визначення). Таким чином, у кращих втіленвикористанням CDAP-методики), капсульний полінях ніякого (значного) несприятливого ефекту не сахарид N. meningitidis типу С, кон'югований з білвиникає у відношенні до додаткових бактеріальних ком D, і капсульний полісахарид Н. infiuenzae типу полісахаридів (як захисної ефективності) у комбіb, кон'югований з ТТ, змішували разом у кількості 5 нації, у порівнянні з їхнім введенням окремо. мкг кожного полісахариду в кожнім кон'югаті на Переважно, полівалентну імуногенну компози0,5мл дози для людини. Значення рН доводили до цію за цим аспектом винаходу готують у виді вак6,1, і ліофілізували в присутності сахарози. цини для введення in vivo в організм хазяїна, що MenC-Hib: капсульний полісахарид N. забезпечує титр антитіл, перевищуючий критерій meningitidis типу С, кон'югований з білком D (з видля серологічного захисту для кожного антигеннокористанням CDAP-методики) і капсульний полісаго компонента для прийнятного відсотка суб'єктівхарид Н. infiuenzae типу b, кон'югований з ТТ, змілюдей (див. вищевказане визначення). шували разом у кількості 5 мкг полісахариду в коКомпозиції за даним аспектом винаходу пережнім кон'югаті на 0,5мл дози для людини. Значенважно готують у виді вакцини. Використання поліня рН доводили до 6,1, і ліофілізували в валентної імуногенної композиції за даним аспекприсутності сахарози. том винаходу у виробництві ліків для лікування 2) МеnА-МеnС-Hib з ад'ювантами або попередження захворювань, викликаних інфеКапсульний полісахарид N. meningitidis типу А, кцією Haemophiius influenzae (і переважно також кон'югований з білком D (з використанням CDAPтими організмами, від яких отримані додаткові методики), капсульний полісахарид N. meningitidis бактеріальні полісахариди), також передбачено, як типу С, кон'югований з білком D, і капсульний поліі спосіб імунізації людини-хазяїна від захворювансахарид Н. infiuenzae типу b, кон'югований з ТТ, ня, викликаного Haemophiius influenzas (і переважадсорбували кожний окремо в сольовому розчині но також тих організмів, від яких отримані додатна фосфаті алюмінію (5мкг кожного кон'югату на кові бактеріальні полісахариди), при якому в 100мкг, 100мкг і 60мкг ΑΙ , відповідно, на дозу). організм хазяїна вводять імунопротективну дозу Адсорбовані вакцини змішували разом при рН 6,1 і полівалентної імуногенної композиції за даним ліофілізували - в присутності сахарози. аспектом винаходу. Приклад 3: Клінічне випробування Також запропонований спосіб готування поліУ дослідженні MenAC-Hib 001 оцінюється імувалентної імуногенної композиції за даним аспекногенність, реактогенність і безпека, індукована том винаходу, що включає в себе стадію, на якій MenC-Hib і MenAC-Hib (адсорбованої і не адсорзмішують разом індивідуальні компоненти. Якщо бованої), виготовленими відповідно до вищевкадодаткові бактеріальні полісахариди повинні бути заного приклада, які давали немовлям у виді адсорбовані на ад'ювантній солі алюмінію, це потрьох-дозової первинної вакцинації. винно бути зроблене перед додаванням Hib до Дане дослідження є фазою II, рандомізованє препарату. Переважно надлишок ад'ювантної солі дослідження, і містило п'ять досліджуваних алюмінію не повинний бути використаний. Найпегруп.Препарати, що оцінювали, були ліофілізовареважніше Hib повинний бути доданий до додатний простий і адсорбований препарат MenАС-Hib і кового полісахариду, який містить ад'ювантний простий препарат MenC-Hib. Ці три препарати алюміній, безпосередньо до композиції, яку ввовводили немовлям у віці 3, 4 і 5 місяців у трьох дять в організм хазяїна. перших досліджуваних групах; Tritanrix-HepB™ Усі цитовані посилання і публікації включені давали відповідним чином (у виді окремої ін'єкції) тут як посилання. у цих трьох групах. Простий препарат MenAC-Hib Приклади запропоновані тільки для цілей ілютакож розводили в рідкій комбінованій дифтерійнострації і не призначені для обмеження об'єму даправцевій, цільно-клітинній коклюшній, гепатит В ного винаходу. вакцині (Tritanrix-HepB™) і вводили у виді єдиної Приклад 1: Отримання DT-TT-Pw-HepB (DTPwін'єкції немовлям у віці 3, 4 і 5 місяців у четвертій HepB) вакцини досліджуваній групі. У п'ятій групі (контроль) ввоЦе отримання здійснювали, як описано в WO дили Tritanrix-HepB™-Hib вакцину немовлям у віці 93/24148. Ця вакцина є у продажу під назвою 3, 4, 5 місяців. Дослідження було відкритим, але в Tritanrix-HepB™ (SmithKline Beecham Biologicals). двох перших групах, що отримують два різних Приклад 2: Отримання MenA-MenC-Hib препарати MenAC-Hib, було подвійним сліпим, (MenAC-Hib) вакцин також як і в двох останніх групах, які отримують 1) MenC-Hib або MenA-MenC-Hib без ад'юванTritanrix-HepB™-MenAC-Hib і Tritanrix-HepB™-Hib тів вакцини. У результаті, досліджуваними групами MenAC-Hib: капсульний полісахарид N. були: meningitidis типу А, кон'югований з білком D "(з Група А Група В Група С Група D Група Ε МепА5мкгС5мкг-Ніb5Мкг+DTPw-HepB МеnА5мкгC5мкг-Ніb5мкгадсорбована+DTPw-HepB МеnС5мкг-Ніb5мкг+DTPw-HepB DTPw-HepB/MenA5мкгC5мкг-Hib5мкг DTPw-HepB/MenA5мкгC5мкг-Hiberix Результати показали, що кожен препарат, що оцінювали, індукував гарну імунну відповідь проти кожного антигену (визначали антитіла проти мені N=80 N=80 N=80 N=80 N=80 нгококових груп А та С, Полі-Рібозил-Фосфата (капсульного полісахариду Н. influenzae типу b), дифтерійного анатоксину, правцевого t анатокси 15 76952 16 ну, Bordetella pertussis і гепатиту В). Кожний вакцинний препарат добре переносився. Пост-Ill Анти-Полі-Рібозил-Фосфат (PRP) Група MenAC-Hib N=67 MenAC-Hib_ads Ν=71 MenC-Hib N=66 DTPw-HepB/MenAC-Hib N=67 DTPw-HepB/Hiberix N=69 >0,15мкг/мл % [LL-U.L] 98,5 [92,0-100,0] 100,0 [94,9-100,0] 100,0 [94,6-100,0] 98,5 [92,0-100,0] 98,6 [92,2-100,0] 0,15 і 1,0мкг/мл є типовими порогами титрів, які спостерігають для оцінки серологічного захисту. У випадку DTPw-HepB/MenAC-Hib вакцини Hib-інтерференція відсутня. Це також можна бачити на Фіг. 1, що показує зворотну кумулятивну криву (RCC) даних. Крім того, є несподіваним . те, що не адсорбована MenAC-Hib вакцина показала значно більш високий анти-PRP титр у порівнянні з адсорбованим препаратом. Пост-Ill анти-білок D IqG Група MenAC-Hib N=64 MenAC-Hib_ads N=66 MenC-Hib N=63 DTPw-HepB/MenACHib N=63 DTPw-HepB/Hiberix N=64 >100ЕШ/мл % [LL-U.L] 96,9 [89,2-99,6] 100,0 [94,6-100,0] 95,2 [86,7-99,0] GMC (ELU/мл) [LL-U.L] 842 [662-1072] 1480 [1195-1831] 550 [426-709] 100 [94,3-100,0] 1815 [1411-2335] 14,1 [6,6-25,0] 62,1 [54-72] Дивися також Фіг.2 для відповідних RCC антиPD IgG кривих. Як можна бачити, усі препарати індукували імунну відповідь до білка-носія (білок D). Пост-ІІІ анти-PSA (капсульний полісахарид менінгококу A) IgG Група MenAC-Hib N=52 >0,3мкг/мл % [LL-U.L] 100,0 [93,2-100,0] GMC (мкг/мл) [L.L.-U.L] 7,4 [6,0-9,1] >1,0мкг/мл % [LL-U.L] 98,5 [92,0-100,0] 90,1 [80,7-95,9] 95,5 [87,3-99,1] 94,0 [85,4-98,3] 92,8 [83,9-97,6] GMC (мкг/мл) [LL-U.L] 19,0 [13,7-26,3] 7,6 [5,6-10,7] 12,6 [9,2-17,2] 8,7 [6,2-12,2] 7,5 [5,5-11,3] MenAC-Hib_ads 100,0 N=55 [93,5-100,0] MenC-Hib 17,9 N=39 [7,5-33,5] DTPw-HepB/MenAC-Hib 98,4 N=61 [91,2-100,0] DTPw-HepB/Hiberix 3,5 N=57 [0,4-12,1] 9,8 [7,9-12,2] 0,22 [0,16-0,29] 15,1 [11,5-19,9] 0,16 [0,14-0,18] Цей тест є тестом EL1SA, в якому визначають вміст IgG проти менінгококового полісахариду А На Фіг.3 показані RCC графіки даних. Відсутня інтерференція МепА полісахаридного антигену, з індукцією щонайменше тієї ж кількості антитіл, які є у випадку DTPw-HepB/MenAC-Hib вакцини. Пост-ІІІ анти-SBA проти менінгококу серогрупи А Група 1:8 % [LL-U.L] 92,5 [79,6-98,4] 90,9 [78,3-97,5] He робили MenAC-Hib N=52 MenAC-Hib_ads N=44 MenC-Hib N=0 DTPw-HepB/MenAC-Hib 92,5 N=50 [79,6-98,4] DTPw-HepB/Hiberix 0,0 N=57 [0,0-8,0] GMT [LL-U.L] 40,1 [26,2-61,4] 40,6 [24,5-67,0] He робили 67,7 [45,3-101,1] 0,16 [0,14-0,18] Цей тест є бактерицидним тестом, в якому визначають антитіла з бактерицидними властивостями проти менінгококу серогрупи А. Відсутня інтерференція МепА полісахаридного антигену, з індукцією щонайменше тієї ж кількості антитіл, які є у випадку DTPw-HepB/MenAC-Hib вакцини. 17 76952 18 Пост III анти-PSC (капсульний полісахарид менінгококу С) laG та SBA-MenC Група MenAC-Hib N=52/51 MenAC-Hib_ads N=55/57 MenC-Hib Ν=40/37 DTPw-HepB/MenAC-Hib N=61/61 DTPw-HepB/Hiberix N=57/59 Анти-PSC IgG %>0,3мкг/мл GMC [LL-U.L] [LL.-U.L] 100,0 6,9 [93,2-100,0] [5,7-8,2] 100,0 10,4 [93,5-100,0] [8,6-12,7] 100,0 6,4 [91,2-100,0] [5,2-7,9] 100,0 12,1 [94,1-100,0] [10,2-14,4] 3,5 0,16 [0,4-12,1] [0,14-0,18] Цей тест є тестом ELISA, в якому визначають вміст IgG проти менінгококового полісахариду С. На Фіг.4 показані RCC графіки даних. SBA-MenC є бактерицидним тестом, в якому визначають бактерицидну активність сироватки проти менінгококу С. Це є одиницею виміру функціональних антитіл. На Фіг.5 показані RCC графіки даних. Відсутня інтерференція на МепС полісахаридний антиген, з індукцією такої ж кількості функціональних антитіл, як у випадку, коли він присутній у DTPwHep/MenAC-Hib вакцині. Пост-Ill SBA-MenC проти менінгококу серогрупи С SBA-MenC %>1:8 GMT [LL.-U.L] [L.L-U.L] 95,1 293,4 Група MenAC-Hib SBA-MenC %>1:8 GMT [LL.-U.L] [LL-U.L] 96,1 322,5 [86,5-99,5] [208,7-498,5] 86,0 144,6 [74,2-93,7] [87,1-239,8] 97,3 270,8 [85,8-99,9] [167,7-437,3] 91,8 394,2 [81,9-97,3] [244,8-634,9] 1,7 4,4 [0,0-9,1] [3,6-5,3] N=61 MenAC-Hib_ads N=67 MenC-Hib N=55 DTPw-HepB/MenAC-Hib N=61 DTPw-HepB/Hiberix N=62 [86,3-99,0] [195,6-440,3] 85,1 151,4 [74,3-92,6] [94,2-242,4] 96,4 297,8 [87,5-99,6] [201,4-440,4] 93,4 426,9 [84,1-98,2] [271,2-671,9] 1,6 4,4 [0,0-8,7] [3,7-5,2] Цей тест є бактерицидним тестом, в якому визначають антитіла з бактерицидними властивостями проти менінгококу серогрупи А. Це є одиницею виміру функціональних антитіл. Відсутня інтерференція на МеnС полісахаридний антиген, з індукцією такої ж кількості функціональних антитіл, як у випадку, коли він присутній у DTPwHepB/MenAC-Hib вакцині. Рівні сероконверсії антитіл до дифтерії, правцеві, клітин В. Pertussis і НерВ Схема (3-4-5 місяців) MenAC-Hib DTPw-HepB/MenAC-Hib DTPw-HepB/Hiberix D 98,5 [92,0-100] 98,5 [92,0-100,0] 100 [94,8-100,0] Τ 98,5 [92,0-100] 100 [94,6-100] 100 [94,7-100] BP 95,5 [87,3-99,1] 97,0 [89,5-99,6] 97,1 [89,8-99,6] НерВ 92,5 [83,4-97,5] 97,0 [89,6-99,6] 97,1 [89,9-99,6] ВР відноситься до В. pertussis. Тест ELISA був зроблений з визначенням IgG проти цільноклітинних бактерій. Геометричний середній титр (GMT) антитіл до дифтерії, правцеві, кліткам В. pertussis і НерВ Схема(3-4-5 місяців) MenAC-Hib DTPw-HepB/ MenAC-Hib DTPw-HepB/ Hiberix D 2,02 [1,62-2,51] 1,69 [1,36-2,09] 1,26 [1,03-1,53] З попередніх двох таблиць спостерігалося, що імунна відповідь на DT, ТТ, Pw і НерВ подібна до відповідей, отриманих за допомогою зареєстрованої Tritanrix-HepB вакцини, з точки зору як сероконверсії, так і GMT. Τ 2,18 [1,69-282] 2,42 [1,96-3,00] 2,08 [1,67-2,59] BP 74,9 [61,9-90,8] 71,6 [59,7-85,9] 69, [58,2-81,8] НерВ 357,5 [236,2-541,2] 380,2 [265,1-545,2] 379,1 [265,0-542,2] Приклад 4: Отримання Hib- 11-валентної пневмококової вакцини на основі кон'югату (Hib/Strep11V) Капсульний полісахарид Н. inffuenzae типу b, кон'югований з ТТ (10мкг полісахариду в кон'югаті 19 76952 20 на дозу), що був ліофілізований при рН 6,1 у приПриклад 5: Клінічні випробування вакцини з сутності лактози [Hiberix™ (SmithKline Beecham Прикладу 4 Biologicals)] розчиняли безпосередньо (у день виВакцину з Прикладу 4 і контрольну вакцину користання) у рідкому розчині 11-валентного пневводили в трьох-дозовом режимі (3-, А-, 5вмококового капсульного полісахариду (серотипи місячний вік) німецьким немовлям. 1, 3, 4, 5, 6В, 7F, 9V, 14, 18С, 19F і 23F), кон'югоРезультати імунної відповіді (визначена через ваного з PD (1 мкг полісахариду в кожнім кон'югаті 1 місяць після останнього первинного введення) на дозу). Пневмококову вакцину попередньо адсобули наступними. рбували на 0,5 мг АІ3+ (у виді АІРО4). Анти-пневмококові IgG антитіла: GMC (мкг/мл) (за допомогою ELISA) PS Антитіло Тимін, г Анти-1 Анти-3 Анти-4 Анти-5 Анти-6В Ahth-7F Ahth-9V Анти-14 Анти-18С Ahtm-19F Ahth-23F РІП РІП РІП РІП РІП РІП РІП РІП РІП Pill PHI N 30 30 30 30 30 30 30 30 30 30 30 Група А S+[%] 100 100 100 100 100 100 100 100 100 100 96,7 GMC 1,23 2,04 0,98 1,33 0,54 1,60 1,61 2,27 1,06 2,05 0,75 N 33 33 33 33 33 33 33 33 33 33 33 Група D S+[%] 100 97,0 100 100 100 100 100 100 100 100 100 GMC 0,99 1,20 1,03 1,34 0,62 1,33 1,21 2,32 1,04 1,92 0,76 Група A = 11 Pn-PD + Infanrix-HeXa™ (Infanrix-Penta плюс доданий Hib-кон'югат); Група D = 11Pn-PD/Hib + Infanrix-PeNTa™. + позначає супутнє (у різних частинах), а не комбіноване введення. Відсоток суб'єктів з концентраціями антитіл не менш ніж 0,5мкг/мл Група D А PS1 84,8 86,7 3 87,9 96,7 4 87,9 76,7 5 90,9 90,0 6В 51,5 50,0 Анти-PRP антитіла: GMC (мкг/мл) (за допомогою ELISA) Анти-PRP РІII Група D (N=34) n 1мкг/мл [%] GMC [мкг/мл] 33 100 10,75 100% суб'єктів мали концентрації анти-PRP (Hib-полісахарид) антитіл не менш ніж 1,0мкг/мл. Hiberix (не адсорбований Hib-ТТ-кон'югат) мала GMC після подібної схеми введення приблизно 6мкг/мл. Імунна відповідь, у показниках антитіл, визначених ELISA, у немовлят, що отримували 11PnPD/Hib вакцину, був подібний відповіді, що спостерігається в тих, хто отримував 11 Pn-PD вакцину, для всіх серотипів, за винятком серотипів 1, 3 і 9V, для яких тенденція до більш низьких геометричних середніх концентрацій спостерігалася для 11PnPD/Hib вакцини. Однак ці відмінності були незначні, як показано перекриванням 95% довірчих інтервалів. 11 Pn-PD/Hib вакцина індукувала функціональні (опсонофагоцитинні) антитіла до всіх 11 серотипів. Комбінована Hib-вакцина з пневмококовою кон'югатною вакциною не перешкоджала в значній мірі пневмококовій імунній відповіді і, на подив, 7F 90,9 93,3 7V 93,9 90,0 14 97,0 90,0 18С 81,8 80,0 19F 97,0 96,7 23F 72(7 66,7 підсилювала анти-PRP відповідь у порівнянні з обома зареєстрованими вакцинами Infanrix-HeXa і Hiberix. Приклад 6: Клінічне випробування ефекту більш низьких кількостей Hib у DTPwHepB вакцині Рандомізоване випробування для оцінки імуногеності вакцини на основі Hib-ТТ-кон'югату в різних дозах у SB Biologicals DTPwHepB (Tritanrix™-HB) вакцини здійснювали у виді первинної вакцинації у здорових немовлят у віці 6, 10 і 14 тижнів. 544 суб'єктам у чотирьох групах (по 136 кожна) вводили наступні вакцини: Група 1: DTPwHepB безпосередньо змішували з повною дозою Hib-TT (PRP 10мкг; ТТ 10-20мкг; лактоза 12,6мкг; алюміній (у виді солей) 0,15мг); Група 2: DTPwHepB безпосередньо змішували з половинною дозою Hib-TT (PRP 5мкг; ТТ 1020мкг; лактоза 10мкг; алюміній (у виді солей) 0,0755мг); Група 3: DTPwHepB безпосередньо змішували з четвертинною дозою Hib-TT (PRP 2,5 мкг; ТТ 510мкг; лактоза 10мкг; алюміній (у виді солей) 0,036 мг); Група 4: DTPwHepB супутнім чином вводили (у різних частинах) з повною дозою Hib-TT. 21 Геометричні середні титри (GMTs) анти-PRP антитіл через один місяць після третьої дози були наступними Група N GMT 1 2 130 124 14,766 17,304 95% довірчий інтервал 11,835 18,423 14,209 21,074 76952 22 3 4 124 126 21,010 22,954 16,950 18,463 26,044 28,538 Препарат з низькою дозою, несподівано, виявляв самі високі величини GMT. Цей ефект повинний бути навіть більше, якщо Hib-TT вакцина не адсорбована. 23 Комп’ютерна верстка Н. Лисенко 76952 Підписне 24 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPolyvalent immunogenic composition, method for its preparation, use for manufacturing drug for treatment and prevention of diseases caused by haemophilus influenzae type b, method of immunization against infections caused by haemophilus influenzae type b
Автори англійськоюBoutriau Dominique, Capiau Carine, Desmons Pierre Michel, Lemoine Dominique, Poolman Jan
Назва патенту російськоюПоливалентная иммуногенная композиция, способ ее изготовления, применение в производстве лекарственного средства для лечения или предупреждения заболеваний, вызванных инфекцией haemophilus influenzae типа в, и способ иммунизации организма-хозяина против заболеваний, вызванных haemophilus influenzae типа в
Автори російськоюБутрьё Доменик, Капьё Карин, Демон Пьер Мишель, Лемуэн Доменик, Полман Ян
МПК / Мітки
МПК: A61K 39/116, A61K 39/385, A61K 39/295, A61P 31/00, A61K 39/102
Мітки: попередження, композиція, лікування, виробництві, спос, лікарського, спосіб, засобу, викликаних, виготовлення, haemophilus, застосування, influenzae, імуногенна, захворювань, полівалентна, типу, інфекцією
Код посилання
<a href="https://ua.patents.su/12-76952-polivalentna-imunogenna-kompoziciya-sposib-vigotovlennya-zastosuvannya-u-virobnictvi-likarskogo-zasobu-dlya-likuvannya-abo-poperedzhennya-zakhvoryuvan-viklikanikh-infekciehyu-haemo.html" target="_blank" rel="follow" title="База патентів України">Полівалентна імуногенна композиція, спосіб її виготовлення, застосування у виробництві лікарського засобу для лікування або попередження захворювань, викликаних інфекцією haemophilus influenzae типу в та спос</a>