Фармацевтична композиція на основі піранонів (варіанти)
Формула / Реферат
1. Фармацевтична композиція, яка містить менше ніж 0,5% спирту і пропіленгліколю або однієї з зазначених сполук або їх комбінації, яка містить:
(а) піранон формули I як агент, який має фармацевтичну активність
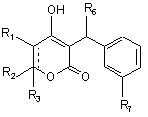 формула I,
формула I,
де R1 означає H-; R2 означає C3-C5алкіл, феніл(CH2)2-, het-SO2NH-(CH2)2-, циклопропіл(CH2)2-, F-феніл(CH2)2-, het-SO2NH-феніл- або F3C-(CH2)2-; або R1 і R2 разом означають подвійний зв'язок; R3 означає R4-(CH2)n-CH(R5)-, H3C-[O(CH2)2]2-CH2-, C3-C5алкіл, феніл(CH2)2-, het-SO2NH-(CH2)2-, (HOCH2)3C-NH-C(O)-NH-(CH2)3-, (HO2C)(H2N)CH-(CH2)2-C(O)-NH-(CH2)3-, піперазин-1-іл-C(O)-NH-(CH2)3, HO3S(CH2)2-N(CH3)-C(O)-(CH2)6-C(O)-NH-(CH2)3-, циклопропіл(CH2)2-, F-феніл-(CH2)2-, het-SO2 NH-феніл або F3C-(CH2)2-; n дорівнює 0, 1 або 2; R4 означає феніл, het, циклопропіл, H3C-[O(CH2)2]2-, het-SO2NH-, Br-, N3- або HO3S(CH2)2-N(CH3)-C(O)-(CH2)6-C(O)-NH-; R5 означає -CH2-CH3 або -CH2-циклопропіл; R6 означає циклопропіл, CH3-CH2- або трет-бутил; R7 означає -NR8SO2-het, -NR8SO2-феніл, необов'язково заміщений R9, -CH2-SO2-феніл, необов'язково заміщений R9 або -CH2-SO2-het; R8 означає –H або -CH3; R9 означає -CN, -F, -OH або -NO2; де het означає 5-, 6- або 7-членне насичене або ненасичене кільце, яке містить 1-3 гетероатоми, вибрані із групи, яка складається з азоту, кисню і сірки; і включає будь-яку біциклічну групу, у якій будь-яке з вказаних вище гетероциклічних кілець сконденсовано з бензольним кільцем або іншим гетероциклом, необов'язково заміщеним -СH3, -CN, -OH, -C(O)OC2H5, -CF3, -NH2 або -C(O)-NH2; або його фармацевтично прийнятну сіль;
(б) одну або декілька фармацевтично прийнятних поверхнево-активних речовин; і
(в) поліетиленгліколь, який має середню молекулярну масу більше 300, але менше 600, як розчинник.
2. Фармацевтична композиція за п. 1, яка містить сполуку формули I у кількості від 1 до 40% у перерахунку на масу всієї композиції.
3. Фармацевтична композиція за п. 1, яка додатково містить основний амін у кількості від 0,1 до 10% у перерахунку на масу всієї композиції.
4. Фармацевтична композиція за п. 3, де основний амін являє собою (нижч.)алкіламін, основну амінокислоту або гідроксид холіну.
5. Фармацевтична композиція за п. 4, де (нижч.)алкіламін вибирають із групи, яка включає: етаноламін, діетаноламін, триетаноламін, етилендіамін, диметиламіноетанол або трис(гідроксиметил)амінометан.
6. Фармацевтична композиція за п. 1, яка додатково містить суміш дигліцериду і моногліцеридів у кількості від 5 до 35% у перерахунку на масу всієї композиції.
7. Фармацевтична композиція за п. 6, де суміш дигліцериду і моногліцеридів являє собою Capmul MCM.
8. Фармацевтична композиція за п. 6, де дигліцерид і моногліцериди являють собою ефіри моно- або динасичених жирних кислот і гліцерину, які мають ланцюг, що містить від 8 до 10 атомів вуглецю.
9. Фармацевтична композиція за п. 1, де піранон формули I являє собою сполуку формули IV:
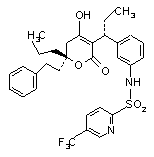 формула IV.
формула IV.
10. Фармацевтична композиція за п. 1, яка містить поліетиленгліколь у кількості від 10 до 40% у перерахунку на масу всієї композиції.
11. Фармацевтична композиція за п. 10, де поліетиленгліколь має середню молекулярну масу 400.
12. Фармацевтична композиція за п. 1, яка містить поверхнево-активну речовину присутня в кількості від 20 до 60% у перерахунку на масу всієї композиції.
13. Фармацевтична композиція за п. 12, де поверхнево-активна речовина являє собою поліоксил(40)-гідрогенізовану рицинову олію, поліоксил(35)-рицинову олію, Solutol HS-15, Tagat TO, пегліколь 6-олеат, поліоксіетиленстеарати, полоксамери, полісорбати або насичені полігліколізовані гліцериди.
14. Фармацевтична композиція за п. 13, де поліоксил(35)-гідрогенізована рицинова олія являє собою Cremophor EL або Cremophor EL-P.
15. Фармацевтична композиція за п. 1, яка містить менше ніж 0,5% спирту і пропіленгліколю або однієї з зазначених сполук або їх комбінації, яка містить:
(а) піранон формули IV
 формула IV
формула IV
у кількості від 1 до 40% у перерахунку на масу всієї композиції;
(б) ліпофільну фазу, яка становить від 5 до 35% у перерахунку на масу всієї композиції;
(в) поліетиленгліколь із середньою молекулярною масою більше 300, але менше 600, у кількості від 10 до 40% у перерахунку на масу всієї композиції;
(г) поверхнево-активну речовину, вибрану з групи, яка включає: поліоксиловану рицинову олію, поліоксіетиленгліцеринтририцинолеат і насичений полігліколізований каприловий-каприновий гліцерид, у кількості від 20 до 60% у перерахунку на масу всієї композиції; і
(д) основний амін, вибраний із групи, яка включає (нижч.)алкіламін, основну амінокислоту або гідроксид холіну, де вказаний основний амін присутній у кількості від 0,1 до 10% у перерахунку на масу всієї композиції.
16. Фармацевтична композиція за п. 15, де ліпофільна фаза являє собою суміш дигліцеридів і моногліцеридів.
17. Фармацевтична композиція за п. 15, де ліпофільна фаза являє собою суміш дигліцеридів і моногліцеридів з довжиною ланцюга 8-10 атомів вуглецю.
18. Фармацевтична композиція за п. 1, яка містить менше ніж 0,5% спирту і пропіленгліколю або однієї з зазначених сполук або їх комбінації, яка містить:
а) піранон формули IV
 формула IV
формула IV
у кількості від 1 до 40% у перерахунку на масу всієї композиції;
(б) ліпофільну фазу, вибрану із групи, яка включає: Capmul MCM, Labrafil M-1944 CS і Myglol-812 і їх суміші, де ліпофільна фаза присутня в кількості від 5 до 35% у перерахунку на масу всієї композиції;
(в) поліетиленгліколь із середньою молекулярною масою більше 300, але менше 600, у кількості від 10 до 40% у перерахунку на масу всієї композиції;
(г) поверхнево-активну речовину, вибрану з групи, яка включає: поліоксиловану рицинову олію, поліоксіетиленгліцеринтририциноолеат і насичений полігліколізований каприловий-каприновий гліцерид, у кількості від 20 до 60% у перерахунку на масу всієї композиції.
19. Композиція за п. 18, яка додатково містить основний амін, вибраний із групи, яка включає (нижч.)алкіламін, основну амінокислоту або гідроксид холіну, де вказаний основний амін присутній у кількості від 0,1 до 10% у перерахунку на масу всієї композиції.
20. Композиція за п. 18, яка знаходиться в рідкій формі, якою можна заповнювати м'які еластичні капсули.
21. Композиція за п. 18, яка знаходиться в рідкій формі, якою можна заповнювати тверді желатинові або нежелатинові капсули.
22. Фармацевтична композиція, яка містить менше ніж 0,5% спирту і пропіленгліколю або однієї з зазначених сполук або їх комбінації, яка містить:
(а) піранон формули II як агент, який має фармацевтичну активність
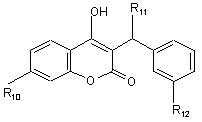 формула IІ,
формула IІ,
де R10 означає H-, CH3O- або CH3O-[(CH2)2O]3-; R11 означає циклопропіл або -CH2-CH(CH3)2; R12 означає -NR14SO2-феніл, необов'язково заміщений R15, -NR14SO2-het, -CH2-SO2-феніл, необов'язково заміщений R15, або -CH2-SO2-het; R13 означає -H, (CH2)2-CH3, -CH2-циклопропіл або -CH2-феніл; R14 означає –H або -CH3; R15 означає -CN, -F, -CH3, -COOH або -OH; het означає 5-, 6- або 7-членне насичене або ненасичене кільце, яке містить 1-3 гетероатоми, вибрані із групи, яка складається з азоту, кисню і сірки; і включає будь-яку біциклічну групу, у якій будь-яке з вказаних вище гетероциклічних кілець сконденсовано з бензольним кільцем або іншим гетероциклом, необов'язково заміщеним 1-2 замісниками з групи, яка складається з -СH3, -CN, -C(O)OC2H5 або -ОН; або його фармацевтично прийнятну сіль;
(б) одну або декілька фармацевтично прийнятних поверхнево-активних речовин; і
(в) поліетиленгліколь, який має середню молекулярну масу більше 300, але менше 600, як розчинник.
23. Фармацевтична композиція за п. 22, яка містить сполуку формули II у кількості від 1 до 40% у перерахунку на масу всієї композиції.
24. Фармацевтична композиція за п. 22, яка додатково містить основний амін у кількості від 0,1 до 10% у перерахунку на масу всієї композиції.
25. Фармацевтична композиція за п. 24, де основний амін являє собою (нижч.)алкіламін, основну амінокислоту або гідроксид холіну.
26. Фармацевтична композиція за п. 25, де (нижч.)алкіламін вибирають із групи, яка включає: етаноламін, діетаноламін, триетаноламін, етилендіамін, диметиламіноетанол або трис(гідроксиметил)амінометан.
27. Фармацевтична композиція за п. 22, яка додатково містить суміш дигліцериду і моногліцеридів у кількості від 5 до 35% у перерахунку на масу всієї композиції.
28. Фармацевтична композиція за п. 27, де суміш дигліцериду і моногліцеридів являє собою Capmul MCM.
29. Фармацевтична композиція за п. 27, де дигліцерид і моногліцериди являють собою ефіри моно- або динасичених жирних кислот і гліцерину, які мають ланцюг, що містить від 8 до 10 атомів вуглецю.
30. Фармацевтична композиція за п. 22, яка містить поліетиленгліколь у кількості від 10 до 40% у перерахунку на масу всієї композиції.
31. Фармацевтична композиція за п. 30, де поліетиленгліколь має середню молекулярну масу 400.
32. Фармацевтична композиція за п. 22, яка містить поверхнево-активну речовину в кількості від 20 до 60% у перерахунку на масу всієї композиції.
33. Фармацевтична композиція за п. 32, де поверхнево-активна речовина являє собою поліоксил(40)-гідрогенізовану рицинову олію, поліоксил(35)-рицинову олію, Solutol HS-15, Tagat TO, пегліколь 6-олеат, поліоксіетиленстеарати, полоксамери, полісорбати або насичені полігліколізовані гліцериди.
34. Фармацевтична композиція за п. 33, де поліоксил(35)-гідрогенізована рицинова олія являє собою Cremophor EL або Cremophor EL-P.
Текст
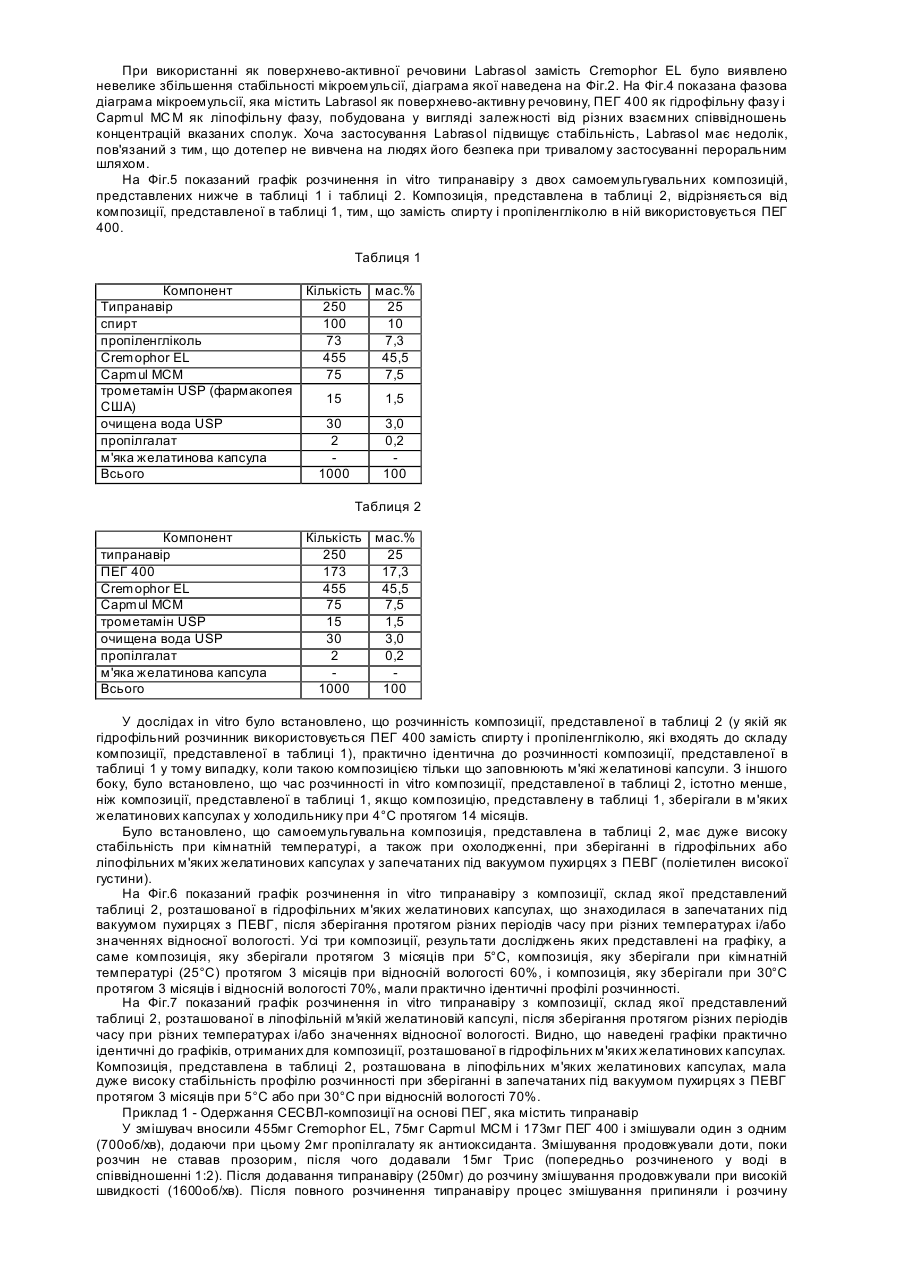
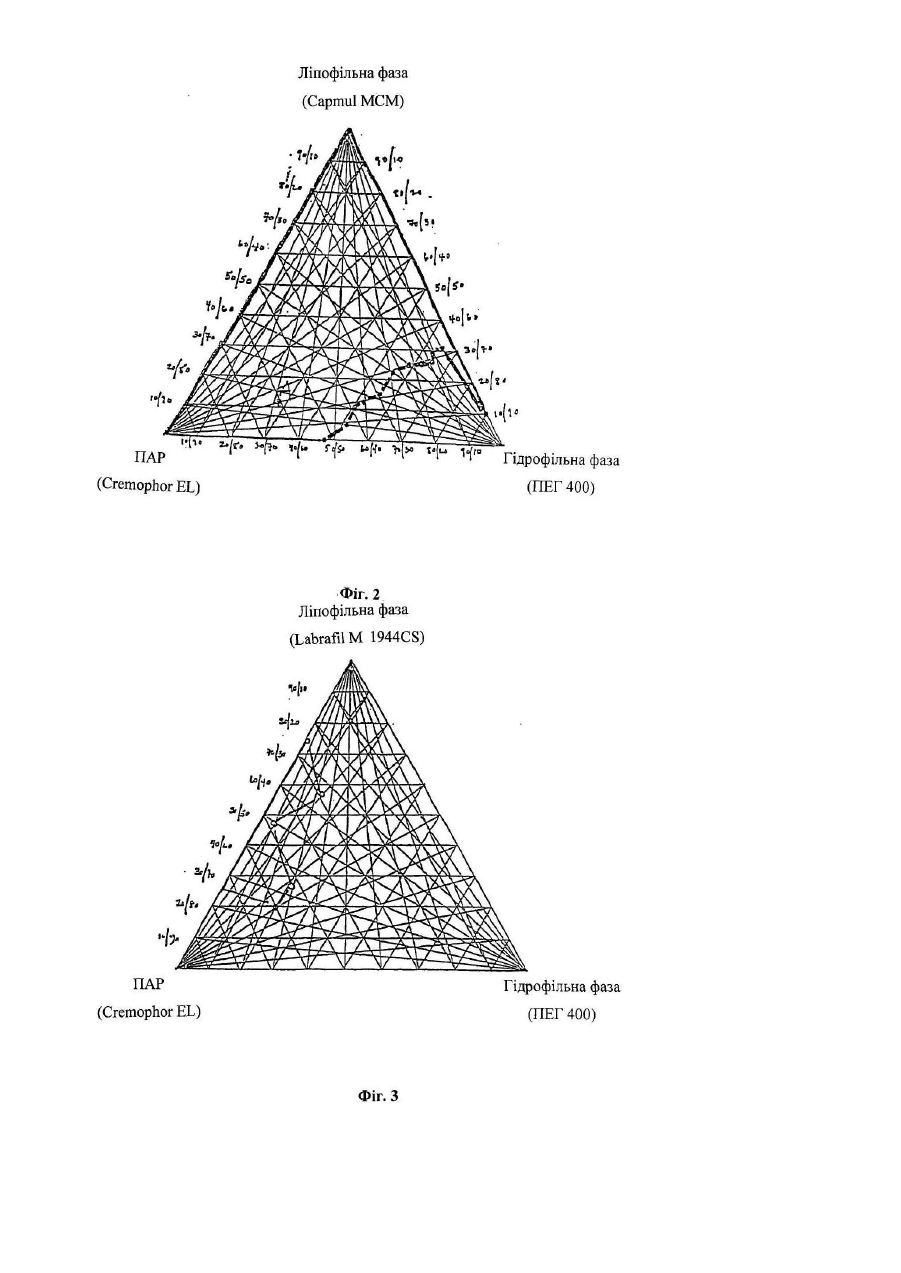
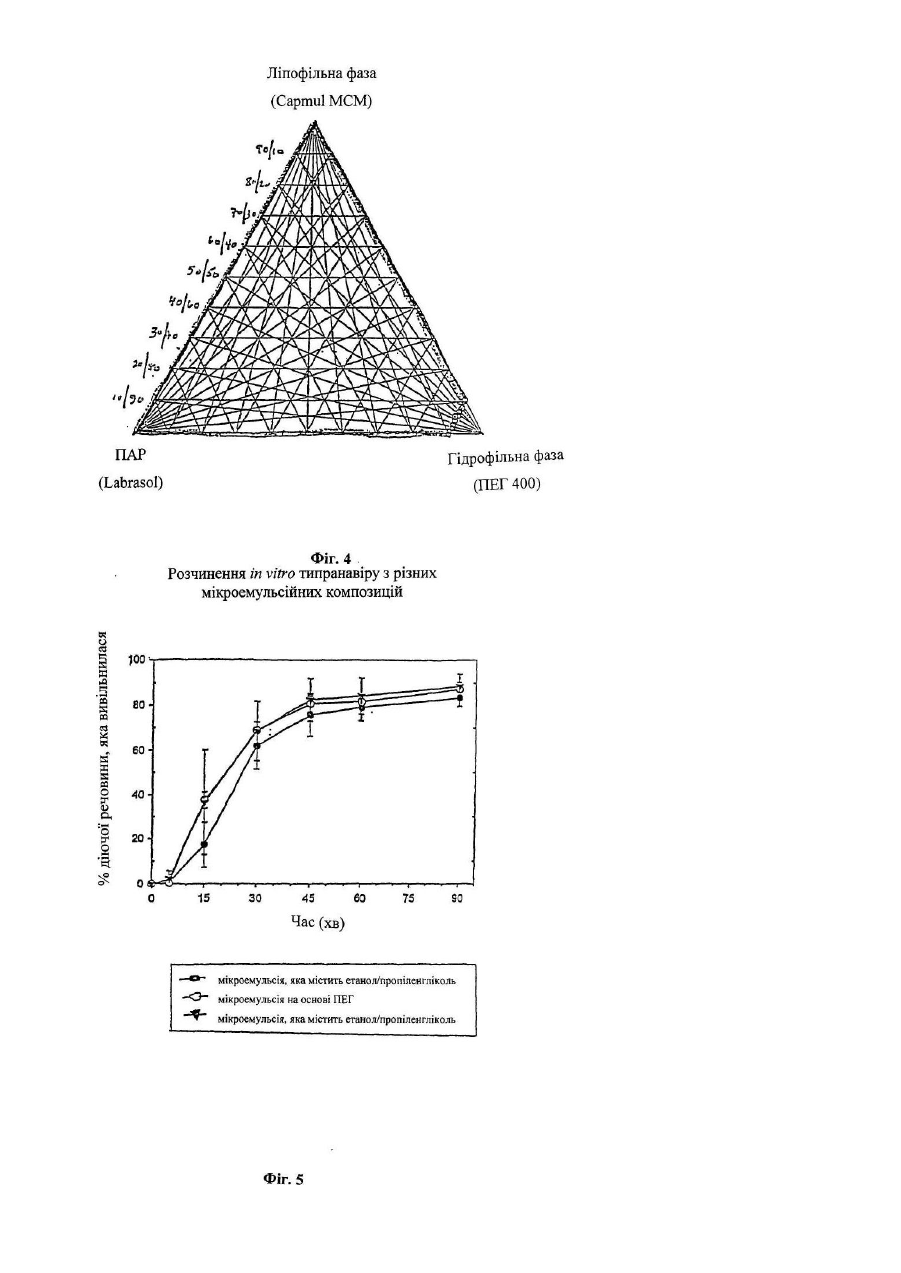
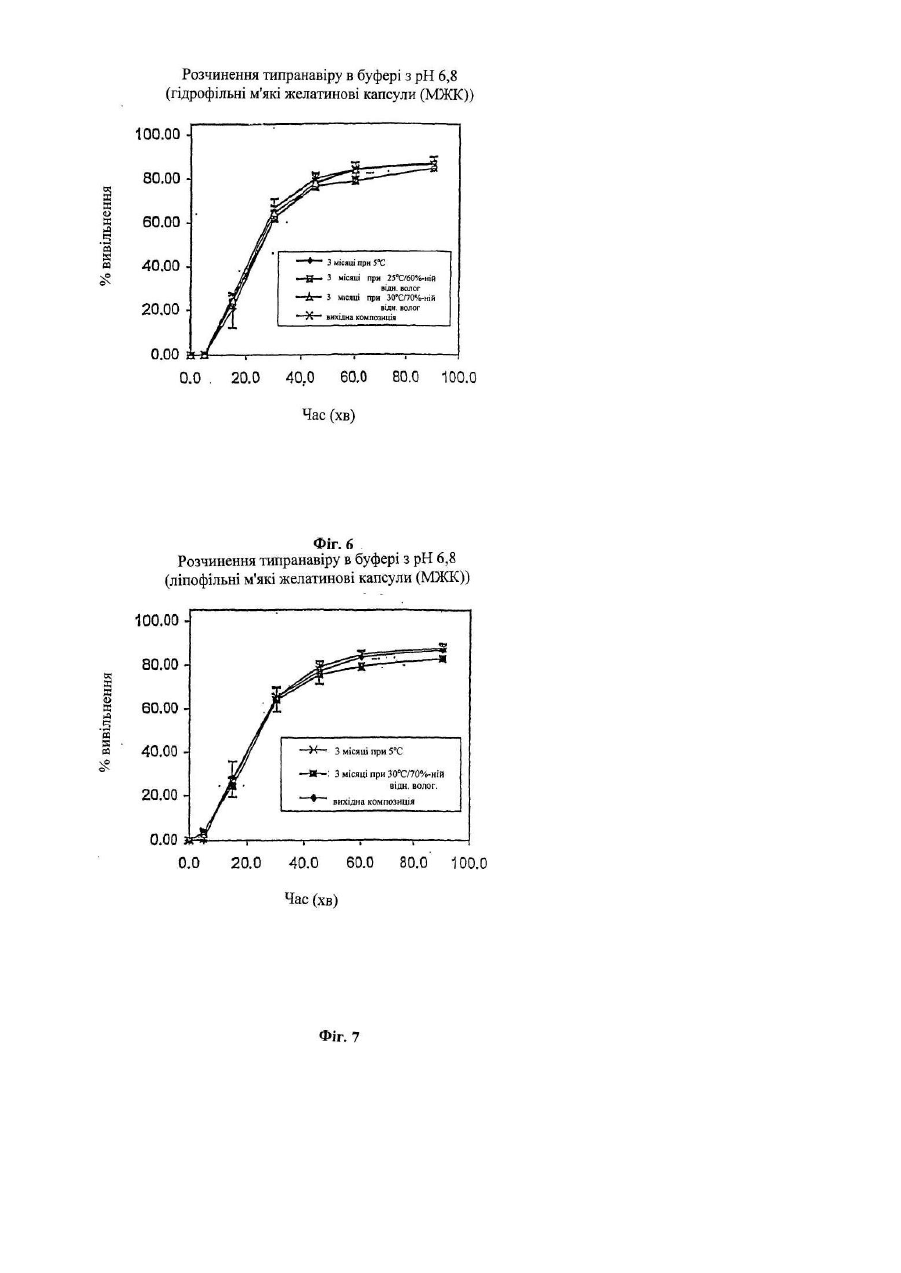
Дана заявка є частковим продовженням попередньої заявки на [патент US No. 60/244434, поданої 31 жовтня 2000р.]. Даний винахід стосується нових лікарських композицій для перорального введення, які містять 5,6дигідро-4-гідрокси-2-пірони. Зокрема, даний винахід стосується композиції у вигляді мікроемульсії, яка практично не містить спирту і пропіленгліколю, яка включає інгібітори протеази з класу 5,6-дигідро-4гідрокси-2-піронів, яка має істотно більш високу біологічну доступність і стабільність при кімнатній температурі. Після відкриття синдрому набутого імунодефіциту (СНІД) на початку 1980-х років, проблема СНІДу й зумовлених ним згубних наслідків стала предметом інтенсивного обговорення в пресі та наукових дослідженнях. Широко відомо, що цей синдром зумовлений зараженням ретровірусом, який звичайно називають вірусом імунодефіциту людини (ВІЛ). З моменту його виявлення майже двадцять років тому і дотепер проблема СНІДу перетворилася з «екзотичної» медичної проблеми, яка стосується лише незначної частини населення, у проблему, яка має першочергове значення. Передбачається, що лише в Сполучених Штатах мільйони людей є серопозитивними у відношенні ВІЛ. Першим лікарським засобом, який був дозволений 20 березня 1987р. для лікування людей, інфікованих ВІЛ, був зидовудин (АЗТ). Зидовудин або АЗТ був дозволений для лікування хворих на СНІД пацієнтів, у яких незадовго перед цим спостерігалися перші ознаки пневмокістозної каріні-пневмонії (яка викликана вірусом саrіnіі), каріні-пневмонії, або пацієнтів, інфікованих вірусом, у яких абсолютна кількість антигенних маркерів хелперних Т-лімфоцитів CD4 у периферичній крові становить менше 200/мм 3. Передбачається, що дія АЗТ обумовлена інгібуванням вірусної зворотної транскриптази, ферменту, необхідного для реплікації вірусу імунодефіциту. Протягом дуже нетривалого періоду часу кількість дозволених до застосування антиретровірусних лікарських засобів зросла від одного лікарського засобу, який має помірну активність, до дванадцяти лікарських засобів, які мають значну ефективність. Дозволені до застосування антиретровірусні лікарські засоби поділяють на три класи: нуклеозидні аналоги інгібіторів зворотної транскриптази; ненуклеозидні аналоги інгібіторів зворотної транскриптази; і інгібітори протеази. Високоефективна антиретровірусна терапія (яка називається "ВЕАРТ") практично завжди полягає в застосуванні інгібітора протеази в сполученні з одним або декількома лікарськими засобами інших класів. Клас інгібіторів протеази має високу антиретровірусну активність. Перший інгібітор протеази був дозволений до застосування Управлінням з контролю за якістю харчових продуктів, медикаментів та косметичних засобів США ("U.S. FDA") у 1995p., і слід зазначити, що цей клас лікарських засобів здійснив революцію в галузі лікування ВІЛ-інфекції. Інгібітори протеази можна охарактеризувати тим, що вони мають здатність перетворювати спочатку безнадійний (фатальний) стан захворювання в хронічне інфекційне захворювання, яке у більшому ступені піддається лікуванню. В даний час існує п'ять дозволених до застосування U.S. FD A інгібіторів протеази: ампренавір, індинавір, нелфинавір, ритонавір і саквінавір. Ретровірусні протеази являють собою ферменти, необхідні для дозрівання вірусних частинок до тих стадій, коли вони можуть здійснювати зараження. Інгібування протеаз або їх відсутність, або порушення їх функції приводить до того, що вірус втрачає здатність ефективно реплікуватися, що перешкоджає продукуванню здатних здійснювати зараження вірусних частинок. Наприклад, ретровірусня протеаза "gagпротеаза", яка, як встановлено на даний час, являє собою один з ферментів, які мають найменший розмір, (що містить лише 99 амінокислот і має гомологію з аспартилпротеазами, такими як пепсин і ренін), забезпечує правильне протеолітичне розщеплення протеїнів-попередників, які продукуються з ділянок геному, які кодують "специфічні для групи антигени" ("gag"). Передбачається, що протеаза кодується ділянкою "роl" вірусного генома, яка містить також ділянки зворотної транскриптази і интегрази. Gagпротеази розщеплюють основний капсидний протеїн р24 ВІЛ-1 і ВІЛ-2 переважно в ділянці N-кінця залишків проліну; наприклад, з утворенням двовалентних фрагментів Phe-pro, Leu-Pro або Tyr-Pro. У процесі розщеплення вивільняються структурні протеїни вірусного ядра. Таким чином, gag-протеаза необхідна для процесування попередників ВІЛ-злитого поліпептиду, що дозволяє здійснювати дозрівання поліпептидів gag і злитих поліпептидів gag/pol, включаючи капсидні і здатні до реплікації ферменти (такі, наприклад, як зворотна транскриптаза, інтеграза). У літературі описані високоефективні інгібітори протеази ВІЛ. Поняття інгібітори протеази стосується групи сполук, які інгібують аспартатпротеази вірусного походження і які можна застосовувати для профілактики або лікування вірусних інфекцій, які викликаються у ссавців ретровірусами, такими як ВІЛ. Можна вважати, що інгібітори протеази здійснили революцію в лікуванні ВІЛ-інфекції, яка полягає в тому, що спільна терапія з використанням таких сполук у сполученні з інгібіторами зворотної транскриптази вірусної ДНК-полімерази може приводити до майже повного пригнічення реплікації вірусу. Стійкість до інгібіторів протеази, очевидно, є наслідком мутацій в кодувальній ділянці ретровірусної протеази. На жаль, дані досліджень п'яти інгібіторів протеаз, дозволених до застосування на даний час у Сполучених Штата х, свідчать про те, що ці мутації можуть викликати перехресну стійкість [Swanstrom і ін., Pharmacol. Ther., 86(2): 145-170 (2000)]. Інгібітори протеази ВІЛ за своєю природою можуть являти собою пептидоміметики або бути відмінними від них. Сполуки, які мають малу подібність з пептидами або відмінні від них, як правило, мають більш високими фармакокінетичні профілі в порівнянні з їх пептидними аналогами. Пептидні інгібітори протеази ВІЛ часто мають низьку біологічну доступність і швидку екскрецію внаслідок швидкого розкладання в шлунковокишковому тракті. У цілому сполуки, відмінні від пептидів, мають більш високу біологічну доступність і меншу швидкість екскреції. Доступні на даний час інгібітори протеїнази, відмінні від пептидів, можуть мати як гідрофобні так і/або ліпофільні властивості. Внаслідок вказаних характеристик розчинності, тобто слабкої розчинності у воді, загальноприйняті тверді і рідкі фармацевтичні композиції, які містять такі інгібітори, не мають задовільної здатності до абсорбції. Серед різних факторів, які можуть впливати на біологічну доступність лікарського засобу при його пероральному введенні (які включають розчинність у воді, абсорбцію лікарського засобу в шлунково-кишковому тракті, величину дози й ефект першого проходження), як правило, розчинність у воді належить до найбільш важливих факторів. Слабка розчинність сполук у воді часто зумовлює неправильну або неповну абсорбцію і тим самим приводить до меншої реакції-відповіді, ніж потрібно. Відомо, що 5,6-дигідро-4-гідрокси-2-пірони є сильними інгібіторами ретровірусних протеаз. Внаслідок цього їх можна застосовувати для інгібування реплікації вірусу імунодефіциту людини (штамів ВІЛ-1 або ВІЛ-2 і/або Т-лімфотропних вірусів людини (HTLV-I (Т-лімфотропний вірус людини типу І) або HTLV-II (Тлімфотропний вірус людини типу І)) і для запобігання СНІДу. Однак такі інгібітори протеази, як правило, мають дуже слабку розчинність у воді. Наприклад, типранавір, який представляє собою 5,6-дигідро-4гідрокси-2-піронсульфонамід у формі вільної кислоти, характеризується дуже слабкою розчинністю у воді, що становить приблизно 10мкг/мл при рН від приблизно 6 до приблизно 7. Для досягнення терапевтичного рівня ліків потрібно приймати дозу, яка складається приблизно з 15 капсул, які містять динатрієву сіль (4,5г), двічі на день. Спроби виявити інші солі таких сполук у твердих формах, які мають істотно більш високу розчинність у воді, не мали успіху. Композиції солей таких сполук, як правило, характеризуються тенденцією до осадження вихідної вільної кислоти в шлунково-кишковому тракті. Було здійснено багато спроб збільшити біологічну доступність непептидних інгібіторів протеази в цілому і зокрема інгібіторів пептидази з класу 5,6-дигідро-4-гідрокси-2-піронів. У даній галузі техніки існує необхідність у розробці поліпшених пероральних композицій інгібіторів протеази ВІЛ, які мають прийнятні профілі біологічної доступності при пероральному введенні, стабільності і побічних дій. Беручи до уваги слабку розчинність багатьох непептидних інгібіторів протеази у вільній формі й у формі солі, було докладено багато зусиль для введення ліків до складу так званих «емульгувальних» композицій, тобто композицій, які містять ліки, гідрофільну фазу і ліпофільну фаз у. Таку стратегію можна запозичити з аналогічної стратегії, розробленої для солюбілізації циклічних полі-N-метилованих ундекапептидів із класу циклоспоринів, біологічна доступність яких була значно збільшена шляхом змішування їх з емульсією, яка містить ліпофільну фазу, яка являє собою тригліцериди жирних кислот із середньою довжиною ланцюга, гідрофільну поверхнево-активну речовину, таку як Cremophor RH 40 (фірма BASF Corp.), і пропіленгліколь [див. патент ЕР №0539319 В1]. Так звані СЕСВЛ-композиції (самоемульгувальні системи введення ліків) мають високий вміст ліпідів і поверхнево-активних речовин для відповідного диспергування ліків при змішуванні з водним середовищем. У міжнародній заявці на [патент №PCT/US97/20794 (WO 98/22106) на ім'я фірми Abbott Laboratories] описана рідка фармацевтична композиція СЕСВЛ для перорального введення, яка забезпечує при пероральному введенні більш високу біологічну доступність інгібіторів протеази ВІЛ, включаючи певні інгібітори протеази з класу 5,6-дигідро-4-гідрокси-2-піронів. Така композиція являє собою фармацевтично прийнятну емульгувальну композицію, яка містить жирні кислоти з довгим ланцюгом або суміш фармацевтично прийнятної жирної кислоти з довгим ланцюгом і фармацевтично прийнятного спирту і необов'язково поверхнево-активної речовини [такої як Cremophor EL, фірма BASF Corp.]. До складу переважних композицій входять етанол або пропіленгліколь або обидві вказані сполуки. У заявці вказано, що вміст жирних кислот з довгим ланцюгом становить від приблизно 40 до приблизно 70% у перерахунку на масу всього розчину, вміст поверхнево-активної речовини становить від приблизно 5 до приблизно 10% у перерахунку на масу всього розчину, а етанолу або пропіленгліколю - від приблизно 1 до приблизно 15% у перерахунку на масу всього розчину. Дослідження на собаках породи Бігль і людині дозволили установити, що в цьому випадку принаймні для п'яти інгібіторів протеази ВІЛ досягається більш висока середня біологічна доступність у порівнянні з біологічною доступністю інгібітора протеази ВІЛ ритонавіру як у формі вільної основи, так і у формі бістозилату. У [патенті US №5484801 на ім'я фірми Abbott Laboratories] заявлена фармацевтична композиція, яка містить сполуку, яка інгібує протеазу ВІЛ, у фармацевтично прийнятному органічному розчиннику, яка включає: (а) розчинник, вибраний із пропіленгліколю і поліетиленгліколю (у кількості від приблизно 10 до приблизно 50% у перерахунку на масу всього розчину) або (б) розчинник, вибраний з поліоксіетиленгліцерину, тририцинолеату, ефіру поліетиленгліколю(40) і гідрогенізованої рицинової олії, фракціонованої кокосової олії, поліоксіетиленсорбітанмоноолеату і 2-(2-етоксіетокси)етанолу (у кількості від приблизно 5 до приблизно 35% у перерахунку на масу всього розчину) або (в) суміш вказаних сполук і етанолу або пропіленгліколю (у кількості від приблизно 5 до приблизно 45% у перерахунку на масу всього розчину). У [міжнародній заявці на патент РСТ/ЕР96/02431 (WO 96/39142) і в патенті US №6008228 на ім'я фірми F. Hoffmann-La Roche AG] описана фармацевтична композиція, яка також дозволяє збільшити біологічну доступність інгібіторів протеази. Композиція містить фармацевтично прийнятний носій, який включає моногліцериди жирних кислот із середньою довжиною ланцюга, які переважно являють собою моногліцериди насичених С 6-С12 жирних кислот і мають кислотне число, яка не перевищує або дорівнює приблизно 2,5. Вказано, що переважне співвідношення моногліцеридів із середньою довжиною ланцюга й інгібітора протеази становить приблизно принаймні 1,5. У [міжнародній заявці на патент №PCT7US95/O529 на ім'я фірми Up John], у якій описане застосування 5,6-дигідро-4-гідрокси-2-піронів для лікування ретровірусних інфекцій, не обговорюється проблема біологічної доступності, властива таким сполукам. У патенті містяться відомості про те, що такі сполуки у вигляді динатрієвої солі можна включати до складу звичайних спресованих таблеток (змішуючи сполуки з загальноприйнятими інгредієнтами, такими як тальк, стеарат магнію і т.д.) або готувати на їх основі загальноприйнятим методом сиропи і еліксири. У [Міжнародних заявках на патент PCT/US98/14816 (WO 99/06043), PCT/US98/14817 (WO 99/06044), PCT/US98/14818 (WO 99/06024) і патенті US №6121313 на ім'я фірми Pharmacia & Up John Company] описані самоемульгувальні композиції, які містять лужні солі діючих речовин, які забезпечують більш високу біологічну доступність таких сполук при пероральному введенні. У патентах описані композиції, які включають суміш дигліцериду і моногліцеридів або основних амінів і однієї або декількох фармацевтично прийнятних поверхнево-активних речовин і розчинників, які дозволяють підвищити абсолютну біологічну доступність при пероральному введенні. Переважною поверхнево-активною речовиною є Cremophor EL або Cremophor RH40, а переважним розчинником є пропіленгліколь або суміш, яка містить пропіленгліколь і 95об.%-ний етанол. У відношенні інгібіторів протеази з класу 5,6-дигідро-4-гідрокси-2-піронів у [PCT/US98/14816] зазначається, що як розчинник можна застосовувати поліпропіленгліколь, пропіленгліколь, поліетиленгліколь, гліцерин, етанол, триацетин, диметилізосорбід, глікольфурол, пропіленкарбонат, воду, диметилацетамід або суміші вказаних сполук. Вказано, що переважним розчинником для таких сполук є пропіленгліколь або суміш, яка містить пропіленгліколь і 95об.% етанол. Вказано, що вміст пропіленгліколю в суміші пропіленгліколю і етанолу становить від приблизно 50 до приблизно 95%. Відзначається, що до поверхнево-активних речовин, які можна застосовувати в сполученні з вказаними в заявці сполуками, належать неіоногені поверхнево-активні речовини, включаючи поліоксил(40)-гідрогенізовану рицинову олію (наприклад, Cremophor RH40), поліоксил(35) рицинову олію (наприклад, Cremophor EL або Cremophor ELP), полісорбати, Solutol HS-15, Tagat TO, пегліколь 6-олеат, поліоксіетиленстеарати, насичені полігліколізовані гліцериди або полоксамери. Відзначається, що переважними поверхнево-активними речовинами для таких емульгувальних композицій є Cremophor RH40 або Cremophor EL. Якщо до складу композиції входять аміни, то в заявці вказано, що їх вибирають із групи, яка включає (нижч.)алкіламіни, такі як етаноламін, діетаноламін, триетаноламін, диметиламіноетанол, трис(гідроксиметил)аміноетан або етилендіамін; похідні четвертинного амонію, такі як гідроксид холіну; і основні амінокислоти, такі як аргінін, лізин або гуанідин. Переважним (нижч.)алкіламіном є диметиламіноетанол або трис(гідроксиметил)амінометан. Якщо до складу композиції входить суміш дигліцериду і моногліцериду, то така суміш переважно має масове співвідношення дигліцерид:моногліцерид від приблизно 9:1 до приблизно 6:4, де дигліцерид і моногліцерид являють собою ефіри гліцерину і моно-або диненасичених жирних кислот, з довжиною ланцюга від 16 до 22 атомів вуглецю. Відзначається, що, як правило, піранонова композиція за винаходом, містить від 1 до 40мас.% лікарського засобу, від приблизно 5 до 35мас.% суміші дигліцериду і моногліцериду і від приблизно 10 до приблизно 50мас.% фармацевтично прийнятного розчинника. До складу композиції необов'язково можна додавати основою амін у кількості від приблизно 0,1 до приблизно 10% у перерахунку на масу всієї композиції. Було встановлено, що серед 5,6-дигідро-4-гідрокси-2-піронів, які мають інгібуючу активність у відношенні протеази, клас 5,6-дигідро-4-гідрокси-2-піронсульфонамідів має найбільш високу інгібуюну активність у відношенні протеази [Turner і ін., J Med. Chem., 41(3): 3467-3476 (1998)]. Встановлено, зокрема, що одна зі сполук, а саме непептидний інгібітор протеази ВІЛ типранаваір, тобто (6R)-3-[{(1R)-1-[3-({[5(тpифтopмeтил)(2-піридил)]сульфоніл}аміно)феніл]пропіл}-4-гідрокси-6-(2-фенілетил)-6-пропіл-5,6-дигідро2Н-піран-2-он [також відомий з літератури під назвами U-140690iPNU-140690]: має дуже високу активність у відношенні вірусних аспартатпротеаз різних лабораторних штамів і клінічних ізолятов ВІЛ типу 1, включаючи ті, які є стійкими до інгібіторів зворотної транскриптази зидовудину і делавірдину. Відомо, що типранавір (формула IV) (MM=602,98) має дуже високу активність у відношенні варіантів ВІЛ-1, стійких до інгібіторів протеази з класу пептидоміметиків [Рорре і ін., Antimicrob. Agents Chemother., 41(5): 1058-1063 (1997)]. У дослідах in vitro було встановлено, що значення Kі для ліків становлять приблизно 8пМ (тобто, вони мають високу інгібуючу активність у відношенні ферменту) і значення ІС 90 в антивірусній клітинній культурі становить приблизно 100нМ [Turner і ін., J. Med. Chem., 41(18): 3467-3476 (1998)]. Воно характеризується величиною Log P приблизно 6,1 і рKа при 6,2 і 8,2. Передбачається, що зв'язування типранавіру з активним центром протеази є гнучким, що обумовлює його більш високі інгібуючі здатності в порівнянні з іншими доступними на даний час інгібіторами протеаз [Larder і ін., 3-є засідання міжнародної робочої групи з проблем стійкості ВІЛ до лікарських засобів і стратегії лікування (ІАРАС 3rd International Workshop on HIV Drug Resistance and Treatment Strategies), 23-26 червня 1999]. У результаті проведення досліджень in vitro культур 134 отриманих у клінічних умовах ізолятів із широким спектром стійкості до доступних на даний час інгібіторів протеази з класу пептидоміметиків було встановлено, що 90% з 105 вірусів, які мають більш ніж десятикратну стійкість до трьох або чотирьох інгібіторів протеїнази і які мають у середньому 6,1 мутацій у гені ферменту протеази, були чутли ві до типранавіру [Larder і ін., AIDS, 14(13): 1943-1948 (2000)]. В іншому дослідженні було встановлено, що типранавір зберігає тривалу активність у відношенні ізолятів, стійких до індинавіру, ритонавіру і нелфинавіру, трьох доступних на даний час інгібіторів протеази [Rusconi і ін., Antimicrob. Agents Chemother., 44(5): 1328-1332 (2000)]. Аналогічна тривала активність була виявлена також по відношенню до ізолятів, стійких до саквінавіру [Larder i ін., ІАРАС 3-rd International Workshop on HIV Drug Resistance and Treatment Strategies, 23-26 червня 1999]. Було встановлено, що інгібітори протеази з класу 5,6-дигідро-4-гідрокси-2-піронів, насамперед інгібітори з класу 5,6-дигідро-4-гідрокси-2-піронсульфонамідів, такі як типранавір, дуже важко включати до складу композицій для перорального введення. Були здійснені численні спроби виготовлення композицій, які містять такі ліки, які мали би прийнятну біологічну доступність при пероральному введенні. Типранавір, наприклад, утворює високогігроскопічні солі, що зменшує стабільність ліків. Фірма-створювач типранавіру після багатьох років спроб розробки оптимальної композиції для перорального введення, на даний час виробляє емульгувальну композицію, яка містить ліки, ліпофільну фаз у, яка представляє собою суміш дигліцеридів і моногліцеридів, поверхнево-активну речовину, основний амін і водну фазу, яка містить пропіленгліколь і спирт, де всіма вказаними компонентами заповнюють м'які желатинові капсули. Така композиція, хоча і забезпечує хорошу біологічну доступність лікарського засобу при пероральному введенні, має ряд недоліків, які включають: тенденцію капсул до розм'якшення і злипання з часом; значне зменшення біологічної доступності після капсулювання в м'яку желатинову капсулу; необхідність зберігання композиції в охолодженому стані до застосування для запобігання зміни композиції капсули; і необхідність застосування складних виробничих процесів для приготування стабільних наповнювачів капсул, що зумовлено в першу чергу високою леткістю етанолу. Таким чином, існує необхідність у створенні поліпшених композицій для перорального введення інгібіторів протеази в цілому, більш переважно інгібіторів протеази з класу 5,6-дигідро-4-гідрокси-2-піронів і ще більш переважно інгібіторів протеази з класу 5,6-дигідро-4-гідрокси-2-піронсульфонамідів, таких як типранавір. Даний винахід стосується поліпшених композицій для перорального введення інгібіторів протеази з класу піранонів і способів виготовлення таких композицій. Такі композиції забезпечують підвищену солюбілізацію, стабільність і/або біологічну доступність лікарських засобів, які містять піранон, а також дають можливість застосовувати менш трудомісткі технологічні процеси для заповнення капсул і дозволяють зберігати капсули при кімнатній температурі. Зокрема, запропоновані композиції для перорального застосування, які містять типранавір і які мають переваги. Поняття «сполуки з класу піранонів» означає сполуки формули І: де R1 означає Н-; R2 означає С 3-С5алкіл, феніл(СН2)2-, het-SO2NH-(CH2)2-, циклопропіл(СН 2)2-, Fфеніл(СН2)2-, het-SО2NH-феніл-, або F3C-(CH2)2-; або R1 і R2 разом означають подвійний зв'язок; R3 означає R4-(CH2)n-CH(R5)-, Н3С-[О(СН2)2] 2-СН2-, С3-С5алкіл, феніл(СН 2)2-, het-SO 2NH-(CH2)2-, (HOCH2)3C-NH-C(O)NH-(CH2)3-, (HO2C)(H2N)CH-(CH 2)2-C(O)-NH-(CH 2)3-, піперазин-1-іл-С(О)-NH-(СН2)3, HO3S(CH2)2-N(CH3)-C(O)(CH2)6-C(O)-NH-(CH 2)3-, циклопропіл(СН 2)2-, F-феніл-(СН2)2-, het-SO2 NH-феніл або F3C-(СН2)2-; n дорівнює 0, 1 або 2; R4 означає феніл, het, циклопропіл, Н3С-[О(СН2)2]2-, het-SO2NH-, Br-, N3 - або HO3S(CH2)2-N(CH3)C(O)-(CH2)6-C(O)-NH-; R5 означає -СН2-СН3 або -СН2-циклопропіл; R6 означає циклопропіл, СН3-СН2- або трет-бутил; R7 означає -NR8SO2-het, -NR 8SO2-феніл, необов'язково заміщений R9, -СН2-SО2-феніл, необов'язково заміщений R9, або -CH2-SO2-het; R 8 означає -Η або -СН3; R9 означає -CN, -F, -ОН або -NO2; де het означає 5-, 6- або 7-членне насичене або ненасичене кільце, яке містить 1-3 гетероатоми, вибраних із групи, яка складається з азоту, кисню і сірки; і включає будь-яку біциклічну груп у, у якій будь-яке з вказаних вище гетероциклічних кілець сконденсовано з бензольним кільцем або іншим гетероциклом, необов'язково заміщеним -СН3, -CN, -ОН, -С(О)ОС 2Н5, -CF3, -NH2 або -C(O)-NH2; або її фармацевтично прийнятну сіль; а також сполуки формули II і формули III: де R10 означає Н-, СН3О- або СН 3О-[(СН2)2 О]3-; R11 означає циклопропіл або -СН2-СН(СН3)2; R12 означає -NR14SO2-феніл, необов'язково заміщений R15, -NR14SO2-het, -СН2-SО2-феніл, необов'язково заміщений R15, або -CH2-SO2-het; R 13 означає -Η, -(СН2)2-СН3, -СН2-циклопропіл або -СН2-феніл; R14 означає -Н або -СН3; R15 означає -CN, -F, -СН3, -СООН або -ОН; het означає 5-, 6- або 7-членне насичене або ненасичене кільце, яке містить 1-3 гетероатоми, вибраних із групи, яка складається з азоту, кисню і сірки; і включає будь-яку біциклічну груп у, у якій будь-яке з вказаних вище гетероциклічних кілець сконденсовано з бензольним кільцем або іншим гетероциклом, необов'язково заміщеним -СН3, -CN, -OH, -(O)OC 2H5, -CF3, -NH2, або C(O)-NH2; або її фармацевтично прийнятну сіль. Було встановлено, що основна трудність, пов'язана зі створенням композицій для перорального введення, які містять відомі на даний час інгібітори протеази з класу піранонів, зумовлена застосуванням етанолу і пропіленгліколю. Як відзначалося вище під час обговорення прототипів, хоча для приготування мікроемульсії інгібітора протеази з класу піранонів пропонувалися інші розчинники, протягом довгого часу вважалося, що переважним є включення етанолу і пропіленгліколю в такі мікроемульсійні композиції, завдяки чому можна створити оптимальну композицію. Було встановлено, що такі розчинники, хоча вони і є ефективними з погляду одержання емульсій інгібіторів протеази з класу піранонів, проникають у желатинові оболонки, які оточують такі мікроемульсійні композиції, приводячи тим самим до зміни складу фаз композиції, розчинності ліків і шкідливо впливаючи на структурн у цілісність капсули. У результаті цього капсули стають липкими при кімнатній температурі і тому їх необхідно зберігати в охолодженому стані. При створенні даного винаходу були розроблені нові самоемульгувальні композиції, для приготуванні яких не потрібно включати етанол або пропіленгліколь до складу композиції. З урахуванням того, що такі композиції мають, зокрема, стабільність при кімнатній температурі, то об'єктом винаходу є істотно поліпшена фармацевтична композиція для перорального введення інгібіторів протеази з класу піранонів. Така композиція дозволяє пацієнтам, які приймають інгібітори протеази з класу піранонів, працювати поза місцями, де є можливість доступу до пристроїв, що забезпечують необхідний рівень охолодження. Крім того, такі композиції мають істотно більш постійний профіль біологічної доступності, ніж існуючі на даний час композиції, які містять значні кількості етанолу або пропіленгліколю. Даний винахід стосується композиції, яка практично не містить значних кількостей етанолу і пропіленгліколю (вміст однієї з вказаних сполук або їх комбінації переважно становить менше приблизно 0,5%, більш переважно менше приблизно 0,1%), що дозволяє створити істотно більш стабільну композицію, яка містить інгібітори протеази з класу піранонів і, насамперед інгібітори протеази з класу сульфонамідів піранонів, таких як типранавір. Такі композиції містять від приблизно 1 до приблизно 40% інгібітора протеази з класу піранонів у перерахунку на масу всієї композиції, від приблизно 5 до приблизно 35% ліпофільної фази, що переважно представляє собою суміш дигліцеридів і моногліцеридів, у перерахунку на масу всієї композиції, від приблизно 20 до приблизно 60% поверхнево-активної речовини в перерахунку на масу всієї композиції і від приблизно 10 до приблизно 40% поліетиленгліколю із середньою молекулярною масою більше 300, але менше 600, у перерахунку на масу всієї композиції і від приблизно 0,1 до приблизно 10% одного або декількох основних амінів у перерахунку на масу всієї композиції. При створенні даного винаходу несподівано було встановлено, що при приготуванні самоемульгувальної композиції для солюбілізації інгібіторів протеази з класу піранонів, насамперед інгібіторів протеази з класу сульфонамідів піранонів, можна застосовувати поліетиленгліколі із середньою молекулярною масою більше приблизно 300, але менше 600 (переважно приблизно 400), без використання спирту або пропіленгліколю, причому такі полімери не мають здатності проникати в желатинові капсули або іншим способом негативно впливати на їх характеристики. З ура хуванням великої кількості альтернативних можливостей створення композицій, які включають інгібітори протеази з класу піранонів, які не містять спирту або пропіленгліколю, були проведені різноманітні дослідження мікроемульсійної фази, що створюється з використанням різних комбінацій матеріалів, для виявлення придатних композицій, які забезпечують клінічно значимі рівні біологічної доступності. Після численних невдалих спроб було встановлено, що для заміни пропіленгліколю і/або етанолу, які входять до складу застосовуваних на даний час композицій, які містять інгібітор протеази з класу піранонів, можна з успіхом використовувати деякі поліетиленгліколі з певною молекулярною масою. Така заміна є порівняно дешевою й ефективною, і несподівано було встановлено, що це дозволяє істотно підвищити біологічну доступність і стабільність. Одним з об'єктів винаходу є фармацевтична композиція, яка практично не містить спирту і пропіленгліколю, яка включає як діючу речовину піранон формули І, II або III, одну або декілька фармацевтично прийнятних поверхнево-активних речовин; і поліетиленгліколь із середньою молекулярною масою більше 300, але менше 600. Фармацевтична композиція переважно містить сполуку формули І, II або III у кількості від приблизно 1 до приблизно 40% у перерахунку на масу всієї композиції і крім того містить основний амін у кількості від приблизно 0,1 до приблизно 10% у перерахунку на масу всієї композиції. Як основний амін переважно застосовують (нижч.)алкіламін, основну амінокислоту або гідроксид холіну, причому (нижч.)алкіламін переважно вибирають з ряду, який включає етаноламін, діетаноламін, триетаноламін, етилендіамін, диметиламіноетанол або трис(гідроксиметил)амінометан. Крім того, фармацевтична композиція може містити суміш моногліцеридів і дигліцеридів у кількості від приблизно 5 до приблизно 35% у перерахунку на масу всієї композиції, причому суміш переважно являє собою Capmul МС М. Найбільшу ефективність композиція має, при включенні до її складу типранавіру, сподуки формули IV. Крім того, переважно, щоб кількість поліетиленгліколю становила від приблизно 10 до приблизно 40% у перерахунку на масу всієї композиції. Найбільш переважно, щоб поліетиленгліколь мав молекулярну масу приблизно 400. Кількість поверхнево-активної речовини переважно становить від приблизно 20 до приблизно 60% у перерахунку на масу всієї композиції, при цьому поверхнево-активну речовину вибирають із групи, яка включає: поліоксил(40)-гідрогенізовану рицинову олію, поліоксил(35)-рицинову олію, Solutol HS15, Tagat TO, пегліколь 6-олеат, поліоксіетиленстеарати, полоксамери, полісорбати або насичені полігліколізовані гліцериди. Переважною поліоксил(35)-гідрогенізованою рициновою олією є Cremophor EL або Cremophor EL-P. Іншим об'єктом даного винаходу є фармацевтична композиція, яка практично не містить спирту і пропіленгліколю, яка включає як діюну речовину типранавір (формула IV) у кількості від приблизно 1 до приблизно 40% у перерахунку на масу всієї композиції; ліпофільну фазу в кількості від приблизно 5 до приблизно 35% у перерахунку на масу всієї композиції; поліетиленгліколь із середньою молекулярною масою більше приблизно 300, але менше приблизно 600, у кількості від приблизно 10 до приблизно 40% у перерахунку на масу всієї композиції; фармацевтично прийнятну поверхнево-активну речовину, переважно вибрану із групи, яка включає: поліоксиловану рицинову олію, поліоксіетиленгліцеринтририцинолеат і насичений полігліколізований каприловий-каприновий гліцерид, у кількості від приблизно 20 до приблизно 60% у перерахунку на масу всієї композиції; і основний амін, переважно вибраний із групи, яка включає (нижч.)алкіламін, основну амінокислоту або гідроксид холіну, де вказаний основний амін присутній у кількості від приблизно 0,1 до приблизно 10% у перерахунку на масу всієї композиції. Переважно ліпофільна фаза містить суміш моногліцеридів і дигліцеридів із середньою довжиною ланцюга, таку як Capmul MCM. Ще одним об'єктом даного винаходу є фармацевтична композиція, яка практично не містить спирту і пропіленгліколю, яка включає: типранавір (формула IV) у кількості від приблизно 1 до приблизно 40% у перерахунку на масу всієї композиції; ліпофільну фазу, переважно вибрану із групи, яка включає Capmul MC M, Labrafil М-1944 CS, Miglyol-812 і їх комбінації, де ліпофільна фаза присутня в кількості від приблизно 5 до приблизно 35% у перерахунку на масу всієї композиції; поліетиленгліколь із середньою молекулярною масою більше приблизно 300, але менше приблизно 600, у кількості від приблизно 10 до приблизно 40% у перерахунку на масу всієї композиції; і фармацевтично прийнятну поверхнево-активну речовину, переважно вибрану із групи, яка включає: поліоксиловану рицинову олію, поліоксіетиленгліцеринтририциноолеат і насичений полігліколізований каприловий-каприновий гліцерид, у кількості від приблизно 20 до приблизно 60% у перерахунку на масу всієї композиції. Переважно, щоб така композиція містила, крім того, основний амін, переважно вибраний із групи, яка включає (нижч.)алкіламін, основну амінокислоту або гідроксид холіну, де вказаний основний амін присутній у кількості від приблизно 0,1 до приблизно 10% у перерахунку на масу всієї композиції. Інші задачі та переваги винаходу більш докладно розглянуті нижче з посиланням на додані креслення, на яких показано: На Фіг.1 - фазова діаграма мікроемульсії, яка містить Cremophor EL як поверхнево-активну речовину, пропіленгліколь як гідрофільну фазу і Capmul MCM як ліпофільну фазу, побудована залежно від різних взаємних співвідношень концентрацій вказаних сполук. На Фіг.2 - фазова діаграма мікроемульсії, яка містить Cremophor EL як поверхнево-активну речовину, ПЕГ 400 як гідрофільну фазу і Capmul MCM як ліпофільну фазу, побудована залежно від різних взаємних співвідношень концентрацій вказаних сполук. На Фіг.3 - фазова діаграма мікроемульсії, яка містить Cremophor EL як поверхнево-активну речовину, ПЕГ 400 як гідрофільну фазу і Labrafil ΜΙ 944 CS як ліпофільну фазу, побудована залежно від різних взаємних співвідношень концентрацій вказаних сполук. На Фіг.4 - фазова діаграма мікроемульсії', яка містить Labrasol як поверхнево-активну речовину, ПЕГ 400 як гідрофільну фазу і Capmul MCM як ліпофільну фаз у, побудо вана залежно від різних взаємних співвідношень концентрацій вказаних сполук. На Фіг.5 - графік розчинення in vitro типранавіру з двох мікроемульсійних композицій, представлених у таблиці 1 і таблиці 2. На Фіг.6 - графік розчинення in vitro типранавіру із самоемульгувальної композиції, представленої в таблиці 2, розташованої в гідрофільній м'якій желатиновій капсулі, після зберігання протягом 3 місяців при різних температурах і/або значеннях відносної вологості. На Фіг.7 - графік розчинення in vitro типранавіру із самоемульгувальної композиції, представленої в таблиці 2, розташованої в ліпофільній м'якій желатиновій капсулі, після зберігання протягом 3 місяців при різних температурах і/або значеннях відносної вологості. Даний винахід дозволяє подолати багато проблем, пов'язаних з незадовільною стабільністю і приготуванням композицій, які містять інгібітори протеази з класу піранонів. У даному винаході запропоновані нові композиції, які містять інгібітори протеази з класу піранонів, які дозволяють істотно збільшити розчинність і біологічну доступність таких інгібіторів протеази при введенні пероральних лікарських засобів. Розчинність є важливим чинником для будь-якої композиції, призначеної для перорального введення. Однак, при створенні композиції слід враховува ти необхідність використання ефективних з економічної точки зору методів, які дозволяють готувати широку розмаїтість лікарських засобів для перорального введення, які є стабільними у відношенні їх фізіохімічних характеристик. Крім того, необхідно, щоб компоненти будь-якої композиції легко піддавалися технологічній обробці. У даному винаході запропонований спосіб ефективного з економічної точки зору виробництва й обробки стабільних у відношенні їх фізіохімічних характеристик пероральних лікарських засобів, які містять інгібітори протеази з класу піранонів, що мають підвищену біологічну доступність. Сполуки формул I, II, III і IV, вказані в даному описі, наведені і заявлені в [Міжнародній заявці на патент №PCT/US95/05219] і їх можна одержувати відповідно до методів, описаних у [Міжнародній заявці на патент №WO 95/30670], зміст яких включений в даний опис повністю як посилання. Поняття "інгібітор протеази з класу піранонів" означає будь-яку сполуку формул І, II, III і IV, яка має здатність інгібувати ретровірусну протеазу. Поняття самоемульгувальна композиція за даним винаходом стосується композиції, яка містить інгібітор протеази з класу піранонів, ліпофільну фазу, гідрофільну фазу, яка переважно включає поліетиленгліколь, одну або декілька фармацевтично прийнятних поверхнево-активних речовин і основний амін у кількості від 0,1 до приблизно 10% у перерахунку на масу всієї композиції. Поняття "самоемульгувальна композиція" означає концентровану композицію, здатну утворювати емульсії або мікроемульсії при змішуванні з достатньою кількістю водних середовищ. Емульсії або мікроемульсії, які одержують згідно із даним винаходом, являють собою розчини, які містять гідрофільну фазу і ліпофільну фазу. Мікроемульсії характеризуються також своєю термодинамічною стабільністю і малим середнім розміром крапель, що, як правило, становить менше приблизно 0,15мкм. Поняття "основний амін" означає (нижч.)алкіламіни, такі, наприклад, як етаноламін, діетаноламін, триетаноламін, диметиламіноетанол, трис(гідроксиметил)амінометан або етилендіамін; похідні четвертинного амонію, такі, наприклад, як гідроксид холіну; і основні амінокислоти, такі, наприклад, як аргінін, лізин або гуанідин. Переважним (нижч.)алкіламіном є диметиламіноетанол або трис(гідроксиметил)амінометан. Поняття "фармацевтично прийнятна поверхнево-активна речовина" стосується неіоногених поверхнево-активних речовин, включаючи поліоксил(40)-гідрогенізовану рицинову олію, що постачається в продаж серед іншого під товарним знаком Cremophor RH40; поліоксил(35)-рицинову олію, яка постачається в продаж серед іншого під товарним знаком Cremophor EL або Cremophor EL-P (фірма BASF Corp.); полісорбати; Solutol HS-15, Tagat TO, пегліколь 6-олеат, поліоксіетиленстеарати, насичені полігліколізовані каприлові-капринові гліцериди, що постачаються в продаж серед іншого під товарним знаком Labrasol (фірма Gattefosse, Вествуд, штат Нью-Джерсі); насичені полігліколізовані гліцериди; або полоксамери, причому всі сполуки є в продажу. Переважною поверхнево-активною речовиною є Cremophor EL. Поняття "ліпофільний компонент" або "ліпофільна фаза" включає будь-яку кількість компонентів, які мають характерні для ліпідів властивості і високу розчинністю в ліпідах, і воно стосується тригліцеридів каприлової/капринової кислоти, що постачаються в продаж серед іншого під товарним знаком Captex 300 (фірма Abitec, Колумбус, штат Огайо), продуктам трансетерифікації кісточкової олії і ПЕГ (або ненасичених полігліколізованих гліцеридів, які одержують шляхом часткового алкоголізу кісточкової абрикосової олії, яка містить гліцериди і складні ефіри ПЕГ), відомих, серед іншого, під товарним знаком Labrafil Μ 1944 CS (фірма Gattefosse, Вествуд, шта т Нью-Джерсі); моно- і дигліцериди каприлової/капринової кислоти в гліцерині, що постачаються в продаж серед іншого під товарними знаками Capmul MCM (фірма Abitec, Колумбус, штат Огайо); і фракціонована олія (така як кокосова олія), що містить тригліцериди каприлової/капринової кислот, що постачається в продаж серед іншого під товарним знаком Miglyol 812. Поняття "моногліцерид" означає ефір жирної кислоти і гліцерину, який має структурну формулу HOCH2CH(OH)-CH2(O2CR) або НОСН2-CH(O2CR)-CH2OH, де R означає мононасичену або динасичену алкільну груп у, яка несе від 8 до 10 атомів вуглецю. Поняття "дигліцерид" означає ефір жирної кислоти і гліцерину, який має структурн у формулу НОСН 2-CH(O2CR) -CH2(O2CR)- або (RCO2)CH2-CH(OH)-CH2(O2CR), де R означає мононасичену або динасичену алкільну груп у, яка несе від 8 до 10 атомів вуглецю. Суміш дигліцериду і моногліцериду можна одержувати шляхом змішування у відповідній пропорції отриманих окремо дигліцериду і моногліцериду і/або шляхом часткового гідролізу тригліцериду, або за допомогою реакції трансетерифікації тригліцеридів, дигліцеридів із гліцерином. Поліетиленгліколь або ПЕГ означає полімер, який має загальну формулу НОСН 2(СН2)СН2)mСН2ОН, де m означає середню кількість оксіетиленових ланок. Число, вказане після ПЕГ, означає середню молекулярну масу полімеру. ПЕГ постачається в продаж різними фірмами, у тому числі фірмою Union Carbide Corp. У найбільш переважній композиції за даним винаходом, яка містить сполуку формули IV (типранавір), використовується самоемульгувальний носій на основі ПЕГ, який містить від приблизно 10 до приблизно 40% ПЕГ 400 (більше переважно від приблизно 15 до приблизно 30% ПЕГ 400), від приблизно 20 до приблизно 60% Cremophor EL (більш переважно від приблизно 35 до приблизно 50% Cremophor EL), від приблизно 5 до приблизно 35% Capmul MCM (більш переважно від приблизно 7 до приблизно 15% Capmul MC M) і від приблизно 0,1 до приблизно 10% основного аміну. Слід зазначити, що загальноприйняті самоемульгувальні композиції інгібіторів протеази з класу піранонів, які містять пропіленгліколь і/або спирт, у вигляді м'яких желатинових капсул після зберігання протягом певного періоду часу характеризуються більш повільною і менш повною диспергованістю у водному середовищі і їх розчинність зменшується приблизно на 40% у порівнянні з розчинністю свіжоприготованих композицій. Слід зазначити також, що біологічна доступність таких лікарських засобів в організмі людини нижче, ніж вихідного розчину такого ж складу, яким заповнюють желатинові капсули, безпосередньо перед їх введенням. Було висунуте припущення, що ці явища зумовлені тим, що розчинник проникає в капсулу. Був проведений перший цикл досліджень, спрямованих на зміну складу желатинової капсули з метою запобігання проникнення розчинників з емульгувальної композиції в капсулу. Ці спроби не мали успіху. Після цього були проведені дослідження з метою визначення, чи можна пропіленгліколь і спирт, які використовуються як розчинники у застосовуваних на даний час композиціях, замінити повністю або частково іншим розчинником. Для систем, які містять різні ліпофільні фази, гідрофільні фази і поверхнево-активні речовини, були побудовані фазові діаграми мікроемульсій. На основі численних досліджень було встановлено, що певні інгібітори протеази з класу піранонів, включаючи типранавір, розчинні в поліетиленгліколях із середньою молекулярною масою, яка знаходиться у певному діапазоні, і їх можна застосовувати для заміни пропіленгліколю і етанолу, які використовуються у звичайних мікроемульсійних композиціях таких лікарських засобів. На Фіг.1 показана діаграма мікроемульсії, яка містить Cremophor EL як поверхнево-активну речовину, Capmul MCM як ліпофільну фазу і пропіленгліколь, який використовується у звичайних композиціях, що містять інгібітори протеази з класу піранонів, як гідрофільну фазу, побудована у вигляді залежності від різних взаємних співвідношень концентрацій вказаних сполук. Наведені дані свідчать про те, що при використанні вказаних компонентів можна одержувати стабільну емульсію в широкому діапазоні концентрацій кожного з компонентів. Однак, оскільки пропіленгліколь розчинний у капсулі, яка містить композицію, то положення точки, що характеризує композицію, на фазовій діаграмі може істотно змінюватися з часом залежно від кількості пропіленгліколю, що виділилася з емульсії. Тому з часом може значно змінюватися розчинність лікарського засобу, який присутній у композиції. На Фіг.2 показана фазова діаграма мікроемульсії, яка містить Cremophor EL як поверхнево-активну речовину, Capmul MCM як ліпофільну фазу і ПЕГ-400 як гідрофільну фазу, також побудована у вигляді залежності від різних взаємних співвідношень концентрацій вказаних сполук. Можна вважати, що фазова діаграма для композиції, яка містить ПЕГ-400 (а не пропіленгліколь як на Фіг.1), є подібною до діаграми, наведеної на Фіг.1. Результати досліджень, розпочатих з метою визначення впливу ліпофільної фази на фазову стабільність мікроемульсії, представлені на Фіг.2, дозволяють припустити, що переважною є ліпофільна фаза, яка представляє собою суміш моно- і дигліцеридів із середньою довжиною ланцюга, таких, які присутні в Capmul MCM. На Фіг.3 показана фазова діаграма мікроемульсії, яка містить Cremophor EL як поверхнево-активну речовину, ПЕГ 400 як гідрофільну фазу і Labrafil-M-1944 CS як ліпофільну фазу, побудована у вигляді залежності від різних взаємних співвідношень концентрацій вказаних сполук. LabrafilM-1944 являє собою продукт трансетерифікації кісточкової олії і ПЕГ, а саме ненасичені полігліколізовані гліцериди, отримані частковим гідролізом абрикосової кісточкової олії, яка містить гліцериди, і складних ефірів ПЕГ. При дослідженні стабільності мікроемульсії в широкому діапазоні концентрацій компонентів було встановлено, що вона має місце в більш вузькому діапазоні, ніж для мікроемульсійної системи, представленої на Фіг.2, у якій як ліпофільна фаза використовується Capmul MCM. Capmul MCM являє собою суміш моно- і дигліцеридів каприлової/капринової кислоти в гліцерині. При використанні як поверхнево-активної речовини Labrasol замість Cremophor EL було виявлено невелике збільшення стабільності мікроемульсії, діаграма якої наведена на Фіг.2. На Фіг.4 показана фазова діаграма мікроемульсії, яка містить Labrasol як поверхнево-активну речовину, ПЕГ 400 як гідрофільну фазу і Capmul MC M як ліпофільну фазу, побудована у вигляді залежності від різних взаємних співвідношень концентрацій вказаних сполук. Хоча застосування Labrasol підвищує стабільність, Labrasol має недолік, пов'язаний з тим, що дотепер не вивчена на людях його безпека при тривалому застосуванні пероральним шляхом. На Фіг.5 показаний графік розчинення in vitro типранавіру з двох самоемульгувальних композицій, представлених нижче в таблиці 1 і таблиці 2. Композиція, представлена в таблиці 2, відрізняється від композиції, представленої в таблиці 1, тим, що замість спирту і пропіленгліколю в ній використовується ПЕГ 400. Таблиця 1 Компонент Кількість мас.% Типранавір 250 25 спирт 100 10 пропіленгліколь 73 7,3 Cremophor EL 455 45,5 Capmul MCM 75 7,5 трометамін USP (фармакопея 15 1,5 США) очищена вода USP 30 3,0 пропілгалат 2 0,2 м'яка желатинова капсула Всього 1000 100 Таблиця 2 Компонент типранавір ПЕГ 400 Cremophor EL Capmul MCM трометамін USP очищена вода USP пропілгалат м'яка желатинова капсула Всього Кількість мас.% 250 25 173 17,3 455 45,5 75 7,5 15 1,5 30 3,0 2 0,2 1000 100 У дослідах in vitro було встановлено, що розчинність композиції, представленої в таблиці 2 (у якій як гідрофільний розчинник використовується ПЕГ 400 замість спирту і пропіленгліколю, які входять до складу композиції, представленої в таблиці 1), практично ідентична до розчинності композиції, представленої в таблиці 1 у тому випадку, коли такою композицією тільки що заповнюють м'які желатинові капсули. З іншого боку, було встановлено, що час розчинності in vitro композиції, представленої в таблиці 2, істотно менше, ніж композиції, представленої в таблиці 1, якщо композицію, представлену в таблиці 1, зберігали в м'яких желатинових капсулах у холодильнику при 4°С протягом 14 місяців. Було встановлено, що самоемульгувальна композиція, представлена в таблиці 2, має дуже високу стабільність при кімнатній температурі, а також при охолодженні, при зберіганні в гідрофільних або ліпофільних м'яких желатинових капсулах у запечатаних під вакуумом пухирцях з ПЕВГ (поліетилен високої густини). На Фіг.6 показаний графік розчинення in vitro типранавіру з композиції, склад якої представлений таблиці 2, розташованої в гідрофільних м'яких желатинових капсулах, що знаходилася в запечатаних під вакуумом пухирцях з ПЕВГ, після зберігання протягом різних періодів часу при різних температурах і/або значеннях відносної вологості. Усі три композиції, результати досліджень яких представлені на графіку, а саме композиція, яку зберігали протягом 3 місяців при 5°С, композиція, яку зберігали при кімнатній температурі (25°С) протягом 3 місяців при відносній вологості 60%, і композиція, яку зберігали при 30°С протягом 3 місяців і відносній вологості 70%, мали практично ідентичні профілі розчинності. На Фіг.7 показаний графік розчинення in vitro типранавіру з композиції, склад якої представлений таблиці 2, розташованої в ліпофільній м'якій желатиновій капсулі, після зберігання протягом різних періодів часу при різних температурах і/або значеннях відносної вологості. Видно, що наведені графіки практично ідентичні до графіків, отриманих для композиції, розташованої в гідрофільних м'яких желатинових капсулах. Композиція, представлена в таблиці 2, розташована в ліпофільних м'яких желатинових капсулах, мала дуже високу стабільність профілю розчинності при зберіганні в запечатаних під вакуумом пухирцях з ПЕВГ протягом 3 місяців при 5°С або при 30°С при відносній вологості 70%. Приклад 1 - Одержання СЕСВЛ-композиції на основі ПЕГ, яка містить типранавір У змішувач вносили 455мг Cremophor EL, 75мг Capmul MCM і 173мг ПЕГ 400 і змішували один з одним (700об/хв), додаючи при цьому 2мг пропілгалату як антиоксиданта. Змішування продовжували доти, поки розчин не ставав прозорим, після чого додавали 15мг Трис (попередньо розчиненого у воді в співвідношенні 1:2). Після додавання типранавіру (250мг) до розчину змішування продовжували при високій швидкості (1600об/хв). Після повного розчинення типранавіру процес змішування припиняли і розчину давали вистоятися для дегазування. Приклад 2 - Біологічна доступність самоемульгувальної композиції на основі ПЕГ, яка містить типранавір Для вивчення in vivo біологічної доступності при пероральному введенні використовували псів породи Бігль. Композицію на основі ПЕГ, яка містить типранавір, представлену в таблиці 2, після внесення в м'які желатинові капсули порівнювали в дослідах на собаках з композицією, яка містить пропіленгліколь/етанол, представленою в таблиці 1. Було встановлено, що біологічна доступність обох композицій є однаковою з погляду статистики. Були проведені додаткові дослідження стабільності композиції, представленої в таблиці 2, розташованої в стандартних м'яких желатинових капсулах. Результати цих досліджень свідчать про те, що композиція за даним винаходом містить меншу кількість домішок і, очевидно, у результаті цього є більш стабільною, ніж композиція, представлена в таблиці 1, у тому випадку, якщо вони знаходяться в стандартних м'яких желатинових капсулах. Крім того, було встановлено, що м'які желатинові капсули, які містять самоемульгувальну композицію за даним винаходом, не стають липкими після зберігання протягом шести місяців при 30°С і відносній вологості 70%. Хоча винахід описаний з посиланням на переважні варіанти здійснення, фахівцям у даній галузі повинно бути очевидно, що можна здійснювати різні зміни і/або модифікації винаходу без відхилення від суті та обсягу винаходу, які визначаються наведеною нижче формулою винаходу. Усі процитовані документи включені повністю в даний опис як посилання.
ДивитисяДодаткова інформація
Назва патенту англійськоюPyranone-based pharmaceutical composition (variants)
Автори англійськоюChen Shirlynn
Назва патенту російськоюФармацевтическая композиция на основе пиранонов (варианты)
Автори російськоюЧен Ширлинн
МПК / Мітки
МПК: A61K 31/4433, A61K 47/34, A61K 31/366, A61K 47/18, A61P 35/02, A61K 47/14, A61P 31/18, A61K 9/48, A61P 37/04, A61K 31/352, A61P 43/00, A61K 9/107
Мітки: фармацевтична, основі, піранонів, композиція, варіанти
Код посилання
<a href="https://ua.patents.su/12-78689-farmacevtichna-kompoziciya-na-osnovi-piranoniv-varianti.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція на основі піранонів (варіанти)</a>
Попередній патент: Пристрій для центрування трубки керування потоком скла та спосіб індикації ступеня концентричності трубки
Наступний патент: Лікарська композиція для інгаляційного застосування у вигляді розчину із сіллю тіотропію
Випадковий патент: Спосіб коригування результатів спектрального аналізу матеріалів дистанційної зйомки грунту