Стерильна ін’єкційна композиція арипіпразолу з контрольованим вивільненням, спосіб її виготовлення та спосіб лікування шизофренії
Номер патенту: 82561
Опубліковано: 25.04.2008
Автори: Матсуда Такакуні, Костанскі Януш В., Нарінгрекар Віджей Х., Неруркар Маной
Формула / Реферат
1. Стерильна ін'єкційна композиція арипіпразолу з контрольованим вивільненням, що після ін'єкції вивільняє арипіпразол протягом щонайменше одного тижня, яка включає:
(a) арипіпразол, що має середній розмір частинок від приблизно 1 до приблизно 10 мкм,
(b) його носій, та
(c) воду для ін'єкції.
2. Композиція за п. 1, де згаданий носій включає один або більше суспензійних агентів.
3. Ін'єкційна композиція арипіпразолу з контрольованим вивільненням, яка при ін'єкції вивільняє арипіпразол протягом щонайменше одного тижня, що включає:
(a) арипіпразол, що має середній розмір частинок від приблизно 1 до приблизно 10 мкм, та
(b) його носій, причому згаданий носій включає:
(1) один або більше суспензійних агентів,
(2) необов'язково один або більше агентів, що збільшують об'єм,
(3) необов'язково один або більше буферних агентів, та
(c) воду для ін'єкції.
4. Композиція за п. 3, що додатково містить агент, що регулює рН.
5. Композиція за п. 3 у формі стерильної суспензії.
6. Композиція за п. 3, розроблена для вивільнення арипіпразолу з контрольованою швидкістю протягом періоду від двох до чотирьох тижнів.
7. Композиція за п. 3 у формі суспензії, де:
(a) арипіпразол присутній у кількості від приблизно 1 до приблизно 40 %,
(b) суспензійний агент присутній у кількості від 0,2 до приблизно 10 %,
(c) агент, що збільшує об'єм, присутній у кількості у діапазоні від приблизно 2 до приблизно 10 %,
(d) буфер присутній у кількості від приблизно 0,02 до приблизно 2 % для регулювання рН суспензії з доведенням її значення від приблизно 6 до приблизно 7,5, причому усі згадані процентні відношення є % відношення вага/об'єм, виходячи з об'єму суспензії.
8. Композиція за п. 3, де суспензійним агентом є карбоксиметилцелюлоза або її натрієва сіль, гідроксипропілцелюлоза, карбоксиметилцелюлоза, гідроксипропілетилцелюлоза, гідроксипропілметилцелюлоза або полівінілпіролідон, агентом, що збільшує об'єм, є маніт, сахароза, мальтоза, лактоза, ксиліт або сорбіт, а буфером є фосфат натрію, фосфат калію або Тріс-буфер.
9. Композиція за п. 3, яка при ін'єкції вивільняє арипіпразол протягом від двох до чотирьох тижнів, що включає:
(a) арипіпразол,
(b) карбоксиметилцелюлозу або її натрієву сіль,
(c) маніт,
(d) фосфат натрію для доведення рН до приблизно 7,
(е) необов'язково гідроксид натрію для доведення рН до приблизно 7, та
(f) воду для ін'єкції.
10. Композиція за п. 9, що включає:
арипіпразол
100 мг
200 мг
400 мг
карбоксиметилцелюлоза
9 мг
9 мг
9 мг
маніт
45 мг
45 мг
45 мг
фосфат натрію
0,8 мг
0,8 мг
0,8 мг
гідроксид натрію
у кількості, достатній для доведення рН до 7
у кількості, достатній для доведення рН до 7
у кількості, достатній для доведення рН до 7
вода для ін'єкції
у кількості, достатній для доведення до 1 мл
у кількості, достатній для доведення до 1 мл
у кількості, достатній для доведення до 1 мл
11. Композиція за п. 1, що забезпечує доставку від приблизно 0,1 до приблизно 600 мг арипіпразолу на 1 мл суспензії.
12. Композиція за п. 1, де арипіпразол знаходиться в ангідридній формі або у формі моногідрату.
13. Композиція за п. 12, де арипіпразол знаходиться у формі кристалів арипіпразолу ангідриду В або арипіпразолу гідрату А.
14. Стерильна ліофілізована композиція арипіпразолу з контрольованим вивільненням, яка включає:
(a) арипіпразол, що має середній розмір частинок від приблизно 1 до приблизно 10 мкм, та
(b) його носій,
яка при змішуванні з водою утворює стерильну ін'єкційну композицію, що при ін'єкції вивільняє арипіпразол протягом щонайменше приблизно двох тижнів.
15. Ліофілізована композиція за п. 14, що має середній розмір частинок у діапазоні від приблизно 1 до приблизно 10 мкм, яка при змішуванні з водою та ін'єкції вивільняє арипіпразол протягом щонайменще приблизно трьох тижнів.
16. Ліофілізована композиція за п. 15, що має середній розмір частинок приблизно 2,5 мкм.
17. Ліофілізована композиція за п. 14, де зазначений носій включає:
(a) один або більше суспензійних агентів,
(b) один або більше агентів, що збільшують об'єм, та
(c) один або більше буферних агентів.
18. Ліофілізована композиція за п. 17, яка додатково містить агент, що регулює рН.
19. Ліофілізована композиція за п. 17, яка після змішування з водою та ін'єкції вивільняє арипіпразол протягом щонайменше приблизно трьох тижнів, що включає:
(a) арипіпразол,
(b) карбоксиметилцелюлозу або її натрієву сіль,
(c) маніт,
(d) фосфат натрію для доведення рН до приблизно 7, та
(е) необов'язково гідроксид натрію для доведення рН до приблизно 7.
20. Ліофілізована композиція за п. 19, яка після розчинення водою та ін'єкції вивільняє арипіпразол протягом приблизно чотирьох тижнів.
21. Ліофілізована композиція за п. 20, де арипіпразол знаходиться у формі кристалів ангідриду або у формі моногідрату.
22. Спосіб виготовлення стерильної ліофілізованої композиції за п. 14, що включає наступні етапи:
(a) виготовляють стерильну масу арипіпразолу, що має бажаний гранулометричний склад частинок,
(b) виготовляють стерильний носій для стерильної маси арипіпразолу,
(c) об'єднують зазначений стерильний арипіпразол та зазначений стерильний носій для утворення стерильної первинної суспензії, яка включає стерильну суміш твердих частинок,
(d) знижують середній розмір частинок зазначеної стерильної суміші твердих частинок зазначеної стерильної первинної суспензії до розміру у діапазоні від приблизно 1 до приблизно 10 мкм для утворення стерильної кінцевої суспензії, та
(е) ліофілізують зазначену стерильну кінцеву суспензію для утворення ліофілізованої композиції.
23. Спосіб за п. 22, де етап зниження середнього розміру частинок стерильної суміші твердих частинок зазначеної стерильної первинної суспензії виконують із застосуванням вологого розмелу.
24. Спосіб за п. 23, де вологий розмел включає вологий розмел на кульовому млині.
25. Спосіб за п. 22, де зазначений етап ліофілізації виконують охолодженням стерильної кінцевої суспензії до приблизно -40 °С та сушінням зазначеної охолодженої стерильної кінцевої суспензії при температурі нижче приблизно 0 °С для утворення ліофілізованого арипіпразолу у формі його моногідрату.
26. Спосіб за п. 22, де етап ліофілізації стерильної кінцевої суспензії виконують у три фази: (1) фаза заморожування, яка включає охолодження стерильної кінцевої суспензії при приблизно -40 °С, (2) фаза первинного сушіння, яку виконують при температурі приблизно нижче 0 °С, та (3) фаза вторинного сушіння, яку здійснюють при температурі приблизно вище 0 °С, для утворення арипіпразолу у формі ангідриду.
27. Спосіб лікування шизофренії, який включає введення пацієнту, що потребує лікування, композиції за п. 3.
28. Спосіб за п. 27, де композиція вводиться внутрішньом'язово або підшкірно.
Текст
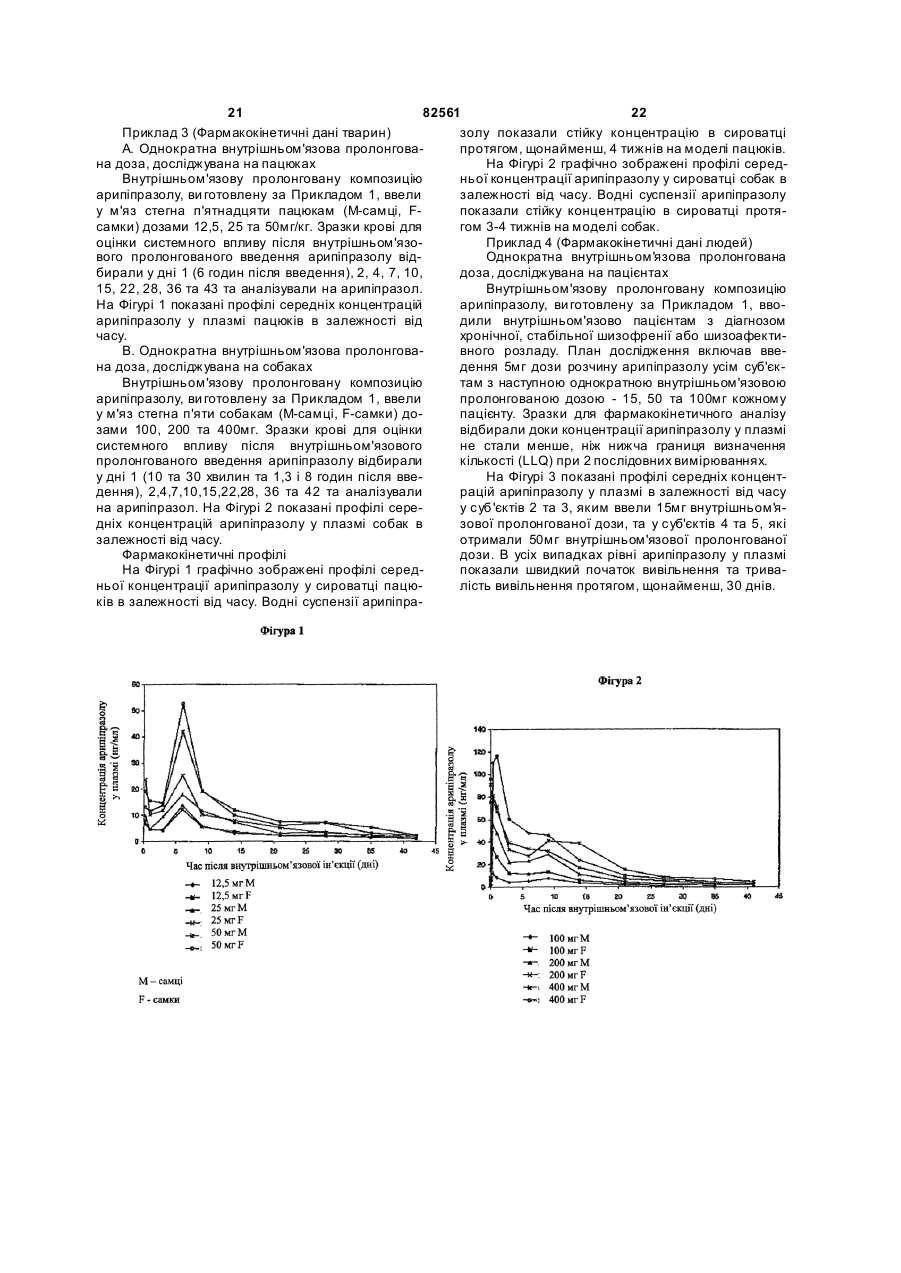
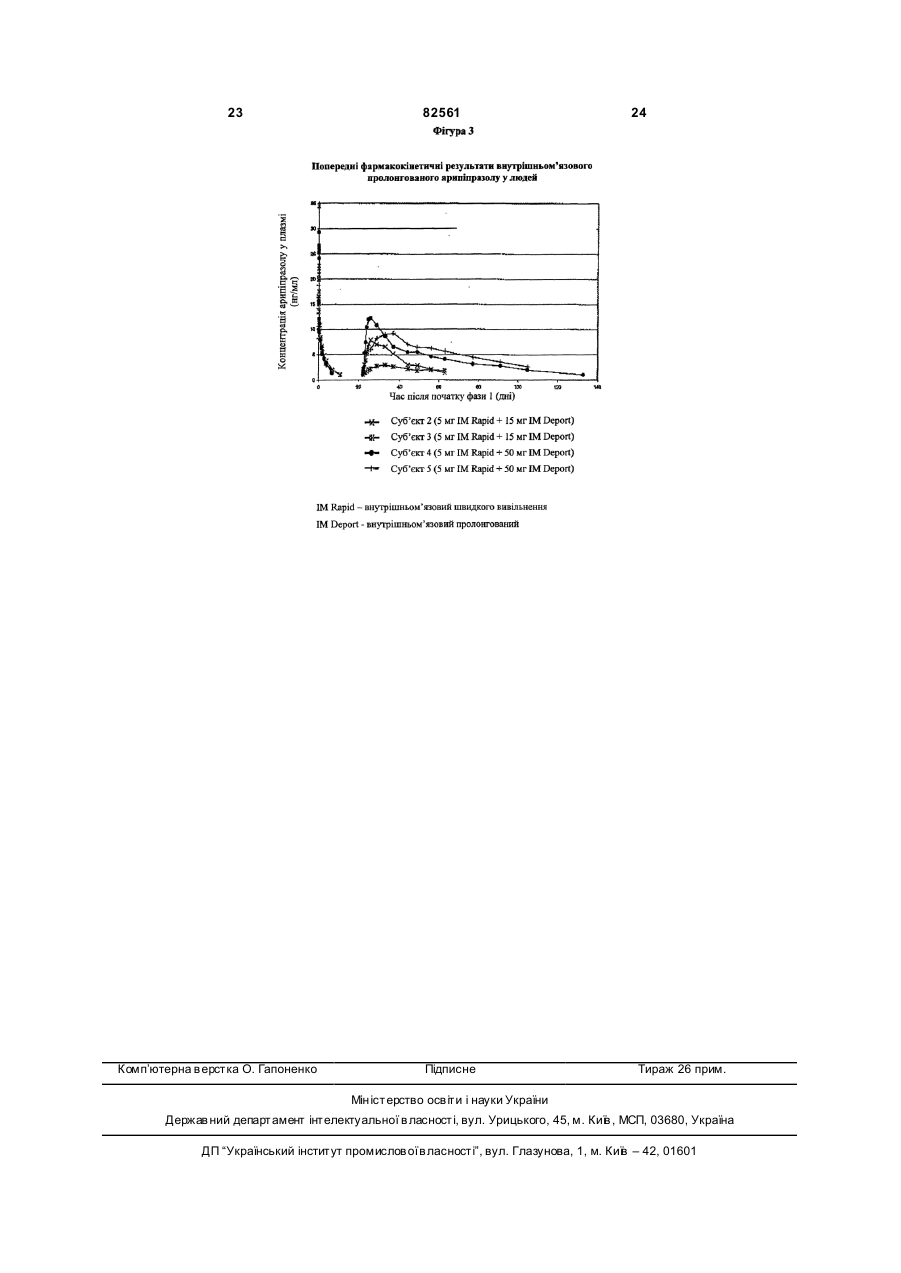
1. Стерильна ін'єкційна композиція арипіпразолу з контрольованим вивільненням, що після ін'єкції вивільняє арипіпразол протягом щонайменше одного тижня, яка включає: (a) арипіпразол, що має середній розмір частинок від приблизно 1 до приблизно 10 мкм, (b) його носій, та (c) воду для ін'єкції. 2. Композиція за п. 1, де згаданий носій включає один або більше суспензійних агентів. 3. Ін'єкційна композиція арипіпразолу з контрольованим вивільненням, яка при ін'єкції вивільняє арипіпразол протягом щонайменше одного тижня, що включає: (a) арипіпразол, що має середній розмір частинок від приблизно 1 до приблизно 10 мкм, та (b) його носій, причому згаданий носій включає: (1) один або більше суспензійних агентів, (2) необов'язково один або більше агентів, що збільшують об'єм, (3) необов'язково один або більше буферних агентів, та (c) воду для ін'єкції. 4. Композиція за п. 3, що додатково містить агент, що регулює рН. 2 (19) 1 3 арипіпразол карбоксиметилцелюлоза маніт фосфа т натрію гідроксид натрію вода для ін'єкції 82561 100 мг 9 мг 45 мг 0,8 мг у кількості, достатній для доведення рН до 7 у кількості, достатній для доведення до 1 мл 11. Композиція за п. 1, що забезпечує доставку від приблизно 0,1 до приблизно 600 мг арипіпразолу на 1 мл суспензії. 12. Композиція за п. 1, де арипіпразол знаходиться в ангідридній формі або у формі моногідрату. 13. Композиція за п. 12, де арипіпразол знаходиться у формі кристалів арипіпразолу ангідриду В або арипіпразолу гідрату А. 14. Стерильна ліофілізована композиція арипіпразолу з контрольованим вивільненням, яка включає: (a) арипіпразол, що має середній розмір частинок від приблизно 1 до приблизно 10 мкм, та (b) його носій, яка при змішуванні з водою утворює стерильну ін'єкційну композицію, що при ін'єкції вивільняє арипіпразол протягом щонайменше приблизно двох тижнів. 15. Ліофілізована композиція за п. 14, що має середній розмір частинок у діапазоні від приблизно 1 до приблизно 10 мкм, яка при змішуванні з водою та ін'єкції вивільняє арипіпразол протягом щонайменще приблизно трьох тижнів. 16. Ліофілізована композиція за п. 15, що має середній розмір частинок приблизно 2,5 мкм. 17. Ліофілізована композиція за п. 14, де зазначений носій включає: (a) один або більше суспензійних агентів, (b) один або більше агентів, що збільшують об'єм, та (c) один або більше буферних а гентів. 18. Ліофілізована композиція за п. 17, яка додатково містить агент, що регулює рН. 19. Ліофілізована композиція за п. 17, яка після змішування з водою та ін'єкції вивільняє арипіпразол протягом щонайменше приблизно трьох тижнів, що включає: (a) арипіпразол, (b) карбоксиметилцелюлозу або її натрієву сіль, (c) маніт, (d) фосфат натрію для доведення рН до приблизно 7, та (е) необов'язково гідроксид натрію для доведення рН до приблизно 7. 20. Ліофілізована композиція за п. 19, яка після розчинення водою та ін'єкції вивільняє арипіпразол протягом приблизно чотирьох тижнів. 4 200 мг 9 мг 45 мг 0,8 мг у кількості, достатній для доведення рН до 7 400 мг 9 мг 45 мг 0,8 мг у кількості, достатній для доведення рН до 7 у кількості, достатній для доведення до 1 мл у кількості, достатній для доведення до 1 мл 21. Ліофілізована композиція за п. 20, де арипіпразол знаходиться у формі кристалів ангідриду або у формі моногідрату. 22. Спосіб виготовлення стерильної ліофілізованої композиції за п. 14, що включає наступні етапи: (a) виготовляють стерильну масу арипіпразолу, що має бажаний гранулометричний склад частинок, (b) виготовляють стерильний носій для стерильної маси арипіпразолу, (c) об'єднують зазначений стерильний арипіпразол та зазначений стерильний носій для утворення стерильної первинної суспензії, яка включає стерильну суміш твердих частинок, (d) знижують середній розмір частинок зазначеної стерильної суміші твердих частинок зазначеної стерильної первинної суспензії до розміру у діапазоні від приблизно 1 до приблизно 10 мкм для утворення стерильної кінцевої суспензії, та (е) ліофілізують зазначену стерильну кінцеву суспензію для утворення ліофілізованої композиції. 23. Спосіб за п. 22, де етап зниження середнього розміру частинок стерильної суміші твердих частинок зазначеної стерильної первинної суспензії виконують із застосуванням вологого розмелу. 24. Спосіб за п. 23, де вологий розмел включає вологий розмел на кульовому млині. 25. Спосіб за п. 22, де зазначений етап ліофілізації виконують охолодженням стерильної кінцевої суспензії до приблизно -40 °С та сушінням зазначеної охолодженої стерильної кінцевої суспензії при температурі нижче приблизно 0 °С для утворення ліофілізованого арипіпразолу у формі його моногідрату. 26. Спосіб за п. 22, де етап ліофілізації стерильної кінцевої суспензії виконують у три фази: (1) фаза заморожування, яка включає охолодження стерильної кінцевої суспензії при приблизно -40 °С, (2) фаза первинного сушіння, яку виконують при температурі приблизно нижче 0 °С, та (3) фаза вторинного сушіння, яку здійснюють при температурі приблизно вище 0 °С, для утворення арипіпразолу у формі ангідриду. 27. Спосіб лікування шизофренії, який включає введення пацієнту, що потребує лікування, композиції за п. 3. 28. Спосіб за п. 27, де композиція вводиться внутрішньом'язово або підшкірно. 5 82561 Дана заявка заявляє пріоритет по заявці на [патент США №60/513618], повний опис якої включений у даний документ у вигляді посилання. Даний винахід стосується стерильної ліофілізованої композиції арипіпразолу з контрольованим вивільненням, ін'єкційної композиції, що містить стерильний ліофілізований арипіпразол та вивільняє арипіпразол протягом, щонайменш, одного тижня, способу виготовлення вищезгаданої композиції, способу лікування шизофренії та пов'язаних з нею розладів з використанням вищезгаданої композиції. У [патенті США №5006528 Oshiro та інші] розкривають 7-[(4-фенілпіперазин)бутокси]карбостирили, які включають арипіпразол, як антагоністи допамінергічних нейротрансмітерів. Арипіпразол, який має структур у , є атиповим антипсихотичним агентом, корисним у лікуванні шизофренії. Він має низьку розчинність у воді (
ДивитисяДодаткова інформація
Назва патенту англійськоюControlled release sterile aripiprazole formulation for injections, method for preparing aripiprazole formulation, and method for treating schizophrenia
Автори англійськоюKostanski Janus V., Matsuda Takakuni
Назва патенту російськоюСтерильная инъекционная композиция арипипразола с контролируемым высвобождением, способ ее изготовления и способ лечения шизофрении
Автори російськоюКостански Януш В., Матсуда Такакуни
МПК / Мітки
МПК: A61P 25/18, A61K 31/496, A61K 47/26, A61K 47/38, A61K 9/19
Мітки: вивільненням, шизофренії, контрольованим, виготовлення, композиція, аріпіпразолу, лікування, ін'єкційна, спосіб, стерильна
Код посилання
<a href="https://ua.patents.su/12-82561-sterilna-inehkcijjna-kompoziciya-aripiprazolu-z-kontrolovanim-vivilnennyam-sposib-vigotovlennya-ta-sposib-likuvannya-shizofreni.html" target="_blank" rel="follow" title="База патентів України">Стерильна ін’єкційна композиція арипіпразолу з контрольованим вивільненням, спосіб її виготовлення та спосіб лікування шизофренії</a>
Попередній патент: Пристрій для видобування високов`язкої нафти
Наступний патент: Керамічна стінова панель каркасного будинку і спосіб монтажу каркасного будинку з використанням цих панелей
Випадковий патент: Броньований транспортний засіб для підрозділів з охорони громадського порядку