Дозована лікарська форма у вигляді таблетки або пелети для перорального введення, яка містить інгібітор pde 4 та полівінілпіролідон, способи її одержання та застосування
Формула / Реферат
1. Дозована лікарська форма у вигляді таблетки або пелети, призначена для перорального введення в організм інгібітора PDE 4, що містить інгібітор PDE 4 разом з полівінілпіролідоном (ПВП) як сполучним й одну або декілька інших прийнятних фармацевтичних допоміжних речовин, у якій інгібітор PDE 4 являє собою сполуку, вибрану з групи сполук формули (І)
 ,
,
у якій R1 означає дифторометоксигрупу,
R2 означає циклопропілметоксигрупу і
R3 означає 3,5-дихлоропірид-4-ил,
солі цієї сполуки та N-оксид піридину та його солі,
де згадана дозована лікарська форма з негайним вивільненням інгібітора PDE 4.
2. Дозована лікарська форма за п. 1, у якій інгібітор PDE 4 являє собою N-(3,5-дихлоропірид-4-ил)-3-циклопропілметокси-4-дифторометоксибензамід (рофлуміласт).
3. Дозована лікарська форма за п. 1, у якій інгібітор PDE 4 являє собою N-оксид піридину сполуки формули (І).
4. Дозована лікарська форма за п. 2, що містить рофлуміласт у разовій дозі від 0,01 мг до 5 мг, від 0,05 мг до 2,5 мг рофлуміласту або від 0,1 мг до 0,5 мг рофлуміласту.
5. Дозована лікарська форма за п. 1, у якій вміст у масових відсотках в перерахунку на масу остаточної дозованої лікарської форми ПВП становить від 1 до 5 %.
6. Дозована лікарська форма за п. 1, у якій вміст у масових відсотках в перерахунку на масу остаточної дозованої лікарської форми ПВП становить від 2 до 3 %.
7. Дозована лікарська форма за п. 1, у якій ПВП вибирають з групи, що містить колідон 25 з молекулярною масою 28000-34000, колідон 30 з молекулярною масою 44000-54000 та колідон 90 F з молекулярною масою 1000000-1500000.
8. Дозована лікарська форма за п. 1, у якій фармацевтичні допоміжні речовини являють собою допоміжні речовини з групи наповнювачів, додаткових сполучних, розпушувачів для таблеток, змащувальних речовин або антиадгезивів, коригентів, буферних речовин, консервантів, барвників та емульгаторів.
9. Дозована лікарська форма за п. 1, у якій вміст у масових відсотках в перерахунку на масу остаточної дозованої лікарської форми сполучного (ПВП та, при необхідності, інші сполучні) становить від 0,5 до 20 %.
10. Дозована лікарська форма за п. 8, яка являє собою таблетку, та де вміст у масових відсотках в перерахунку на масу остаточної дозованої лікарської форми наповнювача становить від 40 до 99 %.
11. Дозована лікарська форма за п. 8, у якій наповнювач вибирають з групи: карбонат кальцію, карбонат натрію, цукроспирти, такі як маніт, сорбіт, ксиліт або мальтит, крохмалі, такі як кукурудзяний крохмаль, картопляний крохмаль та крохмаль пшениці, мікрокристалічна целюлоза, сахариди, такі як глюкоза, лактоза, моногідрат лактози, левулоза, сахароза, декстроза та їх суміші.
12. Дозована лікарська форма за п. 11, у якій наповнювач вибирають з групи: кукурудзяний крохмаль, мікрокристалічна целюлоза, лактоза та їх суміші.
13. Дозована лікарська форма за п. 8, у якій змащувальні речовини або антиадгезиви вибирають з групи: стеарилфумарат натрію, стеарат магнію, стеарат кальцію, стеаринова кислота, тальк та колоїдний безводний діоксид кремнію.
14. Дозована лікарська форма за п. 1, яка являє собою таблетку.
15. Дозована лікарська форма за п. 14, у якій фармацевтичні допоміжні речовини являють собою щонайменше один наповнювач та щонайменше одну змащувальну речовину або антиадгезив.
16. Дозована лікарська форма за п. 14, яка містить:
рофлуміласт 0,125 мг
моногідрат лактози 49,660 мг
кукурудзяний крохмаль 13,390 мг
полівідон К90 1,300 мг
стеарат магнію (рослинний) 0,650 мг.
17. Дозована лікарська форма за п. 14, яка містить:
рофлуміласт 0,250 мг
моногідрат лактози 49,660 мг
кукурудзяний крохмаль 13,390 мг
полівідон К90 1,300 мг
стеарат магнію (рослинний) 0,650 мг.
18. Дозована лікарська форма за п. 14, яка містить:
рофлуміласт 0,500 мг
моногідрат лактози 49,660 мг
кукурудзяний крохмаль 13,390 мг
полівідон К90 1,300 мг
стеарат магнію (рослинний) 0,650 мг.
19. Дозована лікарська форма за п. 1, яка містить твердий розчин інгібітора PDE 4 в сполучному ПВП як носії.
20. Дозована лікарська форма за п. 1, у якій твердий розчин являє собою твердий розчин з аморфною структурою, у якій інгібітор PDE 4 присутній у вигляді молекулярної дисперсії в матеріалі носія.
21. Спосіб одержання дозованої лікарської форми за п. 1, який полягає в тому, що (а) одержують суміш інгібітора PDE 4 формули (І) за п. 1 та фармацевтичних і допоміжних речовин і (б) отриману на стадії (а) суміш гранулюють з водним розчином ПВП.
22. Спосіб за п. 21, який додатково включає висушування гранул та, необов'язково, домішування інших фармацевтичних допоміжних речовин, змішування з антиадгезивом та пресування в таблетувальному пресі.
23. Спосіб за п. 21, який додатково включає переробку вологих продуктів, отриманих після гранулювання, в пелети.
24. Спосіб за п. 21, в якому процес гранулювання здійснюють в грануляторі з псевдорозрідженим шаром у відповідних умовах.
25. Спосіб за п. 21, який полягає в тому, що (а) інгібітор PDE 4 домішують до інших фармацевтичних допоміжних речовин у вигляді тритурації з фармацевтичними допоміжними речовинами.
26. Спосіб за п. 25, в якому тритурацію одержують подрібненням інгібітора PDE 4 разом з фармацевтичними допоміжними речовинами.
27. Спосіб за пп. 25 або 26, в якому фармацевтична допоміжна речовина являє собою наповнювач.
28. Спосіб за п. 21, який включає гранулювання суміші (а) інгібітора PDE 4 формули (І) за п. 1 або тритурації інгібітора PDE 4 формули (І) за п. 1 з кукурудзяним крохмалем, (b) кукурудзяного крохмалю та (с) моногідрату лактози з водним розчином ПВП, висушування гранул, змішування гранул з антиадгезивом та пресування в таблетувальному пресі.
29. Спосіб за п. 21, який включає гранулювання суміші (а) інгібітора PDE 4 формули (І) за п. 1 або тритурації інгібітора PDE 4 формули (І) за п. 1 з кукурудзяним крохмалем, (b) кукурудзяного крохмалю, (с) мікрокристалічної целюлози та (d) натрійкарбоксиметилкрохмалю з водним розчином ПВП, висушування гранул, змішування гранул з антиадгезивом та пресування в таблетувальному пресі.
30. Спосіб одержання дозованої лікарської форми за п. 1, який полягає в тому, що (а) одержують суміш фармацевтичних допоміжних речовин і (б) отриману на стадії (а) суміш гранулюють із суспензією інгібітора PDE 4 формули (І) за п. 1 у водному розчині ПВП.
31. Спосіб за п. 30, який включає гранулювання суміші кукурудзяного крохмалю та моногідрату лактози з суспензією інгібітора PDE 4 формули (І) за п. 1 у водному розчині ПВП, висушування гранул, змішування гранул з антиадгезивом та пресування в таблетувальному пресі.
32. Спосіб одержання дозованої лікарської форми за п. 1, який полягає в тому, що одержують твердий розчин ПВП і інгібітора PDE 4.
33. Спосіб за п. 32, в якому твердий розчин являє собою твердий розчин з аморфною структурою, у якій інгібітор PDE 4 формули (І) за п. 1 присутній у вигляді молекулярної дисперсії в ПВП.
34. Спосіб за п. 32, у якому твердий розчин виготовляють методом, що оснований на застосуванні розчинника, який полягає в розчиненні ПВП, інгібітора PDE 4 та, за необхідності, інших фармацевтичних допоміжних речовин у прийнятному розчиннику, з наступним видаленням розчинника шляхом розпилювального висушування, звичайного висушування, вакуумного висушування або висушування виморожуванням.
35. Спосіб за п. 32, у якому твердий розчин виготовляють методом змішування, де інгібітор PDE 4 та, за необхідності, інші фармацевтичні допоміжні речовини інтенсивно перемішують разом з ПВП.
36. Застосування сполуки формули (І) за п. 1 у виробництві дозованої лікарської форми за п. 1 для лікування або профілактики захворювання, яке розцінюється як таке, що можна вилікувати або попередити за допомогою інгібіторів PDE 4.
37. Застосування за п. 36, де захворювання вибирають з групи: астма або обструкції дихальних шляхів.
38. Застосування за п. 37, де захворювання являє собою ХОЗЛ (хронічне обструктивне захворювання легень).
Текст
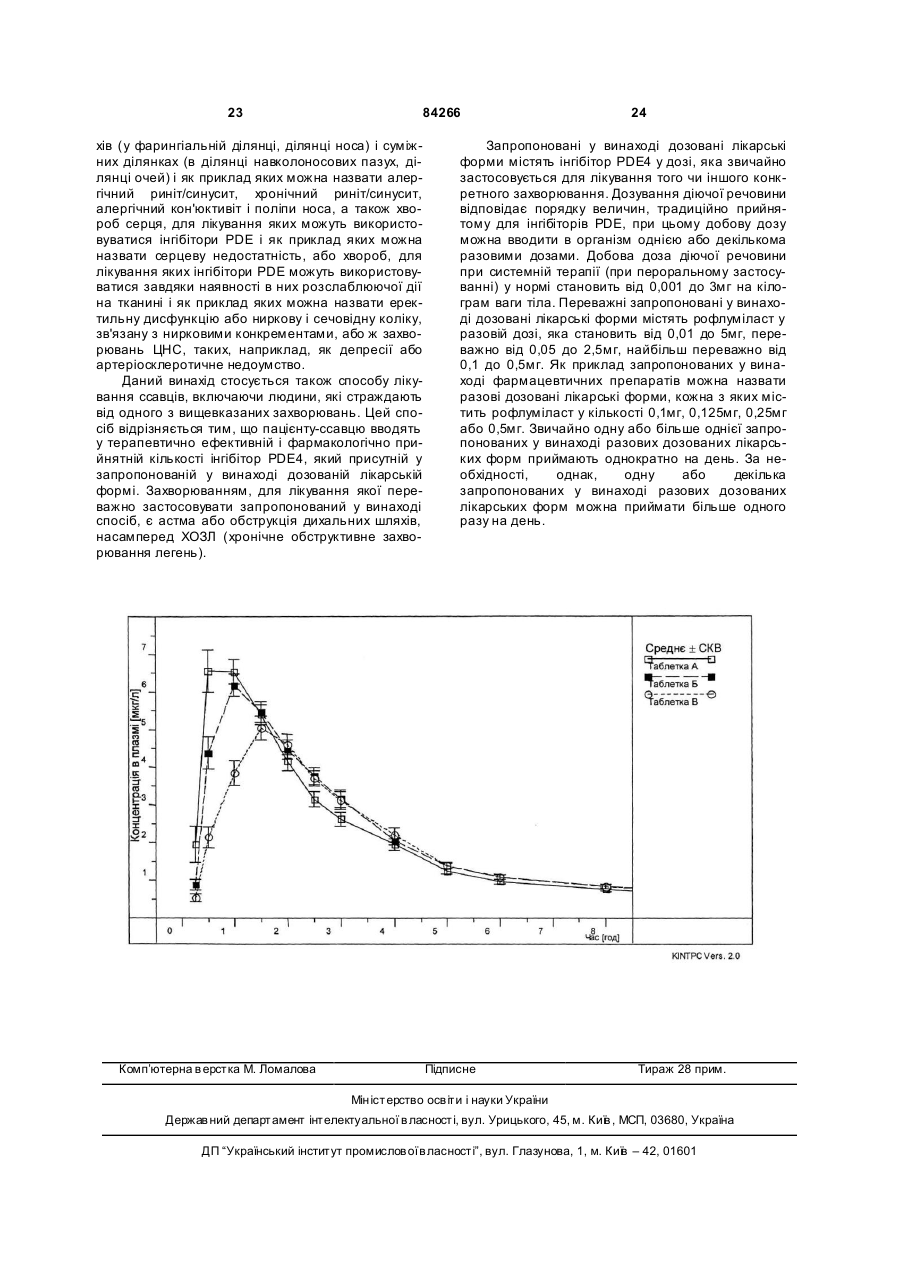
1. Дозована лікарська форма у вигляді таблетки або пелети, призначена для перорального введення в організм інгібітора PDE 4, що містить інгібітор PDE 4 разом з полівінілпіролідоном (ПВП) як сполучним й одну або декілька інших прийнятних фармацевтичних допоміжних речовин, у якій інгібітор PDE 4 являє собою сполуку, вибрану з гр упи сполук формули (І) R1 H C2 2 (19) 1 3 84266 11. Дозована лікарська форма за п. 8, у якій наповнювач вибирають з групи: карбонат кальцію, карбонат натрію, цукроспирти, такі як маніт, сорбіт, ксиліт або мальтит, крохмалі, такі як кукурудзяний крохмаль, картопляний крохмаль та крохмаль пшениці, мікрокристалічна целюлоза, сахариди, такі як глюкоза, лактоза, моногідрат лактози, левулоза, сахароза, декстроза та їх суміші. 12. Дозована лікарська форма за п. 11, у якій наповнювач вибирають з групи: кукурудзяний крохмаль, мікрокристалічна целюлоза, лактоза та їх суміші. 13. Дозована лікарська форма за п. 8, у якій змащувальні речовини або антиадгезиви вибирають з групи: стеарилфумарат натрію, стеарат магнію, стеарат кальцію, стеаринова кислота, тальк та колоїдний безводний діоксид кремнію. 14. Дозована лікарська форма за п. 1, яка являє собою таблетку. 15. Дозована лікарська форма за п. 14, у якій фармацевтичні допоміжні речовини являють собою щонайменше один наповнювач та щонайменше одну змащувальну речовину або антиадгезив. 16. Дозована лікарська форма за п. 14, яка містить: рофлуміласт 0,125мг моногідрат лактози 49,660мг кукурудзяний крохмаль 13,390мг полівідон К90 1,300мг стеарат магнію (рослинний) 0,650мг. 17. Дозована лікарська форма за п. 14, яка містить: рофлуміласт 0,250мг моногідрат лактози 49,660мг кукурудзяний крохмаль 13,390мг полівідон К90 1,300мг стеарат магнію (рослинний) 0,650мг. 18. Дозована лікарська форма за п. 14, яка містить: рофлуміласт 0,500мг моногідрат лактози 49,660мг кукурудзяний крохмаль 13,390мг полівідон К90 1,300мг стеарат магнію (рослинний) 0,650мг. 19. Дозована лікарська форма за п. 1, яка містить твердий розчин інгібітора PDE 4 в сполучному ПВП як носії. 20. Дозована лікарська форма за п. 1, у якій твердий розчин являє собою твердий розчин з аморфною структурою, у якій інгібітор PDE 4 присутній у вигляді молекулярної дисперсії в матеріалі носія. 21. Спосіб одержання дозованої лікарської форми за п. 1, який полягає в тому, що (а) одержують суміш інгібітора PDE 4 формули (І) за п. 1 та фармацевтичних і допоміжних речовин і (б) отриману на стадії (а) суміш гранулюють з водним розчином ПВП. 22. Спосіб за п. 21, який додатково включає висушування гранул та, необов'язково, домішування інших фармацевтичних допоміжних речовин, змішування з антиадгезивом та пресування в таблетувальному пресі. 4 23. Спосіб за п. 21, який додатково включає переробку вологих продуктів, отриманих після гранулювання, в пелети. 24. Спосіб за п. 21, в якому процес гранулювання здійснюють в грануляторі з псевдорозрідженим шаром у відповідних умовах. 25. Спосіб за п. 21, який полягає в тому, що (а) інгібітор PDE 4 домішують до інших фармацевтичних допоміжних речовин у вигляді тритурації з фармацевтичними допоміжними речовинами. 26. Спосіб за п. 25, в якому тритурацію одержують подрібненням інгібітора PDE 4 разом з фармацевтичними допоміжними речовинами. 27. Спосіб за пп. 25 або 26, в якому фармацевтична допоміжна речовина являє собою наповнювач. 28. Спосіб за п. 21, який включає гранулювання суміші (а) інгібітора PDE 4 формули (І) за п. 1 або тритурації інгібітора PDE 4 формули (І) за п. 1 з кукурудзяним крохмалем, (b) кукурудзяного крохмалю та (с) моногідрату лактози з водним розчином ПВП, висушування гранул, змішування гранул з антиадгезивом та пресування в таблетувальному пресі. 29. Спосіб за п. 21, який включає гранулювання суміші (а) інгібітора PDE 4 формули (І) за п. 1 або тритурації інгібітора PDE 4 формули (І) за п. 1 з кукурудзяним крохмалем, (b) кукурудзяного крохмалю, (с) мікрокристалічної целюлози та (d) натрійкарбоксиметилкрохмалю з водним розчином ПВП, висушування гранул, змішування гранул з антиадгезивом та пресування в таблетувальному пресі. 30. Спосіб одержання дозованої лікарської форми за п. 1, який полягає в тому, що (а) одержують суміш фармацевтичних допоміжних речовин і (б) отриману на стадії (а) суміш гранулюють із суспензією інгібітора PDE 4 формули (І) за п. 1 у водному розчині ПВП. 31. Спосіб за п. 30, який включає гранулювання суміші кукурудзяного крохмалю та моногідрату лактози з суспензією інгібітора PDE 4 формули (І) за п. 1 у водному розчині ПВП, висушування гранул, змішування гранул з антиадгезивом та пресування в таблетувальному пресі. 32. Спосіб одержання дозованої лікарської форми за п. 1, який полягає втому, що одержують твердий розчин ПВП і інгібітора PDE 4. 33. Спосіб за п. 32, в якому твердий розчин являє собою твердий розчин з аморфною структурою, у якій інгібітор PDE 4 формули (І) за п. 1 присутній у вигляді молекулярної дисперсії в ПВП. 34. Спосіб за п. 32, у якому твердий розчин виготовляють методом, що оснований на застосуванні розчинника, який полягає в розчиненні ПВП, інгібітора PDE 4 та, за необхідності, інших фармацевтичних допоміжних речовин у прийнятному розчиннику, з наступним видаленням розчинника шляхом розпилювального висушування, звичайного висушування, вакуумного висушування або висушування виморожуванням. 35. Спосіб за п. 32, у якому твердий розчин виготовляють методом змішування, де інгібітор PDE 4 та, за необхідності, інші фармацевтичні допоміжні речовини інтенсивно перемішують разом з ПВП. 5 84266 6 36. Застосування сполуки формули (І) за п. 1 у виробництві дозованої лікарської форми за п. 1 для лікування або профілактики захворювання, яке розцінюється як таке, що можна вилікувати або попередити за допомогою інгібіторів PDE 4. 37. Застосування за п. 36, де захворювання вибирають з групи: астма або обструкції дихальних шляхів. 38. Застосування за п. 37, де захворювання являє собою ХОЗЛ (хронічне обструктивне захворювання легень). Даний винахід стосується галузі фармацевтичної те хнології і, зокрема, дозованої лікарської форми у вигляді таблетки або пелети, призначеної для перорального введення в організм інгібітора PDE4 як діючої речовини при лікуванні таких захворювань, як астма або обструкція дихальних шляхів. Винахід стосується також способу одержання такої дозованої лікарської форми. Інгібітори циклонуклеотид-фосфодіестерази (PDE) (насамперед типу 4) на сьогоднішній день становлять особливий інтерес як нове покоління діючих речовин, придатних для лікування запальних захворювань, насамперед запалень дихальних шляхів, зокрема астми або обструкції дихальних шля хів (наприклад хронічного обструктивного захворювання легень (ХОЗЛ)). На даний час багато інгібіторів PDE 4 успішно проходять клінічні випробування. У [заявках WO 00/50011 і WO 01/32165], які стосуються дозованих лікарських форм із контрольованим або уповільненим вивільненням інгібітора PDE 4, відзначається, що деякі інгібітори PDE 4, такі як Ariflo® (міжнародна непатентована назва (МНН) циломіласт), при їх надходженні в організм у високих дозах несподівано можуть виявляти побічну дію на ЦНС. У вказаних [заявках WO 00/50011 і WO 01/32165] даний факт розглядається як особливий ризик, зв'язаний із застосуванням дозованих лікарських форм із негайним вивільненням діючої речовини, і тому інгібітор PDE4 Ariflo® (МНН циломіласт) пропонується вводити в організм у дозованих лікарських формах з контрольованим або уповільненим його вивільненням. У [патенті US 5286494] запропонована дозована лікарська форма для слабкорозчинного інгібітора PDE4 роліпраму з контрольованим або уповільненим його вивільненням. Однак процес виготовлення дозованих лікарських форм із контрольованим або уповільненим вивільненням слабкорозчинних діючих речовин може бути пов'язаний із складностями технічного і технологічного характеру, про що зазначається, наприклад, у вказаному [патенті US 5286494]. Діючі речовини з класу інгібіторів PDE4 можуть залежно від їх хімічної структури мати низьку розчинність у воді і водних системах. Так, зокрема, встановлена розчинність у воді інгібітора PDE4 N(3,5-дихлорпірид-4-іл)-3-циклопропілметокси-4дифторметоксибензаміду (МНН рофлуміласт), який описаний у [WO 95/01338], становить лише 0,53мг/л при 21°С. Однак біодоступність лікарської речовини значно залежить від швидкості її вивільнення з фармацевтичної лікарської форми. Чим вище швидкість вивільнення лікарської речовини з препарату і її розчинення, тим швидше відбувається її всмоктування. Отже, біодоступність слабкорозчинних у воді лікарських речовин часто обмежена їх розчинністю або швидкістю розчинення. Цим фактором пояснюються значні труднощі, пов'язані з виготовленням відповідних дозованих лікарських форм. В основу даного винаходу була покладена задача запропонувати дозовану лікарську форму для перорального введення в організм слабкорозчинних інгібіторів PDE4, яка допускала б можливість її виготовлення способом, не зв'язаним із значними складностями технічного і технологічного характеру, і яка дозволяла б врахувати низьку розчинність слабкорозчинного інгібітора PDE4 і забезпечувала б швидку, прийнятну біодоступність слабкорозчинного інгібітора PDE4 і тим самим підвищення його концентрації в сироватці до рівня, необхідного для швидкого досягнення необхідного фармакологічного ефекту без прояву побічних дій. Відповідно до винаходу несподівано було встановлено, що у відношенні дозованої лікарської форми для перорального введення в організм слабкорозчинного інгібітора PDE4 вказану задачу вдається вирішити за рахунок використання в ній полівінілпіролідону (ПВП) як сполучного. У порівнянні з дозованими лікарськими формами, у яких ПВП не використовується як сполучне, запропонована у винаході дозована лікарська форма має явно більш високі фармакокінетичні властивості. Так, зокрема, з погляду біодоступності слабкорозчинного інгібітора PDE4 при застосуванні запропонованих у винаході дозованих лікарських форм спостерігається більш швидке всмоктування лікарської речовини і тим самим більш швидкий прояв фармакологічного ефекту в порівнянні з дозованими лікарськими формами без ПВП. Запропонована у винаході дозована лікарська форма для перорального застосування переважно являє собою тверду дозовану лікарську форму у вигляді таблетки або пелети. Переважна при цьому тверда дозована лікарська і форма для перорального застосування з негайним вивільненням діючої речовини. Відповідно до цього у винаході пропонується дозована лікарська форма у вигляді таблетки або пелети, призначена для перорального введення в організм слабкорозчинного інгібітора PDE4 і яка містить слабкорозчинний інгібітор PDE4 разом з полівінілпіролідоном як сполучне й один або декілька інших прийнятних фармацевтичних допоміжних речовин (ексципієнтів). 7 84266 Слабкорозчинний інгібітор PDE4 відповідно до винаходу переважно являє собою сполуку з групи сполук формули І R1 H N R2 R3 (I) O у якій R1 означає С3-С7циклоалкоксигрупу, С3С7циклоалкілметоксигрупу або бензилоксигрупу, а R2 означає С1-С4алкоксигрупу, яка повністю або частково заміщена фтором, або R1 означає С1-С4алкоксигрупу, яка повністю або частково заміщена фтором, а R2 означає С3-С7циклоалкілметоксигрупу або бензилоксигрупу і R3 означає феніл, піридил, феніл, заміщений замісниками R31, R32 і R33, або піридил, заміщений замісниками R34, R35, R36 і R37, де R31 означає гідроксил, галоген, ціаногрупу, карбоксил, трифторметил, С1-С4алкіл, С1С4алкоксигрупу, С1-С4алкоксикарбоніл, С1С4алкілкарбоніл, С1-С4алкілкарбонілоксигрупу, аміногрупу, моно- або ди-С1-С4алкіламіногрупу або С1-С4алкілкарбоніламіногрупу, R32 означає водень, гідроксил, галоген, аміногруп у, трифторметил, С1-С4алкіл або С1С4алкоксигрупу, R33 означає водень, галоген, С1-С4алкіл або С1-С4алкоксигрупу, R34 означає гідроксил, галоген, ціаногрупу, карбоксил, С1-С4алкіл, С1-С4алкоксигрупу, С1С4алкоксикарбоніл або аміногрупу, R35 означає водень, галоген, аміногрупу або С1-С4алкіл, R36 означає водень або галоген і R37 означає водень або галоген, солі цих сполук і N-оксиди піридинів і їх солі. С3-С7циклоалкоксигрупа являє собою, наприклад, циклопропілоксигрупу, циклобутилоксигрупу, циклопентилоксигрупу, циклогексилоксигрупу і циклогептилоксигрупу, серед яких переважні циклопропілоксигрупа, циклобутилоксигрупа і циклопентилоксигрупа. С3-С7циклоалкілметоксигрупа являє собою, наприклад, циклопропілметоксигрупу, циклобутилметоксигрупу, циклопентилметоксигрупу, циклогексилметоксигрупу і циклогептилметоксигрупу, серед яких переважні циклопропілметоксигрупа, циклобутилметоксигрупа і циклопентилметоксигрупа. Як приклади С 1-С4алкоксигрупи, яка повністю або частково заміщена фтором, можна назвати 1,2,2-трифторетокси-, 2,2,3,3,3пентафторпропокси-, перфторетокси- і, зокрема, 1,1,2,2-тетрафторетокси-, трифторметокси-, 2,2,2трифторетокси- і дифторметоксизалишки. Під галогеном у контексті даного винаходу маються на увазі бром, хлор і фтор. Під С1-С4алкілом маються на увазі алкільні залишки з прямим або розгалуженим ланцюгом, які містять від 1 до 4 атомів вуглецю. Як їх приклади можна назвати бутильні, ізобутильні, втор 8 бутипьпі, трет-бутильні, пропільні, ізопропільні, етильні і метильні залишки. С1-С4алкоксигрупа являє собою залишок, які крім атома кисню містить один з вищевказаних С 1С4алкільних залишків. Як такі приклади можна назвати метокси- і етоксизалишки. С1-С4алкоксикарбоніл являє собою карбонільну гр упу, до якої приєднаний один з вищевказаних С1-С4алкоксизалишків. Як такі приклади можна назвати метоксикарбонільний (СН3О-СО-) і етоксикарбонільний (СН3СН2О-СО-) залишки. С1-С4алкілкарбоніл являє собою карбонільну груп у, до якої приєднаний один з вищевказаних С 1С4алкільних залишків. Як такий приклад можна назвати ацетильний залишок (СН 3СО-). С1-С4алкілкарбонілоксизалишки крім атома кисню містять один з вищевказаних С1С4алкілкарбонільних залишків. Як такий приклад можна назвати ацетоксизалишок (СН3СО-О-). Як приклади моноабо диС1С4алкіламінозалишків можна назвати метиламіно-, диметиламіно- і діетиламінозалишки. Прикладом С 1-С4алкілкарбоніламінозалишку служить ацетиламінозалишок (-NH-CO-СН3). Як приклади фенільних залишків, заміщених замісниками R31, R32 і R33, можна назвати такі залишки, як 2-ацетилфеніл, 2-амінофеніл, 2бромфеніл, 2-хлорфеніл, 2,3-дихлорфеніл, 2,4дихлорфеніл, 4-діетиламіно-2-метил феніл, 4бром-2-трифторметил феніл, 2-карбокси-5хлорфеніл, 3,5-дихлор-2-гідроксифеніл, 2-бром-4карбокси-5-гідроксифеніл, 2,6-дихлорфеніл, 2,5дихлорфеніл, 2,4,6-трихлорфеніл, 2,4,6трифторфеніл, 2,6-дибромфеніл, 2-ціанофеніл, 4ціано-2-фторфеніл, 2-фторфеніл, 2,4дифторфеніл, 2,6-дифторфеніл, 2-хлор-6фтор феніл, 2-гідроксифеніл9 2-гідрокси-4метоксифеніл, 2,4-дигідроксифеніл, 2метоксифеніл, 2,3-диметоксифеніл, 2,4диметоксифеніл, 2,6-диметоксифеніл, 2диметиламінофеніл, 2-метилфеніл, 2-хлор-6метилфеніл, 2,4-диметилфеніл, 2,6-диметилфеніл, 2,3-диметилфеніл, 2-метоксикарбонілфеніл, 2трифторметилфеніл, 2,6-дихлор-4-метоксифеніл, 2,6-дихлор-4-ціанофеніл, 2,6-дихлор-4-амінофеніл, 2,6-дихлор-4-метоксикарбонілфеніл, 4ацетиламіно-2,6-дихлорфеніл і 2,6-дихлор-4етоксикарбонілфеніл. Як приклади піридильних залишків, заміщених замісниками R34, R35, R36 і R37, можна назвати такі залишки, як 3,5-дихлорпірид-4-ил, 2,6діамінопірид-3-ил, 4-амінопірид-3-ил, 3метилпірид-2-ил, 4-метилпірид-2-ил, 5гідроксипірид-2-ил, 4-хлорпірид-3-ил, 3-хлорпірид2-ил, 3-хлорпірид-4-ил, 2-хлорпірид-3-ил, 2,3,5,6тетрафторпірид-4-ил, 3,5-дихлор-2,6-дифторпірид4-ил, 3,5-дибромпірид-2-ил, 3,5-дибромпірид-4-ил, 3,5-дихлорпірид-4-ил, 2,6-дихлорпірид-3-ил, 3,5диметилпірид-4-ил, 3-хлор-2,5,6-трифторпірид-4ил і 2,3,5-трифторпірид-4-ил. До солей, які можуть утворювати сполуки формули І, належать залежно від їх заміщення всі можливі кислотно-адитивні солі, але насамперед усі можливі солі з основами. Особливо при цьому можна назвати фармакологічно прийнятні солі з 9 84266 неорганічними й органічними кислотами і основами, які звичайно використовуються у фармацевтичній технології. Фармакологічно неприйнятні солі, які можуть утворюватися, наприклад, як первинні продукти при одержанні сполук за винаходом в промисловому масштабі, відомими методами переводять або перетворюють у їх фармакологічно прийнятні солі. До відповідних фармакологічно прийнятних солей, по-перше, належать водорозчинні і водонерозчинні кислотно-адитивні солі, утворені, наприклад, з такими кислотами, як соляна кислота, бромистоводнева кислота, фосфорна кислота, азотна кислота, сірчана кислота, оцтова кислота, лимонна кислота, D-глюконова кислота, бензойна кислота, 2-(4-гідроксибензоїл)бензойна кислота, масляна кислота, сульфосаліцилова кислота, малеїнова кислота, лауринова кислота, яблучна кислота, фумарова кислота, янтарна кислота, щавле ва кислота, винна кислота, ембонова кислота, стеаринова кислота, толуолсульфонова кислота, метансульфонова кислота або 1-гідрокси2-нафтойна кислота, при цьому кислоти використовують для солеутворення в еквімолярних кількостях або в кількостях, які відрізняються від них, залежно від того, чи є кислота одно- або багатоосновною, а також залежно від конкретного типу солі, яку потрібно одержати. До відповідних фармакологічно прийнятних солей, по-друге, належать також утворені з основами солі, які є найбільш переважними. Як приклад подібних основних солей можна назвати солі літію, натрію, калію, кальцію, алюмінію, магнію, титану, амонію, меглуміну або гуанідинію, при цьому такі основи також використовують для солеутворення в еквімолярних кількостях або в кількостях, які відрізняються від них. До переважних сполук формули І належать сполуки, у яких R1 означає С3-С5циклоалкоксигрупу, С3С5циклоалкілметоксигрупу або бензилоксигрупу, а R2 означає С1-С4алкоксигрупу, яка повністю або частково заміщена фтором, або R1 означає С1-С4алкоксигрупу, яка повністю або частково заміщена фтором, а R2 означає С3-С5циклоалкілметоксигрупу або бензилоксигрупу і R3 означає феніл, піридил, феніл, заміщений замісниками R31, R32 і R33, або піридил, заміщений замісниками R34, R35, R36 і R37, де R31 означає галоген, ціаногрупу, карбоксил, С1-С4алкіл, С1-С4алкоксигрупу або С 1С4алкоксикарбоніл, R32 означає водень, галоген, С1-С4алкіл або С1-С4алкоксигрупу, R33 означає водень, галоген, С1-С4алкіл або С1-С4алкоксигрупу, R34 означає галоген або С1-С4алкіл, R35 означає водень або галоген, R36 означає водень або галоген і R37 означає водень або галоген, солі цих сполук, а також N-оксиди піридинів і їх солі. До більш переважних сполук формули І належать сполуки, у яких 10 R1означає С3-С5циклоалкоксигрупу, С3С5циклоалкілметоксигрупу або бензилоксигрупу, а R2 означає С1-С4алкоксигрупу, яка повністю або частково заміщена фтором, або R1 означає С1-С4алкоксигрупу, яка повністю або частково заміщена фтором, а R2 означає С3-С5циклоалкілметоксигрупу або бензилоксигрупу і R3 означає 2-бромфеніл, 2,6-дихлор-4етоксикарбонілфеніл, 2,6-диметоксифеніл, 4ціано-2-фторфеніл, 2,4,6-трифторфеніл, 2-хлор-6метилфеніл, 2,6-диметилфеніл, 2,6-дифторфеніл, 2,6-дихлорфеніл, 3,5-дихлорпірид-4-ил, 3метилпірид-2-ил, 2-хлорпірид-3-ил, 3,5дибромпірид-2-ил, 2,3,5,6-тетрафторпірид-4-ил, 3хлор-2,5,6-трифторпірид-4-ил, 3,5-дихлор-2,6дифторпірид-4-ил або 2,6-дихлорпірид-3-ил, солі цих сполук, а також N-оксиди піридинів і їх солі. До найбільш переважних сполук формули І належать сполуки, у яких R1 означає дифторметоксигрупу, R2 означає циклопропілметоксигрупу і R3 означає 2-бромфеніл, 2,6-дихлор-4етоксикарбонілфеніл, 2,6-диметоксифеніл, 4ціано-2-фторфеніл, 2,4,6-трифторфеніл, 2-хлор-6метилфеніл, 2,6-диметилфеніл, 2,6-дифторфеніл, 2,6-дихлорфеніл, 3,5-дихлорпірид-4-ил, 3метилпірид-2-ил, 2-хлорпірид-3-ил, 3,5дибромпірид-2-ил, 2,3,5,6-тетрафторпірид-4-ил, 3хлор-2,5,6-трифторпірид-4-ил, 3,5-дихлор-2,6дифторпірид-4-ил або 2,6-дихлорпірид-3-ил, солі цих сполук, а також N-оксиди піридинів і їх солі. Особливо переважною сполукою формули І є сполука, у якому R1 означає дифторметоксигрупу, R2 означає циклопропілметоксигрупу і R3 означає 3,5-дихлорпірид-4-ил, солі цієї сполуки, а також N-оксид піридину і його солі. Хімічна назва цієї сполуки звучить як N-(3,5дихлорпірид-4-ил)-3-циклопропілметокси-4дифторметоксибензамід (МНН рофлуміласт). Слабкорозчинний інгібітор PDE4 переважно являє собою інгібітор PDE4, розчинність якого у воді при температурі від 15 до 25°С, зокрема при 21°С, менше або дорівнює 100мг/л, насамперед менше або дорівнює 1мг/л. Подібна сполука найбільш переважно є однією із сполук формули І. Вказані вище сполуки формули І та їх застосування як інгібіторів фосфодіестерази (PDE) типу 4 описані в [заявці WO 95/01338]. До переліку інших прийнятних фармацевтичних допоміжних речовин, які можуть використовуватися в запропонованій у винаході дозованій лікарській формі, належать такі фармацевтичні допоміжні речовини, як наповнювачі, додаткові сполучні, розпушувачі для таблеток або ж змащувальні речовини й антиадгезиви. Як приклад інших прийнятних допоміжних речовин, які можна включати до складу запропонованої у винаході дозованої лікарської форми, можна назвати коригенти (такі як ароматизатори і підсолоджувальні речовини), буферні речовини, консерванти, барвники 11 84266 (такі як жовтий або червоний оксид заліза) або ж емульгатори. Ароматизатори звичайно додають у кількості від 0,05 до 1мас.%. Іншими прикладами коригентів, які додають для одержання потрібного результату, є кислоти, такі як лимонна кислота, підсолоджувальні речовини, такі як сахарин, аспартам, цикламат натрію або мальтол. Застосовуваний відповідно до винаходу полівінілпіролідон (ПВП) являє собою, зокрема, водорозчинний ПВП із середньою молекулярною масою більш 2000, переважно більше 20000. Як такі приклади можна назвати колідон 12 PF (молекулярна маса 2000-3000), колідон 17 PF (молекулярна маса 7000-11000), колідон 25 (молекулярна маса 28000-34000), колідон 30 (молекулярна маса 44000-54000), колідон 90 F (молекулярна маса 1000000-1500000). Переважні ПВП із високою молекулярною масою, такі, наприклад, як колідон 25, колідон 30 і колідон 90 F. Додатково до ПВП при необхідності можна використовувати й інші сполучні, такі як полівінілацетат (наприклад Kollidon® VA 64), желатин, рослинний клей на основі кукурудзяного крохмалю, попередньо набряклі крохмалі (Starch 1500), гідроксипропілметилцелюлозу (ГПМЦ) або гідроксипропілцелюлозу (L-ГПЦ). До придатних для застосування відповідно до винаходу наповнювачів належать такі наповнювачі, як карбонат кальцію (наприклад MagGran® CC або Destab® 95) і карбонат натрію, цукроспирти, зокрема маніт (наприклад Perlitol® або Parteck® M), сорбіт (наприклад Karion®), ксиліт або мальтит, крохмалі, зокрема кукурудзяний крохмаль, картопляний крохмаль і крохмаль пшениці, мікрокристалічна целюлоза, сахариди, зокрема глюкоза, лактоза (наприклад моногідрат лактози), левулоза, сахароза і декстроза. Вказані наповнювачі за необхідності можна використовувати й у різних сумішах між собою. Кукурудзяний крохмаль, мікрокристалічна целюлоза і лактоза є переважними наповнювачами. Як приклад прийнятних змащувальних речовин і антиадгезивів можна назвати натрійстеарилфумарат, стеарат магнію, стеарат кальцію, стеаринову кислоту, тальк і колоїдний безводний діоксид кремнію (аеросил). До придатних для застосування відповідно до винаходу розпушувачів належать, зокрема, нерозчинний полівінілпіролідон (нерозчинний ПВП, кросповідон), натрійкарбоксиметилкрохмаль (натрійкрохмальгліколят), натрійкарбоксиметилцелюлоза, альгінова кислота, а також крохмалі, здатні виконувати функцію розпушувача (наприклад Starch 1500). Вміст інгібітора PDE4 (у масових відсотках у перерахунку на масу остаточної дозованої лікарської форми) у запропонованій у винаході дозованій лікарській формі залежно від природи інгібітора PDE4 звичайно становить від 0,01 до 50мас.%. Переважний вміст інгібітора PDE4 у дозованій лікарській формі становить до 20мас.%. Вміст сполучного (ПВП і за необхідності інших сполучних) (у масових відсотках у перерахунку на масу остаточної дозованої лікарської форми) відповідно до винаходу переважно становить від 0,5 12 до 20мас.%. Переважний вміст ПВП у дозованій лікарській формі становить від 1 до 5мас.%, найбільш переважно від 2 до 3мас.%. Вміст наповнювача (у масових відсотках у перерахунку на масу остаточної дозованої лікарської форми) у запропонованій у винаході таблетці переважно становить від 40 до 99мас.%. Переважний вміст наповнювача в дозованій лікарській формі становить від 60 до 97мас.%. Вміст розпушувача (у масових відсотках у перерахунку на масу остаточної дозованої лікарської форми) у таблетці, яка швидко розпадається, звичайно може досягати 35мас.%. Переважний вміст розпушувача в дозованій лікарській формі становить від 2 до 20мас.%. Найбільш переважний вміст розпушувача в дозованій лікарській формі становить від 5 до 10мас.%. Вміст змащувальної речовини або антиадгезиву (у масових відсотках у перерахунку на масу остаточної дозованої лікарської форми) у таблетці, яка швидко розпадається, звичайно становить від 0,1 до 5мас.%. Переважний вміст змащувальної речовини або антиадгезиву в дозованій лікарській формі становить від 0,3 до 3мас.%. Найбільш переважний вміст змащувальної речовини або антиадгезиву в дозованій лікарській формі становить від 0,5 до 2мас.%. В одному з переважних варіантів здійснення винаходу запропонована в ньому дозована лікарська форма являє собою таблетку. У цьому випадку до складу такої таблетки крім слабкорозчинного інгібітора PDE4 і ПВП переважно включати також як інші фармацевтичні допоміжні речовини принаймні один наповнювач і принаймні одну змащувальну речовину або антиадгезив. Запропонований у винаході фармацевтичний препарат можна одержувати методами, відомими за їх застосуванням при виробництві таблеток і пелетів. В одному з варіантів здійснення винаходу запропоновану в ньому лікарську форму виготовляють одержанням твердого розчину слабкорозчинного інгібітора PDE4 у сполучному ПВП як носій. Для одержання такого розчину можна використовувати, наприклад, заснований на застосуванні розчинника метод, який полягає в розчиненні ПВП, інгібітора PDE4 і за необхідності інших фармацевтичних допоміжних речовин у прийнятному розчиннику з наступним видаленням розчинника шляхом розпилювального сушіння, звичайного сушіння, вакуумного сушіння або сушіння виморожуванням. Відповідно до винаходу несподівано було встановлено, що вказаний твердий розчин можна також одержувати заснованим на змішуванні методом, який полягає в змішуванні слабкорозчинного інгібітора PDE4 і за необхідності інших фармацевтично допоміжних речовин із ПВП і їх інтенсивному перемішуванні. Даний винахід стосується також твердого розчину слабкорозчинного інгібітора PDE4 у сполучному ПВП як носій. Під твердим розчином інгібітора PDE4 у сполучному ПВП як носія в контексті даного винаходу мається на увазі твердий розчин з аморфною структурою, у якій інгібітор PDE4 при 13 84266 сутній у вигляді молекулярної дисперсії в матеріалі носія. Твердий розчин у випадку його подальшої переробки в таблетки або пелети можна відомими фа хівцям методами переробляти як інгредієнт, який представляє собою діючу речовину, разом з іншими інгредієнтами, до яких належать наповнювачі, сполучні, розпушувачі і змащувальні речовини, у запропоновані у винаході дозовані лікарські форми для перорального застосування. Відповідно до цього винахід стосується також способу одержання дозованої лікарської форми у вигляді таблетки або пелети, призначеної для перорального введення в організм інгібітора PDE4, який полягає в тому, що (а) одержують матеріал, який містить діючу речовину, у вигляді твердого розчину слабкорозчинного інгібітора PDE4 у ПВП, (б) одержують суміш матеріалу, який містить діючу речовину, і фармацевтичних допоміжних речовин і (в) отриману на стадії (б) суміш гранулюють з водним розчином ПВП. Якщо запропоновані у винаході дозовані лікарські форми являють собою таблетки, то отримані на стадії (в) гранули можна після їх сушіння і змішування із змащувальними речовинами або антиадгезивами піддавати пресуванню в таблетувальному пресі. Якщо запропоновані у винаході дозовані лікарські форми являють собою пелети, то отримані на стадії (в) вологі гранули можна переробляти у відповідні пелети шляхом екструдування/сфероїдизації. В іншому варіанті матеріал, який містить діючу речовину, який представляє собою твердий розчин слабкорозчинного інгібітора PDE4 у ПВП, можна наносити з дисперсій/суспензій у прийнятному розчиннику на носії, які мають форму пелет, (наприклад нонпарелі або пелети, які містять ГПМЦ). У наступному переважному варіанті здійснення винаходу запропоновану в ньому дозовану лікарську форму одержують гранулюванням суміші, яка містить діючу речовину і фармацевтичні допоміжні речовини, з водним розчином ПВП, сушінням отриманих гранул і за необхідності примішуванням інших фармацевтичних допоміжних речовин. Отриманий після гранулювання вологий продукт можна потім піддавати подальшій переробці в пелети і після цього розфасовува ти в капсули. Висушені гранули, при необхідності після примішування до них інших фармацевтичних допоміжних речовин, можна після змішування з антиадгезивом пресувати в таблетувальному пресі. Процес гранулювання переважно проводити в грануляторі з псевдозрідженим шаром у відповідних умовах. Крім цього діючу речовину за необхідності можна примішувати до інших фармацевтичних допоміжних речовин у вигляді порошку (тритурації), отриманого розтиранням з фармацевтичною допоміжною речовиною (насамперед з наповнювачем). Подібний підхід найбільш переважно використовувати в тих випадках, коли вміст діючої речовини в дозованій лікарській формі повинен становити менше 5мас.%. Подібну тритурацію звичайно можна одержувати подрібнюванням діючої речовини разом з фармацевтичною допоміжною речовиною (насамперед з наповнювачем). 14 Відповідно до цього винахід стосується також способу одержання дозованої лікарської форми у вигляді таблетки або пелети, призначеної для перорального введення в організм інгібітора PDE 4, який полягає в тому, що а) готують суміш діючої речовини і фармацевтичних допоміжних речовин і б) отриману на стадії а) суміш гранулюють з водним розчином ПВП. Запропоновану у винаході дозовану лікарську форму найбільш переважно одержувати гранулюванням суміші з (а) слабкорозчинного інгібітора PDE4 або тритурації слабкорозчинного інгібітора PDE 4 з кукурудзяним крохмалем, (б) кукурудзяного крохмалю і (в) моногідрату лактози з водним розчином ПВП, сушінням отриманих гранул, їх змішуванням з антиадгезивом і пресуванням отриманої суміші в таблетувальному пресі. Слабкорозчинним інгібітором PDE4 у цьому випадку найбільш переважно є рофлуміласт, одна з його солей, N-оксид піридину або одна з його солей. В іншому варіанті запропоновану у винаході дозовану лікарську форму найбільш переважно одержувати гранулюванням суміші з (а) слабкорозчинного інгібітора PDE4 або тритурації слабкорозчинного інгібітора PDE 4 з кукурудзяним крохмалем, (б) кукурудзяного крохмалю, (в) мікрокристалічної целюлози і (г) натрійкарбоксиметилкрохмалю з водним розчином ПВП, сушінням отриманих гранул, їх змішуванням з антиадгезивом і пресуванням отриманої суміші в таблетувальному пресі. Слабкорозчинним інгібітором PDE4 у цьому випадку найбільш переважно є рофлуміласт, одна з його солей, N-оксид піридину або одна з його солей. В іншому переважному варіанті здійснення винаходу запропоновану в ньому дозовану лікарську форму одержують гранулюванням суміші фармацевтичних допоміжних речовин із суспензією діючої речовини у водному розчині ПВП, сушінням отриманих гранул і за необхідності примішуваням інших фармацевтичних допоміжних речовин. Отриманий таким шляхом продукт можна, за необхідності після примішування до нього антиадгезиву, пресувати в таблетувальному пресі. Процес гранулювання переважно проводити в грануляторі з псевдозрідженим шаром у відповідних умовах. Відповідно до цього винахід стосується також способу одержання дозованої лікарської форми у вигляді таблетки або пелети, призначеної для перорального введення в організм інгібітора PDE4, який полягає в тому, що а) готують суміш фармацевтичних допоміжних речовин і б) отриману на стадії (а) суміш гранулюють із суспензією діючої речовини у водному розчині ПВП. Запропоновану у винаході дозовану лікарську форму найбільш переважно одержувати гранулюванням суміші кукурудзяного крохмалю і моногід 15 84266 рату лактози разом із суспензією слабкорозчинного інгібітора PDE4 у водному розчині ПВП, сушінням отриманих гранул, їх змішуванням з антиадгезивом і пресуванням отриманої суміші в таблетувальному пресі. Відповідно до винаходу несподівано було встановлено, що запропоновані в ньому дозовані лікарські форми, отримані з використанням фізичних сумішей або тритурацій слабкорозчинного інгібітора PDE4 з наповнювачем (отриманих, наприклад, подрібненням, інтенсивним перемішуванням або екструзією) шляхом їх гранулювання з водними розчинами ПВП або отримані шляхом гранулювання з використанням суспензій інгібіторів PDE4 у водних розчинах ПВП, мають такі ж переважні властивості щодо забезпечення біодоступності слабкорозчинного інгібітора PDE4, як і дозовані лікарські форми, при виготовленні яких спочатку одержують тверді розчини ПВП і інгібітора PDE4. Сказане означає, що взаємодії, які відбуваються між ПВП і слабкорозчинним інгібітором PDE4 у процесі виготовлення запропонованих у винаході дозованих лікарських форм на основі фізичних сумішей або тритурацій слабкорозчинного інгібітора PDE4 з наповнювачем, які у подальшому гранулюють з водними розчинами ПВП, або в процесі їх виготовлення шляхом гранулювання з використанням суспензій інгібіторів PDE4 у водних розчинах ПВП, несподівано подібні до взаємодій, які відбуваються у твердому розчині ПВП і інгібітора PDE4. Тому при виробництві запропонованих у винаході дозованих лікарських форм можна також відмовитися від технічно більш складного в здійсненні варіанта, який передбачає одержання твердого розчину заснованим на застосуванні розчинника методом. Короткий опис креслення На доданому до опису кресленні показані графіки, які відображають зміну в часі середньої концентрації рофлуміласту в сироватці після його перорального введення в дозі 0,5мг (2 таблетки по 0,25мг у кожній) з використанням запропонованих у винаході дозованих лікарських форм, а також для порівняння показаний аналогічний графік для дозованої лікарської форми, яка не містить ПВП. Нижче на прикладах розглянуті методи виготовлення запропонованих у винаході таблеток і препаратів. Наведені нижче приклади служать винятково для ілюстрації винаходу і більш докладного пояснення його основних принципів і не обмежують його обсяг. Приклади Виготовлення запропонованих у винаході таблеток Приклад А Дані про масову кількість інгредієнтів вказані в перерахунку на одну таблетку із вмістом рофлуміласту 0,1мг: 1. рофлуміласт (мікронізований) 0,100мг 2. моногідрат лактози 49,660мг 3. кукур удзяний крохмаль 13,390мг 4. полівідон К90 1,300мг 5. стеарат магнію (рослинний) 0,650мг Всього 65,100мг 16 Одержання: Інгредієнт (1) змішують з частиною від усієї передбаченої кількості інгредієнта (3) і з отриманої суміші в планетарному млині готують тритурацію. Отриману тритурацію разом з інгредієнтом (2) і іншою кількістю інгредієнта (3) завантажують у робочий резервуар грануляційної системи з псевдозрідженим шаром, на частинки тритурації розпиленням наносять 5%-ний грануляційний розчин інгредієнта (4) в очищеній воді і сушать у прийнятних умовах. Потім до гранул додають інгредієнт (5) і отриману після перемішування суміш пресують у таблетувальному пресі в таблетки із середньою масою 65,1мг. Приклад Б Дані про масову кількість інгредієнтів вказані в перерахунку на одну таблетку із вмістом рофлуміласту 0,125мг: 1. рофлуміласт 0,125мг 2. моногідрат лактози 49,660мг 3. кукур удзяний крохмаль 13,390мг 4. полівідон К90 1,300мг 5. стеарат магнію (рослинний) 0,650мг Всього 65,125мг Одержання: Інгредієнт (1) змішують з частиною від усієї передбаченої кількості інгредієнта (3) і з отриманої суміші в планетарному млині готують тритурацію. Отриману тритурацію разом з інгредієнтом (2) і іншою кількістю інгредієнта (3) завантажують у робочий резервуар грануляційної системи з псевдозрідженим шаром, на частинки тритурації розпиленням наносять 5%-ний грануляційний розчин інгредієнта (4) в очищеній воді і сушать у прийнятних умовах. Потім до гранул додають інгредієнт (5) і отриману після перемішування суміш пресують у таблетувальному пресі в таблетки із середньою масою 65,125мг. Приклад В Дані про масову кількість інгредієнтів вказані в перерахунку на одну таблетку із вмістом рофлуміласту 0,25мг: 1. рофлуміласт 0,250мг 2. мікрокристалічна целюлоза 33,900мг 3. кукур удзяний крохмаль 2,500мг 4. полівідон К90 2,250мг 5. натрійкарбоксиметилкрохмаль (тип А) 20,000мг 6. стеарат магнію (рослинний) 0,600мг Всього59,500мг Одержання: Інгредієнт (1) змішують з частиною від усієї передбаченої кількості інгредієнта (3) і з отриманої суміші в планетарному млині готують тритурацію. Отриману тритурацію разом з інгредієнтами (2) і (5) і іншою кількістю інгредієнта (3) завантажують у робочий резервуар грануляційної системи з псевдозрідженим шаром, на частинки тритурації розпиленням наносять 5%-ний грануляційний розчин інгредієнта (4) в очищеній воді і сушать у прийнятних умовах. Потім до гранул додають інгредієнт (6) і отриману після перемішування суміш пресують у таблетувальному пресі в таблетки із середньою масою 59,5мг. Приклад Γ Дані про масову кількість інгредієнтів вказані в перерахунку на одну таблетку із вмістом рофлуміласту 0,25мг: 17 84266 1. рофлуміласт 0,250мг 2. моногідрат лактози 49,660мг 3. кукур удзяний крохмаль 13,390мг 4. полівідон К90 1,300мг 5. стеарат магнію (рослинний) 0,650мг Всього 65,250мг Одержання: Інгредієнт (1) змішують з частиною від усієї передбаченої кількості інгредієнта (3) і з отриманої суміші в планетарному млині готують тритурацію. Отриману тритурацію разом з інгредієнтом (2) і іншою кількістю інгредієнта (3) завантажують у робочий резервуар грануляційної системи з псевдозрідженим шаром, на частинки тритурації розпиленням наносять 5%-ний грануляційний розчин інгредієнта (4) в очищеній воді і сушать у прийнятних умовах. Потім до гранул додають інгредієнт (5) і отриману після перемішування суміш пресують у таблетувальному пресі в таблетки із середньою масою 65,25мг. Приклад Д Дані про масову кількість інгредієнтів вказані в перерахунку на одну таблетку із вмістом рофлуміласту 0,5мг: 1. рофлуміласт 0,500мг 2. моногідрат лактози 49,660мг 3. кукур удзяний крохмаль 13,390мг 4. полівідон К90 1,300мг 5. стеарат магнію (рослинний) 0,650мг Всього 65,500мг Одержання: Інгредієнт (1) змішують з частиною від усієї передбаченої кількості інгредієнта (3) і з отриманої суміші в планетарному млині готують тритурацію. Отриману тритурацію разом з інгредієнтом (2) і іншою кількістю інгредієнта (3) завантажують у робочий резервуар грануляційної системи з псевдозрідженим шаром, на частинки тритурації розпиленням наносять 5%-ний грануляційний розчин інгредієнта (4) в очищеній воді і сушать у прийнятних умовах. Потім до гранул додають інгредієнт (5) і отриману після перемішування суміш пресують у таблетувальному пресі в таблетки із середньою масою 65,500мг. Приклад Ε Дані про масову кількість інгредієнтів вказані в перерахунку на одну таблетку із вмістом рофлуміласту 0,5мг: 1. рофлуміласт 0,500мг 2. моногідрат лактози 99,320мг 3. кукур удзяний крохмаль 26,780мг 4. полівідон К90 2,600мг 5. стеарат магнію (рослинний) 1,300мг Всього 130,500мг Одержання: Інгредієнт (1) змішують з частиною від усієї передбаченої кількості інгредієнта (3) і з отриманої суміші в планетарному млині готують тритурацію. Отриману тритурацію разом з інгредієнтом (2) і іншою кількістю інгредієнта (3) завантажують у робочий резервуар грануляційної системи з псевдозрідженим шаром, на частинки тритурації розпиленням наносять 5%-ний грануляційний розчин інгредієнта (4) в очищеній воді і сушать у прийнятних умовах. Потім до гранул додають інгредієнт (5) і отриману після перемішування суміш пресують у таблетувальному пресі в таблетки із середньою масою 130,5мг. 18 Приклад Є Дані про масову кількість інгредієнтів вказані в перерахунку на одну таблетку із вмістом рофлуміласту 2,5мг: 1. рофлуміласт 2,500мг 2. мікрокристалічна целюлоза 33,900мг 3. кукур удзяний крохмаль 2,500мг 4. полівідон К90 2,250мг 5. натрійкарбоксиметилкрохмаль (тип А) 20,000мг 6. стеарат магнію (рослинний) 0,600мг Всього 61,750мг Одержання: Інгредієнт (1) змішують з частиною від усієї передбаченої кількості інгредієнта (3) і з отриманої суміші в планетарному млині готують тритурацію. Отриману тритурацію разом з інгредієнтами (2) і (5) і іншою кількістю інгредієнта (3) завантажують у робочий резервуар грануляційної системи з псевдозрідженим шаром, на частинки тритурації розпиленням наносять 5%-ний грануляційний розчин інгредієнта (4) в очищеній воді і сушать у прийнятних умовах. Потім до гранул додають інгредієнт (6) і отриману після перемішування суміш пресують у таблетувальному пресі в таблетки із середньою масою 61,75мг. Приклад Ж Виготовлення таблеток, які містять як діючу речовину рофлуміласт у кількості 0,1мг (дані про масову кількість інгредієнтів вказані в перерахунку на партію з 70000 таблеток): 1. рофлуміласт (мікронізований) 7,000г 2. моногідрат лактози 3476,200г 3. кукур удзяний крохмаль 937,300г 4. полівідон К90 91,000г 5. стеарат магнію (рослинний) 45,500г Всього 4557,000г Одержання: Інгредієнт (1) змішують з 70г інгредієнта (3) і з отриманої суміші в планетарному млині готують тритурацію. Отриману тритурацію разом з інгредієнтом (2) і іншою кількістю інгредієнта (3) завантажують у робочий резервуар грануляційної системи з псевдозрідженим шаром і на частинки тритурації розпиленням наносять 5%-ний грануляційний розчин інгредієнта (4) в очищеній воді (тиск розпилення: 3 бари, температура продукту: 28-33°С, витрата потоку повітря протягом першої третини від усієї тривалості процесу розпилення: 100м 3/год, витрата потоку повітря впродовж іншої частини процесу розпилення: 150м 3/год, температура повітря на вході: 40-70°С, продуктивність при розпиленні: 30-40г/хв). Після завершення процесу розпилення отриманий продукт сушать доти, поки його температура не досягне 34°С. Після цього гранули просіюють через сито з нержавіючої сталі з розміром комірок 0,8мм і після визначення відносної поверхневої вологості гранул її значення доводять до 20-50%. Потім до гранул додають інгредієнт (5) і отриману після перемішування суміш пресують у таблетувальному пресі в таблетки із середньою масою 65,1мг. Приклад З Виготовлення таблеток, які містять як діючу речовину рофлуміласт у кількості 0,25мг (дані про масову кількість інгредієнтів вказані в перерахунку на партію з 70000 таблеток): 19 84266 1. рофлуміласт (мікронізований) 35,000г 2. моногідрат лактози 3476,200г 3. кукур удзяний крохмаль 937,300г 4. полівідон К90 91,000г 5. стеарат магнію (рослинний) 45,500г Всього 4585,000г Одержання: 19,25г інгредієнта (1) змішують з 192,5г інгредієнта (3) і з отриманої суміші в планетарному млині готують тритурацію. Отриману тритурацію разом з інгредієнтом (2) і іншою кількістю інгредієнта (3) завантажують у робочий резервуар грануляційної системи з псевдозрідженим шаром і на частинки тритурації розпиленням наносять 5%ний грануляційний розчин інгредієнта (4) в очищеній воді (тиск розпилення: 3 бари, температура продукту: 28-33°С, витрата потоку повітря протягом першої третини від усієї тривалості процесу розпилення: 100м 3/год, витрата потоку повітря впродовж іншої частини процесу розпилення: 150м 3/год, температура повітря на вході: 40-70°С, продуктивність при розпиленні: 30-40г/хв). Після завершення процесу розпилення отриманий продукт сушать доти, поки його температура не досягне 34°С. Після цього гранули просіюють через сито з нержавіючої сталі з розміром комірок 0,8мм і після визначення відносної поверхневої вологості гранул її значення доводять до 20-50%. Потім до гранул додають інгредієнт (5) і отриману після перемішування суміш пресують у таблетувальному пресі в таблетки із середньою масою 65,5мг. Приклад И Виготовлення таблеток, які містять як діючу речовину рофлуміласт у кількості 0,1мг (дані про масову кількість інгредієнтів вказані в перерахунку на партію з 70000 таблеток): 1. рофлуміласт (мікронізований) 7,000г 2. моногідрат лактози 3476,200г 3. кукур удзяний крохмаль 937,300г 4. полівідон К90 91,000г 5. стеарат магнію (рослинний) 45,500г Всього 4557,000г Одержання: Інгредієнт (1) до гомогенності суспендують у грануляційному розчині інгредієнта (4) в очищеній воді. Інгредієнти (2) і (3) завантажують у робочий резервуар грануляційної системи з псевдозрідженим шаром і гранулюють з описаною вище грануляційною суспензією, а потім сушать. Потім до гранул додають інгредієнт (5) і отриману після перемішування суміш пресують у таблетувальному пресі в таблетки із середньою масою 65,1мг. Приклад І Виготовлення таблеток, які містять як діючу речовину рофлуміласт у кількості 0,25мг (дані про масову кількість інгредієнтів вказані в перерахунку на партію з 70000 таблеток): 1. рофлуміласт (мікронізований) 35,000г 2. моногідрат лактози 3476,200г 3. кукур удзяний крохмаль 937,300г 4. полівідон К90 91,000г 5. стеарат магнію (рослинний) 45,500г Всього 4585,000г Одержання: Інгредієнт (1) до гомогенності суспендують у грануляційному розчині інгредієнта (4) в очищеній воді. Інгредієнти (2) і (3) заванта 20 жують у робочий резервуар грануляційної системи з псевдозрідженим шаром і гранулюють з описаною вище грануляційною суспензією, а потім сушать. Потім до гранул додають інгредієнт (5) і отриману після перемішування суміш пресують у таблетувальному пресі в таблетки із середньою масою 65,25мг. Приклад Й Дані про масову кількість інгредієнтів вказані в перерахунку на одну таблетку із вмістом рофлуміласту 0,25мг: 1. рофлуміласт 0,250мг 2. моногідрат лактози 49,660мг 3. картопляний крохмаль 10,000мг 4. кукур удзяний крохмаль 3,590мг 5. ПВП 25 1,500мг 6. стеарат магнію (рослинний) 0,650мг Всього 65,650мг Одержання: З інгредієнта (4) і води готують дисперсію, у якій потім до гомогенності суспендують інгредієнт (1). Інгредієнт (5) розчиняють у воді і додають до цієї дисперсії. З використанням цієї дисперсії в грануляційній системі з псевдозрідженим шаром у прийнятних умовах гранулюють інгредієнти (2) і (3). Потім до гранул додають інгредієнт (6) і отриману після перемішування суміш пресують у таблетувальному пресі в таблетки із середньою масою 65,650мг. Приклад К Дані про масову кількість інгредієнтів вказані в перерахунку на одну таблетку із вмістом рофлуміласту 0,25мг: 1. рофлуміласт 0,250мг 2. моногідрат лактози 49,660мг 3. кукур удзяний крохмаль 13,390мг 4. полівідон К90 1,300мг 5. желатин 1,300мг 6. стеарат магнію (рослинний) 0,650мг Всього 66,550мг Одержання: Інгредієнт (1) змішують з частиною від усієї передбаченої кількості інгредієнта (3) і з отриманої суміші в планетарному млині готують тритурацію. Отриману тритурацію разом з інгредієнтом (2) і іншою кількістю інгредієнта (3) завантажують у робочий резервуар грануляційної системи з псевдозрідженим шаром, на частинки тритурації розпиленням наносять 5%-ний грануляційний розчин інгредієнтів (4) і (5) в очищеній воді і сушать у прийнятних умовах. Потім до гранул додають інгредієнт (6) і отриману після перемішування суміш пресують у таблетувальному пресі в таблетки із середньою масою 66,55мг. Приклад К1 Препарат для педіатричного застосування Дані про масову кількість інгредієнтів вказані в перерахунку на одну таблетку із вмістом рофлуміласту 0,125мг: 1. рофлуміласт 0,125мг 2. моногідрат лактози 49,660мг 3. кукур удзяний крохмаль 13,390мг 4. полівідон К90 1,300мг 5. маніт 32,238мг 6. коригент (ароматизатор "туттіфр утті") 0,329мг 7. ПВП (нерозчинний) 12,895мг 21 84266 8. стеарат магнію (рослинний) 1,649мг Всього 111,586мг Препарат такого складу виготовляють описаним вище методом. Дослідження фізичних властивостей і порівняльні досліди з використанням дозованих лікарських форм, при виготовленні яких як сполучне не використовувався ПВП Приклад Л Час розпаду і показники вивільнення діючої речовини визначали для дозованої лікарської форми вказаного в прикладі Г складу. Час розпаду: Час розпаду визначали за допомогою відповідного випробувального приладу за методикою, описаної в Європейській фармакопеї. Результат: 7,08хв. Вивільнення діючої речовини: Показники вивільнення діючої речовини визначали за методикою, описаною у фармакопеї США (USP XXV, апарат 2). Результат: 78% від усієї кількості діючої речовини вивільняється через 15хв, а кількісне вивільнення діючої речовини спостерігається через 60хв. Приклад Μ Виготовлення дозованої лікарської форми, що містить рофлуміласт, у якій не використовується ПВП Дані про масову кількість інгредієнтів вказані в перерахунку на одну таблетку із вмістом рофлуміласту 0,25мг: 1. рофлуміласт 0,250мг 2. моногідрат лактози 70,300мг 3. картопляний крохмаль 19,475мг 4. кукур удзяний крохмаль 3,563мг 5. натрійкарбоксиметилкрохмаль (тип А) 1,900мг 6. стеарат магнію (рослинний) 0,950мг Всього 96,438мг Одержання: З інгредієнта (4) і води готують дисперсію, у якій потім до гомогенності суспендують інгредієнт (1). З використанням цієї дисперсії в грануляційній системі з псевдозрідженим шаром у прийнятних умовах гранулюють інгредієнти (2) і (3). До висушених гранул додають інгредієнт (5) і перемішують до гомогенності. До отриманої суміші додають інгредієнт (6) і отриману після перемішування суміш пресують у таблетувальному пресі в таблетки із середньою масою 96,438мг. Порівняльне дослідження План експерименту: 24 чоловік, у 3 зміни, рандомізований метод; доза в кожному випадку 0,5мг (2 таблетки із вмістом рофлуміласту по 0,25мг у кожній). Концентрацію рофлуміласту в сироватці після його перорального введення в дозі 0,5мг (2 таблетки по 0,25мг у кожній) досліджували для наступних дозованих лікарських форм: з ПВП як сполучним: таблетка, склад якої відповідає прикладу Γ і яка нижче позначена як "таблетка А", таблетка, склад якої відповідає прикладу І і яка нижче позначена як "таблетка Б"; без ПВП як сполучного: таблетка, склад якої відповідає прикладу Μ і яка нижче позначена як "таблетка В". Отримані в цьому дослідженні результати в графічному вигляді представлені на доданому до 22 опису кресленні. Ці результати свідчать про те, що після перорального введення дозованих лікарських форм із ПВП як сполучного концентрація діючої речовини в плазмі досягає максимального рівня набагато швидше ніж після перорального введення дозованих лікарських форм без ПВП. Відповідно до цього при застосуванні запропонованих у винаході дозованих лікарських форм значно підвищується швидкість всмоктування. Промислова застосовність Запропоновані у винаході дозовані лікарські форми можуть використовуватися для лікування і профілактики всіх тих захворювань, при яких показане застосування інгібіторів PDE4. Вибірні інгібітори циклонуклеотид-фосфодіестерази (PDE) (насамперед типу 4), по-перше, придатні для застосування як бронхіальних терапевтичних засобів (для лікування обструкції дихальних шляхів, оскільки вони мають розширювальну дію, а також мають здатність підвищувати частоту ди хання і стимулювати ди хання) і для усунення еректильної дисфункції, оскільки вони мають судинорозширювальну дію, а, по-друге, придатні насамперед для лікування захворювань, головним чином запального характеру, опосередковуваних такими медіаторами, як гістамін, PAF-фактор (фактор активації тромбоцитів), похідні арахідонової кислоти, зокрема лейкотриєни і простагландини, цитокіни, інтерлейкіни, хемокіни, a-, b- і g-інтерферон, фактор некрозу пухлини (TNF-фактор) або вільні радикали кисню, а також протеази, наприклад захворювань дихальних шляхів (для профілактики астми), шкіри, центральної нервової системи, кишечнику, очей і суглобів. Відповідно до цього запропоновані у винаході фармацевтичні препарати можуть використовуватися в медицині і ветеринарії, наприклад, для лікування і профілактики наступних захворювань: гострих і хронічних (насамперед запальних і викликаних алергенами) захворювань дихальних шляхів різної етіології (бронхіту, алергічного бронхіту, бронхіальної астми, ХОЗЛ), дерматозів (насамперед проліферативного, запального й алергічного характеру), таких, наприклад, як псоріаз (лускатий лишай), токсична й алергічна контактна екзема, атопічний дерматит, себорейна екзема, простий лишай, сонячна еритема, свербіж в ділянці статевих органів і заднього проходу, гніздова алопеція, гіпертрофічні рубці, дискоїдний червоний вовчок, фолікулярні і великі піодермії, ендогенні й екзогенні вугри, рожеві вугри й інші проліферативні, запальні й алергічні шкірні захворювання, захворювань, в основі яких лежить вивільнення TNF-фактора і лейкотриєнів, наприклад захворювань артритного типу (ревматоїдного артриту, ревматоїдного спондиліту, остеоартриту й інших артритних станів), захворювань імунної системи (СНІДу, множинного склерозу), шоку різних типів [септичного шоку, ендотоксинового бактеріально-токсичного шоку, грамнегативного сепсису, синдрому токсичного шоку і РДСД (респіраторного дистрес-синдрому дорослих)] і розлитих запалень в ділянці шлунково-кишкового тракту (хвороби Крона і виразкового коліту), за хворювань, в основі яких лежать алергічні і/або хронічні аномальні імунологічні реакції в ділянці верхніх дихальних шля 23 84266 хів (у фарингіальній ділянці, ділянці носа) і суміжних ділянках (в ділянці навколоносових пазух, ділянці очей) і як приклад яких можна назвати алергічний риніт/синусит, хронічний риніт/синусит, алергічний кон'юктивіт і поліпи носа, а також хвороб серця, для лікування яких можуть використовуватися інгібітори PDE і як приклад яких можна назвати серцеву недостатність, або хвороб, для лікування яких інгібітори PDE можуть використовуватися завдяки наявності в них розслаблюючої дії на тканині і як приклад яких можна назвати еректильну дисфункцію або ниркову і сечовідну коліку, зв'язану з нирковими конкрементами, або ж захворювань ЦНС, таких, наприклад, як депресії або артеріосклеротичне недоумство. Даний винахід стосується також способу лікування ссавців, включаючи людини, які страждають від одного з вищевказаних захворювань. Цей спосіб відрізняється тим, що пацієнту-ссавцю вводять у терапевтично ефективній і фармакологічно прийнятній кількості інгібітор PDE4, який присутній у запропонованій у винаході дозованій лікарській формі. Захворюванням, для лікування якої переважно застосовувати запропонований у винаході спосіб, є астма або обструкція дихальних шляхів, насамперед ХОЗЛ (хронічне обструктивне захворювання легень). Комп’ютерна в ерстка М. Ломалова 24 Запропоновані у винаході дозовані лікарські форми містять інгібітор PDE4 у дозі, яка звичайно застосовується для лікування того чи іншого конкретного захворювання. Дозування діючої речовини відповідає порядку величин, традиційно прийнятому для інгібіторів PDE, при цьому добову дозу можна вводити в організм однією або декількома разовими дозами. Добова доза діючої речовини при системній терапії (при пероральному застосуванні) у нормі становить від 0,001 до 3мг на кілограм ваги тіла. Переважні запропоновані у винаході дозовані лікарські форми містять рофлуміласт у разовій дозі, яка становить від 0,01 до 5мг, переважно від 0,05 до 2,5мг, найбільш переважно від 0,1 до 0,5мг. Як приклад запропонованих у винаході фармацевтичних препаратів можна назвати разові дозовані лікарські форми, кожна з яких містить рофлуміласт у кількості 0,1мг, 0,125мг, 0,25мг або 0,5мг. Звичайно одну або більше однієї запропонованих у винаході разових дозованих лікарських форм приймають однократно на день. За необхідності, однак, одну або декілька запропонованих у винаході разових дозованих лікарських форм можна приймати більше одного разу на день. Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюOral dosage form containing a pde 4 inhibitor as an active ingredient and polyvinylpyroolidon as excipient, processes for the preparation and use thereof
Автори англійськоюDietrich Rango, EISTETTER KLAUS, Ney Hartmut
Назва патенту російськоюДозированная врачебная форма в виде таблетки или гранулы для перорального введения, которая содержит ингибитор pde 4 и поливинилпиролидон, способы ее получения и применения
Автори російськоюДитрих Ранго, АЙСТЕТТЕР Клаус, Ней Хартмут
МПК / Мітки
МПК: A61K 47/22, A61K 9/20, A61P 11/08, A61K 31/166, A61P 11/06
Мітки: таблетки, містить, способи, перорального, форма, лікарська, полівінілпіролідон, пелети, застосування, введення, вигляді, одержання, дозована, інгібітор, яка
Код посилання
<a href="https://ua.patents.su/12-84266-dozovana-likarska-forma-u-viglyadi-tabletki-abo-peleti-dlya-peroralnogo-vvedennya-yaka-mistit-ingibitor-pde-4-ta-polivinilpirolidon-sposobi-oderzhannya-ta-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Дозована лікарська форма у вигляді таблетки або пелети для перорального введення, яка містить інгібітор pde 4 та полівінілпіролідон, способи її одержання та застосування</a>
Попередній патент: Вакуумний прямопролітний клапан
Наступний патент: Турбореактивний двигун із зміцненим ущільненням порожнини для відбору повітря в кабіну
Випадковий патент: Сушильна шафа