Лікарська форма тієнопіридинового інгібітора агрегації тромбоцитів
Номер патенту: 91051
Опубліковано: 25.06.2010
Автори: Орен Пітер Ллойд, Тєрнік Роберт Луіс, Едельман Тамара Бет, Дзєннік Девід Брайан
Формула / Реферат
1. Лікарська форма, яка містить терапевтично ефективну кількість сполуки формули І
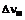 ,
,
вміщену у повітро- та вологонепроникну блістерну упаковку з інертним газом.
2. Лікарська форма за п. 1, яка відрізняється тим, що терапевтично ефективна кількість сполуки формули І становить від приблизно 5 мг до приблизно 60 мг еквіваленту основи.
3. Лікарська форма за п. 1, яка відрізняється тим, що терапевтично ефективна кількість сполуки формули І становить приблизно 5 мг еквіваленту основи.
4. Лікарська форма за п. 1, яка відрізняється тим, що терапевтично ефективна кількість сполуки формули І становить приблизно 10 мг еквіваленту основи.
5. Лікарська форма за п. 1, яка відрізняється тим, що терапевтично ефективна кількість сполуки формули І становить приблизно 15 мг еквіваленту основи.
6. Лікарська форма за п. 1, яка відрізняється тим, що терапевтично ефективна кількість сполуки формули І становить приблизно 60 мг еквіваленту основи.
7. Лікарська форма за п. 1, яка відрізняється тим, що блістерною упаковкою є блістерна упаковка з алюмінієвої фольги.
8. Лікарська форма за п. 1, де сполука за п. 1 є таблеткою, каплетою або капсулою, що містить сполуку формули І.
9. Спосіб виготовлення сполуки формули І, який включає такі стадії:
(a) виготовлення таблеток, каплет або капсул сполуки формули І та
(b) вміщеннязгаданих таблеток, каплет, капсул або іншої твердої лікарської форми сполуки формули І у блістерну упаковку з інертним газом.
10. Спосіб за п. 9, який відрізняється тим, що вміст кисню у газовому просторі блістерної упаковки знижений до рівнів нижче приблизно 2-4 % та активність води у таблетках, каплетах або капсулах сполуки формули І знижена до рівнів від приблизно 0,2 до приблизно 0,4.
11. Промисловий виріб, який включає в себе сполуку формули І, вміщену у повітро- та вологонепроникну блістерну упаковку з інертним газом.
12. Застосування лікарської форми за п. 1 для лікування серцево-судинних захворювань.
Текст
1. Лікарська форма, яка містить терапевтично ефективну кількість сполуки формули І C2 2 (19) 1 3 рель застосовується значно ширше, ніж раніше розроблений препарат тиклопідин. Прасугрель є тієнопіридином нового покоління, який на даний час проходить клінічну розробку для лікування тромбозу та/або пов'язаних із ним захворювань, у тому числі як допоміжний засіб при процедурах черезшкірного впливу на коронарні судини. У патенті США № 5,288,726 розкрито та заявлено похідні тетрагідротієнопіридину, у тому числі 2-ацетокси-5-( -циклопропілкарбоніл-2фторбензил)-4,5,6,7-тетрагідротієно[3,2-с]піридин. У патенті США № 6,693,115 В2 розкрито та заявлено солі 2-ацетокси-5-(а-циклопропілкарбоніл2-фторбензил)-4,5,6,7-тетрагідротієно[3,2с]піридину з хлористоводневою та малеїновою кислотами. Ці гідрохлорид та малеат виявляють неочікуване та неочевидне покращення профілів ефективності та стабільності у порівнянні з іншими солями, а також з вільною основою згаданої сполуки. Хлористоводнева сіль 2-ацетокси-5-(ациклопропілкарбоніл-2-фторбензил)-4,5,6,7тетрагідротієно[3,2-с]піридину відома також під назвою прасугрєль. При довготривалому впливі повітря та вологи на гідрохлорид (прасугрєль) він зазнає певної деградації. Таким чином, існує потреба у додатковому підвищенні стабільності, терміну зберігання і, отже, довготривалої ефективності індивідуальних доз прасугрелю. Цей винахід пропонує лікарську форму, яка містить терапевтично ефективну кількість сполуки формули І вміщену у повітро- та вологонепроникну блістерну упаковку з інертним газом. Крім того, цей винахід пропонує лікарську форму сполуки І, яка охоплює таблетку, каплету, капсулу або іншу тверду лікарську форму сполуки формули І, вміщену у повітро- та вологонепроникну блістерну упаковку з інертним газом. Цей винахід пропонує вдосконалену лікарську форму сполуки формули І, яка містить терапевтично ефективну кількість згаданої сполуки у вигляді таблетки, каплети, капсули або іншої твердої лікарської форми сполуки формули І, вміщену у повітро- та вологонепроникну блістерну упаковку з інертним газом. Цей винахід стосується способу підвищення стабільності та терміну зберігання сполуки формули І, який включає вміщення таблетки (таблеток), каплети (каплет) або капсули (капсул) або іншої твердої лікарської форми сполуки формули І у блістерну упаковку з алюмінієвої фольги з інертним газом. Цей винахід стосується застосування лікарської форми сполуки І, яке включає введення тера 91051 4 певтично ефективної кількості згаданої сполуки у вигляді таблетки, каплети, капсули або іншої твердої лікарської форми сполуки формули І, вміщеної у повітро- та вологонепроникну блістерну упаковку з інертним газом, для лікування та/або профілактики тромбозу, гострого коронарного синдрому, гострого коронарного синдрому під медичним контролем (ACS-MM), інсульту, аневризми судин мозку та судинних захворювань високого ступеня ризику. Цей винахід стосується застосування фармацевтичної композиції сполуки формули І, вміщеної в блістерну упаковку з алюмінієвої фольги з азотом, у комбінації з іншими кардіозахисними засобами для лікування серцево-судинних захворювань. Цей винахід стосується способу підвищення стабільності та терміну зберігання фармацевтичної композиції, яка містить сполуку формули І, у якому окремі таблетки, каплети або капсули сполуки формули І вміщуються у блістерну упаковку з алюмінієвої фольги з азотом. Цей винахід пропонує лікарську форму сполуки формули І, яка містить терапевтично ефективну кількість сполуки формули І від приблизно 5 мг до приблизно 60 мг (у розрахунку на вільну основу), вміщену в блістерну упаковку з алюмінієвої фольги з інертним газом. Цей винахід пропонує спосіб виготовлення сполуки формули І, який включає такі стадії: (a) виготовлення таблеток, каплет або капсул сполуки формули І та (b) вміщення згаданих таблеток, каплет або капсул сполуки формули І у блістерну упаковку з алюмінієвої фольги з інертним газом. Цей винахід пропонує готовий виріб, який містить сполуку формули І, вміщений у повітро- та вологонепроникну блістерну упаковку з інертним газом. Цей винахід стосується способу лікування серцево-судинних захворювань, який включає введення в організм пацієнта, що потребує такого лікування, лікарської форми сполуки формули І, яка містить терапевтично ефективну кількість згаданої сполуки у вигляді таблетки, каплети, капсули або іншої твердої лікарської форми сполуки формули І, вміщену у повітро- та вологонепроникну блістерну упаковку з інертним газом. Цей винахід стосується способу виготовлення лікарського засобу, який включає вміщення сполуки формули І у повітро- та вологонепроникну блістерну упаковку, яка містить переважно інертний газ, для застосування окремо або в комбінації з іншими кардіозахисними засобами для лікування, профілактики та/або полегшення серцевосудинних захворювань. Детальний опис винаходу Термін «прасугрель» при вживанні в цьому описі означає сполуку формули І, представленої вище. Хоча для позначення цієї сполуки в цьому описі та в інших документах вживаються також назви CS-747HC1 та прасугрель-НСІ, ці терміни означають ту саму сполуку формули І, представленої вище. 5 Термін «серцево-судинні захворювання» стосується захворювань, які можуть бути вилікувані, попереджені або полегшені шляхом лікування сполукою формули І та/або шляхом виконання процедур втручань у серцеву діяльність, у тому числі коронарні (РСІ) та некоронарні втручання. Прикладами серцево-судинних захворювань, що охоплюються цим винаходом, є оклюзія коронарної артерії, рестеноз, інсульт, гострий коронарний синдром, (ACS), ACS під медичним контролем (ACS-MM), судинні захворювання високого ризику (HRVD), аневризма мозкових судин (CVA), застійна серцева недостатність, альтернація серця, шлуночкова аневризма, невральна аневризма, інфаркт міокарда, зупинка серця, серцева аритмія, у тому числі фібріляція передсердь, серцевий набряк, задишка при серцевій недостатності, серцева недостатність, тахікардія, кровохаркання при лівошлуночковій недостатності, функціональна серцева недостатність, серцевий шум, втрата свідомості внаслідок раптового падіння серцевого викиду, тампонада серця, захворювання мозкових судин та/або захворювання периферичних артерій. Термін «введення» при вживанні в цьому описі стосується перорального введення сполуки формули І, у тому числі трансбукального, сублінгвального та інших форм перорального введення, які уможливлюють вплив сполуки формули І на організм із метою здійснення її цільової функції лікування та/або профілактики виникнення або рецидиву серцево-судинних захворювань, причому цей вплив здійснюється незалежно або як елемент комплексної терапії (лікування) із застосуванням процедур втручання, наприклад, процедури РСІ, або як елемент комплексної терапії із застосуванням інших кардіозахисних засобів. Таке введення при комплексній терапії включає виконання процедур РСІ, наприклад, імплантації розширювача або виконання балонної пластики судини. Термін «лікування» у цьому описі означає полегшення, пригнічення, попередження виникнення або рецидиву, послаблення тяжкості або впливу серцево-судинних захворювань, до яких належать (без обмеження поданим переліком) рестеноз, гострий коронарний синдром (ACS), у тому числі ACS під медичним контролем, інфаркт міокарда, серцево-судинна аневризма та судинні захворювання високого ризику, шляхом застосування сполуки формули І окремо або у комбінації з іншими кардіозахисними засобами або як допоміжний засіб при процедурі втручання, наприклад, процедурі РСІ або іншій процедурі втручання. Термін «терапевтично ефективна кількість» при вживанні в цьому описі означає кількість сполуки формули І у формі однієї або кількох одиниць, необхідну або достатню для лікування конкретного серцево-судинного захворювання в режимі лікування, який включає сполуку формули І, визначеному кваліфікованим лікарем-куратором або схваленому відповідними керівними органами. Терапевтично ефективна кількість може варіювати залежно від чинників, відомих фахівцеві у галузі (кваліфікованому лікареві-куратору), до яких належать, наприклад, факультативна комбінація 91051 6 сполуки формули І з аспірином або іншим кардіозахисним засобом, або з процедурою втручання, наприклад, із РСІ, застосуванням розширювачів, що мають покриття з лікарської речовини, спосіб та режим введення, масу тіла пацієнта, генетична або поведінкова схильність до серцево-судинних захворювань або тяжкість чи рецидивність цих захворювань. Досвідчений фахівець у галузі здатний урахувати ці та аналогічні чинники та прийняти відповідне рішення щодо терапевтично ефективної кількості для конкретного пацієнта. Вислів «інші кардіозахисні засоби» при вживанні в цьому описі означає терапевтичні засоби, випробувані та прийняті як такі, що забезпечують сприятливі впливи (лікування та/або попередження виникнення чи рецидивів) на пацієнта, ураженого серцево-судинними захворюваннями чи схильного до них. Прикладами кардіозахисних засобів є (без обмеження поданим переліком) аспірин, ефективні інгібітори GPIIb/IIIa, ефективні статини, наприклад, інгібітори HMG-CoA-редукгази, суперстатини, інгібітори ацил-СоА-холестерин-Оацилтрансферази (АСАТ), ефективні антикоагулянти, ефективні тієнопіридини та інші ефективні засоби модифікування ліпідів. Вислів «фармацевтично прийнятний носій» означає будь-яку речовину або середовище, введену (введене) у лікарську форму сполуки формули І, яка (яке) уможливлює здійснення цією сполукою функції, для якої вона призначена. Прикладами таких носіїв є розчини, розчинники, дисперсійні середовища, модифікатори вивільнення, емульсії, мікрочастинки тощо для комплексної терапії. Вислови «комплексна терапія», «комплексне лікування», «у сполученні з», «комбінація сполуки формули І та розширювача» та «у сполученні з процедурою РСІ» в разі вживання в цьому описі є синонімами та вказують, що пацієнту, який є кандидатом на процедуру РСІ або іншу процедуру втручання, вводять терапевтично ефективну дозу (дози) сполуки формули І або її фармацевтично прийнятної солі, проліків, активного метаболіту, рацемату або енантіомеру, факультативно в комбінації з аспірином протягом доцільного періоду часу перед РСІ або іншою процедурою втручання та/або після такої процедури. Доцільний період часу введення сполуки формули І, факультативно в комбінації з аспірином, перед РСІ або іншою процедурою втручання може досягати 60 діб та може не включати попереднього введення. Метою попереднього введення є досягнення поточного сприятливого ефекту, а також швидкого початку впливу на функцію тромбоцитів перед процедурою втручання та, крім того, швидкого початку характерної дії сполуки формули І без попереднього лікування (ударної дози) і, тим самим, досягнення максимальної потенціальної корисності для пацієнта. Введення сполуки формули І перед процедурою втручання, наприклад, перед встановленням розширювача або балонною пластикою судин, може виявитися непрактичним або не необхідним в обставинах, що вимагають невідкладних заходів. Для цілей цього винаходу доцільний період комплексного лікування сполукою формули І після РСІ 7 або іншої процедури втручання може становити від приблизно 5 діб до приблизно 700 діб, при цьому перевага віддається тривалості цього періоду від приблизно 30 діб до приблизно 365 діб. Зрештою, точний період терапії за цим винаходом має визначати лікар-куратор стосовно конкретного пацієнта. Вислів «повітро- та вологонепроникний» при вживанні в цьому описі означає матеріал відповідної товщини, відомий фахівцю у галузі або оцінюваний при мінімальному обсязі експериментальної праці як такий, що після герметизації згідно з технічними вимогами здатний істотною мірою запобігти входу в герметизований об'єм та виходу з нього повітря та вологи. Фахівцю в галузі зрозуміло, що досягнення абсолютної непроникності може бути утруднене, та що автори винаходу вважають, що вислів «повітро- та вологонепроникний» стосовно матеріалу або блістерної упаковки вживається у відносному значенні, виходячи з того факту, що фахівцю у галузі відомо, що деякі матеріали є меншою мірою непроникними для повітря та вологи, ніж інші, та що абсолютної непроникності досягти важко. Перевага віддається матеріалам, непроникним як для повітря, так і для вологи. Прикладами повітро- та вологонепроникних матеріалів є алюміній, поліхлортрифторетилен (ПХТФЕ, PCTFE) (Асіаг®) та Aclar®-EVOH. Найбільша перевага віддається блістерним упаковкам з алюмінієвої фольги. Вислів «з інертним газом» при вживанні в цьому описі означає, що порожнину або простір у блістерній упаковці, не зайнятий таблеткою, каплетою або капсулою, оточує газ, інертний відносно таблетки, каплети, капсули або іншої твердої лікарської форми. Цей газ може бути інертним газом або іншим газом, який не впливає негативно на таблетку, каплету або капсулу (не реагує з ними). Прикладами корисних інертних газів є СО2, аргон, азот, неон, криптон та СО (у нелетальних фармацевтично прийнятних кількостях). Більша перевага серед газів, корисних для здійснення цього винаходу, віддається азоту та аргону. Найбільша перевага віддається азоту. Вислови «переважно» та «переважність інертного газу» при вживанні в цьому описі є синонімами та означають, що об'єм простору, який оточує таблетку, каплету або капсулу у порожнині блістерної упаковки, практично повністю або майже повністю, або максимальною практично можливою мірою заповнений азотом або іншим інертним газом. Ефектом згаданої «переважності інертного газу» є зниження вмісту кисню до рівня приблизно нижче ніж 2-4%. Термін «еквівалент основи» вживається в цьому описі у своєму звичайному значенні, тобто означає кількість сполуки формули І (солі з НСl), еквівалентну кількості вільної основи. Фахівець у галузі здатний провести таке перетворення, і у прикладах вказано еквівалентні кількості проб. Термін «інша тверда лікарська форма» при вживанні в цьому описі охоплює лікарські форми швидкого розпадання, швидкого розчинення, швидкого вивільнення та інші прийняті або прийнятні тверді лікарські форми, відомі фахівцям у галузі. 91051 8 Термін «лікарська форма» у цьому описі вживається у своєму звичайному значенні і охоплює також фармацевтичні препарати сполуки формули І та упаковку сполуки формули І за цим винаходом. Таким чином, лікарською формою для мети цього винаходу є сполука формули І, виготовлена у вигляді таблетки, каплети, капсули, форми повільного вивільнення або швидкого розпадання (розчинення), або іншої твердої лікарської форми, вміщеної в упаковку з алюмінієвої фольги з інертним газом для мети цього винаходу. Аналогічно, сполука формули І, виготовлена у вигляді таблетки, каплети, капсули, форми повільного вивільнення або швидкого розпадання (розчинення), або іншої твердої лікарської форми, вміщеної в упаковку з алюмінієвої фольги з інертним газом є промисловим виробом для мети цього винаходу. Варіанти здійснення винаходу, яким віддається перевага Одним із варіантів здійснення цього винаходу є забезпечення фармацевтичної лікарської форми, яка включає сполуку формули І, в якій окремі таблетки, каплети або капсули згаданої сполуки вміщені в упаковку з повітро- та вологонепроникного матеріалу, яка вміщує інертний газ, із метою підвищення стабільності та/або подовження терміну зберігання. Один із варіантів здійснення цього винаходу, якому віддається перевага, пропонує лікарську форму сполуки формули І, в якій таблетки, каплети або капсули, які містять сполуку формули І, вміщені в блістерну упаковку з алюмінієвої фольги в атмосфері, яка вміщує переважно інертний газ. За іншим варіантом здійснення винаходу, якому віддається перевага, таблетки, каплети або капсули сполуки формули І вміщені в блістерні упаковки, які вміщують газ, вибраний з групи, до якої входять азот, гелій, неон, аргон, діоксид вуглецю та монооксид вуглецю. За варіантом, якому віддається більша перевага, таблетки, каплети або капсули сполуки формули І вміщені в блістерні упаковки, які вміщують газ, вибраний з групи, до якої входять азот, гелій та аргон. За варіантом, якому віддається найбільша перевага, таблетки, каплети або капсули сполуки формули І вміщені в блістерні упаковки з азотом. Таким чином, лікарська форма, якій віддається найбільша перевага, включає в себе таблетки, каплети або капсули сполуки формули І вміщені в блістерні упаковки з алюмінієвої фольги з азотом. За іншим варіантом здійснення винаходу, якому віддається перевага, сполука формули І, вміщена у повітро- та вологонепроникну упаковку з алюмінієвої фольги з азотом, пристосована для лікування ACS, ACS під медичним контролем, інсульту та HRVD окремо або у комбінації з іншими кардіозахисними засобами або як допоміжний засіб при процедурі втручання, наприклад, процедурі РСІ або іншій процедурі втручання. Сполуку формули І, її аналоги, солі, сольвати та енантіомери можна одержати різноманітними способами, у тому числі способами, описаними частково або повністю в інформації, поданій у патентах СІЛА № 5,288,726 та № 6,693,115В2, вміст 9 яких у повному обсязі включено до цього опису шляхом посилання. Зокрема, у патенті США № 6,693,115В2 розкрито та заявлено гідрохлорид 2ацетокси-5-( -циклопропілкарбоніл-2фторбензил)-4,5,6,7-тетрагідротієно[3,2-с]піридину - сполуку формули І, відому також під назвою прасугрель. Тверду дозовану форму для перорального введення можна виготовити, застосовуючи різноманітні фармацевтично прийнятні допоміжні речовини, добре відомі фахівцям у галузі. Як правило, вибирають одну або кілька допоміжних речовин із кожної з таких категорій: (a) розріджувачі, наприклад (але не тільки), маніт, моногідрат лактози, попередньо желатинізований крохмаль або мікрокристалічна целюлоза; (b) розпушувальні речовини, наприклад (але не тільки) натрієва кроскармелоза, гідроксипропілцелюлоза низького ступеня заміщення або крохмаль-гліколят натрію; (c) в'яжучі, у тому числі (але не тільки) гідроксипропілметилцелюлоза та гідроксипропілцелюлоза. Для виготовлення таблеток рекомендується також змащувальний засіб, наприклад (але не тільки), стеарат магнію, стеаринова кислота та гліцерилбегенат. При виготовленні таблеток часто виявляється доцільним виконання плівкового покриття на таблетках для забезпечення фармацевтично прийнятного зовнішнього вигляду та полегшення ковтання таблеток. Комерційні постачальники, наприклад, фірма Colorcon Inc. (США) виробляють різноманітні системи для плівкових покриттів, які включають полімери, пластифікатори та пігменти, які можна змішувати з водою та наносити набризкуванням на таблетки у чашах для покриття з бічною вентиляцією. Система, якій віддається особлива перевага, постачається на ринок під назвою Opadry II®, і ця система для плівкових покриттів (яка містить як домішку моногідрат лактози) є особливо корисною для покриття плівкою таблеток із неопуклою поверхнею. Зрозуміло, що прасугрель можна змішувати з однією або кількома з вищезгаданих допоміжних речовин та вміщувати у капсули або пресувати у таблетки. З метою покращення характеристик плинності може бути доцільним пропускати згадані суміші через валковий ущільнювач або інший пристрій для одержання більш плинного матеріалу. З урахуванням характеристик стабільності прасугрелю (схильності до гідролізу та окиснення), не рекомендується застосування деяких допоміжних речовин — особливо повідону та кросповідону (які, як правило, містять слідові кількості пероксидів) та процесів виготовлення (наприклад, вологого гранулювання). Блістерна упаковка з алюмінієвої фольги з інертним газом є доцільним та привабливим вирішенням проблеми. Доцільним вирішенням проблеми додаткового підвищення стабільності виробленого продукту є застосування блістерної упаковки для окремих дозованих одиниць, зокрема, блістерної упаковки з алюмінієвої фольги з інертним газом. Блістерна упаковка для окремих дозованих одиниць є зручним рішенням для пацієнтів та пра 91051 10 цівників охорони здоров'я, і такі комірки та упаковки можна виготовляти із численних плівкотвірних матеріалів. Блістери звичайно виготовляються з плівок, які включають ПВХ, ПХТФЕ та інші домішки, що уможливлюють формування комірок (блістерів) шляхом нагрівання та механічної обробки з метою утворення комірок для вміщення готових твердих дозованих лікарських форм для перорального застосування (капсул, м'яких капсул або таблеток). Після вміщення лікарських форм у сформовані комірки на верхній бік комірок накладають покривну композитну плівку та герметично з'єднують покривну плівку з блістерною плівкою шляхом постачання відповідної кількості тепла. Фахівець у галузі здатний здійснити цю процедуру, у тому числі визначити необхідну відповідну кількість тепла без надмірного експериментування. Інший тип блістерної упаковки для дозованих лікарських форм складається з алюмінієвих блістерів холодного формування. В таких випадках виконують формування фольги більшої товщини з відповідними домішками без застосування тепла з утворенням комірок для вміщення твердих дозованих лікарських форм для перорального введення. Після вміщення лікарських форм у сформовані комірки на верхній бік комірок накладають покривну композитну фольгу та герметично з'єднують покривну плівку з комірками шляхом постачання відповідної кількості тепла. Значною перевагою цього типу блістерів є те, що алюмінієва фольга практично є непроникною для вологи та кисню і, отже, може бути особливо придатною для пакування дозованих форм прасугрелю (сполуки формули І), які вимагають посиленого захисту від впливу вологи та повітря. Найбільша перевага віддається повітро- та вологонепроникній блістерній упаковці з інертним газом, яка має алюмінієві комірки та покриття з алюмінієвої фольги. Введення інертної атмосфери у блістерні комірки можна виконувати різними способами. За одним варіантом, можна застосувати вакуум для видалення повітря зі сформованих комірок з подальшим вміщенням таблеток у комірки всередині камери, приєднаної до блістерної машини, з уможливленням регулювання атмосфери шляхом введення інертного газу і, тим самим, ефективного зведення до мінімуму вмісту кисню. За альтернативним варіантом, до блістерної машини може бути приєднаний газопродувальний пристрій для подавання інертного газу під тиском у комірки, що містять таблетки, безпосередньо перед їх надходженням на герметизацію. Шляхом регулювання тиску газу у газопродувальному пристрої можна витіснити кисневмісну атмосферу з комірок, ефективно знижуючи вміст кисню у комірках, які містять лікарську форму, шляхом заповнення комірок переважно інертним газом. За ще одним альтернативним варіантом, створення інертної атмосфери можна забезпечити шляхом впорскування регульованої кількості зрідженого інертного газу у блістерну комірку безпосередньо перед її подаванням на герметизацію. В процесі нагрівання та розширення газу кисень може ефективно витіснятися з комірки. Ілюстрація винаходу 11 На стабільність сполуки формули І у формі таблеток, каплет або капсул впливають різноманітні чинники, у тому числі тривалість зберігання та умови зберігання, наприклад, температура та відносна вологість. Належні умови зберігання забезпечують тривалий термін зберігання, протягом якого ефективність таблеток, каплет або капсул із більшою ймовірністю залишається у межах рекомендованих та/або затверджених технічних вимог, тим самим забезпечуючи хімічну та фармакодинамічну цілісність таблеток, каплет або капсул, які вводяться в організм пацієнта. Дослідження показали, що незважаючи на вдосконалення, пов'язані із застосуванням хлористоводневої солі CS-747, що стосуються стабільності тощо (дивись патент 91051 12 США № 6,693,115В2), ще залишаються можливості для подальшого вдосконалення. Конкретно, на цей час відомо, що таблетки, які містять сполуку формули І, зазнають у процесі зберігання деградації як за гідролітичним, так і за окиснювальним механізмом. Вважається також, що існують перетини між цими шляхами деградації, де проміжні сполуки або продукти певних стадій одного шляху можуть зазнавати взаємних перетворень або прискорення чи сповільнення кінетики під впливом концентрації продукту (або проміжної сполуки), повітря чи вологи з навколишнього середовища або під впливом іншого шляху. Схему шляхів деградації, прийняту на даний час, показано нижче на Схемі 1 та Схемі 2. 13 Авторам винаходу вдалося індивідуально ідентифікувати продукти гідролітичної деградації ОХТР1 та ОХТР2, а також продукти окиснювальної деградації — дикетон та HYTP. Як показано на Схемі 2, вважається, що два первинних продукти деградації, таутомер ОХТР та іміній, вступають в реакцію між собою та утворюють суміш димерних ізомерів. Ці димерні ізомери можуть вступати в подальші реакції, утворюючи складну суміш продуктів, позначених на Схемі 2 як «домішки пізнього елюювання» (LEI). Рівень вмісту кожної індивідуальної LEI є незначним; однак за даними сумарного вимірювання ступінь деградації, що характеризується вмістом LEI, може бути значним. Автори винаходу досліджували вдосконалену лікарську форму шляхом контролювання кількостей цих продуктів деградації в залежності від часу в контрольованих умовах температури та вологості із застосуванням різних способів пакування. В ідеальній лікарській формі кількість усіх продуктів деградації мала б залишатися мінімальною протягом тривалого періоду часу. Проте, враховуючи взаємодію механізмів деградації та взаємні перетворення продуктів та шляхів деградації, подальшою найкращою можливістю є віднайдення упаковки або композиції лікарської форми, яка забезпечує найменшу зміну ефективності. Інакше кажучи, метою, якій віддається перевага, є віднайдення лікарської форми, яка забезпечує послаблення часової залежності вмісту більшості продуктів деградації, тим самим відповідаючи не задоволеній до цього часу потреби. Перевага віддається також лікарській формі прасугрелю, яка включає спосіб та процес пакування, при якому реалізується потенціальна перевага «регулювання» суміші продуктів деградації з метою забезпечення більш сприятливого розподілу. Наприклад, може бути бажаним зменшений вміст LEI при збільшеному вмісті ОХТР 1 та ОХТР 2. ОХТР 1 та ОХТР 2 є, поперше, більш «відомими» речовинами, по-друге, охарактеризовані у токсикологічних дослідженнях, по-третє, межі їх вмісту встановлено у технічних вимогах, і, по-четверте, їх можна кількісно визначити методами, які стосуються споріднених речовин. Автори винаходу досягли першої мети загального зниження профіля домішок, що забезпечує підвищену стабільність та збільшений термін зберігання. Цей винахід забезпечує також додаткову 91051 14 мету «регулювання» суміші продуктів деградації для сприяння зменшенню кількості LEI, які гірше ідентифіковані або невідомі, здебільшого не охарактеризовані, та граничні значення їх вмісту не задані технічними вимогами. Авторами винаходу зіставлено вплив пакувальних матеріалів та способів пакування на стабільність лікарського засобу, що містить сполуку формули І. Порівнювані матеріали та способи включали: (1) блістерні упаковки з азотом, що складалися з матеріалу блістерів товщиною 2,0 міл (0,05 мм), який містив ПХТФЕ (поліхлортрифторетилен), та покривної алюмінієвої фольги; (2) блістерні упаковки з азотом, що складалися з матеріалу блістерів товщиною 2,0 міл (0,05 мм), який містив ПХТФЕ в комбінації з полімером етилвінілового спирту (EVOH), та покривної алюмінієвої фольги; (3) блістерні упаковки без інертної атмосфери, що складалися з матеріалу блістерів з алюмінієвої фольги холодного формування та покривної алюмінієвої фольги; (4) блістерні упаковки з азотом, що складалися з матеріалу блістерів з алюмінієвої фольги холодного формування та покривної алюмінієвої фольги; та (5) флакон місткістю 75 мл, розрахований на 50 таблеток, який містив комбінований осушувач на основі силікагелю та активованого вугілля. Загальний опис упаковки та результати досліджень для кожного типу упаковки подано нижче. Таблетки лікарської форми, що містили 12,5 мг сполуки формули І, пакували у чотири описані вище види блістерних упаковок для дозованих одиниць. Потім таблетки у блістерних упаковках вміщували у камери з контрольованим середовищем, де створювалися такі умови: 25°С при відносній вологості (ВВ) 60%, 30°С при відносній вологості 65% та 40°С при відносній вологості 75%. Із цих камер відбирали проби через різні проміжки часу після початкового вміщення їх у контрольовані середовища. Проби піддавали хімічному аналізу для оцінювання змін ефективності, загального вмісту релевантних речовин (TRS), OXTP1, ОХТР2, дикетону, ΗΎΤΡ та домішок пізнього елюювання (LEI). Дані для проб матеріалів, взятих із різних блістерних упаковок, та дані для проб таблеток тієї самої партії, упакованих у флакон з осушувачем, виготовлений з поліетилену високого тиску (HDPE), поданонижче. 15 З Таблиці 1 видно, що ефективність таблеток, які зберігалися у блістерних упаковках холодного формування з алюмінієвої фольги, заповнених азотом, перевищує ефективність таблеток, що зберігалися в інших упаковках, які виявилися нездатними зберегти середовище з низьким вмістом кисню або були герметизовані в нормальних атмосферних умовах. Це твердження стосується кожного з варіантів умов зберігання (25°С, 60% ВВ та 30°С, 65% ВВ). Та сама тенденція спостерігалася при тривалості зберігання 10 місяців та 12 місяців. Домішки пізнього елюювання являють собою комбінацію хроматографічних піків, ідентичність яких не встановлено. Неочікуваною перевагою цього винаходу (зокрема, застосування блістерних 91051 16 упаковок холодного формування з алюмінієвої фольги, заповнених азотом) є значне зниження сумарного вмісту цих домішок пізнього елюювання (LEI), або продуктів деградації. Вміст LEI у таблетках, які зберігалися у блістерних упаковках холодного формування з алюмінієвої фольги, заповнених азотом, був значно нижчим, ніж у таблетках, що зберігалися в інших упаковках, які виявилися нездатними зберегти середовище з низьким вмістом кисню або були герметизовані в нормальних атмосферних умовах. Це твердження стосується кожного з варіантів умов зберігання (25°С, 60% ВВ, 30°С, 65% ВВ та 40°С, 75% ВВ, не показаного в таблиці). При виконанні цього дослідження були виготовлені порожні блістери, заповнені азотом, із 17 91051 18 використанням трьох матеріалів: ПХТФЕ товщиною 2,0 міл (0,05 мм), EVOH/ΠΧΤΦΕ та алюмінієві блістери холодного формування. Через певні проміжки часу вимірювали вміст кисню у цих порожніх блістерах для визначення впливу тривалості та умов зберігання на цей параметр. Типові результати подано на Фіг. 1. З урахуванням непридатності двох прозорих блістерних плівок (ПХТФЕ товщиною 2,0 міл (0,05 мм) та EVOH/ΠΧΤΦΕ) для збереження середовища з низьким вмістом кисню, ці блістери не випробовувалися у деякі пізніші моменти часу в процесі цього дослідження. Це дослідження показало, що найменша кількість кисню зберігається на протязі часу у алюмінієвих блістерах холодного формування, заповнених азотом, які зберігалися при 30°С, 65% ВВ. На наступній стадії досліджень стабільності лікарської форми таблетки, що містили 12,5 мг сполуки формули І, пакували у фольгові комірки, які заповнювали газом, що містив відомі концентрації кисню в азоті, з метою подальшого з'ясування впливу концентрації на утворення домішок у лікарській формі. Результати цього дослідження, названого в цьому описі «дослідженням способом Мультивак», подано нижче в Таблиці 2. З Таблиці 2 видно, що ефективність таблеток, які зберігалися у середовищах із низьким вмістом кисню, наприклад, в умовах, що забезпечувалися у блістерних упаковках холодного формування з алюмінієвої фольги, заповнених азотом, систематично перевищувала ефективність таблеток, що зберігалися в нормальних атмосферних умовах або у середовищах з підвищеним вмістом кисню. Це твердження стосується кожного з варіантів умов випробування на стабільність (25°С, 60% ВВ, 30°С, 65% ВВ та 40°С, 75% ВВ). Вміст LEI у таблетках, які зберігалися у комірках (блістерних упаковках) із низьким вмістом кисню, був систематично нижчим, ніж у таблетках, що зберігалися в упаковках із нормальною атмосферою або у середовищах із підвищеним вмістом кисню. Це твердження стосується кожного з варіантів умов зберігання (25°С, 60% ВВ, 30°С, 65% ВВ та 40°С, 75% ВВ). 19 91051 20 Для з'ясування впливу вологості на результуючу стабільність таблеток при зберіганні у блістерах з азотом або з нормальною атмосферою таблетки лікарської форми 2 (описаної нижче) зберігали при різних значеннях відносної вологості, а потім пакували у блістери холодного формування із заповненням або без заповнення азотом. Результати цього дослідження подано в Таблиці 3. З Таблиці 3 видно, що ефективність таблеток, які піддавалися дії нижчої відносної вологості, а потім зберігалися у блістерних упаковках холодного формування з алюмінієвої фольги в атмосфері азоту, систематично перевищувала ефективність таблеток, які піддавалися дії підвищеної вологості, після чого пакувалися у нормальних атмосферних умовах. Це твердження стосується кожного з варіантів умов випробування на стабільність (25°С, 60% ВВ, 30°С, 65% ВВ та 40°С, 75% ВВ). З Таблиці 3 видно також, що вміст LEI у таблетках, які перед пакуванням піддавалися дії нижчої відносної вологості, а потім зберігалися у блістерних упаковках холодного формування з алюмінієвої фольги в атмосфері азоту, був систематично нижчим, ніж у таблетках, які піддавалися дії підвищеної вологості, після чого пакувалися у нормальних атмосферних умовах. Це твердження стосується кожного з варіантів умов випробування на стабільність (25°С, 60% ВВ, 30°С, 65% ВВ та 40°С, 75% ВВ). Пік дикетону Цей винахід виявляє значне та неочікуване поліпшення у порівнянні з іншими формами лікарської сполуки також стосовно випробуваного рівня вмісту дикетону як однієї з релевантних сполук, що свідчить про перевагу винаходу. У всіх дослідженнях (Таблиці 1-3) виявлено, що утворення цієї домішки пов'язано з концентраціями кисню. Упаковки, наприклад, блістери холодного формування з алюмінієвої фольги, заповнені азотом, де міститься та зберігається середовище зі зниженим містом кисню, сприяють мінімізації утворення цієї домішки. Пік НYТР Цей винахід виявляє значне та неочікуване поліпшення у порівнянні з іншими формами лікарської сполуки/упаковками також стосовно до кіль кості HYTP. У всіх дослідженнях (Таблиці 1-3) виявлено, що утворення цієї домішки пов'язано з концентраціями кисню. Упаковки, наприклад, блістери холодного формування з алюмінієвої фольги, заповнені азотом, де міститься та зберігається середовище зі зниженим вмістом кисню, сприяють мінімізації утворення цієї домішки. Крім того, оскільки ця домішка є похідним продуктів гідролізу (ОХТР), то вплив зниженої відносної вологості та/або упаковок, які містять осушувач, також сприяє послабленню утворення цієї домішки. Таким чином, заявники також пропонують спосіб ефективного регулювання розподілу домішок. Застосування блістерних упаковок, заповнених азотом, обумовлює зменшення кількостей домішок, як показано вище. Важливе значення має також те, що таке застосування змінює розподіл домішок внаслідок особливої мінімізації кількості LEI. При використанні цього винаходу заявниками було досягнуто зниження активності води до рівнів від приблизно 0,2 до приблизно 0,4. Заявниками досягнуто також зниження вмісту кисню у газовому просторі блістерних упаковок до рівнів нижче приблизно 2-4%. Спосіб застосування винаходу Спосіб застосування винаходу включає виготовлення та застосування фармацевтичної лікарської форми, яка включає в себе таблетки, каплети або капсули сполуки формули І, упаковані в алюмінієві блістерні комірки, заповнені азотом. Блістерні комірки можуть являти собою окремі одиниці або утворювати пластину з'єднаних між собою блістерних комірок із перфорацією вздовж ліній з'єднання для зручності виготовлення та постачання або пакування для продажу згідно із затвердженими вимогами. Спосіб за цим винаходом включає лікарську форму активного інгредієнта у вигляді таблетки, каплети або капсули, у тому чи 21 слі капсули для повільного вивільнення або таблеток швидкого розпадання, упаковану в блістерну упаковку з інертним газом, причому перевага віддається блістерним упаковкам з алюмінієвої фольги. Вдосконалений процес виготовлення лікарської форми за визначенням, поданим у цьому описі, включає пакування таблетки, каплети або капсули у блістерну комірку, заповнену інертним газом, причому перевага віддається блістерним коміркам з алюмінієвої фольги. У типових випадках таблетка, каплета або капсула може містити від приблизно 1 мг до приблизно 60 мг сполуки формули І. У варіанті, якому віддається перевага, таблетка, каплета або капсула може містити від приблизно 5 мг до приблизно 60 мг еквіваленту основи сполуки формули І. У варіанті, якому віддається найбільша перевага, таблетка, каплета або капсула може містити приблизно 5 мг, 10 мг, 15 мг, 30мг або 60 мг еквіваленту основи сполуки формули І. Описані нижче методики виготовлення таблеток, каплет або капсул, корисних для здійснення цього винаходу, є лише ілюстративними і не призначені для будь-якого обмеження обсягу винаходу. Мається на увазі, що виготовлені таким чином таблетки, каплети або капсули потім пакуються у блістерні комірки з алюмінієвої фольги, заповнені азотом, виготовлення яких описане у прикладах та в інших розділах цього документу. Вислів «активний інгредієнт» означає сполуку формули І або її фармацевтично прийнятну сіль, сольват, активний метаболіт, енантіомер, рацемат або проліки спільно з іншим кардіозахисним засобом (засобами), який (які) слід вводити в організм пацієнта, котрий цього потребує, факультативно в комбінації з аспірином або як допоміжну речовину при застосуванні розширювача або процедури РСІ. Приклади Описані нижче приклади виготовлення таблеток, каплет або капсул та порівняльні приклади призначені для додаткового ілюстрування цього винаходу та не призначені для обмеження його обсягу. Лікарська форма 1 CS-747 HCl (13,72 мг, еквівалент 12,5 мг основи), маніт, гідроксипропілметилцелюлозу, натрієву кроскармелозу, мікрокристалічну целюлозу та стеарат магнію змішують, після чого пропускають через валковий ущільнювач для гранулювання. До одержаного грануляту додають додаткові кількості натрієвої кроскармелози, мікрокристалічної целюлози та стеарату магнію, матеріал змішують та пресують у таблетки масою по 250 мг. Суміш Opadry®II для бежевого плівкового покриття додають до води, після чого наносять набризкуванням на згадані таблетки у чаші для покриття з бічною вентиляцією. Одержані таблетки потім пакують у блістерні комірки з алюмінієвої фольги, які заповнюють інертним газом, наприклад, азотом, після чого герметизують, застосовуючи процедури, відомі фахівцям у галузі. Лікарська форма 2 CS-747 HCl (10,98 мг, еквівалент 10,00 мг основи), маніт, гідроксипропілметилцелюлозу, натрієву кроскармелозу, мікрокристалічну целюлозу та 91051 22 стеарат магнію змішують, після чого пропускають через валковий ущільнювач для гранулювання. До одержаного грануляту додають додаткові кількості натрієвої кроскармелози, мікрокристалічної целюлози та стеарату магнію, матеріал змішують та пресують у таблетки масою по 250 мг. Суміш Opadry®H для бежевого плівкового покриття додають до води, після чого наносять набризкуванням на згадані таблетки у чаші для покриття з бічною вентиляцією. Тверді композиції сполуки формули І можна виготовляти, застосовуючи вказані нижче інгредієнти (в розрахунку на одну таблетку, капсулу або каплету). Лікарська форма 3 CS-747 HCl (5,49 мг, еквівалент 5,0 мг основи), маніт, гідроксипропілметилцелюлозу, натрієву кроскармелозу, мікрокристалічну целюлозу та стеарат магнію змішують, після чого пропускають через валковий ущільнювач для гранулювання. До одержаного грануляту додають додаткові кількості натрієвої кроскармелози, мікрокристалічної целюлози та стеарату магнію, матеріал змішують та пресують у таблетки масою по 125-250 мг. Суміш Opadry®II для бежевого плівкового покриття додають до води, після чого наносять набризкуванням на згадані таблетки у чаші для покриття з бічною вентиляцією. Одержані таблетки, каплети або капсули потім пакують у блістерні комірки з алюмінієвої фольги, які заповнюють інертним газом, застосовуючи процедури, описані в цьому документі або відомі фахівцям у галузі, або такі, які фахівець у галузі може здійснити при мінімальному експериментуванні. Після цього таблетки, каплети або капсули завантажують у коробки для зберігання та/або перевезення. Лікарська форма 4 CS-747 HCl (8,24 мг, еквівалент 7,5 мг основи), маніт, гідроксипропілметилцелюлозу, натрієву кроскармелозу, мікрокристалічну целюлозу та стеарат магнію змішують, після чого пропускають через валковий ущільнювач для гранулювання. До одержаного грануляту додають додаткові кількості натрієвої кроскармелози, мікрокристалічної целюлози та стеарату магнію, матеріал змішують та пресують у таблетки масою по 125-250 мг. Суміш Opadry®II для бежевого плівкового покриття додають до води, після чого наносять набризкуванням на згадані таблетки у чаші для покриття з бічною вентиляцією. Одержані таблетки, каплети або капсули потім пакують у блістерні комірки з алюмінієвої фольги, які заповнюють інертним газом, застосовуючи процедури, описані в цьому документі або відомі фахівцям у галузі, або такі, які фахівець у галузі може здійснити при мінімальному експериментуванні. Після цього таблетки, каплети або капсули завантажують у коробки для зберігання та/або перевезення. Лікарська форма 5 CS-747 HC1 (16,47 мг, еквівалент 15,00 мг основи), маніт, гідроксипропілметилцелюлозу, натрієву кроскармелозу, мікрокристалічну целюлозу та стеарат магнію змішують, після чого пропускають через валковий ущільнювач для гранулювання. До 23 91051 одержаного грануляту додають додаткові кількості натрієвої кроскармелози, мікрокристалічної целюлози та стеарату магнію, матеріал змішують та пресують у таблетки масою по 125-250 мг. Суміш Opadry®II для бежевого плівкового покриття додають до води, після чого наносять набризкуванням на згадані таблетки у чаші для покриття з бічною вентиляцією. Одержані таблетки, каплети або капсули потім пакують у блістерні комірки з алюмінієвої фольги, які заповнюють інертним газом, застосовуючи процедури, описані в цьому документі або відомі фахівцям у галузі, або такі, які фахівець у галузі може здійснити при мінімальному експериментуванні. Після цього таблетки, каплети або капсули завантажують у коробки для зберігання та/або перевезення. Лікарська форма 6 CS-747 HC1 (32,94 мг, еквівалент 30 мг основи), маніт, гідроксипропілметилцелюлозу, натрієву кроскармелозу, мікрокристалічну целюлозу та стеарат магнію змішують, після чого пропускають через валковий ущільнювач для гранулювання. До Комп’ютерна верстка І. Скворцова 24 одержаного грануляту додають додаткові кількості натрієвої кроскармелози, мікрокристалічної целюлози та стеарату магнію, матеріал змішують та пресують у таблетки масою по 125-250 мг. Суміш Opadry®II для бежевого плівкового покриття додають до води, після чого наносять набризкуванням на згадані таблетки у чаші для покриття з бічною вентиляцією. Одержані таблетки, каплети або капсули потім пакують у блістерні комірки з алюмінієвої фольги, які заповнюють інертним газом, застосовуючи процедури, описані в цьому документі або відомі фахівцям у галузі, або такі, які фахівець у галузі може здійснити при мінімальному експериментуванні. Після цього таблетки, каплети або капсули завантажують у коробки для зберігання та/або перевезення. Для фахівця у галузі зрозуміло, що з використанням методик, описаних вище, можна виготовляти інші дози сполуки формули І, наприклад, 60 мг, з відповідним коригуванням стосовно даних доз. Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП ―Український інститут промислової власності‖, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюFormulation of a thienopyridine platelet aggregation inhibitor
Автори англійськоюDziennik David Brian, Edelman Tamara Beth, Oren Peter Lloyd, Ternik Robert Louis
Назва патенту російськоюЛекарственная форма тиенопиридинового ингибитора агрегации тромбоцитов
Автори російськоюДзенник Девид Брайан, Эдельман Тамара Бэт, Орен Питер Ллойд, Терник Роберт Луис
МПК / Мітки
МПК: A61K 31/4365, A61P 9/00
Мітки: форма, тромбоцитів, лікарська, агрегації, інгібітора, тієнопіридинового
Код посилання
<a href="https://ua.patents.su/12-91051-likarska-forma-tiehnopiridinovogo-ingibitora-agregaci-trombocitiv.html" target="_blank" rel="follow" title="База патентів України">Лікарська форма тієнопіридинового інгібітора агрегації тромбоцитів</a>
Попередній патент: Спосіб компенсації часу затримки встановлення електромагнітного зв’язку між двома будь-якими точками всесвіту
Наступний патент: Засіб для встановлення з’єднання між двома секціями кабелепідтримувального пристрою, а також з’єднувач
Випадковий патент: Підвісний високовольтний ізолятор












