Ацильовані аналоги глюкагону
Номер патенту: 104766
Опубліковано: 11.03.2014
Автори: Толборг Якоб Лінд, Кампен Гіта, Рібер Дітте, Мейєр Едді, Сковгаард Марі, Бек Камілла Ертеберг, Даугаард Йєнс Росенгрен
Формула / Реферат
1. Сполука, яка має формулу:
R1-Z-R2,
де R1 являє собою Н, С1-4 алкіл, ацетил, форміл, бензоїл або трифторацетил;
R2 являє собою ОН або NH2;
і Z являє собою пептид згідно з формулою І:
His-X2-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-X12-Tyr-Leu-Asp-X16-X17-Ala-Ala-X20-X21-Phe-Val-X24-Trp-Leu-X27-X28-Ala-X30; (I)
де
Х2 вибраний із Aib і Ser;
Х12 вибраний із Lys, Arg або Leu;
Х16 вибраний із Arg і X;
Х17 вибраний із Arg і X;
Х20 вибраний із Arg, His і X;
Х21 вибраний із Asp і Glu;
Х24 вибраний із Ala і X;
Х27 вибраний із Leu і X;
Х28 вибраний із Arg і X;
Х30 являє собою X або відсутній;
причому щонайменше один із X16, X17, Х20, Х24, Х27, Х28 і Х30 являє собою X;
і при цьому кожний залишок X незалежним чином вибраний із групи, яка складається з Glu, Lys, Ser, Cys, Dbu, Dpr і Orn;
при цьому бічний ланцюг щонайменше одного залишку X кон'югований із ліпофільним замісником, який має формулу:
(і) Z1, де Z1 являє собою ліпофільну групу, безпосередньо кон'юговану з бічним ланцюгом X;
або
(іі) Z1Z2, де Z1 являє собою ліпофільну групу, Z2 являє собою спейсер, і Z1 кон'югована з бічним ланцюгом X через Z2;
за умови, що Z не являє собою HSQGTFTSDYSKYLDS-K(гeкcaдeкaнoїл-g-Glu)-AAHDFVEWLLRA.
2. Сполука за п. 1, у якій один або більше зазначених залишків X незалежним чином вибраний із Lys, Glu і Cys.
3. Сполука за п. 1 або 2, у якій:
Х16 вибраний із Glu, Lys і Ser;
Х17 вибраний із Lys і Cys;
Х20 вибраний із His, Lys, Arg і Cys;
Х24 вибраний із Lys, Glu і Ala;
Х27 вибраний із Leu і Lys; і/або
Х28 вибраний із Ser, Arg і Lys.
4. Сполука за будь-яким із пп. 1-3, у якій зазначений пептид формули І містить одну з наступних комбінацій залишків:
Х2 являє собою Aib, і X17 являє собою Lys;
Х2 являє собою Aib, і X17 являє собою Cys;
Х2 являє собою Aib, і Х20 являє собою Cys;
Х2 являє собою Aib, і Х28 являє собою Lys;
X12 являє собою Arg, і X17 являє собою Lys;
X12 являє собою Leu, і X17 являє собою Lys;
X12 являє собою Lys, і Х20 являє собою Lys;
Х12 являє собою Lys, і X17 являє собою Lys;
X16 являє собою Lys, і X17 являє собою Lys;
X16 являє собою Ser, і X17 являє собою Lys;
X17 являє собою Lys, і Х20 являє собою Lys;
X17 являє собою Lys, і Х21 являє собою Asp;
X17 являє собою Lys, і Х24 являє собою Glu;
X17 являє собою Lys, і Х27 являє собою Leu;
X17 являє собою Lys, і Х27 являє собою Lys;
X17 являє собою Lys, і Х28 являє собою Ser;
X17 являє собою Lys, і Х28 являє собою Arg;
Х20 являє собою Lys, і Х27 являє собою Leu;
Х21 являє собою Asp, і Х27 являє собою Leu;
Х2 являє собою Aib, X12 являє собою Lys, і Х16 являє собою Ser;
Х12 являє собою Lys, X17 являє собою Lys, і Х16 являє собою Ser;
Х12 являє собою Arg, X17 являє собою Lys, і X16 являє собою Glu;
X16 являє собою Glu, X17 являє собою Lys, і Х20 являє собою Lys;
X16 являє собою Ser, X21 являє собою Asp, і Х24 являє собою Glu;
X17 являє собою Lys, X24 являє собою Glu, і Х28 являє собою Arg;
X17 являє собою Lys, Х24 являє собою Glu, і Х28 являє собою Lys;
X17 являє собою Lys, Х27 являє собою Leu, і Х28 являє собою Ser;
X17 являє собою Lys, X27 являє собою Leu, і Х28 являє собою Arg;
Х20 являє собою Lys, X24 являє собою Glu, і Х27 являє собою Leu;
Х20 являє собою Lys, X27 являє собою Leu, і Х28 являє собою Ser;
Х20 являє собою Lys, X27 являє собою Leu, і Х28 являє собою Arg.
X16 являє собою Ser, X20 являє собою His, X24 являє собою Glu, і Х27 являє собою Leu;
X17 являє собою Lys, X20 являє собою His, X24 являє собою Glu, і Х28 являє собою Ser;
X17 являє собою Lys, X20 являє собою Lys, X24 являє собою Glu, і Х27 являє собою Leu або
X17 являє собою Cys, X20 являє собою Lys, X24 являє собою Glu, і Х27 являє собою Leu.
5. Сполука за будь-яким із попередніх пунктів, у якій зазначений пептид формули І містить тільки одну амінокислоту зазначеного типу, кон'юговану з ліпофільним замісником.
6. Сполука за п. 5, у якій зазначений пептид містить тільки один залишок Lys, тільки один залишок Cys або тільки один залишок Glu, і при цьому зазначений ліофільний замісник кон'югований із цим залишком.
7. Сполука за будь-яким із попередніх пунктів, у якій зазначена послідовність пептиду формули І містить один або більше внутрішньомолекулярних містків.
8. Сполука за п. 7, у якій зазначений внутрішньомолекулярний місток утворений між бічними ланцюгами двох амінокислотних залишків, які розділені трьома амінокислотами в лінійній амінокислотній послідовності формули І.
9. Сполука за п. 8, у якій зазначений внутрішньомолекулярний місток утворений між бічними ланцюгами пар залишків 16 і 20, 17 і 21, 20 і 24 або 24 і 28.
10. Сполука за будь-яким із пп. 7-9, у якій зазначений внутрішньомолекулярний місток являє собою соляний місток або лактамне кільце.
11. Сполука за будь-яким із пп. 7-10, у якій зазначений внутрішньомолекулярний місток включає пари залишків, де:
Х16 являє собою Glu, і Х20 являє собою Lys;
Х16 являє собою Glu, і Х20 являє собою Arg;
Х16 являє собою Lys, і Х20 являє собою Glu; або
X16 являє собою Arg, і Х20 являє собою Glu;
X17 являє собою Arg, і Х21 являє собою Glu;
X17 являє собою Lys, і Х21 являє собою Glu;
X17 являє собою Arg, і Х21 являє собою Asp; або
X17 являє собою Lys, і Х21 являє собою Asp;
Х20 являє собою Glu, і and X24 являє собою Lys;
Х20 являє собою Glu, і Х24 являє собою Arg;
Х20 являє собою Lys, і Х24 являє собою Glu; або
Х20 являє собою Arg, і Х24 являє собою Glu;
Х24 являє собою Glu, і Х28 являє собою Lys;
Х24 являє собою Glu, і Х28 являє собою Arg;
Х24 являє собою Lys, і Х28 являє собою Glu; або
Х24 являє собою Arg, і Х28 являє собою Glu.
12. Сполука за будь-яким із попередніх пунктів, у якій щонайменше один із X16, X17, Х20 і Х28 кон'югований із ліпофільним замісником.
13. Сполука за будь-яким із пп. 1-10, у якій Х30 відсутній.
14. Сполука за будь-яким із пп. 1-10, у якій Х30 є присутнім і кон'югований із ліпофільним замісником.
15. Сполука за будь-яким із попередніх пунктів, у якій зазначена сполука містить тільки один ліпофільний замісник у положенні 16, 17, 20, 24, 27, 28 або 30, переважно в положенні 16, 17 або 20, зокрема в положенні 17.
16. Сполука за будь-яким із пп. 1-14, у якій зазначена сполука містить точно два ліпофільних замісники, кожний у одному з положень 16, 17, 20, 24, 27, 28 або 30.
17. Сполука за п. 16, у якій зазначена сполука містять ліпофільні замісники в положеннях 16 і 17, 16 і 20, 16 і 24, 16 і 27, 16 і 28 або 16 і 30; у положеннях 17 і 20, 17 і 24, 17 і 27, 17 і 28 або 17 і 30; у положеннях 20 і 24, 20 і 27, 20 і 28 або 20 і 30; у положеннях 24 і 27, 24 і 28 або 24 і 30; у положеннях 27 і 28 або 27 і 30; або у положеннях 28 і 30.
18. Сполука за п. 1, яка має формулу:
R1-Z-R2,
де R1 являє собою Н, С1-4 алкіл, ацетил, форміл, бензоїл або трифторацетил;
R2 являє собою ОН або NH2;
і Z являє собою пептид згідно з формулою ІІа:
His-Aib-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-X12-Tyr-Leu-Asp-X16-X17-Ala-Ala-X20-X21-Phe-Val-X24-Trp-Leu-Leu-X28-Ala; (ІІа)
де
Х12 вибраний із Lys, Arg і Leu;
Х16 вибраний із Ser і X;
X17 являє собою X;
Х20 вибраний із His і X;
Х21 вибраний із Asp і Glu;
Х24 вибраний із Ala і Glu;
Х28 вибраний із Ser, Lys і Arg;
і при цьому кожний залишок X незалежним чином вибраний із групи, яка складається з Glu, Lys і Cys;
причому бічний ланцюг щонайменше одного залишку X кон'югований із ліпофільним замісником, який має формулу:
(і) Z1, де Z1 являє собою ліпофільну групу, безпосередньо кон'юговану з бічним ланцюгом X;
або
(іі) Z1Z2, де Z1 являє собою ліпофільну групу, Z2 являє собою спейсер, і Z1 кон'югована з бічним ланцюгом X через Z2.
19. Сполука за п. 1, що має формулу:
R1-Z-R2
де R1 являє собою Н, С1-4 алкіл, ацетил, форміл, бензоїл або трифторацетил;
R2 являє собою ОН або NH2;
і Z являє собою пептид згідно з формулою ІІb:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-X12-Tyr-Leu-Asp-X16-X17-Ala-Ala-X20-X21-Phe-Val-X24-Trp-Leu-Leu-X28-Ala; (IIb)
де
X12 вибраний із Lys, Arg і Leu;
Х16 вибраний із Ser і X;
X17 являє собою X;
Х20 вибраний із His і X;
Х21 вибраний із Asp і Glu;
Х24 вибраний із Ala і Glu;
Х28 вибраний із Ser, Lys і Arg;
і при цьому кожний залишок X незалежним чином вибраний із групи, яка складається з Glu, Lys i Cys;
причому бічний ланцюг щонайменше одного залишку X кон'югований із ліпофільним замісником, який має формулу:
(і) Z1, де Z1 являє собою ліпофільну групу, безпосередньо кон'юговану з бічним ланцюгом X;
або
(іі) Z1Z2, де Z1 являє собою ліпофільну групу, Z2 являє собою спейсер, і Z1 кон'югована з бічним ланцюгом X через Z2;
за умови, що Z не являє собою HSQGTFTSDYSKYLDS-K(гeкcaдeкaноїл-g-Glu))-AAHDFVEWLLRA.
20. Сполука за п. 18, яка має формулу:
R1-Z-R2,
де R1 являє собою Н, С1-4 алкіл, ацетил, форміл, бензоїл або трифторацетил;
R2 являє собою ОН або NH2;
і Z являє собою пептид згідно з формулою ІІІа:
Ніs-Аіb-Сln-Glу-Тhr-Рhe-Тhr-Sеr-Аsр-Туr-Sеr-Х12-Туr-Lеu-Аsр-Sеr-Х17-Аlа-Аlа-Х20-Х21-Рhе-Val-X24-Trp-Leu-Leu-X28-Ala; (IIIa)
де
X12 вибраний із Lys і Arg;
X17 являє собою X;
Х20 вибраний із His і X;
Х21 вибраний із Asp і Glu;
Х24 вибраний із Ala і Glu;
Х28 вибраний із Ser, Lys і Arg;
і при цьому кожний залишок X незалежним чином вибраний із Glu, Lys і Cys;
причому бічний ланцюг щонайменше одного залишку X кон'югований із ліпофільним замісником, який має формулу:
(і) Z1, де Z1 являє собою ліпофільну групу, безпосередньо кон'юговану з бічним ланцюгом X; або
(іі) Z1Z2, де Z1 являє собою ліпофільну групу, Z2 являє собою спейсер, і Z1 кон'югована з бічним ланцюгом X через Z2.
21. Сполука за п. 19, яка має формулу:
R1-Z-R2,
де R1 являє собою Н, С1-4 алкіл, ацетил, форміл, бензоїл або трифторацетил;
R2 являє собою ОН або NH2;
і Z являє собою пептид згідно з формулою ІІІb:
His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-X12-Tyr-Leu-Asp-Ser-X17-Ala-Ala-X20-X21-Phe-Val-X24-Trp-Leu-Leu-X28-Ala; (ІІІb)
де
Х12 вибраний із Lys і Arg;
Х17 являє собою X;
Х20 вибраний із His і X;
Х21 вибраний із Asp і Glu;
Х24 вибраний із Ala і Glu;
Х28 вибраний із Ser, Lys і Arg;
і при цьому кожний залишок X незалежним чином вибраний із Glu, Lys і Cys;
причому бічний ланцюг щонайменше одного залишку X кон'югований із ліпофільним замісником, який має формулу:
(і) Z1, де Z1 являє собою ліпофільну групу, безпосередньо кон'юговану з бічним ланцюгом X;
або
(іі) Z1Z2, де Z1 являє собою ліпофільну групу, Z2 являє собою спейсер, і Z1 кон'югована з бічним ланцюгом X через Z2;
за умови, що Z не являє собою HSQGTFTSDYSKYLDS-K(гeкcaдeкaноїл-g-Glu))-AAHDFVEWLLRA.
22. Сполука за п. 20, яка має формулу:
R1-Z-R2,
де R1 являє собою Н, С1-4 алкіл, ацетил, форміл, бензоїл або трифторацетил;
R2 являє собою ОН або NH2;
і Z являє собою пептид згідно з формулою IVa:
Ніs-Аіb-Gln-Сlу-Тhr-Рhе-Тhr-Sеr-Аsр-Туr-Sеr-Х12-Туr-Lеu-Аsр-Sеr-Х17-Аlа-Аlа-Ніs-Х21-Рhе-Val-X24-Trp-Leu-Leu-X28-Ala; (IVa)
де
Х12 вибраний із Lys і Arg;
X17 являє собою X;
Х21 вибраний із Asp і Glu;
Х24 вибраний із Ala і Glu;
Х28 вибраний із Ser, Lys і Arg;
причому X вибраний із групи, яка складається з Glu, Lys і Cys;
і при цьому бічний ланцюг X кон'югований із ліпофільним замісником, який має формулу:
(і) Z1, де Z1 являє собою ліпофільну групу, безпосередньо кон'юговану з бічним ланцюгом X;
або
(іі) Z1Z2, де Z1 являє собою ліпофільну групу, Z2 являє собою спейсер, і Z1 кон'югована з бічним ланцюгом X через Z2.
23. Сполука за п. 21, що має формулу:
R1-Z-R2
де R1 являє собою Н, С1-4 алкіл, ацетил, форміл, бензоїл або трифторацетил;
R2 являє собою ОН або NH2;
і Z являє собою пептид згідно з формулою IVb:
Ніs-Sеr-Gln-Сlу-Тhr-Рhе-Тhr-Sеr-Аsр-Туr-Sеr-Х12-Туr-Leu-Аsр-Sеr-Х17-Аlа-Аlа-Ніs-Х21-Рhе-Val-X24-Trp-Leu-Leu-X28-Ala; (IVb)
де
Х12 вибраний із Lys і Arg;
X17 являє собою X;
Х21 вибраний із Asp і Glu;
Х24 вибраний із Ala і Glu
Х28 вибраний із Ser, Lys і Arg;
причому X вибраний із групи, яка складається з Glu, Lys і Cys;
і при цьому бічний ланцюг X кон'югований із ліпофільним замісником, який має формулу:
(і) Z1, де Z1 являє собою ліпофільну групу, безпосередньо кон'юговану з бічним ланцюгом X; або
(іі) Z1Z2, де Z1 являє собою ліпофільну групу, Z2 являє собою спейсер, і Z1 кон'югована з бічним ланцюгом X через Z2;
за умови, що Z не являє собою HSQGTFTSDYSKYLDS-K(гeкcaдeкaнoїл-g-Glu))-AAHDFVEWLLRA.
24. Сполука за будь-яким із попередніх пунктів, у якій зазначений пептид формули І має послідовність:
HSQGTFTSDYSKYLDSKAAHDFVEWLLRA;
HSQGTFTSDYSKYLDKKAAHDFVEWLLRA;
HSQGTFTSDYSKYLDSKAAKDFVEWLLRA;
HSQGTFTSDYSKYLDSKAAHDFVEWLKRA;
HSQGTFTSDYSKYLDSKAAHDFVEWLLKA;
HSQGTFTSDYSRYLDSKAAHDFVEWLLRA;
HSQGTFTSDYSLYLDSKAAHDFVEWLLRA;
HSQGTFTSDYSKYLDSKAAHDFVEWLLRAK;
HSQGTFTSDYSKYLDSKAAHDFVEWLLSAK
HSQGTFTSDYSKYLDSKAAHDFVEWLKSA;
HSQGTFTSDYSKYLDSKAAHDFVKWLLRA;
HSQGTFTSDYSKYLDSCAAHDFVEWLLRA;
HSQGTFTSDYSKYLDSCAAHDFVEWLLSA;
HSQGTFTSDYSKYLDSKAACDFVEWLLRA;
HSQGTFTSDYSKYLDKSAAHDFVEWLLRA;
H-Aib-QGTFTSDYSKYLDSKAAHDFVEWLLSA;
H-Aib-QGTFTSDYSKYLDSKAAHDFVEWLLSAK;
H-Aib-OGTFTSDYSKYLDSKAARDFVAWLLRA;
H-Aib-QGTFTSDYSKYLDSKAAKDFVAWLLRA;
H-Aib-OGTFTSDYSKYLDSKAAHDFVEWLLRA;
H-Aib-QGTFTSDYSKYLDSKAAHDFVEWLLKA
H-Aib-QGTFTSDYSKYLDSKAAKDFVAWLLSA
H-Aib-QGTFTSDYSKYLDSKAAHDFVAWLLKA;
H-Aib-QGTFTSDYSKYLDKKAAHDFVAWLLRA;
H-Aib-QGTFTSDYSRYLDSKAAHDFVEWLLSA;
H-Aib-QGTFTSDYSKYLDSKAAHDFVKWLLSA;
H-Aib-QGTFTSDYSLYLDSKAAHDFVEWLLSA;
H-Aib-QGTFTSDYSKYLDSCAAHDFVEWLLSA;
H-Aib-QGTFTSDYSKYLDSKAACDFVEWLLRA;
H-Aib-QGTFTSDYSKYLDK()KAAE()DFVEWLLRA;
H-Aib-QGTFTSDYSKYLDSKAAHDFVE()WLLK()A
H-Aib-QGTFTSDYSKYLDSKAAK()DFVE()WLLRA;
H-Aib-QGTFTSDYSKYLDSK()AAHE()FVEWLLKA або
H-Aib-QGTFTSDYSKYLDSK()AAKE()FVEWLLRA.
25. Сполука за будь-яким із попередніх пунктів, яка містить пептид формули І, який має зазначену послідовність:
HSQGTFTSDYSKYLDS-K*-AAHDFVEWLLRA;
HSQGTFTSDYSKYLD-K*-KAAHDFVEWLLRA;
HSQGTFTSDYSKYLDSKAA-K*-DFVEWLLRA;
HSQGTFTSDYSKYLDSKAAHDFVEWL-K*-RA;
HSQGTFTSDYSKYLDSKAAHDFVEWLL-K*-A;
HSQGTFTSDYSRYLDS-K*-AAHDFVEWLLRA;
HSQGTFTSDYSLYLDS-K*-AAHDFVEWLLRA;
HSQGTFTSDYSKYLDSKAAHDFVEWLLRA-K*;
HSQGTFTSDYSKYLDSKAAHDFVEWLLSA-K*;
HSQGTFTSDYSKYLDSKAAHDFVEWL-K* -SA;
HSQGTFTSDYSKYLDSKAAHDFV-K*-WLLRA;
HSQGTFTSDYSKYLDS-C*-AAHDFVEWLLRA;
HSQGTFTSDYSKYLDS-C*-AAHDFVEWLLSA;
HSQGTFTSDYSKYLDSKAA-C*-DFVEWLLRA;
HSQGTFTSD YSKYLD-K*-SAAHDFVEWLLRA;
H-Aib-QGTFTSDYSKYLDS-K*-AAHDFVEWLLSA;
H-Aib-QGTFTSDYSKYLDSKAAHDFVEWLLSA-K*;
H-Aib-QGTFTSDYSKYLDS-K*-AARDFVAWLLRA;
H-Aib-QGTFTSDYSKYLDSKAA-K*-DFVAWLLRA;
H-Aib-QGTFTSDYSKYLDSKAAHDFVEWLL-K*-A;
H-Aib-QGTFTSDYSKYLDS-K*-AAHDFVEWLLRA;
H-Aib-QGTFTSDYSKYLDS-K*-AAHDFVEWLLKA;
H-Aib-QGTFTSDYSKYLDSKAA-K*-DFVAWLLSA;
H-Aib-QGTFTSDYSKYLDSKAAHDFVAWLL-K*-A;
H-Aib-QGTFTSDYSKYLD-K*-KAAHDFVAWLLRA;
H-Aib-QGTFTSDYSRYLDS-K*-AAHDFVEWLLSA;
H-Aib-QGTFTSDYSKYLDSKAAHDFV-K*-WLLSA;
H-Aib-QGTFTSDYSLYLDS-K*-AAHDFVEWLLSA;
H-Aib-QGTFTSDYSKYLDS-C*-AAHDFVEWLLSA;
H-Aib-QGTFTSDYSKYLDSKAA-C*-DFVEWLLRA;
H-Aib-QGTFTSDYSKYLD-S*-KAAHDFVEWLLSA;
H-Aib-QGTFTSDYSKYLDK()K*AAE()DFVEWLLRA;
H-Aib-QGTFTSDYSKYLDSK*AAHDFVE()WLLK()A
H-Aib-QGTFTSDYSKYLDSK*AAK()DFVE()WLLRA;
H-Aib-QGTFTSDYSKYLDSK()AAHE()FVEWLLK*A або
H-Aib-QGTFTSDYSKYLDSK()AAK*E()FVEWLLRA,
де "*" вказує положення ліпофільного замісника.
26. Сполука за будь-яким із попередніх пунктів, у якій Z1 містить вуглеводневий ланцюг, який включає 10-24 атомів С, 10-22 атомів С або 10-20 атомів С.
27. Сполука за п. 26, у якій Z1 являє собою групу додеканоїлу, 2-бутилоктаноїлу, тетрадеканоїлу, гексадеканоїлу, гептадеканоїлу, октадеканоїлу або ейкозаноїлу.
28. Сполука за будь-яким із попередніх пунктів, у якій Z2 являє собою або містить один або більше амінокислотних залишків.
29. Сполука за п. 28, у якій Z2 являє собою залишок g-Glu, Glu, b-Аlа або e-Lys чи групу 3-амінопропаноїлу, 4-амінобутаноїлу, 8-амінооктаноїлу або 8-аміно-3,6-діоктаноїлу.
30. Сполука за п. 29, у якій зазначений ліофільний замісник вибраний із групи, яка складається з додеканоїл-g-Glu, гексадеканоїл-g-Glu, гексадеканоїл-Glu, гексадеканоїл-[3-амінопропаноїлу], гексадеканоїл-[8-амінооктаноїлу], гексадеканоїл-e-Lys, 2-бутилоктаноїл-g-Glu, октадеканоїл-g-Glu і гексадеканоїл-[4-амінобутаноїлу].
31. Сполука за п. 30, у якій Z має формулу:
HSQGTFTSDYSKYLD-K(гeкcaдeкaноїл-g-Glu)-KAAHDFVEWLLRA; HSQGTFTSDYSKYLDSKAAHDFVEWL-K(гeкcaдeкaноїл-g-Glu)-RA; HSQGTFTSDYSKYLDSKAA-K(гeкcaдeкaноїл-g-Glu)-DFVEWLLRA; HSQGTFTSDYSKYLDSKAAHDFVEWLL-K(гeкcaдeкaноїл-g-Glu)-A;
H-Aib-QGTFTSDYSKYLDS-K(гeкcaдeкaноїл-g-Glu)-AAHDFVEWLLRA;
H-Aib-QGTFTSDYSKYLDS-K(гeкcaдeкaноїл-g-Glu)-AARDFVAWLLRA;
H-Aib-QGTFTSDYSKYLDS-K(гeкcaдeкaноїл-g-Glu)-AAHDFVEWLLSA;
H-Aib-QGTFTSDYSKYLDSKAAHDFVEWLL-K(гeкcaдeкaноїл-g-Glu)-A;
Н-Аіb-QGТFТSDYSКYLDS-К(гексадеканоїл-g-Сlu)-ААНDFVЕWLLКА;
H-Aib-QGTFTSDYSKYLDS-K(гeкcaдeкaноїл-g-Glu)-AAHDFVE()WLLK()A;
HSQGTFTSDYSKYLDS-K(гeкcaдeкaноїл-g-Glu)-AAHDFVEWLLRA;
Н-Аіb-QGТFТSDYSКYLDSКАА-К(гeкcaдeкaноїл-g-Glu)-DFVАWLLRА;
H-Aib-QGTFTSDYSKYLDS-K(дoдeкaнoїл-g-Glu)-AAHDFVEWLLSA;
H-Aib-QGTFTSDYSKYLDS-K(гeкcaдeкaноїл-[3-aмiнoпpoпaнoїл])-AAHDFVEWLLSA;
H-Aib-QGTFTSDYSKYLDS-K(гeкcaдeкaноїл-[8-aмiнооктaнoїл])-AAHDFVEWLLSA;
H-Aib-QGTFTSDYSKYLDS-K(гeкcaдeкaноїл-e-Lys)-AAHDFVEWLLSA;
HSQGTFTSDYSKYLDS-K(гeкcaдeкaноїл)-AAHDFVEWLLSA;
НSQGТFТSDYSКYLDS-К(октадеканоїл-g-Сlu)-ААНDFVЕWLLSА;
НSQGТFТSDYSКYLDS-К([2-бутилоктаноїл]-g-Glu)-ААНDFVЕWLLSА;
HSQGTFTSDYSKYLDS-K(гeкcaдeкaноїл-[4-Aмiнoбyтaнoїл])-AAHDFVEWLLSA;
HSQGTFTSDYSKYLDS-K(октадеканоїл-g-Glu)-AAHDFVEWLLSA;
НSQGТFТSDYSКYLDS-К(гексадеканоїл-Е)-ААНDFVЕWLLSА;
H-Aib-QGTFTSDYSKYLDS-K(гексадеканоїл)-AAHDFVEWLLSA;
Н-Аіb-QGТFТSDYSКYLDS-К(октадеканоїл-g-Сlu)-ААНDFVЕWLLSА;
H-Aib-OGTFTSDYSKYLDS-K([2-бyтилoктаноїл]-g-Glu)-AAHDFVEWLLSA;
H-Aib-QGTFTSDYSKYLDS-K(гексадеканоїл-[4-aмінобyтaноїл])-AAHDFVEWLLSA;
H-Aib-QGTFTSDYSKYLDS-K(oктaдeкaнoїл-g-Glu)-AAHDFVEWLLSA aбo
H-Aib-QGTFTSDYSKYLDS-K(гексадеканоїл-E)-AAHDFVEWLLSA;
де залишки, позначені "()", беруть участь в утворенні внутрішньомолекулярного зв'язку.
32. Сполука за п. 30, у якій Z має формулу:
Н-Аіb-QGТFТSDYS-К(гексадеканоїл-ізоСlu)-YLDSКААНDFYЕWLLSА;
H-Aib-QGTFTSDYSKYLD-K(гексадеканоїл-ізоСlu)-KAAHDFVEWLLSA;
H-Aib-QGTFTSDYSKYLDSKAA-K(гексадеканоїл-ізоСlu)-DFVEWLLSA;
H-Aib-QGTFTSDYSKYLDSKAAHDFV-K(гексадеканоїл-ізоСlu)-WLLSA;
H-Aib-QGTFTSDYSKYLDS-K(гексадеканоїл-ізоLys)-AARDFVAWLLRA;
Н-Аіb-QGТFТSDYSКYLDS-К(гексадеканоїл-ізоGlu)-ААКDFVЕWLLSА;
H-Aib-QGTFTSDYSKYLDE-K(гексадеканоїл-ізоGlu)-AAHDFVEWLLSA;
Н-Аіb-QGТFТSDYSКYLDS-К(гексадеканоїл-ізоСlu)-ААНЕFVЕWLLSА;
H-Aib-QGTFTSDYSKYLDS-K(гексадеканоїл-ізоGlu)-AAEDFVEWLLSA;
H-Aib-QGTFTSDYSKYLDS-K(гексадеканоїл-ізоGlu)-AAHDFVEWLLEA.
33. Сполука, яка має формулу:
R1-Z-R2,
де R1 являє собою Н, С1-4 алкіл, ацетил, форміл, бензоїл або трифторацетил;
R2 являє собою ОН або NH2;
і Z являє собою пептид згідно з формулою V:
His-Aib-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-X17-Ala-Ala-His-Asp-Phe-Val-Glu-Trp-Leu-Leu-X28; (V)
де
X17 являє собою X,
Х28 являє собою Ser або відсутній;
причому X вибраний із групи, яка складається з Glu, Lys і Cys;
і при цьому бічний ланцюг X кон'югований із ліпофільним замісником, який має формулу:
(і) Z1, де Z1 являє собою ліпофільну групу, безпосередньо кон'юговану з бічним ланцюгом X;
або
(іі) Z1Z2, де Z1 являє собою ліпофільну групу, Z2 являє собою спейсер, і Z1 кон'югована з бічним ланцюгом X через Z2;
34. Сполука за п. 33, у якій Z має формулу:
H-Aib-QGTFTSDYSKYLDS-K(гексадеканоїл-ізоGlu)-AAHDFVEWLLS;
Н-Аіb-QGТFТSDYSКYLDS-К(гексадеканоїл-ізоСlu)-ААНDFVЕWLL;
35. Сполука, яка має формулу:
R1-Z-R2,
де R1 являє собою Н, С1-4 алкіл, ацетил, форміл, бензоїл або трифторацетил;
R2 являє собою ОН або NH2;
і Z являє собою пептид згідно з формулою VI:
His-Aib-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-X17-Ala-Ala-His-Asp-Phe-Val-Glu-Trp-Leu-Leu-Ser-Ala; (VI)
де
X17 являє собою X;
причому X вибраний із групи, яка складається з Glu, Lys і Cys;
і при цьому бічний ланцюг X кон'югований із ліпофільним замісником, який має формулу:
(і) Z1, де Z1 являє собою ліпофільну групу, безпосередньо кон'юговану з бічним ланцюгом X;
або
(іі) Z1Z2, де Z1 являє собою ліпофільну групу, Z2 являє собою спейсер, і Z1 кон'югована з бічним ланцюгом X через Z2;
36. Сполука за п. 35, де Z має формулу:
Н-Аіb-ЕGТFТSDYSКYLDS-К(Гексадеканоїл-ізоGlu)-ААНDFVЕWLLSА;
37. Композиція, яка містить сполуку за будь-яким із пп. 1-36 або її сіль, або похідну у вигляді суміші з носієм.
38. Композиція за п. 37, яка відрізняється тим, що зазначена композиція являє собою фармацевтично прийнятну композицію, і зазначений носій являє собою фармацевтично прийнятний носій.
39. Сполука за будь-яким із пп. 1-36 для застосування в способі надання медичної допомоги.
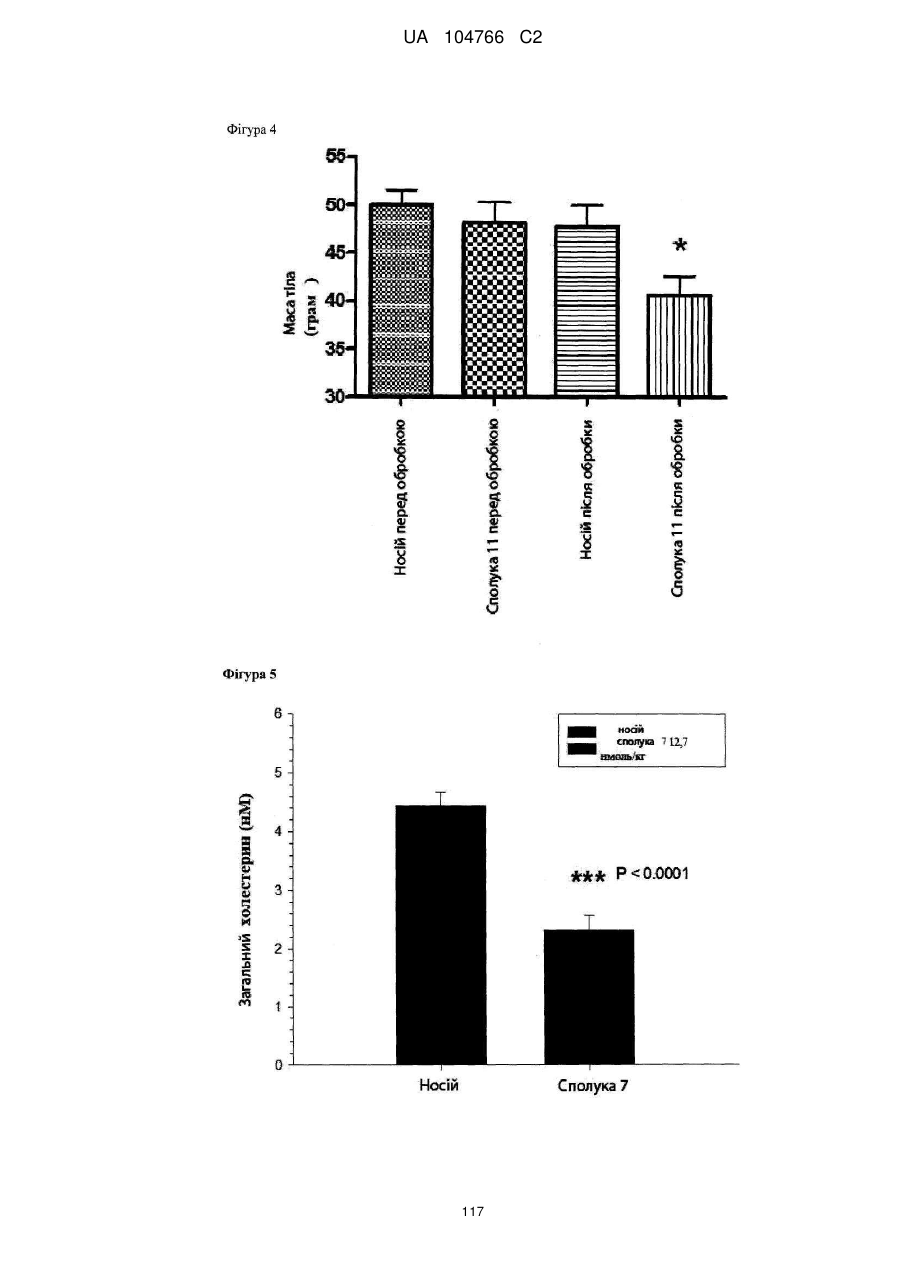
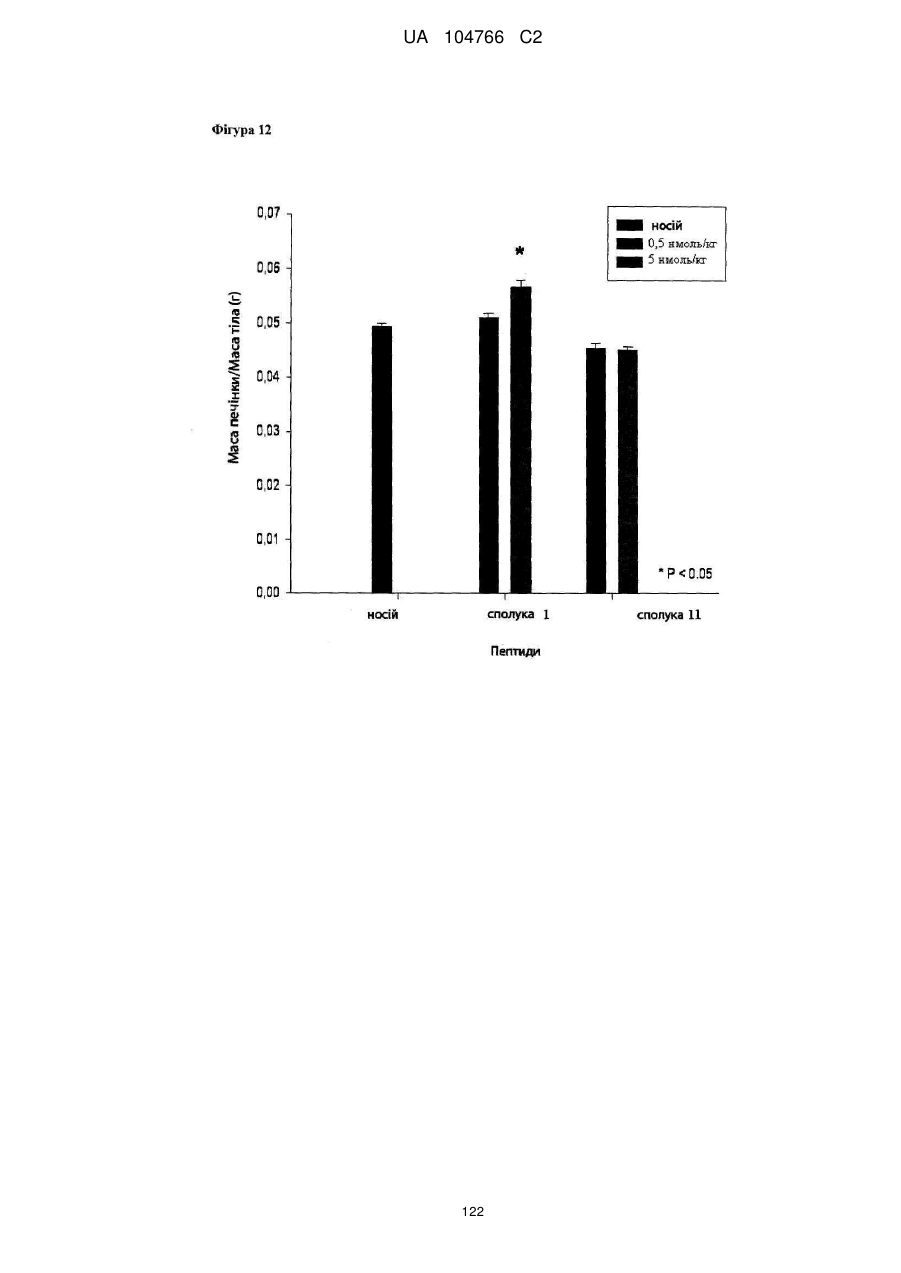
40. Сполука за будь-яким із пп. 1-36 для застосування для попередження збільшення маси тіла або забезпечення зменшення маси тіла.
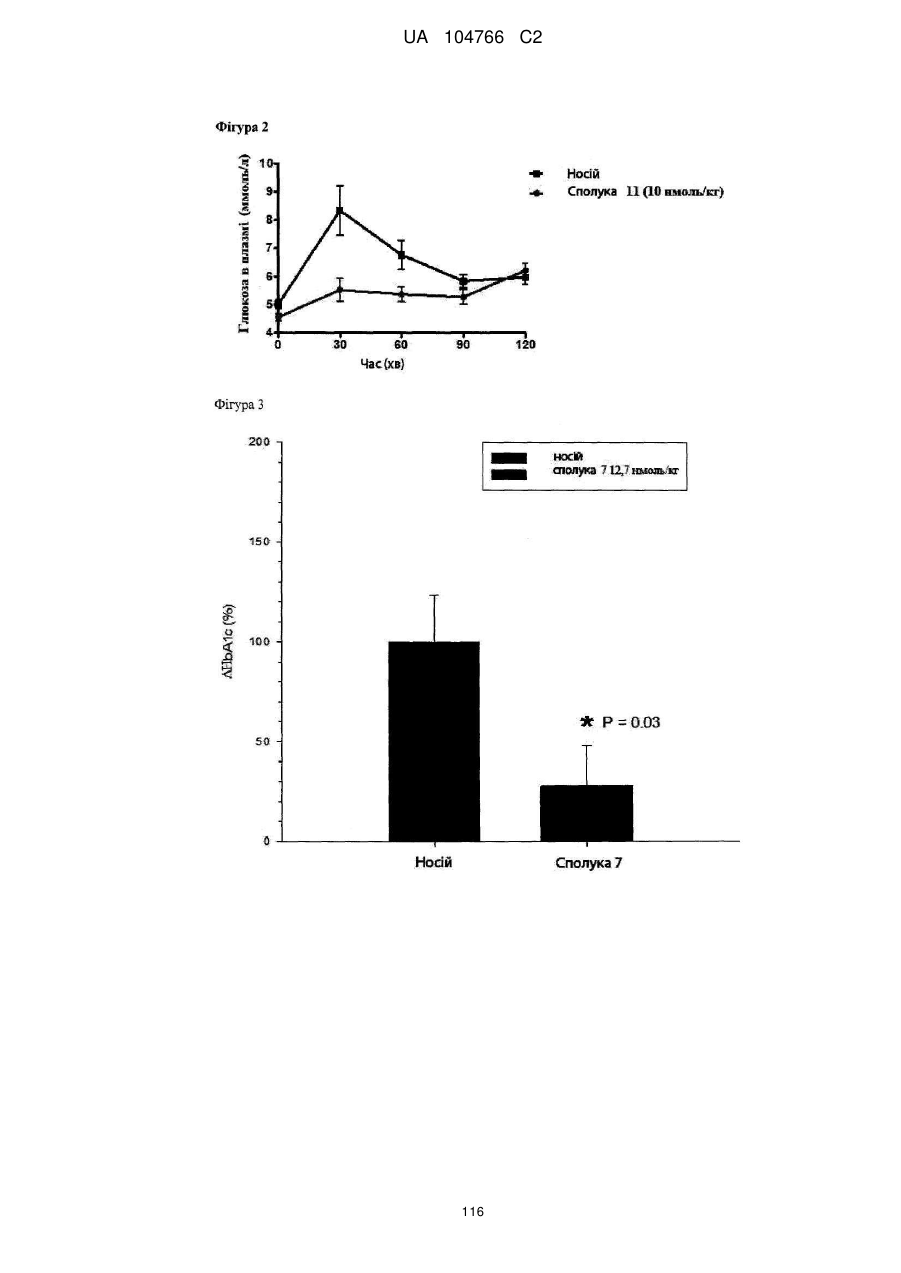
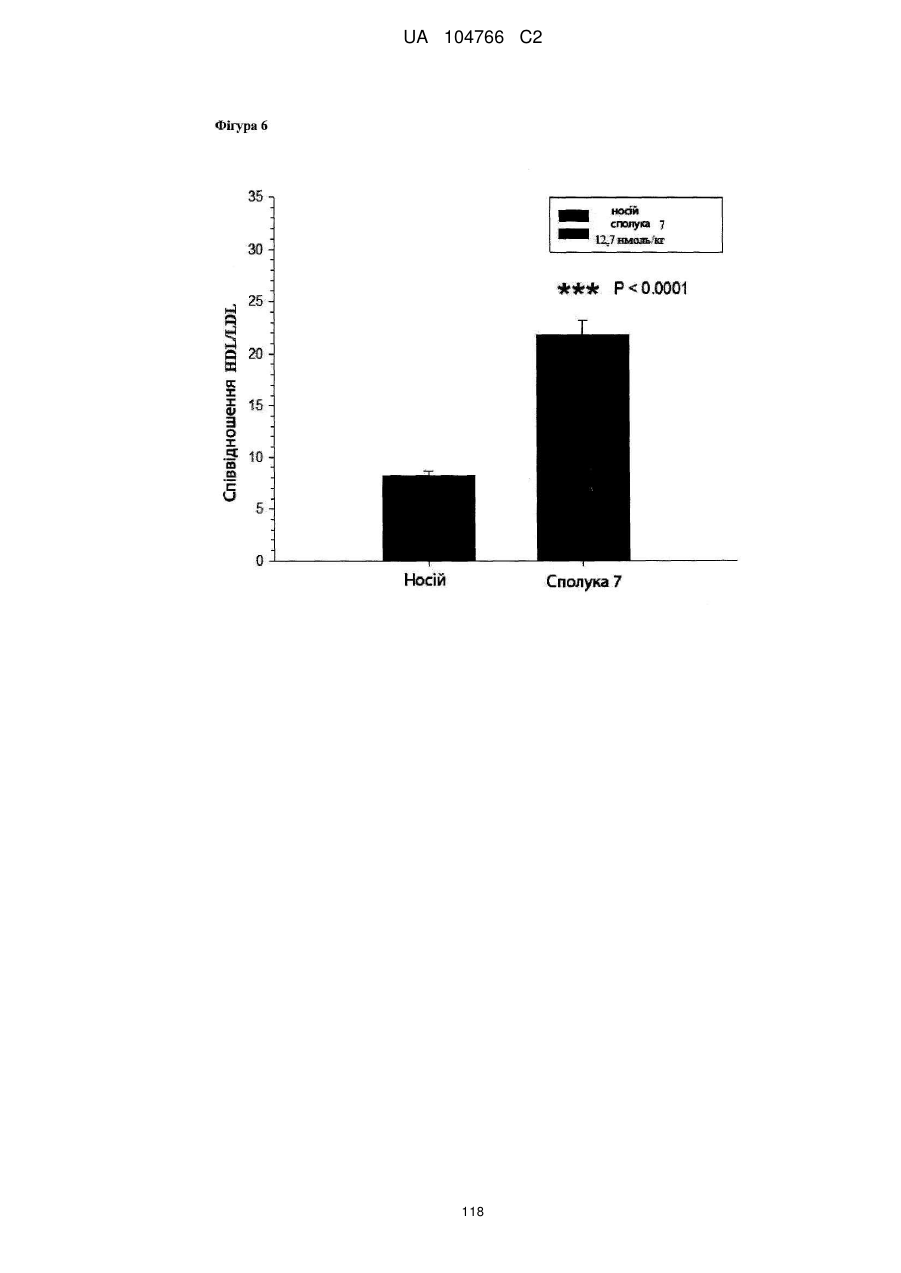
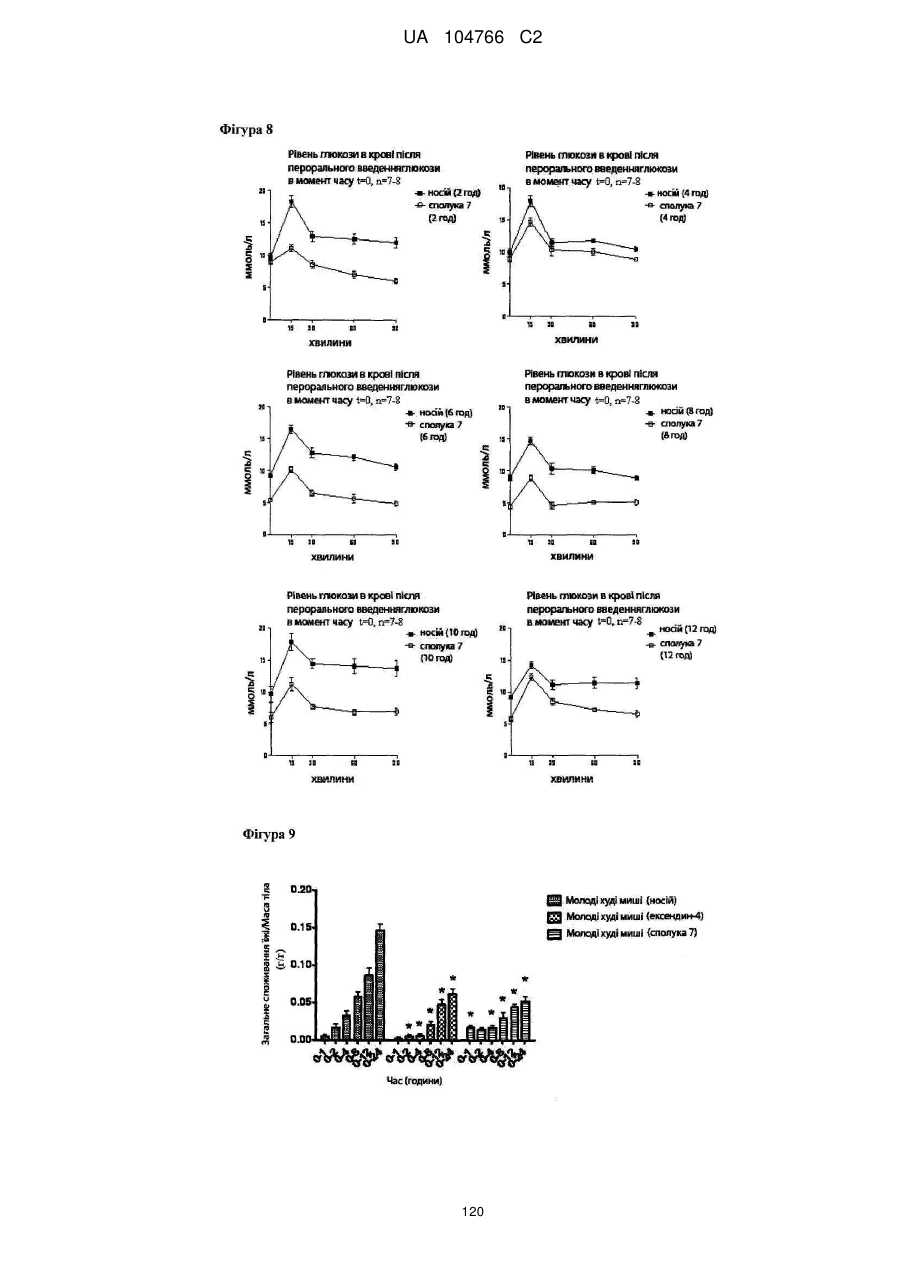
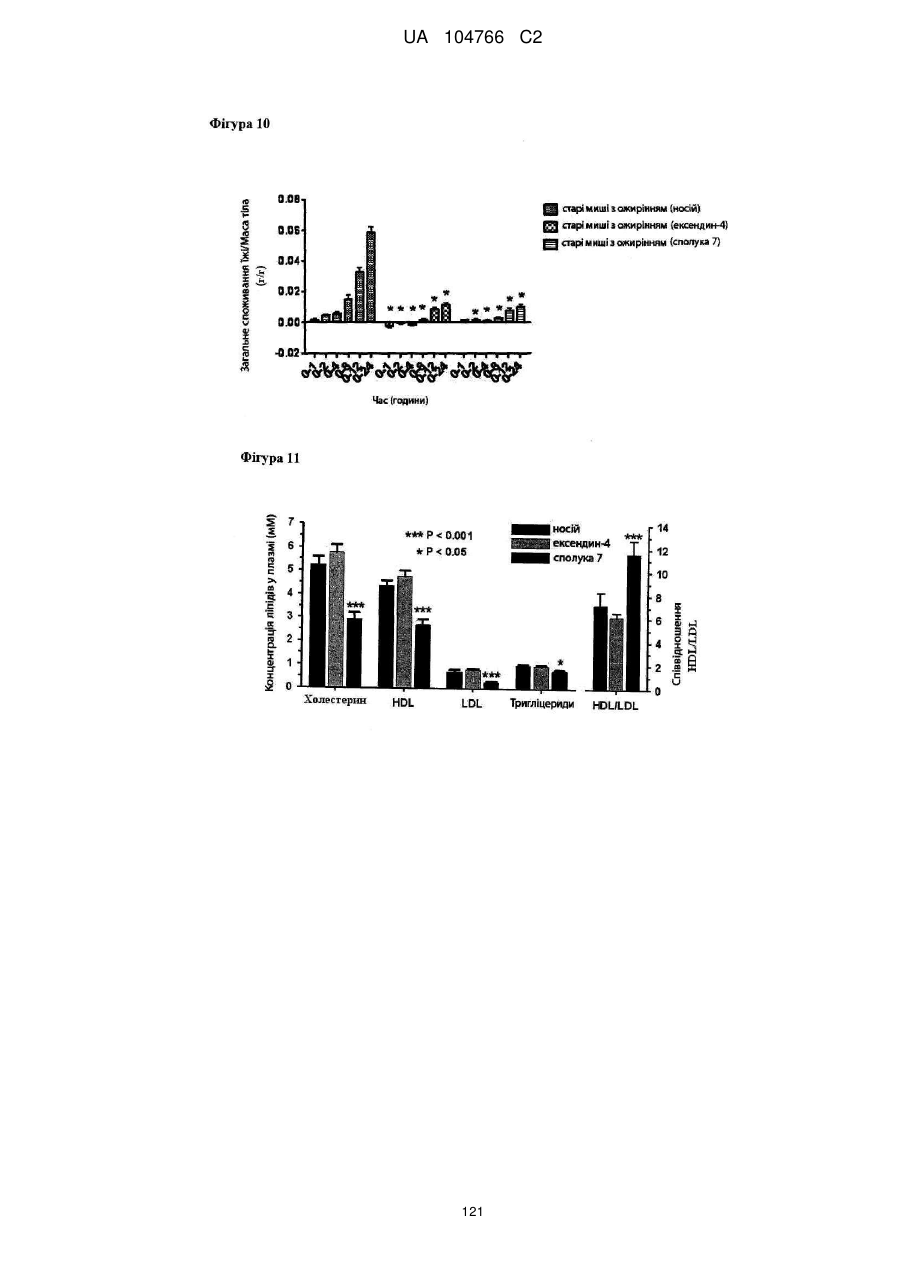
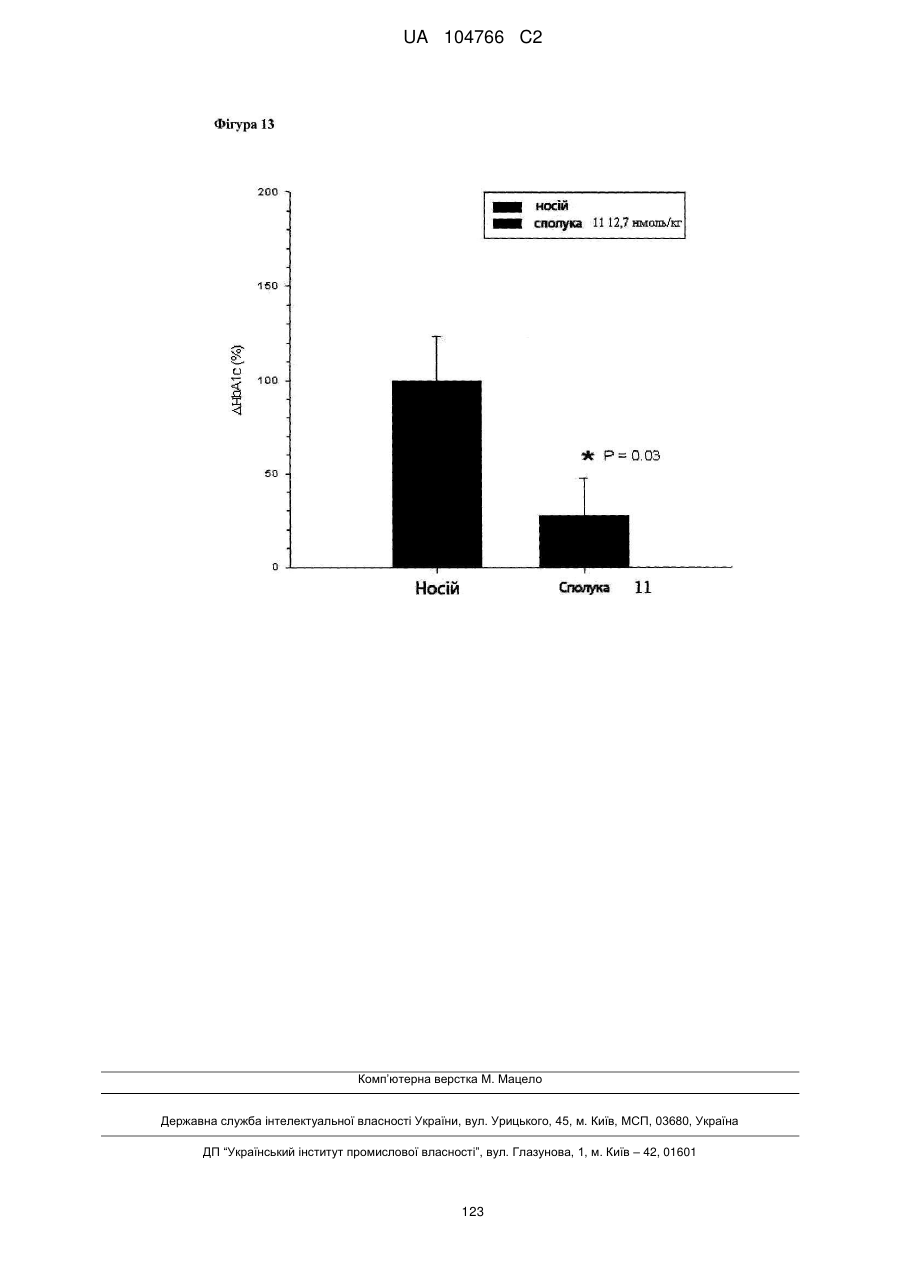
41. Сполука за будь-яким із пп. 1-36 для застосування в способі нормалізації рівня глюкози в крові, переносимості глюкози і/або рівня холестерину в крові, зниження рівня LDL у крові і/або збільшення співвідношення HDL/LDL.
42. Сполука за будь-яким із пп. 1-36 для застосування в способі лікування захворювання, викликаного надлишковою масою тіла або для якого характерна надлишкова маса тіла, наприклад, лікування і/або попередження ожиріння, важкої форми ожиріння, запалення, викликаного ожирінням, захворювання жовчного міхура, викликаного ожирінням, апное сну, викликаного ожирінням, метаболічного синдрому, переддіабетичних станів, стійкості до інсуліну, непереносимості глюкози, діабету 2 типу, діабету 1 типу, гіпертензії, атерогенної дисліпідемії, атеросклерозу, артеріосклерозу, ішемічної хвороби серця, хвороби периферичних артерій, інсульту або захворювання дрібних судин.
43. Застосування сполуки за будь-яким із пп. 1-36 для попередження збільшення маси тіла або забезпечення зниження маси тіла у індивідуума, який цього потребує.
44. Застосування сполуки за будь-яким із пп. 1-36 у способі нормалізації рівня глюкози в крові, переносимості глюкози і/або рівня холестерину в крові, зниження рівня LDL у крові і/або збільшення співвідношення HDL/LDL у індивідуума, який цього потребує.
45. Застосування сполуки за будь-яким із пп. 1-37 у способі лікування захворювання, викликаного надлишковою масою тіла або для якого характерна надлишкова маса тіла, наприклад, лікування і/або попередження ожиріння, важкої форми ожиріння, запалення, викликаного ожирінням, захворювання жовчного міхура, викликаного ожирінням, апное сну, викликаного ожирінням, метаболічного синдрому, переддіабетичних станів, стійкості до інсуліну, непереносимості глюкози, діабету 2 типу, діабету 1 типу, гіпертензії, атерогенної дисліпідемії, атеросклерозу, артеріосклерозу, ішемічної хвороби серця, хвороби периферичних артерій, інсульту або захворювання дрібних судин у індивідуума, який цього потребує.
46. Сполука, застосування або спосіб за будь-яким із пп. 39-45, який відрізняється тим, що сполуку вводять у вигляді компонента комплексного лікування разом із засобом для лікування діабету, ожиріння, дисліпідемії або гіпертензії.
47. Сполука, застосування або спосіб за п. 46, який відрізняється тим, що засіб для лікування діабету являє собою метформін, сульфонілурею, глінід, інгібітор DPP-IV, глітазон, інсулін або аналог інсуліну.
48. Сполука, застосування або спосіб за п. 46, який відрізняється тим, що засіб для лікування ожиріння являє собою агоніст рецептора глюкагоноподібного пептиду 1, пептид YY або його аналог, антагоніст рецептора канабіноїду 1, інгібітор ліпази, агоніст рецептора меланокортину 4 або антагоніст рецептора меланін-концентруючого гормону 1.
49. Сполука, застосування або спосіб за п. 46, який відрізняється тим, що засіб для лікування гіпертензії являє собою інгібітор ангіотензин-конвертуючого ферменту, блокатор рецептора до ангіотензину II, діуретик, бета-блокатор або блокатор кальцієвих каналів.
50. Сполука, застосування або спосіб за п. 46, який відрізняється тим, що засіб для лікування дисліпідемії являє собою статин, фібрат, ніацин і/або інгібітор усмоктування холестерину.
Текст
Реферат: Винахід належить до речовин і способів для зниження маси тіла або попередження збільшення маси тіла і лікування діабету й пов'язаних із ним метаболічних порушень. Зокрема, забезпечує ацильовані пептиди, які являють собою аналоги глюкагону, ефективні в зазначених способах за рахунок підвищеної вибірковості відносно рецептора GLP-1 у порівнянні з глюкагоном людини. UA 104766 C2 (12) UA 104766 C2 UA 104766 C2 5 10 15 20 25 30 35 40 45 50 55 60 Область техніки Даний винахід відноситься до ацильованих аналогів глюкагону та їх застосування в медицині, наприклад, для лікування ожиріння і цукрового діабету. Рівень техніки Ожиріння і цукровий діабет являють собою зростаючі проблеми світової охорони здоров'я і пов'язані з різними захворюваннями, зокрема, серцевосудинними захворюваннями, обструктивним апное сну, інсультом, хворобою периферичних артерій, порушенням мікроциркуляції та остеоартритом. У світі існує 246 млн. хворих на діабет, і за прогнозами до 2025 року 380 млн. людей будуть хворими на діабет. У багатьох із них є додаткові фактори ризику розвитку серцевосудинних захворювань, включаючи високий/порушений рівень LDL (ліпопротеїни низької щільності) та тригліцеридів і низький рівень HDL (ліпопротеїни високої щільності). Серцевосудинні захворювання є причиною 50 % смертей пацієнтів із діабетом, і рівень захворюваності й смертності від ожиріння та діабету підкреслюють необхідність у ефективних способах лікування. Препроглюкагон являє собою поліпептид-попередник довжиною 158 амінокислот, який піддається диференціальному процесингу в тканинах і утворює кілька структурно споріднених пептидів, які походять із проглюкагону, включаючи глюкагон (Glu), глюкагоноподібний пептид-1 (GLP-1), глюкагоноподібний пептид-2 (GLP-2) і оксинтомодулін (OXM). Зазначені молекули виконують різні фізіологічні функції, включаючи гомеостаз глюкози, секрецію інсуліну, випорожнення шлунка і ріст кишечника, а також регуляцію споживання їжі. Глюкагон являє собою пептид із 29 амінокислот, який відповідає амінокислотам 53-81 препроглюкагону й має послідовність His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-LeuAsp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr. Оксинтомодулін (OXM) являє собою пептид довжиною 37 амінокислот, який включає повну послідовність із 29 амінокислот глюкагону і на С-кінці подовження з 8 амінокислот (амінокислоти 82-89 препроглюкагону, які мають послідовність Lys-Arg-Asn-Arg-Asn-Asn-Ile-Ala і позначувані терміном "проміжний пептид 1" або IP-1; таким чином, повна послідовність оксинтомодуліну людини являє собою His-SerGln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-TrpLeu-Met-Asn-Thr-Lys-Arg-Asn-Arg-Asn-Asn-Ile-Ala). Основний біологічно активний фрагмент GLP1 синтезується у вигляді амідованого за С-кінцем пептиду з 30 амінокислот, який відповідає амінокислотам 98-127 препроглюкагону. Глюкагон сприяє підтримці постійного рівня глюкози в крові за допомогою зв'язування з рецепторами глюкагону на гепатоцитах, викликаючи вивільнення глюкози з печінки, запасеної у вигляді глікогену, в процесі глюкогенолізу. Коли ці запаси зменшуються, глюкагон стимулює синтез додаткової глюкози печінкою в ході глюконеогенезу. Ця глюкоза вивільняється в кровоток, запобігаючи розвитку гіпоглікемії. Також було показано, що глюкагон підсилює ліполіз і зменшує масу тіла. GLP-1 знижує підвищений рівень глюкози в крові завдяки покращенню секреції інсуліну, викликаною глюкозою, і сприяє зменшенню маси тіла в основному через зниження споживання їжі. Оксинтомодулін надходить у кров у відповідь на споживання їжі пропорційно кількості калорій у їжі. Механізм дії оксинтомодуліну ще не досить добре відомий. Зокрема невідомо, чи опосередковується дія цього гормону винятково рецептором глюкагону і рецептором GLP-1 або одним чи більше дотепер не виявленими рецепторами. Було показано, що інші пептиди зв'язують і активують рецептор глюкагону та рецептор GLP1 (Hjort et al, Journal of Biological Chemistry, 269, 30121-30124,1994), і придушують збільшення маси тіла, і знижують споживання їжі (WO 2006/134340; WO 2007/100535; WO 2008/101017, WO 2008/152403, WO 2009/155257 і WO 2009/155258). Було показано, що стабілізація пептидів забезпечує кращий фармакокінетичний профіль деяких лікарських засобів. Зокрема показано, що додавання однієї або більше групи поліетиленгліколю (PEG) або ацильной групи подовжує період напіввиведення пептидів, таких як GLP-1 та інших пептидів з нетривалою стабільністю в плазмі. У публікаціях WO 00/55184A1 і WO 00/55119 описані способи ацилювання деяких пептидів, зокрема GLP-1. У публікації Madsen et al (J. Med. Chem. 2007, 50, 6126-6132) описаний ацильований у положенні 20 GLP-1 (Ліраглутид) і представлені дані про його стабільність. У публікаціях WO2007/100535, WO08/071972 і Endocrinology 2009, 150(4), 1712-1721 Druce, M R та ін. показано, що стабілізація OXM завдяки пегилюванню і ацилюванню С-кінця покращує фармакокінетичний профіль секретованих аналогів. Недавно було показано, що пегилювання аналогів глюкагону впливає на фармакокінетичний 1 UA 104766 C2 5 10 15 20 25 30 35 40 45 50 55 60 профіль досліджених сполук (WO2008/101017), але порушує активність зазначених сполук. Короткий опис винаходу Даний винахід забезпечує сполуку, яка має формулу: 1 2 R -Z-R 1 2 де R являє собою H, C1-4 алкіл, ацетил, форміл, бензоїл або трифторацетил; R являє собою OH або NH2; і Z являє собою пептид, який має формулу I: His-X2-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-X12-Tyr-Leu-Asp-X16-X17-Ala-Ala-X20-X21-PheVal-X24-Trp-Leu-X27-X28-Ala-X30; (I) де X2 обраний із Aib або Ser; X12 обраний із Lys, Arg і Leu; X16 обраний із Arg і X; X17 обраний із Arg і X; X20 обраний із Arg, His і X; X21 обраний із Asp і Glu; X24 обраний із Ala і X; X27 обраний із Leu і X; X28 обраний із Arg і X; X30 являє собою X або відсутній; причому щонайменше один із X16, X17, X20, X24, X27, X28 і X30 являє собою X; і при цьому кожний залишок X незалежно обраний із групи, яка складається з Glu, Lys, Ser, Cys, Dbu, Dpr і Orn; причому бічний ланцюг щонайменше одного залишку X кон'югований із ліпофільним замісником, який має формулу: 1 1 (i) Z , де Z являє собою ліпофільну групу, кон'юговану безпосередньо з бічним ланцюгом X; або 1 2 1 2 1 (ii) Z Z , де Z являє собою ліпофільну групу, Z являє собою спейсер, і Z кон'югована з 2 бічним ланцюгом X через Z ; за умови, що Z не є HSQGTFTSDYSKYLDS-K(гексадеканоїл-γ-Glu)-AAHDFVEWLLRA. X30 може бути присутнім або відсутнім. Згідно з варіантами реалізації, у яких X30 є присутнім, він може переважно являти собою Lys. Згідно з деякими варіантами реалізації будь-який залишок X, і особливо будь-який залишок X, який кон'югований із ліпофільним замісником, незалежно обраний із Lys, Glu або Cys. Згідно з деякими варіантами реалізації X16 обраний із Glu, Lys і Ser; X17 обраний із Lys і Cys; X20 обраний із His, Lys, Arg і Cys; X24 обраний із Lys, Glu і Ala; X27 обраний із Leu і Lys; і/або X28 обраний із Ser, Arg і Lys. Певні комбінації залишків, які можуть бути присутніми в пептиді формули I, включають наступні: X2 являє собою Aib, і X17 являє собою Lys; X2 являє собою Aib, і X17 являє собою Cys; X2 являє собою Aib, і X20 являє собою Cys; X2 являє собою Aib, і X28 являє собою Lys; X12 являє собою Arg, і X17 являє собою Lys; X12 являє собою Leu, і X17 являє собою Lys; X12 являє собою Lys, і X20 являє собою Lys; X12 являє собою Lys, і X17 являє собою Lys; X16 являє собою Lys, і X17 являє собою Lys; X16 являє собою Ser, і X17 являє собою Lys; X17 являє собою Lys, і X20 являє собою Lys; X17 являє собою Lys, і X21 являє собою Asp; X17 являє собою Lys, і X24 являє собою Glu; X17 являє собою Lys, і X27 являє собою Leu; X17 являє собою Lys, і X27 являє собою Lys; X17 являє собою Lys, і X28 являє собою Ser; X17 являє собою Lys, і X28 являє собою Arg; 2 UA 104766 C2 X20 являє собою Lys, і X27 являє собою Leu; X21 являє собою Asp, і X27 являє собою Leu; X2 являє собою Aib, X12 являє собою Lys, і X16 являє собою Ser; X12 являє собою Lys, X17 являє собою Lys, і X16 являє собою Ser; X12 являє собою Arg, X17 являє собою Lys, і X16 являє собою Glu; X16 являє собою Glu, X17 являє собою Lys, і X20 являє собою Lys; X16 являє собою Ser, X21 являє собою Asp, і X24 являє собою Glu; X17 являє собою Lys, X24 являє собою Glu, і X28 являє собою Arg; X17 являє собою Lys, X24 являє собою Glu, і X28 являє собою Lys; X17 являє собою Lys, X27 являє собою Leu, і X28 являє собою Ser; X17 являє собою Lys, X27 являє собою Leu, і X28 являє собою Arg; X20 являє собою Lys, X24 являє собою Glu, і X27 являє собою Leu; X20 являє собою Lys, X27 являє собою Leu, і X28 являє собою Ser; X20 являє собою Lys, X27 являє собою Leu, і X28 являє собою Arg; X16 являє собою Ser, X20 являє собою His, X24 являє собою Glu, і X27 являє собою Leu; X17 являє собою Lys, X20 являє собою His, X24 являє собою Glu, і X28 являє собою Ser; X17 являє собою Lys, X20 являє собою Lys, X24 являє собою Glu, і X27 являє собою Leu; 5 10 15 або 20 25 30 35 40 45 50 55 60 X17 являє собою Cys, X20 являє собою Lys, X24 являє собою Glu, і X27 являє собою Leu. Може бути бажаним, щоб пептид формули I містив тільки одну амінокислоту того типу, який необхідно модифікувати за допомогою додавання ліпофільного замісника. Наприклад, зазначений пептид може містити тільки один залишок Lys, тільки один залишок Cys або тільки один залишок Glu для здійснення кон'югації ліпофільного замісника з зазначеним залишком. Сполуки згідно з даним винаходом можуть мати один або більше внутрішньомолекулярних містків у межах послідовності пептиду формули I. Кожний зазначений місток утворюється між бічними ланцюгами двох амінокислотних залишків формули I, які зазвичай розділені трьома амінокислотами в лінійній послідовності амінокислот (тобто між амінокислотою A і амінокислотою A+4). Зокрема, зазначений місток може бути утворений між бічними ланцюгами пар залишків у положеннях 16 і 20, 17 і 21, 20 і 24 або 24 і 28. Зазначені бічні ланцюги можуть бути пов'язані з іншим ланцюгом за допомогою йонних взаємодій або ковалентних зв'язків. Таким чином, зазначені пари залишків можуть містити протилежно заряджені бічні ланцюги для утворення соляного містка за допомогою йонних взаємодій. Наприклад, один із залишків може являти собою Glu або Asp, тоді як інший може являти собою Lys або Arg. Утворення пар Lys і Glu та Lys і Asp також може забезпечувати взаємодію з утворенням лактамного кільця. Приклади підходящих пар залишків у положеннях 16 і 20 включають: X16 являє собою Glu, і X20 являє собою Lys; X16 являє собою Glu, і X20 являє собою Arg; X16 являє собою Lys, і X20 являє собою Glu; і X16 являє собою Arg, і X20 являє собою Glu. Приклади підходящих пар залишків у положеннях 17 і 21 включають: X17 являє собою Arg, і X21 являє собою Glu; Х17 являє собою Lys, і X21 являє собою Glu; X17 являє собою Arg, і X21 являє собою Asp; і Х17 являє собою Lys, і X21 являє собою Asp. Приклади підходящих пар залишків у положеннях 20 і 24 включають: X20 являє собою Glu and X24 являє собою Lys; X20 являє собою Glu, і X24 являє собою Arg; X20 являє собою Lys, і X24 являє собою Glu; і X20 являє собою Arg, і X24 являє собою Glu. Приклади підходящих пар залишків у положеннях 24 і 28 включають: X24 являє собою Glu, і X28 являє собою Lys; X24 являє собою Glu, і X28 являє собою Arg; X24 являє собою Lys, і X28 являє собою Glu; і X24 являє собою Arg, і X28 являє собою Glu. Утворення пари Lys і Glu, наприклад, для утворення лактамного кільця, може бути особливо бажаним, особливо між положеннями 24 і 28. Очевидно, що залишки, які беруть участь в утворенні внутрішньомолекулярного містка, не можна піддавати дериватизації з ліпофільним замісником. Таким чином, якщо один із залишків X бере участь в утворенні внутрішньомолекулярного містка, щонайменше один із інших 3 UA 104766 C2 5 10 15 20 25 30 35 40 45 50 55 60 залишків X кон'югований із ліпофільним замісником або замісниками. Вважається, що такі внутрішньомолекулярні містки стабілізують альфа-спіральну структуру молекули й завдяки цьому підвищують її активність і/або вибірковість відносно рецептора GLP-1 і можливо також рецептора глюкагону. Зазначена сполука може мати наступну формулу: 1 2 R -Z-R 1 де R являє собою H, C1-4 алкіл, ацетил, форміл, бензоїл або трифторацетил; 2 R являє собою OH або NH2; і Z являє собою пептид, який має формулу IIa: His-Aib-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-X12-Tyr-Leu-Asp-X16-X17-Ala-Ala-X20-X21-PheVal-X24-Trp-Leu-Leu-X28-Ala; (IIa) де X12 обраний із Lys, Arg і Leu; X16 обраний із Ser і X; Х17 являє собою Х; X20 обраний із His і X; X21 обраний із Asp і Glu; X24 обраний із Ala і Glu; X28 обраний із Ser, Lys і Arg; і при цьому кожний залишок X незалежним чином обраний із групи, яка складається з Glu, Lys і Cys; причому бічний ланцюг щонайменше одного залишку X кон'югований із ліпофільним замісником, який має формулу: 1 1 (i) Z , де Z являє собою ліпофільну групу, безпосередньо кон'юговану з бічним ланцюгом X; або 1 2 1 2 1 (ii) Z Z , де Z являє собою ліпофільну групу, Z являє собою спейсер, і Z кон'югована з 2 бічним ланцюгом Х через Z . Як альтернатива зазначена сполука може мати наступну формулу: 1 2 R -Z-R 1 де R являє собою H, C1-4 алкіл, ацетил, форміл, бензоїл або трифторацетил; 2 R являє собою OH або NH2; і Z являє собою пептид, який має формулу IIb: His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-X12-Tyr-Leu-Asp-X16-X17-Ala-Ala-X20-X21-PheVal-X24-Trp-Leu-Leu-X28-Ala; (IIb) де X12 обраний із Lys, Arg і Leu; X16 обраний із Ser і X; Х17 являє собою Х; X20 обраний із His і X; X21 обраний із Asp і Glu; X24 обраний із Ala і Glu; X28 обраний із Ser, Lys і Arg; і при цьому кожний залишок X незалежним чином обраний із групи, яка складається з Glu, Lys і Cys; причому бічний ланцюг щонайменше одного залишку X кон'югований із ліпофільним замісником, який має формулу: 1 1 (i) Z , де Z являє собою ліпофільну групу, безпосередньо кон'юговану з бічним ланцюгом X; або 1 2 1 2 1 (ii) Z Z , де Z являє собою ліпофільну групу, Z являє собою спейсер, і Z кон'югована з 2 бічним ланцюгом Х через Z ; за умови, що Z не являє собою HSQGTFTSDYSKYLDS-K(Гексадеканоїл-γ-Glu))AAHDFVEWLLRA. Зазначена сполука може мати наступну формулу: 1 2 R -Z-R 1 де R являє собою Н, C1-4 алкіл, ацетил, форміл, бензоїл або трифторацетил; 2 R являє собою OH або NH2; і Z являє собою пептид, який має формулу IIIa: His-Aib-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-X12-Tyr-Leu-Asp-Ser-X17-Ala-Ala-X20-X21-PheVal-X24-Trp-Leu-Leu-X28-Ala; (IIIa) де 4 UA 104766 C2 5 10 15 20 25 30 35 40 45 50 55 60 X12 обраний із Lys і Arg; Х17 являє собою Х; X20 обраний із His і X; X21 обраний із Asp і Glu; X24 обраний із Ala і Glu; X28 обраний із Ser, Lys і Arg; і при цьому кожний залишок X незалежним чином обраний із Glu, Lys і Cys; причому бічний ланцюг щонайменше одного залишку X кон'югований із ліпофільним замісником, який має формулу: 1 1 (i) Z , де Z являє собою ліпофільну групу, безпосередньо кон'юговану з бічним ланцюгом X; або 1 2 1 2 1 (ii) Z Z , де Z являє собою ліпофільну групу, Z являє собою спейсер, і Z кон'югована з 2 бічним ланцюгом Х через Z . Як альтернатива, зазначена сполука може мати наступну формулу: 1 2 R -Z-R 1 де R являє собою Н, C1-4 алкіл, ацетил, форміл, бензоїл або трифторацетил; 2 R являє собою OH або NH2; і Z являє собою пептид, який має формулу IIIb: His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-X12-Tyr-Leu-Asp-Ser-X17-Ala-Ala-X20-X21-PheVal-X24-Trp-Leu-Leu-X28-Ala; (IIIb) де X12 обраний із Lys або Arg; Х17 являє собою Х; X20 обраний із His і X; X21 обраний із Asp і Glu; X24 обраний із Ala і Glu; X28 обраний із Ser, Lys і Arg; і при цьому кожний залишок X незалежним чином обраний із Glu, Lys і Cys; причому бічний ланцюг щонайменше одного залишку X кон'югований із ліпофільним замісником, який має формулу: 1 1 (i) Z , де Z являє собою ліпофільну групу, безпосередньо кон'юговану з бічним ланцюгом X; або 1 2 1 2 1 (ii) Z Z , де Z являє собою ліпофільну групу, Z являє собою спейсер, і Z кон'югована з 2 бічним ланцюгом Х через Z ; за умови, що Z не являє собою HSQGTFTSDYSKYLDS-K(Гексадеканоїл-γ-Glu))AAHDFVEWLLRA. Зазначена сполука може мати наступну формулу: 1 2 R -Z-R 1 де R являє собою Н, C1-4 алкіл, ацетил, форміл, бензоїл або трифторацетил; 2 R являє собою OH або NH2; і Z являє собою пептид, який має формулу IVa: His-Aib-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-X12-Tyr-Leu-Asp-Ser-X17-Ala-Ala-His-X21-PheVal-X24-Trp-Leu-Leu-X28-Ala; (IVa) де X12 обраний із Lys і Arg; Х17 являє собою Х; X21 обраний із Asp і Glu; X24 обраний із Ala і Glu; X28 обраний із Ser, Lys і Arg; де X обраний із групи, яка складається з Glu, Lys і Cys; і при цьому бічний ланцюг X кон'югований із ліпофільним замісником, який має формулу: 1 1 (i) Z , де Z являє собою ліпофільну групу, безпосередньо кон'юговану з бічним ланцюгом X; або 1 2 1 2 1 (ii) Z Z , де Z являє собою ліпофільну групу, Z являє собою спейсер, і Z кон'югована з 2 бічним ланцюгом Х через Z . Як альтернатива зазначена сполука може мати наступну формулу: 1 2 R -Z-R 1 де R являє собою Н, C 1-4 алкіл, ацетил, форміл, бензоїл або трифторацетил; 2 R являє собою OH або NH2; і Z являє собою пептид, який має формулу IVб: 5 UA 104766 C2 5 10 15 20 25 30 35 40 45 50 55 60 His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-X12-Tyr-Leu-Asp-Ser-X17-Ala-Ala-His-X21-PheVal-X24-Trp-Leu-Leu-X28-Ala; (IVб) де X12 обраний із Lys і Arg; Х17 являє собою Х; X21 обраний із Asp і Glu; X24 обраний із Ala і Glu X28 обраний із Ser, Lys і Arg; де X обраний із групи, яка складається з Glu, Lys і Cys; і при цьому бічний ланцюг X кон'югований із ліпофільним замісником, який має формулу: 1 1 (i) Z , де Z являє собою ліпофільну групу, безпосередньо кон'юговану з бічним ланцюгом X; або 1 2 1 2 1 (ii) Z Z , де Z являє собою ліпофільну групу, Z являє собою спейсер, і Z кон'югована з 2 бічним ланцюгом Х через Z ; за умови, що Z не являє собою HSQGTFTSDYSKYLDS-K(Гексадеканоїл-γ-Glu))AAHDFVEWLLRA. Як альтернатива зазначена сполука може мати наступну формулу: 1 2 R -Z-R 1 де R являє собою Н, C1-4 алкіл, ацетил, форміл, бензоїл або трифторацетил; 2 R являє собою OH або NH2; і Z являє собою пептид, який має формулу V: His-Aib-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Lys-Ala-Ala-His-Asp-Phe-ValGlu-Trp-Leu-Leu-X28; (V) де X28 являє собою Ser або відсутній; Х17 являє собою Х, де X обраний із групи, яка складається з Glu, Lys і Cys; і при цьому бічний ланцюг X кон'югований із ліпофільним замісником, який має формулу: 1 1 (i) Z , де Z являє собою ліпофільну групу, безпосередньо кон'юговану з бічним ланцюгом X; або 1 2 1 2 1 (ii) Z Z , де Z являє собою ліпофільну групу, Z являє собою спейсер, і Z кон'югована з 2 бічним ланцюгом Х через Z ; Згідно з деякими варіантами реалізації даного винаходу пептид, який має формулу I, може мати послідовність: HSQGTFTSDYSKYLDSKAAHDFVEWLLRA; HSQGTFTSDYSKYLDKKAAHDFVEWLLRA; HSQGTFTSDYSKYLDSKAAKDFVEWLLRA; HSQGTFTSDYSKYLDSKAAHDFVEWLKRA; HSQGTFTSDYSKYLDSKAAHDFVEWLLKA; HSQGTFTSDYSRYLDSKAAHDFVEWLLRA; HSQGTFTSDYSLYLDSKAAHDFVEWLLRA; HSQGTFTSDYSKYLDSKAAHDFVEWLLRAK; HSQGTFTSDYSKYLDSKAAHDFVEWLLSAK HSQGTFTSDYSKYLDSKAAHDFVEWLKSA; HSQGTFTSDYSKYLDSKAAHDFVKWLLRA; HSQGTFTSDYSKYLDSCAAHDFVEWLLRA; HSQGTFTSDYSKYLDSCAAHDFVEWLLSA; HSQGTFTSDYSKYLDSKAACDFVEWLLRA; HSQGTFTSDYSKYLDKSAAHDFVEWLLRA; H-Aib-QGTFTSDYSKYLDSKAAHDFVEWLLSA; H-Aib-QGTFTSDYSKYLDSKAAHDFVEWLLSAK; H-Aib-QGTFTSDYSKYLDSKAARDFVAWLLRA; H-Aib-QGTFTSDYSKYLDSKAAKDFVAWLLRA; H-Aib-QGTFTSDYSKYLDSKAAHDFVEWLLRA; H-Aib-QGTFTSDYSKYLDSKAAHDFVEWLLKA H-Aib-QGTFTSDYSKYLDSKAAKDFVAWLLSA H-Aib-QGTFTSDYSKYLDSKAAHDFVAWLLKA; H-Aib-QGTFTSDYSKYLDKKAAHDFVAWLLRA; H-Aib-QGTFTSDYSRYLDSKAAHDFVEWLLSA; H-Aib-QGTFTSDYSKYLDSKAAHDFVKWLLSA; 6 UA 104766 C2 5 10 15 20 25 30 35 40 45 50 55 60 H-Aib-QGTFTSDYSLYLDSKAAHDFVEWLLSA; H-Aib-QGTFTSDYSKYLDSCAAHDFVEWLLSA; H-Aib-QGTFTSDYSKYLDSKAACDFVEWLLRA; H-Aib-QGTFTSDYSKYLDK()KAAE()DFVEWLLRA; H-Aib-QGTFTSDYSKYLDSKAAHDFVE()WLLK()A H-Aib-QGTFTSDYSKYLDSKAAK()DFVE()WLLRA; H-Aib-QGTFTSDYSKYLDSK()AAHE()FVEWLLKA; або H-Aib-QGTFTSDYSKYLDSK()AAKE()FVEWLLRA. Згідно з деякими варіантами реалізації зазначені пептиди можуть містити ліпофільний замісник у положеннях, позначених “*”, наприклад: HSQGTFTSDYSKYLDS-K*-AAHDFVEWLLRA; HSQGTFTSDYSKYLD-K*-KAAHDFVEWLLRA; HSQGTFTSDYSKYLDSKAA-K*-DFVEWLLRA; HSQGTFTSDYSKYLDSKAAHDFVEWL-K*-RA; HSQGTFTSDYSKYLDSKAAHDFVEWLL-K*-A; HSQGTFTSDYSRYLDS-K*-AAHDFVEWLLRA; HSQGTFTSDYSLYLDS-K*-AAHDFVEWLLRA; HSQGTFTSDYSKYLDSKAAHDFVEWLLRA-K*; HSQGTFTSDYSKYLDSKAAHDFVEWLLSA-K*; HSQGTFTSDYSKYLDSKAAHDFVEWL-K*-SA; HSQGTFTSDYSKYLDSKAAHDFV-K*-WLLRA; HSQGTFTSDYSKYLDS-C*-AAHDFVEWLLRA; HSQGTFTSDYSKYLDS-C*-AAHDFVEWLLSA; HSQGTFTSDYSKYLDSKAA-C*-DFVEWLLRA; HSQGTFTSDYSKYLD-K*-SAAHDFVEWLLRA; H-Aib-QGTFTSDYSKYLDS-K*-AAHDFVEWLLSA; H-Aib-QGTFTSDYSKYLDSKAAHDFVEWLLSA-K*; H-Aib-QGTFTSDYSKYLDS-K*-AARDFVAWLLRA; H-Aib-QGTFTSDYSKYLDSKAA-K*-DFVAWLLRA; H-Aib-QGTFTSDYSKYLDSKAAHDFVEWLL-K*-A; H-Aib-QGTFTSDYSKYLDS-K*-AAHDFVEWLLKA; H-Aib-QGTFTSDYSKYLDS-K*-AAHDFVEWLLRA; H-Aib-QGTFTSDYSKYLDSKAA-K*-DFVAWLLSA; H-Aib-QGTFTSDYSKYLDSKAAHDFVAWLL-K*-A; H-Aib-QGTFTSDYSKYLD-K*-KAAHDFVAWLLRA; H-Aib-QGTFTSDYSRYLDS-K*-AAHDFVEWLLSA; H-Aib-QGTFTSDYSKYLDSKAAHDFV-K*-WLLSA; H-Aib-QGTFTSDYSLYLDS-K*-AAHDFVEWLLSA; H-Aib-QGTFTSDYSKYLDS-C*-AAHDFVEWLLSA; H-Aib-QGTFTSDYSKYLDSKAA-C*-DFVEWLLRA; H-Aib-QGTFTSDYSKYLD-S*-KAAHDFVEWLLSA; H-Aib-QGTFTSDYSKYLDK()K*AAE()DFVEWLLRA; H-Aib-QGTFTSDYSKYLDSK*AAHDFVE()WLLK()A; H-Aib-QGTFTSDYSKYLDSK*AAK()DFVE()WLLRA; H-Aib-QGTFTSDYSKYLDSK()AAHE()FVEWLLK*A; або H-Aib-QGTFTSDYSKYLDSK()AAK*E()FVEWLLRA. Залишки, позначені за допомогою «()», беруть участь в утворенні внутрішньомолекулярного зв'язку, наприклад, лактамного кільця. Бічний ланцюг (ланцюги) одного або більше залишків Х кон'югований із ліпофільним замісником. Наприклад, один бічний ланцюг залишку Х може бути кон'югований із ліпофільним замісником. Як альтернатива, два або навіть більше двох бічних ланцюгів залишків Х можуть бути кон'юговані з ліпофільним замісником. Наприклад, щонайменше один із Х16, X17, X20 і X28 може бути кон'югований із ліпофільним замісником. У таких випадках Х30 може бути відсутнім. Якщо Х30 є присутнім, він зазвичай кон'югований із ліпофільним замісником. Таким чином, сполука може містити щонайменше один ліпофільний замісник у положенні 16, 17, 20, 24, 27, 28 або 30, переважно в положенні 16, 17 або 20, зокрема в положенні 17. Як альтернатива, зазначена сполука може містити точно два ліпофільних замісники, кожний у одному з положень 16, 17, 20, 24, 27, 28 або 30. Переважно в одному з положень 16, 17 або 20 розташований один або обидва ліпофільні замісники. 7 UA 104766 C2 5 10 15 20 25 30 35 40 45 50 55 60 Таким чином, зазначена сполука може містити ліпофільні замісники в положеннях 16 і 17, 16 і 20, 16 і 24, 16 і 27, 16 і 28 або 16 і 30; у положеннях 17 і 20, 17 і 24, 17 і 27, 17 і 28 або 17 і 30; у положеннях 20 і 24, 20 і 27, 20 і 28 або 20 і 30; у положеннях 24 і 27, 24 і 28 або 24 і 30; у положеннях 27 і 28 або 27 і 30; або в положеннях 28 і 30. Також згідно з іншими варіантами реалізації зазначена сполука може додатково містити один або більше ліпофільних замісників (у цілому три або більше) в інших положеннях, обраних із положень 16, 17, 20, 24, 27, 28 або 30. Однак може бути бажаним, щоб не більше двох положень були змінені таким чином. 1 Z може містити вуглеводневий ланцюг, який включає 10-24 атоми вуглецю, наприклад, 1022 атоми вуглецю, наприклад, 10-20 атомів вуглецю. Вона може включати щонайменше 11 атомів вуглецю і/або 18 атомів вуглецю або менше. Наприклад, зазначений вуглеводневий 1 ланцюг може містити 12, 13, 14, 15, 16, 17 або 18 атомів вуглецю. Таким чином, Z може являти собою групу додеканоїлу, 2-бутилоктаноїлу, тетрадеканоїлу, гексадеканоїлу, гептадеканоїлу, октадеканоїлу або ейкозаноїлу. 2 Незалежним чином, якщо присутній, Z може являти собою або містити один або більше 2 амінокислотних залишків. Наприклад, Z може являти собою залишок γ-Glu, Glu, β-Ala чи ε-Lys або групу 4-амінобутаноїлу, 8-амінооктаноїлу або аміно-3,6-диоксаоктаноїлу. 1 2 Певні сполучення Z і Z включають додеканоїл-γ-Glu, гексадеканоїл-γ-Glu, гексадеканоїлGlu, гексадеканоїл-[3-амінопропаноїл], гексадеканоїл-[8-амінооктаноїл], гексадеканоїл-ε-Lys, 2бутилоктаноїл-γ-Glu, октадеканоїл-γ-Glu і гексадеканоїл-[4-амінобутаноїл]. Згідно з деякими варіантами реалізації Z має формулу: HSQGTFTSDYSKYLD-K(Гексадеканоїл-γ-Glu)-KAAHDFVEWLLRA; HSQGTFTSDYSKYLDSKAAHDFVEWL-K(Гексадеканоїл-γ-Glu)-RA; HSQGTFTSDYSKYLDSKAA-K(Гексадеканоїл-γ-Glu)-DFVEWLLRA; HSQGTFTSDYSKYLDSKAAHDFVEWLL-K(Гексадеканоїл-γ-Glu)-A; H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-γ-Glu)-AAHDFVEWLLRA; H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-γ-Glu)-AARDFVAWLLRA; H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-γ-Glu)-AAHDFVEWLLSA; H-Aib-QGTFTSDYSKYLDSKAAHDFVEWLL-K(Гексадеканоїл-γ-Glu)-A; H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-γ-Glu)-AAHDFVE()WLLK()A; H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-γ-Glu)-AAHDFVEWLLKA; HSQGTFTSDYSKYLDS-K(Гексадеканоїл-γ-Glu)-AAHDFVEWLLRA; H-Aib-QGTFTSDYSKYLDSKAA-K(Гексадеканоїл-γ-Glu)-DFVAWLLRA; H-Aib-QGTFTSDYSKYLDS-K(Додеканоїл-γ-Glu)-AAHDFVEWLLSA; H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-[3-амінопропаноїл])-AAHDFVEWLLSA; H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-[8-амінооктаноїл])-AAHDFVEWLLSA; H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-ε-Lys)-AAHDFVEWLLSA: HSQGTFTSDYSKYLDS-K(Гексадеканоїл)-AAHDFVEWLLSA; HSQGTFTSDYSKYLDS-K(Октадеканоїл- γ-Glu)-AAHDFVEWLLSA; HSQGTFTSDYSKYLDS-K([2-Бутилоктаноїл]-γ-Glu)-AAHDFVEWLLSA; HSQGTFTSDYSKYLDS-K(Гексадеканоїл-[4-Амінобутаноїл])-AAHDFVEWLLSA; HSQGTFTSDYSKYLDS-K(Октадеканоїл-γ-Glu)-AAHDFVEWLLSA; HSQGTFTSDYSKYLDS-K(Гексадеканоїл-E)-AAHDFVEWLLSA; H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл)-AAHDFVEWLLSA; H-Aib-QGTFTSDYSKYLDS-K(Октадеканоїл-γ-Glu)-AAHDFVEWLLSA; H-Aib-QGTFTSDYSKYLDS-K([2-Бутилоктаноїл]-γ-Glu)-AAHDFVEWLLSA; H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-[4-Амінобутаноїл])-AAHDFVEWLLSA; H-Aib-QGTFTSDYSKYLDS-K(Октадеканоїл-γ-Glu)-AAHDFVEWLLSA; або H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-E)-AAHDFVEWLLSA. Залишки, позначені за допомогою «()», беруть участь в утворенні внутрішньомолекулярного зв'язку, наприклад, лактамного кільця. Згідно з іншими варіантами реалізації Z має формулу: H-Aib-QGTFTSDYS-K(Гексадеканоїл-ізоGlu)-YLDSKAAHDFVEWLLSA; H-Aib-QGTFTSDYSKYLD-K(Гексадеканоїл-ізоGlu)-KAAHDFVEWLLSA; H-Aib-QGTFTSDYSKYLDSKAA-K(Гексадеканоїл-ізоGlu)-DFVEWLLSA; H-Aib-QGTFTSDYSKYLDSKAAHDFV-K(Гексадеканоїл-ізоGlu)-WLLSA; H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-ізоLys)-AARDFVAWLLRA; H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-ізоGlu)-AAKDFVEWLLSA; H-Aib-QGTFTSDYSKYLDE-K(Гексадеканоїл-ізоGlu)-AAHDFVEWLLSA; H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-ізоGlu)-AAHEFVEWLLSA; 8 UA 104766 C2 5 10 15 20 25 30 35 40 45 50 55 60 H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-ізоGlu)-AAEDFVEWLLSA; H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-ізоGlu)-AAHDFVEWLLEA. Згідно з іншим аспектом Z має формулу: H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-ізоGlu)-AAHDFVEWLLS; H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-ізоGlu)-AAHDFVEWLL; Згідно зі ще одним аспектом Z має формулу: H-Aib-EGTFTSDYSKYLDS-K(Гексадеканоїл-ізоGlu)-AAHDFVEWLLSA; Даний винахід забезпечує сполуку, яка має формулу: 1 2 R -Z-R 1 де R являє собою Н, C1-4 алкіл, ацетил, форміл, бензоїл або трифторацетил; 2 R являє собою OH або NH2; і Z являє собою пептид, який має формулу I: His-X2-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-X12-Tyr-Leu-Asp-X16-X17-Ala-Ala-X20-X21-PheVal-X24-Trp-Leu-X27-X28-Ala-X30; де X2 являє собою Aib або Ser; X12 обраний із Lys, Arg або Leu; X16 являє собою Arg або X; X17 являє собою Arg або X; X20 являє собою Arg, His або X; X21 являє собою Asp або Glu; X24 являє собою Ala або X; X27 являє собою Leu або X; X28 являє собою Arg або X; X30 являє собою X або відсутній; і при цьому кожний залишок X незалежним чином обраний із групи, яка складається з Glu, Lys, Ser, Cys, Dbu, Dpr і Orn; причому бічний ланцюг щонайменше одного залишку X кон'югований із ліпофільним замісником, який має формулу: 1 1 (i) Z , де Z являє собою ліпофільну групу, безпосередньо кон'юговану з бічним ланцюгом X; або 1 2 1 2 1 (ii) Z Z , де Z являє собою ліпофільну групу, Z являє собою спейсер, і Z кон'югована з 2 бічним ланцюгом Х через Z ; за умови, що Z не являє собою HSQGTFTSDYSKYLDS-K(Гексадеканоїл-γ-Glu)AAHDFVEWLLRA. X30 може бути присутнім або відсутнім. Згідно з тими варіантами реалізації, у яких Х30 є присутнім, бажано, щоб він являв собою Lys. Згідно з певними варіантами реалізації будь-який залишок Х, і особливо будь-який залишок Х, кон'югований із ліпофільним замісником, незалежним чином обраний із Lys, Glu або Cys. Зазначена сполука може мати наступну формулу: 1 2 R -Z-R 1 де R являє собою Н, C1-4 алкіл, ацетил, форміл, бензоїл або трифторацетил; 2 R являє собою OH або NH2; і Z являє собою пептид, який має формулу IIa: His-Aib-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-X12-Tyr-Leu-Asp-X16-X17-Ala-Ala-X20-X21-PheVal-X24-Trp-Leu-Leu-X28-Ala; де X12 обраний із Lys, Arg або Leu; X16 являє собою Ser або X; Х17 являє собою Х; X20 являє собою His або X; X21 являє собою Asp або Glu; X24 являє собою Ala або Glu; X28 являє собою Ser, Lys або Arg; і при цьому кожний залишок X незалежним чином обраний із групи, яка складається з Glu, Lys або Cys; причому бічний ланцюг щонайменше одного залишку X кон'югований із ліпофільним замісником, який має формулу: 1 1 (i) Z , де Z являє собою ліпофільну групу, безпосередньо кон'юговану з бічним ланцюгом X; або 9 UA 104766 C2 1 2 5 10 15 20 25 30 35 40 45 50 55 60 1 2 1 (ii) Z Z , де Z являє собою ліпофільну групу, Z являє собою спейсер, і Z кон'югована з 2 бічним ланцюгом Х через Z . Як альтернатива, зазначена сполука може мати наступну формулу: 1 2 R -Z-R 1 де R являє собою Н, C1-4 алкіл, ацетил, форміл, бензоїл або трифторацетил; 2 R являє собою OH або NH2; і Z являє собою пептид, який має формулу IIb: His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-X12-Tyr-Leu-Asp-X16-X17-Ala-Ala-X20-X21-PheVal-X24-Trp-Leu-Leu-X28-Ala; де X12 обраний із Lys, Arg або Leu; X16 являє собою Ser або X; Х17 являє собою Х; X20 являє собою His або X; X21 являє собою Asp або Glu; X24 являє собою Ala або Glu; X28 являє собою Ser, Lys або Arg; і при цьому кожний залишок X незалежним чином обраний із групи, яка складається з Glu, Lys або Cys; причому бічний ланцюг щонайменше одного залишку X кон'югований із ліпофільним замісником, який має формулу: 1 1 (i) Z , де Z являє собою ліпофільну групу, безпосередньо кон'юговану з бічним ланцюгом X; або 1 2 1 2 1 (ii) Z Z , де Z являє собою ліпофільну групу, Z являє собою спейсер, і Z кон'югована з 2 бічним ланцюгом Х через Z ; за умови, що Z не являє собою HSQGTFTSDYSKYLDS-K(Гексадеканоїл-γ-Glu))AAHDFVEWLLRA. Зазначена сполука може мати наступну формулу: 1 2 R -Z-R 1 де R являє собою Н, C1-4 алкіл, ацетил, форміл, бензоїл або трифторацетил; 2 R являє собою OH або NH2; і Z являє собою пептид, який має формулу IIIa: His-Aib-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-X12-Tyr-Leu-Asp-Ser-X17-Ala-Ala-X20-X21-PheVal-X24-Trp-Leu-Leu-X28-Ala; де X12 обраний із Lys або Arg; Х17 являє собою Х; X20 являє собою His або X; X21 являє собою Asp або Glu; X24 являє собою Ala або Glu; X28 являє собою Ser, Lys або Arg; і при цьому кожний залишок X незалежним чином обраний із Glu, Lys або Cys; причому бічний ланцюг щонайменше одного залишку X кон'югований із ліпофільним замісником, який має формулу: 1 1 (i) Z , де Z являє собою ліпофільну групу, безпосередньо кон'юговану з бічним ланцюгом X; або 1 2 1 2 1 (ii) Z Z , де Z являє собою ліпофільну групу, Z являє собою спейсер, і Z кон'югована з 2 бічним ланцюгом Х через Z . Як альтернатива, зазначена сполука може мати наступну формулу: 1 2 R -Z-R 1 де R являє собою Н, C1-4 алкіл, ацетил, форміл, бензоїл або трифторацетил; 2 R являє собою OH або NH2; і Z являє собою пептид, який має формулу IIIb: His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-X12-Tyr-Leu-Asp-Ser-X17-Ala-Ala-X20-X21-PheVal-X24-Trp-Leu-Leu-X28-Ala; де X12 обраний із Lys або Arg; Х17 являє собою Х; X20 являє собою His або X; X21 являє собою Asp або Glu; 10 UA 104766 C2 5 10 15 20 25 30 35 40 45 50 55 60 X24 являє собою Ala або Glu; X28 являє собою Ser, Lys або Arg; і при цьому кожний залишок X незалежним чином обраний із Glu, Lys або Cys; причому бічний ланцюг щонайменше одногозалишку X кон'югований із ліпофільним замісником, який має формулу: 1 1 (i) Z , де Z являє собою ліпофільну групу, безпосередньо кон'юговану з бічним ланцюгом X; або 1 2 1 2 1 (ii) Z Z , де Z являє собою ліпофільну групу, Z являє собою спейсер, і Z кон'югована з 2 бічним ланцюгом Х через Z ; за умови, що Z не являє собою HSQGTFTSDYSKYLDS-K(Гексадеканоїл-γ-Glu))AAHDFVEWLLRA. Зазначена сполука може мати наступну формулу: 1 2 R -Z-R 1 де R являє собою Н, C1-4 алкіл, ацетил, форміл, бензоїл або трифторацетил; 2 R являє собою OH або NH2; і Z являє собою пептид, який має формулу IVa: His-Aib-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-X12-Tyr-Leu-Asp-Ser-X17-Ala-Ala-His-X21-PheVal-X24-Trp-Leu-Leu-X28-Ala; де X12 обраний із Lys або Arg; Х17 являє собою Х; X21 являє собою Asp або Glu; X24 являє собою Ala або Glu; X28 являє собою Ser, Lys або Arg; де X обраний із групи, яка складається з Glu, Lys або Cys; і при цьому зазначений бічний ланцюг X кон'югований із ліпофільним замісником, який має формулу: 1 1 (i) Z , де Z являє собою ліпофільну групу, безпосередньо кон'юговану з бічним ланцюгом X; або 1 2 1 2 1 (ii) Z Z , де Z являє собою ліпофільну групу, Z являє собою спейсер, і Z кон'югована з 2 бічним ланцюгом Х через Z . Як альтернатива, зазначена сполука може мати наступну формулу: 1 2 R -Z-R 1 де R являє собою Н, C1-4 алкіл, ацетил, форміл, бензоїл або трифторацетил; 2 R являє собою OH або NH2; і Z являє собою пептид, який має формулу IVб: His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-X12-Tyr-Leu-Asp-Ser-X17-Ala-Ala-His-X21-PheVal-X24-Trp-Leu-Leu-X28-Ala; де X12 обраний із Lys або Arg; Х17 являє собою Х; X21 являє собою Asp або Glu; X24 являє собою Ala або Glu X28 являє собою Ser, Lys або Arg; де X обраний із групи, яка складається з Glu, Lys або Cys; і при цьому зазначений бічний ланцюг X кон'югований із ліпофільним замісником, який має формулу: 1 1 (i) Z , де Z являє собою ліпофільну групу, безпосередньо кон'юговану з бічним ланцюгом X; або 1 2 1 2 1 (ii) Z Z , де Z являє собою ліпофільну групу, Z являє собою спейсер, і Z кон'югована з 2 бічним ланцюгом Х через Z ; за умови, що Z не являє собою HSQGTFTSDYSKYLDS-K(Гексадеканоїл-γ-Glu))AAHDFVEWLLRA. Згідно з іншим варіантом реалізації даний винахід забезпечує композицію, яка містить сполуку згідно з даним винаходом або її сіль, або похідну у вигляді суміші з носієм. Згідно з переважними варіантами реалізації зазначена композиція являє собою фармацевтично прийнятну композицію, і зазначений носій являє собою фармацевтично прийнятний носій. Зазначена сіль може являти собою фармацевтично прийнятну кислотно-адитивну сіль зазначеної сполуки, наприклад, ацетат або хлорид. Сполуки згідно з даним описом будуть застосовуватися для попередження збільшення маси 11 UA 104766 C2 5 10 15 20 25 30 35 40 45 50 55 60 тіла або забезпечення втрати маси тіла. Термін "попередження" означає придушення або зниження збільшення маси в порівнянні з відсутністю лікування, і не обов'язково означає повне припинення збільшення маси тіла. Зазначені пептиди можуть викликати зменшення споживання їжі і/або підвищені витрати енергії, що призводить до спостережуваного впливу на масу тіла. Поза залежністю від їх дії на масу тіла зазначені сполуки згідно з даним винаходом можуть впливати на рівень глюкози в крові, переносимість глюкози і/або рівень холестерину в крові, оскільки вони можуть знижувати рівень LDL у крові й підвищувати співвідношення HDL/LDL. Зазначені сполуки згідно з даним винаходом можна застосовувати в спрямованій або опосередкованій терапії будь-якого захворювання, викликаного або характеризованого надмірною масою тіла, наприклад, для лікування і/або попередження ожиріння, важкої форми ожиріння, запалення, викликаного ожирінням, захворювання жовчного міхура, викликаного ожирінням, апное сну, викликаного ожирінням. Також вони можуть застосовуватися при лікуванні переддіабетичних станів, стійкості до інсуліну, непереносимості глюкози, діабету 2 типу, діабету 1 типу, гіпертензії або атерогенної дисліпідемії (або поєднання двох або більше зазначених метаболічних факторів ризику), атеросклерозу, артеріосклерозу, ішемічної хвороби серця, хвороби периферичних артерій, інсульту й хвороби дрібних кровоносних судин. Їх дія на зазначені захворювання може бути результатом або може бути пов'язана з їх впливом на масу тіла, або може не залежати від них. Таким чином, даний винахід забезпечує застосування сполуки згідно з даним винаходом при лікуванні захворювання згідно з описом вище у індивідуума, що потребує такого лікування. Також даний винахід забезпечує сполуку для застосування в способі лікування, зокрема в способі лікування захворювання згідно з описом вище. Також даний винахід забезпечує застосування сполуки згідно з даним винаходом у виготовленні лікарського засобу для лікування стану згідно з описом вище. Зазначену сполуку згідно з даним винаходом можна вводити у вигляді компонента комбінованої терапії з агентом для лікування діабету, ожиріння, дисліпідемії або гіпертензії. У таких випадках зазначені два активних агенти можна вводити спільно або окремо і у вигляді частини тої ж лікарської форми або у вигляді окремих лікарських форм. Таким чином, сполуки згідно з даним винаходом (або їх солі) можна використовувати в поєднанні з протидіабетичним агентом, включаючи, але не обмежуючись ними, метформін, сульфонілсечовину, глінід, інгібітор DPP-IV, глітазон або інсулін. Згідно з переважним варіантом реалізації зазначену речовину або її сіль застосовують у поєднанні з інсуліном, інгібітором DPPIV, сульфонілсечовиною або метформіном, зокрема сульфонілсечовиною або метформіном, для одержання відповідного контролю глікемії. Згідно з більш переважним варіантом реалізації зазначену сполуку або її сіль застосовують у сполученні з метформіном, сульфонілсечовиною, інсуліном або аналогом інсуліну для досягнення відповідного контролю глікемії. Приклади аналогів інсуліну включають, але не обмежуються ними, Лантус, Новорапід, Хумалог, Новомікс, Актрафан HM, Левемір і Апідра. Також зазначену сполуку або її сіль можна застосовувати в поєднанні з засобом проти ожиріння, включаючи, але не обмежуючись ними, агоніст рецепторів глюкагоноподібного пептиду-1, пептид YY або його аналог, антагоніст рецептора канабіноїдів 1, інгібітор ліпази, агоніст рецептора меланокортину 4 або антагоніст рецептора меланін-концентруючого гормону 1. Також зазначену сполуку або її сіль можна застосовувати в сполученні з засобом проти гіпертензії, включаючи, але не обмежуючись ними, інгібітор ангіотензинконвертуючого ферменту, блокатор рецептора ангіотензину II, діуретик, бета-блокатор або блокатор кальцієвих каналів. Зазначену сполуку або її сіль можна застосовувати в сполученні з засобом проти дисліпідемії, включаючи, але не обмежуючись ними, статин, фібрат, ніацин або інгібітор адсорбції холестерину. Опис фігур На Фігурі 1 зображений фармакокінетичний профіль сполуки 13 після підшкірного (s.c.) введення мишам у дозі 100 нМоль/кг. На Фігурі 2 зображений вплив підшкірного введення сполуки 11 протягом 21 дня (10 нМоль/кг) на переносимість пероральної глюкози мишами лінії C57BL/6J, які утримувалися протягом тривалого періоду часу на високожировій дієті. Дані представлені у вигляді середнє ± СПС. На Фігурі 3. Мишам, хворим на діабет (db/db), уводили носій або сполуку 7 (12,7 нмоль/кг) протягом 4 тижнів і визначали рівень HbА1c (Cobas® примітки з застосування: A1C-2) у зразках цільної крові (20 мкл), отриманих від оброблених мишей. ∆HbA1c (%) визначали в кожної миші, 12 UA 104766 C2 5 10 15 20 25 30 35 40 45 50 55 60 віднімаючи з HbА1c (%) через 4 тижні HbА1c (%) у початковий момент часу. ∆HbA1c (%) мишей db/db, яким протягом 4 тижнів уводили носій, = 100 %. * (P=0,03, Т-критерій Стьюдента). На Фігурі 4 зображений вплив підшкірного введення сполуки 11 протягом 21 дня на масу тіла мишей лінії C57BL/6J, яких утримували протягом тривалого періоду часу на високожировій дієті. Дані представлені у вигляді середнє ± СПС. На Фігурі 5. Мишам моделі ожиріння, викликаного харчуванням (DIO), уводили носій або сполуку 7 (12,7 нмоль/кг) протягом 4 тижнів і одержували плазму з забраних зразків крові. У кожному зразку плазми визначали загальний холестерин (Cobas® примітки з застосування: CHOL2) ***(P < 0,0001, Т-критерій Стьюдента). Дані представлені у вигляді середнє ± СПС. На Фігурі 6. Мишам моделі ожиріння, викликаного харчуванням (DIO), уводили носій або сполуку 7 (12,7 нмоль/кг) протягом 4 тижнів і одержували плазму із забраних зразків крові. У кожному зразку плазми визначали рівень LDL і HDL (Cobas®; примітки з застосування HDLC3 і LDL_C). ***(P < 0,0001, Т-критерій Стьюдента). Дані представлені у вигляді середнє ± СПС. На Фігурі 7 зображений вплив введення s.c. агоністів GluGLP-1 на збільшення маси тіла у мишей лінії C57BL/6J, яких утримували на високожировій дієті. Дані представлені у вигляді середнє ± СПС. Чорна лінія: носій (PBS), сіра лінія: невелика доза (0,5 нмоль/кг), пунктир: велика доза (5 нмоль/кг). На Фігурі 8 зображений вплив гострого введення s.c. сполуки 7 на переносимість пероральної глюкози через 2, 4, 6, 8, 10 і 12 годин після введення дози на мишах лінії C57BL/6J, яких утримували на високожировій дієті. Дані представлені у вигляді середнє ± СПС. На Фігурі 9 зображений вплив введення s.c. сполуки 7 і ексендину-4 на споживання їжі/масу тіла в молодих худих мишей лінії C57BL/6J. Дані представлені у вигляді середнє ± СПС. *=p < 0,05 у порівнянні з молодими худими мишами, яким уводили носій. Дані представлені у вигляді середнє ± СПС. На Фігурі 10 зображений вплив введення s.c. сполуки 7 і ексендину-4 на загальне споживання їжі/масу тіла у старих мишей з ожирінням лінії C57BL/6J. Дані представлені у вигляді середнє ± СПС. *=p < 0,05 у порівнянні зі старими мишами з ожирінням, яким уводили носій. На Фігурі 11 зображений вплив s.c. введення носія, ексендину-4 (10 нмоль/кг) і сполуки 11 (10 нмоль/кг) на концентрацію ліпідів у плазмі у старих мишей з ожирінням лінії C57BL/6J. Дані представлені у вигляді середнє ± СПС. На Фігурі 12. Мишам вводили два рази на добу сполуку 1 і сполуку 11 (у двох дозах 0,5 і 5 нмоль/кг) або носій протягом 2 тижнів. У день умертвіння забирали печінку і зважували її. Сполука 1 у високій дозі призводила до істотного збільшення співвідношення "маса печінки/маса тіла". Сполука 11 не впливала на співвідношення "маса печінки/маса тіла" в обох дозах (0,5 і 5 нмоль/кг). Сполука 1 є неацильованим подвійним агоністом GluGLP-1, і сполука 11 є ацильованим подвійним агоністом GluGLP-1 тривалої дії (Фігура 12). На Фігурі 13. Мишам, хворим на діабет (db/db), уводили носій або сполуку 11 (12,7 нмоль/кг) протягом 4 тижнів, і визначали рівень HbА1c (Cobas® примітка з застосування: A1C-2) у зразках цільної крові (20 мкл), отриманих від оброблених мишей. Значення ∆HbA1c (%) розраховували для кожної миші, віднімаючи від HbА1c (%) миші через 4 тижні HbА1c (%) у початковий момент часу. ∆HbA1c (%) мишей db/db, яким протягом 4 тижнів уводили носій = 100 %. *(P=0,03, Ткритерій Стьюдента). Докладний опис винаходу У даному описі використовуються однозначні й тризначні позначення природних амінокислот, а також прийняті тризначні позначення інших амінокислот, включаючи Aib (αаміномасляна кислота), Orn (орнітин), Dbu (2,4-диаміномасляна кислота) і Dpr (2,3диамінопропанова кислота). Термін "нативний глюкагон" означає природний глюкагон людини, який має послідовність HHis-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-ValGln-Trp-Leu-Met-Asn-Thr-OH. Пептидні послідовності сполук згідно з даним винаходом відрізняються від нативного глюкагону щонайменше в положеннях 18, 20, 24, 27, 28 і 29. Також вони можуть відрізнятися від нативного глюкагону в одному або більше з положень 12, 16 і 17. Нативний глюкагон містить Arg у положенні 18. Сполуки згідно з даним винаходом містять невеликий гідрофобний залишок Ala у положенні 18, який, як вважають, підвищує його активність відносно рецепторів глюкагону і GLP-1, але особливо рецептора GLP-1. Очевидно, залишки в положеннях 27, 28 і 29 нативного глюкагону забезпечують значну вибірковість відносно рецептора глюкагону. Заміни в цих положеннях у нативній послідовності глюкагону, зокрема Ala у положенні 29, можуть підвищувати активність і/або вибірковість 13 UA 104766 C2 5 10 15 20 25 30 35 40 45 50 55 60 відносно рецептора GLP-1, імовірно без значного зниження активності відносно рецептора глюкагону. Інші приклади, які можуть бути включені в сполуки згідно з даним винаходом, містять Leu в положенні 27 і Arg у положенні 28. Більше того, Arg у положенні 28 може бути особливо переважним, якщо є присутнім Glu у положенні 24, з яким він може утворити внутрішньомолекулярний місток, оскільки це може підсилити його вплив на активність відносно рецептора GLP-1. Заміна природного залишку Met у положенні 27 (наприклад, на Leu, Lys або Glu) також знижує ризик окиснення, підвищуючи, таким чином, хімічну стабільність зазначених сполук. Заміна природного залишку Asn у положенні 28 (наприклад, на Arg або Ser) також знижує ризик дезамінування в кислому розчині, підвищуючи, таким чином, хімічну стабільність зазначених сполук. Активність і/або вибірковість відносно рецептора GLP-1 без ризику значної втрати активності відносно рецептора глюкагону також можна підвищити за допомогою введення залишків, які сприяють стабілізації структури альфа-спіралі в С-кінцевій частині пептиду. Може бути бажаним, але не необхідним, щоб зазначена спіральна частина молекули мала амфіпатичні властивості. Цьому може допомогти введення таких залишків, як Leu у положенні 12 і/або Ala у положенні 24. Як доповнення або альтернатива, можна вводити заряджені залишки в одне або більше з положень 16, 20, 24 або 28. Таким чином, усі залишки в положеннях 24 і 28 можуть бути заряджені, всі залишки в положеннях 20, 24 і 28 можуть бути заряджені, або всі залишки в положеннях 16, 20, 24 і 28 можуть бути заряджені. Наприклад, залишок у положенні 20 може являти собою His або Arg, зокрема His. Залишок у положенні 24 може являти собою Glu, Lys або Arg, зокрема Glu. Залишок у положенні 28 може являти собою Arg. Введення внутрішньомолекулярного містка в зазначеній частині молекули, згідно з описом вище, також може сприяти стабілізації спіральної структури, наприклад, між положеннями 24 і28. Заміна одного або обох природних залишків Gln у положеннях 20 і 24 також знижує ризик дезамінування в кислому розчині, підвищуючи, таким чином, хімічну стабільність зазначених сполук. Заміна в нативній послідовності глюкагону в положенні 12 (тобто Arg або Leu) може підвищувати активність відносно обох рецепторів і/або вибірковість відносно рецептора GLP-1. Укорочення С-кінця пептиду не знижує активність відносно обох рецепторів і/або вибірковість відносно рецептора GLP-1. Зокрема вкорочення в положенні 29 або в обох положеннях 28 і 29 не знижує активність ні відносно одного, ні відносно іншого рецептора. Бічний ланцюг з одного або більше залишків, позначений X (тобто положення 16, 17, 20, 24, 27 і 28 і/або 30 за наявності), кон'югований із ліпофільним замісником. Мається на увазі, що кон'югація ліпофільного замісника з конкретним бічним ланцюгом може впливати на (наприклад, знижувати) певні переваги, які може забезпечувати некон'югований бічний ланцюг у цьому положенні. Автори винаходу виявили, що сполуки згідно з даним винаходом забезпечують рівновагу між перевагами, які дає ацилювання, і перевагами певних замін у природній послідовності глюкагону. Композиції згідно з даним винаходом також можуть перебувати в суміші або бути з'єднані, наприклад, за допомогою ковалентних, гідрофобних або електростатичних взаємодій, з носієм лікарського засобу, системою для доставки лікарських засобів і вдосконаленою системою для доставки лікарських засобів для подальшого підвищення стабільності сполуки, підвищення біодоступності, розчинності, зниження побічних ефектів, дотримання хронотерапії, відомих фахівцям у даній області техніки, і підвищення дотримання пацієнтами режиму прийому препарату, або їх поєднання. Приклади носіїв, систем для доставки лікарських засобів і вдосконалених систем для доставки лікарських засобів включають, але не обмежуються ними, полімери, наприклад, целюлозу і її похідні, полісахариди, наприклад, декстран і його похідні, крохмаль і його похідні, полівініловий спирт, полімери акрилату і метакрилату, полімолочну і полігліколеву кислоту і їх блокові співполімери, поліетиленгліколі, білки-носії, наприклад, альбумін, гелі, наприклад, термогелі, наприклад, блокові співполімерні системи, відомі фахівцям у даній області техніки, міцели, ліпосоми, мікросфери, наночастинки, рідкі кристали і їх дисперсії, L2 фазу і їх дисперсії, відомі фахівцям в області техніки розподілу фаз у системі рідина-вода, полімерні міцели, різні емульсії, агенти, які самоемульгуються, агенти, які самомікроемульгуються, циклодекстрини та їх похідні й дендромери. Інші групи дослідників намагалися збільшити період напіввиведення подвійного агоніста GluGLP-1 за допомогою одержання його похідної з PEG (WO2008/101017). Однак, виявилося, що більш ефективно одержувати зазначену похідну за С-кінцем молекули, ніж похідну центральної частини каркаса пептиду, і активність зазначених сполук, як і раніше, залишається зниженою в порівнянні з активністю відповідного незміненого пептиду. 14 UA 104766 C2 5 10 15 20 25 30 35 40 45 50 55 60 На відміну від цього, сполуки згідно з даним винаходом зберігають високу активність відносно рецепторів глюкагону й GLP-1, маючи тривалий фармакокінетичний профіль у порівнянні з відповідними незміненими пептидами. Нативний глюкагон містить Ser у положенні 16. Було показано, що його заміна на Ala, Gly або Thr значно знижує активацію аденілатциклази рецептором глюкагону (Unson et al. Proc. Natl. Acad. Sci. 1994, 91, 454-458). Таким чином, не можна було очікувати, що одержання похідної з заміною на ліпофільну групу в положенні 16 дозволить одержати сполуки, які зберігають активність відносно рецептора глюкагону, що несподівано показано на прикладі сполук згідно з даним описом. У публікації WO2008/101017 виявлено, що для найменшої втрати активності бажаною є наявність негативно зарядженого залишку в положенні 16. Традиційно вважається, що наявність основних амінокислот у положеннях 17 і 18 необхідна для повної активації рецептора глюкагону (Unson et al. J. Biol. Chem. 1998, 273, 10308-10312). Автори даного винаходу виявили, що якщо в положенні 18 перебуває аланін, заміна на гідрофобну амінокислоту в положенні 17 все-таки дозволяє одержувати високо активну сполуку. Навіть сполуки, у яких амінокислота в положенні 17 замінена на ліпофільний замінник, майже повністю зберігають активність відносно рецепторів глюкагону й GLP-1, а також демонструють істотно більш тривалий фармакокінетичний профіль. Це справедливо навіть, якщо відбулося перетворення лізину в положенні 17, що перетворює бічний ланцюг з основного аміну в нейтральну амідну групу. Також автори даного винаходу виявили, що сполуки, ацильовані в положенні 20, як і раніше, є високо активними подвійними агоністами, незважаючи на результати інших досліджень, згідно з якими в положенні 20 повинна бути заміна на основну амінокислоту, яка має в бічному ланцюзі 4-6 атомів, для підсилення активності відносно рецептора GLP-1 у порівнянні з активністю відносно рецептора глюкагону (WO2008/101017). Сполуки згідно з даним описом мають активність відносно рецептора до GLP-1 і глюкагону, якщо в положенні 20 відбулася заміна на лізин і ацилювання. Синтез пептидів Пептидний компонент сполук згідно з даним винаходом можна одержати за допомогою стандартних способів синтезу, систем експресії рекомбінатних генів або будь-якого іншого підходящого способу. Таким чином, зазначений пептид можна синтезувати різними способами, включаючи, наприклад, спосіб, який включає: (а) синтезування зазначеного пептиду способами твердофазного або рідкофазного синтезу пептидів поетапно або за допомогою складання фрагментів і виділення й очищення кінцевого пептидного продукту; (б) експресію конструкції нуклеїнової кислоти, яка кодує зазначений пептид у клітині хазяїна, і виділення продукту експресії з культури клітин хазяїна; або (в) здійснення експресії конструкції нуклеїнової кислоти, яка кодує зазначений продукт, in vitro у безклітковій системі й виділення продукту експресії; або будь-яке сполучення зазначених способів (a), (б) і (в) для одержання фрагментів зазначеного пептиду з наступним лігуванням фрагментів для одержання зазначеного пептиду і його виділення. Може бути переважним синтез аналогів згідно з даним описом способом твердофазного або рідкофазного синтезу пептидів. У зв'язку з цим наводиться посилання на публікацію WO 98/11125 і серед інших Fields, GB et al., 2002, "Principles and practice of solid-phase peptide synthesis" в Synthetic Peptides (2 видання) і приклади в публікації. Ліпофільний замісник Один або більше бічних ланцюгів амінокислот сполуки згідно з даним винаходом кон'юговані 1 з ліпофільним замісником Z . Вважається, що зазначений ліпофільний замісник зв'язує альбумін у кровотоці, захищаючи таким чином сполуки згідно з даним винаходом від руйнування ферментами, що може збільшити період напіввиведення зазначених сполук. Також він здатний змінювати активність зазначеної сполуки, наприклад, відносно рецептора глюкагону і/або рецептора GLP-1. Згідно з деякими варіантами реалізації бічний ланцюг тільки однієї амінокислоти кон'югований із ліпофільним замісником. Згідно з іншими варіантами реалізації кожен із бічних ланцюгів двох амінокислот кон'югований із ліпофільним замісником. Згідно з іншими варіантами реалізації кожен із бічних ланцюгів трьох або більше амінокислот кон'югований із ліпофільним замісником. Якщо сполука містить два або більше ліпофільних замісників, вони можуть бути однаковими або різними. 1 Ліпофільний замісник Z може бути ковалентно пов'язаний із атомом у бічному ланцюзі амінокислоти або, як альтернатива, може бути кон'югований із бічним ланцюгом амінокислоти 15 UA 104766 C2 2 5 10 15 20 25 30 35 40 45 50 за допомогою спейсера Z . Термін "кон'югований" у даному описі використовують для опису фізичного прикріплення однієї певної хімічної групи до іншої та структурних взаємодій між зазначеними групами. Це не вимагає використання якогось певного способу синтезу. 2 Якщо він присутній, спейсер Z використовують для створення проміжку між сполукою і ліпофільною групою. Ліпофільний замісник може бути приєднаний до бічного ланцюга амінокислоти або спейсеру за допомогою ефіру, сульфонового ефіру, тіоефіру, аміду або сульфоніламіду. Також варто розуміти, що зазначений ліпофільний замісник включає ацильну групу, сульфонільну групу, атом азоту, атом кисню або атом сірки, які утворюють частину зазначеного ефіру, сульфонового ефіру, тіоефіру, аміду або сульфоніламіду. Переважно ацильна група зазначеного ліпофільного замісника утворює частину аміду або ефіру з бічним ланцюгом амінокислоти або спейсера. Зазначений ліпофільний замісник може включати вуглеводневий ланцюг, який містить 10-24 атоми вуглецю, наприклад, 10-22 атоми вуглецю, наприклад, 10-2 атоми вуглецю. Переважно він містить щонайменше 11 атомів вуглецю, переважно він містить 18 атомів вуглецю або менше. Наприклад, зазначений вуглеводневий ланцюг може містити 12, 13, 14, 15, 16, 17 або 18 атомів вуглецю. Зазначений вуглеводневий ланцюг може бути лінійним або розгалуженим і може бути насиченим або ненасиченим. З обговорення вище буде зрозумілим, що зазначений вуглеводневий ланцюг переважно заміщений на групу, яка утворює частину прикріплення до бічного ланцюга амінокислоти або спейсер, наприклад, ацильну групу, атом азоту, кисню або сірки. Найбільш переважно зазначений вуглеводневий ланцюг заміщений на ацил, і тому зазначений вуглеводневий ланцюг може бути частиною алканоїлової групи, наприклад, групою додеканоїл, 2-бутилоктаноїл, тетрадеканоїл, гексадеканоїл, гептадеканоїл, октадеканоїл або ейкозаноїл. 1 Як уже згадувалося вище, ліпофільний замісник Z може бути кон'югований із бічним 2 ланцюгом амінокислоти за допомогою спейсера Z . Якщо він присутній, зазначений спейсер приєднаний до зазначеного ліпофільного замісника й зазначеного бічного ланцюга амінокислоти. Зазначений спейсер може бути прикріплений до зазначеного ліпофільного замісника й зазначеного бічного ланцюга амінокислоти незалежно у вигляді ефіру, сульфонового ефіру, тіоефіру, аміду або сульфонаміду. Відповідно він може містити дві функціональні групи, незалежно обрані з ацилу, сульфонілу, атома азоту, атома кисню або атома сірки. Зазначений спейсер може складатися з лінійного вуглеводневого ланцюжка C1-10 або більш переважно лінійного вуглеводневого ланцюжка C1-5. Більше того, зазначений спейсер може мати один або більше замісників, обраних із C 1-6 алкілу, C1-6 аміноалкілу, C1-6 гідроксиалкілу і C1-6 карбоксиалкілу. Зазначений спейсер може являти собою, наприклад, залишок природної або штучної амінокислоти. Наприклад, зазначений спейсер може являти собою залишок Gly, Pro, Ala, Val, Leu, Ile, Met, Cys, Phe, Tyr, Trp, His, Lys, Arg, Gln, Asn, α-Glu, γ-Glu, ε-Lys, Asp, Ser, Thr, Gaba, Aib, β-Ala (тобто 3-амінопропаноїл), 4-амінобутаноїлу, 5-амінопентаноїлу, 6-аміногексаноїлу, 7аміногептаноїлу, 8-амінооктаноїлу, 9-амінононаноїлу, 10-амінодеканоїлу або аміно-3,6диоктаноїлу. Згідно з деякими варіантами реалізації зазначений спейсер являє собою залишок Glu, γ-Glu, ε-Lys, β-Ala (тобто 3-амінопропаноїл), 4-амінобутаноїлу, 8-амінооктаноїлу або аміно3,6-диоксаоктаноїлу. Згідно з даним винаходом γ-Glu та ізоGlu використовуються взаємозамінно. Зазначений бічний ланцюг амінокислоти, з якого кон'югований зазначений ліпофільний замісник, являє собою бічний ланцюг залишку Glu, Lys, Ser, Cys, Dbu, Dpr або Orn. Наприклад, він може являти собою бічний ланцюг залишку Lys, Glu або Cys. Якщо два або більше бічних ланцюгів мають ліпофільний замісник, їх можна незалежним чином вибирати з зазначених залишків. Таким чином, зазначений бічний ланцюг амінокислоти включає карбоксильну, гідроксильну, тіолову, амідну або аміногрупу, для утворення ефіру, сульфонільного ефіру, тіоефіру, аміду або сульфонаміду зі спейсером або ліпофільним замісником. 1 2 Приклад ліпофільного замісника, який включає ліпофільну групу Z і спейсер Z , представлений у формулі нижче: 16 UA 104766 C2 5 10 15 20 25 30 35 40 45 Згідно з даним описом зазначений бічний ланцюг залишку Lys з пептиду згідно з формулою I 2 ковалентно з'єднаний зі спейсером γ-Glu (Z ) за допомогою амідного зв'язку. Гексадеканоїлова 1 група (Z ) ковалентно з'єднана зі спейсером γ-Glu за допомогою амідного зв'язку. Зазначене поєднання ліпофільної групи й спейсера, кон'югованого з залишком Lys, можна позначати за допомогою скорочення К(Гексадеканоїл-γ-Glu), наприклад, у формулах певних сполук. γ-Glu також можна позначати як ізоGlu, і гексадеканоїлову групу можна позначати як пальмітоїлову групу. Таким чином, буде очевидно, що позначення (Гексадеканоїл-γ-Glu) рівносильне позначенням (ізоGlu(Palm)) або (ізоGlu(пальмітоїл)), наприклад, у публікації РCT/GB2008/004121. Фахівцеві в даній області техніки будуть відомі підходящі способи одержання сполук згідно з даним винаходом. Приклади способів представлені в публікаціях WO98/08871, WO00/55184, WO00/55119, Madsen et al (J. Med. Chem. 2007, 50, 6126-32) і Knudsen et al. 2000 (J. Med Chem. 43, 1664-1669). Пегильовані і/або ацильовані сполуки мають короткий період напіввиведення (T½), що призводить до різкого підвищення концентрацій агоніста GluGLP-1. Таким чином, рецептор глюкагону піддається інтенсивному впливу агоніста глюкагону один раз (або два рази) на добу щодня протягом періоду лікування. Без зв'язку з якою-небудь теорією, очевидно, повторна раптова дія агоністів глюкагону на GluR порушує перенос ліпідів і вільних жирних кислот між печінкою й жировою тканиною, що призводить до нагромадження жиру в печінці. Постійна дія на GluR агоністів глюкагону блокує нагромадження жиру в печінці. Було виявлено, що повторна обробка глюкагоном або подвійними агоністами короткої дії GluGLP-1 призводить до збільшення печінки за рахунок відкладення жиру й глікогену (Chan et al., 1984. Exp. Mol. Path. 40, 320-327). Повторна обробка ацильованими подвійними агоністами GluGLP-1 тривалої діїне призводить до зміни розміру печінки (збільшення або зменшення) у пацієнтів з нормальною вагою, але нормалізує рівень ліпідів у печінці (Day et al., 2009; Nat.Chem.Biol. 5, 749-57). Ефективність Зв'язування відповідних сполук із рецепторами GLP-1 або глюкагону (Glu) можна використовувати як показник активності агоніста, але зазвичай надають перевагу використанню біологічного способу аналізу, в якому вимірюють передачу сигналу всередині клітини, викликану зв'язуванням зазначеної сполуки з відповідним рецептором. Наприклад, активація рецептора глюкагону агоністом глюкагону буде стимулювати утворення циклічного АМФ (цАМФ) у клітині. Також активація рецептора GLP-1 агоністом GLP-1 буде стимулювати утворення цАМФ. Таким чином, утворення цАМФ у відповідних клітинах, які експресують один із зазначених рецепторів, можна використовувати для спостереження за активністю рецептора, який представляє інтерес. Тому для визначення активності агоніста відносно обох типів рецепторів можна використовувати відповідну пару типів клітин, кожний із яких експресує тільки один із рецепторів. Фахівцеві в даній області техніки відомі відповідні типи аналізів, а їх приклади представлені нижче. Рецептор GLP-1 і/або глюкагону можуть мати послідовність рецепторів згідно з описом у Прикладах. Наприклад, при аналізі можна використовувати рецептор глюкагону людини (Glucagon-R), який має первинний номер доступу GI: 4503947 (NP_000151.1), і/або рецептор глюкагоноподібного рецептора людини 1 (GLP-1R), який має первинний номер доступу GI:166795283 (NP_002053.3). (Якщо посилаються на послідовності білків-попередників, треба, 17 UA 104766 C2 5 10 15 20 25 30 35 40 45 50 55 60 звичайно, розуміти, що в аналізах може бути використаний зрілий білок, який не містить сигнальної послідовності). Значення EC50 можна використовувати як кількісну міру активності агоніста відносно даного рецептора. Значення EC50 являє собою концентрацію сполуки, необхідну для прояву активності сполуки, рівній половині максимальної активності, у даному аналізі. Таким чином, наприклад, можна вважати, що сполука, EC50 [GLP-1R] якої нижче, ніж EC50 [GLP-1R] нативного глюкагону за результатами певного аналізу, має більшу активність відносно GLP-1R, ніж глюкагон. Сполуки згідно з даним описом в більшості випадків являють собою подвійні агоністи GluGLP-1, тобто вони можуть стимулювати утворення цАМФ як рецептором глюкагону, так і рецептором GLP-1. Стимуляцію кожного рецептора можна виміряти в незалежних аналізах і після цього порівняти один із одним. Порівнюючи значення EC50 для рецептора глюкагону (EC50 [Glucagon-R]) зі значенням EC50 для рецептора GLP-1 (EC50 [GLP-1R]), можна визначити відносну вибірковість даної сполуки відносно рецептора глюкагону (%): Відносна вибірковість відносно рецептора глюкагону (сполуки) = (1/EC50 [Glucagon-R])x100 % / (1/EC50 [Glucagon-R] + 1/EC50 [GLP-1R]) Таким же чином можна визначити відносну вибірковість відносно GLP-1R: Відносна вибірковість відносно рецептора GLP-1R (сполуки) = (1/EC50 [GLP-1R])x100 % / (1/EC50 [Glucagon-R] + 1/EC50 [GLP-1R]) Відносна вибірковість сполуки дозволяє безпосередньо порівнювати її дію на рецептор GLP1 або рецептор глюкагону з її дією на інший рецептор. Наприклад, чим більша відносна вибірковість сполуки відносно GLP-1, тим більш ефективною є сполука відносно рецептора GLP-1 у порівнянні з рецептором глюкагону. За допомогою способів аналізів, описаних нижче, автори виявили, що відносна вибірковість рецептора GLP-1 відносно глюкагону людини становить приблизно 5 %. Сполуки згідно з даним винаходом мають більш високу відносну вибірковість відносно GLP1R, ніж глюкагон людини. Таким чином, при певному рівні активності агоніста рецептора глюкагону людини зазначена сполука буде проявляти підвищений рівень активності агоніста GLP-1R (тобто більшу активність відносно рецептора GLP-1), ніж глюкагон. Варто розуміти, що абсолютна активність конкретної сполуки відносно рецепторів глюкагону й GLP-1 може бути вищою, нижчою або приблизно дорівнювати активності нативного глюкагону людини, якщо сполука має відповідну відносну вибірковість відносно GLP-1R. Однак у зазначених сполук згідно з даним описом значення EC50 [GLP-1R] може бути меншим, ніж у глюкагону людини. Зазначені сполуки можуть мати менше значення EC 50 [GLP1R], ніж глюкагон людини, при збереженні значення EC50 [Glucagon-R], яке не більше, ніж у 10 разів вище за EC50 [Glucagon-R] глюкагону людини, що не більше, ніж у 5 разів вище за EC 50 [Glucagon-R] глюкагону людини, або яке не більше, ніж у 2 рази вище EC 50 [Glucagon-R] глюкагону людини. Бажано, щоб EC50 будь-якої даної сполуки, як для рецептора глюкагону людини (GlucagonR), так і для GLP-1R, була меншою за 1 нМ. Сполуки згідно з даним винаходом можуть мати EC50 [Glucagon-R] не більше, ніж в 2 рази вище, ніж глюкагон. Сполуки згідно з даним винаходом можуть мати EC 50 [Glucagon-R] не більше, ніж в 2 рази вище, ніж глюкагон, і мати EC50 [GLP-1R] не більше, ніж половина, одна п'ята або одна десята EC50 [GLP-1R] глюкагону людини. Відносна вибірковість зазначених сполук відносно рецептора GLP-1 може бути більше 5 % і менше 95 %. Наприклад, зазначені сполуки можуть мати відносну вибірковість 5-20 %, 10-30 %, 20-50 %, 30-70 % або 50-80 %, або 30-50 %, 40-60 %, 50-70 % або 75-95 %. Терапевтичне застосування Сполуки згідно з даним винаходом можуть забезпечувати привабливий спосіб лікування порушень метаболізму, включаючи ожиріння й цукровий діабет. Діабет включає групу метаболічних захворювань, для яких характерна гіперглікемія, яка виникає в результаті порушення секреції інсуліну і/або дії інсуліну. Гострі ознаки діабету включають рясне вироблення сечі, що призводить до компенсаторної спраги й надлишкового споживання їжі, погіршення зору, безпричинної втрати ваги, млявості і зміни енергетичного метаболізму. Хронічна гіперглікемія при діабеті викликає тривале руйнування, дисфункцію й відмову різних органів, зокрема, очей, нирок, нервів, серця й кровоносних судин. Діабет класифікують на діабет 1 типу, діабет 2 типу і гестаційний цукровий діабет у залежності від патогенетичних особливостей. Діабет 1 типу становить 5-10 % усіх випадків діабету й викликається аутоімунним руйнуванням інсулін-секретуючих бета-клітин підшлункової залози. 18 UA 104766 C2 5 10 15 20 25 30 35 40 45 50 55 60 На частку діабету 2 типу припадає 90-95 % випадків захворювання діабетом, і він є результатом цілого набору порушень метаболізму. Діабет 2 типу є наслідком того, що власне вироблення інсуліну стає недостатнім для підтримки рівня глюкози в плазмі нижче граничного. Термін гестаційний діабет означає будь-який ступінь непереносимості глюкози, виявлений під час вагітності. Переддіабетичні стани включають порушений рівень глюкози натщесерце й порушену переносимість глюкози, і означає ті стани, які виникають, якщо рівень глюкози в крові підвищений, але нижче рівня, встановленого для діагностики діабету. Більша частина людей, що страждають від діабету 2 типу й переддіабетичних станів, має підвищений ризик захворюваності й смертності через високе поширення додаткових метаболічних факторів ризику, включаючи центральне ожиріння (надлишкова жирова тканина навколо внутрішніх органів живота), атерогенну дисліпідемію (порушення рівня жиру в крові, включаючи високий рівень тригліцеридів, низький рівень HDL холестерину і/або високий рівень LDL холестерину, які сприяють відкладенню бляшок у стінці артерій), підвищений тиск (гіпертензія), схильність до тромбоутворення (наприклад, високий рівень фібриногену або інгібітора активатора плазміногену-1 у крові) і прозапальний стан (наприклад, підвищений рівень С-реактивного білка в крові). У свою чергу, ожиріння збільшує ризик розвитку переддіабетичних станів, діабету 2 типу, а також деяких типів раку, обструктивного апное сну й хвороби жовчного міхура. Дисліпідемія підвищує ризик розвитку серцевосудинних захворювань. Ліпопротеїни високої щільності (HDL) мають клінічне значення, оскільки існує зворотна залежність між концентрацією HDL у плазмі й ризиком розвитку атеросклерозу. Більша частина холестерину, відкладеного в атеросклеротичних бляшках, походить від LDL, і тому підвищені концентрації ліпопротеїнів низької щільності (LDL) у великій мірі пов'язані з атеросклерозом. Співвідношення HDL/LDL є показником ризику розвитку атеросклерозу й, зокрема, атеросклерозу коронарних судин. Без зв'язку з певною теорією, вважають, що зазначені сполуки згідно з даним винаходом діють як подвійні агоністи GluGLP-1. Подвійні агоністи можуть об'єднувати дію глюкагону, наприклад, на обмін жирів, із дією GLP-1, наприклад, на рівень глюкози в крові й споживання їжі. Тому вони можуть прискорювати усунення зайвої жирової тканини, викликати стійку втрату ваги й покращувати глікемічний контроль. Також подвійні агоністи GluGLP-1 можуть впливати на зниження факторів ризику розвитку серцевосудинних захворювань, таких як високий рівень холестерину й LDL-холестерину. Таким чином, сполуки згідно з даним описом можна використовувати як фармацевтичні агенти для попередження збільшення маси тіла, забезпечення втрати ваги, зниження надлишкової маси тіла або лікування ожиріння (наприклад, завдяки контролю апетиту, годівлі, споживання їжі, споживання калорій і/або витрати енергії), включаючи патологічне ожиріння, а також супутні захворювання й стани, включаючи, але не обмежуючись ними, запалення, викликане ожирінням, захворювання жовчного міхура, викликане ожирінням, і апное сну, викликане ожирінням. Також сполуки згідно з даним винаходом можна використовувати для лікування стійкості до інсуліну, переносимості глюкози, переддіабетичних станів, підвищеного рівня глюкози в крові натщесерце, діабету 2 типу, гіпертензії, дисліпідемії (або сполучення зазначених метаболічних факторів ризику), атеросклерозу, артеріосклерозу, ішемічної хвороби серця, захворювання периферичних артерій і інсульту. Представлено всі стани, які можуть бути викликані ожирінням. Однак дії сполук згідно з даним винаходом на зазначені стани можуть здійснюватися в цілому або частково за допомогою впливу на масу тіла або можуть не залежати від цього. Фармацевтичні композиції Сполуки згідно з даним винаходом або їх солі можуть бути приготовані у вигляді фармацевтичних композицій, підготовлених для зберігання або введення, які зазвичай містять терапевтично ефективну кількість сполуки згідно з даним винаходом або її солі у фармацевтично прийнятному носії. Терапевтично ефективна кількість сполуки згідно з даним винаходом буде залежати від способу введення, виду ссавця, якого лікують, і фізичних особливостей конкретного розглянутого ссавця. Перераховані фактори та їх роль у визначенні зазначеної кількості відомі фахівцям в області медицини. Ця кількість і спосіб введення можуть бути адаптовані для досягнення оптимальної ефективності, а також можуть залежати від таких факторів, як вага, харчування, яке супроводжує лікування, та інших факторів, добре відомих фахівцям в області медицини. Розміри доз і режим дозування, найбільш підходящий для людини, можуть бути визначені за результатами, отриманими за допомогою даного винаходу, і можуть бути підтверджені належним чином спланованими клінічними випробуваннями. 19 UA 104766 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ефективну дозу й протокол лікування можна визначити традиційними способами, починаючи з низьких доз на лабораторних тваринах, а потім збільшуючи дозу при спостереженні дії, а також систематично змінюючи режим дозування. Численні фактори можуть бути прийняті до уваги лікарем при визначенні оптимальної дози для даного пацієнта. Такі фактори відомі фахівцям у даній галузі науки. Термін "фармацевтично прийнятний носій" включає будь-які стандартні фармацевтичні носії. Фармацевтично прийнятні носії для терапевтичного використання добре відомі в даній області техніки й описані в Remington's Pharmaceutical Sciences, Mack Publishing Co. (A. R. Gennaro edit. 1985). Наприклад, можуть бути використані стерильний фізіологічний розчин і фосфатний сольовий буфер, які мають слабокислий або фізіологічний рН. Буферні агенти можуть являти собою фосфат, цитрат, ацетат, трис/гідроксиметил амінометан (TRIS), N-трис (гідроксиметил) метил-3-амінопропансульфонову кислоту (TAPS), бікарбонат амонію, диетаноламін, гістидин, який є переважним буфером, аргінін, лізин або ацетат, або їх суміші. Термін також включає будь-які агенти, перераховані у Фармакопеї США для застосування для тварин, включаючи людину. Термін "фармацевтично прийнятна сіль" відноситься до солі цих сполук. Солі включають фармацевтично прийнятні солі, такі як кислотно-адитивні солі й основні солі. Приклади адитивних солей включають солі хлористоводневої кислоти, солі лимонної кислоти й солі оцтової кислоти. Приклади основних солей включають солі, у яких катіон обраний із катіонів лужних металів, таких як натрій і калій, лужноземельных металів, таких як кальцій і йони амонію + 3 4 3 4 N(R ) 3(R ), де R і R незалежно позначає необов'язково заміщений C 1-6-алкіл, необов'язково заміщений C2-6-алкеніл, необов'язково заміщений арил або необов'язково заміщений гетероарил. Інші приклади фармацевтично прийнятних солей описані в публікації "Remington's Pharmaceutical Sciences", 17 видання Ed. Alfonso R. Gennaro (Ed.), Mark Publishing Company, Easton, PA, U.S.A., 1985 і більш пізніх виданнях та в Енциклопедії Фармацевтичної Технології. Термін "лікування" позначає підхід, спрямований на досягнення сприятливих або бажаних клінічних результатів. З метою даного винаходу, сприятливі або бажані клінічні результати включають, але не обмежуються ними, полегшення симптомів, зменшення ступеня розвитку захворювання, стабілізований (тобто не погіршується) стан захворювання, затримку або вповільнення розвитку захворювання, покращення або послаблення хворобливого стану й ремісію (як часткову, так і повну), як помітні, так і непомітні. Термін "лікування" також може означати подовжене виживання в порівнянні з очікуваним виживанням при відсутності лікування. Термін "лікування" означає втручання, здійснюване з метою попередження розвитку або зміни патології захворювання. Відповідно термін "лікування" відноситься як до терапевтичного лікування й попередження, так і профілактичних заходів. Ті, хто має потребу в лікуванні, включають тих, хто вже страждає від захворювання, а також тих, у яких захворювання повинно бути відверненим. Під лікуванням розуміють інгібування або зниження росту патології або симптомів (наприклад, збільшення маси тіла, гіперглікемія) у порівнянні з відсутністю лікування, і не обов'язково повне припинення відповідного захворювання. Фармацевтичні композиції можуть перебувати у вигляді дозованої лікарської форми. У такому вигляді композиція розділена на окремі дози, які містять відповідну кількість активного компонента. Дозована лікарська форма може являти собою упакований лікарський засіб, при цьому упакування містить певні кількості препаратів, наприклад, упаковані таблетки, капсули й порошки у флаконах або ампулах. Дозована лікарська форма також може являти собою капсулу, облатку або таблетку, або ж вона може являти собою необхідну кількість кожної з цих упакованих форм. Вона може бути представлена у вигляді одноразової дози для ін'єкцій, наприклад, у вигляді ручки. Композиції можуть бути сформульовані для будь-якого підходящого шляху й способу введення. Фармацевтично прийнятні носії або розріджувачі включають носії або розріджувачі, які використовуються в лікарських формах, які підходять для перорального, ректального, назального або парентерального (включаючи підшкірне, внутрішньом'язове, внутрішньовенне, внутрішньошкірне й трансдермальне) введення. Композиції можуть бути зручно представлені у вигляді дозованої лікарської форми й можуть бути отримані будь-яким зі способів, добре відомих у області фармацевтики. Підшкірний або трансдермальний способи введення можуть бути особливо підходящими для сполук згідно з даним описом. Комбінована терапія Зазначені сполуки згідно з даним винаходом можна вводити як компонент комбінованої терапії з засобом для лікування діабету, ожиріння, дисліпідемії або гіпертензії. У таких випадках два активних агенти можна вводити спільно або окремо, і як компонент одного лікарського засобу або у вигляді окремого лікарського засобу. Таким чином, сполуку згідно з даним винаходом (або її сіль) можна застосовувати в 20 UA 104766 C2 5 10 15 20 25 30 35 40 45 50 55 60 поєднанні з анти-діабетичними засобами, включаючи, але не обмежуючись ними, метформін, сульфонілсечовину, глінід, інгібітор DPP-IV глітазон або інсулін. Згідно з переважним варіантом реалізації сполуку або її сіль застосовують у поєднанні з інсуліном, інгібітором DPP-IV, сульфонілсечовиною або метформіном, зокрема з сульфонілсечовиною або метформіном, для досягнення адекватного контролю глікемії. Згідно з більш переважним варіантом реалізації зазначена сполука або її сіль використовується в поєднанні з інсуліном або аналогом інсуліну для досягнення адекватного контролю глікемії. Приклади аналогів інсуліну, включають, але не обмежуються ними, препарати Лантус, Новорапід, Хумалог, Новомікс, Актрафан HM, Левемір і Апідра. Зазначену сполуку або її сіль можна надалі застосовувати в поєднанні з засобом проти ожиріння, включаючи, але не обмежуючись ними, агоніст рецептора глюкагон-подібного пептиду 1, пептид YY або його аналог, антагоніст рецептора канабіноїдів 1, інгібітор ліпази, агоніст рецептора меланокортину 4 або антагоніст рецептора меланін-концентруючого гормону 1. Сполуку або її сіль можна надалі застосовувати в поєднанні з засобом проти гіпертензії, включаючи, але не обмежуючись ними, інгібітор ангіотензинперетворюючого ферменту, блокатор рецептора ангіотензину II, діуретики, бета-блокатори або блокатори кальцієвих каналів. Зазначену сполуку або її сіль можна надалі застосовувати в поєднанні з засобом проти дисліпідемії, включаючи, але не обмежуючись ними, статин, фібрат, ніацин і/або інгібітор усмоктування холестерину. Методи Схема синтезу ацильованих аналогів глюкагону Твердофазний Fmoc-синтез пептидів здійснювали за допомогою системи для синтезу пептидів CEM Liberty. Перед використанням смолу TentaGel S Ram (1 г; 0,25 ммоль/г) розмочували в NMP (10 мл) і наносили між пробіркою й хімічним реактором з використанням DCM і NMP. Спряження: Fmoc-амінокислоту в NMP/DMF/DCM (1:1:1; 0,2 M; 5 мл) додавали до смоли в мікрохвильовій комірці CEM Discover разом із HATU/NMP (0,5 M; 2 мл) і DIPEA/NMP (2,0 M; 1 мл). Реакційну суміш нагрівали до 75 °C протягом 5 хвилин, при цьому азот у вигляді бульбашок проходив через суміш. Потім смолу промивали NMP (4 × 10 мл). Відщеплення захисних груп: Піперидин/NMP (20 %; 10 мл) додавали до суміші для початкового відщеплення захисних груп і зазначену суміш нагрівали за допомогою мікрохвильового випромінювання (30 с.; 40 °C). Осушували хімічний реактор і вносили другу частину піперидин/NMP (20 %; 10 мл) і повторно нагрівали (75 °C; 3 хв). Потім смолу промивали NMP (6 × 10 мл). Ацилювання бічного ланцюга: Fmoc-Lys(ivDde)-OH або іншу амінокислоту з ортогональною захисною групою бічного ланцюга вводили в положення ацилювання. Потім проводили Boc-захист на N-кінці каркаса пептиду з використанням Boc2O або, як альтернатива, з використанням Boc-захищеної амінокислоти при останньому спряженні. Поки пептид залишався іммобілізованим на смолі, ортогональну захисну групу бічного ланцюга селективно відщеплювали з використанням свіжоприготовленого розчину гідразин гідрату (2-4 %) в NMP два рази по 15 хв. Незахищений бічний ланцюг лізину сполучали з Fmoc-Glu-OtBu або іншою амінокислотою спейсера, захист якої знімали за допомогою піперидину, і яку ацилювали за допомогою ліпофільної групи з використанням способу сполучення пептидів згідно з описом вище. Використовували наступні скорочення: ivDde: 1-(4,4-диметил-2,6-діоксоциклогексиліден)-3-метил-бутил Dde: 1-(4,4-диметил-2,6-діоксоциклогексиліден)-етил DCM: дихлорметан DMF: N, N-диметилформамід DIPEA: диізопропілетиламін EtOH: етанол Et2O: діетилефір HATU: N-[(диметиламіно)-1H-1,2,3-триазол[4,5-b]піридин-1-ілметилен]-N-метилметанамін гексафторфосфат N-оксид MeCN: ацетонітрил NMP: N-метилпіролідон TFA: трифтороцтова кислота TIS: триізопропілсилан 21 UA 104766 C2 5 10 15 20 25 30 35 40 45 50 55 60 Розщеплення: Смолу промивали EtOH (3 × 10 мл) і Et2O (3 × 10 мл) і висушували до постійної маси при кімнатній температурі (r.t.). Неочищений пептид відщеплювали від смоли за допомогою TFA/TIS/вода (95/2.5/2.5; 40 мл, 2 год.; r.t.). Більшу частину TFA видаляли при зниженому тиску, осаджували неочищений пептид, промивали три рази діетиленом і висушували до постійної маси при кімнатній температурі. Очищення способом ВЕРХ неочищеного пептиду: Неочищений пептид очищали до ступеня більше 90 % за допомогою препаративної зворотно-фазової ВЕРХ з використанням PerSeptive Biosystems VISION Workstation, обладнаної колонкою C-18 (5 см, 10 мкм), та колектора фракцій і пропускали зі швидкістю 35 мл/хв при градієнті буфера А (0,1 % TFA, вода) і буфера Б (0,1 % TFA, 90 % MeCN, вода). Фракції аналізували способом аналітичної ВЕРХ та МС і відповідні фракції накопичували й ліофілізували. Кінцевий продукт піддавали ВЕРХ і МС. Одержання ліній клітин, які експресують рецептори глюкагону і GLP-1 людини кДНК, які кодують рецептор глюкагону людини (Glucagon-R) (основний номер доступу P47871) або рецептор глюкагоноподобного пептиду-1 людини (GLP-1R) (основний номер доступу P43220), були клоновані з бібліотеки кДНК BC104854 (MGC: 132514 / Image: 8143857) або BC112126 (MGC: 138331/IMAGE: 8327594), відповідно. ДНК, яка кодує рецептор глюкагону людини або GLP-1R, ампліфікували методом ПЛР з використанням праймерів, які кодують термінальні сайти рестрикції для субклонування. Праймери 5'-кінця додатково кодували консенсусну послідовність Козак для забезпечення ефективної трансляції. Точність ДНК, які кодують рецептор глюкагону людини (Glucagon-R) і GLP-1R, підтверджували за допомогою секвенування ДНК. ПЛР-продукти, які кодують рецептор глюкагону людини або GLP-1R, субклонували у вектор експресії ссавців, який містить маркер стійкості до неоміцину (G418). Векторами експресії ссавців, які кодують рецептор глюкагону людини або GLP-1R, трансфікували клітини HEK293 з використанням стандартного кальцій-фосфатного методу трансфекції. Через 48 годин після трансфекції клітини висівали для проведення клонування методом серійних розведень, і відбирали клони, додаючи в культуральне середовище 1 мг/мл G418. Через три тижні було відібрано 12 колоній клітин, які вижили і які експресують рецептор глюкагону людини й GLP-1R, їх культивували й проводили аналіз ефективності відносно рецептора глюкагону людини й GLP-1R згідно з описом нижче. Для профілювання сполук відібрали один клон, який експресує рецептор глюкагону людини, і один клон, який експресує GLP-1R. Аналізи ефективності відносно рецептора глюкагону й рецептора GLP-1 Клітини HEK293, які експресують рецептор глюкагону людини або GLP-1R людини, сіяли при щільності 40,000 клітин/лунку в 96-лункові мікротитровальні планшети, покриті 0,01 % полі-Lлізиному й культивували протягом доби в 100 мкл поживного середовища. У день проведення аналізу кондиціоноване середовище видаляли й клітини промивали 200 мкл розчину Тироде. Клітини інкубували в 100 мкл розчину Тироде, який містив зростаючі концентрації досліджуваних пептидів, 100 мкМ IBMX і 6 мМ глюкози протягом 15 хв при 37 C. Реакцію зупиняли додаванням 25 мкл 0,5 M HCl і витримували на льоду протягом 60 хв. Кількість цАМФ визначали за допомогою набору FlashPlate cAMP Perkin-Elmer. EC50 і відносні ефективності в порівнянні з контрольними сполуками (глюкагон і GLP-1) визначали за допомогою автоматичної побудови кривої. Біоаналітичний спосіб аналізу для кількісного визначення агоністів пептиду Glu-GLP1 у плазмі мишей після підшкірного введення Мишам уводили підшкірно (s.c.) 100 нмоль/кг агоністів. Мишей забивали й одержували кров у наступні моменти часу; 0,5, 2, 4, 6, 16 і 24 години. Зразки плазми досліджували методом осадження білків з наступної твердофазною екстракцією (SPE) і рідкою хроматографією й масспектрометрією (LC-MS). Тест на переносимість пероральної глюкози (OGTT), рівень ліпідів і маса тіла у нормальних мишей лінії C57Bl/6J, яких довгостроково утримували на високожировій дієті, і HbА1c у мишей db/db Самці мишей (лінії C57Bl/6J, які довгостроково утримувалися на високожировій дієті, лінії C57Bl/6J, які короткочасно утримувалися на високожировій дієті, і db/db) адаптувалися до умов і мали вільний доступ до їжі й води. Їх утримували групами по 5-6 мишей у приміщенні з контрольованим освітленням, температурою й вологістю (цикл 12 годин світло: 12 годин темрява, світло вмикали/вимикали о 20.00/8.00; 24 °C; 50 % відносна вологість). Тваринам вводили s.c. 100 мкл контролю (раз на добу) протягом 3 днів для адаптації тварин до умов утримування та ін'єкцій. Зразки крові одержували з очей або кінчика хвоста. Перед 22 UA 104766 C2 5 10 15 20 25 30 35 40 45 50 55 60 початком лікування тварин випадковим чином розподіляли по групах. Два рази на день мишам вводили s.c. агоніст GluGLP-1 або носій (об'єм для введення = 2,5 мл/кг). Під час дослідження щодня реєстрували масу тіла й використовували її для введення дози пептиду, підібраної в залежності від маси тіла. Розчини пептидів готували безпосередньо перед введенням дози. Тести на переносимість пероральної глюкози (OGTT) проводили після невеликого голодування тварин. Для попередження спотворювальної дії прийому їжі тварин піддавали голодуванню протягом всіх OGTT. Після введення дози пептиду проводили забір початкових зразків крові. Після цього перорально вводили дозу глюкози (1 г/кг), розчиненої у фосфатному буфері (pН = 7,4) (5 мл/кг), і тварин повертали в домашні клітки (t=0). Рівень глюкози в цільній крові (BG) визначали в моменти часу t=15 хв, t=30 хв, t=60 хв, t=90 хв і t=120 хв. Концентрації BG визначали глюкозооксидазним методом у краплі крові (< 5 мкл; Elite Autoanalyser, Bayer, Данія) згідно з інструкціями виробника. Визначення HbА1c Можна оцінювати довгострокову дію сполуки на рівень глюкози у пацієнта за визначенням рівня гемоглобіну A1C (HbА1c). HbА1c являє собою глікозильований гемоглобін, рівень якого в клітині відображає середній рівень глюкози, яка діє на клітину протягом її життя. У мишей HbА1c є біологічним маркером середнього рівня глюкози протягом попередніх 4 тижнів, оскільки перетворення гемоглобіну в HbА1c обмежене тривалістю життя еритроцитів протягом 47 днів (Abbrecht & Littell, 1972; J. Appl. Physiol. 32, 443-445). Визначення HbА1c основане на Turbidimetric INhibition ImmunoAssay (TINIA), у ході якого HbА1c у зразку взаємодіє з антитілами до HbА1c з утворенням розчинних комплексів антигенантитіло. При додаванні полігаптенів вони взаємодіють із зайвими антитілами до HbА1c з утворенням нерозчинного комплексу антитіло-гаптен, який можна визначити методами турбідиметрії. Вільний гемоглобін у гемолізованому зразку перетворюється в похідну, яка має певний спектр поглинання, який можна виміряти біхроматично під час фази попередньої інкубації. Кінцевий результат виражається у вигляді відносного вмісту HbА1c у загальному гемоглобіні (Cobas® вказівка з застосування A1 C-2). Визначення рівня холестерину Зазначений аналіз являє собою ферментативний колориметричний метод. У присутності йонів магнію декстран сульфан вибірково утворює водорозчинні комплекси з LDL, VLDLA і хіломікронами, які стійкі до PEG-модифікованих ферментів. HDL холестерин визначається ферментативно за допомогою холестерин-естерази й холестерин-оксидази, сполученими з PEG через аміногрупи. Ефіри холестерину розпадаються ферментативно до вільного холестерину й жирних кислот. Холестерин HDL ферментативно окисляється до холест-4-ен-3-она й H2O2, і утворена H2O2 визначається колориметрично (Cobas®; вказівка з застосування HDLC3). При прямому визначенні LDL використовується вибіркова міцелярна розчинність LDL під дією нейонного детергенту і взаємодія цукру й ліпопротеїнів (VLDL і хіломікронів). Сполучення цукру й детергенту дозволяє вибірково визначати LDL у плазмі. Принцип аналізу такий же, як у випадку холестерину й HDL, але через цукор і детергент тільки ефіри LDL-холестерин розпадаються до вільного холестерину й жирних кислот. Вільний холестерин потім окисляється, і утворена H2O2 визначається колориметрично (Вказівка з застосування LDL_C, Cobas®). Збільшення маси тіла на мишах лінії C57BL/6J, яких утримували на високожировій дієті. Самців мишей C57Bl/6J у віці 6 тижнів адаптували до нових умов із триразовою годівлею за високожировою дієтою (D12492, Research Diet Inc., New Brunswick, USA) і доступом до води. Тваринам вводили ін'єкції s.c. 100 мкл носія протягом 3 днів для адаптації тварин до умов та ін'єкцій. Тваринам вводили два рази на добу ексендин-4, сполуку 3, сполуку 6, сполуку 7, сполуку 8, сполуку 11 і сполуку 12 або носій. Протягом дослідження щодня записували масу тіла й використовували це для введення дози пептиду в залежності від маси тіла. Усіх тварин умертвлювали в один день методом цервікальної дислокації. Переносимість пероральної глюкози через 2, 4, 6, 8, 10 і 12 години після введення дози засобів на мишах лінії C57BL/6J, яких утримували на високожировій дієті. Самців мишей C57Bl/6J у віці 6 тижнів адаптували до нових умов із триразовою годівлею за високожировою дієтою (D12492, Research Diet Inc., New Brunswick, USA) і доступом до води. Тваринам вводили ін'єкції носія s.c. протягом 3 днів для адаптації тварин до умов та ін'єкцій. З кінця хвоста забирали зразки крові й визначали рівень глюкози. Концентрацію глюкози (мМ) визначали глюкозооксидазним методом у краплі крові (< 5 мкл; Contour Autoanalyser, Bayer, Denmark) згідно з інструкцією виробника. Через 4 тижні дотримання високожирової дієти тварин зважували й використовували масу тіла для введення дози пептиду в залежності від маси тіла. Тест на переносимість пероральної глюкози (OGTT) проводили після піддавання тварин 23 UA 104766 C2 5 10 15 20 25 30 35 40 45 50 55 голодуванню протягом 4 годин. Через 2, 4, 6, 8, 10 і 12 годин після введення дози пептиду або носія забирали початковий зразок крові (t=-0 хв). Відразу після цього вводили пероральну дозу глюкози (1 г/кг) і тварин повертали в їх домашні клітки (t=0). Рівні BG визначали через t=15 хв, t=30 хв, t=60 хв і t=90 хв. Безпосередньо після забору крові всіх тварин умертвлювали під дією анестезії CO2 методом цервікальної дислокації. Споживання їжі молодими худими мишами лінії C57BL/6J і старими мишами з ожирінням лінії C57BL/6J. Мишей лінії C57BL/6J утримували на високожировій дієті протягом 11 днів і мишей лінії C57BL/6J утримували на високожировій дієті протягом 52 тижнів. За три дні до початку дослідження мишей поміщали в окремі клітки і зважували. За 4 дні до початку дослідження їх адаптували до обігу й введення засобів за допомогою щоденних ін'єкцій s.c. За день до початку дослідження їжу забирали в 20:00. У день дослідження мишей зважували і вводили їм ін'єкції s.c. ексендину-4, сполуки 7 або носія в момент часу t=0 годин (8:00) і t=12 годин (20:00). Безпосередньо після введення засобів (t=0) мишам давали попередньо зважену їжу й визначали загальне споживання їжі, зважуючи їжу, що залишилася, через t=1, 2, 4, 8, 12 і 24 години. Після зважування їжі й тварин у момент часу t=24 години мишей умертвлювали за допомогою цервікальної дислокації. Утворення цАМФ у гепатоцитах. Методика Первинні гепатоцити людини, отримані від Lonza Walkersvill, Inc., акуратно промивали буфером TB та інкубували при 37 °C з пептидами, розчиненими в буфері TB, у який додавали 100 мкМ IBMX і 0,1 % казеїн протягом 15 хв. Перед додаванням до клітин зазначені розчини пептидів нагрівали до 37 °C. Реакцію зупиняли додаванням 25 мкл льодяного 0,5 M HCl і клітини інкубували на льоді протягом 60 хв. Вміст цАМФ у лунках визначали, додаючи 25 мкл кислих витяжок лунок в 75 мкл розчину буфера ацетату натрію, pН 6,2, в 96-лункові мікротитровальні планшети "FlashPlates", покриті сцинтилятором і антитілами до цАМФ. Після додавання 100 мкл 125 розчину 10 μCi [ I]цАМФ до кожної лунки, планшети інкубували протягом ночі при 4 C, 125 випорожнювали їх і кількість [ I]цАМФ, який зв'язався з планшетами FlashPlates, визначали за 125 допомогою програми “[ I]cAMP flashplate 10 min" на TopCount NXT. Пептиди досліджували в концентраціях у межах 0,1-1000 нМ. Аналіз даних і статистика Кількість цАМФ, утвореного в клітинах, визначали за стандартною кривою, побудованою за даними про кількість цАМФ. Значення EC50 визначали, підставляючи дані кількості цАМФ у формулу нижче з використанням Sigma Plot: Наведені нижче приклади представлені для ілюстрації даного винаходу. Маса печінки/маса тіла мишей лінії C57BL/6J Два рази на добу мишам уводили s.c. сполуку 1 і сполуку 11 (у двох дозах: 0,5 і 5 нмоль/кг) або носій протягом 2 тижнів. Під час проведення дослідження щодня записували масу тіла й використовували це для введення доз пептиду в залежності від маси тіла. У день, коли тварин умертвлювали, вилучали печінку й визначали її масу. Приклади Приклад 1: Синтез сполук і властивості пептидів Приклад синтезу: Сполуку 9 синтезували методом твердофазного Fmoc-синтезу за допомогою синтезатора CEM Liberty з використанням смоли TentaGel S Ram (1,17 г; 0,23 ммоль/г) згідно з описом вище. У положенні 17 використовували Fmoc-Lys(ivDde)-OH і для каркаса пептиду використовували псевдопроліни Fmoc-Phe-Thr(Psi. Me, Me про)-OH і Fmoc-Asp(OtBu)-Ser(.Psi., Me, Me про)-OH. Після синтезу каркаса пептиду на смолі ручним способом відщеплювали N-кінцеву Fmoc-групу з наступним Boc-захистом з використанням Boc2O (226 мг) і DIEA (54 мкл) в DCM. Потім за допомогою свіжоприготовленого розчину гідразин-гідрату/NMP (4 %; 2 × 15 хв) відщеплювали групу ivDde. Після цього на синтезаторі CEM Liberty два елементарні блоки Fmoc-Glu-OtBu, що залишилися, і гексадеканову кислоту додавали до незахищеного бічного ланцюга лізину. Пептид відщеплювали від смоли відповідно до опису вище й здійснювали його очищення на колонці Gemini-NX (5 см, 10 мкм, C18) при пропущенні суміші буфера А (0,1 % TFA, вода) і 24 UA 104766 C2 5 10 буфера Б (0,1 % TFA, 90 % MeCN, вода). Проводили елюцію продукту градієнтом 25 % - 65 % буфера Б протягом 47 хв і фракції (9 мл) збирали за допомогою колектора фракцій. Проводили аналітичну ВЕРХ і МС відповідних, і фракції з чистотою вище 95 % збирали й ліофілізували з одержанням білого порошку. Вихід продукту вагою 72 мг мав чистоту 97 % за результатами аналітичної ВЕРХ і молекулярну масу 3697,05 Да за результатами МС (3696,97 Да). Приклад 2: Ефективність стосовно рецепторів до GLP-1 і глюкагону Ефективність агоністів GluGLP-1 визначали за допомогою дії на клітини, які експресують рецептор глюкагону людини (hGlucagonR) і hGLP-1R, зростаючими концентраціями ацильованих сполук зі списку і вимірювання утвореного цАМФ згідно з описом в Методах. Результати представлені в Таблиці 1: Таблиця 1 Значення EC50 ацильованих сполук для рецептора GLP-1 і рецептора глюкагону Послідовність Сполука 1 EC50 (нМ) GLP1R 0,06 Сполука 2 0,20 0,13 Сполука 3 0,11 0,12 Сполука 4 0,10 0,04 Сполука 5 0,57 0,22 Сполука 6 0,09 0,10 Сполука 7 0,11 0,16 Сполука 9 0,12 0,17 Сполука 10 0,15 0,63 Сполука 11 0,09 0,16 Сполука 12 0,27 0,27 Сполука 13 0,08 0,26 Сполука 14 0,14 0,78 Сполука 15 0,23 1,87 Сполука 16 0,24 0,46 Сполука 17 0,09 0,39 Сполука H-HSQGTFTSDYSKYLDSKAAHDFVEWLLRA-NH2 H-HSQGTFTSDYSKYLD-K(Гексадеканоїл-γ-Glu)KAAHDFVEWLLRA-NH2 H-HSQGTFTSDYSKYLD-S-K(Гексадеканоїл-γ-Glu)AAHDFVEWLLRA-NH2 H-HSQGTFTSDYSKYLDSKAA-K(Гексадеканоїл-γ-Glu)DFVEWLLRA-NH2 H-HSQGTFTSDYSKYLDSKAAHDFVEWL-K(Гексадеканоїлγ-Glu)-RA-NH2 H-HSQGTFTSDYSKYLDSKAAHDFVEWLLK(Гексадеканоїл-γ-Glu)-A-NH2 H-H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-γ-Glu)AAHDFVEWLLSA-NH2 H-H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-γ-Glu)AARDFVAWLLRA-NH2 H-H-Aib-QGTFTSDYSKYLDSKAA-K(Гексадеканоїл-γ-Glu)DFVAWLLRA-NH2 H-H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-γ-Glu)AAHDFVEWLLRA-NH2 H-H-Aib-QGTFTSDYSKYLDSKAAHDFVEWLLK(Гексадеканоїл-γ-Glu)-A-NH2 H-H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-γ-Glu)AAHDFVE()WLLK()A-NH2 H-H-Aib-QGTFTSDYSKYLDS-K(Додеканоїл-γ-Glu)AAHDFVEWLLSA-NH2 H-H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-[3Амінопропаноїл])-AAHDFVEWLLSA-NH2 H-H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-[8Амінооктаноїл])-AAHDFVEWLLSA-NH2 H-H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-ε-Lys)AAHDFVEWLLSA-NH2 EC50 (нМ) Glu 0,06 Залишки, позначені за допомогою (), утворюють внутрішньомолекулярне лактамне кільце. 25 UA 104766 C2 Таблиця 1a Значення EC50 додаткових сполук згідно з даним винаходом EC50 Послідовність Сполука (нМ) GLP-1R H-H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-ізоGlu)Сполука 18 0,066 AAHDFVEWLLS-OH H-H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-ізоGlu)Сполука 19 0,048 AAHDFVEWLL-OH H-H-Aib-EGTFTSDYSKYLDS-K(Гексадеканоїл-ізоGlu)Сполука 20 0,057 AAHDFVEWLLSA-OH H-H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-ізоGlu)Сполука 21 0,077 AAHDFVEWLLSA-OH H-H-Aib-EGTFTSDYSKYLDS-K(Гексадеканоїл-ізоGlu)Сполука 22 0,014 AAHDFVEWLLSA-NH2 H-H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл)Сполука 23 0,140 AAHDFVEWLLSA-NH2 H-H-Aib-QGTFTSDYSKYLDS-K([2-Бутилоктаноїл]-ізоGlu)Сполука 24 0,161 AAHDFVEWLLSA-NH2 H-H-Aib-QGTFTSDYSKYLDS-K(Октадеканоїл-ізоGlu)Сполука 25 0,069 AAHDFVEWLLSA-NH2 H-H-Aib-QGTFTSDYSKYLDS-K(Додеканоїл-ізоGlu)Сполука 26 0,097 AAHDFVEWLLSA-NH2 H-H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-[4Сполука 27 0,152 Амінобутаноїл])-AAHDFVEWLLSA-NH2 H-H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-E)Сполука 28 0,149 AAHDFVEWLLSA-NH2 H-H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-[8Сполука 29 0,199 Амінооктаноїл])-AAHDFVEWLLSA-NH2 H-H-Aib-QGTFTSDYSKYLDS-K(ГексадеканоїлізоLys)Сполука 30 0,132 AAHDFVEWLLSA-NH2 H-H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-[3Сполука 31 0,103 Амінопропаноїл])-AAHDFVEWLLSA-NH2 H-H-Aib-QGTFTSDYSKYLDS-Orn(Гексадеканоїл-ізоGlu)Сполука 32 0,195 AAHDFVEWLLSA-NH2 H-H-Aib-QGTFTSDYS-K(Гексадеканоїл-ізоGlu)Сполука 33 0,131 YLDSKAAHDFVEWLLSA-NH2 H-H-Aib-QGTFTSDYSKYLD-K(Гексадеканоїл-ізоGlu)Сполука 34 0,109 KAAHDFVEWLLSA-NH2 H-H-Aib-QGTFTSDYSKYLDSKAA-K(Гексадеканоїл-ізоGlu)Сполуа 35 0,202 DFVEWLLSA-NH2 H-H-Aib-QGTFTSDYSKYLDSKAAHDFV-K(ГексадеканоїлСполука 36 0,191 ізоGlu)-WLLSA-NH2 H-H-Aib-QGTFTSDYSKYLDSKAAHDFVEWLLСполука 37 0,207 K(Гексадеканоїл-ізоGlu)-A-NH2 H-H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-ізоLys)Сполука 38 0,132 AARDFVAWLLRA-NH2 H-H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-ізоGlu)Сполука 39 0,16 AAKDFVEWLLSA-NH2 H-H-Aib-QGTFTSDYSKYLDE-K(Гексадеканоїл-ізоGlu)Сполука 40 0,20 AAHDFVEWLLSA-NH2 H-H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-ізоGlu)Сполука 41 0,13 AAHEFVEWLLSA-NH2 H-H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-ізоGlu)Сполука 42 0,03 AAEDFVEWLLSA-NH2 H-H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-ізоGlu)Сполука 43 0,082 AAHDFVEWLLEA-NH2 26 EC50 (нМ) Glu 0,091 0,483 13,266 0,150 26,370 0,124 0,133 0,103 0,116 0,147 0,108 0,123 0,110 0,151 0,193 0,389 0,053 0,180 0,213 0,147 0,183 0,24 0,18 0,08 0,27 0,12 UA 104766 C2 5 У випадку сполуки 28 H-H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл-E)- AAHDFVEWLLSANH2 також може бути записано як H-H-Aib-QGTFTSDYSKYLDS-K(Гексадеканоїл -αGlu)AAHDFVEWLLSA-NH2 Приклад 3: Дослідження фармакокінетики: Визначили фармакокінетичні профілі різних ацильованих сполук. Обчислені значення T 1/2 представлені в Таблиці 2 у порівнянні з неацильованою Сполукою 1. Сполука 1 2 5 4 6 7 9 11 12 13 10 15 20 25 30 35 40 45 Т ½ година 0,23 5,8 5,3 2,0 4,8 3,4 2,4* 4,9 6,0 6,4 *: Тільки дві часові точки використовували для обчислення T½. Усі ацильовані сполуки мали покращений T½ у порівнянні зі сполукою 1. Приклад фармакокінетичного профілю для сполуки 13 представлений на Фігурі 1. Приклад 4: Тест на переносимість пероральної глюкози на мишах DIO Досліджували вплив s.c. введення протягом 21 дня сполуки 11 (10 нмоль/кг) на переносимість пероральної глюкози на мишах лінії C57BL/6J, яких протягом тривалого періоду часу утримували на високожировій дієті. Мишей, яких утримували на високожировій дієті, піддавали голодуванню й забирали первинні зразки крові для визначення рівня глюкози в крові натщесерце (t=0). Потім перорально вводили глюкозу (1 г/кг з розрахунку 5 мл/кг) і визначали рівень глюкози в крові через t=30 хв, t=60 хв і t=120 хв. Сполука 11 істотно підвищувала переносимість глюкози (двохфакторний дисперсійний аналіз). Дані представлені у вигляді середнє ± СПС (стандартна помилка середнього). Приклад 5: HbА1c у мишей db/db через 28 днів Мишам, хворим на діабет (db/db), вводили носій або сполуку 7 протягом 4 тижнів і визначали рівень HbА1c (Cobas® примітки з застосування: A1C-2) у зразках цільної крові (20 мкл), отриманих від оброблених мишей. Результати представлені на Фігурі 3. Значення ∆HbА1c (%) визначали для кожної миші, віднімаючи від HbА1c (%) через 4 тижні HbА1c (%) у початковий момент часу. Обробка сполукою 7 істотно знижувала ∆HbА1c (%) (P=0,03; Т-критерій Стьюдента) у порівнянні з носієм. Приклад 6: Знижена маса тіла Визначали вплив s.c. введення сполуки 11 протягом 21 дня на масу тіла у відділеному періоді на мишах лінії C57Bl/6J, яких протягом тривалого періоду часу утримували на високожировій дієті. Самцям мишей C57Bl/6J, яких утримували на високожировій дієті (HFD), уводили (b.i.d.; s.c.) сполуку 11 (10 нмоль/кг) або носій. Щодня записували масу тіла і враховували її при введенні дози пептиду, підібраної в залежності від маси тіла протягом дослідження. Дані представлені у вигляді середнє ± СПС на Фігурі 4. Сполука 11 помітно знижувала масу тіла (p < 0,05). Приклад 7: Загальний холестерин і співвідношення HDL/LDL Мишам моделі ожиріння, викликаного харчуванням (DIO), уводили носій або сполуку 7 протягом 4 тижнів і одержували плазму з забраних зразків крові. У кожному зразку плазми визначали загальний холестерин, LDL і HDL (Cobas® примітки з застосування: CHOL2, HDLC3 і LDL_C). Результати представлені на фігурах 5 і 6. Обробка сполукою 7 істотно (P < 0,0001, Ткритерій Стьюдента) знижувала концентрації загального холестерину (на Фігурі 5) і істотно (P < 0,0001, Т-критерій Стьюдента) збільшувала співвідношення HDL/LDL (на Фігурі 6). Приклад 8: Збільшення маси тіла у мишей лінії C57BL/6J, яких утримували на високожировій дієті. Досліджували вплив s.c. введення протягом 10 днів ексендину-4, сполуки 8, сполуки 3, сполуки 7, сполуки 11, сполуки 12 і сполуки 6 на мишей лінії C57BL/6J, яких утримували протягом короткого періоду часу на високожировій дієті. Самцям мишей C57Bl/6J, яких утримували на висококалорійній дієті (HFD), вводили пептид (b.i.d.; s.c.) (0,5 і 5 нмоль/кг) або 27 UA 104766 C2 5 10 15 20 25 30 35 40 45 50 носій. Щодня записували масу тіла і враховували її при введенні дози пептиду, підібраної в залежності від маси тіла. Дані представлені на Фігурі 7 у вигляді середнє ± СПС. Контрольний пептид (ексендин-4) так само, як сполука 8, призводив до істотного зниження збільшення маси тіла в обох дозах (0,5 і 5 нмоль/кг). Сполука 3, сполука 7, сполука 11 і сполука 12 істотно знижували збільшення маси тіла у великій дозі (5 нмоль/кг), але не в малій дозі (0,5 нмоль/кг) (Фігура 7). Сполука 6 істотно знижувала збільшення маси тіла тільки в невеликій дозі (0,5 нмоль/кг). Приклад 9: Переносимість пероральної глюкози через 2, 4, 6, 8, 10 і 12 годин після введення дози на мишах лінії C57BL/6J, яких утримували на високожировій дієті. Після голодування протягом 4 годин на тваринах проводили тест на переносимість пероральної глюкози (OGTT). Через 2, 4, 6, 8, 10 і 12 годин після введення дози сполуки 7 або носія забирали початковий зразок крові (t=-0 хв). Безпосередньо після цього вводили перорально дозу глюкози (1 г/кг). Рівень глюкози в крові визначали через t=15 хв, t=30 хв, t=60 хв і t=90 хв. Безпосередньо після забору зразка крові тварин умертвлювали під дією анестезії CO2 методом цервікальної дислокації. Дослідження показало, що підшкірне введення сполуки 7 (10 нмоль/кг) істотно покращує переносимість глюкози (за результатами зниженого AUC під час тесту на переносимість пероральної глюкози) через 2, 4, 6, 8, 10 і 12 годин після введення дози мишам лінії C57BL/6J, яких утримували на висококалорійній дієті. Приклад 10: Споживання їжі молодими худими мишами лінії С57BL/6J і старими мишами з ожирінням лінії С57BL/6J. Мишей C57BL/6J утримували на високожировій дієті протягом 11 днів, і мишей C57BL/6J утримували на високожировій дієті протягом 52 тижнів. У день проведення експерименту мишей зважували і вводили s.c. у вигляді ін'єкцій ексендрин-4, сполука 7 або носій у момент часу t=0 годин (8:00) і t=12 годин (20:00). Безпосередньо після введення (t=0) мишам вводили зважену кількість їжі й визначали загальне споживання їжі за допомогою зважування залишків їжі через t=1, 2, 4, 8, 12 і 24 години. У молодих худих мишей сполука 7 статистично значимо (p < 0,05) знижувала споживання їжі протягом періодів часу 0-4, 0-8, 0-12 і 0-24. Ексендин-4 статистично значимо (p < 0,05) знижував споживання їжі протягом періодів часу 0-2, 0-4, 0-8, 0-12 і 0-24. У старих мишей з ожирінням сполука 7 статистично значимо (p < 0,05) знижувала споживання їжі протягом періодів часу 0-2, 0-4, 0-8, 0-12 і 0-24. Ексендин-4 статистично значимо (p < 0,05) знижував споживання їжі протягом усіх періодів часу. Приклад 11: Вплив підшкірного введення агоніста GluGLP-1 сполуки 11 протягом 3 тижнів на рівень ліпідів у мишей, яких утримували на високожировій дієті протягом 30 тижнів. Досліджували вплив (s.c.) введення протягом 3 тижнів на рівень ліпідів у мишей, яких попередньо за 30 тижнів утримували на високожировій дієті протягом 30 тижнів, носія (PBS), ексендину-4 (10 нмоль/кг) або сполуки 11 (10 нмоль/кг) два рази на добу (Фігура 11). Про вплив судили за рівнем LDL, HDL і тригліцеридів (CHO: загальний холестерин; HDL: холестерин високої щільності; LDL: холестерин низької щільності; TRIG: тригліцериди; HDL/LDL: співвідношення HDL і LDL). Сполука 11 істотно знижувала рівень холестерину, HDL, LDL (P < 0,001) і тригліцеридів (P < 0,05), при цьому співвідношення HDL/LDL істотно підвищувалося (p глюкагон > сполука 11 > оксинтомодулін >>> ексендин-4 і ліраглютид (Таблиця 9). У остаточному підсумку, при високих концентраціях сполука не викликала зменшення числа рецепторів і зниження відповіді цАМФ, на відміну від результатів, отриманих на клітинах HEK293, які несуть Glu. 55 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAcylated glucagon analogues
Автори англійськоюRiber, Ditte, Meier, Eddi, Daugaard, Jens, Rosengren, Skovgaard, Marie, Tolborg, Jakob, Lind, Kampen, Gita, Baek, Camilla, Aerteberg
Автори російськоюРибер Дитте, Мейер Эдди, Даугаард Йенс Росенгрен, Сковгаард Мари, Толборг Якоб Линд, Кампен Гита, Бэк Камилла Эртеберг
МПК / Мітки
МПК: C07K 14/605, A61K 38/26, A61P 5/48
Мітки: аналоги, ацильовані, глюкагону
Код посилання
<a href="https://ua.patents.su/125-104766-acilovani-analogi-glyukagonu.html" target="_blank" rel="follow" title="База патентів України">Ацильовані аналоги глюкагону</a>
Попередній патент: Спосіб вимірювання швидкості направленого потоку рідини або газу
Наступний патент: Контейнер з піднімальним елементом
Випадковий патент: Спосіб змащування контактуючих поверхонь важконавантажених вузлів тертя