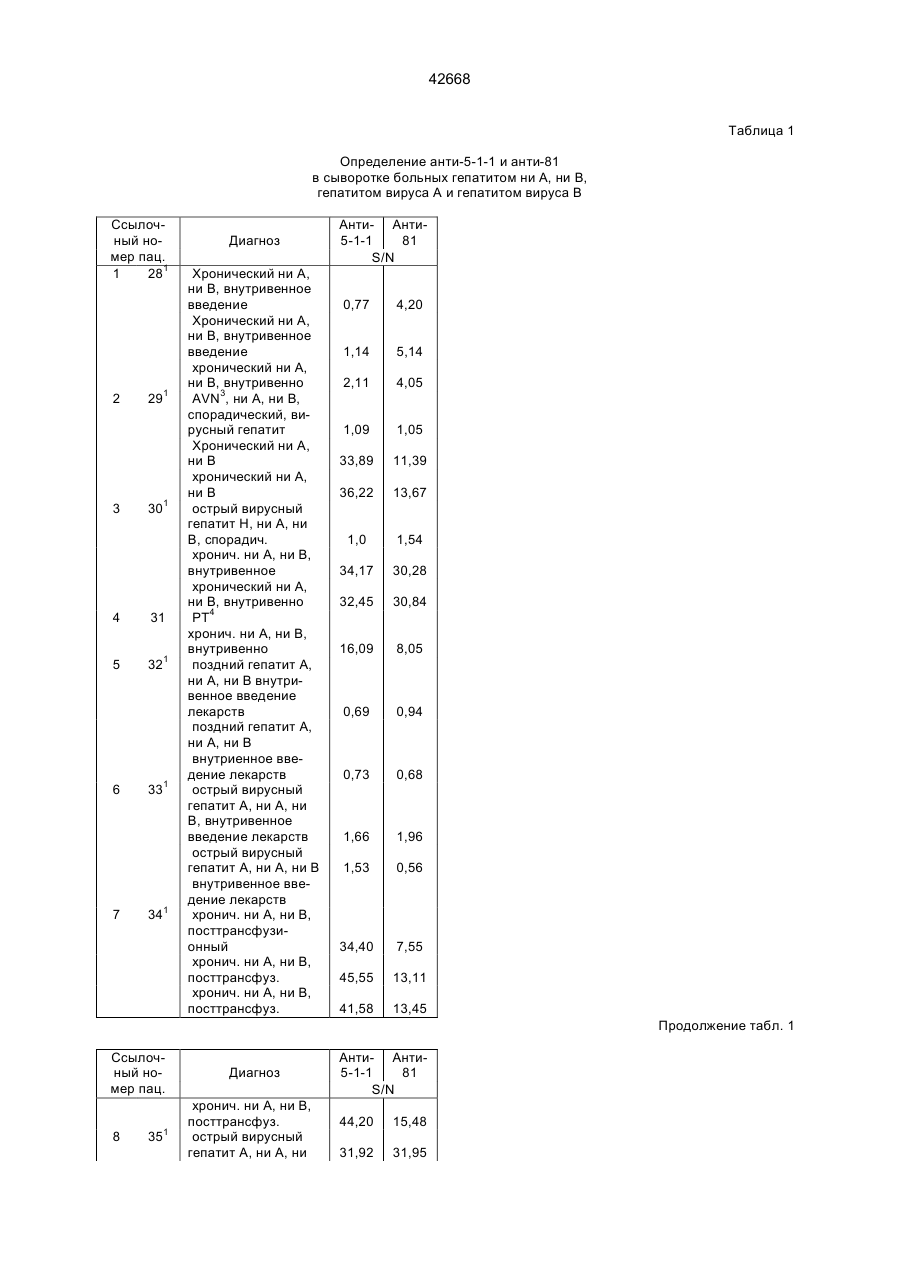
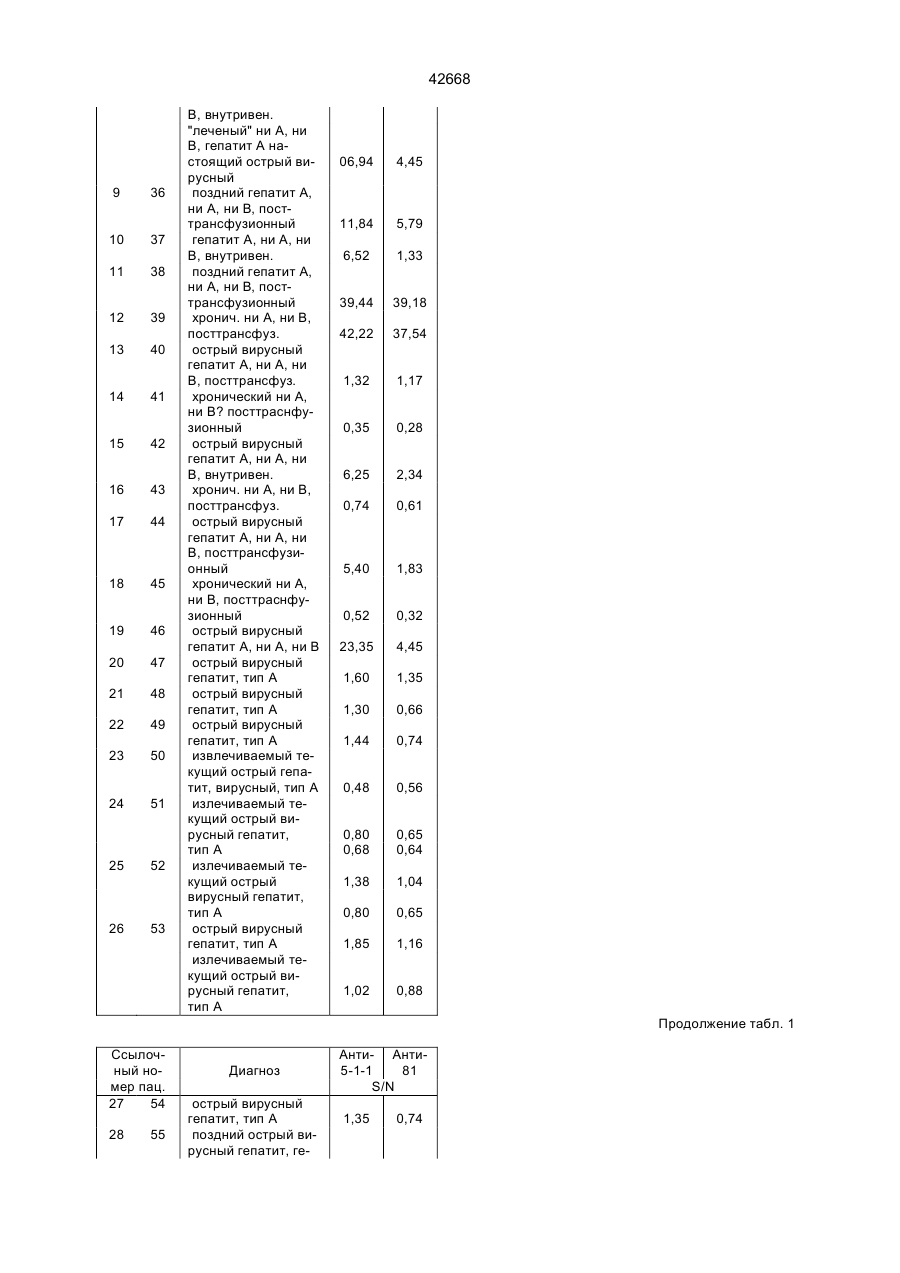
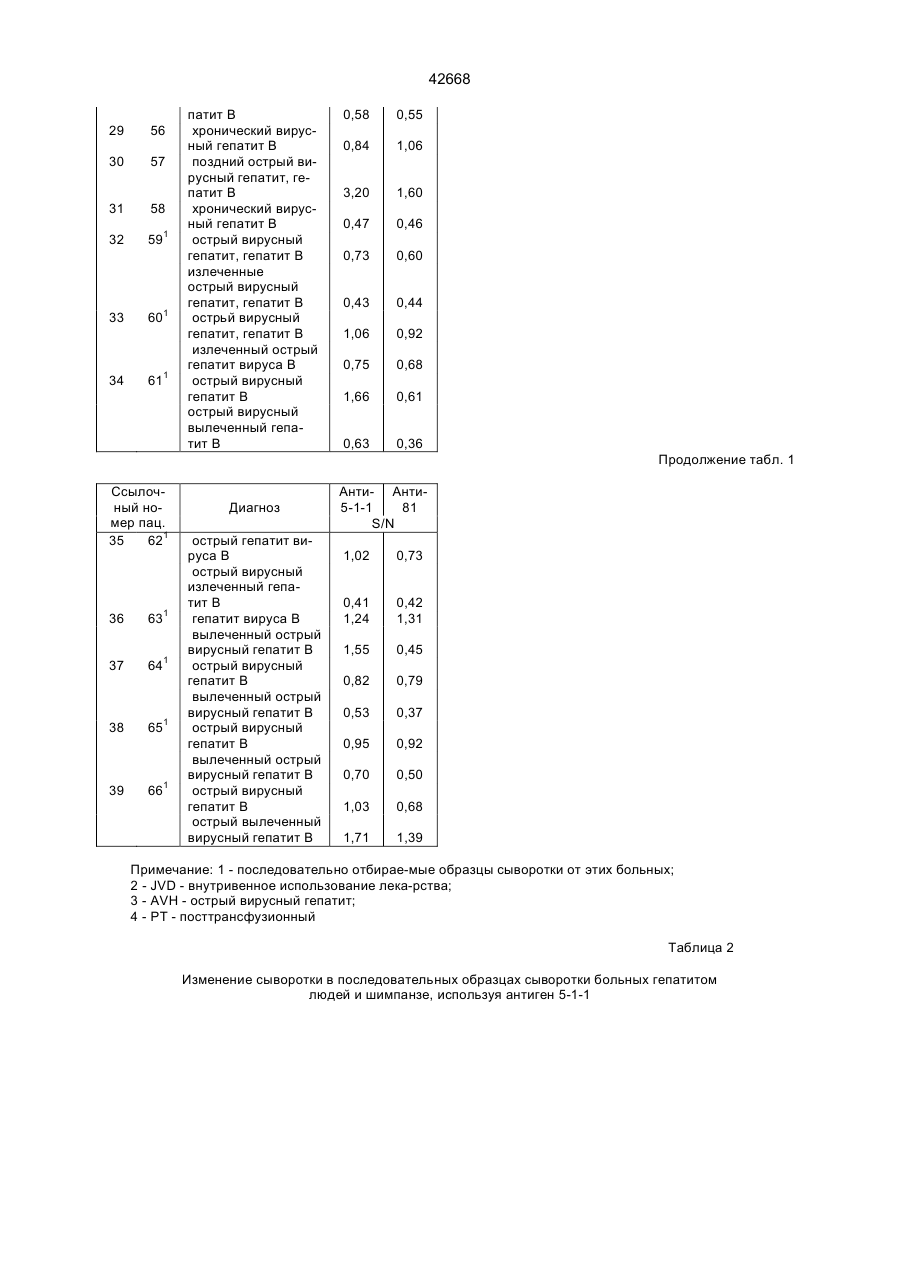
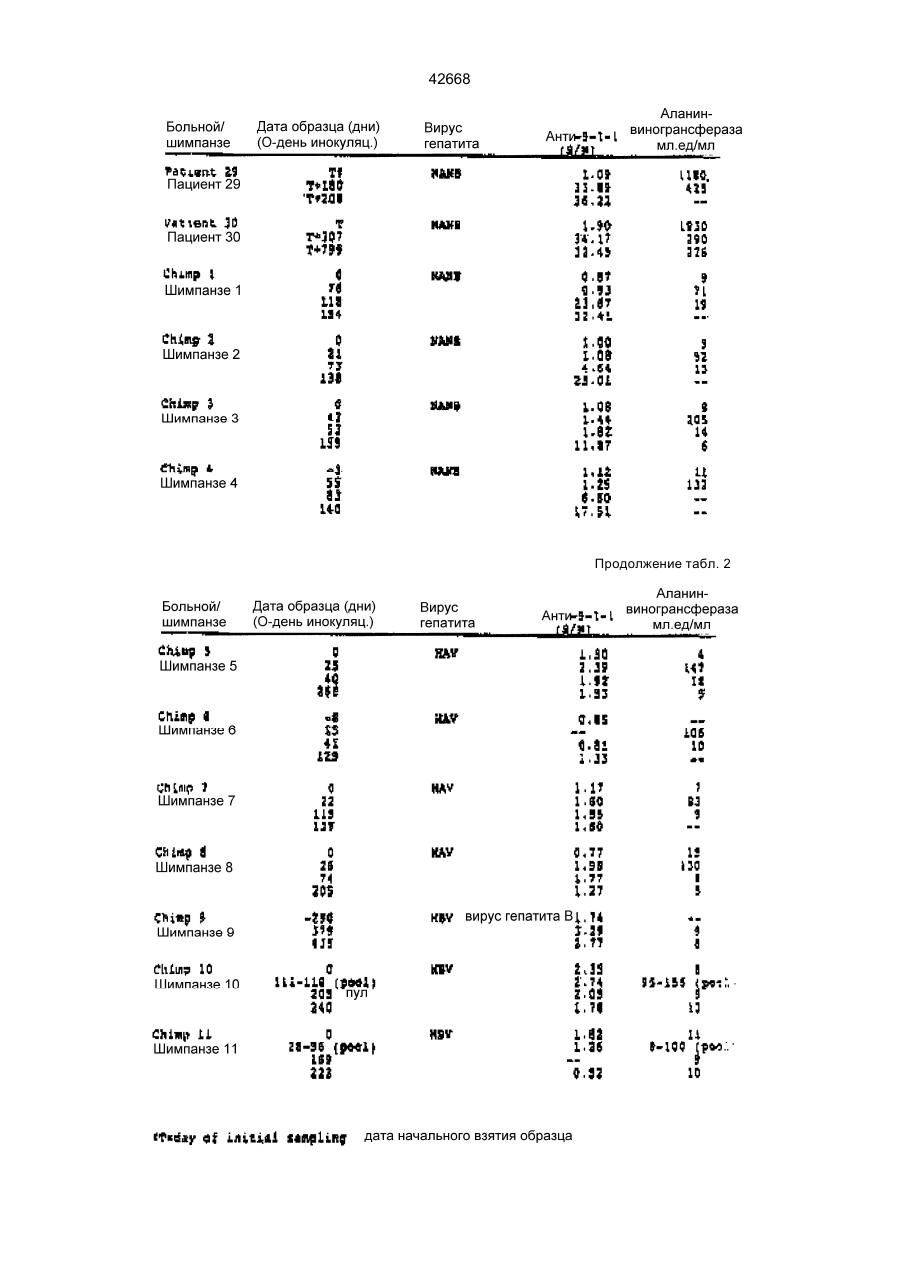
Поліпептид, що має антигенні властивості вірусу гепатиту с (hcv) (варіанти), діагностичний реагент для виявлення антитіл до вірусу гепатиту с (варіанти), набір для виявлення антитіл до вірусу гепатиту с (варіа
Формула / Реферат
1. Полипептид, который обладает антигенными свойствами вируса гепатита С (HCV), содержащий следующую аминокислотную последовательность:
или фрагмент указанной аминокислотной последовательности полипептида, причем указанный фрагмент содержит, по меньшей мере, 10 последовательно расположенных аминокислотных остатков.
2. Полипептид по п.1, отличающийся тем, что аминокислотная последовательность HCV является слитой с последовательностью слияния, причем указанная последовательность слияния представляет собой последовательность бета-галактозидазы или супероксиддисмутазы.
3. Полипептид по п.2, отличающийся тем, что он содержит аминокислотную последовательность, состоящую из 363 аминокислотных остатков
связанную с последовательностью супероксид-дисмутазы.
4. Полипептид, обладающий антигенными свойствами HCV и содержащий следующую аминокислотную последовательность:
или фрагмент указанной аминокислотной последовательности, причем указанный фрагмент содержит по меньшей мере 10 последовательно расположенных аминокислотных остатков.
5. Полипептид по п.4, отличающийся тем, что аминокислотная последовательность HCV является слитой с последовательностью слияния, причем указанная последовательность слияния представляет собой последовательность бета-галактозидазы или супероксиддисмутазы.
6. Полипептид, обладающий антигенными свойствами HCV и содержащий следующую аминокислотную последовательность:
или фрагмент указанной аминокислотной последовательности, причем указанный фрагмент содержит по меньшей мере 10 последовательно расположенных аминокислотных остатков.
7. Полипептид по п.6, отличающийся тем, что аминокислотная последовательность HCV явля-ется слитой с последовательностью слияния, причем указанная последовательность слияния представляет собой последовательность бета-галактозидазы или супероксиддисмутазы.
8. Диагностический реагент для выявления антител к вирусу гепатита С с помощью иммунологического анализа, содержащий полипептид или его фрагмент по п.1.
9. Диагностический реагент по п.8, отличающийся тем, что полипептид или его фрагмент соединен с твердым носителем.
10. Диагностический реагент для выявления антител к вирусу гепатита С с помощью иммунологического анализа, содержащий полипептид или его фрагмент по п.4.
11. Диагностический реагент по п.10, отличающийся тем, что полипептид или его фрагмент соединен с твердым носителем.
12. Диагностический реагент для выявления антител к вирусу гепатита С с помощью иммунологического анализа, содержащий полипептид или его фрагмент по п.6.
13. Набор для выявления антител к вирусу гепатита С путем иммунологического анализа, отличающийся тем, что он содержит диагностический реагент по п.8.
14. Набор для выявления антител к вирусу гепатита С путем иммунологического анализа, отличающийся тем, что он содержит диагностический реагент по п.10.
15. Набор для выявления антител к вирусу гепатита С путем иммунологического анализа, отличающийся тем, что он содержит диагностический реагент по п.12.
16. Способ выявления антител к вирусу гепатита С путем иммунологического анализа, предусматривающий инкубирование диагностической системы с биологическим образцом, предположительно содержащим антитела к вирусу гепатита С, в условиях, обеспечивающих образование комплекса антиген-антитело, и последующее обнаружение данного комплекса, отличающийся тем, что в качестве диагностической системы используют реагент по п.8.
17. Способ выявления антител к вирусу гепатита С путем иммунологического анализа, предусматривающий инкубирование диагностической системы с биологическим образцом, предположительно содержащим антитела к вирусу гепатита С, в условиях, обеспечивающих образование комплекса антиген-антитело, и последующее обнаружение данного комплекса, отличающийся тем, что в качестве диагностической системы используют реагент по п.10.
18. Способ выявления антител к вирусу гепатита С путем иммунологического анализа, предусматривающий инкубирование диагностической системы с биологическим образцом, предположительно содержащим антитела к вирусу гепатита С, в условиях, обеспечивающих образование комплекса антиген-антитело, и последующее обнаружение данного комплекса, отличающийся тем, что в качестве диагностической системы используют реагент по п.12.
19. Способ выявления антител к вирусу гепатита С путем иммунологического анализа, предусматривающий инкубирование диагностической системы с биологическим образцом, предположительно содержащим антитела к вирусу гепатита С, в условиях, обеспечивающих образование комплекса антиген-антитело, и последующее обнаружение данного комплекса, отличающийся тем, что в качестве диагностической системы используют набор по п.13.
20. Способ выявления антител к вирусу гепатита С путем иммунологического анализа, предусматривающий инкубирование диагностической системы с биологическим образцом, предположительно содержащим антитела к вирусу гепатита С, в условиях, обеспечивающих образование комплекса антиген-антитело, и последующее обнаружение данного комплекса, отличающийся тем, что в качестве диагностической системы используют набор по п.14.
21. Способ выявления антител к вирусу гепатита С путем иммунологического анализа, предусматривающий инкубирование диагностической системы с биологическим образцом, предположительно содержащим антитела к вирусу гепатита С, в условиях, обеспечивающих образование комплекса антиген-антитело, и последующее обнаружение данного комплекса, отличающийся тем, что в качестве диагностической системы используют набор по п.15.
Текст
42668 Это изобретение касается материалов и ме-тодов определения распространения инфекции вируса гепатита ни А, ни Б. Более конкретно оно касается диагностических фрагментов дезоксири-бонуклеиновой кислоты (ДНК), диагностических белков, диагностических антител и защитных ан-тигенов и антител для этиологического агента ге-патита вируса ни А, ни В, т.е. гепатита вируса С. Библиографические ссылки в описании к па-тенту Barr et al. (1986), Biotechniques, 4:428. Botstein (1979), Gene, 8:17. Brinton, M.A. (1986) in THE VIRUSES: THE TOGAVIRIDAE AND FLAVIVIRIDAE (Series eds. FraenkelConrat and Wagner, vol. eds. Schlesinger and Schlesinger, Plenum Press), p. 327-374. Broach (1981) in: Molecular Biology of the Yeast Saccharomyces, Vol. 1, p. 445, Cold Spring Harbor Press. Broach et al. (1983), Meth. Enz. 101:307. Chang et al. (1977), Nature 198:1056. Chirgwin et al. (1979), Biochemistry 18: 5294. Chomczynski and Sacchi (1987), Analytical Bio-chemistry 162:156. Clewell et al. (1969), Proc. Natl. Acad. Sci. USA 62:1159. Clewell (1972), J. Bacteriol. 110:667. Cohen (1972), Proc. Natl. Acad. Sci. USA 69:2110. Cousens et al. (1987), gene 61:265. De Boer et al. (1983), Proc. Natl. Acad. Sci. USA 292:128. Dreesman et al. (1985), J. Infect. Disease 151:761. Feinstone S.M. and Hoofnagle, J.H. (1984), New Engl. J. Med. 311:185. Fields & Knipe (1986), FUNDAMENTAL VI-ROLOGY (Raven Press, N.Y.). Fiers et al. (1978), Nature 273:113. Gerety, R.J. et al., in VIRAL HEPATITIS AND LIVER DISEASE (Vyas, B.N., Dienstag, J.L., and Hoofnagle, J.H., eds, Grune and Stratton, Inc., 1984) pp. 23-47. Goeddel et al. (1980), Nucleic Acids Res. 8:4057. Graham and Van der Eb (1978), Virology 52:546. Grunstein and Hogness (1975), Proc. Natl. Acad. Sci. USA 73:3961. Grych et al. (1985), Nature 316:74. Gubler and Hoffman (1983), Gene 25:263. Hammerling et al. (1981), MONOCLONAL ANTIBODIES AND T-CELL HYBRIDOMAS. Hess et al. (1968), J. Adv. Enzyme Reg 7:149. Hinnen et al. (1978), Proc. Natl. Acad. Sci. 75:1929. Hitzeman et al. (1980), J. Biol. Chem. 255:2073. Holland et al. (1978), Biochemistry 17:4900. Holland (1981), J. Biol. Chem. 256:1385. Houghton et al. (1981), Nucleic Acids Reg. 9:247. Hunyh, T.V. et al. (1985) in DNA CLONING TECHNIQUES; A PRACTICAL APPROACH (D. Glover, Ed., IRL Press, Oxford, U.K.) pp. 49-78. Immun. Rev. (1982) 62:185. Iwarson (1987), British Medical J. 295:946. Kennett et al. (1980) MONOCLONAL ANTI-BODIES. Laemmli (1970), Nature 227, 680. Lee et al. (1988), Science 239:1288. Maniatis, Т., et al. (1982) MOLECULAR CLONING; A LABORATORY MANUAL (Cold Spring Harbor Press, Cold Spring Harbor, N.Y.). Mayer and Walker, eds. (1987), IMMUNO-CHEMICAL METHODS IN CELL AND MOLECULAR BIOLOGY (Academic Press, London). Maxam et al. (1980), Methods in Enzymology 65:499. MacNamara et al. (1984), Science 226:1325. Messing et al. (1981), Nucleic Acids Res. 9:309. Messing (1983), Methods in Enzymology 101:20-37. METHODS IN ENZYMOLOGY (Academic Press). Michelle et al., Int. Symposium on Viral Hepatitis. Monath (1986) in THE VIRUSES: THE TOGA-VIRADAE AND FLAVIVIRIDAE (Series eds. Fraenkel-Conrat and Wagner, vol. eds. Schlesinger and Schlesinger, Plenum Press), p. 375-440. Nagahuma et al. (1984), Anal. Biochem. 141:74. Neurath et al. (1984), Science 224:392. Nisonoff et al. (1981), Clin. Immunol. Immu-nopathol. 21:397-406. Overby, L.R. (1985), Curr. Hepatol. 5:49. Overby, L.R. (1986), Curr. Hepatol. 6:65. Overby, L.R. (1987), Curr. Hepatol. 7:35. Peleg (1969), Nature 221:193. Pfefferkorn and Shapiro (1974), in COMPRE-HENSIVE VIROLOGY, vol. 2 (Fraenkel-Conrat & Wagner, eds., Plenum, N.Y.) pp. 171-230. Prince, A.M. (1983), Annu. Rev. Microbiol. 37:217. 42668 Rice et al. (1986) in THE VIRUSES: THE TOGAVIRIDAE AND FLAVIVIRIDAE (Series eds. Fraenkel-Conrat and Wagner, vol. eds. Schlesinger and Schlesinger, Plenum Press), p. 279-328. Roehrig (1986) in THE VIRUSES: THE TOGA-VIRIDAE AND FLAVIVIRIDAE (Series eds. Fraenkel-Conrat and Wagner, vol. eds. Schlesinger and Schlesinger, Plenum Press). Sadler et al. (1980), Gene 8, 279. Saiki et al. (1986), Nature 324:163. Sanger et al. (1977), Proc. Natl. Acad. Sci. USA 74:5463. Schlesinger et al. (1986), J. Virol. 60:1153. Schreier, M., et al. (1980) HYBRIDOMA TECHNIQUES. Scopes (1984), PROTEIN PURIFICATION, PRINCIPLES AND PRACTICE, SECOND EDITION (SpringerVerlag, N.Y.). Shimatake et al. (1981), Nature 292:128. Steimer et al. (1986), J. Virol. 58:9. Stollar (1980), in THE TOGAVIRUSES (R.W. Schlesinger, ed., Academic Press, N.Y.), pp. 584-622. Taylor et al. (1976), Biochem. Biophys. Acta 442:324. Towbin et al. (1979), Proc. Natl. Acad. Sci. USA 76, 4350. Tsu and Herzenberg (1980), in SELECTED ME-THODS IN CELLULAR IMMUNOLOGY (W.H. Free-man and Co.) pp. 373-391. Vytdehaag et. al. (1985), J. Immunol. 134:1225. Valenzuela, P., et al. (1982), Nature 298:344. Valenzuela, P., et al. (1984), in HEPATITIS В (Millman, I., et al., ed, Plenum Press) pp. 225-236. Warner (1984), DNA 3:401. Wu and Grossman (1987), Methods in Enzy-mology, vol. 154, RECOMBINANT DNA, Part E. Wu (1987), Methods in Ezymology, vol. 155, RECOMBINANT DHA, part F. Zoller (1982), Nucleic Acids Res. 10:6487. Ссылки на патенты Патенты США № 4341761, 4399121, 4427783, 4444887, 4466917, 4472500, 4491632 и 4495890. Гепатит ни А, ни В является передающейся болезнью из семейства заболеваний, индуциро-ванных, по-видимому, вирусом, и которые отли-чаются от других форм обусловленных вирусом болезней печени, включая и те заболевания, ко-торые вызваны известными вирусами гепатита, т.е. вирусом гепатита А, вирусом гепатита В и ви-русом дельта-гепатита, а также от гепатитов, вы-званных цитомегаловирусом или вирусом Эп-штейна-Барра. Гепатит ни А, ни В был впервые идентифицирован у посттрансфузионных больных. Передача от человека шимпанзе и серия пе-репрививок у шимпанзе свидетельствуют о том, что гепатит ни А, ни В обусловлен переносимым инфекционным агентом или агентами. Однако пе-реносимый возбудитель, ответственный за гепа-тит ни А, ни В, до настоящего времени не иденти-фицирован, и ряд агентов, которые является при-чиной болезни, неизвестны. Эпидемиологические данные наводят на мысль, что может быть три типа гепатита ни А, ни В, эпидемический тип, связанный с водой; эпиде-мический тип, переносимый с кровью или иглой, и спорадически появляющийся (коммунально при-обретенный) тип гепатита. Однако, ряд возбуди-телей, которые могут вызывать гепатит ни А, ни В, неизвестен. Клинический диагноз и идентификация гепа-тита ни А, ни В прежде всего осуществлялись пу-тем исключения других вирусных маркеров. Среди методов, используемых для определения предпо-лагаемых антигеном и антител гепатита ни А, ни В, агар-гелевая диффузия, радиоиммуноэлектро-форез, иммунофлюоресцентная микроскопия, им-муно-электронная микроскопия, радиоиммуноло-гические тесты, ферментосвязанный иммуносорб-ционный тест. Однако, ни один из этих методов анализа не показал достаточной чувствительно-сти, специфичности и воспроизводимости, чтобы быть использованным в качестве диагностическо-го теста на гепатит ни А, ни В. До настоящего времени не существует ни яс-ности, ни согласия относительно идентичности и специфичности систем антиген-антитело, связан-ных с возбудителями гепатита ни А, ни В. Это обусловлено, по меньшой мере частично, первич-ной или сопутствующей инфекцией вируса гепати-та В с вирусом гепатита ни А, ни В у больных и из-вестной сложностью растворимых и в виде частиц антигенов, связанных с вирусом гепатита В, а так-же интеграцией ДНК вируса гепатита В в геном пе-ченочных клеток. В дополнение не исключена воз-можность, что гепатит ни А, ни В вызывается не одним инфекционным агентом, а также возмож-ность того, что гепатит ни А, и В диагностирован ошибочно. Кроме того неясно, что определяют се-рологические анализы в сыворотке больных гепа-титом ни А, ни В. Было принято без доказательст-ва, что агар-гелевая диффузия и радиоиммуно-электрофоретические анализы определяют ауто-иммунные реакции или взаимодействия неспеци-фических белков, которые иногда происходят ме-жду пробами сыворотки, и что они не представля-ют собой специфических реакций антиген-анти-тело. Иммунофлюоресценция, ферментосвязан-ный иммуносорбент и радиоиммунологический анализы, повидимому, определяют низкие уровни материала, аналогичного ревматоидному факто-ру, который часто присутствует в сыворотке боль-ных гепатитом ни А, ни В, а равно как и у больных с другими заболеваниями печени и непеченочны-ми болезнями. Некоторую иммунологическую ре-активность, определенную анализами, может представлять антитело к определенным хозяином цитоплазменным антигенам. Имеется несколько кандидатов на вирус гепа-тита ни А, ни В. См., например, обзоры Prince (1983 г.), Feinstone и Hoofnagle (1984 г.), и Overby (1985, 1986 и 1987 гг.) и статью Iwarson (1987 г.). Но нет 42668 доказательств, что какой-либо из этих кан-дидатов представляет собой этиологический агент гепатита ни А, ни В. Потребность в чувствительных, специфиче-ских методах выявления и идентификации носи-телей вируса гепатита ни А, ни В и зараженной вирусом ни А, ни В крови и продуктов крови, весь-ма значительная. Посттрансфузионные гепатиты появляются примерно в 10% случаев больных с переливанием крови и до 90% из этих случаев на-считывается больных гепатитом ни А, ни В. Ос-новной проблемой при этом заболевании яв-ляется частое развитие хронического поражения печени. Лечение больного, а также профилактика пе-редачи гепатита ни А, ни В с кровью или продук-тами крови или при тесном контакте с больными требуют надежных диагностических и прогности-ческих средств для определения нуклеиновых ки-слот, антигенов и антител, связанных с вирусом гепатита ни А, и В. В дополнение имеется необхо-димость также в эффективных вакцинах и имму-нотерапевтических лечебных средствах для про-филактики и/или лечения этой болезни. Изобретение касается выделения и опреде-лению характеристик недавно открытого этиоло-гического агента гепатита ни А, ни В, вируса гепа-тита С. Более конкретно изобретение касается се-мейства реплик кольцевой ДНК частей генома ге-патита вируса С. Эти реплики кольцевой ДНК бы-ли выделены методом, который включает новую операцию отсеивания продуктов экспрессии их пу-лов кольцевой ДНК, созданных из частиц возбуди-теля (агента) в инфицированной ткани с сыворот-ками больных гепатитом ни А, ни В, для опреде-ления вновь синтезированных антигенов, произ-водных от генома до этого выделенного и неоха-рактеризованного вирусного агента, и селекцию клонов, которые вырабатывают продукты, иммунологически взаимодействующие только с сыво-ротками инфицированных индивидов в сравнении с неинфицированными лицами. Исследования природы генома вируса гепати-та С, используя пробы, полученные из кольцевой ДНК вируса гепатита С, а также последователь-ность информации, содержащейся в кольцевой ДНК вируса гепатита С, говорят о том, что вирус гепатита С является Флави-вирусом или Флави-подобным вирусом. Части последовательности оснований кольце-вой ДНК, производные от вируса гепатита С, по-лезны как пробы для определения присутствия ви-руса в образцах и для выделения встречающихся в природе вариантов вируса. Эти фрагменты коль-цевой ДНК позволяют также оценить полипептид-ные последовательности антигенов вируса гепа-тита С, закодированные в геноме (геномах) вируса гепатита С, и позволяют продуцирование поли-пептидов, которые полезны в качестве стандартов реагентов в диагностических тестах и/или в каче-стве компонентов вакцин. Антитела, как поликло-нальные, так моноклональные, направленные про-тив эпитопов вируса гепатита С, содержащихся в этих полипептидных последовательностях, также полезны для диагностических тестов, в качестве терапевтических средств, для отсеивания проти-вовирусных агентов и для изоляции (выделения) возбудителя вируса ни А, ни В, от которого полу-чены эти фрагменты кольцевой ДНК. В дополне-ние при использовании проб, полученных от этих частей кольцевой ДНК возможно выделить и оце-нить последовательность других частей генома вируса гепатита С, получая таким образом допол-нительные пробы и полипептиды, полезные для диагностики и/или лечения, как в профилактиче-ском, так и в лечебном воздействии на гепатит ни А, ни В. Следовательно в отношении к полинуклеоти-дам некоторыми целями изобретения являются: очищенные полинуклеотиды вируса гепатита С; рекомбинантные полинуклеотиды вируса гепатита С; рекомбинантный полинуклеотид, включающий последовательность, производную от генома ви-руса гепатита С или от кольцевой ДНК вируса ге-патита С; рекомбинантный полинуклеотид, коди-рующий эпитоп вируса гепатита С; рекомбинант-ный вектор, содержащий любой из упомянутых выше рекомбинантных полинуклеотидов и клетка-хозяин, видоизмененная любым из этих векторов. Другими аспектами изобретения являются: ре-комбинантная экспрессионная система, содержа-щая открыто читаемую структуру ДНК, получен-ную из генома вируса гепатита С или из кольцевой ДНК вируса гепатита С, в которых открыто читае-мая структура операбельно связана с контрольной последовательностью, совместимой с желаемым хозяином, и полипептид, продуцированный трансформированной клеткой. Следующими аспектами изобретения являют-ся: очищенный вирус гепатита С; приготовление полипептидов из очищенного вируса гепатита С; очищенный полипептид вируса гепатита С; очи-щенный полипептид, содержащий эпитоп, иммуно-логически идентифицируемый эпитопом, содер-жащимся в вирусе гепатита С. Включенными аспектами изобретения явля-ются: рекомбинантный полипептид вируса гепати-та С; рекомбинантный полипептид, содержащий последовательность, полученную от генома виру-са гепатита С или от кольцевой ДНК вируса гепа-тита С; рекомбинантный полипептид, содержащий эпитоп вируса гепатита С и конденсированный по-липептид, полипептид слияния, содержащий поли-пептид вируса гепатита С. Включенными в изобретение являются также моноклональное антитело, направленное против эпитопа вируса гепатита С и очищенной препарат поликлональных антител, направленных против эпитопа вируса гепатита С. Еще одним аспектом изобретения является частица, являющаяся иммуногенной против ин-фекции вируса гепатита С, содержащая полипеп-тид не вируса С гепатита, имеющий последова-тельность аминокислот, способную формировать частицу, если упомянутая последовательность продуцирована эукариотическим хозяином, и эпи-топ вируса гепатита C. Последующим аспектом изобретения являет-ся полинуклеотидная проба на вирус гепатита С. Аспекты изобретения, касающиеся комплектов диагностических средств, следующие: образцы для анализа на присутствие полинуклеотидов, производных от вируса гепатита С, включающие пробу, 42668 содержащую последовательность нуклео-тидов вируса гепатита С примерно 8 или более ну-клеотидов, в подходящей упаковке; образцы для анализа на присутствие антигена вируса гепатита С, содержащие антитело, направленное против антигена вируса С, подлежащего определению, в подходящей упаковке; образцы для анализа на присутствие антител, направленных против анти-гена вирусa гепатита С, включающие полипептид, содержащий эпитоп вируса гепатита С, присутст-вующий в антигене вируса гепатита С, в соответ-ствующей упаковке. Другими аспектами изобретения являются: по-липептид, содержащий эпитоп вируса гепатита С, фиксированный на твердом субстрате, и антитело к эпитопу вируса гепатита С, фиксированное на твердом субстрате. Следующими аспектами изобретения являют-ся: метод получения полипептида, содержащего эпитоп вируса гепатита С, включающий инкубиро-вание клеток хозяина, трансформированных экс-прессионным вектором, содержащим последова-тельность кодирования полипептида, содержаще-го эпитоп вируса гепатита С в условиях, допус-кающих экспрессию упомянутого полипептида, и полипептид, содержащий эпитоп, полученный этим методом. Изобретение включает также способ опреде-ления нуклеиновых кислот в образце, содержа-щем реагирующие нуклеиновые кислоты образца с пробой на полинуклеотид вируса гепатита С в условиях, позволяющих образование полипептид-ного дуплекса между пробой и нуклеиновой кисло-той вируса гепатита С образца, и определение полинуклеотидного дуплекса, который содержит проба. Иммунологические исследования также вклю-чены в объем изобретения. Они включают иммунологический анализ для определения антигена вируса гепатита С, включающий инкубирование образца, подозрительного на содержание антиге-на вируса гепатита С, с антителом пробы, направ-ленным против антигена вируса гепатита С, под-лежащего определению в условиях, позволяющих образование комплекса антиген-антитело; и опре-деление комплекса антиген-антитело, содержаще-го антитело пробы. Иммунологический анализ для определения антител, направленных против анти-гена вируса гепатита С, включающий инкубирова-ние образца, подозрительного на содержание ан-тител антивируса гепатита С, с полипептидом про-бы, которая содержит эпитоп вируca гепатита С, в условиях, допускающих образование системы ан-титело-антиген, и определение системы антитело-антиген, содержащий антиген пробы. В объем изобретения включены также вакци-ны для лечения инфекции вируса гепатита С; включающие иммуногенный пептид, эпитоп вируса гепатита С, или инактивированный препарат виру-са гепатита С, или аттенуированный препарат ви-руса гепатита С. Другим аспектом изобретения является куль-тура ткани растущих клеток, инфицированных ви-русом гепатита С. Еще иным аспектом изобретения является способ получения антител к вирусу гепатита С, включающий введение больному выделенный им-муногенный полипептид, содержащий эпитоп ви-руса гепатита С в количестве, достаточном для продуцирования имммунной реакции. И еще одним аспектом изобретения является способ выделения кольцевой ДНК, полученной из генома неидентифицированного инфекционного агента, включающий: (а) получение клеток хозяи-на, трансформированных векторами экспрессии, содержащимися в пуле кольцевой ДНК, приготов-ленном из нуклеиновых кислот, выделенных из ткани, инфицированной агентом, и выращивание клеток хозяина в условиях, допускающих экспрес-сию полипептида(ов), закодированных в кольце-вой ДНК; (b) взаимодействие продуктов экспрес-сии кольцевой ДНК с содержащим антитело ком-понентом тела больного, инфицированного упо-мянутым инфекционным возбудителем в услови-ях, позволяющих иммунную реакцию, и определе-ние комплексов антитело-антиген, образованных в результате взаимодействия; (с) выращивание кле-ток хозяина, осуществляющих экспрессию поли-пептидов, которые образуют комплексы антитело-антиген на операции (b) в условиях, допускающих их выращивание как индивидуальных клонов, и выделение упомянутых клонов; (d) выращивание клеток из клонов, полученных на операции (с) в условиях, допускающих экспрессию полипепти-да(ов), закодированных в кольцевой ДНК, и взаи-модействие продуктов экспрессии с содержащими антитело компонентами тела индивидов, отличных от больного на операции (а), которые инфи-цированы инфекционным агентом, и с контроль-ными лицами, не инфицированными агентом, и определение комплексов антитело-антиген, обра-зованных в результате взаимодействия; (е) выра-щивание клеток хозяина, которые осуществляют экспрессию полипептидов, которые образуют ком-плексы антитело-антиген с содержащими антите-лом компонентами тела инфицированных индиви-дов и лиц, подозрительных на инфекцию, но не с компонентами лиц в контрольной группе, в усло-виях, допускающих развитие как отдельных кло-нов и выделение упомянутых клонов; и (f) выде-ление кольцевой ДНК из клонов клеток хозяина, полученных на операции (е). На фиг. 1 показана двунитчатая последова-тельность нуклеотидов кольцевой ДНК вируса ге-патита С, вставленная в клон 5-1-1, и предпола-гаемая последовательность аминокислот поли-пептида, закодированного в ней. На фиг. 2 представлены гомологи перекрытия последовательностей кольцевой ДНК вируса гепа-тита С в клонах 5-1-1, 81, 1-2 и 91. На фиг. 3 показана сложная последователь-ность оснований кольцевой ДНК вируса гепатита С, полученная от перекрытия клонов 81, 1-2, и 91 и последовательность аминокислот, закодирован-ная в ней. На фиг. 4 показана последовательность дву-нитчатых нуклеотидов кольцевой ДНК вируса ге-патита С, вставленной в клон 81, и предполагае-мая последовательность аминокислот, закодиро-ванная в ней. На фиг. 5 представлена последовательность оснований кольцевой ДНК вируса гепатита С в клоне 36, сегмент которой перекрывает кольцевую ДНК вируса гепатита ни А, ни В в клоне 81, и последовательность полипептидов, закодированная в клоне 36. 42668 На фиг. 6 представлена объединенная от-крыто читаемая структура кольцевой ДНК вируса гепатита С в клонах 36 и 81, и полипептиды, за-кодированные в ней. На фиг. 7 показана последовательность осно-ваний кольцевой ДНК вируса гепатита С в кло-не 32, сегмент которой перекрывает клон 81, и за-кодированный в ней полипептид. На фиг. 8 представлена последовательность оснований кольцевой ДНК вируса гепатита С в клоне 35, сегмент которой перекрывает клон 36, и закодированный в ней полипептид. На фиг. 9 представлена объединенная откры-то читаемая структура кольцевой ДНК вируса ге-патита С в клонах 35, 36, 81 и 32 и закодиро-ванный в ней полипептид. На фиг. 10 показана последовательность ос-нований кольцевой ДНК вируса гепатита С в кло-не 37b, сегмент которой перекрывает клон 35, и закодированный в ней полипептид. На фиг. 11 представлена последовательность оснований кольцевой ДНК вируса гепатита В в клоне 33, сегмент которой перекрывает клон 32, и закодированный в ней полипептид. На фиг. 12 представлена последовательность оснований кольцевой ДНК вируса гепатита С в клоне 40b, сегмент которой перекрывает клон 37b, и закодированный в ней полипептид. На фиг. 13 представлена последовательность оснований кольцевой ДНК вируса гепатита С в клоне 25с, сегмент которой перекрывает клон 33b, и закодированный в ней полипептид. На фиг. 14 представлена последовательность нуклеотидов и закодированный в ней полипептид открыто читаемой структуры, которая простира-ется через кольцевую ДНК вируса гепатита С в клонах 40b, 37b, 35, 36, 81, 32, 33b и 25с. На фиг. 15 представлена последовательность оснований кольцевой ДНК вируса гепатита С в клонах 40b и 33с, и закодированные в ней амино-кислоты. На фиг. 16 представлена последовательность оснований (кольцевой) ДНК вируса гепатита С в клоне 8h, сегмент которой перекрывает клон 33с, и закодированные в ней аминокислоты. На фиг. 17 представлена последовательность оснований в кольцевой ДНК вируса гепатита С в клоне 7е, сегмент которой перекрывает клон 8h, и закодированные в ней аминокислоты. Hа фиг. 18 представлена последовательность оснований кольцевой ДНК вируса гепатита С, в клоне 14с, сегмент которой перекрывает клон 25с, и закодированные в ней аминокислоты. На фиг. 19 представлена последовательность оснований в кольцевой ДНК вируса гепатита С в клоне 8f, сегмент которой перекрывает клон 14с, и закодированные в ней аминокислоты. На фиг. 20 представлена последовательность оснований кольцевой ДНК вируса гепатита С в клоне 33g сегмент которой перекрывает клон 8f и закодированные в ней аминокислоты. На фиг. 21 представлена последовательность оснований кольцевой ДНК вируса гепатита С в клоне 33g, сегмент которой перекрывает клон 33f и закодированные в ней аминокислоты. На фиг. 22 представлена последовательность оснований кольцевой ДНК вируса гепатита С в клоне 7f, сегмент которой перекрывает последо-вательность оснований в клоне 7е, и закодиро-ванные в ней аминокислоты. На фиг. 23 представлена последовательность оснований кольцевой ДНК вируса гепатита С в клоне 11b, сегмент которой перекрывает последовательность оснований в клоне 7f и закодирован-ные в ней аминокислоты. На фиг. 24 представлена последовательность оснований кольцевой ДНК вируса гепатита С в клоне 14і сегмент которой перекрывает последо-вательность оснований в клоне 11b и закодиро-ванные в ней аминокислоты. На фиг. 25 представлена последовательность оснований кольцевой ДНК вируса гепатита С в клоне 39с, сегмент которой перекрывает последо-вательность оснований в клоне 33g, и закодиро-ванные в ней аминокислоты. На фиг. 26 представлена сложная последова-тельность оснований кольцевой ДНК вируса гепа-тита С, полученная от объединения кольцевых ДНК в клонах 14і, 11b, 7f, 7e, 8h, 33c, 40b, 37b, 35, 36, 81, 32, 33b, 25c, 14c, 8f, 33f и 33g, а также пре-дставлена последовательность аминокислот по-липептида, закодированная в протяженной откры-то читаемой структуре в полученной последова-тельности оснований. На фиг. 27 представлена последовательность оснований кольцевой ДНК вируса гепатита С в клоне 12f, сегмент которой перекрывает клон 14i, и закодированные в ней аминокислоты. На фиг. 28 представлена последовательность оснований кольцевой ДНК вируса гепатита С в клоне 35f, сегмент которой перекрывает клон 39с, и закодированная в ней последовательность ами-нокислот. На фиг. 29 представлена последовательность оснований кольцевой ДНК вируса гепатита С в клоне 19g, сегмент которой перекрывает клон 35f и закодированные в ней аминокислоты. На фиг. 30 представлена последовательность оснований в клоне 26g, сегмент которой перекры-вает клон 19g, и закодированные в ней аминокис-лоты. На фиг. 31 представлена последовательность оснований в клоне 15е, сегмент которой перекры-вает клон 26g, и закодированные в ней аминокис-лоты. На фиг. 32 представлена последовательность оснований в сложной кольцевой ДНК, которая по-лучена объединением клонов 12f до 15е в на-правлении 5' к 3': представлены также аминокис-лоты, закодированные на непрерывной открыто читаемой структуре. На фиг. 33 представлена фотография запад-ных пятен, полученная на конденсированном бел-ке, пероксиддисмутазе – ни А, ни В5-1-1 с сыворот-кой шимпанзе, инфицированной вирусами гепати-та ни А, ни В, А и В. 42668 На фиг. 34 представлена фотография запад-ных пятен, полученная на конденсированном бел-ке, пероксиддисмутазе – ни А, ни В5-1-1 с сыворот-кой человека, инфицированного вирусом гепатита ни А, ни В, вирусом гепатита А, вирусом гепатита В и от контрольной группы лиц. На фиг. 35 представлена диаграмма сущест-венных признаков вектора рАВ24. На фиг. 36 представлена предполагаемая по-следовательность аминокислот карбокси-оконча-ния конденсированного полипептида С100-3 и за-кодированная в ней последовательность нуклео-тидов. На фиг. 37А представлена фотография окра-шенного синим красителем полиакриламидного геля, который идентифицирует С100-3, экспресси-рованный в дрожжах. На фиг. 37В представлено западное пятно по-липептида С100-3 с сывороткой инфицированного вирусом ни А, ни В человека. На фиг. 38 представлена ауторадиография северного пятна РНК, выделенной из печени инфицированной вирусом ВВ-ни А, ни В шимпанзе, исследованной вирусом ВВ-ни А, ни В кольцевой ДНК клона 81. На фиг. 39 представлена ауторадиография ну-клеиновой кислоты вируса ни А, ни В, обработан-ной рибонуклеазой А или дезоксирибонуклеазой I и исследованной кольцевой ДНК вируса ВВ-ни А, ни В клона 81. На фиг. 40 представлена ауторадиография ну-клеиновых кислот, экстрагированных из частиц ви-руса ни А, ни В, отловленных в инфицированной анти-ни А, ни В5-1-1 плазме, и исследованных ме-ченой фосфором-32 кольцевой ДНК вируса ни А, ни В из клона 81. На фиг. 41 представлена ауторадиограмма фильтров, содержащих выделенные аминокисло-ты вируса ни А, ни В, исследованные мечеными фосфором-32 и плюс окрашенными пробами для ДНК, полученными из кольцевой ДНК вируса ни А, ни В в клоне 81. На фиг. 42 представлены гомологи между по-липептидом, закодированным в кольцевой ДНК вируса гепатита С и NS-белком флави-вируса Dengue. На фиг. 43 представлена гистограмма распре-деления инфекции вируса гепатита С в выбран-ных наугад образцах, как определено иммуно-ферментным твердофазным анализом. На фиг. 44 представлена гистограмма распре-деления инфекции вируса гепатита С в случайных образцах, полученная с использованием двух кон-фигураций сопряжения иммуноглобулин-фермент в иммуноферментном твердофазном анализе. На фиг. 45 представлены последовательности в первичной смеси, полученной из сохраненной последовательности в NS1 флавивирусов. На фиг. 46 представлена последовательность оснований кольцевой ДНК вируса гепатита С в клоне 91, сегмент которой перекрывает кольце-вую ДНК на фиг. 26, и закодированные на ней аминокислоты. На фиг. 47 представлена последовательность оснований сложной кольцевой ДНК, полученной при соединении клонов к 9-1 до 15е в направле-нии 5' и 3': представлены также аминокислоты, закодированные в открыто читаемой протяженной структуре. І. Определения Термин "вирус гепатита С" предназначался разработчиками в данной области для дотоле неизвестного этиологического агента ни А, ни В ге-патита. Следовательно, употребленный в описа-нии "вирус гепатита С" касается возбудителя ге-патита ни А, ни В, который ранее относился к ви-русу ни А, ни В и/или ВВ-ни А, ни В. Термины "ви-рус гепатита С, вирус гепатита ни А, ни В и вирус гепатита ВВ-ни А, ни В" используются здесь как равнозначные. Термин "вирус гепатита С", используемый в описании, означает виды вирусов, вызывающих гепатит ни А, ни В, и ослабленные штаммы и де-фектные вирусные частицы, производные от этих штаммов. Как показано будет ниже, геном вируса гепатита С состоит из РНК. Известно, что РНК-содержащие вирусы имеют относительно высокие спонтанные мутации, т.е. по опубликованным дан-ным порядка 10-3-10-4 на нуклеотид (Fields и Knipe, 1986). Поэтому имеют место множественные штаммы внутри вида вируса гепатита С, опреде-ленные ниже. Составы и методы, описанные здесь, делают возможным репродукцию, иденти-фикацию, детектирование и выделение различных родственных вирусов. Более того, они позволяют также обеспечить получение диагностических средств и вакцин для различных штаммов и полезны в процессе отбора противовирусных аген-тов для фармакологического использования, так как они ингибируют репликацию вируса гепати-та С. Приведенная здесь информация, хотя и полу-чена на одном штамме вируса гепатита С, назы-ваемого далее СDС/НСV1, является достаточной для того, чтобы вирусный таксономист идентифи-цировал другие штаммы, которые принадлежат этому виду вирусов. Как описывалось уже, мы от-крыли, что вирус гепатита С относится к флавиви-русу или флавиподобному вирусу. Морфология и состав частиц флавивируса известны и описаны Brinton (1986). Что касается морфологии, то фла-вивирусы содержат центральный нуклеокапсид, окруженный липидным двуслоем. Вирионы сфе-рической формы и имеют диаметр 25-30 наномет-ров. Вдоль наружной поверхности оболочки ви-риона имеются выросты длиной примерно 510 нанометров с концевыми выпуклостями диа-метром около 2 нанометров. Вирус гепатита С кодирует эпитоп, который иммунологически тождественен эпитопу в геноме вируса гепатита С, от которого происходят коль-цевые ДНК, записанные в нем. Эпитоп является единственным в своем роде к вирусу гепатита С, если сравнить с другими известными флавивиру-сами. Уникальность эпитопа может быть опреде-лена его иммунологической реактивностью с виру-сом гепатита С и отсутствием иммунологической реактивности с другими видами флавивирусов. Способы определения иммунологической реактив-ности известны в данной области, например, ра-диоиммунологическим 42668 анализом, иммунофермен-тным твердофазным анализом, гемагглютинаци-ей, и несколько примеров подходящих методов анализа даны в описании. В дополнение к описанному выше применимы следующие параметры, либо в отдельности, либо в сочетании при идентификации штамма как виру-са гепатита С. Поскольку штаммы вируса гепатита С эволюционно родственны, то следует ожидать, что полная гомологрия геномов на нуклеотидном уровне будет около 40% или более, предпочтите-льно около 60% или более и еще более предпоч-тительно около 80% или более: и в дополнение, что будет иметь место соответствующие близкие последовательности по меньшей мере около 13 нуклеотидов. Соответствие между геномной по-следовательностью предполагаемого вируса ге-патита С и последовательностью оснований коль-цевой ДНК вируса гепатита С СDС/НС1 может быть определена методами, известными в данной области. Например, они могут быть определены непосредственным сравнением последовательной информации полинуклеотида от предполагаемого вируса гепатита С и последовательности(ей) коль-цевой ДНК вируса гепатита С, записанной в нем. Например, они могут быть, таким образом, опре-делены гибридизацией полинуклеотидов в усло-виях, в которых образуются стабильные дуплексы между гомологическими участками, например, те, которые должны быть использованы до фермен-тации с последующей ферментацией однотяжевой специфической нуклеазой(ами), сопровождаемой определением размеров ферментационных фраг-ментов. По причине эволюционного родства штаммов вируса гепатита С, предполагаемые штаммы ви-руса гепатита С тождественны по своей гомологии на полипептидном уровне. Вообще штаммы виру-са гепатита С более чем на 10% являются гомоло-гическими, предпочтительно более чем 60, гомо-логи и даже еще более предпочтительно более чем на 80% гомологи на полипептидном уровне. Методы определения гомологии последователь-ности аминокислот известны в данной области. Например, последовательность аминокислот мо-жет быть определена непосредственно и сравне-на с последовательностями, предусмотренными при этом заранее. Например, также нуклеотидная последовательность геномного материала пред-полагаемого вируса гепатита С может быть опре-делена (обычно через промежуточную кольцевую ДНК): закодированная в ней последовательность аминокислот может быть определена и соответст-вующие участки сравнены. Как использовано в описании, полинуклеотид, "производный от" (полученный из) указанной последовательности, например, кольцевой ДНК ви-руса гепатита С, в особенности из тех, которые приведены в примерах на фиг. 1-32, или от генома вируса гепатита С, относится к полинуклеотидной последовательности, которая содержит примерно последовательность по меньшей мере 6 нуклео-тидов, является предпочтительно по меньшей ме-ре последовательностью около 8 нуклеотидов и более предпочтительно по меньшей мере 10-12 нуклеотидов и еще более предпочтительней по меньшей мере 15-20 нуклеотидов соответственно, т.е. гомологично или комплиментарно к участку указанной последовательности нуклеотидов. Пре-дпочтительно, чтобы последовательность участка, из которого происходит полинуклеотид, являлась гомологичной или комплементарной последова-тельности, которая уникальна для генома вируса гепатита С. Будет или нет эта последовательность уникальна к геному вируса гепатита С, можно оп-ределить методами, известными специалистам в данной области. Например, последовательность можно сравнить с последовательностями в банке данных, т.е. в банке генов, чтобы определить, при-сутствует ли она у неинфицированного хозяина или в других организмах. Последовательность мо-жно также сравнить с известными последователь-ностями других вирусных агентов, включая тех, ко-торые известны как возбудители гепатита, т.е. ви-руса гепатита А, вирус гепатита В и вирус гепати-та Д и с другими членами семейства флавивиру-сов. Соответствие или несоответствие взятой по-следовательности другим последовательностям может быть также определена гибридизацией в соответствующих строгих условиях. Методы опре-деления комплементарности последовательнос-тей нуклиеновых кислот посредством гибридиза-ции известны в данной области и обсуждаются ни-же. См. также, например, Maniatis и др. (1982). В дополнение несоответствия двойных полинуклео-тидов, образованных при гибридизации, можно оп-ределить известными методами, включающими, например, ферментацию нуклеазой, такой как S1, которая специфически сбраживает однотяжевые участки в двойных полинуклеотидах. Области, из которых может быть "произведена" типичная по-следовательность ДНК, включают, но этим не ог-раничиваясь, области, кодируемые специфиче-скими эпитопами, а также нетранскрибированные и/или нетранслированные области. Производный нуклеотид не обязательно явля-ется физически произведенным от показанной последовательности нуклеотидов, а может быть по-лучен любым образом, включающим, например, химический синтез или репликацию ДНК или об-ратную транскрипцию или транскрипцию, которая основана на информации, даваемой последова-тельностью оснований в участке (в участках), от которых происходит полинуклеотид. В дополнение сочетания участков, соответствующих таковым из-вестной последовательности, могут быть модифи-цированы путями, известными в данной области, соответствующими намечаемому использованию. Аналогично последовательность полипептида или аминокислот, "производных" от соответствую-щей последовательности нуклеиновых кислот, на-пример, последовательности, представленные на фиг. 1-32, или от генома вируса гепатита С, отно-сится к полипептиду, имеющему последователь-ность аминокислот, идентичную последователь-ности полипептида, закодированного в последова-тельности или в ее части, при этом часть содер-жит по меньшей мере 3-5 аминокислот, и более предпочтительно по меньшей мере 8-10 амино-кислот, и еще более предпочтительнее по мень-шей мере 11-15 аминокислот, или который имму-нологически тождественен полипептиду, закоди-рованному в последовательности. 42668 Рекомбинантный или производный полипеп-тид не обязательно является транслированным от известной последовательности нуклеиновых кис-лот, например, последовательностей, представ-ленных на фиг. 1-26, или от генома вируса гепати-та С: он может быть получен и иным образом, включая, например, химическим синтезом или экс-прессией рекомбинантной экспрессионной систе-мы или выделением из мутированного вируса ге-патита С. Термин "рекомбинантный полинуклеотид", ис-пользованный в описании, имеет в виду полинук-леотид геномного, полусинтетического, синтети-ческого происхождения или происходящий от кольцевой ДНК, и благодаря своему происхожде-нию и обработке: (1) не связан со всем или с час-тью полинуклеотида, с которым он связан в приро-де или в форме банка данных; и/или (2) присоеди-нен к полинуклеотиду иначе, чем полинуклеотид, с которым он связан в природе. Термин "полинуклеотид", использованный в описании, относится к полимерной форме нуклео-тидов любой длины, как рибонуклеотидам, так и к дезоксирибонуклеотидам. Этот термин относится только к первичной структуре молекулы. Таким об-разом, этот термин включает двунитчатую и одно-нитчатую ДНК, а также двунитчатую и однонитча-тую РНК. Он также включает модифицированные, например, метилированием и/или покрытием, и немодифицированные формы полинуклеотида. Использованный в описании термин "вирус ге-патита С, содержащий последовательность, соответствующую кольцевой ДНК" означает, что вирус гепатита С содержит полинуклеотидную последовательность, которая гомологична или компле-ментарна последовательности в соответствующей ДНК: степень гомологии или комплементарна по-следовательности в соответствующей ДНК: сте-пень гомологии или комплементарности к кольце-вой ДНК будет приблизительно 50% или более и предпочтительно по меньшей мере около 70% и даже еще более предпочтительнее будет по мень-шей мере около 90%. Последовательности, кото-рые соответственны, будут насчитывать по мень-шей мере 70 нуклеотидов, предпочтительно по меньшей мере около 80 нуклеоитдов и даже еще более предпочтительней по меньшей мере около 90 нуклеотидов в длину. Соответствие между по-следовательностью вируса гепатита С и кольце-вой ДНК можно определить методами, известны-ми в данной области, включающими например, прямое сравнение материала последовательнос-ти с описанными кольцевыми ДНК или гибридиза-цией и ферментацией однонитчатой нуклеазой с последующим определением размера фермента-ционных фрагментов. Термин "очищенный вирусный полинуклеотид" относится к геному вируса гепатита С или его фрагменту, который в значительной мере свобо-ден, т.е. содержит менее чем 50%, предпочтите-льно менее 70% и даже еще более предпочти-тельно менее 90% полипептидов, с которыми ви-русный полинуклеотид связан в природе. Техноло-гия очистки вирусных полинуклеотидов от вирус-ных частиц известна в данной области и включа-ет, например, разрыв частицы chao-тропным аген-том и разделение полинуклеотида(ов) и полипеп-тидов ионообменной хроматографией, хромато-графией по сродству и седиментацией по плот-ности. Термин "очищенный вирусный полипептид" от-носится к полипептиду вируса гепатита С или его фрагменту, который в значительной мере свобо-ден, т.е. содержит менее 50%, предпочтительно менее 70% и даже более предпочтительно менее 90% клеточных компонентов, с которыми вирус-ный полипептид естественно связан. Методы очи-стки вирусных полипептидов известны в данной области и примеры этих методов будут рассмот-рены ниже. "Рекомбинантные клетки хозяина", "клетки хо-зяина", "клетки", "линии клеток", "культуры клеток" и другие такие термины означают микроорганизмы или линии высших кариотных клеток, выращенные как одноклеточные формы, относящиеся к клет-кам, которые могут быть или были использованы как реципиенты для рекомбинантного вектора или других переносов ДНК и включают прогению первоначальных клеток, которые были заражены ви-русной нуклеиновой кислотой. Следует понимать, что прогения отдельной родительской клетки мо-жет необязательно быть полностью идентичной по морфологии или по геномному или общему ком-плементу ДНК, как первоначальный родитель вследствие случайной или преднамеренной мута-ции. Потомки родительской клетки, которые дос-таточно аналогичны родительским, должны харак-теризоваться релевантным свойством, таким как наличие нуклеотидной последовательности, коди-рующей желаемый блок, включены в потомство, подпадающее под это определение и входят в объем упомянутого выше термина. "Репликон" является любым генетическим элементом, т.е. плазмида, хромосома, вирус, ко-торый ведет себя как автономная единица поли-нуклеотидной репликации в клетке, т.е. способен к репликации под своим собственным контролем. "Вектор" является репликоном, к которому присоединен другой полинуклеотидный сегмент с тем, чтобы осуществить репликацию и/или экс-прессию (синтез) присоединенного сегмента. "Контрольная последовательность" относится к полинуклеотидным последовательностям, кото-рые необходимы для осуществления экспрессии кодируемых последовательностей, с которыми они связаны. Природа таких контрольных после-довательностей различна в зависимости от орга-низма хозяина: у прокариотов такие контрольные последовательности обычно включают промотор, место связывания рибосомы и терминаторы; у эу-кариотов вообще такие контрольные последова-тельности включают промоторы, терминаторы и в некоторых случаях – гены-усилители. Термин "контрольная последовательность" имеет в виду включение, как минимум, всех компонентов, при-сутствие которых необходимо для экспрессии, и может также включать дополнительные компонен-ты, присутствие которых выгодно, например, ос-новные последовательности. "Операбельно связан" относится к положению, при котором описанные компоненты находятся в отношении, позволяющем им осуществлять функ-цию предназначенным образом. Контрольная по 42668 следовательность, "операбельно связанная" с ко-дирующей последовательностью, соединена та-ким образом, что экспрессия кодирующей после-довательности достигается в условиях, совмести-мых с контрольными последовательностями. "Кодирующая последовательность" является последовательностью полинуклеотидов, которая транскрибирована в информационную РНК и/или транслирована в полипептид, будучи поставлена под контроль соответствующих регуляторных по-следовательностей. Границы кодирующей последовательности определены запускающим транс-ляцию кодоном при 5'-терминале и останавливаю-щим трансляцию кодоном при 3'-терминале. Коди-рующая последовательность, включает, но не ог-раничиваясь этим, информационную РНК, кольце-вую ДНК и рекомбинантные полинуклеотидные последовательности. "Иммунологически идентичны с/как" относится к наличию эпитопа(ов) и полипептида(ов), которые также присутствуют и являются уникальными к оп-ределенным полипептидам(у), обычно к белкам вируса гепатита С. Иммунологическая идентич-ность может быть определена связыванием анти-тел и/или конкуренцией в связывании; эти методы известны среднему специалисту в данной области и также пояснены ниже. Уникальность эпитопа мо-жет быть также определена компьютерными ис-следованиями известных банков данных, т.е. ген-ного банка, для полинуклеотидных последова-тельностей, которые кодируют эпитоп, и сравне-ниями последовательности аминокислот с други-ми известными белками. Использованный в описании термин "эпитоп" относится к антигенной детерминанте полипепти-да: эпитоп должен содержать три аминокислоты в пространственной конформации, которая уника-льна для эпитопа, обычно эпитоп содержит по меньшей мере пять аминокислот и более, обычно содержит по меньшей мере 8-10 аминокислот. Ме-тоды определения пространственной конформа-ции аминокислот известны в данной области и включают, например рентгеновскую кристалло-графию и ядерный магнитный резонанс в двух из-мерениях. Полипептид является "иммунологически реак-ционноспособным" с антителом, если он связыва-ет антитело благодаря распознаванию антителом специфического эпитопа, заключенного в полипеп-тиде. Иммунологическая реактивность может быть определена связыванием антитела, более конкре-тно кинетикой связывания антитела, и/или конку-ренцией в связывании, используя в качестве кон-курента(ов) известный полипептид(ы), содержа-щий эпитоп, против которого направлено антите-ло. Методы определения, является ли полипептид реакционноспособным с антителом, известны в данной области. Использованный в описании термин "иммуно-генный полипептид, содержащий эпитоп вируса гепатита С" включает встречающиеся в природе полипептиды вируса гепатита С или его фрагмен-ты, а также полипептиды, полученные другими средствами, например, химическим синтезом или экспрессией полипептида в рекомбинантном орга-низме. Термин "полипептид" относится к молекуляр-ной цепи аминокислот и не относится к специфи-ческой длине продукта; таким образом пептиды, олигопептиды и белки включены в определение полипептида. Этот термин не относится к пост-экспрессионным модификациям полипептида, на-пример, гликолизациям, ацетиляциям, фосфори-ляциям и тому подобным. Термин "трансформация" использованный в описании, относится к вставке экзогенного полинуклеотида в клетку хозяина, независимо от метода, используемого для введения, например, прямое поглощение, трансдукция, или f-скрещивание. Эк-зогенный полинуклеотид может быть сохранен как неинтегрированный вектор, например, плазмида, или альтернативно может быть интегрирован в ге-ном хозяина. "Обработка", использованная в описании, от-носится к профилактике и/или терапии. Термин "индивид", использованный в описа-нии, относится к позвоночным, в честности, к осо-бям вида млекопитающих, и включает, но не огра-ничивается домашними животными, спортивными животными, приматами и людьми. Термин "плюс-тяж" (нить) нуклеиновой кисло-ты, использованный в описании, содержит последовательность, которая кодирует полипептид. "Минус-нить" содержит последовательность, комплементарную к последовательности "плюс-нити". Термин "положительный нитчатый геном" ви-руса, использованный в описании, является тако-вым, в котором геном, или ДНК или РНК является однонитчатой, и который кодирует вирусный по-липептид(ы). Примеры положительных нитчатых РНК-вирусов включают тогавирусы, коронавирусы, ретровирусы, пикорнавирусы и кальцывирусы. Включены также флавивирусы, которые прежде классифицировались как тогавирусы. См. Fields и Knipe (1986). Использованный в описании термин "антите-ло, содержащее компонент тела" относится к ком-поненту тела индивида, который является источ-ником антител, представляющих интерес. Антите-ло, содержащее компоненты тела, известны в дан-ной области и включают, но не ограничиваются, например, плазмой, сывороткой, спиномозговой жидкостью, лимфой и внешними секрециями ды-хательного, желудочнокишечного и мочеполового трактов, а также слезы, слюна, молоко, клетки бе-лой крови и миеломы. Использованный в описании термин "очищен-ный вирус гепатита вируса гепатита С, который выделен из клеточных составляющих, с которыми обычно связан вирус, и из других типов вирусов, которые могут присутствовать в инфицированной ткани. Методы выделения вирусов известны спе-циалистам в данной области и включают, напри-мер, центрифугирование, аффинную хроматогра-фию; методы получения очищенного вируса гепа-тита С описаны ниже. ІІ. Описание изобретения При осуществлении настоящего изобретения будут использованы, если не указано специально, традиционные методы молекулярной биологии, микробиологии, рекомбинантной ДНК и иммуноло-гии, известные специалистам в данных областях. Такие методы полностью разъяснены в литерату-ре. См. 42668 следующие источники: Maniatis, Fitsch & Sambrook, MOLECULAR CLONING; A LABORATO-RY MANUAL (1982); DNA CLONING, VOLUMES I AND II (D.N. Glover ed. 1985); OLIGONUCLEOTIDE SYNTHESIS (M.J. Gait ed, 1984); NUCLEIC ACID HYBRIDIZATION (B.D. Hames & S.J. Higgins eds. 1984); TRANSCRIPTION AND TRANSLATION (B.D. Hames & S.J. Higgins eds. 1984); ANIMAL CELL CULTURE (R.I. Freshney ed. 1986); IMMOBILIZED CELLS AND ENZYMES (IRL Press, 1986); B. Perbal, A PRACTICAL GUIDE TO MOLECULAR CLONING (1984); the series, METHODS IN ENZYMOLOGY (Academic Press, Inc.); GENE TRANSFER VECTOR FOR MAMMALIAN CELLS (J.H. Miller and M.P. Calos eds. 1987, Cold Spring Harbor Laboratory), Methods in Enzymology, vol. 154 and vol. 155 (Wu and Grossman, and Wu, eds., respectively), Mayer and Walker, eds. (1987), IMMUNOCHEMICAL ME-THODS IN CELL AND MOLECULAR BIOLOGY (Aca-demic Press, London), Scopes, (1987), PROTEIN PURIFICATION: PRINCIPLES AND PRACTICE, Se-cond Edition (Springer-Verlag, N.Y.), and HAND-BOOK OF EXPERIMENTAL IMMUNOLOGY, VOLU-MES I-IV (D.M. Weir and C.C. Blackwell eds 1986). Все патенты, патентные заявки и публикации, упомянутые ранее и ниже, включены в библиографический перечень. Полезные материалы и процессы согласно на-стоящему изобретению сделали возможным полу-чение семейства близко гомологических последо-вательностей нуклеотидов, обособленных из пула кольцевой ДНК, производных от последователь-ностей нуклеиновых кислот, присутствующих в плазме инфицированных вирусом гепатита С ши-мпанзе. Это семейство нуклеотидных последова-тельностей происходит не от человека или шим-панзе, поскольку оно не гибридизирует геномную ДНК от неинфицированных индивидуумов ни че-ловека, ни шимпанзе, поскольку нуклеотиды этого семейства последовательностей присутствуют только в печени и плазме шимпанзе с инфекцией вируса гепатита С и поскольку последователь-ность не присутствует в банке генов. В дополне-ние семейство последовательностей не показы-вает существенной гомологии с последователь-ностями, содержащимися в геноме вируса гепа-тита В. Последовательность одного члена семейства, содержащегося в клоне 5-1-1, имеет одну непре-рывную открыто читаемую структуру, которая ко-дирует полипептид примерно с 50 аминокислота-ми. Сыворотка лиц, инцицкрованных вирусом ге-патита С, содержит антитела, связанные с этим полипептидом, тогда как сыворотка от неинфици-рованного человека не содержит антител к этому полипептиду. И, наконец, в то время как сыворот-ка от неинфицированных шимпанзе не содержит антител к этому полипептиду, антитела вырабаты-ваются у шимпанзе вследствие острой инфекции вируса ни А, ни В. Кроме того антитела к этому по-липептиду не определяются у шимпанзе и людей, инфицированных вирусом гепатита А и вирусом гепатита В. По этим критериям последователь-ность является кольцевой ДНК к вирусной после-довательности, при этом вирус вызывает или свя-зан с гепатитом ни А, ни В; эта последовательность показана на фиг. 1. Как обсуждалось выше, последовательность кольцевой ДНК в клоне 5-1-1 отличается от последовательностей других выде-ленных кольцевых ДНК тем, что она содержит 28 дополнительных пар оснований. Состав других идентифицированных членов семейства кольцевой ДНК, которые были выделе-ны с использованием в качестве пробы синтетиче-ского эквивалента последовательности к фрагме-нту кольцевой ДНК в клоне 5-1-1, представлен на фиг. 3. Член семейства кольцевой ДНК, который был выделен с использованием синтетической по-следовательности, производной от кольцевой ДНК в клоне 81, представлен на фиг. 5, и состав этой последовательности с последовательностью кло-на 81 показан на фиг. 6. Другие члены семейства кольцевой ДНК, включая таковых, присутствующих в клонах 12f, 14i, 11b, 7f, 7e, 8h, 33с, 40b, 37b, 35, 36, 81, 82, 33f, 25с, 14с, 8f, 33f и 33g, 39с, 35f, 19g, 26g и 15e описаны в разделе IV.А. Состав кольце-вых ДНК в этих клонах описан в разделе IV.A.19 и показан на фиг. 34. Состав кольцевой ДНК пока-зывает, что она содержит один непрерывный от-крыто читаемый участок структуры и таким обра-зом кодирует полипротеин. Эти данные согласу-ются с предположением, рассмотренным выше, что вирус гепатита С является флавивирусом или флазиподобным вирусом. Наличие этого семейства кольцевых ДНК, пре-дставленных на фиг. 1-32 включительно, позволя-ет составление проб ДНК и полипептидов, полез-ных в диагностике гепатита ни А, ни В, вызванного инфекцией вируса гепатита С, и при массовой проверке донорской крови и крови реципиентов, а также продуктов крови на инфекцию. Например, из последовательностей возможно синтезировать олигомеры ДНК с 8-10 нуклеотидами или больше, полезные в качестве гибридизационных проб для определения наличия вирусного генома, напри-мер, в сыворотке лиц, подозрительных на носите-лей вируса, или для проверки крови больного на присутствие вируса. Семейство последовательно-стей кольцевой ДНК позволяет также проектиро-вание и получение специфических полипептидов вируса гепатита С, полезных в качестве диагнос-тических средств для определения наличия анти-тел, образующихся при гепатите ни А, ни В. Анти-тела в очищенным полипептидам, полученным из кольцевых ДНК, могут быть также использованы для определения вирусных антигенов у инфици-рованных лиц и в крови. Знание этих последовательностей кольцевой ДНК делает возможным также проектирование и получение полипепидов, которое могут быть испо-льзованы в качестве вакцин против вируса гепати-та С, а также для получения антител, которые в свою очередь могут быть использованы для защи-ты от болезни и/или лечения инфицированных ви-русом гепатита С индивидов. Кроме того, семейство последовательностей кольцевой ДНК позволяет дальнейшее определе-ние свойств генома вируса гепатита С. Полинук-леотидные пробы, полученные из этих последова-тельностей, могут быть использованы для провер-ки пулов кольцевой ДНК на дополнительное пере-крытие последовательностей кольцевой ДНК, ко-торые в свою очередь могут быть использованы для получения еще последовательностей с пере-крытым генетическим иодом. Несмотря на то, что геном разделен на 42668 сегменты и сегментов недоста-ет в общих последовательностях. Этот метод мо-жет быть использован для получения последова-тельности цеаого генома. Однако, если гоном раз-делен на сегменты, то другие сегменты генома мо-гут быть получены повторением процедуры серо-логического скрининга ламбда-gt11, использован-ной для выделения описанных здесь клонов коль-цевой ДНК, или альтернативно выделением гено-ма из очищенных частиц вируса гепатита С. Семейство последовательностей кольцевой ДНК и полипептидов, производных от этих последовательностей, а также антитела, направленные против этих полипептидов, полезны также при выделении и идентификации вирусного агента(ов) ВВ ни А, ни В. Например, антитела, направленные против эпитопов вируса гепатита С, содержав-шихся в полипептидах, полученных из кольцевых ДНК, могут быть использованы в способах, осно-ванных на аффинной хроматографии для выде-ления вируса. Альтернативно антитела могут быть использованы для идентификации вирусных час-тиц, выделенных другими методами. Вирусные ан-тигены и геномный материал выделенных вирус-ных частиц могут быть затем исследованы далее для определения их характеристик. Информация, полученная от дальнейших ис-следований гонома(ов) вируса гепатита С, а также дальнейшие характеристики антигенов вируса ге-патита С и характеристики генома позволяют проектирование и синтез дополнительных проб и по-липептидов, и антител, которые могут быть использованы для диагностики, профилактики и ле-чения гепатита ни А, ни В, индуцированного виру-сом гепатита С, и для скрининга инфицированной крови и родственных крови продуктов. Наличие проб на вирус гепатита С, включая антигены и антитела, и полинуклеотидов, произ-водных от генома, от которого получено семейст-во последовательностей кольцевой ДНК, позволя-ет также развитие систем культуры тканей, кото-рые найдут основное использование в выяснении биологии вируса гепатита С. Это в свою очередь может привести к усовершенствованию новых ре-жимов лечения, основанных на противовирусных соединениях, которые преимущественно инги-бируют репликацию или инфекцию вируса гепа-тита С. Метод, использованный для идентификации и выделения этиологического агента гепатита ни А, ни В, является новым, и он может быть применен для идентификации и/или выделения до сих пор неохарактеризованных агентов, которые содержат геном и которые связаны с различными болезня-ми, включая болезни, вызываемые вирусами, ви-роидами, бактериями, грибками и паразитами. В этом методе пул кольцевой ДНК был создан из ну-клеиновых кислот, присутствующих в инфициро-ванной ткани инфицированного индивида. Пул был создан в векторе, позволяющем экспрессию полипептидаз, закодированных в кольцевой ДНК. Клоны клеток хозяина, содержащие вектор, кото-рые производит иммунологически реактивный фрагмент полипептида этиологического агента, были выбраны иммунологическим просеиванием продуктов экспрессии пула с антителом, содер-жащим компонент тела от другого индивида, ра-нее инфицированного предполагаемым возбуди-телем. Операции метода иммунологического скри-нинга включали взаимодействие продуктов экс-прессии содержащей векторы кольцевой ДНК с антителом, содержащим в компоненте тела второ-го инфицированного индивида, и определение об-разования комплекса антитело-антиген между продуктом(ами) экспрессии и антителами второго инфицированного индивида. Выделенные клоны подвергали дальнейшему иммунологическому отсеиванию взаимодействием их продуктов экспрес-сии с антителом, содержащимся в компонентах тела других индивидуумов, инфицированных пре-дполагаемым агентом, и с контрольными индиви-дами, неинфицированными предполагаемым аген-том, и определяли образование комплексов анти-ген-антитело с антителами от инфицированных индивидов; и выделяли векторы, содержащие кольцевые ДНК, которые кодировали полипепти-ды, иммунологически взаимодействующие с анти-телами от инфицированных индивидов и индиви-дов, подозрительных на инфекцию, но не с конт-рольными индивидами. Инфицированные индиви-ды, используемые для построения пула кольцевой ДНК и для иммунологического скрининга, необяза-тельно должны быть одного и того же вида. Выделенные кольцевые ДНК, как результат настоящего метода, и продукты их экспрессии, и антитела, направленные против продуктов экс-прессии, полезны для получения характеристик и/или удавливания этиологического агента. Как описано более детально ниже, этот метод ус-пешно использовали для выделения семейства кольцевых ДНК, полученных из генома вируса ге-патита С. II.А. Получение последовательности кольце-вой ДНК Депонированную сыворотку от шимпанзе с хронической инфекцией вируса гепатита С и соде-ржащее высокий титр вируса, т.е. по меньшей ме-ре 106 инфекционных доз шимпанзе/мл (ИДШ/мл) использовали для выделения вирусных частиц; нуклеиновые кислоты, выделенные из этих час-тиц, использовали в качестве матрицы при конст-руировании пула кольцевой ДНК к вирусному ге-ному. Процесс выделения частиц предполагаемо-го вируса гепатита С и конструирования пула кольцевой ДНК в ламбда-gt11 описан в разде-ле ІV.А.1. Ламбда-gt11 является вектором, кото-рые был специально разработан для экспрессии встроенных кольцевых ДНК как (конденсирован-ных) полипептидов слияния с бета-галактозидазой и для просеивания большого числа рекомбинант-ного фага специфической антисывороткой, выве-денной против определенного антигена. Пул лам-бда-gt11 кольцевой ДНК, выработанный из пула кольцевой ДНК, содержащего кольцевую ДНК со средним размером приблизительно 200 пар осно-ваний, исследовали на закодированные эпитопы, которые должны связываться специфически с сы-воротками, полученными от больных, перенесших ранее бытовой гепатит ни А, ни В. Huynk T.V. et al., (1985). Было просеяно примерно 106 фагов и идентифицировано пять положительных фагов, очищено и затем испытано на специфичность свя-зывания с сыворотками от различных людей и шимпанзе, прежде инфицированных возбудите-лем вируса гепатита С. Один из фагов, а именно, 5-1-1, связывал пять из восьми испытываемых сы-вороток человека. Это связывание казалось изби-рательным для сывороток больных с предшест-вующими 42668 инфекциями гепатита ни А, ни В, по-скольку семь сывороток нормальной донорской крови не показали такого связывания. Последовательность кольцевой ДНК в реком-бинантном фаге 5-1-1 была определена и пред-ставлена на фиг. 1. Полипептид, закодированный этой клоновой кольцевой ДНК, которая находится в той же трансляционной структуре, что и бета-галактозидазная часть молекулы (конденсирован-ного) полипептида слияния, показан над нуклео-тидной последовательностью. Эта трансляцион-ная открыто читаемая структура, таким образом, кодирует эпитоп(ы), специфически распознавае-мые сывороткой больных, перенесших инфекции гепатита ни А, ни В. Наличие кольцевой ДНК в рекомбинантном фаге 5-1-1 позволило выделение других клонов, содержащих дополнительные сегменты и/или аль-тернативные сегменты кольцевой ДНК к вирусно-му геному. Пул кольцевой ДНК ламбда-gt11, опи-санный выше, исследовали с использованием синтетического полинуклеотида, производного от по-следовательности клоновой кольцевой ДНК 5-1-1. Этот скрининг дал три других клона, которое были идентифицированы как 81, 1-2 и 91; кольцевые ДНК, содержащиеся в этих клонах, были упорядо-чены, т.е. определена их последовательность. См. разделы ІV.А.3 и IV.А.4. Гомологи между четырьмя самостоятельными клонами показаны на фиг. 2, на которой гомологи указаны вертикальными ли-ниями. Последовательности нуклеотидов, присут-ствующих уникально в клонах 5-1-1, 81 и 91, показаны мелкими буквами. Клоновые кольцевые ДНК, присутствующие в рекомбинантных фагах в кло-нах 5-1-1, 81, 1-2 и 91, являются высоко гомоло-гичными и отличаются только двумя участками. Во-первых, нуклеотидный номер 67 в клоне 1-2 яв-ляется тимидином, в то время как остальные три клона содержат цитидиновый остаток в этом по-ложении. Это замещение, однако, не изменяет природы закодированной аминокислоты. Второе отличие между клонами заключается в том, что клон 5-1-1 содержит 28 пар оснований в своем 5'-терминале которые не присутствуют в других клонах. Дополнительная последователь-ность может быть 5'-концевым артефактом клони-рования 5'-концевые артефакты клонирования обычно наблюдаются в продуктах методов, свя-занных с кольцевой ДНК. Синтетические последовательности, произ-водные от 5'-участка и 3'-участка кольцевой ДНК вируса гепатита С в клоне 81 были использованы для отсеивания и выделения кольцевых ДНК из пула кольцевой ДНК вируса гепатита ни А, ни В ламбда-gt11, которые перекрывают кольцевую ДНК клона 81. (Раздел IV.А.5.). Последовательно-сти полученных кольцевых ДНК, которые находят-ся в клоне 36 и клоне 32, соответственно, пред-ставлены на фиг. 5 и на фиг. 7. Аналогично этому синтетический полинуклео-тид, базирующиеся на 5'-участок клона 36, был использован для отсеивания и выделения кольце-вых ДНК из пула кольцевой ДНК вируса гепатита ни А, ни В ламбда-gt11, которые перекрывали кольцевую ДНК клона 36 (раздел IV.А.8.) Очищен-ный клон рекомбинантной, содержащей фаг, коль-цевой ДНК, который гибридизировал синтетиче-скую полинуклеотидную пробу, был назван кло-ном 35, и последовательность кольцевой ДНК ви-руса ни А ни В в этом клоне представлена на фиг. 8. При использовании метода выделения пере-крывающих последовательностей кольцевой ДНК вируса гепатита С были получены клоны, содер-жащие дополнительные восходящие и нисходя-щие последовательности кольцевой ДНК вируса гепатита С. Выделение этих клонов описано ниже в разделе ІV.A. Анализ нуклеотидных последовательностей кольцевых ДНК вируса гепатита С в выделенных клонах показывает, что композиционная кольце-вая ДНК, закодированная в выделенных клонах, содержит один длинный участок открыто читаемой структуры. На фиг. 26 представлена последова-тельность композиционной ДНК из этих клонов, вместе с полипептидом предполагаемого вируса гепатита С, закодированным в ней. Описание метода реабилитации последова-тельностей кольцевой ДНК представляет собой в основном, исторический интерес. Полученные по-следовательности (и их комплементы) представ-лены в описании, и последовательности или лю-бая их часть могут быть получены, используя син-тетические методы, или сочетанием методов син-теза с восстановлением частичных последова-тельностей, используя методы, аналогичные опи-санным здесь методам. Штаммы ламбда-gt11, реплицированные из пула кольцевой ДНК вируса гепатита С и из кло-нов 5-1-1, 81, 1-2 и 91, депонированы в Американ-ском собрании типов культур (АТСС) № 12301 Parklawn Dr., Rockville, Maryland 20852 и им при-своены следующие возрастающие номера (в тер-минах Budapest Treaty). Ламба-gt11 № АТСС депонир. Пул кольцевой ДНК вируса гепатита С 40394 1 дек. 1987 г. клон 81 40388 17 ноябр. 1987 г. клон 91 40389 17 ноябр. 1987 г. клон 1-2 40390 17 ноябр. 1987 г. клон 5-1-1 40391 18 ноябр. 1987 г. При принятии и регистрации этой заявки, как патента Соединенных Штатов, все ограничения по наличию этих депозитов будут безусловно устра-нены и доступ к указанным депо будет обеспечен на период рассмотрения упомянутой заявки лицу, определенному на это уполномоченным, который указан в 37 СFR 1.14 и 35 USC 1.22. Кроме того, эти депонированное штаммы будут сохранены в течение 30 лет, считая от даты депонирования, или спустя пять лет после последнего обращения за депонированными 42668 культурами, или в течение времени действия патента США, если не дольше, эти и другие депонированные материалы, упомя-нутые в описании, приведены только для удобст-ва, а не потому, что требуются для осуществления настоящего изобретения ввиду прилагаемого опи-сания. Последовательности кольцевой ДНК виру-са гепатита С во всех депонированных материа-лах приведены в библиографической ссылке. Описание выше "перехода" генома при выде-лении перекрывающих последовательностей ко-льцевой ДНК из пула вируса гепатита С. Однако, помимо приведенной в описании информации, су-ществуют другие методы выделения кольцевых ДНК, очевидные для специалистов в данной об-ласти. Некоторые из этих методов описаны в раз-деле IV.А, ниже. II.B. Получение вирусных полипептидов и их фрагментов Наличие последовательностей кольцевой ДНК, либо выделенных с использованием последовательностей ДНК на фиг. 1-32, как обсуждено ниже, а также последовательностей кольцевой ДНК на этих фигурах позволяет конструирование векторов экспрессии, кодирующих антигенно ак-тивные участки полипептида, закодированного в одной из нитей. Эти антигенно активные участки могут быть получены из внешнего покрова или оболочки антигенов, или из сердцевины антиге-нов, включая, например, полинуклеотид связыва-ющие белки, полинуклеотидную полимеразу(ы) и другие вирусные белки, требующиеся для репли-кации и/или сборки вирусных частиц. Фрагменты, кодирующие желаемые полипептиды, получены из клонов кольцевой ДНК, используя традиционное ограниченное сбраживание или синтетическими методами, и лигированы в векторы, которые мо-гут, например, содержать части последовательно-стей слияния, таких как бета-галактозидаза или пероксиддисмутаза, предпочтительно пероксид-дисмутаза. Методы и векторы, полезные для по-лучения полипептидов, содержащих последовательности слияния пероксиддисмутазы, описаны в публикации Европейского патентного ведомства № 0196056 от 1 октября 1986 года. Векторы, коди-рующие полипептиды слияния (синтетические полипептиды) пероксиддисмутазы и полипептиды вируса гепатита С, т.е. ни А, ни В5-1-1 и C100-3, ко-торый закодирован в композиционных кольцевых ДНК вируса гепатита С, описаны в разделах IV.В.2 и IV.В.4 соответственно. Любая желаемая часть кольцевой ДНК вируса гепатита С, содержащая открыто читаемую структуру в одной из чувстви-тельных нитей, может быть получена как реком-бинантный полипептид, такой как зрелый белок или белок слияния; альтернативно полипептид, закодированный в кольцевой ДНК, может быть получен химическим синтезом. ДНК, кодирующая желаемый полипептид либо в слитой или в зрелой форме, содержащий или не содержащий сигнальную последовательность, чтобы разрешить секрецию, может быть лигиро-ван в векторы экспрессии, пригодные для любого традиционного хозяина. Как эукариотный, так и прокариотный типы хозяина используют теперь при формировании рекомбинантных полипепти-дов, и кратко некоторые общие контрольные сис-темы и линии клеток хозяина описаны в разде-ле III.А, ниже. Затем полипептид выделяют из ли-зированных клеток или из культуральной среды и очищают до степени, необходимой для его после-дующего использования. Очистка может быть про-ведена известными в данной области методами, например, солевое фракционирование, хромато-графия на ионообменных смолах, центрифугиро-вание и тому подобные. См., например, "Методы в энзимологии для различных способов очистки белков". Такие полипептиды могут быть использо-ваны как диагностические средства, или те из них, которые способствуют нейтрализации антител, могут быть использованы для приготовления вак-цин. Антитела, образующиеся против этих поли-пептидов, могут быть также использованы как ди-агностические средства или для пассивной имму-нотерапии. В дополнение, как описано ниже в раз-деле II.J, антитела к этим полипептидам полезны при выделении и идентификации частиц вируса гепатита С. Антигены вируса гепатите С могут быть выде-лены из вирионов вируса гепатита С. Вирионы мо-гут быть выращены в инфицированных вирусом гепатита С клетках в культуре ткани или в инфи-цированном хозяине. II.С. Получение антигенных полипептидов и соединение их с носителем Антигенный участок полипептида, в общем, относительно мал - типично 8-10 аминокислот или менее в длину. Фрагменты менее пяти аминокис-лот могут характеризовать антигенний участок. Эти сегменты могут соответствовать участкам ан-тигена вируса гепатита С. Следовательно, ис-пользуя кольцевые ДНК вируса гепатита С как ос-нову, можно получить кодируемые дезоксирибо-нуклеиновой кислотой короткие сегменты полипе-птидов вируса гепатита С рекомбинантной экс-прессией, либо как белки слияния, либо как обо-собленные полипептиды. В дополнение, короткие аминокислотные последовательности могут быть удобно получены химическим синтезом. В случа-ях, когда синтезированный полипептид имеет точ-ную конфигурацию, чтобы дать корректный эпи-топ, но слишком мал, чтобы быть иммуногенным, полипептид может быть связан с подходящим но-сителем. Ряд методов получения токой связи известен в данной области, включая образование бисуль-фидных связей с использованием N-сукцин-имидил-3-(2-пиридилтио)-пропионата и сукцин-имидил-4-(Nмалеимидометил)-циклогексан-1-карбоксилата, поставляемых Pierce Company, Rockford, Illinois (если в пептиде отсутствует сульфгидрильная группа, то это можно получить добавлением цистеинового остатка). Эти реагенты образуют бисульфидную связь между ними и пеп-тидными цистеиновыми остатками на одном белке и амидную связь через эпсилон-амино на лизин, или другую свободную аминогруппу в другом бел-ке. Разнообразие таких дисульфид/амид-обра-зующих средств известно. См., например, Immun. Rev. (1982), 62:185. Другие бифункциональные связующие агенты образуют тиоэфиры скорее, чем бисульфидную связь. Многие из этих тио-эфиробразующих средств имеются в продаже и включают реакционноспособные сложные эфиры 6-малеимидокапроновой кислоты, 2-бромуксусной кислоты, 2иодуксусной кислоты, 4-(N-малеимидо-метил)-циклогексан-1-карбоновой кислоты и тому подобные. Карбоксильные группы могут быть ак-тивированы сочетанием их с сукцинимидом или с натриевой солью 1 42668 гидроксил-2-нитро-4-сульф-оновой кислоты. Перечисленный выше список не является исчерпывающим, и могут быть исполь-зованы модификации приведенных в перечне со-единений. Может быть использован любой носитель, ко-торый сам не вызывает образования антител, вре-дных для хозяина. Подходящие носители обычно являются крупными, медленно метаболизирую-щимися макромолекулами, такими как белки, по-лисахариды, такие как функционализированная латексом сефароза, агароза, целлюлоза, целлю-лозные шарики и тому подобные; полимерные аминокислоты, такие как полиглутаминовая кисло-та, полилизин и тому подобные; сополимеры ами-нокислот и неактивные вирусные частицы (см., на-пример, раздел II.D.). Особенно полезными белко-выми субстратами являются альбумины сыворот-ки, гемоцианин, молекулы иммуноглобулина, ти-роглобулин, овальбумин, тетанусанатоксин и дру-гие белки, известные специалистам в данной об-ласти. II.D. Получение гибридных частиц иммуноге-нов, содержащих эпитопы вируса гепатита С Иммуногенность эпитопов вируса гепатита С может быть также повышена получением их в сис-темах млекопитающих или ферментных системах, слитых или собранных с образующими частицы белками, таких как, например, система, связанная с поверхностным антигеном гепатита В. Получен-ный в ней эпитоп вируса ни А, ни В связан непо-средственно с образующим частицы белком, ко-дирующим последовательности, продуцирующие гибриды, которые являются иммуногенными по от-ношению к эпитопу вируса гепатита С. В дополне-ние все полученные векторы включают эпитопы специфические к вирусу гепатита ни А, ни В, имеющие различную степень иммуногенности, та-кие, как, например, пре-S пептид. Таким образом, частицы, построенные из образующего частицы белка, которые включают последовательности ви-руса гепатита С, иммуногенны в отношении к ви-русу гепатита С и вирусу гепатита В. Поверхностный антиген гепатита, как было ус-тановлено, был образован и собран в частицы в S. cerevisiae (Valenzuela и соавт., 1982 г.), а также в клетках молочной железы (Valenzuela Р. и со-авт., 1984 г.). Образование таких частиц, как было показано, повышает иммуногенность мономерной субъединицы. Сборки могут также включать им-мунодоминатный эпитоп поверхностного антигена гепатита В, содержащий 55 аминокислот предпо-верхностного (пре-S) участка. (Neurath и cоавт., 1984 г.). Сборки частицы пре-S поверхностного ан-тигена гепатита В, синтезированные в дрожжах, описаны в публикации Европейского патентного ведомства № 174444 от 19 марта 1986 г.; гибриды, включающие гетерологические вирусные после-довательности для ферментной экспрессии опи-саны в публикации Европейского патентного ве-домства № 175261 от 26 марта 1986 г. Обе заявки принадлежат настоящему автору и приведены в библиографической ссылке. Эти сборки частиц могут быть также осуществлены в клетках млеко-питающих, таким как яйцеклетки китайского хомя-ка, используя SV40дигидрофолятредуктазный вектор (Michelle и соавт., 1984 г.). В дополнение, части образующего частицы белка, кодирующие последовательность, могут быть замещены кодонами, кодирующими эпитоп вируса гепатита С. В этом замещении участки, не требующиеся для посредничества в агрегации элементов (единиц) для образования иммуноген-ных частиц в дрожжах или у млекопитающих, мо-гут быть стерты, устраняя таким образом дополни-тельные антигенные локализации вируса гепатита В от конкуренции с эпитопом вируса гепатита С. II.Е. Получение вакцин Вакцины могут быть получены из одного или более иммуногенных полипептидов, полученных из кольцевой ДНК вируса гепатита С, а также из последовательностей кольцевой ДНК на фиг. 1-32, или из генома вируса гепатита С, к которому они относятся. Наблюдаемая гомология между виру-сом гепатита С и флавивирусами дает информа-цию, касающуюся полипептидов, которые наибо-лее вероятно подходят для вакцин по своей эф-фективности, а также участков генома, на которых они закодированы. Общая структура генома фла-вивирусов описана Rice и соавт., 1986 г. РНК ге-нома флавивирусов, по-видимому, является толь-ко вирусоспецифичным штаммом информацион-ной РНК и транслирована в три вирусных струк-турных белка, т.е. С, М и Е, а также как и в два крупных неструктурных белка, NV4 и NV5 и слож-ный ряд более мелких неструктурных белков. Из-вестно, что основные нейтрализующие эпитопы для флавивирусов в оболочке Е-белка (Roehrig, 1986 г.). Соответствующий Е-ген вируса гепатита С и полипептидный кодирующий участок могут быть предсказаны на основе гомологии с флави-вирусами. Таким образом, вакцины могут состоять из рекомбинантных полипептидов, содержащих эпитопы Е вируса гепатита С. Эти полипептиды могут быть получены в бактериях, дрожжах или в клетках млекопитающих или альтернативно могут быть выделены из вирусных препаратов. Следует также ожидать, что и другие структурные белки могут также содержать эпитопы, которые образу-ют защитные антитела анти-вирусу гепатита С. Таким образом, полипептиды, содержащие эпито-пы Е, С и М, могут быть также использованы от-дельно или в сочетании в вакцинах вируса гепа-тита С. В дополнение к изложенному выше было по-казано, что иммунизация неструктурным белком 1 (NS1) приводит к защите от желтой лихорадки (Schlesinger и соавт., 1986 г.). Это верно даже, ес-ли иммунизация не приводит к образованию ней-трализованных антител. Ввиду вышесказанного, поливалентные вакци-ны против вируса гепатита С могут состоять из од-ного или более структурных белков и/или одного или более неструктурных белков. Эти вакцины мо-гут содержать, например, рекомбинантные поли-пептиды вируса гепатита С и/или полипептиды, выделенные из вирионов. В дополнение возможно использование инактивированных вирусов гепати-та С в вакцинах; инактивация может быть осуще-ствлена при получении вирусного лизата или ины-ми средствами, известными в данной области, чтобы вызвать инактивацию флавивирусов, на-пример, обработкой органическими растворителя-ми или детергентами или обработкой формали-ном. Кроме того вакцины 42668 могут быть получены из ослабленных штаммов вируса гепатита С. Полу-чение аттенуированных штаммов вируса гепатита С описано ниже. Известно, что некоторые белки флавивирусов содержат высоко консервированные участки, т.е. ожидается некоторая иммунологическая перекре-стная реактивность между вирусом гепатита С и другими флавивирусами. Возможно, что поделен-ные эпитопы между флавивирусами и вирусом ге-патита С вызовут образование защитных антител против одного или более расстройств, обуслов-ленных этими патогенными возбудителями. Таким образом возможно проектирование многоцелевых вакцин, основываясь на этих знаниях. Получение вакцин, содержащих иммуноген-ный полипептид(ы) в качестве активного ингреди-ента, известно специалистам в данной области. Типично такие вакцины готовят в форме препара-тов для инъекции, либо в виде жидких растворов или суспензий; твердые формы, пригодные для растворения или суспендирования в жидкости до проведения инъекции, могут быть также приготов-лены. Препарат может быть также эмульгирован или белок инкапсулирован в липосомы. Активные иммуногенные ингредиенты часто смешивают с носителями, которые являются фармацевтически приемлемыми и совместимыми с активным ингре-диентом. Подходящими наполнителями является, например, вода, физиологический раствор, декст-роза, глицерол, этанол, и тому подобные и их со-четания. В дополнение, если необходимо, вакцина может содержать небольшие количества вспомо-гательных веществ, таких как смачивающие или эмульгирующие средства, рН буферные средства и/или добавки, повышающие эффективность вак-цины. Примеры адъювантов, которые могут быть эффективными, включают, но не ограничиваются этим: гидроокись алюминия, N-ацетил-мурамил-L-треонил-Д-изоглутамил, N-ацетил-нор-мурамил-L-аланил-Дизоглутамин (СGR 11637, называемый далее нор-МДР), N-ацeтилмурамил-L-aланил-Д-изоглутаминил-Lаланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин (СGР 19835А, называемый далее как МТР-РЕ) и RIВI, который содержит три компонента, экстраги-рованных из бактерий: монофосфориловый липид А, димиколат трехалозы и сколот клеточных обо-лочек (МРL+ТДМ+С WS в 2% эмульсии сквалена в твине 80. Эффективность адъютанта может быть определена измерением количества антител, на-правленных против иммуногенного полипептида, содержащего антигенную последовательность ви-руса гепатита С, полученную от введения этого полипептида в вакцины, которые включали также различные адьюванты. Вакцины традиционно вводили парентераль-но, инъекциями, например, либо подкожно, либо внутривенно, или внутримышечно. Дополнитель-ные формы медицинских препаратов, пригодных для введения другими путями, включают суппози-тории и в некоторых случаях - формы для введе-ния перорально. Суппозитории, традиционные связующие и носители могут включать, например, полиалкиленгликоли или триглицериды; такие суп-позитории могут быть получены из смесей, содер-жащих активный ингредиент в пределах от 0,5 до 10%, предпочтительно 1-2%. Формы препара-тов для перорального введения включают такие обычно применяемые экспиенты, как, например, миннит фармацевтической чистоты, лактоза, кра-хмал, стеарат магния, сахарин натрия, целлюлоза, карбонат магния и тому подобные. Этим компози-циям придают форму растворов, суспензий, таб-леток, пилюль, капсул, формы с длительным ос-вобождением активного ингредиента или порош-ков и содержит 10-95% активного ингредиента, предпочтительно 25-70%. Белки могут быть приготовлены как вакцины в нейтральной форме или в форме соли. Фармацевтически приемлемые соли включают кислотно-аддитивные соли (образованы со свободными аминогруппами пептида), и которые образованы с неорганическими кислотами, такими, как, напри-мер, хлористоводородная или фосфорная кисло-ты, или такими органическими кислотами, как ук-сусная, щавелевая, винная, малеиновая и тому подобные. Соли, образованные со свободными карбоксильными группами, могут быть также по-лучены от неорганических оснований, таких как, например, гидроокиси натрия, калия, аммония, кальция или железа и такими органическими ос-нованиями, как изопропиламин, триметиламин, 2-этиламиноэтанол, гистидин, прокаин и тому по-добные. II.F. Дозирование и введение вакцин Вакцины вводили способом, совместимым с дозированными формами препаратов, и в таких количествах, которые были бы диагностически и/или терапевтически эффективными. Количество вводимой вакцины, которое обычно находится в пределах от 5 до 250 микрограмм антигена на до-зу, зависит от субъекта, подлежащего лечению, функциональной активности иммунной системы субъекта синтезировать антитела и степени же-лаемой защиты. Точные количества активного ин-гредиента, потребные для введения, могут зави-сеть от заключения лечащего врача и могут быть строго индивидуальными для каждого субъекта. Вакцина может быть предписана для введе-ния в однократной дозе или предпочтительно в множественных дозах. При назначении много-кратной дозы первичный курс вакцинации может заключать 1-10 отдельных доз с последующим введением других доз в известном интервале вре-мени, потребного для поддержания и/или усиле-ния иммунной реакции, например, с 1-4 месячным интервалом для второй дозы и, если необходимо, то последующие дозы(а) после нескольких меся-цев. Режим дозирования будет также, по меньшей мере частично, зависеть от заключения лечащего врача. В дополнение вакцина, содержащая иммуно-генные антигены (антиген) вируса гепатита С, мо-жет быть введена в сочетании с другими иммуно-регулирующими средствами, например, иммуно-глобулином. II.G. Получение антител против эпитопов ви-руса гепатита С Иммуногенные полипептиды, полученные как описано выше, использовали для продуцирования антител, как поликлональных, так и моноклональ-ных. Если необходимы поликлональные антитела, то выбранное млекопитающее (т.е. мышь, кролик, коза, лошадь и так далее) иммунизировали имму-ногенным 42668 пептидом, несущим эпитоп(ы) вируса ге-патита С. Сыворотку иммунизированного животно-го собирали и обрабатывали известными метода-ми. Если сыворотка, содержащая поликлональные антитела к эпитопу вируса гепатита С, содержит антитела к другим антигенам, то поликлональные антитела могут быть очищены иммуноаффинной хроматографией. Методы получения и обработки поликлональной антисыворотки известны в дан-ной области, см., например Mayer и Walker, 1987 г. Альтернативно поликлональные антитела мо-гут быть выделены из млекопитающего, который ранее был инфицирован вирусом гепатита С. При-мер очистки антител к эпитопам вируса гепатита С из сыворотки от неинфицированного индивида, основанный на аффинной хроматографии и ис-пользовании полипептида сплавлення пероксида дисмутазы и полипептида, закодированного в кольцевой ДНК клона 51-1, представлен в разде-ле V.Е. Моноклональные антитела, направленные против эпитопов вируса гепатита С, могут быть также легко получены специалистом в данной об-ласти. Общая методология получения монокло-нальных антител гибридизацией хорошо известна. Жизнедеятельные линии клеток-продуцентов ан-тител могут быть созданы слиянием клеток, а так-же и другими методами, такими как прямая транс-формация В лимфоцитов онкогенной ДНК или трансфекция вирусом Эпстайна-Барра. См., также Schreier и соавт., 1980; Hammerling и соавт., 1981; Kennett и соавт.1980 г.; см. также патенты США № 4341761, 4399121, 4427783, 4444887, 4466917, 4472500, 4491632 и 4493890. Перечень монокло-нальных антител, продуцированных против эпито-пов вируса гепатита С, может быть исследован на различные свойства, т.е. на изотип, сродство к эпитопу и так далее. Антитела, как моноклональные, так и поликло-нальные, которые направлены против эпитопов вируса гепатита С, особенно полезны в диагнос-тике, а нейтрализованные антитела полезны в пассивной иммунотерапии. Моноклональные анти-тела, в частности, могут быть полезны при обра-зовании антиидиотипичных антител. Анти-идиотипичные антитела являются имму-ноглобулинами, которые несут "внутреннее изображение" антигена инфекционного агента, от ко-торого желательна защита. См., например, Nisonoff A. и соaвт., 1981, и Dreesman и соавт., 1985 г. Методы вырабатывания антигенотипичных ан-тител известны в данной области. См. например, Grzych (1985), MacNamara и соавт. (1984) и Uytdehaad и соавт. (1985 г.). Эти антигенотипич-ные антитела могут быть также полезны при ле-чении гепатита ни А, ни В, а также для выяснения иммуногенных участков антигенов вируса гепа-тита С. II.H. Диагностические олигонуклеотидные про-бы и комплекты Используя раскрытые в изобретении части вы-деленной кольцевой ДНК вируса гепатита С за ос-нову, включая и части кольцевой ДНК, представ-ленные на фиг. 1-32, можно получить олигомеры примерно с 8 нуклеотидами и более, которые об-разуют гибриды с геномом вируса гепатита С и по-лезны для идентификации вирусного агента(ов), дальнейшей характеризации вирусного гено-ма(ов), а также при определении вируса(ов) у за-болевших индивидов. Пробы на полинуклеотиды (природные или производные) имеют длину, кото-рая позволяет определение уникальных вирусных последовательностей гибридизацией. В то время как 6-8 нуклеотидов могут быть пригодной для ра-боты длины, последовательность 10-12 нуклеоти-дов, однако, предпочтительна и оптимальной, по-видимому, является последовательность пример-но 20 нуклеотидов. Предпочтительно, чтобы эти последовательности получали от участков, в ко-торых отсутствует гетерогенность. Эти пробы мо-гут быть получены с использованием обычных ме-тодов, включая методы автоматизированного син-теза олигонуклеотидов. Среди полезных проб, на-пример, можно назвать клон 5-1-1 и дополнитель-ные клоны, раскрытые в описании, а также раз-личные олигомеры, полезные в апробации пулов кольцевой ДНК, представленных ниже. Компле-мент в любой уникальной части генома вируса ге-патита С будет удовлетворительным. Для исполь-зования в качестве проб желательна полная ком-плементарность, хотя она может быть необязательной, так как длина фрагмента увеличивается. Для использования таких проб в качестве ди-агностических обрабатывают образец, который подлежит анализу, такой как кровь или сыворотка, если необходимо, для экстрагирования содержа-щихся в нем нуклеиновых кислот. Полученную из образца нуклеиновую кислоту можно подвергнуть гельэлектрофорезу или другому методу разделе-ния по размерам, альтернативно образец нуклеи-новой кислоты может быть радиографирован без разделения по размерам. Затем пробы метят. По-дходящие метки и методы меченых проб известны в данной области, и включают, например, радио-активные метки, инкорпорированные при синтезе белка или ферментации, биотин, флюоресцент-ные пробы и хемолюминесцентные пробы. Нук-леиновые кислоты, экстрагированные из образца, обрабатывают затем мечеными пробами в усло-виях гибридизации с соответствующими мерами предосторожности. Пробы можно получить полно-стью комплементарными к геному вируса гепатита С. Поэтому соблюдают условия особой строгости, чтобы предотвратить ложные находки. Однако особо строгие условия должны соблюдаться толь-ко если пробы комплементарны к участкам вирус-ного генома, которые утратили гетерогенность. Строгость условий проведения гибридизации оп-ределяется рядом факторов в процессе самой ги-бридизации и при процедуре промывки, включаю-щих температуру, ионную силу, деятельность времени и концентрацию формамида. Эти факто-ры описаны, например, в Maniatis T. (1982 г.). Обычно следует ожидать, что последователь-ности генома вируса гепатита С будут присутство-вать в сыворотке инфицированных индивидов на относительно низких уровнях, т.е. примерно 102-103 последовательностей в мл. Этот уровень мо-жет потребовать использование методов усиле-ния при гибридизационных исследованиях. Такие методы известны в данной области. Например, си-стема "BioBridge" Enzo биохимической корпора-ции использует концевую дезоксинуклеотидную трансферазу для 42668 добавления немодифицирован-ных 3'-поли-dТ-хвостов к пробе ДНК. Снабженная хвостами поли-dT-проба гибридизируется в по-следовательность нуклеотидной мишени, а затем в модифицированную биотином поли-А последо-вательность. Заявка по РСТ № 84 (03520) и заявка на европейский патент № 124221 описывают ис-следования по гибридизации ДНК, в которых: (1) аналит ренатурирован пробой однонитчатой ДНК, которая комплементарна меченому ферментом олигонуклеотиду; и (2) полученный хвостатый дуп-лекс гибридизируется в меченый ферментом оли-гонуклеотид. Заявка на европейский патент № 204510 описывает исследования по гибридиза-ции ДНК, в которых анализируемая ДНК контактирует с пробой, имеющей хвост, такой как поли-dT хвост, увеличенная нить которой имеет последовательность, которая гибридизирует к хвосту про-бы, такой как последовательность поли-А, и кото-рая способна связывать множество меченых ни-тей. Особенно желаемый метод может сначала вовлекать увеличение последовательностей ми-шени вируса гепатита С в сыворотках примерно в 1000 раз, т.е. попарно до 106 последовательно-стей на миллилитр. Это можно осуществить, на-пример, по методу Saiki и соавт. (1986 г.). Увели-ченная последовательность(и) может быть затем определена, используя гибридизационный анализ, который описан в продолжающейся заявке на па-тент CШA № 2300-0171, зарегистрированной 15 октября 1987 года на имя приемников по на-стоящему изобретению и приведенной в библио-графической ссылке. В этих исследованиях гибри-дизации, которые должны определять последова-тельности на уровне 106/мл, используются поли-меры нуклеиновых кислот, которые связываются с анализируемой однонитчатой нуклеиновой кисло-той и которые связывают также множество одно-нитчатых меченых олигонуклеотидов. Анализ фа-зы расслоения подходящего раствора, который может быть использован с меченными полинук-леотидными пробами, и методы получения проб описаны в публикации о европейском патенте № 225807, опубликованном 16 июня 1987 года, принадлежащем правоприемникам настоящего изобретения, и который пpиведeн в библиографи-ческой ссылке. Пробы могут быть упакованы в диагностиче-ский комплект. Диагностические комплекты вклю-чают пробы ДНК, которые могут быть мечены; альтернативно пробы ДНК могут не иметь метки, а ингредиенты для введения метки могут быть включены в комплект. Комплект может содержать надежно упакованные реагенты и материалы, не-обходимые для конкретной гибридизации, на-пример, стандарты и инструкции по проведению теста. II.I. Иммунологический анализ и диагностиче-ские комплекты Полипептиды, которые взаимодействуют им-мунологически с антителами сыворотки, содер-жащей вирус гепатита С, например, полипептиды, полученные от клонов, описанных в разделе IV.А, или закодированные в них и их композиты (cм. раздел IV.А) и антитела, образованные против специфических эпитонов вируса гепатита С в этих полипептидах (см. например, раздел IV.Е) явля-ются полезными для проведения иммунологиче-ского анализа на определение наличия антител против вируса гепатита С, или присутствие вируса и/или вирусных антигенов в биологических образ-цах, включающих, например, образцы крови или сыворотки. Осуществление иммунологического анализа имеет дело с вариациями и их разнооб-разие известно специалистам в данной области. Например, в иммунологическом анализе можно использовать одни вирусный антиген, например, полипептид, полученный от любого из клонов, содержащих кольцевую ДНК вируса гепатита С, опи-санных в разделе IV.А, или от композиционных кольцевых ДНК, полученных от кольцевых ДНК в этих клонах, или от генома вируса гепатита С, от которого получена кольцевая ДНК в этих клонах; альтернативно в иммунологическом анализе мож-но использовать комбинацию вирусных антигенов, полученных из этих источников. Можно использо-вать, например, моноклональное антитело, напра-вленное против одного вирусного антигена, моно-клональные антитела, направленные против раз-личных вирусных антигенов, поликлональные ан-титела, направленные против того же вирусного антигена или поликлональные антитела, направ-ленные против различных вирусных антигенов. Анализы могут быть основаны, например, на кон-куренции или непосредственной реакции или на анализах типа сендвич. В анализах могут быть ис-пользованы также, например, твердые подложки или могут быть с использованием иммунопреци-питации. Большинство анализов включают ис-пользование меченых антител или полипептидов; метки могут быть, например, флюоресцентные, хемолюминесцентные, радиоактивные или моле-кулы красителя. Анализы, в которых усиливают сигналы от пробы, также известны и примерами таких анализов является использование биотина и авидина, и иммунологические анализы с мечены-ми ферментами и промежуточные анализы, такие как иммуноферментный твердофазный анализ. Модель флавивируса для вируса гепатита С позволяет предсказания относительно вероятной локализации диагностических эпитопов для струк-турных белков пириона. Участки С, пре-М, М и Е вероятно все содержат эпитопы значительного по-тенциала для детектирования вирусных антигенов и в особенности для диагностики. Аналогично это-му локализации неструктурных белков, следует ожидать, содержат важные диагностические эпи-топы (т.е. NS5, кодирующий предполагаемую по-лимеразу, и NS1, кодирующий предполагаемый комплементсвязывающий антиген). Рекомбинант-ные полипептиды или вирусные полипептиды, ко-торые включают эпитопы от этих специфических локализаций, могут быть использованы для опре-деления вирусных антител в инфекциях донор-ской крови и у инфицированных пациентов. В дополнение антитела, направленные против белков Е и/или М, могут быть использованы в иммунологических анализах для определения вирус-ных антигенов у больных с вирусом гепатита С, вызывающим гепатит ни А, ни В, и в инфекциях крови доноров. Кроме того, эти антитела могут быть чрезвычайно полезны при определении до-норов и больных в острой фазе. 42668 Комплекты удобны для иммунодиагностики и содержат соответствующим образом меченые ре-агенты, и укомплектованы необходимыми мате-риалами, включающими упаковки полипептидов согласно изобретению, содержащих эпитопы ви-руса гепатита С или антитела, направленные про-тив эпитопов вируса гепатита С в подходящих ем-костях вместе с остальными реагентами, потреб-ными для проведения анализа, а также ряд инст-рукций по проведению анализа. II.J. Дальнейшая характеристика генома виру-са гепатита С, вирионов и вирусных агентов, ис-пользуя пробы, полученные от кольцевой ДНК, к вирусному геному Информация о последовательностях кольце-вой ДНК вируса гепатита С в клонах, описанных в разделе IV.А и показанных на фиг. 1-32 включи-тельно, может быть использована для получения дальнейшей информации о последовательности генома вируса гепатита С и для идентификации и выделения агента вируса гепатита С и таким об-разом будет помогать в характеристике последо-вательности, включая природу генома, структуру вирусной частицы и природу антигенов, из кото-рых она состоит. Эта информация, в свою оче-редь, может привести к дополнительным полинук-леотидным пробам, полипептидам, полученным из генома вируса гепатита С, и антителам, направ-ленным против эпитопов вируса гепатита С, кото-рые будут полезны для диагностики и/или лече-ния гепатита ни А, ни В, вызванного вирусом гепа-тита С. Информация о последовательности кольце-вой ДНК в упомянутых выше клонах полезна для составления проб для выделения дополнитель-ных последовательностей кольцевой ДНК, полу-ченных из еще неопределенных участков гено-ма(ов) вируса гепатита С, от которых получены кольцевые ДНК в клонах, в разделе IV.А. Напри-мер, меченые пробы, содержащие последова-тельность примерно 8 или более нуклеотидов и предпочтительно 20 и более нуклеотидов, кото-рые получены из участков, примыкающих к 5'-око-нчаниям и 3'-окончаниям семейства последова-тельностей кольцевой ДНК вируса гепатита С, по-казанных на фиг. 1, 3, 6, 9, 14 и 32, могут быть ис-пользованы для выделения перекрывающихся по-следовательностей кольцевой ДНК от пулов коль-цевой ДНК вируса гепатита С. Эти последова-тельности, которые, перекрывают кольцевые ДНК в упомянутых выше клонах, но которые содержат также последовательности, производные от участ-ков генома, от которых кольцевая ДНК в упомяну-тых выше клонах не происходит, могут быть ис-пользованы для синтеза проб для идентификации других перекрывающих сегментом, которые не обязательно перекрывают кольцевые ДНК в кло-нах, описанных в раздела IV.А. Несмотря на то, что геном вируса гепатита С разделен на сегмен-ты, и общим последовательностям недостает сег-ментов, возможно проследить полный вирусный геном(ы), используя метод выделения перекры-вающих кольцевых ДНК, полученных от вирусного генома(ов). Хотя и маловероятно, если геном яв-ляется сегментированным геномом, которому не-достает общих последовательностей, но последо-вательность гонома может быть определена се-рологическим скринингом пулов кольцевой ДНК вируса гепатита С ламбда-gt11 как использовано для выделения клона 51-1, определения после-довательностей в изолятах кольцевой ДНК и ис-пользования выделенных кольцевых ДНК для вы-деления перекрывающих фрагментов с использо-ванием метода, описанного для выделения и оп-ределения последовательностей клонов, приве-денных в разделе IV.А. Альтернативно характери-стика геномных сегментов может исходить от ви-русного генома(ов), выделенных из очищенных ча-стиц вируса гепатита С. Методы очистки частиц вируса гепатита С и определение их в процессе очистки приведены в описании ниже. Способы вы-деления полинуклеотидных геномов из вирусных частиц известны в данной области, и один про-цесс, который может быть использован, приведен в примере к разделу IV.А.1. Выделенные геном-ные сегменты могут быть затем клонированы и оп-ределена их последовательность. Таким образом с помощью полученной здесь информации можно провести клонирование и определение последо-вательности генома(ов) вируса гепатита С, неза-висимо от его природы. Методы создания пулов кольцевой ДНК изве-стны в данной области и обсуждены ниже и рассматривались выше; метод конструирования пу-лов кольцевой ДНК вируса гепатита С в ламбда-gt11 описан ниже в разделе ІV.А. Однако пулы ко-льцевой ДНК, полезные для отбора проб нуклеи-новых кислот, могут быть созданы также в других векторах, известных в данной области, Например, ламбда-gt10 (Huynh и соавт., 1985 г.). Кольцевая ДНК, полученная из вируса гепатита С, опреде-ленная пробами, полученными от кольцевых ДНК на фиг. 1-32 и от проб, синтезированных из поли-нуклеотидов, производных от этих кольцевых ДНК, может быть выделена из клона ферментацией вы-деленного полинуклеотида подходящим ограни-чивающим ферментом(ами) и определена ее по-следовательность. См., например, раздел IV.А.3 и раздел IV.А.4, методы, использованные для вы-деления и определения последовательности коль-цевой ДНК вируса гепатита С, которая перекрыва-ет кольцевую ДНК вируса гепатита С в клоне 5-1-1, разделы IV.А.6-IV.А.7, методы, использованные для выделения и определения последовательно-сти кольцевой ДНК, которая перекрывает таковую в клоне 81, и раздел IV.А.8 и IV.А.9 для выделе-ния и определения последовательности в клоне, который перекрывает другой клон (клон 36), кото-рый перекрывает клон 81. Информация о последовательностях, полу-ченная из этих перекрывающихся кольцевых ДНК вируса гепатита С полезна для определения об-ластей гомологии и гетерогенности в вирусном ге-номе(ах), которые могут указывать на присутствие различных штаммов генома и/или популяций де-фектных частиц. Она также полезна для состав-ления гибридизационных проб для определения вируса гепатита С или антигенов вируса гепатита С, или нуклеиновых кислот вируса гепатита С в биологических образцах, и в процессе выделения вируса гепатита С (описано ниже, используя ме-тоды, описанные в разделе II.С. Кроме того, пере-крывающиеся кольцевые ДНК могут быть исполь-зованы для создания векторов экспрессии для по-липептидов, полученных из генома(ов) вируca ге-патита С, которые также кодируют 42668 полипептиды, закодированные в клонах 5-1-1, 36, 81, 91 и 1-2 и в других клонах, описанных в разделе IV.А. Спосо-бы создания этих полипептидов, содержащих эпи-топы вируса гепатита С, и антител, направленных против эпитопов вируса гепатита С, содержащих-ся в них, а также их использование являются аналогичными таковым, описанным для полипепти-дов, полученных от последовательностей кольце-вой ДНК вируса гепатита ни А, ни В, содержащих-ся в клонах 5-1-1, 32, 35, 36, 1-2 и 91, рассмотрен-ных выше и ниже. Закодированные в семействе кольцевых ДНК последовательности, содержащиеся в клонах 5-1-1, 32, 35, 36, 81, 91, 1-2 и других клонах, описан-ных в разделе IV.А, являются антигеном(ами), со-держащими эпитопы, которые, по-видимому, уни-кальны к вирусу гепатита С, т.е. антитела, на-правленные против этих антигенов, отсутствуют у индивидов, инфицированных вирусом гепатита А или вирусом гепатита В, и у индивидов, не инфи-цированных вирусом гепатита С (см. серологиче-ские данные, представленные в разделе IV.В). Кроме того, сравнение информации последова-тельностей этих кольцевых ДНК с последователь-ностями вируса гепатита А, вируса гепатита В, ви-руса гепатита Д и с геномными последовательно-стями в банке генсов показывает, что существует минимальная гомология между этими кольцевыми ДНК и последовательностями нуклеотидов тех ис-точников. Таким образом, антитела, направлен-ные против антигенов, закодированных в кольце-вых ДНК этих клонов могут быть использованы для идентификации частиц вируса ВВ-ни А, ни В, выделенных у инфицированных индивидуумов. В дополнение они полезны также для выделения возбудителя(ей) гепатита ни А, ни В. Частицы вируса гепатита С могут быть выде-лены из сыворотки индивидов, инфицированных вирусом ВВ-ни А, ни В, или из культуры клеток лю-бым известным методом в данной области, вклю-чая, например, методы, основанные на распреде-лении по размерам, такие как седиментации или методы исключения, или методы, основанные на плотности, такие как ультрацентрифугирование в градиентах плотности, или преципитация агентом, таким полиэтиленгликоль, или хроматография на различных материалах, таких как анионо- или ка-тионообменные материалы, которые связывают вследствие гидрофобности, а также аффинные ко-лонии. В процессе выделения присутствие вируса гепатита С может определяться гибридизацион-ным анализом экстрагированного генома, исполь-зуя пробы, полученные из кольцевых ДНК вируса гепатита С, описанных выше, или иммунологиче-ским анализом (см. раздел II.I) с использованием в качестве проб антитела, направленные против ан-тигенов вируса гепатита С, закодированных в се-мействе последовательностей кольцевой ДНК, по-казанных на фиг. 1-32, а также направленных про-тив антигенов вируса гепатита С, закодированных в перекрывающихся последовательностях кольце-вой ДНК вируса гепатита С, описанных выше. Ан-титела могут быть моноклонными или поликлон-ными и может быть желательной очистка антител до их использования в иммунологическом анали-зе. Процесс очистки поликлональных антител, на-правленных против антигена(ов), закодированных в клоне 5-1-1, списан в разделе IV.Е; аналогичный процесс очистки может быть использован для ан-тител, направленных против других антигенов ви-руса гепатита С. Антитела, направленные против антигенов ви-руса гепатита С, закодированных в семействе кольцевых ДНК, представленных на фиг. 1-32, а так-же антигенов, закодированных в перекрывающих-ся кольцевых ДНК вируса гепатита С, которые фи-ксированы на твердых подложках, полезны для выделения вируса гепатита С при иммуноаффин-ной хроматографии. Методы проведения иммуно-аффинной хроматографии известны в данной об-ласти, включая и методы фиксации антител на твердых подложках, так что они сохраняют свою избирательную иммунологическую активность; ме-тоды могут предусматривать адсорбцию антител к подложке (см., например, Kurstak в Enzyme Immu-nodiagnosis, с. 3137), а также методы, в которых антитела ковалентно связаны подложкой. Вообще методы аналогичны таковым, используемым для ковалентного связывания антител с твердой под-ложкой, которые в общих чертах описаны в разде-ле II.С; однако, пространственные группы могут быть включены в бифункциональные связующие агенты с тем, чтобы локализация связывания ан-тигена оставалась доступной для антитела. В процессе проведения очистки присутствие вируса гепатита С может быть определено и/или подтверждено гибридизацией нуклеиновой кисло-ты, используя в качестве пробы полинуклеотиды, полученные из семейства последовательностей кольцевой ДНК вируса гепатита С, представлен-ных на фиг. 1-32, а также из последовательностей перекрывающихся кольцевых ДНК вируса гепати-та С, описанных выше. В этом случае фракции об-рабатывают в условиях, вызывающих разрыв ви-русных частиц, например, детергентами в присут-ствии хелатообразующих средств, а присутствие вирусной нуклеиновой кислоты определяют мето-дом гибридизации, описанным в разделе II.Н. Дальнейшее подтверждение того, что выделен-ные частицы являются агентами, вызывающими вирус гепатита С, может быть получена инфици-рованием шимпанзе выделенными вирусными частицами с последующим определением того, что являются ли симптомы гепатита ни А, ни В ре-зультатом инфекции. Вирусные частицы очищенного препарата мо-гут быть исследованы далее. Очищают геномную нуклеиновую кислоту. Основываясь на ее чувстви-тельности к рибонуклеазе, а не к дезоксирибонук-леазе I, становится очевидным, что вирус включа-ет геном РНК. См. пример из раздела IV.С.2 ниже. Количество нитей и циклизация или нециклизация могут быть определены известными в данной об-ласти методами, включающими, например, наблю-дение под электронным микроскопом, миграцией в плотные градиенты и седиментационными харак-теристиками. Основываясь на гибридизации за-хваченного генома вируса гепатита С с отрица-тельными нитями кольцевых ДНК вируса гепатита С, оказывается, что вирус гепатита С может вклю-чать положительный нитчатый геном РНК (см. раздел IV.I). Подобные методы описаны, напри-мер, Methods in Enzymology. В дополнение очи-щенная нуклеиновая кислота может быть блокирована и определена ее последовательность из-вестными методами, включающими обратную 42668 транскрипцию, поскольку материалом генома яв-ляется РНК. См., например, Maniatis, 1982 г., и Glover (1985 г.). Использование нуклеиновой ки-слоты, полученной из вирусных частиц, позволяет проследить весь геном, сегментирован он или нет. Исследование гомологии полипептида, зако-дированного в непрерывной открыто читаемой структуре объединенных клонов с 14i по 39с вклю-чительно (см. фиг. 26), показывает, что полипеп-тид вируса гепатита С содержит участки гомоло-гии с соответствующими белками в консервиро-ванных участках флавивирусов. Пример тому опи-сан в разделе IV.H.3. Эта находка имеет много ва-жных ответвлений. Вопервых, это свидетельство в сочетании с результатами, показывающими, что вирус гепатита С содержит положительный нитча-тый геном, размер которого составляет примерно 10000 нуклеотидов, согласуется с предположени-ем, что вирус гепатита С является флавивирусом или флавиподобным вирусом. Вообще вирионы флавивируса и его геномы имеют относительно стойкую структуру и организацию, которые известны. См. Rice и соавт., (1986 г.) и Brinton (1988 г.). Таким образом, структурные гены, коди-рующие полипептиды С, пре-М/М и Е могут быть локализованы в 5'-окончании генома вверху в на-правлении слова 14i. Кроме того, использование стравнения с другими флавивирусами может предсказать точную локализацию последователь-ностей, кодирующих эти белки. Выделение последовательностей вверх от по-следовательностей в клоне 14i может быть прове-дено различными путями, которые, располагая приведенной в описании информацией, будут оче-видны для специалиста в данной области, напри-мер, метод "блуждающего" генома может быть ис-пользован для выделения других последователь-ностей, являющихся 5'-окончаниями к последова-тельностям в клоне 14i, но которые перекрывают этот клон; это в свою очередь ведет к изоляции дополнительных последовательностей. Этот ме-тод достаточно обширно описан ниже в разде-ле IV.А. Например, известно также, что флавиви-русы имеют консервированные эпитопы и участки последовательностей консервированных нуклеи-новых кислот. Полинуклеотиды, содержащие за-консервированные последовательности, могут быть использованы в качестве проб, которые свя-зывают геном вируса гепатита С, разрешая таким образом его выделение. В дополнение эти закон-сервированные последовательности в сочетании с последовательностями, полученными от кольце-вой ДНК вируса гепатита С, представленным на фиг. 22, могут быть использованы для конструи-рования затравок в системах, которые увеличива-ют последовательности генома вверх от после-довательностей в клоне 14i используя реакцию роста полимеразной цепи. Такой пример описан ниже. Строение вируса гепатита С может быть также определено и его компоненты выделены. Морфо-логия и размеры могут быть определены, напри-мер, электронной микроскопией. Идентификация и локализация специфических вирусных полипеп-тидных антигенов, таких как покрытие или оболоч-ка антигенов или внутренние антигены, такие как белки, связывающие нуклеиновые кислоты, серд-цевина антигенов и полинуклеотидная полимера-за(ы) могут быть также определены, например, из того, присутствуют ли антигены как основные или незначительные компоненты вируса, а также ис-пользованием антител, направленных против спе-цифических антигенов, закодированных в выде-ленных кольцевых ДНК как пробах. Эта информа-ция полезна для составления вакцин; например, может быть предпочтительно включить внешний антиген в препарат вакцины. Поливалентные вак-цины могут быть образованы, например, из поли-пептида, полученного из генома, кодирующего структурный белок, например, белок Е, а также из полипептида от другой части генома, например, неструктурного или структурного полипептида. II.K. Системы клеточных культур и системы модельных животных для репликации вируса ге-патита С Предположение, что вирус гепатита С являет-ся флавивирусом или флавивоподобным вирусом, предлагает также информацию о методах выра-щивания вируса гепатита С. Термин "флавипо-добный" означает, что вирус показывает значи-тельное число гомологии к известным законсер-вированным участкам флавивирусов и, что боль-шая часть генома является одной открыто читае-мой структурой. Методы выращивания флавиви-русов известны специалистам в данной области (см., например, обзоры Brinton (1986) и Stollar V. (1980). Вообще подходящие клетки или культуры клеток для выращивания вируса гепатита С могут включать клетки, поддерживающие репликацию флавивирусов, например, следующие: линии кле-ток почек обезьяны (т.е. MK2, VERO); линии клеток почек свиньи (т.е. PS), линии почечных клеток мо-лодого хомяка (т.е. BHK), линии макрофаговых клеток мурены (т.е. P388D1, МK1, Мm1); линии ма-крофаговых клеток человека (т.е. U-937), лейкоци-ты периферической крови человека, слипшиеся моноциты человека, гепатоциты и линии клеток ге-патоцитов (т.е. НUH7, НЕРG2), зародыши и зародышевые клетки (т.е. фибробласты зародышей цыплят) или клетки, полученные от беспозвоноч-ных, предпочтительно от насекомых (т.е. линии клеток дрозофилы) и более предпочтительно от членистоногих, например, линии клеток москитов (т.е. A. Albopictus, Aedes aegypti, Cutex tritaenior-hynchus) или линии клеток клещей (т.е. RML-14 Dermacentor parumapertus). Возможно, что будут выращены первичные ге-патоциты и затем инфицированы вирусом гепати-та С; или альтернативно культуры гепатоцитов мо-гут быть получены из печени инфицированных ин-дивидов (т.е. человека или шимпанзе), в послед-нем случае это будет примером клетки, которая инфицирована in vivo и перевита in vitro. В допол-нение могут быть использованы различные мето-ды оживления, чтобы получить линии клеток, про-изводные от культур гепатоцитов. Например, пер-вичные культуры печени (до и после обогащения популяции) могут быть слиты в многообразие кле-ток для поддержания стабильности. Например, культуры могут быть также инфицированы транс-формированными вирусами или заражены чуже-родными трансформированными генами, чтобы получить перманентные и полуперманентные ли-нии клеток. В дополнение, например, клетки в культурах печени могут быть сплавлены до вос-становленных линий клеток (т.е. НерG2). Методы слияния клеток известны в данной области и включают, например, использование агентов сли-яния, таких как полиэтиленгликоль, вирус Сендан и вирус Эпштейна-Бappa. 42668 Как обсуждалось выше, вирус гепатита С яв-ляется флавивирусом или флавиподобным виру-сом. Поэтому вероятно, что инфекция линий кле-ток вирусом гепатита С может быть осуществлена методами, известными в данной области при ин-фицировании клеток флавивирусами. Эти методы включают, например, инкубирование клеток с ви-русными препаратами в условиях, позволяющих вирусу проникновение в клетку. В дополнение воз-можно получить вирусную продукцию заражением клеток вирусными полинуклеотидами. Известно, что тогавирусы и флавивирусы, как РНК-содержа-щие вирусы, инфекционны в различных линиях клеток позвоночных (Pfefferkorn и Shapiro, 1974) и в линии клеток москитов (Peleg, 1969). Методы за-ражения клеток культуры ткани дуплексами РНК, положительными митчатыми РНК и кольцевыми ДНК (и другими ДНК) известны в данной области и включает, например, методы, которые используют электропорацию и преципитацию ДЕАЕ-декстра-ном или фосфатом кальция. Обильный источник РНК вируса гепатита С можно получить проведе-нием in vitro транскрипции кольцевой ДНК вируса гепатита С на полный геном. Трансфекция этим материалом или клонированной кольцевой ДНК вируса гепатита С проявится в вирусной реплика-ции и воспроизведении вируса in vitro. В дополнение к культивируемым клеткам мо-гут быть использованы системы модельных жи-вотных для репликации вирусов: животные систе-мы, в которых известны флавивирусы, знакомы специалистам в данной области (см., например, обзор Monath 1986). Таким образом, репликация вируса гепатита С происходит не только у шим-панзе, а также и у мармозетки и у сосунков мышей. II.L. Проверка (скрининг) противовирусных агентов на вирус гепатита С Наличие культуры клеток и систем модельных животных для вируса гепатита С делает также возможным проверку антивирусных агентов, которые ингибируют репликацию вируса гепатита С, и осо-бенно тех агентов, которые преимущественно спо-собствуют росту клеток и увеличению их числен-ности, ингибируют в то жe время вирусную репли-кацию. Эти методы скрининга известны специали-стам в данной области. Вообще противовирусные агенты испытывают при различных концентрациях на их действие по предотвращению вирусной реп-ликации в системах культур клеток, которые под-держивают репликацию вируса, и затем на инги-бирование инфекционности или вирусной пато-генности (и на низший ypовень токсичности) в мо-дельной системе животного. Методы и композиции, предусмотренные в описании для определения витигенов вируса ге-патита С и полинуклеотидов вируса гепатита С, полезны для испытаний антивирусных агентов тем, что они представляют альтернативу и вооб-ще более чувствительные средства для детекти-рования кипения агента на вирусную репликацию чем, метод розеток или тест на ингибирующую дозу-50%. Например, описанные здесь пробы по-линуклеотидные пробы вируса гепатита С могут быть использованы для количественной оценки вирусной нуклеиновой кислоты, продуцированной в культуре клеток. Это можно осуществить, на-пример, гибридизацией или конкурентной гибри-дизацией инфицированных нуклеиновых кислот клетки с меченым полинуклеотидом вируса гепа-тита С пробы. Например, антитела, направленные против вируса гепатита С, могут быть использова-ны для идентификации и количественной оценки антигена(ов) вируса гепатита С в клеточной куль-туре, используя иммунологический анализ, опи-санный выше. В дополнение, поскольку может быть желательно количественно оценить антиге-ны вируса гепатита С в инфицированной культуре клеток конкурентным анализом, то полипептиды, закодированные в кольцевых ДНК вируса гепатита С, описанные в изобретении, полезны при прове-дении этих конкурентных анализов. Вообще ре-комбинантные полипептиды вируса гепатита С, полученные от кольцевых ДНК вируса гепатита С, должны быть помечены и ингибирование связы-вания этих меченых полипептидов с полипепти-дами вируса гепатита С благодаря антигену, про-дуцированному в системе культуры клеток, может быть зарегистрировано. Кроме того, эти методы особенно полезны в случаях, когда вирус гепатита С может быть способен к репликации в линии кле-ток, не вызывая их гибели. II.М. Получение ослабленных штаммов вируса гепатита С В дополнение к описанному выше, используя системы тканевых культур и/или систем модель-ных животных, можно выделить ослабленные ли-нии вируса гепатита С. Эти линии могут быть при-годны для вакцин или для выделения вирусных антигенов. Ослабленные линии могут быть выде-лены после многократных пассажей в культуре клеток и/или модельного животного. Определение ослабленного штамма в инфицированных клетках или у индивида осуществляется методами, из-вестными в данной области, и может включать, например, использование антител к одному или более эпитопам, закодированным в вирусе гепа-тита С как в пробе, или использование полинук-леотида, содержащего последовательность виру-са гепатита С по меньшей мере из 8 нуклеотидов, как пробу. Альтернативно или в дополнение ос-лабленный штамм может быть получен с исполь-зованием информации генома вируса гепатита С, приводимой в описании, и использованием реком-бинантных методов. Вообще можно попытаться уничтожить участок генома, кодирующий напри-мер, полипептид, относящийся к патогенности, но который допускает репликацию вируса. В допол-нение строение генома должно допускать экс-прессию генома, ведущего к образованию нейтра-лизующих антител к вирусу гепатита С. Этот ви-доизмененный геном может быть затем использо-ван для трансформации клеток, допускающих ре-пликацию вируса гепатита С, и клетки выращива-ют в условиях, позволяющих вирусную реплика-цию. Ослабленные штаммы вируса гепатита С по-лезны не только для целей, связанных с получе-нием вакцин, но и как источник коммерческого продуцирования вирусных антигенов, поскольку обработка этих вирусов потребует менее строгих защитных мер для пользователей, участвующих в получении вирусов и/или вирусной продукции. III. Общие методы Общие методы, использованные для экстра-гирования генома из вируса, получение и испыта-ние пула кольцевой ДНК, определение последо-вательностей в клонах, конструирование векторов экспрессии, 42668 трансформация клеток, проведение радиоиммунологического анализа и иммунофер-ментного твердофазного анализа для выращива-ния клеток в культуре и тому подобные известны в данной области и лабораторные справочники дос-тупно описывают эти методы. Однако, для общего руководства ниже приводятся некоторые источни-ки, в настоящее время доступные для проведения таких методов, и материалы, полезные при их осу-ществлении. III.А. Хозяева и контрольные последователь-ности экспрессии Прокарнотные и эукариотные клетки хозяева могут быть использованы для экспрессии желае-мых кодирующих последовательностей, если ис-пользуются соответствующие контрольные последовательности, совместимые с определенным хо-зяином. Среди прокариотных хозяев наиболее ча-сто употребляют E. coli. Контрольные последова-тельности экспрессии для прокаристов включают промоторы, необязательно содержащие части ге-на-оператора, и локализации связывания рибо-сом. Векторы переноса, совместимые с прокари-отными хозяевами, обычно получают, например, из рВР322, плазмиды, содержащей опероны, при-дающие устойчивость к ампициллину и тетрацик-лину, и различные рVС векторы, которые также содержат последовательности, передающие мар-керы антибиотической устойчивости. Эти маркеры могут быть использованы для получения транс-формантов селекцией. Обычно используемые кон-трольные прокариотные последовательности включают беталактамазу (пенициллиназу) и систе-мы лактозных промоторов (Chang и соавт., 1977 г.), систему триптофанового промотора (trp) (Goeddel и соавт., 1980 г.) и ламбда-производный PL промотор и локализация связывания рибосомы N гена (Shimatake и соaвт., 1981 г.) и гидридный tac промотор (De Boer и соавт., 1983 г.), получен-ный из последовательности trp и lac UV5 промото-ров. Предыдущие системы особенно совместимы с E. coli; если необходимо, то могут быть исполь-зованы другие прокариотные хозяев, такие как штаммы Bacillus или Pseudomonas с соответст-вующими контрольными последовательностями. Еукариотные хозяева включают дрожжи и кле-тки млекопитающих в системах культур. Saccharo-myces cerevisiae и Saccharomyces carlsbergensis наиболее обычно используемые дрожжевые хо-зяева и удобными являются грибковые хозяева. Совместимые дрожжевые векторы несут маркеры, которые допускают селекцию удачных трансфор-мантов передачей прототропии аутотропным му-тантам или устойчивость к тяжелым металлам штаммам диких типов. Совместимые дрожжевые векторы могут применять двухмикронный источник репликации (Broach и соавт., 1983 г.), сочетание СЕN3 и АRS1 или другие средства для обеспече-ния репликации, такие как последовательности, которые приводят к внедрению соответствующего фрагмента в геном клетки хозяина. Контрольные последовательности для дрожжевых векторов из-вестны в данной области и включают промоторы синтеза гликолитических ферментов (Hess и сo-aвт., 1968 г.; Holland и соавт., 1978 г.) включая промотор для 3-фосфоглицератиназы (Hitzeman, 1980 г.). Могут быть также включены прекращаю-щие синтез агенты (терминаторы), такие как про-изводные от анолазного гена (Holland, 1981 г.). Особенно полезными контрольными системами являются системы, которые содержат глицераль-дегид-3-фосфатдегидрогеназный промотор (GАРDН) или спиртовой дегидрогенозный регули-рующий промотор, терминаторы, также получен-ные из глицеральдегид-3-фосфатдегидрогеназы и, если необходимо вызвать секрецию, то головная последовательность из дрожжевого альфа-факто-ра. В дополнение участки транскрипционного регулирования и транскрипционного инициирования, которые операбельно связаны, могут быть такими, что они не естественно соединены в организме дикого типа. Эти системы детально описаны в ев-ропейском патенте № 120551, опубликованном 3 октября 1984 г.; в европейском патенте № 116201, опубликованном 22 августа 1984 г., и в европейском патенте № 164556, опубликованном 18 декабря 1985 года; все патенты принадлежат настоящему автору и приведены в библиографи-ческой ссылке. Линии клеток млекопитающих, полезных в ка-честве хозяев для экспрессии, известны в данной области и включают многие оживленные линии клеток, получаемые из собрания типов культур Америки (АТСС), например, клетки Hela, клетки яичника китайского хомяка (CHО), клетки почек де-теныша хомяка (ВНК) и ряд других линий клеток. Подходящие промоторы также известны в данной области и включает вирусные промоторы, такие как промоторы из вакуолизирующего обезьяньего вируса (ОВ-40), вируса саркомы Роуза (ВСР), аде-новируса и вирус бычьей папилломы (ВБП). Клет-ки млекопитающих могут также нуждаться в ко-нечных последовательностях и поли А дополни-тельных последовательностях; могут быть также включены усиливающие последовательности, ко-торые увеличивают экспрессию, и последовательности, которые вызывают увеличение числа генов, могут быть также желательны. Эти последовательности известны в данной области. Векторы, при-годные для репликации в клетках млекопитающих, могут включать вирусные репликоны или после-довательности, которое обеспечивают целост-ность соответствующих последовательностей, ко-дирующих эпитопы вируса ни А, ни В в геноме хо-зяина. III.B. Трансформации Трансформация может быть осуществлена любым известным методом введения полинуклео-тидов в клетку хозяина, включая, например, упа-ковку полинуклеотида в вирус и перенос в клетку хозяина генетического материала вируса или не-посредственное поглощение полинуклеотида. Процесс трансформации зависит от хозяина, под-лежащего трансформированию. Например, транс-формация клеток хозяина E. coli посредством лaм-бда-gt11, содержащим последовательности виру-са гепатита ВВ-ни А, ни В, рассмотрены в этом ра-зделе ниже. Бактериальная трансформация мо-жет быть при непосредственном поглощении, обы-чно исключающем oбpаботку хлористым кальцием или хлористым рубидием (Cohen, 1972 г.; Maniatis, 1982 г.). Трансформация дрожжей прямым погло-щением может быть проведена с использованием метода Hinnen и соавт., 1978. Трансформация клеток млекопитающих прямым поглощением мо-жет быть выполнена с использованием метода осаждения фосфатом кальция (метод Graham and Van der Eb, 1978 г.) или различных известных его модификаций. 42668 III.С. Построение векторов При конструировании векторов применяют способы, известные в данной области. Местоспецифическую сегментацию ДНК проводят обработ-кой подходящими ограничивающими ферментами в условиях, которые обычно определяются изго-товителями этих коммерчески доступных фермен-тов. В общем, примерно 1 микрограмм плазмиды или последовательности ДНК расщепляется 1 единицей фермента примерно в 20 микролитрах буферного раствора при инкубации 1-2 часа при 37°С. После инкубации с ограничивающим фер-ментом белок удаляют экстракцией смесью фе-нол-хлороформ, а ДНК выделяют осаждением с этанолом. Расщепленные фрагменты могут быть разделены с использованием полиакриламида или методом электрофореза на агарозовом геле согласно общим методам, описанным в Methods in Enzymology (1980), 65:499-560. Фрагменты расщепления с острыми концами могут стать с рваными концами, используя поли-меразу І ДНК E. coli (Кленов) в присутствии соот-ветствующего дезоксинуклеотидтрифосфата, на-ходящегося в смеси. Может быть использована также обработка S1 нуклеазой, приводящая к гид-ролизу частей любой однонитчатой ДНК. Лигации могут быть выполнены с использова-нием стандартного буфера и стандартных температурных условий с использованием лигазы ДНК Т4 и аденозинтрифосфата и меньше лигазы, чем лигации с рваными краями. Если фрагменты век-тора используют как часть лигационной смеси, то фрагмент вектора часто обрабатывают щелочной фосфатазой бактерий или кишечной щелочной фосфатазой теленка для удаления 5'-фосфата и таким образом предотвращения повторной лига-ции вектора; альтернативно рассасывание огра-ничивающим ферментом нежелательных фраг-ментов может быть использовано для предотвра-щения лигации. Лигационные смеси преобразуют в подходя-щих клонирующих хозяев, таких как E. coli и эф-фективные трансформанты отбирают, например, резистентностью к антибиотикам, и исследуют ис-тинную структуру. III.D. Построение желаемых последовательно-стей ДНК Синтетические олигонуклеотиды могут быть получены с использованием автоматического синтезатора, как описано Warner (1984). Если жела-ют, то синтетические нити могут быть помечены фосфором-32 при обработке полинуклеотидной киназой в присутствии меченого фосфором-32 аденозинтрифосфата, используя стандартные ус-ловия реакции. Последовательности ДНК, включающие тако-вые, выделенные из пулов кольцевой ДНК, могут быть модифицированы методами, включающими, например, локально направленный мутагенез, как описано Zoller (1982). Коротко говоря, подлежа-щую модифицированию ДНК упаковывают в фаг, как однонитчатую последовательность, и обраща-ют в двунитчатую ДНК полимеразой ДНК, исполь-зуя как затравку синтетическую олигонуклеотид-ную комплементарность к части ДНК, которая дол-жна быть модифицирована, и имеющая желаемую модификацию, включенную в ее собственную последовательность. Полученная двунитчатая ДНК трансформирована в фаг, поддерживающий бак-териюхозяина. Культуры трансформированных бактерий, которые содержат репликации каждой нити фага, помещали в чашки с агаровой средой, чтобы получить пятно. Теоретически 50% новых пятен содержат фаг, имеющий мутированную по-следовательность, а остальные 50% имеют исход-ную последовательность. Репликаты пятен гибри-дизируют в меченую синтетическую пробу при те-мпературах и условиях, которые допускают гибри-дизацию с правильной нитью, но не с немодифи-цированной последовательностью. Последова-тельности, которые были идентифицированы гиб-ридизацией, выделяли и из них образовывали клоны. III.Е. Гибридизация с пробой Пулы ДНК могут быть опробированы по мето-ду Grunstein и Hogness (1975). Кратко в этом ме-тоде, ДНК, подлежащую испытаниям, фиксирова-ли на нитроцеллюлозных фильтрах, денатуриро-вали и предварительно гибридизировали с буфе-ром, содержащим 0-50% формамида, 0,75 моля хлористого натрия, 75 мМ нитрата натрия, 0,02% (от веса по объема) каждого: альбумина бычьей сыворотки, поливинилпирролидона и фикола нат-рия (рН 6,5), 0,1% додецилсульфата натрия и 100 микрограмм на миллилитр носителя денату-рированной ДНК. Процентное содержание форм-амида в буфере, а также время и температурные условия предварительной гибридизации и после-дующей операции гибридизации зависит от со-блюдения требуемой строгости. Олигомерные пробы, которые требуют для проведения более мягкие условия строгости, обычно используют низ-кое процентное содержание формамида, требуют более низких температур и более продолжитель-ного времени гибридизации. Пробы, содержащие более 30 или 40 нуклеотидов, такие как пробы, по-лученные от кольцевой ДНК или геномных последовательностей, обычно требуют применения бо-лее высоких температур, т.е. около 40-42°С и вы-соких процентов, т.е. 50% формамида. В ходе пре-дварительной гибридизации к буферу добавляли меченую фосфором-32 5'-олигонуклеотидную про-бу, и фильтры инкубировали в этой смеси в усло-виях гибридизации. После промывки обработан-ные фильтры подвергали ауторадиографии для определения локализации гибридизированной пробы: ДНК в соответствующих локализациях на исходных агаровых пластинках использовали как источник желаемой ДНК. III.F. Подтверждение конструкции и определе-ние последовательности Для традиционных построений векторов лига-ционную смесь трансформировали в штамм E. coli HB101 или другой подходящий хозяин и эффек-тивные трансформанты отбирали по антибиотиче-ской резистентности или другим маркерам. Плаз-миды от трансформантов готовили потом по ме-тоду Clewell и соавт. (1969), обычно сопровождая увеличением хлорамфениколом (Clewell, 1972 г.). ДНК выделяли и анализировали обычно опреде-лением ограничения активности фермента и/или определением последовательности. Определение последовательности можно провести дидезокси-методом Sanger и 42668 соавт. (1977 г.) как далее опи-сано Messing и cоавт., (1981) или по методу Maxam и соавт. (1980). Проблемы, связанные со сжатием полос, которое наблюдается иногда в участках, богатых СС, преодолевают использова-нием Т-деазогуанозина согласно Барру и соавто-ров (1986). III.G. Иммуносорбентный анализ с фермент-ной меткой Иммуноферментный анализ с ферментной ме-ткой (ELISA) может быть использован для измере-ния концентраций либо антигена, или антител. Этот метод зависит от слияния фермента либо с антигеном, либо с антителом и использует актив-ность связывания фермента как количественную метку. Чтобы измерить антитела, известный анти-ген фиксируют на твердой фазе (т.е. на микропла-стинке или пластиковой чашке), инкубируют с раз-ведениями испытываемой сыворотки, промывают, инкубируют с иммуноглобулином, меченым фер-ментом, и снова промывают. Подходящие фер-менты для введения метки известны в данной об-ласти и включают, например, пероксидазу ложеч-ницы. Активность фермента, связанного с твердой фазой, измеряют добавлением специфического субстрата и определяют образование продукта или использование субстрата колориметрическим методом. Активность связанного фермента есть прямая функция количества связанных антител. Чтобы измерить антиген, известное специфи-ческое антитело фиксируют к твердой фазе и до-бавляют испытываемый материал, содержащий антиген; после инкубирования твердую фазу про-мывают и добавляют второе меченое ферментом антитело. После промывки добавляют субстрат и активность фермента определяют колориметри-чески и относят к концентрации антигена. IV. Примеры Представленные ниже примеры реализации настоящего изобретения имеют чисто иллюстра-тивные цели и не ограничивают объема изобрете-ния. В свете настоящего описания многочислен-ные осуществления в объеме изобретения будут очевидны для обычных специалистов в данной об-ласти. Представленные процедуры, например, в разделе IV.А могут быть при желании повторены, так как методы доступны для конструирования ну-клеотидных последовательностей, основываясь на информации, представляемой изобретением. Экспрессия описана на примере E. coli однако и другие системы, описанные более полно в разде-ле III.А, доступны. Могут быть получены дополни-тельные эпитопы, производные от геномной стру-ктуры и использованы для образования антител, как описано ниже. IV.А. Получение, выделение и определение последовательностей кольцевой ДНК вируса гепа-тита С IV.А.1. Получение кольцевой ДНК вируса гепа-тита С Источником возбудителя гепатита ни А, ни В был пул плазмы, полученной от шимпанзе с хро-нической инфекцией гепатита ни А, ни В. Шимпан-зе был экспериментально инфицирован кровью другого шимпанзе с хроническим гепатитом ни А, ни В, индуцированным инфекцией вирусом гепа-тита С в зараженной пробе концентрата факто-ра 8, полученного из пула сывороток человека. Пул плазмы шимпанзе был образован объедине-нием многих отдельных образцов плазмы, содер-жащих высокие уровни активности аланинамино-трансферазы; эта активность является результа-том повреждения печени, вследствие инфекции вирусом гепатита С. Поскольку 1 мл 106 разбавле-ния этой депонированной сыворотки, введенный внутривенно, вызывал гепатит ни А, и В у другой шимпанзе, то ее инфекционная доза для шимпан-зе была по меньшей мере 106/мл, т.е. имела высо-кий инфекционный вирусный титр. Пул кольцевой НК из пула плазмы с высоким титром генерировали следующим образом. Сна-чала выделяли вирусные частицы из плазмы: 90 мл аликвотной пробы разбавляли 310 мл рас-твора, содержащего 50 мМ трис-НСІ, рН 8,0, 1 мМ этилендиаминтетрауксусной кислоты, 100 мМ хло-ристого натрия. Дебрис удаляли центрифугирова-нием в течение 20 минут при 15000g и 20°С. Ви-русные частицы в полученном надосадочным сло-ем обращали затем в сферы центрифугированием в роторе Beckman SW 28 при 28000 оборотов в минуту в течение пяти часов при 20°С. Чтобы ос-вободить вирусный геном. Частицы разрывали су-спендированием шариков в 15 мл раствора, соде-ржащего 1% додецилсульфата натрия, 10 мМ эти-лендиаминтетрауксусной кислоты, 10 мМ этилен-диаминтетрауксусной кислоты, 10 мМ трис-НСІ бу-фера, рН 7,5, также содержащего 2 мг/мл протеи-назы к, с последующим инкубированием при 45°С в течение 90 минут. Нуклеиновые кислоты выде-ляли добавлением 0,8 микрограмма MS2 РНК бактериофага в качестве носителя и экстрагировали смесь 4 раза смесью фенол-хлороформ в отноше-нии 1:1 (фенол, насыщенный 0,5М трис-НСІ, рН 7,5; 0,1% (по объему) бета-меркаптоэтанола, 0,1% (от веса по объему) оксихинолона, с после-дующим экстрагированием хлороформом два ра-за. Водную фазу концентрировали с 1-бутанолом перед осаждением с 2,5 объемами абсолютного этанола при -20°С и оставляли на ночь. Нуклеино-вую кислоту выделяли центрифугированием в ро-торе Beckman SWh1 при 40000 оборотов в минуту в течение 90 минут при 4°С и растворяли в воде, которая была обработана 0,05% (по объему) ди-этилпирокарбонатом и автоклавировали. Нуклеиновую кислоту, полученную на преды-дущей операции (
ДивитисяДодаткова інформація
Назва патенту англійськоюPolypeptide, which has the antigenic properties of the virus of hepatite s (hcv) (variants), diagnostic reagent dl4 to the virus of hepatite s (variants), collection for the development of antibodies to the virus of hepatite s (variants), method of the development of antibodies to the virus of hepatite s (variants)
Автори англійськоюHOUGHTON MICHAEL, CHOO QUI-LIM, KUO GEORGE
Назва патенту російськоюПолипептид, имеющий антигенные свойства вируса гепатита с (hcv) (варианты), диагностический реагент для к вируса гепатита с (варианты), набор для выявления антител к вирусу гепатита с (варианты), способ выявления антител к вирусу гепатита с (варианты)
Автори російськоюХоутон Майкл, Чу Кви-Лим, Куо Джордж
МПК / Мітки
МПК: C07K 16/08, C07K 14/02, C07H 21/04, G01N 33/53, C07K 7/06, C07K 14/195, G01N 33/569, C07K 7/08, A61P 1/16, C12N 15/00, C12Q 1/70, G01N 33/566, C07K 14/10, G01N 33/576, C12P 21/08, C12Q 1/68, C12N 1/19, C12N 5/10, A61K 39/395, C07K 14/005, A61P 31/12, C07K 7/04, G01N 33/577, A61K 39/29, C12N 1/21, C12N 15/02, C07K 14/00, C07K 19/00, C12N 15/09, C07K 16/00, C07K 14/18, C12P 21/02
Мітки: антитіл, набір, варіа, антигенні, властивості, діагностичний, вірусу, виявлення, hcv, варіанти, поліпептид, гепатиту, має, реагент
Код посилання
<a href="https://ua.patents.su/125-42668-polipeptid-shho-maeh-antigenni-vlastivosti-virusu-gepatitu-s-hcv-varianti-diagnostichnijj-reagent-dlya-viyavlennya-antitil-do-virusu-gepatitu-s-varianti-nabir-dlya-viyavlennya-anti.html" target="_blank" rel="follow" title="База патентів України">Поліпептид, що має антигенні властивості вірусу гепатиту с (hcv) (варіанти), діагностичний реагент для виявлення антитіл до вірусу гепатиту с (варіанти), набір для виявлення антитіл до вірусу гепатиту с (варіа</a>
Попередній патент: Споруда
Наступний патент: Спосіб одержання електричної енергії з органічних речовин
Випадковий патент: Спосіб отримання рідкого біопалива з технічних тваринних жирів