5-(3,4-дихлорфеніл)-n-(2-гідроксициклогексил)-6-(2,2,2-трифторетокси)нікотинамід і його солі як засоби, що підвищують концентрацію лвщ холестерину
Формула / Реферат
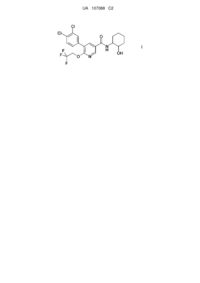
1. Сполука формули
 I
I
та її ізомерні форми й фармацевтично прийнятні солі.
2. Сполука формули І за п. 1, що являє собою 5-(3,4-дихлорфеніл)-N-((1R,2R)-2-гідроксициклогексил)-6-(2,2,2-трифторетокси)-нікотинамід.
3. Сполука формули І за п. 1, що являє собою 5-(3,4-дихлорфеніл)-N-((1S,2R)-2-гідроксициклогексил)-6-(2,2,2-трифторетокси)-нікотинамід.
4. Фармацевтична композиція, що містить сполуку формули І за будь-яким із пп. 1-3 та фармацевтично прийнятний носій і/або допоміжну речовину.
5. Фармацевтична композиція за п. 4, призначена для лікування і/або профілактики захворювань, які можна лікувати засобами, що підвищують концентрацію ЛВЩ холестерину.
6. Сполука формули І за будь-яким із пп. 1-3, призначена для застосування як лікарського засобу.
7. Сполука формули І за п. 6, призначена для застосування як лікарського засобу для лікування і/або профілактики атеросклерозу, захворювання периферичних судин, дисліпідемії, гіпербеталіпопротеїнемії, гіпоальфаліпопротеїнемії, гіперхолестеринемії, гіпертригліцеридемії, сімейної гіперхолестеринемії, серцево-судинних захворювань, таких як стенокардія, ішемія, ішемічна хвороба серця, удар, інфаркт міокарда, реперфузійне ураження, рестеноз після ангіопластики, гіпертензія та судинні ускладнення діабету, ожиріння або ендотоксикозу.
8. Сполука формули І за п. 6, призначена для застосування як лікарського засобу для лікування і/або профілактики дисліпідемії.
9. Сполука формули І за п. 6, призначена для застосування як лікарського засобу для лікування і/або профілактики атеросклерозу.
10. Сполука формули І за п. 6, призначена для застосування як лікарського засобу для лікування і/або профілактики серцево-судинних захворювань.
Текст
Реферат: Даний винахід стосується сполуки зазначеної формули у всіх її ізомерних формах та її фармацевтично прийнятних солей, їх одержання, фармацевтичних композицій, що містять їх, та їх застосування як лікарських засобів для лікування і/або профілактики захворювань, які можна лікувати засобами, що підвищують концентрацію ЛВЩ холестерину, переважно таких як дисліпідемія, атеросклероз і серцево-судинні захворювання. Cl Cl O N H F OH F O F N I UA 107088 C2 (12) UA 107088 C2 UA 107088 C2 Даний винахід відноситься до сполуки формули І 5 10 15 20 25 30 35 40 45 50 і до її ізомерних форм і фармацевтично прийнятних солей, до їх одержання, фармацевтичних композицій, що містять їх, і до їх застосування як лікарські засоби. Сполука формули І, її ізомерні форми та фармацевтично прийнятні солі є особливо придатними для застосування як засоби, що підвищують концентрацію ЛВЩ холестерину. Атеросклероз і зв'язана з ним ішемічна хвороба серця є основною причиною смерті у промислово-розвинених країнах. Показано, що ризик виникнення ішемічної хвороби серця добре корелює з концентраціями деяких ліпідів у плазмі. Ліпіди переносяться у крові ліпопротеїнами. Загальна структура ліпопротеїнів являє собою ядро, утворене нейтральними ліпідами (тригліцерид і холестериловий ефір) і оболонку, що складається з полярних ліпідів (фосфоліпідів і неетерифікованого холестерину). Існують 3 різних класи ліпопротеїнів плазми, що мають різні вмісти ліпідів в ядрі: ліпопротеїн низької щільності (ЛНЩ), який збагачений холестериловим ефіром (ХЕ); ліпопротеїн високої щільності (ЛВЩ), який також збагачений холестериловим ефіром (ХЕ); і ліпопротеїн дуже низької щільності (ЛДНЩ), який збагачений тригліцеридом (ТГ). Різні ліпопротеїни можна розділити за допомогою флотації, заснованої на розходженнях їх щільностей або розмірів. Високі концентрації ЛНЩ-холестерину (ЛНЩ-Х) і тригліцеридів позитивно корелюють, а високі концентрації ЛВЩ-холестерину (ЛВЩ-Х) негативно корелюють з ризиком розвитку серцево-судинних захворювань. Відсутні повністю задовільні терапевтичні засоби, що приводять до підвищення концентрації ЛВЩ. Ніацин може значно підвищити концентрацію ЛВЩ, але він погано переноситься, що погіршує дотримання режиму лікування. Фібрати та інгібітори HMG СоА редуктази приводять лише до помірного підвищення концентрації ЛВЩ (10-12 %). Внаслідок цього для медицини все ще необхідний добре переносимий засіб, що може значно підвищити концентрацію ЛВЩ у плазмі. Таким чином, засоби, що підвищують концентрацію ЛВЩ холестерину, можна застосовувати як лікарські засоби для лікування і/або профілактики атеросклерозу, захворювання периферичних судин, дисліпідемії, гіпербеталіпопротеїнемії, гіпоальфаліпопротеїнемії, гіперхолестеринемії, гіпертригліцеридемії, сімейної гіперхолестеринемії, серцево-судинних порушень, стенокардії, ішемії, ішемічної хвороби серця, удару, інфаркту міокарда, реперфузійного ураження, рестенозу після ангіопластики, гіпертензії та судинних ускладнень діабету, ожиріння або ендотоксикозу. Крім того, засоби, що підвищують концентрацію ЛВЩ холестерину, можна використовувати у комбінації з іншою сполукою, де така сполука являє собою інгібітор HMG-CoA редуктази, інгібітор мікросомного білка-переносника тригліцеридів (МТР)/секреції АроВ, активатор PPAR, інгібітор повторного поглинання жовчних кислот, інгібітор білка-переносника холестерилового ефіру (СЕТР), інгібітор поглинання холестерину, інгібітор синтезу холестерину, фібрат, ніацин, препарати, що містять ніацин або інші агоністи НМ74а, іонообмінну смолу, антиоксидант, інгібітор АСАТ або речовину, що підсилює екскрецію жовчних кислот. Тому об'єктом даного винаходу є одержання сполуки, яка є активним засобом, що підвищує концентрацію ЛВЩ холестерину. Відповідно до винаходу було встановлено, що сполука формули І, запропонована у даному винаході, є особливо придатною для лікування і/або профілактики захворювань, які можна лікувати засобами, що підвищують концентрацію ЛВЩ холестерину, тобто сполука формули І є особливо придатною для лікування і/або попередження дисліпідемії, атеросклерозу та серцево-судинних захворювань. Об'єктом даного винаходу також є одержання сполуки, яка у терапевтично активних концентраціях, які підвищують концентрації ЛВЩ, не взаємодіє з рецептором СВ1. Це обумовлено тим, що ліганди рецептора СВ1 можуть погіршувати терапевтичну застосовність засобів, які підвищують концентрацію ЛВЩ холестерину, оскільки і агоністи, і антагоністи рецептора СВ1, можуть привести до побічних ефектів. Сполуки зі загальними структурними елементами розкриті як антагоністи рецептора СВ1 (WO2006/106054) і змішані антагоністи рецептора СВІ/засобів, що підвищують концентрацію ЛВЩ холестерину (WO2008/040651). 1 UA 107088 C2 5 10 15 20 25 30 35 40 45 Якщо не зазначене інше, наведені нижче визначення призначені для ілюстрації та визначення значення й об'єму різних термінів, що використовуються для опису даного винаходу. "Ізомерними формами" є всі форми сполуки, які мають ідентичні молекулярні формули, але різняться за природою або послідовністю зв'язування своїх атомів або за розташуванням своїх атомів у просторі. Переважно, якщо ізомерні форми різняться за розташуванням своїх атомів у просторі та їх також можна назвати "стереоізомерами". Стереоізомери, які не є дзеркальними відображеннями один одного, називаються "діастереоізомерами" і стереоізомери, які не накладаються один на одного дзеркальними відображеннями, називаються "енантіомерами", а іноді й оптичними ізомерами. Атом вуглецю, що має чотири різні замісники, називається "хіральним центром". Термін "фармацевтично прийнятні солі" означає такі солі, які зберігають біологічну ефективність та характеристики вільних основ або вільних кислот і які не є небажаними у біологічному або іншому відношенні. Ці солі утворюються з неорганічними кислотами, такими як хлористоводнева кислота, бромистоводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота тощо, переважно хлористоводнева кислота, і органічними кислотами, такими як мурашина кислота, оцтова кислота, пропіонова кислота, гліколева кислота, піровиноградна кислота, щавлева кислота, малеїнова кислота, малонова кислота, саліцилова кислота, бурштинова кислота, фумарова кислота, винна кислота, лимонна кислота, бензойна кислота, корична кислота, мигдальна кислота, метансульфонова кислота, етансульфонова кислота, п-толуолсульфонова кислота, саліцилова кислота, N-ацетилцистеїн тощо. Таким чином, кращі "фармацевтично прийнятні солі" включають ацетат, бромід, хлорид, форміат, фумарат, малеат, мезилат, нітрат, оксалат, фосфат, сульфат, тартрат і тозилат сполук формули І. Крім того, фармацевтично прийнятні солі можна одержати шляхом додавання неорганічної основи або органічної основи до вільної кислоти. Солі, утворені з неорганічної основи, включають, але не обмежуються тільки ними, солі натрію, калію, літію, амонію, кальцію, магнію тощо. Солі, утворені з органічних основ, включають, але не обмежуються тільки ними, солі первинних, вторинних і третинних амінів, заміщених амінів, включаючи природні заміщені аміни, циклічні аміни та основні іонообмінні смоли, такі як ізопропіламін, триметиламін, діетиламін, триетиламін, трипропіламін, етаноламін, діетиламін, лізин, аргінін, N-етилпіперидин, піперидин, піперазин тощо. Сполука формули І також може міститися у формі цвітеріонів або у формі гідратів. Особливо кращими фармацевтично прийнятними солями сполук формули І є гідрохлориди. Кращим об'єктом даного винаходу є 5-(3,4-дихлорфеніл)-N-((1R,2R)-2-гідроксициклогексил)6-(2,2,2-трифторетокси)-нікотинамід, тобто сполука формули І в ізомерній формі Іа. Даний винахід також відноситься до 5-(3,4-дихлорфеніл)-N-((1R,2R)-2-гідроксициклогексил)6-(2,2,2-трифторетокси)нікотинаміду та її фармацевтично прийнятним солям. Іншим кращим об'єктом даного винаходу є 5-(3,4-дихлорфеніл)-N-((1R,2R)-2гідроксициклогексил)-6-(2,2,2-трифторетокси)-нікотинамід, тобто сполука формули І в ізомерній формі Іb. Даний винахід також відноситься до 5-(3,4-дихлорфеніл)-N-((1S,2R)-2-гідроксициклогексил)6-(2,2,2-трифторетокси)нікотинаміду та її фармацевтично прийнятним солям. Сполуку формули І можна одержати способом, що включає введення у реакцію сполучення сполуки формули 2 UA 107088 C2 , в якій X означає галоген, з арилом формули, що містить метал 5 10 15 20 25 30 35 в якій Μ означає боронову кислоту або складний ефір боронової кислоти, у присутності каталізатора, що містить Pd, у лужному середовищі, і необов'язковий поділ ізомерів на хіральній колонці ВЕРХ, і якщо необхідно, перетворення отриманої сполуки формули І в її фармацевтично прийнятну сіль. Арил, що містить метал, переважно являє собою арилборонову кислоту або складний ефір арилборонової кислоти. Каталізатор, що містить паладій, переважно являє собою суміш ацетат паладію(ll)/трифенілфосфін або комплекс хлорид паладію(ІІ)-dppf, який використовують у присутності основи, переважно триетиламіну або карбонату натрію. X означає галоген, більше переважно якщо X означає бром або йод. Синтез сполук загальної структури І можна провести за наведеними нижче схемами 1 і 2. За методикою, представленою на схемі 1, сполука АА (5-бром-6-хлор-3-піридинкарбонова кислота, CAS RN 29241-62-1) можна використовувати як вихідну речовину. Сполука АА є у продажу або її альтернативно можна одержати за допомогою послідовності декількох реакцій з 6-гідрокси-3-піридинкарбонової кислоти за описаними у літературі методиками. Сполуку АС можна одержати зі сполуки АА за реакцією з придатним заміщеним первинним або вторинним спиртом формули АВ у присутності основи, наприклад гідроксиду калію, в інертному розчиннику, наприклад диметилсульфоксиді, при температурах від кімнатної температури до температури кипіння розчинника, переважно при кімнатній температурі. Сполуку АЕ можна одержати за реакцією сполучення АС з відповідним аміном формули AD за допомогою придатних реакцій утворення амідного зв'язку. Ці реакції відомі у даній галузі техніки. Наприклад, для проведення такого перетворення можна використовувати реагенти сполучення, такі як Ν,Ν'-карбонілдіімідазол (CDI), Ν,Ν'-дициклогексилкарбодіімід (DCC), 1-(3диметиламінопропіл)-3-етилкарбодіімідгідрохлорид (EDCI), 1-[біс(диметиламіно)-метилен]-1Н1,2,3-триазоло[4,5-b]піридиній-3-оксид гексафторфосфат (HATU), 1-гідрокси-1,2,3-бензотриазол (НОВТ) і О-бензотриазол-1-іл-N,N,N',N'-тетраметилуронійтетрафторборат (TBTU). Звичайною методикою є використання, наприклад, TBTU та основи, наприклад основи Хюніга (Nетилдіізопропіламін) в інертному розчиннику, такому як наприклад, диметилформамід, при кімнатній температурі. На наступній стадії сполуки формули І одержують за реакцією сполучення придатного заміщеного арилу формули AF, що містить метал, переважно арилборонової кислоти або складного ефіру арилборонової кислоти, з АЕ у присутності придатного каталізатора, переважно каталізатора, що містить паладій, та більше переважно сумішей ацетат паладію(ІІ)/трифенілфосфін або комплексів хлорид паладію(ІІ)-dppf (1,1'біс(дифенілфосфіно)фероцен) та основи, переважно триетиламіну або карбонату натрію в інертному розчиннику, такому як диметилформамід або толуол. 40 3 UA 107088 C2 5 10 Сполуки формули АЕ або сполуки І, які одержують у відповідності зі схемою 1, залежно від природи аміну AD можуть містити один або більшу кількість хіральних центрів. Хіральні сполуки АЕ-хіральний або І-хіральний можна одержати за різними методиками, відомими у даній галузі техніки, таким як синтез із хіральних попередників або методики хірального поділу. Хіральний поділ на хіральних колонках ВЕРХ переважно проводити для сполуки, яка краще розчинна у рухливій фазі. Сполуки формули АЕ звичайно розчинні у сумішах гептан/спирт краще, ніж сполуки формули І. Виділення сполук АЕ-хіральний 1 і АЕ-хіральний 2 з АЕ-рацемічного можна провести у відповідності зі схемою 2 з використанням придатної хіральної колонки ВЕРХ, такої як ChiralPak AD® або використовуючих аналогічні нерухомі фази у періодичному режимі або за технологією псевдозрідженого шару з використанням придатних рухомих фаз, таких як суміші гептан/ізопропанол. 15 20 25 Як відзначено вище, сполуки формули І, запропоновані у даному винаході, можна застосовувати як лікарські засоби для лікування і/або профілактики захворювань, які можна лікувати засобами, що підвищують концентрацію ЛВЩ холестерину. Прикладами таких захворювань є атеросклероз, захворювання периферичних судин, дисліпідемія, гіпербеталіпопротеїнемія, гіпоальфаліпопротеїнемія, гіперхолестеринемія, гіпертригліцеридемія, сімейна гіперхолестеринемія, серцево-судинні захворювання, такі як стенокардія, ішемія, ішемічна хвороба серця, удар, інфаркт міокарда, реперфузійне ураження, рестеноз після ангіопластики, гіпертензія та судинні ускладнення діабету, ожиріння або ендотоксикоз. Кращим є застосування як лікарський засіб для лікування і/або попередження дисліпідемії, атеросклерозу та серцево-судинних захворювань. Тому даний винахід також відноситься до фармацевтичних композицій, що включають сполуку, визначену вище, і фармацевтично прийнятний носій і/або допоміжну речовину, які 4 UA 107088 C2 5 10 15 20 25 30 35 40 45 50 55 60 застосовні для лікування і/або профілактики захворювань, які можна лікувати засобами, що підвищують концентрацію ЛВЩ холестерину. Таким чином, даний винахід відноситься до фармацевтичної композиції, визначеної вище, призначеної для лікування і/або профілактики атеросклерозу, захворювання периферичних судин, дисліпідемії, гіпербеталіпопротеїнемії, гіпоальфаліпопротеїнемії, гіперхолестеринемії, гіпертригліцеридемії, сімейної гіперхолестеринемії, серцево-судинних захворювань, таких як стенокардія, ішемія, ішемічна хвороба серця, удар, інфаркт міокарда, реперфузійне ураження, рестеноз після ангіопластики, гіпертензія та судинні ускладнення діабету, ожиріння або ендотоксикозу. В іншому варіанті здійснення даний винахід відноситься до способу лікування і/або профілактики захворювань, які можна лікувати засобами, що підвищують концентрацію ЛВЩ холестерину, спосіб включає введення пацієнтові, що потребує нього, сполуки формули І у терапевтично ефективній кількості. Прикладами таких захворювань є атеросклероз, захворювання периферичних судин, дисліпідемія, гіпербеталіпопротеїнемія, гіпоальфаліпопротеїнемія, гіперхолестеринемія, гіпертригліцеридемія, сімейна гіперхолестеринемія, серцево-судинні захворювання, такі як стенокардія, ішемія, ішемічна хвороба серця, удар, інфаркт міокарда, реперфузійне ураження, рестеноз після ангіопластики, гіпертензія та судинні ускладнення діабету, ожиріння або ендотоксикоз. Кращим є спосіб лікування і/або профілактики дисліпідемії, атеросклерозу та серцево-судинних захворювань. Крім того, даний винахід відноситься до застосування сполук формули І, визначених вище, для готування лікарського засобу, призначеного для лікування і/або профілактики захворювань, які можна лікувати засобами, що підвищують концентрацію ЛВЩ. Прикладами таких захворювань є атеросклероз, захворювання периферичних судин, дисліпідемія, гіпербеталіпопротеїнемія, гіпоальфаліпопротеїнемія, гіперхолестеринемія, гіпертригліцеридемія, сімейна гіперхолестеринемія, серцево-судинні порушення, такі як стенокардія, ішемія, ішемічна хвороба серця, удар, інфаркт міокарда, реперфузійне ураження, рестеноз після ангіопластики, гіпертензія та судинні ускладнення діабету, ожиріння або ендотоксикоз. Кращим є застосування сполук формули І, визначених вище, для готування лікарських засобів, призначених для лікування і/або профілактики дисліпідемії, атеросклерозу та серцево-судинних захворювань. Крім того, засоби, що підвищують концентрацію ЛВЩ, формули І застосовні у комбінації або разом з іншою сполукою, де така сполука вибрана з групи, що включає інгібітор HMG-CoA редуктази, інгібітор мікросомного білка-переносника тригліцеридів (МТР)/секреції АроВ, активатор PPAR, інгібітор білка-переносника холестерилового ефіру (СЕТР), інгібітор повторного поглинання жовчних кислот, інгібітор поглинання холестерину, інгібітор синтезу холестерину, фібрат, ніацин, препарат, що містить ніацин або інші агоністи НМ74а, іонообмінну смолу, антиоксидант, інгібітор АСАТ або речовину, що підсилює екскрецію жовчних кислот. Тому даний винахід також відноситься до фармацевтичної композиції, що містить сполуку формули І, визначену вище, у комбінації або разом зі сполукою, вибраною з групи, що включає інгібітор HMG-CoA редуктази, інгібітор мікросомного білка-переносника тригліцеридів (МТР)/секреції АроВ, активатор PPAR, інгібітор білка-переносника холестерилового ефіру (СЕТР), інгібітор повторного поглинання жовчних кислот, інгібітор поглинання холестерину, інгібітор синтезу холестерину, фібрат, ніацин, препарат, що містить ніацин або інші агоністи НМ74а, іонообмінну смолу, антиоксидант, інгібітор АСАТ або речовину, що підсилює екскрецію жовчних кислот, а також фармацевтично прийнятний носій і/або допоміжну речовину. Даний винахід також відноситься до застосування сполук формули І, визначених вище, у комбінації або разом зі сполукою, вибраною з групи, що включає інгібітор HMG-CoA редуктази, інгібітор мікросомного білка-переносника тригліцеридів (МТР)/секреції АроВ, активатор PPAR, інгібітор білка-переносника холестерилового ефіру (СЕТР), інгібітор повторного поглинання жовчних кислот, інгібітор поглинання холестерину, інгібітор синтезу холестерину, фібрат, ніацин, препарат, що містить ніацин або інші агоністи НМ74а, іонообмінну смолу, антиоксидант, інгібітор АСАТ або речовину, що підсилює екскрецію жовчних кислот, для готування лікарського засобу, призначеного для лікування і/або профілактики захворювань, таких як атеросклероз, захворювання периферичних судин, дисліпідемія, гіпербеталіпопротеїнемія, гіпоальфаліпопротеїнемія, гіперхолестеринемія, гіпертригліцеридемія, сімейна гіперхолестеринемія, серцево-судинні порушення, стенокардія, ішемія, ішемічна хвороба серця, удар, інфаркт міокарда, реперфузійне ураження, рестеноз після ангіопластики, гіпертензія та судинні ускладнення діабету, ожиріння або ендотоксикоз. Даний винахід також відноситься до способу лікування і/або профілактики захворювань, які можна лікувати засобами, що підвищують концентрацію ЛВЩ холестерину, що включає 5 UA 107088 C2 5 10 15 20 25 30 35 40 45 50 55 60 введення сполуки формули І у терапевтично ефективній кількості у комбінації або разом із терапевтично ефективною кількістю сполуки, вибраної з групи, що включає інгібітор HMG-CoA редуктази, інгібітор мікросомного білка-переносника тригліцеридів (МТР)/секреції АроВ, активатор PPAR, інгібітор білка-переносника холестерилового ефіру (СЕТР), інгібітор повторного поглинання жовчних кислот, інгібітор поглинання холестерину, інгібітор синтезу холестерину, фібрат, ніацин, препарат, що містить ніацин або інші агоністи НМ74а, іонообмінну смолу, антиоксидант, інгібітор АСАТ або речовину, що підсилює екскрецію жовчних кислот. Сполуки формули І і/або їх фармацевтично прийнятні солі можна використовувати у формі фармацевтичних композицій для ентерального, парентерального або місцевого введення. їх можна вводити, наприклад перорально, наприклад у формі таблеток, таблеток з покриттям, драже, капсул із твердого або м'якого желатину, розчинів, емульсій, суспензій, перорально, наприклад у порожнину рота, ректально, наприклад у формі супозиторіїв, парентерально, наприклад у формі розчинів для ін'єкції або розчинів для вливання, призначених для внутрішньом'язової, внутрішньовенної або підшкірної ін'єкції, або місцево, наприклад у формі мазей, кремів або масел. Кращим є пероральне введення. Готування фармацевтичних композицій можна проводити за технологіями, які відомі будьякому фахівцеві у даній галузі техніки, шляхом внесення описаних сполук формули І і/або їх фармацевтично прийнятних солей, необов'язково у комбінації з іншими терапевтично коштовними речовинами, у галенові препаративні форми разом із придатними нетоксичними, інертними, терапевтично сумісними твердими або рідкими носіями та при необхідності зі звичайними фармацевтичними допоміжними речовинами. Придатними носіями є не тільки неорганічні носії, але й органічні носії. Так, наприклад, лактозу, кукурудзяний крохмаль або його похідні, тальк, стеаринові кислоти або їх солі тощо можна використовувати як носії для таблеток, таблеток з покриттям, драже і капсул із твердого желатину. Для капсул з м'якого желатину придатними носіями є, наприклад, рослинні масла, воски, жири та напіврідкі й рідкі поліоли (однак залежно від природи активної речовини у випадку капсул з м'якого желатину носій може не знадобитися). Носіями, що підходять для готування розчинів і сиропів, є, наприклад, вода, поліоли, сахароза, інвертний цукор тощо. Носіями, що підходять для розчинів для ін'єкцій, є, наприклад, вода, спирти, поліоли, гліцерин і рослинні масла. Носіями, що підходять для супозиторіїв, є, наприклад, натуральні або затверділі масла, воски, жири, напіврідкі та рідкі поліоли. Носіями, що підходять для препаратів, призначених для місцевого застосування, є гліцериди, напівсинтетичні та синтетичні гліцериди, гідровані масла, рідкі воски, рідкі парафіни, рідкі жирні спирти, стерини, поліетиленгліколі та похідні целюлози. В якості фармацевтичних допоміжних речовин розглядаються звичайні стабілізатори, консерванти, змочуючі та емульгуючі агенти, агенти, що поліпшують консистенцію, агенти, що поліпшують смак, солі для регулювання осмотичного тиску, буферні речовини, солюбілізатори, барвники та агенти, що маскують, і антиоксиданти. Терапевтично ефективна кількість або дозування сполук формули І може мінятися у широких межах залежно від захворювання, що піддається лікуванню, віку та індивідуального стану пацієнта й шляху введення та, зрозуміло, у кожному конкретному випадку буде мінятися відповідно до індивідуальних потреб. Для дорослих пацієнтів розглядається добова доза, що становить приблизно від 1 до 100 мг, переважно приблизно від 1 до 50 мг. Залежно від тяжкості захворювання та точного фармакокінетичного профілю сполуку можна вводити у вигляді однієї або декількох дозованих одиниць на добу, наприклад, від 1 до 3 дозованих одиниць. Фармацевтичні композиції звичайно містять приблизно 1-100 мг, переважно 5-50 мг сполуки формули І. У наведених нижче прикладах описані дослідження, які проводили для визначення активності сполук формули І та особливо їх коштовних фармакологічних характеристик. Приклади МС = мас-спектрометрія; ЕУ = електронний удар; lOР = іонне розпилення, відповідає ІЕР (електророзпилення); дані ЯМР наведені у частинах на мільйон (δ) щодо внутрішнього стандарту тетраметилсилану та для порівняння використаний сигнал дейтерію розчинника (d6ДМСО якщо не зазначене інше); константи спін-спінової взаємодії (J) наведені у герцах, tпл = температура плавлення; tкип = температура кипіння; ВЕРХ = РХ = високоефективна рідинна хроматографія, Rt = час утримання, ТШХ = тонкошарова хроматографія, КТ = кімнатна температура, TBTU = О-(бензотриазол-1-іл)-N,N',N'-тетраметилуронійтетрафторборат; ДМФ = диметилформамід, ДМСО = диметилсульфоксид, ТГФ = тетрагідрофуран, CAN = реєстраційний номер СAS. Приклад 1 6 UA 107088 C2 5 10 Вплив на концентрацію ліпідів у плазмі у хом'яків Ефективність сполук для модулювання концентрації ліпідів у плазмі визначали у хом'яків після 5 днів щоденного введення сполук. У всіх дослідженнях використовували самців хом'яків у віці 6-8 тижнів. Після тижневої акліматизації у тварин після 4-годинного голодування відбирали проби крові для визначення концентрації ліпідів у плазмі. Потім тварин розподіляли на групи на підставі значень концентрації ЛВЩ холестерину. Сполуки вводили через шлунковий зонд один раз на день протягом 5 днів. Контрольним тваринам вводили тільки розріджувач. Для визначення концентрації ліпідів у плазмі проби крові у хом'яків відбирали на п'ятий день після 4годинного голодування через 2 години після введення останньої дози. Загальний холестерин, ЛВЩ холестерин, ЛНЩ холестерин і тригліцериди визначали за допомогою колориметричних ферментних аналізів (Roche Diagnostic GmbH, Mannheim, Germany). ЛВЩ холестерин також визначали після селективного осадження ЛВЩ з плазми, проведеного за стандартними методиками. 15 20 25 30 35 Приклад 2 Спорідненість до рецепторів СВ1 і СВ2 Спорідненість сполук, запропонованих у даному винаході, до канабіноїдних рецепторів визначали з використанням препаратів мембран клітин нирок ембріона людини (НЕЛ), в які канабіноїдний рецептор СВ1 людини тимчасово трансфікований з використанням системи вірусу лихоманки лісу Семліки разом із [3Н]-СР-55,940 в якості радіоліганду. Після інкубації свіжевиготовленого препарату мембран клітин із лігандом [3Н] з додаванням або без додавання сполук, запропонованих у даному винаході, поділ зв'язаного та вільного лігандів проводили фільтруванням через скловолоконні фільтри. Радіоактивність фільтра вимірювали за сцинтиляційною методикою. Спорідненість сполук, запропонованих у даному винаході, до канабіноїдних рецепторів СВ2 визначали з використанням препаратів мембран клітин нирок ембріона людини (НЕЛ), в які канабіноїдний рецептор СВ2 людини тимчасово трансфікований з використанням системи вірусу лихоманки лісу Семліки разом із [3Н]-СР-55,940 в якості радіоліганду. Після інкубації свіжевиготовленого препарату мембран клітин із лігандом [3Н] з додаванням або без додавання сполук, запропонованих у даному винаході, поділ зв'язаного та вільного лігандів проводили фільтруванням через скловолоконні фільтри. Радіоактивність фільтра вимірювали за сцинтиляційною методикою. Значення Кi розраховували за значеннями ІС50 за рівнянням Чена-Прусова. 7 UA 107088 C2 5 10 15 20 25 30 35 Приклад 3 Одержання трифторетокси)нікотинаміду 5-(3,4-дихлорфеніл)-N-((1R,2R)-2-гідроксициклогексил)-6-(2,2,2 а) 5-Бром-6-(2,2,2-трифторетокси)нікотинова кислота 5-Бром-6-хлор-3-піридинкарбонову кислоту (68,0 г, 0,288 моля, CAN 29241-62-1) розчиняли у ДМСО (1000 мл). До цього розчину при перемішуванні додавали гідроксид калію (48,25 г, 0,86 моля) і після 10 хв перемішування при кімнатній температурі додавали 2,2,2-трифторетанол (26,9 мол, 0,374 моля). Суміш перемішували при кімнатній температурі протягом 24 год. Додавали воду (1000 мл) і концентровану хлористоводневу кислоту (107 мл, 1280 ммоля, 37 %) і суспензію енергійно перемішували протягом 4 год. Осад фільтрували, промивали водою (4 × 100 мл) і сушили у вакуумі протягом ночі та одержували шукану сполуку (80,4 г) у вигляді майже + білої твердої речовини; МС (ЕУ) 299, 301 (М) . b) 5-Бром-N-((1R,2R)-2-гідроксициклогексил)-6-(2,2,2-трифторетокси)-нікотинамід 5-Бром-6-(2,2,2-трифторетокси)-нікотинову кислоту (50,0 г, 0,166 моля) розчиняли у ДМФ (600 мл). До розчину додавали TBTU (58,9 г, 0,183 моля), Ν,Ν-діізопропілетиламін (142,6 мл, 0,83 моля) і (1R,2R)-2-аміноциклогексанол (21,1 г, 0,183 моля). Реакційну суміш перемішували протягом 3 год. при кімнатній температурі. Розчинник випарювали у вакуумі, залишок розчиняли у суміші етилацетату (1200 мл) і ТГФ (300 мол). Розчин двічі промивали водою (700 мл) і водні фази екстрагували етилацетатом (600 мл). Органічні фази поєднували, сушили над MgSO4 і концентрували до об'єму, рівного приблизно 900 мл. При перемішуванні та охолодженні до 0 °C осаджувався продукт. Фільтрування, промивання сумішшю етилацетат/н-гептан (1:1) і сушіння у + вакуумі давали шукану сполуку (53,1 г) у вигляді білої твердої речовини; МС (ЮР) 397, 399 (М) . c) 5-(3,4-Дихлорфеніл)-N-((1R,2R)-2-гідроксициклогексил)-6-(2,2,2трифторетокси)нікотинамід 5-Бром-N-((1R,2R)-2-гідроксициклогексил)-6-(2,2,2-трифторетокси)-нікотинамід (59,8 г, 151 ммоля) розчиняли у толуолі (2500 мл) і ДМФ (200 мл). До цього розчину при перемішуванні додавали [1,1'-біс(дифенілфосфіно) фероцен]дихлорпаладій(ll) СН2СІ2 (6,15 г, 7,5 ммоля), 3,4дихлорфенілборонову кислоту (30,2 г, 158 ммоля) і розчин карбонату натрію (2М, 150 мл). Цю суміш нагрівали при 90 °C протягом 2 год., охолоджували до кімнатної температури та фільтрували через діатомову землю. Осад на фільтрі ретельно промивали етилацетатом (3000 мл). Фільтрати поєднували, двічі промивали водою (2 × 2000 мл) і водні фази екстрагували етилацетатом (2 × 1500 мл). Органічні фази поєднували, сушили над MgSO4 і летучі речовини видаляли у вакуумі. Залишок очищали фільтруванням через діоксид кремнію (500 г) з промиванням етилацетатом. Розчинник видаляли та залишок розтирали з діетиловим ефіром і 8 UA 107088 C2 5 10 15 20 25 30 35 40 одержували після сушіння у вакуумі шукану сполуку (45,6 г) у вигляді сіруватої твердої + речовини; МС 463,079, 465,077 (М+Н) . Приклад 4 Одержання 5-(3,4-дихлорфеніл)-N-((1S,2R)-2-гідроксициклогексил)-6-(2,2,2трифторетокси)нікотинаміду a) 5-Бром-N-((1SR,2RS)-2-гідроксициклогексил)-6-(2,2,2-трифторетокси)-нікотинамід 5-Бром-6-(2,2,2-трифторетокси)нікотинову кислоту (75,0 г, 0,25 моля) розчиняли у ДМФ (850 мл). До розчину додавали TBTU (91,0 г, 0,275 моля), Ν,Ν-діізопропілетиламін (214 мл, 1,25 моля) і (1SR, 2RS)-2-аміноциклогексанолгідрохлорид (41,7 г, 0,275 моля). Реакційну суміш перемішували протягом 1,5 год. при кімнатній температурі. Розчинник випарювали у вакуумі, залишок піддавали розподілу між етилацетатом (2500 мл) і 1 н. розчином гідроксиду натрію (2000 мл), водну фазу відокремлювали, ще раз екстрагували етилацетатом (1000 мл) і органічні фази 2 рази промивали водою (2 × 1500 мл). Органічні фази поєднували, сушили над MgSO4 і концентрували до об'єму, рівного приблизно 900 мл. При перемішуванні та охолодженні до 0 °C осаджувався продукт. Фільтрування, промивання сумішшю етилацетат/н-гептан (1:1) і сушіння у + вакуумі давала шукану сполуку (81,1 г) у вигляді білої твердої речовини; МС (IOР) 397, 399 (М) . b) 5-Бром-N-((1S,2R)-2-гідроксициклогексил)-6-(2,2,2-трифторетокси)-нікотинамід 5-Бром-N-((1SR,2RS)-2-гідроксициклогексил)-6-(2,2,2-трифторетокси)-нікотинамід (91,3 г, 0,23 моля) обробляли за допомогою препаративної ВЕРХ на колонці ChiralPak AD® (колонка 250 × 110 мм) з використанням суміші н-гептан/ізопропанол 85/15 як рухома фаза. Забезпечувався основний поділ і шукану сполуку (43,6 г) виділяли у вигляді безбарвної твердої речовини з фракції, що відповідає першому піку; МС (IOР) 395,2, 397,2 (М-Н); дисперсія оптичного обертання (589 нМ, 20 °C, СНСl3) -21,6°. с) 5-(3,4-Дихлорфеніл)-N-((1S,2R)-2-гідроксициклогексил)-6-(2,2,2трифторетокси)нікотинамід 5-Бром-N-((1S,2R)-2-гідроксициклогексил)-6-(2,2,2-трифторетокси)-нікотинамід (42,0 г, 106 ммоля) розчиняли у толуолі (1900 мл) і ДМФ (100 мл). До цього розчину при перемішуванні додавали [1,1'-біс(дифенілфосфіно) фероцен]-дихлорпаладій(ІІ) СН2СІ2 (0,9 г, 1,06 ммоля), 3,4дихлорфенілборонову кислоту (20,2 г, 106 ммоля) і розчин карбонату натрію (2М, 106 мл). Цю суміш нагрівали при 90 °C протягом 2 год., охолоджували до кімнатної температури та піддавали розподілу між етилацетатом (1000 мл) і водою (2000 мл), водну фазу відокремлювали, ще двічі екстрагували етилацетатом (2 × 1000 мл) і органічні фази промивали один раз водою та один раз розсолом (по 1000 мл кожного). Органічні фази поєднували, сушили над MgSO4 і летучі речовини видаляли у вакуумі. Залишок розчиняли у діетиловому ефірі (500 мл) і фільтрували через діатомову землю. Шукана сполука осаджувалася при проведеному по краплях додаванні н-гептану (500 мл) до розчину у діетиловому ефірі, її відфільтровували та сушили у вакуумі й одержували 33,3 г шуканої сполуки у вигляді майже білої твердої речовини; МС 463,079 (М+Н). Приклад 5 Таблетки з плівковим покриттям, що містять зазначені нижче інгредієнти, можна приготувати звичайним чином: 9 UA 107088 C2 5 10 15 20 Активний інгредієнт просівають і змішують з мікрокристалічною целюлозою та суміш гранулюють з використанням водного розчину полівінілпіролідону. Потім гранулят змішують з натрієвою сіллю гліколяту крохмалю та стеаратом магнію та пресують і одержують ядра масою 120 або 350 мг відповідно. Ядра лакують водним розчином/суспензією зазначеного вище плівкового покриття. Приклад 6 Капсули, що містять зазначені нижче інгредієнти, можна приготувати звичайним способом: Компоненти просівають і змішують і поміщають у капсули розміру 2. Приклад 7 Розчини для ін'єкції можуть мати наступний склад: Активний інгредієнт розчиняють у суміші поліетиленгліколю 400 і води для ін'єкції (частина). Значення рН встановлюють рівним 5,0 шляхом додавання оцтової кислоти. Об'єм доводять до 1,0 мл шляхом додавання кількості води, що залишилася. Розчин фільтрують, поміщають у флакони з відповідним надлишком і стерилізують. 25 10 UA 107088 C2 ФОРМУЛА ВИНАХОДУ 1. Сполука формули Cl Cl O N H F OH F O N F 5 10 15 20 25 I та її ізомерні форми й фармацевтично прийнятні солі. 2. Сполука формули І за п. 1, що являє собою 5-(3,4-дихлорфеніл)-N-((1R,2R)-2гідроксициклогексил)-6-(2,2,2-трифторетокси)-нікотинамід. 3. Сполука формули І за п. 1, що являє собою 5-(3,4-дихлорфеніл)-N-((1S,2R)-2гідроксициклогексил)-6-(2,2,2-трифторетокси)-нікотинамід. 4. Фармацевтична композиція, що містить сполуку формули І за будь-яким із пп. 1-3 та фармацевтично прийнятний носій і/або допоміжну речовину. 5. Фармацевтична композиція за п. 4, призначена для лікування і/або профілактики захворювань, які можна лікувати засобами, що підвищують концентрацію ЛВЩ холестерину. 6. Сполука формули І за будь-яким із пп. 1-3, призначена для застосування як лікарського засобу. 7. Сполука формули І за п. 6, призначена для застосування як лікарського засобу для лікування і/або профілактики атеросклерозу, захворювання периферичних судин, дисліпідемії, гіпербеталіпопротеїнемії, гіпоальфаліпопротеїнемії, гіперхолестеринемії, гіпертригліцеридемії, сімейної гіперхолестеринемії, серцево-судинних захворювань, таких як стенокардія, ішемія, ішемічна хвороба серця, удар, інфаркт міокарда, реперфузійне ураження, рестеноз після ангіопластики, гіпертензія та судинні ускладнення діабету, ожиріння або ендотоксикозу. 8. Сполука формули І за п. 6, призначена для застосування як лікарського засобу для лікування і/або профілактики дисліпідемії. 9. Сполука формули І за п. 6, призначена для застосування як лікарського засобу для лікування і/або профілактики атеросклерозу. 10. Сполука формули І за п. 6, призначена для застосування як лікарського засобу для лікування і/або профілактики серцево-судинних захворювань. Комп’ютерна верстка Л. Бурлак Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 11
ДивитисяДодаткова інформація
Назва патенту англійською5-(3,4-dichloro-phenyl)-n-(2-hydroxy-cyclohexyl)-6-(2,2,2-trifluoro-ethoxy)-nico tinamide and salts thereof as hdl cholesterol raising agents
Автори англійськоюRoever, Stephan, Wright, Matthew
Автори російськоюРьофер Штэфан, Райт Метью
МПК / Мітки
МПК: A61K 31/465, A61P 3/06, C07D 213/82
Мітки: холестерину, 5-(3,4-дихлорфеніл)-n-(2-гідроксициклогексил)-6-(2,2,2-трифторетокси)нікотинамід, засоби, солі, концентрацію, підвищують, лвщ
Код посилання
<a href="https://ua.patents.su/13-107088-5-34-dikhlorfenil-n-2-gidroksiciklogeksil-6-222-triftoretoksinikotinamid-i-jjogo-soli-yak-zasobi-shho-pidvishhuyut-koncentraciyu-lvshh-kholesterinu.html" target="_blank" rel="follow" title="База патентів України">5-(3,4-дихлорфеніл)-n-(2-гідроксициклогексил)-6-(2,2,2-трифторетокси)нікотинамід і його солі як засоби, що підвищують концентрацію лвщ холестерину</a>
Попередній патент: Пристрій для монтажу дверної ручки
Наступний патент: Штами lactobacillus plantarum як гіпохолестеринемічні агенти
Випадковий патент: Спосіб імунореабілітації хворих на метаболічний синдром