Похідні 3-гетероарил-3,5-дигідро-4-оксо-4н-піридазино[4,5-b]індол-1-карбоксаміду, спосіб їх одержання (варіанти), фармацевтична композиція на їх основі, проміжна сполука (варіанти)
Номер патенту: 77984
Опубліковано: 15.02.2007
Автори: ФРУАССАН Жак, Марґе Франк, Пюеш Фредерік, Бюрньє Філіпп, МАРАБУ Бенуа
Формула / Реферат
1. Сполука загальної формули (І)
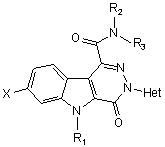 , (I)
, (I)
котра може існувати у формі основи, кислотно-адитивної солі, сольвату або гідрату, у котрій
Х - атом гідрогену чи галогену,
R1 - атом гідрогену або (С1-С4)алкіл,
R2 та R3, кожний незалежно, - атом гідрогену чи (С1-С4)алкіл, або R2 та R3 утворюють разом з атомом нітрогену, до котрого вони приєднані, піролідиніл, піперидиніл, морфолініл чи 4-алкілпіперазиніл, а
Het - гетероароматична група, а саме: піридиніл, 1-оксидопіридиніл, хінолініл, ізохінолініл, піримідиніл, піразиніл або піридазиніл, до цієї гетероароматичної групи може бути приєднано один або більше атомів галогену та/або один або більше (С1-С4)алкілів або (С1-С4)алкоксилів.
2. Сполука за п. 1, яка відрізняється тим, що Х - атом галогену;
R1 - (С1-С4)алкіл;
R2 та R3, кожний незалежно, - атом гідрогену або (С1-С4)алкіл, або R2 та R3 утворюють разом з атомом нітрогену, до котрого вони приєднані, піролідиніл, піперидиніл, морфолініл або 4-алкілпіперазиніл;
Het - гетероароматична група, а саме: піридиніл, хінолініл, ізохінолініл, піримідиніл, піразиніл або піридазиніл, до цієї гетероароматичної групи може бути приєднано один або більше атомів галогену та/або один або більше (С1-С4)алкілів або (С1-С4)алкоксилів.
3. Сполука за п. 1 або 2, яка відрізняється тим, що Х - атом хлору;
R1 - метил.
4. Сполука за п. 1, вибрана з наступних сполук;
7-флуор-N,N,5-триметил-4-оксо-3-(хінолін-3-іл)-3,5-дигідро-4Н-піридазино[4,5-b]індол-1-карбоксамід,
1-[[7-флуор-5-метил-3-(піридин-3-іл)-4-оксо-3,5-дигідро-4Н-піридазино[4,5-b]індол-1-іл]карбоніл]піролідин,
7-хлор-N,N,5-триметил-4-оксо-3-(2-метоксипіридин-5-іл)-3,5-дигідро-4Н-піридазино[4,5-b]індол-1-карбоксамід,
7-хлор-N,N,5-триметил-4-оксо-3-(2-бромпіридин-5-іл)-3,5-дигідро-4Н-піридазино[4,5-b]індол-1-карбоксамід,
7-хлор-N,N,5-триметил-4-оксо-3-(ізохінолін-4-іл)-3,5-дигідро-4Н-піридазино[4,5-b]індол-1-карбоксамід,
7-хлор-N,N,5-триметил-4-оксо-3-(піразин-2-іл)-3,5-дигідро-4Н-піридазино[4,5-b]індол-1-карбоксамід,
1-[[7-хлор-5-метил-3-(піридин-4-іл)-4-оксо-3,5-дигідро-4Н-піридазино[4,5-b]індол-1-іл]карбоніл]піперидин,
7-хлор-N,N,5-триметил-4-оксо-3-(2-метилпіридин-4-іл]-3,5-дигідро-4Н-піридазино[4,5-b]індол-1-карбоксамід,
1-[[7-хлор-5-метил-3-(2-метилпіридин-4-іл)-4-оксо-3,5-дигідро-4Н-піридазино[4,5-b]індол-1-іл]карбоніл]піролідин,
7-хлор-3-(2-метоксипіридин-4-іл)-N,N,5-триметил-4-оксо-3,5-дигідро-4Н-піридазино[4,5-b]індол-1-карбоксамід.
5. Сполука за п. 1, якою є 7-хлор-N,N,5-триметил-4-оксо-3-(2-метоксипіридин-5-іл)-3,5-дигідро-4Н-піридазино[4,5-b]індол-1-карбоксамід.
6. Спосіб отримання сполуки загальної формули (І)
 , (I)
, (I)
у котрій
Х - атом гідрогену чи галогену,
R1 - атом гідрогену або (С1-С4)алкіл,
R2 та R3, кожний незалежно, - атом гідрогену чи (С1-С4)алкіл, або R2 та R3 утворюють разом з атомом нітрогену, до котрого вони приєднані, піролідиніл, піперидиніл, морфолініл чи 4-алкілпіперазиніл, а
Het - гетероароматична група, а саме: піридиніл, 1-оксидопіридиніл, хінолініл, ізохінолініл, піримідиніл, піразиніл або піридазиніл, до цієї гетероароматичної групи може бути приєднано один або більше атомів галогену та/або один або більше (С1-С4)алкілів або (С1-С4)алкоксилів,
що має етап, який полягає у перетворенні естеру загальної формули (III)
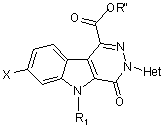 , (III)
, (III)
у котрій
X, R1 та Het визначені вище,
R"- (С1-С4)алкіл,
в амід вищенаведеної загальної формули (І)
реакцією з аміном загальної формули HNR2R3, у котрій R2 та R3 визначені вище,
або омиленням естеру загальної формули (III) у кислоту, а тоді сполученням отриманої кислоти з аміном загальної формули HNR2R3, у котрій R2 та R3 визначені вище.
7. Спосіб за п. 6, який відрізняється тим, що естер загальної формули (III)
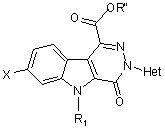 , (III)
, (III)
у котрій
R1, Het та R" визначені у п. 6,
отримують реакцією сполуки загальної формули (II)
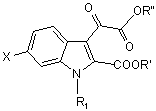 , (II)
, (II)
у котрій
X та R1 визначені у п. 6,
R' та R", кожний незалежно, - (С1-С4)алкіл,
з гетероарилгідразином у полярному розчиннику у присутності кислоти при температурі кипіння із зворотним холодильником.
8. Спосіб отримання сполуки загальної формули (І)
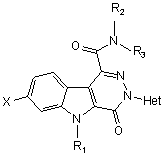 , (I)
, (I)
у котрій
Х - атом гідрогену чи галогену,
R1 - атом гідрогену або (С1-С4)алкіл,
R2 та R3, кожний незалежно, - атом гідрогену чи (С1-С4)алкіл, або R2 та R3 утворюють разом з атомом нітрогену, до котрого вони приєднані, піролідиніл, піперидиніл, морфолініл чи 4-алкілпіперазиніл, а
Het - гетероароматична група, а саме: піридиніл, 1-оксидопіридиніл, хінолініл, ізохінолініл, піримідиніл, піразиніл або піридазиніл, до цієї гетероароматичної групи може бути приєднано один або більше атомів галогену та/або один або більше (С1-С4)алкілів або (С1-С4)алкоксилів,
що має етап, який полягає у проведенні реакції N-гетероарилування аміду загальної формули(V)
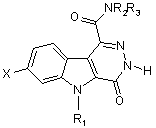 , (V)
, (V)
у котрій X, R1, R2 та R3 визначені вище.
9. Спосіб за п. 8, який відрізняється тим, що амід загальної формули (V)
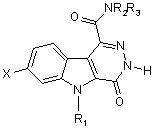 , (V)
, (V)
у котрій X, R1, R2 та R3 визначені у п. 8, отримують перетворенням естеру загальної формули (IV)
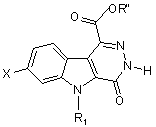 , (IV)
, (IV)
у котрій Х та R1 визначені у п. 8, a R" - (С1-С4)алкіл, реакцією з аміном загальної формули HNR2R3, у котрій R2 та R3 визначені у п. 8,
або омиленням естеру загальної формули (IV) у кислоту та тоді сполученням отриманої кислоти з аміном загальної формули HNR2R3, у котрій R2 та R3 визначені у п. 8.
10. Сполука загальної формули (II)
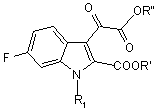 , (II)
, (II)
у котрій
R1 - атом гідрогену або (С1-С4)алкіл,
R' та R", кожний незалежно, - (С1-С4)алкіл.
11. Сполука загальної формули (ІІІ)
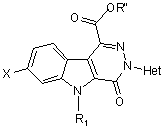 , (III)
, (III)
у котрій
X - атом гідрогену чи галогену,
R1 - атом гідрогену або (С1-С4)алкіл,
Het - гетероароматична група, а саме: піридиніл, 1-оксидопіридиніл, хінолініл, ізохінолініл, піримідиніл, піразиніл або піридазиніл, до цієї гетероароматичної групи може бути приєднано один або більше атомів галогену та/або один або більше (С1-С4)алкілів або (С1-С4)алкоксилів,
R"- (С1-С4)алкіл.
12. Сполука нижченаведеної загальної формули
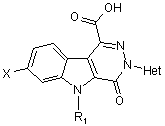 ,
,
у котрій
Х - атом гідрогену чи галогену,
R1 - атом гідрогену або (С1-С4)алкіл,
Het - гетероароматична група, а саме: піридиніл, 1-оксидопіридиніл, хінолініл, ізохінолініл, піримідиніл, піразиніл або піридазиніл, до цієї гетероароматичної групи може бути приєднано один або більше атомів галогену та/або один або більше (С1-С4)алкілів або (С1-С4)алкоксилів.
13. Сполука загальної формули (IV)
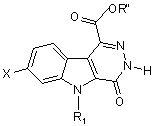 , (IV)
, (IV)
у котрій
X - атом гідрогену чи галогену,
R1 - атом гідрогену або (С1-С4)алкіл,
R"- (С1-С4)алкіл.
14. Сполука нижченаведеної загальної формули
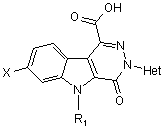
у котрій
Х - атом гідрогену чи галогену,
R1 - атом гідрогену або (С1-С4)алкіл.
15. Сполука загальної формули (V)
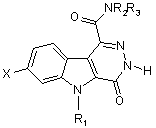 , (V)
, (V)
у котрій
Х - атом гідрогену чи галогену,
R1 - атом гідрогену або (С1-С4)алкіл,
R2 та R3, кожний незалежно, - атом гідрогену чи (С1-С4)алкіл, або R2 та R3 утворюють разом з атомом нітрогену, до котрого вони приєднані, піролідиніл, піперидиніл, морфолініл чи 4-алкілпіперазиніл.
16. Медикамент, який відрізняється тим, що містить сполуку за будь-яким з пп. 1-5.
17. Фармацевтична композиція, яка відрізняється тим, що містить принаймні одну сполуку за будь-яким з пп. 1-5, у формі основи, фармацевтично прийнятної солі, фармацевтично прийнятного сольвату або фармацевтично прийнятного гідрату, як варіант, у комбінації з одним або більше наповнювачами.
18. Застосування сполуки за пп. 1 - 5 в отриманні медикаменту для попередження або лікування периферійних невропатій, неврональних моторних станів, нейродегенеративних хвороб центральної нервової системи, тривожності, епілепсії, розладів сну, гострої або хронічної ниркової недостатності, гломерулонефриту, діабетичної нефропатії, серцевої ішемії та серцевої недостатності, інфаркту міокарда, ішемії нижніх кінцівок, коронарного вазоспазму, стенокардії, патологій, асоційованих з клапанами серця, запальних хвороб серця, побічної дії від кардіотоксичних медикаментів або в результаті хірургії серця, атеросклерозу та його тромбоемболічних ускладнень, рестенозу, відторгнення трансплантата, станів, пов'язаних з некоректною проліферацією або некоректною міграцією клітин гладких м'язів, пухлин та раку, впливів на шкіру, хронічних запальних хвороб, запальних хвороб легень.
Текст
1. Сполука загальної формули (І) 2 (19) 1 3 77984 4 карбоксамід, у котрій 7-хлор-N,N,5-триметил-4-оксо-3-(піразин-2-іл)-3,5R1, Het та R" визначені у п. 6, дигідро-4Н-піридазино[4,5-b]індол-1-карбоксамід, отримують реакцією сполуки загальної формули 1-[[7-хлор-5-метил-3-(піридин-4-іл)-4-оксо-3,5(II) O OR" дигідро-4Н-піридазино[4,5-b]індол-1іл]карбоніл]піперидин, O X 7-хлор-N,N,5-триметил-4-оксо-3-(2-метилпіридинCOOR' N 4-іл]-3,5-дигідро-4Н-піридазино[4,5-b]індол-1R , (II) карбоксамід, у котрій 1-[[7-хлор-5-метил-3-(2-метилпіридин-4-іл)-4-оксоX та R1 визначені у п. 6, 3,5-дигідро-4Н-піридазино[4,5-b]індол-1R' та R", кожний незалежно, - (С1-С4)алкіл, іл]карбоніл]піролідин, з гетероарилгідразином у полярному розчиннику у 7-хлор-3-(2-метоксипіридин-4-іл)-N,N,5-триметилприсутності кислоти при температурі кипіння із 4-оксо-3,5-дигідро-4Н-піридазино[4,5-b]індол-1зворотним холодильником. карбоксамід. 8. Спосіб отримання сполуки загальної форму5. Сполука за п. 1, якою є 7-хлор-N,N,5-триметилли (І) 4-оксо-3-(2-метоксипіридин-5-іл)-3,5-дигідро-4НR2 піридазино[4,5-b]індол-1-карбоксамід. N 6. Спосіб отримання сполуки загальної формуO R3 ли (І) N 1 R2 R3 N N O , (I) у котрій Х - атом гідрогену чи галогену, R1 - атом гідрогену або (С1-С4)алкіл, R2 та R3, кожний незалежно, - атом гідрогену чи (С1-С4)алкіл, або R2 та R3 утворюють разом з атомом нітрогену, до котрого вони приєднані, піролідиніл, піперидиніл, морфолініл чи 4алкілпіперазиніл, а Het - гетероароматична група, а саме: піридиніл, 1оксидопіридиніл, хінолініл, ізохінолініл, піримідиніл, піразиніл або піридазиніл, до цієї гетероароматичної групи може бути приєднано один або більше атомів галогену та/або один або більше (С1-С4)алкілів або (С1-С4)алкоксилів, що має етап, який полягає у перетворенні естеру загальної формули (III) R1 OR" O , (I) у котрій Х - атом гідрогену чи галогену, R1 - атом гідрогену або (С1-С4)алкіл, R2 та R3, кожний незалежно, - атом гідрогену чи (С1-С4)алкіл, або R2 та R3 утворюють разом з атомом нітрогену, до котрого вони приєднані, піролідиніл, піперидиніл, морфолініл чи 4алкілпіперазиніл, а Het - гетероароматична група, а саме: піридиніл, 1оксидопіридиніл, хінолініл, ізохінолініл, піримідиніл, піразиніл або піридазиніл, до цієї гетероароматичної групи може бути приєднано один або більше атомів галогену та/або один або більше (С1-С4)алкілів або (С1-С4)алкоксилів, що має етап, який полягає у проведенні реакції Nгетероарилування аміду загальної формули(V) O N N H N O R , (III) у котрій X, R1 та Het визначені вище, R"- (С1-С4)алкіл, в амід вищенаведеної загальної формули (І) реакцією з аміном загальної формули HNR2R3, у котрій R2 та R3 визначені вище, або омиленням естеру загальної формули (III) у кислоту, а тоді сполученням отриманої кислоти з аміном загальної формули HNR2R3, у котрій R2 та R3 визначені вище. 7. Спосіб за п. 6, який відрізняється тим, що естер загальної формули (III) 1 O OR " X N R1 , (V) у котрій X, R1, R2 та R3 визначені вище. 9. Спосіб за п. 8, який відрізняється тим, що амід загальної формули (V) NR2R 3 O N N H X N O R , (V) у котрій X, R1, R2 та R3 визначені у п. 8, отримують перетворенням естеру загальної формули (IV) 1 O Het O , (III) OR" N N X N H O , (IV) у котрій Х та R1 визначені у п. 8, a R" - (С1-С4)алкіл, реакцією з аміном загальної формули HNR2R3, у котрій R2 та R3 визначені у п. 8, або омиленням естеру загальної формули (IV) у R1 N N O R1 N Het N NR2R3 X N X O R1 N Het X N N Het X N O 5 77984 6 кислоту та тоді сполученням отриманої кислоти з R"- (С1-С4)алкіл. аміном загальної формули HNR2R3, у котрій R2 та 14. Сполука нижченаведеної загальної формули OH R3 визначені у п. 8. O 10. Сполука загальної формули (II) O N OR" N Het X F N N O COOR' , (II) R1 у котрій R1 - атом гідрогену або (С1-С4)алкіл, R' та R", кожний незалежно, - (С1-С4)алкіл. 11. Сполука загальної формули (ІІІ) O у котрій Х - атом гідрогену чи галогену, R1 - атом гідрогену або (С1-С4)алкіл. 15. Сполука загальної формули (V) O N N H N N N Het O , (III) у котрій X - атом гідрогену чи галогену, R1 - атом гідрогену або (С1-С4)алкіл, Het - гетероароматична група, а саме: піридиніл, 1оксидопіридиніл, хінолініл, ізохінолініл, піримідиніл, піразиніл або піридазиніл, до цієї гетероароматичної групи може бути приєднано один або більше атомів галогену та/або один або більше (С1-С4)алкілів або (С1-С4)алкоксилів, R"- (С1-С4)алкіл. 12. Сполука нижченаведеної загальної формули R1 O OH N N Het X N O , у котрій Х - атом гідрогену чи галогену, R1 - атом гідрогену або (С1-С4)алкіл, Het - гетероароматична група, а саме: піридиніл, 1оксидопіридиніл, хінолініл, ізохінолініл, піримідиніл, піразиніл або піридазиніл, до цієї гетероароматичної групи може бути приєднано один або більше атомів галогену та/або один або більше (С1-С4)алкілів або (С1-С4)алкоксилів. 13. Сполука загальної формули (IV) R1 O OR" N N X N NR2R 3 N OR" X X O R1 H O , (IV) у котрій X - атом гідрогену чи галогену, R1 - атом гідрогену або (С1-С4)алкіл, R1 Винахід стосується сполук, що є похідними 1гетероарил-3,5-дигідро-1-оксо-4Н-піридазино-[4,5b]індол-1-карбоксаміду. Відомо, що сполуки одержані з 3,5дигідропіридазино-[4,5-b] індолу і описані у доку O , (V) у котрій Х - атом гідрогену чи галогену, R1 - атом гідрогену або (С1-С4)алкіл, R2 та R3, кожний незалежно, - атом гідрогену чи (С1-С4)алкіл, або R2 та R3 утворюють разом з атомом нітрогену, до котрого вони приєднані, піролідиніл, піперидиніл, морфолініл чи 4алкілпіперазиніл. 16. Медикамент, який відрізняється тим, що містить сполуку за будь-яким з пп. 1-5. 17. Фармацевтична композиція, яка відрізняється тим, що містить принаймні одну сполуку за будьяким з пп. 1-5, у формі основи, фармацевтично прийнятної солі, фармацевтично прийнятного сольвату або фармацевтично прийнятного гідрату, як варіант, у комбінації з одним або більше наповнювачами. 18. Застосування сполуки за пп. 1 - 5 в отриманні медикаменту для попередження або лікування периферійних невропатій, неврональних моторних станів, нейродегенеративних хвороб центральної нервової системи, тривожності, епілепсії, розладів сну, гострої або хронічної ниркової недостатності, гломерулонефриту, діабетичної нефропатії, серцевої ішемії та серцевої недостатності, інфаркту міокарда, ішемії нижніх кінцівок, коронарного вазоспазму, стенокардії, патологій, асоційованих з клапанами серця, запальних хвороб серця, побічної дії від кардіотоксичних медикаментів або в результаті хір ургії серця, атеросклерозу та його тромбоемболічних ускладнень, рестенозу, відторгнення трансплантата, станів, пов'язаних з некоректною проліферацією або некоректною міграцією клітин гладких м'язів, пухлин та раку, впливів на шкіру, хронічних запальних хвороб, запальних хвороб легень. R1 менті WO-A-00/44751, мають in vitro спорідненість до рецепторів бензодіазепіну периферійного типу (РБП або р-сайти). Однак, існує потреба винайти і удосконалити продукти з високою активністю in vi vo. 7 77984 8 Задачею винаходу є створення нових сполук, іл)-3,5-дигідро-4Н-піридазино[4,5-b]індол-1які мають високу спорідненість до рецепторів бенкарбоксамід зодіазепіну периферійного типу in vitro і in vi vo. 2. 7-флуор-N,N,5-триметил-4-оксо-3-(піридинПершим об'єктом винаходу є сполуки загаль3-іл)-3,5-дигідро-4Н-піридазино[4,5-b]індол-1ної формули (І) (див. нижче). карбоксамід Іншим об'єктом винаходу є способи приготу3. 7-флуор-N,N,5-триметил-4-оксо-3-(піридинвання сполук загальної формули (І). 4-іл)-3,5-дигідро-4Н-піридазино[4,5-b]індол-1Ще одним об'єктом винаходу є сполуки, які карбоксамідгідрохлорид (1:1) можуть бути використані, зокрема, як інтер4. 7-флуор-N,N,5-триметил-4-оксо-3-(2медіати у синтезі сполук загальної формули (І). метоксипіридин-5-іл)-3,5-дигідро-4НОб'єктом винаходу є також сполуки загальної піридазино[4,5-b]індол-1-карбоксамід формули (І), зокрема, медикаменти або фармаце5. 7-флуор-N,N,5-триметил-4-оксо-3-(хінолін-3втичні композиції. іл)-3,5-дигідро-4Н-піридазино[4,5-b]індол-1Сполуки винаходу відповідають загальній фокарбоксамід рмулі (І): 6. 1-[[7-флуор-5-метил-3-(піримідин-2-іл)-4оксо-3,5-дигідро-4Н-піридазино[4,5-b]індол-1іл]карбоніл]-піролідин 7. 4-метил-1-[[7-флуор-5-метил-3-(піридин-3іл)-4-оксо-3,5-дигідро-4Н-піридазино[4,5-b]індол-1іл]карбоніл]піперазингідрохлорид (1:1) 8. 1-[[7-флуор-5-метил-3-(піридин-3-іл)-4-оксо3,5-дигідро-4Н-піридазино[4,5-b]індол-1-іл] карбоніл]піролідин у якій 9. 7-флуор-N,5-диметил-4-оксо-3-(піридин-3X - атом гідрогену або галогену, R1 - атом гіділ)-3,5-дигідро-4Н-піридазино-[4,5-b]індол-1рогену або (С1-С4)алкільна група, R2 і R3 кожна є, карбоксамід незалежно одна від одної, атомом гідрогену або 10. 7-флуор-5-метил-4-оксо-3-(піридин-3-іл)(С1-С4)алкільною групою, або R2 і R3 разом з ато3,5-дигідро-4Н-піридазино[4,5-b]індол-1мом нітрогену, який їх несе, утворюють піролідинікарбоксамід льну, піперидинільну, морфолінільну або 411. 7-хлор-N,N,5-триметил-4-оксо-3-(піридин-2алкілпіперазинільну групу; Het - ге тероароматична іл)-3, 5-дигідро-4Н-піридазино[4,5-b]індол-1група піридинільного, 1-оксидопіридинільного, хікарбоксамід нолінільного, ізохінолінільного, піримідинільного, 12. 7-хлор-N,N,5-триметил-4-оксо-3- (піридинпіразинільно-го або піридазинільного типу, причо3-іл)-3,5-дигідро-4Н-піридазино[4,5-b]індол-1 му ця гетероароматична група може мати один карбоксамідгідрохлорид (1:1) або більше атомів галогену і/або одну або більше 13 7-хлор-N,N,5-триметил-4-оксо-3-(піридин-4(С1-С4)алкільних або (С1-С4)алкоксигруп. іл)-3,5-дигідро-4Н-піридазино[4,5-b]індол-1 У даному випадку (С1-С4)алкільна група є накарбоксамід сиченою лінійною або розгалуженою аліфатичною 14. 7-хлор-N,N,5-триметил-4-оксо-3-(піридин-4групою, яка включає 1-4 атоми карбону. Можна іл)-3,5-дигідро-4Н-піридазино[4,5-b]індол-1відзначити (див. Приклади), що метильна, етилькарбоксамідгідрохлорид (1:1) на, пропільна, ізопропільна, бутильна, ізобутильна 15. 7-хлор-N,N,5-триметил-4-оксо-3-(5або трет-бутильна групи, метилпіридин-2-іл)-3,5-дигідро-4Н-піридазино-[4,5(С1-С4)алкоксигрупа репрезентують оксигеноb]індол-1-карбоксамід вий радикал, заміщений алкільною групою, що 16. 7-хлор-N,N,5-триметил-4-оксо-3-(2включає 1-4 атоми карбону, як це було визначено метоксипіридин-5-іл)-3,5-дигідро-4Н-піридазиновище. [4,5-b]індол-1-карбоксамід Бажаними є такі сполуки винаходу, у яких X 17. 7-хлор-N,N,5-триметил-4-оксо-3-(2атом галогену; і/або R1 - (С1-С 4)алкіл; і/або R2 і R3 метилпiридин-5-1л)-3,5-дипдро-4Н-пiридазино[4,5кожна є незалежно одна від одної атомом гідрогеb]індол-1-карбоксамід ну або (С1-С4)алкільною групою, зокрема метилом 18. 7-хлор-N,N,5-триметил-4-оксо-3-(2або етилом, або R2 і R3 разом з атомом нітрогену, бромпіридин-5-іл)-3,5-дигідро-4Н-піридазино[4,5який їх несе, утворюють піролідинільну, піперидиb]індол-1-карбоксамід нільну, морфолінільну або 4-алкілпіперазинільну 19. 7-хлор-N,N,5-триметил-4-оксо-3-(хінолін-3груп у; і/або Het - ге тероароматична група піридиіл)-3,5-дигідро-4Н-піридазино[4,5-b]індол-1нільного, хінолінільного, ізохінолінільного, піримікарбоксамід динільного, піразинільного або піридазинільного 20. 7-хлор-N,N,5-триметил-4-оксо-3-(ізохінолінтипу, яка може мати один або більше атомів гало4-іл)-3,5-дигідро-4Н-піридазино[4,5-b]індол-1гену, зокрема, атомів брому і/або одну або більше карбоксамід (С1-С4)алкільних гр уп, бажано, метильних або (С121. 7-хлор-N,N,5-триметил-4-оксо-3-(6С4)алкоксигруп, найкраще метокси. метилпіридазин-3-іл)-3,5-дигідро-4Н-піридазиноСполуки, у яких X, R1 R2, R3 і Het є такими, як [4,5-b]індол-1-карбоксамід це визначено вище, є особливо бажаними у під22. 7-хлор-N,N,5-триметил-4-оксо-3-(піримідингрупах бажаних сполук і, зокрема, є такими, у яких: 5-іл)-3,5-дигідро-4Н-піридазино [4,5-b]індол-1X - атом хлору і R1 - метильна група. карбоксамід Прикладами сполук винаходу є: 23. 7-хлор-N,N,5-триметил-4-оксо-3-(піримідин1. 7-флуор-N,N5-триметил-4-оксо-3-(піридин-2 9 77984 10 2-іл)-3,5-дигідро-4Н-піридазино[4,5-b]індол-1рмули (І) реакцією з аміном загальної формули карбоксамід HNR2R3, де R2 і R3 є такими, що визначені вище, 24. 7-хлор-N,N,5-триметил-4-оксо-3-(піразин-2наприклад, у присутності похідної триалкілалюмііл)-3,5-дигідро-4Н-піридазино[4,5-b] індол-1нію у розчині, наприклад, толуолі, або омиленням карбоксамід естеру загальної формули (III) у кислоту, викорис25. 1-[[7-хлор-5-метил-3-(піридин-3-іл)-4-оксотовуючи, наприклад, гідроксид літію у суміші з ме3,5-дигідро-4Н-піридазино[4,5-b]індол-1танолом, водою і етерним розчином, і потім з'єділ]карбоніл]-піролідингідрохлорид (1:1) нанням кислоти, одержаною методами, відомими 26. 4-метил-1-[[7-хлор-5-метил-3-(піридин-3фа хівцям, з аміном загальної формули HNR2Ra як іл)-4-оксо-3,5-дигідро-4Н-піридазино[4,5-b]індол-1це було визначено вище. іл]карбоніл]піперазингідрохлорид (1:1) Згідно з другою процедурою приготування, ді27. 1-[[7-хлор-5-метил-3-(піридин-4-іл)-4-оксоестер загальної формули (II) обробляють гідрази3,5-дигідро-4Н-піридазино[4,5-b]індол-1ном з підігріванням у розчині, наприклад, оцтової іл]карбоніл]піролідин кислоти або толуолу, у присутності кислоти, для 28. 7-хлор-N,5-диметил-4-оксо-3-(піридин-4одержання естеру загальної формули (IV), де у іл)-3,5-дигідро-4Н-піридазино[4,5-b]індол-1which X, R 1 і R" є такими, що визначені вище. карбоксамід 29. 7-хлор-5-метил-4-оксо-3-(піридин-4-іл)-3,5дигідро-4Н-піридазино[4,5-b]індол-1-карбоксамід 30. 7-хлор-N,N,5-триметил-4-оксо-3-(4метоксипіридин-2-іл)-3,5-дигідро-4Нпіридазино[4,5-b]індол-1-карбоксамід 31. 1-[[7-хлор-5-метил-3-(піридин-4-іл)-4-оксо3,5-дигідро-4Н-піридазин[4,5-b]індол-1іл]карбоніл]морфолін 32. 7-хлор-N,N,-діетил-5-метил-4-оксо-3(піридин-4-т)-3,5-дигідро-4Н-піридазино[4,5b]індол-1-карбоксамід 33. 7-хлор-N-етил-N,5-диметил-4-оксо-3(піридин-4-іл)-3,5-дигідро-4Н-піридазино[4,5b]індол-1-карбоксамід 34. 1-[[7-хлор-5-метил-3-(піридин-4-іл)-4-оксо3,5-дигідро-4Н-піридазино[4,5-b]індол-1іл]карбоніл]піперидин 35. 7-хлор-N,N,5-триметил-4-оксо-3-(2метилпіридин-4-іл)-3,5-дигідро-4Н-піридазино[4,5b]індол-1-карбоксамід 36. 1-[[7-хлор-5-метил-3-(2-метилпіридин-4-іл)4-оксо-3,5-дигідро-4Н-піридазино[4,5-b]індол-1іл]карбоніл]піролідин Цей естер перетворюють в амід загальної формули (V), де X, R1, R2 і R3 є такими, що визначені 37. 7-хлор-N,N,5-триметил-3-(1-оксидопіридинвище, реакцією з аміном загальної формули 4-іл)-4-оксо-3,5-дигідро-4Н-піридазино[4,5-b]індолHNR2R3, де R2 і R3 є такими, що визначені вище, 1-карбоксамід 38. 7-хлор-3-(2-метоксипіридин-4-іл)-N,N,5наприклад, у присутності похідної триалкілалюмітриметил-4-оксо-3,5-дигідро-4Н-піридазино-[4,5нію у розчині, наприклад, толуолі. Нарешті, проводять N-гетероарилювання реаb]індол-1-карбоксамід кцією з'єднання у присутності гетеро39. 3-(2-бромпіридин-4-іл)-7-хлор-N,N,5арилгалогеніду або похідної гетероарилборної триметил-4-оксо-3,5-дигідро-4Н-піридазино[4,5b]індол-1-карбоксамід кислоти і солі металу, наприклад, міді, з одержанСполуки винаходу можуть існувати у формі ням сполуки загальної формули (І). Цю реакцію N-гетероарилювання можна також основ, солей приєднання кислот, сольватів або проводити з сполукою загальної формули (IV) з гідратів. одержанням естеру загальної формули (III). Цей Далі розглядаються способи приготування сполуки загальної формули (І). естер далі перетворюють в амід загальної формуДалі у тексті проміжні сполуки (II), (III), (IV) і (V) ли (І) реакцією з аміном загальної формули HNR2R3, де R2 і R3 є такими, що визначені вище, представлені у схемах, наведених нижче. наприклад, у суміші розчинів, наприклад, ДХМ і Згідно з першою процедурою приготування, метанолу. сполуку загальної формули (II), у якій X і R1 є такими, що були визначені вище, a R' і R" кожна реАміди загальної формули (V) і (І) можна також презентує, незалежно одна від одної, (C1отримати омиленням естерів відповідних загальних формул (IV) і (III) у кислоту і потім з'єднанням С4)алкільну групу, обробляють гетероарилгідразицієї кислоти з аміном загальної формули HNR2R3, ном у полярному розчині у присутності кислоти як це було визначено вище, згідно з способами, при температурі флегми і одержують естер загальної формули (III), де X, R 1, Het і R" є такими, що відомими фахівцям. визначені вище. Похідні борної кислоти, які містять гетероароматичну групу, є комерційно доступними або моЦей естер перетворюють в амід загальної фо 11 77984 12 жуть бути приготовлені способами, подібними описаним у літературі [Syntrofl. Commun., 1996, 26, 3543 і Li et al., J. Med. Chem., 1995,38,4570]. Сполуки загальної формули (І), у якій X, R1 R 2 і R3 є такими, що визначені вище, a Het - гетероароматична група 1-оксидопіридинільного типу, можна приготувати окислюванням окислювальним де агентом, наприклад, гідрогенпероксидом, еквіваX - атом гідрогену або атом галогену, R1 - (С1лентної похідної, у якій Het є гетероароматичною С4)алкільна група, R" - (С1-С4)алкільна група, групою піридинільного типу. які можна використати як синтетичні інтермеСполуки загальної формули (І), у яких X, R1, R2 діати при приготуванні сполуки загальної формули і R3 є такими, що визначені вище, a Het - гетеро(І). ароматична група 2-галопіридинільного типу, можІншим об'єктом винаходу є сполуки загальної на приготувати галогенуванням фосфортригалоформули (V) генідом еквівалентної похідної, у якій Het є гетероароматичною групою 1-оксидопіридинільного типу. Сполуки загальної формули (І), у яких X, R1 R2 і R3 є такими, що визначені вище, a Het - гетероароматична група 2-алкоксипіридинільного типу, де можна приготувати заміщенням алкоксидом наX - атом гідрогену або атом галогену, трію, наприклад, еквівалентної похідної, у якій Het R1 - атом гідрогену або (С1-С4)алкільна група, є гетероароматичною групою 2R2 і R3 кожна є, незалежно одна від одної, галогенопіридинільного типу. атомом гідрогену або (С1-С4)алкільною групою, Приготування вихідної сполуки загальної фоабо R2 і R3 разом з атомом нітрогену, який їх несе, рмули (II) [описано у документі WO-A-00/44751] утворюють піролідинільну, піперидинільну, мордля випадку, коли X - атом хлору. Спосіб приготуфолінільну або 4-алкілпіперазинільну груп у, вання є таким же у випадку, коли X - атом флуору. які можна використати як синтетичні інтермеІншим об'єктом винаходу є сполуки загальної діати при приготуванні сполуки загальної формули формули (II) (І). Інші сполуки є новими і можуть бути використані як синтетичні інтермедіати при приготуванні сполуки загальної формули (І). Вони є сполуками загальних формул (III) і (IV), у яких R" є не (С1С4)алкільною групою, а атомом гідрогену. де Дали наведено приклади, які ілюструють приR1 - атом гідрогену або (С1-С4)алкільна група, готування деяких сполук винаходу. Елементні мікR' і R" кожна є, незалежно одна від одної, (С1роаналізи ІЧ і ЯМР спектри підтверджують струкС4)алкільною групою, і вони використовуються як тури одержаних сполук. синтетичні інтермедіати при приготування сполуки Приклад 1 (Сполука №1) загальної формули (І). Ще одним об'єктом винахо7-флуор-N,N,5-триметил-4-оксо-3-(піридин-2ду є сполуки загальної формули (III) іл)-3,5-дигідро-4Н-піридазино[4,5-b]індол-1карбоксамід 1.1. 2-(4-флуор-2-нітрофеніл)-1-метоксикарбонілетенолат калію 47г (0,419моль) t-бутоксиду калію вносять у 900мл ТГФ. Реакційне середовище охолоджують де до приблизно -5°С і додають 90мл метанолу. КраX - атом гідрогену або атом галогену, плями при низькій температурі додають 61,2г R1 - атом гідрогену або (С1-С4)алкільна група, (0,419моль) етилоксалату і потім розчин 54г Het - гетероароматична група піридинільного, (0,348моль) 4-флуор-2-нітротолуолу у 100мл ТГФ. хінолінільного, ізохінолінільного, пі-римідинільного, Перемішують 12год. при зовнішній температурі, піразинільного або піридазинільного типу і може розчин фільтрують і тверду речовину промивають нести один або більше атомів галогенів і/або одну діетилетером і сушать під зниженим тиском, одерабо більше (С1-С4)алкільних або (С1жуючи 78г 2-(4-флуор-2-нітрофеніл)-1С4)алкоксигруп, метоксикарбонілетенолату калію - фіолетової твеR" - (С1-С4)алкільна група, рдої речовини, яка містить 10-20% 2-(4-флуор-2які можна використати як синтетичні інтерменітрофеніл)-1-етоксикарбонілетенолату натрію. діати при приготуванні сполук загальної формули 1.2. Ме тил 6-флуор-1Н-індол-2-карбоксилат (І). Суміш 35г солі калію, одержаної в етапі 1.1, у Подальшим об'єктом винаходу є сполуки зага500мл етанолу охолоджують до приблизно 0°С. льної формули (IV) Малими порціями додають 80мл концентр, гідрохлорної кислоти і порціями додають 35г (627ммоль) залізного порошку. Суміш гріють під зворотним холодильником 5год. і потім охолоджу 13 77984 14 ють і фільтрують. Одержану тверду речовину прованням, промивають діетилетером і очищують мивають ДХМ, фільтрат концентрують під знижехроматографією на колонці силікагелю з сумішшю ним тиском і залишок очищують хроматографією розчинів (ДХМ/етилацетат: від 100/0 до 0/100, пона колонці силікагелю з сумішшю розчинів тім етилацетат/метанол: від 100/0 до 90/10) і оде(ДХМ/е тилацетат: від 100/0 до 70/30). Хроматогржують сполуку (0,20г, 0,55ммоль) у формі жовтої рафічні фракції частково концентрують і тверду твердої речовини. речовину, що випала в осад, збирають фільтру1.6. 7-Флуор-N,N,5-триметил-4-оксо-3ванням, промивають циклогексаном і сушать під (піридин-2-іл)-3,5-дигідро-4Н-піридазино[4,5-b]зниженим тиском, одержуючи 10г білої твердої індол-1-карбоксамід речовини метил6-флуор-1Н-індол-2Розчин диметиламінгідрохлориду (0,50г; карбоксилату, який містить 10-20% етил 6-флуор6ммоль) у 50мл толуолу під аргоном охолоджують 1Н-індол-2-карбоксилату. до 0°С і потім малими порціями додають 4мл 1.3. Метил 6-флуор-1-метил-1Н-індол-2(8ммоль) розчину триметилалюмінію (2М у толуокарбоксилат лі). Перемішують 2год. при зовнішній температурі, Суспензію 7,9г (191ммоль) 60%-го гідриду напотім додають етил 7-флуор-5-метил-4-оксо-3трію і 36,1г (176ммоль) метил 6-флуор-1Н-індол-2(піридин-2-іл)-3,5-дигідро-4Н-піридазино[4,5карбоксилату (етап 1.2.) у 250мл Ν,Ν-ДМФ переb]індол-1-карбоксилат у вигляді твердої речовини мішують 2год. при зовнішній температурі і потім (0,38г; 1,0ммоль, етап 1.5) і гріють реакційне середодають 12мл (193ммоль) іодометану у 50мл Ν,Νдовище при 110°С протягом 5год. ДМФ. Суміш перемішують при зовнішній темпераРозчин охолоджують до приблизно 0°С і краптурі протягом 12год. лями додають воду, потім додають ДХМ і 30%-й Реакційне середовище вливають у суміш води гідроксид натрію до розчинення похідних алюміі льоду, додають ДХМ і водну фазу нейтралізують нію. Органічну фазу відокремлюють . осадженням, гідрохлорною кислотою (1М). Ор ганічну фазу відпромивають водою, сушать над сульфатом наділяють осадженням, промивають водою, сушать трію, фільтрують і концентрують під зниженим над сульфатом натрію, фільтрують і концентрують тиском. Залишок очищують хроматографією на під зниженим тиском. Залишок очищують хроматоколонці силікагелю з сумішшю розчинів графією на колонці силікагелю з сумішшю розчинів (ДХМ/е тилацетат: від 90/10 до 0/100, потім етила(циклогексан/ДХМ: 50/50; потім ДХМ/етилацетат: цетат/метанол: від 100/0 до 90/10). Одержану твевід 100/0 до 70/30) і одержують 37,2г (170ммоль) рду речовину рекристалізують з суміші ДХМ і е тибілої сполуки - метил 6-флуор-1-метил-1Н-індол-2лацетату і одержують 0,070г (6,5ммоль) сполуки у карбоксилату, який містить 10-20% етил 6-флуорформі білої твердої речовини. Точка плавл.: 1991-метил-1Н-індол-2-карбоксилату. 200°С. 1.4. Етил 6-флуор-2-(метоксикарбоніл)-1Приклад 2 (Сполука №12) метил-а-оксо-1Н-індол-3-ацетат 7-хлор-М,М,5-триметил-4-оксо-3-(піридин-3-іл)Розчин 6,7мл (60ммоль) етилхлороксоацетату 3,5-дигідро-4Н-піридазино[4,5-Ь]індол-1у 220мл 1,2-дихлоретану охолоджують до 0°С і карбоксамідгідрохлорид (1:1) малими порціями додають 6,6мл (60ммоль) тетра2.1. Етил 7-хлор-5-метил-4-оксо-3,5-дигідрохлориду титан у. Реакційне середовище перемі4Н-піридазино[4,5-b]індол-1-карбоксилат Розчин шують 30хвил. при 0°С. Додають 10г (47ммоль) 4,38г (13,5ммоль) етил 6-хлор-2-(етоксикарбоніл)метил 6-флуор-1-метил-1Н-індол-2-карбоксилату 1-метил-a-оксо-1Н-індол-3-ацетату [див. WO-A(етап 1.3) і перемішують 12год. при зовнішній тем00/44751], 65мл льодяної оцтової кислоти і 2,7мл пературі. Суміш вливають у суміш води і льоду і (55,7ммоль) гідразин-моногідрату витримують під екстрагують ДХМ. Органічну фазу відокремлюють зворотним холодильником протягом 3год. осадженням, промивають водою, сушать над суСередовище охолоджують, нерозчинний мальфатом натрію, фільтрують і концентрують під теріал збирають фільтруванням, промивають возниженим тиском. Залишок очищують хроматогдою і сушать під зниженим тиском, одержуючи рафією на колонці силікагелю з сумішшю розчинів 3,58г (11,7ммоль) сполуки у формі білої твердої (цикло-гексан/ДХМ: 50/50; потім ДХМ/етилацетат: речовини. Точка плавл.: 302-303°С. від 100/0 до 90/10). Тверду речовину рекристалізу2.2. 7-Хлор-N,N,5-триметил-4-оксо-3,5-дигідроють з суміші ДХМ і етилацетату і одержують 12,1г 4Н-піридазино[4,5-b]індол-1-карбоксамід 2,45г жовтуватої твердої речовини - етил 6-флуор-2(30ммоль) диметиламінгідрохлориду у 30мл толуолу вносять в атмосферу аргону. Розчин охоло(метоксикарбоніл)-1-метил-a-оксо-1Н-індол-3ацетату, який містить 10-20% етил 6-флуор-2джують до 0°С і потім малими порціями додають 15мл (30ммоль) розчину триметилалюмінію (2М у (етоксикарбоніл)-1-метил-a-оксо-1Н-індол-3толуолі) і реакційне середовище перемішують ацетату. Точка плавл.: 88-91°С. 2год. при зовнішній температурі. 1.5. Етил 7-флуор-5-метил-4-оксо-3-(піридинДодають 30мл (20,1ммоль) приготовленого 2-іл)-3,5-дигідро-4Н-піридазино[4,5-b]-індол-1вище розчину до суспензії 2г (6,5ммоль) етил 7карбоксилат хлор-5-метил-4-оксо-3,5-дигідро-4НРозчин 0,40г (1,36ммоль) етил 6-флуор-2піридазино[4,5-b]індол-1-карбоксилату (етап 2.1.) у (метоксикарбоніл)-1-метил-а-оксо-1Н-індол-360мл толуолу і реакційне середовище гріють при ацетату (етап 1.4), 30мл абсолютного етанолу, 100°С протягом 3год. кілька крапель льодяної оцтової кислоти і 0,60г Розчин охолоджують до приблизно 0°С і вли(5,5ммоль) 2-піридинілгідразину витримують під вають у суміш водного розчину гідрохлорної. кисзворотним холодильником 17год., потім охололоти (1М) і льоду. Реакційне середовище підлужуджують. Нерозчинний матеріал збирають фільтру 15 77984 16 ють водним розчином гідроксиду натрію (1М). протягом 18год., потім розчин охолоджують до Одержаний осад відфільтровують, промивають приблизно 0°С. Додають воду і потім краплями 1М водою і сушать під зниженим тиском, одержуючи розчин гідрохлорної кислоти до досягнення рН 1-2. сполуку (1,99г; 6,5ммоль) у формі світлобежевої Осад збирають фільтруванням, промивають вотвердої речовини. Точка плавл.: >300°С. дою і сушать під зниженим тиском у присутності 2.3. 7-Хлор-N,N,5-триметил-4-оксо-3-(піридинпентоксиду фосфор у, одержуючи сполуку (1,10г; 3-іл)-3,5-дигідро-4Н-піридазино[4,5-b]-індол-13,8ммоль) у формі білої твердої речовини. Точка карбоксамідиідрохлорид плавл.: >300°С. 0,4г 7-хлор-N,N,5-триметил-4-оксо-3,5-дигідро3.3. 7-флуор-N,N,5-триметил-4-оксо-3-(24Н-піридазино[4,5-b]індол-1-карбоксаміду метоксипіридин-5-іл)-3,5-дигідро-4Н(1,3ммоль, етап 2.2), розчиняють у 35мл Nпіридазино[4,5-b]індол-1-карбоксамід метилпіролідону. При зовнішній температурі в атРозчин 0,3г (1,04ммоль) 7-флуор-N,N,5мосфері аргону додають 0,21мл (2,6ммоль) піритриметил-4-оксо-3,5-дигідро-4Н-піридазино[4,5дину, 0,36мл (2,6ммоль) триетиламіну, 340мг моb]індол-1-карбоксаміду (етап 3.2.), 0,120г лекулярного сита, 0,47г (2,6ммоль) ацетату міді і (0,63ммоль) йодиду міді, 0,20г (1,45ммоль) карбо0,42г (2,6ммоль) 2-(піридин-3-іл)-1,3,2нату калію і 0,60г (3,19ммоль) 3-бром-6діоксаборинану. Через 24год. нерозчинні матеріаметоксипіридину у 50мл Ν,Ν-ДМФ гріють при ли відокремлюють фільтруванням і до розчину 150°С 20год. Реакційну суміш о холоджують і кондодають 0,21мл (2,6ммоль) піридину, 0,36мл центрують під зниженим тиском. Додають ДХМ, (2,6ммоль) триетиламіну, 340мг молекулярного воду і розчин гідроксиду натрію (1М). Органічну сита, 0,47г (2,6ммоль) ацетату міді і 0,42г фазу відокремлюють осадженням, промивають (2,6ммоль) 2-(піридин-3-іл)-1,3,2-діоксаборинану. водою, сушать над сульфатом натрію, фільтрують Перемішування продовжують 24год., нерозчинні і концентрують під зниженим тиском. Залишок матеріали відокремлюють. фільтруванням і розочищують хроматографією на колонці силікагелю чинник видаляють під зниженим тиском. До зали(елюент: ДХМ/етилацетат: від 100/0 до 0/100; пошку додають ДХМ і воду. Водну фазу екстрагують тім етилацетат/метанол: 95/5). Одержану білу твеДХМ, органічні фази з'єднують, промивають ворду речовину рекристалізують з суміші дою, сушать над сульфатом натрію, фільтрують і ДХМ/е тилацетат і промивають діетилетером, одеконцентрують під зниженим тиском. Залишок очиржуючи білу тверду речовину (0,26г; 0,66ммоль). щують хроматографією на колонці кремнезему Точка плавл.: 225-226°С. (елюент: гептан/етилацетат: 10/90) Одержану білу Приклад 4 (Сполука №9) тверду речовину перетирають у діетилетері і оде7-флуор-N,5-диметил-4-оксо-3-(піридин-3-іл)ржують 400мг білої твердої речовини. 3,5-дигідро-4Н-піридазино[4,5-b]індол-1Гідрохлорид отримують розчиненням цієї твекарбоксамід рдої речовини в етанолі і доданням розчину гідро4.1. Етил 7-флуор-5-метил-4-оксо-3-(піридинхлорної кислоти (5N) у пропан-2-олі. Після рекрис3-іл)-3,5-дигідро-4Н-піридазино[4,5-b]-індол-1талізації з пропан-2-олу одержують сполуку (0,35г; карбоксилат 0,84ммоль) у формі білої твердої речовини. Точка Етил 7-флуор-5-метил-4-оксо-3,5-дигідро-4Нплавл.: 228-230°С. піридазино[4,5-b]індол-1-карбоксилат (0,9г; Приклад 3 (Сполука №4) 3,11ммоль, етап 3.1 Прикладу 3) розчиняють у 1-флуор-N,N,5-триметил-4-оксо-3-(260мл N-метилпіролідону. При зовнішній темпераметоксипіридин-5-іл)-3,5-дигідро-4Нтурі в атмосфері аргону додають 0,50мл піридазино[4,5-b]індол-1-карбоксамід (6,2ммоль) піридину, 0,8мл (5,7ммоль) триетила3.1. Етил 7-флуор-5-метил-4-оксо-3,5-дигідроміну, 4г молекулярного сита, 1,0г (5,5ммоль) аце4Н-піридазино[4,5-b]індол-1-карбоксилат. Розчин тату міді і 0,90г (5,5ммоль) 2-(3-піридиніл)-1,3,27,80г (26,6ммоль) етил 6-флуор-2діоксаборинану. Через 24 год. розчинник видаляють під зниженим тиском і додають ДХМ, воду і (метоксикарбоніл)-1-метил-a-оксо-1Н-індол-3ацетату (етап 1.4 Прикладу 1), 200мл льодяної гідроксид натрію (1М). Нерозчинні матеріали відокремлюють фільтруванням, органічну фазу відооцтової кислоти і 5мл (103ммоль) гідразинкремлюють осадженням і водну фазу екстрагують моногідрату гріють при 90°С протягом 20год., потім ДХМ. Органічні фази з'єднують, промивають воохолоджують і після додання води нерозчинний дою, сушать над сульфатом натрію, фільтрують і матеріал збирають фільтруванням, промивають водою і сушать під зниженим тиском, одержуючи концентрують під зниженим тиском. Залишок очищують хроматографією на колонці силікагелю 19,3ммоль сполуки у формі білої твердої речови(елюент: ДХМ/е тил ацетат: від 100/0 до 0/100; ни. Точка плавл.: 314-315°С. етилацетат/метанол: від 100/0 до 90/10) і одержу3.2. 7-флуор-N,N,5-триметил-4-оксо-3,5ють білу тверду речовину (0,57г). Точка плавл.: дигідро-4Н-піридазино[4,5-b]індол-1-карбоксамід. Розчин 2,50г (30,6ммоль) диметиламінгідрохлори214-215°С. 4.2. 7-флуор-N,5-диметил-4-оксо-3-(піридин-3ду у 150мл толуолу під аргоном охолоджують до іл)-3,5-дигідро-4Н-піридазино[4,5-b]індол-10°С і потім малими порціями додають 8мл карбоксамід (36ммоль) розчину триметилалюмі-нію (2М у толуПотік газового метиламіну вводять у розчин олі). Перемішують 2год. при зовнішній температурі і потім додають 2,6г (9ммоль) етил 7-флуор-50,28г (0,76ммоль) етил 7-флуор-5-метил-4-оксо-3(піридин-3-іл)-3,5-дигідро-4Н-піридазино[4,5метил-4-оксо-3,5-дигідро-4Н-піридазино[4,5b]індол-1-карбоксилату (етап 4.1) у 30мл ДХМ і b]індол-1-карбоксилату у вигляді твердої речовини 70мл метанолу і перемішують 4год. Реакційне се(етап 3.1). Реакційне середовище гріють при 110°С 17 77984 18 редовище концентрують під зниженим тиском, 110°С 2год., розчин охолоджують до приблизно залишок очищують хроматографією на колонці 0°С і краплями додають воду і потім концентр, силікагелю (елюент: ДХМ/метанолу: від 100/0 до розчин гідроксиду натрію. Осад відфільтровують, 90/10). Одержану тверду речовину рекристалізупромивають водою і сушать під зниженим тиском у ють з суміші ДХМ і етилацетату, і одержують білу присутності пентоксиду фосфор у, одержуючи спотверду речовину (0,22г). Точка плавл.: 270-272°С. луку (0,89г) у формі білої твердої речовини. Приклад 5 (Сполука №6) 6.2. 4-метил-1-[[7-хлор-5-метил-3-(піридин-31-[[7-флуор-5-метил-3-(піримідин-2-іл)-4-оксоіл)-4-оксо-3,5-дигідро-4Н-піридазино[4,5-b]-індол-13,5-дигідро-4Н-піридазино[4,5-b]індол-1іл] карбоніл]піперазингідрохлорид (1:1) іл]карбоніл]-піролідин 4-метил-І-[[7-хлор-5-метил-4-оксо-3,5-дигідро5.1. 1-[[7-флуор-5-метил-4-оксо-3,5-дигідро4Н-піридазино[4,5-b]індол-1-іл]карбоніл]-піперазин 4Н-піридазино[4,5-b]індол-1-іл]-карбоніл]-піролідин (0,75г; 2,1ммоль) (етап 6.1) розчиняють у 60мл N12мл (24ммоль) розчину триметилалюмінію метилпіролідону. При зовнішній температурі в ат(2М у толуолі) у 100мл толуолу під арго-. ном охомосфері аргону додають 0,39мл (4,8ммоль) пірилоджують до 0°С, потім малими порціями додають дину, 0,67мл (4,8ммоль) триетиламіну, 800мг мо2мл (24ммоль) піролідину і перемішують протягом лекулярного сита, 0,87г (4,8ммоль) ацетату міді і 2год. при зовнішній температурі. Додають 2,0 г 0,78г (4,8ммоль) 2-(піридин-3-іл)-1,3,2(6,9ммоль) етил 7-флуор-5-метил-4-оксо-3,5діоксаборинану. Через 24год. нерозчинний матерідигідро-4Н-піридазино[4,5-b]індол-1-карбоксилату ал відокремлюють фільтруванням і до розчину (етап 3.1 Прикладу 3) у формі твердої речовини. додають 0,39мл (4,8ммоль) піридину, 0,67мл Реакційне середовище гріють при 110°С 18 год., (4,8ммоль) триетиламіну, 2,0г молекулярного сита, потім розчин охолоджують до приблизно 0°С і до0,87г (4,8ммоль) ацетату міді і 0,78г (4,8ммоль) 2дають воду і потім краплями розчин гідрохлорної (піридин-3-іл)-1,3,2-діоксаборинану. Після 24кислоти (1М) до досягнення рН 1-2. Осад відфільгодинного перемішування розчинник видаляють тровують, промивають водою і сушать під знижепід зниженим тиском і додають ДХМ і воду. Нерозним тиском у присутності пентоксиду фосфору, чинні матеріали відокремлюють фільтруванням, одержуючи сполуку (1,50г; 4,6ммоль) у формі білої органічну фазу відокремлюють осадженням і водтвердої речовини. Точка плавл.: >300°С. ну фазу екстрагують ДХМ. Органічні фази з'єдну5.2. 1-[[7-флуор-5-метил-3-(піримідин-2-іл)-4ють, промивають водою, сушать над сульфатом оксо-3,5-дигідро-4Н-піридазино[4,5-b]індол-1натрію, фільтрують і концентрують під зниженим іл]карбоніл]-піролідин тиском. Залишок перетирають у діізопропіловому Розчин 0,24г (0,73ммоль) 1-[[7-флуор-5-метилетері. Осад збирають фільтруванням і очищують 4-оксо-3,5-дигідро-4Н-піридазино[4,5-b]індол-1хроматографією на колонці силікагелю (елюент: іл]карбоніл]піролідину (етап 5.1), 0,120г ДХМ/метанол: від 100/0 до 90/10), одержуючи кре(0,63ммоль) йодиду міді, 0,15г (1,09ммоль) карбомову тверду речовину (0,3г). нату калію і 0,30г (1,89ммоль) 2-бромпіримідину у Гідрохлорид одержують розчиненням твердої 40мл Ν,Ν-ДМФ гріють при 150°С 16год. Реакційну речовини у пропан-2-олі і доданням 7мл розчину суміш охолоджують і концентрують під зниженим гідрохлорної кислоти (0,1N) у пропан-2-олі. Після тиском. Додають ДХМ, воду і концентр, розчин рекристалізації з пропан-2-олу одержують сполуку гідроксиду натрію. Органічну фазу відокремлюють (0,23г; 0,44ммоль) у формі білої твердої речовини. осадженням, фільтрують через Celite®, промиваТочка плавл.: 267-268°С (розкладення). ють водою, сушать над сульфатом натрію, фільтПриклад 7 (Сполука №11) рують і концентрують . під зниженим тиском. За7-хлор-N,N,5-триметил-4-оксо-3-(піридин-2-іл)лишок очищують хроматографією на колонці 3,5-дигідро-4Н-піридазино[4,5-b]індол-1силікагелю (елюент: ДХМ/етилацетат: від 80/20 до карбоксамід 0/100; етилацетат/метанол: від 100/0 до 90/10). 0,4г 1-хлор-N,N,5-триметил-4-оксо-3,5-дигідроТверду речовину рекристалізують з суміші 4Н-піридазино[4,5-b]індол-1-карбоксаміду ДХМ/е тилацетат і промивають діетилетером, оде(1,3ммоль, етап 2.2 Прикладу 2) розчиняють у ржуючи білу тверду речовину (0,04г; 0,10ммоль). 35мл N-метилпіролідону. При зовнішній темпераТочка плавл.: 238-239°С. турі у атмосфері аргону додають 0,2мл (2,6ммоль) Приклад 6 (Сполука №26) піридину, 0,36мл (2,6ммоль) триетиламіну, 420мг 4-метил-1-[[7-хлор-5-метил-3-(піридин-3-іл)-4молекулярного сита, 0,48г (2,6ммоль) ацетату міді оксо-3,5-дигідро-4Н-піридазино[4,5-b]індол-1і 0,874г (2,6ммоль) суміші [1:1] трипропоксипіриіл]карбоніл]піперазингідрохлорид (1:1) дин-2-ілборонату літію і пропанолу. Через 24год. 6.1. 4-метил-І-[[7-хлор-5-метил-4-оксо-3,5до розчину додають 0,2мл (2,6ммоль) піридину, дигідро-4Н-піридазино[4,5-b]індол-1-іл]0,36мл (2,6ммоль) триетиламіну, 420мг молекулякарбоніл]піперазин. рного сита, 0,48г (2,6ммоль) ацетату міді і 0,874г Розчин 4-метилпіперазину (1,1мл; 10ммоль) у (2,6ммоль) суміші [1:1] трипропоксипіридин-210мл толуолу о холоджують до 0°С під аргоном і ілборонату літію і пропанолу. Після 24-годинного малими порціями додають 5мл (10ммоль) розчину перемішування додають ДХМ і воду. Органічну триметилалюмінію (2М у толуолі). Після 2фазу відокремлюють осадженням і водну фазу годинного перемішування при зовнішній темпераекстрагують ДХМ. Ор ганічні фази . з'єднують, сутурі додають 1,0г (3,27ммоль) етил 7-хлор-5шать над сульфатом натрію, фільтрують і конценметил-4-оксо-3,5-дигідро-4Н-піридазино[4,5трують при зниженому тиску. Залишок очищують b]індол-1-карбоксилату (етап 2.1 Прикладу 2) у хроматографією на колонці силікагелю (елюент: 30мл толуолу. Реакційне середовище гріють при ДХМ/метанол; від 100/0 до 35/5) і одержану тверду 19 77984 20 речовину рекристалізують з етанолу, одержуючи 98/2 до 80/20). Одержану тверду речовину рекриссвітлобежеву тверду речовину (0,95г). Точка талі-зують з метанолу і одержують 100мг сполуки плавл.: 210-211°С. у формі білої твердої речовини. Точка плавл.: 301Приклад 8 (Сполука №14) 304°С. 7-хлор-N,N,5-триметил-4-оксо-3-(піридин-4-іл)Приклад 10 (Сполука №38) 3,5-дигідро~4Н-піридазино[4,5-b]індол-17-хлор-3-(2-метоксипіридин-4-іл)-N,N,5карбоксамідгідрохлорид (1:1) триметил-4-оксо-3,5-дигідро-4Н-піридазино[4,50,4г 7-хлор-N,N,5-триметил-4-оксо-3,5-дигідроb]індол-1-карбоксамід 4Н-піридазино[4,5-b]індол-1-карбоксаміду 10.1.3-(2-бромпіридин-4-іл)-7-хлop-N,N,5(1,3ммоль, етап 2.2 Прикладу 2) розчиняють у триметил-4-oкco-3,5-дигідро-4H-піридазино[4,535мл N-метилпіролідону. При зовнішній темпераb]індол-1-карбоксамід турі в атмосфері аргону додають 0,2мл (2,6ммоль) 0,34г (0,85ммоль) 7-хлор-N,N,5-триметил-3-(1піридину, 0,4мл (2,7ммоль) триетиламіну, 300мг оксидопіридин-4-іл)-4-оксо-3,5-дигідро-4Нмолекулярного сита, 0,48г (2,6ммоль) ацетату міді піридазино[4,5-b]індол-1-карбоксаміду (Приклад 9) і 0,32г (2,6ммоль) піридин-4-ілборної кислоти. Черозчиняють у 50мл ДХМ в інертній атмосфері і рез 24год. нерозчинний матеріал відокремлюють додають 0,24мл (1,7ммоль) триетиламіну. С уміш фільтруванням і до розчину додають 0,2мл охолоджують у льодяно-водній ванні і додають (2,6ммоль) піридину, 0,4мл (2,7ммоль) триетиламалими порціями 0,49г (1,7ммоль) оксиброміду міну, 300мг молекулярного сита, 0,48г (2,6ммоль) фосфор у. Реакційне середовище перемішують ацетату міді і 0,32г (2,6ммоль) піридин-4-ілборної 30хвил. при зовнішній температурі, потім гріють кислоти, перемішують 24год. і нерозчинні матеріапротягом 2,5 год. під зворотним холодильником і ли відокремлюють фільтруванням. Розчинник виохолоджують до зовнішньої температури. Суміш даляють під зниженим тиском і до залишку додавливають у подрібнений лід і додають ДХМ і розють ДХМ і воду і водн у фазу екстрагують ДХМ. чин гідроксиду натрію (1М) до досягнення лужного Органічні фази з'єднують, промивають водою, сурН. Органічну фазу відокремлюють осадженням, шать над сульфатом натрію, фільтрують і конценпромивають водою, сушать над сульфатом натрують під зниженим тиском. Залишок очищують трію, фільтрують і концентрують під зниженим хроматографією на колонці силікагелю (елюент: тиском. Залишок очищують хроматографією на циклогексан/етилацетат: 10/90, потім колонці силікагелю (елюент: ДХМ/е тилацетат: від ДХМ/метанол: 95/5). Одержану білу тверду речо80/20 до 0/100), одержуючи 180мг білої твердої вину перетирають у діетилетері і одержують 350мг речовини. Цю сполуку використовують у наступній 7-хлορ-Ν,Ν,5-триметил-4-оксо-3-(піридин-4-іл)-3,5операції. дигідро-4Н-піридазино[4,5-b]індол-1-карбоксаміду 10.2. 7-хлор-3-(2-метоксипіридин-4-іл)-N,N,5(Сполука №13) у формі білої твердої речовини. триметил-4-оксо-3,5-дигідро-4Н-піридазино-[4,5Точка плавл.: 276-278°С. b]індол-1-карбоксамід Гідрохлорид одержують розчиненням одержа120мг (5,2ммоль) натрію у інертній атмосфері ної вище твердої речовини в етанолі і доданням додають до 20мл метанолу і додають 180мг розчину гідрохлорної кислоти (5N) у пропан-2-олі. (0,39ммоль) 3-(2-бромпіридин-4-іл)-7-хлор-N,N,5Після рекристалізації з пропан-2-олу одержують триметил-4-оксо-3,5-дигідро-4Н-піридазино[4,5сполуку (0,30г; 0,72ммоль) у формі білої твердої b]індол-1-карбоксаміду (Приклад 10.1) і 20мл Ν,Νречовини. Точка плавл.: 263-265°С. ДМФ. Розчин гріють при 80°С 14год. і потім охолоПриклад 9 (Сполука №37) джують до зовнішньої температури, концентрують 7-хлор-N,N,5-триметил-3-(1-оксидопіридин-4під зниженим тиском і додають воду і ДХМ до заіл)-4-оксо-3,5-дигідро-4Н-піридазино[4,5-b]індол-1лишку. Органічну фазу відокремлюють осадженкарбоксамід ням, промивають водою, суша ть над сульфатом 0,35г (0,92ммоль) 7-хлор-М,М,5-триметил-4натрію, фільтрують і концентрують під зниженим оксо-3-(піридин-4-іл)-3,5-дигідро-4Нтиском. Залишок очищують хроматографією на піридазино[4,5-b]індол-1-карбоксаміду, одержаного колонці силікагелю (елюент: ДХМ/е тилацетат: від у Прикладі 8, розчиняють у 30мл льодяної оцтової 80/20 до 0/100). Одержану тверду речовину рекрикислоти і повільно додають 3,5г (36ммоль) розчину сталізують з суміші ДХМ/етилацетат і потім прогідрогенпероксиду (35% у воді). Реакційну суміш мивають діетилетером, одержуючи 60мг білої твегріють при 80°С протягом 30год. і потім охолоджурдої речовини. Точка плавл.: 237-238°С. ють до зовнішньої температури. Додають воду і Хімічні структури і фізичні властивості деяких потім гідрокарбонат натрію до досягнення рН присполук винаходу ілюстр уються наведеною нижче близно 8. Водну фаз у екстрагують ДХМ, органічну таблицею. фазу промивають водою, сушать над сульфатом У колонці "Сіль" цієї таблиці "НС1" означає гінатрію, фільтрують і концентрують під зниженим дрохлорид і "-" означає сполуку у формі основи. тиском. Залишок очищують хроматографією на Молярне відношення кислота:основа наведено колонці силікагелю (елюент: ДХМ/метанол: від навпроти. 21 77984 Сполуки винаходу були піддані фармакологічним тестам, які показали їх переваги як сполук з терапевтичною активністю. Сполуки винаходу також показали розчинність у воді, яка сприяє активності in vivo. Вивчення зв'язування [3H]Ro5-4864 з рецепторами бензодіазепіну периферійного типу (РБП або р-сайти) Була визначена спорідненість сполук винаходу до РБП або р-сайтів (сайтів зв'язків периферійного типу з бензодіазепінами). Рецептори р-сайту можна селективно позначити у мембранах нирки щура, інкубованих у присутності [3H]Ro5-4864. Сполуки винаходу є об'єк 22 том вивчення in vitro їх спорідненості до цих рецепторів. Були використані самці щурів Sprague-Dawley (Iffa Credo) вагою 180-300мг. Після обезголовлювання видаляли нирки і тканини гомогенізували при 4°С, використовуючи гомогенізатор Polytron™, протягом 2хвил. при 6/10 максимальної швидкості у 35 об'ємів фосфатного буфера 50мМ Na2HPO4 при рН, скоригованим до 7,5 доданням NaH2PO4. Мембранний гомогенат фільтрували через марлю і розбавляли вдесятеро буфером. Специфічна активність [3H]Ro5-4864: 70-90Сі/ммоль; New England Nuclear, при концентрації 0,5нМ, інкубували у присутності 100мкл мембранного гомогенату у кінцевому об'ємі 1 мл буфера, що містить тест-сполук у. Після 3-годинного інкубування при 0°С мембрани відділяли фільтруванням через фільтри Whatman GF/B™ і двічі промивали 4,5мл холодного (0°С) інкубаційного буфера. Рівень радіоактивності, затриманої фільтром, виміряли рідинною сцинтиграфією. Для кожної концентрації сполук, що вивчались, визначали процент інгібування зв'язування [3H]Ro5-4864 і потім визначали концентрацію IK50, яка інгібує 50% специфічного зв'язування. Значення ІK50 найбільш активних сполук винаходу становили від 1 до 200нМ. Отже, сполуки винаходу є лігандами з спорідненістю до рецепторів бензодіазепіну периферійного типу Вивчення нейротрофічної активності Тест на виживання моторних нейронів після розсічення лицевого нерва у щурів віком 4 дні Після пошкодження лицевого нерва у незрілих щурів моторні нейрони лицевого ядра зазнають нейронної смерті через апоптоз. Виживання нейронів оцінювали підраховуванням нейронів з використанням гістологічних методів. Незрілі щури віком 4 дні були анестезовані пентобарбіталом (3мг/кг внутрішньочеревно). Правий лицевій нерв оголяли і розсікали у місті виходу з стиломастощного каналу. Після пробудження молоді щури були повернуті до їх матерів і протягом 7 днів їм одно- або дворазово на день орально або внутрішньочеревно вводили дози від1 до 10мг/кг. Через 7 днів після розсікання тварини були обезголовлені і мозок був заморожений в ізопентані при -40°С. Весь лицевий нерв розрізали кріостатом на секції шириною 10мкм. Моторні нейрони фарбували крезилвіолетом і підраховували, використовуючи програмне забезпечення Histo™ (Biocom™). У цій моделі сполуки винаходу підвищували здатність нейронів до виживання приблизно на 1030%. Результати тесту показують, що найбільш активні сполуки винаходу сприяють регенерації нейронів. Отже, сполуки винаходу можуть використовуватись як складові медикаментів. Їх можна використати для приготування медикаментів, призначених для профілактики і/або лікування периферійних нейропатій різних типів, 23 77984 24 наприклад, травматичних або ішемічних, інфекційний з агресивним потенціалом пухлини, а них, алкоголічних, медичних або генетичних нейнаявність агоніста таких рецепторів стимулює ріст ропатій і моторно- нейронних станів, наприклад, ракової пухлини грудей. спинальних аміотрофій і аміотрафічного латераЦі комбіновані результати, які доводять нельного склерозу. Ці медикаменти можуть також безпечну дію рецептора бензодіазепіну перифевикористовува тись для лікування нейродегенерарійного типу на розвиток раку, дають підґрунтя для тивних хвороб центральної нервової системи госпошуку синтетичних лігандів, специфічних для трого типу, наприклад, інсультів і черепнорецептора бензодіазепіну периферійного типу і мозкових травм, або хронічного типу, наприклад, здатного блокувати його дію. автоімунних хвороб (множинного склерозу), хвоОтже, сполуки винаходу можуть бути викорисроби Альцгеймера, хвороби Паркінсона і будь-яких тані для лікування пухлин і раків. хвороб, при яких введення нейрот-рофічних факРецептори бензодіазепіну периферійного типу торів дає терапевтичний ефект. є присутніми також у шкірі і тому ці сполуки можна Сполуки винаходу можуть також бути викорисвикористовува ти для профілактики або лікування тані для приготування медикаментів, призначених шкірного стресу. для профілактики і/або лікування тривожного стаТермін "шкірний стрес" включає різні ситуації, ну, епілепсії і порушень сну. Це зумовлюється тим, які можуть спричинитись до пошкодження, зокрещо ліганди РБП або р-сайти стимулюють виробма, епідермісу незалежно від агента, що є причилення нейростеро-їдів, наприклад, прегнонолону, ною цього стресу. Цей агент може бути внутрішнім і/або зовнішнім відносно тіла, наприклад, напридегідроепландростерону і 3a-гідрокси-5а-прегнанклад, хімічним агентом або вільним радикалом, 20-ону сприянням перенесення холестеролу з наабо бути зовнішнім подразником, наприклад, ультзовні у середину мітохондріальної мембрани. Ці нейростероїди модулюють активність GABAAрафіолетом. Отже, сполуки, що можуть бути використані хлоридного каналу макромолекулярного комплекзгідно з винаходом, призначаються для профілаксу і, отже, можуть викликати анксіолітичну, антикотики і лікування шкірних подразнень, сухих блянвульсійну і седативну активність [D.Bitran et al., шок, еритем, неестетичних відчуттів, відчуттів жаPsychopharmacology, 2000, 151, 64-71; S.Okuyama et a I., Life ScL, 1999, 64 (16), 1455-1464; LD. ру, з уду шкіри і/або слизових мембран або старіння, а також можуть бути використані у випаMcCauley et al., Eur. J.Pharmacol., 1995, 276, 145дках шкірних розладів, наприклад, наприклад, 153; S.K.Kulkarni et al., Drugs of Today, 1995, 31, псоріазу, пруригінозних хвороб, герпесу, фотоде433-4558]. рматозу, атопічних дерматидів, контактних дермаСполуки винаходу можуть бути використані також у лікуванні гострої або хронічної ниркової тидів, лишаїв, пруриго, зуду, ук усів комах, при фіброзах і/або розладах дозрівання колагену, при недостатності, гломерулонефриту, діабетичної імунологічних розладах або дерматологічних станефропатії, серцевої ішемії і серцевої недостатнонах, наприклад, екземі. сті, інфаркту міокарду, ішемії нижніх кінцівок, короСполуки винаходу також можуть бути викориснарного вазоспазму, стенокардії, патологій серцевих клапанів, запальних серцевих захворювань, тані для профілактики і лікування хронічних запальних захворювань, зокрема, ревматоїдного артпобічних ефектів кардіотоксичних медикаментів риту і легеневих запальних хвороб, зокрема, або серцевої хірургії, атеросклерозу і його тромастми, синдрому гострого респираторного розладу боемболічних ускладнень, рестенозу, відторгнення і хронічної обструктивної легеневої хвороби, цистрансплантату або станів, пов'язаних з неправильними проліферацією або міграцією клітин гладтозного фіброзу, бронхо-легеневих захворювань, легеневих хвороб або легеневого фіброзу. ких м'язів. Отже, об'єктом винаходу є фармацевтичні Крім того, поточні дані у літературі вказують, композиції, які включають ефективну дозу щонайщо рецептор бензодіазепіну периферійного типу менше однієї сполуки загальної формули (І), у фоможе грати фундаментальну роль у регуляції проліферації клітин і у процесах розвитку раку. Взагармі основи, фармацевтично прийнятної солі, фармацевтично прийнятного сольвату або лі, порівняно з нормальними тканинами підвищенфармацевтично прийнятного гідрату, у суміші, якня густини рецепторів бензодіазепіну що потрібно, з належними ексціпієнтами. периферійного типу спостерігається у пухлинах і Зазначені ексціпієнти вибирають згідно з бараках різних типів. У астроцитомах людини рівень експресії рецежаною фармацевтичною формою і способом введення. птора бензодіазепіну периферійного типу корелює Фармацевтичні композиції винаходу можуть з рівнем злоякісності пухлини, індексом проліфепризначатись для орального, під'язичного, підшкірації і виживаємості пацієнтів. У пухлинах мозку рного, внутрішньом'язового, внутрішньовенного, людини підвищення кількості рецепторів бензодіазепіну периферійного типу використовують для локального, внутрішньотрахеального, внутрішньоносового, трансдермального, ректального або очдіагнозування і визначення терапевтичної цілі для ного введення. кон'югатів, утворених з лігандів рецептора бензоОдиничними формами введення можуть бути, діазепіну периферійного типу і з цитостатичних наприклад, таблетки, желатинові капсули, гранули, ліків. Висока густина рецепторів бензодіазепіну периферійного типу також спостерігається при порошки, розчини або суспензії для орального прийому або ін'єкцій, трансдермальні пластирі або карциномах яєчників і раку грудей. Щодо остансупозиторії. Для локального введення можна занього, було показано, що рівень експресії рецепстосовувати мазі, лосьйони і колірії. торів бензодіазепіну периферійного типу пов'яза 25 77984 26 Зазначені одиничні форми забезпечують денКомпозиції у формі сиропу або еліксиру або не введення 0,001-20мг активного агента на кг призначені для введення краплями можуть вклюмаси тіла. чати активний інгредієнт разом з підсолоджуваПри приготуванні таблеток до мікронізованого чем, бажано, безкалорійним, з метилпарабеном або немікронізованого активного агента додають або пропілпарабеном, як антисептиками, покрафармацевтичний носій, який може складатись з щувачами смаку і забарвлювачами. розріджувачів, наприклад, лактози, мікрокристаліПорошки і гранули, що диспергуються у воді, чної целюлози або крохмалю, і ад'ювантів, наприможуть включати активний інгредієнт у суміші з клад, зв'язуючих (полівінілпіролідону, гідроксипродиспергуючими або зволожуючими агентами, напілметилцелюлози тощо), агентів, підвищуючих приклад, полівінілпіролідоном, а також з пдсолотекучість, наприклад, кремнію, або змащувачів, джувачами і смаковими добавками. наприклад, стеарату магнію, стеаринових кислот, Для ректального введення можуть бути застогліцерилтрибегенату або стеарилфумарату насовані супозиторії, приготовлені з зв'язуючими, які трію. Можна додавати також зволожуючі або повеплавляться при ректальній температурі, наприрхневоактивні агенти, наприклад, лаурилсульфат клад, з маслом какао або поліети-ленгліколями. натрію. Для парентерального введення використовуСпособами приготування можуть бути пряме ють водні суспензії, ізотонічні сольові розчини або таблетування, сухе гранулювання, вологе гранустерильні розчини, які можна вводити ін'єкцією і які лювання або гаряче плавлення. містять фармакологічно сумісні диспергуючі і/або Таблетки можуть бути непокритими, покритизволожуючі агенти, наприклад, пропіленгліколь ми цукром, наприклад, сахарозою, різними поліабо бутиленгліколь. мерами або іншими належними матеріалами. Вони Активний інгредієнт можна також вводити у можуть мати будову, яка забезпечує швидке, заформі мікрокапсул, як варіант, з одним або декільтримане або уповільнене вивільнення активного кома носіями і добавками, або з полімерною матінгредієнта завдяки застосуванню полімерних марицею, або з циклодекстрилом (трансдермальні триць або спеціальних полімерів у покритті пластирі або форми з уповільненим вивільненПри приготуванні желатинових капсул активням). ний інгредієнт змішують з сухими, рідкими або наЛокальні композиції, згідно з винаходом, вклюпівтвердими фармацевтичними носіями (прямим чають середовище, сумісне з шкірою. Вони можуть змішуванням, сухою або вологою грануляцією, або мати, зокрема, форму водних, спиртових або водгарячим плавленням). носпиртових розчинів, желе, водномасляних або Желатинові капсули можуть бути жорсткими масловодних емульсій у вигляді крему або желе, або м'якими, без покриття або з покриттям тонкою мікроемульсій або аерозолів, або у формі везикуплівкою для забезпечення швидкої, уповільненої лярних дисперсій, що містіть іонні і/або неіонні або затриманої дії (наприклад, для ентеричних ліпіди. Ці фармацевтичні дозовані форми виготовформ). ляють методами, відомими у галузі. Комп’ютерна в ерстка Н. Лисенко Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of 3-heteroaryl-3,5-dihydro-4-oxo-4h-pyridazino[4,5-b]indol-1-carboxamide, method for synthesis, pharmaceutical compositions, intermediates (variants)
Автори англійськоюBurnier Philippe, Marabout Benoit
Назва патенту російськоюПроизводные 3-гетероарил-3,5-дигидро-4-оксо-4н-пиридазино[4,5-b]индол-1-карбоксамида, способ их получения (варианты), фармацевтическая композиция на их основе, промежуточное соединение (варианты)
Автори російськоюБюрнье Филипп, МАРАБУ Бенуа
МПК / Мітки
МПК: A61P 9/00, A61P 13/12, A61P 7/02, A61P 25/02, C07D 487/04, A61P 25/22, A61P 17/00, A61K 31/5025, A61P 25/00, A61P 37/02, A61P 11/00, A61P 19/02, A61P 25/08, A61K 31/5377, A61P 9/10, A61P 29/00, A61P 9/04, A61P 25/16, A61P 35/00, C07D 209/42, A61P 3/10, A61K 31/506, A61P 9/08, A61P 25/28
Мітки: спосіб, одержання, композиція, проміжна, 3-гетероарил-3,5-дигідро-4-оксо-4н-піридазино[4,5-b]індол-1-карбоксаміду, сполука, основі, похідні, варіанти, фармацевтична
Код посилання
<a href="https://ua.patents.su/13-77984-pokhidni-3-geteroaril-35-digidro-4-okso-4n-piridazino45-bindol-1-karboksamidu-sposib-kh-oderzhannya-varianti-farmacevtichna-kompoziciya-na-kh-osnovi-promizhna-spoluka-varianti.html" target="_blank" rel="follow" title="База патентів України">Похідні 3-гетероарил-3,5-дигідро-4-оксо-4н-піридазино[4,5-b]індол-1-карбоксаміду, спосіб їх одержання (варіанти), фармацевтична композиція на їх основі, проміжна сполука (варіанти)</a>
Попередній патент: Спосіб одержання вінілхлориду, здатного полімеризуватися, з вихідного продукту, одержаного при піролізі 1,2-дихлоретану
Наступний патент: Спосіб склеювання матеріалів на основі деревини, клейова система, її застосування, композиція фенольної смоли для клейової системи та виріб на основі деревини
Випадковий патент: Знаряддя для обробітку грунту












