Похідні азабіциклооктану, корисні при лікуванні серцевих аритмій, спосіб їх одержання (варіанти), фармацевтична композиція на їх основі та проміжна сполука
Номер патенту: 75057
Опубліковано: 15.03.2006
Автори: Свенссон Педер, Понтен Фрітьйоф, Страндлунд Герт, Бйорсне Магнус
Формула / Реферат
1. Сполука формули І
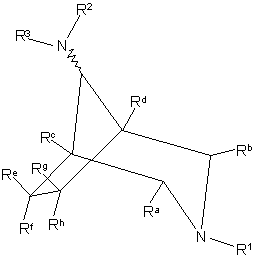 , I
, I
де хвилястий зв'язок означає, як варіант, ендо- або екзостереохімічну будову; один з R1 та R2 є R1а, а інший є фрагментом формули Іа,
 , Ia
, Ia
R1a є С1-12 алкілом (як варіант, заміщеним та/або закінченим одною або більше групами, вибраними з фенілу, Het1, -C(О)R7а, -OR7b, -N(R8)R7c, -C(O)XR9, -C(O)N(R10)R7d та -S(O)2R11), Het2, -C(O)R7a, -C(O)XR9, -C(O)N(R10)R7d та -S(O)2R11;
R7a-R7b незалежно означають Н, С1-6 алкіл (як варіант, заміщений та/або закінчений одним або більше замісниками, вибраними з С1-6 алкоксилу, галогену, фенілу, Het3 та -NHC(O)R12), фенілу або Het4;
R12 є С1-4 алкілом (як варіант, заміщеним та/або закінченим -NHC(O)R13) чи арилом;
R13 є С1-4 алкілом;
R8 є Н чи фенілом;
Х є О;
R9 є С1-12 алкілом (як варіант, заміщеним та/або закінченим -ОН, С1-6 алкоксилом, -SO2R15 чи Het5);
R15 є С1-6 алкілом чи арилом;
R10 є Н, С1-12 алкілом, С1-6 алкоксилом (останні дві групи, як варіант, заміщені та/або закінчені С1-4 алкоксилом), -D-фенілом, -D-Het6 чи -D-S(O)2R17a,
R17a є фенілом;
D означає прямий зв'язок або С1-6 алкілен;
R11 є С1-6 алкілом, фенілом чи Het7;
R4 є Н, -OR18, -E-N(R19)R20 або, разом з R5, = О;
R5 є Н або, разом з R4, = О;
R18 є Н, феніл чи -C(О)OR21b;
R19 є Н, чи –С(O)ОR21b;
R20 є Н;
R21b є С1-6 алкіл (як варіант, заміщений та/або закінчений фенілом);
Е означає прямий зв'язок або С1-4 алкілен;
Het1-Het7 окремо означають ізоксазоліл, тетрагідропіраніл, піразоліл, піперазиніл, морфолініл, піридиніл, бензоксадіазоліл, імідазоліл, імідазолідиніл, піроліл, тіазоліл чи бензодіоксаніл і ці групи, як варіант, заміщені одним або більше замісниками, вибраними з оксогрупи, галогену, С1-6 алкілу, -C(O)R23c та –N(R23g)С(O)R23h;
R23c, R23g та R23h окремо означають С1-6 алкіл або Н;
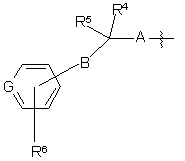
А означає прямий зв'язок чи -J-;
В є -Z-, -Z-N(R25)-, -N(R25)-Z-, -Z-S(O)n-, -Z-O- (у двох останніх групах Z приєднано до атома карбону, що несе R4 та R5);
J є С1-6 алкіленом, як варіант, заміщеним одним або більше замісниками, вибраними з -ОН, та аміногрупи;
Z означає прямий зв'язок або С1-4 алкілен;
R25 є Н;
G є СН або N;
R6 означає один або більше необов'язкових замісників, вибраних з ціаногрупи, галогену, С1-6 алкілу та С1-6 алкоксилу;
n є 2; та
Ra-Rh окремо означають Н;
R3 означає Н або С1-4 алкіл;
причому кожний феніл та фенілоксил, як варіант, заміщено;
або її фармацевтично прийнятне похідне;
за умови, що
коли А означає прямий зв'язок, то R4 та R5 разом не означають =O.
2. Сполука за п. 1, яка відрізняється тим, що необов'язкові замісники на фенілі та фенілоксилі означають одну або більше груп, вибраних з -ОН, галогену, ціаногрупи, нітрогрупи, С1-6алкілу, С1-6алкоксилу, -N(R27g)C(O)R27h та -S(O)nR26c, де R26c є С1-6 алкілом, R27g та R27h окремо означають Н або С1-6 алкіл, та n - як визначено у п. 1.
3. Сполука за будь-яким з пп. 1-2, яка відрізняється тим, що R1a є С1-8 алкілом (як варіант, заміщеним та/або закінченим однією або більше групами, вибраними із заміщеного, як варіант, фенілу, Het1, -C(O)R7a, -OR7b, -N(R8)R7c, -C(O)XR9, -C(O)N(R10)R7d та -S(O)2R11), Het2, -С(O)R7a, -C(O)XR9, -C(O)N(R10)R7d або -S(O)2R11.
4. Сполука за п. 3, яка відрізняється тим, що R7a-R7d окремо означають Н, С1-5 алкіл (як варіант, заміщений та/або закінчений одним або більше замісниками, вибраними з С1-4 алкоксилу, галогену, заміщеного, як варіант, фенілу, Het3 та -NHC(O)R12), заміщеного, як варіант, фенілу чи Het4.
5. Сполука за п. 4, яка відрізняється тим, що R12 є С1-3 алкілом (як варіант, заміщеним та/або закінченим -NHC(O)R13).
6. Сполука за п. 5, яка відрізняється тим, що R13 є С1-3 алкілом.
7. Сполука за будь-яким з пп. 1-6, яка відрізняється тим, що R9 є С1-8 алкілом (як варіант, заміщеним та/або закінченим -ОН, ціаногрупою, С1-4 алкоксилом, -SO2R15 чи Het5).
8. Сполука за п. 7, де R15 є С1-4алкілом.
9. Сполука за будь-яким з пп. 1-8, яка відрізняється тим, що R10 є Н, С1-8 алкілом, С1-4алкоксилом (останні дві групи, як варіант, заміщені та/або закінчені С1-4алкоксилом, -D- (як варіант, заміщений феніл), -D-Het6 чи -D-S(O)2R17a.
10. Сполука за будь-яким з пп. 1-9, яка відрізняється тим, що D означає прямий зв'язок.
11. Сполука за будь-яким з пп. 1-10, яка відрізняється тим, що R11 є С1-5 алкілом, заміщеним, як варіант, фенілом або Het7.
12. Сполука за будь-яким з пп. 1-11, яка відрізняється тим, що R4 є Н, -OR18 або -Е-N(R19)R20.
13. Сполука за будь-яким з пп. 1-12, яка відрізняється тим, що R5 є Н.
14. Сполука за будь-яким з пп. 1-13, яка відрізняється тим, що R18 є Н чи -Е-(заміщений, як варіант, феніл).
15. Сполука за будь-яким з пп. 1-14, яка відрізняється тим, що R21b є С1-4 алкілом (як варіант, заміщеним та/або закінченим фенілом).
16. Сполука за будь-яким з пп. 1-15, яка відрізняється тим, що Е означає прямий зв'язок.
17. Сполука за будь-яким з пп. 1-16, яка відрізняється тим, що Het1-Het7 заміщені, як варіант, одним або більше замісниками, вибраними з оксогрупи, галогену, C1-5 алкілу, -C(O)R23c та –N(R23g)C(O)R23h.
18. Сполука за п. 17, яка відрізняється тим, що R23c, R23g та R23h окремо означають Н або С1-3алкіл.
19. Сполука за будь-яким з пп. 1-18, яка відрізняється тим, що В є -Z-, -Z-N(R25)-, -Z-S(O)n- або -Z-O- (в останніх трьох групах Z приєднано до атома карбону, що несе R4 та R5).
20. Сполука за будь-яким з пп. 1-19, яка відрізняється тим, що J є С1-5алкіленом, як варіант, заміщеним одним замісником, вибраним з -ОН та аміногрупи.
21. Сполука за будь-яким з пп. 1-20, яка відрізняється тим, що Z означає прямий зв'язок або С1-3 алкілен.
22. Сполука за будь-яким одним з пп. 1-21, яка відрізняється тим, що R6 є одним або більше необов'язковим замісником, вибраним з ціаногрупи, галогену, С1-3 алкілу та С1-4 алкоксилу.
23. Сполука за п. 22, яка відрізняється тим, що R6 є однією або двома ціаногрупами.
24. Сполука за будь-яким з пп. 1-23, яка відрізняється тим, що R3 є Н або С1-2 алкілом.
25. Фармацевтична композиція, що має активність блокатора затриманого спрямленого струму К та містить сполуку за будь-яким з пп.1-24 у суміші з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм.
26. Фармацевтична композиція, що має активність блокатора затриманого спрямленого струму К для використання у профілактиці або лікуванні аритмії, яка містить як активний інгредієнт сполуку за будь-яким з пп. 1-24.
27. Сполука за будь-яким з пп. 1-24, яка відрізняється тим, що призначена для використання як лікарський препарат.
28. Сполука за будь-яким з пп. 1-24, яка відрізняється тим, що призначена для використання у профілактиці або лікуванні аритмії.
29. Сполука за будь-яким з пп. 1-24, яка відрізняється тим, що призначена для використання як активний інгредієнт у виробництві лікарських засобів для профілактики або лікування аритмії.
30. Сполука за п. 29, яка відрізняється тим, що аритмія є передсердною або шлуночковою.
31. Спосіб профілактики або лікування аритмії, який полягає у введенні терапевтично ефективної кількості сполуки за будь-яким з пп.1-24 особі, що потерпає від такого стану або схильна до нього.
32. Спосіб одержання сполуки формули І за п. 1, який включає:
реакцію сполуки формули IIА або ІІВ
 , IIA
, IIA
 , IIB
, IIB
де R1, R2, R3 та Ra-Rh визначено у п. 1, зі сполукою формули III
R28-L1, III
де R28 є (за прийнятністю) R1 або R2, L1 є групою, що відщеплюється, а R1 та R2 визначено у п. 1;
за потреби, перетворення одного R6 на інший;
за потреби, зняття захисту із захищеного похідного сполуки формули І за п. 1.
33. Спосіб одержання сполуки формули І за п. 1, в якій R1 або R2 (за прийнятністю) є -C(O)N(H)R10, який включає:
реакцію сполуки формули IIА або ІІВ (за прийнятністю),
 , IIA
, IIA
 , IIB
, IIB
як визначено вище (за винятком того, що R1 або R2 (за прийнятністю) не означає R1a), зі сполукою формули VI,
R10-N=C=O, VI
де R10 визначено у п. 1;
за потреби, перетворення одного R6 на інший;
за потреби, зняття захисту із захищеного похідного сполуки формули І за п. 1.
34. Спосіб одержання сполуки формули І за п. 1, в якій R1 або R2 (за прийнятністю) є фрагментом формули Іа, у якому А - СН2, а R4 - -ОН або -N(H)R19, який включає: реакцію сполуки формул IIА або ІІВ,
 , IIA
, IIA
 , IIB
, IIB
які визначено вище (за винятком того, що R1 або R2 (за прийнятністю) не є фрагментом формули Іа), зі сполукою формули VII,
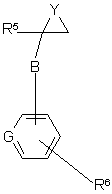 , VII
, VII
де Y є О або N(R19), a R5, R6, R19, В та G визначено у п. 1;
за потреби, перетворення одного R6 на інший;
за потреби, зняття захисту із захищеного похідного сполуки формули І за п. 1.
35. Спосіб одержання сполуки формули І за п. 1, в якій R4 є -OR18, де R18 є -Е-феніл, який включає:
реакцію відповідної сполуки формули І, в якій R4 є ОН, зі сполукою формули XI,
R18aOH, XI
де R18a є -Е-феніл, а Е визначено у п. 1;
за потреби, перетворення одного R6 на інший;
за потреби, зняття захисту із захищеного похідного сполуки формули І за п. 1.
36. Спосіб одержання сполуки формули І за п. 1, в якій R4 є -E-NH2, який полягає у відновленні сполуки формули ХІIIА або ХІІІВ
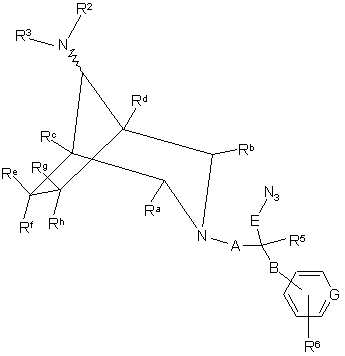 , XIIIA
, XIIIA
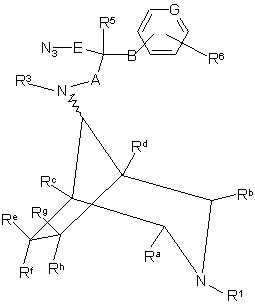 , XIIIB
, XIIIB
де R1 або R2 (за прийнятністю) означає R1a, a R1a, R3, R5, R6, Ra-Rh, А, В, Е та G як визначено у п. 1;
за потреби, перетворення одного R6 на інший;
за потреби, зняття захисту із захищеного похідного сполуки формули І за п. 1.
37. Спосіб одержання сполуки формули І за п. 1, в якій R4 - -Е-N(R19)R20, де R19 - –C(O)OR21b, який включає:
реакцію відповідної сполуки формули І, в якій R4 є -E-N(H)R20, зі сполукою формули XIV
R19a-L1, XIV
де R19a є –C(O)OR21b, a R21b, R20, та Е визначено у п. 1, і L1 визначено вище;
за потреби, перетворення одного R6 на інший;
за потреби, зняття захисту із захищеного похідного сполуки формули І за п. 1.
38. Спосіб одержання сполуки формули І за п. 1, в якій R3 є Н, а R2 є незаміщеним С1-4 алкілом, і який включає:
реакцію сполуки формули XXI
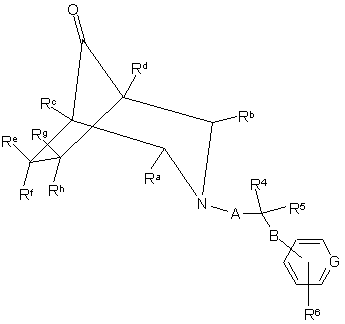 , XXI
, XXI
де R4, R5, R6, R1 до R11, А, В та G визначено у п. 1,
зі сполукою формули XXII
R31-NH2, XXII
де R31 є С1-4 алкілом, у присутності відновнику;
за потреби, перетворення одного R6 на інший;
за потреби, зняття захисту із захищеного похідного сполуки формули І за п. 1.
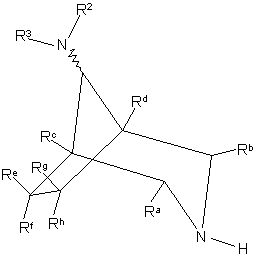
39. Сполука формули IIА або IIВ
 , IIA
, IIA
 , IIB
, IIB
де R1, R2, R3,тa Ra – Rh визначено у п. 1, або її захищене похідне, за умови, що сполука не є:
![]()
8-аміно-3-метил-3-азадицикло[3.2.1 ]октан;
8-аміно-3-ізопропіл-3-азадицикло[3.2.1]октан;
8-аміно-3-бензил-3-азадицикло[3.2.1]октан;
3-{2-[4-(6-амінопіридин-2-іл)феніл]етил}-3-азадицикло[3.2.1]окт-8-иламін або
трет-бутилкарбамат-3-азадицикло[3.2.1]окт-8-иламіну.
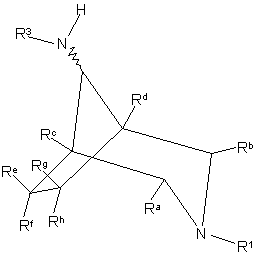
40. Сполука формули ХІIIА або ХІІІВ
 , XIIIA
, XIIIA
 , XIIIB
, XIIIB
де R1 або R2 (за прийнятністю) означає R1a, a R1a, R3, R5, R6, Ra-Rh, А, В, Е та G як визначено у п. 1;
або її захищене похідне.
41. Сполука формули XXI
 , XXI
, XXI
де R4, R5, R6, Rа-Rh, А, В та G визначено у п. 1 (за умови, що коли Rа-Rh всі є Н, G є СН, а R6 – відсутній, тоді –А-С(R4)(R5)-B- не є заміщеним етилом), або її захищене похідне.
Текст
1. Сполука формули І R2 3 75057 4 10. Сполука за будь-яким з пп. 1-9, яка відрізняридиніл, бензоксадіазоліл, імідазоліл, імідазолідиється тим, що D означає прямий зв'язок. ніл, піроліл, тіазоліл чи бензодіоксаніл і ці групи, як 11. Сполука за будь-яким з пп. 1-10, яка відрізняваріант, заміщені одним або більше замісниками, ється тим, що R11 є С1-5 алкілом, заміщеним, як вибраними з оксогрупи, галогену, С1-6 алкілу, 23c 23g 23h C(O)R та –N(R )С(O)R ; варіант, фенілом або Het7. 23c 23g 23h 12. Сполука за будь-яким з пп. 1-11, яка відрізняR ,R та R окремо означають С1-6 алкіл або ється тим, що R4 є Н, -OR18 або -Е-N(R19)R20. Н; 13. Сполука за будь-яким з пп. 1-12, яка відрізняА означає прямий зв'язок чи -J-; ється тим, що R5 є Н. В є -Z-, -Z-N(R25)-, -N(R25)-Z-, -Z-S(O)n-, -Z-O- (у 14. Сполука за будь-яким з пп. 1-13, яка відрізнядвох останніх групах Z приєднано до атома карбоється тим, що R18 є Н чи -Е-(заміщений, як варіну, що несе R4 та R5); J є С1-6 алкіленом, як варіант, заміщеним одним ант, феніл). 15. Сполука за будь-яким з пп. 1-14, яка відрізняабо більше замісниками, вибраними з -ОН, та аміється тим, що R21b є С1-4 алкілом (як варіант, заногрупи; Z означає прямий зв'язок або С1-4 алкілен; міщеним та/або закінченим фенілом). 16. Сполука за будь-яким з пп. 1-15, яка відрізняR25 є Н; ється тим, що Е означає прямий зв'язок. G є СН або N; 17. Сполука за будь-яким з пп. 1-16, яка відрізняR6 означає один або більше необов'язкових замісється тим, що Het1-Het7 заміщені, як варіант, одників, вибраних з ціаногрупи, галогену, С1-6 алкілу та С1-6 алкоксилу; ним або більше замісниками, вибраними з оксогn є 2; та рупи, галогену, C1-5 алкілу, -C(O)R23c та – a h R -R окремо означають Н; N(R23g)C(O)R23h. 18. Сполука за п. 17, яка відрізняється тим, що R3 означає Н або С1-4 алкіл; причому кожний феніл та фенілоксил, як варіант, R23c, R23g та R23h окремо означають Н або С1заміщено; 3алкіл. 19. Сполука за будь-яким з пп. 1-18, яка відрізняабо її фармацевтично прийнятне похідне; ється тим, що В є -Z-, -Z-N(R25)-, -Z-S(O)n- або -Zза умови, що коли А означає прямий зв'язок, то R4 та R5 разом O- (в останніх трьох групах Z приєднано до атома не означають =O. карбону, що несе R4 та R5). 2. Сполука за п. 1, яка відрізняється тим, що не20. Сполука за будь-яким з пп. 1-19, яка відрізняється тим, що J є С1-5алкіленом, як варіант, заміобов'язкові замісники на фенілі та фенілоксилі означають одну або більше груп, вибраних з -ОН, щеним одним замісником, вибраним з -ОН та амігалогену, ціаногрупи, нітрогрупи, С1-6алкілу, С1ногрупи. 27g 21. Сполука за будь-яким з пп. 1-20, яка відрізня)C(O)R27h та -S(O)nR26c, де R26c 6алкоксилу, -N(R ється тим, що Z означає прямий зв'язок або С1-3 є С1-6 алкілом, R27g та R27h окремо означають Н або С1-6 алкіл, та n - як визначено у п. 1. алкілен. 3. Сполука за будь-яким з пп. 1-2, яка відрізня22. Сполука за будь-яким одним з пп. 1-21, яка ється тим, що R1a є С1-8 алкілом (як варіант, замівідрізняється тим, що R6 є одним або більше щеним та/або закінченим однією або більше грунеобов'язковим замісником, вибраним з ціаногрупами, вибраними із заміщеного, як варіант, фенілу, пи, галогену, С1-3 алкілу та С1-4 алкоксилу. 23. Сполука за п. 22, яка відрізняється тим, що R6 Het1, -C(O)R7a, -OR7b, -N(R8)R7c, -C(O)XR9, C(O)N(R10)R7d та -S(O)2R11), Het2, -С(O)R7a, є однією або двома ціаногрупами. 24. Сполука за будь-яким з пп. 1-23, яка відрізняC(O)XR9, -C(O)N(R10)R7d або -S(O)2R11. 4. Сполука за п. 3, яка відрізняється тим, що R7aється тим, що R3 є Н або С1-2 алкілом. R7d окремо означають Н, С1-5 алкіл (як варіант, 25. Фармацевтична композиція, що має активність заміщений та/або закінчений одним або більше блокатора затриманого спрямленого струму К та замісниками, вибраними з С1-4 алкоксилу, галогемістить сполуку за будь-яким з пп.1-24 у суміші з ну, заміщеного, як варіант, фенілу, Het3 та фармацевтично прийнятним ад'ювантом, розріNHC(O)R12), заміщеного, як варіант, фенілу чи джувачем або носієм. Het4. 26. Фармацевтична композиція, що має активність 5. Сполука за п. 4, яка відрізняється тим, що R12 блокатора затриманого спрямленого струму К для є С1-3 алкілом (як варіант, заміщеним та/або закінвикористання у профілактиці або лікуванні аритмії, ченим -NHC(O)R13). яка містить як активний інгредієнт сполуку за будь6. Сполука за п. 5, яка відрізняється тим, що R13 яким з пп. 1-24. 27. Сполука за будь-яким з пп. 1-24, яка відрізняє С1-3 алкілом. 7. Сполука за будь-яким з пп. 1-6, яка відрізняється тим, що призначена для використання як ється тим, що R9 є С1-8 алкілом (як варіант, замілікарський препарат. 28. Сполука за будь-яким з пп. 1-24, яка відрізнященим та/або закінченим -ОН, ціаногрупою, С1-4 ється тим, що призначена для використання у алкоксилом, -SO2R15 чи Het5). 15 8. Сполука за п. 7, де R є С1-4алкілом. профілактиці або лікуванні аритмії. 9. Сполука за будь-яким з пп. 1-8, яка відрізня29. Сполука за будь-яким з пп. 1-24, яка відрізняється тим, що R10 є Н, С1-8 алкілом, С1ється тим, що призначена для використання як активний інгредієнт у виробництві лікарських засо4алкоксилом (останні дві групи, як варіант, заміщені та/або закінчені С1-4алкоксилом, -D- (як варіант, бів для профілактики або лікування аритмії. 30. Сполука за п. 29, яка відрізняється тим, що заміщений феніл), -D-Het6 чи -D-S(O)2R17a. аритмія є передсердною або шлуночковою. 5 75057 31. Спосіб профілактики або лікування аритмії, який полягає у введенні терапевтично ефективної кількості сполуки за будь-яким з пп.1-24 особі, що потерпає від такого стану або схильна до нього. 32. Спосіб одержання сполуки формули І за п. 1, який включає: реакцію сполуки формули IIА або ІІВ R2 R3 6 H R3 Rd Rf Rc Rb Rg Ra Rh N H , IIA H R3 N Rd N N Rb g Re R Rd Rh Ra N Rc R1 , IIB де R1, R2, R3 та Ra-Rh визначено у п. 1, зі сполукою формули III R28-L1, III де R28 є (за прийнятністю) R1 або R2, L1 є групою, що відщеплюється, а R1 та R2 визначено у п. 1; за потреби, перетворення одного R6 на інший; за потреби, зняття захисту із захищеного похідного сполуки формули І за п. 1. 33. Спосіб одержання сполуки формули І за п. 1, в якій R1 або R2 (за прийнятністю) є -C(O)N(H)R10, який включає: реакцію сполуки формули IIА або ІІВ (за прийнятністю), R2 R3 N Rb g Re R Rh Ra N H , IIA Ra Rh Rf N H , IIA H R3 N Rd Rc Rb Rg Rf Rc Rb Rg Re Re Rd Rf Ra Rh R1 , як визначено вище (за винятком того, що R1 або R2 (за прийнятністю) не означає R1a), зі сполукою формули VI, R10-N=C=O, VI де R10 визначено у п. 1; за потреби, перетворення одного R6 на інший; за потреби, зняття захисту із захищеного похідного сполуки формули І за п. 1. 34. Спосіб одержання сполуки формули І за п. 1, в якій R1 або R2 (за прийнятністю) є фрагментом формули Іа, у якому А - СН2, а R4 - -ОН або N(H)R19, який включає: реакцію сполуки формул IIА або ІІВ, R2 R3 Rc Rf Rb g Re R N Rf IIB Rc Rd Re N Rh Ra N R1 , IIB 1 які визначено вище (за винятком того, що R або 2 R (за прийнятністю) не є фрагментом формули Іа), зі сполукою формули VII, 7 75057 8 37. Спосіб одержання сполуки формули І за п. 1, в Y якій R4 - -Е-N(R19)R20, де R19 - –C(O)OR21b, який R5 включає: реакцію відповідної сполуки формули І, в якій R4 є B -E-N(H)R20, зі сполукою формули XIV 19a 1 R -L , XIV , VII де R19a є –C(O)OR21b, a R21b, R20, та Е визначено у п. 1, і L1 визначено вище; G за потреби, перетворення одного R6 на інший; за потреби, зняття захисту із захищеного похідного сполуки формули І за п. 1. R6 38. Спосіб одержання сполуки формули І за п. 1, в де Y є О або N(R19), a R5, R6, R19, В та G визначено якій R3 є Н, а R2 є незаміщеним С1-4 алкілом, і який у п. 1; включає: за потреби, перетворення одного R6 на інший; реакцію сполуки формули XXI за потреби, зняття захисту із захищеного похідного O сполуки формули І за п. 1. 35. Спосіб одержання сполуки формули І за п. 1, в якій R4 є -OR18, де R18 є -Е-феніл, який включає: Rd реакцію відповідної сполуки формули І, в якій R4 є ОН, зі сполукою формули XI, Rc Rb R18aOH, XI g e R де R18a є -Е-феніл, а Е визначено у п. 1; R за потреби, перетворення одного R6 на інший; , XXI Ra за потреби, зняття захисту із захищеного похідного R4 h Rf R сполуки формули І за п. 1. N R5 A 36. Спосіб одержання сполуки формули І за п. 1, в B якій R4 є -E-NH2, який полягає у відновленні сполуG ки формули ХІIIА або ХІІІВ R2 R3 N R6 Rd Rc Rb Rg Re , XIIIA N3 Ra Rh Rf E N R5 A B де R4, R5, R6, R1 до R11, А, В та G визначено у п. 1, зі сполукою формули XXII R31-NH2, XXII де R31 є С1-4 алкілом, у присутності відновнику; за потреби, перетворення одного R6 на інший; за потреби, зняття захисту із захищеного похідного сполуки формули І за п. 1. 39. Сполука формули IIА або IIВ R2 R3 G N R6 N3 R3 E N Rd G R5 g Re R A , XIIIB Rc 1 Rb Rg Rf Rh 2 Rb R6 Rd Re , IIA Rc B Ra N R1 де R або R (за прийнятністю) означає R1a, a R1a, R3, R5, R6, Ra-Rh, А, В, Е та G як визначено у п. 1; за потреби, перетворення одного R6 на інший; за потреби, зняття захисту із захищеного похідного сполуки формули І за п. 1. Rf Rh Ra N H 9 75057 10 H R3 R5 N N3 R3 , XIIIB Rc 3 Re Ra Rh 2 N a R1 ( )(8 , ) 3 åòèë 3 àçàäèöèêëî [3.2.1]îêòàí 8 àì³í ; 8-аміно-3-метил-3-азадицикло[3.2.1 ]октан; 8-аміно-3-ізопропіл-3-азадицикло[3.2.1]октан; 8-аміно-3-бензил-3-азадицикло[3.2.1]октан; 3-{2-[4-(6-амінопіридин-2-іл)феніл]етил}-3азадицикло[3.2.1]окт-8-иламін або трет-бутилкарбамат-3-азадицикло[3.2.1]окт-8иламіну. 40. Сполука формули ХІIIА або ХІІІВ Rb Rg Ra Rh Rf h де R , R , R ,тa R – R визначено у п. 1, або її захищене похідне, за умови, що сполука не є: 1 N R1 де R або R (за прийнятністю) означає R1a, a R1a, R3, R5, R6, Ra-Rh, А, В, Е та G як визначено у п. 1; або її захищене похідне. 41. Сполука формули XXI 2 O Rd Rc R2 Re Rb Rg N Rf Rd , XXI Ra R4 N R5 A Rb G g Re R , XIIIA N3 Rh Rh B Rc Rf R6 Rd Rb g Re R R3 B A , IIB Rc 1 E N Rd Rf G Ra R6 E N R5 A B G де R4, R5, R6, Rа-Rh, А, В та G визначено у п. 1 (за умови, що коли Rа-Rh всі є Н, G є СН, а R6 – відсутній, тоді –А-С(R4)(R5)-B- не є заміщеним етилом), або її захищене похідне. R6 Згідно з цим винаходом запропоновано нові фармацевтично корисні сполуки, зокрема сполуки, які корисні при лікуванні серцевих аритмій. Серцеві аритмії можна визначити як ненормальності частоти, регулярності чи місця походження серцевого імпульсу, або як порушення провідності, що викликає ненормальну послідовність активації. Аритмії можна класифікувати клінічно за ознаками прогнозованого місця походження (тобто як суправентрикулярного, включаючи атріальне та атріовентрикулярне, аритмій та вентрикулярних аритмій) та/або за ознаками частоти (тобто брадикардії (повільна) та тахікардії (швидка)). При лікуванні серцевих аритмій негативні наслідки при клінічній перевірці (дивися, наприклад, результати дослідження пригнічення серцевої аритмії (Cardiac Arrhythmia Suppression Trial CAST), що представлено у New England Journal of Medicine, 321, 406 (1989)) "традиційними" антиаритмічними ліками, які діють перш за все уповільненням швидкості провідності (клас І антиаритмічних ліків), спрямовують розвиток лікувальних засобів в напрямі сполук, які селективно затримують серцеву реполяризацію, отже подовжуючи інтервал QT. Клас III антиаритмічних ліків можна визначити як ліки, які подовжують тривалість транс-мембранної дії потенціалу (що може бути викликаним блокуванням спрямованого назовні струму К+, чи зростанням спрямованого всередину іонного струму) та затятість, без впливу на серцеву провідність. Одним з ключових недоліків відомих до цього часу ліків, які діють затримкою реполяризації (клас III або інакший) є те, що усі відомі з них виявляють унікальну форму проаритмії, відому як torsades de pointes (пірует, зміна ритму), яка може бути фатальною. З точки зору безпеки мінімізація цього явища (показано, що воно виявляється як результат вживання несерцевих ліків, як-то фенотіазин, трициклічні антидепресанти, антигістаміни та антибіотики) є ключовою проблемою, що потребує вирішення для забезпечення ефективних антиаритмічних ліків. Антіаритмічні ліки на основі біспідинів (3,7діазадицикло[3,3,1]нонанів) відомі серед іншого з міжнародних патентних заявок WO 91/07405 та WO 99/31100, Європейських патентних заявок 306871, 308843 та 665228 і патентів США 3962449, 11 75057 12 4556662, 4550112, 4459301 та 5468858, а також алкілен (цей алкілен, як варіант, розірваний ато6 статей у журналах, включаючи серед іншого J. мом О та/або, як варіант, заміщено одним або біMed. Chem. 39, 2559, (1996), Pharmacol. Res., 24, льше С1-3алкілом); 149 (1991), Circulation, 90, 2032\1994) ma Anal. Sci. R12 представляє Н, С1-4алкіл (як варіант, замі9, 429, (1993). 3-азадицикло[3,2,1]октанові сполуки щений та/або закінчений одним або більше замісне розкрито чи не запропоновано у будь-якому з никами, вибраними з галогену, ціаногрупи, арилу цих документів. та -NHC(O)R13) або арил; Сполуки на основі 3-азадицикло[3,2,1]октанів є R13 представляє Н, С1-4алкіл або арил; відомими стосовно використання у ряді інших меR8 представляє Н, С1-6алкіл (як варіант, замідичних застосувань, включаючи антагонізм серощений та/або закінчений одним або більше замістоніну (як. описано в патентах ЕР 212802 та ЕР никами, вибраними з -ОН, галогену, ціаногрупи, 645 391), антагонізм рецепторів нейрокініну-1 (як нітрогрупи та арилу), арил, -C(O)R14a або описано у WO 98/18788), інгібування синтази окC(O)OR14b; сиду нітрогену (як описано у WO 97/36871) та анаR14a та R14b представляють С1-6алкіл (як варілгезію (як описано у Rico, В, et al., J. Heterocycl. ант, заміщений та/або закінчений одним або більChem. 31(2), 313-318 (1994)). У жодному з цих доше замісниками, вибраними з -ОН, галогену, ціанокументів не розкрито чи не запропоновано викоригрупи, нітрогрупи та арилу) або арил, або R14a стання сполук на основі 3-азадицикло[3,2,1]октану представляє Н; як антиаритмічних засобів. X представляє О або S; Нами неочікувано виявлено, що нові групи R9 представляє, при його наявності, С1-12алкіл сполук на основі 3-азадицикло[3,2,1]октану вияв(як варіант, заміщений та/або закінчений одним ляють електрофізіологічну активність, переважно або більше замісниками, вибраними з -ОН, галогеелектрофізіологічну активність класу III, і можна, ну, ціаногрупи, нітрогрупи, арилу, C1-6алкоксилу, відповідно, очікувати, що вони корисні при лікуSO2R15 та Het5); ванні серцевих аритмії. R15 представляє С1-6алкіл або арил; Згідно з винаходом запропоновано сполуки R10 представляє, при його наявності, Н, С1формули І 12алкіл, С1-6алкоксил (останні дві групи, як варіант, заміщені та/або закінчені одним або більше замісниками, вибраними з -ОН, галогену, ціаногрупи, нітрогрупи, С1-4алкілу та С1-4алкоксилу), -D-арил, D-арилоксил, -D-Het6, -D-N(H)C(O)R16a, -D17a 16b S(O)2R , -D-C(O)R , -D-C(O)OR17b, -D16c 16d 10 7d C(O)N(R )R , або R , разом з R , представляє С3-6алкілен (цей алкілен, як варіант, розірваний атомом О та/або, як варіант, заміщено одним або більше С1-3алкілом); R16a-R16d незалежно представляють Н, С16алкіл (як варіант, заміщений та/або закінчений одним або більше замісниками, вибраними з -ОН, де хвилястий зв'язок представляє, як варіант, галогену, ціаногрупи, нітрогрупи та арилу), арил, ендо- або екзо- стереохімічну будову; один з R1 та або R16a та R16d разом представляють С3-6алкілен; R2 представляє R1a, а інший представляє фрагR17a та R17b незалежно представляють С1мент формули Іа, 6алкіл (як варіант, заміщений та/або закінчений одним або більше замісниками, вибраними з -ОН, галогену, ціаногрупи, нітрогрупи та арилу) або арил; D представляє прямий зв'язок або С1-6алкілен; R11 представляє, при його наявності, С1-6алкіл (як варіант, заміщений та/або закінчений одним або більше замісниками, вибраними з -ОН, галогену, ціаногрупи, нітрогрупи та арилу), арил або Het7; R4 представляє Н, галоген, С1-6алкіл, -OR18, -E19 N(R )R20 або, разом з R5, представляє =О; R5 представляє Н, С1-6алкіл або, разом з R4, представляє =О; R1a представляє С1-12алкіл (як варіант, заміR18 представляє Н, С1-6алкіл, -Е-арил, -E-Het8, щений та/або закінчений одною або більше група-C(O)R21a, -C(O)OR21b або -C(O)N(R22a)R22b; ми, вибраними з галогену, ціаногрупи, нітрогрупи, R19 представляє Н, С1-6алкіл. -Е-арил, -E-Het8, арилу, Het1, -C(O)R7a, -OR7b, -N(R8)R7C, -C(O)XR9, 10 7d 11 2 7a -C(O)R21a, -C(O)OR21b, -S(O)2R21c, C(O)N(R )R та -S(O)2R ), Het , -C(O)R , 22a 22b 9 10 7d 11 [C(O)]pN(R )R або -C(NH)NH2; C(O)XR , -C(O)N(R )R aбo -S(O)2R ; R20 представляє Η, С1-6алкіл, -Е-арил або R7a-R7d незалежно представляють, при наявC(O)R21d; ності кожного, Η, С1-6алкіл (як варіант, заміщений R21a-R21d незалежно представляють, при наявта/або закінчений одним або більше замісниками, ності кожного, С1-6алкіл (як варіант, заміщений вибраними з -ОН, С1-6алкоксилу, галогену, ціаногта/або закінчений одним або більше замісниками, рупи, нітрогрупи, арилу, Het3 та -NHC(O)R12), арил 4 7d 10 вибраними з галогену, арилу та Het9), арил, Het10, або Het , або R , разом з R , представляють С 3 13 75057 14 або R21a тa R21d незалежно представляють Н; останній групі N(R25) приєднано до атому карбону, R22a та R22b незалежно представляють, при що несе R4 та R5), -S(O)n-, -О- або -N(R25)C(O)O-Z-; наявності кожного, Η або С1-6алкіл (як варіант, за(c) коли А представляє прямий зв'язок, то R4 міщений та/або закінчений одним або більше заміта R5 разом не представляють =O; та 11 сниками, вибраними з галогену, арилу та Het ), (d) сполукою не є: 12 арил, Het , або разом представляють С3-6алкілен, (±)(8 )-4-аміно-5-хлор-2-метокси-N-(3-бензилщо як варіант, розірваний атомом О; 3-азадицикло-[3.2.1]окт-8-ил)бензамід; Ε представляє, при його наявності, прямий (5)-N-(3-бензил-3-азадицикло[3.2.1]окт-8-ил)-4зв'язок або С1-4алкілен; аміно-5-хлор-2-(1-метил-2-бутиніл)оксибензамід; р дорівнює 1 або 2; або Het1-Het12 незалежно представляють, при наягідрохлорид (5)-N-(3-бензил-3вності кожного, п'яти-дванадцяти-членні гетероциазадицикло[3.2.1]окт-8-ил)-4-аміно-5-хлор-2-(1кли, що містять один або більше гетероатомів, метил-2-бутиніл)оксибензаміду, вибраних з оксигену, нітрогену та/або сульфуру, ці ці сполуки позначені далі як "сполуки згідно з групи, як варіант, заміщені одним або більше замівинаходом". сниками, вибраними з -ОН, оксогрупи, галогену, Якщо не визначено інше, алкіли та алкоксили, ціаногрупи, нітрогрупи, С1-6алкілу, С1-6алкоксилу, які тут визначені, можуть бути з лінійним ланцюгом арилу, арилоксилу, -N(R23a)R23b, -C(O)R23c, або, коли є достатнє число (тобто мінімум три) C(O)OR23d, -C(O)N(R23e)R23f, -N(R239)C(O)R23h та атомів карбону, бути з розгалуженим ланцюгом 23і 23j N(R )S(O)2R ; та/або циклічними. Більш того, коли є достатнє R23a-R23j незалежно представляють С1-6алкіл, число (тобто мінімум чотири) атомів карбону, такі арил або R23a-R23i незалежно представляють Н; алкіли та алкоксили можуть також мати циклічА представляє прямий зв'язок, -J-, -J-N(R24)ні/ациклічні частини. Такі алкіли та алкоксили моабо -J-O- (у двох останніх групах N(R24)-або Ожуть також бути насиченими або, коли є достатнє приєднано до атому карбону, що несе R4 та R5); число (тобто мінімум два) атомів карбону, ненасиВ представляє -Z-, -Z-N(R25)-, -N(R25)-Z-, -Zченими та/або розірваними одним або більше S(O)n-, -Z-O- (у двох останніх групах Ζ приєднано атомами оксигену та/або сульфуру. Якщо не видо атому карбону, що несе R4 та R5), значено інше, алкіли та алкоксили можуть також N(R25)C(O)O-Z-, (у останній групі -N(R25) приєднано бути заміщеними одним або більше атомами галодо атому карбону, що несе R9 та R10) або гену, а конкретно атомами флуору. C(O)N(R25)- (у останній групі -С(О) приєднано до Якщо не визначено інше, алкілен, який тут ви4 5 атому карбону, що несе R та R ); значено, може бути з лінійним ланцюгом або, коли J представляє С1-6алкілен, як варіант, заміщеє достатнє число (тобто мінімум два) атомів карний одним або більше замісниками, вибраними з бону, бути з розгалуженим ланцюгом. Такі ланцюОН, галогену та аміногрупи; ги алкілену можуть також бути насиченими або, Ζ представляє прямий зв'язок або С1-4алкілен; коли є достатнє число (тобто мінімум два)атомів 24 25 R та R незалежно представляють Η або С1карбону, бути ненасиченими та/або розірваними одним або більше атомами оксигену та/або суль6алкіл; G представляє СН або Ν; фуру. Якщо не визначено інше, алкілени можуть R6 представляє один або більше необов'язкотакож бути заміщеними одним або більше атомавих замісників, вибраних з -ОН, ціаногрупи, галоми галогену. гену, нітрогрупи, С1-6алкілу (як варіант, закінченого Термін "арил", використаний тут, включає С6групою -N(H)C(O)OR26a), C1-6алкоксилу, 10арили, як-то феніл, нафтил та подібне Термін N(R27a)R27b, -C(O)R27c, -C(O)OR27d, -C(O)N(R27c)R27f, "арилоксил", використаний тут, включає С6-N(R27s)C(O)R27h, -N(R27l)C(O)N(R27))R27k, 10арилоксили, як-то феноксил, нафтоксил та подіN(R27m)S(O)2R26b, -S(O)nR26c та/або -OS(O)2R26d; бне. Для уникнення дублювання визначені тут R26a-R26d незалежно представляють С1-6алкіл; арилоксили приєднані до залишку молекули через R27a-R27m незалежно представляють Η або С1О-атом оксигрупи. Якщо не визначено інше, арили та арилоксили можуть бути заміщеними одним або 6алкіл; n дорівнює, у кожному випадку, 0, 1 або 2; а більше замісниками, включаючи -ОН, галоген, Ra-Rh та R3 незалежно представляють Η або Het1, ціаногрупу, нітрогрупу, С1-6алкіл, СГ6алкоксил, С1-4алкіл; -N(R27a)R27b, -C(O)R27c, -C(O)OR27d, 27c 27f 279 причому кожний арил та арилоксил, якщо не C(O)N(R )R , -N(R )C(O)R27h, визначено інше, як варіант, заміщено; N(R27m)S(O)2R26b, -S(O)nR26c та/або -OS(O)2R26d (де або їх фармацевтично прийнятне похідне; Het1, R26b-R26d, R27a-R27m та n визначено вище). за умови, що Коли арили та арилоксили заміщені, вони перева(a) коли А представляє -J-N(R24)- або -J-O-, то: жно заміщені 1-3 замісниками. Коли арил заміще(і) J не представляє С1алкілен; а ний одною або більше групами Het1, будь-який (іі) В не представляє -N(R25)-, -N(R25)-Z- (у арил(и), яким вказана група(и) Het1 може бути за25 останній групі N(R ) приєднано до атому карбону, міщена, не може сам(самі) бути заміщеним будьщо несе R4 та R5), -S(O)n-, -О- або -N(R25)C(O)O-Z-, якою групою(ами) Het1. коли R4 та R5 разом не представляють =O; Термін "галоген", використаний тут, включає (b) коли R4 представляє -OR18 або -N(R19)R20), флуор, хлор, бром та йод. то: Групи Het (Het1, Het2, Het3, Het4, Het5, Het6, 24 7 (і) А не представляє -J-N(R )- або -J-O-; а Het , Het8, Het9, Het10, Het11 та Het12), що можуть 25 25 іі) В не представляє -N(R )-, -N(R )-Z- (у бути згаданими, включають ті, що містять 1-4 ге 15 75057 16 тероатоми (вибрані з групи: оксиген, нітроген лити використанням звичайних способів, наприта/або сульфур), та в яких загальне число атомів у клад хроматографією або фракційною кристалізакільцевій системі складає 5-12. Групи Het (Het1, цією. Різні стереоізомери можна виділити роздіHet2, Het3, Het4, Het5, Het6, Het7, Het8, Het9, Het10, ленням рацемічної або іншої звичайно Het11 та Het12) можуть бути повністю насиченими, використовуваної суміші сполук, наприклад спосоцілком ароматичними, частково ароматичними бами фракційної кристалізації або ВЕРХ. Альтерта/або дициклічними за природою. Гетероцикли, нативно, потрібні оптичні ізомери можна виготовиякі можуть бути згаданими, включають бензодіти реакцією прийнятних оптично активних вихідних оксаніл, бензодіоксепаніл, бензодіоксоліл, бензоматеріалів в умовах, які не спричинюють рацеміфураніл, бензофуразаніл, бензимідазоліл, бензозацію або епімеризацію, або дериватизацією, наморфолініл, бензотіофеніл, хроманіл, цинолініл, приклад гомохіральною кислотою, з наступним діоксаніл, фураніл, гідантоїніл, імідазоліл, імідарозділенням діастереомерних естерів звичайними засобами (наприклад хроматографією ВЕРХ на зо[1,2- ]піридиніл, індоліл, ізохінолініл, ізоксазоліл, діоксиді силіцію). Усі стереоізомери включено у малеімідогрупу, мор-фолініл, оксазоліл, фталазирамки винаходу. ніл, піперазиніл, піперидиніл, пуриніл, піраніл, піЗгідно з наступним аспектом винаходу, запроразиніл, піра-золіл, піридиніл, піримідиніл, піроліпоновано сполуки формули І, які визначено вище, диноніл, піролідиніл, піролінил, піроліл, за додаткової умови, що коли Het1 або Het4 предхіназолініл, хі-нолініл, 3-сульфоленіл, тетрагідроставляє піперазин-1-іл, тоді піперазиніл не несе як піраніл, тетрагідрофураніл, тіазоліл, тієніл, тіохрозамісник 3,4-дихлорфеніл. маніл, триазоліл та подібне. Значення Het1, які Згідно з наступним аспектом винаходу, запроможуть бути згаданими, включають малеімідогрупоновано сполуки формули І, які визначено вище, пу та піперазиніл. Значення Het2, які можуть бути але без умови (d) та за додаткової умови, що: згаданими, включають тіазоліл. Значення Het3, які (і) коли R1 представляє фрагмент формули Іа, можуть бути згаданими, включають гідантоїніл. 4 в якій А представляє J, В представляє Z, a R4 та Значення Het , які можуть бути згаданими, вклюR5 представляють Η або С1-6алкіл; чають бензодіоксаніл, бензофуразаніл, піразоліл 5 то R2 не представляє С1-10алкіл, заміщений та піроліл. Значення Het , які можуть бути згадаHet1 або -C(O)Het4 (де Het1 або Het4 представляє ними, включають морфолініл, піперазиніл та піригомопіперазин-1-іл, піперазин-1-іл або 1диніл. Значення Het6, які можуть бути згаданими, імідазолідиніл, причому гомопіперазиніл, піперавключають ізоксазоліл та тетрагідропіраніл. Зназиніл або імідазолідиніл заміщено у 4-, 4- або 3чення Het7, які можуть бути згаданими, включають позиці (відповідно) -C(O)R (в якому R23c представімідазоліл, піразоліл, 3-сульфоленіл та тіазоліл. 1 2 3 4 ляє арил) та (на одному з кільцевих С-атомів) ариЗамісники на групах Het (Het , Het , Het , Het , лом і при цьому гомопіперазиніл, піперазиніл або Het5, Het6, Het7, Het8, Het9, Het10, Het11 та Het12) імідазолідиніл крім того, як варіант, заміщено С1можуть, де прийнятно, бути розташованими на будь-якому атомі у кільцевій системі, включаючи 6алкілом), а С1-10алкіл, як варіант, заміщено одним замісником вибраним, як варіант, із заміщеного гетероатом. Точка приєднання груп Het (Het1, Het2, фенілу, ціаногрупи, -OR7b, -C(NR8)R7c, -C(O)OR9, Het3, Het4, Het5, Het6, Het7, Het8, Het9, Het10, Het11 та 12 C(O)(NR10)R7d, (де R7b, R7c, R7d, Het ) може бути на будь-якому атомі у кільцевій R9 та R10 представляють Н, С1-6алкіл або, як системі, включаючи (де прийнятно) гетероатом, варіант, заміщений феніл), імідазоліл або, як варіабо атом на будь-якому конденсованому карбоциант, заміщений індоліл; клічному кільці, що може бути представлене як (іі) коли Ra-Rh та R3 усі представляють Н; а частин кільцевої системи. Групи Het (Het1, Het2, 3 4 5 6 7 8 9 10 11 R1 представляє фрагмент формули Іа, в якоHet , Het , Het , Het , Het , Het , Het , Het , Het та му, група -A-C(R4)(R54)-B- представляє С1-3алкілен, Het12) можуть також бути у формі з окисненими G представляє СН, a R6 відсутній; атомами N або S. тоді R2 не представляє групу -C(O)R7a, де R7a Фармацевтично прийнятні похідні включають представляє феніл, заміщений у 2-позиції С3солі та сольвати. Солі, які можуть бути згаданими, включають кислотно-адитивні солі. Фармацевтич6алкінілоксилом (як варіант, розірваним атомом оксигену), у 4-позиції групою -N(R27a)R27b або груно прийнятні похідні також включають, при 3пою -N(H)C(O)R27h (де R27h представляє С1-6алкіл), азадицикло[3,2,1]октановому або (коли G предстаа у 5-позиції галогеном, та вляє N) піридиловому атомах нітрогену, С1(ііі) коли R3 представляє Н; а 4алкілчетвертинні солі амонію та N-оксиди, за R1 представляє фрагмент формули Іа, в якому умови, що коли наявний N-оксид. 1 2 3 4 5 6 група -A-C(R4)(R54)-B- представляє С1-2алкілен, G (a) групи Het (Het , Het , Het , Het , Het , Het , 7 8 9 10 11 12 представляє СН, a R6 представляє один або два Het , Het , Het , Het , Het та Het ) не містять замісники, вибрані з С1-6алкілу (як варіант, розірнеокиснений атом S; та/або ваного атомом оксигену), С1-4алкоксилу, CF3, гало(b) n не дорівнює 0, коли В представляє -Zгену, нітрогрупи, -С(О)ОН або -С(О)О-С1-6алкілу); S(O)n-. 2 7a 7a тоді R не представляє -C(O)R , де R предСполуки згідно з винаходом можуть виявляти ставляє феніл, заміщений у 2-позиції С1таутомерію. Усі таутомери, що утворюється, та їх 27h суміші включено у рамках винаходу. 6алкоксилом, у 4-позиції -NH2 або -N(H)C(O)R 27h (де R представляє С1-6алкіл), а у 5-позиції галоСполуки згідно з винаходом можуть також місгеном або -SR26c. тити один або більше асиметричних атомів карбоСкорочення наведено в кінці опису. ну та можуть, відповідно, виявляти оптичну та/або Кращі сполуки згідно з винаходом включають діастереоізомерію. Діастереоізомери можна відді 17 75057 18 ті в яких: варіант, заміщені одним або більше замісниками, R1a представляє С1-8алкіл (як варіант, заміщевибраними з оксогрупи, галогену, ціаногрупи, С123a ний та/або закінчений одною або більше групами, )R23b, -C(O)R23c, 5алкілу, С1-4алкоксилу, -N(R 23d 23e 23f вибраними з галогену, як варіант, заміщеного ариC(O)OR , -C(O)N(R )R та -N(R239)C(O)R23h. 1 7a 7b 8 7c 9 лу, Het , -C(O)R , -OR , -N(R )R , -C(O)XR , R23a- R23h незалежно представляють Η або С110 7d 11 2 7a C(O)N(R )R та -S(O)2R ), Het , -C(O)R , алкіл. 3 C(O)XR9, -C(O)N(R10)R7d aбo -S(О)2R11; А представляє прямий зв'язок або -J-. 7a- 7d R R незалежно представляють, у кожному В представляє -Ζ-, -Z-N(R25)-, -Z-S(O)n- або -Zвипадку, Η, С1-5алкіл (як варіант, заміщений та/або O- (в останніх трьох групах Ζ приєднано до атому закінчений одним або більше замісниками, вибракарбону, що несе R4 та R5). ними з -ОН, С1-4алкоксилу, галогену, ціаногрупи, як J представляє С1-5алкілен, як варіант, заміщеваріант, заміщеного арилу, Het3 та -NHC(O)R12), як ний одним або більше замісниками, вибраними з варіант, заміщений арил або Het4, або R7d, разом з ОН, галогену та аміногрупи. R10, представляють С3-6алкілен; Ζ представляє прямий зв'язок або С1-3алкілен. R12 представляє С1-3алкіл (як варіант, заміщеn дорівнює 0 або 2. ний та/або закінчений одним або більше замісниR25 представляє Η або С1-4алкіл. 13 ками, вибраними з галогену, арилу та -NHC(O)R ) G представляє СН. або, як варіант, заміщений арил; R6 представляє один або більше необов'язко13 R представляє С1-3алкіл або арил; вих замісників, вибраних з -ОН, ціаногрупи, галоR8 представляє Н, С1-4алкіл (як варіант, замігену, нітрогрупи, С1-3алкілу (як варіант, закінченого щений та/або закінчений, як варіант, заміщеним by -N(H)C(O)OR26a) та C1-4алкоксилу. 14a арилом), як варіант, заміщений арил, -C(O)R R26a представляє С1-4алкіл. або -C(O)OR14b; R3 представляє Η або С1-2алкіл. 14a 14b R та R представляють С1-4алкіл (як варіRa- Rh усі представляють Н. ант, заміщений та/або закінчений арилом) або Ще кращі сполуки згідно з винаходом включаарил; ють ті в яких: R9 представляє, при його наявності, С1-8алкіл R1a представляє лінійний, розгалужений або (як варіант, заміщений та/або закінчений одним частково циклічний/ациклічний С1-6алкіл (цей алкіл або більше замісниками, вибраними з -ОН, галоге(і) як варіант, розірвано одним або більше атоману, ціаногрупи, як варіант, заміщеного арилу, С1ми оксигену; та/або (іі) як варіант, заміщений 15 та Het5); та/або закінчений одною або більше групами, виб4алкоксилу, -SO2R R15 представляє С1-4алкіл або арил; раними з фенілу (як варіант, заміщеного одним 10 R представляє, при його наявності, Н, С1або більше замісниками, вибраними з галогену та метоксилу), Het1 (як варіант, заміщеного 8алкіл, С1-4алкоксил (останні дві групи, як варіант, заміщені та/або закінчені одним або більше замісC(O)R23c), -C(O)R7a, -OR7b, -C(O)N(H)R10 та никами, вибраними з -ОН, галогену та С1S(O)2R11), Het2, -C(O)R7a, -C(O)OR9, -C(O)N(H)R10 або -S(O)2R11; 4алкоксилу), -О-(як варіант, заміщений арил, -D6 17a 10 арилоксил, -D-Het , -D-S(O)2R , або R , разом з R7a та R7b незалежно представляють, у кожно7d R , представляє С3-6алкілен; му випадку, Η, лінійний або розгалужений С1-5алкіл R17a представляє С1-4алкіл або, як варіант, за(цей алкіл (і), як варіант, є ненасиченим; та/або (іі), міщений арил. як варіант, заміщеним та/або закінченим одним D представляє прямий зв'язок або С1-3алкілен. або більше замісниками, вибраними з -ОН, С13 12 R11 представляє, у кожному випадку, С1-5алкіл 2алкоксилу, Het та -NHC(O)R ), феніл (як варіант, (як варіант, заміщений та/або закінчений одним заміщений галогеном або метоксилом) або Het4 або більше атомами галогену), як варіант, заміще(як варіант, заміщений С1-4алкілом); ний арил або Het7. R12 представляє С1-2алкіл (як варіант, заміщеR4 представляє Н, галоген, С1-2алкіл, -OR18 ний та/або закінчений групою -NHC(O)R13); або -E-N(R19)R20. R13 представляє С1-2алкіл; 5 R представляє Н, або С1-2алкіл. R9 представляє, у кожному випадку, лінійний, 18 R представляє Н, С1-4алкіл, -Е-(як варіант, розгалужений або частково циклічний/ациклічний заміщений арил) або -E-Het8. С1-6алкіл (цей алкіл (і) як варіант, є ненасиченим; R19 представляє Н, С1-4алкіл, -Е-арил, -E-Het8, (іі), як варіант, розірвано одним або більше ато-C(O)R21a або -C(O)OR21b. мами оксигену; та/або (ііі), як варіант, заміщеним R20 представляє Η, С1-4алкіл або -Е-арил. та/або закінченим одним або більше замісниками, R21a та R21b незалежно представляють С1вибраними з вибраними з -ОН, ціаногрупи, С115 та Het5 (як варіант, заміщено4алкіл (як варіант, заміщений та/або закінчений 2алкоксилу, -SO2R одним або більше замісниками, вибраними з галого -C(O)R23c)); гену та арилу) або арил. R15 представляє С1-2алкіл; Ε представляє, у кожному випадку, прямий R10 представляє, у кожному випадку, Н, лінійзв'язок або С1-2алкілен. ний, розгалужений або частково циклічHet1-Het8 (за прийнятністю) незалежно предний/ациклічний С1-7алкіл (цей алкіл (і) як варіант, ставляють, у кожному випадку, повністю насичені, розірвано одним або більше атомами оксигену; цілком ароматичні, частково ароматичні та/або та/або (іі), як варіант, заміщений та/або закінчений дициклічні п'яти-дванадцяти-членні гетероцикли, С1-2алкоксилом), феніл (як варіант, заміщений одщо містять один-чотири гетероатоми, вибрані з ним або більше замісниками, вибраними з галогеоксигену, нітрогену та/або сульфуру, ці групи, як ну, метоксилу, Het та SR26c), Het6 (як варіант, за 19 75057 20 міщений одним або більше С1-2алкілами) або S(O)2R17a; R26c представляє С1-2алкіл, як варіант, заміщений одним або більше атомами галогену; R17a представляє феніл (як варіант, заміщений С1-2алкілом); R11 представляє, у кожному випадку, лінійний, розгалужений або частково циклічний/ациклічний С1-5алкіл, феніл (як варіант, заміщений одним або більше замісниками, вибраними з нітрогрупи, меде R1, R2, R3 та Ra-Rh визначено вище, зі спотоксилу та N(H)C(O)R27h) або Het7 (як варіант, залукою формули III міщений одним або більше замісниками, вибраниR28-L1 III, ми з галогену, С1-2алкілу та N(H)C(O)R23h); де R28 представляє (за прийнятністю) R1 або 4 18 19 R представляє Н, -OR або -N(H)R ; R2, L1 представляє таку відщеплювану групу, як R5 представляє Н; галоген, алкансульфонат, перфлуоралкансульфоR18 представляє Η або феніл (як варіант, занат, аренсульфонат, -OC(O)XR9, імідазол або міщений одним або більше замісниками, вибраниR29O- (де R29 представляє, наприклад, С1-10алкіл ми з ОН та метоксилу); або арил, які, як варіант, заміщені одним або біR19 представляє Η або -C(O)OR21b; льше галогеном або нітрогрупами), a R1, R2 та R9 21b R представляє С1-2алкіл; визначено вище, наприклад між кімнатною темпеHet1-Het8 незалежно представляють, у кожноратурою та температурою кипіння у присутності му випадку, повністю насичені, цілком ароматичні, придатної основи (наприклад триетиламін або частково ароматичні та/або дициклічні п'ятикарбонату калію ) та прийнятного органічного роздванадцяти-членні гетероцикли, що містять між 1чиннику (наприклад дихлорметану, хлороформу, 4 гетероатоми, вибрані з оксигену, нітрогену ацетонітрилу, Ν,Ν-диметилформаміду, диметилта/або сульфуру; сульфоксиду, тетрагідрофурану, толуолу чи їх 23с 23h 27h R ,R та R незалежно представляють, у суміші), a R1 та R2 визначено вище; кожному випадку, С1-2алкіл; (b) для сполук формули І, в яких R1 або R2 (за А представляє прямий зв'язок або -J-; прийнятністю) представляють -C(O)XR9 або В представляє -Z-, -Z-N(H)-, -Z-SO2- або -Z-OC(O)N(R10)R7d, реакцію сполуки формули IVA або (в останніх трьох групах Ζ приєднано до атому IVB карбону, що несе R4 та R5); J представляє С1-3алкілен, як варіант, заміщений -ОН або аміногрупою; Ζ представляє прямий зв'язок або С1-2алкілен; R6 представляє одну або дві ціаногрупи; R3 представляє Η або метил. Особливо кращі сполуки згідно з винаходом включають ті в яких: R1a представляє -C(O)R7a, -C(O)N(H)R10 або S(O)2R11; 3 a h 1 де R та R -R визначено вище, L визначено R10 представляє лінійний, розгалужений або 1 2 вище, a R та R представляють фрагмент формучастково циклічний/ациклічний C1-5алкіл, (цей алли Іа, який визначено вище, зі сполукою формукіл, як варіант, є розірваним одним або більше ли V, атомами оксигену); R30-H V R4 представляє Н, -ОН або -NH2; де R30 представляє -XR9 або -N(R10)R7d, a R7d, А представляє прямий зв'язок або -J-; R9, R10 та X визначено вище, наприклад в описаВ представляє -Z-N(H)- або -Z-O- (у двох них вище умовах (спосіб з етапу (а)); останніх групах Ζ приєднано до атому карбону, що (c) для сполук формули І, в яких R1 або R2 (за несе R4 та R5); прийнятністю) представляють -C(O)N(H)R10, реакJ представляє С1-3алкілен; 6 цією сполуки формули llА або ІІВ (за прийнятнісR представляє ціаногрупу у пара-позиції стотю), яку визначено вище (за винятком того, що R1 совно місця приєднання В; 3 або R2 (за прийнятністю) не представляють R1a), зі R представляє метил. сполукою формули VI, Кращі сполуки згідно з винаходом включають R10-N=C=O VI сполуки з прикладів, що наведено далі. де R10 визначено вище, наприклад, між 0°С та Виготовлення температурою кипіння під зворотним холодильниЗгідно з винаходом також запропоновано споком у присутності прийнятного органічного розчинсіб виготовлення сполук формули І, який включає: нику (наприклад дихлорметану), або твердофаз(а) реакцію сполуки формули llА або чи ІІВ ним синтезом у відомих фахівцям умовах; (d) для сполук формули І, в яких R1 або R2 (за прийнятністю) представляють фрагмент формули Іа, у якому А представляє СН2, a R4 представляє ОН або -N(H)R19, реакцією сполуки формул llА або ІІВ, які визначено вище (за винятком того, що R1 21 75057 або R2 (за прийнятністю) не представляють фрагмент формули Іа), зі сполукою формули VII, де Υ представляє О або N(R19), a R5, R6, R19, В та G визначено вище, наприклад, при підвищеній температурі (наприклад, при температурі від 60°С до температури кипіння під зворотним холодильником) у присутності придатного розчиннику (наприклад нижчого алкіл-спирту (наприклад ЕРА), ацетонітрилу, або суміші нижчого алкіл-спирту та води); (e) для сполук формули І, в яких у фрагменті формули Іа В представляє -Z-O-, реакцією сполук формул VIIIA або VIIIB 22 де L2 представляє відщеплювану групу, як-то галоген, алкансульфонат, перфлуоралкансульфонат або аренсульфонат, a R6 визначено вище, наприклад при температурі між 10°С та температурою кипіння під зворотним холодильником у присутності придатної основи (наприклад гідриду натрію) та прийнятного розчиннику (наприклад Ν,Ν-диметилформаміду); (g) для сполук формули І, в яких R4 представляє -OR18, в яких R18 представляє C1-6алкіл, -Еарил або -E-Het8, реакцією відповідної сполуки формули І, в якій R4 представляє ОН, зі сполукою формули XI, R18aOH XI де R18a представляє С1-6алкіл, -Е-арил або -EHet8, а Е та Het8 визначено вище, наприклад в умовах Міцунобу (наприклад, як описано вище у способі з етапу (e)); (h) для сполук формули І, в яких R4 представляє -OR18, в якому R18 представляє С1-6алкіл, -Еарил або -E-Het8, реакцією сполуки формули ХllА чи ХІІВ, де R3, R4, R5, Ra-Rh, А та Ζ визначено вище, a R та R2 (за прийнятністю) визначено вище (за винятком того, що, у кожному випадку, вони не представляють фрагмент формули Іа), зі сполукою формули IX 1 де R1 або R2 (за прийнятністю) представляють R , a R1a, R3, R5, R6, Ra-Rh, А, В, G та L2 визначено вище, зі сполукою формули XI, яку визначено вище, наприклад при температурі між зовнішньою (наприклад 25°С) та температурою кипіння під зворотним холодильником, в умовах Вільямсона (тобто у присутності прийнятної основи (наприклад КОН або NaH) та придатного органічного розчиннику (наприклад диметилсульфоксиду або N,Nдиметилформаміду))(фахівцям зрозуміло, що деякі сполуки формул ХНА та ХІІВ (наприклад ті, в яких L2 представляє галоген) можна також вважати сполуками формули І, які визначено вище); (і) для сполук формули І, в яких R4 представляє -E-NH2, відновленням сполуки формули ХІllА або ХІІІВ 1a де R6 та G визначено вище, наприклад в умовах Міцунобу наприклад при температурі між зовнішньою (наприклад 25°С) та температурою кипіння під зворотним холодильником у присутності третинного фосфіну (наприклад трибутилфосфіну або трифенілфос-фіну), азодикарбоксилатного похідного (наприклад діетилазодикарбоксилату або 1,1'-(азодикарбоніл)дипіперидину) та прийнятного органічного розчиннику (наприклад дихлорметану або толуолу); (f) для сполук формули І, в яких G представляє N, а В представляє -Z-O-, реакцією сполук формул VIIIA або VIIIB, які визначено вище, зі сполукою формули X 23 75057 24 C(O)OR21b або -C(O)N(R22a)R22b, реакцією відповідної сполуки формули І, в якій R4 представляє -ОН, зі сполукою формули XVII R18b-L3 XVll де R18b -C(O)R21a, -C(O)OR21b або 22a 22b 3 C(O)N(R )R , L представляє відщеплювану групу, як-то галоген, п-нітрофеноксил, -OC(O)R21a, -OC(O)OR211', -ОН або імідазол, a R21a, R21b R22a та R22b, визначено вище, наприклад, при температурі між -10°С та температурою кипіння під зворотним холодильником у присутності придатної основи (наприклад, триетиламіну, піридину або карбонату калію), прийнятного органічного розчиннику (наприклад, тетрагідрофурану, дихлорметану або ацетонітрилу) та (де прийнятно) придатного засоде R1 або R2 (за прийнятністю) представляють бу сполучення (наприклад, 1-(3R1a, a R1a, R3, R5, R6, Ra-Rh, А, В, Ε та G визначено диметиламінопропіл)-3-етилкарбодііміду); вище, наприклад, гідруванням при придатному (о) для сполук формули І, в яких R4 представтиску у присутності придатного каталізатору (наляє Η або -ОН, a R5 представляє Н, відновленням приклад, паладію на вугіллі) та прийнятного розвідповідної сполуки формули І, в якій R4 та R5 рачиннику (наприклад, суміші води та етанолу); зом представляють =О, у присутності придатного (j) для сполук формули І, в яких R4 представ19 20 19 відновнику та у прийнятних реакційних умовах; ляє -E-N(R )R , де R представляє С1-6алкіл, -Енаприклад, для утворення сполук формули І, в якій арил -E-Het8, -C(O)R21a, -C(O)OR21b, -S(O)2OR21c 22a 22b R4 представляє ОН, відновлення можна проводити або -C(O)N(R )R , реакцією відповідної сполуки 4 20 у помірних реакційних умовах у присутності, наформули І, в якій R представляє -E-N(H)R зі приклад, борогідриду натрію та прийнятного оргасполукою формули XIV 19a 1 нічного розчиннику (наприклад, тетрагідрофурану); R -L ΦlV а для утворення сполук формули І, в якій R4 предде R19a представляє С1-6алкіл, -Е-арил -E-Het8, ставляє Н, відновлення можна проводити в умовах -C(O)R21a, -C(O)OR21b, -S(O)2OR21c або Вольфа-Кіршнера, відомих фахівцям або активуC(O)N(R22a)R22b, a R21a, R21b, R21c, R22a, R22b, Het8, Ε 1 ванням належної групи С=О з використанням прита L визначено вище, наприклад, в описаних вийнятного засобу (такого, як тозилгідразин) у присуще умовах (спосіб з етапу (а)); тності придатного відновнику (наприклад, (k) для сполук формули І, в яких R4 представ22a 22a борогідриду натрію або ціаноборогідриду натрію) ляє -E-N(R )C(O)N(H)R , реакцією відповідної та прийнятного органічного розчиннику (наприсполуки формули І, в якій R4 представляє -E20 клад, нижчого (наприклад, С1-6) алкіл-спирту); N(H)R , зі сполукою формули XV, (р) для сполук формули І, в яких R4 представR22a-N=C=O XV ляє галоген, заміщенням відповідної сполуки форде R22a визначено вище, наприклад, в описамули І, в якій R4 представляє -ОН, з використанних вище умовах (спосіб з етапу (с)); 4 ням засобу галогенування, (наприклад, для сполук (І) для сполук формули І, в яких R представв як R4 представляє флуор, реакцією з (трифлуоляє -E-N(H)[C(O)]2NH2, реакцією відповідної сполу4 ридом діетиламіно)сульфуру); ки формули І, в якій R представляє -E-NH2 з діа(q) для сполук формули І, в яких R4 та R5 мідом щавлевої кислоти, наприклад, при представляють Н, А представляє -J-, а В предстатемпературі між -10 та 25°С у присутності придатвляє -N(R25)-Z- (де -N(R25) приєднано до атому ного засобу сполучення (наприклад, і-(3карбону, що несе R4 та R5), реакцією сполуки фодиметиламінопропіл)-3-етилкарбодііміду), прийнярмул XVIllА або XVIllВ тного активувального засобу (наприклад, 1гідроксибензотриазолу), придатної основи (наприклад, триетиламіну) та інертного у реакції розчиннику (наприклад, Ν,Ν-диметилформаміду); (m) для сполук формули І, в яких R4 представляє -E-N(H)C(NH)NH2, реакцією відповідної сполуки формули І, в якій R4 представляє -E-NH2, зі сполукою формули XVI R29O-C(=NH)NH2 XVI або її N-протектованим похідним, де R29 представляє С1-10алкіл або арил, які, як варіант, заміщені одним або більше галогеном або нітрогрупою, наприклад, між кімнатною температурою та температурою кипіння, як варіант, у присутності придатного розчиннику (наприклад, толуолу) та/або прийнятного кислотного каталізатору (наприклад, оцтової кислоти при концентрації, наприклад, 10моль%); (n) для сполук формули І, в яких R4 представляє -OR18, в якому R18 представляє -C(O)R21a, де R1 або R2 (за прийнятністю) представляють R , a R1a, R3, R4, R5, R25, Ra-Rh та J визначено вище, зі сполукою формули XIX 1a 25 75057 26 риду цинку); (t) для сполук формули І, в яких R1 представляє -C(O)OR9, a Ra та/або Rb представляють С14алкіл, реакцією відповідної сполуки формули І, в якій R1 представляє -C(O)OR9, a Ra та Rb представляють Н, з одним або більше еквівалентами сполуки формули XXIII R32-L4 XXIII де R32 представляє С1-4алкіл, a L4 - відщеплювана група, як-то галоген, алкілсульфат, алкансуде R6, G, Z та L2 визначено вище, наприклад, льфонат або аренсульфонат, у присутності прийнпри підвищеній температурі (наприклад, від 40°С ятної сильної основи (наприклад, бутиллітію), до температури кипіння під зворотним холодильнаприклад, при температурі між -80°С та кімнатником) у присутності придатного органічного розною температурою температур у присутності причиннику (наприклад, ацетонітрилу); датного розчиннику (наприклад, (r) для сполук формули І, в яких А представляє N,N,N',N',тетраметилетилендіаміну, тетрагідрофу4 5 С2алкілен, a R тa R разом представляють =О, рану або їх суміші); реакцією сполук формул llА або ІІВ, які визначено (u) для сполук формули І, якими є N-оксидні 1 2 вище (за винятком того, що R або R (за прийнятпохідні 3-азадицикло[3.2.1]октанового нітрогену, ністю) не представляють фрагмент формули Іа), зі окисненням відповідного 3-азадициклосполукою формули XX [3.2.1]октанового нітрогену відповідної сполуки формули І, у присутності придатного органічного окиснику (наприклад, 3-хлорпероксибензойної кислоти - мХПБК), наприклад, при температурі 0°С у присутності придатного органічного розчиннику (наприклад, дихлорметану); (ν) для сполук формули І, які є похідними солями четвертинного алкіламонію, в яких алкіл приєднано до 3-азадицикло[3.2.1]октанового нітрогену, реакцією на 3-азадицикло[3.2.1]октановому нітрогені відповідної сполуки формули І зі сполуде В, G та R6 визначено вище, наприклад, між кою формули XXIII, яку визначено вище, наприкімнатною температурою та температурою кипіння клад, при кімнатній температурі у присутності приу присутності придатної основи (наприклад, триейнятного органічного розчиннику (наприклад, Ν,Νтиламіну, карбонату калію або гідроксиду тетрабудиметилформаміду), а потім очисткою (використиламонію) та прийнятного органічного розчиннику танням наприклад, ВЕРХ) у присутності придатно(наприклад, нижчого алкіл-спирту (наприклад, С1го поглиначу протиіонів (наприклад, NH4OAc); або (w) конверсією одного заміснику R6 у інший з 6); 3 (s) для сполук формули І, в яких R представвикористанням способів, добре, відомих фахівцям. ляє Н, a R2 представляє незаміщений С1-4алкіл, Сполуки формули llА та llB можна виготовити реакцією сполуки формули XXI реакцією сполуки формули XXIV, де R4, R5, R6, R1 до R11, А, В та G визначено вище, зі сполукою формули XXII R31-NH2 XXII де R31 представляє незаміщений С1-4алкіл, у присутності придатного відновнику (наприклад, ціаноборогідриду натрію), наприклад, між кімнатною температурою та температурою кипіння, як варіант, у присутності прийнятного розчиннику (наприклад, нижчого алкіл-спирту, як-то метанолу) та/або придатного каталізатору (наприклад, хло або її N-протектованого похідного, де R3, Ra-Rh визначено вище, зі сполукою формули III, яку визначено вище, наприклад, як описано вище для синтезу сполук формули І (спосіб з етапу (а)), або, 1 2 у випадку сполук формули llА або ІІВ, де R або R (за прийнятністю) представляє фрагмент формули Іа, в якій А представляє СН; a R4 представляє -ОН або N(H)R19, де R19 визначено вище, зі сполукою формули VII, яку визначено вище, наприклад, як описано вище для синтезу сполуки формули І (спосіб з етапу (d)). 27 75057 28 Сполуки формули III можна виготовити станзі способами, що є відомими фахівцям Наприклад, дартними способами. Наприклад, сполуки формусполуки формули VII в яких: ли III в як R28 представляє фрагмент формули Іа, (1) В представляє -СН2О-, а Υ представляє О де: можна виготовити реакцією сполуки формули IX, (1) В представляє -Z-O-, можна виготовити яку визначено вище, зі сполукою формули XXX сполученням сполуки формули IX, яку визначено вище, зі сполукою формули XXV, L2-Z-C(R4)(R5)-A-L2 XXV де R4, R5, Α, Ζ та L2 визначено вище, а дві групи L2 можуть бути однаковими або відмінними, або (2) В представляє -C(O)N(R25)-, можна виготовити сполученням сполуки формули де R5 та L2 визначено вище, наприклад, при підвищеній температурі (наприклад, між 60°С та температурою кипіння під зворотним холодильником) у присутності придатної основи (наприклад, карбонату калію або NaOH) та прийнятного органічного розчиннику (наприклад, ацетонітрилу або толуолу/води), або як інакше описано у рівні техніки; (2) R5 представляє Н, В представляє прямий де G, R6 та R25 визначено вище, зі сполукою зв'язок, С1-4алкілен, -Z-N(R25)-, -Z-S(O)n- або -Z-Oформули XXVII 5 5 2 (де у кожному випадку, група Ζ представляє С1L -C(O)-C(R4)(R )-A-L XXVII де L5 представляє придатну відщеплювану 4алкілен, приєднаний до атому карбону, що несе R5), a Y представляє О, можна виготовити відновгрупу (наприклад, -ОН або галоген), a R4, R5, А та 2 ленням сполуки формули ХХХІА або ХХХІВ L визначено вище; в обох випадках, в умовах, добре відомих фахівцям. Сполуки формули III, в яких R28 представляє фрагмент формули Іа, де А представляє С2алкілен, a R4 представляє -OR18, в якому R18 представляє С1-6алкіл, -Е-арил або -Е- Het , можна альтернативно виготовити реакцією сполуки формули XI, яку визначено вище, зі сполукою формули XXVIII де Ва представляє -Za-NCR25), -Za-S(O)n- або Za-O- (в яких у кожному випадку, група Za представляє прямий зв'язок або C1-3алкілен, приєднаний до атому карбону, що несе R5), Вb представляє прямий зв'язок або С1-4алкілен, a R6, R25, G та n визначено вище, наприклад, при температурі між 15°С та кімнатною температурою у присутності придатного відновнику (наприклад, NaBH4) та прийнятного органічного розчиннику (наприклад, тетрагідрофурану), а потім реакцією внутрішнього 5 6 32 де R , R , R , В та G визначено вище, напризаміщення в утвореному інтермедіаті, наприклад, клад, при температурі між зовнішньою температупри кімнатній температурі у присутності придатної рою (наприклад, 25°С) та температурою кипіння основи (наприклад, карбонату калію ) та прийнятпід зворотним холодильником у присутності приного органічного розчиннику (наприклад, ацетонітдатної основи (наприклад, карбонату калію) та рилу); прийнятного органічного розчиннику (наприклад, (3) В представляє прямий зв'язок, С1-4алкілен, ацетонітрилу), а потім конверсією естерної функ-Z-N(R25)-, -Z-S(O)2- або -Z-O- (в якому у кожному 2 2 ціональної групи у групу L (де L визначено вище), випадку, група Ζ представляє С1-4алкілен, приєдв умовах, добре відомих фахівцям. наний до атому карбону, що несе R5), a Y предСполуки формули IVA та IVB можна виготовиставляє О, можна виготовити окисненням сполуки ти реакцією сполуки формули llА або ІІВ, відповідформули ХХХІІА або XXXIIB но, які визначено вище, зі сполукою формули XXIX, L1-C(O)-L1 XXIX де L1 визначено вище та де дві групи L1 можуть бути однаковими або відмінними, наприклад, при температурі між 0°С та температурою кипіння під зворотним холодильником у присутності придатної основи (наприклад, триетиламіну або карбонату калію) та прийнятного органічного розчиннику (наприклад, толуолу або дихлорметану). де R5, R6, В', В1' та G визначено вище, у присуСполуки формули VII можна виготовити згідно 29 75057 тності придатного окиснику (наприклад, мХПБК), наприклад, кип'ятінням під зворотним холодильником у присутності придатного органічного розчиннику (наприклад, дихлорметану); або (4) В представляє групу -Z-Ο-, в якій Ζ представляє С1-4алкілен, приєднаний до атому карбону, що несе R5, a Y представляє -N(R19), де R19 представляє -C(O)OR21b або -S(O)2R21c, можна виготовити циклізацією сполуки формули XXXIII де R19b представляє -C(O)OR21b або -S(O)2R21c, Zb представляє С1-4алкілен, a R5, R6, R21b, R210, G та L2 визначено вище, наприклад, при температурі між 0°С та температурою кипіння під зворотним холодильником у присутності придатної основи (наприклад, гідроксиду натрію), прийнятного розчиннику (наприклад, дихлорметану, води, або їх суміші) та, якщо необхідно, каталізатору міжфазного переносу (такого, як гідросульфат тетрабутиламонію) Сполуки формули VIIIA та VIIIB можна виготовити подібно сполукам формули І (дивися, наприклад, спосіб з етапів (а) - (d)). Сполуки формули ХllА та ХІІВ можна виготовити заміщенням групи -ОН відповідної сполуки формули І, в якій R4 представляє -ОН групою L2 в умовах, відомих фахівцям. Сполуки формули ХІllА та ХІІІВ, в яких Ε представляє прямий зв'язок, можна виготовити реакцією відповідної сполуки формули І, в якій R4 представляє -ОН, зі сполукою формули XXXIV R33S(O)2CI XXXIV де R33 представляє С1-4алкіл або арил (ці дві групи, як варіант, заміщені одним або більше замісниками, вибраними з С1-4алкілу, галогену та нітрогрупи), наприклад, при температурі між -10 та 25°С у присутності придатного розчиннику (наприклад, дихлорметану) та потім реакцією з придатним джерелом азидного іону (наприклад, азиду натрію), наприклад, при температурі між зовнішньою та температурою кипіння під зворотним холодильником у присутності прийнятного розчиннику (наприклад, Ν,Ν-диметилформаміду) та придатної основи (наприклад, гідрокарбонат натрію). Сполуки формули ХІllА та ХІІІВ можна альтернативно виготовити реакцією сполуки формул llА або ІІВ, які визначено вище (за винятком того, що R1 або R2 (за прийнятністю) не представляє фрагмент формули Іа), зі сполукою формули XXXV 30 де R5, R8, Α, Β, Ε, G та L2 визначено вище, наприклад, в умовах, аналогічних описаним вище для синтезу сполук формули І (спосіб з етапу (а)). Сполуки формули XVIIIA та XVIllВ можна виготовити видаленням, як варіант, заміщеного бензилоксикарбонілу (тобто депротектуванням) відповідної сполуки формули І, в якій В представляє N(R25)C(O)OCH2-, а А представляє J, де R25 тa J визначено вище, наприклад, в умовах, відомих фахівцям. Сполуки формули XXI можна виготовити реакцією сполуки формули III, в якій R28 представляє фрагмент формули Іа, зі сполукою формули XXXVI де Ra-Rh визначено вище, наприклад, в описаних вище умовах (спосіб з етапу (а)). Сполуки формули XXI, в яких обидва Ra та Rb представляють Η можна альтернативно виготовити реакцією сполуки формули XXXVII де Rc-Rh визначено вище, зі сполукою формули XXXVIII 31 75057 32 галоген. Сполуки згідно з винаходом можна виділити з їх реакційних сумішей використанням звичайних способів. Фахівцям повинно бути ясно, що, у описаних вище способах функціональні групи інтермедіатів можуть бути протектованими, або можуть потребувати протектування. Функціональні групи, які бажано протектувати, включають гідроксил, аміногрупу та карбоксильну групу. Придатні протектувальні групи для гідроксилу включають триалкілси-ліли та діарилалкілсиліли (наприклад, трет-бутилдиметилсиліл, трет4 5 6 бутилдифенілсиліл або триметилсиліл), тетрагідде R , R , R , А, В та G визначено вище, у приропіраніл та алкілкарбоніл групи (наприклад, месутності формальдегіду (тобто прийнятного джетил- та етил-карбоніл групи). Придатні для протекрела формальдегіду, як-то параформальдегід або тування групи для аміногрупи включають бензил, формаліновий розчин), наприклад, між кімнатною трет-бутилоксикарбоніл, 9температурою та температурою кипіння у присутфлуоренілметоксикарбоніл або бензилоксикарбоності придатного розчиннику (наприклад, нижчого ніл. Придатні для протектування групи для амідиалкіл-спирту, як-то метанол) та, як варіант, у приногрупи та гуанідиногрупи включають бензилоксисутності прийнятної кислоти (наприклад, оцтової карбоніл. Придатні для протектування групи для кислоти). карбонових кислот включають C1-6алкілові або Сполуки формули XXIV можна виготовити ребензилові естери. акцією сполуки формули XXXVI, яку визначено Протектування та депротектування функціовище, або її N-протектованого похідного зі сполунальних груп можна проводити до або після будькою формули XXXIX якого з описаних вище реакційних етапів. R3-NH2 XXXIX Протектувальні групи можна видалити згідно зі або (у випадку де R3 представляє Н) її протекспособами, які добре відомі фахівцям та які опитованого похідного (наприклад, N-бензилового), сано далі. наприклад, в описаних вище умовах для синтезу Використання протектувальних груп повністю сполук формули І (спосіб з етапу (s)) описано у "Protective Groups in Organic Chemistry", Сполуки формули XXXV можна виготовити J.W.F. McOmie, Plenum Press (1973), та "Protective аналогічно сполукам формул ХІllА та ХІІІВ (тобто з Groups in Organic Synthesis", 3nd ed, T.W. Greene & відповідного спирту). a P.G.M. Wutz, Wiley-lnterscience (1999). Сполуки формул XXXVI, в яких обидва R та b Фахівцям ясно, що, для отримання сполуR представляють Н, можна виготовити реакцією ки згідно з винаходом альтернативним, а в деяких сполуки формули XXXVII з аміаком, або його Nвипадках зручнішим способом, можна проводити протектованим похідним (наприклад, бензиламіокремі процеси зі згаданих тут етапів у відмінному ном), у присутності формальдегіду, наприклад, в порядку та/або можна проводити індивідуальні описаних вище умовах для синтезу сполук формуреакції у відмінних етапах у загальному шляху ли XXI. (тобто замісники можна додавати до та/або проСполуки формул V, VI, IX, X, XI, XIV, XV, XVI, водити хімічне перетворення через відмінні від XVII, XIX, XX, XXII, XXIII, XXV, XXVI, XXVII, XXVIII, асоційованих з вищенаведеними певними реакціXXIX, XXX, ХХХІА, ХХХІВ, ХХХІІА, ХХХІІВ, XXXIII, ями інтермедіати). Це серед іншого залежатиме XXXIV, XXXVII, XXXVIII та XXXIX та їх похідні, ковід таких факторів, як природа інших функціональмерційно доступні, відомі з літератури, або їх можних груп, представлених у окремому субстраті, на отримати аналогічно способам, описаним тут, наявності ключових інтермедіатів та стратегії проабо звичайними способами синтезу, згідно зі стантектувальних груп (будь-яких), яку треба адаптудартними способами, з легко доступних вихідних вати. Ясно, що тип залучених хімічних способів матеріалів, з використанням прийнятних реагентів залежатиме від вибору реагентів, що використота реакційних умов. вують у вказаних етапах синтезу, потребі та типу Замісники на арилах (наприклад, фенілі) та (за протектувальних груп, що застосовують, та посліприйнятністю) гетероциклах у визначених тут сподовності для завершення синтезу. луках можна перетворити у інші потрібні замісники Фахівцям також повинно бути ясно, що, хоча використанням способів, добре відомих фахівцям. деякі протектовані похідні сполук формули І, які Наприклад, гідроксил можна перетворити у алкокможна виготовити до кінцевого етапу депротектусил, феніл можна галогенувати, одержавши галовання, можуть самі не виявляти фармакологічну генофеніл, нітрогрупу можна відновити, одержавактивність, їх можна уводити парентерально або ши аміногрупу, аміногрупу можна ацетилувати, перорально, а далі вони метаболізуватимуть у тілі одержавши ацетиламіногрупу, тощо. з утворенням сполук згідно з винаходом, які є фаФахівцям також зрозуміло, що інтерконверсія рмакологічно активними. Такі похідні можна відпота перетворення різних стандартних замісників відно описати як "проліки". Більш того, деякі споабо функціональних груп у деяких сполуках форлуки формули І можуть діяти як проліки інших мули І забезпечуватимуть інші сполуки формули І. сполук формули І. Наприклад, карбоніл можна відновити до гідроксиУсі проліки сполук формули І включено у рамлу або алкілену, а гідроксил можна перетворити у 33 75057 34 ках винаходу. че дослідженнях. Деякі з вищенаведених інтермедіатів є новиОтже можна очікувати, що сполуки згідно з вими. Згідно з наступним аспектом винаходу отже находом є корисними при профілактиці та лікуванзапропоновано: (а) сполуки формул llА або ІІВ, які ні аритмій, а зокрема, передсерцевої та шлуночковизначено вище, або їх протектовані похідні; (b) вої аритмій. сполуки формул IVA або IVB, які визначено вище, Сполуки згідно з винаходом тому показані при або їх протектовані похідні; (с) сполуки формул лікуванні або профілактиці серцевих хвороб, або VIIIIA. або VIIIB, які визначено вище, або їх протекпри визначенні спорідненості до серцевих хвороб, товані похідні; (d) сполуки формул ХllА або ХllВ, які в яких аритмії, можна вважати, грають головну визначено вище, або їх протектовані похідні; (e) роль, включаючи ішемічну серцеву хворобу, несполуки формул ХІllА або ХІІІВ, які визначено висподіваний серцевий напад, інфаркт міокарду, ще, або їх протектовані похідні; (f) сполуки формул серцеву нестачу, серцеву хірургію та тромбоембоXVIIIA або XVIIIB, які визначено вище, або їх пролічні випадки. тектовані похідні; (д) сполуки формул XXI, які виПри лікуванні аритмій, сполуки згідно з виназначено вище (за умови, що коли усі Ra-Rh предходом, як виявлено, селективно затримують серставляють Н, G представляє СН, a R6 відсутній, то цеву реполяризацію, отже подовжуючи інтервал група -A-C(R4)(R5)-B- не представляє незаміщений QT та, зокрема, виявляють активність класу III. етил), або їх протектовані похідні; та (h) сполуки Хоча сполуки згідно з винаходом, як виявлено, формули XXIV, які визначено вище (за умови, що виявляють активність класу III, зокрема, при лікуусі Ra-Rh не представляють Н), або їх протектовані ванні аритмій, далі нема необхідності зводити попохідні. няття активності до цього класу. Сполуки формули DA, які можуть бути згадаЗгідно з наступним аспектом винаходу запроними, включають ті, в яких, коли R3 представляє Н, поновано спосіб лікування аритмії, що включає a R2 представляє -С(О)( R7a)-, то R7a не представвживання терапевтично ефективної кількості споляє феніл, заміщений у 2-позиції C1-6алкоксилом, у луки згідно з винаходом персоною, що потерпає 4-позиції -NH2 або -N(H)C(O)R27h (де R27h представід такого стану або схильна до нього. вляє С1-6алкіл) та у 5-позиці галогеном або -SR26c. Фармацевтичні препарати Сполуки формули ІІВ, які можуть бути згадаСполуки згідно з винаходом звичайно слід заними, включають ті в яких: стосовувати перорально, підшкірно, внутрішньо(і) коли Ra-Rh та R3 усі представляють Н, то R1 венно, інтраартеріально, трансдермально, інтране представляє С1-3алкіл, як варіант, заміщений назально, інгаляцією, або будь-яким іншим фенілом; парентеральним шляхом, у формі фармацевтич3 1 (іі) коли R представляє Н, то R не представних препаратів, що включають активний інгредієнт ляє С1-10оалкіл, або С1-2алкіл, закінчений фенілом як вільну основу, фармацевтично прийнятний іоабо тієнілом (ці феніл або тієніл, як варіант, замінообмінник або нетоксичну органічну або неоргащені одним або двома замісниками, вибраними з нічну кислотно-адитивну сіль, у фармацевтично С1-6алкілу (як варіант, розірваного атомом оксигеприйнятній формі дозування. ну), С1-4алкоксилу, CF3, галогену, нітрогрупи, Залежно від розладу та лікованого пацієнта, а С(О)ОН або -С(О)О-С1-6алкілу; також шляху вживання, композиції можна уводити (iiі) R1 не представляє С1-12алкіл, заміщений у різних дозах. фенілом (цей феніл несе замісник пара-[2-аміно-4Сполуки згідно з винаходом можна також по(С1-6алкіл)-піридин-6-іл] та, як варіант, один або єднувати з будь-якими іншими корисними при лідва інші замісники незалежно вибрані з метилу, куванні аритмій та/або інших серцево-судинних метоксилу та гідроксилу) та, як варіант, ще одним розладів ліками. або двома арилами; Згідно з наступним аспектом винаходу, отже, (iv) R1 не представляє С2алкіл, закінчений фезапропоновано фармацевтичну композицію, що нілом (як феніл груп цей феніл несе замісник павключає сполуки згідно з винаходом у суміші з ра-{2-[1-(2,5-диметил-1Н-піроліл)-4-(С1-6алкіл)фармацевтично прийнятним ад'ювантом, розріпіридин-6-іл] та, як варіант, один або два інші заміджувачем або носієм. сники незалежно вибрані з метилу, метоксилу та Придатні добові дози сполуки згідно з винахогідроксилу); або дом при терапевтичному лікуванні людини скла(ν) R1 не представляє С1алкіл, заміщений федають приблизно 0,005-10,0мг/кг маси тіла при нілом (цей феніл несе замісник пара-{2-[Nпероральному застосуванні та приблизно 0,005фталоїл]-4-(С1-6алкіл)-піридин-6-іл} та, як варіант, 5,0мг/кг маси тіла при парентеральному застосуодин або два інші замісники незалежно вибрані з ванні. метилу, метоксилу та гідроксилу). Сполуки згідно з винаходом мають ту переваМедичне та фармацевтичне використання гу, що вони є ефективними проти серцевої аритмії. Сполуки згідно з винаходом корисні внаслідок Сполуки згідно з винаходом можуть також матого, що виявляють фармакологічну активність. ти перевагу в тому, що вони можуть бути більш Відповідно вони позначені як фармацевтичні. ефективними, менше токсичними, мати ширші Отже, згідно з наступним аспектом винаходу межі активності (включаючи виявлення будь-якої запропоновано сполуки згідно з винаходом для комбінації активності класу І, класу II, класу III використання в якості фармацевтичних. та/або класу IV (конкретно активності класу І Зокрема, сполуки згідно з винаходом виявлята/або класу IV на додаток до активності класу lll)), ють міокардіальну електрофізіологічну активність, бути більш потужними, бути більш довгодіючими, наприклад, як продемонстровано у описаних нижпродукувати меншу побічну дію (включаючи нижчу 35 75057 36 інцидентність проаритмій, як-то torsades de далі робили кожні 20с протягом подальших 10 pointes), легше поглинатися, або мати інші корисні хвилин. Усі експерименти проводили при 35°С, фармакологічні властивості ніж сполуки, відомі у внаслідок високої температурної чутливості провірівні техніки. дності запізнілого спрямленого каналу калію та Біологічні дослідження флуоресценції DiBac4(3). Досліджувані речовини Дослідження А виготовляли у другому 96-комірковому планшеті у Оброблені глюкокортикоїдом фібробласти PBS, що містить 5мкМ DiBac4(3). Концентрація вимиші як модель для визначення блокера-торів готовленої речовини була 10-кратною стосовно запізнілого спрямленого струму К потрібної концентрації у експерименті, а додаткові ІС50 стосовно блокади каналу К визначали, вирозбавлення 1 10 здійснювали при додаванні рекористовуючи мікротитрувальний планшет на осчовини протягом експерименту. Дофетилід нові способу скринування на основі змін мембран(10мкМ) використовували як позитивний контроль, ного потенціалу оброблених глюкокортикоїдом тобто для визначення максимального збільшення фібробластів миші. Мембранний потенціал обробфлуоресценції. лених глюкокортикоїдом фібробластів миші виміПригінку кривих, використану для визначення рювали використанням флуоресценції бізоксоновеличин ІК50, проводили за програмою Graphpad льного барвнику DiBac4(3), яку можна надійно Prism (Graphpad Software Inc., San Diego, CA). детектувати використанням флуоресцентного лаДослідження В зерного планшетного зчитувача образів (FLIPR). Метаболічна стабільність досліджуваної споЕкспресію запізнілого спрямленого каналу калію луки індукували у фібробластах миші 24-годиною дією Скринінг in vitro провели для визначення меглюкокортикоїду дексамехазон (5мкМ). Блокада таболічної стабільності сполук згідно з винаходом. цих каналів калію деполяризувала фібробласти, Використовували гепатичну фракцію S-9 від призводячи до збільшення флуоресценції собак, людей, кролів та щурів з NACLPH як кофакDiBac4(3). тором. Умови аналізу були такими: S-9 (3мг/мл), Фібробласти мишей Itk (L-клітини) отримали з NACLPH (0,83мМ), буфер Трис-НСІ (50мМ) при рН Американської колекції типових культур (АТСС, 7,4 та 10мкМ досліджуваної сполуки. Manassa, VA) та культивували у модифікованому Реакцію викликали додаванням досліджуваної середовищі Дульбекко, доповненому сироваткою сполуки та закінчували через 0,1,5, 15 та 30 хвизародка теляти (5% за об'ємом), пеніциліном лин збільшенням величини рН у зразку до більше (500одиниць/мл), стрептоміцином (500мкг/мл) та L10 (NaOH; 1мМ). Після екстракції розчиннику коналанін-L-глутаміном (0,862мг/мл). Клітини пропусцентрацію досліджуваної сполуки вимірювали прокали кожні 3-4 доби, використовуючи трипсин ти внутрішнього стандарту LC (флуоресценція/УФ(0,5мг/мл у вільному від кальцію буферованому детектування). фосфатом сольовому розчині, Gibco BRL). За три Процент досліджуваної сполуки, що залишивдоби до експериментів, суспензію клітин перенося через 30 хвилин (а отже t1/2 розраховували та сили піпеткою у 96-коміркові планшети з чорного використовували як вимір метаболічної стабільнопластику з прозорим дном (Costar) при 25000 клісті. тин/комірку. Винахід ілюстровано наступними прикладами. Флуоресцентний зонд DiBac4(3) (DiBac Приклади Molecular probes) використовували для виміру Загальні експериментальні способи мембранного потенціалу. DiBac4(3) максимально Мас-спектри реєстрували на одному з прилапоглинає при 488нМ та випромінює при 513нМ. дів: спектрометр Perkin-Elmer SciX API 150ех; масDiBac4(3) є абізоксонолом, а тому є негативно заспектрометри VG Quattro II triple quadrupole; VG рядженим при рН 7. Внаслідок свого негативного Platform II single quadrupole; або Micromass заряду, проходження DiBac4(3) крізь мембрану є Platfonn LCZ single quadrupole (останні три прилазалежним від трансмембранного потенціалу: якщо ди опоряджено пневматичним напівавтоматичним клітина деполяризується (тобто внутрішня частина електророзпилювальним інтерфейсом (МС-ЕР)). клітини стає менш негативною відносно поверхні Виміри спектрів 1Н ЯМР та 13С ЯМР проводили на клітини), Концентрація DiBac4(3) всередині клітини спектрометрах BRUKER АСР 300 та Varian 300, збільшується внаслідок електростатичних сил. 400 та 500, що працює на частотах 300, 400 та 500 Всередині клітини молекули DiBac4(3) можуть приєМГц відповідно та при частотах для 13С 75,5, 100,6 днуватися до ліпідів та білків, що викликає зроста 125,7МГц відповідно. Альтернативно, виміри тання флуоресцентної емісії. Отже, деполяризація спектрів 13С ЯМР проводили на спектрометрі відображуватиметься зростанням флуоресценції BRUKER АСЕ 200 при частоті 50,3МГц. DiBac4(3). Зміни флуоресценції DiBac4(3) визначали Ротамери можуть або ні виявлятися у спектза допомогою FLIPR. рах залежно від легкості інтерпретації спектрів. Перед кожним експериментом клітини промиЯкщо не визначено інше, хімічні зсуви представвали 4 рази у буферованому фосфатом сольоволено у чому з розчинником як внутрішнім стандарму розчині (PBS) для видалення усіх культиваційтом. них середовищ. Клітини далі обробляли 5мкМ Синтез інтермедіатів. DiBac4(3) (у 180мкл PBS) при 35°С. Після стабілізаНаступні інтермедіати комерційно недоступні і ції флуоресценції (звичайно через 10 хвилин), добули відповідно виготовлені описаними нижче давали 20мкл досліджуваної речовини, використоспособами. вуючи внутрішню 96-коміркову систему Виготовлення А піпетування приладу FLIPR. Виміри флуоресценції 3-бензил-3-азадицикло[3,2,1]октан-8-он 37 75057 38 Розчин бензиламіну (127,4г, 1,19моль) у метаосад збирали фільтруванням крізь спечену скляну нолі (125мл) додавали краплями протягом 3 годин лійку та далі сушили під вакуумом. Тверду речодо киплячого під зворотним холодильником розчивину розчиняли у метанолі (4,0л) та додавали 10% ну циклопентанону (100г, 1,19моль), параформапаладій на вугіллі (24г). Суміш перемішували при льдегіду (107г, 3,57моль) та льодяної оцтової кисодній атмосфері водню при 40°С протягом ночі. лоти (71,4г, 1,19моль) у метанолі (600мл) під Каталізатор відфільтровували крізь шар Celite®, азотом. Через 1 годину кип'ятіння під зворотним промиваючи метанолом (1,0л). Фільтрат концентхолодильником коричневу суміш перемішували рували під вакуумом та хроматографували, елюпротягом ночі при 25°С та концентрували під вакуюючи сумішшю дихлормеумом. Утворене масло розбавляли водою (200мл) тан:метанол:концентрований розчин гідроксиду та підлужували 6Η NaOH (200мл) Водний розчин амонію (88:10:2), отримавши 70г (40%) масла. Розчин цього масла (70г, 296ммоль) у діетиловому екстрагували дихлорметаном (3 400мл). Поєднані етері (1,0л) оброблений 1Μ НСІ у діетиловому органічні екстракти сушили сульфатом натрію та етері (300мл), додавали краплями. Утворений концентрували під вакуумом. Залишок хроматогосад видаляли фільтруванням крізь спечену склярафували, елююючи етилацетану лійку. Сіль суспендували у ацетонітрилі та тветом:дихлорметаном (1:35), отримавши 47,6г (19%) рду речовину збирали, одержавши 80г солі НСІ потрібної сполуки як жовте масло. 1 потрібної сполуки: Н ЯМР (300МГц, CDCI3): δ 7,40-7,10 (m, 5H), Т.пл. =: 170-177°С 3,60 (s, 2H), 3,01-2,92 (m, 2 Η), 2,57-2,50 (m, 2H), 1 Н ЯМР (300МГц, CD3OD): δ 3,35-3,10 (m, 6Н), 2,18-2,0 (m, 4H), 1,90-1,81 (m, 2H). 2,90 (s, 3Н), 3,02-2,80 (m, 2H), 2,02-1,70 (m,4H), Виготовлення В 1,45 (s,9H). 3-бензил-N-метил-3-азадицикло[3,2,1]октан-813 C ЯМР (75 МГц, CD3OD): δ 159,2, 81,8, 61,6, амін 45,6, 36,6, 36,0,28,5, 24,8.. Суміш ціаноборогідриду натрію (35,0г, CI-MC: (М+1) = 241 m/z 0,557моль) та хлориду цинку (37,9г, 0,278моль) у Вільну основу отримали обробкою солі НСІ метанолі (500мл) додавали краплями при 25°С під К2СО3 у MeCN азотом до механічно перемішуваної суміші 3Виготовлення Ε бензил-3-азадицикло[3,2,1]октан-8-ону (Виготов4-{3-[3-азадицикло[3,2,1]окт-8-ил(метил)аміно]лення А; 120г, 0,557моль) та гідрохлориду мети2-гідроксипропокси)-бензонітрил ламіну (151г, 2,23моль) у метанолі (1,0л). Через (і) 4-(2-оксиранілметокси)бензонітрил 2,5 годин перемішування додавали краплями 6Η Епіхлоргідрин (800мл) та К2СО3 (414г) додаваNaOH (90мл). Суміш фільтрували крізь шар ли до перемішуваного розчину п-ціанофенолу Celite®, промиваючи метанолом (500мл). Фільтрат (238г) у 2,0л MeCN та реакційну суміш кип'ятили концентрували під вакуумом. Воду (500мл) додапід зворотним холодильником в інертній атмосфевали та водну суміш екстрагували етилацетатом рі протягом 2 годин. Гарячий розчин фільтрували (3 500мл). Поєднані органічні екстракти сушили та фільтрат концентрували, одержавши прозоре сульфатом натрію та концентрували під вакуумом. масло, яке кристалізували з діізопропілового етеЗалишок хроматографували, елююючи сумішшю ру, одержавши потрібну сполуку з виходом 75%. метанол:дихлорметан (1:10), отримавши 63,0г (іі) 4-(3-[(3-бензил-3-азадицикло[3,2,1]окт-8(49%) потрібної сполуки як твердий продукт. 1 ил)(метил)аміно]-2-гідроксипропокси)-бензонітрил Н ЯМР (300 МГц, CDCI3): δ 7,40-7,10 (m, 5H). До розчину 3-бензил-N-метил-33,88 (s, 2H), 3,60 (s, 2H). 3,45 (s, 1H). 2,85-2,80 (m, азадицикло[3,2,1]октан-8-аміну (Виготовлення В; 1H), 2,60-2,45 (m, 2H). 2,50 (s, ЗН). 2,15 (s, 2H), 3,72г, 16,1ммоль) у дихлорметані (80мл) при 25°С 2,40-2,30 (m, 2H), 1,70-1,62 (m, 2H). під азотом додавали триметилалюмінію (8,05мл Виготовлення С 2,0Μ у гексані, 16,1ммоль). Після перемішування Трет-бутилу 3-бензил-3-азадицикло[3,2,1]октпри 25°С протягом 30 хвилин, додавали одною 8-ил(метил)карбамат порцією 4-(2-оксираніл-метокси)бензонітрил (диСуміш 3-бензил-N-метил-3вися етап (і) вище; 2,83г, 16,1ммоль) та суміш пеазадицикло[3,2,1]октан-8-аміну (Виготовлення В; ремішували протягом ночі. Суміш гасили 6Η NaOH 168,1г, 0,730моль) та ди-трет-бутилдикарбонату (13,5мл) та перемішували 1 годин. Воду (100мл) (159г, 0,730моль) у дихлорметані (2,5л) перемішудодавали та водний шар екстрагували дихлормевали протягом ночі при 25°С під азотом. Суміш таном (3 100мл). Поєднані органічні екстракти концентрували під вакуумом, одержавши 240г сушили сульфатом натрію, фільтрували та конце(100%) потрібної сполуки як білу тверду речовину, нтрували під вакуумом, одержуючи масла. Залияку використовували без очистки. 1 шок хроматографували на силікагелі, елююючи Н ЯМР (300МГц, CDCI3): δ 7,40-7,30 (m, 5H), сумішшю дихлорметан:метанол (98:2), отримавши 4,0 (s, 2H), 3,60 (s, 2H), 3,45 (s, 1H), 3,02-2,50 (m, 4,30г (66%) потрібної сполуки як безбарвне масло. 5H), 2,80 (s, 3Н), 2,0-1,70 (m, 4H), 1,50 (s, 9H). 1 Н ЯМР (300МГц, CDCI3): δ 7,58 (d, J = 8,2Гц, Виготовлення D 2H), 7,32-7,20 (m, 5H), 6,97 (d, J = 8,2Гц, 2H), 4,22Трет-бутилу 3-азадицикло[3,2,1]окт-84,14 (m, 1H), 4,08-4,0 (m, 2H), 3,50 (s, 2H), 2,82ил(метил)карбамат 2,70 (m, 1H), 2,64-2,52 (m, 2H), 2,48-2,30 (m, 5H), Розчин 1Μ НСІ у діетиловому етері (730мл, 2,30 (s, 3Н), 1,94-1,82 (m, 2H), 1,72-1,50 (m, 4H). 730ммоль) додавали краплями до розчину трет13 C ЯМР (75МГц, CDCI3): δ 162,4, 139,4, 134,0, бутилу 3-бензил-3-азадицикло[3,2,1]окт-8128,2, 128,0, 126,8, 119,5, 115,6, 104,4, 70,6, 68,0, ил(метил)карбамату (Виготовлення С, 241г, 66,0, 62,4, 57,7, 52,4, 52,0, 40,4, 36,8, 36,2, 27,8. 0,730моль) у діетиловому етері (1,5л). Утворений 39 75057 40 XI (хімічна іонізація)-МС: (М+1) = 406 m/z 2-гідроксипропіл]-3-азадицикло[3,2,1]окт-8(ііі) 4-{3-[3-азадицикло[3,2,1]окт-8ил(метил)карбамату (дивися етап (і) вище; 3,15г, ил(метил)аміно]-2-гідроксипропокси}-бензонітрил 7,58ммоль) у етилацетаті, насиченому НСІ (40мл), Розчин НСІ у ефірі (4,3мл 1,0М, 4,3ммоль) доперемішували протягом 5 годин при 25°С під азодавали краплями до розчину 4-{3-[(3-бензил-3том. Суміш розподіляли між водою (100мл) та етиазадицикло[3,2,1]окт-8-ил)(метил)аміно]-2лацетатом (50мл). Водний шар відділяли та прогідроксипропокси)бензонітрилу (дивися етап (іі) мивали етилацетатом. Водний шар відділяли, вище; 1,75г, 4,32ммоль) у діетиловому етері підлужували насиченим гідрокарбонатом натрію (50мл) при 0°С. Концентрація під вакуумом дала (30мл) та далі екстрагували дихлорметаном сіль НСІ. Сіль НСІ та 10% паладію на вугіллі (3 50мл). Органічні екстракти сушили сульфатом (175мг) суспендували у метанолі (25мл), далі пенатрію, фільтрували, концентрували під вакуумом ремішували при одній атмосфері водню протягом та далі хроматографували на силікагелі, елююючи 5 годин при 40°С. Каталізатор видаляли фільтрусумішшю дихлорметан:метанол:концентрований ванням крізь тонкий шар Celite®, промиваючи мерозчин гідроксиду амонію (88:10:2), отримавши танолом (50мл). Фільтрат концентрували під ваку2,30г (96%) потрібної сполуки як безбарвне масло. 1 умом та хроматографували на силікагелі, Н ЯМР (300МГц, CDCI3): δ 7,58 (d, J = 8,2Гц, елююючи сумішшю дихлорме2Н), 6,97 (d, J = 8,2Гц, 2Н), 4,10-3,90 (m, 4H), 3,90 тан:метанол:концентрований розчин гідроксиду (d, J = 8,2Гц, 1H), 2,70-2,67 (m, 1H), 2,60-2,30 (m, амонію (88:10:2), отримавши 980мг (72%) потріб5H), 2,40 (s, 3Н), 2,08-2,0 (m, 2H), 1,82-1,64 (m,5H). 13 ної сполуки як білу піну. C ЯМР (75МГц. CDCI3): δ 162,2, 134,0. 132,7, 1 Н ЯМР (300МГц, CDCI3): δ 7,58 (d, J = 8,2Гц, 119,2, 115,6, 104,1, 70,6, 65,2, 60,8, 59,8, 54,2, 50,4, 2Н), 6,97 (d, J = 8,2Гц, 2Н), 4,30-4,16 (m, 1H), 4,1237,8, 37,2, 35,4, 27,4, 27,2. 4,0 (m, 2H), 3,33-3,10 (m, 4H), 2,82-2,70 (m, 1H), XI-MC:(M+1) = 316m/z 2,52-2,30 (m, 4H), 2,30 (s, ЗН), 2,20-2,05 (m, 2H), Виготовлення G 1,91-1,70 (m, 4H). 4-({3-[8-(метиламіно)-3-азадицикло[3,2,1]окт-313 C ЯМР (75МГц, CDCI3): δ 162,4, 134,0, 119,5, ил]пропіл}аміно)-бензонітрил 115,6, 104,4. 70,6, 68,0, 66,0, 57,7, 52,0, 40,4, 36,8, (і) 4-[(3-гідроксипропіл)аміно]бензонітрил 36,2, 27,8. Суміш 4-флуорбензонітрилу (12,0г, 99,1ммоль) ХІ-МС: (М+1) = 316m/z та 3-аміно-1-пропанолу (59,6г, 793ммоль) переміВиготовлення F шували при 80°С в інертній атмосфері протягом 3 4-{2-гідрокси-3-[8-(метиламіно)-3годин перед додаванням води (150мл). Суміші азадицикло[3,2,1]окт-3-ил]пропокси}-бензонітрил давали охолонути до кімнатної температури та (і) Трет-бутилу 3-[3-(4-ціанофенокси)-2далі екстрагували діетиловим етером. Органічний гідроксипропіл]-3-азадицикло-[3,2,1]окт-8шар відділяли, сушили сульфатом натрію, фільтил(метил)карбамат рували та концентрували під вакуумом, одержавДо розчину трет-бутилу 3ши 17г (97%) потрібної сполуки як масло, що крисазадицикло[3,2,1]окт-8-ил(метил)карбамату (Виготалізувалося при стоянні. товлення D; 1,68г, 7,0ммоль) у дихлорметані (іі) 3-(4-ціаноаміно)пропіл 4(35мл) при 25°С під азотом додавали триметиламетилбензолсульфонат люміній (3,75мл 2,0Μ у гексанах, 7,0ммоль). Після Охолоджений (0°С) розчин 4-[(3перемішування при 25°С протягом 30 хвилин догідроксипропіл)аміно]бензонітрилу (дивися етап (і) давали одною порцією 4-(2-оксиранілвище; 17г, 96,5 ммоль) у сухому MeCN (195мл) метокси)бензонітрил (Виготовлення Е(і); 1,22г, обробляли триетиламіном (9,8г, 96,5ммоль) та 7,0ммоль) та суміш перемішували протягом ночі. далі п-толуолсульфонілхлоридом (20,2г, Суміш гасили 3Η NaOH (11,5мл) та перемішували 106ммоль). Суміш перемішували при 0°С протягом протягом 1 годин. Воду (30мл) додавали та водний 90 хвилин, потім концентрували під вакуумом. Вошар екстрагували дихлорметаном (3 30мл). Поєдду (200мл) додавали до залишку та водний розчин нані органічні екстракти сушили сульфатом наекстрагували ДХМ. Органічну фазу сушили сультрію, фільтрували та концентрували у вакуумі, фатом натрію, фільтрували та концентрували під одержуючи масла. Залишок хроматографували на вакуумом. Утворений залишок очищали кристалісилікагелі, елююючи сумішшю дихлормезацією з ізопропанолу, одержавши 24,6г (77%) тан:метанол (98:2), отримавши 2,35г (81%) потрібпотрібної сполуки. ної сполуки як білу тверду речовину. (iii) Трет-бутилу 3-[3-(4-ціаноаніліно)пропіл]-3Т.пл. =: 109-112°С азадицикло[3,2,1]окт-8-ил-(метил)карбамат 1 Н ЯМР (300МГц. CDCI3): δ (7,58 (d, J = 8,2Гц, Суміш трет-бутилу 3-азадицикло[3,2,1]окт-82Н), 6,97 (d, J = 8,2Гц, 2Н), 4,10-3,70 (m, 3Н), 3,22ил(метил)карбамату (Виготовлення D; 2,90г, 3,16 (m, 1H), 2,90 (s, 3Н), 2,70-2,25 (m, 8H), 1,5012,1ммоль), 3-(4-ціаноаніліно)пропілу 4-метил1,82 (m, 5H), 1,45 (s, 9H). бензолсульфонату (дивися етап (іі) вище; 3,98г, 13 C ЯМР (75 МГц, CDCI3): δ 162,2, 157,6, 134,0, 12,1ммоль) та карбонату калію (1,67г, 12,1ммоль) 132,7. 119,2, 115,6, 104,1, 79,8, 70,6. 65,2, 60,8, у диметилформаміді (50мл) гріли при 90°С під азо59,8, 58,0, 55,2, 52,0, 37,8, 37,2, 35,4, 28,4, 26,1, том протягом 4 годин. Суміш розподіляли між во26,0. дою (50мл) та діетиловим етером (50мл). Водний XI-MC: (M+1) = 416m/z шар відділяли та далі екстрагували діетиловим (іі) 4-{2-гідрокси-3-[8-(метиламіно)-3етером (2 50мл). Поєднані органічні екстракти азадицикло[3,2,1]окт-3-ил]-пропокси}бензонітрил промивали насиченим розсолом (2 30мл), сушили Суспензію трет-бутилу 3-(3-(4-ціанофенокси)сульфатом натрію, фільтрували та далі концент 41 75057 42 рували під вакуумом. Залишок хроматографували 128,4, 128,2. 136,4, 121,2, 112,2, 98,4, 68,8, 62,4, на силікагелі, елююючи сумішшю дихлорме54,5, 52,8, 43,0, 39,9. 36,4, 28,8, 25,8. тан:метанол (98:2), отримавши 2,85 г (59%) потріХІ-МС: (М+1) = 389m/z бної сполуки. (іі) 4-({(3-[3-азадицикло[3,2,1]окт-81 Н ЯМР (300МГц, CDCI3): δ 7,40 (d, J = 8,2Гц, ил(метил)аміно]пропіл}аміно)-бензонітрил 2Н), 6,52 (d, J = 8,2Гц, 2Н), 3,25-3,18 (m, 4H), 2,80 Розчин НСІ у діетиловому етері (3,4мл 1,0М, (s, 3Н), 2,72-2,60 (m, 4H), 2,50-2,42 (m, 2H), 2,283,4ммоль) додавали краплями до розчину 4-({3-[(32,20 (m, 2H), 1,85-1,70 (m, 6H), 1,45 (s, 9H). бензил-3-азадицикло[3,2,1]окт-813 C ЯМР (75МГц, CDCI3): δ 157,4, 152,0, 133,8, ил)(метил)аміно]пропіл}аміно)-бензонітрилу (диви133,2, 120,4. 111,8, 97,7, 79,8, 61,4, 57,8, 53,9, 44,2, ся етап (і) вище; 1,32г, 3,39ммоль) у діетиловому 37,8, 35,0, 28,0, 26,0, 24,2. етері (50мл) при 0°С. Концентрація під вакуумом ХІ-МС: (М+1) = 399m/z дала сіль НСІ. Сіль НСІ та 10% паладію на вугіллі (iv) 4-({3-[8-(метиламіно)-3(132мг) суспендували у метанолі (20мл) та переазадицикло[3,2,1]окт-3-ил]пропіл}аміно)мішували при одній атмосфері водню протягом 2 бензонітрил годин при 40°С. Каталізатор видаляли фільтруСуспензію трет-бутилу 3-[3-(4ванням крізь тонкий шар Celite®, промиваючи меціаноаніліно)пропіл]-3-азадицикло-[3,2,1]окт-8танолом (50мл). Фільтрат концентрували під вакуил(метил)карбамату (дивися етап (ііі) вище; 2,66г, умом та хроматографували на силікагелі, 6,67ммоль) у етилацетаті, насиченому НСІ (40мл) елююючи сумішшю дихлормеперемішували протягом ночі при 25°С під азотом. тан:метанол:концентрований розчин гідроксиду Суміш розподіляли між водою (100мл) та етилацеамонію (88:10:2), отримавши 590мг (59%) потрібтатом (50мл). Водний шар підлужували насиченим ної сполуки як білу піну. гідрокарбонатом натрію (50мл) та далі екстрагуваТ.пл. =: 59-63°С 1 Н ЯМР (300МГц, CD3OD): δ 7,48 (d, J = 8,2Гц, ли дихлорметаном (3 50мл). Органічні екстракти 2Н), 6,66 (d, J =8,2Гц, 2Н), 4,80m (s, 1H), 3,35-3,10 сушили сульфатом натрію, фільтрували, концент(m, 4H), 2,62-2,40 (m, 4H), 2,30-2,10 (m, 4H), 2,25 рували під вакуумом та далі хроматографували на (s, 3H), 1,91-1,70 (m, 6H). силікагелі, елююючи сумішшю дихлорме13 C ЯМР (75МГц, CD3OD): δ 154,0, 133,8, тан:метанол:концентрований розчин гідроксиду 122,2, 113,2, 97,8, 68,8, 54,5, 45,8, 42,0, 40,4, 37,0, амонію (92:7:1), отримавши 1,07г (54%) потрібної 26,8, 26,6. сполуки як білу тверду речовину 1 XI-MC:(M+1) = 299m/z Н ЯМР (300МГц, CD3OD): δ 7,40 (d, J = 8,2Гц, Виготовлення I 2Н), 6,52 (d, J = 8,2Гц, 2Н), 3,40-3,10 (m, 6H), 2,724-(1-(3,4-диметоксифенокси)-4-[82,40 (m, 6H), 2,40 (s, 3Н), 2,22-2,0 (m, 2H), 1,80(метиламіно)-3-азадицикло[3,2,1]окт-31,62 (m, 5H). 13 ил]бутил}бензонітрил C ЯМР (75МГц, CD3OD): δ 154,0, 134,2. (і) 4-[1-(3,4-диметоксифенокси)-3113,4, 97,7, 64,4, 57,8, 53,9, 42,5, 37,8, 34,0, 28,0, бутеніл]бензонітрил 26,0. Охолоджену (0°С) суміш 4-(1-гідрокси-3ХІ-МС: (М+1) = 299m/z бутеніл)бензонітрилу (14,6г, 84,3ммоль) та 3,4Виготовлення Η диметоксифенолу (19,5г, 125,4ммоль) у толуолі 4-({3-[3-азадицикло[3,2,1]окт-8(500мл) обробляли трибутилфосфіном (32,14мл ил(метил)аміно]пропіл}аміно)-бензонітрил 97% чистоти, 25,6г, 126,4ммоль) та потім 1,1'(i) 4-({3-[(3-бензил-3-азадицикло[3,2,1]окт-8(азодикарбоніл)піперидином (31,8г, 126,4ммоль). ил)(метил)аміно]пропіл}-аміно)-бензонітрил Після закінчення додавання реакційна суміш стала Суміш 3-бензил-N-метил-3густою та температура зросла до 15°С. Додаткоазадицикло[3,2,1]октан-8-аміну (Виготовлення В; вий толуол додавали (500мл) та суміш перемішу4,0г, 17,4ммоль), 3-(4-ціаноаніліно)пропілу 4вали при кімнатній температурі протягом ночі. метил-бензолсульфонату (Виготовлення G(ii); Осад трибутилфосфіноксиду далі видаляли філь5,74г, 17,4ммоль) та карбонату калію (2,40г, труванням та фільтрат концентрували під вакуу17,4ммоль) у диметилформаміді (85мл) гріли при мом, одержавши 65,8г сирого продукту, який очи90°С під азотом протягом ночі. Суміш розподіляли щали хроматографією на силікагелі, елююючи між водою (200мл) та діетиловим етером (150мл). сумішшю толуол:метанол (98:2), одержавши 17,9г Водний шар екстрагували етилацетатом (2 50мл). потрібної сполуки. Поєднані органічні екстракти промивали розсолом (іі) 4-[1-(3,4-диметоксифенокси)-4(2 30мл), сушили сульфатом натрію, фільтрували гідроксибутил]бензонітрил та далі концентрували під вакуумом. Залишок Боран-метилсульфідний комплекс (2Μ у ефірі, хроматографували на силікагелі, елююючи сумі11мл, 22ммоль) додавали краплями до охолоджешшю дихлорметан:метанол (98:2), отримавши ного (-5°С) розчину 4-[1-(3,4-диметокси-фенокси)3,40г (50%) потрібної сполуки як білу тверду речо3-бутеніл]бензонітрилу (дивися етап (і) вище; вину. 17,6г, 56,8ммоль) у сухому тетрагідрофурані Т.пл. =: 91-93°С 1 (15мл) протягом 15-хвилинного періоду (протягом Н ЯМР (300МГц, CDCI3): δ 7,48 (d, J = 8,2Гц, часу реакції температура зросла до 0°С). Утворену 2H), 7,32-7,20 (m, 5H). 6,60 (d, J = 8,2Гц, 2H), 5,78суміш перемішували при температурі між 0 та 5,70 (m, 1H), 3,50 (s, 2H), 3,30-3,20 (m, 2H), 2,6210°С протягом 1,5 годин перед тим, як давали на2,52 (m, 4H), 2,40-2,32 (m, 2H), 2,25 (s, 3Н), 2,25грітися до кімнатної температури. Перемішування 2,10 (m, 3Н), 1,92-1,80 (m, 4H), 1,72-1,60 (m, 2H). 13 продовжували ще протягом 3,5 годин при цій темC ЯМР (75 МГц, CDCI3): δ 152,2, 140,0, 133,8, 43 75057 44 пературі перед додаванням води (222мл) та тетранатрію (50мл) та далі екстрагували дихлорметагідрату перборату натрію (11г, 66ммоль). Двофазном (3 50мл). Органічні екстракти сушили сульфану суміш перемішували протягом 2 годин при кімтом натрію, фільтрували, концентрували під вакунатній температурі перед відділенням водного умом та далі хроматографували на силікагелі, шару та екстрагували етером. Поєднані органічні елююючи сумішшю дихлормешари промивали розсолом, сушили та концентрутан:метанол:концентрований розчин гідроксиду вали під вакуумом. Утворений залишок очищали амонію (92:7:1), отримавши 1,32г (61%) потрібної хроматографією на силікагелі, елююючи сумішшю сполуки як жовте масло. 1 ІРА:етилацетат:гептан (5:25:70), одержавши 14,5г Н ЯМР (300МГц, CDCI3): δ 7,62 (d, J = 8,2Гц, (77%) потрібної сполуки. 2Н), 7,46 (d, J = 8,2Гц, 2Н), 6,62 (d, J = 8,2Гц, 2H), (ііі) 4-(4-ціанофеніл)-4-(3,46,50 (s, 1H), 6,18 (d, J = 4,0Гц, 2H), 5,21-5,10 (m, диметоксифенокси)бутил метансульфонат 1H), 3,80 (s, 3Н), 3,76 (s, 3Н), 3,50-3,48 (m, 1H), Розчин метансульфонілхлориду (3,4мл, 5,0г, 2,70-2,62 (m, 1H), 2,40 (s, 3Н), 2,48-2,30 (m, 4H), 44ммоль) у ДХМ (15мл) повільно додавали до 2,10-1,40 (m, 10Н). 13 охолодженої (-5°С) суміші 4-[1-(3,4C ЯМР (75МГц, CDCI3): δ 152,0, 149,8, 148,2, диметоксифенокси)-4-гідроксибутил]бензонітрилу 143,6, 132,4, 126,5, 118,4, 112,0, 111,7, 105,6, (дивися етап (іі) вище; 11г, 34 ммоль) та триети102,2, 79,6, 79,4. 62,5, 57,6, 56,4, 55,8, 53,8, 53,4, ламіну (7мл, 5,2г, 50,6ммоль) у ДХМ (50мл), протя37,6, 35,8, 35,4, 28,2, 26,4. гом додавання температура не зростала вище ХІ-МС: (М+1) = 450m/z 2°С. Перемішування продовжували при темпераВиготовлення J турі між 0 та 5°С ще протягом 2 годин перед дода4-[4-[3-азадицикло[3,2,1]окт-8-ил(метил)аміно]ванням води. Утворений органічний шар відділяли 1-(3,4-диметоксифенокси)бутил]-бензонітрил та промивали водою, відділяли знов та далі суши(і) 4-[4-[(3-бензил-3-азадицикло[3,2,1]окт-8ли, одержавши потрібну сполуку зі 100% виходу. ил)(метил)аміно]-1-(3,4(іv) Трет-бутил 3-[4-(4-ціанофеніл)-4-(3,4диметоксифенокси)бутил]бензонітрил диметоксифенокси)бутил]-3-азадицикло[3,2,1]октСуміш 3-бензил-N-метил-38-ил(метил)карбамат азадицикло[3,2,1]октан-8-аміну (Виготовлення В; Суміш трет-бутилу 3-азадицикло[3,2,1]окт-81,3г, 5,95ммоль), 4-(4-ціанофеніл)-4-(3,4ил(метил)карбамату (Виготовлення D; 2,60г, диметокси-фенокси)бутилу метансульфонату (Ви10,9ммоль), 4-(4-ціанофеніл)-4-(3,4готовлення І (ііі); 2,41г, 5,95ммоль) та карбонату диметоксифенокси)бутилу метансульфонату (дикалію (822мг, 5,95ммоль) у диметилформаміді вися етап (ііі) вище; 4,40г, 10,9ммоль) та карбонату (25мл) гріли при 90°С під азотом протягом ночі. калію (1,50г, 10,9ммоль) у диметилформаміді Суміш розподіляли між водою (50мл) та діетило(50мл) гріли при 90°С під азотом протягом 4 годин. вим етером (40мл). Водний шар екстрагували діеСуміш розподіляли між водою (50мл) та діетилотиловим етером (2 40мл). Поєднані органічні ексвим етером (50мл). Водний шар екстрагували діетракти промивали розсолом (2 30мл), сушили тиловим етером (2 50мл). Поєднані органічні екссульфатом натрію, фільтрували та далі конценттракти промивали розсолом (2 30мл), сушили рували під вакуумом. Залишок хроматографували сульфатом натрію, фільтрували та далі концентна силікагелі, елююючи сумішшю дихлормерували під вакуумом. Залишок хроматографували тан:метанол (98:2), отримавши 860мг (27%) потріна силікагелі, елююючи сумішшю дихлормебної сполуки. 1 тан:метанол (98:2), отримавши 3,60г (60%) потрібН ЯМР (300МГц, CDCI3): δ 7,62 (d, J = 8,2Гц, ної сполуки як аморфний продукт. 2Н), 7,46 (d, J = 8,2Гц. 2Н), 7,38-7,20 (m, 5H), 6,62 1 Н ЯМР (300МГц, CDCI3): δ 7,62 (d, J = 8,2Гц, (d, J = 8,2Гц, 2Н), 6,50 (s, 1H), 6,18 (d, J = 4,0Гц, 2Н), 7,46 (d, J = 8,2Гц, 2Н), 6,62 (d, J = 8,2Гц, 2H); 2Н), 5,22-5,10 (m, 1H), 3,80 (s, 3Н), 3,76 (s, 3Н), 6,50 (s, 1H), 6,18 (d, J = 4,0Гц, 2H), 5,10 (m, 1H), 3,50 (s, 2H), 2,68-2,52 (m, 2H), 2,50-2,28 (m, 4H), 3,80 (s, 3Н), 3,76 (s, 3Н), 3,20-3,16 (m, 1H), 2,90 (s, 2,15 (s, 3Н), 2,0-1,75 (m, 4H), 1,68-1,50 (m,5H). 13 3Н), 2,62-2,56 (m, 2H), 2,50-2,12 (m, 6H), 2,0-1,60 С ЯМР (75МГц, CDCI3): δ 152,0, 149,8, 148,2, (m, 7H), 1,43 (s, 9H). 143,6, 140,0, 132,4, 128,0, 127,8, 126,0, 118,4, 13 C ЯМР (75МГц, CDCI3): δ 157,8, 152,0, 149,8, 112,0, 111,7, 105,6, 102,2, 79,6, 68,4, 61,8, 59,2, 148,2, 143,6, 132,4, 130,0, 118,4, 112,0, 111,7, 57,6, 56,4, 55,8, 53,8, 53,4, 39,8, 35,8, 35,4, 28,2, 105,6, 102,2, 79,6, 79,4, 61,8, 57,6, 56,4, 55,8, 53,8, 22,4. 53,4, 37,6, 35,8, 35,4, 28,2, 26,4, 22,4. ХІ-МС: (М+1) = 540m/z ХІ-МС: (М+1) = 550m/z (ii) 4-[4-[3-азадицикло[3,2,1]окт-8(ν) 4-{1-(3,4-диметоксифенокси)-4-[8ил(метил)аміно]-1-(3,4-диметокси(метиламіно)-3-азадицикло-[3,2,1]окт-3фенокси)бутил]бензонітрил ил]бутил}бензонітрил Розчин НСІ у діетиловому етері (4,1мл 1,0М, Суспензію трет-бутилу 3-[4-(4-ціанофеніл)-44,1ммоль) додавали краплями до розчину 4-[4-[(3(3,4-диметокси-фенокси)бутил]-3бензил-3-азадицикло[3,2,1]-окт-8-ил)(метил)аміно]азадицикло[3,2,1]окт-8-ил(метил)карбамату (диви1-(3,4-диметоксифенокси)бутил]бензонітрилу (дися етап (iv) вище; 2,67г, 4,86ммоль) у етилацетаті, вися етап (і) вище; 2,20г, 4,08ммоль) у діетиловонасиченому НСІ (60мл) перемішували протягом му етері (50мл) при 0°С. Концентрація під вакууночі при 25°С під азотом. Суміш розподіляли між мом дала сіль НСІ. Сіль НСІ та 10% паладію на водою (100мл) та етилацетатом (50мл). Водний вугіллі (220мг) суспендували у метанолі (20мл) та шар перед відділенням промивали етилацетатом перемішували при одній атмосфері водню протя(50мл), підлужували насиченим гідрокарбонатом гом ночі при 40°С. Каталізатор видаляли фільтру 45 75057 46 ванням крізь тонкий шар Celite®, промиваючи мезворотним холодильником протягом ночі. Фільтрутанолом (50мл). Фільтрат концентрували під вакування та випарювання розчиннику дали коричневе умом та хроматографували на силікагелі, елюююмасло, що кристалізувалося при обробці EtOH. чи сумішшю Кристали виділяли фільтруванням, одержавши дихлорметан:метанол:концентрований розчин потрібну сполуку (24,5г, 62%). гідроксиду амонію (88:10:2), отримавши 502мг (іі) 4-[(3-бромпропіл)сульфоніл]бензонітрил (28%) потрібної сполуки як білувату піну. 3-Хлорпероксибензойну кислоту (44,9г 70%, Т.пл. = 47-53°С 182ммоль) додавали повільно до охолодженого 1 Н ЯМР (300МГц, CD3OD): δ 7,62 (d, J = 8,2Гц, (0°С) розчину 4-[(32Н), 7,46 (d, J =8,2Гц, 2Н), 6,62 (d, J = 8,2Гц, 2H), бромпропіл)сульфаніл]бензонітрилу (дивися етап 6,50 (s, 1H), 6,18 (d, J = 4,0Гц, 2H), 5,22-5,10 (m, (і) вище; 23,4г, 91ммоль) у ДХМ (250мл). Суміш 1H), 3,80 (s, 3Н), 3,76 (s, 3Н), 3,33-3,20 (m, 2H), далі перемішували при кімнатній температурі про2,50-2,30 (m, 6H), 2,15 (s, 3Н), 2,20-2,0 (m, 3Н), тягом ночі та утворений осад відфільтровували. 1,92-1,50 (m, 5H). Фільтрат концентрували під вакуумом, одержавши 13 C ЯМР (75МГц, CD3OD): δ 152,0, 149,8, залишок, який за ЯМР-аналізом містив 25% суль148,2, 143,6, 132,4, 128,0, 118,4, 112,0, 111,7, фоксиду на додаток до потрібного продукту. За105,6, 102,2, 79,6, 68,4, 57,6, 56,4, 55,8, 50,5, 44,6, лишок знов розчиняли у ДХМ (250мл), ще додава39,8, 35,8, 35,4, 26,2, 22,4. ли 3-хлорпероксибензойну кислоту (5,6г 70%, XI-MC:(M+1)= 450m/z 23ммоль) та суміш перемішували протягом 30 Виготовлення К хвилин. Диметилсульфоксид (20ммоль) додавали 4-{2-[8-(метиламіно)-3-азадицикло[3,2,1]окт-3для руйнування надлишку мХПБК і розчин у ДХМ ил]етокси}бензонітрил промивали водним NaHCO3, відділяли, сушили та (і) 4-(2-брометокси)бензонітрил концентрували під вакуумом. Це дало потрібну Суміш 4-ціанофенолу (35,7г, 0,3моль), К2СО3 сполуку з 76% виходу. (41,4г, 0,3моль) та 1,2-диброметану (561г, (ііі) Трет-бутилу 3-{3-[(43,0моль) у MeCN (450мл) перемішували при кип'яціанофеніл)сульфоніл]пропіл}-3-азадииикло[3,2,1]тінні під зворотним холодильником протягом ночі. окт-8-ил(метил)карбамат Суміш фільтрували та випарювали, одержавши Потрібну сполуку отримали з 70% виходу 30,2г (45%) потрібної сполуки, як використовували (1,1г) згідно зі способом, описаним у Виготовленні без подальшої очистки. К(іі) вище з використанням 4-[(3(іі) Трет-бутилу 3-[2-(4-ціанофенокси)етил]-3бромпропіл)сульфоніл]бензонітрилу (дивися етап азадицикло[3,2,1]окт-8-ил-(метил)карбамат (іі) вище) замість 4-(2-брометокси)бензонітрилу. Суміш 4-(2-брометокси)бензонітрилу (дивися (iv) 4-({3-[8-(метиламіно)-3етап (і) вище; 0,94г, 4,2ммоль), трет-бутилу 3азадицикло[3,2,1]окт-3-ил]пропіл}сульфоніл)азадицикло[3,2,1]окт-8-ил(метил)карбамату (Вигобензонітрил товлення D; 0,91г, 3,8ммоль) та К2СО3 (0,79г, Потрібну сполуку виготовляли зі 100% виходу 5,7ммоль) у 15мл сухого диметилформаміду пезгідно зі способом, описаним у Виготовленні К(ііі) ремішували при 90°С протягом ночі і додавали вище, використовуючи трет-бутилу 3-{3-[(4додатковий К2СО3 (1г). Суміш розбавляли 300мл ціанофеніл)сульфоніл]пропіл}-3ДХМ та суміш промивали водою. Органічний шар азадицикло[3,2,1]окт-8-ил(метил)карбамат (дивися відділяли, сушили сульфатом натрію та далі випаетап (ііі) вище) замість трет-бутилу 3-[2-(4рювали. Сирий продукт очищали флешціанофенокси)етил]-3-азадицикло[3,2,1]окт-8хроматографією на силікагелі, елююючи ДХМ: ил(метил)карбамату. МеОН (10:1), що містить 0,1% TEA, одержавши Виготовлення Μ 1,1г (76%) потрібної сполуки. 4-{2-[8-(метиламіно)-3-азадииикло[3,2,1]окт-3(ііі) 4-{2-[8-(метиламіно)-3ил]стокси}ізофталонітрил азадицикло[3,2,1]окт-3-ил]етокси}-бензонітрил (і) 4-(2-брометокси)ізофталонітрил Етилацетат (30мл), насичений газуватим НСІ, Потрібну сполуку виготовляли з 64% виходу додавали до розчину трет-бутилу 3-[2-(4згідно зі способом, описаним у Виготовленні К(і) ціанофенокси)етил]-3-азадицикло[3,2,1]окт-8-илвище, використовуючи 4-гідроксиізофталонітрил (метил)карбамату (дивися етап (іі) вище; 1,1г, замість 4-ціанофенолу. 2,8ммоль) у етилацетаті при 0°С. Утворену суміш (ii) Трет-бутилу 3-[2-(2,4перемішували протягом 4 годин при кімнатній темдиціанофенокси)етил]-3-азадицикло[3,2,1]окт-8пературі. Розчинник видаляли під вакуумом і доил(метил)карбамат. давали MeCN (29мл), воду (21,5мл) та К2СО3 Потрібну сполуку виготовляли з 85% виходу (2,4г). Утворену суміш перемішували протягом згідно зі способом, описаним у Виготовленні К(іі) ночі, фільтрували, промивали СНСІ3 і далі конценвище, використовуючи 4-(2-брометокси)трували під вакуумом, одержавши 0,79г (99%) поізофталонітрил (дивися етап (і) вище) замість 4-(2трібної сполуки. брометокси)бензонітрилу. Виготовлення L (ііі) 4-{2-[8-(метиламіно)-34-({3-[8-(метиламіно)-3-азадицикло[3,2,1]окт-3азадицикло[3,2,1]окт-3-ил]етокси}ізофталонітрил ил]пропіл)сульфоніл)-бензонітрил Потрібну сполуку виготовляли з 20% виходу (і) 4-[(3-бромпропіл)сульфаніл]бензонітрил згідно зі способом, описаним у Виготовленні К(ііі) Суміш 4-ціанотіофенолу (20,8г, 154ммоль), вище, використовуючи трет-бутилу 3-[2-(2,41,3-дибромпропану (155г, 0,77моль) та К2СО3 диціанофенокси)етил]-3-азадицикло[3,2,1]окт-8(21,3г, 154ммоль) у MeCN (300мл) кип'ятили під ил(метил)карбамат замість трет-бутилу 3-[2-(4 47 75057 48 ціанофенокси)етил]-3-азадицикло[3,2,1]окт-8-ил(v) 4-{1-(4-гідроксифенокси)-4-[8-(метиламіно)(метил)карбамату. 3-азадицикло[3,2,1]окт-3-ил]бутил}бензонітрил Виготовлення N Потрібну сполуку виготовляли з 83,4% виходу 4-{1-(4-гідроксифенокси)-4-[8-(метиламіно)-3згідно зі способом, описаним у Виготовленні К(ііі) азадицикло[3,2,1]окт-3-ил]бутил}бензонітрил вище, використовуючи трет-бутилу 3-{4-(4(і) 4-{1-[4-(тетрагідро-2Н-піран-2ціанофеніл)-4-[4-(тетрагідро-2Н-піран-2ілокси)фенокси]-3-бутеніл}бензонітрил ілокси)фенокси]бутил)-3-азадицикло-[3,2,1]окт-8Охолоджену (0°С) суміш 4-(1-гідрокси-3ил(метил)карбамат (дивися етап (iv) вище) замість бутеніл)бензонітрилу (4,93г, 28,5ммоль) та 4трет-бутилу 3-[2-(4-ціанофенокси)етил]-3(тетрагідро-2Н-піран-2-ілокси)фенолу (8,3г, азадицикло[3,2,1]окт-8-ил(метил)-карбамату. 42,7ммоль) у сухому тетрагідрофурані (200мл) Виготовлення О обробляли трибутилфосфіном (8,85мл, Метилу (1S)-2-(4-ціанофенокси)-1-{[842,7ммоль), а потім 1,1'(метиламіно)-3-азадицикло[3,2,1]-окт-3(азодикарбоніл)дипіперидином (10,77г, ил]метил}етилкарбамат 42,7ммоль). Після закінчення додавання реакційну (і) 4-[(2R)-оксиранілметокси]бензонітрил суміш перемішували при 0°С протягом 10 хвилин, Потрібну сполуку виготовляли згідно зі спосоперед тим, як перемішувати при кімнатній темпебом, описаним у Виготовленні Е(і) вище, викорисратурі протягом ночі. Осад трибутилфосфіноксиду товуючи S-епіхлоргідрин замість епіхлоргідрину. видаляли фільтруванням та фільтрат концентру(іі) 4-{[(2R)-3-аміно-2вали під вакуумом, одержавши 24,6г сирого продугідроксипропіл]окси}бензонітрил кту, який очищали хроматографією на силікагелі, 4-[(2R)-оксиранілметокси]бензонітрил (дивися елююючи сумішшю ІРА:етилацетат:гептан (5:5:90), етап (і) вище; 14,65г, 83,6ммоль) змішували з одержавши 4,6г (47%) потрібної сполуки. NH4OH (конц., 64мл) та 87мл ізопропанолу. Суміш (іі) 4-{4-гідрокси-1-[4-(тетрагідро-2Н-піран-2перемішували при кімнатній температурі протягом ілокси)фенокси]бутил}бензонітрил 18 годин. Реакційну суміш далі фільтрували та Боран-диметилсульфідний комплекс (3,5мл випарювали, одержавши 14,6г (91%) потрібної 2Μ у ефірі, 7ммоль) додавали краплями до охолосполуки як білу тверду речовину. дженого (5°С) розчину 4-{1-[4-(тетрагідро-2Н-піран(ііі) Бензилу (2R)-3-(4-ціанофенокси)-22-ілокси)фенокси]-3-бутеніл}бензонітрилу (дивися гідроксипропілкарбамат етап (і) вище; 4,6г, 13ммоль) у сухому тетрагідроСуміш 4-{[(2R)-3-аміно-2фурані протягом 15-хвилинного періоду. Утворену гідроксипропіл]окси}бензонітрилу (дивися етап (іі) суміш перемішували при температурі між 0 та 5°С вище; 3,4г, 17,7ммоль), TEA (2,69г, 26,6ммоль) та протягом 1,5 годин. Перемішування далі продовСНСІ3 (20мл) охолоджували до 0°С і повільно дожували ще протягом 4 годин при кімнатній темпедавали N-(бензилоксикарбонілокси)сукцинімід ратурі. Воду (214мл) та NaBO3 (5г) додавали та (4,86г, 19,5моль) у СНСІ3 (15мл). Суміші давали суміш перемішували протягом ночі. Етер додавали досягти кімнатної температури та перемішували та утворений органічний шар відділяли, промивапри, цій температурі протягом ночі. Розчинник вили водою та розсолом, сушили та далі випарювапарювали, одержавши залишок, що розчиняли у ли. Утворений залишок очищали хроматографією ДХМ, розчин промивали водою та розсолом і далі на силікагелі, елююючи сумішшю сушили сульфатом натрію. Випарювання розчинІРА:етилацетат:гептан (5:20:70), одержавши 2,44г нику дало 5,79г (100%) потрібної сполуки. (58%) потрібної сполуки. (iv) (1R)-2-{[(бензилокси)карбоніл]аміно}-1-(4(ііі) 4-(4-ціанофеніл)-4-[4-(тетрагідро-2Н-піранціанофенокси)метил]-етилу метансульфонат 2-ілокси)фенікси]бутилу метансульфонат 4-(диметиламіно)піридин (0,22г, 1,77ммоль) Розчин 4-{4-гідрокси-1-[4-(тетрагідро-2Н-пірандодавали до розчину бензилу (2R)-3-(42-ілокси)фенокси]-бутил}-бензонітрилу (дивися ціанофенокси)-2-гідроксипропілкарбамату (дивися етап (іі) вище; 2,37г, 6,45ммоль) та TEA (1,35мл, етап (ііі) вище; 5,79г, 17,7ммоль) у піридині (15мл). 9,68ммоль) у ДХМ (10мл) охолоджували до -5°С. Суміш охолоджували до 0°С та повільно додавали Метансульфонілхлорид (0,65мл, 8,38ммоль) у при 0°С метансульфонілхлорид (2,23г, ДХМ (5мл) додавали повільно. Після закінчення 19,5ммоль). Суміші давали досягти кімнатної темдодавання температуру витримували нижче 5°С ператури, при якій її далі перемішували протягом 4 протягом 1 годин і додавали ДХМ та воду. Органігодин. Розчинник випарювали. Додавали ДХМ чний шар промивали водою, сушили сульфатом (100мл), промивали водою, 1N H2SO4 та розсолом, натрію та далі випарювали, одержавши 2,87г сушили сульфатом натрію та випарювали, отри(100%) потрібної сполуки, яку використовували у мавши 6,0г (84%) жовтого масла. наступному етапі без подальшої очистки. (v) Бензилу (2S)-2-[(4-ціанофенокси)метил]-1(iv) Трет-бутилу 3-{4-(4-ціанофеніл)-4-[4азиридинкарбоксилат (тетрагідро-2Н-піран-2-ілокси)-фенокси]бутил}-3Розчин NaOH у воді (11мл 50мас%) додавали азадицикло[3,2,1]окт-8-ил(метил)карбамат з енергійним перемішуванням до розчину (1R)-2Потрібну сполуку виготовляли з 93,4% виходу {[(бензилокси)карбоніл]аміно}-1-[(4-ціанофенокси)згідно зі способом, описаним у Виготовленні К(іі) метил]етилу метансульфонату (дивися етап (iv) вище, використовуючи 4-(4-ціанофеніл)-4-[4вище; 5,7г, 14,1ммоль) та гідросульфату тетрабу(тетрагідро-2Н-піран-2-ілокси)фенокси]бутилу метиламонію (0,6г, 1,7ммоль) у ДХМ (34мл). Суміш тансульфонат (дивися етап (ііі) вище) та MeCN перемішували протягом 1 годин і додавали воду замість 4-(2-брометокси)бензонітрилу та димети(2200мл) та етер (200мл). Органічну фазу промилформаміду, відповідно. вали водою та далі сушили. Розчинники випарю 49 75057 50 вали та утворений залишок очищали хроматогральодяній бані та додавали порціями ди-третфією (елюент - ДХМ), одержавши 3,0г (69%) потрібутилдикарбонат (7,7г, 3,5ммоль). Суміш перемібної сполуки. шували при кімнатній температурі протягом ночі і (vi) Бензилу (1S)-2-(8-[(третвипарювали розчинники та додавали ДХМ. Утвобутоксикарбоніл)(метил)аміно]-3-азадициклорений розчин промивали водою, сушили сульфа[3,2,1]окт-3-ил)-1-[(4том натрію та випарювали, одержавши 9,2г потріціанофенокси)метил]етилкарбамат бної сполуки. Бензилу (2S)-2-[(4-ціанофенокси)метил]-1(іі) (1R-2-[(трет-бутоксикарбоніл)аміно]-1-[(4азиридинкарбоксилат (дивися етап (ν) вище; 1,3г, ціанофенокси)метилу етилметансульфонат 4,2ммоль) та трет-бутилу 3-азадицикло[3,2,1]окт-8Потрібну сполуку виготовляли зі 100% виходу ил-(метил)карбамат (Виготовлення D; 1,1г, згідно зі способом, описаним у Виготовленні O(iv) 4,6ммоль) змішували у ІРА (15мл) та перемішувавище, використовуючи трет-бутилу (2R)-3-(4ли при 60°С протягом ночі. Розчинник далі випаціанофенокси)-2-гідроксипропілкарбамат (дивися рювали, одержавши залишок, що очищали хромаетап (і) вище) замість бензилу (2R)-3-(4тографією на силікагелі, елююючи ДХМ:МеОН ціанофенокси)-2-гідроксипропілкарбамату. (100:3), одержавши 1,9г (82%) потрібної сполуки. (ііі) Трет-бутил (2S)-2-[(4-ціанофенокси)метил](vii) Трет-бутилу 3-[(2S)-2-аміно-3-(41-азиридинкарбоксилат ціанофенокси)пропіл]-3-азадицикло-[3,2,1]окт-8Потрібну сполуку виготовляли згідно зі спосоил(метил)карбамат бом, описаним у Виготовленні O(v) вище, викорисБензилу (1S)-2-{8-[(треттовуючи (1R)-2-[(трет-бутоксикарбоніл)аміно]-1-[(4бутоксикарбоніл)(метил)аміно]-3-азадициклоціанофенокси)метил]-етилу метансульфонат (ди[3,2,1]окт-3-ил}-1-[(4вися етап (іі) вище) замість (1R)-2ціанофенокси)метил]етилкарбамат (дивися етап {[(бензилокси)карбоніл]-аміно)-1-[(4(vi) вище; 1,8г, 3,3ммоль) розчиняли у етанолі ціанофенокси)метил]етилу метансульфонату. (50мл 95%). Розчин гідрували над 5% Pd/C протя(iv) Трет-бутилу метил[3-(2,2,2гом 1 годин, після чого суміш фільтрували крізь трифлуорацетил)-3-азадицикло[3,2,1]окт-8-ил]Celite®. Фільтрат концентрували під вакуумом, карбамат. одержавши 1,3г (95%) потрібної сполуки. Трифлуороцтовий ангідрид (10,5г, 50ммоль) (viii) Метилу (1S)-2-{8-[(третдодавали краплями до охолодженої (0°С) суміші бутоксикарбоніл)(метил)аміно]-3-азатрет-бутилу 3-азадицикло[3,2,1]окт-8-ил(метил)дицикло[3,2,1]окт-3-ил)-1-[(4карбамату (Виготовлення D; 11,1г, 46ммоль), TEA ціанофенокси)метил]етилкарбамат (5,6г, 55ммоль) та толуолу (120мл). Суміш переМетилхлорформіат (0,24мл, 3,2ммоль) додамішували протягом 3 годин та далі випарювали. вали при 0°С до суміші трет-бутилу 3-[(2S)-2Утворений залишок розчиняли у ДХМ і утворений аміно-3-(4-ціанофенокси)пропіл]-3-азарозчин промивали 1Μ НСІ (холодною). Органічний дицикло[3,2,1]окт-8-ил(метил)карбамату (дивися шар відділяли, сушили та випарювали, одержавши етап (vii) вище; 1,2г, 2,9ммоль) та TEA (1,2мл, 14,8г (96%) потрібної сполуки. 9ммоль) у ДХМ (30мл). Суміші давали досягти (у) 2,2,2-Трифлуор-1-[8-(метиламіно)-3кімнатної температури протягом 3 годин, після азадицикло[3,2,1]окт-3-ил-1-етанон чого додавали насичений розчин Na2CO3. ОрганічЕтилацетат (100мл), насичений НСІ (г), додану фазу відділяли, сушили та випарювали, одервали при 0°С, до розчину трет-бутилу метил[3жавши сирий продукт, що очищали хроматографі(2,2,2-трифлуорацетил)-3-азадицикло[3,2,1]-окт-8єю на силікагелі. Це дало 0,6г (45%) потрібної ил]карбамату (дивися етап (iv) вище; 5г, 15ммоль) сполуки. у етилацетаті (50мл). Суміші давали досягти кім(іх) Метилу (1S)-2-(4-ціанофенокси)-1-{[8натної температури протягом 3 годин, після чого (метиламіно)-3-азадицикло-[3,2,1]окт-3розчинник випарювали. Це дало 4г (100%) потрібил]метил)етилкарбамат ної сполуки як гідрохлорид. Потрібну сполуку виготовляли з 87% виходу (vi) 1-{8-[бензил(метил)аміно]-3згідно зі способом, описаним у Виготовленні К(ііі) азадицикло[3,2,1]окт-3-ил}-2,2,2-трифлуор-1вище, використовуючи метилу (1S)-2-{8-[(трететанон бутоксикарбоніл)(метил)аміно]-3Суміш 2,2,2-трифлуор-1-[8-(метиламіно)-3азадицикло[3,2,1]окт-3-ил}-1-[(4азадицикло[3,2,1]окт-3-ил]-1-етанону (дивися етап ціанофенокси)метил]-етилкарбамат (дивися етап (ν) вище; 4,5г, 16ммоль), бензилхлориду (3,0г, (viii) вище) замість трет-бутилу 3-[2-(416ммоль) та TEA (6,6мл) у MeCN (50мл) переміціанофенокси)етил]-3-азадицикло[3,2,1]окт-8шували при 60°С протягом ночі. Суміш випарюваил(метил)-карбамату. ли та додавали далі ДХМ та воду. Органічну фазу Виготовлення Ρ промивали розчином NaHCO3, сушили сульфатом Трет-бутилу (1S)-2-(4-ціанофенокси)-1-{[8натрію та далі випарювали. Утворений сирий про(метиламіно)-3-азадицикло-[3,2,1]окт-3дукт очищали хроматографією на силікагелі (елюил]метил}етилкарбамат ент - ДХМ), одержавши 2,2г (42%) потрібної спо(і) Трет-бутилу (2R)-3-(4-ціанофенокси)-2луки. гідроксипропілкарбамат (vii) N-бензил-N-метил-34-{[(2R)-3-аміно-2азадицикло[3,2,1]октан-8-амін гідроксипропіл]окси}бензонітрил (Виготовлення О Суміш 1-{8-[бензил(метил)аміно]-3(іі); 6,8г, 3,5ммоль) розчиняли у суміші тетрагідроазадицикло[3,2,1]окт-3-ил}-2,2,2-трифлуор-1фурану з водою (8:1). Розчин охолоджували на етанону (дивися етап (vi) вище; 2,1г, 6,4ммоль ) та. 51 75057 52 К2СО3 (3г, 21,7ммоль) у МеОН/воді (110мл 10:1) Поєднані органічні шари сушили над сульфаперемішували при кімнатній температурі протягом том натрію та випарювали, одержавши 6,0г (70%) ночі та далі випарювали. Додавали ДХМ і воду та потрібної сполуки. шари розділяли. Водний шар екстрагували ДХМ Виготовлення Τ (3х). Поєднані органічні шари сушили та випарю2-(4-піридиніл)етилу 1Н-імідазол-1вали, одержавши 1,2г (81%) потрібної сполуки. карбоксилат (viii) Трет-бутилу (1S)-2-{8Потрібну сполуку виготовляли з 100% виходу [бензил(метил)аміно]-3-азадицикло[3,2,1]окт-3-ил}згідно зі способом, описаним у Виготовленні S 1-[(4-ціанофенокси)метил]етилкарбамат вище, використовуючи 2-(4-піридиніл)-1-етанол Суміш трет-бутилу (2S)-2-[(4замість 2-(4-морфолініл)-1-етанолу. ціанофенокси)метил]-1-азиридинкарбоксилату Виготовлення U (дивися етап (ііі) вище; 1,26г, 4,6ммоль) та NN-[2-(2-метоксіетокси)етил]-1Н-імідазол-1бензил-N-метил-3-азадицикло[3,2,1]октан-8-аміну карбоксамід (дивися етап (vii) вище; 1,05г, 4,6ммоль) у ІРА Потрібну сполуку виготовляли з 40% виходу (15мл) перемішували при 60°С протягом ночі. Роззгідно зі способом, описаним у Виготовленні S чинник випарювали та залишок очищали хроматовище, використовуючи 2-(2графією на силікагелі, елююючи ДХМ: МеОН метоксіетокси)етиламін замість 2-(4-морфолініл)(20:1). Це дало 1,8г (78%) потрібної сполуки 1-етанолу. (іх) Трет-бутилу (1S)-2-(4-ціанофенокси)-1-{[8Виготовлення V (метиламіно)-3-азадицикло-[3,2,1]окт-32-(4-ацетил-1-піперазиніліетилу 1Н-імідазол-1ил]метил}етилкарбамат карбоксилат Суміш трет-бутилу (1S)-2-{8(і) 1-[4-(2-гідроксіетил)-1-піперазинілі-1-етанон [бензил(метил)аміно]-3-азадицикло-[3,2,1]окт-3Розчин 2-(1-піперазиніл)-1-етанолу (6,5г, ил}-1-[(4-ціанофенокси)метил]етилкарбамату (0,8г, 0,05моль) у ДХМ (5мл) обробляли, додаючи крап1,6ммоль), 1Μ НСІ (0,8мл) та МеОН (30мл) гідрулями, оцтовим ангідридом (5,1г, 0,05моль). Протявали над 5% Pd/C. Реакцію зупиняли коли витрагом додавання температура реакції зростала з 22 чалася кількість водню, розрахована для повного до 60°С. Реакційну суміш випарювали кілька разів протікання реакції. Суміш фільтрували крізь діокз толуолом, одержавши 5,6г (65%) потрібної спосид силіцію, а фільтрат випарювали. Утворений луки. сирий продукт очищали на силікагелі, елююючи (іі) 2-(4-ацетил-1-піперазиніл)етилу 1НДХМ: аміачним метанолом (9:1), одержавши 0,4г імідазол-1-карбоксилат (61%) потрібної сполуки. Розчин 1,1'-карбонілдіімідазолу (5г, 31ммоль) Виготовлення Q у ДХМ (200мл) обробляли розчином 1-[4-(22-(ацетилокси)-1,1-диметилетилу 1Н-імідазолгідроксіетил)-1-піперазиніл]-1-етанону (дивися 1-карбоксилат етап (і) вище; 5г, 29ммоль) у ДХМ (50мл). РеакційСуміш 2-гідрокси-2-метилпропілацетату (3,35г, ну суміш перемішували при кімнатній температурі 25,3ммоль) та 1,1'-карбонілдіімідазолу (4,11г, протягом ночі перед додаванням води. Шари роз25,3ммоль) у ДХМ перемішували протягом 8 годин діляли та органічний шар промивали водою, супри кімнатній температурі. Суміш далі переносили шили та концентрували під вакуумом, одержавши у закриту посудину та гріли до 100°С протягом 7,4г (96%) потрібної сполуки. ночі. Суміш концентрували під вакуумом, а потім Виготовлення W додавали етер та воду. Органічну фазу відділяли, 1-[4-(3-бромпропіл)-1-піперазиніл]-1-етанон сушили та концентрували під вакуумом. Утворений Суміш 1-(1-піперазиніл)-1-етанону (6,7г, залишок очищали хроматографією на силікагелі, 0,052моль), дибромпропану (330мл, надлишок) та елююючи сумішшю тетрагідрофуран:гептан (1:1), К2СО3 (10,2г, 0,079моль) перемішували при кімнаодержавши потрібну сполуку у 20% виходу. тній температурі протягом 4 годин. Суміш промиВиготовлення R вали 4 100мл води та органічну фазу (розбавлену 1-ціано-1-метилетилу 1Н-імідазол-1ДХМ) підкислювали водною гідробромідною кискарбоксилат лотою (7мл 62% НВr розчиняли у 150мл води). Суміш 1,1'-карбонілдіімідазол (5г, 31ммоль) та Органічний шар відділяли та промивали водою 2-гідрокси-2-метилпропаннітрил (2,6г, 31ммоль) у (2 50мл). Поєднані водні шари екстрагували етеДХМ перемішували при кімнатній температурі прором, нейтралізували (до рН 7) 13мл 10Μ NaOH та тягом ночі. Воду додавали та органічний шар віддалі екстрагували ДХМ. Поєднані органічні шари діляли, сушили сульфатом натрію та концентрусушили та концентрували під вакуумом, одержаввали під вакуумом. Утворений залишок очищали ши 4,1г (32%) потрібної сполуки. хроматографією на силікагелі, елююючи етилацеВиготовлення X татом, одержавши 2,7г (50%) потрібної сполуки. 3-(етилсульфоніл)пропіл 4Виготовлення S метилбензолсульфонат 2-(4-морфолініл)етилу 1Н-імідазол-1(і) 3-(етилсульфоніл)-1-пропанол карбоксилат Розчин 3-(етилтіо)-1-пропанолу (13г, 0,11моль) Суміш 1,1'-карбонілдіімідазолу (6,5г, 40ммоль) у оцтовій кислоті (40мл) обробляли Н2О2 (30% у та 2-(4-морфолініл)-1-етанолу (5,0г, 38,1ммоль) у воді, 12,2г, 0,11моль), додаючи її краплями. Суміш ДХМ (200мл) перемішували протягом 22 годин при перемішували протягом 2 годин при кімнатній темкімнатній температурі. Етер (400мл) додавали та пературі і концентрували під вакуумом. ЯМРсуміш промивали водою. Водний шар далі екстрааналізом виявлено, що утворений залишок склагували ДХМ. дався з 40% потрібного продукту та 60% відповід 53 75057 54 ного О-ацетату. Ацетат гідролізували розчиненням етанон; реакційної суміші у 200мл метанолу та додаванN-ізопропілхлорацетамід; ням 3г NaOH (розчиненого у невеликій кількості 1-бром-2-(2-метоксіетоксі)етан; води). Цю суміш перемішували протягом ночі при 4-флуорбензилбромід; кімнатній температурі, далі концентрували під ва2-бром-4-метоксіацетофенон; куумом. Утворений сирий продукт розчиняли у 4-(трифлуорметилтіо)фенілізоціанат; ДХМ та нерозчинний матеріал відфільтровували. 3-(метилсульфоніл)пропіл-1-хлорформіат; та ДХМ видаляли випарюванням, одержавши 13,4г 3-метилмасляна кислота. (88%) потрібної сполуки. Синтез сполук формули І (іі) 3-(етилсульфоніл)пропілу 4Приклад 1 метилбензолсульфонат Трет-бутилу 8-{[3-(4Суміш 3-(етилсульфоніл)-1-пропанолу (дивися ціаноаміно)пропіл](метил)аміно}-3-азадициклоетап (і) вище; 13,4г, 88ммоль) та п[3,2,1]октан-3-карбоксилат толуолсульфонілхлориду (16,8г, 88ммоль) у ДХМ Суміш 4-({3-[3-азадицикло[3,2,1]окт-8-ил (ме(150мл) обробляли, додаючи краплями, TEA тил)аміно]пропіл}-аміно)бензонітрилу (Виготов(13,4г, 132ммоль). Утворену суміш перемішували лення Н; 170мг, 0,569ммоль) та ди-третпри кімнатній температурі протягом 3 годин перед бутилдикарбонату (124мг, 0,569ммоль) у дихлорпромиванням водним розчином хлориду амонію. метані (3,0мл) перемішували протягом 2 годин при Органічний шар далі відділяли, сушили та концен25°С під азотом. Суміш концентрували під вакуутрували під вакуумом. Продукт кристалізували з мом та залишок хроматографували на силікагелі, етеру, що містить невелику кількість ДХМ, одерелююючи сумішшю етилацетат:дихлорметан (1:2), жавши 17,9г (66%) потрібної сполуки. одержавши 90мг (40%) потрібної сполуки як безНаступні інтермедіати були комерційно достубарвне масло. 1 пними або їх виготовляли за опублікованими споН ЯМР (300МГц, CDCI3): δ 7,40 (d, J = 8,2Гц, собами: 2Н), 6,50 (d, J=8,2Гц. 2Н), 5,45 (s, 1H), 3,68-3,60 (m, 3,4-диметоксифенетилу метансульфонат; 1H). 3,52-3,40 (m, 1H), 3,32-3,10 (m, 4H), 2,60 (s, гексилу ізоціанат; 2H), 2,30 (s, 3Н), 2,22-2,15 (m, 3Н), 1,92-1,60(m, етилу ізоціанат; 6H), 1,45(s, 9H). 13 бутаноїлхлорид; С ЯМР (75МГц, CDCI3): δ 156,4, 151,6. 133,6, 1-бутансульфонілхлорид; 120,6, 112,0, 108,1, 79,4, 67,8, 54,2, 45,0, 44,0, 42,7, 1-хлорпінаколін; 39,8, 35,6, 28,4, 26,0, 25,4. 4-ізоціанато-3,5-диметилізоксазол; ХІ-МС: (М+1) = 399m/z п-толуолсульфонілізоціанат; Приклад 2 4-метоксифенілізоціанат; Трет-бутилу 8-[[3-(4-ціанофенокси)-22-ізоціанатотетрагідро-2Н-піран; гідроксипропіл](метил)аміно]-3-аза-дициклоізопропілізоціанат; [3,2,1]октан-3-карбоксилат 3,4-дифлуорфеніл ізоціанат; Суміш 4-{3-[3-азадицикло[3,2,1]окт-8бутилізоціанат; ил(метил)аміно]-2-гідроксипропокси}-бензонітрилу 1-(ізоціанатометил)циклопропан; (Виготовлення Ε; 229мг, 0,726ммоль) та ди-трет2-(ацетиламіно)-4-метил-1,3-тіазол-5бутилдикарбонату (158мг, 0,726ммоль) у дихлорсульфонілхлорид; метані (3,0мл) перемішували протягом 2 годин при 4-нітробензолсульфонілхлорид; 25°С під азотом. Суміш концентрували під вакууN-ацетилсульфанілхлорид; мом та залишок хроматографували на силікагелі, ізопропілсульфонілхлорид; елююючи сумішшю етилацетат:дихлорметан (1:2), 3,4-диметоксибензолсульфонілхлорид; одержавши 70мг (25%) потрібної сполуки як без5-хлор-1,3-диметилпіразоліл-4барвне масло. 1 сульфонілхлорид; Н ЯМР (300МГц, CDCI3): δ 7,58 (d, J = 8,2Гц, 1,1-діоксо-2,5-дигідро-1-тіофен-32H), 6,97 (d, J = 8,2Гц, 2Н), 4,30-4,16 (m, 1H), 4,12сульфонілхлорид; 4,0 (m, 2H), 3,70-3,10 (m, 5H), 2,82-2,70 (m, 1H), етансульфонілхлорид; 2,52-2,10 (m, 4H), 2,30 (s, 3Н), 1,80-1,52 (m, 4H), етилхлорформіат; 1,45 (s, 9H). 13 2-бутин-1-хлорформіат; C ЯМР (75МГц, CDCI3): δ 162,4, 156,5, 134,0, 2-метоксіетилхлорформіат; 119,5, 115,6, 104,4, 79,5, 70,6, 68,0. 66,0, 57,7, 45,0, гідантоін-5-оцтова кислота; 43,8, 40,4, 36,8, 36,2, 28,5, 27,8. 2-{[2-(ацетиламіно)ацетил]аміно)оцтова кислоХІ-МС: (М+1) = 416m/z та; Приклад 3 метоксіоцтова кислота; N-{3-[2-(4-ціанофенокси)етил]-3DL-гліцеринова кислота; азадицикло[3,2,1]окт-8-ил}-N'-етил-Nпірол-2-карбонова кислота; метилсечовина 2-метилпропіонова кислота; Розчин етилізоціанату (0,8мл, 9,66ммоль) у бензофуразан-5-карбонова кислота; ДХМ (3мл) додавали краплями при 0°С до суміші 2-гідрокси-3-бутинова кислота; 4-{2-[8-(метиламіно)-3-азадицикло[3,2,1]окт-33-(трет-бутил)-1-метил-1Н-піразол-5ил]етокси}бензонітрилу (Виготовлення К; 2,5г, карбонова кислота; 8,76ммоль) та MeCN (50мл). Суміш перемішували (хлорметил)циклопропан; при кімнатній температурі протягом 3 годин. Дода2-бром-1-(2,3-дигідро-1,4-бензодіоксин-6-іл)-1вали К2СО3 (2г, 14,4ммоль) та суміш перемішува 55 75057 56 ли ще 2 години. Фільтрування та випарювання 74,6мг, 0,25ммоль) у диметилформаміді (3,0мл). дали 2,96г сирого продукту, який двічі очищали Розчин 3-метилмасляної кислоти (105,0мг, хроматографією на силікагелі, першого разу елю1,02ммоль) у ДХМ (1,0мл) додавали та суміш пеюючи з градієнтом ЕtOАс: МеОН: аміачний метаремішували протягом ночі при кімнатній температурі, а потім ще протягом 72 годин при 50°С. Полінол (10:1:0 10:0:1), а другого разу елююючи ДХМ: стиролізоціанат (150мг) та ДХМ (1,5мл) додавали МеОН: TEA (190:10:1). Це дало 2,3г (71,4%) потріта цю суміш перемішували протягом 1,5 годин. бної сполуки. 13 Додавали К2СО3 (75мг) та суміш перемішували С ЯМР (CD3OD): δ 15,84, 26,98, 36,35, 36,54, протягом ще 5 годин. Розчинники випарювали та 38,70, 55,02, 57,88, 61,99, 67,68, 104,67, 116,66, до утвореного залишку додавали ДХМ (3мл). Цю 120,11, 135,16, 163,68, 163,94. суміш переносили на іонообмінний твердо-фазний МС (електророзпилення - ЕР): (М+1) = екстракційний шар (СВА). Шар промивали ДХМ: 357,0m/z MeCN (4:1; 10мл). Продукт далі елюювали ДХМ: Приклад 4 МеОН: TEA (90:5:5; 7,5мл), одержавши 75мг N-{3-[3-(4-ціаноаміно)пропіл]-3(70,9%) потрібної сполуки. азадицикло[3,2,1]окт-8-ил}-N-метил-1МС (ЕР): 383,3m/z бутансульфонамід Приклад 7 Розчин 1-бутансульфонілхлориду (39,1мг, Наступні сполуки виготовляли з прийнятних ін0,25ммоль) у MeCN (2мл) додавали до розчину 4термедіатів (так як ті, що описані вище), згідно з ({3-[8-(метиламіно)-3-азадицикло-[3,2,1]окт-3описаними тут способами або аналогічно їм, ил]пропіл}аміно)бензонітрилу (Виготовлення G; та/або стандартними способами комбінаторної 74,6мг, 0,25ммоль) у СНСІ3, (0,5мл). Додавали хімії у твердій фазі або розчині (мас-спектри споК2СО3 та суміш перемішували при кімнатній темлук, коли їх реєстрували, надано у дужках: якщо не пературі протягом 24 годин. Суміш фільтрували визначено інше, величини стосуються іонів (М+1), крізь шар діоксиду силіцію (500мг), шар далі елювиміри проведено з електророзпиленням): ювали MeCN: СНСІ3 (80:20; 3 2,5мл), а потім 4-{3-[(3-бутирил-3-азадицикло[3,2,1]окт-8СНСІ3: МеОН (95:5), одержавши потрібну сполуку ил)(метил)аміно]-2-гідроксипропокси}бензонітрил з 35% виходу. МС (ЕР): (М+1) = 419,2m/z (m/z = 386,2); Приклад 5 4-{3-[[3-(бутилсульфоніл)-3Етилу 3-[3-(4-ціаноаміно)пропіл]-3азадицикло[3,2,1]окт-8-ил](метил)аміно]-2азадицикло[3,2,1]окт-8-ил(метил)-карбамат гідроксипропокси)бензонітрил (m/z = 436,2); Суміш 4-({3-[8-(метиламіно)-34-{3-[[3-(3,3-диметил-2-оксобутил)-3азадицикло[3,2,1]окт-3-ил]пропіл}-аміно)азадицикло[3,2,1]окт-8-ил](метил)-аміно]-2бензонітрилу (Виготовлення G; 74,6мг, 0,25ммоль) пдроксипропокси}бензонітрил (m/z = 414,3); та етилхлорформіату (29,8мг, 0,27ммоль) у диме4-{3-[[3-(3,4-диметоксифенетил)-3тилформаміді (2,5мл) перемішували при кімнатній азадицикло[3,2,1]окт-8-ил](метил)-аміно]-2температурі протягом 24 годин. Маспдроксипропокси}бензонітрил (m/z = 480,3); спектроскопічним аналізом виявлено, що аміновий 8-[[3-(4-ціаноаніліно)пропіл](метил)аміно]-Nвихідний матеріал не було загалом витрачено, а гексил-3-азадицикло[3,2,1]-октан-3-карбоксамід тому додавали ще етилхлорформіат (50мкл). Су(m/z = 426,3); міш перемішували протягом ночі, після чого кон8-[[3-(4-ціаноаніліно)пропіл](метил)аміно]-Nцентрували під вакуумом. Утворений залишок розетил-3-азадицикло[3,2,1]-октан-3-карбоксамід (m/z чиняли у суміші ДХМ (0,5мл) та MeCN (2мл), = 370,3); додавали К2СО3 (100мг, 0,7ммоль) та суміш пере4-({3-[(3-бутирил-3-азадицикло[3,2,1]окт-8мішували протягом 4 годин. Фільтрування суміші ил)(метил)аміно]пропіл}-аміно)бензонітрил (m/z = та випарювання фільтрату дали залишок, що роз369,3); чиняли у СНСІ3 (1мл). Розчин фільтрували крізь 4-({3-[[3-(бутилсульфоніл)-3іонообмінний твердо-фазний екстракційний шар азадицикло[3,2,1]окт-8-ил](метил)аміно](СВА, 2г). Вихідну колбу промивали додатковим пропіл)аміно)бензонітрил (m/z = 419,2); СНСІ3 (0,75мл), який далі додавали до екстракцій4-({3-[[3-(3,3-диметил-2-оксобутил)-3ного шару та елюювали як фракцію 1. Шар далі азадицикло[3,2,1]окт-8-ил](метил)елюювали СНСІ3: МеОН: TEA (8:1:1; 4 2мл), одеаміно]пропіл}аміно)бензонітрил (m/z = 397,3); ржавши наступні фракції, в яких не було виявлено 4-({3-[[3-(3,4-диметоксифенетил)-3вмісту будь-якого продукту. Фракцію 1 далі додаазадицикло[3,2,1]окт-8-ил](метил)вали до шару діоксиду силіцію, як елюювали аміно]пропіл}аміно)бензонітрил (m/z = 463,3); CHCI3:MeCN(4:1; 3 2,5мл). 8-[[4-(4-ціанофеніл)-4-(3,4Випарювання зібраних фракцій дало 79,6мг диметоксифенокси)бутил](метил)аміно]-N-гексил(85,9%) потрібної сполуки. 3-азадицикло[3,2,1]октан-3-карбоксамід (m/z = МС(ЕР): (М+1) = 371,5m/z 577,4); Приклад 6 8-[[4-(4-ціанофеніл)-4-(3,4N-{3-[3-(4-ціаноаніліно)пропіл]-3диметоксифенокси)бутил](метил)аміно]-N-етил-3азадицикло[3,2,1]окт-8-ил)-N,3-диметилбутанамід азадицикло[3,2,1]октан-3-карбоксамід (m/z = 1,3-дициклогексилкарбодіімід на N521,3); метилполістиролі (0,67г 2,39ммоль/г, 1,74ммоль) 4-[4-[(3-бутирил-3-азадицикло[3,2,1]окт-8додавали до розчину 4-({3-[8-(метиламіно)-3ил)(метил)аміно]-1-(3,4азадицикло[3,2,1]окт-3диметоксифенокси)бутил]бензонітрил (m/z = ил]пропіл}аміно)бензонітрилу (Виготовлення G; 57 75057 58 520,3); метилфеніл)сульфоніл]-аміно}карбоніл)аміно]-34-[4-[[3-(бутилсульфоніл)-3азадицикло[3,2,1]октан) (ЕР (М-l): m/z = 494); азадицикло[3,2,1]окт-8-ил](метил)аміно]-1-(3,4N-{3-[3-(4-ціаноаніліно)пропіл]-3диметоксифенокси)бутил]бензонітрил (m/z = азадицикло[3,2,1]окт-8-ил}-N'-(циклопропілметил]570,3); N-метилсечовина (m/z = 397); 4-{1-(3,4-диметоксифенокси)-4-[[3-(3,3N-{3-[3-(4-ціаноаніліно)пропіл]-3диметил-2-оксобутил)-3-аза-дицикло[3,2,1]окт-8азадицикло[3,2,1]окт-8-ил)-N'-ізопропіл-Nил](метил)аміно]бутил}бензонітрил (m/z = 548,3); метилсечовина (m/z = 384); 4-[4-[[3-(3,4-диметоксифенетил)-3N'-бутил-N-{3-[3-(4-ціаноаніліно)пропіл]-3азадицикло[3,2,1]окт-8-ил](метил)-аміно]-1-(3,4азадицикло[3,2,1]окт-8-ил}-N-метилсечовина (ЕР диметоксифенокси)бутил]бензонітрил (m/z = (М-І): m/z = 396); 614,4); 4-(3-{8-[(3,4-диметоксифенетил)(метил)аміно]N-{3-[3-(4-ціанофенокси)-2-гідроксипропіл]-33-азадицикло[3,2,1]окт-3-ил}-2азадицикло[3,2,1]окт-8-ил}-N'-гексил-Nгідроксипропоксі/і)бензонітрил (m/z = 480,3); метилсечовина (m/z = 443,3); 3-[3-(4-ціанофенокси)-2-гідроксипропіл]-8N-{3-[3-(4-ціанофенокси)-2-гідроксипропіл]-3[метил({[(4-метилфеніл)азадицикло[3,2,1]окт-8-ил}-N'-етил-Nсульфоніл]амідо}карбоніл)аміно]-3метилсечовина (m/z = 387,2); азадицикло[3,2,1]октан (ЕР (М-І); m/z = 511); N-{3-[3-(4-ціанофенокси)-2-гідроксипропіл]-3N-{3-[3-(4-ціанофенокси)-2-гідроксипропіл]-3азадицикло[3,2,1]окт-8-ил}-N-метилбутанамід (m/z азадицикло[3,2,1]окт-8-ил}-N'-(3,4-дифлуорфеніл)= 386,2); N-метилсечовина (m/z = 471); 4-(3-{8-[(3,3-диметил-2N-{3-[3-(4-ціаноаміно)пропіл]-3оксобутил)(метил)аміно]-3-азадицикло[3,2,1]окт-3азадицикло[3,2,1]окт-8-ил}-N'-(4-метоксифеніл)-Nил}-2-гідроксипропокси)бензонітрил (m/z = 414,3); метилсечовина (m/z = 448); N-{3-[3-(4-ціаноаніліно)пропіл]-3N-{3-[3-(4-ціаноаніліно)пропіл]-3азадицикло[3,2,1]окт-8-ил}-N'-гексил-Nазадицикло[3,2,1]окт-8-ил}-N'-(3,4-дифлуорфеніл)метилсечовина (m/z = 426,3); N-метилсечовина (m/z = 454); N-{3-[3-(4-ціаноаніліно)пропіл]-3N-{3-[2-(4-ціанофенокси)етил]-3азадицикло[3,2,1]окт-8-ил}-N'-етил-Nазадицикло[3,2,1]окт-8-ил}-N'-(3,5-диметил-4метилсечовина (m/z = 370,3); ізоксазоліл)-N-метилсечовина (m/z = 424); N-{3-[3-(4-ціаноаніліно)пропіл]-3N-{3-[2-(4-ціанофенокси)етил]-3азадицикло[3,2,1]окт-8-ил}-N-метил-бутанамід (m/z азадицикло[3,2,1]окт-8-ил)-N'-(4-метоксифеніл)-N= 369,3); метилсечовина (m/z = 435); 4-[(3-{8-[(3,3-диметил-2N-{3-[2-(4-ціанофенокси)етил]-3оксобутил)(метил)аміно]-3-азадицикло[3,2,1]окт-3азадицикло[3,2,1]окт-8-ил}-N'-метил-N-тетрагідроил}пропіл)аміно]бензонітрил (m/z = 397,3); 2Н-піран-2-ілсечовина (m/z = 413); 4-[(3-{8-[(3,4-диметоксифенетил)(метил)аміно]N-{3-[2-(4-ціанофенокси)етил]-33-азадицикло[3,2,1]окт-3азадицикло[3,2,1]окт-8-ил}-N'-циклопропілметил)ил}пропіл)аміно]бензонітрил (m/z = 463,3); N-метилсечовина (m/z = 383); N-{3-[4-(4-ціанофеніл)-4-(3,4N-{3-[2-(4-ціанофенокси)етил]-3диметоксифенокси)бутил]-3-азадицикло-[3,2,1]октазадицикло[3,2,1]окт-8-ил}-N'-ізопропіл-N8-ил]-N'-гексил-N-метилсечовина (m/z = 577,4); метилсечовина (m/z = 371); N-{3-[4-(4-ціанофеніл)-4-(3,4N-{3-[2-(4-ціанофенокси)етил]-3диметоксифенокси)бутил]-3-азадицикло-[3,2,1]октазадицикло[3,2,1]окт-8-ил}-N'-(3,4-дифлуорфеніл)8-ил}-N'-етил-N-метилсечовина (m/z = 521,3); N-метилсечовина (m/z = 441); N-{3-[4-(4-ціанофеніл)-4-(3,4N-(3-{3-[(4-ціанофеніл)сульфоніл]пропіл}-3диметоксифенокси)бутил]-3-азадицикло-[3,2,1]октазадицикло[3,2,1]окт-8-ил)-N'-(3,5-диметил-48-ил}-N-метилбутанамід (m/z = 520,3); ізоксазоліл)-N-метилсечовина(m/z = 486); N-{3-[4-(4-ціанофеніл)-4-(3,43-{3-[(4-ціанофеніл)сульфоніл]пропіл}-8диметоксифенокси)бутил]-3-азадицикло-(3,2,1]окт[метил({[(4-метилфеніл)8-ил}-N-метил-1-бутансульфонамід (m/z = 570,3); сульфоніл]аміно}карбоніл)аміно]-34-(1-(3,4-диметоксифенокси)-4-{8-[(3,3азадицикло[3,2,1]октан (ЕР (М-І): m/z = 543); диметил-2-оксобутил)(метил)-аміно]-3N-(3-{3-[(4-ціанофеніл)сульфоніл]пропіл}-3азадицикло[3,2,1]окт-3-ил}бутил)бензонітрил (m/z азадицикло[3,2,1]окт-8-ил)-N'-(4-метоксифеніл)-N= 548,3); метилсечовина (m/z = 497); 4-[4-{8-[(3,4-диметоксифенетил)(метил)аміно]N-(3-{3-[(4-ціанофеніл)сульфоніл]пропіл}-33-азадицикло(3,2,1]окт-3-ил}-1-(3,4азадицикло[3,2,1]окт-8-ил)-N'-(циклопропілметил)диметоксифенокси)бутил]бензонітрил (m/z = N-метилсечовина (m/z = 44S); 614,4); N-(3-{3-[(4-ціанофеніл)сульфоніл]пропіл}-3N-{3-[3-(4-ціанофенокси)-2-пдроксипропіл]-3азадицикло[3,2,1]окт-8-ил)-N'-(3,4-дифлуорфеніл)азадицикло[3,2,1]окт-8-ил}-N-метил-N'-тетрагідроN-метилсечовина (m/z = 503); 2Н-піран-2-ілсечовина (m/z = 443); N-{3-[3-(4-ціанофенокси)-2-гідроксипропіл]-3N-{3-[3-(4-ціанофенокси)-2-гідроксипропіл]-3азадицикло(3,2,1]окт-8-ил}-N-метил-1азадицикло[3,2,1]окт-8-ил}-N'-(циклопропілметил)бутансульфонамід (m/z = 436,2); N-метилсечовина (m/z = 413); N-{3-[3-(4-ціанофенокси)-2-гідроксипропіл]-33-[3-(4-ціаноаміно)пропіл]-8-[метил({[(4азадицикло[3,2,1]окт-8-ил}-3,4-диметокси-N 59 75057 60 метилбензолсульфонамід (m/z = 516,2); 2-гідрокси-1,1-диметилетилу 3-[3-(45-хлор-N-{3-[3-(4-ціанофенокси)-2ціаноаміно)пропіл]-3-азадицикло-[3,2,1]окт-8гідроксипропіл]-3-азадицикло[3,2,1]-окт-8-ил}ил(метил)карбамат; N,1,3-триметил-1Н-піразол-4-сульфонамід (m/z = 1-ціано-1-метилетилу 3-[3-(4508,2); ціаноаміно)пропіл]-3-азадицикло[3,2,1]-окт-8N-(5-{[{3-[3-(4-ціаноаміно)пропіл]-3ил(метил)карбамат (m/z = 410,5); азадицикло[3,2,1]окт-8-ил}(метил)2-бутинілу 3-[3-(4-ціаноаміно)пропіл]-3аміно]сульфоніл}-4-метил-1,3-тіазол-2-іл)ацетамід азадицикло[3,2,1]окт-8-ил-(метил)карбамат (m/z = (m/z = 517,2); 395,5); N-{3-[3-(4-ціаноаміно)пропіл]-32-метоксіетилу 3-[3-(4-ціаноаміно)пропіл]-3азадицикло[3,2,1]окт-8-ил}-N-метил-4азадицикло[3,2,1]окт-8-ил-(метил)карбамат (m/z = нітробензолсульфонамід (m/z = 484,2); 401,6); N-(4-{[{3-[3-(4-ціаноаміно)пропіл]-33-(метилсульфоніл)пропілу 3-[3-(4азадицикло[3,2,1]окт-8-ил}(метил)ціаноаніліно)пропіл]-3-азадицикло[3,2,1]окт-8аміно]сульфоніл}феніл)ацетамід (m/z = 496,2); ил(метил)карбамат(m/z = 463,5); N-{3-[3-(4-ціаноаніліно)пропіл]-32-(4-піридиніл)етилу 3-[3-(4-ціаноаміно)пропіл]азадицикло[3,2,1]окт-8-ил}-3,4-диметокси-N3-азадицикло[3,2,1]окт-8-ил(метил)карбамат (m/z = метилбензолсульфонамід (m/z = 499,2); 448,6); 5-хлор-N-{3-[3-(4-ціаноаніліно)пропіл]-3N-{3-[3-(4-ціаноаніліно)пропіл]-3азадицикло[3,2,1]окт-8-ил}-N,1,3-триметил-1Назадицикло[3,2,1]окт-8-ил}-N'-[2-(2піразол-4-сульфонамід (m/z = 491,2); метоксіетоксі)етил]-N-метилсечовина (m/z = N-{3-[3-(4-ціаноаніліно)пропіл]-3444,6); азадицикло[3,2,1]окт-8-ил}-N-метил-1етилу 3-{3-[(4-ціанофеніл)сульфоніл]пропіл}-3етансульфонамід (m/z = 391,2); азадицикло[3,2,1]окт-8-ил(метил)карбамат (m/z = N-(3-{3-[(4-цiaнoфeнiл)cyльфoнiл]пpoпiл}-3420,5); aзaдициклo[3,2,1]oкт-8-ил)-N-мeтил-42-гідрокси-1,1-диметилетилу 3-{3-[(4нітробензолсульфонамід (m/z = 533,1); ціанофеніл)сульфоніл]пропіл}-3N-(3-{3-[(4-ціанофеніл)сульфоніл]пропіл}-3азадицикло[3,2,1]окт-8-ил(метил)карбамат; азадицикло[3,2,1]окт-8-ил)-3,4-диметокси-N2-(4-морфолініл)етилу 3-{3-[(4метилбензолсульфонамід (m/z = 548,2); ціанофеніл)сульфоніл]пропіл}-3-азаN-(5-{[{3-[2-(4-ціанофенокси)етил]-3дицикло[3,2,1]окт-8-ил(метил)карбамат (m/z = азадицикло[3,2,1]окт-8-ил}505,5); (метил)аміно]сульфоніл}-4-метил-1,3-тіазол-2N-(3-{3-[(4-ціанофеніл)сульфоніл]пропіл)-3іл)ацетамід (m/z = 504,2); азадицикло[3,2,1]окт-8-ил)-N'-[2-(2N-{3-[2-(4-ціанофенокси)етил]-3метоксіетоксі)етил]-N-метилсечовина (m/z = азадицикло[3,2,1]окт-8-ил}-N-метил-4493,5); нітробензолсульфонамід (m/z = 471,2); етилу 3-[2-(4-ціанофенокси)етил]-3N-(4-{[{3-[2-(4-ціанофенокси)етил]-3азадицикло[3,2,1]окт-8-ил(метил)-карбамат (m/z = азадицикло[3,2,1]окт-8-ил}358,5); (метил)аміно]сульфоніл}феніл)ацетамід (m/z = 2-гідрокси-1,1-диметилетилу 3-[2-(4483,2); ціанофенокси)етил]-3-азадицикло-(3,2,1]окт-8N-{3-[2-(4-ц1анофенокси)етил]-3ил(метил)карбамат; азадицикло[3,2,1]окт-8-ил)-N-метил-21-ціано-1-метилетилу 3-[2-(4пропансульфонамід; ціанофенокси)етил]-3-азадицикло[3,2,1]-окт-8N-{3-[2-(4-ціанофенокси)етил]-3ил(метил)карбамат (m/z = 397,5); азадицикло[3,2,1]окт-8-ил}-3,4-диметокси-N2-бутинілу 3-[2-(4-ціанофенокси)етил]-3метилбензолсульфонамід (m/z = 486,2); азадицикло[3,2,1]окт-8-ил-(метил)карбамат (m/z = 5-хлор-N-{3-[2-(4-ціанофенокси)етил]-3382,5); азадицикло[3,2,1]окт-8-ил}-N,1,3-триметил-1Н2-метоксіетилу 3-[2-(4-ціанофенокси)етил]-3піразол-4-сульфонамід (m/z = 478,2), азадицикло[3,2,1]окт-8-ил-(метил)карбамат (m/z = N-{3-[2-(4-ціанофенокси)етил]-3388,5); азадицикло[3,2,1]окт-8-ил}-N,1-диметил-1Н3-(метилсульфоніл)пропілу 3-[2-(4імідазол-4-сульфонамід (m/z = 430,2); ціанофенокси)етил]-3-азадицикло-[3,2,1]окт-82-бутинілу 3-[3-(4-ціанофенокси)-2ил(метил)карбамат (m/z = 450,5); гідроксипропіл]-3-азадицикло[3,2,1]-окт-82-(4-піридиніл)етилу 3-[2-(4ил(метил)карбамат (m/z = 412,5); ціанофенокси)етил]-3-азадицикло[3,2,1]окт-82-метоксіетилу 3-[3-(4-ціанофенокси)-2ил(метил)карбамат (m/z = 435,5); гідроксипропіл]-3-азадицикло-[3,2,1]окт-8N-{3-[3-(4-ціанофенокси)-2-гідроксипропіл]-3ил(метил)карбамат (m/z = 418,5); азадицикло[3,2,1]окт-8-ил}-2-метокси-N3-(метилсульфоніл)пропілу 3-[3-(4метилацетамід (m/z = 388,2); ціанофенокси)-2-гідроксипропіл]-3-азаN-{3-[3-(4-ціанофенокси)-2-гідроксипропіл]-3дицикло[3,2,1]окт-8-ил(метил)карбамат (m/z = азадицикло[3,2,1]окт-8-ил}-N,2-диметилпропанамід 480,5); (m/z = 386,3); 2-(4-ацетил-1-піперазиніл)етилу 3-[3-(4N-{3-[3-(4-ціанофенокси)-2-гідроксипропіл]-3ціанофенокси)-2-гідроксипропіл]-3азадицикло[3,2,1]окт-8-ил}-N,3-диметилбутанамід азадицикло[3,2,1]окт-8-ил (метил)карбамат; (m/z = 400,3);
ДивитисяДодаткова інформація
Назва патенту англійськоюAzabicyclooctane derivatives useful in the treatment of cardiac arrhythmias, a method for obtaining thereof (variants), pharmaceutical composition based thereon and intermediary compound
Назва патенту російськоюПроизводные азабициклооктана, полезные при лечении сердечных аритмий, способ их получения (варианты), фармацевтическая композиция на их основании и промежуточное соединение
Автори російськоюSvensson, Peder
МПК / Мітки
МПК: C07D 221/24, A61K 31/496, A61K 31/444, C07D 417/12, A61K 31/5377, A61P 9/06, A61P 9/00, C07D 405/12, C07D 401/12, C07D 221/22, A61K 31/439, C07D 413/12
Мітки: фармацевтична, основі, аритмій, серцевих, лікуванні, сполука, корисні, похідні, азабіциклооктану, композиція, варіанти, одержання, проміжна, спосіб
Код посилання
<a href="https://ua.patents.su/33-75057-pokhidni-azabiciklooktanu-korisni-pri-likuvanni-sercevikh-aritmijj-sposib-kh-oderzhannya-varianti-farmacevtichna-kompoziciya-na-kh-osnovi-ta-promizhna-spoluka.html" target="_blank" rel="follow" title="База патентів України">Похідні азабіциклооктану, корисні при лікуванні серцевих аритмій, спосіб їх одержання (варіанти), фармацевтична композиція на їх основі та проміжна сполука</a>
Попередній патент: Імплантат протинаркотичної та протиалкогольної дії та спосіб його одержання
Наступний патент: Спосіб обробки даних у приймальному вузлі системи зв’язку з багатьма входами/виходами, сама система такого зв’язку та приймальний вузол такої системи
Випадковий патент: Спосіб визначення магнітної сприйнятливості мікрооб'єкта












