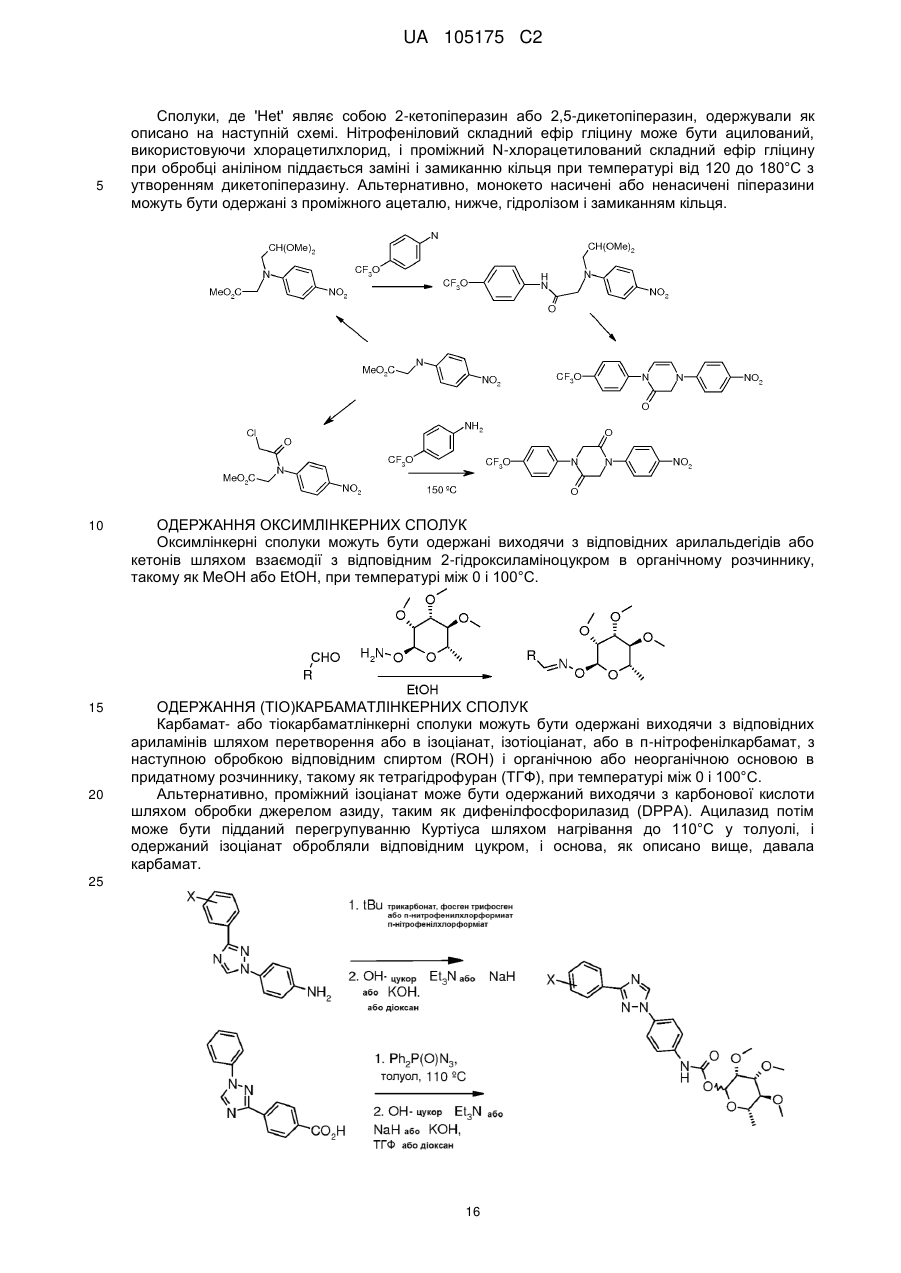
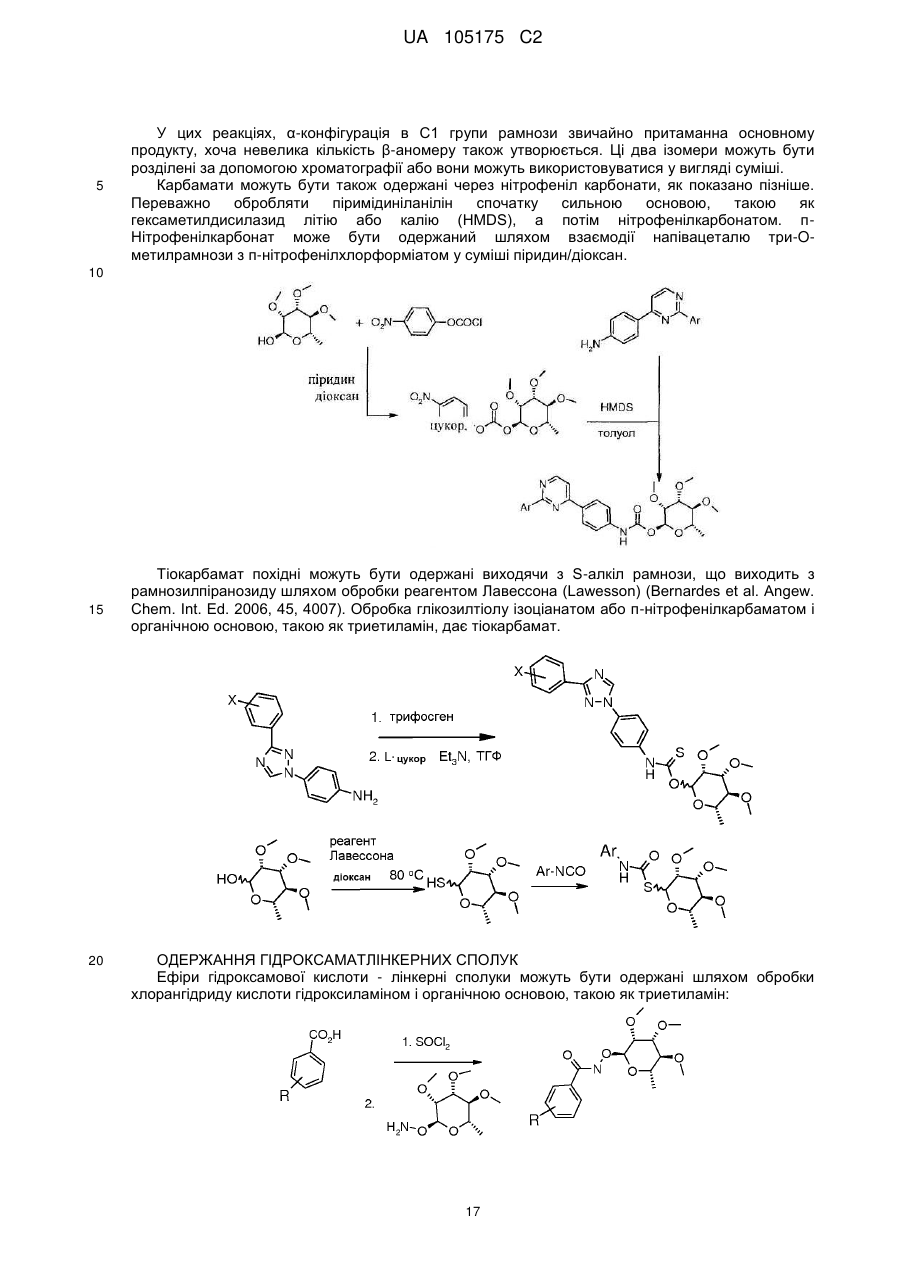
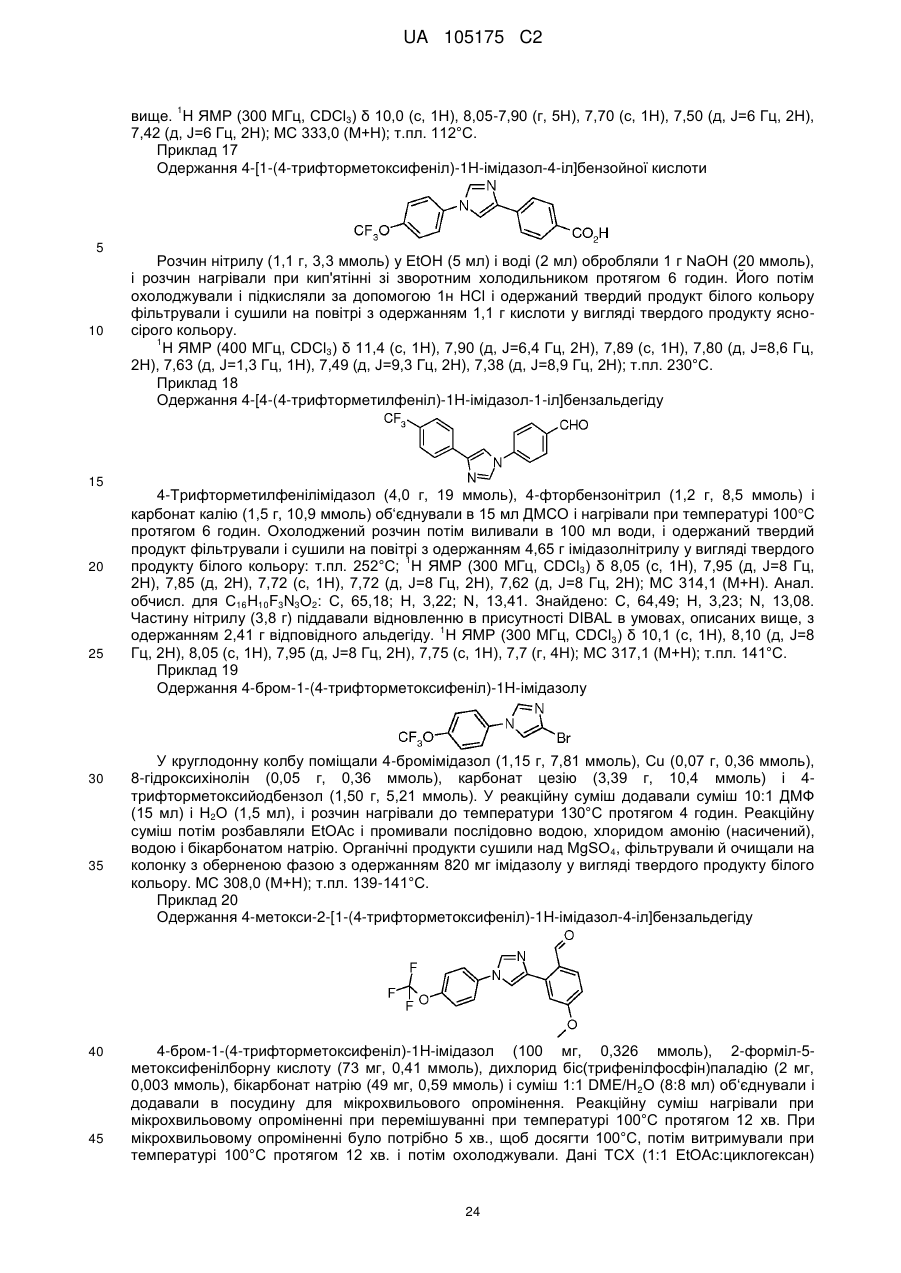
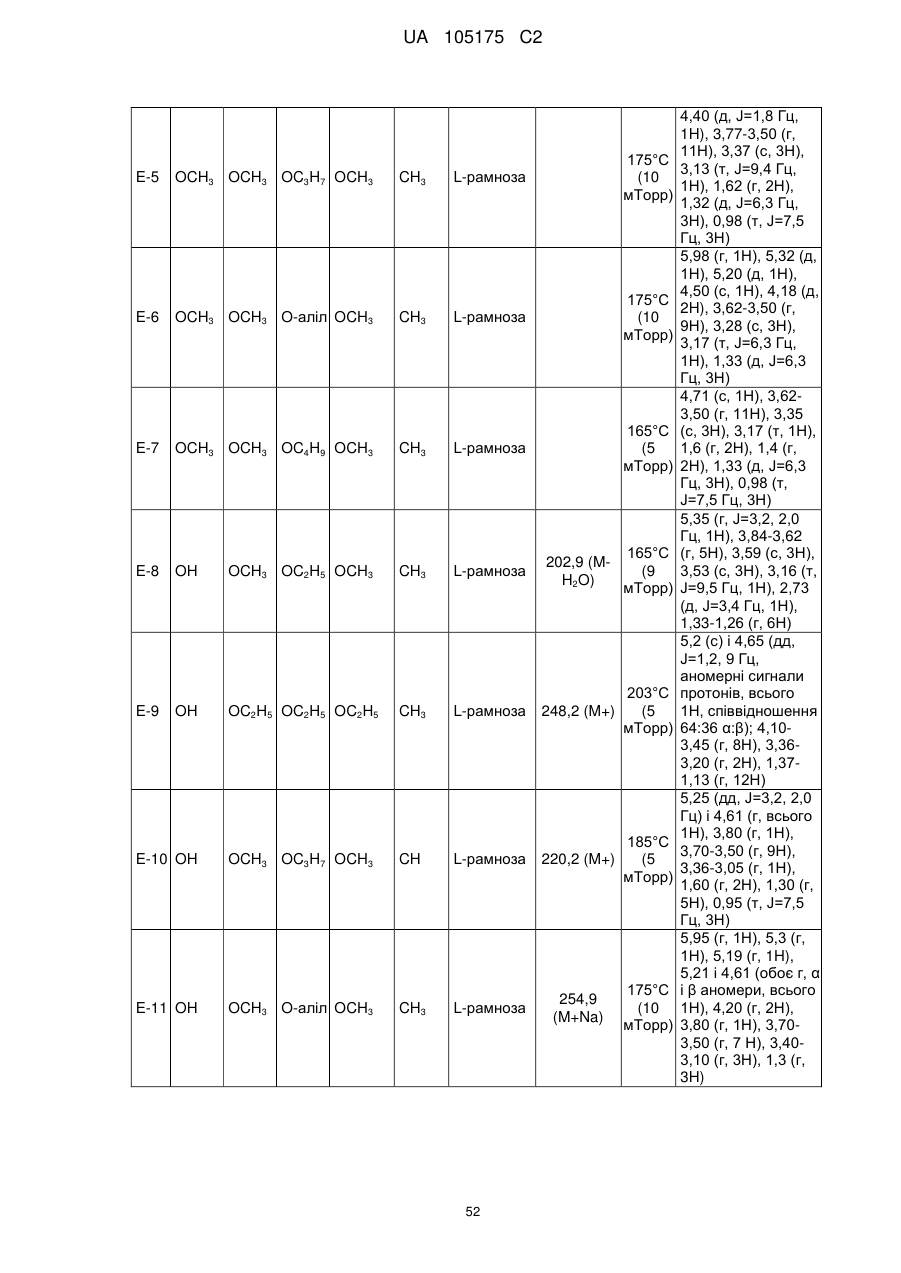
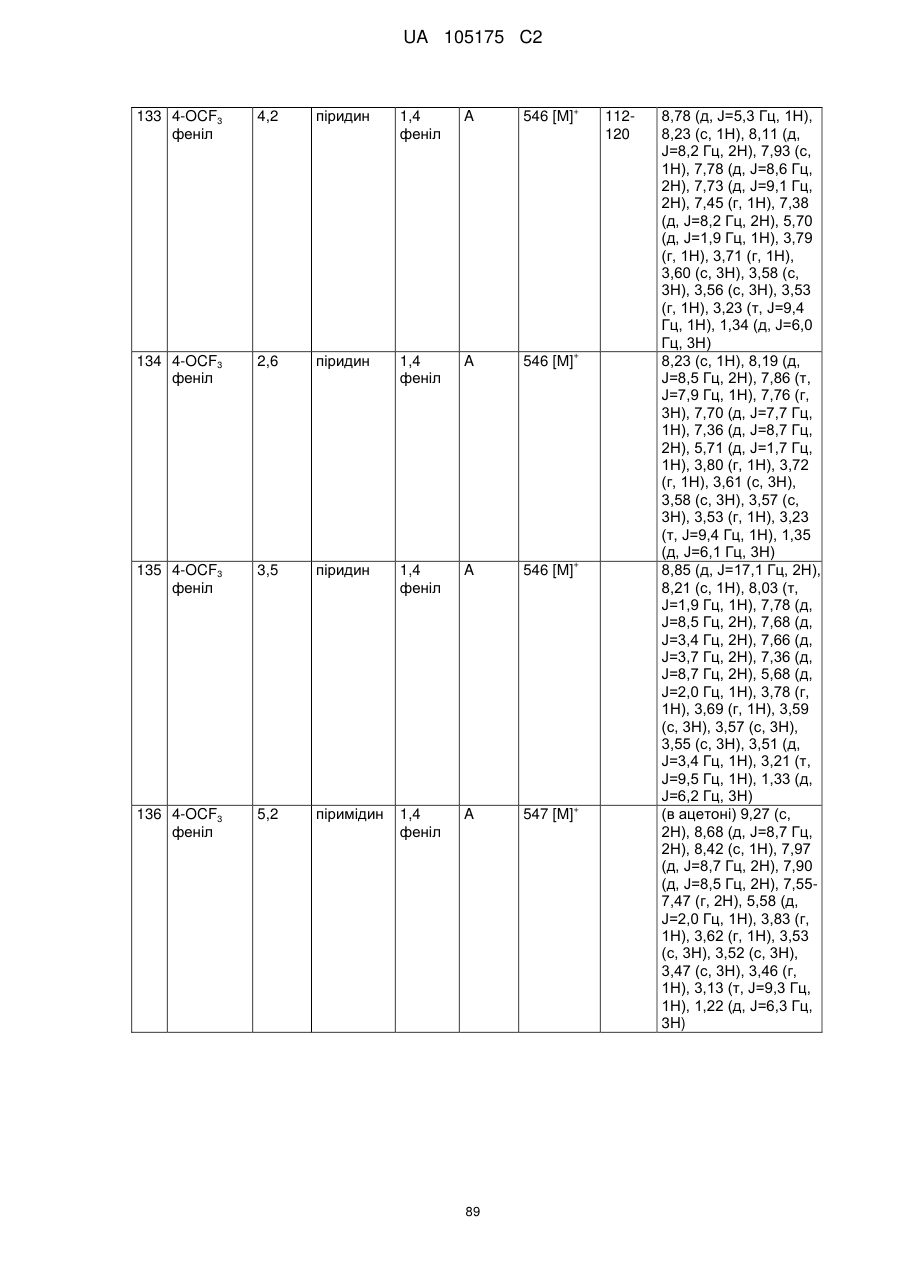
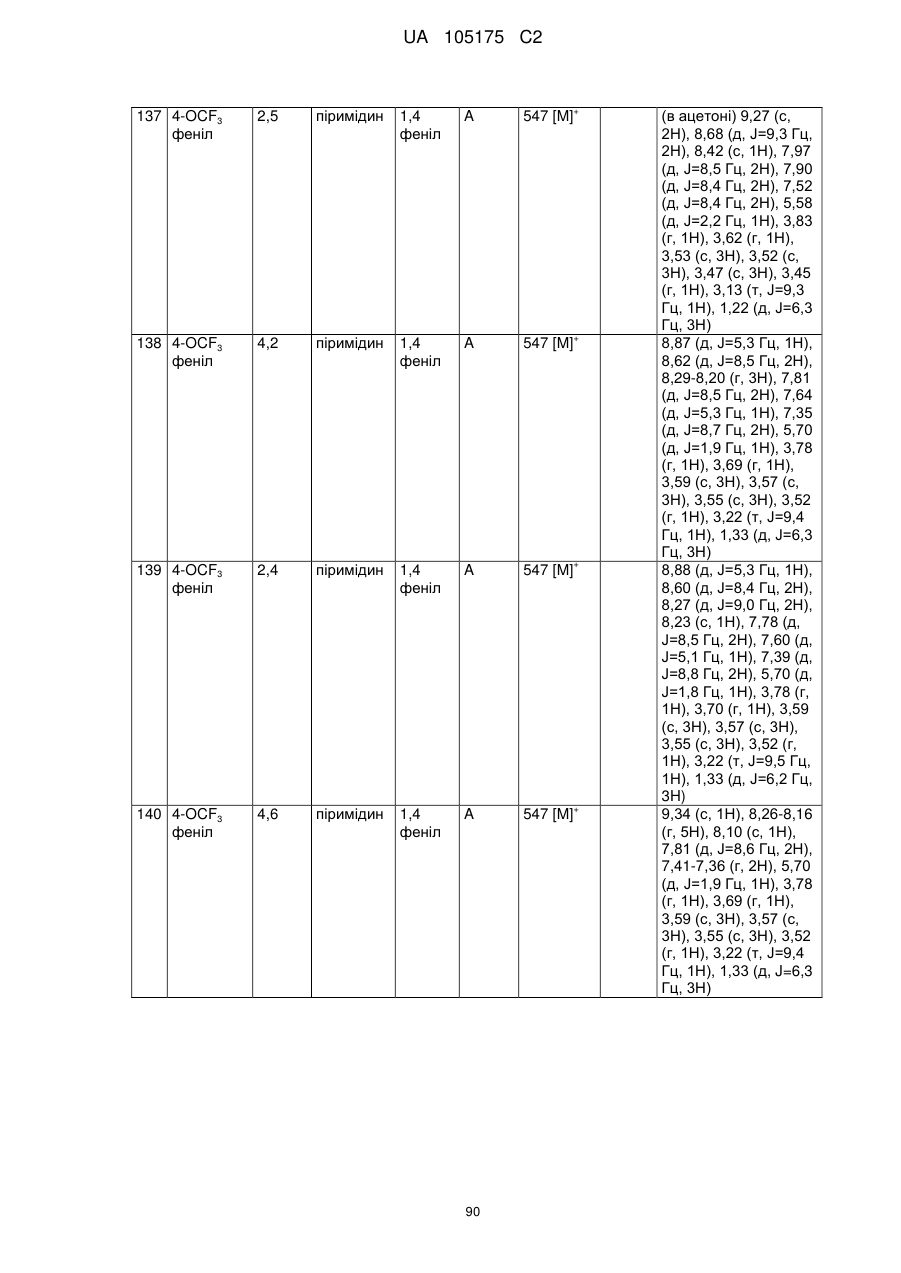
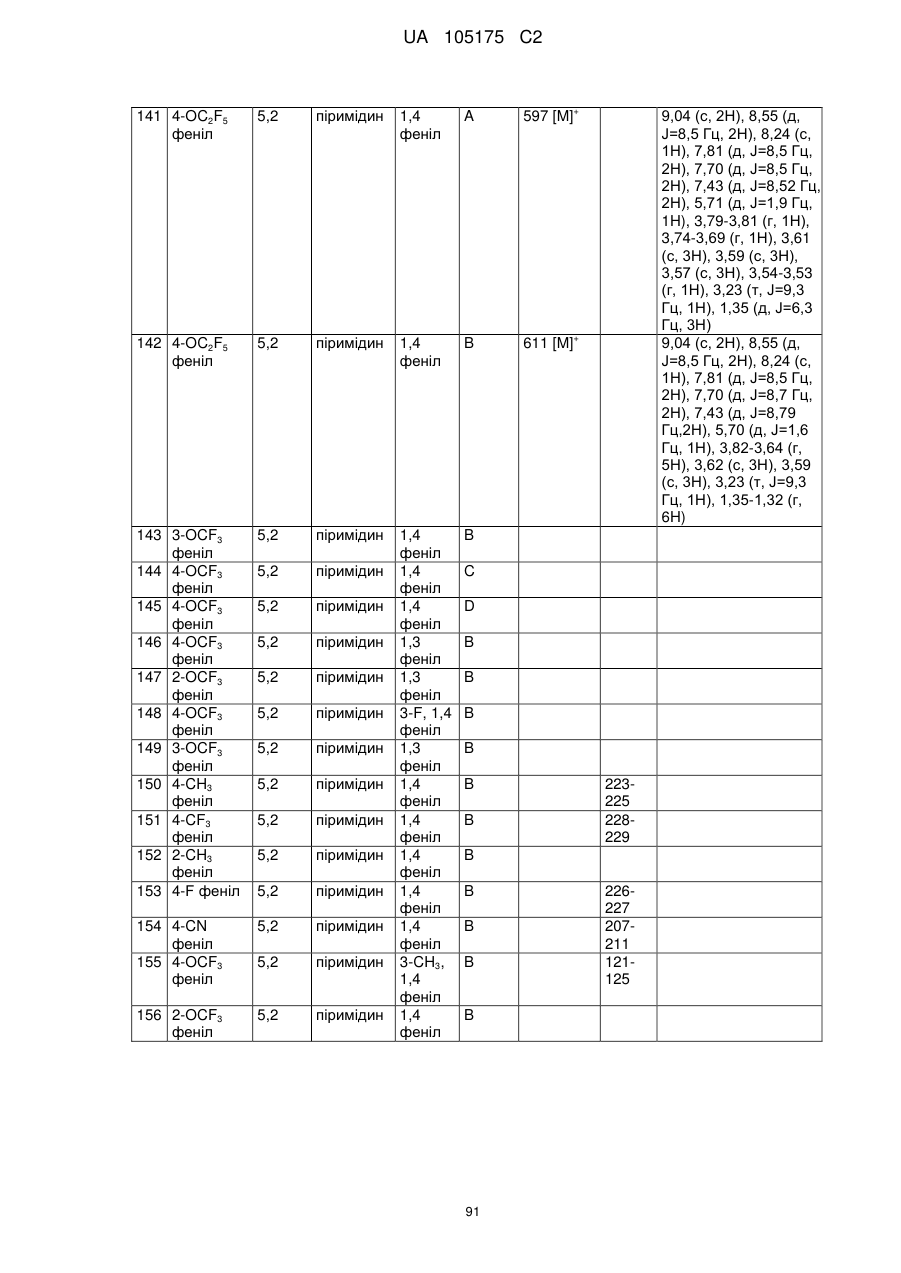
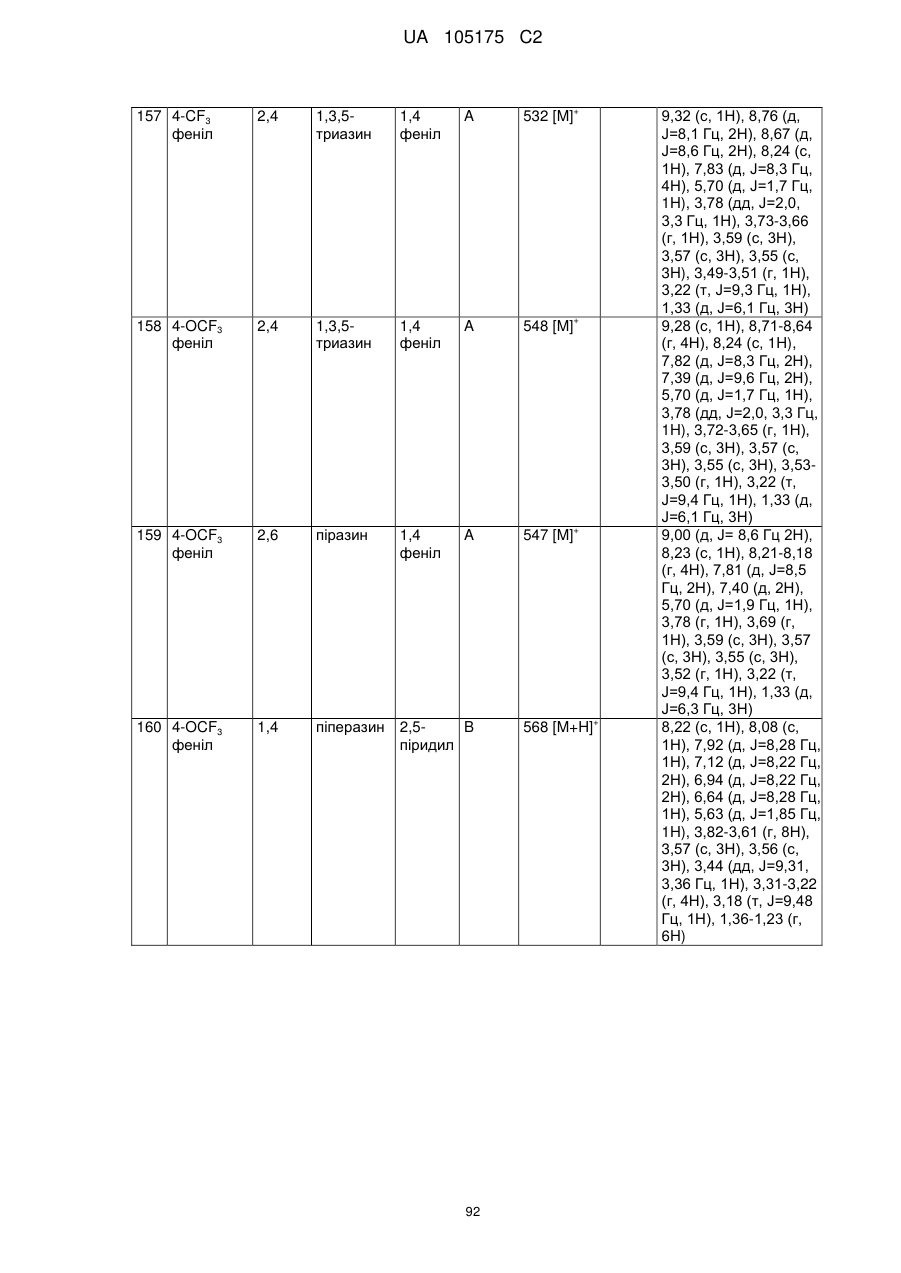
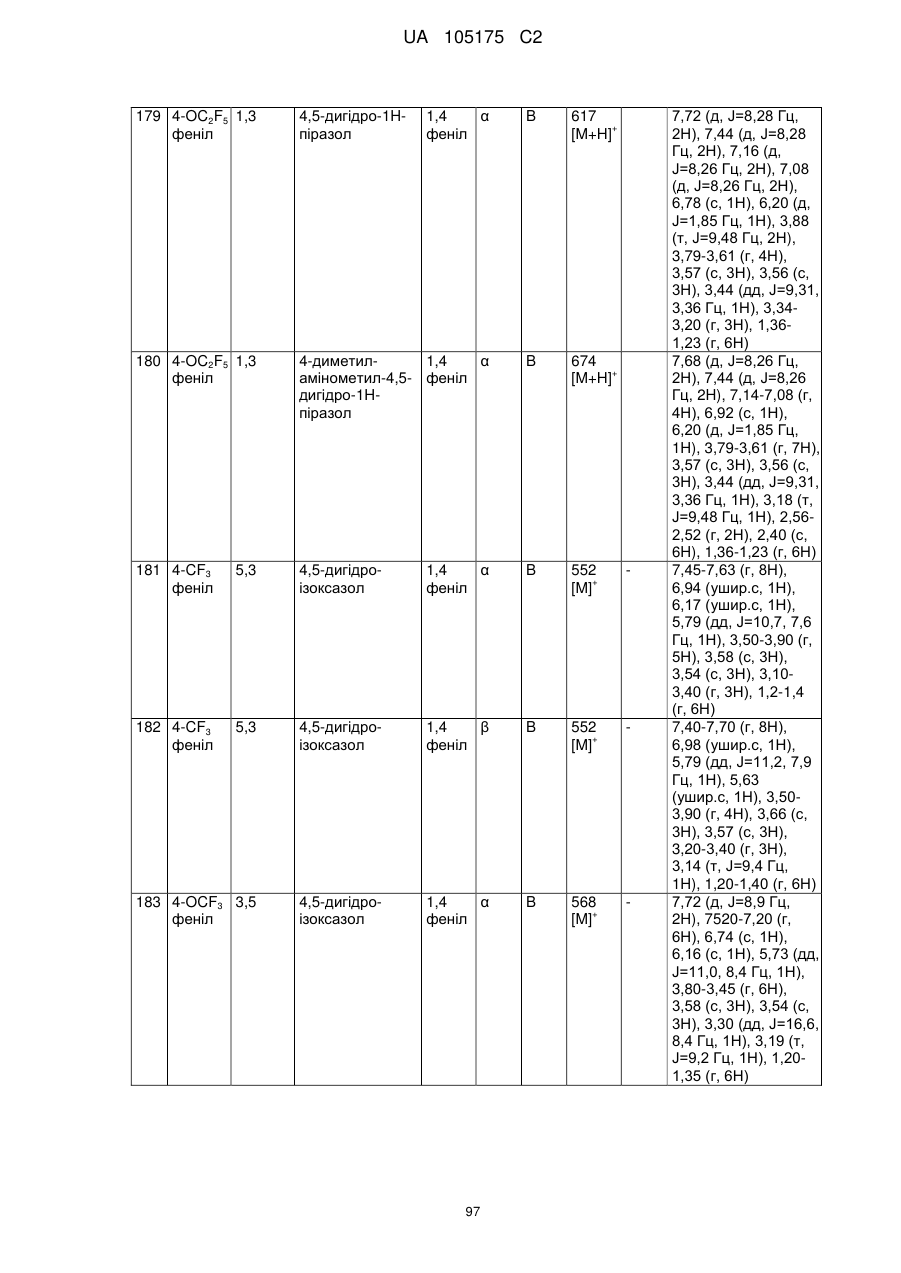
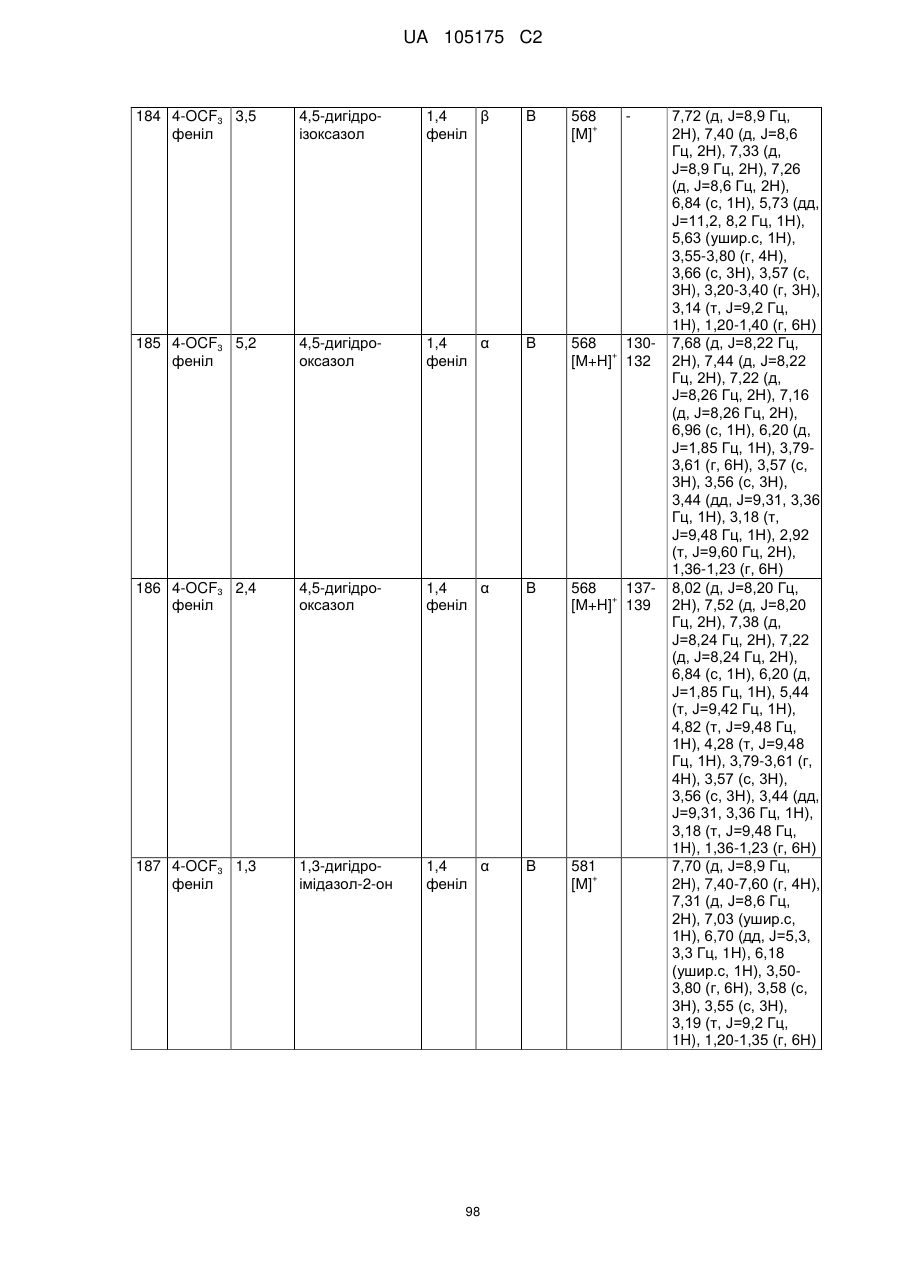
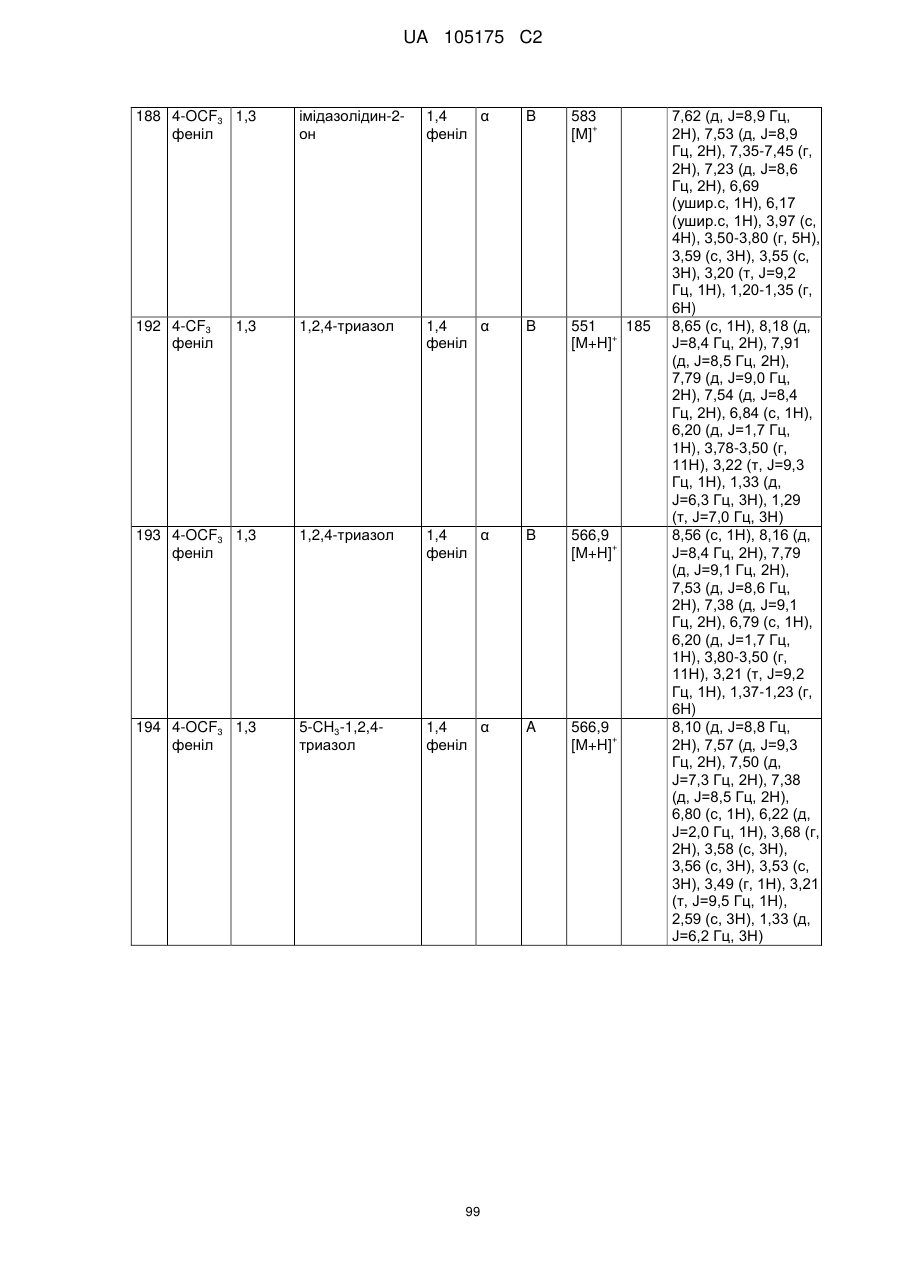
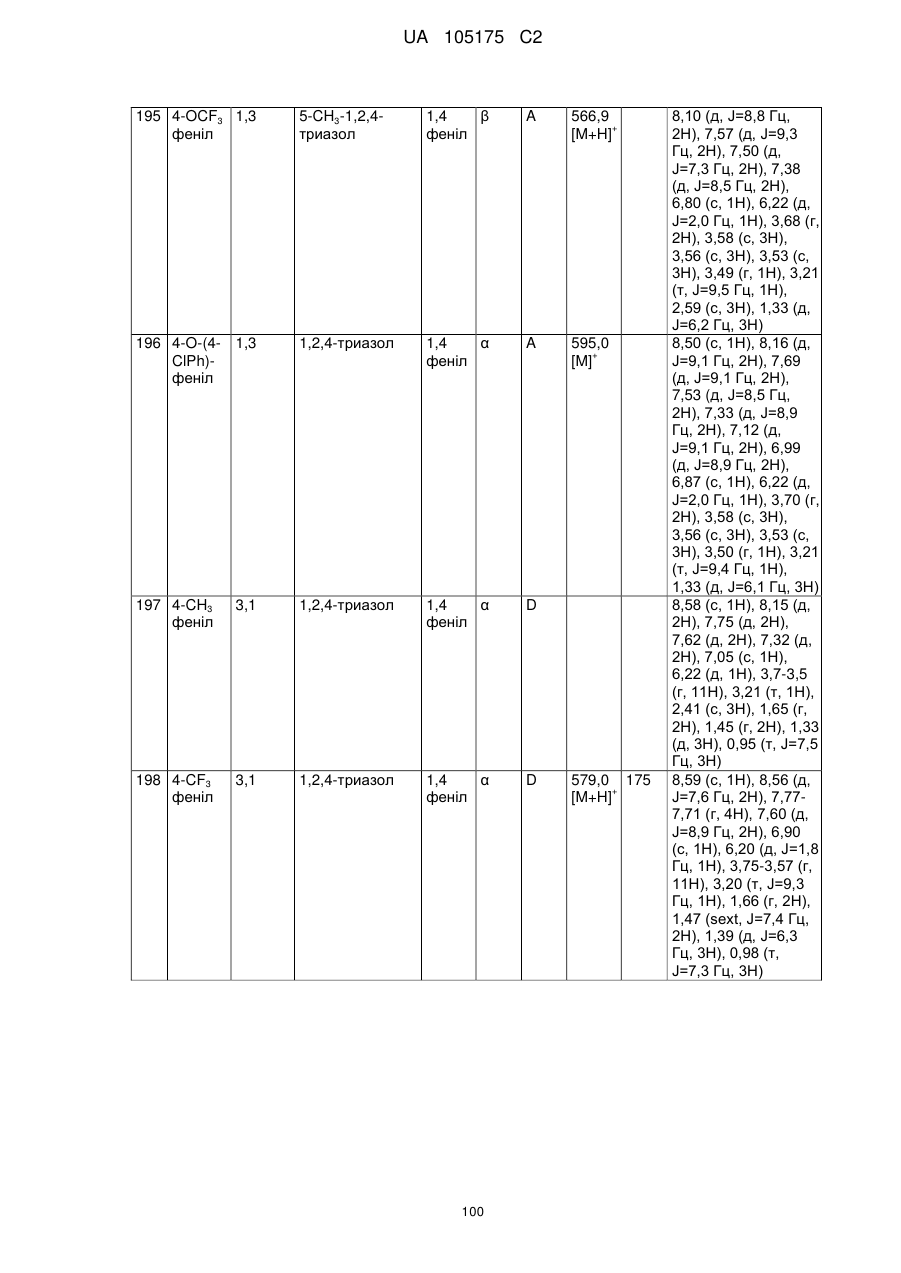
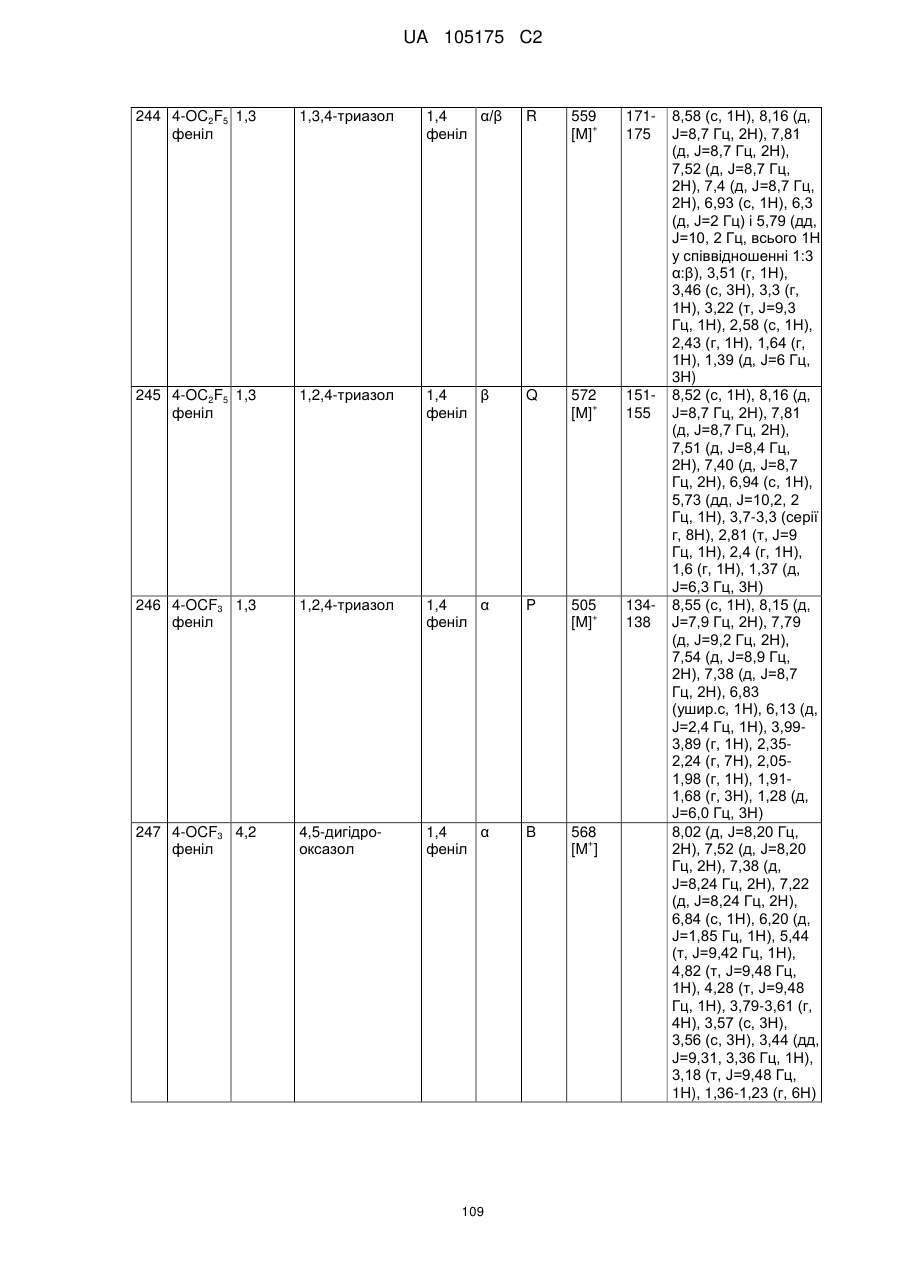
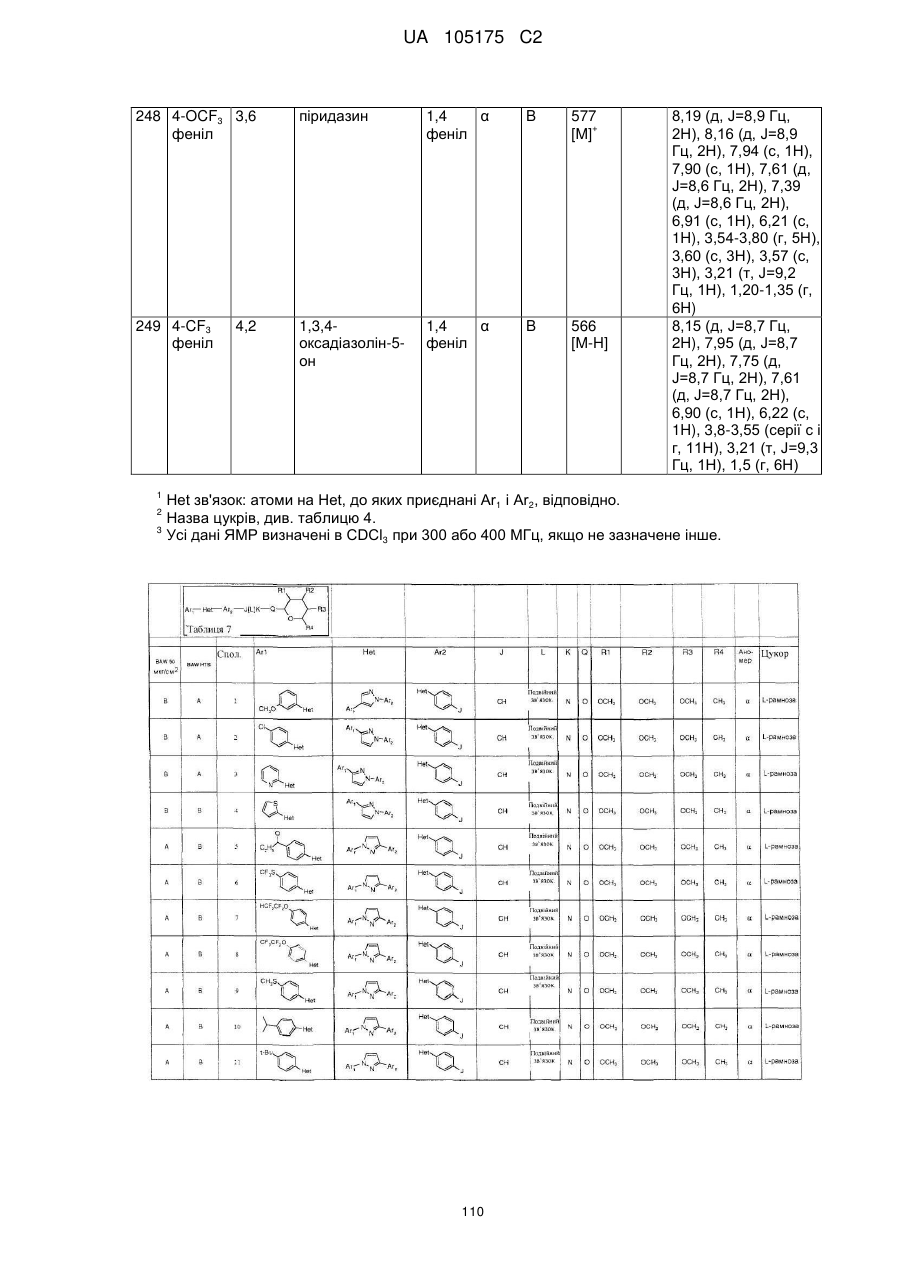
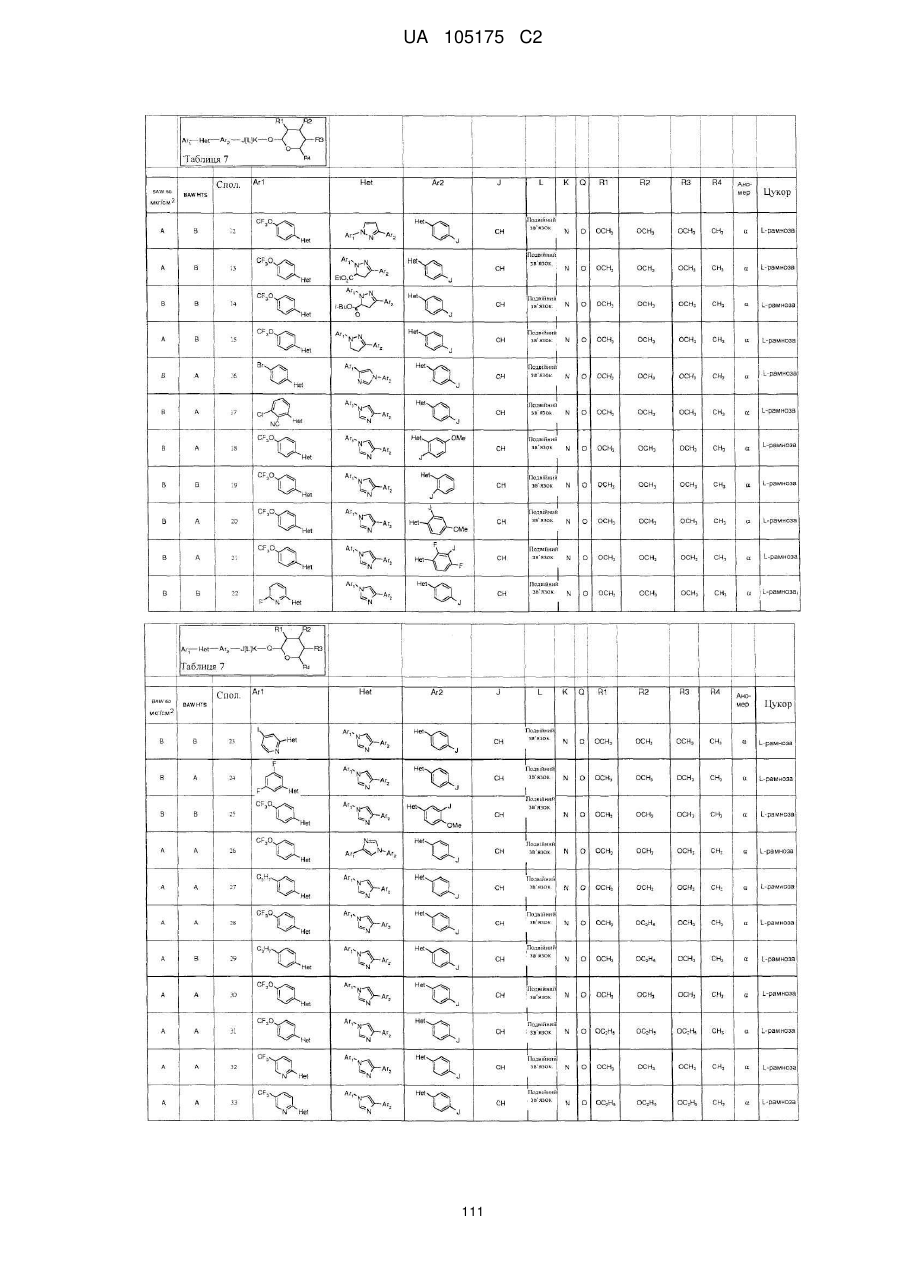
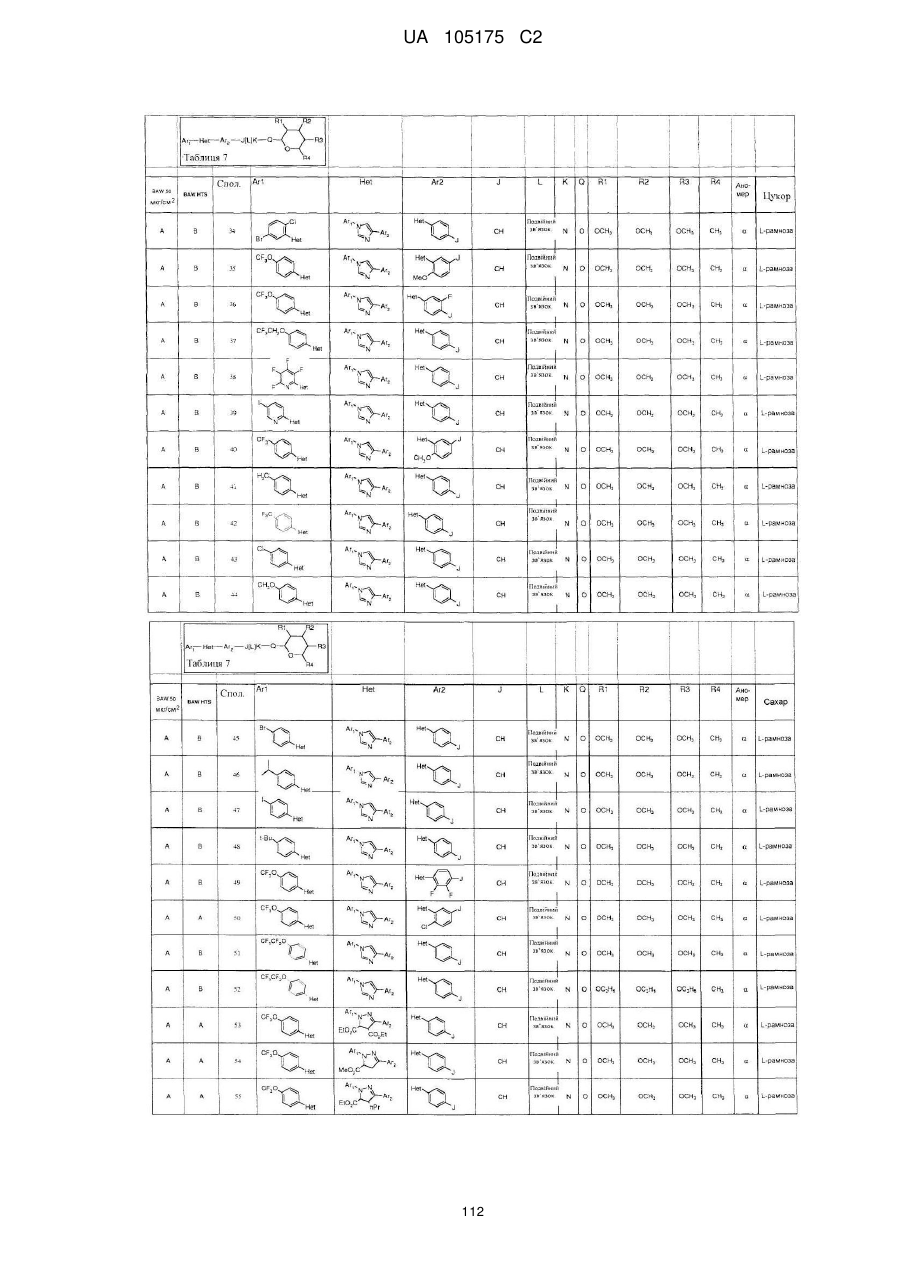
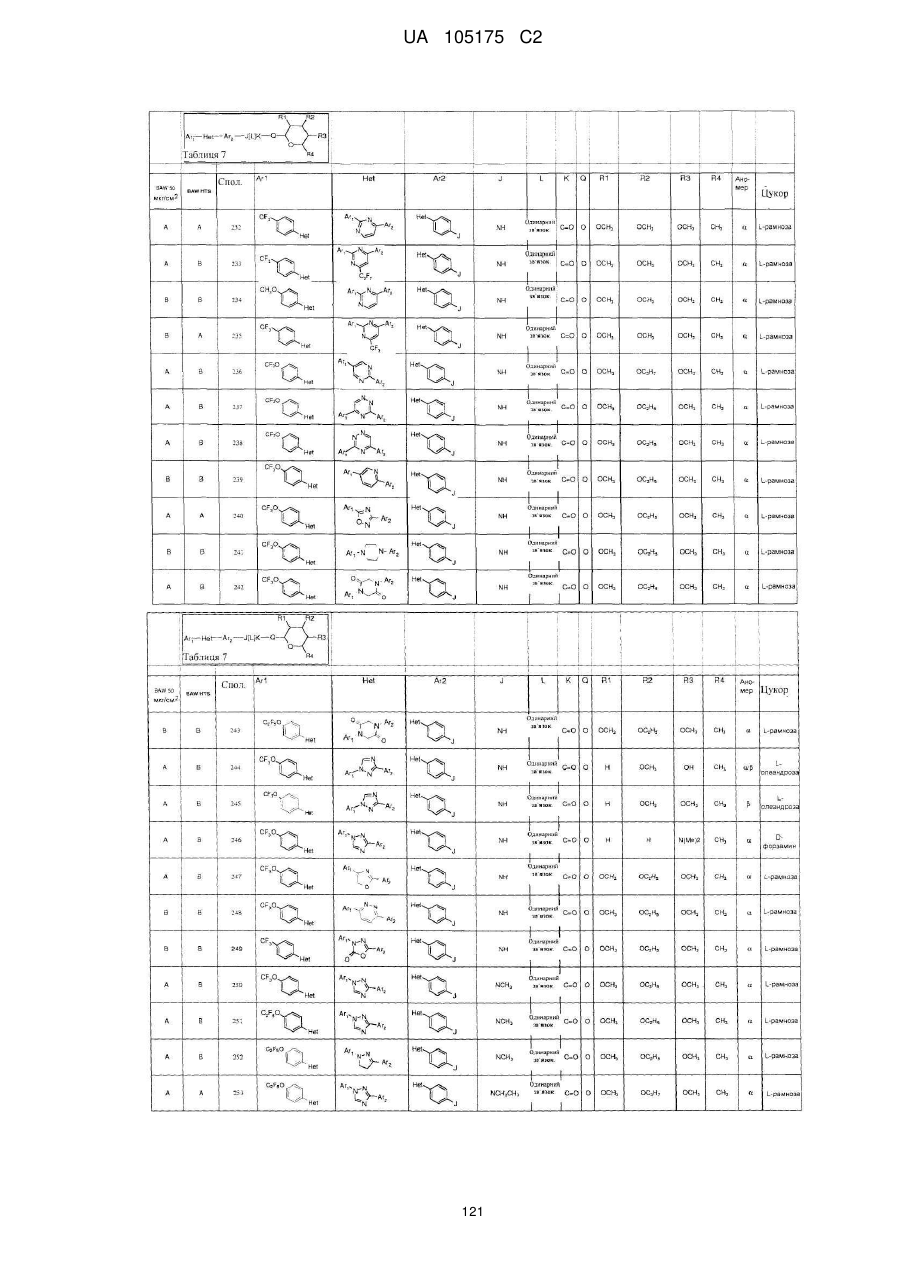
Пестициди
Номер патенту: 105175
Опубліковано: 25.04.2014
Автори: Маклеод КаСандра, Деметер Девід, Брайан Крісті, Браун Аннетт, Дент Уілльям, Хантер Рікі, Спаркс Томас, Самарітоні Джек, Наджент Джеймі, Крауз Гарі, Кадуорт Деніз
Формула / Реферат
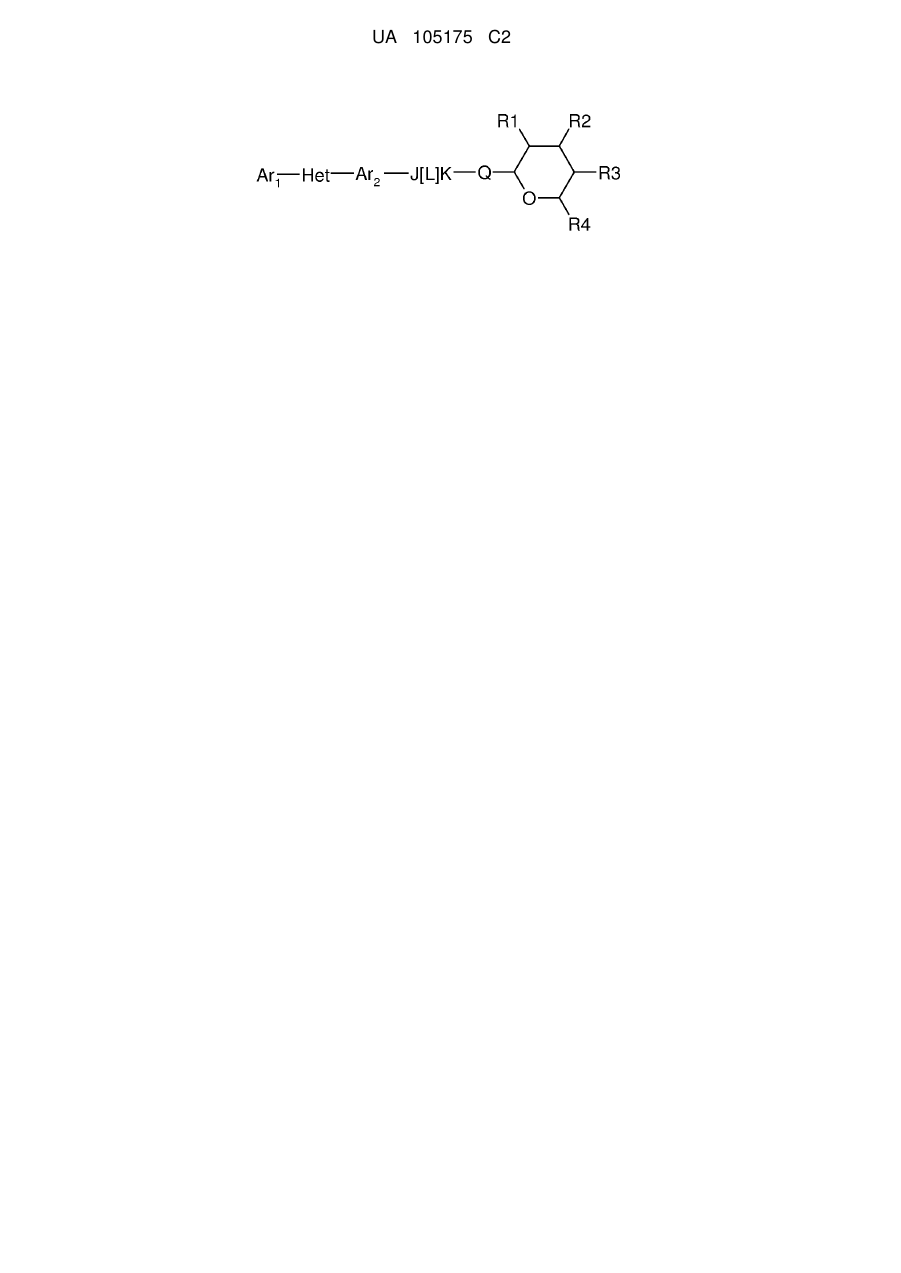
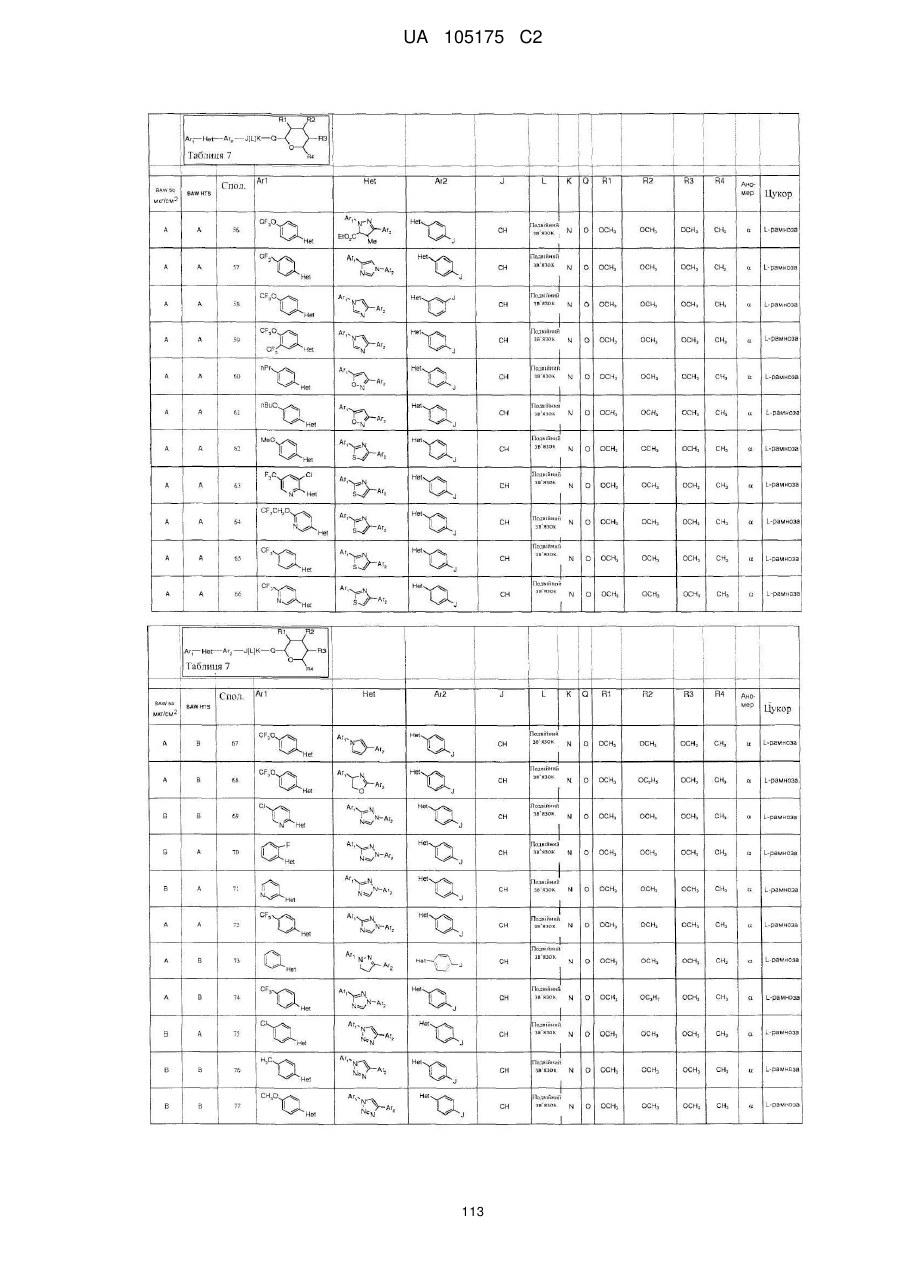
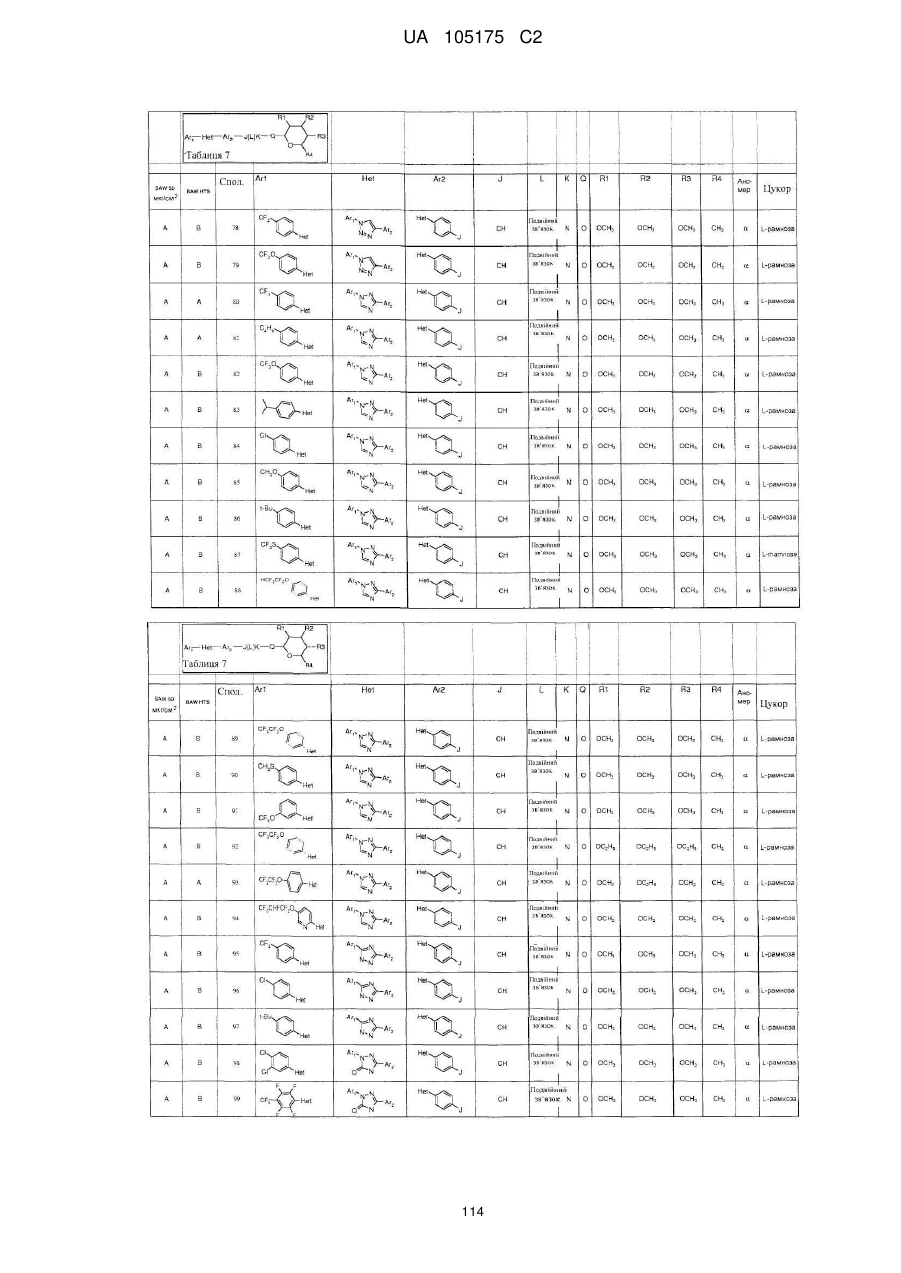
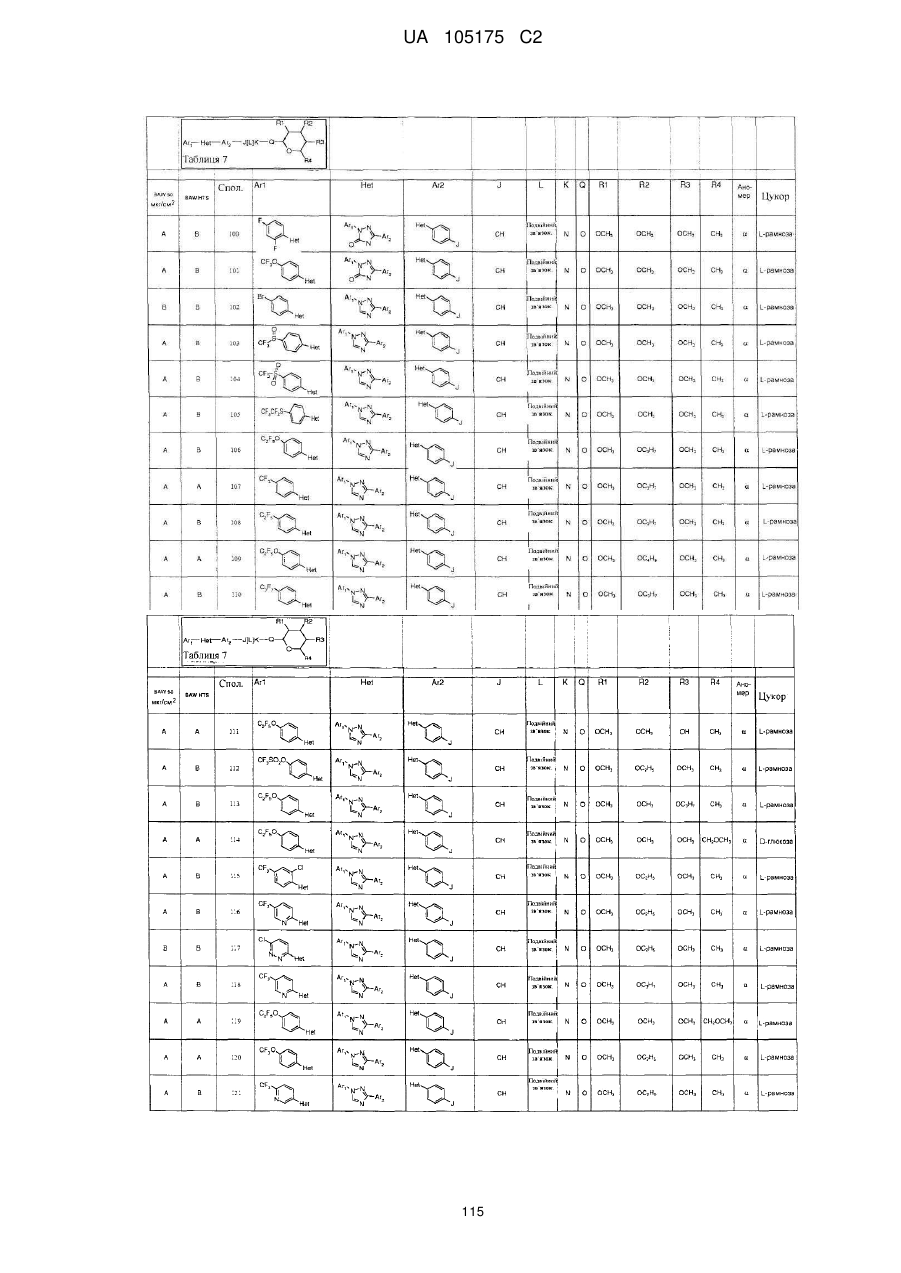
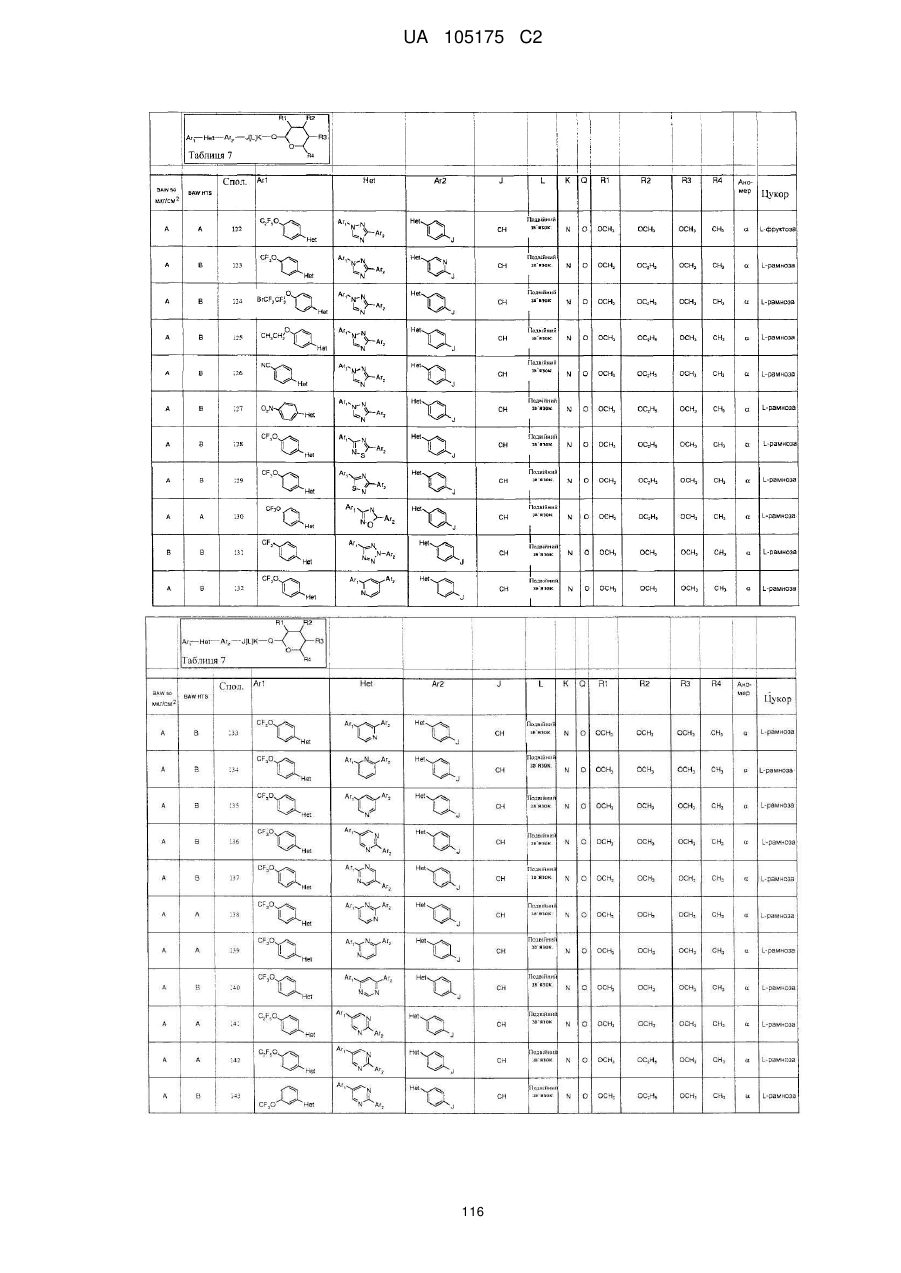
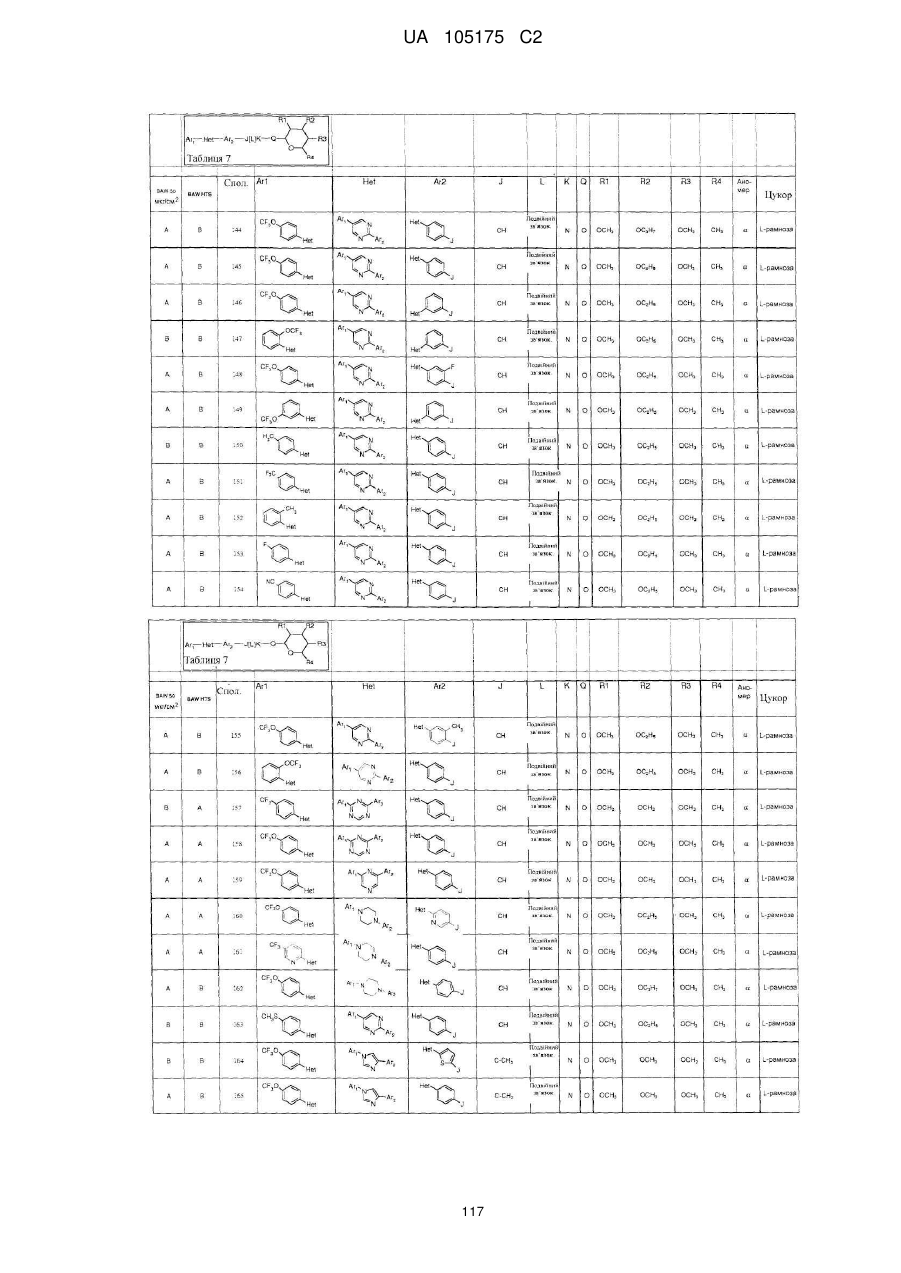
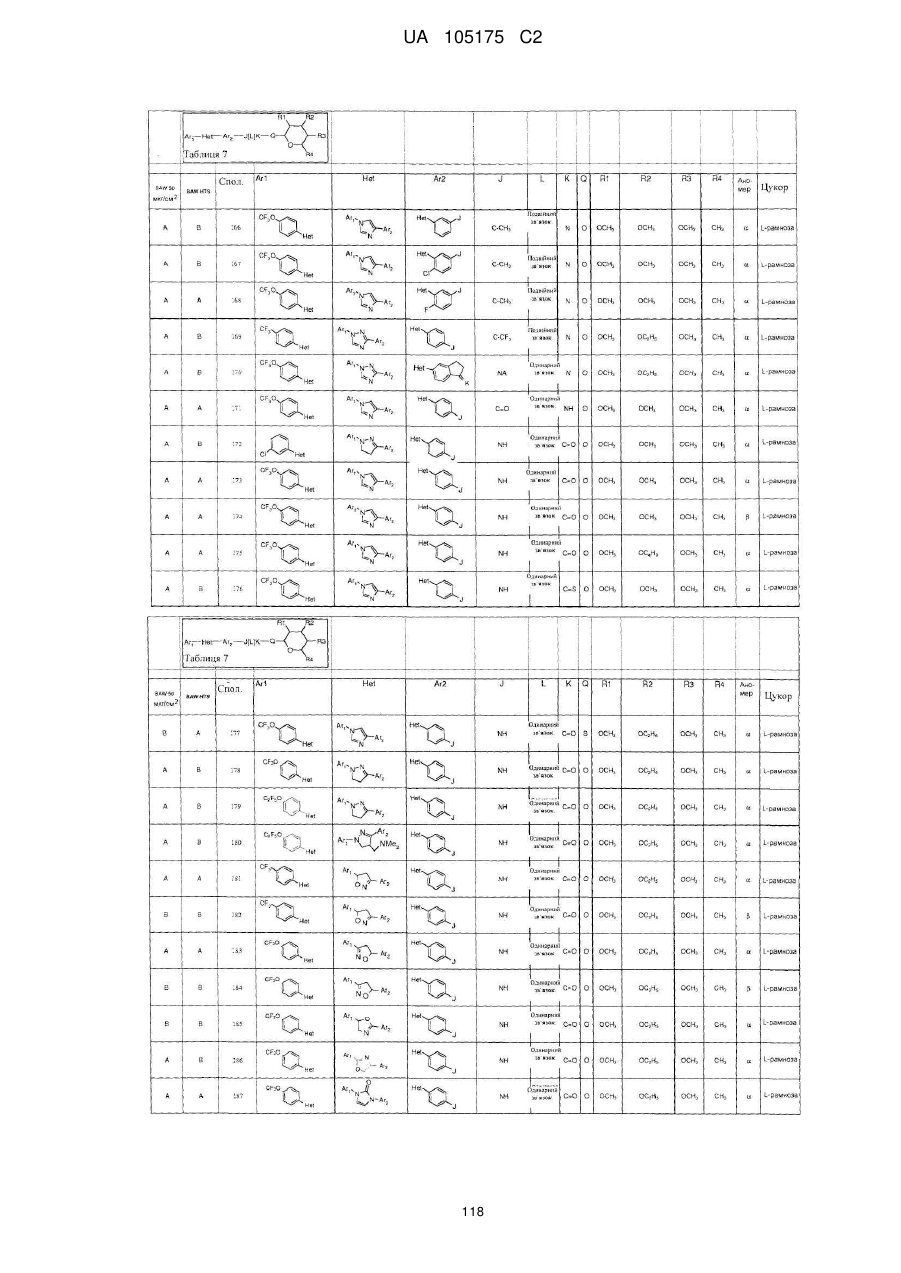
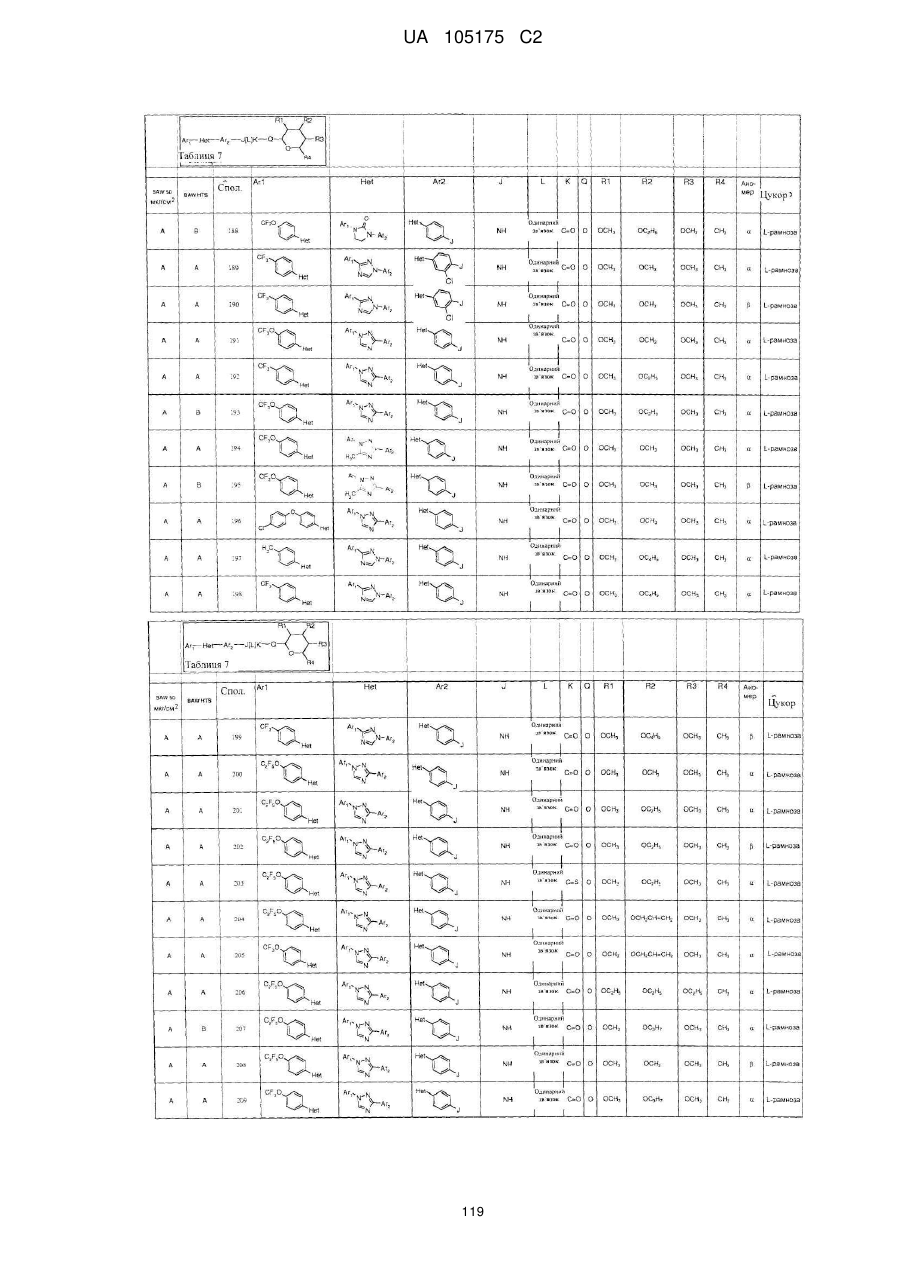
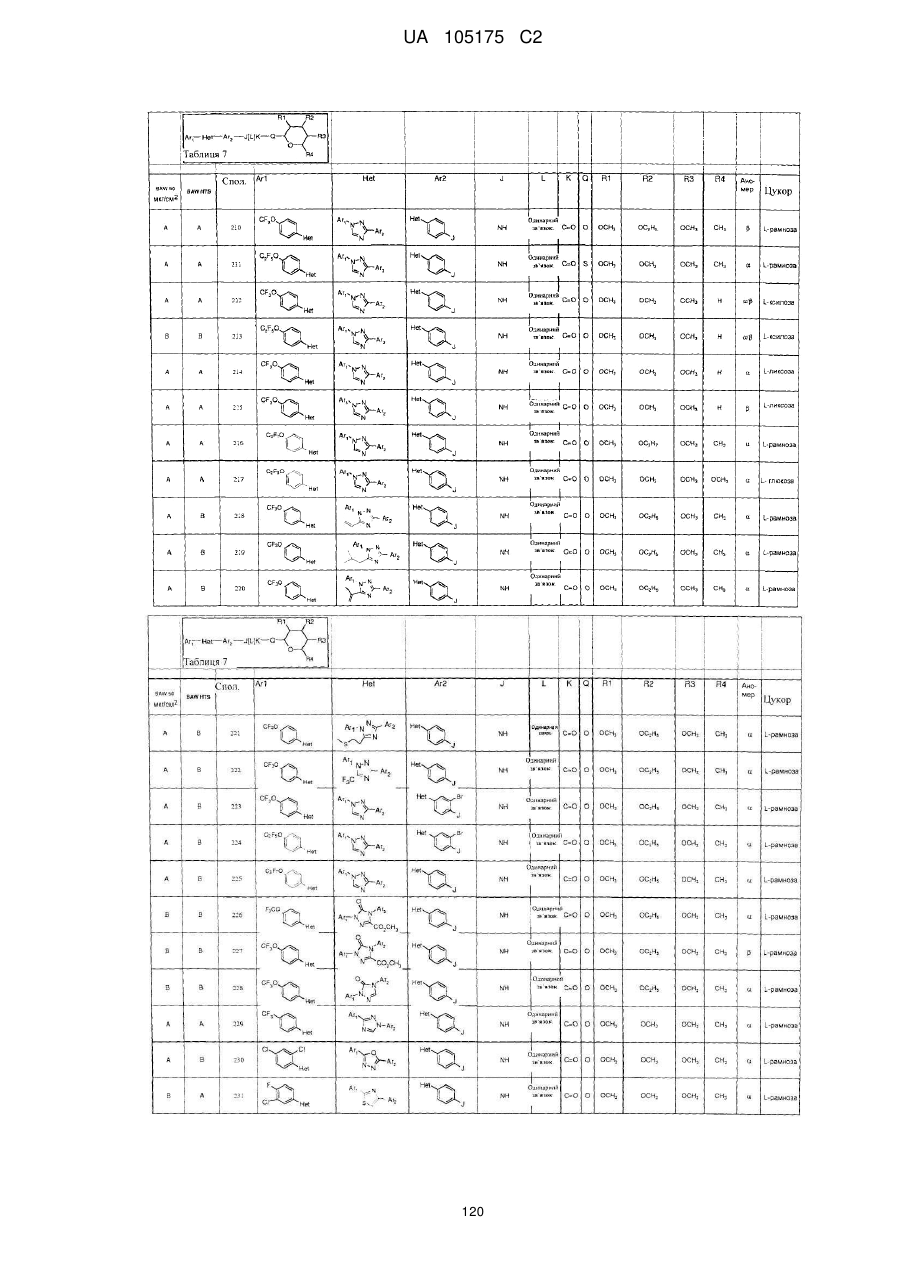
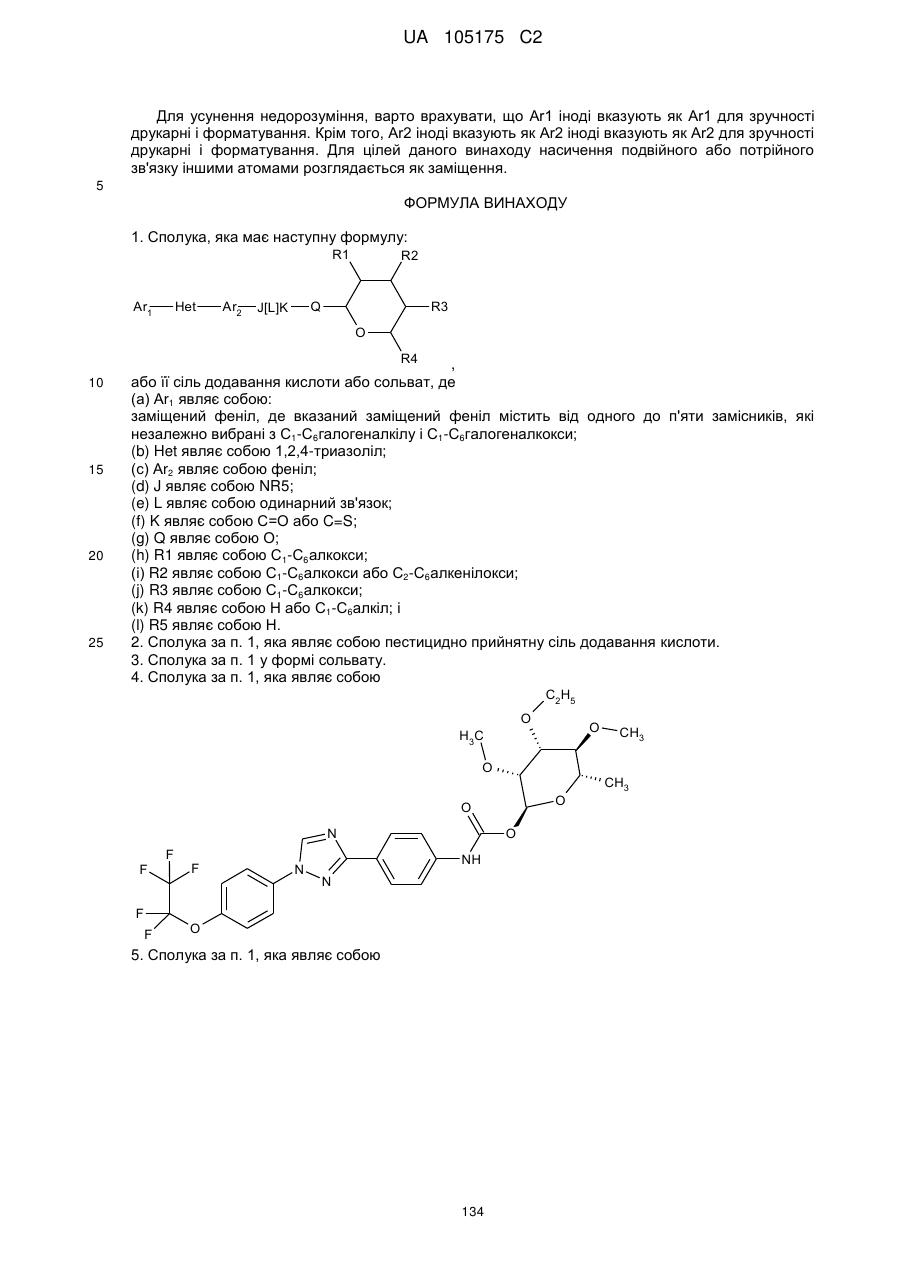
1. Сполука, яка має наступну формулу:
 ,
,
або її сіль додавання кислоти або сольват, де
(a) Аr1 являє собою:
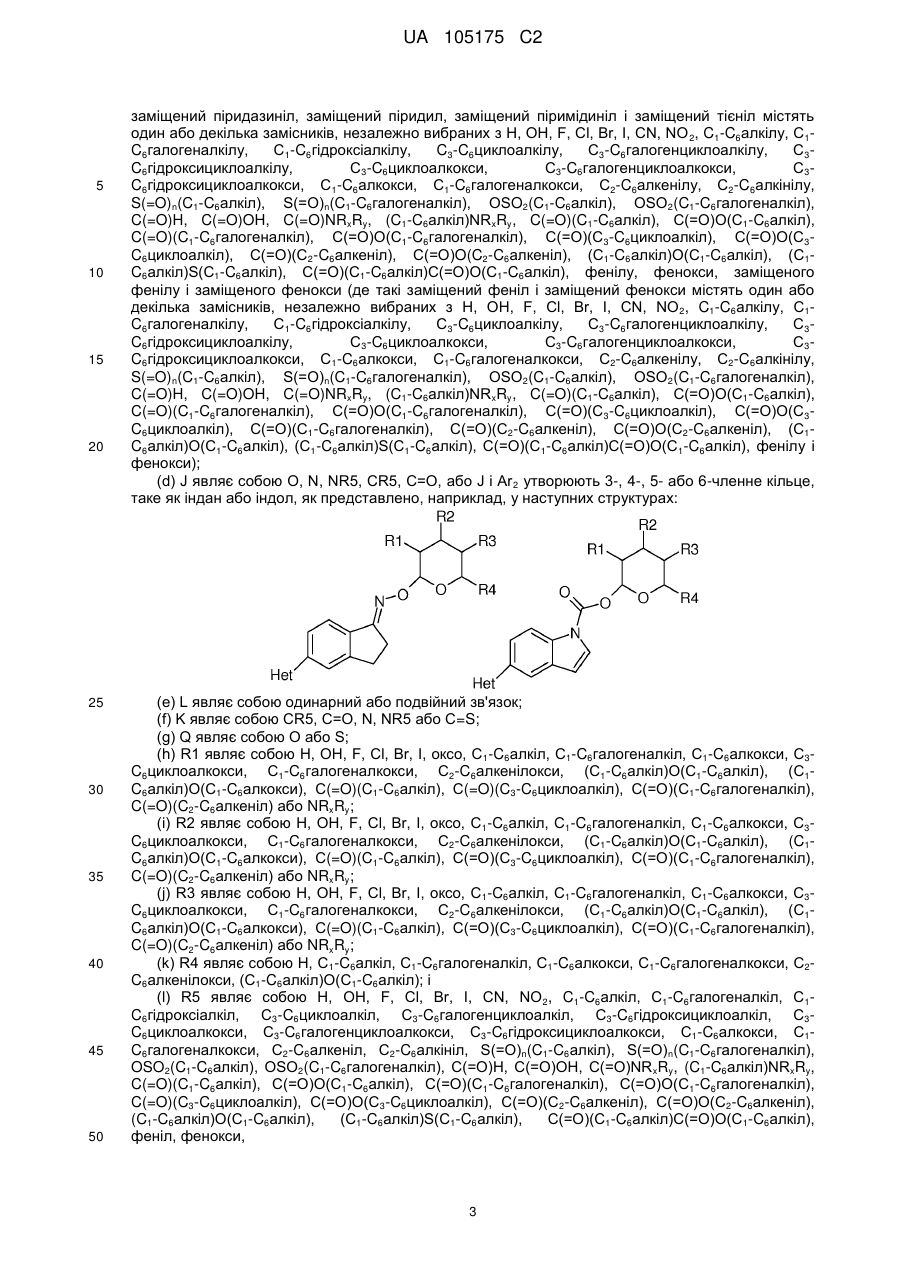
заміщений феніл, де вказаний заміщений феніл містить від одного до п'яти замісників, які незалежно вибрані з С1-С6галогеналкілу і С1-С6галогеналкокси;
(b) Het являє собою 1,2,4-триазоліл;
(c) Аr2 являє собою феніл;
(d) J являє собою NR5;
(e) L являє собою одинарний зв'язок;
(f) K являє собою С=О або C=S;
(g) Q являє собою О;
(h) R1 являє собою С1-С6алкокси;
(і) R2 являє собою С1-С6алкокси або С2-С6алкенілокси;
(j) R3 являє собою С1-С6алкокси;
(k) R4 являє собою Н або С1-С6алкіл; і
(l) R5 являє собою Н.
2. Сполука за п. 1, яка являє собою пестицидно прийнятну сіль додавання кислоти.
3. Сполука за п. 1 у формі сольвату.
4. Сполука за п. 1, яка являє собою
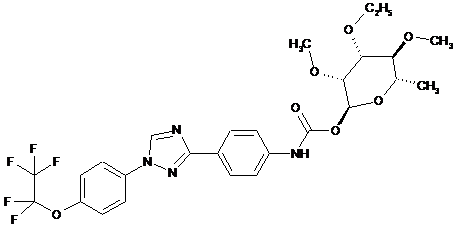 .
.
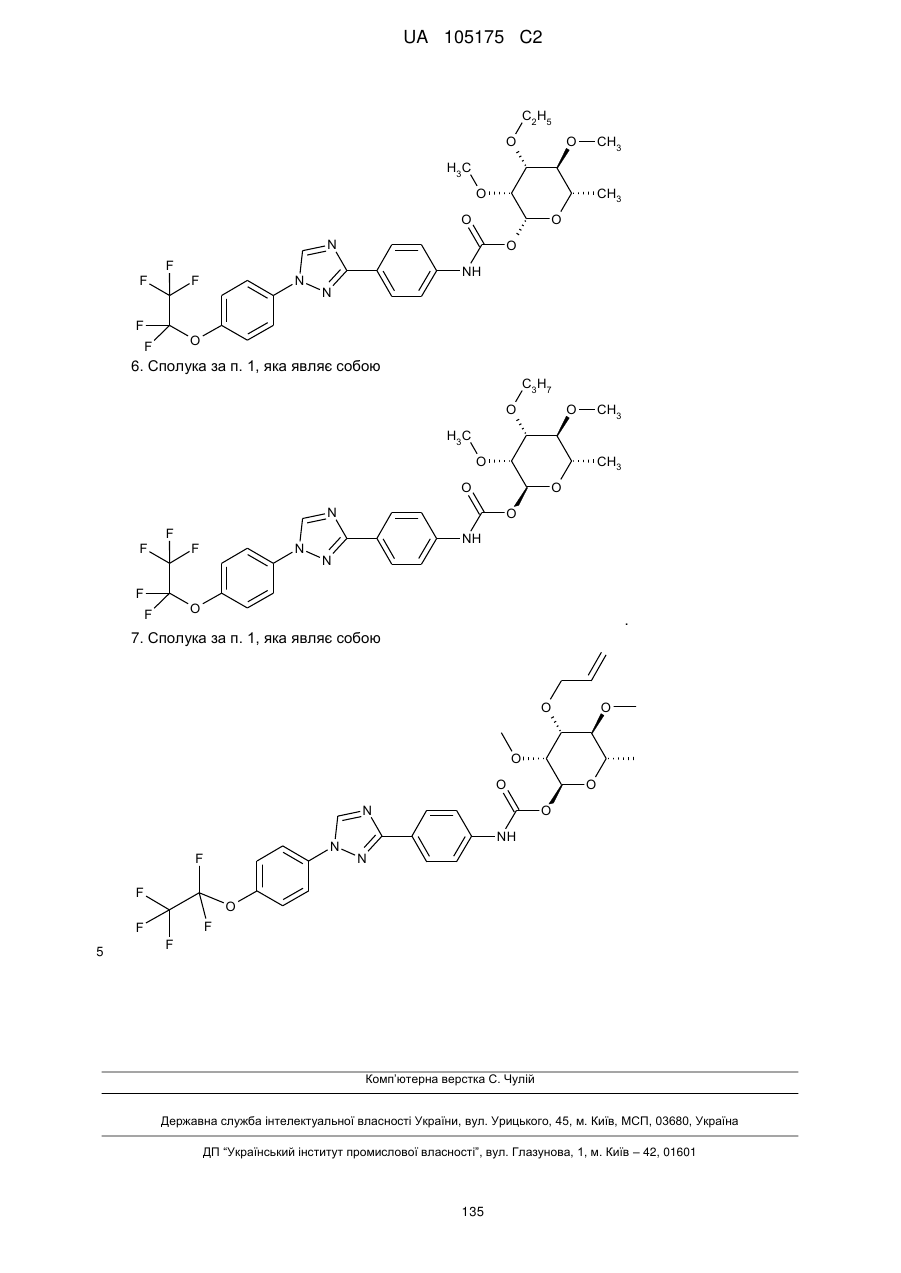
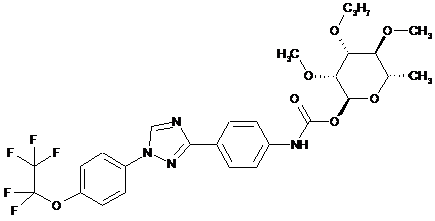
5. Сполука за п. 1, яка являє собою
 .
.
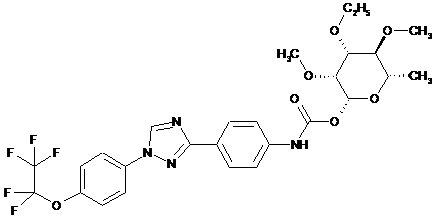
6. Сполука за п. 1, яка являє собою
 .
.
7. Сполука за п. 1, яка являє собою
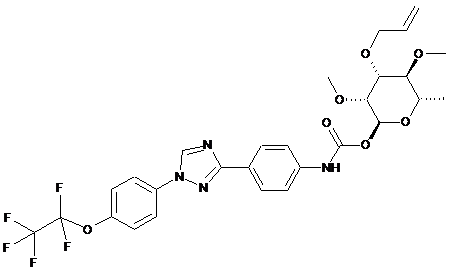 .
.
Текст
Реферат: Винахід, описаний у даному документі, належить до галузі пестицидів і їх застосування для боротьби зі шкідниками. Описана сполука, що має наступну структуру R2 R1 Ar1 Het Ar2 J[L]K R3 Q O R4 . UA 105175 C2 (12) UA 105175 C2 UA 105175 C2 5 10 15 20 25 30 35 40 45 50 55 Перехресне посилання на споріднену заявку За даною заявкою домагається пріоритет відповідно до попередньої заявки США, серійний номер 61/065475, поданої 12 лютого 2008, повний зміст якої включений тут у вигляді посилання. Галузь винаходу Описаний в даному документі винахід належить до галузі пестицидів і їх застосування для боротьби зі шкідниками. Рівень техніки Щороку шкідники викликають мільйони смертельних випадків у людей в усьому світі. Крім того, існує більше десяти тисяч різновидів шкідників, що є причиною втрат у сільському господарстві. Щороку ці сільськогосподарські втрати становлять мільярди доларів США. Терміти наносять шкоду різним спорудам, таким як, наприклад, будинки. Ці втрати в результаті шкідливої діяльності термітів становлять мільярди доларів США щороку. І, нарешті, велика кількість шкідників поїдає і псує харчові продукти, що зберігаються в магазинах і на складах. Ці втрати продуктів харчування становлять мільярди доларів США щороку, але що ще більш важливо, вони позбавляють людей необхідної їжі. Існує гостра необхідність у нових пестицидах. До використовуваних в даний час пестицидів у комах розвивається стійкість. Сотні різновидів комах є стійкими до одного або декількох пестицидів. Розвиток стійкості до деяких з давно використовуваних пестицидів, таких як ДД, карбамати й органофосфати, добре відомий. Однак, стійкість розвивалася навіть до деяких більш нових пестицидів. Відповідно, існує потреба в нових пестицидах і зокрема пестицидах, що мають новий принцип дії. Замісники (неповний перелік) Наведені для замісників приклади є (за винятком галогену) неповними і не можуть бути витлумачені як такі, що обмежують описаний в даному документі винахід. Термін “алкеніл” означає ациклічний ненасичений (щонайменше один вуглець-вуглецевий подвійний зв'язок) розгалужений або не розгалужений замісник, що містить вуглець і водень, наприклад, вініл, аліл, бутеніл, пентеніл, гексеніл, гептеніл, октеніл, ноненіл і деценіл. Термін “алкенілокси” означає алкеніл, що додатково має вуглець-кисневий одинарний зв'язок, наприклад, алілокси, бутенілокси, пентенілокси, гексенілокси, гептенілокси, октенілокси, ноненілокси і деценілокси. Термін “алкокси” означає алкіл, що додатково має вуглець-кисневий одинарний зв'язок, наприклад, метокси, етокси, пропокси, ізопропокси, 1-бутокси, 2-бутокси, ізобутокси, третбутокси, пентокси, 2-метилбутокси, 1,1-диметилпропокси, гексоокси, гептокси, октокси, нонокси і децокси. Термін “алкіл” означає ациклічний насичений розгалужений або нерозгалужений замісник, що містить вуглець і водень, наприклад, метил, етил, пропіл, ізопропіл, 1-бутил, 2-бутил, ізобутил, трет-бутил, пентил, 2-метилбутил, 1,1-диметилпропіл, гексил, гептил, октил, ноніл і децил. Термін “алкініл” означає ациклічний ненасичений (щонайменше один вуглець-вуглецевий потрійний зв'язок і будь-які подвійні зв'язки) розгалужений або нерозгалужений замісник, що містить вуглець і водень, наприклад, етиніл, пропаргіл, бутиніл, пентиніл, гексиніл, гептиніл, октиніл, нонініл і дециніл. Термін “галоген” означає фтор, хлор, бром і йод. Термін “галогеналкокси” означає галогеналкіл, що додатково містить вуглець-кисневий одинарний зв'язок, наприклад, фторметокси, дифторметокси і трифторметокси, 2-фторетокси, 1,1,2,2,2-пентафторетокси, 1,1,2,2-тетрафтор-2-брометокси і 1,1,2,2-тетрафторетокси. Термін “галогеналкіл” означає алкіл, що додатково містить, у кількості від одного до максимально можливого, однакові або різн, галогени, наприклад, фторметил, дифторметил, трифторметил, 2-фторетил, 2,2,2-трифторетил, хлорметил, трихлорметил і 1,1,2,2тетрафторетил. Термін “галогенфенілокси” означає фенілокси, що містить один або декілька, однакових або різних, галогенів. Термін “гідроксіалкіл” означає алкіл, що містить одну або декілька гідроксигруп. Докладний опис винаходу Сполуки за даним винаходом мають наступну формулу: 1 UA 105175 C2 5 10 15 20 25 30 35 40 45 50 55 , де (a) Ar1 являє собою: (1) фураніл, феніл, піридазиніл, піридил, піримідиніл, тієніл або (2) заміщений фураніл, заміщений феніл, заміщений піридазиніл, заміщений піридил, заміщений піримідиніл або заміщений тієніл, де зазначені заміщений фураніл, заміщений феніл, заміщений піридазиніл, заміщений піридил, заміщений піримідиніл і заміщений тієніл містять один або декілька замісників, незалежно вибраних з H, OH, F, Cl, Br, I, CN, NO 2, C1-C6алкілу, C1-C6галогеналкілу, C1-C6гідроксіалкілу, C3-C6циклоалкілу, C3-C6галогенциклоалкілу, C3-C6гідроксициклоалкілу, C3-C6циклоалкокси, C3-C6галогенциклоалкокси, C3-C6гідроксициклоалкокси, C1-C6алкокси, C1-C6галогеналкокси, C2-C6алкенілу, C2-C6алкінілу, S(=O)n(C1-C6алкіл), S(=O)n(C1-C6галогеналкіл), OSO2(C1-C6алкіл), OSO2(C1-C6галогеналкіл), C(=O)H, C(=O)OH, C(=O)NRxRy, (C1-C6алкіл)NRxRy, C(=O)(C1-C6алкіл), C(=O)O(C1-C6алкіл), C(=O)(C1-C6галогеналкіл), C(=O)O(C1-C6галогеналкіл), C(=O)(C3-C6циклоалкіл), C(=O)O(C3C6циклоалкіл), C(=O)(C2-C6алкеніл), C(=O)O(C2-C6алкеніл), (C1-C6алкіл)O(C1-C6алкіл), (C1C6алкіл)S(C1-C6алкіл), C(=O)(C1-C6алкіл)C(=O)O(C1-C6алкіл), фенілу, фенокси, заміщеного фенілу і заміщеного фенокси (де такий заміщений феніл і заміщений фенокси містять один або декілька замісників, незалежно вибраних з H, OH, F, Cl, Br, I, CN, NO 2, C1-C6алкілу, C1C6галогеналкілу, C1-C6гідроксіалкілу, C3-C6циклоалкілу, C3-C6галогенциклоалкілу, C3C6гідроксициклоалкілу, C3-C6циклоалкокси, C3-C6галогенциклоалкокси, C3C6гідроксициклоалкокси, C1-C6алкокси, C1-C6галогеналкокси, C2-C6алкенілу, C2-C6алкінілу, S(=O)n(C1-C6алкіл), S(=O)n(C1-C6галогеналкіл), OSO2(C1-C6алкіл), OSO2(C1-C6галогеналкіл), C(=O)H, C(=O)OH, C(=O)NRxRy, (C1-C6алкіл)NRxRy, C(=O)(C1-C6алкіл), C(=O)O(C1-C6алкіл), C(=O)(C1-C6галогеналкіл), C(=O)O(C1-C6галогеналкіл), C(=O)(C3-C6циклоалкіл), C(=O)O(C3C6циклоалкіл), C(=O)(C2-C6алкеніл), C(=O)O(C2-C6алкеніл), (C1-C6алкіл)O(C1-C6алкіл), (C1C6алкіл)S(C1-C6алкіл), C(=O)(C1-C6алкіл)C(=O)O(C1-C6алкіл), фенілу і фенокси); (b) Het являє собою 5- або 6-членне насичене або ненасичене гетероциклічне кільце, що містить один або декілька гетероатомів, незалежно вибраних з атомів азоту, сірки або кисню, і де Ar1 і Ar2 не знаходяться в орто-положенні відносно один одного (але можуть знаходитися в мета- або пара-положенні, наприклад, для 5-членного кільця це 1,3-положення, і для 6-членного кільця це або 1,3-, або 1,4-положення), і де зазначене гетероциклічне кільце також може бути заміщене одним або декількома замісниками, незалежно вибраними з H, OH, F, Cl, Br, I, CN, NO2, оксо, C1-C6алкілу, C1-C6галогеналкілу, C1-C6гідроксіалкілу, C3-C6циклоалкілу, C3C6галогенциклоалкілу, C3-C6гідроксициклоалкілу, C3-C6циклоалкокси, C3C6галогенциклоалкокси, C3-C6гідроксициклоалкокси, C1-C6алкокси, C1-C6галогеналкокси, C2C6алкенілу, C2-C6алкінілу, S(=O)n(C1-C6алкіл), S(=O)n(C1-C6галогеналкіл), OSO2(C1-C6алкіл), OSO2(C1-C6галогеналкіл), C(=O)H, C(=O)OH, C(=O)NRxRy, (C1-C6алкіл)NRxRy, C(=O)(C1-C6алкіл), C(=O)O(C1-C6алкіл), C(=O)(C1-C6галогеналкіл), C(=O)O(C1-C6галогеналкіл), C(=O)(C3C6циклоалкіл), C(=O)O(C3-C6циклоалкіл), C(=O)(C2-C6алкеніл), C(=O)O(C2-C6алкеніл), (C1C6алкіл)O(C1-C6алкіл), (C1-C6алкіл)S(C1-C6алкіл), C(=O)(C1-C6алкіл)C(=O)O(C1-C6алкіл), фенілу, фенокси, заміщеного фенілу і заміщеного фенокси (де такі заміщений феніл і заміщений фенокси містять один або декілька замісників, незалежно вибраних з H, OH, F, Cl, Br, I, CN, NO 2, C1-C6алкілу, C1-C6галогеналкілу, C1-C6гідроксіалкілу, C3-C6циклоалкілу, C3C6галогенциклоалкілу, C3-C6гідроксициклоалкілу, C3-C6циклоалкокси, C3C6галогенциклоалкокси, C3-C6гідроксициклоалкокси, C1-C6алкокси, C1-C6галогеналкокси, C2C6алкенілу, C2-C6алкінілу, S(=O)n(C1-C6алкіл), S(=O)n(C1-C6галогеналкіл), OSO2(C1-C6алкіл), OSO2(C1-C6галогеналкіл), C(=O)H, C(=O)OH, C(=O)NRxRy, (C1-C6алкіл)NRxRy, C(=O)(C1-C6алкіл), C(=O)O(C1-C6алкіл), C(=O)(C1-C6галогеналкіл), C(=O)O(C1-C6галогеналкіл), C(=O)(C3C6циклоалкіл), C(=O)O(C3-C6циклоалкіл), C(=O)(C2-C6алкеніл), C(=O)O(C2-C6алкеніл), (C1C6алкіл)O(C1-C6алкіл), (C1-C6алкіл)S(C1-C6алкіл), C(=O)(C1-C6алкіл)C(=O)O(C1-C6алкіл), фенілу і фенокси); (c) Ar2 являє собою: (1) фураніл, феніл, піридазиніл, піридил, піримідиніл, тієніл або (2) заміщений фураніл, заміщений феніл, заміщений піридазиніл, заміщений піридил, заміщений піримідиніл або заміщений тієніл, де зазначені заміщений фураніл, заміщений феніл, 2 UA 105175 C2 5 10 15 20 25 30 35 40 45 50 заміщений піридазиніл, заміщений піридил, заміщений піримідиніл і заміщений тієніл містять один або декілька замісників, незалежно вибраних з H, OH, F, Cl, Br, I, CN, NO 2, C1-C6алкілу, C1C6галогеналкілу, C1-C6гідроксіалкілу, C3-C6циклоалкілу, C3-C6галогенциклоалкілу, C3C6гідроксициклоалкілу, C3-C6циклоалкокси, C3-C6галогенциклоалкокси, C3C6гідроксициклоалкокси, C1-C6алкокси, C1-C6галогеналкокси, C2-C6алкенілу, C2-C6алкінілу, S(=O)n(C1-C6алкіл), S(=O)n(C1-C6галогеналкіл), OSO2(C1-C6алкіл), OSO2(C1-C6галогеналкіл), C(=O)H, C(=O)OH, C(=O)NRxRy, (C1-C6алкіл)NRxRy, C(=O)(C1-C6алкіл), C(=O)O(C1-C6алкіл), C(=O)(C1-C6галогеналкіл), C(=O)O(C1-C6галогеналкіл), C(=O)(C3-C6циклоалкіл), C(=O)O(C3C6циклоалкіл), C(=O)(C2-C6алкеніл), C(=O)O(C2-C6алкеніл), (C1-C6алкіл)O(C1-C6алкіл), (C1C6алкіл)S(C1-C6алкіл), C(=O)(C1-C6алкіл)C(=O)O(C1-C6алкіл), фенілу, фенокси, заміщеного фенілу і заміщеного фенокси (де такі заміщений феніл і заміщений фенокси містять один або декілька замісників, незалежно вибраних з H, OH, F, Cl, Br, I, CN, NO 2, C1-C6алкілу, C1C6галогеналкілу, C1-C6гідроксіалкілу, C3-C6циклоалкілу, C3-C6галогенциклоалкілу, C3C6гідроксициклоалкілу, C3-C6циклоалкокси, C3-C6галогенциклоалкокси, C3C6гідроксициклоалкокси, C1-C6алкокси, C1-C6галогеналкокси, C2-C6алкенілу, C2-C6алкінілу, S(=O)n(C1-C6алкіл), S(=O)n(C1-C6галогеналкіл), OSO2(C1-C6алкіл), OSO2(C1-C6галогеналкіл), C(=O)H, C(=O)OH, C(=O)NRxRy, (C1-C6алкіл)NRxRy, C(=O)(C1-C6алкіл), C(=O)O(C1-C6алкіл), C(=O)(C1-C6галогеналкіл), C(=O)O(C1-C6галогеналкіл), C(=O)(C3-C6циклоалкіл), C(=O)O(C3C6циклоалкіл), C(=O)(C1-C6галогеналкіл), C(=O)(C2-C6алкеніл), C(=O)O(C2-C6алкеніл), (C1C6алкіл)O(C1-C6алкіл), (C1-C6алкіл)S(C1-C6алкіл), C(=O)(C1-C6алкіл)C(=O)O(C1-C6алкіл), фенілу і фенокси); (d) J являє собою O, N, NR5, CR5, C=O, або J і Ar 2 утворюють 3-, 4-, 5- або 6-членне кільце, таке як індан або індол, як представлено, наприклад, у наступних структурах: (e) L являє собою одинарний або подвійний зв'язок; (f) K являє собою CR5, C=O, N, NR5 або C=S; (g) Q являє собою O або S; (h) R1 являє собою H, OH, F, Cl, Br, I, оксо, C1-C6алкіл, C1-C6галогеналкіл, C1-C6алкокси, C3C6циклоалкокси, C1-C6галогеналкокси, C2-C6алкенілокси, (C1-C6алкіл)O(C1-C6алкіл), (C1C6алкіл)O(C1-C6алкокси), C(=O)(C1-C6алкіл), C(=O)(C3-C6циклоалкіл), C(=O)(C1-C6галогеналкіл), C(=O)(C2-C6алкеніл) або NRxRy; (i) R2 являє собою H, OH, F, Cl, Br, I, оксо, C1-C6алкіл, C1-C6галогеналкіл, C1-C6алкокси, C3C6циклоалкокси, C1-C6галогеналкокси, C2-C6алкенілокси, (C1-C6алкіл)O(C1-C6алкіл), (C1C6алкіл)O(C1-C6алкокси), C(=O)(C1-C6алкіл), C(=O)(C3-C6циклоалкіл), C(=O)(C1-C6галогеналкіл), C(=O)(C2-C6алкеніл) або NRxRy; (j) R3 являє собою H, OH, F, Cl, Br, I, оксо, C1-C6алкіл, C1-C6галогеналкіл, C1-C6алкокси, C3C6циклоалкокси, C1-C6галогеналкокси, C2-C6алкенілокси, (C1-C6алкіл)O(C1-C6алкіл), (C1C6алкіл)O(C1-C6алкокси), C(=O)(C1-C6алкіл), C(=O)(C3-C6циклоалкіл), C(=O)(C1-C6галогеналкіл), C(=O)(C2-C6алкеніл) або NRxRy; (k) R4 являє собою H, C1-C6алкіл, C1-C6галогеналкіл, C1-C6алкокси, C1-C6галогеналкокси, C2C6алкенілокси, (C1-C6алкіл)O(C1-C6алкіл); і (l) R5 являє собою H, OH, F, Cl, Br, I, CN, NO 2, C1-C6алкіл, C1-C6галогеналкіл, C1C6гідроксіалкіл, C3-C6циклоалкіл, C3-C6галогенциклоалкіл, C3-C6гідроксициклоалкіл, C3C6циклоалкокси, C3-C6галогенциклоалкокси, C3-C6гідроксициклоалкокси, C1-C6алкокси, C1C6галогеналкокси, C2-C6алкеніл, C2-C6алкініл, S(=O)n(C1-C6алкіл), S(=O)n(C1-C6галогеналкіл), OSO2(C1-C6алкіл), OSO2(C1-C6галогеналкіл), C(=O)H, C(=O)OH, C(=O)NR xRy, (C1-C6алкіл)NRxRy, C(=O)(C1-C6алкіл), C(=O)O(C1-C6алкіл), C(=O)(C1-C6галогеналкіл), C(=O)O(C1-C6галогеналкіл), C(=O)(C3-C6циклоалкіл), C(=O)O(C3-C6циклоалкіл), C(=O)(C2-C6алкеніл), C(=O)O(C2-C6алкеніл), (C1-C6алкіл)O(C1-C6алкіл), (C1-C6алкіл)S(C1-C6алкіл), C(=O)(C1-C6алкіл)C(=O)O(C1-C6алкіл), феніл, фенокси, 3 UA 105175 C2 5 10 15 20 25 30 35 40 45 50 55 60 де кожний алкіл, галогеналкіл, гідроксіалкіл, циклоалкіл, галогенциклоалкіл, гідроксициклоалкіл, циклоалкокси, галогенциклоалкокси, гідроксициклоалкокси, алкокси, галогеналкокси, алкеніл, алкініл, феніл і фенокси необов'язково заміщені одним або декількома замісниками, незалежно вибраними з OH, F, Cl, Br, I, CN, NO 2, оксо, C1-C6алкілу, C1C6галогеналкілу, C1-C6гідроксіалкілу, C3-C6циклоалкілу, C3-C6галогенциклоалкілу, C3C6гідроксициклоалкілу, C3-C6циклоалкокси, C3-C6галогенциклоалкокси, C3C6гідроксициклоалкокси, C1-C6алкокси, C1-C6галогеналкокси, C2-C6алкенілу, C2-C6алкінілу, S(=O)n(C1-C6алкіл), S(=O)n(C1-C6галогеналкіл), OSO2(C1-C6алкіл), OSO2(C1-C6галогеналкіл), C(=O)H, C(=O)OH, C(=O)NRxRy, (C1-C6алкіл)NRxRy, C(=O)(C1-C6алкіл), C(=O)O(C1-C6алкіл), C(=O)(C1-C6галогеналкіл), C(=O)O(C1-C6галогеналкіл), C(=O)(C3-C6циклоалкіл), C(=O)O(C3C6циклоалкіл), C(=O)(C2-C6алкеніл), C(=O)O(C2-C6алкеніл), (C1-C6алкіл)O(C1-C6алкіл), (C1C6алкіл)S(C1-C6алкіл), C(=O)(C1-C6алкіл)C(=O)O(C1-C6алкіл), фенілу і фенокси; (m) n = 0, 1 або 2; (n) Rx і Ry незалежно вибрані з H, C1-C6алкілу, C1-C6галогеналкілу, C1-C6гідроксіалкілу, C3C6циклоалкілу, C3-C6галогенциклоалкілу, C3-C6гідроксициклоалкілу, C3-C6циклоалкокси, C3C6галогенциклоалкокси, C3-C6гідроксициклоалкокси, C1-C6алкокси, C1-C6галогеналкокси, C2C6алкенілу, C2-C6алкінілу, S(=O)n(C1-C6алкіл), S(=O)n(C1-C6галогеналкіл), OSO2(C1-C6алкіл), OSO2(C1-C6галогеналкіл), C(=O)H, C(=O)OH, C(=O)(C 1-C6алкіл), C(=O)O(C1-C6алкіл), C(=O)(C1C6галогеналкіл), C(=O)O(C1-C6галогеналкіл), C(=O)(C3-C6циклоалкіл), C(=O)O(C3-C6циклоалкіл), C(=O)(C2-C6алкеніл), C(=O)O(C2-C6алкеніл), (C1-C6алкіл)O(C1-C6алкіл), (C1-C6алкіл)S(C1-C6алкіл), C(=O)(C1-C6алкіл)C(=O)O(C1-C6алкіл), фенілу і фенокси. В іншому варіанті здійснення даного винаходу: (a) Ar1 являє собою феніл, піридазиніл, піридил, тієніл, заміщений феніл, заміщений піридазиніл, заміщений піридил або заміщений тієніл, де зазначені заміщений феніл, заміщений піридазиніл, заміщений піридил і заміщений тієніл, містять один або декілька замісників, незалежно вибраних з F, Cl, Br, I, CN, NO2, C1-C6алкілу, C1-C6галогеналкілу, C1-C6гідроксіалкілу, C1-C6галогеналкокси, C2-C6алкенілу, S(=O)n(C1-C6алкіл), S(=O)n(C1-C6галогеналкіл), OSO2(C1C6галогеналкіл), C(=O)(C1-C6алкіл), (C1-C6алкіл)S(C1-C6алкіл) і фенокси (де такий заміщений фенокси має один або декілька замісників, незалежно вибраних з F, Cl, Br або I). В іншому варіанті здійснення винаходу: (a) Ar1 являє собою заміщений феніл або заміщений піридил, де зазначені заміщений феніл і заміщений піридил містять один або декілька замісників, незалежно вибраних з F, Cl, Br, I, CN, NO2, C1-C6алкілу, C1-C6галогеналкілу, C1-C6гідроксіалкілу, C1-C6галогеналкокси, C2-C6алкенілу, S(=O)n(C1-C6алкіл), S(=O)n(C1-C6галогеналкіл), OSO2(C1-C6галогеналкіл), C(=O)(C1-C6алкіл), (C1C6алкіл)S(C1-C6алкіл) і фенокси (де такий заміщений фенокси має один або декілька замісників, незалежно вибраних з F, Cl, Br або I). В іншому варіанті здійснення винаходу: (a) Ar1 являє собою заміщений феніл, де зазначений заміщений феніл має один або декілька замісників, незалежно вибраних з F, Cl, Br, I, C 1-C6алкілу, C1-C6галогеналкілу і C1C6галогеналкокси. В іншому варіанті здійснення винаходу: (b) Het являє собою імідазоліл, ізотіазоліл, ізоксазоліл, 1,2,4-оксадіазоліл, 1,3,4-оксадіазоліл, оксазолініл, оксазоліл, піперазиніл, піперидиніл, піразиніл, піразолініл, піразоліл, піридазиніл, піридил, піримідиніл, піроліл, 1,2,3,4-тетразоліл, тіадіазоліл, тіазолініл, тіазоліл, 1,2,3-триазиніл, 1,2,4-триазиніл, 1,3,5-триазиніл, 1,2,3-триазоліл, 1,2,4-триазоліл, заміщений імідазоліл, заміщений ізотіазоліл, заміщений ізоксазоліл, заміщений 1,2,4-оксадіазоліл, заміщений 1,3,4оксадіазоліл, заміщений оксазолініл, заміщений оксазоліл, заміщений піперазиніл, заміщений піперидиніл, заміщений піразиніл, заміщений піразолініл, заміщений піразоліл, заміщений піридазиніл, заміщений піридил, заміщений піримідиніл, заміщений піроліл, заміщений тетразоліл, заміщений тіадіазоліл, заміщений тіазолініл, заміщений тіазоліл, заміщений 1,2,3триазиніл, заміщений 1,2,4-триазиніл, заміщений 1,3,5-триазиніл, заміщений 1,2,3-триазоліл і заміщений 1,2,4-триазоліл, де зазначені заміщені групи містять один або декілька замісників, незалежно вибраних з H, OH, F, Cl, Br, I, CN, NO2, оксо, C1-C6алкілу, C1-C6галогеналкілу, C1C6гідроксіалкілу, C3-C6циклоалкілу, C3-C6галогенциклоалкілу, C3-C6гідроксициклоалкілу, C3C6циклоалкокси, C3-C6галогенциклоалкокси, C3-C6гідроксициклоалкокси, C1-C6алкокси, C1C6галогеналкокси, C2-C6алкенілу, C2-C6алкінілу, S(=O)n(C1-C6алкіл), S(=O)n(C1-C6галогеналкіл), OSO2(C1-C6алкіл), OSO2(C1-C6галогеналкіл), C(=O)H, C(=O)OH, C(=O)NR xRy, (C1-C6алкіл)NRxRy, C(=O)(C1-C6алкіл), C(=O)O(C1-C6алкіл), C(=O)(C1-C6галогеналкіл), C(=O)(C3-C6циклоалкіл), C(=O)O(C3-C6циклоалкіл), C(=O)(C1-C6галогеналкіл), C(=O)(C2-C6алкеніл), C(=O)O(C2-C6алкеніл), (C1-C6алкіл)O(C1-C6алкіл), (C1-C6алкіл)S(C2-C6алкіл), C(=O)(C1-C6алкіл)C(=O)O(C1-C6алкіл), 4 UA 105175 C2 5 10 15 20 25 30 35 40 45 50 55 фенілу, фенокси, заміщеного фенілу і заміщеного фенокси (де такі заміщений феніл і заміщений фенокси містять один або декілька замісників, незалежно вибраних з H, OH, F, Cl, Br, I, CN, NO2, оксо, C1-C6алкілу, C1-C6галогеналкілу, C1-C6гідроксіалкілу, C3-C6циклоалкілу, C3C6галогенциклоалкілу, C3-C6гідроксициклоалкілу, C3-C6циклоалкокси, C3C6галогенциклоалкокси, C3-C6гідроксициклоалкокси, C1-C6алкокси, C1-C6галогеналкокси, C2C6алкенілу, C2-C6алкінілу, S(=O)n(C1-C6алкіл), S(=O)n(C1-C6галогеналкіл), OSO2(C1-C6алкіл), OSO2(C1-C6галогеналкіл), C(=O)H, C(=O)OH, C(=O)NRxRy, (C1-C6алкіл)NRxRy, C(=O)(C1-C6алкіл), C(=O)O(C1-C6алкіл), C(=O)(C1-C6галогеналкіл), C(=O)(C3-C6циклоалкіл), C(=O)O(C3C6циклоалкіл), C(=O)(C1-C6галогеналкіл), C(=O)(C2-C6алкеніл), C(=O)O(C2-C6алкеніл), (C1C6алкіл)O(C1-C6алкіл), (C1-C6алкіл)S(C1-C6алкіл), C(=O)(C1-C6алкіл)C(=O)O(C1-C6алкіл) фенілу і фенокси). В іншому варіанті здійснення даного винаходу: (b) Het являє собою імідазоліл, ізоксазоліл, 1,2,4-оксадіазоліл, 1,3,4-оксадіазоліл, оксазоліл, піперазиніл, піразиніл, піразоліл, піридазиніл, піридил, піримідиніл, піроліл, 1,2,3,4-тетразоліл, тіадіазоліл, тіазоліл, 1,2,4-триазиніл, 1,3,5-триазиніл, 1,2,3-триазоліл, 1,2,4-триазоліл, заміщений імідазоліл, заміщений 1,3,4-оксадіазоліл, заміщений піперазиніл, заміщений піразоліл, заміщений піримідиніл і заміщений 1,2,4-триазоліл, де зазначені заміщені групи містять один або декілька замісників, незалежно вибраних з F, Cl, Br, I, CN, NO 2, оксо, C1C6алкілу, C1-C6галогеналкілу, C1-C6гідроксіалкілу, C1-C6алкокси, C1-C6галогеналкокси, C2C6алкенілу, S(=O)n(C1-C6алкіл), S(=O)n(C1-C6галогеналкіл), OSO2(C1-C6галогеналкіл), C(=O)O(C1C6алкіл) і (C1-C6алкіл)S(C1-C6алкіл). В іншому варіанті здійснення даного винаходу: (b) Het являє собою імідазоліл, ізоксазоліл, 1,2,4-оксадіазоліл, піразиніл, піримідиніл, тіазоліл, 1,3,5-триазиніл, 1,2,4-триазоліл, заміщений імідазоліл, заміщений піразоліл і заміщений 1,2,4-триазоліл, де зазначені заміщені групи містять один або декілька замісників, незалежно вибраних з оксо, C1-C6алкілу, C1-C6галогеналкілу, C2-C6алкенілу і C(=O)O(C1C6алкіл). В іншому варіанті здійснення даного винаходу: (c) Ar2 являє собою феніл, піридазиніл, піридил, тієніл, заміщений феніл, заміщений піридазиніл, заміщений піридил або заміщений тієніл, де зазначені заміщений феніл, заміщений піридазиніл, заміщений піридил і заміщений тієніл, містять один або декілька замісників, незалежно вибраних з F, Cl, Br, I, CN, NO2, C1-C6алкілу, C1-C6галогеналкілу, C1-C6гідроксіалкілу, C1-C6галогеналкокси, C2-C6алкенілу, S(=O)n(C1-C6алкіл), S(=O)n(C1-C6галогеналкіл), OSO2(C1C6галогеналкіл), C(=O)(C1-C6алкіл), (C1-C6алкіл)S(C1-C6алкіл) і фенокси (де такий заміщений фенокси має один або декілька замісників, незалежно вибраних з F, Cl, Br або I). В іншому варіанті здійснення винаходу: (c) Ar2 являє собою заміщений феніл або заміщений піридил, де зазначені заміщений феніл і заміщений піридил містять один або декілька замісників, незалежно вибраних з F, Cl, Br, I, CN, NO2, C1-C6алкілу, C1-C6галогеналкілу, C1-C6гідроксіалкілу, C1-C6галогеналкокси, C2-C6алкенілу, S(=O)n(C1-C6алкіл), S(=O)n(C1-C6галогеналкіл), OSO2(C1-C6галогеналкіл), C(=O)(C1-C6алкіл), (C1C6алкіл)S(C1-C6алкіл) і фенокси (де такий заміщений фенокси має один або декілька замісників, незалежно вибраних з F, Cl, Br або I). В іншому варіанті здійснення винаходу: (c) Ar2 являє собою заміщений феніл, де зазначений заміщений феніл має один або декілька замісників, незалежно вибраних з F, Cl, Br, I, C 1-C6алкілу, C1-C6галогеналкілу і C1C6алкокси. В іншому варіанті здійснення даного винаходу: (d) J являє собою NR5, CR5 або C=O. В іншому варіанті здійснення даного винаходу: (f) K являє собою C=O, N, NR5 або C=S. В іншому варіанті здійснення даного винаходу: (h) R1 являє собою H або C1-C6алкокси. В іншому варіанті здійснення даного винаходу: (i) R2 являє собою H, C1-C6алкокси або C2-C6алкенілокси. В іншому варіанті здійснення даного винаходу: (j) R3 являє собою C1-C6алкокси. В іншому варіанті здійснення даного винаходу: (k) R4 являє собою H, C1-C6алкіл, C1-C6алкокси або (C1-C6алкіл)O(C1-C6алкіл). В іншому варіанті здійснення даного винаходу: 5 UA 105175 C2 5 10 15 20 25 30 35 40 45 50 55 60 (l) R5 являє собою H, C1-C6алкіл, C1-C6галогеналкіл, C1-C6гідроксіалкіл, C2-C6алкеніл, C(=O)(C1-C6алкіл), (C1-C6алкіл)O(C1-C6алкіл) і C(=O)(C1-C6алкіл)C(=O)O(C1-C6алкіл). В іншому варіанті здійснення даного винаходу: (l) R5 являє собою H, C1-C6алкіл, C1-C6алкокси або C1-C6галогеналкіл. В іншому варіанті здійснення винаходу: (a) Ar1 являє собою феніл, піридил, тієніл, заміщений феніл, заміщений піридазиніл або заміщений піридил, де зазначений заміщений феніл має один або декілька замісників, незалежно вибраних з F, Cl, Br, I, CN, CH3, C3H7, C4H9, OCH3, OC4H9, CF3, C2F5, C3F7, OCF3, OC2F5, OCH2CF3, OCF2CHF2, SCF3, SCH3, S(=O)CF3, S(=O)2CF3, OPhCl і C(OH)C2H5; де зазначений заміщений піридазиніл має один або декілька Cl, де зазначений заміщений піридил має один або декілька замісників, незалежно вибраних з F, Cl, I, CF3, OCF3, OCF2CHFCF3 і OCH2CF3. В іншому варіанті здійснення даного винаходу: (b) Het являє собою імідазоліл, ізоксазоліл, 1,3,4-оксадіазоліл, піразиніл, піразолініл, піразоліл, піридил, піримідиніл, піроліл, 1,2,3,4-тетразоліл, тіазоліл, 1,3,5-триазиніл, 1,2,3триазоліл, 1,2,4-триазоліл, заміщений піразолініл, заміщений піримідиніл або заміщений 1,2,4триазоліл, де зазначений заміщений піразоліл має один або декілька замісників, незалежно вибраних з H, CH3, C3H7, C(=O)OCH3, C(=O)OC2H5 і C(=O)OC4H9, де зазначений заміщений піримідиніл має один або декілька замісників, незалежно вибраних з CF3 і C3F7, де зазначений заміщений 1,2,4-триазоліл має один або декілька замісників, що вибрані з CH3 і оксо. В іншому варіанті здійснення даного винаходу: (c) Ar2 являє собою феніл, тієніл або заміщений феніл, де зазначений заміщений феніл має один або декілька замісників, незалежно вибраних з F, Cl, OCH3 і CF3. В іншому варіанті здійснення даного винаходу: (d) J являє собою NH, CH, CCH3 або C=O. В іншому варіанті здійснення даного винаходу: (h) R1 являє собою OCH3 або OC2H5. В іншому варіанті здійснення даного винаходу: (i) R2 являє собою OCH2CH=CH2, OCH3, OC2H5, OC3H7 або OC4H9. В іншому варіанті здійснення даного винаходу: (j) R3 являє собою OH, OCH3, OC2H5 або OC3H7; В іншому варіанті здійснення даного винаходу: (k) R4 являє собою CH3 або CH2OCH3. В іншому варіанті здійснення даного винаходу: (a) Ar1 являє собою фураніл, феніл, піридазиніл, піридил, піримідиніл, тієніл, заміщений фураніл, заміщений феніл, заміщений піридазиніл, заміщений піридил, заміщений піримідиніл або заміщений тієніл, де зазначені заміщений фураніл, заміщений феніл, заміщений піридазиніл, заміщений піридил, заміщений піримідиніл і заміщений тієніл, містять один або декілька замісників, незалежно вибраних з H, F, Cl, Br, I, CN, NO 2, оксо, C1-C6алкілу, C2C6алкенілу, C2-C6алкінілу, C1-C6алкокси, C1-C6галогеналкілу, C1-C6галогеналкокси, S(=O)n1C6алкілу, S(=O)n1-C6галогеналкілу, OSO2C1-C6галогеналкілу, C(=O)OC1-C6алкілу, C(=O)C1C6алкілу, C(=O)C1-C6галогеналкілу, фенілу, фенокси, галогенфенокси і C1-C6гідроксіалкілу; (b) Het являє собою 5- або 6-членне насичене або ненасичене гетероциклічне кільце, що містить один або декілька гетероатомів, незалежно вибраних з азоту, сірки або кисню, і де Ar 1 і Ar2 не знаходяться в ортоположенні відносно один одного (але можуть знаходитися в мета- або параположенні, наприклад, для 5-членного кільця це 1,3-положення, і для 6-членного кільця це або 1,3-, або 1,4-положення, відповідно), і де зазначене гетероциклічне кільце також може бути заміщене одним або декількома замісниками, незалежно вибраними з H, F, Cl, Br, I, CN, NO 2, оксо, C1-C6алкілу, C2-C6алкенілу, C2-C6алкінілу, C1-C6алкокси, C1-C6галогеналкілу, C1C6галогеналкокси, S(=O)n1-C6алкілу, S(=O)n1-C6галогеналкілу, OSO2C1-C6галогеналкілу, C(=O)OC1-C6алкілу, C(=O)C1-C6алкілу, C(=O)C1-C6галогеналкілу, фенілу, фенокси, галогенфенокси і C1-C6гідроксіалкілу; (c) Ar2 являє собою фураніл, феніл, піридазиніл, піридил, піримідиніл, тієніл, заміщений фураніл, заміщений феніл, заміщений піридазиніл, заміщений піридил, заміщений піримідиніл або заміщений тієніл, де зазначені заміщений фураніл, заміщений феніл, заміщений 6 UA 105175 C2 5 10 15 20 25 30 35 40 45 50 піридазиніл, заміщений піридил, заміщений піримідиніл і заміщений тієніл містять один або декілька замісників, незалежно вибраних з H, F, Cl, Br, I, CN, NO 2, оксо, C1-C6алкілу, C2C6алкенілу, C2-C6алкінілу, C1-C6алкокси, C1-C6галогеналкілу, C1-C6галогеналкокси, S(=O)n1C6алкілу, S(=O)n1-C6галогеналкілу, OSO2C1-C6галогеналкілу, C(=O)OC1-C6алкілу, C(=O)C1C6алкілу, C(=O)C1-C6галогеналкілу, фенілу, фенокси, галогенфенокси і C1-C6гідроксіалкілу; (d) J являє собою O, N, NR5, CR5 або C=O; (e) L являє собою одинарний або подвійний зв'язок; (f) K являє собою CR5, C=O, N, NR5 або C=S; (g) Q являє собою O або S; (h) R1 являє собою C1-C6алкіл, C1-C6алкіл-O-C1-C6алкіл, C1-C6галогеналкіл, галоген, оксо, C1-C6галогеналкокси, C1-C6алкіл-O-C1-C6алкокси, H, OH, C1-C6алкокси, C2-C6алкенілокси; (i) R2 являє собою C1-C6алкіл, C1-C6алкіл-O-C1-C6алкіл, C1-C6галогеналкіл, галоген, оксо, C1C6галогеналкокси, C1-C6алкіл-O-C1-C6алкокси, H, OH, C1-C6алкокси, C2-C6алкенілокси; (j) R3 являє собою C1-C6алкіл, C1-C6алкіл-O-C1-C6алкіл, C1-C6галогеналкіл, галоген, оксо, C 1C6галогеналкокси, C1-C6алкіл-O-C1-C6алкокси, H, OH, C1-C6алкокси, C2-C6алкенілокси; (k) R4 являє собою C1-C6алкіл, C1-C6алкіл-O-C1-C6алкіл, C1-C6галогеналкіл, H, C1-C6алкокси, C1-C6галогеналкокси, C2-C6алкенілокси; (l) R5 являє собою H або C1-C6алкіл; і (m) n = 0, 1 або 2. Незважаючи на те, що представлені ці варіанти здійснення винаходу, можливі й інші варіанти здійснення і сполучення даних представлених варіантів здійснення й інших варіантів здійснення. ОДЕРЖАННЯ ПІРАНОЗОПРОМПКНИХ СПОЛУК Для одержання сполук за даним винаходом може бути використана широка розмаїтість піраноз (у вигляді різних структурних форм, наприклад, D і L). Наприклад, може бути використаний наступний невичерпний перелік піраноз: рибоза, арабіноза, ксилоза, ліксоза, рубілоза, ксилулоза, алоза, альтроза, глюкоза, маноза, гулоза, ідоза, галактоза, талоза, псикоза, фруктоза, сорбоза, тагатоза, фукоза, мікароза, хіновоза, олеандроза, рамноза і паратоза. У більшості прикладів, представлених нижче, для одержання піранозопроміжних сполук використовували L-рамнозу. Звичайно, піранозопроміжні сполуки можуть бути одержані в такий спосіб (використовуючи L-рамнозу як приклад). O-алкіловані похідні рамнози можуть бути одержані виходячи з комерційно доступних L-рамнози або гідрату L-рамнози, використовуючи алкілйодид і порошкоподібний гідроксид калію в сухому диметилсульфоксиді (ДМСО) при температурі від 5°C до 15°C. Цілком алкілований продукт потім виділяли за допомогою екстракції диметилсульфоксидного розчину гексаном, потім концентруванням гексанового шару у вакуумі. Цей проміжний продукт, алкілпіранозид, потім обробляли прямо водною HCl або іншою водною кислотою, що утворює вільний гідроксицукор, звичайно у вигляді суміші α- і β-аномерів. Альтернативно, пералкілована L-рамноза може бути виділена гідролізом спіносаду (spinosad) або іншого три-(O-алкіл)рамнозилованого природного продукту, використовуючи умови, подібні тим, що описані для виділення метилолеандрозиду з авермектину B 2 (Loewe et al. J. Org. Chem. 1994, 59, 7870). Таким чином, обробка технічного спіносаду надлишком концентрованої сірчаної кислоти в сухому метанолі (MeOH) приводить до гідролізу цукру рамнози і перетворення в метилпіранозид. Чистий метилпіранозид потім може бути вилучений з реакційного середовища вичерпною екстракцією гексаном або іншим вуглеводним розчинником. Чистий рамнопіранозид потім може бути виділений із загальним виходом прибл. 65–75% за допомогою перегонки сирої в‘язкої рідини у вакуумі. 3-O-етил-2,4-ди-O-метил рамноза може бути одержана тим же способом, виходячи зі спінетораму. Інші алкіловані похідні можуть бути одержані подібним чином, виходячи з похідних спінозоїдів з відповідними функціональними групами, що одержані з будь-якого представника спіносину (спіносин), що має одну або декілька вільних гідроксильних груп, приєднаних до рамнози (наприклад, спіносин J), використовуючи умови, описані в документі DeAmicis et al. U.S. Patent 6001981, 1999. 7 UA 105175 C2 5 10 Попередник рамнози, що селективно алкілований більш об'ємним замісником у C3, був описаний (дивися, наприклад, Pozsgay et al. Can. J. Chem. 1987, 65, 2764). Альтернативний шлях, що дозволяє використовувати реагенти на основі олова, описаний нижче. Взаємодія метилпіранозиду L-рамнози з одним еквівалентом фенілборонової кислоти або трифенілбороксолу, в умовах, що дозволяють видаляти воду, приводять до утворення боронацеталю. Обробка даного ацеталю алкілгалогенідом і оксидом срібла в полярному апротонному розчиннику, такому як диметилформамід, при температурі від 0°C до 110°C приводить до селективного алкілування на C3-OH, даючи 3-O-алкілметилпіранозид. Даний продукт потім може бути далі метилований у положеннях 2-OH і 4-OH за допомогою метил йодиду, використовуючи умови, описані раніше. Цілком алкілована рамноза потім може бути гідролізована, як описано вище, з одержанням 2,4-ди-O-метил-3-O-алкіл-L-рамнози. 15 20 25 30 Ілюстрація способів одержання таких піранозопроміжних сполук дана в прикладах. Також можуть бути одержані гідроксиламіно піранозопроміжні сполуки. Наприклад, вони можуть бути одержані виходячи з відповідного похідного рамнози і N-гідрокси сукциніміду (NHS) в умовах, при яких вода, що утворюється, видаляється азеотропно, даючи адукт Nсукцинімідоїл гідроксиламін. В одному варіанті здійснення, ці умови включають об'єднання рамнози і NHS у толуолі або бензолі, додавання каталітичної кількості кислоти, такої як птолуолсульфонова кислота (TsOH), і нагрівання при кип'ятінні зі зворотним холодильником в апараті, забезпеченому пристроєм Діна-Старка. Перетворення у вільний гідроксиламіновий проміжний продукт здійснюють шляхом обробки сукцинімідоїльного адукту надлишком гідразингідрату або безводним гідразином у спиртовому розчиннику, такому як метанол (MeOH) або етанол (EtOH). Взаємодія O-рамнозилгідроксиламіну з альдегідом або кетоном, використовуючи EtOH або інший розчинник на основі нижчого спирту при температурі від кімнатної до кип'ятіння зі зворотним холодильником, приводить до одержання Oрамнозилоксиму. 8 UA 105175 C2 5 10 15 20 ОДЕРЖАННЯ ТРИАРИЛПРОМІЖНИХ СПОЛУК Сполуки за даним винаходом одержують зв'язуванням описаних вище піраноз із триарилпроміжним продуктом, Ar1-Het-Ar2, за допомогою ковалентного лінкера J[L]KQ (описаного вище). Для одержання сполук за даним винаходом може бути використане широке різноманіття триарилових попередників, за умови, що вони містять придатну функціональну групу на Ar2, до якої може бути приєднаний проміжний продукт піранози для утворення ковалентного лінкера. Придатні функціональні групи включають аміно, оксоалкіл, форміл або карбоксильну групу. Ці триарилпроміжні сполуки можуть бути одержані способами, раніше описаними в хімічній літературі. Деякі з цих способів описані нижче. Проміжні сполуки, де ‘Het’ являє собою дизаміщений піридин, піримідин, піразин або піридизин, можуть бути одержані шляхом конденсації галоген- або алкілтіозаміщених піридину, піримідину або піразину з арилбороновою кислотою або боратним ефіром, в умовах арилування по Сузукі. Дивися, наприклад, наступні документи. Для піридинів: Couve-Bonnaire et al. Tetrahedron 2003, 59, 2793 and Puglisi et al. Eur, J. Org. Chem. 2003, 1552. Для піразинів: Schultheiss and Bosch Heterocycles 2003, 60, 1891. Для піримідинів: Qing et al. J. Fluorine Chem. 2003, 120, 21 and Ceide and Montalban Tetrahedron Lett. 2006, 47, 4415. Для 2,4-діарилпіримідинів: Schomake rand Delia, J. Org.Chem. 2001, 66, 7125. Таким чином, наступні арилування, що каталізуються паладієм, використовуючи 4формілфенілборонову кислоту і 4-трифторметоксифенілборонову кислоту, може привести до одержання практично будь-якої конкретної моделі заміщення, як показано на схемі нижче: 25 30 Умови: a) 4-трифторметоксифенілборонова кислота, (Ph3P)4Pd; b) 4-формілфенілборонова кислота, (Ph3P)4Pd. 9 UA 105175 C2 Подібним же чином, діарилпіридини і піразини й інші дигалогеновані гетероциклічні ароматичні сполуки можуть бути одержані, виходячи з дигалогенованих піридинів і піразинів і інших дигалогенованих гетероциклічних ароматичних сполук, використовуючи той же метод: 5 10 15 Умови: a) 4-трифторметоксифенілборонова кислота, (Ph3P)4Pd; b) 4-формілфенілборонова кислота, (Ph3P)4Pd; С) 4-нітрофенілборонова кислота, (Ph3P)4Pd. Галоген- або алкілтіопіримідинові і піридинові попередники є або комерційно доступними, або можуть бути синтезовані шляхами, описаними в літературі (Rorig and Wagner U.S. Patent 3149109, 1964; Kreutzberger and Tesch Arzneim.-Forsch. 1978, 28, 235). Сполуки, де ‘Het’ являє собою 1,3-діарил-6-перфторалкілпіримідин, можуть бути одержані відповідно до наступної схеми. 2-Метилтіозаміщений піримідин арилували в модифікованих умовах реакції по Сузукі (Liebeskind and Srogl Org. Lett. 2002, 4, 979) з одержанням 2фенілпіримідинів, що потім відновлювали до відповідних анілінів, використовуючи, наприклад, каталізатор Pd/C у EtOH в атмосфері водню. 20 25 Проміжні сполуки, де ‘Het’ являє собою 1,3-дизаміщений 1,2,4-триазол, можуть бути одержані відповідно до однієї з наступних схем. Шлях A: 1,3-діарил 1,2,4-триазоли одержували з відповідних -NH 3-арил 1,2,4-триазолів відповідно до наступного опублікованого методу N-арилування імідазолів (Lin et al. J. Org. Chem. 1979, 44, 4160). Конденсацію 1,2,4-триазолів з арил галогенідами здійснювали при підвищеній температурі або, переважно, в умовах мікрохвильового опромінення (Antilla et al. J. Org. Chem. 2004, 69, 5578). (DIBAL являє собою діізобутилалюміній гідрид). 10 UA 105175 C2 5 10 15 Шлях B: Бромування гідразонів з наступною обробкою бромгідразону тетразолом приводить до утворення 1,3-діарил 1,2,4-триазолу (Butler і Fitzgerald J. Chem. Soc., Perkin Trans. 1 1988, 1587). Шлях C: 1,2,4-Триазольні сполуки, у яких 5-е положення заміщене далі алкілом або заміщеною алкільною групою, можуть бути одержані відповідно до наступної схеми (Paulvannan and Hale Tetrahedron 2000, 56, 8071): Сполуки, де ‘Het’ являє собою імідазол, можуть бути одержані відповідно до однієї з наступних схем: Шлях A (Стадія 1: Lynch et al. J. Am. Chem. Soc. 1994, 116, 11030. Стадія 2: Liu et al. J. Org. Chem. 2005, 70, 10135): 11 UA 105175 C2 5 10 15 20 Шлях B. Для галоген-арильних груп, що містять також активуючу групу, таку як нітро або ціано, заміну арилгалогеніду на імідазол, використовуючи основу, таку як карбонат калію, у полярному апротонному розчиннику, такому як N,N-диметилформамід (ДМФ) або диметилсульфоксид (ДМСО), може бути здійснена в такий спосіб (Bouchet et al., Tetrahedron 1979, 35, 1331): Шлях C: Слідуючи способу, вперше описаному Porretta et al. (Farmaco, Edizione Scientifica 1985, 40, 404), N-фенациланілін обробляли тіоціанатом калію в кислому середовищі (HCl) і одержаний 2-меркапто імідазол потім перетворювали в десульфований діарил імідазол шляхом обробки азотною кислотою в оцтовій кислоті. Шлях D. N-арилування 4-бромімідазолу в умовах мікрохвильового опромінення (шлях A, стадія 2) давали проміжну сполуку 1-арил-4-бромімідазол, що перетворювали в триарилпроміжні сполуки шляхом обробки арилборними кислотами в каталізованих паладієм умовах. Сполуки, де ‘Het’ являє собою 1,4-дизаміщений 1,2,3-триазол, можуть бути одержані відповідно до наступної схеми (Feldman et al. Org Lett. 2004, 6, 3897): Сполуки, де ‘Het’ являє собою 3,5-дизаміщений 1,2,4-триазол, можуть бути одержані відповідно до наступної схеми (Yeung et al. Tetrahedron Lett. 2005, 46, 3429): 25 12 UA 105175 C2 Сполуки, де ‘Het’ являє собою 1,3-дизаміщений 1,2,4-триазолін-5-он, можуть бути одержані відповідно до наступної схеми (Pirrung and Tepper J. Org. Chem. 1995, 60, 2461 and Lyga Synth. Commun. 1986, 16, 163). (DPPA являє собою дифенілфосфорилазид.): 5 Сполуки, де 'Het' являє собою 1,3-діарил піразолін, можуть бути одержані відповідно до наступної схеми. Моногідразон альдегіду терефталевої кислоти обробляли NCS у ізо-PrOH і одержаний проміжний хлоргідразон прямо обробляли основою і заміщеним олефіном з одержанням піразоліну: 10 Сполуки, де 'Het' являє собою 3,5-дизаміщений ізоксазол, можуть бути одержані відповідно до наступної схеми: 15 20 Сполуки, де 'Het' являє собою 1,3-дизаміщений піразол, можуть бути одержані відповідно до наступної схеми. Конденсацію піразолу з галогенованими ароматичними похідними здійснювали, використовуючи умови мікрохвильового опромінення, описані Liu et al., шлях A, стадія 2, вище. (DMA являє собою диметилацеталь). Сполуки, де ‘Het’ являє собою 2,4-дизаміщений триазол, одержували конденсуванням тіоаміду з α-галогенацетофеноном у протонному розчиннику, такому як етанол (наприклад, Potts and Marshall J. Org. Chem. 1976, 41, 129). 13 UA 105175 C2 Сполуки, де ‘Het’ являє собою 1,4-дизаміщений 1,2,4-триазолін-5-он, одержували відповідно до наступної схеми (Henbach DE 2724819 A1, 1978, з незначним модифікуванням у двох стадіях): 5 10 15 Сполуки, де ‘Het’ являє собою 2,4-дизаміщений оксозолін, одержували виходячи з αбромацетофенону відповідно до наступної схеми (Periasamy et al. Синтез 2003, 1965 and Liu et al. J. Am. Chem. Soc. 2007, 129, 5834). Сполуки, де ‘Het’ являє собою 2,5-дизаміщений оксозолін, одержували відповідно до наступної схеми (Favretto et al. Tetrahedron Lett. 2002, 43, 2581 and Liu et al. J. Am. Chem. Soc. 2007, 129, 5834): 14 UA 105175 C2 Сполуки, де ‘Het’ являє собою 1,4-дизаміщений піперазин, одержували відповідно до наступної схеми (Evans et al. Tetrahedron Lett. 1998, 39, 2937): 5 10 15 Сполуки, де ‘Het’ являє собою 1,3-дизаміщений піразолін, одержували додаванням арилгідразину до β-диметиламінопропіофенону, як показано на наступній схемі, що описана в роботах Linton et al. Tetrahedron Lett. 2007, 48, 1993, і Wheatley et al. J. Am. Chem. Soc. 1954, 76, 4490. При додаванні до піразоліну мінімального по кількості біс-додавання приводить до відповідного диметиламінометил піразоліну. Ці продукти можуть бути розділені хроматографічно. Сполуки, де ‘Het’ являє собою 3,5-дизаміщений 1,2,4-триазин, одержували відповідно до наступної схеми (Reid et al. Bioorg. Med. Chem. Lett. 2008, 18, 2455 and Saraswathi and Srinivasan Tetrahedron Lett. 1971, 2315): 20 15 UA 105175 C2 5 Сполуки, де 'Het' являє собою 2-кетопіперазин або 2,5-дикетопіперазин, одержували як описано на наступній схемі. Нітрофеніловий складний ефір гліцину може бути ацилований, використовуючи хлорацетилхлорид, і проміжний N-хлорацетилований складний ефір гліцину при обробці аніліном піддається заміні і замиканню кільця при температурі від 120 до 180°C з утворенням дикетопіперазину. Альтернативно, монокето насичені або ненасичені піперазини можуть бути одержані з проміжного ацеталю, нижче, гідролізом і замиканням кільця. 10 ОДЕРЖАННЯ ОКСИМЛІНКЕРНИХ СПОЛУК Оксимлінкерні сполуки можуть бути одержані виходячи з відповідних арилальдегідів або кетонів шляхом взаємодії з відповідним 2-гідроксиламіноцукром в органічному розчиннику, такому як MeOH або EtOH, при температурі між 0 і 100°C. 15 ОДЕРЖАННЯ (ТІО)КАРБАМАТЛІНКЕРНИХ СПОЛУК Карбамат- або тіокарбаматлінкерні сполуки можуть бути одержані виходячи з відповідних ариламінів шляхом перетворення або в ізоціанат, ізотіоціанат, або в п-нітрофенілкарбамат, з наступною обробкою відповідним спиртом (ROH) і органічною або неорганічною основою в придатному розчиннику, такому як тетрагідрофуран (ТГФ), при температурі між 0 і 100°C. Альтернативно, проміжний ізоціанат може бути одержаний виходячи з карбонової кислоти шляхом обробки джерелом азиду, таким як дифенілфосфорилазид (DPPA). Ацилазид потім може бути підданий перегрупуванню Куртіуса шляхом нагрівання до 110°C у толуолі, і одержаний ізоціанат обробляли відповідним цукром, і основа, як описано вище, давала карбамат. 20 25 16 UA 105175 C2 5 У цих реакціях, α-конфігурація в C1 групи рамнози звичайно притаманна основному продукту, хоча невелика кількість β-аномеру також утворюється. Ці два ізомери можуть бути розділені за допомогою хроматографії або вони можуть використовуватися у вигляді суміші. Карбамати можуть бути також одержані через нітрофеніл карбонати, як показано пізніше. Переважно обробляти піримідиніланілін спочатку сильною основою, такою як гексаметилдисилазид літію або калію (HMDS), а потім нітрофенілкарбонатом. пНітрофенілкарбонат може бути одержаний шляхом взаємодії напівацеталю три-Oметилрамнози з п-нітрофенілхлорформіатом у суміші піридин/діоксан. 10 15 20 Тіокарбамат похідні можуть бути одержані виходячи з S-алкіл рамнози, що виходить з рамнозилпіранозиду шляхом обробки реагентом Лавессона (Lawesson) (Bernardes et al. Angew. Chem. Int. Ed. 2006, 45, 4007). Обробка глікозилтіолу ізоціанатом або п-нітрофенілкарбаматом і органічною основою, такою як триетиламін, дає тіокарбамат. ОДЕРЖАННЯ ГІДРОКСАМАТЛІНКЕРНИХ СПОЛУК Ефіри гідроксамової кислоти - лінкерні сполуки можуть бути одержані шляхом обробки хлорангідриду кислоти гідроксиламіном і органічною основою, такою як триетиламін: 17 UA 105175 C2 5 10 15 20 25 30 35 40 45 Одержання сполук в обсязі домагань даного винаходу може бути здійснене синтезом відповідного проміжного триарилу, що містить кислотну, альдегідну, кетонну або амінно функціональну групу для приєднання до проміжної піранози. ПРИКЛАДИ Дані приклади наведені в ілюстративних цілях і не повинні розглядатися як такі, що обмежують винахід, описаний у даному документі, тільки представленими варіантами здійснення. Приклад 1 Одержання (3R,4R,5S,6S)-2,3,4,5-тетраметокси-6-метилтетрагідропірану (сполука E-1) Розчин гідрату L-рамнози (40 г, 0,22 моль) у 450 мл сухого диметилсульфоксиду поміщали в дволітрову 3-горлу круглодонну колбу і перемішували за допомогою механічної мішалки, у цей час однією порцією додавали порошкоподібний KOH (75 г, 1,34 моль). До цього розчину додавали йодметан (187 г, 1,32 моль) з такою швидкістю, щоб температура розчину підтримувалася нижче 30°C. Для підтримання даної температури періодично підставляли і забирали баню сухий лід-ацетон. Після завершення додавання (приблизно 2 години) розчин перемішували ще 3 години, потім залишали стояти при кімнатній температурі протягом ночі. Цей прозорий розчин потім екстрагували за допомогою 4500 мл гексану й об'єднаний гексановий розчин промивали насиченим сольовим розчином, потім висушували й упарювали розчинник. У такий спосіб одержували 44 г (92%) розчину світложовтогарячого кольору. Перегонка давала 40 г безбарвної олії, темп. кипіння 150°C (0,5 мм рт. ст.). Приклад 2 Одержання (3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагідропіран-2-олу (сполука E-2) Розчин 35,7 г (0,162 моль) E-1 у 300 мл 2 н соляної кислоти нагрівали при температурі 98°C протягом 5 годин, потім охолоджували до кімнатної температури й екстрагували за допомогою чотирьох 170-мілілітрових порцій дихлорметану (DCM). Об'єднані екстракти сушили над сульфатом магнію і знебарвлювали за допомогою активованого вугілля. Концентрування давало 24,7 г (74%) зазначеної в заголовку сполуки у вигляді смолистої олії. Частину сирого продукту (960 мг) піддавали вакуумній перегонці, використовуючи апарат Кугельрора, збираючи 890 мг при температурі 145-155C (1-2 мм). Приклад 3 Одержання (3R,4R,5S,6S)-4-етокси-2,3,5-триметокси-6-метилтетрагідропірану (сполука E-3) Сірчану кислоту (300 мл, 98%, 5,6 моль) повільно додавали до перемішуваного розчину 2,5 л метанолу в чотирилітровій посудині Ерленмейєра. Після того, як розчин охолов до температури навколишнього середовища, додавали 3’-OEt спіносин J/L (350 г, 0,47 моль, одержаний, як описано в документі DeAmicis et al., U.S. Patent 6001981, 1999), і одержаний розчин нагрівали при температурі кипіння зі зворотним холодильником протягом 6 годин. Охолоджений розчин переносили в чотирилітрову розділювальну лійку й екстрагували за допомогою 31 л гексану. Об'єднаний органічний розчин сушили і концентрували у вакуумі, потім переганяли, використовуючи апарат Кугельрора. У такий спосіб одержували 65 г (60%) безбарвної олії, темп. кипіння 165°C (при 10 мТорр). Приклад 4 Одержання (2R,3R,4R,5S,6S)-2,3,5-триметокси-6-метил-4-пропокситетрагідропірану (сполука E-5) 18 UA 105175 C2 5 10 15 20 25 30 35 40 Стадія 1. (2R,3R,4R,5R,6S)-2-метокси-6-метил-4-пропокситетрагідропіран-3,5-діол. Випливаючи з способу, описаного в роботі Aoyama et al. (Tetrahedron Lett. 1997, 38, 5001) для одержання 3,4-боронатного складного ефіру метил α-L-фукопіранозиду, метил α-Lрамнопіранозид перетворювали в 2,3-боронатний складний ефір. Сирий складний ефір (10,0 г, 37,7 ммоль) розчиняли в 150 мл толуолу й обробляли йодпропаном (8,0 г, 47 ммоль), оксидом срібла (21,8 г, 94,3 ммоль) і триетиламіном (4,47 г, 47,1 ммоль). Розчин нагрівали до температури 100°C і залишали перемішуватися протягом ночі (16 годин). Після охолодження і фільтрування розчин концентрували до смолистої олії й очищали за допомогою хроматографії на силікагелі, елююючи градієнтом суміші EtOAc-гексан з одержанням 5,9 г чистого продукту. Стадія 2. Продукт зі стадії 1 піддавали метилуванню, використовуючи Me і KOH, в умовах, описаних у прикладі 1, з одержанням сполуки E-4. Проміжні піранози, представлені в таблиці 1 (сполуки E-1 через E-E-22), одержували способами, описаними раніше і проілюстрованими в прикладах 1-4. Приклад одержання проміжної 2-O-сукцинімідоїл піранози описаний нижче. Приклад 5 Одержання 1-((2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагідропіран-2ілокси)піролідин-2,5-діону (сполука E-23) До переміщуваного розчину 2,3,4-три-O-метил-L-рамнози (6,5 г, 31,5 ммоль) і Nгідроксисукциніміду (5,4 г, 47 ммоль) у 50 мл бензолу додавали 50 мг (кат.) птолуолсульфонової кислоти. Розчин нагрівали при кип'ятінні зі зворотним холодильником і відбирали воду, використовуючи насадку Діна-Старка. Через 4 години розчин охолоджували і поверхневий толуольний шар відокремлювали від невеликої кількості нерозчинної смоли. Органічний шар промивали 20 мл насиченого розчину NaHCO 3, потім сушили над MgSO4 і концентрували з одержанням твердого продукту. Перекристалізація із суміші ефір-гексан давала 4,95 г (52%) зазначеної в заголовку сполуки у вигляді твердого продукту не зовсім білого кольору. Приклад 6 Одержання 1-((2S,3R,4R,5S,6S)-5-гідрокси-3,4-диметокси-6-метилтетрагідропіран-2ілокси)піролідин-2,5-діону (сполука E-24) Розчин (2R,3R,4R,5S,6S)-5-бензилокси-3,4-диметокси-6-метилтетрагідропіран-2-олу (10,5 г, 26,6 ммоль, одержаний, як описано в роботі Wu et al. Carbohydr. Res. 1998, 306, 493), Nгідроксисукциніміду (5,0 г, 50 ммоль) і TsOH (250 мг, кат.) у 100 мл бензолу нагрівали при температурі кипіння зі зворотним холодильником протягом 24 годин з видаленням води, використовуючи насадку Діна-Старка. Коричневий розчин охолоджували, фільтрували, промивали насиченим розчином бікарбонату натрію і концентрували. Смолисту олія очищали за допомогою хроматографії на силікагелі, елююючи сумішшю 70:30 гексан:ацетон. Чистий Oсукцинімід (7,5 г, 14,5 ммоль) потім переносили в 500 мл апарат Парра для гідрування і дебензилували, використовуючи 0,95 г Pd(OH)2/C у 75 мл EtOH. Розчин, що обробляли при тиску 19 фунт на кв. дюйм воднем протягом 24 годин, потім фільтрували і концентрували, одержуючи твердий залишок, що перекристалізовували з EtOH з одержанням 3,25 г твердого продукту білого кольору. 19 UA 105175 C2 5 10 15 20 25 30 35 40 45 Проміжні O-сукцинімідилпіранози, представлені в таблиці 2 (сполуки E-23 через E-29), одержували способами, описаними раніше і проілюстрованими в прикладах 5 і 6. Приклад одержання проміжної 2-гідроксиламінопіранози виходячи з відповідної проміжної Oсукцинімідоїлпіранози описаний далі. Приклад 7 Одержання O-((2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагідропіран-2іл)гідроксиламіну (сполука E-30) Похідне 2,3,4-три-O-метил-N-сукцинімідил рамнози E-23 (0,50 г, 1,6 ммоль), одержане, як описано в прикладі 5, розчиняли в 5 мл абсолютного EtOH і обробляли надлишком гідразингідрату (0,4 г, 8 ммоль). Розчин залишали перемішуватися при кімнатній температурі протягом 60 хв., при цьому утворювався об'ємний осад білого кольору. Додавали ще 5 мл EtOH і розчин перемішували при кімнатній температурі протягом ночі. Розчин фільтрували і концентрували, потім очищали за допомогою хроматографії (100% EtOAc) з одержанням E-30 у вигляді кристалічного твердого продукту. Проміжні піранози, представлені в таблиці 3 (сполуки E-30 через E-38), одержували способами, описаними раніше і проілюстрованими в прикладі 7. Приклади 8-63 ілюструють одержання додаткових речовин, що можуть бути використані при різних варіантах здійснення даного винаходу. Приклад 8 Одержання 4-[1-(4-трифторметоксифеніл)-1H-пірол-3-іл]бензальдегіду Стадія 1. 1-(4-Трифторметоксифеніл)-1H-пірол. Сполуку одержували як описано в роботі Colotta et al. J. Med. Chem. 2006, 49, 6015. Розчин 4-трифторметоксифеніламіну (500 мг, 2,82 ммоль, 1,00 екв.) і 2,5-діетокситетрагідрофурану (452 мг, 2,82 ммоль, 1,00 екв.) у крижаній оцтовій кислоті (20 мл) нагрівали при температурі 90°C протягом 1 години, потім сушили на силікагелі. Залишок потім переводили в суспензію шляхом кип'ятіння зі зворотним холодильником у гексані, фільтрували гарячим і концентрували досуха, одержуючи бажану проміжну сполуку (519 мг, 81%). Стадія 2. 3-бром-1-(4-трифторметоксифеніл)-1H-пірол. Сполуку одержували як описано в роботі Bray et al. J. Org. Chem. 1990, 55, 6317. До розчину 1-(4-трифторметоксифеніл)-1H-піролу (519 мг, 2,29 ммоль, 1,00 екв.) у ТГФ (250 мл) при температурі -78°C додавали 0,05M розчину Nбромсукциніміду (408 мг, 2,29 ммоль, 1,00 екв.) у ТГФ протягом 45 хв. Посудину повільно нагрівали до кімнатної температури, потім концентрували з одержанням сирого бромпіролу , що показував за допомогою GC/MS вміст бажаної проміжної сполуки як 55%. Продукт використовували в наступній реакції без додаткового очищення. Стадія 3. 4-[1-(4-Трифторметоксифеніл)-1H-пірол-3-іл]бензальдегід. Суспензію сирого 3бром-1-(4-трифторметоксифеніл)-1H-піролу (356 мг, 1,26 ммоль, 1,00 екв.), 4формілфенілборонової кислоти (283 мг, 1,89 ммоль, 1,50 екв.), дихлориду біс(трифенілфосфін)паладію(II) (27 мг, 0,04 ммоль, 0,03 екв.), 2M Na 2CO3 (водн.) (1,26 мл, 2,52 ммоль, 2,0 екв.) і 1,4-діоксану (5 мл) нагрівали при температурі 150°C у посудині для мікрохвильового опромінення протягом 45 хв. Охолоджений розчин потім розбавляли EtOAc (20 мл), фільтрували через Celite®, концентрували досуха й очищали за допомогою хроматографії (2:2:1, гексан:EtOAc:ацетон) з одержанням бажаної проміжної сполуки (79 мг, 21%). Приклад 9 Одержання 4-[1-(4-трифторметоксифеніл)-4,5-дигідро-1H- піразол-3-іл]бензальдегіду Стадія 1. 1-(4-Трифторметоксифеніл)піразолідин-3-он. Сполуку одержували як описано в роботі Rees and Tsoi Chem. Commun. 2000, 415. Суспензію гідрохлориду (4 20 UA 105175 C2 5 10 15 20 25 30 35 40 45 50 трифторметоксифеніл)гідразину (300 мг, 1,32 ммоль, 1,00 екв.), 3-хлорпропіонілхлориду (167 мг, 1,32 ммоль, 1,00 екв.) і PS-DIEA (1,30 г, 5,28 ммоль, 4,00 екв.) у ТГФ (20 мл) перемішували при кімнатній температурі протягом 12 годин. Розчин потім фільтрували, концентрували досуха й очищали за допомогою хроматографії (2:2:1, гексан:EtOAc:ацетон) з одержанням бажаної проміжної сполуки (120 мг, 37%). Стадія 2. 3-хлор-1-(4-трифторметоксифеніл)-4,5-дигідро-1H-піразол. Скористалися загальним способом, описаним у роботі Wang et al. Tetrahedron Lett. 2005, 46, 2631. До розчину 1-(4-трифторметоксифеніл)піразолідин-3-ону (120 мг, 0,49 ммоль, 1,00 екв.) у толуолі (20 мл) повільно додавали фосфорилхлорид (22,5 мг, 1,47 ммоль, 3,00 екв.). Суміш потім нагрівали при температурі 80°C протягом 1 години, далі охолоджували до кімнатної температури і гасили за допомогою H2O (10 мл). Посудину перемішували в атмосфері N 2 протягом 8 годин, потім продукт екстрагували EtOAc (200 мл), сушили (MgSO 4) і концентрували при зниженому тиску. Аналіз GC/MS показував 88%-не утворення бажаної проміжної сполуки, яку використовували в наступних реакціях без додаткового очищення. Стадія 3. 4-[1-(4-Трифторметоксифеніл)-4,5-дигідро-1H-піразол-3-іл]бензальдегід. Суспензію 3-хлор-1-(4-трифторметоксифеніл)-4,5-дигідро-1H-піразолу (114 мг, 0,43 ммоль, 1,00 екв.), 4формілфенілборонової кислоти (97 мг, 0,65 ммоль, 1,50 екв.), дихлориду біс(трифенілфосфін)паладію(II) (10 мг, 0,01 ммоль, 0,03 екв.), 2M Na 2CO3 (водн.) (0,43 мл, 0,86 ммоль, 2,0 екв.) і 1,4-діоксану (5 мл) нагрівали при температурі 150°C у посудині для мікрохвильового опромінення протягом 45 хв. Охолоджений розчин потім розбавляли EtOAc (20 мл), фільтрували через Celite®, концентрували досуха й очищали за допомогою хроматографії (2:2:1, гексан:EtOAc:ацетон) з одержанням бажаної проміжної сполуки (50 мг, 0,15 ммоль, 31%). Приклад 10 Одержання 4-[1-(5-бром-2-хлорфеніл)-1H-імідазол-4-іл]бензальдегіду Стадія 1. 4-[1-(5-Бром-2-хлорфеніл)-1H-імідазол-4-іл]бензонітрил. Сполуку одержували як описано в роботі Liu et al. J. Org. Chem. 2005, 70, 10135. 4-(1H-імідазол-4-іл)бензонітрил (75 мг, 0,44 ммоль, одержаний виходячи з 4-(2-бромацетил)бензонітрилу, використовуючи спосіб, описаний Lynch et al. J. Am. Chem. Soc. 1994, 116, 11030), 4-бром-1-хлор-2-йодбензол (169 мг, 0,532 ммоль), Cs2CO3 (577 мг, 1,77 ммоль), Cu (3 мг, 0,013 ммоль), 8-гідроксихінолін (2 мг, 0,013 ммоль) і ДМФ/H2O (2 мл розчини 10:1) об‘єднували в 10 мл посудині для мікрохвильового опромінення (CEM Microwave), забезпеченій магнітною мішалкою, і піддавали мікрохвильовому опроміненню при температурі 150C протягом 30 хв. Вміст потім фільтрували і концентрували досуха, одержуючи проміжну сполуку 5-бром-2-хлорфеніл)-1H-імідазол-4-іл]бензонітрил (68 мг, 43%). Стадія 2. 4-[1-(5-Бром-2-хлорфеніл)-1H-імідазол-4-іл]бензальдегід. До суспензії нітрилу (68 мг, 0,19 ммоль) у DCM (3 мл) при температурі -78°C повільно додавали гідрид діізобутилалюмінію (DIBAL) у толуолі (0,48 мл, 0,475 ммоль). Крижану баню потім забирали, і температурі давали піднятися до 0-10°C, і її підтримували протягом 2 годин. Вміст знову охолоджували до -78°C і повільно підкисляли (p=6) за допомогою 1н HCl (водн.). Колбу нагрівали до температури навколишнього середовища протягом ночі, потім видаляли солі алюмінію, що залишилися, шляхом фільтрування. Фільтрат потім промивали H2O (5 мл), насиченим сольовим розчином (5 мл), сушили (Mg 2SO4) і концентрували досуха, одержуючи проміжну сполуку 1-(5-бром-2-хлорфеніл)-1H-імідазол-4-іл]бензальдегід (33 мг, 48%). Приклад 11 Одержання 4-[5-(4-пропілфеніл)ізоксазол-3-іл]бензальдегіду Стадія 1. 4-(гідроксіімінометил)бензонітрил. Сполуку одержували як описано в роботі Biasotti et al. Bioorg. Med. Chem. 2003, 11, 2247. Суспензію 4-формілбензонітрилу (500 мг, 3,81 ммоль, 1,00 екв.), гідрохлориду гідроксиламіну (290 мг, 4,19 ммоль, 1,10 екв.) і ацетату натрію (1,56 г, 19,05 ммоль, 5,00 екв.) у MeOH (50 мл) нагрівали при температурі 70°C протягом 4 годин, потім концентрували досуха. Залишок потім переводили в суспензію в Et 2O, фільтрували і концентрували з одержанням бажаної проміжної сполуки (496 мг, 3,39 ммоль, 89%). 21 UA 105175 C2 5 10 15 20 25 30 35 40 45 50 Стадія 2. 4-(Гідроксіімінобромметил)бензонітрил. Сполуку одержували як описано в роботі Tanaka et al. Bull. Chem. Soc. Jpn. 1984, 57, 2184. 0,05M розчин N-бромсукциніміду (724 мг, 4,07 ммоль, 1,20 екв.) у DCM додавали по краплях до охолодженого до 0°C розчину 4(гідроксіімінометил)бензонітрилу (496 мг, 3,39 ммоль, 1,00 екв.) у DCM (50 мл). Розчин нагрівали до кімнатної температури, потім у рівних обсягах розподіляли в дві різних реакційних посудини. Кожну посудину потім концентрували, і сирі залишки використовували без додаткового очищення. Стадія 3. 4-[5-(4-Пропілфеніл)ізоксазол-3-іл]бензонітрил. Розчин 4(гідроксіімінобромметил)бензонітрилу (381 мг, 1,70 ммоль), триетиламіну (0,71 мл, 5,10 ммоль, 3,0 екв.) і 1-етиніл-4-пропілбензолу (1,23 г, 8,50 ммоль, 5,0 екв.) у толуолі (20 мл) нагрівали при температурі 100°C протягом 1 години, потім концентрували досуха й очищали за допомогою звичайної фазової хроматографії з одержанням бажаної проміжної сполуки (108 мг, 22%). Відновлення нітрилу до відповідного альдегіду здійснювали відповідно до способу, що використовує DIBAL, описаного раніше. Приклад 12 Одержання 4-{1-[4-(1-гідроксипропіл)феніл]-1H-піразол-3-іл}бензальдегіду Стадія 1. 3-(4-Ціанофеніл)піразол. У круглодонну колбу, забезпечену механічною мішалкою і зворотним холодильником, додавали п-ціаноацетофенон (5 г, 34,44 ммоль) і диметилацеталь диметилформаміду (40 мл). Суміш перемішували при кип'ятінні зі зворотним холодильником протягом 5 годин, потім концентрували при зниженому тиску, що давало сирий проміжний диметиламіноакрилоїлбензонітрил. Залишок потім суспендували в мінімальному об‘ємі EtOH (~20 мл), додавали моногідрат гідразину (1,67 мл, 34,4 ммоль) і нагрівали при температурі 80°C протягом 30 хв., потім концентрували з одержанням сирого 3-(4-ціанофеніл)піразолу (5,59 г, 33 ммоль, 96%), ступінь чистоти якого була достатня для використання в наступній реакції. Стадія 2. 4-[1-(4-Пропіонілфеніл)-1H-піразол-3-іл]бензонітрил. 4-(1H-піразол-3іл)бензонітрил (100 мг, 0,591 ммоль), 1-(4-бромфеніл)-пропан-1-он (126 мг, 0,591 ммоль), Cs2CO3 (770 мг, 2,364 ммоль), Cu (4 мг, 0,018 ммоль), 8-гідроксихінолін (3 мг, 0,018 ммоль) і ДМФ/H2O (2 мл 10:1 розчин) об’єднували в 10 мл посудині для мікрохвильового опромінення (CEM Microwave), забезпеченій магнітною мішалкою, і піддавали мікрохвильовому опроміненню при температурі 150°C протягом 30 хв. Вміст потім фільтрували і концентрували досуха, одержуючи нітрил (158 мг, 0,508 ммоль, 86%). Відновлення нітрилу до відповідного альдегіду здійснювали відповідно до способу, що використовує DIBAL, описаного раніше. Приклад 13 Одержання діетилового ефіру 5-(4-формілфеніл)-2-(4-трифторметоксифеніл)-3,4-дигідро2H-піразол-3,4-дикарбонової кислоти Стадія 1. Одержання 4-[(4-трифторметоксифеніл)гідразонометил]бензальдегіду. Сполуку одержували як описано в роботі Paulvannan et al. Tetrahedron. 2000, 56, 8071. До перемішуваного розчину бензол-1,4-дикарбальдегіду (1,50 г, 11,2 ммоль, 1,0 екв.) у ізо-PrOH (250 мл) додавали гідрохлорид 4-трифторметокси)фенілгідразину (2,55 г, 11,2 ммоль, 1,0 екв.) вроздріб протягом 5 хв. Розчин перемішували при кімнатній температурі протягом 1 години, потім концентрували досуха й очищали за допомогою хроматографії (2:2:1, гексан:EtOAc:ацетон) з одержанням проміжної сполуки (2,48 г, 72%). Стадія 2. Синтез хлоргідразону. Проміжну сполуку одержували як описано в роботі Lokanatha Rai and Hassner Synth. Commun. 1989, 19, 2799. Розчин 4-[(4трифторметоксифеніл)гідразонометил]бензальдегіду (2,48 г, 8,05 ммоль, 1,00 екв.) і Nхлорсукциніміду (1,61 г, 12,08 ммоль, 1,5 екв.) у ізо-PrOH (100 мл) нагрівали при температурі 80°C протягом 1 години. Розчин потім охолоджували, і в рівних обсягах розподіляли в шість різних реакційних посудин так, щоб кожна містила 1,34 ммоль проміжної сполуки. Стадія 3. Синтез піразоліну. Сполуки одержували відповідно до способу, описаного Paulvannan et al. Tetrahedron 2000, 56, 8071. У кожну реакційну посудину додавали триетиламін (0,56 мл, 4,02 ммоль, 3,00 екв.) і відповідний акрилат (6,70 ммоль, 5,00 екв.). Посудини потім 22 UA 105175 C2 5 10 15 20 25 30 35 40 45 нагрівали при температурі 70°C протягом 90 хв, потім концентрували досуха й очищали за допомогою хроматографії (2:2:1, гексан:EtOAc:ацетон). Відновлення нітрилів до відповідних альдегідів здійснювали відповідно до способу, що використовує DIBAL, описаного раніше. Приклад 14 Одержання 4-{1-[4-(2,2,2-трифторетокси)феніл]-1H-імідазол-4-іл}бензальдегіду 4-(2-Бромацетил)бензонітрил (58 мг, 0,21 ммоль) і 4-(2,2,2-трифторетокси)феніламін (50 мг, 0,21 ммоль) об‘єднували в 100 мл посудині Ерленмейєра, забезпеченій магнітною мішалкою. Вміст розчиняли в 1 мл EtOH і перемішували при кімнатній температурі протягом 2 годин. Сирий проміжний продукт потім переносили в 100 мілілітрову круглодонну колбу, що містить KSCN (21 мг, 0,21 ммоль) і концентровану HCl (18 мкл, 0,21 ммоль). Посудину нагрівали при температурі 80°C протягом 1 години, потім її вміст виливали в 5 мл розчину 1:1 H 2O/NH4OH. Розчин залишали стояти протягом 24 годин, і потім твердий продукт фільтрували і промивали ефіром з одержанням проміжного імідазолтіолу (32 мг, 0,086 ммоль, 33%). Потім до суспензії імідазолтіолу в 2 мл оцтової кислоти додавали по краплях протягом 10 хв. водний розчин HNO 3 (1,35 мл, 0,387 ммоль) і KNO3 (1 мг, 0,003 ммоль). Після перемішування протягом 2 годин при кімнатній температурі, розчин виливали на подрібнений лід і нейтралізували (p=7) за допомогою 0,1н NaOH (водн.). Проміжний нітрил виділяли шляхом вакуумної фільтрації і сушили у вакуумній печі при 45°C протягом 12 годин (23 мг, 78%), т.пл. 179C. Відновлення до відповідного альдегіду здійснювали, використовуючи DIBAL, в умовах, описаних вище. Приклад 15 Одержання 4-[1-(4-пропілфеніл)-1H-імідазол-4-іл]бензальдегіду 4-Пропіланілін (2,70 г, 20 ммоль) додавали по краплях до розчину 4-ціанофенацилброміду (2,20 г, 10 ммоль) у 5 мл ДМФ. Цей розчин потім додавали до 20 мл гарячого (180°C) формамідного розчину протягом 5 хв., і цей розчин залишали перемішуватися при температурі 180°C протягом 2 годин. Охолоджений розчин потім виливали на 100 мл льоду й екстрагували за допомогою 275 мл ефіру. Після висушування і концентрування одержану темну олія очищали за допомогою хроматографії (3:1:2 гексан:EtOAc:DCM). Перший продукт (510 мг) був ідентифікований як 4-(5-пропіл-1H-індол-3-іл)бензонітрил, т.пл. 140°C. Друга фракція (275 мг) 1 була ідентифікована як бажаний імідазол. H ЯМР (400 MГц, CDCl3) δ 7,95 (д, J=6 Гц, 2H), 7,90 (с, 1H), 7,70 (д, J=6 Гц, 2H), 7,68 (с, 1H), 7,38 (д, J=4 Гц, 2H), 7,31 (д, J=4 Гц, 2H), 2,69 (т, J=8,9 Гц, 2H), 1,68 (г, 2H), 0,98 (т, J=7,5 Гц, 3H); т.пл. 133°C; ESIMS 288,1 (M+H). Відновлення до відповідного альдегіду здійснювали, використовуючи DIBAL, в умовах, 1 описаних вище. H ЯМР (300 MГц, CDCl3) δ 10,02 (с, 1H), 8,03 (д, J=6 Гц, 2H), 7,92 (д, J=6 Гц, 2H), 7,90 (с, 1H), 7,72 (с, 1H), 7,38 (д, J=4 Гц, 2H), 7,31 (д, J=4 Гц, 2H), 2,69 (т, J=8,9 Гц, 2H), 1,68 (г, 2H), 0,98 (т, J=7,5 Гц, 3H); ESIMS 291,1 (M+H); т.пл. 97°C. Приклад 16 Одержання 4-[1-(4-трифторметоксифеніл)-1H-імідазол-4-іл]бензальдегіду 4-Трифторметоксіанілін (2,20 г, 12,4 ммоль) додавали по краплях до розчину 4ціанофенацилброміду (1,50 г, 6,7 ммоль) у 5 мл ДМФ. Цей розчин потім додавали до 20 мл гарячого (180°C) формамідного розчину протягом 5 хв. і цей розчин залишали перемішуватися при температурі 180C протягом 2 годин. Охолоджений розчин потім виливали на 100 мл льоду й екстрагували за допомогою 275 мл ефіру. Після висушування і концентрування, одержаний напівтвердий продукт кристалізували з MeOH/H2O. Друга перекристалізація із суміші MeOH/H2O дозволяла видалити сліди домішки форманіліду, і давала 200 мг чистого продукту, т.пл. 155°C. Анал. обчисл. для C17H10F3N3O: C, 62,01; H, 3,06; N, 12,76. Знайдено: C. 61,53; H, 3,13; N, 12,55. Відновлення до відповідного альдегіду здійснювали, використовуючи DIBAL, в умовах, описаних 23 UA 105175 C2 1 вище. H ЯМР (300 MГц, CDCl3) δ 10,0 (с, 1H), 8,05-7,90 (г, 5H), 7,70 (с, 1H), 7,50 (д, J=6 Гц, 2H), 7,42 (д, J=6 Гц, 2H); МС 333,0 (M+H); т.пл. 112°C. Приклад 17 Одержання 4-[1-(4-трифторметоксифеніл)-1H-імідазол-4-іл]бензойної кислоти 5 10 15 20 25 30 35 40 45 Розчин нітрилу (1,1 г, 3,3 ммоль) у EtOH (5 мл) і воді (2 мл) обробляли 1 г NaOH (20 ммоль), і розчин нагрівали при кип'ятінні зі зворотним холодильником протягом 6 годин. Його потім охолоджували і підкисляли за допомогою 1н HCl і одержаний твердий продукт білого кольору фільтрували і сушили на повітрі з одержанням 1,1 г кислоти у вигляді твердого продукту ясносірого кольору. 1 H ЯМР (400 MГц, CDCl3) δ 11,4 (с, 1H), 7,90 (д, J=6,4 Гц, 2H), 7,89 (с, 1H), 7,80 (д, J=8,6 Гц, 2H), 7,63 (д, J=1,3 Гц, 1H), 7,49 (д, J=9,3 Гц, 2H), 7,38 (д, J=8,9 Гц, 2H); т.пл. 230°C. Приклад 18 Одержання 4-[4-(4-трифторметилфеніл)-1H-імідазол-1-іл]бензальдегіду 4-Трифторметилфенілімідазол (4,0 г, 19 ммоль), 4-фторбензонітрил (1,2 г, 8,5 ммоль) і карбонат калію (1,5 г, 10,9 ммоль) об‘єднували в 15 мл ДМСО і нагрівали при температурі 100C протягом 6 годин. Охолоджений розчин потім виливали в 100 мл води, і одержаний твердий продукт фільтрували і сушили на повітрі з одержанням 4,65 г імідазолнітрилу у вигляді твердого 1 продукту білого кольору: т.пл. 252°C; H ЯМР (300 MГц, CDCl3) δ 8,05 (с, 1H), 7,95 (д, J=8 Гц, 2H), 7,85 (д, 2H), 7,72 (с, 1H), 7,72 (д, J=8 Гц, 2H), 7,62 (д, J=8 Гц, 2H); MС 314,1 (M+H). Анал. обчисл. для C16H10F3N3O2: C, 65,18; H, 3,22; N, 13,41. Знайдено: C, 64,49; H, 3,23; N, 13,08. Частину нітрилу (3,8 г) піддавали відновленню в присутності DIBAL в умовах, описаних вище, з 1 одержанням 2,41 г відповідного альдегіду. H ЯМР (300 MГц, CDCl3) δ 10,1 (с, 1H), 8,10 (д, J=8 Гц, 2H), 8,05 (с, 1H), 7,95 (д, J=8 Гц, 2H), 7,75 (с, 1H), 7,7 (г, 4H); МС 317,1 (M+H); т.пл. 141°C. Приклад 19 Одержання 4-бром-1-(4-трифторметоксифеніл)-1H-імідазолу У круглодонну колбу поміщали 4-бромімідазол (1,15 г, 7,81 ммоль), Cu (0,07 г, 0,36 ммоль), 8-гідроксихінолін (0,05 г, 0,36 ммоль), карбонат цезію (3,39 г, 10,4 ммоль) і 4трифторметоксийодбензол (1,50 г, 5,21 ммоль). У реакційну суміш додавали суміш 10:1 ДМФ (15 мл) і H2O (1,5 мл), і розчин нагрівали до температури 130°C протягом 4 годин. Реакційну суміш потім розбавляли EtOAc і промивали послідовно водою, хлоридом амонію (насичений), водою і бікарбонатом натрію. Органічні продукти сушили над MgSO 4, фільтрували й очищали на колонку з оберненою фазою з одержанням 820 мг імідазолу у вигляді твердого продукту білого кольору. МС 308,0 (M+H); т.пл. 139-141°C. Приклад 20 Одержання 4-метокси-2-[1-(4-трифторметоксифеніл)-1H-імідазол-4-іл]бензальдегіду 4-бром-1-(4-трифторметоксифеніл)-1H-імідазол (100 мг, 0,326 ммоль), 2-форміл-5метоксифенілборну кислоту (73 мг, 0,41 ммоль), дихлорид біс(трифенілфосфін)паладію (2 мг, 0,003 ммоль), бікарбонат натрію (49 мг, 0,59 ммоль) і суміш 1:1 DME/H 2O (8:8 мл) об‘єднували і додавали в посудину для мікрохвильового опромінення. Реакційну суміш нагрівали при мікрохвильовому опроміненні при перемішуванні при температурі 100°C протягом 12 хв. При мікрохвильовому опроміненні було потрібно 5 хв., щоб досягти 100°C, потім витримували при температурі 100°C протягом 12 хв. і потім охолоджували. Дані ТСХ (1:1 EtOAc:циклогексан) 24 UA 105175 C2 5 10 15 20 25 30 35 40 45 показували наявність вихідних продуктів, тому зразок нагрівали до температури 100°C протягом ще 8 хв. При охолодженні утворювався осад; його фільтрували і промивали водою з одержанням 86 мг твердого продукту сірого кольору. ESIMS 363,0 (M+H). Представлений далі проміжний продукт також був одержаний, використовуючи даний спосіб: Приклад 21 Одержання 2-фтор-4-[1-(4-трифторметоксифеніл)-1H-імідазол-4-іл]бензальдегіду ESIMS 351,0 (M+H). Приклад 22 Одержання 1-{4-фтор-3-[1-(4-трифторметоксифеніл)-1H-імідазол-4-іл]феніл}етанону 4-бром-1-(4-трифторметоксифеніл)-1H-імідазол (200 мг, 0,651 ммоль), 5-ацетил-2фторфенілборну кислоту (178 мг, 0,977 ммоль), тетракис(трифенілфосфін)паладій(0) (7 мг, 0,007 ммоль), 2н водний розчин карбонату калію (0,651 мл) і діоксан (8 мл) об‘єднували і додавали в посудину для мікрохвильового опромінення. Реакційну суміш нагрівали при мікрохвильовому опроміненні при перемішуванні при температурі 150°C протягом 20 хв. Дані LC-MS указували на 88% очікуваного продукту; дані ТСХ (1:1 гексани:EtOAc) указували на присутність вихідного продукту і 3 інших продуктів. У реакційну суміш додавали EtOAc і воду. Водний шар екстрагували за допомогою EtOAc і органічні екстракти промивали насиченим сольовим розчином, сушили над MgSO4 і концентрували у вакуумі. Сирий продукт очищали за допомогою хроматографії з градієнтним елююванням (від 100% гексану до 100% EtOAc) з одержанням 90 мг твердого продукту не зовсім білого кольору. ESIMS 265,0 (M+H); т.пл. 129°C. Приклад 23 Одержання 4-[1-(4-трифторметоксифеніл)-1H-[1,2,4]триазол-3-іл]бензальдегіду Стадія 1. 4-(1H-[1,2,4]триазол-3-іл)бензонітрил. Для одержання 3-(4-нітрофеніл)-1H[1,2,4]триазолу використовували загальний спосіб, описаний у роботі Lin et. al. (J. Org. Chem. 1979, 44, 4163). 4-Ціанобензамід (21,63 г, 0,148 моль) розчиняли в ДМФ-DMA (100 мл) і перемішували при кип'ятінні зі зворотним холодильником в атмосфері N2 протягом 8 годин. Суміш концентрували досуха і суспендували в 50 мл AcOH. У посудину потім завантажували моногідрат гідразину (7,18 мл, 0,148 ммоль) і перемішували при кип'ятінні зі зворотним холодильником протягом 1 години, потім концентрували. Бажаний 4-(1H-[1,2,4]триазол-3іл)бензонітрил одержували з 98%-ною чистотою шляхом розтирання в Et2O і далі шляхом фільтрування (12,17 г, 0,072 мл, 48%). Стадія 2. 4-[1-(4-Трифторметоксифеніл)-1H-[1,2,4]триазол-3-іл]бензонітрил. Триазол (70 мг, 0,41 ммоль), 1-йод-4-трифторметоксибензол (142 мг, 0,493 ммоль), Cs 2CO3 (535 мг, 1,644 ммоль), Cu (3 мг, 0,012 ммоль), 8-гідроксихінолін (2 мг, 0,012 ммоль) і ДМФ/H2O (2 мл 10:1 розчин) об‘єднували в 10 мл посудині для мікрохвильового опромінення (CEM Microwave), забезпеченій магнітною мішалкою, і піддавали мікрохвильовому опроміненню при температурі 150°C протягом 30 хв. Вміст потім фільтрували і концентрували досуха, одержуючи проміжний продукт, 1,3-дифенілтриазол (18 мг, 13%). Стадія 3. 4-[1-(4-Трифторметоксифеніл)-1H-[1,2,4]триазол-3-іл]бензальдегід. Нітрил 1 піддавали відновленню в присутності DIBAL в умовах, описаних вище. H ЯМР (300 MГц, CDCl3) δ 10,1 (с, 1H), 8,61 (с, 1H), 8,37 (д, J=9 Гц, 2H), 8,0 (д, J=8,4 Гц, 2H), 7,8 (д, J=9 Гц, 2H), 7,4 (д, J=8,4 Гц, 2H); ESIMS 334,2 (M+H); т.пл. 137-140°C. Приклад 24 Одержання 4-[1-(4-пентафторетилсульфанілфеніл)-1H-[1,2,4]триазол-3-іл]бензальдегіду 25 UA 105175 C2 5 10 15 Стадія 1. 1-Бром-4-пентафторетилсульфанілбензол. Зазначену в заголовку сполуку одержували використовуючи умови перфторалкілування згідно з описаним у роботі Popov et. al. J. Fluorine Chem. 1982, 21, 365. У розчин 4-бромбензолтіолу (500 мг, 2,64 ммоль, 1,00 екв.) і хлориду триетилбензиламонію (60 мг, 0,26 ммоль, 0,10 екв.) у 10 мл 1:1 Et2O/NaOH (25% водн.) при температурі 0°C барботували газоподібний 1,1,1,2,2-пентафтор-2-йодетан протягом 30 хв. (>5 екв.). Протягом зазначеного часу УФ лампа була спрямована на реакційну посудину, при цьому температура підтримувалася нижче 10°C шляхом підставляння і видалення крижаної бані. Вміст потім нагрівали до кімнатної температури, екстрагували Et 2O (300 мл), сушили (MgSO4) і концентрували при зниженому тиску. Частину даного сирого продукт використовували в наступних реакціях без додаткового очищення (200 мг залишок: 120 мг продукт, 0,39 ммоль, 1,2 екв.). Стадія 2. 4-[1-(4-Пентафторетилсульфанілфеніл)-1H-[1,2,4]триазол-3-іл]бензонітрил. Конденсація з 4-(1H-[1,2,4]триазол-3-іл)бензонітрилом, як описано вище, давала 4-[1-(4пентафторетилсульфанілфеніл)-1H-[1,2,4]триазол-3-іл]бензонітрил: 70 мг, 46%. Відновлення з DIBAL, як описано вище, давало відповідний альдегід. Приклад 25 Одержання 4-[1-(4-пентафторетилоксифеніл)-1H-[1,2,4]триазол-3-іл]бензальдегіду 45 Стадія 1. Розчин 3-п-толіл-1H-[1,2,4]триазолу (4,85 г, 30,5 ммоль), 4-бромфенілового пентафторетилового ефіру (10,0 г, 34,4 ммоль), Cs 2CO3 (25 г, 77 ммоль), Cu (1,25 г, 6,5 ммоль) і 8-гідроксихіноліну (0,35 г, 2,4 ммоль) у 50 мл суміші 9:1 ДМФ/H 2O енергійно перемішували і нагрівали до температури 130°C (внутрішня температура) протягом 20 годин. Розчин потім охолоджували, виливали у воду і підкисляли за допомогою 2н HCl до p 2. Потім додавали ефір (250 мл), і розчин струшували і фільтрували, потім шари розділяли. Органічний шар сушили і концентрували, і одержаний смолистий твердий продукт нагрівали з 100 мл гексану. Гарячий гексановий шар декантували від нерозчиненого залишку, одержаний розчин охолоджували до 0°C і твердий продукт, що випав в осад, фільтрували і сушили на повітрі з одержанням 7,0 г (61% у розрахунку на вихідний триазол) 1-(4-пентафторетилоксифеніл)-3-п-толіл-1H[1,2,4]триазолу у вигляді твердого продукту не зовсім білого кольору, т.пл. 130-132(C; ESIMS 370,8 (M+H). Стадія 2. Продукт зі стадії 1 (7,0 г, 18,7 ммоль) розчиняли в 200 мл ацетонітрилу і перемішували при кімнатній температурі при цьому частинами протягом 10 хв. додавали нітрат церію(IV) амонію (32 г, 58 ммоль) у 60 мл води. Розчин потім нагрівали при кип'ятінні зі зворотним холодильником протягом 4 годин, охолоджували і розбавляли 200 мл води. Розчин екстрагували за допомогою 2200 мл ефіру, і об'єднаний органічний шар сушили і концентрували з одержанням олії жовтогарячого кольору. Продукт розчиняли в 40 мл діоксану й обробляли розчином KOH (5 г, 90 ммоль) у 20 мл води. Розчин нагрівали при кип'ятінні зі зворотним холодильником протягом 2 годин, потім охолоджували і розбавляли 100 мл води. Альдегід випадав в осад і його збирали шляхом фільтрування. Перекристалізація із суміші 1 MeOH/H2O давала чистий альдегід у вигляді твердого продукту білого кольору. H ЯМР (300 MГц, CDCl3) δ 10,1 (с, 1H), 8,65 (с, 1H), 8,40 (д, J=8,4 Гц, 2H), 8,0 (д, J=8,4 Гц, 2H), 7,85 (д, J=9 Гц, 2H), 7,45 (д, J=9 Гц, 2H); ESIMS 384,2 (M+H); т.пл. 137-144°C. Приклад 26 Одержання 4-[1-(4-пентафторетилоксифеніл)-1H-[1,2,4]триазол-3-іл]бензойної кислоти 50 Розчин 4-[1-(4-пентафторетилоксифеніл)-1H-[1,2,4]триазол-3-іл]бензальдегіду (1,7 г, 4,4 ммоль), бромату натрію (2,1 г, 13,9 ммоль) і бісульфату натрію (0,53 г, 4,5 ммоль) у 50 мл ацетонітрилу нагрівали при кип'ятінні зі зворотним холодильником протягом 5 годин, у процесі чого утворювався об'ємний осад. Розчин потім охолоджували і виливали в 100 мл води, 20 25 30 35 40 26 UA 105175 C2 5 10 15 20 25 30 35 40 45 50 фільтрували і сушили з одержанням 1,67 г кислоти у вигляді твердого продукту білого кольору. 1 H ЯМР (300 MГц, CDCl3) δ 10,1 (с, 1H), 8,65 (с, 1H), 8,40 (д, J=8,4 Гц, 2H), 8,0 (д, J=8,4 Гц, 2H), + 7,85 (д, J=9 Гц, 2H), 7,45 (д, J=9 Гц, 2H); ESIMS 399,2 (M+H ); т.пл. 225°C. Приклад 27 Одержання 4-[1-(4-пентафторетилоксифеніл)-1H-[1,2,4]триазол-3-іл]бензоїл азиду Розчин 4-[1-(4-пентафторетилоксифеніл)-1H-[1,2,4]триазол-3-іл]бензойної кислоти (1,67 г, 4,2 ммоль), дифенілфосфорил азиду (1,26 г, 4,58 ммоль) і триетиламіну (0,5 г, 5 ммоль) у 10 мл сухого трет-BuOH нагрівали до температури 75°C протягом 90 хв., що приводило до розчинення вихідної кислоти і наступного випадання в осад азиду. Охолоджений розчин потім виливали на 10 г льоду, і одержану суміш фільтрували і сушили з одержанням 0,80 г азиду у вигляді 1 твердого продукту білого кольору. H ЯМР (300 MГц, CDCl3) δ 10,1 (с, 1H), 8,65 (с, 1H), 8,40 (д, J=8,4 Гц, 2H), 8,0 (д, J=8,4 Гц, 2H), 7,85 (д, J=9 Гц, 2H), 7,45 (д, J=9 Гц, 2H); ESIMS 399,2 (M+H); т.пл. 175°C розклад. Приклад 28 Одержання 4-[1-(4-бутилфеніл)-1H-[1,2,4]триазол-3-іл]бензальдегіду Стадія 1. 4-[1-(4-Бутилфеніл)-1H-[1,2,4]триазол-3-іл]бензонітрил. Розчин 4-нбутилфенілгідразину (1,0 г, 5 ммоль) і 4-ціанобензальдегіду (0,8 г, 6,0 ммоль) у 15 мл ізо-PrOH нагрівали на паровій бані протягом 2 годин і потім охолоджували і розбавляли 5 мл води. Одержаний твердий продукт жовтогарячого кольору фільтрували і сушили на повітрі з одержанням 1,30 г гідразону у вигляді твердого продукту жовтого кольору, т.пл. 107°C. Розчин одержаного гідразону (1,1 г, 4,0 ммоль) і NCS (0,67 г, 5 ммоль) у 20 мл ізо-PrOH перемішували в атмосфері азоту при кімнатній температурі протягом 2 годин, під час цього процесу вихідний твердий продукт розчинялася й утворювався новий твердий продукт. Одержаний розчин жовтогарячого кольору потім обробляли тетразолом (0,45 г, 6,4 ммоль) і триетиламіном (960 мл, 7,0 ммоль). Розчин оранжево-коричневого кольору нагрівали при температурі кипіння зі зворотним холодильником протягом 2 годин. Розчин потім охолоджували, розбавляли 25 мл води, екстрагували за допомогою EtOAc, сушили, концентрували й очищали за допомогою хроматографії (Biotage, 4:1 Hex:EtOAc) з одержанням 0,42 г (35%) триазолу у вигляді твердого 1 продукту не зовсім білого кольору. H ЯМР (300 MГц, CDCl3) δ 8,58 (с, 1H), 8,33 (д, J=8 Гц, 2H), 7,78 (д, J=8 Гц, 2H), 7,64 (д, J=8,2 Гц, 2H), 7,33 (д, J=8,2 Гц, 2H), 2,70 (т, J=7,8 Гц, 2H), 1,63 (г, 2H), 1,38 (г, 2H), 0,95 (т, J=7,5 Гц, 3H); ESIMS 303,1; т.пл. 124°C. Стадія 2. 4-[1-(4-Бутилфеніл)-1H-[1,2,4]триазол-3-іл]бензальдегід. Відновлення за 1 допомогою DIBAL, як описано раніше, давало відповідний альдегід. H ЯМР (300 MГц, CDCl3) δ 10,08 (с, 1H), 8,58 (с, 1H), 8,37 (д, J=8 Гц, 2H), 7,98 (д, J=8 Гц, 2H), 7,62 (д, J=8,2 Гц, 2H), 7,33 (д, J=8,2 Гц, 2H), 2,70 (т, J=7,8 Гц, 2H), 1,63 (г, 2H), 1,38 (г, 2H), 0,95 (т, J=7,5 Гц, 3H); ESIMS 306,1; т.пл. 124°C. Приклад 29 Одержання 4-[1-(4-пентафторетилфеніл)-1H-[1,2,4]триазол-3-іл]бензальдегіду Стадія 1. 1-(4-Пентафторетилфеніл)-3-п-толіл-1H-[1,2,4]триазол. Пентафторетилйодид (521 мг, 2,12 ммоль) піддавали конденсації в посудині, що містить 1-бром-4-йодбензол (300 мг, 1,06 ммоль), порошок міді(0) (135 мг, 2,12 ммоль) і ДМСО (5 мл). Посудину потім герметично закривали і піддавали мікрохвильовому опроміненню при температурі 150°C протягом 60 хв. Дані GC/MS підтверджували використання вихідного продукту з одержанням двох проміжних сполук, 1-бром-4-пентафторетилбензолу і 1-йод-4-пентафторетилбензолу. Суміш (1,06 ммоль) переносили в 250 мл круглодонну колбу і додавали 3-п-толіл-1H-[1,2,4]триазол (169 мг, 1,06 ммоль), Cs2CO3 (1,38 г, 4,24 ммоль), Cu (202 мг, 1,06 ммоль), 8-гідроксихінолін (2 мг, 0,011 ммоль) і ДМФ/H2O (12 мл 10:1 розчин), і розчин кип'ятили зі зворотним холодильником при 27 UA 105175 C2 5 10 15 20 25 30 35 40 45 50 температурі 160°C протягом 6 годин. Після закінчення кип'ятіння розчин охолоджували, вміст виливали в H2O і залишали осаджуватися протягом 1 години. Осад збирали вакуумною фільтрацією і сушили протягом ночі при 45°C у вакуумній печі. Сирий проміжний продукт 1-(4пентафторетилфеніл)-3-п-толіл-1H-[1,2,4]триазол використовували на стадії 2 без додаткового очищення. Стадія 2. Окислення до альдегіду. Нітрат амонію церію(IV) (3,32 г, 4,24 ммоль) і проміжну сполуку зі стадії 1 об’єднували в круглодонній колбі з ацетонітрилом і водою (20 мл, 1:1). Розчин перемішували при кип'ятінні зі зворотним холодильником при температурі 110°C протягом 4 годин, одержуючи суміш проміжних сполук, 3-(4-нітрооксиметилфеніл)-1-(4пентафторетилфеніл)-1H-[1,2,4]триазолу і 4-[1-(4-пентафторетилфеніл)-1H-[1,2,4]триазол-3іл]бензальдегіду. Ацетонітрил видаляли у вакуумі, а осади сирих проміжних продуктів збирали шляхом фільтрування. Продукт потім об‘єднували з порошкоподібним KOH (178 мг, 3,18 ммоль) у діоксані і воді (10 мл, 1:1) і перемішували при кип'ятінні зі зворотним холодильником при температурі 105°C протягом 90 хв., потім у вакуумі видаляли діоксан, даючи випасти в осад з води проміжній сполуці. Проміжний 4-[1-(4-пентафторетилфеніл)-1H-[1,2,4]триазол-3іл]бензальдегід збирали шляхом фільтрування (35 мг, 0,095 ммоль, 9% усього з 4толілтриазолу). Приклад 30 Одержання 4-[3-(4-формілфеніл)-[1,2,4]триазол-1-іл]фенілового ефіру трифторметансульфонової кислоти Стадія 1. 1-(4-Метоксифеніл)-3-п-толіл-1H-[1,2,4]триазол одержували шляхом конденсації 3п-толіл-1H-[1,2,4]триазолу з 4-йоданізолом в умовах, описаних для стадії 1 попереднього прикладу. Цей продукт потім деметилували, використовуючи умови, описані в роботі Hitchcock et al. Synlett 2006, 2625. Трибромід бору (1M розчин у гексані; 1,67 мл, 1,67 ммоль) додавали по краплях до розчину 1-(4-метоксифеніл)-3-п-толіл-1H-[1,2,4]триазолу (300 мг, 1,28 ммоль) у DCM (10 мл) при температурі 0°C в атмосфері N2. Після завершення додавання посудину нагрівали до температури навколишнього середовища, потім кип'ятили зі зворотним холодильником при температурі 40°C протягом 6 годин. Охолоджений вміст потім гасили H 2O, далі видаляли DCM і розподіляли між EtOAc і водою. Органічний шар збирали, промивали насиченим сольовим розчином, сушили (MgSO4), концентрували й очищали за допомогою хроматографії (3:1:1, гексани:EtOAc:ацетон) з одержанням проміжного 4-(3-п-толіл-[1,2,4]триазол-1-іл)фенолу (219 мг, 0,872 ммоль, 68%). Ангідрид трифторметансульфонової кислоти (0,16 мл, 0,96 ммоль) додавали по краплях до розчину фенолу і 4-трет-бутил-2,6-диметилпіридину (142 мг, 0,872 ммоль) у DCM (10 мл) при температурі 0°C в атмосфері N 2. Посидину нагрівали до температури навколишнього середовища, потім розчинник видаляли при зниженому тиску і залишок очищали за допомогою хроматографії (2:2:1, гексан:EtOAc:ацетон), одержуючи проміжний 4-(3-п-толіл[1,2,4]триазол-1-іл)феніловий ефір трифторметансульфонової кислоти (304 мг, 0,794 ммоль, 91%). Стадія 2. Окислення 4-метилового проміжного продукту, зазначеного вище, до відповідного альдегіду, здійснювали використовуючи нітрат амонію церію(IV) в умовах, описаних для стадія 2 попереднього прикладу. Приклад 31 Одержання 4-[5-(4-трифторметилфеніл)-1H-[1,2,4]триазол-3-іл]бензальдегіду Терефталонітрил (115 мг, 0,90 ммоль), гідразид 4-трифторметилбензойної кислоти (92 мг, 0,450 ммоль), K2CO3 (31 мг, 0,225 ммоль) і н-бутиловий спирт (~2 мл) об‘єднували в десятимілілітровій реакційній посудині для мікрохвильового опромінення (CEM Microwave), забезпеченій магнітною мішалкою, і піддавали мікрохвильовому опроміненню при температурі 150°C протягом 30 хв. Вміст потім фільтрували і концентрували досуха. Хроматографія (3:1 гексан/EtOAc) давала 1,2,4-триазолнітрил (72 мг, 0,230 ммоль, 51%). Потім відновлення за допомогою DIBAL приводило до одержання відповідного альдегіду. Приклад 32 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPesticidal compositions
Автори російськоюCrouse, Gary, Sparks, Thomas, Mcleod, CaSandra, Demeter, David, Bryan, Kristy, Brown, Annette, Dent, William, Cudworth, Denis, Nugent, Jaime, Hunter, Ricky, Samaritoni, Jack
МПК / Мітки
МПК: C07D 405/12, C07D 405/14
Мітки: пестициди
Код посилання
<a href="https://ua.patents.su/137-105175-pesticidi.html" target="_blank" rel="follow" title="База патентів України">Пестициди</a>
Попередній патент: Кришка для ємності для упаковки двох компонентів
Наступний патент: Обробна головка
Випадковий патент: Циліндрична лопать