Тверді фармацевтичні композиції з фіксованою дозою, що містять ірбесартан і амлодипін, їх отримання і їх терапевтичне застосування
Номер патенту: 103688
Опубліковано: 11.11.2013
Автори: Пхадке Яшвант, Сараванан Д., Колхе Вінай, Шингте Мансінг, Кхуллар Правін, Кулкарні Амол, Пател Ширішбай
Формула / Реферат
1. Стабільна тверда пероральна фармацевтична композиція з фіксованою дозою в формі одношарової таблетки, що містить ірбесартан, безилат амлодипіну і фармацевтично прийнятні ексципієнти, де ірбесартан фізично відділений від безилату амлодипіну і де ірбесартан в формі гранул з покриттям поміщений в екстрагранулярну матрицю, шо містить безилат амлодипіну.
2. Композиція за п. 1, де таблетка має плівкове покриття.
3. Композиція за п. 1 або 2, де ірбесартан складає від 20 % до 70 % від загальної маси композиції.
4. Композиція за будь-яким з пп. 1-3, де безилат амлодипіну складає приблизно від 1 % до приблизно 20 % від загальної маси композиції.
5. Композиція за будь-яким з пп. 1-4, де фармацевтично прийнятні ексципієнти вибрані з групи, яка складається з розріджувача, розпушувача, антиадгезиву, зв'язувальної речовини, мастильної речовини і їх суміші.
6. Композиція за будь-яким з пп. 1-5, де вказана тверда композиція не містить лактози.
7. Тверда композиція за будь-яким з пп. 1-6, де кількість ірбесартану знаходиться в межах між 150 мг і 300 мг від загальної маси таблетки, переважно 300 мг або 150 мг.
8. Тверда композиція за будь-яким з пп. 1-7, де кількість безилату амлодипіну складає від 5 мг до 10 мг від загальної маси таблетки, переважно 7 мг або 14 мг.
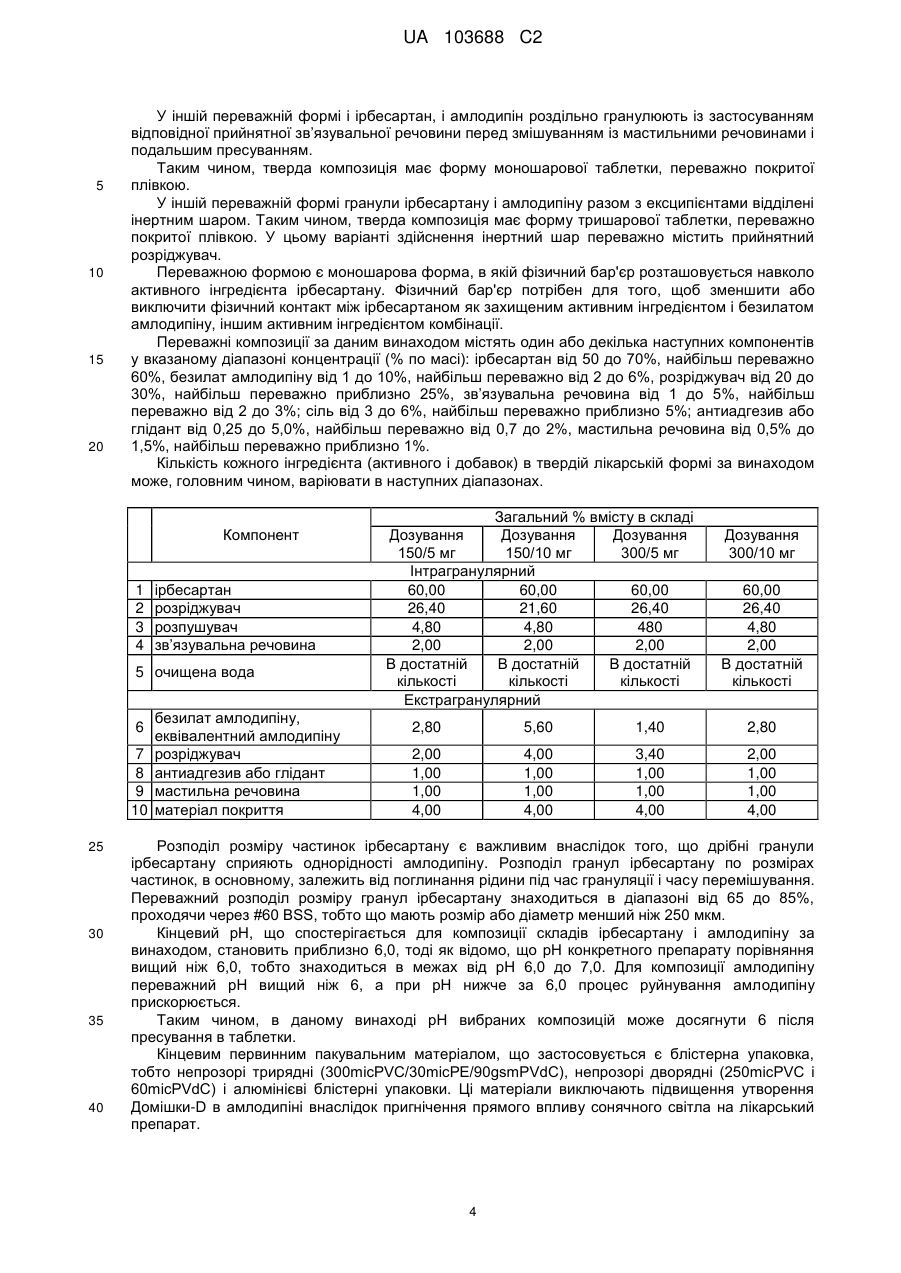
9. Тверда композиція за будь-яким з пп. 1-8 в формі таблетки, де загальна маса таблетки складає від 400 мг до 600 мг, переважно 500 мг.
10. Композиція за будь-яким з пп. 1-9, що має менше 1,50 % (мас/мас.) від загального вмісту домішок для амлодипіну і менше 0,50 % (мас/мас.) від загального вмісту домішок для ірбесартану через 6 місяців при 40 °C/75 % RH.
11. Спосіб отримання стабільної пероральної фармацевтичної композиції в формі одношарової таблетки, шо містить ірбесартан і безилат амлодипіну, шо включає стадії:
і) гранулювання ірбесартану і одного або декількох фармацевтично прийнятних ексципієнтів з водним розчином, що містить зв'язувальну речовину, для формування гранул;
ii) сушіння гранул;
ііі) роздільне змішування безилату амлодипіну з фармацевтично прийнятними ексципієнтами;
iv) змішування гранул ірбесартану зі стадії іі) з сумішшю безилату амлодипіну зі стадії ііі);
v) додавання мастильної речовини в суміш зі стадії iv); необов'язково після стадії, що передує додаванню мастильної речовини; і
vi) пресування суміші в таблетки.
12. Спосіб за п. 11, де група фармацевтично прийнятних ексципієнтів, що використовуються на стадіях і) і ііі) способу, не містить лактози.
13. Спосіб за будь-яким з пп. 11 або 12, де стадія, що передує додаванню мастильної речовини, включає змішування суміші зі стадії iv) протягом від 10 до 25 хвилин, переважно 20 хвилин, перед стадією додавання мастильної речовини.
14. Застосування ірбесартану і безилату амлодипіну для виробництва лікарського засобу для лікування гіпертензії, де вказаний лікарський засіб знаходиться в стабільній твердій композиції з фіксованою дозою за будь-яким з пп. 1-10.
15. Застосування за п. 14 як терапії другої лінії для пацієнтів з гіпертензією, стан яких недостатньо контролюється застосуванням монотерапії амлодипіном як блокатором кальцієвих каналів (ССВ) або ірбесартаном як антагоністом рецепторів ангіотензину II (ARB).
Текст
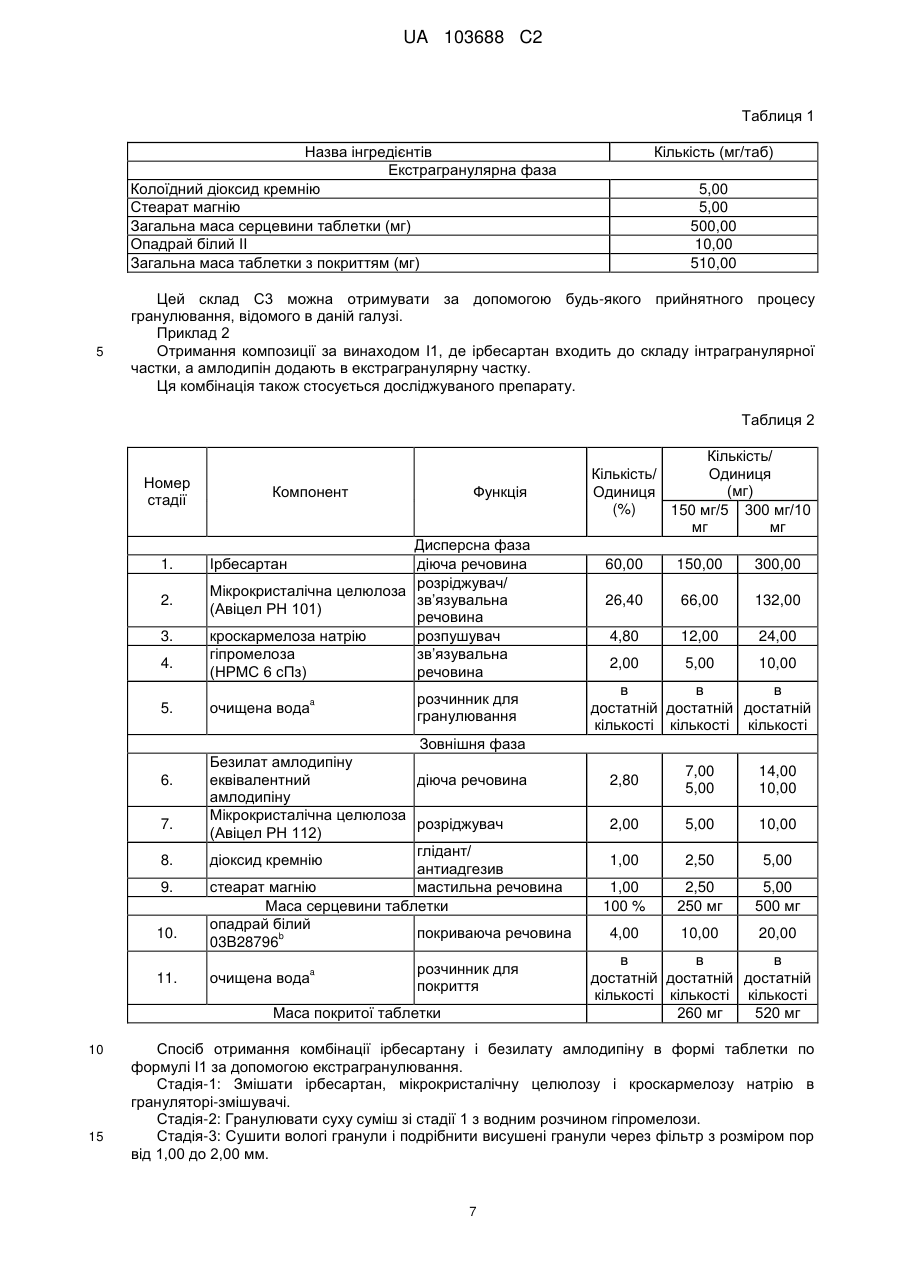
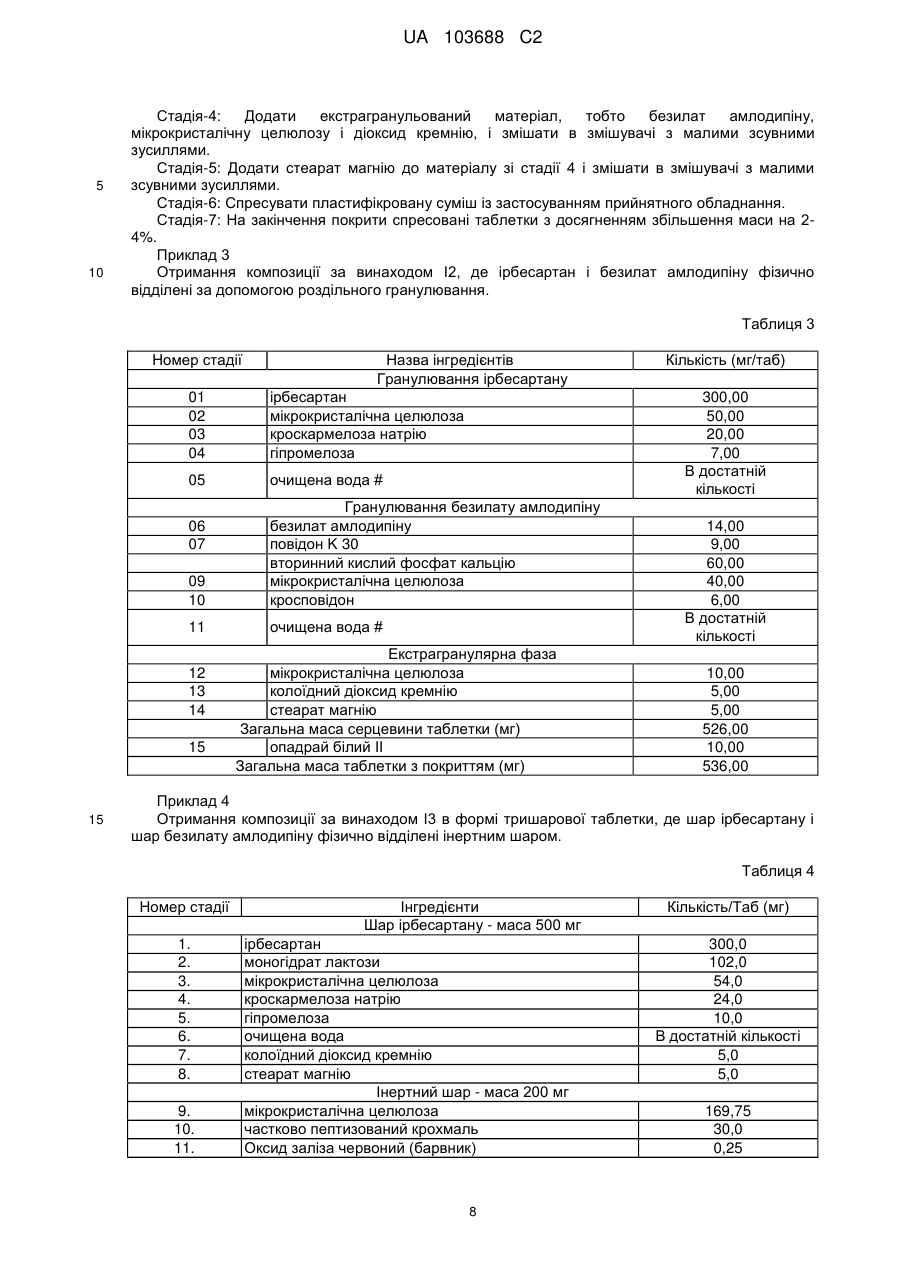
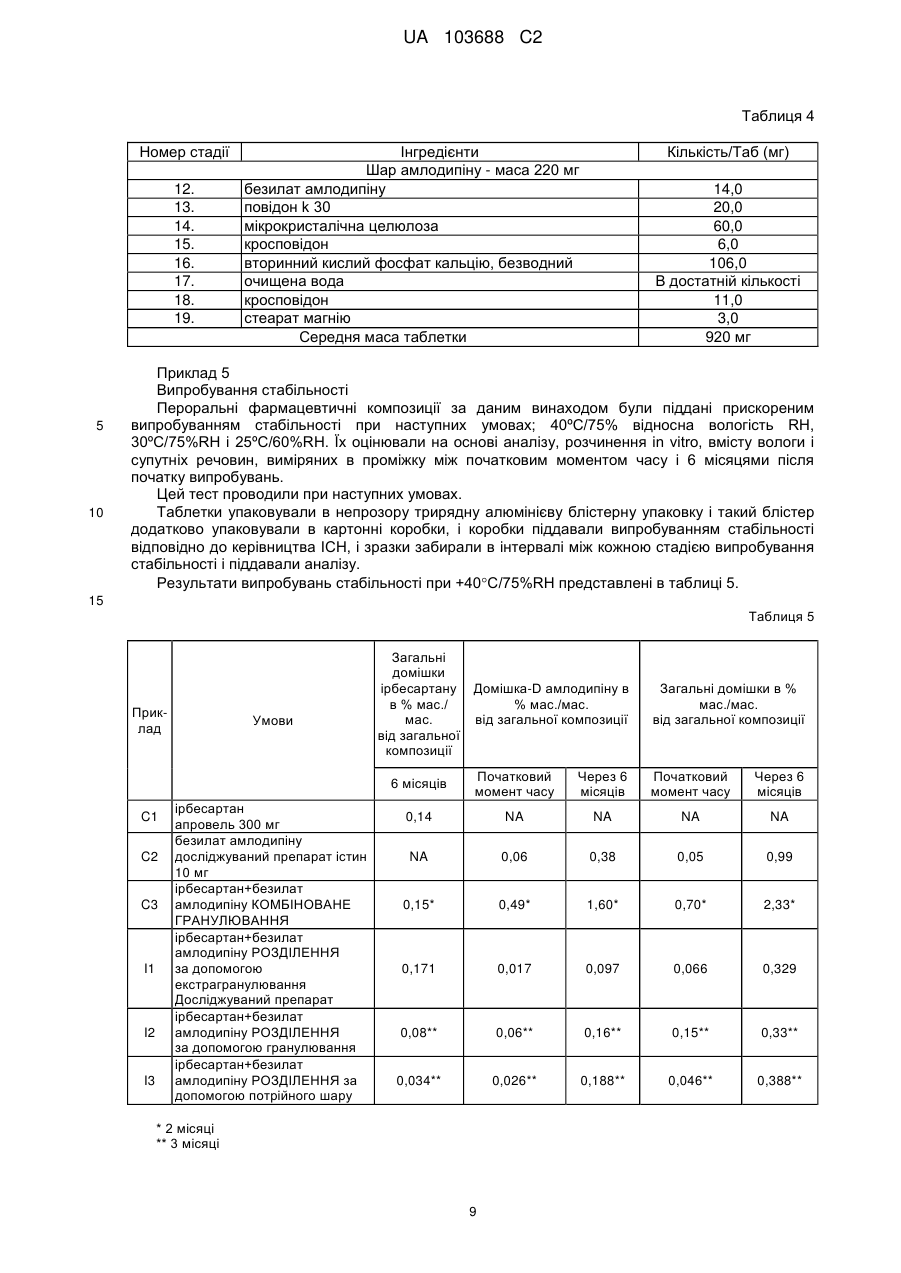
Реферат: Винахід стосується стабільної твердої пероральної фармацевтичної композиції з фіксованою дозою в формі одношарової таблетки, що містить ірбесартан, безилат амлодипіну і фармацевтично прийнятні ексципієнти, де ірбесартан фізично відділений від безилату амлодипіну і де ірбесартан в формі гранул з покриттям поміщений в екстрагранулярну матрицю, шо містить безилат амлодипіну; її отримання та терапевтичного застосування. UA 103688 C2 (12) UA 103688 C2 UA 103688 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь винаходу Даний винахід стосується твердих стабільних фармацевтичних композицій з фіксованою дозою, що містять ірбесартан, безилат амлодипіну і фармацевтично прийнятні ексципієнти, їх отримання і їх терапевтичного застосування. Попередній рівень техніки Амлодипін є блокатором кальцієвих каналів, розробленим для лікування гіпертензії і інших медичних показань, як описано в USP 4572909 і USP 4879303. Його хімічна назва 3-етил-5метил-(+-)-2-[(2-аміноетокси)метил]-4-(2-хлорфеніл)-1,4-дигідро-6-метилпіридин-3,5дикарбоксилат. Амлодипін представлений на ринку як монобензолсульфонатна сіль, безилат амлодипіну, під торговим найменуванням норваск (Norvasc®) або істин (Istin®). Він представлений у вигляді пероральних таблеток в дозуванні 2,5 мг, 5 мг і 10 мг. Неактивні інгредієнти в таблетках норваск® включають мікрокристалічну целюлозу, двоосновний фосфат кальцію безводний, крохмальгліколят натрію і стеарат магнію. Безилат амлодипіну малорозчинним у воді і має абсолютну біодоступність 64-90%. Ірбесартан описаний в Bernhart et al., U.S. Patent № 5270317, включений в даний документ як посилання. Ірбесартан, є сильним, тривало діючим антагоністом рецепторів ангіотензину II, який особливо придатний в лікуванні серцево-судинних захворювань, таких як гіпертензія і серцева недостатність. Його хімічна назва 2-н-бутил-4-спірoциклопентан-1-[(2'-(тетразол-5-іл)біфеніл-4іл)метил]-2-імідазолін-5-он. Ірбесартан продається під торговою маркою апровель (Aprovel®) або карвеа (Karvea®). Ірбесартан не розчинний у воді. Ірбесартан має параболічну залежність розчинності від рН у водному середовищі з мінімальною розчинністю при pH від 2,0 до 6,0 і максимальною розчинністю в 0,1 н HCl і фосфатному буфері при pH 7,5. Часто бажано комбінувати множину активних інгредієнтів в єдиній фармацевтичній композиції. Включення множини інгредієнтів в єдину композицію, як правило, знижує вартість і забезпечує зручність споживання одного препарату, а не декількох препаратів для лікування окремих симптомів. Однак комбінація активних інгредієнтів не позбавлена недоліків. Досягнення певних фізичних властивостей лікарських засобів і, головним чином, стабільності є складною задачею при розробці складів, прийнятних для отримання таблеток із зниженим рівнем загального вмісту домішок при довготривалій стабільності. Наприклад, ірбесартан є сипучою речовиною з відносно низькою об'ємною і насипною густиною. Крім того, він є в'язкою і абразивною речовиною. Ці властивості утруднюють формулювання ефективної кількості лікарського засобу в маленьких таблетках, однорідних по масі, жорсткості, і інших бажаних властивостях таблетки. Крім того, ірбесартан має певні небажані властивості текучості, наприклад, він є в'язким і може прилипати до поверхонь, таких як поверхня таблетки і прес-форми, викликаючи проблеми при таблетуванні, особливо у високошвидкісних пресах для отримання таблеток. Також проблемою є дуже низька розчинність ірбесартану у воді, оскільки можна додавати тільки обмежену кількість ексципієнтів, що полегшують змочування, дезінтеграцію і, зрештою, швидке і повне вивільнення лікарського засобу. Крім того, додаткові проблеми при отриманні таблеток або збереженні одноманітності одиниць дозування може викликати другий активний інгредієнт, такий як безилат амлодипіну, який також є сипкою речовиною, що має слабку текучість і низьку розчинність у воді. Крім того, стабільність композиції може порушуватися внаслідок несумісності між активною речовиною і незамінним ексципієнтом або навіть з самим другим активним засобом. Відносно складів, які містять тільки безилат амлодипіну, в WO 2006/059217 описано, що амлодипін є високогігроскопічним і поглинає вологу, що веде до руйнування. Одним з головних шляхів руйнування є каталітичний окиснювальний процес, що залежить від рН. Одним з основних продуктів руйнування є відомий в даній галузі 3-етил-5-метил-2-[(2аміноетокси)метил]-4-(2-хлорфеніл)-6-метилпіридин-3,5-дикарбоксилат і що називається Домішка D. У W02003/051364 описані таблетки безилату амлодипіну з підвищеною стабільністю активного інгредієнта і зниженою масою, що містять мікрокристалічну целюлозу, мастильну речовину і розпушувач, і спосіб отримання вказаних таблеток. У W02008/062435 описана стабільна тверда лікарська форма безилату амлодипіну, що містить поліоли і має знижений рівень загального вмісту домішок відносно стабільності і, головним чином, Домішка D. 1 UA 103688 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відносно складів, що містять ірбесартан, в EP747050 від Санофі описана фармацевтична композиція в таблетованій формі, що містить тільки ірбесартан, або в комбінації з діуретичним засобом, таким як гідрохлортіазид (HCTZ), отриманим за допомогою процесу змішування екстрагранульованої композиції з гранулами, що містять тільки ірбесартан або два активні компоненти в присутності лактози і антиадгезиву, такого як діоксид кремнію. При цьому не виникає проблеми стабільності. У W02005/070762 від Sepracor описаний пероральний склад у вигляді капсул, що містить комбінацію S-амлодипіну і ірбесартану, отриману простим змішуванням приблизно 25% мас. двох активних компонентів разом в присутності кукурудзяного крохмалю і приблизно 65% мас. лактози. При цьому не виникає проблеми стабільності. Таким чином, не існує відомої стабільної твердої лікарської форми, що містить специфічну комбінацію ірбесартану і безилату амлодипіну. У доповнення до стабільності, при формулюванні твердої комбінації з фіксованою дозою метою є забезпечити лікарську форму комбінації активних інгредієнтів, зручну для прийому пацієнтами, яка є біоеквівалентною, відповідній вільній комбінації тих же активних інгредієнтів. Як застосовують в даному документі, "комбінація з фіксованою дозою або FDC" стосується комбінації двох лікарських засобів або активних інгредієнтів, представлених в одній одиниці дозування, такій як таблетка або пероральна лікарська форма. Додатково, як застосовують в даному документі, "вільна комбінація" стосується комбінації двох лікарських засобів або активних інгредієнтів, що дозуються одночасно, але у вигляді двох одиниць дозування. Внаслідок цих складних біофармацевтичних властивостей, розробка лікарської форми з фіксованою комбінацією ірбесартану і безилату амлодипіну, яка є біоеквівалентною їх вільній комбінації, є складною задачею. Таким чином, переважною є тверда лікарська форма з фіксованою комбінацією ірбесартану і безилату амлодипіну, яка є стабільною і біоеквівалентною відповідній вільній комбінації. Ще однією складною проблемою є гомогенність амлодипіну в пластифікованій суміші внаслідок того, що вміст амлодипіну в загальній масі таблетки повинен був би бути низьким в порівнянні з високим вмістом ірбесартану. Метою за даним винаходом є щонайменше часткове зменшення вищезазначених недоліків. Суть винаходу Ця мета досягається створенням стабільної твердої пероральної фармацевтичної композиції з фіксованою дозою, що містить ірбесартан, безилат амлодипіну і фармацевтично прийнятні ексципієнти, де ірбесартан фізично відділений від безилату амлодипіну. Ця тверда лікарська форма особливо ефективна, внаслідок того, що безилат амлодипіну не піддається руйнуванню, і цей комбінований продукт містить знижену і контрольовану кількість домішок навіть в меншій мірі, ніж відповідні окремі продукти того ж дозування після дослідження в екстремальних умовах і в кінцевій упаковці. Крім того, профіль розчинення ірбесартану і безилату амлодипіну спільно не програє в порівнянні з профілем розчинення кожного активного інгредієнта окремо. У переважному варіанті здійснення ірбесартан в формі гранул з покриттям вбудований в екстрагранульовану матрицю, що містить безилат амлодипіну. Переважно, тверда композиція за винаходом має форму моношарової таблетки переважно з плівковим покриттям. Переважно, таблетка додатково упакована у прийнятний пакувальний матеріал, такий як PVC, PVC/PVdC, PVC/PE/PVdC. У переважному варіанті здійснення композиції за винаходом, ірбесартан складає від приблизно 20% до приблизно 70% від загальної маси композиції. У переважному варіанті здійснення композиції за винаходом безилат амлодипіну складає від приблизно 1% до приблизно 20% від загальної маси композиції. У переважному варіанті здійснення композиції за винаходом фармацевтично прийнятні ексципієнти вибрані з групи, яка складається з розріджувача, розпушувача, антиадгезиву, зв'язувальної речовини, мастильної речовини і їх суміші. Переважно, вказана тверда композиція не містить лактози. У переважному варіанті здійснення композиції за винаходом кількість ірбесартану складає від 150 мг до 300 мг від загальної маси таблетки, переважно 300 мг або 150 мг. У переважному варіанті здійснення композиції за винаходом кількість безилату амлодипіну складає від 5 мг до 10 мг загальної маси таблетки, переважно 7 мг або 14 мг. У переважному варіанті здійснення композиції за винаходом тверда композиція має форму таблетки, де загальна маса таблетки складає від 400 мг до 600 мг, переважно 500 мг. 2 UA 103688 C2 5 10 15 20 25 30 35 40 45 50 55 У переважному варіанті здійснення композиція має менше ніж 1,50% (мас./мас.) від загального вмісту домішок для амлодипіну і менше ніж 0,50% (мас./мас.) від загального вмісту домішок для ірбесартану через 6 місяців при 40C/75%RH. Відповідно до іншої мети, винахід стосується способу отримання стабільної пероральної фармацевтичної композиції, що містить ірбесартан і безилат амлодипіну, що включає наступні стадії: i. гранулювання ірбесартану і один або декілька фармацевтично прийнятних ексципієнтів з водним розчином, що містить зв'язувальну речовину для формування гранул, ii. сушіння гранул; iii. роздільне отримання суміші безилату амлодипіну з фармацевтично прийнятними ексципієнтами, iv. змішування гранул ірбесартану стадії ii із сумішшю безилату амлодипіну стадії iii); v. додавання мастильної речовини до суміші стадії iv); необов'язково після стадії, що передує додаванню мастильної речовини; і vi. пресування суміші в таблетки. Переважно, група фармацевтично прийнятних ексципієнтів, що застосовуються на стадіях способу I і iii) не містить лактози. У переважному варіанті здійснення спосіб додатково включає стадію покривання таблетки оболонкою і упакування у прийнятний пакувальний матеріал, такий як PVC, PVC/PVdC, PVC /PE/PVdC. Переважно, стадія, що передує змащуванню, включає змішування суміші на стадії (iv) протягом від 10 до 25 хвилин, переважно 20 хвилин перед стадією додавання мастильної речовини. Відповідно до іншої мети, винахід стосується застосування ірбесартану і безилату амлодипіну для виробництва лікарського засобу для лікування гіпертензії, де вказаний лікарський засіб знаходиться в стабільній твердій композиції з фіксованою дозою, як описаний вище. Переважно, застосування стосується терапії другої лінії для хворих на артеріальну гіпертензію, лікування яких недостатньо контролюється застосуванням монотерапії амлодипіном як блокатором кальцієвих каналів (CCB) або ірбесартаном як антагоністом рецепторів ангіотензину II (ARB). Короткий опис малюнків На Фіг. 1 показаний профіль розчинення ірбесартану в стандартному середовищі, тобто 0,1 н HCl. На Фіг. 2 показаний профіль розчинення амлодипіну в стандартному середовищі, тобто 0,1 н HCl. Докладний опис винаходу Переважні композиції ірбесартану і безилату амлодипіну. Два активних компоненти присутні в одній стандартній лікарській формі, такій як таблетки або гранули, де ірбесартан фізично відділений від безилату амлодипіну. Фармацевтично прийнятні добавки, придатні для застосування в даному винаході з безилатом амлодипіну, вибрані з прийнятних розріджувачів, таких як мікрокристалічна целюлоза, дифосфат кальцію і прийнятні мастильні речовини, такі як стеарат магнію. Фармацевтично прийнятні добавки, придатні для застосування в даному винаході з ірбесартаном, вибрані з прийнятних розріджувачів, таких як мікрокристалічна целюлоза, прийнятних глідантів, таких як діоксид кремнію, прийнятних мастильних речовин, таких як стеарат магнію, прийнятних зв’язувальних речовин, таких як гіпромелоза. У композиції за винаходом композиція, що містить амлодипін, схожа з відповідною композицією амлодипіну в складі норваска®, і частка ірбесартану схожа з відповідною композицією в складі апровелю®, за винятком моногідрату лактози. У переважному варіанті здійснення композиція не містить лактози як розріджувача. Фактично відсутність цього ексципієнта дозволяє досягнути кращих результатів для загальної стабільності безилату амлодипіну і, особливо, для зниження вмісту Домішки D. У переважній таблетованій формі ірбесартан випускається в формі гранул з покриттям, вміщених в екстрагранульовану матрицю, що містить безилат амлодипіну з ексципієнтами. Для полегшення процесу гранулювання в гранули ірбесартану додається зв’язувальна речовина, така як HPMC, а перед стадією пресування додають амлодипін в складі екстрагранульованої частки. 3 UA 103688 C2 5 10 15 20 У іншій переважній формі і ірбесартан, і амлодипін роздільно гранулюють із застосуванням відповідної прийнятної зв’язувальної речовини перед змішуванням із мастильними речовинами і подальшим пресуванням. Таким чином, тверда композиція має форму моношарової таблетки, переважно покритої плівкою. У іншій переважній формі гранули ірбесартану і амлодипіну разом з ексципієнтами відділені інертним шаром. Таким чином, тверда композиція має форму тришарової таблетки, переважно покритої плівкою. У цьому варіанті здійснення інертний шар переважно містить прийнятний розріджувач. Переважною формою є моношарова форма, в якій фізичний бар'єр розташовується навколо активного інгредієнта ірбесартану. Фізичний бар'єр потрібен для того, щоб зменшити або виключити фізичний контакт між ірбесартаном як захищеним активним інгредієнтом і безилатом амлодипіну, іншим активним інгредієнтом комбінації. Переважні композиції за даним винаходом містять один або декілька наступних компонентів у вказаному діапазоні концентрації (% по масі): ірбесартан від 50 до 70%, найбільш переважно 60%, безилат амлодипіну від 1 до 10%, найбільш переважно від 2 до 6%, розріджувач від 20 до 30%, найбільш переважно приблизно 25%, зв’язувальна речовина від 1 до 5%, найбільш переважно від 2 до 3%; сіль від 3 до 6%, найбільш переважно приблизно 5%; антиадгезив або глідант від 0,25 до 5,0%, найбільш переважно від 0,7 до 2%, мастильна речовина від 0,5% до 1,5%, найбільш переважно приблизно 1%. Кількість кожного інгредієнта (активного і добавок) в твердій лікарській формі за винаходом може, головним чином, варіювати в наступних діапазонах. Компонент 1 2 3 4 ірбесартан розріджувач розпушувач зв’язувальна речовина 5 очищена вода 6 7 8 9 10 25 30 35 40 безилат амлодипіну, еквівалентний амлодипіну розріджувач антиадгезив або глідант мастильна речовина матеріал покриття Загальний % вмісту в складі Дозування Дозування Дозування 150/5 мг 150/10 мг 300/5 мг Інтрагранулярний 60,00 60,00 60,00 26,40 21,60 26,40 4,80 4,80 480 2,00 2,00 2,00 В достатній В достатній В достатній кількості кількості кількості Екстрагранулярний Дозування 300/10 мг 60,00 26,40 4,80 2,00 В достатній кількості 2,80 5,60 1,40 2,80 2,00 1,00 1,00 4,00 4,00 1,00 1,00 4,00 3,40 1,00 1,00 4,00 2,00 1,00 1,00 4,00 Розподіл розміру частинок ірбесартану є важливим внаслідок того, що дрібні гранули ірбесартану сприяють однорідності амлодипіну. Розподіл гранул ірбесартану по розмірах частинок, в основному, залежить від поглинання рідини під час грануляції і часу перемішування. Переважний розподіл розміру гранул ірбесартану знаходиться в діапазоні від 65 до 85%, проходячи через #60 BSS, тобто що мають розмір або діаметр менший ніж 250 мкм. Кінцевий pH, що спостерігається для композиції складів ірбесартану і амлодипіну за винаходом, становить приблизно 6,0, тоді як відомо, що pH конкретного препарату порівняння вищий ніж 6,0, тобто знаходиться в межах від pH 6,0 до 7,0. Для композиції амлодипіну переважний рН вищий ніж 6, а при pH нижче за 6,0 процес руйнування амлодипіну прискорюється. Таким чином, в даному винаході рН вибраних композицій може досягнути 6 після пресування в таблетки. Кінцевим первинним пакувальним матеріалом, що застосовується є блістерна упаковка, тобто непрозорі трирядні (300micPVC/30micPE/90gsmPVdC), непрозорі дворядні (250micPVC і 60micPVdC) і алюмінієві блістерні упаковки. Ці матеріали виключають підвищення утворення Домішки-D в амлодипіні внаслідок пригнічення прямого впливу сонячного світла на лікарський препарат. 4 UA 103688 C2 5 10 15 20 25 30 35 40 45 50 55 60 Основною домішкою, вміст якої необхідно контролювати в композиції за винаходом, є Домішка D, відома в даній галузі як 3-етил-5-метил-2-[(2-аміноетокси)метил]-4-(2-хлорфеніл)-6метилпіридин-3,5-дикарбоксилат. У композиціях за винаходом через 6 місяців при 40C/75%RH виявляють менше ніж 1,5% (мас./мас.) від загального вмісту домішок у випадку амлодипіну, але коли ірбесартан і амлодипін фізично не відділені, виявлено більше ніж 1,6% домішок. У переважному варіанті здійснення в композиції за винаходом через 6 місяців при 40C/75%RH виявляють менше ніж 1,0% і більш переважно менше ніж 0,5% (мас./мас.) від загального вмісту домішок у випадку амлодипіну. Крім того, в композиціях за винаходом через 6 місяців при 40C/75%RH виявляють менше ніж 1,5%(мас./мас.) [фактично 0,097 % мас./мас.]. Домішки D у випадку амлодипіну, але більше ніж 1,6%. Домішки D у випадку, якщо ірбесартан і амлодипін фізично не відділені. У переважному варіанті здійснення в композиції за винаходом через 6 місяців при 40C/75%RH виявляють менше ніж 1,0% і більш переважно менше ніж 0,15% (мас./мас.). Домішки D у випадку амлодипіну. Це демонструє, що конкретні композиції за винаходом чинять знижуючий вплив на профіль руйнування безилату амлодипіну. З іншого боку, через 6 місяців при 40C/75%RH виявляють менше ніж 0,5% (мас./мас.) від загального вмісту домішок у випадку ірбесартану. Це показує, що специфічна композиція за винаходом не чинить впливу на профіль ірбесартану. Крім того, фізичні властивості таблетки, такі як колір, форма, жорсткість і час дезінтеграції не змінюються. Фізичні властивості Характеристики стабільності Пероральні фармацевтичні композиції за даним винаходом були піддані прискореним дослідженням стабільності при наступних умовах; 40C/75% відносна вологість RH, 30C/75%RH і 25C /60%RH. Вони були оцінені на основі аналізу, розчинення in vitro, вмісту вологи і відповідних речовин, виміряних в різні моменти часу від початку дослідження до терміну через 6 місяців після нього для ірбесартану, а також безилату амлодипіну. Дані результати представляють значне зниження рівня загального вмісту домішок у випадку амлодипіну, в основному, Домішки D у випадку, якщо ірбесартан і амлодипін фізично відділені. Зокрема, виявлено, що рівень домішок у випадку амлодипіну є досить низьким і знаходиться в рамках встановленої межі складу лікарського засобу, в якому ірбесартан гранулювали, а амлодипін додавали в складі екстрагранулярної частки. Ця композиція демонструє рівень домішок набагато нижчий, ніж у препаратів порівняння. Характеристики розчинення "Характеристики розчинення" таблетки, що містить комбінацію ірбесартану і безилату амлодипіну, порівнюють з характеристиками розчинення кожного препарату порівняння в умовах розчинення в різних середовищах, таких як 0,1 н HCl, pH 4,5, ацетатний буфер, фосфатний буфер з pH 6,8 і фосфатний буфер з pH 7,5. Хід розчинення відстежують в різні моменти часу від початкового моменту до 60 хвилин. Профіль розчинення стосується % по масі вивільнення ірбесартану або амлодипіну відносно до загальної маси ірбесартану або амлодипіну, що містяться в таблетці, яка розчиняється протягом 60 хвилин в різних середовищах (див. Фіг. 1 і 2 для стандартного середовища, тобто 0,1 н HCl). Результати показують, що характеристики розчинення таблетки, що містить комбінацію ірбесартану і безилату амлодипіну, за винаходом еквівалентні характеристикам таблеток, що містять кожний активний інгредієнт, ірбесартан або амлодипін окремо. Спосіб виробництва Спосіб отримання стабільної пероральної фармацевтичної композиції, що містить ірбесартан і безилат амлодипіну, включає наступні стадії: i. гранулювання ірбесартану і один або декілька фармацевтично прийнятних ексципієнтів з водним розчином, що містить зв’язувальну речовину для формування гранул. Переважно, прийнятні ексципієнти вибрані з групи, яка складається з мікрокристалічної целюлози, кроскармелози натрію. Переважно, прийнятні зв’язувальні речовини вибрані з групи, яка складається з похідних целюлози, таких як гідроксипропілметилцелюлоза. ii. сушіння гранул; iii. окреме змішування безилату амлодипіну з фармацевтично прийнятними ексципієнтами для кращого рівномірного розподілу амлодипіну. Переважно прийнятні ексципієнти вибрані з групи, яка складається з мікрокристалічної целюлози, діоксиду кремнію. iv. змішування гранул ірбесартану стадії i) із сумішшю безилату амлодипіну стадії iii); 5 UA 103688 C2 5 10 15 20 25 30 35 40 45 v. додавання мастильної речовини в суміш стадії iv); необов'язково після стадії, що передує додаванню мастильної речовини; і vi. пресування суміші в таблетки. У переважному варіанті здійснення способу стадія, що передує змащуванню, проводиться перед стадією v) для досягнення кращої однорідності і ірбесартану, і амлодипіну. Переважно стадія, що передує додаванню мастильної речовини, включає змішування суміші (iv) від 10 до 25 хвилин, переважно 20 хвилин перед здійсненням стадії додавання мастильної речовини. Фактично, внаслідок того, що ірбесартан присутній в інтрагранулярній частці, а амлодипін змішують з іншими екстрагранулярними ексципієнтами, подібними мікрокристалічній целюлозі і діоксиду кремнію, гомогенний розподіл амлодипіну в кінцевій суміші є необхідним. Таким чином, правильне змішування інтрагранулярного і екстрагранулярного матеріалу є важливою стадією для досягнення гомогенності амлодипіну в кінцевій суміші і може бути здійснене на стадії, що передує додаванню мастильної речовини, за допомогою змішування гранул ірбесартану з екстрагранулярним матеріалом до досягнення однорідності складу амлодипіну від 90 до 110% від заявленого вмісту з RSD (відносне стандартне відхилення) менше ніж 5%, що виявило однорідний розподіл безилату амлодипіну в пластифікованій суміші. У переважному варіанті здійснення група фармацевтично прийнятних ексципієнтів, що застосовуються в способі, не містить лактози. Спосіб додатково містить стадію покривання таблетки оболонкою і упаковування переважно в непрозору трирядну блістерну упаковку. Характеристика ефективності Метою за винаходом є застосування композиції за винаходом, що містить ірбесартан і безилат амлодипіну у виробництві лікарського засобу для лікування гіпертензії, де вказаний лікарський засіб знаходиться в стабільних твердих композиціях з фіксованою дозою, як описано вище. У переважному варіанті здійснення композиції за винаходом вводять пацієнту з гіпертензією від легкої форми до помірної внаслідок того, що терапія другої лінії для пацієнтів з гіпертензією недостатньо контролюється застосуванням монотерапії амлодипіном (блокатор кальцієвих каналів ССВ) або ірбесартаном (антагоніст рецепторів ангиотензину II ARB). Для оцінки комбінацій ірбесартану 150 мг/амлодипін 5 мг і ірбесартану 300 мг/амлодипін 5 мг в формі таблеток в порівнянні з монотерапією амлодипіном 5 мг, ірбесартаном 150 мг і 300 мг, через 8 тижнів лікування пацієнтів з неускладненою есенціальною гіпертензією розроблена подвійна сліпа, рандомізована, частково факторна III фаза з контролем плацебо тривалістю 8 тижнів. Метою цього дослідження є продемонструвати, що антигіпертензивна ефективність композиції ірбесартану і амлодипіну з фіксованою дозою 150/5 мг або 300/5 мг перевершує відповідну дозу при монотерапії амлодипіном або ірбесартаном. Винахід стосується переважних варіантів здійснення. Однак в об'ємі винаходу можлива множина варіантів. Приклади C1, C2, C3 представляють склади для порівняння. I1, I2, I3 представляють склади за винаходом, де ірбесартан фізично відділений від амлодипіну. Апровель® 300 мг, Карвеа® 300 мг представляють склад C1 як препарат порівняння для ірбесартану окремо. Істин 10 мг або норваск® 10 мг представляють склад C2 як препарат порівняння безилату амлодипіну окремо. Приклад 1 Отримання препарату композиції C3, де ірбесартан і амлодипін гранульовані разом. 50 Таблиця 1 Назва інгредієнтів Інтрагранулярна фаза Ірбесартан Безилат амлодипіну Мікрокристалічна целюлоза Кроскармелоза натрію Гіпромелоза Очищена вода # Кількість (мг/таб) 300,00 14,00 142,00 24,00 10,00 в достатній кількості 6 UA 103688 C2 Таблиця 1 Назва інгредієнтів Екстрагранулярна фаза Колоїдний діоксид кремнію Стеарат магнію Загальна маса серцевини таблетки (мг) Опадрай білий II Загальна маса таблетки з покриттям (мг) 5 Кількість (мг/таб) 5,00 5,00 500,00 10,00 510,00 Цей склад C3 можна отримувати за допомогою будь-якого прийнятного процесу гранулювання, відомого в даній галузі. Приклад 2 Отримання композиції за винаходом I1, де ірбесартан входить до складу інтрагранулярної частки, а амлодипін додають в екстрагранулярну частку. Ця комбінація також стосується досліджуваного препарату. Таблиця 2 Номер стадії 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. Компонент Функція Дисперсна фаза діюча речовина розріджувач/ Мікрокристалічна целюлоза зв’язувальна (Авіцел PH 101) речовина кроскармелоза натрію розпушувач гіпромелоза зв’язувальна (HPMC 6 сПз) речовина Ірбесартан очищена вода a розчинник для гранулювання Зовнішня фаза Безилат амлодипіну еквівалентний діюча речовина амлодипіну Мікрокристалічна целюлоза розріджувач (Авіцел PH 112) глідант/ діоксид кремнію антиадгезив стеарат магнію мастильна речовина Маса серцевини таблетки опадрай білий покриваюча речовина b 03B28796 очищена вода a розчинник для покриття Маса покритої таблетки 10 15 Кількість/ Одиниця Кількість/ (мг) Одиниця (%) 150 мг/5 300 мг/10 мг мг 60,00 150,00 300,00 26,40 66,00 132,00 4,80 12,00 24,00 2,00 5,00 10,00 в в в достатній достатній достатній кількості кількості кількості 2,80 7,00 5,00 14,00 10,00 2,00 5,00 10,00 1,00 2,50 5,00 1,00 100 % 2,50 250 мг 5,00 500 мг 4,00 10,00 20,00 в в в достатній достатній достатній кількості кількості кількості 260 мг 520 мг Спосіб отримання комбінації ірбесартану і безилату амлодипіну в формі таблетки по формулі I1 за допомогою екстрагранулювання. Стадія-1: Змішати ірбесартан, мікрокристалічну целюлозу і кроскармелозу натрію в грануляторі-змішувачі. Стадія-2: Гранулювати суху суміш зі стадії 1 з водним розчином гіпромелози. Стадія-3: Сушити вологі гранули і подрібнити висушені гранули через фільтр з розміром пор від 1,00 до 2,00 мм. 7 UA 103688 C2 5 10 Стадія-4: Додати екстрагранульований матеріал, тобто безилат амлодипіну, мікрокристалічну целюлозу і діоксид кремнію, і змішати в змішувачі з малими зсувними зусиллями. Стадія-5: Додати стеарат магнію до матеріалу зі стадії 4 і змішати в змішувачі з малими зсувними зусиллями. Стадія-6: Спресувати пластифікровану суміш із застосуванням прийнятного обладнання. Стадія-7: На закінчення покрити спресовані таблеткиз досягненням збільшення маси на 24%. Приклад 3 Отримання композиції за винаходом I2, де ірбесартан і безилат амлодипіну фізично відділені за допомогою роздільного гранулювання. Таблиця 3 Номер стадії Назва інгредієнтів Гранулювання ірбесартану 01 02 03 04 ірбесартан мікрокристалічна целюлоза кроскармелоза натрію гіпромелоза 05 очищена вода # 300,00 50,00 20,00 7,00 В достатній кількості 09 10 Гранулювання безилату амлодипіну безилат амлодипіну повідон K 30 вторинний кислий фосфат кальцію мікрокристалічна целюлоза кросповідон 11 очищена вода # 06 07 12 13 14 15 15 Кількість (мг/таб) Екстрагранулярна фаза мікрокристалічна целюлоза колоїдний діоксид кремнію стеарат магнію Загальна маса серцевини таблетки (мг) опадрай білий II Загальна маса таблетки з покриттям (мг) 14,00 9,00 60,00 40,00 6,00 В достатній кількості 10,00 5,00 5,00 526,00 10,00 536,00 Приклад 4 Отримання композиції за винаходом I3 в формі тришарової таблетки, де шар ірбесартану і шар безилату амлодипіну фізично відділені інертним шаром. Таблиця 4 Номер стадії 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. Інгредієнти Шар ірбесартану - маса 500 мг ірбесартан моногідрат лактози мікрокристалічна целюлоза кроскармелоза натрію гіпромелоза очищена вода колоїдний діоксид кремнію стеарат магнію Інертний шар - маса 200 мг мікрокристалічна целюлоза частково пептизований крохмаль Оксид заліза червоний (барвник) 8 Кількість/Таб (мг) 300,0 102,0 54,0 24,0 10,0 В достатній кількості 5,0 5,0 169,75 30,0 0,25 UA 103688 C2 Таблиця 4 Номер стадії 12. 13. 14. 15. 16. 17. 18. 19. 5 10 Інгредієнти Шар амлодипіну - маса 220 мг безилат амлодипіну повідон k 30 мікрокристалічна целюлоза кросповідон вторинний кислий фосфат кальцію, безводний очищена вода кросповідон стеарат магнію Середня маса таблетки Кількість/Таб (мг) 14,0 20,0 60,0 6,0 106,0 В достатній кількості 11,0 3,0 920 мг Приклад 5 Випробування стабільності Пероральні фармацевтичні композиції за даним винаходом були піддані прискореним випробуванням стабільності при наступних умовах; 40ºС/75% відносна вологість RH, 30ºС/75%RH і 25ºС/60%RH. Їх оцінювали на основі аналізу, розчинення in vitro, вмісту вологи і супутніх речовин, виміряних в проміжку між початковим моментом часу і 6 місяцями після початку випробувань. Цей тест проводили при наступних умовах. Таблетки упаковували в непрозору трирядну алюмінієву блістерну упаковку і такий блістер додатково упаковували в картонні коробки, і коробки піддавали випробуванням стабільності відповідно до керівництва ICH, і зразки забирали в інтервалі між кожною стадією випробування стабільності і піддавали аналізу. Результати випробувань стабільності при +40C/75%RH представлені в таблиці 5. 15 Таблиця 5 Загальні домішки ірбесартану в % мас./ мас. від загальної композиції C1 C2 C3 I1 I2 I3 Умови ірбесартан апровель 300 мг безилат амлодипіну досліджуваний препарат істин 10 мг ірбесартан+безилат амлодипіну КОМБІНОВАНЕ ГРАНУЛЮВАННЯ ірбесартан+безилат амлодипіну РОЗДІЛЕННЯ за допомогою екстрагранулювання Досліджуваний препарат ірбесартан+безилат амлодипіну РОЗДІЛЕННЯ за допомогою гранулювання ірбесартан+безилат амлодипіну РОЗДІЛЕННЯ за допомогою потрійного шару Загальні домішки в % мас./мас. від загальної композиції 6 місяців Приклад Домішка-D амлодипіну в % мас./мас. від загальної композиції Початковий момент часу Через 6 місяців Початковий момент часу Через 6 місяців 0,14 NA NA NA NA NA 0,06 0,38 0,05 0,99 0,15* 0,49* 1,60* 0,70* 2,33* 0,171 0,017 0,097 0,066 0,329 0,08** 0,06** 0,16** 0,15** 0,33** 0,034** 0,026** 0,188** 0,046** 0,388** * 2 місяці ** 3 місяці 9 UA 103688 C2 5 10 15 20 25 30 35 40 45 50 55 60 Склад, що містить ірбесартан і амлодипін, гранульовані разом, показує вищий рівень Домішки D під час випробувань стабільності при 40C/75%RH через 2 місяці, внаслідок чого подальше випробування стабільності було припинене. З результатів, вміщених вище, можна зробити висновок, що коли ірбесартан і амлодипін гранулюють разом, в амлодипіні відбувається збільшення рівнів загального вмісту домішок і головним чином Домішки D. Виявлено, що коли ірбесартан і амлодипін фізично відділені, рівень домішок в амлодипіні досить низький. Таким чином, склад I1, де ірбесартан гранулювали, а амлодипін додавали в екстрагранулярну частку, показує найкращі результати рівня домішок, тобто визначено набагато нижчі, ніж у препаратів порівняння (істин 10 мг). У композиціях за винаходом I1, I2, I3 виявлено менше ніж 1,5% (мас./мас.) від загального вмісту домішок для амлодипіну через 6 місяців при 40C/75%RH, хоча, коли ірбесартан і амлодипін фізично не відділені (C3), виявлено більше ніж 1,6% домішки. В переважному варіанті здійснення через 6 місяців при 40C/75%RH для амлодипіну в композиції за винаходом (I1, I2, I3) виявлено менше ніж 1,0% і більш переважно менше ніж 0,5% (мас./мас.) від загального вмісту домішок. Крім того, виявлено менше ніж 1,5% (мас./мас.) Домішки D у випадку амлодипіну через 6 місяців при 40C/75%RH в композиції за винаходом (I1, I2, I3), хоча більше ніж 1,6%. Домішки D виявлено, коли ірбесартан і амлодипін фізично не відділені (C3). В переважних варіантах здійснення менше ніж 1,0% і більш переважно менше ніж 0,15% (мас./мас.) Домішки D для амлодипіну виявлено в композиції за винаходом (I1, I2, I3) через 6 місяців при 40C/75%RH. У більш переважному варіанті здійснення менше ніж 0,15% (мас./мас.). Домішки D для амлодипіну і менше ніж 1,5% (мас./мас.) від загального вмісту домішок для амлодипіну виявлено через 6 місяців при 40C/75%RH в композиції за винаходом (I1). Це демонструє, що конкретні композиції за винаходом чинять понижувальний вплив на профіль руйнування безилату амлодипіну. З іншого боку, менше ніж 0,5% (мас./мас.) від загального вмісту домішок для ірбесартану виявлено через 6 місяців при 40C/75%RH. Це показує, що специфічна композиція за винаходом не чинить впливу на профіль руйнування ірбесартану. Приклад 4 Профілі - Біоеквівалентність Розчинення Профілі розчинення препаратів за винаходом порівнюють з профілями розчинення препаратів порівняння. Ці випробування проводять при кожних умовах дослідження профілю розчинення в різних середовищах, як показано нижче. Профілі розчинення отримували для таблеток зі середньою масою 260 мг [для 150/5 мг і 150/10 мг] або 520 мг [для дози 300/5 і 300/10 мг] ірбесартану і амлодипіну в формі FCT з використанням пристрою USP II, поміщуючи таблетку в 900 мл розчинник при 37°С і вимірюючи кількість ірбесартану, що поступово розчиняється, або амлодипіну [за допомогою ВЕРХ, довжина хвилі 240 нм] в різні моменти часу, такі як 10, 15, 30, 45 і 60 хвилин, до розчинення 90% лікарського засобу. Ці результати, як зображено на фіг. 1 і 2, показують, що характеристики розчинення таблетки, що містить комбінацію ірбесартану і безилату амлодипіну за винаходом, еквівалентні характеристикам розчинення таблеток, що містять кожний активний інгредієнт, - ірбесартан або амлодипін окремо. Приклад 5 III фаза клінічних досліджень Перше дослідження проводять з фіксованою комбінацією ірбесартану і амлодипіну 150/5 і 300/5 мг і з ірбесартаном 150 і 300 мг. Передбачається, що комбінована терапія ірбесартаном і амлодипіном забезпечить підвищену ефективність у пацієнтів, стан яких неадекватно контролюється однією тільки монотерапією ірбесартаном. Друге дослідження проводять з фіксованою комбінацією ірбесартану і амлодипіну 150/5 і 150/10 мг і з амлодипіном 5 і 10 мг. Передбачається, що комбінована терапія ірбесартаном і амлодипіном забезпечує підвищену ефективність у пацієнтів, стан яких неадекватно контролюється однією тільки монотерапією ірбесартаном. Результати демонструють, що антигіпертензивний ефект фіксованої комбінації ірбесартану і амлодипіну 150/5 мг, оцінений вимірюванням артеріального тиску в домашніх умовах (HBPM), 10 UA 103688 C2 5 10 15 20 25 30 перевищує антигіпертензивний ефект амлодипіну 5 мг окремо у пацієнтів з артеріальною гіпертензією, у яких гіпертензія недостатньо контролюється монотерапією амлодипіном 5 мг. У кожному клінічному дослідженні випадковим чином відбирали 244 пацієнта. Це дозволяло отримувати 122 випадково відібраних пацієнта і 103 пацієнта для оцінки в кожній лікувальній групі. Всі препарати вводилися пацієнтам перорально, щодня один раз на день вранці. Критерії ефективності Вимірювання артеріального тиску BP в домашніх умовах для всіх пацієнтів проводять за допомогою валідованого автоматичного неінвазивного контролю ВР відповідно до стандартної процедури: двічі на добу протягом 7 діб 2 вимірювання вранці і 2 вимірювання увечері. Ці періоди HBPM проводять за тиждень до V2, V3 і V4. Вимірювання BP в кабінеті проводять під час кожного візиту. Всі дослідники застосовують той же самий валідований автоматичний, але неінвазивний BP монітор. Первинний критерій ефективності: SBP в домашніх умовах як первинний критерій основується на вимірюваннях, проведених у пацієнта за останні 7 діб кожного періоду вимірювання. Ранкові і вечірні вимірювання перших діб кожного періоду вимірювання не враховуються по цьому критерію внаслідок того, що їх вважають тренувальними. Первинний критерій обчислюється на основі середньоарифметичного всіх доступних вимірювань максимум з 24 вимірювань (4 вимірювання на добу протягом 6 діб). Це середньоарифметичне обчислюється тільки, якщо за останні 6 діб кожного періоду вимірювання реєструється як мінімум 12 правильних вимірювань. Результати першого дослідження демонструють, що антигіпертензивна ефективність фіксованої комбінації ірбесартан/амлодипін 300/5 мг перевищує ефективність монотерапії ірбесартаном 300 мг для пониження систолічного артеріального тиску, оціненого за допомогою вимірювання артеріального тиску в домашніх умовах (HBPM) через 10 тижнів лікування (W10). Результати другого дослідження демонструють, що антигіпертензивний ефект, оцінений за допомогою вимірювання артеріального тиску в домашніх умовах (HBPM) фіксованої комбінації ірбесартану і амлодипіну 150/5 мг, перевищує ефективність амлодипіну 5 мг окремо у пацієнтів з гіпертензією, стан яких недостатньо контролюється монотерапією амлодипіном 5 мг. ФОРМУЛА ВИНАХОДУ 35 40 45 50 55 60 1. Стабільна тверда пероральна фармацевтична композиція з фіксованою дозою в формі одношарової таблетки, що містить ірбесартан, безилат амлодипіну і фармацевтично прийнятні ексципієнти, де ірбесартан фізично відділений від безилату амлодипіну і де ірбесартан в формі гранул з покриттям поміщений в екстрагранулярну матрицю, шо містить безилат амлодипіну. 2. Композиція за п. 1, де таблетка має плівкове покриття. 3. Композиція за п. 1 або 2, де ірбесартан складає від 20 % до 70 % від загальної маси композиції. 4. Композиція за будь-яким з пп. 1-3, де безилат амлодипіну складає приблизно від 1 % до приблизно 20 % від загальної маси композиції. 5. Композиція за будь-яким з пп. 1-4, де фармацевтично прийнятні ексципієнти вибрані з групи, яка складається з розріджувача, розпушувача, антиадгезиву, зв'язувальної речовини, мастильної речовини і їх суміші. 6. Композиція за будь-яким з пп. 1-5, де вказана тверда композиція не містить лактози. 7. Тверда композиція за будь-яким з пп. 1-6, де кількість ірбесартану знаходиться в межах між 150 мг і 300 мг від загальної маси таблетки, переважно 300 мг або 150 мг. 8. Тверда композиція за будь-яким з пп. 1-7, де кількість безилату амлодипіну складає від 5 мг до 10 мг від загальної маси таблетки, переважно 7 мг або 14 мг. 9. Тверда композиція за будь-яким з пп. 1-8 в формі таблетки, де загальна маса таблетки складає від 400 мг до 600 мг, переважно 500 мг. 10. Композиція за будь-яким з пп. 1-9, що має менше 1,50 % (мас./мас.) від загального вмісту домішок для амлодипіну і менше 0,50 % (мас./мас.) від загального вмісту домішок для ірбесартану через 6 місяців при 40 °C/75 % RH. 11. Спосіб отримання стабільної пероральної фармацевтичної композиції в формі одношарової таблетки, шо містить ірбесартан і безилат амлодипіну, шо включає стадії: і) гранулювання ірбесартану і одного або декількох фармацевтично прийнятних ексципієнтів з водним розчином, що містить зв'язувальну речовину, для формування гранул; ii) сушіння гранул; 11 UA 103688 C2 5 10 15 ііі) роздільне змішування безилату амлодипіну з фармацевтично прийнятними ексципієнтами; iv) змішування гранул ірбесартану зі стадії іі) з сумішшю безилату амлодипіну зі стадії ііі); v) додавання мастильної речовини в суміш зі стадії iv); необов'язково після стадії, що передує додаванню мастильної речовини; і vi) пресування суміші в таблетки. 12. Спосіб за п. 11, де група фармацевтично прийнятних ексципієнтів, що використовуються на стадіях і) і ііі) способу, не містить лактози. 13. Спосіб за будь-яким з пп. 11 або 12, де стадія, що передує додаванню мастильної речовини, включає змішування суміші зі стадії iv) протягом від 10 до 25 хвилин, переважно 20 хвилин, перед стадією додавання мастильної речовини. 14. Застосування ірбесартану і безилату амлодипіну для виробництва лікарського засобу для лікування гіпертензії, де вказаний лікарський засіб знаходиться в стабільній твердій композиції з фіксованою дозою за будь-яким з пп. 1-10. 15. Застосування за п. 14 як терапії другої лінії для пацієнтів з гіпертензією, стан яких недостатньо контролюється застосуванням монотерапії амлодипіном як блокатором кальцієвих каналів (ССВ) або ірбесартаном як антагоністом рецепторів ангіотензину II (ARB). Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 12
ДивитисяДодаткова інформація
Назва патенту англійськоюSolid pharmaceutical fixed dose compositions comprising irbesartan and amlodipine, their prepatation and their therapeutic application
Автори англійськоюKhullar, Praveen, Kolhe, Vinay, Kulkarni, Amol, Patil, Shirishbay, Phadke, Yashwant, Saravanan, D., Shingte, Mansing
Автори російськоюКхуллар Правин, Колхе Винай, Кулкарни Амол, Пател Ширишбай, Пхадке Яшвант, Сараванан Д., Шингте Мансинг
МПК / Мітки
МПК: A61K 31/4178, A61K 9/50, A61P 9/12, A61K 31/4422, A61K 9/20
Мітки: амлодипін, отримання, фіксованою, тверді, фармацевтичні, застосування, містять, композиції, дозою, ірбесартан, терапевтичне
Код посилання
<a href="https://ua.patents.su/14-103688-tverdi-farmacevtichni-kompozici-z-fiksovanoyu-dozoyu-shho-mistyat-irbesartan-i-amlodipin-kh-otrimannya-i-kh-terapevtichne-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Тверді фармацевтичні композиції з фіксованою дозою, що містять ірбесартан і амлодипін, їх отримання і їх терапевтичне застосування</a>
Попередній патент: Ортез для розробки контрактур колінних суглобів
Наступний патент: Спосіб одержання водної суспензії органічної пестицидної сполуки
Випадковий патент: Гідродинамічний кавітаційний реактор