Спосіб одержання похідних метилендифосфонової кислоти
Номер патенту: 4913
Опубліковано: 28.12.1994
Автори: Жорж Гарсіа, Ксавьє Емонд-Альт, Жан-Клод Брєльєр
Формула / Реферат
Способ получения производных метилевди-фосфоновой кислоты общей формулы
где R1- водород, линейный или разветвленный низший С1-С4-алкил;
R2- алкил, который может быть замещен гидроксильной или тиольной группой, одним или несколькими атомами галогена, алкоксикарбонильной группой или группой
где Z1 и Z2- независимо друг от друга водород, низший алкил, фенил, который может быть замещен одним или несколькими атомами галогена, нитрогруппой, низшей алкильной или низшей алкоксильной группой, трифторметил, -NН2, -СООН или -СОО- алкил группами;
группа
где Х- кислород или сера, Z1 и Z2 имеют указанные значения, 5- или 6-ти членный гетероцикл, содержащий 1 или 2 гетероатома, выбранных из азота и серы, 5-ти членный гетероцикл, конденсированный с бензольным кольцом и имеющий формулу
где Х- кислород, группа NН или сера;
R3- водород или галоген;
n - целое число от 0 до 10,
при условии, что при R1- водород и n=0, R2 не является метильной или пиридильной группами, при R1 - метил или этил, n=0, R2 не является фенилом или замещенным фенилом формулы
где Q - галоген, нитро- или трифторметильная группа, заключающийся в том, что тетраалкило-вый эфир метилевдифосфоновой кислоты подвергают взаимодействию с гидридом натрия в среде толуола и/или диметилформамида при 15-25°С с последующей обработкой образующегося натрийсодержащего дифосфоната сульфидом общей формулы
или дисульфидом общей формулы
R2-S-S-R2,
где R2 и n - имеют указанные значения;
Y - галоген,
при температуре от 20°С до температуры кипения реакционной смеси и выделением целевого продукта в виде эфира или переводом его в кислоту путем омыления.
Текст
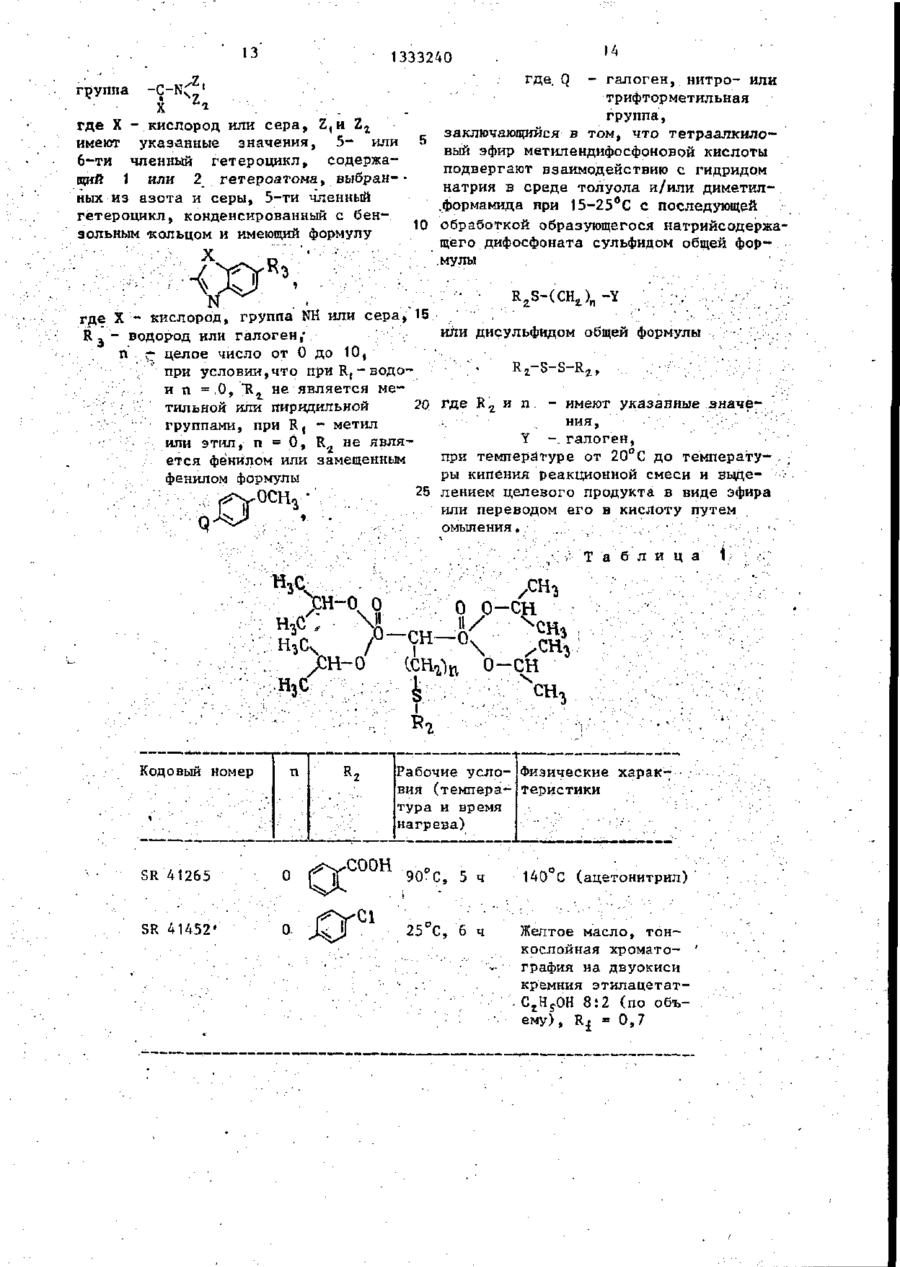
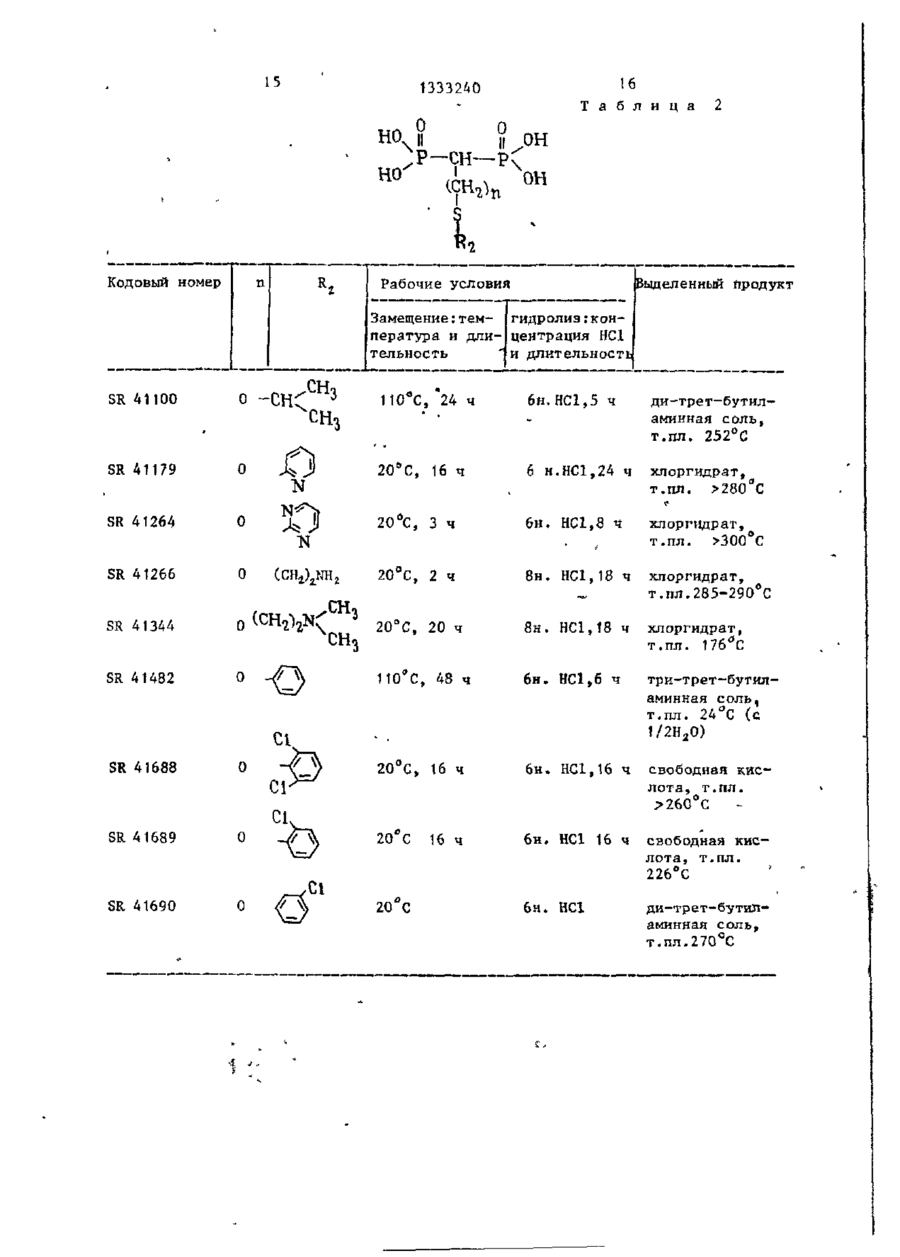
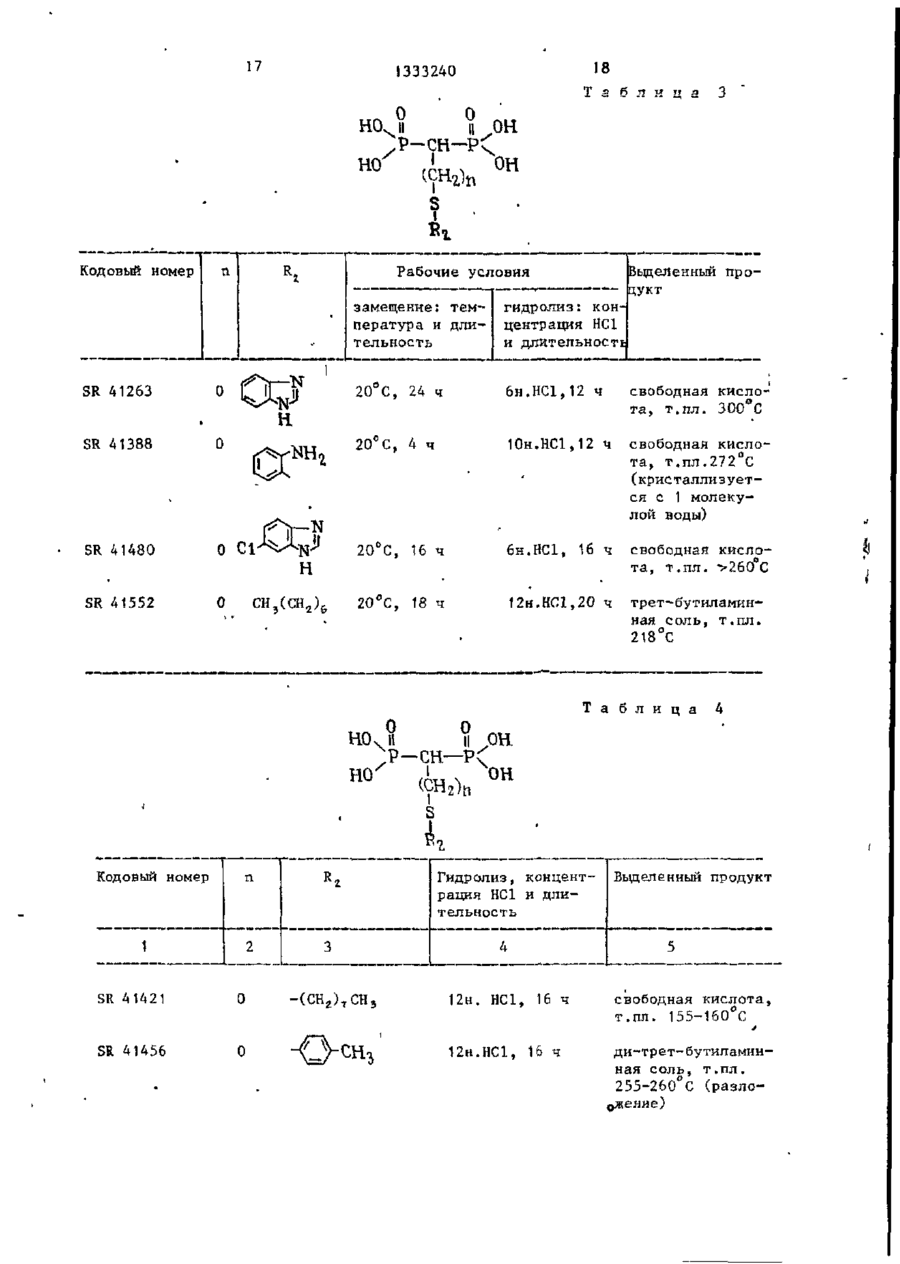
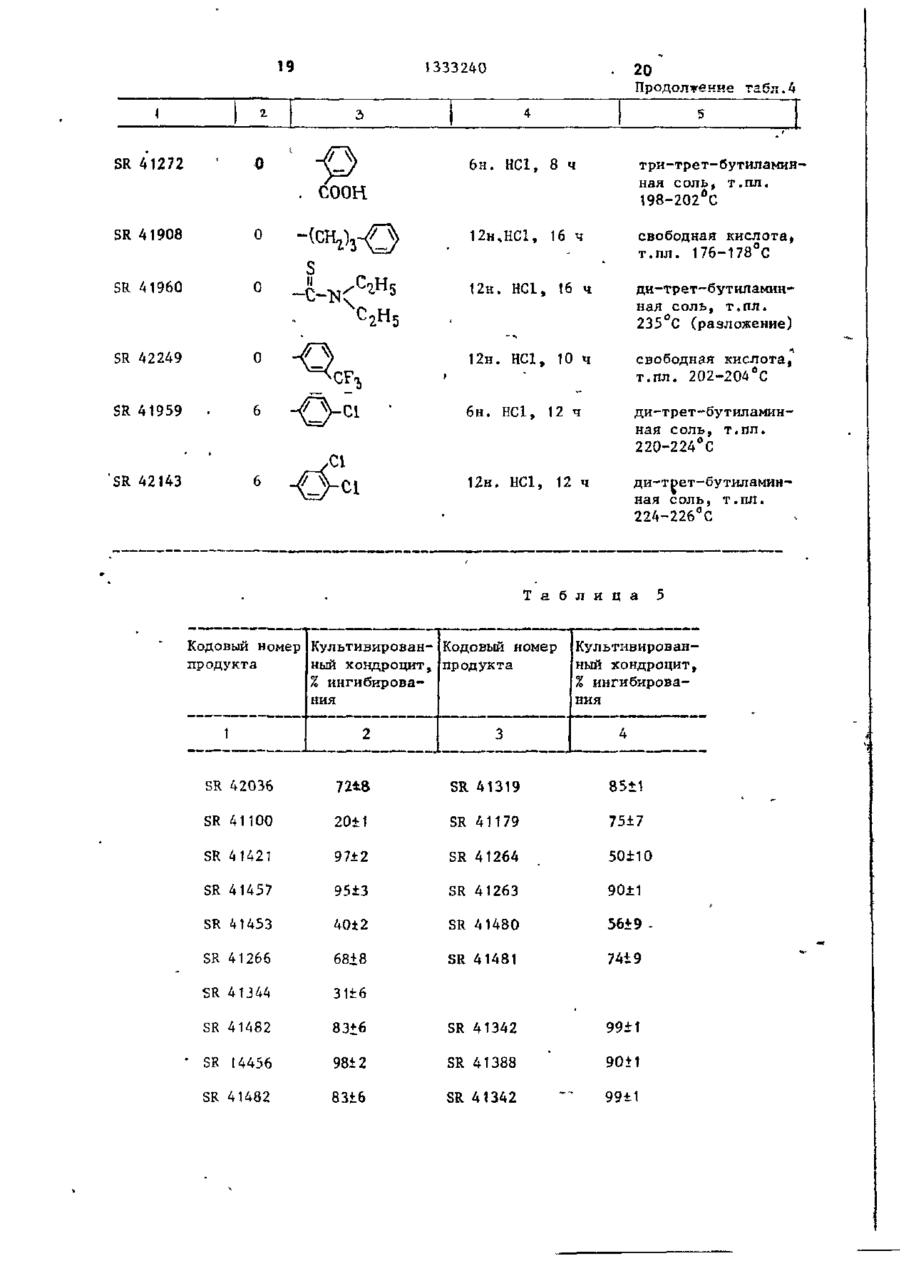
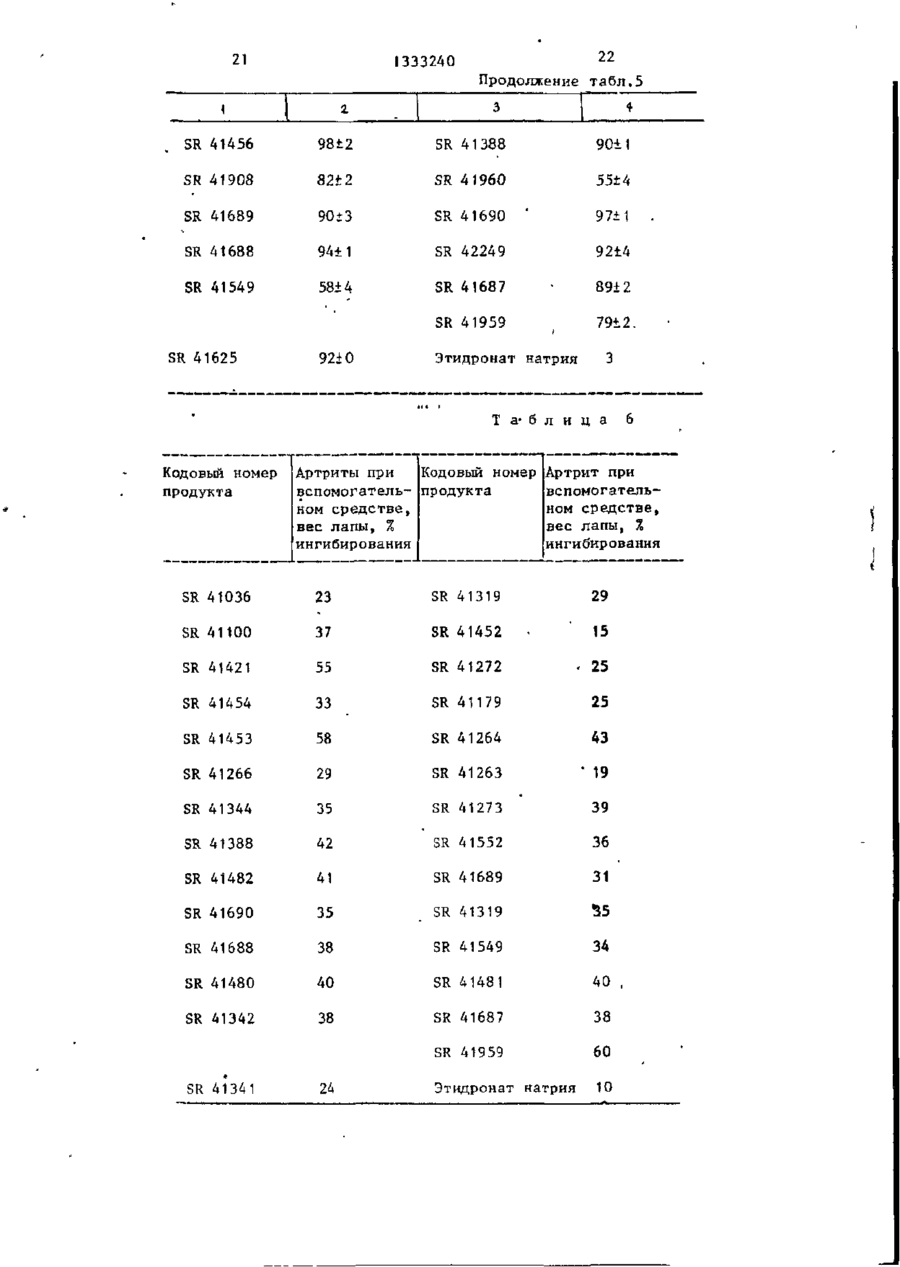
Изобретение касается фосфорорганической химии, в частности получения производных метилендифосфоновой кислоты (МФК) общей формулы И (R(O)ZR(O)-CHK-R(O) (СЖ,)г,где К= (СНДSR 2 ; R, = Н, прямой или разветвленный С,-С4-алкил; Кг -алкил, не- или ^замещенный: а) ОН, SH, одним или несколькими галогенами, алкоксикарбонилом-, б) NZ,Z a ; Z, и г2-независимы и представляют Н, низший алкил, фенил, не- или замещенный одним или несколькими атомами галогена, N 0 2 , низшим алкилом, низшим алкоксилом, CFg, NH 2 , С(0)ОН, С(0)0 - алкил; в) C(X)NZ 4 Z 2 ; X = 0 или S, или вместе с азотом 5- или 6-ти' членный гетероцикл, содержащий один или два гетероатома азота и/или серы, гетероцикл: где X = 0*, >NN, S^ -Y, или дисульфидом -R 2 -S-S-R 2 , где R 2 и п - указаны выше; Y - галоген, при температуре от 20°С до точки кипения реакционной смеси. Выделение целевого продукта ведут в виде эфира, который при необходимости может быть переведен омылением в кислоту. Новые МФК оказывают ингибирующее действие на секреции нейтральных протеиназ стимулированными хондроцитами до 99%, а также на артриты'и ревматоидные полиартриты до 55%. 6 табл. СО С оз 00 > 1333240 Изобретение относится к химии фосПроизводные метилендифосфоновой форорганических соединений с С-Р кислоты формулы (1) обладают противосвязью, а именно к способу получеревматической и противовоспалительния новых производных метилендифосной активностью и могут найти примефоновой кислоты общей фор>чулы нение в медицине. Целью изобретения является разраCD ^ORi ботка способа получения новых производных метилендифосфоновой кислоты, которые проявляют противоревматичес10 0 (СН,)и о кую и противовоспалительную активность , где R, - водород, линейный или разП р и м е р 1. Тетраметил-2-бенветвленный низший алкил С,-С 4 , зоксазолилтиометилендифосфонат, R, = » R - алкил, который может быть /0 15 = СП,; п = 0; п * замещен гидроксильной или тиольной группой, одним или несколькими атомами галогена, алкоксикарбонильной гругг В смесь 24 г тетраметилметилендипой или группой 7і фосфоната и 50 мл диметилформамида добавляют в атмосфере азота и при 15 С 2,5 г гидрида натрия. Выдержигде Z, и Z 2 - независимо друг от вают смесь при перемешивании при 15 С друга водород, низший алкил, фенил, в течение 1 ч, затем добавляют при который может быть замещен одним или 20 С 44 г 2-дибензоксазолилдисульфинесколькими атомами галогена, нит25 да. Продолжают перемешивание при 25 С рогруппой, низшей алкильной или низв течение 68 ч, затем выпаривают ди^ шей алкоксильной группой, трифтормеметилформамид при 20 С под вакуумом. тилом, -NH 2 , -СООН или - С00 - алОстаток, растворенный в метиленхлорикил группами; де, хроматографируюг на колонке с Z, 30 500 г двуокиси кремния. группа - С - NЭлюируя метиленхлоридом, удаляют X ^Z. непрореагировавшие исходные продукты, затем, элюируя смесью метиленхлорида где X - кислород или сера-, с этанолом 96:4 (по объему), получаZ, H Z 2 - имеют указанные значения; 35 ют загрязненный целевой продукт. 5- или 6-ти членный гетероцикл, соОчищают путем нового хроматографидержащий 1 или 2 гетероатома, выбрования на 160 г двуокиси кремния. ранных из азота и серы, 5-ти членС помощью смеси метиленхлорида и этаный гетероцикл, конденсированный с нола 97:3 (по объему) получают пробензольным кольцом и имеющий формулу дукт, который кристаллизуется при охлаждении раствора до 0 С, т.пл.7678°С. Работая таким же образом со сложным тетраизопропиловым эфиром мети— где X - кислород, группа NH или се- 45 лендифосфоновой кислоты и изменяя используемый дисульфид, получают разра, личные сложные эфиры, представленные R 5 - водород или галоген; в табл. 1. п - целое число от 0 до 10, Условия синтеза и физические хапри условии, что при Rf -водород и рактеристики производных метилендип = 0, R 2 - не является метильной или 50 фосфоновой кислоты представлены в пиридильной группами, при Rf -метил табл. 1. или этил, п = 0, R 2 - не является феП р и м е р 2, Тетраизопропил-4нилом или замещенным фенилом формулы фенилтио-1,1-бутилендифосфонат (SR55 41341), где Q - галоген, нитро- или трифтор метильная группа. \ сн 1333240 Получают натриевое производное ношении этилацетата и этанола 95:5 гетраизопрогшлметилендифосфоната (по объему) (SR-42248). (34,4 г) как в примере 1, затем доНаконец, используя ди(3-трифторбавляют 28,7 г 1-бром-3-фенилтиометил-4-нитро-фенил)дисульфид, полупропана и нагревают при 100 С в течают точно так же тетраизопропил (3чение t ч. трифторметил-4-нитро-фенилтио)мети* Растворитель выпаривают досуха лендифосфонат, Ri = 0,51, при соотпод вакуумом, затем остаток раствоношении этилацетата и этанола 95:5 ряют в 500 мл воды и экстрагируют ме10 (по объему), SR 42247. тиленхлоридом. Отделяют органичесП р и м е р 4. Тетраизопропилікую фазу, сушат над сульфатом нат7-(4-нитрофенилтио)-1,1-гептилидендирия и растворитель выпаривают под фосфонат (SR-42147), вакуумом. Остаток нагревают при V 130 С под вакуумом для удаления ле3 тучих продуктов, затем хроматографируют на колонке с силикагелем, = 6, R, = Н, В,= элюируя смесью хлороформа и метаноК раствору 27 г тетраиэопропилла 99:1 (по объему). метилендифосфоната в 200 мл толуола Таким образом, получают масло (23 г ) , которое очищают снова путем 20 порциями добавляют 3,8 г 50%-ной суспензии гидрида натрия в масле. хроматографии на силккагеле с помоПосле окончания добавления оставляют щью той же системы растворителей. Пу1 ч перемешиваться, затем добавляют •тем тонкослойной хроматографии на 27 г 1-(4-нитро-фенилтио)-6-бромгекдвуокиси кремния с помощью системы 25 сана и нагревают в течение 3 ч при растворителей бутанон-2 и воды 45:5 80°С. (по объему), получают пятно с R, = Выпаривают досуха под вакуумом и = 0,57. остаток растворяют в гексане. Раствор П р и м е р 3. Тетраизопропил-нпромывают два раза водой, затем суоктилтиометилендифосфонат (SR-41454) 30 шат над сульфатом натрия. Раствори.СН = 0, R 2 = -(CH,)7-CH: тель выпаривают досуха и остаток хроt матографируют на колонке с двуокисью кремния, элюируя смесью метиленхлорид:метанол 98:2 (по объему). Таким Работают согласно примеру 1, используя в качестве растворителя смесь 35 образом, получают 8,5 г масла, хабезводного толуола с диметилформамирактеризующегося путем тонкослойной хроматографии на.двуокиси кремния дом. с помощью системы растворителей этилПосле нагревания в течение 16 ч ацетата и этанола 95:5 (по объему), при 100°С путем такой же обработки 40 R., равном 0,37. получают целевой продукт в виде масПоступая таким же образом, но ла, характеризующийся согласно тонизменяя используемое бромсодержащее кослойной хроматографии на двуокиси производное, получают: кремния в системе растворителей этилтетраизопропил-7~(4-метоксифенилацетата и этанола 8:2 (по объему), 45 тио)-1,1-гептилидендифосфонат (SR R, = 0,65. . Точно так же, заменяя диоктилдисуль- 42306) , R £ 0,37 этилацетат:этанол 95:5, по объему)і фид эквивалентным количеством ди-птетранзопропил-7(4-хлорфенилтио)~ толилдисульфида, получают тетраизо1,1-гептнлидендифосфонат (SR 41964), пропил-n толилтиометилендифосфонат (SR-41455), масло, характеризующее- 5 0 Rx О»37(зтилацетат:этанол, 95:5, по объему)-, ся путем тонкослойной хроматографии тетраизолропил-7-(3,4-дихлорфенилна двуокиси кремния с помощью систетио)-1,1-гептилидендифосфонат (SR мы растворителей этилацетата и эта42146), R, :0,37 (этилацетат:этанол нола 8:2 (по объему), Rr, равным 0,57. 55 95:5, по объему),' тетраизопропил-7-(4-хлорфенилтио)Точно гак же с ди(3-трифгорметил1,1-ундецилидендифосфонат (SR 42145),' фенил)дисульфидом получают тетраизоЇЦ-0,37 (этилацетат:этанол 95:5, по пропил (3-трифторметилфенилтио)метиобъему). лендифосфопат, Ri = 0,51, (при соот сн 6 1333240 дукт смесью метиленхлорида с этаноП р и м е р 5. Тетраизопропил лом У7:3 (ПО объему). Продукт полу(З-фетш-ііропшітио)метипидендифосфочается в виде масла R. 0,60 (этилнат (SR 41907), а ц е т а т : этанол,' 95: 5, по объему). Б течение 20 ч при 25 С перемешивают смесь 29,2 г тетраизопропилметиП р и м е р 8. Три(трет-бутиллиденфосфоната, 80 мл толуола, 11,2 г амин)метилтиометилендифосфонат (SR • 4 1 0 3 6 ) , R, = Н, п = 0, R 2 = СН 3 . поташа и 23,2 г (3-фенил-пропил)дисульфида. В смесь 8,8 г тетраизопропилмеСмесь промывают пять раз 50 мл во- 10 тилендифосфоната и 25 мл толуола ды, затем сушат раствор над сульфатом при 0°С добавляют 0,65 г гидрида натнатрия и выпаривают досуха под вакурия, затем перемешивают в течение затем перемешивают умом. 1 ч при 15 С. Добавляют 25 мл диметилПолучают масло, хроматографируемое дисульфида, затем нагревают при 60 С на колонке с 500 г двуокиси кремния. 15 в течение 24 ч. Концентрируют досуПосле удаления элюированных метиленха под вакуумом, затем остаток растхлоридом примесей путем элюирования воряют в 250 мл диизопропилового эфисмесью метиленхлорида с этанолом ра. Отфильтровывают нерастворимую •95:5 (по объему) получают целевой прочасть и концентрируют досуха. Хромадукт (11,2 г ) , хроматографируемой на . тографируют на колонке с окисью алютонком слое двуокиси кремния: R, = миния (150 г ) . Элюируют сначала ди= 0,5 (этилацетат:этанол 95:5, по объизопропиловым эфиром для удаления ему) . Точно таким же образом, но испримесей, затем метиленхлоридом, изпользуя ди(2-метокси-токсикарбонилвлекающим целевой продукт. этил)дисульфид, получают тетраизопроКипятят с обратным холодильником пил С2-метоксикарбонилэтилтио)метиленв течение 5 ч 3 г вышеполученного дифосфонат (SR 42250), Я і 0,37 (этилсложного эфира в 12 мл водного 6 н, ацетат :этанол 95:5, по объему). раствора НС1. Раствор промывают три і раза 30 мл пентана, затем обесцвеП р и м е р 6. TeTpa3THn(N,N-flHчивают водную фазу активным углем и этилтиокарбамоилтио)-метилендифосфо- 30 концентрируют под вакуумом досуха. нат (SR 41905). Таким образом, полученную сырую Работают, как в примере 3, исходя кислоту превращают в соль, добавляя из тетраэтилметилендифосфоната и биск ней 2,4 г трет-бутиламина в 200 мл (диэтилтиокарбамоил)дисульфида. Точкипящего абсолютного этанола. После но таким же образом получают масло 35 охлаждения получают тритетрабутилс R, 0,5 (этилацетат:этанол 8:2, по амииную соль в виде бесцветного объему), при тонкослойной хроматогратвердого вещества, т.пл, 212 С. фии на двуокиси кремния, Точно таким же образом, изменяя П р и м е р 7. Тетраизопропил используемые дисульфиды, получают (перфторгексилтио)метилендифосфонат 40 кислоты (1), представленные в табл.2. (SR 42327). Условия синтеза и физические хаПри 25 С и в атмосфере азота перактеристики производных метиленди— ремешивают смесь 16 г тетраизопрофосфоновой кислоты представлены в пилметилендифосфоната и 1,05 г гидтабл. 2. рида натрия. Спустя 1 ч добавляют П р и м е р 9. Ди-(трет-бутил10 мл перфторгексилсульфенилхлорида. амин)-(4-хлорфенил)тиометилендифосТемпература спонтанно повышается до фонат (SR 41319), R. = Н; п = 0; 80°С. Выдерживают 3 ч при этой температуре, затем смесь выливают в 50 мл воды и экстрагируют эфиром. 50 Растворитель выпаривают и остаток * Работают как описано в примере растворяют в 100 мл гексана. Раст4, заменяя в качестве растворителя вор промывают 5 раз 100 мл воды, затолуол диметилформамйдом. тем сушат раствор и концентрируют Для осуществления замещения эфир досуха под вакуумом. метилендифосфоновой кислоты нагревагот с дисульфидом при 25 С в тече, Остаток хроматографируют на коние 6 ч. Выделяют сложный эфир как лонке с двуокисью кремния. Иепрореауказано в примере 4, затем превращагировавшие продукты удаляют метиленют в сопь с 12 н.НС1 в течение 18 ч. хлоридом, затем элюируют целевой про 7 1333240 Таким же образом получают кислоцилтиометилендифосфоновую кислоту, ту, которую превращают в ди-трет-бувыделяемую в виде ди-трет-бутиламинтиламинную соль, как указано в приной соли (SR 41457), т.пл. 170-175°С. мере 4, т.пл. 253°С (разложение). П р и м е*р 13О Ди(трет-бутилУсловия синтеза и физические хаамин)~-(2-окси-этилтио)-метилендифосфонат (SR 4T3T8), R ( = Н, п = 0, R 2 рактеристики производных метиленди= Н0-СН 2 СН г -. фосфоновой кислоты представлены в табл. 3. При 70 С в течение \ мин нагреваП р и м е р 10. Трет-бутиламин10 ют смесь 35 г ди-(2-оксиэтил)дисульЗ-метилтио-1,1~пропилидендифосфонат фида, 80 мп 3,4-дигидро-2Н-пирана и 0,1 г п-толуолсульфокислоты. (SR 41273),, R, = Н, п = 2, Rz = СН 3 . Работают как в примере 4, заменяя Охлаждают до 40°С и в течение дисульфид 1-бром~2-метилтиоэтаном. 10 мин перемешивают. Выливают в После нагревания в течение 20 ч при 15 200 мл воды и экстрагируют эфиром. Эфирйый раствор высушивают и выпари30 С» выделяют сложный эфир, затем вают растворитель досуха с получением его гидролизуют как указано в при71 г дисульфида, содержащего две мере 4 с помощью 8 н,НС1 при кипяспиртовые функцииs блокированные в чении с обратным холодильником. Наконец,, кислоту превращают в соль 20 Форме простого 3,4-дигидро-2н-пиранилового эфира * воздействием на нее трет-бутиламина, т.пл. 2!2-2К°С. Осуществляют конденсацию вышеукаП р и м е р 11. Ди-(трет-бутилзанного дисульфида с тетраизопропилметилендифосфонатом, согласно приамин)-4-фенилтиобутилидендифосфонат 25 меру 5, поддерживая температуру 20 С (SR 41342), = Н; п = 3; Я ^ в течение 3-х ч. Кипятят с обратным холодильником в Полученный продукт (18 г) раствотечение 7 ч раствор 5 г сложного эфиряют в 150 мл метанола и добавляют ра SR 41341 (пример 1) в 18 мл 6 н, 2 мл концентрированной соляной кислоНС1. Выпаривают досуха и остаток ты. Кипятят с обратным холодильником 30 растворяют в 25 мл воды. Отсасывают в течение 1 ч, затем концентрируют и осадок высушивают и перекристалметанол и выпивают в 200 мл воды. лизуют из ацетонитрила, затем преЭкстрагируют 2 раза метиленхлоридом, вращают в соль с трет-бутиламином, раствор "высушивают и концентрируют т . п л . 223°С. досуха. Таким образом, получают 13 г 35 сложного эфира, защитные группы котоТочно таким же образом, изменяя рого удалены. исходный сложный эфир, получают продукты, представленные в табл. 4. Сложный эфир превращают в соль как описано в примере 4 путем кипяУсловия синтеза и физические хачения с обратным холодильником с 6 н. 40 НС1 в течение 16 ч. рактеристики производных метилендифосфоновой кислоты представлены Таким образом, полученная кислота,, в табл. 4. обработанная трет-бутиламином в этаП р и м е р 12. Моноаммониевая ноле, дает дисоль (SR 41318), т.пл. соль гексадецилтиометилендифосфоно168°С. вой кислоты (SR 41453), R, = Н, п = 45 П р и м е р 14, Три-(трет-бутил= П Т> — — f СІЛ \ — PTJ амин)~2-бензотиаэолилтиометилендиРаботают согласно способу примера фосфонат (SR 41481), R, = Н, п = 0, 4, но в качестве растворителя используют смесь толуола с диметилформамидом 40:2 (по объему). 50 После нагревания при 100 С в теДи(2-бензотиазолил)дисульфид, чение 20 ч получают соответствующий К раствору 30 г 2-меркаптобензосложный эфир, который гидролизуют тиазола и 1,6 г гидроксида натрия кипячением с обратным холодильником в течение 15 ч с 12 н. ВС1 в Сырая 55 в 800 мл абсолютного этанола прикапьгвают раствор 20 г иода и 115 г иодикислота, растворенная в аммиаке, дает да калия в 400 мл воды. По окончании моноаммониевую соль, т.пл. 103-110 С. добавления перемешивают 30 мин при Точно таким же образом, изменяя комнатной температуре, затем отсасыиспользуемый дисульфид, получают де 0 1333240 вают осадо*, который промывают этанои их фармакологические свойства подлом, затем сложным эфиром. После вычеркиваются следующим образом. сушивания получают 28 г дисульфида, Изучение in vitro. т.пл. 174°С. Изучение in'vitro основано на том Конденсируют вышеполученный дифакте, что культивированные хондроцисульфид с тетраметилметилендифосфоты выделяют нейтральные протеиназы натом согласно примеру 5 (нагревание после стимуляции фактором, синтези2 ч при 20°С). рованным перитонеальными макрофагами и моионуклеарными клетками крови. К раствору 6,5 v вышеполученного тетраметилового эфира в 80 мл четыПривлечение этого типа стимуляции реххлористого углерода добавляют в в ревматические заболевания широко атмосфере азота при температуре 1Q С известно. 7 мл триметилсилилбромида и перемеПринцип теста заключается в изучешивают 30 мин при этой температуре. нии секреции нейтральных протеиназ Добавляют 10 мл воды, отделяют стимулированными хондроцитзми, обводную фазу и промывают ее эфиром. работанными продуктами, по сравнению После выпаривания водной фазы полус секрецией необработанных стимуличают 4 г целевой кислоты, ее преврарованных хондроцитов. щают в трисоль путем воздействия Используют следующий ход теста. 20 трет-бутиламина в этаноле, т.пл, 202-^ Приготовление хондроцитов. 204°С. Хондроциты выделяют из хряща ноТочно таким же образом, используя совой перегородки теленка или межди(2-тиенил)дисульфид, получают 2суставного хряща кролика путем фертиенилтиометилеидифосфоновую кислоту, 25 ментативного переваривания и культивыделяемую в виде три-трет-бутиламинвируют в питательной среде ДМЕМ с ной соли, кристаллизующейся с двумя 10% телячьей сыворотки, при плотносмолекулами воды (SR 41549), т.пл. ти клеток 5х10 1? на чашку Петри, раз210°С. мером 10 см. Среда для культивироваП р и м е р 15. Ди(трет-бутиламин)--,« ния обновляется все 48 ч. 7-(1-метил-2-имидазолилтио)-1,1-гепСпустя неделю после культивирова-, тилидендифосфонат (SR 42132). ния клетки субкультивируют обработкой трипсином ЕДТА. Клетки снова поТетраизопропил-7-бром-1,1-гептимещают для культивирования в среду лидендифосфонат получают, используя ДМЕМ с 10% сыворотки зародышевого 1,6-дибромгексан. Нагревают при 80 С в течение 2 ч ^5 теленка, при плотности клеток 2x10 точками размером 16 мм. Слив реализураствор 10 г предыдущего бромированют спустя 3 дня культивирования. ного производного, 2 г 2-меркапто-1метилимидазола и 0,8 г гидроксида Перитонеальные макрофаги кролика натрия в 50 мл этанола. получают согласно известному методу. Выпаривают досуха, остаток раство- 40 Мононуклеарные клетки человечесряют в воде и экстрагируют эфиром. кой крови готовят и культивируют согПромывают раствор Зн.раствором гидрласно способу ДАУЕР. оксида натрия, затем водой. Раствор После культивирования содержащую высушивают над сульфатом натрия и вы"хондроцит стимулирующий фактор" 45 среду рекуперируют, фильтруют на паривают досуха. Хроматографируют на колонке с фильтре с размером пор 0,22 мк и задвуокисью кремния, элюируя смесью мораживают при -20 С. метиленхлорида с метанопом, 98-2, Стимулирование хондроцитов. по объему. Таким образом получают При слиянии культуральная среда 50 хондроцитов нагружается средой ДМЕМ 4 г целевого сложного эфира. Гидролизуют с помощью 1? Н.ИС1 пус 1% сыворотки зародышевого теленка, тем кипячения с обратным холодильнисодержащей 20% среды, содержащей факком в течение 16 ч. Целевое соедитор активации хондроцитов. некие выдепяют в виде ди-трет-бутилИспытуемые продукты вводятся в аминной соли, т.лл. 158—162°С. 55 1 культуральную среду в то же самое Соединения предпочтительно испольвремя, что и среда активации, при зуются в качестве противовоспалительконцентрации, при которой избегают цитотоксичности продукта или его неных и противоревматических лекарств 11 12 1333240 растворимости. Спустя 3 дня культивиЖелатиноэные капсулы или таблетки рования, среду рекуперируют с целью содержат количество действующего наопределения в ней содержания нейтральчала 10-500 мг/единица. ных протеиназ. Ежедневная доза этих продуктов Полученные с различными продуктавзрослому может быть порядка 100 мг ми результаты представлены в табл.5 5 г в день, разделенная на несколь(выражены в % ингибирования секреции ко порций. нейтральных протеиназ стимулированныЦифровые результаты, приведенные ми хондроцитами, обработанными и с с л е - 1 0 в табл. 5 и 6, указывают на более дуемыми продуктами, по сравнению высокую эффективность новых соединес таковой стимулированных хондроциний, чем этидронат натрия. тов, не обработанных продуктами). Токсичность соединения SR 41319 Изучение in vivo: Артрит при вспо(пример 9) : ЛД 50 для мышей - 1414 мг/2г могательном средстве. J5 при оральном введении и 197 мг/кг Инъекция Mycobacterium крысе выпри внутривенном введении; ЛД 50 зывает полиартрит, напоминающий чедля крыс - 700 мг/кг при оральном ловеческий ревматоидный артрит. введении и 197 мг/кг при внутривенном введении. Суспензию Mycobacterium tuberculoses (0,4,мг на 0,05 мл парафиноСоединения SR 4Ї960, SR 41036, 20 вого масла) инъекцируют внутрикожно SR 4142I, введенные мышам в дозе я хвост самцов крыс Sprague Dawley 300 мг/кг оральным путем ни в одном со средним весом 150 г. случае не приводят к летальному и с Спустя 15 дней отбирают животных, ходу. обладающих наиболее заметными симпто-25 мами артрита. Этих крыс разбивают на Ф о р м у л а и з о б р е т е н и я партии по 5 животных, затем каждую группу обрабатывают исследуемым проСпособ получения производных м е дуктом в дозе 10 мг/кг в день, в тетилендифосфоновой кислоты общей ф о р чение 6 дней в неделю (подкожно). Од-, мулы в на из групп получает только раство- 30 :р-сн .р, ритель и служит контролем. Спустя 3 недели обработки, живот0 (CHz)n 0 ных убивают и отрезают правую заднюю лапу на уровне берцово-предплюсневого 35 сустава, затем взвешивают. где R( - водород, линейный или р а з Для каждой группы определяют средветвленный низший С.-С 4 ~алнее и стандартную погрешность этих КИЛ} весов. R 2 - алкил, который может быть замещен гидроксильной или Активность каждого продукта вы40 тиольной группой, одним или ражается изменением в процентах среднесколькими атомами галогенего веса лап артритных, обработанных на, алкоксикарбонильнои груп-* крыс, по сравнению с таковыми артритZ, ных лап контрольных крыс. пой или группой -N Ингибирование артрита новыми соеди- 45 нениями представлено в табл. 6. Кроме того, предлагаемые продукты мало токсичны. Они могут быть испольгде Z., и 2„ -независимо друг от друзованы в терапии человека для лечега водород, низший алния заболеваний, обязанных воспали- 50 кил, фенил, который мотельным явлениям, и в особенности жет быть замещен одним для лечения артритных состояний. Осоили несколькими атомабенно соединения могут быть испольми галогена, нитрогрупзованы при лечении ревматоидного попой, низшей алкильной лиартрита. 55 или низшей алкоксильной Соединения могут быть в формах, группой, трифторметисоответствующих для введения перолом, - NH , -СООН или рально, парентерально и эндоректаль-С00 - алкил группами; но. 13 1333240 где. Q - галоген, нитро- или трифтормєтильная X "і группа, где X - кислород или сера, Z,H Z J заключающийся в том, что тетраалкилоимеют указанные значения, 5- или 5 вый эфир метилендифосфоновой кислоты 6-ти членный гетероцикл, содержаподвергают взаимодействию с гидридом щий 1 или 2 гетероатома, выбраннатрия в среде толуола и/или диметилных из азота и серы, 5-ти членный .формамида при 15-25°С с последующей гетероцикл, конденсированный с бен-, 10 обработкой образующегося натрийсодержазольным -кольцом и имеющий формулу щего дифосфоната сульфидом общей фор- . X мулы • • R 2 S - ( C H z ) n - Y / ;•/ ...•. -••*•'. где X - кислород, группа NH или сера» 15 или дисульфидом общей формулы R, - водород или галоген,* п v- целое число от 0 до 10, : : при условии,что при R, - водо. и п = 0, "Rz не является ме20 тильной или пиридильной группами, при R, - метил или этил, п = 0, R не является фенилом или замещенным фенилом формулы 25 • где ;. Ri-s-s-R., К2 и п Y -_ галоген, ; ще. '\ /Н-0 S SR 41265 SR 41452' ... .\ R, СООН значе'• •• • .'• • при темперйтуре от 20°С до температуры кипения реакционной смеси и выделением целевого продукта в виде эфира или переводом его в кислоту путем О М Ы П е Н И Я , Кодовый номер - имеют у к а з а н н ы е ния, •' . • • . . •. .' Т а б л и ц а о~сн Рабочие усло- Физические хараквия (темпера- теристики тура и время нагрева) 90°С, 5 ч 140 С (ацетонитрил) 25 С, 6 ч Желтое масло, тонкослойная хроматография на двуокиси кремния этилацетат- C Z H ? OH 8:2 (по объ• ему), R f = 0 , 7 .• . . •• • • . • • • 1 -. 15 16 1333240 Т а б л и ц а >—сн—• Кодовый номер 2 0Н Рабочие условия Вьщеленный продукт Замещение:тем- гидролиз:конпература и дли- центрация НС1 тельность и длительность SR 41100 0 110 e C, 24 ч ди-трет-бутиламинная соль, т.пл. 252°С 20°С, 16 ч SR 41179 6н.НС1,5 ч 6 н.НС1,24 ч хлоргидрат, т.пл. SR 41264 20°C, 3 ч 6н. НСЗ.,8 ч SR 41266 20°C, 2 ч 8н. НС1,18 ч >280°С хлоргвдрат, т.пл. >300°С хлоргидрат, т.пл.285-290°С SR 41344 20°C, 20 ч 8н. HCl t 18 ч хлоргидрат, т.пл. i76dC 6н. НС1,6 ч три-трет-бутиламинная соль, т.пл. 24°С (с 1/2Ня0) 20°C, 16 ч сн 6н. НС1,16 ч свободная кислота, т.пл. 20 С 6н. НС1 16 ч свободная кис SR 41482 : 48 ч , Сі SR 41688 С1 SR 41689 16 ч лота, т.пл. 226°С SR 41690 20°С 6н. неї ди-трет-бутил аминная соль, т.пл.270°С 17 18 1333240 Т з б л и тт а 3 0 НО S R. Кодовый номер Вьщеленный про дукт Рабочие условия замещение: температура и длительность 20°С, 24 ч 6н.НС1,12 ч свободная кислота, т . п л . 300 С 20260 С SR 41552 0 20°С, 18 ч )2н,НС1,20 ч трет-бутиламинная соль, т . п л . 218°С н CH-CCHJ, Т а б л и ц а НОчи НО' Кодовый номер 1 SR 4 1 4 2 1 SR 41456 п 2 О —СИ— ОН Гидролиз, концентрация НС1 и длительность 3 -(СН 2 ) Т СН Э 4 4 12н. НС1, 16 ч 12н.НС1, 16 ч Выделенный продукт 5 свободная кислота, т.пл. 155-16О°С ди-трет-бутиламинная соль, т . п л . 255-260°С (разло„жение) 1333240 О SR 41272 20 Продолжение тзбл.4 три-трет-бутиламинная соль, т.пл. 198-202°С HCl, 8 ч 6H. . С00Н SR 41908 12н,НС1, 16 ч ди-трет-бутиламинная соль, т.пл. 220-224°С ди-трет-бутиламинная соль, т.пл. 224-226°С CoH 5 2П SR 42249 SR 41959 свободная кислота, т.пл. 202-204°С 12н. НС1, 12 ч \ ди-трет-бутиламинная соль, т.пл. 235 С (разложение) 6н. НС1, 12 ч ! 12н. HCl, 16 ч 12н, HCl, 10 ч SR 41960 свободная кислота, т.пл. 176-178°С . SR 42143 Т а б л и ц а Кодовый номер Культивирован- Кодовый номер продукта ный хондроцит, продукта % ингибирования 1 2 3 5 Культивированный хондроцит, % ингибирования 4 SR 42036 72±8 SR 41319 8511 SR 41100 20+1 SR 41179 75±7 SR 41421 97±2 SR 41264 50±10 SR 41457 95±3 SR 41263 90±1 SR 41453 40±2 SR 414S0 56±9 SR 41266 68+8 SR 41481 74І9 SR 41J44 31 + 6 SR 41482 83+6 SR 41342 99±\ SR 14456 98І2 SR 41388 90 + 1 SR 41482 83+6 SR 41342 99i1 21 2 2 1333240 Продолжение табл.5 2 3 4 SR 41456 98 + 2 SR 41388 90+1 SR 41908 82±2 SR 41960 55*4 SR 41689 90±3 SR 41690 SR 41688 94+1 SR 42249 92+4 SR 41549 58+4 SR 41687 89+2 SR 41959 79+2. SR 41625 92±0 ' 97±1 Этидронат натрия Т а - б л и ц а Кодовый номер продукта Кодовый номер Артриты при вспомогатель- продукта ном средстве, вес лапы, % ингибирования 23 SR 41319 SR 41100 37 SR 41452 SR 41421 55 SR 41272 - 25 SR 41454 33 SR 41179 25 SR 41453 58 SR 41264 43 SR 41266 29 SR 41263 * 19 SR 41344 35 SR 41273 39 SR 41388 42 SR 41552 36 SR 41482 41 SR 41689 31 SR 41690 35 SR 41319 •5 3 SR 41688 38 SR 41549 34 SR 41480 40 SR 41481 40 , SR 41342 38 SR 41687 38 SR 41959 60 Этидронат натрия 10 24 6 Артрит при вспомогательном средстве, вес лапы, % ингибирования SR 41036 SR 41341 29 • 15 1333240 Редактор Г.Волкова Составитель Л.Карунина Техред Л.Сердюкова Корректор Л.Пилипенко Заказ 3853/58 Тираж. 347 Подписное ВНИИПИ Государственного комитета СССР по делам изобретений и открытий 113035, Москва, Ж-35, Раушская наб., д. 4/5 Производственно-полиграфическое предприятие, г. Ужгород, ул. Проектная, 4
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for producing derivatives of methylene diphosphonic acid
Автори англійськоюJean-Claude Brelier, George Garcia
Назва патенту російськоюСпособ получения производных метилендифосфоновой кислоты
Автори російськоюЖан-Клод Брельер, Жорж Гарсия
МПК / Мітки
МПК: C07F 9/653, C07F 9/38, A61K 31/66, C07F 9/40, A61P 29/00, C07F 9/58, C07F 9/6506, C07F 9/6541, C07F 9/6512
Мітки: похідних, кислоти, метилендифосфонової, спосіб, одержання
Код посилання
<a href="https://ua.patents.su/14-4913-sposib-oderzhannya-pokhidnikh-metilendifosfonovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання похідних метилендифосфонової кислоти</a>
Попередній патент: Спосіб створення та добору рослин з високим вмістом ефірної олії
Наступний патент: Спосіб отримання похідних циклопропанкарбонової кислоти у вигляді стереоізомерів чи їх сумішей
Випадковий патент: Пристрій для контролю стану полідисперсних біологічних рідин на основі спектрополяриметричних зображень їх частинок