Аміногуанідинкарбоксилати
Номер патенту: 54382
Опубліковано: 17.03.2003
Автори: Теніс Стівен П., Меглессон Мартін Д., Вейленкорт Валері А., Скостарез Хайнріх Дж., Такер Джон А., Мей Пол Д., Ларсен Скотт Д.
Формула / Реферат
1. Аминогуанидинкарбоксилаты формулы I или II:
![]()
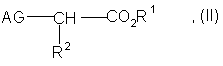
где AG является
(a) N-аминогуанидином,
(b) N,N'-диаминогуанидином, или
(c) N,N',N"–триаминогуанидином,
где n является целым числом от 1 до 5,
R1 является
(a) водородом,
(b) фенилом,
(c) С1-С5 алкилом или
(d) С1-С3 алкилфенилом, и
R2 является
(a) фенилом,
(b) С1-С10 алкилом или
(c) C1-C5 алкилфенилом, при следующих условиях:
(a) в формуле I, когда n равно 2 или 3, R1 не является водородом,
(b) в формуле I, когда n равно 1, R1 не является водородом или метилом,
(c) в формуле II, когда R2 является этилом или фенилом, R1 не является водородом, и
(d) соединение не является N-аминогуанилглицином или N-аминогуанил-D,L-фенилаланином.
2. Соединение по пункту 1, выбранное из:
[2-(аминоиминометил)гидразино]уксусной кислоты, ее моногидрата и ее фенилметилового эфира, моногидрохлорида,
![]() -[2-(аминоиминометил)гидразино]бензолпропановой кислоты моногидрата,
-[2-(аминоиминометил)гидразино]бензолпропановой кислоты моногидрата,
[1-(аминоиминометил)гидразино]уксусной кислоты моногидробромида,
N-(гидразиноиминометил)-![]() -аланина,
-аланина,
N-(дигидразинометилен)глицина,
[2-(гидразиноиминометил)гидразино]уксусной кислоты,
N-(дигидразинометилен)-![]() -аланина,
-аланина,
N-(дигидразинометилен)-L-аланина,
рацемической HN=C(NH2)-NH-NH-CH(CH3)-COOH,
N-(дигидpaзинoмeтилeн)-d-aлaнинa и
N-(дигидразинометилен)валина.
3. Соединение по п. 1, выбранное из
[2-(аминоиминометил)гидразино]уксусной кислоты и ее моногидрохлорида,
N-(дигидразинометилен) глицина,
[2-(гидразиноиминометил)гидразино]уксусной кислоты и
[1-(гидразиноиминометил)гидразино]уксусной кислоты.
Текст
1 Аминогуанидинкарбоксилаты формулы I или II где AG является (a) N-аминогуанидином, (b) N.N'-диаминогуанидином, или (c) І\І,І\Г,М"-триаминогуанидином, где п является целым числом от 1 до 5, R1является (a) водородом, (b) фенилом, (c) С1-С5 алкилом или (el) C1-C3 алкилфенилом, и R является Данная заявка является частичным продолжением заявки США с серийным номером (a) фенилом, (b) C-i-C-io алкилом или (c) С1-С5 алкилфенилом, при следующих условиях (a) в формуле I, когда п равно 2 или 3, R1 не является водородом, (b) в формуле I, когда п равно 1, R1 не является водородом или метилом, (c) в формуле II, когда R2 является этилом или фенилом, R1 не является водородом, и (d) соединение не является Nаминогуанил глицином или І\І-аминогуанил-О,І_фенилаланином 2 Соединение по пункту 1, выбранное из [2-(аминоиминометил)гидразино]уксусной кислоты, ее моногидрата и ее фенилметилового эфира, моногидрохлорида, а-[2(аминоиминометил)гидразино]бензолпропановой кислоты моногидрата, [1-(аминоиминометил)гидразино]уксусной кислоты моногидробромида, М-(гидразиноиминометил)- р-аланина, |\|-(дигидразинометилен)глицина, [2-(гидразиноиминометил)гидразино]уксусной кислоты, |\|-(дигидразинометилен)- р -аланина, |\|-(дигидразинометилен)-1_-аланина, рацемической HN=C(NH2)-NH-NH-CH(CH3)-COOH, |\|-(дигидразинометилен)-Ь-аланина и г\І-(дигидразинометилен)валина 3 Соединение по п 1, выбранное из [2-(аминоиминометил)гидразино]уксусной кислоты и ее моногидрохлорида, М-(дигидразинометилен) глицина, [2-(гидразиноиминометил)гидразино]уксусной кислоты и [1-(гидразиноиминометил)гидразино]уксусной кислоты 08/344274, зарегистрированной 23 ноября 1994, находящейся в настоящее время на стадии рас О 00 го ю 54382 смотрения Данное изобретение представляет новые соединения и новый способ лечения инсулиннезависимого сахарного диабета (ИНСД), осложнений диабета, происходящих в результате избыточного неферментативного гликозирования белков при инсулиннезависимом и инсулинзависимом сахарном диабете, нарушенной толерантности к глюкозе и ожирения Инсулиннезависимый сахарный диабет, или ИНСД и диабет типа II являются синонимами Больные ИНСД имеют необычайно высокие концентрации глюкозы в крови на голодный желудок и замедленное клеточное поглощение глюкозы после еды или после диагностического теста, известного как тест на толерантность к глюкозе ИНСД диагностируется на основании общепризнанных критериев (American Diabetes Association, Physician's Guide to Insulin-Dependent (Type I) Diabetes, 1988, American Diabetes Association, Physician's Guide Non-lnsuhn-Dependent (Type II) Diabetes, 1988) Инсулинзависимый сахарный диабет, ИЗСД и диабет типа I являются синонимами Больные ИЗСД имеют ненормально высокие концентрации глюкозы в крови на голодный желудок и замедленное клеточное поглощение глюкозы после приема пищи или после диагностического теста, известного как тест на толерантность к глюкозе ИЗСД диагностируется на основе общепринятых критериев (American Diabetes Association, Physician's Guide to Insulin-Dependent (Type I) Diabetes, 1988) Нарушенная толерантность к глюкозе появляется, когда степень метаболического клиренса глюкозы из крови меньше чем обычно существующая в основном у населения после того, как стандартная доза глюкозы была принята перорально или введена парентерально (American Diabetes Association, Physician's Guide to Nonlnsuhn-Dependent (Type II) Diabetes, 1988) Нарушенная толерантность к глюкозе может также наблюдаться при ИНСД, ИЗСД диабете беременных и ожирении Нарушенная толерантность к глюкозе может также встречаться у лиц не отвечающим критериям для этих заболеваний Нарушенная толерантность к глюкозе у лиц без диабета является фактором, предрасполагающим к развитию ИНСД Ожирение является состоянием, при котором происходит увеличение содержания жировой ткани в теле, приводя к избыточному весу тела выше норм, принятых для возраста, пола, роста и телосложения данного человека (Bray, Obesity, an Endocrine Perspective, p 2303, Multihormonal Systems and Disorders (1989)) Принятые нормы определялись смертностью по данным страхования жизни и заболеваемостью в связи со строением тела Чрезмерная смертность, которая наблюдается среди лиц с ожирением, происходит в результате заболеваний, к которым предрасполагает это состояние Они включают рак, сердечнососудистые заболевания, заболевания пищеварительной системы, респираторные заболевания и сахарный диабет У больных с хронической гипергликемией, та кой, которая присутствует при инсулиннезависимом сахарном диабете и инсулинзависимом диабете, глюкозозависимое перекрестное связывание белков происходит со скоростью свыше нормальной (Bunn, American Journal of Medicine, Vol 70, p 325, 1981), приводя к измененной структуре белков (Brownlee, Chapter 18, Diabetes Melhtus, p 279, 1990) Избыточное неферментативное гликозирование белков способствует осложнениям при диабете и осложнениям при старении людей без диабета, таким как нейропатии, нефропатии, ретинопатия, гипертензия и атеросклероз (Brownlee, 1990, выше) Гипергликемия определяется как концентрация глюкозы в крови, превышающая принятую норму для основного населения (American Diabetes Association, Physician's Guide to Nonlnsuhn-Dependent (Type II) Diabetes, 1988) В то время как взаимоотношение между этими состояниями известно, было бы целесообразно иметь лекарственный препарат, которым можно лечить или предотвращать все из них В JP 54128523 (Chem Abstr 92 75899h сообщается о том, что 3-(1-(аминометил)гидразино))пропановая кислота является фунгицидом и инсектицидом О синтезе ^(гидразиноиминометил)-глицина сообщается у Gante, J Chem Ber 1968, 101, 1195 Некоторые алкилид-аминогуанидиновые производные описаны в патенте США 5272165, с названием "Подавление повышенного гликозирования белков в организме - применение 2-алкилиденаминогуанидиновых производных, используемых, например, для лечения сопутствующих диабету эффектов или, особенно, предотвращения окрашивания зубов" Аминогуанидиновые аналоги аргинина раскрыты в DE 4244539А1 и WO 9104-023A В патенте США 5132453 раскрыто, что N6-(rnflpa3HHO имино метил)-лизин применим в качестве ингибитора образования окиси азота и для лечения гипертензии В ЕР-230037-А раскрыты некоторые новые 2-замещенные гуанидиновые производные, обладающие противоишемической и кардиопротекторной активностью В патенте США 3412105 раскрывается рарил-^гуанидино-(р-аланины или а-карбокси-раланины), как ингибиторы МАО и пролонгированные гипотензивные средства Данное изобретение, в частности, представляет (I) Соединение формулы I или II AG-(CH2)D-CO2R1 I или AG-CH-CO.R1 R3 или их фармакологически приемлемые соли, где AG является a) N-аминогуанидин, b) N, N'-диаминогуанидин или c) N, N', N" - триаминогуанидин, где п является целым числом из 1 - 5, где R1 является a) водородом, b) фенилом, 54382 c) С1-С5 алкилом или d) C1-C3 алкилфенилом и 2 где R является a) водородом, b) фенилом, c) С-і-Сю алкилом или d) C1-C5 алкилфенилом при следующих условиях 1 a) в формуле I, когда п равно 2, R не является водородом, 1 b) в формуле I, когда п равно 1, R не является метилом, 2 1 c) в формуле II, когда R является этилом, R не является водородом, 2 d) в формуле II, когда R является фенилом, 1 R не является водородом и 1 e) в формуле I, когда п равно 3, R не является водородом 2) способ лечения или профилактики инсулиннезависимого сахарного диабета у пациента, подверженного диабету или заболевшего ИНСД включающий системное введение количества, эффективного для лечения и предотвращения ИНСД соединения формулы III NH N CO2H H9N где R3 является водородом, метилом, этилом, СН2~фенилом или н-гексилом Для общих формул I и II связывание фрагмента AG не является принципиальным, т е связь с примыкающим атомом углерода может находиться у любого одного атома азота фрагмента AG Оставшиеся атомы азота фрагмента AG не замещены Количество атомов углерода в содержащих углерод заместителях указывается префиксом "С г С,", где і является наименьшим числом атомов углерода, a j является самым большим числом атомов углерода Примеры алкильных групп, имеющих от 1 до 10 атомов углерода, включают, например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, тбутил, н-пентил, изоамил, н-гексил, н-гептил, ноктил, н-нонил, н-децил и другие их изомерные формы Примеры фармацевтически приемлемых солей с присоединением кислоты включают ацетат, адипат, алгинат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, цитрат, камфорат, комфорсульфонат, циклопентан-пропионат, диглюконат, д од ецил сульфат, этан сул ьфонат, фумарат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, 2-нафталенсульфонат, никотинат, оксалат, пальмоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, тозилат и ундеканоат Доза соединение по формуле 1-ІII, которая должна применяться, находится между 0,1 и 100мг/кг веса тела в сутки Предпочтительная до за составляет 1 - 50мг/кг/сут Введение может быть пероральным, парентеральным, интраназальным, буккальным, сублингвальным, интраректальным или трансдермальным путем Пероральный путь введения предпочтителен Новые соединение этого изобретения представлены общими формулами I и II Известные соединения, заявляемые для использования при лечении ИНСД представлены формулой III Из соединений этого изобретения, представленных общими формулами I и II, соединения, перечисленные в таблице 1, являются особеннопредпочтительными, и предпочтительно их применение при лечении ИНСД и его осложнений В таблице 2 содержится перечень родственных соединений, которые не заявлены Они включены, чтобы продемонстрировать удивительное действие заявляемых соединений путем демонстрации того, что эти соединения, которые близко родственны заявляемым соединениям, не считаются активными в самой высокой испытанной дозе В таблице 3 содержится список соединений в рамках общего объема, заключенного в общих формулах I и II, которые не проявляют активности в самых высоких испытанных дозах и, таким образом, составляют исключение, что видно по условиям пункта 1, формулы Таблица 4 содержит список новых соединений, конкретно заявляемых в изобретении Методики их получения даны в разделе 4 Таблица 5 содержит перечень известных соединений, которые заявлены в изобретении для применения припечений ИНСД Таким образом, это изобретение представляет новые и известные соединения, обладающие неожиданными и удивительными противодиабетическими свойствами Введение соединений этого изобретения мышам ККАу в дозе, равной примерно 100 500мг/кг/сут, приводит к частичному улучшению или полному устранению гипергликемии на этой модели инсулиннезависимого сахарного диабета у грызунов (конкретные соединения перечислены в таблицах 4 и 5, смотрите, Chang, Wyse, Copeland, Peterson, and Ledbetter, Diabetes 1985, p 466, 1986) Мышки ККАу являются инсулинорезистентными (Chand, et al , выше), и обнаружение того, что уровень глюкозы в крови у неголодающих мышей снижен у этих животных, указывает на то, что инсулиновая резистентность, наиболее вероятно, меньше после лечения заявляемыми соединениями Мыши ККАу имеют избыточный вес по сравнению с нормальными, аутбредными мышами (Chand, et al , выше), и введение соединений этого изобретения приводит к потере веса Введение І\І-(дигидразинметилен)-глицина, предпочтительного соединения в этой серии, мышам ККАу с диабетом в течение 4 дней снижало уровень глюкозы в крови у не голодных животных (см таблицу 6) Доза, равная 60мг/кг/сутки, вызывала 35% снижение уровня глюкозы в крови, что было статистически значимо по сравнению с контролем Более высокие дозы давали еще большее снижение концентраций глюкозы в крови 3Гуанидинпропионовая кислота в дозе 54382 500мг/кг/сутки давала примерно такое же снижение концентрации глюкозы в крови, которое достигалось при дозе 60мг/кг/сутки 1\1-(дигидразинметилен)-глицина Введение 1\1-(дигидразинметилен)-глицина мышам ККАу с диабетом в течение 4 дней снижало вес тела животных (см таблицу 6) Доза, равная 100мг/кг/сутки вызывала 4% снижение веса тела, что было статистически значимо по сравнению с контролем Более высокие дозы вызывали еще большее снижение избыточного веса тела у мышей ККАу 3-гуанидинпропионовая кислота в дозе 500мг/кг/сутки давала примерно такое же снижение веса тела у мышей ККАу, которое достигалось при помощи дозы 100мг/кг/сутки ІЧ-(дигидразинметилен)-глицина Введение І\І-(дигидразинметилен)-глицина нормальным мышам C57BL в дозе 100мг/кг снижало концентрацию глюкозы в крови на голодный желудок у этих животных (таблица 7) Введение І\І-(дигидразинметилен)-глицина мышам ККАу с диабетом или нормальным мышам C57BL в дозе 100мг/кг приводит к улучшенной глюкозной толерантности, что демонстрируется более низкими уровнями глюкозы после инъекции стандартной дозы глюкозы для исследования (таблица 7) Неферментативное гликозирование белков является первоначальной стадией в глюкозависимом перекрестном связывании белков (Brownlee, выше) Неферментативное гликозирование человеческого сывороточного альбумина снижается in vitro І\І-(дигидразинметилен)-глицином, ІЧ-(гидразиниминометил)-глицином и [2-(аминоиминометил)гидразин]-уксусной кислоты моногидрохлоридом (таблица 8) Аминогуанидин, который, как было показано ранее, подавляет неферментативное гликозирование белков in vitro (Khatami, Suldan, David, Li and Rockey, Life Sciences, vol 43, p 1725 - 1731, 1988) и in vivo (Brownlee, выше) также эффективен и в этом исследовании (таблица 8) 3Гуанидинпропионовая кислота не действовала на неферментативное гликозирование альбумина в этом исследовании У пациентов с сахарным диабетом присутствует несколько метаболических нарушений, которые было бы целесообразно скорректировать ненормально повышенный уровень глюкозы в крови после приема пищи и на голодный желудок, замедленный клиренс глюкозы из кровотока (American Diabetes Association, Physicians Guide to Insulin-Dependent (Type I) Diabetes, 1988, American Diabetes Association, Physician's Guide to NonInsulm-Dependent (Type II) Diabetes, 1988) и избыточное гликозирование белков, которое способствует развитию диабетических осложнений (Brownlee, выше) Кроме того, с инсулиннезависимым сахарным диабетом часто связано ожирение и оно отягощает нарушенный метаболизм глюкозы у этих больных (Horton and Jeanrenaud, Chapter 27, Obesity and Diabetes Melhtus, 1990) При оптимальном лечении инсулиннезавнсимого сахарного диабета должны корректироваться все эти нарушения Избыточное гликозированние белков, такое, которое может происходить при инсулиннезависимом сахарном диабете и инсулинзависимом 8 сахарном диабете, можно предотвратить путем блокирования химической реакции глюкозы и молекул белка (Brownlee, выше) и снижения ненормального повышения концентрации глюкозы в крови при диабетическом состоянии (Holman and Turner, Diabetic Medicine, 5 582 - 588, 1988, Benjamin and Sacks, Clin Chem , 4015 683 - 687, 1994) Наиболее желательное лечение должно действовать двумя путями, так чтобы более полно снизить степень неферментативного гликозирования белков Заявляемые соединения обладают способностью положительно воздействовать на многие метаболические дефекты, сопровождающие сахарный диабет, и предотвращать метаболические нарушения с помощью более чем одного механизма, что четко отличает их фармакологическое действие от действия других гуанидиновых соединений, которые ранее были заявлены в качестве средств лечения сахарного диабета Заявляемые соединения неожиданно превосходят аминогуанидин, диаминогуанидин, 3-гуанидинпропионовую кислоту и метформин при лечении инсулиннезависимого сахарного диабета, так как они проявляют более полный спектр желаемой активности и эффективны в более низких дозах Заявляемые соединения представляют неожиданные преимущества при лечении сахарного диабета по сравнению с диамингуанидином и аминогуанидином, так как заявляемые соединения действуют метаболически со снижением избыточных концентраций глюкозы в крови, а также блокированием неферментативного гликозирования белков Заявляемые соединения неожиданно превосходят амино- и диаминогуанидин при лечении нарушенной толерантности к глюкозе или ожирения, так как у аминогуанидина и диаминогуанидина отсутствует эффективность в этом отношении Аминогуанидин и диаминогуанидин подавляют неферментативное гликозирование белков in vitro и образование конечных продуктов усиленного гликозирования in vivo (Kuman, Umar, Bansal, and Sahid, Diabetes, 40, 1079 - 1084, 1991) На основании этого подавления неферментативного гликозирования белков, предположили, что аминогуанидин будет полезен при лечении диабета (Brownlee, выше) Аминогуанидин не действует на уровень глюкозы в крови у нормальных грызунов или крыс, которым создали диабет с помощью инъекции аллоксана или стрептозотоцина (Kuman, Umar, Bansal, Sahib, выше, Yagihashi, Kamijo, Baba, Yagihashi, and Nagai, Diabetes, 41 47 - 52, 1992, Edelstem and Brownlee, Diabetologia, 35 95 97, 1992, Oxlund and Andreassen, Diabeterologia, 35 19 - 25, 1992) Диаминогуанидин не действует на уровень глюкозы в крови нормальных крыс и с диабетом, вызванным аллоксаном (Kuman, Umar, Bansal, Sahib, выше) Аминогуанидин не влияет на вес тела нормальных крыс или крыс с диабетом (Kuman, Umar, Bansal, Sahib, выше, Yagihashi, Kamijo, Baba, Yagihashi, and Nagai, выше, Oxlund and Andreassen, Diabetoljgia, 35 19 - 25, 1992) или приводит к увеличению веса тела человека и крыс (Baylm, Horakova, and Beaven, Expenentia, 31 562, 1975) Диаминогуанидин не влияет на вес тела нормальных крыс и крыс с диабетом, вызванным 54382 аллоксаном (Kuman, Umar, Bansal, Sahib, выше) Действие аминогуанидина или диаминогуанидина на толерантность к глюкозе еще нужно выявить Заявляемые соединения неожиданно превосходят 3-гуанидинпропионовую кислоту при лечении сахарного диабета, так как последняя менее активна в отношении регуляции гипергликемии, и у нее отсутствует способность подавлять неферментативное гликозирование белков Заявляемые соединения неожиданно превосходят 3-гуанидинпропионовую кислоту при лечении нарушенной толерантности к глюкозе или ожирения благодаря большей активности этих соединений Ранее было показано, что 3-гуанидинпропионовая кислота снижает гипергликемию и избыточный вес тела и улучшает толерантность к глюкозе у грызунов с диабетом (Meglasson, Wilson, Yu, Robinson, Wyse, and de Souza, J Pharm And Exp Therapeutics, 266 1454 - 1462, 1933) Предпочтительное соединение в этом пункте, (г\І-дигидразинметилен)-глицин, активнее 3-гуанидинпропионовой кислоты по снижению ненормально повышенных уровней глюкозы в крови и веса тела у мышей ККАу Для снижения уровня глюкозы в крови у мышей ККАу на 20% необходимо 130мг/кг/сутки последнего соединения Сходное снижение уровня глюкозы в крови могло достигаться с помощью дозы, равной 30мг/кг/сутки, г\І-(гидразинметилен)-глицина N(дигидразинметилен)-глицин, введенный мышам ККАу в дозе 60мг/кг/сутки, был примерно также эффективен, как и 3-гуанидинпропионовая кислота в дозе 500мг/кг/сутки З-Гуанидинпропионовая кислота улучшает толерантность к глюкозе у мышей ККАу с диабетом при введении с пищей в виде 1% примеси, которая должна поставлять дозу, равную примерно 1000мг/кг/сутки (патент США 5132324) Для сравнения, І\І-(дигидразинметилен)глицин улучшал толерантность к глюкозе у нормальных мышей C57BL и мышей ККАу с диабетом при введении в дозе 100мг/кг/сутки В отношении снижения веса тела доза 100мг/кг/сутки ІЧ-(дигидразинметилен)-глицина была примерно также эффективна, как и 500мг/кг/сутки 3-гуанидинпропионовой кислоты З-Гуанидинпропионовая кислота не подавляет неферментативное гликозилирование альбумина in vitro в противоположность заявляемым соединениям Заявляемые соединения неожиданно превосходят метформин при лечении сахарного диабета, непереносимости глюкозы, ожирения, так как последний менее активен при испытании на той же модели на животных, что и заявляемые соединения К тому же, в отношении его эффективности по снижению веса тела и предотвращению неферментативного гликозирования белков, данные, опубликованные для метформина являются противоречивыми и не демонстрируют стабильных результатов Как было показано ранее, метформин снижает гипергликемию у больных с инсулиннезависимым диабетом при введении в дозе 1000 - ЗОООмг/сутки и повышает скорость клиренса глюкозы у таких больных при введении в дозе 1500 2500мг/сутки (Baily, Diabetes Care, 15 755 - 772, 1992) Грызуны менее чувствительны к метформину, чем люди, и поэтому необходимы более высокие дозы, чтобы продемонстрировать глике 10 мические эффекты (Baily, Flatt, Wilcock, and Day, Frontiers in Diabetes Research, pp 277 - 282, 1990, Pemcaud, Hitier, Ferre, and Girard, Biochem J 262 881 - 885, 1989) Хроническое пероральное введение метформина снижает гипергликемию при введении новорожденным мышам с вызванным стрептозотоцином диабетом в дозе 100мг/кг/сутки (Rossetti, DeFronzo, Gherzi, Stem, et al , Metabolism, 39 425 - 435, 1990), мышам DBM в дозе 400мг/кг/сутки (Baily, Flatt, Wilcock, and Day, выше), крысам Zucker fa/fa в дозе 350мг/кг/сутки (Pemcaud, Hitier, Ferre, and Girard, выше) и мышам ККАу в дозе 300мг/кг/сутки или более (Meglasson, Wilson, Yu, Robinson, de Souza, выше) Хроническое пероральное введение метформина не влияло на концентрацию глюкозы в крови у нормальных мышей, получающих 250мг/кг/сутки, у мышей с диабетом, вызванным стрептозотоцином, получающим 250мг/кг/сутки (Baily, Flatt, Wilcock, and Day, выше) или мышей ob/ob с диабетом, получающих 250мг/кг/сутки (Baily, Flatt, and Ewan, Arch Int Pharmacodyn , 282 233 - 239, 1986) Острое введение 264мг/кг метформина или его аналога буформина в дозе 132мг/кг не влияло на уровень глюкозы в крови у крыс (Tutwiler and Bndi, Diabetes, 27 868 - 876, 1978) Когда предпочтительное соединение по этой формуле, N(дигидразинметилен)-глицин испытывали на мышах ККАу, он был более активен, чем метформин в отношении снижения ненормально повышенного уровня глюкозы в крови на этой модели Чтобы снизить уровень глюкозы в крови у мышей ККАу на 25% требовалось 300мг/кг/сутки метформина и (Meglasson, Wilson, Yu, Robinson, Wyse, and de Sousa, выше) Сходное снижение уровня глюкозы в крови могло достигаться с помощью дозы 30 60мг/кг/сутки І\І-(дигидразинметилен)-глицина В отношении повышения толерантности к глюкозе, сообщалось, что метформин не влиял на толерантность к глюкозе у нормальных мышей, когда его давали в дозе 750мг/кг (Tutwiler and Bndi, выше) или у нормальных мышей, которым давали 50мг/кг (Baily, Flatt, Wilcock, and Day, выше) Когда его давали нормальным мышам или крысам с вызванным стрептозотоцином диабетом в дозе 250мг/кг толерантность к пероральному приему глюкозы повышалась (Baily, Flatt, Wilcock, and Day, выше) Для сравнения, І\І-(дигидразинметилен)глицин повышал толерантность к глюкозе при введении нормальным мышам C57BL или мышам ККАу с диабетом в более низкой дозе, 100мг/кг В отношении снижения веса тела, было сообщено, что метформин вызывает потерю веса у больных инсулиннезависимым диабетом, лечившимся в течение одного года (Baily, выше) или не имеет значительного действия на вес тела больных инсулиннезависимым диабетом с ожирением, лечившихся в течение того же срока (Multi-centre Study, Diabetologia, 24 404 - 411, 1983) Метформин не вызывал потери веса у мышей ob/ob с диабетом при введении в дозе 240мг/кг/сутки или у мышей с вызванным стрептозотоцином диабетом при введении в дозе 60мг/кг/сутки (Lord, Atkins, and Baily, Diabetologia 25 108 - 113, 1983) Метформин вызывал статистически значимую потерю веса у мышей ККАу, леченных 12 11 54382 1700мг/кг/сутки этого соединения, но не оказывал J Pharm Sci 1980, 69, 1000 этого действия, когда его давали в более низких Схема 4 Lee, К, Kim, S , Um, H , Synthesis дозах (Meglasson, Wilson, Yu, Robinson, Wyse, and 1989, 638 Reddy, Т І , Bhawal, B M , Rajappa, S de Souza, выше) Для сравнения, когда NTetrahedron 1993, 49, 2101 (дигидразинметилен)-глицин вводили мышам Методы отбора in vivo и in vitro ККАу в дозе 100мг/кг/сутки, он был примерно такСледующие экспериментальные процедуры же эффективен, как и метформин в дозе являются конкретными примерами, в которых опи1700мг/кг/сутки в отношении получения потери сывается получение ряда соединений этого изовеса у линии мышей с ожирением (Meglasson, бретения Wilson, Yu, Robinson, Wyse, and de Souza, выше) ПРИМЕР 1 [2-(аминоиминометил)гидразин]Сообщалось, что метформин подавляет неферуксусная кислота ментативное гликозирование эритроцитных плазЭтилгидразинацетата гидрохлорид (7,73г, 50 менных мембран в концентрациях, равных 0,5 и 5 ммолей) омыляли с помощью нагревания в колбе микромолей на литр на основе его способности с обратным холодильником в 100мл 1N NaOH в предотвращать снижение основных параметров течение 2 часов Затем к горячему раствору доплазменных мембран, при спектроскопии с исбавляли сульфат 2-метил-2-тиопсевдомочевины пользованием электронного парамагнитного резо(6,95г, 50 ммолей) и раствор нагревали в колбе с нанса, инкубированных с глюкозой in vitro обратным холодильником дополнительно в тече(Freisleben, Rucket, Wiernsperger, and Zimmer, ние 2 часов Смесь концентрировали до -1/2 объBiochemical Pharmacology, 43 1185 - 1194, 1992) ема, во время чего осаждалось более твердое При высоких концентрациях, 50 и 100 микромолей вещество Раствор охлаждали и фильтровали с на литр, метформин обладал обратным эффектом получением 3,34г белого твердого вещества Пеи давал очень низкий основной показатель Слерекристаллизация из воды давала 2,41 г (36%) [2довательно, можно было ожидать, что то, что аминоиминометил)гидразин]-уксусной кислоты в уменьшит или усилит ли метформин неферментавиде белого твердого вещества с высокой концентивное гликозирование белков у пациентов с диатрацией Т пл 247 - 248°С (разл ), 1Н ЯМР (D2O) бетом, должно зависеть от концентрации мет5 3,40 (s, 2H) формина в сыворотке лечившихся пациентов У ПРИМЕР 2 Моногидрохлорид [2-(аминоимилюдей с диабетом, которые получали 1 грамм нометил)гидразин]-уксусной кислоты метформина перорально, среднее значение С т а х К перемешиваемому раствору моногидрата концентрации в плазме составляет 3,24 микромонохлорида [(аминоиминометил)гидразон]-уксусграмм на миллилитр (или 25 микромолей на литр) ной кислоты (Юг, 60 ммолей) в метаноле (300мл) (Tucker, Casey, Phillips, Connor, et al , Br J Clm добавляли 10% Pd-C (0,25г), и смесь гидрогенизиPharmacol , 2 235 - 246, 1981) и поэтому находится ровали при давлении 206,7 103н/м2 в промежутке между наивысшей концентрацией, 2 которая, как показано, снижает неферментативное (ЗОфунт/дюйм ) Смесь фильтровали и растворигликозирование эритроцитов, и самой низкой контель выпаривали до сухости Остаток перекрицентрацией, которая, как показано, стимулирует сталлизовывали из ЕЮН с получением 4,2г (42%) этот процесс На основании опубликованных знавещества, названного в заголовке, в виде белого чений уровня метформина в плазме у пациентов с твердого вещества (т пл 163 - 165°С) 1Н ЯМР диабетом, нельзя сделать заключение, будет ли (D2O) 5 3,68 (с, 2Н) метформин подавлять неферментативное гликоПРИМЕР 3 [2-(аминоиминометил)гидразин]зирование белков или будет усиливать процесс уксусной кислоты фенилметилового эфира монотем же путем при назначении в качестве терапии гидрохлорид для больных HCI (г) пропускали через суспензию [2(аминоиминометил)гидразин]-уксусной кислоты Основные методы получения соединений это(2,00г, 15,2 ммоля) в бензиловом спирте (30мл) го изобретения представлены на схемах 1 - 4 Реакционную смесь перемешивали в течение Конкретные примеры для ряда этих методик можпримерно часа до тех пор пока все не перейдет в но найти в экспериментальных методиках, предраствор Неочищенный продукт осаждали путем ставленных в описании предпочтительного осудобавления Et20 Это вещество перекристаллизоществления Путем применения других исходных вывали из МеОН/ЕЮАс с получением монохлориматериалов и реагентов могут быть получены да фенилметилового эфира [2-(аминоиминомеразнообразные соединения этого изобретения В тил)гидразин]-уксусной кислоты (3,20г, 82%) в виследующих источниках изложены методики, каде твердого кристаллического вещества сающиеся основных методов синтеза соединений Т пл 162-164°С 1 этого изобретения Н ЯМР (CD3OD) 5 3,69 (с, 2Н), 5,24 (с, 2Н), Схема 1 Gante, J Chem Ber 1968, 101, 1195 7,34-7,42(м, 5Н) Armarego, W L F , Kobayashi, T J Chem Soc (C) ПРИМЕР 4 а-гидразинбензолпропановая ки1971, 238 Evans, D A , Bntton, T C , Dorow, R L , слота Dellana, J F J Am Chem Soc 1986, 108, 6395 Раствор ЛДА (50мл 1,5М раствора в ТГФ) в Evans, D A , Bntton, T С , Dorow, R L , Dellana, J F 250мл безводного ТГФ охлаждали до -78°С К Tetrahedron 1988, 44, 5525 этому раствору по каплям добавляли раствор Схема 3 Gut, J , Hesoun, D , Novacek, A Coll этилгидроциннамата (12,0мл, 68,2 ммоля) в 250мл Czech Chem Comm 1966, 31, 2014 Miura, K, безводного ТГФ Раствор перемешивали при Ikeda, M , Kondo, T, Setogawa, К Chem Abstr 78°С в течение ЗОмин Затем по каплям добавля1962, 56 4767b Pankaskie, M , Abdel-Monem, M M ли раствор ди-трет-бутилазокарбоксилата (18,84г, 14 13 54382 81,8 ммоля) в 100мл безводного ТГФ Через кипящей в колбе с обратным холодильником дисЮмин реакцию останавливали путем добавления тиллированной воды и полученный раствор раз14мл НОАс и давая нагреться до комнатной тембавляли 90мл горячего абсолютного спирта Смепературы Смесь разделяли между Et20 и водой си давали охладиться до 25°С и через 24 часа Водный слой экстрагировали Et20 (3 х 100мл) осадок, который при этом образовывался, собиОбъединенные органические слои промывали рали фильтрованием Твердое вещество сушили насыщенным водным раствором ЫаНСОз (2 х (20 торр/50°С/24 часа) с получением 3,8г вещест100мл) и рассолом (1 х 100мл), сушили сульфатом ва, названного в заголовке, в виде белого твердонатрия и конденсировали Неочищенный продукт го вещества, т пл 239 - 241 °С подвергали хроматографии на двуокиси кремния ПРИМЕР 6 Моногидробромид [1-(аминоими(90/10 гексан/ЕЮАс) с получением 15,33г (55%) нометил)гидразин]уксусной кислоты бис-БОК-защищенного гидразинового эфира К перемешиваемой суспензии бикарбоната Эфир собирали в 200мл CH2CI2 К этому раствору аминогуанидина (ЮОг, 734 ммоля) в воде (200мл) добавляли 120мл тиофторуксусной кислоты добавляли бромуксусную кислоту (ЮОг, 720 ммоСмесь перемешивали в течение 2 часов при комлей) После первоначального вспенивания гомонатной температуре После удаления растворитегенный раствор нагревали в колбе с обратным ля неочищенный продукт собирали в 75мл 1N холодильником в течение ночи, охлаждали до NaOH и нагревали в колбе с обратным холодилькомнатной температуры и растворитель выпариником в течение 2 часов Раствор охлаждали, эксвали до сухости Остаток суспендировали в ЕЮН трагировали Et20, нейтрализовали, конденсиро(200мл) и диспергировали с помощью ультразвували до половины объема, охлаждали и ка Твердое вещество отфильтровывали с полуфильтровали Полученное коричневатое твердое чением 13,6г (9%) вещества, названного в заговещество перемешивали в кипящем 1-РЮН в теловке, в виде белого твердого вещества (т пл чение 5мин для удаления окрашенных примесей 163 - 165°С) 1Н ЯМР (D2O) 5 4,25 (с, 2Н) Фильтрация и высушивание давали 3,35г (27%) аПРИМЕР 7 3-[[имино[(1-метилэтилиден)гидрагидразинбензолпропановой кислоты в виде белого зин]метил]амино]пропановая кислота твердого вещества Р-аланин (6,00г, 67,5 ммоля) растворяли в Т пл 198 - 20ГС (разл) 1Н ЯМР (D2O) 5 67,5мл 1 N NaOH К этому раствору добавляли 7,41 - 7,29 (м, 5Н), 3,89 (дд, J = 7,6Гц, 1Н), 3,23 гидройодид ^амино-5-метилизотиомочевины 3,08 (м, 2Н) (15,69г, 67,5 ммоля) Смесь нагревали до кипения в колбе с обратным холодильником в течение 1,5 ПРИМЕР 5 Моногидрат а-[2-(аминоиминомечасов Растворитель удаляли Неочищенный протил)гидразин]бензолпропановой кислоты дукт собирали в примерно 50мл воды и добавляли Раствор а-гидразинбензолпропановой кисло50мл ацетона Удаление растворителя давало ты (3,00г, 16,7 ммоля) и сульфата 2-метил-2оранжевое твердое вещество, которое подвергали тиопсевдомочевины (2,55г, 18,3 ммоля) в 17мл 1N хроматографии на двуокиси кремния (80/20 NaOH нагревали до кипения в колбе с обратным СНС1_3/МеОН, затем 60/40 CHCL3/Me0H) с полухолодильником в течение 2 часов Смесь нейтрачением 5,88г (47%) 3-[[имино[(1-метилэтиллизовали 3N Неї и концентрировали до тех пор, иден)гидразин]метил]амино] пропановой кислоты пока не начиналось осаждение (примерно, 1/2 в виде бледно-оранжевого твердого вещества Т объема) Неочищенный продукт фильтровали и пл - 125°С (разл) 1 Н ЯМР (D2O) 5 3,36 (т, J = перекристаллизовывали из воды с получением 6Гц, 2Н), 2,35 (т, J = 6Гц, 2Н), 1,87 (с, ЗН), 1,80 (с, 1,81 г (49%) моногидрата а-[2-(аминоиминомеЗН) тил)гидразин]бензолпропановой кислоты 1 ПРИМЕР 8 М-(гидразиниминометил)-р-аланин Т пл 127 - 130°С (разл) Н ЯМР (D2O) 5 3-[[имино[(1-метилэтилиден)гидразин]ме7,40 - 7,27 (м, 5Н), 3,60 (дд, J = 8,6Гц, 1Н), 3,04 тил]амино] пропановую кислоту (5,88г, 31,61 ммо(дд, J = 14,6Гц, 1Н), 2,86 (дд, J = 14,8Гц, 1Н) ля) растворяли в 125мл воды и нагревали при 2-[2-(Аминоиминометил)гидразин]пропановая 60°С в течение 72час Растворитель выпаривали и кислота продукт перемешивали в смеси 4 1 ЕЮН и МеОН Смесь 10,0г (55,4 ммоля) гидрохлорида 2Полученный бледно-оранжевый осадок отфильт[(аминоиминометил)гидразин]пропановой кислоты ровывали, промывали этанолом и сушили с полу(J Pharmaceut Sci 1980, 69, 1000 - 1004), 1,5г 10% чением 3,16г (68%) ^(гидразиниминометил)-рпалладия на угле и 300мл дистиллированной воаланина в виде бледно-оранжевого твердого веды встряхивали при давлении водорода 344,5 щества Т пл 177-179°С 1 НЯМР (D2O) 5 3,39 (т, 103н/м2 (50фунт/дюйм2) в течение 16 часов при J = 6Гц, 2Н), 2,42 (т, J = 6Гц, 2Н), 25°С Смесь фильтровали К фильтрату добавляли 75г сильно кислотной катионобменной смолы ПРИМЕР 9 ^(дигидразинметилен)-1-аланин Dowex IR118H в водородной форме Смесь переК суспензии L-аланина (10,Ог, 0,11 моля) и мешивали 1 час и затем смесь фильтровали триэтиламина (33,5мл, 0,24 моля) в ЕЮН (90мл) и Смолу промывали три раза 150мл порциями дисНгО (6мл) добавляли дисульфид углерода (7,2мл, тиллированной воды Объединенный фильтрат и 0,12 моля) После перемешивания в течение ночи промывные воды отбрасывали и смолу промывак желтому раствору добавляли метил йод ид ли пятью 200мл порциями 20% (объем/объем) (7,5мл, 0,12 моля) Смесь перемешивали в течепиридина в дистиллированной воде Эти промывние 1 часа и концентрировали до густой суспенные воды объединяли и растворитель выпаривазии Остаток растворяли в НгО (25мл) и добавляли при пониженном давлении (25°С, 1 торр) Поли HCI до кислой реакции Смесь экстрагировали лученный белый порошок растворяли в 30мл Et20 (3 х 100мл) и органическую фазу сушили 16 15 54382 и концентрировали с получением 18,4г ние 2 часов К горячему раствору затем добавля(93%) соответствующего дитиокарбамата в виде ли гидройодид ^амино-З-метилизотиомочевины бледно-желтого твердого вещества с хорошей (13,98г, 60 ммолей) и раствор нагревали в колбе с чистотой Аналитически чистый образец получали обратным холодильником дополнительно в течепутем перекристаллизации из ЕігО/гексана т пл ние 2 часов Растворитель удаляли Неочищенный 1 90 - 92°С, Н ЯМР (D2O) 5 4,89 (кв, J = 7Гц, 1Н), продукт растворяли в метаноле и фильтровали 2,59 (с, ЗН), 1,52 (д, J = 7Гц, ЗН) для удаления NaCI Фильтрат конденсировали и сушили при высоком вакууме Остаток затем пеК раствору дитиокарбамата (5,0г, 28 ммолей) ремешивали со 150мл МеОН в течение ночи Пов метиленхлориде (50мл) при 0°С добавляли мелученное белое твердое вещество отфильтровытилтрифторметансульфонат (3,5мл, 31 ммоль) вали Это твердое вещество затем кипятили в Смесь нагревали до комнатной температуры и колбе с обратным холодильником в 100мл МеОН перемешивали в течение 20 часов Смесь конценв течение 2 часов для удаления загрязняющих трировали под пониженным давлением до полупримесей Затем смесь охлаждали и фильтровачения бесцветного масла Полученное масло расли Полученное твердое вещество сушили под творяли в НгО (5мл) и добавляли 1,0М NaOH (28 вакуумом с получением 2,14г (24%) [2ммолей) Смесь экстрагировали ЕЮАс (3 х 100мл) гидразиниминометил)гидразин]уксусной кислоты в и органическую фазу сушили (МдБСч) После виде не совсем белого твердого вещества Т пл фильтрации растворитель удаляли под вакуумом 201 - 203°С (разл ) 1Н ЯМР (D2O) 5 3,39 (с, 2Н) с получением густого вязкого масла Это масло ПРИМЕР 13 ^(дигидразинметилен)-сі-аланин растворяли в абсолютном ЕЮН (25мл) и добавляК суспензии D-аланина (1,8г, 20 ммолей) и ли безводный гидразин (4,4мл, 0,14 моля) Смесь триэтиламина (6,1мл, 44 ммоля) в ЕЮН (15мл) и перемешивали в течение 1,5 часа и твердое веНгО (1мл) добавляли дисульфид углерода (1,3мл, щество (2,5), которое при этом образовывалось, 22 ммоля) После перемешивания в течение ночи собирали путем фильтрации Белый порошок док желтому раствору добавляли метил йод ид полнительно очищали путем кристаллизации из (1,4мл, 22 ммоля) Смесь перемешивали в течеНгО/ИФК с получением 2,2г (49%) диамингуанидиние 1 часа и концентрировали до густой взвеси на в виде белого порошка т пл 174 - 176°С Остаток растворяли в НгО и добавляли концен(разд), 1Н ЯМР (D2O) 5 3,69 (кв , J = 7Гц, 1Н), 1,20 трированную НСІ до кислой реакции раствора (д, J = 7Гц, ЗН) Смесь экстрагировали метил-т-бутиловым эфиром ПРИМЕР 10 І\І-(дигидразинметилен)-р-аланин (3 х 50мл) и органическую фазу сушили (MgSO4) и С помощью процедуры, аналогичной примеконцентрировали с получением желтого масла, ненной для получения 1\1-(дигидразинметилен)-1которое с помощью обработки ультразвуком и аланина, р-аланин превращали в ІЧ-(дигидразиндобавления небольшого количества гексана преметилен)-р-аланин (т пл 192°С, разл) 1Н ЯМР вращалось в твердое вещество При дальнейшем (D2O) 3,40 (т 2Н, J = 7Гц), 2,48 (т, 2Н, J = 7Гц) высушивании получали 2,9г желтого твердого вещества Продукт дополнительно очищали путем ПРИМЕР 11 І\І-(дигидразинметилен)-глицин перекристаллизации (ЕЮг/гексан) с получением Раствор метилированного тиокарбогидразида 1,67г (47%) соединения, идентифицированного как (25,Ог, 101 ммоль) и глицина (6,314г, 83,98 ммоля) соединение А из таблицы 9, в виде кремового в воде (50мл) и 12,5 N NaOH (8,89мл, 111 ммолей) твердого вещества т пл 89 - 91 °С, 1Н ЯМР (D2O) перемешивали в атмосфере азота при 75 - 80°С в 5 4,67 (ср, 1Н), 2,39 (с, ЗН), 1,32 (д, J = 7,0Гц, ЗН) течение 3 часов Раствор охлаждали на льду, в то время как он все еще находился в атмосфере азоК раствору дитиокарбамата соединения А из та, перед добавлением порциями абсолютного таблицы 9 (15,1г, 84,3 ммоля) в метиленхлориде этанола (550мл 50мл порциями), перемешивая (170мл) при 0°С добавляли м етилтр и фтор метанпосле каждого добавления до тех пор, пока не сульфонат (10,5мл, 92,7 ммоля) Смесь нагревали завершалось осаждение Затем смесь перемешидо комнатной температуры и перемешивали в вали в течение 15 минут при 0°С перед фильтротечение 20 часов Смесь концентрировали при ванием Собранное твердое вещество тщательно пониженном давлении до бесцветного масла Попромывали абсолютным спиртом Высушивание лученное масло растворяли в НгО (40мл) и додавало легкий розовый порошок (8,04г) Неочибавляли 1,0М NaOH (84,3 ммоля) Смесь экстращенное твердое вещество растворяли в воде гировали ЕЮАс (3 х 200мл) и органическую фазу (30мл), фильтровали для удаления некоторого сушили (MgSO4) После фильтрации растворитель количества тонко измельченного нерастворимого удаляли под вакуумом с получением густого вязвещества и затем разводили до объема, равного кого масла Масло растворяли в абсолютном ЕЮН 250мл, абсолютным этанолом Осаждение начи(85мл) и добавляли безводный гидразин (13,2мл, налось почти сразу же и ускорялось с помощью 0,42 моля) Смесь перемешивали в течение 1,5 обработки ультразвуком в течение нескольких часов и образовавшееся твердое вещество (7,5г) секунд После стояния при комнатной температусобирали фильтрованием Белый порошок дополре в течение Юмин смесь фильтровали с полученительно очищали путем перекристаллизации из нием бледно-розового порошка (5,25г, 42%, т пл Н2О/ИФК с получением 6,48г (48%) соединения, 200°С, разд ) 1Н ЯМР (D2O) 3,78 (с) названного в заголовке, в виде белого порошка т ПРИМЕР 12 [2-гидразиниминометил)гидрапл 175 - 177°С, 1Н ЯМР (D2O) 5 3,69 (кв , J = 7,0Гц, зин]уксусная кислота 1Н), 1,20 (д, J = 7I~4, ЗН) Этилгидразинацетата гидрохлорид (9,28г, 60 ПРИМЕР 14 ^(дигидразинметилен)-валин ммолей) омыляли путем нагревания в колбе с обК суспензии L-валина (5,0г, 42,7 ммоля) и триратным холодильником в 120мл 1 N NaOH в тече 17 этиламина (13,1мл, 93,9 ммоля) в ЕЮН (30мл) и НгО (2мл) добавляли дисульфид углерода (2, мл, 47,0 ммолей) После перемешивания в течение ночи к желтому раствору добавляли метилйодид (2,9мл, 47,0 ммолей) Микстуру перемешивали в течение 2 часов и концентрировали до густой взвеси Остаток растворяли в Ь^О (10мл) и добавляли концентрированную HCI до кислой реакции раствора Смесь экстрагировали Et20 (3 х 100мл) и органическую фазу сушили (MgSO4) и концентрировали с получением желтого масла, которое после внесения затравки давало желтое твердое вещество Твердое вещество суспендировали в гексане и фильтровали с получением 7,7г соединения В из таблицы 9, в виде не совсем белого твердого вещества Фильтрат охлаждали до 0°С с получением второй порции, равной 0,27г соединения В из таблицы 9 (7,97г всего, 90%) в виде белого твердого вещества т пл 76 - 78°С, Н ЯМР (CDCI3) 5 530 (м , 1Н), 2,40 (м, 1Н), 1,08 (д, J = 7,0Гц, ЗН), 1,04 (д, J = 7,0Гц, ЗН) 54382 18 5,13 (с, 2Н), 6,77 (уш с , 1Н), 7,33 (м, 5Н) ПОЛУЧЕНИЕ СОЕДИНЕНИЯ 10 К раствору соединения В из таблицы 9 (8,0г, 38,6 ммоля) в метиленхлориде (60мл) при 0°С добавляли м етилтр и фтор метан сул ьфонат (4,8мл, 42,5ммоля) Смесь нагревали до комнатной температуры и перемешивали в течение 20 часов Смесь концентрировали под пониженным давлением до бесцветного масла Полученное масло растворяли в НгО (10мл) и добавляли 1,0М NaOH (38,6мл) Смесь экстрагировали ЕЮАс (3 х 100мл) и органическую фазу сушили (MgSO4) После фильтрации растворитель удаляли под вакуумом с получением густого вязкого масла Масло растворяли в изопропиловом спирте (150мл) и добавляли моногидрат гидразина (9,4мл, 0,19 моля) Смесь перемешивали в течение 2 часов и добавляли ТГФ, что давало в результате более фильтруемое твердое вещество Фильтрация давала 2,4г (33%) соединения, указанного в заголовке, в виде слегка гигроскопичного белого твердого вещества т пл, 112-116°С, 1Н Я М Р р 2 О ) 5 3,70 (д, J = 5,0Гц, 1Н), 2,20 (м, 1Н), 0,97 (д, J = 7,0Гц, ЗН), 0,94 (д, J = 7,0l~4, ЗН) ПРИМЕР 15 [1-(аминогидразонметил)гидразин]уксусная кислота (Пожалуйста, обратитесь к схеме 5) ПОЛУЧЕНИЕ СОЕДИНЕНИЯ 9 К перемешиваемой суспензии гидрохлорида этил гид разинацетата (5,0г, 32,34 ммоля) и Nметилморфолина (3,26г, 32,34 ммоля) добавляли при 0°С твердый М-(бензилоксикарбонилокси)сукцинимид (8,06г, 32,34 ммоля) Смеси давали нагреться до комнатной температуры в течение ночи и растворитель удаляли под вакуумом Остаток суспендировали между ЕЮАс/НгО, слои встряхивали, органические вещества отделяли и сушили над Na2SO4 Растворитель удаляли и остаток хроматографировали с помощью тонкослойной хроматографии на S1O2 (элюент гексан/ЕЮАс) с получением 5,7г (70%) вещества заголовка в виде белого твердого вещества, т пл 95 - 97°С Остаток при последующих реакциях очищали путем перекристаллизации из ЕЮАс/гексана с получением вещества, названного в заголовке со слегка более низким выходом -1Н ЯМР (CDCI3) 5 1,27 (т, J = 7,0Гц, ЗН), 3,66 (с, 2Н), 4,19 (кв , J = 7,0Гц, 2Н), К перемешиваемой суспензии препарата 9 (3,0г, 11,89 ммоля) в ЕЮН (30мл) при комнатной температуре добавляли водный раствор NaOH (1N, 11,89мл) К смеси дополнительно добавляли НгО (10мл) и перемешивали в течение 1 часа (смесь становилась гомогенным раствором, а затем осаждалось твердое вещество) Затем добавляли водный раствор HCI (1 N, 11,89мл), этанол удаляли под вакуумом и водный раствор экстрагировали с помощью ЕЮАс (2 х 100мл) Органические слои объединяли, сушили над Na2SO4 и растворитель удаляли с получением 2,31 г (87%) вещества заголовка в виде белого твердого вещества Т пл 131 - 133°С 1Н ЯМР (CD3OD) 5 3,59 (с, 2Н), 5,15 (с, 2Н), 7,37 (м , 5Н) ПОЛУЧЕНИЕ СОЕДИНЕНИЯ 11 К перемешиваемой суспензии препарата 10 (25,44г, 112,7 ммоля) в ЕЮАс 500мл) добавляли триметилсилилизотиоцианат (14,79г, 112,7 ммоля) и смесь нагревали при легком нагревании (80°С) в колбе с обратным холодильником в течение ночи Полученный раствор охлаждали до комнатной температуры и промывали НгО (2 х 100мл) ОграНИЧЄСКИЙ СЛОЙ ОТДеЛЯЛИ, СуШИЛИ Над N32SO4 И растворитель выпаривали до сухости Маслянистый остаток растворяли в CH2CI2 и оставляли стоять при комнатной температуре на 3 минуты, на срок, во время которого образуется твердое вещество Твердое вещество отфильтровывали, промывали CH2CI2 (100мл) и сушили под вакуумом Твердое вещество суспендировали в горячем ЕЮАс (300мл), чтобы растворить какое-то количество серы, связанной с побочными продуктами, и растирали с гексаном (200мл) с получением 17,1г вещества заголовка (53%) в виде твердого белого вещества Т пл 148 - 149°С 1Н ЯМР (CD3OD) 5 5,20 (с, 2Н), 7,30 (м, 5Н) оставшиеся СНг не наблюдаются ПОЛУЧЕНИЕ СОЕДИНЕНИЯ 12 К перемешиваемому раствору препарата 11 (5,0г, 17,64 ммоля) в EtOH (15 мл) при комнатной температуре добавляли метилйодид (2,73г, 19,41 ммоля) и полученный раствор перемешивали в течение ночи Растворитель удаляли под вакуумом с получением 7,50г (количест) вещества заголовка в виде желтой пены 1Н ЯМР (CD3OD) 5 2.69 (ушир, с , 6 Н), 2,84 (ушир с , 0,4Н), 4,40 4.70 (м, 2Н), 5,31 (ушир с , 2Н), 7,46 (м, 5Н) ПОЛУЧЕНИЕ СОЕДИНЕНИЯ 13 К энергично перемешиваемому раствору препарата 12 (25,5г, 60 ммолей) в НгО (100мл) при комнатной температуре медленно добавляли гидразина гидрат (6,06г, 120 ммолей), до тех пор, пока не будет добавлена 1/2 К образовавшейся твердой массе добавляли НгО (10мл) и твердое вещество разбивали механически с помощью шпателя Затем добавляли оставшийся гидразин и раствор энергично перемешивали в течение 1 часа Гетерогенную смесь обрабатывали ультразвуком и перемешивание продолжали до тех пор, пока не образовывалась густая масса Добавляли ЕЮН (50мл), твердое вещество отфильтровывали, промывали ЕЮН и сушили под вакуумом с получением 9,24г (55%) вещества, названного в 54382 20 19 заголовке, в виде белого твердого вещества, т пл виде процента изменения веса тела Соединения, 168 - 170°С 1Н ЯМР (D2O) 5 3,86 (ушир с, 1Н), дающие в результате снижение на 1% или более 4,21 (ушир с , 1Н), 5,17 (с, 2Н), 7,39 (с 5Н) по сравнению с контролем веса тела через три дня, считаются активными средствами против [1-(гидразиниминометил)гидразин]уксусная ожирения кислота К раствору препарата 13 (9,20г, 32,71 ммоля) в МеОН/Н2О (400мл, -2,1 объем/объем) добавляТБИ А 1 АЛ Ц ли 10% Pd-C (1,0г) и смесь гидрогенизировали при 3 2 2 соединения этого изобоаїет 206,7 10 н/м (ЗОфунтов/дюйм ) в течение 4 чаHNC« - HC ,CC , - -HN - H- - H сов Катализатор отфильтровывали через диатоAcetic Bad [S-CammoiminomethyllИ If мовую землю и снова добавляли 10% Pd-C (1,0г) ° 3 2 Смесь гидрогенизировали при 206,7 10 н/м метил)гилрлзир ] Уксусчач ь (ЗОфунтов/дюйм2) в течение 2,5 часов и опредеH N-C Ш NHCHj-C-OH Аегйе and, В-СашгааипівотгЙіу!)ляли завершение гидрогенизации с помощью ТСХ hydraimol monohydcodhlonde (элюент CH2CL2/MeOH/HCO2H 85 14 1) Смесь фильтровали через диатомовую землю и раствоУксусная кислота, і. оиохлорИЕ ритель удаляли до ~50мл, и в это время осаждан н II лось твердое вещество Твердое вещество отGlyase, нч&уііаалдші; пошегауі) Рі-ігидразич шикометжя)фильтровывали, промывали минимальным колиГхщиа, чеством Н2О и сушили под вакуумом с получением 3,60г (75%) соединения, названного в заголовке, в виде не совсем белого твердого вещества Т Glycme. пл 196 - 198°С Вторую порцию получали путем Ьу&чхЫоЫв (21) концентрации фильтрата до образования твердого вещества Фильтрование давало дополнительГлицин, гидрохлср/Щ IS. I) но 0,90г (19%, общий выход 94%) вещества, 1 имеющего идентичную температуру плавления Н el glyone ЯМР (D2O) 5 4,06 (с, 2 Н) m Z БИОЛОГИЧЕСКОЕ ИСПЫТАНИЕ Соединения этого изобретения были испытаны на их способность снижать уровень глюкозы в крови и вес тела следующим образом Мыши ККАу служат моделями ИНСД и ожирения на грызунах (Chang, Wyse, Copeland, Peterson and Ledbetter, 1986) Образец крови до лечения получали из ретроорбитального синуса, и мышей распределяли на группы по 6 животных, так что средний уровень глюкозы в крови до лечения был в среднем одинаковым во всех группах Испытуемые соединения смешивали с пищей до концентрации 0,5%, и мышам давали потреблять пищу по желанию Контрольные мыши получали питание без добавок В день 0 мышей взвешивали и давали контрольную пищу или пищу с добавкой испытуемых соединений Через 3 дня после потребления контрольной пищи или пищи с добавками испытуемых соединений получали образец крови для определения концентрации глюкозы, и животных взвешивали для определения потери веса Потребление пищи определяли путем взвешивания корма, предоставленного в начале испытания, и остатка корма в конце испытания Потребление корма рассчитывали путем вычитания веса остатка из веса предоставленного корма Потребление лекарства рассчитывали путем умножения потребления пищи на 0,5% С использованием этого метода определено, что прием лекарства составил примерно 500 м г/кг/сутки Данные по уровню глюкозы в крови представлены в виде средней концентрации глюкозы в крови в испытуемой группе, деленной на средний уровень глюкозы в крови в контрольной группе (лечившаяся/контрольная или Л/К) Соединения, дающие в результате Л/К значения, равные или менее 0,90 считаются активными противогликемическими средствами Данные по потере веса выражены в HoN-C-NH-tJHCHa-C-QH Acetic and, [2 (bytlrazmoinunomethyi bydrazjoo] їй (пдоазин зи-і }ьисюта, [1 fhj acid [і- ( і і гидразин] Родотаеккые НЄЗ-ЇТИВНЬІЄ соецл^ечая, котооие не заявлен і^ -C~N--N=CH-C-OH », II ГЧП Ґ\ Acetic acsd, tfauunoiminomethv!!щвйуіЬу^гамшІ suIfateSl) О й с aad ЕІившо{шН-оаиішо).yllhydfaranoj •уснея кі-сюта. *сн-с-он II 0 Леей.с acid, ЦшиваЬае&уіатаніУ .уіЗЬуйгагопоІ у" н ? н н ? ' сьяя кислота. 21 54382 ТБИ А3 АЛ Ц 22 ТЛЁДША 4 исключения к обьее у ооъечу j-c—PJH-flH—CH^Hj—G-OH Propanoic aad, 3 О гмвдаэщ ] (іропатовая кислота, hydrazma] 10 ~ QH—С — N NH tl О Butaaoic aad, 2 [2 (ашпоimmometbyl!hydrazino]2-[2-(аминоишномегші) гщшазйк 1Бутановая аислота. tUJ-C-NH-NH-CH — C-OH п и H О Э0 e^d akoma Bulaaoic aad, 4-[(hydrsano -[(ГИДрЗЕИН UFboJ Вутановая кислота, -(диі ТА5ЛНШ ааяв^яемьіе СОЄДРЧЄЕ-РІ ЭТОГО изобрэтен я f, | Г Acetic aad [2 faBuaoioitnom«tbvl) H;N-C-NH-NHCH2-C -ОН .ни -NH-NH-CHj-C-0—CHj—^ hydranno] monohydroctdorkie -{аминов ми пометил)гид Уксусгі=я кислота, "онегидроЛ—^ХЛОВВД ^ Acetic aad, [ 2 ^ а т і шзчшпожейу!) hjdtaziaoS, pheaytmethyi ester, monohydrodiionde [2- (аминоидаисмеїкл Уйо/сра? кислота, й ё моногидзохлорид X — с — №i-N=СН--С—ОМ И N но НА [{аникой к/слота BenzscepropanOic aad alphaE2с н • не Н J4-G-NH- МН-СН— G -GH ? ІІ II > ЇІВОПЙЧОЙЙТ /ис •'ота «о"оги^рохлорин Eutanaic and, 2-ftsmmoкш nometbyl/hydf агопої mnooiiydrodibtids гщразич] Бензолпроганова^ F "слота, ь очогилрат r н V К II ЛІЙ"!*/)- ГЛ4І.ІИ, ми, о Г І! Acetic aod, [ 1 -(am і ноипшоше&уй hydrasujo], moftdsydrobfoauda н н Glycuse, К [J. - (амш»о лчмьо ^eTHJi) гидваз/н} H^-C-NH-ОНзСНз-С - Ші а-{(аяцзо fiat ановач «ис/ота. 23 54382 ТАБЛИЦА 6 Доза-ответ в отношении гипергликемии и ожирения у мышей ККАу с помощью перорального введения 1\1-(дигидразинметилен)-глицина Мышей ККАу лечили 1\1-(дигидразинметилен)глицином, как описано выше, за исключением того, что соединение примешивали к корму в количестве 0,03, 0,06, 0,10, 0,20, 0,30 и 0,40%, так чтобы суточные дозы составили примерно 30, 60, 100, 300 и 400мг/кг Контрольные мыши получали корм без добавок Для сравнения с ІЧ-(дигидразинметилен)-глицином давали 3-гуанидинпропионоДобавка Нет (0) г\І-(дигидразинметилен)- глицин г\І-(дигидразинметилен)- глицин г\І-(дигидразинметилен)- глицин г\І-(дигидразинметилен)- глицин г\І-(дигидразинметилен)- глицин г\І-(дигидразинметилен)- глицин 0,5% 3-ГФК 0,03% 0,06% 0,10% 0,2% 0,3% 0,4% 24 вую кислоту (3-ГПК) в виде 0,5% примеси к корму (примерная доза 500мг/кг/сутки) Данные представлены в виде процентного изменения концентрации глюкозы в крови и веса тела на 3-й день по сравнению с 1-ым днем испытания Средние значения ± С К О для п = 6 мышей/группу Статистическое значение определяли с помощью анализа дисперсии с использованием программного обеспечения JMP 3 0 2 (SAS Institute) *, Р < 0,05 при сравнении с нулем, ї ї значительно меньше, чем 3-ГФК (Р < 0,05) % Изменения уровня глюкозы в крови в % Изменения веса тела -5,8 ±7,1 -0,71 ±0,65 -13,5 ±10,5 - 0,92 ± 0,35 -34,9 ±17,1* -1,51 ±2,11 - 45,2 ± 6,4* - 4,04 ± 0,76* -8,22 ±1,05* - 69,9 ± 3,2*, < П -70,4 ±1,5*. 51 - 9,94 ± 1,62*, < П - 70,3 ± 3,9*, < П -10,3 ± 0,97*, < П - 38,4 ± 4,4* -5,4 ±0,81* *, Р < 0,05 по сравнению с нулем < П , значительно меньше, чем 3-ГФК (Р < 0,05) ТАБЛИЦА 7 Улучшение толерантности к глюкозе при внутрибрюшинном введении Толерантность к глюкозе определяли у мышей без диабета C57BL и мышей с диабетом ККАу Животным вводили перорально через зонд дистиллированную воду (контроль) или 100мг/кг N(дигидразинметилен)-глицина, затем их не кормили в течение 1 6 - 1 7 часов Образцы крови для определения концентрации глюкозы получали из ретроорбитального синуса Образцы отбирали непосредственно перед введением 2г/кг глюкозы в/в (время = 0) и через 30, 60 и 90 минут после инъекции Уровень глюкозы в крови определяли используя автоанализатор на глюкозу Данные выражали как среднее значение ± С К О для группы из 5 - 6 мышей Статистическое значение определяли с помощью анализа дисперсии с использованием программного обеспечения JMP 3 02 (SAS Institute) *, Р < 0,05при сравнении контролем Линия Время Уровень глюкозы Группа мышей (мин) в крови (мг/дл) 0 143 ± 8 30 233 ±14 Контрольная 60 240 ± 8 90 226 ± 9 C57BL 114 ± 9* 0 |\|-(дигидра174 ±17* 30 зинметилен)60 153 ± 7* глицина 90 161 ±19* ККАу 0 188 ±43 30 487 ±10 Контрольная 60 469 ± 20 90 486 ± 26 |\|-(дигидра115 ± 16 зинметилен)(Р = 0,12 при о глицина сравнении с контр) 383 ± 38* 30 60 90 396 ± 63 392 ± 67 ТАБЛИЦА 8 Подавление неферментативного гликозирования белков Неферментативное гликозирование белков определяли, используя общепринятые методы (Dolhofer and Wieland, 1979, Khatami, Suldan, David, Li and Rocky, 1988) Включение ЮОмМ [14C]-D-mhDKO3bi в человеческий сывороточный альбумин определяли путем растворения человеческого сывороточного альбумина (Sigma Chemical Co), [14С]-О-глюкозы и глюкозы в физиологическом растворе соли и инкубирования при 37°С в течение 8 дней Испытуемые соединения добавляли к раствору в концентрации 19,1 мМ Гликозирование альбумина определяли путем осаждения белка с помощью 1 объема 12% трихлоруксусной кислоты, центрифугирования и промывания осадка дважды 6% трихлоруксусной кислотой с центрифугированием после каждого промывания Промытый осадок солюбилизировали, добавляли сцинтиллирующее вещество, и включение рад помеченной глюкозы определяли путем подсчета сцинтилляций в жидкости Данные выражены в процентах [14С]-О-глюкозы, включенной в альбумин (среднее из 2 измерений) Статистическое значение определяли с помощью анализа дисперсии с использованием программного обеспечения JMP 3/0/2 (SAS Institute) Добавленное вещество Контроль Аминогуанидин З-Гуанидинпропионовая кислота % включенной [14C]-Dглюкозы 1,50 0,96 (Р< 0,05 при сравнении с контролем) 1,52 25 26 54382 0,81 (Р< 0,05 при ІЧ-(дигидразинметилен)сравнении с контроглицин лем) 1,21 (Р< 0,05 при |\|-(дигидразинметилен)сравнении с контроглицин лем) 1,29 (Р< 0,10 при Моногидрохлорид уксуссравнении с контронои кислоты лем) СХЕЙА 2 NH ТАБЛИЦА 9 NH Промежуточные соединения Compound A Соединение СХЕМА З 10 N H Compound В Соединение NH CXSMA 1 S II N-R н н NH R-H.NH, •сн. «НІ СХЕМА 4 H-N-N N-R Н Н Н2 N—X—СОаН NaOH н ,N~X— N-R н н Xи 2 Ml ) e NaOH — N ^ A—lAJah HJ4-N N-R £ н н Ml e I Se M NaOH -CH NH R2 ~CH 54382 28 он TMSNCS і 65% 3 Y о GBZ ^4• H СНЭГ | EtOH CH3 . У, 32 н « Hi 47% NH2 ^ О H 65% Підписано до друку 03 04 2003 p Тираж 39 прим ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)236-47-24
ДивитисяДодаткова інформація
Назва патенту англійськоюAminoguanidinecarboxylates
Назва патенту російськоюАминогуанидинкарбоксилаты
МПК / Мітки
МПК: A61P 3/10, A61K 31/215, A61K 31/195, A61P 3/08, A61K 31/198, C07C 281/00
Мітки: аміногуанідинкарбоксилати
Код посилання
<a href="https://ua.patents.su/14-54382-aminoguanidinkarboksilati.html" target="_blank" rel="follow" title="База патентів України">Аміногуанідинкарбоксилати</a>
Попередній патент: Похідні азетидинону та їх фармацевтично прийнятні солі, фармацевтична композиція з антисклеротичною або гіпохолестеринемічною активністю
Наступний патент: Запобіжна вибухова речовина
Випадковий патент: Пневмомеханічний висівний апарат












