Стабільна фармацевтична композиція, що містить похідне азетидину n-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-n-(3,5-дифторфеніл)метилсульфонамід
Номер патенту: 82539
Опубліковано: 25.04.2008
Автори: Бобіно Валері, Пераккія Марія-Тереза, Коте Софі
Формула / Реферат
1. Стабільна фармацевтична композиція, що включає похідне азетидину, що являє собою N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід, у системі, яка містить:
(і) фосфоліпід або
(іі) комбінацію Мігліолу, Капріолу і Кремофору.
2. Фармацевтична композиція за п. 1, яка включає до 200 мг похідного азетидину на 1 г.
3. Фармацевтична композиція за п. 1 або 2, яка далі включає додаткову домішку, вибрану із стабілізаторів, консервантів, агентів для регулювання в'язкості або агентів, які можуть змінювати, наприклад, органолептичні властивості.
4. Фармацевтична композиція за п. 1, в якій активний інгредієнт, що є похідним азетидину, присутній у кількості від 0,01 до 70 % за масою по відношенню до загальної маси композиції.
5. Спосіб одержання композиції за будь-яким з пп. 1-4, відповідно до якого одержують, якщо це прийнятно, суміш основних наповнювачів після нагрівання, якщо це необхідно, у випадку твердих або напівтвердих наповнювачів, і потім, якщо це необхідно, суміш з додатковими домішками, і потім додають похідне азетидину, яке визначене у п. 1, і здійснюють перемішування для одержання гомогенної суміші.
Текст
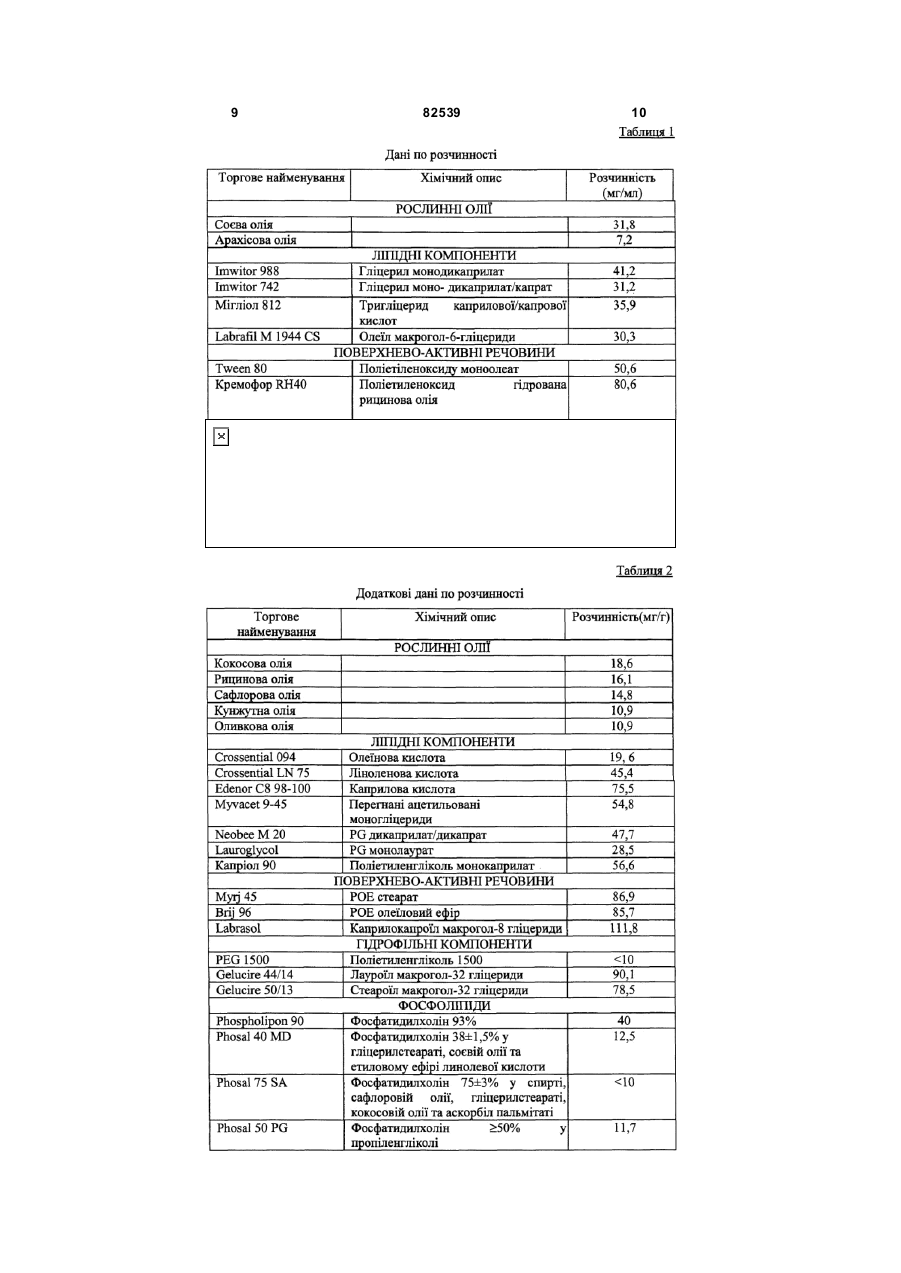
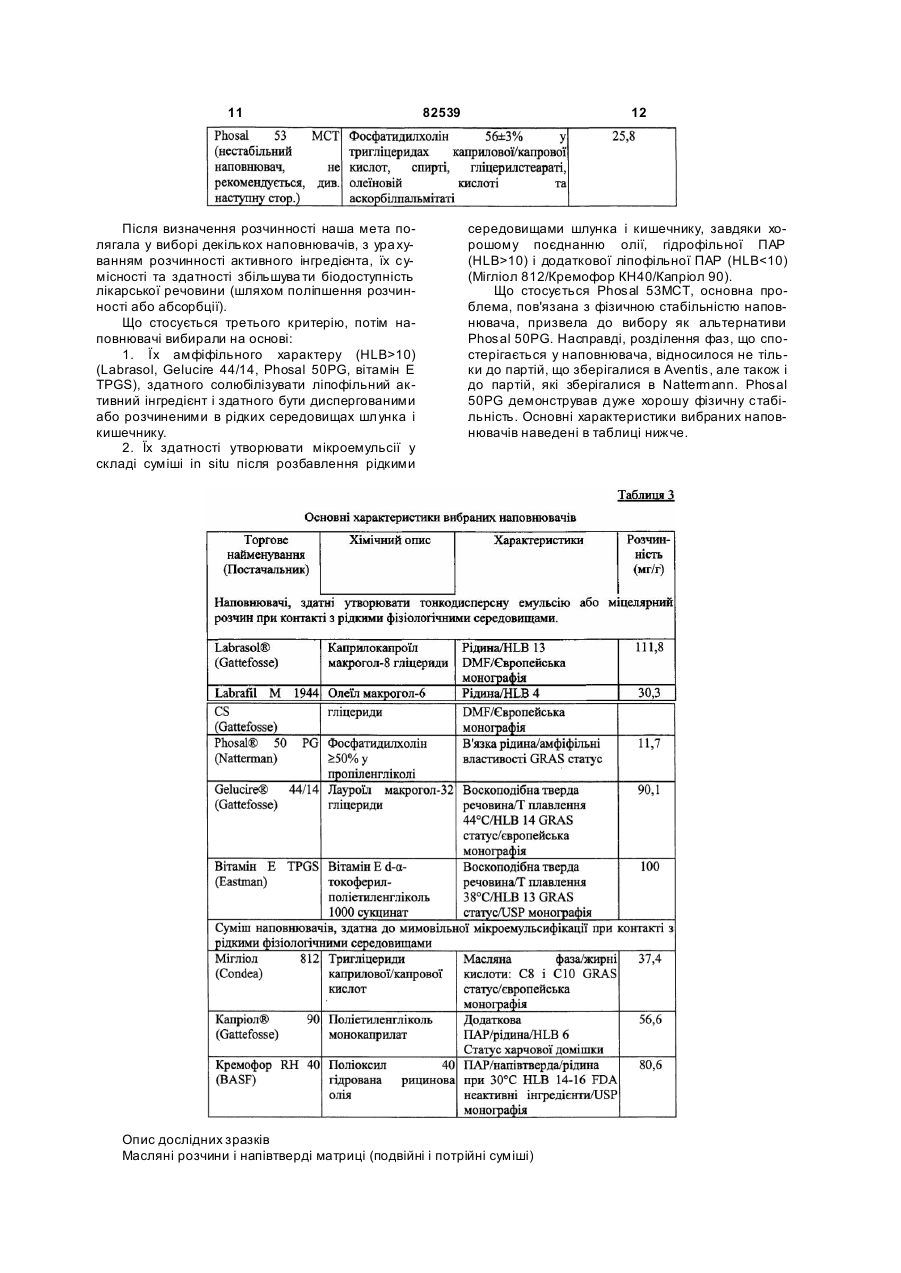
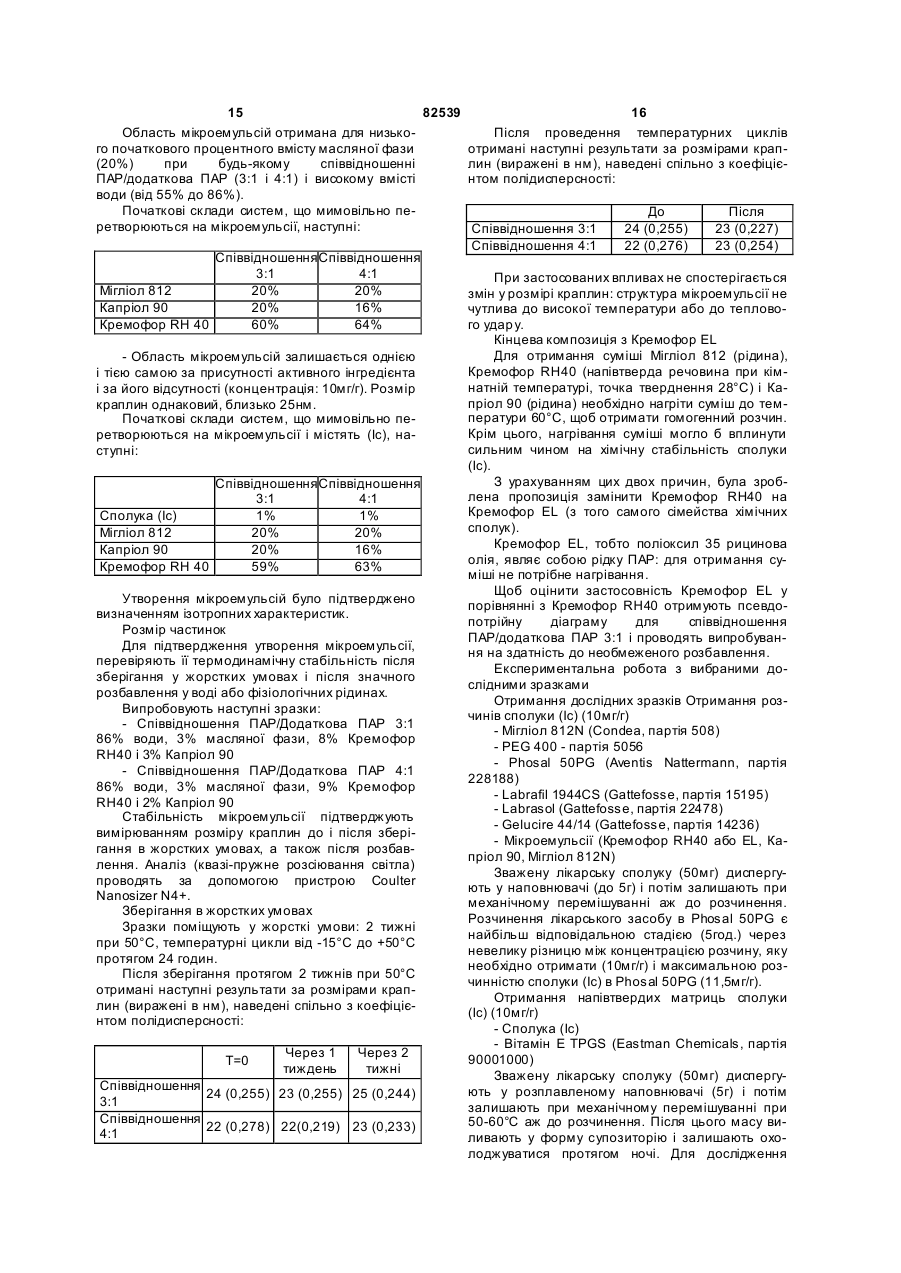
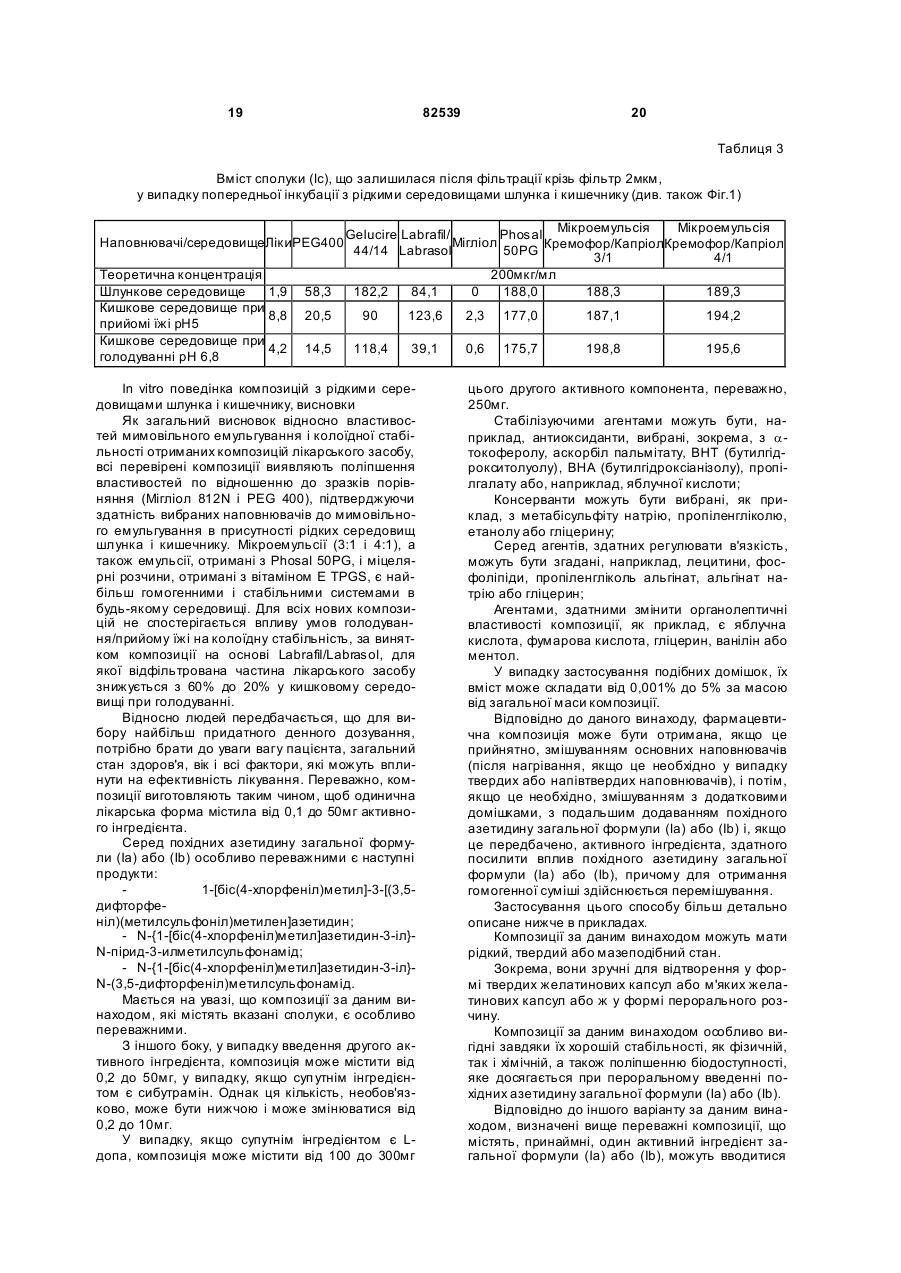
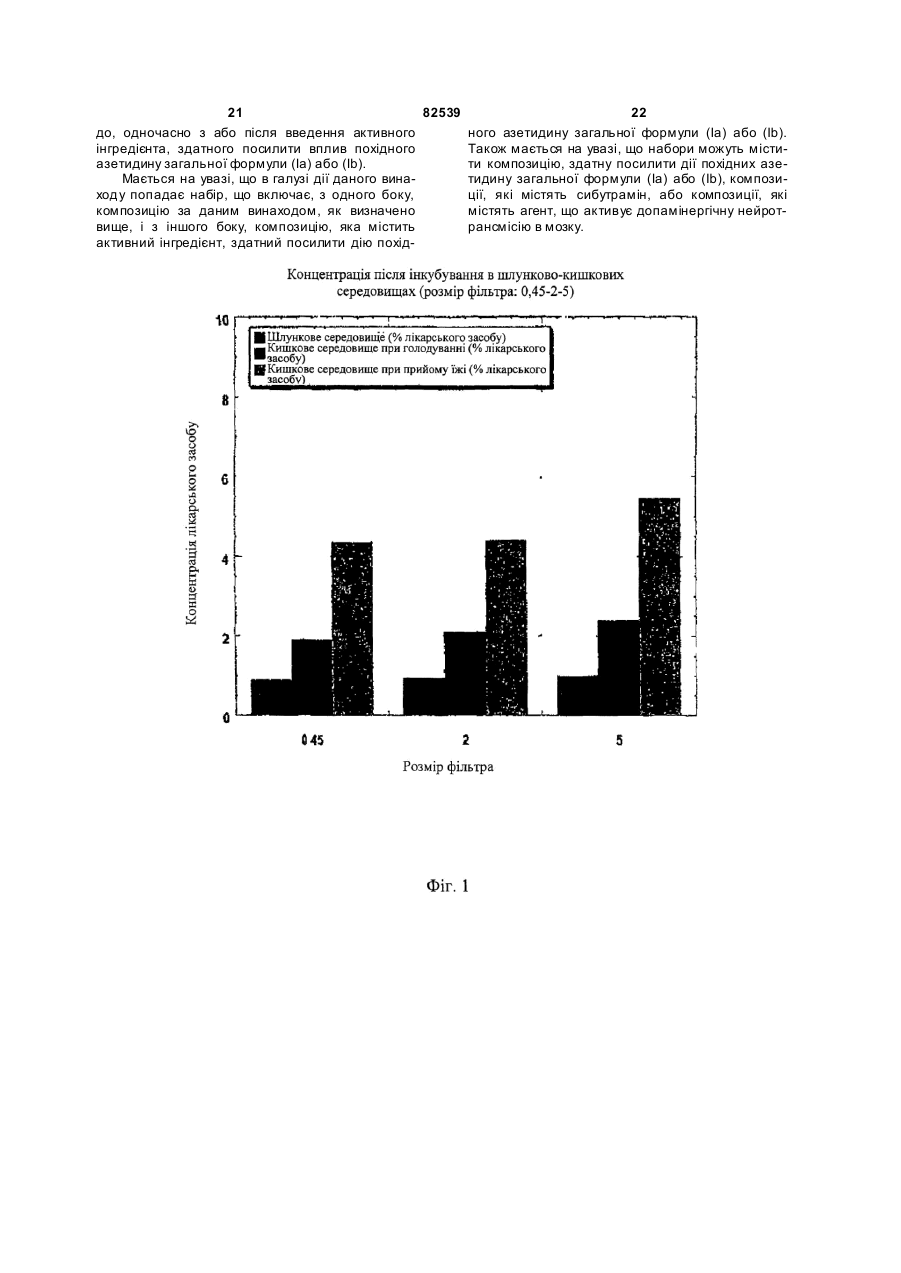
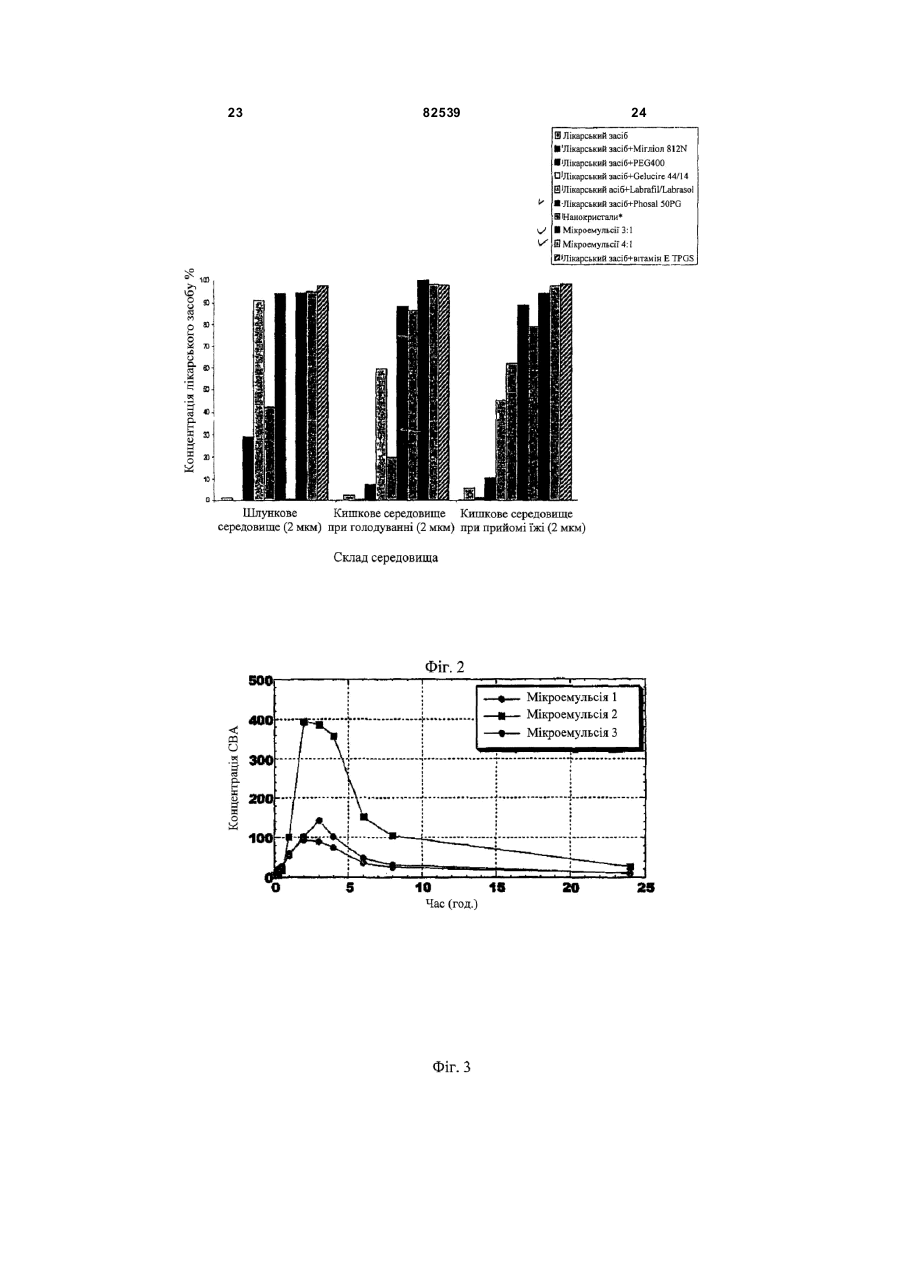
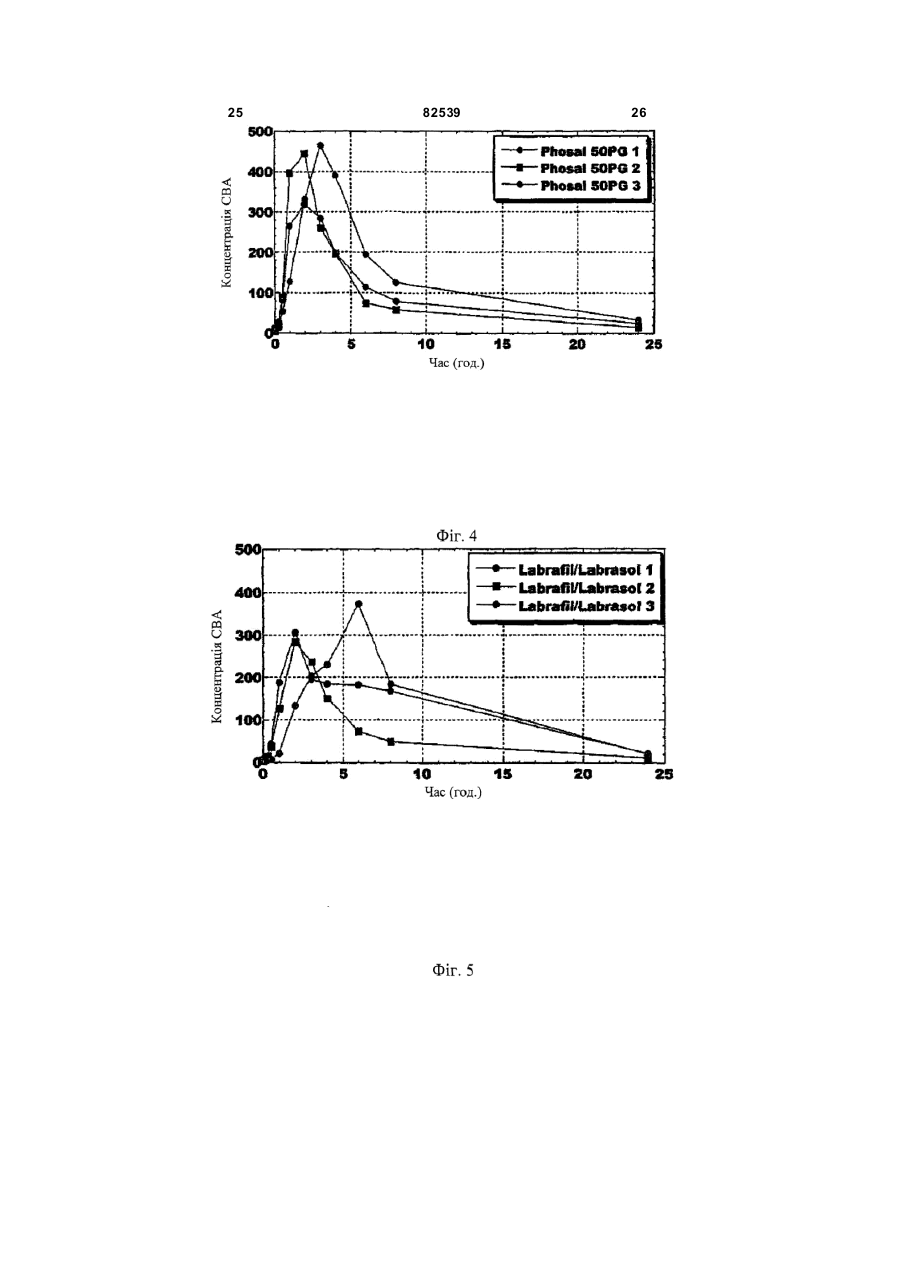
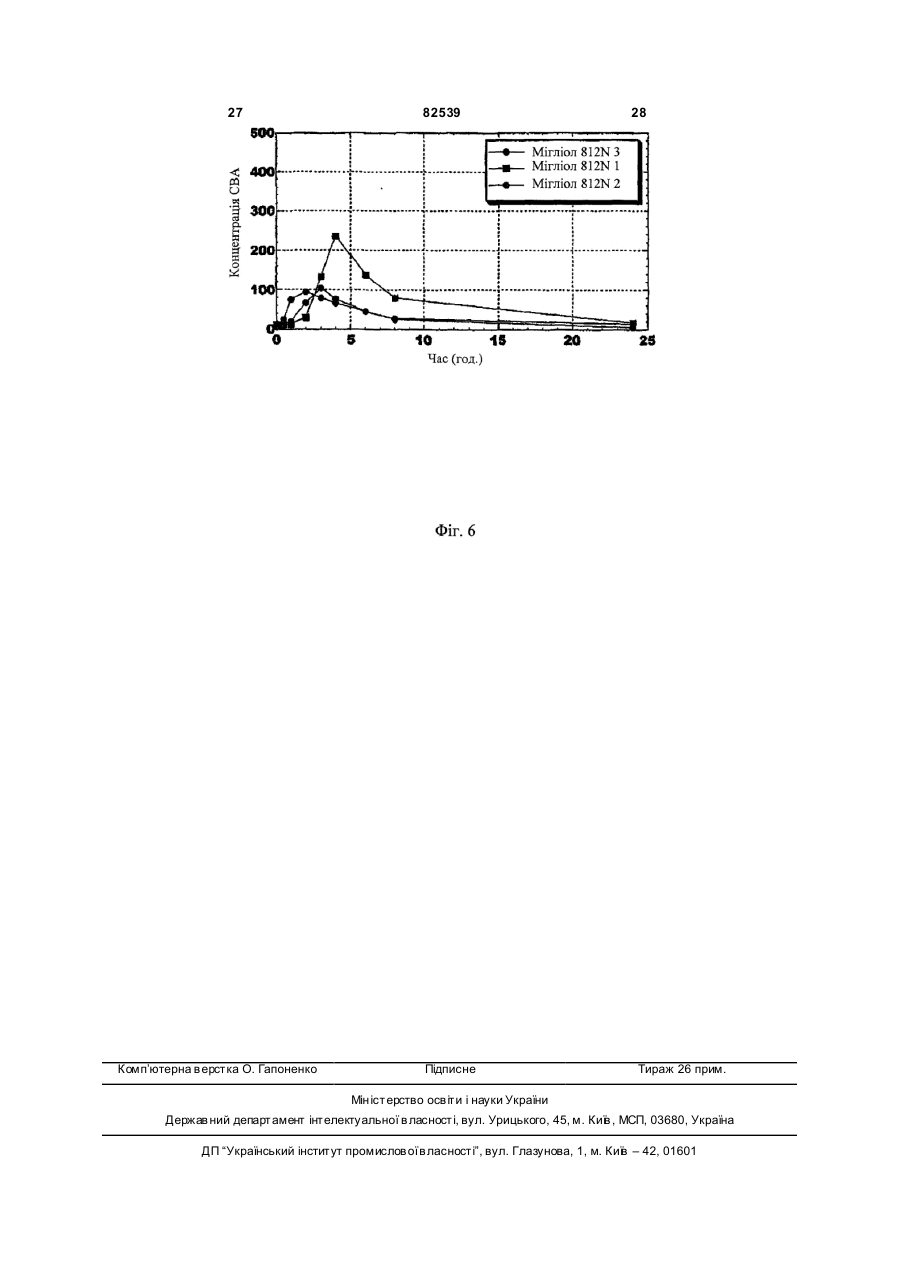
1. Стабільна фармацевтична композиція, що включає похідне азетидину, що являє собою N-{1[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3,5дифторфеніл)метилсульфонамід, у системі, яка містить: (і) фосфоліпід або (іі) комбінацію Мігліолу, Капріолу і Кремофору. 2 (13) 1 3 82539 4 льну групу, і галоген означає фтор, хлор, бром або зиції, які містять похідні загальної формули (Іа) йод. або (Іb), необов'язково у сполученні з іншим актиНаведена нижче сполука (Іс) являє собою конвним інгредієнтом, здатним посилити дію похідних кретний приклад азетидину загальної формули азетидину загальної формули (Іа) або (Іb) у систе(Іа): мі, що містить: (і) фосфоліпід, солюбілізований у рідкому розчиннику, або (іі) комбінацію Мігліолу, Капріолу і Кремофору. Дійсно було виявлено, що композиції сполук (Іа) або (Іb), які містять фосфоліпіди, несподіваним чином дозволяють отримати дуже хороший in vi vo фармако-кінетичний профіль відносно AUC, Сmах і зміни Сmах. Аналогічним чином, і всупереч тому, що стверджувалося раніше в [PCT/FR 02/04514], спостерігалося, що композиції сполук (Іа) або (Іb) з У заявках на [патент WO 00/15609, WO мікроемульсіями, отриманими шляхом комбіну01/64633, WO 00/64634 і WO 99/01451] були опивання Мігліол, Капріол і Кремофор дозволяють сані похідні азетидину загальної формули (Іа) або отримати дуже хороший in vivo фармако(Іb) і їх застосування. Зокрема, ці похідні азетидикінетичний профіль у відношенні AUC і Сmах для ну особливо корисні завдяки їх високій споріднеоднієї з трьох досліджених собак. Блювота, що ності до рецепторів канабіноїдів і, зокрема, до респостерігалася, могла б бути однією з причин нецепторів типу СВ 1. вдалих результатів для двох інших собак. На жаль, похідні азетидину являють собою реПереважна композиція містить сполуку (Іс). човини, які розчинні у воді лише у дуже невеликій Фармацевтична композиція переважно містить мірі. Аж до даного часу передбачається введення до 200мг похідного азетидину на грам. похідних азетидину загальної формули (Іа) або Далі, фармацевтична композиція може містити (Іb), зокрема, пероральним шляхом, у формі табдодаткову домішку, вибрану із стабілізаторів, конлеток, у вигляді композицій, що містять, серед інсервантів, агентів для регулювання в'язкості або шого, целюлозу, лактозу та інші наповнювачі. Одагентів, які можуть змінювати, наприклад, органонак, подібні препаративні форми не завжди досить лептичні властивості. добре підходять для таких мало розчинних у воді Для певних видів лікування, як, наприклад, продуктів через дуже низьку біодоступність. для лікування ожиріння, може бути вигідно вводиСистеми, придатні для солюбілізації і/або поти похідні азетидину загальної формули (Іа) або ліпшення біодоступності гідрофобних активних (Іb) одночасно із сибутраміном, який викликає сиінгредієнтів, описані в численних документах. Однергічний ефект відносно зменшення споживання нак було доведено, що перевірені до даного часу їжі. системи неефективні при отриманні таких фармаСибутрамін і результати його застосування цевтичних композицій, які містять описані вище описані у наведених нижче посиланнях: [WO похідні азетидину, є стабільними і біодоступними, і 90/061110; D.H. RYAN et al., Obesity Research, 3 в яких розчинність похідних азетидину підвищена (4), 553 (1995); H.C. JACKSON et al., British Journal до ефективної концентрації. of Pharmacology, 121, 1758 (1997); G. FANGH ANEL Зокрема, у [J. Pharm Sciences, 89(8), 967 et al., Inter. J. Obes., 24 (2), 144 (2000); G.A. BRAY (2000) і Pharmaceutical Technology Europe, p.20, et al., Obes. Res., 7(2), 189(1999)]. September 2000] згадується композиція на основі Більше того, для лікування інших захворютригліцеридів із середньою довжиною ланцюга для вань, таких як шизофренія, або при лікуванні непогано розчинних у воді активних інгредієнтів. Одврологічних розладів, таких як хвороба Паркінсонак випробування, виконані з композиціями на на, може бути вигідно вводити похідні азетидину основі МігліолуÒ (MiglyolÒ), призвели до незадовізагальної формули (Іа) або (Іb) одночасно з одним льних результатів з точки зору їх біодоступності. або декількома агентами, які активують допамінерБільш того, у [міжнародній заявці WO гічну нейротрансмісію у мозку. Ці комбінації роб95/24893] описані композиції, що містять олію, яка лять можливими посилення результатів допамінезасвоюється, ліпофільну ПАР (поверхнево-активну ргічної монотерапії (леводопу, допамінергічні речовину) і гідрофільну П АР, які призначені для агоністи та інгібітори ферментів), а також дає мопрепаративних форм, що містять гідрофобні актижливість зменшити побічні ефекти, зокрема, дисківні інгредієнти, і для поліпшення біодоступності незію. цих інгредієнтів. У [міжнародній заявці на патент Серед допамінергічних агоністів можуть бути, PCT/FR 02/04514] роз'яснено, що наведені вище зокрема, згадані наступні продукти: бромокриптин похідні азетидину мають дуже слабку біодоступ(bromocriptin) (Novartis), каберголін (cabergoline) ність у композиції даного типу. Зокрема, компози(Pharmacia Соrp.), адроголід (adrogolide) (Abbott ція, що містить такі похідні азетидину, у системі Laboratories), BAM-1110 (Maruko Seiyaku Co Ltd), МігліолÒ (МіglуоlÒ)/КапріолÒ дуодопа (DuodopaÒ) (Neopharma), L-допа (L-dopa), (СарrуоlÒ)/КремофорÒ (CremophorÒ) є незадовідопадоз (dopadose) (Neopharma), CHF 1512 (Chiesi), NeuroCell-PD (Diacrin Inc), PNU-95666 льними з точки зору фармакокінетики in vivo. (Pharmacia & Upjohn), ропінірол (ropinirole) У даному дослідженні виявлено, і це складає об'єкт даного винаходу, що є можливість отримати (GlaxoSmithKline Beecham), праміпексол хімічно і фізично стабільні фармацевтичні компо(pramipexole) (Boehringer Ingelheim), ротиготин 5 82539 6 (rotigotine) (Discovery Therapeutics, Lohmann На основі цих результатів були висун уті настуTherapie System), сферамін (spheramine) (Titan пні вимоги для розробки нових композицій: Pharmaceuticals), TV 1203(Teva pharmaceutical), 1. Розробити композицію зі зниженою конценуридин (undine) (Polifarma). трацією лікарського засобу (10мг/г замість 25мг/г). Мається на увазі, що композиції, які містять 2. Збільшити біодоступність. додатковий активний інгредієнт, що відрізняється 3. Знизити мінливість від пацієнта до пацієнта. від похідного азетидину загальної формули (Іа) 4. Зменшити вплив прийому їжі (відмінності в або (Іb) і здатний посилювати його дію, можуть умовах голодування/прийому їжі). містити продукти, вказані у розташованих ви ще Можливість розробки нестандартних композипараграфах, і що згадані композиції входять у межі цій виникла завдяки застосуванню наповнювачів, даного винаходу. здатних збільшити розчинність активного початку. Активний інгредієнт, що є по хідним азетидину, Таким чином, для подальшої розробки компопереважно присутній у кількості від 0,01 до 70% за зиції з метою поліпшення стадій солюбілізамасою від загальної маси композиції. ції/абсорбції лікарського засобу були досліджені Відповідно до другого аспекту, даний винахід інші ліпідні наповнювачі. Зусилля були сконцентвідноситься до способу отримання композиції, що ровані на «композиціях на основі ліпідів», які здатмістить азетидин за першим аспектом винаходу, в ні утворювати гомогенні та мілкодисперсні емульякому отримують, якщо це прийнятно, суміш осносії, мікроемульсії або міцелярні розчини in situ, вних наповнювачів, після нагрівання, якщо воно завдяки поверхнево-активним властивостям напонеобхідне у випадку тверди х або напівтвердих внювачів. Насправді, Мігліол демонструє емульгунаповнювачів, і потім, якщо це необхідно, отримуючі властивості, але при зіткненні з водним сереють суміш із додатковими домішками, і після цього довищем він утворює гетерогенну і грубу емульсію додають похідні азетидину (Іа) або (Іb) і, коли це (великі краплі олії, видимі в мікроскоп), що могло б передбачено, активний інгредієнт, здатний посипояснити результати in vi vo. лити вплив похідних азетидину загальної формули «Композиції на основі ліпідів» включають різні (Іа) або (Іb), які визначені у п.1 формули винаходу, речовини від чистих олій до сумішей, які містять і здійснюють перемішування для отримання гомоістотні кількості поверхнево-активних речовин і генної суміші. додаткові розчинники (більш високої полярності). Відповідно до додаткового аспекту, винахід Насамперед була визначена розчинність сполуки відноситься до набору, який включає визначену (Іс) у різноманітних ліпідах та інших фармацевтичвище композицію, а також композицію, що містить них додаткових розчинниках. активний інгредієнт, який здатний посилювати дію Для композицій сполуки (Іс) були визначені і похідних азетидину (Іа) або (Іb). вибрані три категорії наповнювачів: Активний інгредієнт набору, який здатний по- Амфі фільні наповнювачі для введення у висилювати дію похідних азетидину, переважно явгляді розчину (Phosal 50PG, Labrasol), здатні до ляє собою сибутрамін. мимовільного емульгування при зіткненні з фізіоВідповідно до останнього аспекту, винахід відлогічним середовищем (розмір крапель 1-10мкм). носиться до набору, який включає композицію за - Амфі фільні наповнювачі для введення у випершим аспектом і композицію, що містить агент, гляді напівтвердих матриць (Gelucire 44/14, вітамін який активує допамінергічну нейротрансмісію у Ε TPGS) для солюбілізації лікарського засобу мозку. шляхом утворення міцел (розмір крапель 2мкм), потім визначають концентрацію за [посилання: Dressman et al., PharmRes., 1998] допомогою ВЕРХ. Розмір фільтра (2мкм) вибирають внаслідок експериментів з фільтрами з Таблиця 2 різними розмірами пор (0,45, 2 і 5мкм), які випробовують на водних розчинах лікарського засобу. Склад імітацій шлунково-кишкового середовища Насправді, як показано на Фіг.1, при будь-якому розмірі пор фільтра (0,45, 2 і 5мкм) спостерігається висока міра затримки лікарської речовини, Шлункове середовище (G) що передбачає наявність великих кристалів Хлорид калію 2г >5мкм. Розмір пор фільтра (у дослідженому діаХлорводнева кислота 1Н 100мл пазоні) не впливає на утриману фільтром фракДемінералізована вода до 1000мл цію, тоді як склад середовища впливає радикаКишкове середовище при прийомі їжі на 500мл льним чином. У результаті, виділена фільтром (IFed) частка речовини складає приблизно 1% у випадГідрофосфат калію 0,029Μ 1,97г ку шлункового середовища, 2% у випадку кишкоГідроксид натрію до рН 6,8 до рН 6,8 вого середовища при голодуванні і 4,5-5,5% у Таурохолат натрію 5мМ 1,34г випадку кишкового середовища при прийомі їжі. Лецитин 1,5мМ 0,58г Дані, наведені у розташованій нижче таблиці, Хлорид калію 0,22Μ 8,2г і подальших кресленнях, показують, що всі переЗ панкреатином або без вірені композиції показують кращі властивості у 10г або 0 5г або 0 нього порівнянні зі зразком порівняння (Мігліол 812N і Демінералізована вода до 1л до 500мл PEG400), підтверджуючи здатність вибраних наКишкове середовище при голодуванні повнювачів до мимовільного емульгування в прина 500мл (IFast) сутності рідких середовищ шлунка і кишечнику. Оцтова кислота Мікроемульсії (3:1 і 4:1), міцелярний розчин, Гідроксид натрію до рН 5 до рН 5 отриманий з вітаміном Ε TPGS і емульсія, отримана з Phosal 50PG, виявляються найбільш гомоТаурохолат натрію 15мМ 4,03г генними і стабільними системами в будь-якому Лецитин 4мМ 1,55г середовищі. Нанокристали стабільні в кишковому Хлорид калію 0,19Μ 7,08г середовищі, тоді як у шлунковому середовищі 3 панкреатином або без 10г або 0 5г або 0 має місце «флокуляція», яка призводить до того, нього що вся лікарська речовина утримується фільтДемінералізована вода до 1л до 500мл ром. Емульсії, отримані на основі Labrafil/Labrasol і Gelucire 44/14, після фільтрації показували конУмови експерименту і результати центрацію лікарського засобу в межах 20-60% Всі композиції сполуки (Іс) (400мг) розбавля(Labrafil/Labrasol) і 40-90% (Gelucire 44/14). Для ють у співвідношенні 1:50 у шлунковому середовсіх нових композицій, за винятком вищі, кишковому середовищі при голодуванні і Labrafil/Labrasol, не спостерігається вплив режикишковому середовищі при прийомі їжі (20мл), му прийому їжі (рН, концентрація лецитину і жовпотім інкубують протягом 2 годин при 37°С при чних солей). механічному перемішуванні (300об/хв.). Концент 19 82539 20 Таблиця 3 Вміст сполуки (Іс), що залишилася після фільтрації крізь фільтр 2мкм, у випадку попередньої інкубації з рідкими середовищами шлунка і кишечнику (див. також Фіг.1) Наповнювачі/середовищеЛікиPEG400 Теоретична концентрація Шлункове середовище 1,9 Кишкове середовище при 8,8 прийомі їжі рН5 Кишкове середовище при 4,2 голодуванні pH 6,8 58,3 Мікроемульсія Gelucire Labrafil/ Phosal Мікроемульсія Мігліол Кремофор/КапріолКремофор/Капріол 44/14 Labrasol 50PG 3/1 4/1 200мкг/мл 182,2 84,1 0 188,0 188,3 189,3 20,5 90 123,6 2,3 177,0 187,1 194,2 14,5 118,4 39,1 0,6 175,7 198,8 195,6 In vitro поведінка композицій з рідкими середовищами шлунка і кишечнику, висновки Як загальний висновок відносно властивостей мимовільного емульгування і колоїдної стабільності отриманих композицій лікарського засобу, всі перевірені композиції виявляють поліпшення властивостей по відношенню до зразків порівняння (Мігліол 812N і PEG 400), підтверджуючи здатність вибраних наповнювачів до мимовільного емульгування в присутності рідких середовищ шлунка і кишечнику. Мікроемульсії (3:1 і 4:1), а також емульсії, отримані з Phosal 50PG, і міцелярні розчини, отримані з вітаміном Ε TPGS, є найбільш гомогенними і стабільними системами в будь-якому середовищі. Для всіх нових композицій не спостерігається впливу умов голодування/прийому їжі на колоїдну стабільність, за винятком композиції на основі Labrafil/Labrasol, для якої відфільтрована частина лікарського засобу знижується з 60% до 20% у кишковому середовищі при голодуванні. Відносно людей передбачається, що для вибору найбільш придатного денного дозування, потрібно брати до уваги вагу пацієнта, загальний стан здоров'я, вік і всі фактори, які можуть вплинути на ефективність лікування. Переважно, композиції виготовляють таким чином, щоб одинична лікарська форма містила від 0,1 до 50мг активного інгредієнта. Серед похідних азетидину загальної формули (Іа) або (Іb) особливо переважними є наступні продукти: 1-[біс(4-хлорфеніл)метил]-3-[(3,5дифторфеніл)(метилсульфоніл)метилен]азетидин; - N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}N-пірид-3-илметилсульфонамід; - N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}N-(3,5-дифторфеніл)метилсульфонамід. Мається на увазі, що композиції за даним винаходом, які містять вказані сполуки, є особливо переважними. З іншого боку, у випадку введення другого активного інгредієнта, композиція може містити від 0,2 до 50мг, у випадку, якщо суп утнім інгредієнтом є сибутрамін. Однак ця кількість, необов'язково, може бути нижчою і може змінюватися від 0,2 до 10мг. У випадку, якщо супутнім інгредієнтом є Lдопа, композиція може містити від 100 до 300мг цього другого активного компонента, переважно, 250мг. Стабілізуючими агентами можуть бути, наприклад, антиоксиданти, вибрані, зокрема, з aтокоферолу, аскорбіл пальмітату, ВНТ (бутилгідрокситолуолу), ВНА (бутилгідроксіанізолу), пропілгалату або, наприклад, яблучної кислоти; Консерванти можуть бути вибрані, як приклад, з метабісульфіту натрію, пропіленгліколю, етанолу або гліцерину; Серед агентів, здатних регулювати в'язкість, можуть бути згадані, наприклад, лецитини, фосфоліпіди, пропіленгліколь альгінат, альгінат натрію або гліцерин; Агентами, здатними змінити органолептичні властивості композиції, як приклад, є яблучна кислота, фумарова кислота, гліцерин, ванілін або ментол. У випадку застосування подібних домішок, їх вміст може складати від 0,001% до 5% за масою від загальної маси композиції. Відповідно до даного винаходу, фармацевтична композиція може бути отримана, якщо це прийнятно, змішуванням основних наповнювачів (після нагрівання, якщо це необхідно у випадку твердих або напівтвердих наповнювачів), і потім, якщо це необхідно, змішуванням з додатковими домішками, з подальшим додаванням похідного азетидину загальної формули (Іа) або (Іb) і, якщо це передбачено, активного інгредієнта, здатного посилити вплив похідного азетидину загальної формули (Іа) або (Іb), причому для отримання гомогенної суміші здійснюється перемішування. Застосування цього способу більш детально описане нижче в прикладах. Композиції за даним винаходом можуть мати рідкий, твердий або мазеподібний стан. Зокрема, вони зручні для відтворення у формі твердих желатинових капсул або м'яких желатинових капсул або ж у формі перорального розчину. Композиції за даним винаходом особливо вигідні завдяки їх хорошій стабільності, як фізичній, так і хімічній, а також поліпшенню біодоступності, яке досягається при пероральному введенні похідних азетидину загальної формули (Іа) або (Іb). Відповідно до іншого варіанту за даним винаходом, визначені вище переважні композиції, що містять, принаймні, один активний інгредієнт загальної формули (Іа) або (Ib), можуть вводитися 21 82539 22 до, одночасно з або після введення активного ного азетидину загальної формули (Іа) або (Іb). інгредієнта, здатного посилити вплив похідного Також мається на увазі, що набори можуть містиазетидину загальної формули (Іа) або (Іb). ти композицію, здатну посилити дії похідних азеМається на увазі, що в галузі дії даного винатидину загальної формули (Іа) або (Іb), композиходу попадає набір, що включає, з одного боку, ції, які містять сибутрамін, або композиції, які композицію за даним винаходом, як визначено містять агент, що активує допамінергічну нейротвище, і з іншого боку, композицію, яка містить рансмісію в мозку. активний інгредієнт, здатний посилити дію похід 23 82539 24 25 82539 26 27 Комп’ютерна в ерстка О. Гапоненко 82539 Підписне 28 Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюEmulsifying system containing azetidine derivative n-{1-[bis(4-chlorophenyl)methyl]azetidine-3-yl}-n-(3,5-difluorophenyl)methylsulphonamide
Автори англійськоюCote Sophie, Peracchia Maria-Teresa, Bobineau Valerie
Назва патенту російськоюСтабильная фармацевтическая композиция, которая содержит производное азетидина n-{1-[бис( 4-хлорфенил)метил]азетидин-3-ил}-n-(3,5-дифторфенил)метилсульфонамид
Автори російськоюКоте Софи, Пераккия Мария-Тереза, Бобино Валери
МПК / Мітки
МПК: A61K 47/44, A61K 31/397, A61P 25/00
Мітки: n-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-n-(3,5-дифторфеніл)метилсульфонамід, композиція, азетидину, містить, стабільна, фармацевтична, похідне
Код посилання
<a href="https://ua.patents.su/14-82539-stabilna-farmacevtichna-kompoziciya-shho-mistit-pokhidne-azetidinu-n-1-bis4-khlorfenilmetilazetidin-3-il-n-35-diftorfenilmetilsulfonamid.html" target="_blank" rel="follow" title="База патентів України">Стабільна фармацевтична композиція, що містить похідне азетидину n-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-n-(3,5-дифторфеніл)метилсульфонамід</a>
Попередній патент: Спосіб вимірювання стійкості електронного пристрою
Наступний патент: Солі мелдонію, спосіб їх одержання і фармацевтична композиція (варіанти) на їх основі
Випадковий патент: Сировинна суміш для виготовлення жаростійкого бетону