Фармацевтична композиція, що містить похідні азетидину, похідні азетидину і їх одержання
Номер патенту: 73554
Опубліковано: 15.08.2005
Автори: Міерс Мішель, Боушард Херве, Філош Бруно, Ашард Даніель, Букерель Жан, Грізоні Серж, Хіттінгер Огюстін
Формула / Реферат
1. Фармацевтична композиція, що містить як активне начало щонайменше одну сполуку формули:
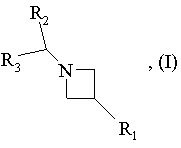
в якій
R1 означає радикал -N(R4)R5, -N(R4)-CO-R5, -N(R4)-SO2R6,
R2 та R3, однакові або різні, означають або ароматичний радикал, вибраний з фенілу, нафтилу та інденілу, що можуть бути незаміщеними або заміщеними одним або декількома з наступних замісників: галоген, алкіл, алкокси, форміл, гідрокси, трифторметил, трифторметокси, -CO-alk, ціано, -СООН, -COOalk, -CONR7R8, -CO-NH-NR9R10, алкілсульфаніл, алкілсульфініл, алкілсульфоніл, алкілсульфанілалкіл, алкілсульфінілалкіл, алкілсульфонілалкіл, гідроксіалкіл або -alk-NR7R8; або гетероароматичний радикал, вибраний з наступних циклів: бензофурил, бензотіазоліл, бензотієніл, бензоксазоліл, хроманіл, 2,3-дигідробензофурил, 2,3-дигідробензотієніл, фурил, імідазоліл, ізохроманіл, ізохіноліл, піроліл, піридил, піримідил, хіноліл, 1,2,3,4-тетрагідроізохіноліл, тіазоліл та тієніл, що можуть бути незаміщеними або заміщеними галогеном, алкілом, алкокси, гідрокси, трифторметилом, трифторметокси, ціано, -СООН, -COOalk, -CO-NH-NR9R10, -CONR7R8, -alk-NR9R10, алкілсульфанілом, алкілсульфінілом, алкілсульфонілом, алкілсульфанілалкілом, алкілсульфінілалкілом, алкілсульфонілалкілом або гідроксіалкілом;
R4 означає радикал -C(R11)(R12)-Het, Het, -C(R11)(R12)-Ar, Аr, циклоалкіл або норборніл;
R5 означає атом водню або радикал гідроксіалкіл, -alk-COOalk, -alk-CONR7R8, -alk-NR7R8, алкокси, Аr, Het, -CH2Ar, -CH2Het або алкіл, можливо заміщений одним або декількома галогенами;
R6 означає радикал гідроксіалкіл, -alk-COOalk, -alk-CONR7R8, -alk-NR7R8, алкокси, Аr, Het, -CH2Ar, -CH2Het або алкіл, можливо заміщений одним або декількома галогенами;
R7 та R8, однакові або різні, означають атом водню або алкіл, або ж R7 та R8, разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та може містити другий гетероатом, вибраний з кисню, сірки та азоту, та бути заміщеним одним або декількома алкілами;
R9 та R10, однакові або різні, означають атом водню або радикал алкіл, -COOalk, циклоалкіл, алкілциклоалкіл, -alk-O-alk або гідроксіалкіл, або ж R9 та R10, разом з атомом азоту, з яким вони з'єднані, утворюють насичений або ненасичений моно- чи біциклічний гетероцикл, що має від 3 до 10 ланок та може містити другий гетероатом, вибраний з кисню, сірки та азоту, та бути заміщеним одним або декількома з наступних радикалів: алкіл, -COalk, -COOalk, -CO-NHalk, -CS-NHalk, оксо, гідроксіалкіл, -alk-O-alk або -CO-NH2;
R11 означає атом водню або радикал гідроксіалкіл, -alk-COOalk, -alk-CONR7R8, -alk-NR7R8, алкоксіалкіл, Аr, Het, -CH2Ar, -CH2Het або алкіл, можливо заміщений одним або декількома галогенами;
R12 означає атом водню або радикал гідроксіалкіл, alk-COOalk, alk-CONR7R8, -alk-NR7R8, алкоксіалкіл або алкіл, можливо заміщений одним або декількома галогенами;
або ж R11 та R12, разом з атомом вуглецю, з яким вони з'єднані, утворюють насичений моно- або біциклічний цикл, що має від 3 до 10 ланок та може містити другий гетероатом, вибраний з кисню, сірки та азоту, та бути заміщеним одним або декількома алкілами;
Аr означає феніл, нафтил або інденіл, що можуть бути заміщені одним або декількома з наступних замісників: галоген, алкіл, алкокси, -CO-alk, ціано, -СООН, -COOalk, -CONR13R14, -CO-NH-NR15R16, алкілсульфаніл, алкілсульфініл, алкілсульфоніл, alk-NR15R16, -NR15R16, алкілтіоалкіл, форміл, CF3, OCF3, Het, -O-alk-NH-циклоалкіл, -SO2NH2, гідрокси, гідроксіалкіл, -NH-CO-alk, -NH-COOalk або, за двома суміжними атомами вуглецю, діоксиметиленом;
Het означає ненасичений або насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та містить один або декілька гетероатомів, вибраних з кисню, сірки та азоту, та який може бути заміщений одним або декількома з наступних радикалів: алкіл, алкокси, галоген, алкоксикарбоніл, оксо, гідрокси, причому азотовмісні гетероцикли можуть бути у формі N-оксидів,
R13 та R14 однакові або різні, означають атом водню або алкіл, або ж R13 та R14, разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та може містити другий гетероатом, вибраний з кисню, сірки та азоту, та бути заміщеним одним або декількома алкілами;
R15 та R16, однакові або різні, означають атом водню або алкіл, або ж R15 та R16, разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та може містити другий гетероатом, вибраний з кисню, сірки та азоту, та бути заміщеним одним або декількома алкільними радикалами;
аlk означає алкіл або алкілен,
причому алкільні або алкіленові радикали та частини молекул або алкоксильні радикали та частини молекул мають прямий або розгалужений ланцюг та містять від 1 до 6 атомів вуглецю, а циклоалкільні радикали містять від 3 до 10 атомів вуглецю;
оптичні ізомери цієї сполуки та її фармацевтичнo прийнятні солі з мінеральними або органічними кислотами.
2. Фармацевтична композиція за п. 1, для якої у формулі І Het вибирають з бензимідазолу, бензоксазолу, бензотіазолу, бензотіофену, циноліну, тіофену, хіназоліну, хіноксаліну, хіноліну, піразолу, піролу, піридину, імідазолу, індолу, ізохіноліну, піримідину, тіазолу, тіадіазолу, піперидину, піперазину, триазолу, фурану, тетрагідроізохіноліну та тетрагідрохіноліну, що можуть бути заміщені одним або декількома з наступних замісників: алкіл, алкокси, галоген, алкоксикарбоніл, оксо, гідрокси, ОСF3 або СF3.
3. Фармацевтична композиція за п. 1, для якої в сполуці формули І
R1 означає радикал -N(R4)R5, -N(R4)-SO2R6,
R2 означає або феніл, не заміщений або заміщений одним або декількома з наступних замісників: галоген, алкіл, алкокси, трифторметил, трифторметокси, -CO-alk, ціано, -CONR7R8, гідроксіалкіл або -alk-NR7R8, або гетероароматичний радикал, вибраний з піридилу, піримідилу, тіазолілу та тієнілу, що можуть бути не заміщеними або заміщеними галогеном, алкілом, алкокси, гідрокси, трифторметилом, трифторметокси, -CONR7R8, -alk-NR9R10, алкілсульфанілом, алкілсульфінілом, алкілсульфонілом або гідроксіалкілом;
R3 означає або феніл, не заміщений або заміщений одним або декількома з наступних замісників: галоген, алкіл, алкокси, трифторметил, трифторметокси, -CO-alk, ціано, -CONR7R8, гідроксіалкіл або -alk-NR7R8, або гетероароматичний радикал, вибраний з піридилу, піримідилу, тіазолілу та тієнілу, що можуть бути не заміщеними або заміщеними галогеном, алкілом, алкокси, гідрокси, трифторметилом, трифторметокси, -CONR7R8, -alk-NR9R10, алкілсульфанілом, алкілсульфінілом, алкілсульфонілом або гідроксіалкілом;
R4 означає радикал -C(R11)(R12)-Het, Het, -C(R11)(R12)-Ar, Аr або норборніл;
R5 означає атом водню або радикал гідроксіалкіл, -alk-COOalk, -alk-CONR7R8, -alk-NR7R8, алкокси, -CH2Ar, -СН2Неt або алкіл;
R6 означає радикал гідроксіалкіл, -alk-COOalk, -alk-CONR7R8, -alk-NR7R8, алкокси, -CH2Ar, -CH2Het або алкіл;
R7 та R8, однакові або різні, означають атом водню або алкіл, або ж R7 та R8, разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та може містити другий гетероатом, вибраний з кисню, сірки та азоту, та бути заміщеним одним або декількома алкілами;
R9 та R10, однакові або різні, означають атом водню або радикал алкіл, -COalk, циклоалкіл, алкілциклоалкіл, -alk-O-alk або гідроксіалкіл, або ж R9 та R10, разом з атомом азоту, з яким вони з'єднані, утворюють насичений або ненасичений моно- чи біциклічний гетероцикл, що має від 3 до 10 ланок та може містити другий гетероатом, вибраний з кисню, сірки та азоту, та бути заміщеним одним або декількома з наступних радикалів: алкіл, -COalk, -COOalk, -CO-NHalk, оксо, гідроксіалкіл або -CO-NH2;
R11 означає атом водню або радикал гідроксіалкіл, alk-COOalk, alk-CONR7R8, -alk-NR7R8, алкоксіалкіл, Аr, Het, -CH2Ar, -CH2Het або алкіл, можливо заміщений одним або декількома галогенами;
R12 означає атом водню або радикал гідроксіалкіл, alk-COOalk, alk-CONR7R8, -alk-NR7R8, алкоксіалкіл або алкіл, можливо заміщений одним або декількома галогенами;
або ж R11 та R12, разом з атомом вуглецю, з яким вони з'єднані, утворюють насичений моно- або біциклічний цикл, що має від 3 до 10 ланок, який може містити другий гетероатом, вибраний з кисню, сірки та азоту, та бути заміщеним одним або декількома алкілами;
Аr означає феніл або нафтил, що можуть бути заміщені одним або декількома з наступних замісників: галоген, алкіл, алкокси, -CO-alk, ціано, -CONR13R14, алкілсульфоніл, -alk-NR15R16, -NR15R16, CF3, OCF3, SO2NH2, гідрокси, гідроксіалкіл або, за двома суміжними атомами вуглецю, діоксиметиленом;
Het означає гетероцикл, вибраний з бензимідазолу, бензоксазолу, бензотіазолу, бензотіофену, тіофену, хіназоліну, хіноксаліну, хіноліну, піролу, піридину, імідазолу, індолу, ізохіноліну, піримідину, тіазолу, тіадіазолу, фурану, тетрагідроізохіноліну та тетрагідрохіноліну, що можуть бути заміщені одним або декількома з наступних замісників: алкіл, алкокси, галоген, алкоксикарбоніл, оксо, гідрокси, OCF3 або CF3.
R13 та R14, однакові або різні, означають атом водню або алкіл, або ж R13 та R14, разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та може містити другий гетероатом, вибраний з кисню, сірки та азоту, та бути заміщеним одним або декількома алкілами;
R15 та R16, однакові або різні, означають атом водню або алкіл, або ж R15 та R16, разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та який може містити другий гетероатом, вибраний з кисню, сірки та азоту, та бути заміщеним одним або декількома алкілами;
оптичні ізомери цієї сполуки та її фармацевтичнo прийнятні солі з мінеральними або органічними кислотами.
4. Фармацевтична композиція за п. 1, для якої в сполуці формули І
R1 означає радикал -N(R4)-SO2R6,
R2 означає або феніл, не заміщений або заміщений одним або декількома з наступних замісників: галоген, алкіл, алкокси, трифторметил, трифторметокси, ціано, -CONR7R8, гідроксіалкіл або -alk-NR7R8, або гетероароматичний радикал, вибраний з піридилу, піримідилу, тіазолілу та тієнілу, що можуть бути не заміщеними або заміщеними галогеном, алкілом, алкокси, гідрокси, трифторметилом, трифторметокси, -CONR7R8 або гідроксіалкілом;
R3 означає або феніл, не заміщений або заміщений одним або декількома з наступних замісників: галоген, алкіл, алкокси, трифторметил, трифторметокси, ціано, -CONR7R8, гідроксіалкіл або -alk-NR7R8, або гетероароматичний радикал, вибраний з піридилу, піримідилу, тіазолілу та тієнілу, що можуть бути не заміщеними або заміщеними галогеном, алкілом, алкокси, гідрокси, трифторметилом, трифторметокси, -CONR7R8 або гідроксіалкілом;
R4 означає радикал -Het або Аr;
R6 означає гідроксіалкіл або алкіл;
R7 та R8, однакові або різні, означають атом водню або алкіл, або ж R7 та R8, разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок, що може містити другий гетероатом, вибраний з кисню, сірки й азоту, та бути заміщеним одним або декількома алкілами;
Аr означає феніл або нафтил, що можуть бути заміщені одним або декількома з наступних замісників: галоген, алкіл, алкокси, -CO-alk, ціано, -CONR13R14, -alk-NR15R16, -NR15R16, CF3, OCF3, -SO2NH2, гідрокси або гідроксіалкіл;
Het означає гетероцикл, вибраний з бензимідазолу, бензоксазолу, бензотіазолу, бензотіофену, тіофену, хіназоліну, хіноксаліну, хіноліну, піролу, піридину, імідазолу, індолу, ізохіноліну, тіазолу, тіадіазолу, фурану, тетрагідроізохіноліну та тетрагідрохіноліну, що можуть бути заміщені одним або декількома з наступних замісників: алкіл, алкокси, галоген, алкоксикарбоніл, оксо, гідрокси, ОСF3 або СF3;
R13 та R14, однакові або різні, означають атом водню або алкіл, або ж R13 та R14, разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок, що може містити другий гетероатом, вибраний з кисню, сірки й азоту, та бути заміщеним одним або декількома алкілами;
R15 та R16 однакові або різні, означають атом водню або алкіл, або ж R15 та R16, разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок, що може містити другий гетероатом, вибраний з кисню, сірки й азоту, та бути заміщеним одним або декількома алкілами;
оптичні ізомери цієї сполуки та її фармацевтичнo прийнятні солі з мінеральними або органічними кислотами.
5. Композиція за п. 1, для якої сполуку формули І вибирають з наступних сполук:
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(6-хлорпірид-2-ил)метилсульфонамід,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(6-етилпірид-2-ил)метилсульфонамід,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-хінол-6-ілметансульфонамід,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-хінол-5-ілметилсульфонамід,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-ізохінол-5-ілметилсульфонамід,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-пірид-3-ил-метилсульфонамід,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(1-оксидпірид-3-ил)метилсульфонамід,
N-(1R,2S,4S)-біцикло[2.2.1]гепт-2-ил-N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}метилсульфонамід,
N-(1R,2R,4S)-біцикло[2.2.1]гепт-2-ил-N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}метилсульфонамід,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(тіазол-2-іл)метилсульфонамід,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3-метоксифеніл)метилсульфонамід,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3-гідроксифеніл)метилсульфонамід,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3-гідроксиметилфеніл)метилсульфонамід,
етиловий ефір N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(метилсульфоніл)-3-амінобензойної кислоти,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(1-ізобутилпіперид-4-ил)метилсульфонамід,
N-бензил-N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}амін,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3,5-дифторбензил)амін,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3,5-дифторбензил)метилсульфонамід,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(пірид-3-илметил)метилсульфонамід,
N-{1-[біс(4-фторфеніл)метил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід,
(RS)-N-{1-[(4-хлорфеніл)пірид-3-илметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід,
(R)-N-{1-[(4-хлорфеніл)пірид-3-илметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід,
(S)-N-{1-[(4-хлорфеніл)-пірид-3-илметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід,
(RS)-N-{1-[(4-хлорфеніл)пірид-4-илметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід,
(R)-N-{1-[(4-хлорфеніл)пірид-4-илметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід,
(S)-N-{1-[(4-хлорфеніл)пірид-4-илметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід,
(RS)-N-{1-[(4-хлорфеніл)піримідин-5-ілметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід,
(R)-N-{1-[(4-хлорфеніл)піримідин-5-ілметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід,
(S)-N-{1-[(4-хлорфеніл)піримідин-5-ілметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3,5-дифторфеніл)бензилсульфонамід.
6. Сполука формули:

в якій
R1 означає радикал -N(R4)R5, -N(R4)-CO-R5, -N(R4)-SO2R6,
R2 та R3, однакові або різні, означають або ароматичний радикал, вибраний з фенілу, нафтилу та інденілу, що можуть бути не заміщеними або заміщеними одним або декількома з наступних замісників: галоген, алкіл, алкокси, форміл, гідрокси, трифторметил, трифторметокси, -CO-alk, ціано, -СООН, -COOalk, -CONR7R8, -CO-NH-NR9R10, алкілсульфаніл, алкілсульфініл, алкілсульфоніл, алкілсульфанілалкіл, алкілсульфінілалкіл, алкілсульфонілалкіл, гідроксіалкіл або -alk-NR7R8; або гетероароматичний радикал, вибраний з бензофурилу, бензотіазолілу, бензотієнілу, бензоксазолілу, хроманілу, 2,3-дигідробензофурилу, 2,3-дигідробензотієнілу, фурилу, імідазолілу, ізохроманілу, ізохінолілу, піролілу, піридилу, піримідилу, хінолілу, 1,2,3,4-тетрагідроізохінолілу, тіазолілу та тієнілу, що можуть бути не заміщеними або заміщеними галогеном, алкілом, алкокси, гідрокси, трифторметилом, трифторметокси, ціано, -СООН, -COOalk, -CO-NH-NR9R10, -CONR7R8, -alk-NR9R10, алкілсульфанілом, алкілсульфінілом, алкілсульфонілом, алкілсульфанілалкілом, алкілсульфінілалкілом, алкілсульфонілалкілом або гідроксіалкілом;
R4 означає радикал -C(R11)(R12)-Het, Het, -C(R11)(R12)-Ar, Аr, циклоалкіл або норборніл;
R5 означає атом водню або радикал гідроксіалкіл, -alk-COOalk, -alk-CONR7R8, -alk-NR7R8, алкокси, Аr, Het, -CH2Ar, -CH2Het або алкіл, можливо заміщений одним або декількома галогенами;
R6 означає радикал гідроксіалкіл, -alk-COOalk, -alk-CONR7R8, -alk-NR7R8, алкокси, Аr, Het, -CH2Ar, -CH2Het або алкіл, можливо заміщений одним або декількома галогенами;
R7 та R8, однакові або різні, означають атом водню або алкіл, або ж R7 та R8, разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та може містити другий гетероатом, вибраний з кисню, сірки та азоту, та бути заміщеним одним або декількома алкілами;
R9 та R10, однакові або різні, означають атом водню або радикал алкіл, -COOalk, циклоалкіл, алкілциклоалкіл, -alk-O-alk або гідроксіалкіл, або ж R9 та R10, разом з атомом азоту, з яким вони з'єднані, утворюють насичений або ненасичений моно- чи біциклічний гетероцикл, що має від 3 до 10 ланок та може містити другий гетероатом, вибраний з кисню, сірки та азоту, та бути заміщеним одним або декількома з наступних радикалів: алкіл, -COalk, -COOalk, -CO-NHalk, -CS-NHalk, оксо, гідроксіалкіл, -alk-O-alk або -CO-NH2;
R11 означає атом водню або радикал гідроксіалкіл, -alk-COOalk, -alk-CONR7R8, -alk-NR7R8, алкоксіалкіл, Аr, Het, -CH2Ar, -CH2Het або алкіл, можливо заміщений одним або декількома галогенами;
R12 означає атом водню або радикал гідроксіалкіл, -alk-COOalk, -alk-CONR7R8, -alk-NR7R8, алкоксіалкіл або алкіл, можливо заміщений одним або декількома галогенами;
або ж R11 та R12, разом з атомом вуглецю, з яким вони з'єднані, утворюють насичений моно- або біциклічний цикл, що має від 3 до 10 ланок та може містити другий гетероатом, вибраний з кисню, сірки та азоту, та бути заміщеним одним або декількома алкілами;
Аr означає радикал феніл, нафтил або інденіл, що можуть бути заміщені одним або декількома з наступних замісників: галоген, алкіл, алкокси, -CO-alk, ціано, -СООН, -COOalk, -CONR13R14, -CO-NH-NR15R16, алкілсульфаніл, алкілсульфініл, алкілсульфоніл, -alk-NR15R16, -NR15R16, алкілтіоалкіл, форміл, CF3, OCF3, Het, -O-alk-NH-циклоалкіл, -SO2NH2, гідрокси, гідроксіалкіл, -NH-CO-alk, -NH-COOalk або, за двома суміжними атомами вуглецю, діоксиметиленом;
Het означає ненасичений або насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та містить один або декілька гетероатомів, вибраних з кисню, сірки та азоту, та який може бути заміщений одним або декількома з наступних радикалів: алкіл, алкокси, галоген, алкоксикарбоніл, оксо, гідрокси, причому азотовмісні гетероцикли можуть бути у формі N-оксидів;
R13 та R14, однакові або різні, означають атом водню або алкіл, або ж R13 та R14, разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та може містити другий гетероатом, вибраний з кисню, сірки та азоту, та бути заміщеним одним або декількома алкілами;
R15 та R16, однакові або різні, означають атом водню або алкіл, або ж R15 та R16, разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та може містити другий гетероатом, вибраний з кисню, сірки та азоту, та бути заміщеним одним або декількома алкільними радикалами;
alk означає алкіл або алкілен,
причому алкільні або алкіленові радикали та частини молекул або алкоксильні радикали та частини молекул мають прямий або розгалужений ланцюг та містять від 1 до 6 атомів вуглецю, а циклоалкільні радикали містять від 3 до 10 атомів вуглецю;
оптичні ізомери цих сполук та їх фармацевтичнo прийнятні солі з мінеральними або органічними кислотами,
за винятком сполуки, в якій R2 та R3 означають феніл, R1 означає радикал -N(R4)SO2R6, де R4 означає феніл, a R6 означає метил.
7. Сполука формули І за п. 6, в якій
Het вибирають з бензимідазолу, бензоксазолу, бензотіазолу, бензотіофену, циноліну, тіофену, хіназоліну, хіноксаліну, хіноліну, піразолу, піролу, піридину, імідазолу, індолу, ізохіноліну, піримідину, тіазолу, тіадіазолу, піперидину, піперазину, триазолу, фурану, тетрагідроізохіноліну та тетрагідрохіноліну, що можуть бути заміщені одним або декількома з наступних замісників: алкіл, алкокси, галоген, алкоксикарбоніл, оксо, гідрокси, OCF3 або СF3.
8. Сполука формули І за п. 6, в якій
R1 означає радикал -N(R4)R5, -N(R4)-SO2R6,
R2 означає або феніл, не заміщений або заміщений одним або декількома з наступних замісників: галоген, алкіл, алкокси, трифторметил, трифторметокси, -CO-alk, ціано, -CONR7R8, гідроксіалкіл або -alk-NR7R8, або гетероароматичний радикал, вибраний з піридилу, піримідилу, тіазолілу та тієнілу, що можуть бути не заміщеними або заміщеними галогеном, алкілом, алкокси, гідрокси, трифторметилом, трифторметокси, -CONR7R8, -alk-NR9R10 алкілсульфанілом, алкілсульфінілом, алкілсульфонілом або гідроксіалкілом;
R3 означає або феніл, не заміщений або заміщений одним або декількома з наступних замісників: галоген, алкіл, алкокси, трифторметил, трифторметокси, -CO-alk, ціано, -CONR7R8, гідроксіалкіл або -alk-NR7R8, або гетероароматичний радикал, вибраний з піридилу, піримідилу, тіазолілу та тієнілу, що можуть бути не заміщеними або заміщеними галогеном, алкілом, алкокси, гідрокси, трифторметилом, трифторметокси, -CONR7R8, alk-NR9R10, алкілсульфанілом, алкілсульфінілом, алкілсульфонілом або гідроксіалкілом;
R4 означає радикал -C(R11)(R12)-Het, Het, -C(R11)(R12)-Ar, Аr або норборніл;
R5 означає атом водню або радикал гідроксіалкіл, -alk-COOalk, -alk-CONR7R8, -alk-NR7R8, алкокси, -CH2Ar, -CH2Het або алкіл;
R6 означає радикал гідроксіалкіл, -alk-COOalk, -alk-CONR7R8, -alk-NR7R8, алкокси, -CH2Ar, -CH2Het або алкіл;
R7 та R8, однакові або різні, означають атом водню або алкіл, або ж R7 та R8, разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та може містити другий гетероатом, вибраний з кисню, сірки й азоту, та бути заміщеним одним або декількома алкілами;
R9 та R10, однакові або різні, означають атом водню або радикал алкіл, циклоалкіл, алкілциклоалкіл, -alk-O-alk або гідроксіалкіл, або ж R9 та R10, разом з атомом азоту, з яким вони з'єднані, утворюють насичений або ненасичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та може містити другий гетероатом, вибраний з кисню, сірки й азоту, та бути заміщеним одним або декількома з наступних радикалів: алкіл, -COalk, -COOalk, -CO-NHalk, оксо, гідроксіалкіл або -CO-NH2;
R11 означає атом водню або радикал гідроксіалкіл, alk-COOalk, alk-CONR7R8, -alk-NR7R8, алкоксіалкіл, Аr, Het, -CH2Ar, -CH2Het або алкіл, можливо заміщений одним або декількома галогенами;
R12 означає атом водню або радикал гідроксіалкіл, -alk-COOalk, -alk-CONR7R8, -alk-NR7R8, алкоксіалкіл або алкіл, можливо заміщений одним або декількома галогенами;
або ж R11 та R12, разом з атомом вуглецю, з яким вони з'єднані, утворюють насичений моно- або біциклічний цикл, що має від 3 до 10 ланок та може містити другий гетероатом, вибраний з кисню, сірки й азоту, та бути заміщеним одним або декількома алкілами;
Аr означає феніл або нафтил, що можуть бути заміщені одним або декількома з наступних замісників: галоген, алкіл, алкокси, -CO-alk, ціано, -CONR13R14, алкіл сульфоніл, -alk-NR15R16, -NR15R16, CF3, OCF3, -SO2NH2, гідрокси, гідроксіалкіл або, за двома суміжними атомами вуглецю, діоксиметиленом;
Het означає гетероцикл, вибраний з бензимідазолу, бензоксазолу, бензотіазолу, бензотіофену, тіофену, хіназоліну, хіноксаліну, хіноліну, піролу, піридину, імідазолу, індолу, ізохіноліну, піримідину, тіазолу, тіадіазолу, фурану, тетрагідроізохіноліну та тетрагідрохіноліну, що можуть бути заміщені одним або декількома з наступних замісників: алкіл, алкокси, галоген, алкоксикарбоніл, оксо, гідрокси, OCF3 або СF3;
R13 та R14, однакові або різні, означають атом водню або алкіл, або ж R13 та R14, разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та може містити другий гетероатом, вибраний з кисню, сірки й азоту, та бути заміщеним одним або декількома алкілами,
R15 та R16, однакові або різні, означають атом водню або алкіл, або ж R15 та R16, разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та може містити другий гетероатом, вибраний з кисню, сірки й азоту, та бути заміщеним одним або декількома алкілами;
оптичні ізомери цих сполук та їх фармацевтичнo прийнятні солі з мінеральними або органічними кислотами,
за винятком сполуки, в якій R2 та R3 є фенільними радикалами, R1 є радикалом -N(R4)SO2R6, де R4 означає феніл та R6 означає метил.
9. Сполуки формули І за п. 6, в яких
R1 означає радикал -N(R4)-SO2R6,
R2 означає або феніл, не заміщений або заміщений одним або декількома з наступних замісників: галоген, алкіл, алкокси, трифторметил, трифторметокси, ціано, -CONR7R8, гідроксіалкіл або -alk-NR7R8, або гетероароматичний радикал, вибраний з піридилу, піримідилу, тіазолілу та тієнілу, що можуть бути не заміщеними або заміщеними галогеном, алкілом, алкокси, гідрокси, трифторметилом, трифторметокси, -CONR7R8 або гідроксіалкілом;
R3 означає або феніл, не заміщений або заміщений одним або декількома з наступних замісників: галоген, алкіл, алкокси, трифторметил, трифторметокси, ціано, -CONR7R8, гідроксіалкіл або -alk-NR7R8, або гетероароматичний радикал, вибраний з піридилу, піримідилу, тіазолілу та тієнілу, що можуть бути не заміщеними або заміщеними галогеном, алкілом, алкокси, гідрокси, трифторметилом, трифторметокси, -CONR7R8 або гідроксіалкілом;
R4 означає -Het або Аr;
R6 означає гідроксіалкіл або алкіл;
R7 та R8, однакові або різні, означають атом водню або алкіл, або ж R7 та R8, разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та може містити другий гетероатом, вибраний з кисню, сірки й азоту, та бути заміщеним одним або декількома алкілами;
Аr означає феніл або нафтил, що можуть бути заміщені одним або декількома з наступних замісників: галоген, алкіл, алкокси, -CO-alk, ціано, -CONR13R14, -alk-NR15R16, -NR15R16, CF3, OCF3, -SO2NH2, гідрокси або гідроксіалкіл;
Het означає гетероцикл, вибраний з бензимідазолу, бензоксазолу, бензотіазолу, бензотіофену, тіофену, хіназоліну, хіноксаліну, хіноліну, піролу, піридину, імідазолу, індолу, ізохіноліну, тіазолу, тіадіазолу, фурану, тетрагідроізохіноліну та тетрагідрохіноліну, що можуть бути заміщені одним або декількома з наступних замісників: алкіл, алкокси, галоген, алкоксикарбоніл, оксо, гідрокси, ОСF3 або СF3;
R13 та R14, однакові або різні, означають атом водню або алкіл, або ж R13 та R14, разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та може містити другий гетероатом, вибраний з кисню, сірки й азоту, та бути заміщеним одним або декількома алкілами;
R15 та R16, однакові або різні, означають атом водню або алкіл, або ж R15 та R16, разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та може містити другий гетероатом, вибраний з кисню, сірки й азоту, та бути заміщеним одним або декількома алкілами;
оптичні ізомери цих сполук та їх фармацевтичнo прийнятні солі з мінеральними або органічними кислотами,
за винятком сполуки, в якій R2 та R3 є фенільними радикалами, R1 є радикалом -N(R4)SO2R6, де R4 означає феніл та R6 означає метил.
10. Сполука формули І за п. 6, вибрана з наступних сполук:
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(6-хлорпірид-2-ил)метилсульфонамід,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(6-етилпірид-2-ил)метилсульфонамід,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-хінол-6-ілметилсульфонамід,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-хінол-5-ілметилсульфонамід,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-ізохінол-5-ілметилсульфонамід,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-пірид-3-ил-метилсульфонамід,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(1-оксидпірид-3-ил)метилсульфонамід,
N-(1R,2S,4S)-біцикло[2.2.1]гепт-2-ил-N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}метилсульфонамід,
N-(1R,2R,4S)-біцикло[2.2.1]гепт-2-ил-N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}метилсульфонамід,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(тіазол-2-іл)метилсульфонамід,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3-метоксифеніл)метилсульфонамід,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3-гідроксифеніл)метилсульфонамід,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3-гідроксиметилфеніл)метилсульфонамід,
етиловий ефір N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(метилсульфоніл)-3-амінобензойної кислоти,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(1-ізобутилпіперид-4-ил)метилсульфонамід,
N-бензил-N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}амін,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3,5-дифторбензил)амін,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3,5-дифторбензил)метилсульфонамід,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(пірид-3-илметил)метилсульфонамід,
N-{1-[біс(4-фторфеніл)метил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід,
(RS)-N-{1-[(4-хлорфеніл)пірид-3-илметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід,
(R)-N-{1-[(4-хлорфеніл)пірид-3-илметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід,
(S)-{1-[(4-xлopфeнiл)]пipид-3-илмeтилaзeтидин-3-iл}-N-(3,5-дифторфеніл)метилсульфонамід,
(RS)-N-{1-[(4-хлорфеніл)пірид-4-илметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід,
(R)-N-{1-[(4-хлорфеніл)пірид-4-илметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід,
(S)-N-{1-[(4-хлорфеніл)пірид-4-илметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід,
(RS)-N-{1-[(4-хлорфеніл)піримідин-5-ілметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід,
(R)-N-{1-[(4-хлорфеніл)піримідин-5-ілметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід,
(S)-N-{1-[(4-хлорфеніл)піримідин-5-ілметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід,
N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3,5-дифторфеніл)бензилсульфонамід,
оптичні ізомери цих сполук та їх фармацевтичнo прийнятні солі з мінеральними або органічними кислотами.
11. N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід, його оптичні ізомери та фармацевтичнo прийнятні солі з мінеральними або органічними кислотами.
12. Спосіб одержання сполук формули І за п. 6, в яких R1 є радикалом -N(R4)R5, в якому R5 означає атом водню, R4 означає радикал -CR11R12-Ar або -CR11R12-Het, та R12 означає атом водню, який відрізняється тим, що
похідне Rb-COR11, в якому R11 мають ті ж значення, як у п. 6, вводять у взаємодію з похідним формули:
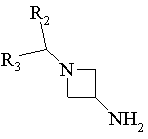 ,
,
Rb означає радикал Аr або Het, R2, R3, R11, Аr та Het мають ті ж значення, як у п. 6, виділяють продукт та, при необхідності, перетворюють його у фармацевтичнo прийнятну сіль.
13. Спосіб одержання сполук формули І за п. 6, в яких R1 є радикалом -N(R4)-CO-R5, в якому R4 означає радикал -C(R11)(R12)-Het або -C(R11)(R12)-Ar та R12 означає атом водню, який відрізняється тим, що
похідне Hal-COR5 вводять у взаємодію з похідним формули:
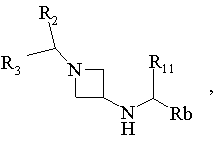
Hal означає атом галогену, Rb означає Аr або Het, R2, R3, R5, R11, Аr та Het мають ті ж значення, як у п. 6, виділяють продукт та, при необхідності, перетворюють його у фармацевтичнo прийнятну сіль.
14. Спосіб одержання сполук формули І за п. 6, в яких R1 є радикалом -N(R4)-SO2-R6, в якому R4 означає -C(R11)(R12)-Ar або -C(R11)(R12)-Het та R12 означає атом водню, який відрізняється тим, що
похідне Hal-SO2R6 вводять у взаємодію з похідним формули:

R2, R3, R11, R5 мають ті ж значення, як у п. 6, Hal означає атом галогену, та Rb означає Аr та Het, виділяють продукт та, при необхідності, перетворюють його у фармацевтичнo прийнятну сіль.
15. Спосіб одержання сполук формули І за п. 6, в яких R1 є радикалом -N(R4)R5, який відрізняється тим, що
похідне R5(R4)NН вводять у взаємодію з похідним формули:
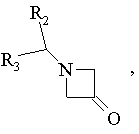
R2, R3, R4, R5 мають ті ж значення, як у п. 6, виділяють продукт та, при необхідності, перетворюють його у фармацевтичнo прийнятну сіль.
16. Спосіб одержання сполук формули І за п. 6, в яких R1 є радикалом -N(R4)SO2R6, який відрізняється тим, що
похідне Hal-SO2R6 вводять у взаємодію з похідним формули:
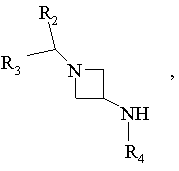
R2, R3, R4 та R6 мають ті ж значення, як у п. 6, та Hal означає атом галогену, виділяють продукт та, при необхідності, перетворюють його у фармацевтичнo прийнятну сіль.
17. Спосіб одержання сполук формули І за п. 6, в яких R1 є радикалом -N(R4)COR5, який відрізняється тим, що
похідне Hal-COR6 вводять у взаємодію з похідним формули:

R2, R3, R4 та R5 мають ті ж значення, як у п. 6, та Hal означає атом галогену, виділяють продукт та, при необхідності, перетворюють його у фармацевтичнo прийнятну сіль.
18. Спосіб одержання сполук формули І за п. 6, в яких R1 є радикалом -N(R4)-SO2-R6, в якому R4 означає радикал Het або Аr, який відрізняється тим, що
похідне Rd-NH-SO2-R6 вводять у взаємодію з похідним формули:
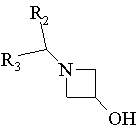
або
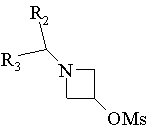 ,
,
Rd означає Аr або Het, R2, R3 та R6 мають ті ж значення, як у п. 6, та Ms означає радикал метилсульфонілокси, виділяють продукт та, при необхідності, перетворюють його у фармацевтичнo прийнятну сіль.
19. Спосіб одержання сполук формули І за п. 6, який відрізняється тим, що
похідне R2-CHBr-R3 вводять у взаємодію з похідним формули:
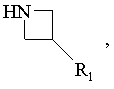
R1, R2 та R3 мають ті ж значення, як у п. 6, виділяють продукт та, при необхідності, перетворюють його у фармацевтичнo прийнятну сіль.
20. Спосіб одержання сполук формули І за п. 6, в яких R1 є радикалом -N(R4)-SO2-R6, в якому R4 означає піперид-4-ил, заміщений по азоту алкільним радикалом, який відрізняється тим, що алкілують відповідну сполуку формули І, в якій R1 є радикалом -N(R4)-SO2-R6, в якому R4 означає піперид-4-ил, виділяють продукт та, при необхідності, перетворюють його у фармацевтичнo прийнятну сіль.
21. Спосіб одержання сполук формули І за п. 6, в яких R1 є радикалом -N(R4)-SO2-R6, в якому R4 означає феніл, заміщений піролід-1-илом, який відрізняється тим, що піролідин вводять у взаємодію з відповідною сполукою формули І, в якій R1 є радикалом -N(R4)-SO2-R6, в якому R4 означає феніл, заміщений атомом галогену, виділяють продукт та, при необхідності, перетворюють його у фармацевтичнo прийнятну сіль.
Текст
Даний винахід відноситься до фармацевтичних композицій, що містять як активний початок щонайменше одну сполуку формули: або одну з її фармацевтично прийнятних солей, до нових похідних формули І, їх фармацевтично прийнятних солей та їх одержання. Сполука формули І, у якій R2 та R3 є фенільними радикалами, R1 означає радикал -N(R4)SO2R6, R 4 означає фенільний радикал та R6 означає метильний радикал, описана як проміжний продукт синтезу в патенті WO 99/01451. Інші сполуки та фармацевтично прийнятні солі є новими та як такі складають частину винаходу. У формулі І R1 означає радикал -N(R4)R5, -N(R4)-CO-R5, -N(R4)-SO2R 6, R2 та R3, однакові або різні, означають або ароматичний радикал, обраний з фенілу, нафтилу та інденілу, що можуть бути незаміщеними або заміщеними одним або декількома замісниками, обраними з галогену, алкілу, алкокси, формілу, гідрокси, трифторметилу, трифторметокси, -CO-alk, ціано, -СООН, -COOalk, CONR7R8, -CO-NH-NR9R10, алкілсульфанілу, алкілсульфінілу, алкілсульфонілу, алкілсульфанілалкілу, алкілсульфінілалкілу, алкілсульфонілалкілу, гідроксіалкілу або -alk-NR 7R8; або гетероароматичний радикал, обраний з наступних циклів: бензофурил, бензотіазоліл, бензотієніл, бензоксазоліл, хроманіл, 2,3дигідробензофурил, 2,3-дигідробензотієніл, фурил, імідазоліл, ізохроманіл, ізохіноліл, піроліл, піридил, піримідил, хіноліл,1,2,3,4-тетрагідроізохіноліл, тіазоліл та тієніл, що можуть бути незаміщеними або заміщеними галогеном, алкілом, алкокси, гідрокси, трифторметилом, трифторметокси, ціано, -СООН, -COOalk, -CO-NH-NR9R10, -CONR7R8, -alk-NR 9R10, алкілсульфанілом, алкілсульфінілом, алкілсульфонілом, алкілсульфанілалкілом, алкілсульфінілалкілом, алкілсульфонілалкілом або гідроксіалкілом; R4 означає радикал -C(R11)(R12)-Het, Het, -C(R 11)(R 12)-Ar, Аr, циклоалкіл або норборніл; R5 означає атом водню або радикал гідроксіалкіл, -alk-COOalk, -alk-CONR7R8, -alk-NR 7R8, алкокси, Аr, Het, -CH2Ar, -CH2Het або алкіл, можливо заміщений одним або декількома галогенами; R6 означає радикал гідроксіалкіл, -alk-COOalk, -alk-CONR 7R8, -alk-NR 7R8, алкокси, Аr, Het, -CH 2 Ar, -CH2Het або алкіл, можливо заміщений одним або декількома галогенами; R7 та R8 , однакові або різні, означають атом водню або алкіл, або ж R 7 та R8, разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та який може містити другий гетероатом, обраний з кисню, сірки та азоту, та бути заміщеним одним або декількома алкілами; R9 та R10, однакові або різні, означають атом водню або радикал алкіл, -COOalk, циклоалкіл, алкілциклоалкіл, -alk-O-alk або гідроксіалкіл, або ж R 9 та R10, разом з атомом азоту, з яким вони з'єднані, утворюють насичений або ненасичений моно- чи біциклічний гетероцикл, що має від 3 до 10 ланок та який може містити другий гетероатом, обраний з кисню, сірки та азоту, та бути заміщеним одним або декількома з наступних радикалів: алкіл, -COalk, -COOalk, -CO-NHalk, -CS-NHalk, оксо, гідроксіалкіл, -alk-O-alk або -CO-NH2; R11 означає атом водню або радикал гідроксіалкіл, alk-COOalk, alk-CONR7R8, -alk-NR 7R8, алкоксіалкіл, Аr, Het, -CH 2Ar, -CH2Het або алкіл, можливо заміщений одним або декількома галогенами; R12 означає атом водню або радикал гідроксіалкіл, -alk-COOalk, -alk-CONR7R8, -alk-NR 7R8, алкоксіалкіл або алкіл, можливо заміщений одним або декількома галогенами; або ж R11 та R12, разом з атомом вуглецю, з яким вони з'єднані, утворюють насичений моно- або біциклічний цикл, що має від 3 до 10 ланок та який може містити другий гетероатом, обраний з кисню, сірки та азоту, та бути заміщеним одним або декількома алкілами; Аr означає феніл, нафтил або інденіл, що можуть бути заміщені одним або декількома з наступних замісників: галоген, алкіл, алкокси, -CO-alk, ціано, -СООН, -COOalk, -CONR 13R14, -CO-NH-NR15R16, алкілсульфаніл, алкілсульфініл, алкілсульфоніл, alk-NR15R16, -NR15R16, алкілтіоалкіл, форміл, CF3, OCF3, Het, O-alk-NH-циклоалкіл, -SO2NH2, гідрокси, гідроксіалкіл, -NH-CO-alk, -NH-COOalk або, за двома суміжними атомами вуглецю, діоксиметиленом; Het означає ненасичений або насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та який містить один або декілька гетероатомів, обраних з кисню, сірки та азоту, та який може бути заміщений одним або декількома з наступних радикалів: алкіл, алкокси, вініл, галоген, алкоксикарбоніл, оксо, гідрокси, причому азотовмісні гетероцикли можуть бути у формі N-оксидів, R13 та R14 однакові або різні, означають атом водню або алкіл, або ж R 13 та R14 , разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та який може містити другий гетероатом, обраний з кисню, сірки та азоту, та бути заміщеним одним або декількома алкілами; R15 та R16 , однакові або різні, означають атом водню або алкіл, або ж R15 та R16 , разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та який може містити другий гетероатом, обраний з кисню, сірки та азоту, та бути заміщеним одним або декількома алкільними радикалами; alk означає алкіл або алкілен. У приведених та наступних визначеннях, якщо не обговорено особливо, алкільні або алкіленові радикали та частини молекул або алкоксильні радикали та частини молекул мають прямий або розгалужений ланцюг та містять від 1 до 6 атомів вуглецю, а циклоалкільні радикали містять від 3 до 10 атомів вуглецю. З алкільних радикалів можна назвати метил, етил, н-пропіл, ізопропіл, н-бутил, втор-бутил, ізобутил, трет-бутил, пентил, гексил. З радикалів алкокси можна назвати радикали метокси, етокси, н-пропокси, ізопропокси, н-бутокси, втор-бутокси, ізобутокси, трет-бутокси, пентилокси. З цикпоалкільних радикалів можна назвати циклопропіл, циклобутил, циклопентил, циклогексил. Термін галоген має на увазі хлор, фтор, бром та йод. З гетероциклічних радикалів, що означаються Het, можна назвати наступні гетероцикли: бензимідазол, бензоксазол, бензотіазол, бензотіофен, цинолін, тіофен, хіназолін, хіноксалін, хінолін, піразол, пірол, піридин, імідазол, індол, ізохінолін, піримідин, тіазол, тіадіазол, піперидин, піперазин, триазол, фуран, тетрагідроізохінолін та тетрагідрохінолін, що можуть бути заміщені одним або декількома з наступних замісників: алкіл, алкокси, галоген, алкоксикарбоніл, оксо, гідрокси, OCF3 або CF3 . Сполуки формули І можуть бути у формі енантіомерів або діастереоізомерів. Ці оптичні ізомери та їх суміші також складають частину винаходу. Переважно сполуки формули І являють собою такі сполуки, для яких: R1 означає радикал -N(R4)R5, -Ν (R4)-SO2R6 , R2 означає або феніл, не заміщений або заміщений одним або декількома з наступних замісників: галоген, алкіл, алкокси, трифторметил, трифторметокси, -CO-alk, ціано, -CONR7R8, гідроксіалкіл або -alk-NR 7R8, або гетероароматичний радикал, обраний з наступних циклів: піридил, піримідил, тіазоліл та тієніл, що можуть бути незаміщеними або заміщеними галогеном, алкілом, алкокси, гідрокси, трифторметилом, трифторметокси, -CONR7R8, -alk-NR 9R10, алкілсульфанілом, алкілсульфінілом, алкілсульфонілом або гідроксіалкілом; R3 означає або феніл, не заміщений або заміщений одним або декількома з наступних замісників: галоген, алкіл, алкокси, трифторметил, трифторметокси, -CO-alk, ціано, -CONR7R8, гідроксіалкіл або -alk-NR 7R8, або гетероароматичний радикал, обраний з наступних циклів: піридил, піримідил, тіазоліл та тієніл, що можуть бути незаміщеними або заміщеними галогеном, алкілом, алкокси, гідрокси, трифторметилом, трифторметокси, -CONR7R8, -alk-NR 9R10, алкілсульфанілом, алкілсульфінілом, алкілсульфонілом або гідроксіалкілом; R4 означає радикал -C(R11)(R12)-Het, Het, -C(R 11)(R 12)-Ar, Аr або норборніл; R5 означає атом водню або радикал гідроксіалкіл, -alk-COOalk, -alk-CONR7R8, -alk-NR 7R8, алкокси, -CH2Ar, -CH2Het або алкіл; R6 означає радикал гідроксіалкіл, -alk-COOalk, -alk-CONR 7R8, -alk-NR 7R8, алкокси, -CH2Ar, -CH2Het або алкіл; R7 та R8 , однакові або різні, означають атом водню або алкіл, або ж R 7 та R8, разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та який може містити другий гетероатом, обраний з кисню, сірки та азоту, та бути заміщеним одним або декількома алкілами; R9 та R10 , однакові або різні, означають атом водню або радикал алкіл, циклоалкіл, алкілциклоалкіл, -alkO-alk або гідроксіалкіл, або ж R9 та R10, разом з атомом азоту, з яким вони з'єднані, утворюють насичений або ненасичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та який може містити другий гетероатом, обраний з кисню, сірки та азоту, та бути заміщеним одним або декількома з наступних радикалів: алкіл, -COalk, -COOalk, -CO-NHalk, оксо, гідроксіалкіл або -CO-NH 2; R11 означає атом водню або радикал гідроксіалкіл, -alk-COOalk, -alk-CONR7R8, -alk-NR 7R8, алкоксіалкіл, Аr, Het, -CH 2Ar, -CH2Het або алкіл, можливо заміщений одним або декількома галогенами; R12 означає атом водню або радикал гідроксіалкіл, alk-COOalk, alk-CONR7R8, -alk-NR 7R8, алкоксіалкіл або алкіл, можливо заміщений одним або декількома галогенами; або ж R11 та R12, разом з атомом вуглецю, з яким вони з'єднані, утворюють насичений моно- або біциклічний цикл, що має від 3 до 10 ланок та який може містити другий гетероатом, обраний з кисню, сірки та азоту, та бути заміщеним одним або декількома алкілами; Аr означає феніл або нафтил, що можуть бути заміщені одним або декількома з наступних замісників: галоген, алкіл, алкокси, -CO-alk, ціано, -CONR13R14,- алкілсульфоніл, -alk-NR 15R16, -NR15R16, CF 3, OCF 3, SO2NH2, гідрокси, гідроксіалкіл або, за двома суміжними атомами вуглецю, діоксиметиленом; Het означає ненасичений або насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та який містить один або декілька гетероатомів, обраних з кисню, сірки та азоту, та який може бути заміщений одним або декількома з наступних радикалів: алкіл, алкокси, галоген, оксо, гідрокси, причому азотовмісні гетероцикли можуть бути у формі N-оксидів та, більш конкретно, Het означає гетероцикл, обраний з бензимідазолу, бензоксазолу, бензотіазолу, бензотіофену, тіофену, хіназоліну, хіноксаліну, хіноліну, піролу, піридину, імідазолу, індолу, ізохіноліну, піримідину, тіазолу, тіадіазолу, фурану, тетрагідроізохіноліну та тетрагідрохіноліну, що можуть бути заміщені одним або декількома з наступних замісників: алкіл, алкокси, галоген, алкоксикарбоніл, оксо, гідрокси, OCF3 або CF3 . R13 та R14 , однакові або різні, означають атом водню або алкіл, або ж R13 та R14 , разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та який може містити другий гетероатом, обраний з кисню, сірки та азоту, та бути заміщеним одним або декількома алкілами; R15 та R16 , однакові або різні, означають атом водню або алкіл, або ж R15 та R16 , разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та який може містити другий гетероатом, обраний з кисню, сірки та азоту, та бути заміщеним одним або декількома алкілами. Більш переважні сполуки формули І, обрані з наступних сполук: R1 означає радикал -N(R4)-SO2R6, R2 означає або феніл, не заміщений або заміщений одним або декількома з наступних замісників: галоген, алкіл, алкокси, трифторметил, трифторметокси, ціано, -CONR7R8, гідроксіалкіл або -alk-NR7R8, або гетероароматичний радикал, обраний з наступних циклів: піридил, піримідил, тіазоліл та тієніл, що можуть бути незаміщеними або заміщеними галогеном, алкілом, алкокси, гідрокси, трифторметилом, трифторметокси, -CONR7R8 або гідроксіалкілом; R3 означає або феніл, не заміщений або заміщений одним або декількома з наступних замісників: галоген, алкіл, алкокси, трифторметил, трифторметокси, ціано, -CONR7R8, гідроксіалкіл або -alk-NR7R8, або гетероароматичний радикал, обраний з наступних циклів: піридил, піримідил, тіазоліл та тієніл, що можуть бути незаміщеними або заміщеними галогеном, алкілом, алкокси, гідрокси, трифторметилом, трифторметокси, -CONR7R8 або гідроксіалкілом; R4 означає радикал -Het або Аr; R6 означає гідроксіалкіл або алкіл; R7 та R8 , однакові або різні, означають атом водню або алкіл, або ж R 7 та R8, разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та який може містити другий гетероатом, обраний з кисню, сірки та азоту, та бути заміщеним одним або декількома алкілами; Аr означає феніл або нафтил, що можуть бути заміщені одним або декількома з наступних замісників: галоген, алкіл, алкокси, -CO-alk, ціано, -CONR13R14, -alk-NR 15R16 , -NR15R16, CF 3, OCF 3, SO2NH2, гідрокси або гідроксіалкіл; Het означає ненасичений або насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та який містить один або декілька гетероатомів, обраних з кисню, сірки та азоту, та який може бути заміщений одним або декількома з наступних радикалів: алкіл, алкокси, галоген, оксо, гідрокси та, більш конкретно, Het означає гетероцикл, обраний з бензимідазолу, бензоксазолу, бензотіазолу, бензотіофену, тіофену, хіназоліну, хіноксаліну, хіноліну, піролу, піридину, імідазолу, індолу, ізохіноліну, тіазолу, тіадіазолу, фурану, тетрагідроізохіноліну та тетрагідрохіноліну, що можуть бути заміщені одним або декількома з наступних замісників: алкіл, алкокси, галоген, алкоксикарбоніл, оксо, гідрокси, OCF3 або CF3 . R13 та R14 , однакові або різні, означають атом водню або алкіл, або ж R13 та R14 , разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та який може містити другий гетероатом, обраний з кисню, сірки та азоту, та бути заміщеним одним або декількома алкілами; R15 та R16 , однакові або різні, означають атом водню або алкіл, або ж R15 та R16 , разом з атомом азоту, з яким вони з'єднані, утворюють насичений моно- або біциклічний гетероцикл, що має від 3 до 10 ланок та який може містити другий гетероатом, обраний з кисню, сірки та азоту, та бути заміщеним одним або декількома алкілами. З переважних сполук можуть бути названі наступні сполуки: N-{1-[біс-(4-хлорфеніл)метил]азетидин-3-іл}-N-(6-хлорпірид-2-ил)метилсульфонамід, N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(6-етилпірид-2-ил)метилсульфонамід, N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-хінол-6-ілметилсульфонамід, N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-хінол-5-ілметилсульфонамід, N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-изохінол-5-ілметилсульфонамід, N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-пірид-3-ил-метилсульфонамід, N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(1-оксид-пірид-3-ил)метилсульфонамід, N-(1R,2S,4S)-біцикло[2.2.1]гепт-2-ил-N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}метилсульфонамід, N-(1R,2R,4S)-біцикло[2.2.1]гепт-2-ил-N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}метилсульфонамід, N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід, N-{1-[біс(4-хлорфент)метил]азетидин-3-ил}-N-(тіазол-2-іл)метилсульфонамід, N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3-метоксифеніл)метилсульфонамід, N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3-гідроксифеніл)метилсульфонамід, N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3-гідроксиметилфеніл)метилсульфонамід, етиловий ефір N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(метилсульфоніл)-3-амінобензойної кислоти, N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(1-ізобутил-піперид-4-ил)метилсульфонамід, N-бензил-N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}амін, N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3,5-дифторбензил)амін, N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3,5-дифторбензил)метилсульфонамід, N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(пірид-3-илметил)метилсульфонамід, N-{1-[біс(4-фторфеніл)метил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід, (RS)-N-{1-[(4-хлорфеніл)пірид-3-илметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід, (R)-N-{1-[(4-хлорфеніл)пірид-3-илметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід, (S)-N-{1-[(4-хлорфеніл)пірид-3-илметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід, (RS)-N-{1-[(4-хлорфеніл)пірид-4-илметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід, (R)-N-{1-[(4-хлорфеніл)пірид-4-илметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід, (S)-N-{1-[(4-хлорфеніл)пірид-4-илметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід, (RS)-N-{1-[(4-хлорфеніл)піримідин-5-ілметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід, (R)-N-{1-[(4-хлорфеніл)піримідин-5-ілметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід, (S)-N-{1-[біс(4-хлорфеніл)піримідин-5-ілметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід, N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3,5-дифторфеніл)бензилсульфонамід, їх оптичні ізомери та їх фармацевтично прийнятні солі. Сполуки формули І, у яких R1 є радикалом -N(R4)R5, де R5 означає атом водню, -N(R4)-CO-R5 або -N(R4)SO2R6, R4 означає радикал C(R11)(R12)-Ar або -C(R11)(R12)-Het, та R12 означає атом водню, можуть бути отримані за наступною реакційною схемою: У приведених формулах R2, R3, R 6 та R11 мають ті ж значення, що й у формулі І, Rb означає радикал Аr або Het, Аr та Het мають ті ж значення, що й у формулі І, та Hal означає атом галогену, переважно хлор або бром. Стадію а звичайно проводять в інертному розчиннику такому як тетрагідрофуран, діоксан, хлоровмісний розчинник (наприклад, дихлорметан, хлороформ) при температурі в межах від 15 до 30°С в присутності основи такої як триалкіламін (наприклад, триетиламін, дипропілетиламін) або в піридині при температурі від 0 до 30°С. Стадію b проводять переважно в метанолі в автоклаві при температурі в межах від 50 до 70°С. Стадію с звичайно проводять в інертному розчиннику, такому як хлоровмісний розчинник (наприклад, дихлорметан) у присутності триацетоксиборогідриду натрію та оцтової кислоти при температурі, близькій до 20°С. Стадії d та є звичайно проводять в інертному розчиннику такому як тетрагідрофуран, діоксан, хлоровмісний розчинник (наприклад, дихлорметан, хлороформ) у присутності аміну, такого як триалкіламін (наприклад, триетиламін) при температурі від 5 до 20°С. Похідні Rb-COR11 є промисловими продуктами або можуть бути отримані за методами, які описані у R.C. LAROCK, Comprehensive Organic Transformations, VCH editor. Похідні Hal-SO2R6 є промисловими продуктами або можуть бути отримані галогенуванням відповідних сульфонових кислот, зокрема, in situ у присутності хлорсульфонілізоціанату та спирту в галогеновмісному розчиннику (наприклад дихлорметані, хлороформі). Похідні Hal-CO-R5 є промисловими продуктами або можуть бути отримані галогенуванням відповідних карбонових кислот, зокрема in situ у присутності тіонілхлориду в галогеновмісному розчиннику (наприклад, дихлорметані, хлороформі). Азетидиноли 1 можуть бути отримані з застосуванням або адаптацією методів, описаних KATRITZKY A.R. с coaвт.J. Heterocycl. Chem., 271 (1994) або DAVE P.R., J. Org. Chem., 61, 5453 (1996), та в прикладах. Роботу звичайно проводять за наступною схемою реакції: у формула х якої R2 і R3 мають ті ж значення, що й у формулі І, a Hal позначає атом хлору чи брому. У стадії А працюють переважно в інертному розчиннику такому як аліфатичний С 1-С4-спирт (наприклад, метанол, етанол), можливо в присутності гідроксиду лужного металу, при температурі кипіння реакційного середовища. У стадії В відновлення звичайно проводять з використанням гідриду літію й алюмінію в тетрагідрофурані при температурі кипіння реакційного середовища. У стадії С працюють переважно в інертному розчиннику, такому як аліфатичний С 1-С4-спирт (наприклад, етанол, метанол) у присутності гідрокарбонату натрію при температурі в межах від 20°С до температури кипіння реакційного середовища. У стадії D працюють по методу, описаному GRISAR М. із співавт. у J. Med. Chem., 885 (1973). Готують магнійорганічну сполуку з бромпохідного і потім у реакцію вводять нітрил в ефірі, такому як діетиловий ефір, при температурі від 0°С до температури кипіння реакційного середовища. Після гідролізу спиртом проміжний імін відновлюють in situ борогідридом натрію при температурі від 0°С до температури кипіння реакційного середовища. Похідні R2-CO-R3 є промисловими продуктами чи можуть бути отримані з застосуванням чи адаптацією методів, описаних KUNDER N.G. із співавт., J. Chem. Soc. Perkin Trans 1, 2815 (1997); MORENO-MARRAS Μ., Eur. J. Med. Chem., 23 (5) 477 (1988); SKINNER із співавт., J. Med. Chem., 14 (6) 546 (1971); HURN N.K., Tetr. Lett., 36 (52) 9453 (1995); MEDICI А. із співавт., Tetr. Lett., 24 (28) 2901 (1983); RIECKE R.D. із співавт., J. Org. Chem., 62 (20) 6921 (1997); KNABE J. із співавт., Arch, Pharm., 306 (9) 648 (1973); CONSONNI R. із співавт., J. Chem. Soc. Perkin Trans 1, 1989 (1996); FR-96-2481 і JP-94-261393. Похідні R3Br є промисловими продуктами чи можуть бути отримані з застосуванням чи адаптацією методів, описаних BRANDSMA L. Synth. Comm., 20 (11) 1967 із співавт., 3153 (1990); LEMAIRE М. із співавт., Synth. Comm., 24 (1) 95 (1994); GODA Η. із співавт., Synthesis, 9, 849 (1992); BAUERLE P. із співавт., J. Chem. Soc. Perkin Trans 2, 489 (1993). Похідні R3CN є промисловими продуктами чи можуть бути отримані з застосуванням чи адаптацією методів, описаних BOUYSSOU Р. із співавт., J. Het. Chem., 29 (4) 895 (1992); SUZUKI N. із співавт., J. Chem. Soc. Chem. Comm., 1523 (1984); MARBURG S. із співавт., J. Het. Chem., 17, 1333 (1980); PERCEC V. із співавт., J. Org. Chem., 60 (21) 6895 (1995). Сполуки формули І, у яких R1 є радикалом -N(R4)R5, можуть бути отримані за наступною схемою реакції: у формулах якої R2, R3, R4 і R5 мають ті ж значення, що й у формулі І. Цю реакцію зазвичай проводять в інертному розчиннику, такому як хлорвмісний розчинник (наприклад, дихлорметан) у присутності триацетоксиборогідрида натрію й оцтової кислоти при температурі близькій до 20°С. Сполуки HN(R4)R5 є промисловими продуктами чи можуть бути отримані відповідно до класичних, відомих фа хівцям методів або з застосуванням чи адаптацією методів, описаних Park K.K., J. Org. Chem., 60 (19) 6202 (1995); Kalir A. J. Med. Chem., 12 (3) 473 (1969); Sarges R., J. Org. Chem., 40 (9) 1216 (1975); Zaugg H.E., J. Org. Chem., 33 (5) 2167 (1968); Med. Chem., 10, 128 (1967); J. Am. Chem. Soc, 2244 (1955); Chem. Ber., 106, 2890 (1973); Chem. Pharm Bull., 16 (10) 1953 (1968); Bull. Soc. Chim. Fr., 835 (1962). Азетидинони 2 можуть бути отримані окислюванням відповідних азетидинолів переважно в диметилсульфоксиді за допомогою комплексу піридин-сульфотриоксид при температурі близькій до 20°С чи за допомогою диметилсульфоксиду в присутності оксалілхлориду і триетиламіну при температурі від -70 до 50°С. Сполуки формули І, у яких R1 є радикалом -N(R4)COR 5 чи -N(R4)SO 2R6 можуть бути отримані за наступною схемою реакції: У приведених формулах R2 , R3, R4, R5 і R6 мають ті ж значення, що й у формулі І, a Hal позначає галоген, переважно хлор. Стадії а і b зазвичай проводять в інертному розчиннику, такому як тетрагідрофуран, діоксан, хлорвмісний розчинник (наприклад, дихлорметан, хлороформ) у присутності аміну, такого як триалкіламін (наприклад, триетиламін) при температурі від 5 до 20°С. Сполуки формули І, у яких R1 є радикалом -N (R4) -SO2R6, у якому R4 позначає Het чи Аr, можуть бути отримані за наступною схемою реакції: У приведених формулах R2 , R3 і R6 мають ті ж значення, що й у формулі І, Rd позначає радикал Аr чи Het (Het і Аr мають ті ж значення, що й у формулі І), і Ms позначає радикал метансульфонілокси. Стадію а зазвичай проводять в інертному розчиннику, такому як тетрагідрофуран, у присутності трифенілфосфіну і діетилазодикарбоксилату при температурі від 0°С до температури кипіння реакційного середовища. Стадію b зазвичай проводять в інертному розчиннику, такому як тетрагідрофуран, діоксан, хлорвмісний розчинник (наприклад, дихлорметан, хлороформ) при температурі в межах від 15 до 30°С в присутності основи, такої як триалкіламін (наприклад, триетиламін, дипропілетиламін) чи в піридині при температурі від 0 до 30°С. Стадію с переважно проводять в інертному розчиннику, такому як діоксан, у присутності CsCO3 у киплячій реакційній суміші. Похідні, у яких Rd є N-оксидом азотвмісного гетероциклу, можуть бути відновлені до неокисленої сполуки по методу, описаному SANGHANEL Е. із співавт., Synthesis 1375 (1996). Похідні Rd-NH-SO2R6 можуть бути отримані за наступною схемою реакції: У приведених формулах Hal позначає атом галогену, a Rd позначає радикал Het чи Аr. Реакцію проводять в інертному розчиннику, такому як тетрагідрофуран, діоксан, хлорвмісний розчинник (наприклад, дихлорметан, хлороформ) при температурі в межах від 15 до 30°С в присутності основи, такої як триалкіламін (наприклад, триетиламін, дипропілетиламін) чи в піридині при температурі від 0 до 30°С. Похідні, у яких Rd є N-оксидом азотвмісного гетероциклу, можуть бути отримані по методу, описаному RHIE R., Heterocycles, 41. (2) 323 (1995). Сполуки формули І можуть бути також отримані за наступною схемою реакції: У приведених формулах R1, R2 і R3 мають ті ж значення, що й у формулі І, a Ph позначає феніл. Стадію а зазвичай проводять у спирті, такому як метанол, у присутності борогідриду натрію при температурі близькій до 20°С. У стадії b готують із бромпохідного магнійорганічну сполуку і вводять її в реакцію в інертному розчиннику, такому як діетиловий ефір чи тетрагідрофуран, при температурі в межах від 0°С до температури кипіння реакційного середовища. Стадію с проводять з використанням галогенуючого агента, такого як бромистоводнева кислота, тіонілбромід, тіонілхлорид, суміш три фенілфосфіну і чотирьохбромистого чи чотирьоххлористого вуглецю в оцтовій кислоті чи в інертному розчиннику, такому як дихлорметан, хлороформ, чотирьоххлористий вуглець чи толуол при температурі від 0°С до температури кипіння реакційного середовища. Стадію d проводять з використанням водню в присутності палладію на вугіллі в спирті, такому як метанол, при температурі близькій до 20°С. Стадію є проводять в інертному розчиннику, такому як ацетонітрил, у присутності карбонату лужного металу (наприклад, карбонату калію) і йодиду калію при температурі від 20°С до температури кипіння реакційного середовища. Похідні R3Br і похідні R2-CHO є промисловими продуктами чи можуть бути отримані по методах, описаним, наприклад, R.C. LAROCK, Comprehensive Organic Transformations, VCH editor. Сполуки формули І, у яких R1 є радикалом -N(R4)-SO2-R6, де R4 позначає радикал піперид-4-ил, можливо заміщений по азоту алкільним радикалом, можуть бути також отримані за наступною схемою реакції: У приведених формула х R2 , R3 і R6 мають ті ж значення, що й у формулі І, аlк позначає алкільний радикал, і Re позначає радикал трет-бутилкарбонілокси. Стадію а проводять в інертному розчиннику, такому як хлорвмісний розчинник (наприклад, дихлорметан), у присутності гідриду, такого як триацетоксиборогідрид натрію, і оцтової кислоти при температурі від 0°С до температури кипіння реакційного середовища. Стадію b зазвичай проводять в інертному розчиннику, такому як тетрагідрофуран, діоксан, хлорвмісний розчинник (наприклад, дихлорметан, хлороформ), у присутності аміну, такого як триалкіламін (наприклад, триетиламін), при температурі від 5 до 20°С. Стадію c проводять з використанням хлористоводневої кислоти в діоксані при температурі від 0°С до температури кипіння реакційного середовища. Стадію d проводять з використанням будь-якого відомого фахівцям засобу для алкілування аміну без порушення іншої частини молекули. Можуть бути, наприклад, використані алкілгалогеніди в присутності органічної основи, такої як триетиламін, гідроксид лужного металу (наприклад, гідроксид натрію і калію), можливо в присутності броміду тетрабутиламонія в інертному розчиннику, такому як диметилсульфоксид, диметилформамід чи піридин, при температурі від 20 до 50°С. Сполуки формули І, у яких R1 є радикалом -N(R4)-SO2-R6, де R4 позначає піролід-1-ил-заміщений фенільний радикал, можуть бути також отримані дією піролідина на відповідну сполуку формули І, у якої R1 є радикалом -N(R4)SO2R6, де R4 позначає феніл, заміщений атомом галогену. Цю реакцію переважно проводять у диметилсульфоксиді при температурі від 50 до 95°С. Для фахівця є очевидним, що при здійсненні описаних вище способів по винаходу може виявитися необхідним для уникнення побічних реакцій вводити захисні групи для амінних, гідроксильних і карбоксильних функцій. Такими групами є групи, що можуть бути вилучені без порушення іншої частини молекули. Як приклади захисних груп для амінної функції можна назвати трет-бутил чи метилкарбамати, що можуть бути регенеровані за допомогою йодтриметилсилану, чи алілкарбамат, що може бути вилучений за допомогою паладієвих каталізаторів. Як приклади захисних груп для гідроксильної функції можна назвати триетилсиліл, трет-бутилдиметилсиліл, що можуть бути регенеровані за допомогою фторида тетрабутиламонія, чи ж несиметричні ацеталі (наприклад, метоксиметил, тетрагідропіраніл), що регенеруються за допомогою хлористоводневої кислоти. Як захисні групи для карбоксильних функцій можна назвати складні ефіри (наприклад, аліловий, бензиловий), оксазоли і 2-алкіл-1,3-оксазоліни. Інші придатні для використання захисні групи описані GREENE T.W. із співавт., Protecting groups in Organic Synthesis, second edition, 1991, John Wiley & Sons. Сполуки формули І можуть бути очищені звичайними відомими методами, наприклад кристалізацією, хроматографією чи екстракцією. Енантіомери сполук формули І можуть бути отримані розщепленням рацемічних сумішей, наприклад за допомогою хроматографії на хіральній колонці по PICKLE W.H. із співавт., Assymetric Synthesis, vol.1, Academic Press (1983) або шляхом утворення солей чи синтезом з хіральних попередників. Діастереоізомери можуть бути отримані за допомогою відомих класичних методів (кристалізації, чи хроматографії з хіральних попередників). Сполуки формули І можуть бути при необхідності перетворені в сольові аддукти з мінеральними чи органічними кислотами дією кислоти в органічному розчиннику, такому як спирт, кетон, простий ефір чи хлорвмісний розчинник. Ці солі також складають частину винаходу. Як приклади фармацевтично прийнятних солей можуть бути названі наступні солі: бензолсульфонат, гідробромід, гідрохлорид, цитарат, етансульфонат, фумарат, глюконат, йодат, ізетіонат, малеат, метансульфонат, метилен-бис-b-оксинафтоат, нітрат, оксалат, памоат, фосфат, саліцилат, сукцинат, сульфат, тартрат, тео філінацетат і п-толуолсульфонат. Сполуки формули І мають цікаві фармакологічні властивості. Ці сполуки характеризуються сильною спорідненістю до каннабіноїдних рецепторів і, зокрема, до рецепторів типу СВ1. Вони є антагоністами рецептора СВ1 і, отже, можуть бути використані при лікуванні і профілактиці розладів, що торкаються центральної нервової системи, імунної системи, серцево-судинної чи ендокринної системи, респіраторної системи, шлунково-кишкового апарату і розладів репродуктивної системи (Hollister, Pharm. Rev., 38, 1986, 120; Reny і Sinha, Prog. Drug. Res., 36, 71-114 (1991); Consroe і Sandyk, у Marijua na/Cannabinoids, Neurobiology and Neurophysiology, 459; Murphy L and Barthe A. Eds, CRC Press, 1992). Таким чином, ці сполуки можуть бути використані для лікування і попередження психозів, включаючи шизофренію, тривожних станів, депресії, епілепсії, нейродегенерації, мозочкових і спинномозочкових розладів, порушення когнітивних функцій, черепномозгової травми, панічних приступів, периферичних нейропатій, глауком, мігрені, хвороби Паркінсона, хвороби Альцгеймера, хореї Гентингтона, синдрому Рейно, тремору, обсесивно-імпульсивного синдрому, старечого слабоумства, порушень тимуса, синдрому Туретта, уповільненої дискинезії, двохполюсних розладів, рака, порушень рухо вого апарата під впливом лік, дистоній, ендотоксемічних шоків, геморагічних шоків, гіпотензії, безсоння, імунологічних захворювань, розсіяного склерозу, рвот, астми, порушень апетиту (булимія, анорексія), ожиріння, порушень пам'яті, порушень проходу по кишечнику, при скасуванні хронічного лікування, при лікуванні синдрому скасування чи алкоголю лік (наприклад, опіоідів, барбітуратів, коноплі, кокаїну, амфетамінів, фенцикліда, галюциногенів, бензодіазепінів), таких як аналгетики чи підсилювачі анальгетичної активності наркотичних і ненаркотичних лік. Вони можуть бути також використані для лікування чи профілактики проходу по кишечнику. Спорідненість сполук формули І до рецепторів конопель було визначено по методу, описаному KUSTER J.E., STEVENSON J.I., WARD S.J., D'AMBR A Т.Е., HAYCOCK D.A. у J. Pharmacol. Exp. Ther., 264, 1352-1363 (1993). У проведеному тесті значення СІ50 для сполук формули І нижче чи дорівнює 1000нм. Їхня антагоністична активність була продемонстрована за допомогою моделі гіпотермії, яка викликається агоністом рецепторів конопель (СР-55940) у миші, по методу, описаному Pertwee у R.G. у Marijuana, Harvey D.J. eds, 84 Oxford IRL Press, 263-277 (1985). У цьому тесті значення DE50 для сполук формули І нижче чи дорівнює 50мг/кг. Сполуки формули І мають низьку токсичність. Їх DL50 вище 40мг/кг при підшкірному введенні в миші. Винахід ілюструють наступні приклади. Приклад 1 N-{1-[Бic(4-xлopфeнiл)мeтил]aзeтидин-3-iл}-N-(6-xлopпipид-2-ил)метилсульфонамід може бути отриманий наступною послідовністю операцій: до розчину 1,54г 1-[біс(4-хлорфеніл)метил]азетидин-3-олу і 1,22г N-(6хлорпірид-2-ил)метилсульфонаміду в 120см 3 безводного тетрагідрофурана додають під аргоном 2,4см 3 діетилазодикарбоксилата і 1,44г трифенілфосфіну. Після 20 годин перемішування при 20°С реакційну суміш досуха упарюють при зниженому тиску (2,7кПа). Залишок хроматографують на колонці із силікагелем (гранулометрія 0,040-0,063мм, висота 30см, діаметр 4,5см), елюючи під тиском 0,5 бар аргону сумішшю циклогексану і етилацетата (80/20 по об'єму) і збираючи фракції об'ємом 60см 3. Фракції 6-9 поєднують і досуха упарюють при зниженому тиску (2,7кПа). Одержують 1,75гм N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(6хлорпірид-2-ил)метилсульфонаміду у вигляді білої пінистої маси. [Спектр ЯМР 1Н (300 МГц, CDCI3, δ у м.д.): 2,85-3,00 (м:2Н); 2,91 (с:3Н); 3,57 (т розщепл., J=7 і 2Гц:2Н); 4,25 (с:1Н); 4,64 (м:1Н); від 7,20 до 7,35 (м:9Н); 7,36 (дд, J=8 і 1Гц:1Н); 7,71 (т, J=8Гц:1Н)]. 1-[Біс(4-хлорфеніл)метил]азетидин-3-ол може бути отриманий відповідно до послідовності операцій, описаної KATRITZKY A.R. із співавт. J. Heterocycl. Chem., 271 (1994), виходячи з 35,5г гідрохлориду [біс(4хлорфеніл)метил]аміну і 11,0см 3 епіхлоргідрину. Виділяють 9,0г 1-[біс(4-хлорфеніл)метил]азетидин-3-олу. Гідрохлорид [біс(4-хлорфеніл)метил]аміну може бути отриманий по методу, описаному GRISAR М. із співавт. J. Med. Chem., 885 (1973). N-(6-хлорпірид-2-ил)метилсульфонамід може бути отриманий наступною послідовністю операцій: До охолодженого до +5°С розчину 2-аміно-6-хлорпіридина в 12,5см 3 піридину додають по краплях протягом 1 години 7,8см 3 метилсульфонілхлориду. Після досягнення кімнатної температури і перемішування протягом 20 годин до чорної реакційної суміші додають 140см 3 води й екстрагують 200см 3 дихлорметана. Органічну фазу відокремлюють, висушують над сульфатом магнію, фільтрують і досуха упарюють при зниженому тиску (2,7кПа). Отриманий масляний залишок хроматографують на колонці із силікагелем (гранулометрія 0,0630,200мм, висота 30см, діаметр 4см), елюючи під тиском 0,5 бар аргону сумішшю циклогексану і етилацетата (70/30 по об'єму) і збираючи фракції об'ємом 60см 3. Фракції 5-10 поєднують і досуха упарюють при зниженому тиску (2,7кПа), одержуючи 17г N-(6-хлорпірид-2-ил)метилсульфонаміду у вигляді жовтої олії. Приклад 2 N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(6-етилпірид-2-ил)метилсульфонамід може бути отриманий повторенням послідовності операцій, описаній в прикладі 1, виходячи з 0,61г 1-[біс(4хлорфеніл)метил]азетидин-3-олу, 0,40г N-(6-етилпірид-2-ил)метилсульфонаміду, 50см 3 безводного тетрагідрофурану, 0,96см 3 діетилазодикарбоксилату і 0,577г трифенілфосфіну. Сирий продукт хроматографують на колонці із силікагелем (гранулометрія 0,040-0,063мм, висота 20см, діаметр 2см), елюючи під тиском 0,5 бар аргону сумішшю циклогексану і етилацетату (70/30 по об'єму) і збираючи фракції об'ємом 30см 3. Фракції 6-9 поєднують і досуха упарюють при зниженому тиску (2,7кПа). Одержують 0,3г олії, яке розтирають у суміші 5см 3 діетилового ефіру і 5см 3 діізопропілового ефіру. Суспензію фільтрують, тверду речовину віджимають і сушать при зниженому тиску (2,7кПа), одержуючи 0,11г N-{1-[бic(4хлорфеніл)метил]азетидин-3-іл}-N-(6-етилпірид-2-ил)метилсульфонаміду у вигляді білої твердої речовини. [Спектр ЯМР 1Н (300 МГц, CDCI3, δ у м.д.): 1,26 (τ, J=7,5Гц:3Н); 2,76 (кв, J=7,5Гц:2Н); від 2,85 до 2,95 (м:2Н); 2,90 (с:3Н); 3,53 (т розщепл., J=7 і 2Гц:2Н); 4,22 (с:1Н); 4,69 (м:1Н); 7,07 (д, J=7,5Гц:1Н); від 7,15 до 7,30 (м:9Н); 7, 64 (т, J=7,5Гц:1Η)]. N-(6-етилпірид-2-ил)метилсульфонамід може бути отриманий наступною послідовністю операцій: До охолодженого до +5°С розчину 2,50г 2-аміно-6-хлорпіридину в 2,50см 3 піридину додають по краплях 1,56см 3 метилсульфонілхлориду. Після 20 годин перемішування при 20°С до реакційної суміші додають 8см 3 води і потім суміш фільтрують. Фільтрат досуха упарюють при 50°С и зниженому тиску (2,7кПа). Залишок хроматографують на колонці із силікагелем (гранулометрія 0,040-0,063мм, висота 30см, діаметр 4см), елюючи під тиском 0,5 бар аргону 1,5л дихлорметану і потім сумішшю дихлорметана і етанола (98/2 по об'єму) і збираючи фракції об'ємом 60см 3. Фракції 8-12 поєднують і досуха упарюють при зниженому тиску (2,7кПа), одержуючи 2,8г N-(6-етилрпірид-2-ил)метилсульфонаміду у вигляді жовтої олії. Приклад 3 N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N-хінол-6-ілметилсульфонамід може бути отриманий у такий спосіб. До розчину 0,50г N-хінол-6-ілметилсульфонаміду в 50см 3 безводного тетрагідрофурану додають під аргоном 0,70г 1-[біс (4-хлорфеніл)метил]азетидин-3-олу, 0,597 трифенілфосфіну, після чого доливають 0,40см 3 діетилазодикарбоксилату. Після 20 годин перемішування при 20°С реакційну суміш нагрівають при температурі кипіння протягом 4 годин і додають 2,98г трифенілфосфіну і 2,0см 3 діетилазодикарбоксилату. Після 48 годин перемішування при 20°С суміш досуха упарюють при зниженому тиску (2,7кПа). Залишок забирають 30см 3 диетилового ефіру й отриману суспензію фільтрують, а фільтрат досуха упарюють. Частину отриманого залишку (0,90г) хроматографують на колонці Bond Elut з катионообмінною сульфоновокислотною смолою SCX (гранулометрія 0,054мм, висота 4см, діаметр 3см), елюючи спочатку метанолом і потім 2Μ аміачним розчином для елювання цільового продукту і збираючи фракції об'ємом 5см 3. Фракції 16-19 поєднують і досуха упарюють при зниженому тиску (2,7кПа). Одержують 0,33г масла, що перемішують у 10см 3 діізопропілового ефіру. Суспензію, що утворилася, фільтрують. Відфільтрований повторно фільтрат виділяє через 15хв тверду речовину, що сушать при 50°С и зниженому тиску (2,7кПа). Одержують 83мг N-{1-[бic(4хлорфеніл)метил]азетидин-3-іл}-N-хінол-6-ілметилсульфонаміду у вигляді білої твердої речовини. [Спектр ЯМР 1Н (300 МГц, CDCI3, δ у м.д.): 2,87 (с:3Н); 2,89 (м:2Н); 3,55 (т розщепл., J=7 і 1Гц:2Н); 4,18 (с:1Н); 4,69 (м:1Н); від 7,15 до 7,30 (м:8Н); 7,47 (дд, J=8,5 і 4Гц:1Н); 7,58 (дд, J=9 і 2,5Гц:1Н); 7,73 (д, J=2,5Гц:1Н); 8,10-8,20 (м:2Н); 8,97 (дд, J=4 і 1,5Гц:1Н)]. N-Хінол-6-ілметилсульфонамід може бути отриманий у такий спосіб. До охолодженого до +3°С розчину 1,98г 6-амінохінолеїну в 1,75см 3 піридину доливають протягом 1 години по краплях 1,1см 3 метилсульфонілхлориду. Після 20 годин перемішування при 20°С до реакційної суміші додають 50см дихлорметану і потім суміш фільтрують. Фільтрат розділяють на фази. Органічну фаз у висушують над сульфатом магнію, фільтрують і досуха упарюють при зниженому тиску (2,7кПа), одержуючи 1,15г N-хінол-6ілметилсульфонаміду у вигляді твердої речовини жовто-кремового кольору. Приклад 4 N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N-хінол-5-ілметилсульфонамід може бути отриманий у такий спосіб. До розчину 0,50г N-хінол-5-ілметилсульфонаміду в 70см 3 безводного тетрагідрофурана додають під аргоном 0,70г 1-[біс(4-хлорфеніл)метил]азетидин-3-ола, 0,597г трифенілфосфіна, після чого доливають 0,40см 3 діетилазодикарбоксилату і 0,45г 1,2-біс(дифенілфосфін)етану. Після 20 годин перемішування при 20°С реакційну суміш досуха упарюють при зниженому тиску (2,7кПа). Залишок забирають 70см 3 етилацетату і розчин, що утворився, промивають 30см 3 соляного розчину, висушують над сульфатом магнію, фільтрують і досуха упарюють при 0°С і зниженому тиску (2,7кПа). Отримане фіолетове масло хроматографують на колонці із силікагелем (гранулометрія 0,063-0,200мм, висота 35см, діаметр 3,9см), елюючи під тиском 0,5 бар аргону сумішшю циклогексану і етилацетата (40/60, потім 30/70 і 20/80 по об'єму) і збираючи фракції об'ємом 50см 3. Фракції 6-12 поєднують і досуха упарюють при зниженому тиску (2,7кПа) . Залишок забирають 15 см3 метанолу, білу суспензію, що утворилася, фільтрують, тверду речовину віджимають і сушать при 50°С і зниженому тиску (2,7кПа), одержуючи 0,35г N-{1-[бic(4-хлорфеніл)метил]азетидин-3-іл}-N-хінол-5ілметилсульфонаміду у вигляді білої твердої речовини. [Спектр ЯМР 1Н (300 Мгц, CDCI3, δ у м.д.): 2,60 (т, J=7Гц:1Н); 2,84 (т, J=7Гц:1Н); 2,99 (с:3Н); 3,36 (т розщепл., J=7 і 2,5Гц:1Н); 3,56 (т розщепл., J=7 і 2,5Гц:1Н); 4,01 (с:1Н); 4,85 (м:1Н); від 7,10 до 7,25 (м:8Н); 7,40 (дд, J=7,5 і 1Гц:1Н); 7,54 (дд, J=8,5 і 4Гц:1Н); 7,74 (дд, J=8 і 7,5Гц:1Н); 8,20 (д ушир. J=8Гц :1Н); 8,54 (д ушир., J=9 Гц:1Н); 8,99 (дд, J=4 і 1,5Гц:1Н)]. N-хінол-5-ілметилсульфонамід може бути отриманий повторенням послідовності операцій, описаної в прикладі 3, виходячи з 2,0г амінохінолеїну, 3,0см 3 піридину і 1,1см 3 метилсульфонілхлориду. Одержують 2,47г N-хінол-5-ілметилсульфонаміду у вигляді коричнево-жовтої твердої речовини. Приклад 5 N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N-ізохінол-5-ілметилсульфонамід може бути отриманий повторенням послідовності операцій, описаної в прикладі 4, виходячи з 0,497г N-(изохiнол-5іл)метилсульфонаміду, 70см 3 безводного тетрагідрофурану, 0,712г 1-[біс(4-хлор феніл)метил]азетидин-3-олу, 0,597 трифенілфосфіну, 0,40см 3 діетилазодикарбоксилату і 0,45г 1,2-біс(дифенілфосфін)етану. Отримане неочищене буре масло очищують хроматографією на колонці із силікагелем (гранулометрія 0,063-0,200мм, висота 38см, діаметр 3см), елюючи сумішшю циклогексану і етилацетата (30/70 по об'єму) і збираючи фракції об'ємом 40см 3. Фракції 8-23 поєднують і досуха упарюють при зниженому тиску (2,7кПа). Залишок перемішують у 15см 3 діетилового ефіру, суспензію фільтрують і нерозчинний матеріал хроматографують на колонці зі смолою SCX (висота 4см, діаметр 3см), промиваючи спочатку сумішшю метанолу з дихлорметаном (50/50 по об'єму) і потім елюючи 2М розчином аміаку в метанолі і збираючи фракції об'ємом 20см 3. Фракції 1-6 поєднують і відфільтровують білий нерозчинний твердий матеріал, що з'явився, який віджимають і потім сушать при 50°С і зниженому тиску (2,7кПа). Одержують 0,169г N-{1-[бic(4-хлорфеніл)метил]азетидин-3-іл}-Nізохінол-5-ілметилсульфонаміду у ви гляді білої твердої речовини. [Спектр ЯМР 1Н (300 Мгц, CDCI3, δ у м.д.): 2,64 (т, J=7Гц:1Н); 2,81 (т, J=7Гц:1Н); 2,98 (с:3Н); 3,36 (т розщепл., J=7 і 2Гц:1Н); 3,55 (т розщепл., J=7 і 2Гц:1Н); 4,02 (с:1Н); 4,86 (м:1Н); 7,10-7,25 (м:8Н); 7,60 (дд, J=8 і 1Гц:1Н); 7,66 (т, J=8Гц:1Н); 7,93 (д ушир., J=6Гц:1Н); 8,06 (д ушир., J=8Гц:1Н); 8,66 (д, J=6Гц:1Н);9,32(зушир.:1Н)]. М-(ізохінол-5-іл)метилсульфонамід може бути отриманий повторенням послідовності операцій, описаній в прикладі 4, виходячи з 2,0 г 5-аміноізохінолеїну, 3,0 см3 піридину і 1,1 см3 метилсульфоніилхлориду. Одержують 2,3 г М-(ізохінол-5-іл)метилсульфонаміду у вигляді твердої речовини бежевого кольору. Приклад 6 N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N-пирид-3-ілметилсульфонамід може бути отриманий у такий спосіб. До розчину 0,144г N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(1-оксидпірид-3-іл)метилсульфонаміду в 5см 3 хлороформу, вливають 0,042см 3 трьоххлористого фосфор у і нагрівають суміш при температурі кипіння. Після перемішування протягом 1 години 30хв реакційну суміш залишають до повернення її температури до кімнатної, додають 5см 3 0,1 н. соляної кислоти, перемішують і розділяють фази. Органічну фазу розбавляють 20см 3 хлороформу, висушують над сульфа том магнію, фільтрують і досуха упарюють при зниженому тиску (2,7кПа). Залишок хроматографують на колонці із силікагелем (гранулометрія 0,063-0,200мм, висота 9см, діаметр 1,8см), елюючи під тиском 0,1 бар аргону сумішшю дихлорметана і метанолу (95/5 по об'єму) і збираючи фракції об'ємом 15см 3. Фракції 2-4 поєднують і досуха упарюють при зниженому тиску (2,7кПа). Залишок перемішують у 15см 3 діетилового ефіру, суспензію фільтрують і твердий матеріал сушать при зниженому тиску (2,7кПа). Одержують 35мг N-{1-[бic(4-хлорфеніл)метил]азетидин-3-іл}-N-пірид-3илметилсульфонаміду у вигляді твердої речовини кремового кольору. [Спектр ЯМР 1Н (300 Мгц, CDCI3, δ у м.д.): 2,80-2,95 (м:2Н); 2,87 (с:3Н); 3,51 (т розщепл., J=7 і 1,5Гц:2Н); 4,18 (с:1Н); 4,65 (м:1Н); 7,15-7,35 (м:8Н); 7,37 (дд ушир., J=8 і 5Гц:1Н); 7,64 (д редуцир., J=8Гц:1Н); 8,52 (д ушир., J=2Гц:1Н); 8,61 (д ушир., J=5Гц:1Н)]. Приклад 7 N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(1-оксидпірид-3-ил)метилсульфонамід може бути отриманий у такий спосіб. До розчину 0,265г 1-[біс (4-хлорфеніл)метил]азетидин-3-олу і 0,162г N-(1-оксидпірид-3ил)метилсульфонаміду в 25см 3 безводного тетрагідрофурану додають під аргоном 0,16см 3 діетилазодикарбоксилату і 0,226г трифенілфосфіну. Після 20 годин перемішування при 20°С и потім 24 годин при температурі кипіння реакційну суміш досуха упарюють при зниженому тиску (2,7кПа). Залишок хроматографують на колонці із силікагелем (гранулометрія 0,063-0,200мм, висота 20см, діаметр 1,5см), елюючи під тиском 0,5 бар аргону сумішшю дихлорметана і метанолу (98/2 по об'єму) і збираючи фракції об'ємом 40см 3. Фракції 26-64 поєднують і досуха упарюють при зниженому тиску (2,7кПа). Залишок перемішують у 10см 3 діетилового ефіру, суспензію фільтрують, нерозчинний матеріал віджимають і сушать при зниженому тиску (2,7кПа). Одержують 0,10г N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(1-оксидпірид-3ил) метилсульфонаміду у вигляді білої твердої речовини. [Спектр ЯМР 1Н (400 Мгц, (CD3)2SO d6, δ у м.д.): 2,78 (т, J=7Гц:2Н); 3,06 (с:3Н); 3,37 (т, J=7Гц:2Н); 4,45 (с:1Н); 4,71 (м:1Н); 7,30-7,50 (м:10Н); 8,21 (д ушир., J=6,5Гц:1Н); 8,27 (з ушир.:1Н)]. N-(1-оксидпірид-3-ил)метилсульфонамід може бути отриманий у такий спосіб. До розчину 1,81г N-пірид-3ил-метилсульфонаміду в 71см 3 Ν,Ν-диметилформаміду і 3см 3 метанолу додають частинами 7,1г 50-55%-ної 3хлорнадбензойної кислоти і потім 0,56см 3 40%-ної фтористоводневої кислоти. Після 2 годин перемішування при 20°С реакційну суміш виливають на 500г льоду, перемішують і потім фільтрують. Фільтрат досуха упарюють при 60°С і зниженому тиску (2,7кПа). Залишок забирають 50см 3 суміші дихлорметана з метанолом (98/2 по об'єму) і фільтрують. Фільтрат хроматографують на колонці із силікагелем (гранулометрія 0,0630,200мм, висота 27см, діаметр 4см), елюючи під тиском 0,5 бар аргону сумішшю ди хлорметана і метанолу (98/2 по об'єму) і збираючи фракції об'ємом 60см 3. Фракцію 62 досуха упарюють при зниженому тиску (2,7кПа). Одержують 0,96г N-(1-оксид-пірид-3-ил)метилсульфонаміду у вигляді жовтуватої твердої речовини. N-пірид-3-ил-метилсульфонамід може бути отриманий повторенням послідовності операцій, описаної в прикладі 1, виходячи з 2г 3-амінопіридину, 5см 3 піридину і 1,8см 3 метилсульфонілхлориду. Отриманий сирий продукт перемішують у 40см 3 діетилового ефіру, суспензію фільтрують і твердий матеріал віджимають і сушать при зниженому тиску (2,7кПа), одержуючи 2,47г N-пірид-3-ил-метилсульфонаміду у вигляді розуватої твердої речовини. Приклад 8 N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N-циклогексилметилсульфонамід може бути отриманий у такий спосіб. До розчину 1,8г N-1-[біс(4-хлорфеніл)метил]азетидин-3-іл) -N-циклогексиламіну, 0,7см 3 триетиламіну і 20мг 4-диметиламінопіридину в 25см 3 дихлорметану додають при перемішуванні 0,4см 3 метилсульфонілхлориду. Після 48 годин перемішування при 20°С додають до реакційної суміші 20см 3 дихлорметану, 20см 3 води, перемішують і розділяють фази. Органічну фазу висушують над сульфатом магнію й упарюють при 50°С и зниженому тиску (2,7кПа). Бурий масляний залишок хроматографують на колонці із силікагелем (гранулометрія 0,063-0,2мм, висота 20см, діаметр 2,0см), елюючи під тиском 0,1 бар аргону сумішшю дихлорметана і метанолу (96/4 по об'єму) і збираючи фракції об'ємом 10см 3. Фракції 2-4 і 5-10 поєднують і досуха упарюють при зниженому тиску (2,7кПа). Залишок хроматографують обсягом із силікагелем (гранулометрія 0,063-0,2мм, висота 30см, діаметр 1,5см), елюючи під тиском 0,1 бар аргону сумішшю циклогексану і етилацетата (70/30 по об'єму) і збираючи фракції об'ємом 5см 3. Фракції 7-10 поєднують і досуха упарюють при зниженому тиску (2,7кПа). Одержують 0,10г N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-метилсульфонаміду у вигляді пінистої маси кремового кольору. [Спектр ЯМР 1Н (300 МГц, CDCI3, δ у м.д.): 0,80-1,90 (м:10Н); 2,82 (с:3Н); 3,36 (т ушир., J=7,5Гц:2Н); 3,46 (т, J=7,5Гц:2Н); 3,59 (м:1Н); 4,08 (м:1Н); 4,42 (с:1Н); 7,20-7,40 (м:8Н)]. N-1-[Біс(4-хлорфеніл)метил]азетидин-3-іл) -N-циклогексиламін може бути отриманий у такий спосіб. До розчину 1,5г 1-[біс(4-хлор феніл)метил]азетидин-3-ону в 25см 3 1,2-дихлоретану додають 0,5г циклогексиламіну, 1г триацетоксиборогідриду натрію і 0,3см 3 100%-ної оцтової кислоти. Після 20 годин перемішування при 20°С додають до реакційної суміші при перемішуванні 20см 3 дихлорметану і 10см 3 води, після чого суміш нейтралізують до рН 7-8 1 н. водяним розчином гідроксиду натрію. Суміш розділяють на фази, органічну фазу висушують над суль фатом магнію і досуха упарюють при 50°С и зниженому тиску (2,7кПа). Одержують 1,8м N-1-[біс(4-хлорфеніл)метил]азетидин-3-іл) -N-циклогексиламін у вигляді пасти кремового кольору, що буде використана як така в наступній стадії. 1-[Біс(4-хлорфеніл)метил]азетидин-3-он може бути отриманий у відповідності до наступної послідовності операцій: до розчину 5,0см 3 оксалілхлориду в 73см 3 охолодженого до -78°С дихлорметану додають розчин 8,1см 3 диметилсульфоксиду в 17,6см 3 дихлорметану. С уміш витримують 5 годин при -78°С и доливають розчин 16,0г 1-[біс(4-хлорфеніл)метил]азетидин-3-ола в 50см 3 дихлорметана. Суміш витримують 5 годин при 78°С, додають по краплях 26,6см 3 триетиламіну і залишають суміш до повернення її температури до кімнатної. Через 16 годин реакційну суміш 4 рази промивають 200см 3 води і потім 200см 3 насиченого розчину хлориду натрію, висушують над сульфатом магнію, фільтрують і досуха упарюють при зниженому тиску (2,7кПа). Отриманий залишок хроматографують на колонці із силікагелем (гранулометрія 0,04-0,06мм, діаметр 9,2см висота 21см), елюючи під тиском 0,5 бар аргону сумішшю етилацетата і циклогексану (40/60 по об'єму) і збираючи фракції об'ємом 200см 3. Фракції 15-25 поєднують і досуха упарюють при зниженому тиску (2,7кПа), одержуючи 8,9г 1-[біс(4-хлорфеніл)метил]азетидин-3-она у вигляді блідо-жовтих кристалів з т.пл.111°С. Приклад 9 N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N-циклопропілметилсульфонамід може бути отриманий повторенням послідовності операцій, описаній в прикладі 8, виходячи з 1,6г N-1-[бic(4-хлор феніл)метил]азетидин-3-іл)-N-циклопропіламіну, 25см 3 дихлорметану, 0,7см 3 триетиламіну, 20мг 4диметиламінопиридину і 0,4см 3 метилсульфонілхлориду і перемішуючи суміш протягом 20 годин при 20°С. Сирий продукт хроматографують на колонці із силікагелем (гранулометрія 0,063-0,2мм, висота 30см, діаметр 2,0см), елюючи під тиском 0,1 бар аргону сумішшю ди хлорметана і метанолу (97/3 по об'єму) і збираючи фракції об'ємом 10см 3. Фракції 6-9 і 10-20 поєднують і досуха упарюють при зниженому тиску (2,7кПа). Отриманий залишок хроматографують на колонці із силікагелем (гранулометрія 0,063-0,200мм, висота 30см, діаметр 2,0см), елюючи під тиском 0,1 бар аргону сумішшю циклогексану і етилацетата (70/30 по об'єму) і збираючи фракції об'ємом 10см 3. Фракції 6-11 поєднують і досуха упарюють при зниженому тиску (2,7кПа). Одержують 0,14г N-{1-[бic(4-хлорфеніл)метил]азетидин-3-іл}-N-циклопропілметилсульфонаміду у вигляді пінистої маси кремового кольору [Спектр ЯМР 1Н (300 МГц, CDCI3, δ у м.д.): 0,79 (м:2Н); 0,95 (м:2Н); 2,11 (м:1Н); 2,84 (с:3Н); 3,17 (т ушир., J=7Гц:2Н); 3,50 (м:2Н); 4,18 (м:1Н); 4,29 (с:1Н); 7,20-7,40 (м:8Н)]. N-1-[Біс(4-хлорфеніл)метил]азетидин-3-іл)-N-циклопропіламін може бути отриманий, як описано в прикладі 8, виходячи з 1,5г 1-[біс(4-хлорфеніл)метил]азетидин-3-ону, 25см 3 1,2-дихлоретану, 0,37см 3 циклопропіламіну, 1г триацетоксиборогідрида натрію і 0,3см 3 100%-ної оцтової кислоти. Одержують 1,6г N-1[біс(4-хлорфеніл)метил]азетидин-3-іл)-N-циклопропіламіну у вигляді бурого масла, яке буде використано як таке в наступній стадії. Приклад 10 N-(1R,2S,4S)-Біцикло[2.2.1]гепт-2-ил-N-{1-[бic(4хлорфеніл)метил]азетидин-3-іл}метилсульфонамід може бути отриманий повторенням послідовності операцій, описаній в прикладі 8, виходячи з 2,0г N-(1R,2S,4S)-біцикло[2.2.1]гепт-2-ил-N-{1-[біс(4хлорфеніл)метил]азетидин-3-іл}аміну, 25см 3 дихлорметану, 0,7см 3 триетиламіну, 20мг 43 диметиламінопіридину і 0,4см метилсульфонілхлориду і перемішуючи суміш протягом 20 годин. Бурий маслянистий залишок хроматографують на колонці із силікагелем (гранулометрія 0,063-0,2мм, висота 30см, діаметр 2,0см), елюючи під тиском 0,1 бар аргону сумішшю дихлорметана і метанолу (97/3 по об'єму) і збираючи фракції об'ємом 10см 3. Фракції 6-18 поєднують і досуха упарюють при зниженому тиску (2,7кПа). Залишок хроматографують на колонці із силікагелем (гранулометрія 0,063-0,2мм, висота 30см, діаметр 2,0см), елюючи під тиском 0,1 бар аргону сумішшю циклогексану і етилацетата (70/30 по об'єму) і збираючи фракції об'ємом 10см 3. Фракції 8-14 поєднують і досуха упарюють при зниженому тиску (2,7кПа). Одержують 0,70г N(1R,2S,4S)-біцикло[2.2.1]гепт-2-ил-N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}метилсульфонаміду у вигляді пінистої маси кремового кольору. [Спектр ЯМР 1Н (300 МГц, CDCI3, δ у м.д.): 1,20-1,75 (м:7Н); 1,84 (т ушир., J=12,5Гц:1Н); 2,29 (м:1Н); 2,35 (м:1Н); 2,82 (с:3Н); 3,35-3,55 (м:3Н); 3,66 (м:1Н); 3,90-4,05 (м:2Н); 4,51 (с:1Н); 7,20-7,45 (м:8Н)]. N-(1R,2S,4S)-Біцикло[2.2.1]гепт-2-ил-N-{1-[бic(4-хлорфеніл)метил]азетидин-3-іл}амін може бути отриманий повторенням послідовності операцій, описаній в прикладі 8, виходячи з 1,5г 1-[біс(4хлорфеніл)метил]азетидин-3-она, 25см 3 1,2-дихлоретану, 1,5г (1R,2S,4S)-біцикло[2.2.1]гептил-3-аміну, 1г триацетоксиборогідриду натрію і 0,3см 3 100%-ної оцтової кислоти. Одержують 2г N-(1R,2S,4S)біцикло[2.2.1]гепт-2-ил-N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}аміну у вигляді бурого масла, яке буде використано як таке в наступній стадії. Приклад 11 N-(1R,2R,4S)-Біцикло[2.2.1]гепт-2-ил-N-{1-[бic(4-хлорфеніл)метил]азетидин-3-іл}метилсульфонамід може бути отриманий повторенням послідовності операцій, описаній в прикладі 8, виходячи з 1,8г N-(1R,2R,4S)біцикло[2.2.1]гепт-2-ил-N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}аміну, 25см 3 дихлорметану, 0,7см 3 3 триетиламіну, 20мг 4-диметиламінопіридину і 0,4см метилсульфонілхлориду і перемішуючи суміш протягом 20 годин. Бурий маслянистий залишок хроматографують на колонці із силікагелем (гранулометрія 0,0630,2мм, висота 30см, діаметр 2,0см), елюючи під тиском 0,1 бар аргону сумішшю циклогексану і етилацетата (60/40 по об'єму) і збираючи фракції об'ємом 10см 3. Фракції 3-12 поєднують і досуха упарюють при зниженому тиску (2,7кПа). Залишок хроматографують на колонці із силікагелем (гранулометрія 0,063-0,2мм, висота 30см, діаметр 2,0см), елюючи під тиском 0,1 бар аргону сумішшю циклогексану і етилацетата (70/30 по об'єму) і збираючи фракції об'ємом 10см 3. Фракції 4-10 поєднують і досуха упарюють при зниженому тиску (2,7кПа). Одержують 0,10г N-(1R,2R,4S)-біцикло[2.2.1]гепт-2-ил-N-{1-[біс(4-хлорфеніл)метил]азетидин-3іл}метилсульфонаміду у вигляді жовтої пінистої маси. [Спектр ЯМР 1Н (300 МГц, CDCI3, δ у м.д.): 1,00-1,85 (м:8Н); 2,14 (м:1Н); 2,33 (м:1Н); 2,82 (с:3Н); 3,40-3,60 (м:4Н); 3,71 (дд ушир., J=8 і 6Гц:1Н); 4,10 (м:1 Н); 4,47 (с:1 Н); 7,20-7,40 (м:8Н)]. N-(1R,2R,4S)-Біцикло[2.2.1]гепт-2-ил-N-{1-[бic(4-хлорфеніл)метил]азетидин-3-іл}амін може бути отриманий повторенням послідовності операцій, описаній в прикладі 8, виходячи з 1,5г 1-[біс(4хлорфеніл)метил]азетидин-3-она, 25см 3 1,2-дихлоретану, 0,6г (1R,2R,4S)-біцикло [2.2.1] гептил-3-аміну, 1,0г триацетоксиборогідриду натрію і 0,3см 3 100%-ної оцтової кислоти. Одержують 1,8г N-(1R,2R,4S)біцикло[2.2.1]гепт-2-ил-N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}аміну у вигляді пасти кремового кольору, що використовують як таку в наступній стадії. Приклад 12 N-[(1-Бензгідрил)азетидин-3-іл]-N-фенілметилсульфонамід може бути отриманий у такий спосіб. До розчину 2г 1-бензгідрил-3-аніліноазетидину в 40см 3 дихлорметана доливають 0,7см 3 метилсульфонілхлориду і потім додають 1,34г триетиламіну. Після перемішування протягом 4 годин 15хв при 20°С реакційну суміш двічі промивають водою й органічну фазу висушують над сульфатом магнію і потім досуха упарюють при 50°С і зниженому тиску (2,7кПа). Отримане каштанового кольору масло хроматографують на колонці із силікагелем (гранулометрія 0,063-0,2мм, висота 26см, діаметр 3,6см), елюючи під тиском 0,5 бар аргону сумішшю циклогексану і етилацетата (70/30 по об'єму) і збираючи фракції об'ємом 50см 3. Фракції 10-15 поєднують і досуха упарюють при зниженому тиску (2,7кПа). Залишок розтирають у диетиловому ефірі, суспензію фільтрують, твердий матеріал віджимають і потім сушать при зниженому тиску (2,7кПа). Одержують 35мг N[(1-бензгідрил)азетидин-3-іл]-N-фенілметилсульфонаміду у вигляді білої твердої речовини. [Спектр ЯМР 1Н (300 МГц, (CD3)2SO d6 з добавкою декількох крапель CD3COOD d4, δ у м.д.): 2,72 (м:2Н); 2,92 (с:3Н); 3,36 (м:2Н); 4,32 (с:1Н); 4,73 (м:1Н);7,10-7.45 (м:15Н)]. 1-бензгідрил-3-аніліноазетидин може бути отриманий повторенням послідовності операцій, описаній в прикладі 8, виходячи з 5г 1-бензгідрилазетидин-3-она, 1,92см 3 аніліну, 74см 3 1,2-дихлоретану, 6,3г триацетоксиборогідриду натрія і 1,2см 3 100%-ної оцтової кислоти. Одержують 8,81г 1-бензгідрил-3аніліноазетидину у ви гляді смоли каштанового кольору, що буде використана як така в наступній стадії. Приклад 13 N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід може бути отриманий у такий спосіб. До розчину 1,23г 1-[біс(4-хлорфеніл)метил]азетидин-3-ілового ефіру метилсульфонової кислоти і 0,66г N-(3,5-дифторфеніл)метилсульфонаміду в 25см 3 діоксану додають 1,0г карбонату цезію. Після 5 годин перемішування при температурі кипіння і потім 20 годин при 20°С до реакційної суміші додають 50см 3 диетилового ефіру і 30см 3 соляного розчину, після чого перемішують і розділяють фази. Органічну фазу висушують над сульфатом магнію, фільтрують і досуха упарюють при 50°С и зниженому тиску (2,7кПа). Отримане жовтогаряче масло хроматографують на колонці із силікагелем (гранулометрія 0,040-0,063мм, висота 25см, діаметр 2,0см), елюючи під тиском 0,5 бар аргону сумішшю циклогексану і етилацетата (65/35 по об'єму) і збираючи фракції об'ємом 10см 3. Фракції 6-10 поєднують і досуха упарюють при зниженому тиску (2,7кПа). Залишок хроматографують на колонці із силікагелем (гранулометрія 0,040-0,063мм, висота 15см, діаметр 1,0см), елюючи під тиском 0,5 бар аргону сумішшю циклогексану і етилацетата (65/35 по об'єму) і збираючи фракції об'ємом 5см 3. Фракцію 7 досуха упарюють при зниженому тиску (2,7кПа). Одержують 0,11г N-{1-[бic(4-хлорфеніл)метил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонаміду у вигляді білого порошку. [Спектр ЯМР 1Н (300 МГц, CDCI3, δ у м.д.): 2,82 (с:3Н); 2,85 (м:2Н); 3,52 (т розщепл., J=7 і 2Гц:2Н); 4,22 (с:1Н); 4,47 (м:1Н); 6,75-6,90 (м:3Н); 7,20-7,35 (м:8Н)]. Метод 2 До розчину 1,41г 1-[біс(4-хлорфеніл)метил]азетидин-3-ола і 0,95г N-(3,5-дифторфеніл)метилсульфонаміду в 100см 3 безводного тетрагідрофурану додають під аргоном 0,78см 3 диетилазодикарбоксилату і 1,31г трифенілфосфіну. Після 16 годин перемішування при 20°С додають 300см 3 етилацетату, реакційну суміш двічі промивають 100см 3 води, висушують над сульфатом магнію і досуха упарюють при зниженому тиску (2,7кПа). Залишок хроматографують на колонці із силікагелем (гранулометрія 0,2-0,063мм, висота 50см, діаметр 4см), елюючи під тиском 0,6 бар аргону сумішшю циклогексану і зтилацетата (75/25 по об'єму) і збираючи фракції об'ємом 125см 3. Фракції 6-12 поєднують і досуха упарюють при зниженому тиску (2,7кПа). Одержують 1,8г твердої речовини, що розчиняють при нагріванні в суміші етилацетат/діізопропіловий ефір (15/2 по об'єму), охолоджують і розбавляють 100см 3 пентану для ініціювання кристалізації. Після відфільтровування і сушіння одержують 1,0г N-{1-[бic(4-хлорфеніл)метил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонаміду у вигляді білих кристалів, що плавляться при 154°С. N-(3,5-Дифторфеніл)метилсульфонамід може бути отриманий у такий спосіб. До розчину 3,5г 3,5дифтораніліну в 75см 3 дихлорметана, повільно додають 2,0см 3 метилсульфонілхлориду, 3,8см 3 триетиламіну і 20мг 4-диметиламінопіридину. Після 20 годин перемішування при 20°С до реакційної суміші додають 20см 3 дихлорметану і 20см 3 води, суміш перемішують і розділяють фази. Органічну фазу висушують над сульфатом магнію, фільтрують і досуха упарюють при зниженому тиску (2,7кПа). Залишок хроматографують на колонці із силікагелем (гранулометрія 0,063-0,200мм, висота 20см, діаметр 2,0см), елюючи під тиском 0,1 бар аргону дихлорметаном і збираючи фракції об'ємом 25см 3. Фракції 14-20 поєднують і досуха упарюють при зниженому тиску (2,7кПа). Одержують 0,66г N-(3,5-дифторфеніл)метилсульфонаміду у вигляді білого порошку. 1-[Біс(4-хлорфеніл)метил]азетидин-3-іловий ефір метилсульфонової кислоти може бути отриманий у такий спосіб. До розчину 12г 1-[біс(4-хлор феніл)метил]азетидин-3-олу в 200см 3 дихлорметана, додають під аргоном протягом 10хв 3,5см 3 метилсульфонілхлориду, о холоджують суміш до + 5°С і протягом 10хв доливають 3,8см 3 піридину. Після 30 годин перемішування при + 5°С і потім 20 годин при 20°С реакційну суміш розбавляють 100см 3 води і 100см 3 дихлорметана, фільтрують і розділяють на фази. Органічну фазу промивають водою, висушують над сульфатом магнію, фільтрують і досуха упарюють при зниженому тиску (2,7кПа). Отримане масло хроматографують на колонці із силікагелем (гранулометрія 0,063-0,200мм, висота 40см, діаметр 3,0см), елюючи під тиском 0,5 бар аргону сумішшю циклогексану і етилацетата (70/30 по об'єму) і збираючи фракції об'ємом 100см 3. Фракції 4-15 поєднують і досуха упарюють при зниженому тиску (2,7кПа). Одержують 6,8г 1-[біс(4-хлорфеніл)метил]азетидин-3-ілового ефіру метилсульфонової кислоти у вигляді жовтого масла. 1-[Біс(4-хлорфеніл)метил]азетидин-3-ол може бути отриманий, використовуючи послідовність операцій, описаній KATRITZKY A.R. із співроб., J. Heterocycl. Chem., 271 (1994), виходячи з 35,5г гідрохлориду [біс(4хлорфеніл)метил]аміну і 11,0см 3 епіхлоргідрину. Гідрохлорид [біс(4-хлорфеніл)метил]аміну може бути отриманий по методу, описаному GRISAR М. із співроб. у J. Med. Chem., 885 (1973). Приклад 14 N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(4,6-диметилпіримід-2-ил)метилсульфонамід може бути отриманий повторенням послідовності операцій, описаній в прикладі 13 (метод 2), виходячи з 0,20г N-(4,6диметилпіримід-2-ил)метилсульфонаміду і 0,308г 1-[біс(4-хлорфеніл)метил]азетидин-3-олу. Після хроматографування на колонці із силікагелем (гранулометрія 0,06-0,04мм, висота 50см, діаметр 2см), елюючи під тиском 0,6 бар аргону дихлорметаном і потім сумішшю дихлорметана з 1% метанолу і збираючи фракції об'ємом 200см 3. Фракції 4-7 поєднують і досуха упарюють при зниженому тиску (2,7кПа). Після кристалізації з діізопропілового ефіру, відфільтровування і сушіння одержують 0,20г N-{1-[біс(4-хлорфеніл)метил]азетидин-3іл}-N-(4,6-диметилпіримід-2-ил)метилсульфонаміду у вигляді білої твердої речовини. [Спектр ЯМР 1Н (300 МГц, CDCI3, δ у м.д.): 2,39 (с:6Н); 2,89 (т ушир., J=7,5 Гц:2Н); 3,51 (с:3Н); 3,77 (м:2Н); 4,27 (с:1Н); 4,77 (м:1Н); 6,73 (с:1Н); 7,20-7,35 (м:8Н)]. N-(4,6-диметилпіримід-2-ил)метилсульфонамід може бути отриманий у такий спосіб. До суміші 1,23г 2аміно-4,6-диметилпіримідина, 0,77см 3 метилсульфонілхлорида і 50мг 4-диметиламінопіримідина, розчиненої в 50см 3 дихлорметана, додають 1,4см 3 триетиламіну при температурі 0°С. Реакційне середовище залишають на 16 годин при кімнатній температурі, двічі промивають 100см 3 води, висушують над суль фатом магнію, фільтрують і досуха упарюють при зниженому тиску (2,7кПа). Одержують 1,0г жовтого порошку, який протягом 1 години обробляють при 100°С 15см 3 10%-ного розчину гідроксиду натрію. Після охолодження реакційну суміш двічі екстрагують 50см 3 дихлорметану. Водяну фазу підкислюють 5см 3 10 н. соляної кислоти до рН 1 і двічі екстрагують 50см 3 дихлорметана. Отримані органічні фази поєднують, промивають 50см 3 води, висушують над сульфатом магнію, фільтрують і упарюють. Одержують 0,20г N-(4,6-диметилпіримід-2ил)метилсульфонаміду у вигляді жовтого порошку. Приклад 15 N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(1,3,4-тіадіазол-2-іл)метилсульфонамід може бути отриманий повторенням послідовності операцій, описаній в прикладі 13 (метод 2), виходячи з 0,10г N-(1,3,4тіадіазол-2-іл)метилсульфонаміду і 0,215г 1-[біс(4-хлорфеніл)метил]азетидин-3-олу. Після хроматографування на колонці із силікагелем (гранулометрія 0,06-0,04мм, висота 50см, діаметр 1см), елюючи під тиском 0,8 бар аргону сумішшю етилацетат/циклогексан 20/80 і потім 40/60 по об'єму і збираючи фракції об'ємом 60см 3. Фракції 26-31 поєднують і досуха упарюють при зниженому тиску (2,7кПа). Після кристалізації з діізопропілового ефіру, відфільтровування і сушіння одержують 40мг N-{1-[біс(4-хлорфеніл)метил]азетидин-3іл}-N-(1,3,4-тіадіазол-2-іл)метилсульфонаміду у вигляді білої твердої речовини. [Спектр ЯМР 1Н (300 МГц, CDCI3, δ у м.д.): 3,01 (с:3Н); 3,09 (т розщепл., J=7 і 1,5Гц:2Н); 3,70 (т розщепл., 3=7 і 1,5Гц:2Н); 4,28 (с:1Н); 4,76 (м:1Н); 7,20-7,35 (м:8Н); 9,01 (с:1Н)]. N-(1,3,4-тіадіазол-2-іл)метилсульфонамід може бути о триманий у такий спосіб. До суміші 2,02г 2-аміно1,3,4-тіадіазолу в 10см 3 піридину додають 1,5см 3 метилсульфонілхлориду. Реакційну суміш залишають на 2 години при кімнатній температурі, додають до неї 60см 3 води і фільтрують. Зібрану водяну фазу підкисляють 1 н. соляною кислотою до рН 2 і двічі екстрагують 50см 3 етилацетату. Ор ганічну фазу 2 рази промивають 50см 3 води, висушують над сульфатом магнію, фільтрують і досуха упарюють при зниженому тиску (2,7кПа), одержуючи 0,1г жовтого порошку. Приклад 16 N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(тіазол-2-іл)метилсульфонамід може бути отриманий повторенням послідовності операцій, описаній в прикладі 15, виходячи з 0,50г N-(тіазол-2іл)метилсульфонаміду і 0,5г 1-[біс(4-хлорфеніл)метил]азетидин-3-олу. Після хроматографування на колонці із силікагелем (гранулометрія 0,06-0,04мм, висота 60см, діаметр 2см), елюючи під тиском 0,9 бар аргону сумішшю етилацетат/циклогексан 20/80 і потім 40/60 по об'єму, збирають фракції об'ємом 30см 3. Фракції 9-12 поєднують і досуха упарюють при зниженому тиску (2,7кПа). Після кристалізації з діізопропілового ефіру, відфільтровування і сушіння одержують 0,21г N-{1-[бic(4-хлорфеніл)метил]азетидин-3-іл}-N-(тіазол-2іл)метилсульфонаміду у вигляді білої твердої речовини. [Спектр ЯМР 1Н (300 МГц, CDCI3, δ в м.д.): 2,95-3,10 (м:2Н); 3,00 (с:3Н); 3,59 (м:2Н); 4,22 (з ушир.:1Н); 4,69 (м:1Н); 7,20-7,35 (м:9Н); 7,60 (м:1Н)]. N-(Тіазол-2-іл)метилсульфонамід може бути отриманий у такий спосіб. До суміші 1,0г 2-амінотіазолу в 10см 3 піридину додають 1,5см 3 метилсульфонілхлориду. Реакційну суміш залишають на 2 години при кімнатній температурі, додають до неї 60см 3 води, фільтрують і збирають твердий матеріал (0,35г). Зібрану водяну фаз у підкисляють 1 н. соляною кислотою до рН 2 і двічі екстрагують 40см 3 етилацетату. Органічну фазу 2 рази промивають 50см 3 води, висушують над сульфатом магнію, фільтрують і досуха упарюють при зниженому тиску (2,7кПа), одержуючи 0,15г білої твердої речовини зі спектральними характеристиками близькими до характеристик відфільтрованої твердої речовини, що відповідає суміші Ν-(тіазол-2іл)метилсульфонаміда і N-(тіазол-2-іл)-ди(метилсульфоніл)имида, що використовують як такий у наступній стадії. Приклад 17 N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3-гідроксифеніл)метилсульфонамід може бути отриманий у такий спосіб. До суміші 0,5г N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3метоксифеніл)метилсульфонаміду в 20см 3 ди хлорметана додають по краплях при 2°С 7,63см 3 1Μ розчина триброміду бора. Реакційну суміш залишають на 20 годин при кімнатній температурі, виливають на лід і екстрагують 60см 3 дихлорметана. Органічну фазу тричі промивають 80см 3 води і потім двічі 80см 3 насиченого водяного розчину хлориду натрію, висушують над сульфатом магнію, фільтрують і досуха упарюють при зниженому тиску (2,7кПа). Одержують 0,33г білої пінистої маси, що забирають ацетонітрилом, фільтрують і сушать, одержуючи 0,20г білої твердої речовини. [Спектр ЯМР 1Н (300 МГц, CDCI3, δ у м.д.): 2,81 (с:3Н); 2,86 (т ушир., J=7,5Гц:2Н); 3,50 (т ушир., J=7,5Гц:2Н); 4,20 (с:1Н); 4,53 (м:1Н); 5,36 (м:1Н); 6,70-6,85 (м:3Н); 7,15-7,35 (м:9Н)]. Приклад 18 N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3-метоксифеніл)метилсульфонамід може бути отриманий повторенням послідовності операцій, описаній в прикладі 15, виходячи з 1,58г N-(3 метоксифеніл)метилсульфонаміду і 2,0г 1-[біс(4-хлорфеніл)метил]азетидин-3-олу. Після хроматографування на колонці із силікагелем (гранулометрія 0,06-0,04мм, висота 24см, діаметр 7,8см), елюючи під тиском 0,7 бар аргону сумішшю етилацетат/циклогексан 50/50 і потім 40/60 по об'єму, збирають фракції об'ємом 100см 3. Фракції 7-10 поєднують і досуха упарюють при зниженому тиску (2,7кПа) (2,05г). Після кристалізації з діізопропілового ефіру, відфільтровування і сушіння одержують 0,21г N-{1-[бic(4-хлорфеніл)метил]азетидин-3іл}-N-(3-метоксифеніл)метилсульфонаміду. N-(3-Метоксифеніл)метилсульфонамід може бути отриманий у такий спосіб. До суміші 5,0г 3метоксианіліна в 150см 3 піридину додають при 3°С 3,14см 3 метилсульфонілхлориду. Залишають реакційне середовище на 20 годин при кімнатній температурі, додають до нього 200см 3 води і 400см 3 етилацетату і розділяють на фази. Органічну фазу 3 рази промивають 400см 3 води і 400см 3 насиченого розчину хлориду натрію, висушують над сульфатом магнію, фільтрують і досуха упарюють при зниженому тиску (2,7кПа). Після хроматографування на колонці із силікагелем (гранулометрія 0,06-0,04мм, висота 23см, діаметр 7,8см), елюючи під тиском 0,7 бар аргону сумішшю етилацетат/циклогексан 25/75 по об'єму, збирають фракції об'ємом 100см 3. Фракції 24-36 поєднують і досуха упарюють при зниженому тиску (2,7кПа), одержуючи 6,21г N(3-метоксифеніл)метилсульфонаміду у вигляді жовтогарячого масла. Приклад 19 N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3-гідроксиметилфеніл)метилсульфонамід може бути отриманий у такий спосіб. До суміші 0,5г етилового ефіру N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N(метилсульфоніл)-3-амінобензойної кислоти в 20см 3 толуолу додають по краплях при -50°С 1,46см 3 20%-ного толуольного розчину гідриду діізопропілалюмінія. Реакційне середовище залишають на 1,5 години при 0°С и 1,5 години при 20°С, охолоджують до 0°С и повільно додають 20см 3 води. Після відфільтровування осаду й екстрагування його етилацетатом органічну фазу 2 рази промивають 80см 3 води і потім 80см 3 насиченого водяного розчину хлориду натрію, висушують над сульфатом магнію, фільтрують і досуха упарюють при зниженому тиску (2,7кПа). Одержують 0,46г масла, що хроматографують на колонці із силікагелем (гранулометрія 0,06-0,4мм, висота 16см, діаметр 4,0см), елюючи під тиском 0,7 бар аргону сумішшю е тилацетата/циклогексан (60/40 по об'єму) і збираючи фракції об'ємом 20см 3. Фракції 72-76 поєднують і досуха упарюють при зниженому тиску (2,7кПа). Одержують 0,20г N-{1-[бic(4-хлорфеніл)метил]азетидин-3-іл}-N-(3-гідроксиметилфеніл)метилсульфонаміду у вигляді білої твердої речовини. [Спектр ЯМР 1Н (300 МГц, CDCI3, δ у м.д.): 1,80 (м:1Н); 2,83 (с:3Н); 2,87 (м:2Н); 3,52 (м:2Н); 4,21 (з ушир.:1Н); 4,60 (м:1Н); 4,74 (д ушир., J=4Гц:2Н); 7,10-7,45 (м:12Н)]. Приклад 20 Етиловий ефір N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(метилсульфоніл)-3-амінобензойної кислоти може бути отриманий повторенням послідовності операцій, описаній в прикладі 15, виходячи з 1,58г етилового ефіру N-(метилсульфоніл)-3-амінобензойної кислоти і 2,0г 1-[біс(4-хлорфеніл)метил]азетидин-3-олу. Після хроматографування на колонці із силікагелем (гранулометрія 0,06-0,04мм, висота 24см, діаметр 7,8см), елюючи під тиском 0,7 бар аргону сумішшю етилацетат/циклогексан 50/50 і потім 40/60 по об'єму, збирають фракції об'ємом 100см 3. Фракції 7-10 поєднують і досуха упарюють при зниженому тиску (2,7кПа), одержуючи 2,0г жовтого масла. Етиловий ефір N-(метилсульфоніл)-3-амінобензойної кислоти може бути отриманий у такий спосіб. До суміші 5,0г етил-3-аміно бензоата в 150см 3 піридину додають при 3°С 2,35см 3 метилсульфонілхлориду. Залишають реакційне середовище на 20 годин при кімнатній температурі, додають до неї 200см 3 води і 400см 3 етилацетату і розділяють на фази. Органічну фазу промивають 3 рази 400см 3 води і 400см 3 насиченого розчину хлориду натрію, висушують над сульфа том магнію, фільтрують і досуха упарюють при зниженому тиску (2,7кПа). Після хроматографування на колонці із силікагелем (гранулометрія 0,06-0,04мм, висота 25см, діаметр 7,8см), елюючи під тиском 0,7 бар аргону сумішшю етилацетат/циклогексан 25/75 по об'єму, збирають фракції об'ємом 100см 3. Фракції 27-36 поєднують і досуха упарюють при зниженому тиску (2,7кПа), одержуючи 5,24г етилового ефіру N-(метилсульфоніл)-3-амінобензойної кислоти у вигляді жовтогарячого масла. Приклад 21 N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(1-ізобутилпіперид-4-ил)метилсульфонамід може бути отриманий у такий спосіб. До розчину 0,47г N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(1-піперид-4ил)метилсульфонаміду в 20см 3 дихлорметана додають 0,11см 3 ізомасляного альдегіду, 0,057см 3 100%-ної оцтової кислоти і 320мг триацетоксиборогідриду натрію. Після 20 годин перемішування при 20°С до реакційної суміші додають 50см 3 насиченого водяного розчину гідрокарбонату натрію і розділяють фази. Органічну фазу висушують над сульфатом магнію, фільтрують і досуха упарюють при зниженому тиску (2,7кПа). Залишок очищають хроматографуванням на колонці із силікагелем (гранулометрія 0,063-0,200мм, висота 20см, діаметр 2см), елюючи під тиском 0,5 бар аргону сумішшю циклогексану і етилацетата (40/60 по об'єму) і збираючи фракції об'ємом 30см 3. Фракції 3-15 поєднують і досуха упарюють при зниженому тиску (2,7кПа). Одержують 0,22г N-{1-[бic(4-хлорфеніл)метил]азетидин-3-іл}-N-(1-ізобутилпіперид-4-ил)метилсульфонаміду у вигляді білої пінистої маси. [Спектр ЯМР 1Н (300 МГц, CDCI3, δ у м.д.): 0,87 (д, J=7Гц:бн); 1,60-1,90 (м:5Н); 1,93 (т ушир., J=11,5Гц:2Н); 2,03 (д, J=7,5Гц:2Н); 2,84 (с:3Н); 2,89 (д ушир., J=11,5Гц:2Н); 3,38 (т ушир., J=7Гц:2Н); 3,47 (т ушир., J=7Гц:2Н); 3,62 (м:1Н); 4,08 (м:1Н); 4,43 (с:1Н); 7,20-7,40 (м:8Н)]. {1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(1-піперид-4-ил)метилсульфонамід може бути отриманий у такий спосіб. До розчину 19г N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(1-трет-бутоксикарбоніл-піперид-4ил)метилсульфонаміду в 199см 3 діоксана повільно доливають 50см 3 6 н. розчину хлористоводневої кислоти в діоксані. Після 20 годин перемішування при 20°С реакційну суміш упарюють при 50°С і зниженому тиску (2,7кПа). Залишок забирають 200см 3 етилацетата і 200см 3 води. Водяну фазу підлужують 4 н. водяним розчином гідроксиду натрію і потім екстрагують 200см 3 етилацетата. Цю органічну фазу висушують над сульфатом магнію, фільтрують і досуха упарюють при 50°С і зниженому тиску (2,7кПа). Одержують 15,5г N-{1 [біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(піперид-4-ил)метилсульфонаміду у ви гляді пінистої маси кремового кольору. N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(1-трет-бутоксикарбоніл-піперид-4-ил)метилсульфонамід може бути отриманий у такий спосіб. До розчину 14,7г 4-{1-[біс(4-хлорфеніл)метил]азетидин-3-іламіно}-(1трет-бутилкарбоніл)піперидину в 250см 3 дихлорметана повільно додають 4,60см 3 метилсульфонілхлорида, потім 4,60см 3 триетиламіна і 100мг 4-диметиламінопіридину. Після 20 годин перемішування при 20°С до реакційної суміші додають 200см 3 насиченого водяного розчину гідрокарбонату натрію, після чого суміш перемішують протягом 30хв і розділяють на фази. Органічну фазу висушують над сульфатом магнію, фільтрують і досуха упарюють при зниженому тиску (2,7кПа). До отриманої пінистої маси, забраної 250см 3 дихлорметана, знову повільно додають 4,60см 3 метилсульфонілхлорида, потім 4,60см 3 триетиламіна і 100мг 4-диметиламінопіридину. Після 20 годин перемішування при 20°С до реакційної суміші додають 200см 3 насиченого водяного розчину гідрокарбонату натрію, після чого суміш перемішують протягом 30хв і розділяють на фази. Органічну фазу висушують над сульфатом магнію, фільтрують і досуха упарюють при зниженому тиску (2 ,7кПа). Залишок очищають хроматографією на колонці із силікагелем (гранулометрія 0,0630,200мм, висота 35см, діаметр 5см), елюючи під тиском 0,5 бар аргону сумішшю циклогексану і етилацетата (70/30 по об'єму) і збираючи фракції об'ємом 250см 3. Фракції 4-18 поєднують і досуха упарюють при зниженому тиску (2,7кПа). Одержують 19г N-{1-[бic(4-хлорфеніл)метил]азетидин-3-іл}-N-(1-третбутилкарбонілпіперид-4-ил)метилсульфонаміду у вигляді спіненої маси кремового кольору, що буде використана як така в наступній стадії. 4-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іламіно}-(1-трет-бутоксикарбоніл)піперидин може бути отриманий у такий спосіб. До розчину 9,22г 1-[біс(4-хлорфеніл)метил]азетидин-3-іламіну в 300см 3 дихлорметана додають 6,58г 1-трет-бутоксикарбонілпіперидин-4-она. До охолодженої до +5°С суміші додають двома порціями 9,54г триацетоксиборогідриду натрію і потім доливають 1,72см 3 100%-ної оцтової кислоти. Після 20 годин перемішування при 20°С до реакційної суміші повільно додають 500см 3 насиченого водяного розчину гідрокарбонату натрію, після чого суміш добре перемішують і розділяють на фази. Органічну фазу висушують над сульфатом магнію, фільтрують і досуха упарюють при 50°С и зниженому тиску (2,7кПа). Одержують 15г 4{1-[біс (4-хлорфеніл)метил]азетидин-3-іламіно}- (1-трет-бутоксикарбоніл)піперидину у вигляді спіненої маси кремового кольору, що буде використана як така в наступній стадії. Приклад 22 N-Бензил-N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}амін: До розчину 369мг 1-[біс(4хлорфеніл)метил]азетидин-3-іламіну в 15см 3 дихлорметана додають при кімнатній температурі в атмосфері аргону 0,134см 3 бензальдегіду. Суміш охолоджують до 0°С, після чого послідовно додають 382мг триацетоксиборогідриду натрію і потім 70мм 3 оцтової кислоти. Після 16 годин перемішування при кімнатній температурі суміш вливають у 50см 3 насиченого водяного розчину гідрокарбонату натрію, після чого двічі екстрагують 25см 3 дихлорметану. Об'єднані органічні фази висушують над сульфа том магнію, фільтрують і досуха упарюють при зниженому тиску (2,7кПа). Отриманий залишок очищають флеш-хроматографією на колонці із силікагелем [елюент: дихлорметан/метанол (95/5 по об'єму)]. Одержують 0,29г N-бензил-N-{1-[Біс(4хлорфеніл)метил]азетидин-3-іл}аміну у вигляді безбарвного масла. [Спектр ЯМР 1Н (300 МГц, CDCI3; δ у м.ч.): 2,71 (т ушир., J=7Гц:2Н); 3,42 (м:2Н); 3,49 (м:1Н); 3,70 (с:2Н); 4,25 (с:1Н); 7,20-7,40 (м:13Н)]. 1-[Біс(4-хлорфеніл)метил]азетидин-3-іламін може бути отриманий у такий спосіб. До 27г 1-[біс(4хлорфеніл)метил]азетидин-3-ілового ефіру метилсульфонової кислоти, поміщеної в попередньо охолоджений до -60°С автоклав, додають 400см 3 суміші метанолу і рідкого аміаку (50/50 за об'ємом). Реакційне середовище перемішують після цього 24 години при 60°С, потім залишають на повітрі для випарювання аміаку і, нарешті, насухо випаровують при зниженому тиску (2,7кПа). Залишок забирають 500см 3 0,37 н. водного розчину гідроксиду натрію і чотири рази екстрагують 500см 3 діетилового ефіру. Об'єднані органічні фази послідовно промивають два рази 100см 3 води і 100см 3 насиченого розчину хлориду натрію, висушують над сульфатом магнію, фільтрують і насухо випаровують при зниженому тиску (2,7кПа). Отриманий залишок очищають флешхроматографією на колонці із силікагелем [елюент: дихлорметан/метанол (95/5 за об'ємом)]. Одержують 14,2г 1-[біс(4-хлорфеніл)метил]азетидин-3-іламіну у виді масла, що застигає з утворенням твердої речовини кремового кольору. Приклад 23 N-Бензил-N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}метилсульфонамід До розчину 120мг N-бензил-N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}аміну в 5см 3 дихлорметану додають при кімнатній температурі в атмосфері аргону 104мм 3 триетиламіну. Суміш охолоджують до 0°С та потім додають 46,4мм 3 метилсульфонілхлориду і перемішують 16 годин при кімнатній температурі, після чого розбавляють 20см 3 дихлорметану і двічі промивають 15см 3 дистильованої води. Органічну фазу висушують над сульфатом магнію, фільтрують і насухо випарюють при зниженому тиску (2,7кПа) з утворенням лаку, що кристалізують розтиранням у метанолі. Одержують 42мг N-бензил-N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}метилсульфонаміду у виді порошку кремового кольору, що плавиться при 171°С. Приклад 24 N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3,5-дифторбензил)амін може бути отриманий як у прикладі 22, але з використанням 188мг 3,5-дифторбензальдегіду і 369мг 1-[біс(4-хлорфеніл)метил]азетидин-3-іламіну і 382мг триацетоксиборогідриду натрію без очищення флеш-хроматографією. Одержують 0,48г N-{1-[біс(4хлорфеніл)метил]азетидин-3-іл}-N-(3,5-дифторбензил)амін у виді безбарвної олії. [Спектр ЯМР 1Н (300 Мгц, CDCI3 , δ в м.ч.): 2,73 (м:2Н); 3,40-3,55 (м:3Н); 3,70 (с:2Н); 4,26 (с:1Н); 6,69 (тт, J=9 і 2Гц:1Н); 6,83 (м:2Н); 7,20-7,35 (м:8Н)]. Приклад 25 N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3,5-дифторбензил)метилсульфонамід До розчину 433мг N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3,5-дифторбензил)аміну в 30см 3 дихлорметану додають при кімнатній температурі в атмосфері аргону 347мм 3 триетиламіну. Суміш охолоджують до 0°С та потім додають розчин 46,4мм 3 метилсульфонілхлориду в 5см 3 дихлорметану і перемішують 1 годину при кімнатній температурі, після чого реакційну суміш розбавляють 20см 3 дихлорметану і двічі промивають 15см 3 дистильованої води. Органічну фазу висушують над сульфатом магнію, фільтрують і насухо випарюють при зниженому тиску (2,7кПа). Залишок вводять у виді етанольного розчину в патрон Bond Elut® SCX (10г), послідовно елююя метанолом і 1Μ розчином аміаку в метанолі. Аміачні фракції поєднують і насухо випарюють при зниженому тиску (2,7кПа), одержуючи в такий спосіб 0,44г N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3,5-дифторбензил)метилсульфонаміду у виді пінистої маси кремового кольору. [Спектр ЯМР 1Н (300 Мгц, CDCI3, δ у м.ч.): 2,81 (с:3Н); 3,02 (т ушир., J=7,5Гц:2Н); 3,38 (т ушир., J=7,5Гц:2Н); 4,23 (с:1Н); 4,40 (м:1Н); 4,54 (с:2Н); 6,75 (тт, J=9 і 2Гц:1Н); 6,95 (м:2Н); 7,25 (м:8Н)]. Приклад 26 N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-ил}-N-(3,5-дифторбензил)ацетамід До розчину 2г N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3,5-дифторбензил)аміну в 75см 3 дихлорметану додають при кімнатній температурі в атмосфері аргону 1,6см 3 триетиламіну. Суміш охолоджують до 0°С та потім додають по краплях розчин 0,66см 3 ацетилхлориду і перемішують 16 годин при кімнатній температурі, після чого реакційну суміш розбавляють 50см 3 дихлорметану і двічі промивають 20см 3 дистильованої води. Органічну фазу висушують над сульфатом магнію, фільтрують і насухо випарюють при зниженому тиску (2,7кПа). Отриманий залишок очищають флеш-хроматографією на колонку із силікагелем [елюент: дихлорметан/метанол (98/2 за об'ємом). Одержують 1,2г N-{1-[бic(4-хлорфеніл)метил]азетидин-3-іл}N-(3,5-дифторбензил)ацетаміду у виді безбарвної олії. [Спектр ЯМР 1Н (300 Мгц, CDCI3 , δ у м.ч.), спостерігають суміш ротамерів: 2,06 і 2,14 (2с:3Н у сумі); 2,97 (м:2Н); 3,43 (м:2Н); 4,20 і 4,25 (2с:1Н в сумі); 4,54 і 4,75-4,80 (м:1Н в сумі); 4,68 і 4,78 (2с ушир.:2Н в сумі); 6,70 (м:3Н); 7,24 (з ушир.:8Н)]. Приклад 27 N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(пірид-4-илметил)метилсульфонамід До розчину 398мг N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(пірид-4-илметил)аміну в 8см 3 дихлорметану додають при кімнатній температурі в атмосфері аргону 346мм 3 триетиламіну. Реакційну суміш охолоджують до 0°С, додають 155мм 3 метилсульфонілхлориду, перемішують 3 години при кімнатній температурі, розбавляють 35см 3 дихлорметану і двічі промивають 20см 3 дистильованої води. Органічну фазу висушують над сульфатом магнію, фільтрують і насухо випарюють при зниженому тиску (2,7кПа). Отриманий залишок очищають флеш-хроматографією на колонці із силікагелем [елюент: дихлорметан/метанол (97/3 за об'ємом)]. Одержують 288мг N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(пірид-4илметил)метилсульфонаміду у виді пінистої маси кремового кольору. [Спектр ЯМР 1Н (300 Мгц, CDCI3, δ у м.ч.): 2,83 (с:3Н); 3,02 (т ушир., J=7,5Гц:2Н); 3,40 (т ушир., J=7,5Гц:2Н); 4,23 (с:1Н); 4,43 (м:1Н); 4,57 (с:2Н); 7,20-7,35 (м:8Н); 7,32 (д ушир., J=5,5Гц:2Н); 8,60 (д ушир., J=5,5Гц:2Н)]. Приклад 28 N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(пірид-4-илметил)амін може бути отриманий у такий спосіб. До розчину 369мг 1-[біс(4-хлорфеніл)метил]азетидин-3-іламіну в 15см 3 дихлорметану додають при кімнатній температурі в атмосфері аргону 0,126см 3 4-піридоксалю. Реакційну суміш охолоджують до 0°С та потім послідовно додають 382мг триацетоксиборогідриду натрію і потім 70мм 3 оцтової кислоти. Після 72 годин перемішування при кімнатній температурі суміш вливають у 100см 3 насичені водні розчини гідрокарбонату натрію, після чого двічі екстрагують 100см 3 дихлорметану. Об'єднані органічні фази промивають 50см 3 дистильованої води, висушують над сульфатом магнію, фільтрують і насухо випарюють при зниженому тиску (2,7кПа). Залишок вводять у виді розчину в 5см 3 метанолу в патрон Bond Elut® SCX (10г), послідовно елююючи 50см 3 метанолу і 60см 3 1Μ розчином аміаку в метанолі. Аміачні фракції поєднують і насухо випарюють при зниженому тиску (2,7кПа), одержуючи в такий спосіб 0,48г Ν-{1-[біс(4хлорфеніл)метил]азетидин-3-іл}-N-(пірид-4-илметил)амін у виді безбарвної олії. Приклад 29 N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(пірид-3-илметил)метилсульфонамід Повторюючи послідовність операцій приклада 27, але виходячи з 380мг N-{1-[біс(4хлорфеніл)метил]азетидин-3-іл}-N-(пірид-3-илметил)аміну, одержують 319мг N-{1-[біс(4хлорфеніл)метил]азетидин-3-іл}-N-(пірид-3-илметил)метилсульфонаміду у виді пінистої маси кремового кольору. [Спектр ЯМР 1Н (300 Мгц, CDCI3, δ у м.ч.): 2,80 (с:3Н); 3,02 (т розщепл., J=7 і 1,5 Гц:2Н); 3,38 (т розщепл., J=7 і 1,5Гц:2Н); 4,22 (с:1Н); 4,35 (м:1Н); 4,56 (с:2Н); 7,23 (з ушир.:8Н); 7,31 (дд, J=8 і 5Гц:1Н); 7,80 (д ушир., J=8Гц:1Н); 8,57 (дд, J=5 і 1,5Гц:1Н); 8,63 (д ушир., J=l,5Гц:1Н)]. Приклад 30 N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(пірид-3-илметил)амін може бути отриманий як у прикладі 28, але виходячи з 0,124см 3 3-піридоксалю, 0,36г 1-[біс(4-хлорфеніл)метил]азетидин-3-іламіну і 0,38г триацетоксиборогідриду натрію. Одержують у такий спосіб 0,44г N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N(пірид-3-илметил)аміну у виді безбарвної олії. Приклад 31 N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(1,1-діоксо-1Н-1-l6-бензо[d]ізотіазол-3-іл)амін До 386мг 1-[біс(4-хлорфеніл)метил]азетидин-3-ілового ефіру метилсульфонової кислоти в 10см 3 диметилформаміду додають 182мг 1,2-бензізотіазол-3-амін-1,1-діоксиду і 326мг карбонату цезію. Після цього реакційне середовище перемішують 9 годин при 100°С та насухо випарюють при зниженому тиску (2,7кПа). Залишок чотири рази промивають 5см 3 киплячої дистильовані води, розбивають перемішуванням у 5см 3 дистильованої води при кімнатній температурі, потім відфільтровують і очищають флеш-хроматографією на колонці із силікагелем [елюент: дихлорметан/метанол (98/2 за об'ємом)]. Одержують 53мг N-{1-[бic(4хлорфеніл)метил]азетидин-3-іл}-N-(1,1-діоксо-1Н-1-l6-бензо[d]ізотіазол-3-іл)аміну у виді пастоподібного продукту. [Спектр ЯМР 1Н (300 Мгц, CDCI3, δ у м.ч.): 3,17 (м:2Н); 3,61 (т ушир., J=7,5Гц:2Н); 4,37 (с:1Н); 4,75 (м:1Н); 6,30-6,40 (м:1Н); 7,20-7,35 (м:8Н); 7,62 (д ушир., J=7,5Гц:1Н); 7,69 (т ушир., J=7,5Гц:1Н); 7,76 (т ушир., J=7,5Гц:1Н); 7,93 (д ушир., J=7,5Гц:1Н)]. 1,2-бензізотіазол-3-амін-1,1-діоксид може бути отриманий за методом, описаному Stoss P. із співавт., Chem. Ber. (1975), 108 (12), 3855 - 63. Приклад 32 N-{1-[Біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3,5-дифторфеніл)-N'-трет-бутилоксикарбонілсульфамід може бути отриманий у такий спосіб. До розчину 0,095см 3 трет-бутилового спирту в 2см 3 безводного дихлорметану додають 0,048см 3 хлорсульфонілізоціанату, перемішують 2хв і послідовно додають 0,21г N-{1[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3,5-дифторфеніл)аміну в 1,25см 3 безводного дихлорметану і потім 0,084см 3 триетиламіну. Після перемішування протягом 1 годин при температурі близькій до 20°С додають при швидкому перемішуванні 2см 3 насиченого розчину бікарбонату натрію. Реакційну суміш розділяють на фази, висушують над сульфатом магнію, фільтрують і насухо випарюють при 50°С та зниженому тиску (2,7кПа). Отриманий залишок хроматографують у патроні Varian (6см 3), що містить 3г тонкого силікагелю (0,0400,063мм), вводячи і елююючи сумішшю петролейний ефір/етилацетат за допомогою насосу Duramat і збираючи фракції обсягом 2см 3. Фракції 6-17 поєднують і насухо випарюють при зниженому тиску (2,7кПа) і 40°С протягом 2 годин. Одержують у такий спосіб 61мг N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}-N-(3,5дифторфеніл)-N'-трет-бутилоксикарбонілсульфаміду у виді білої пінистої маси. [Спектр ЯМР 1Н (400 Мгц, CDCI3, δ у м.ч.): 1,47 (с:9Н); 2,77 (т ушир., J=8Гц:2Н); 3,52 (м:2Н); 4,19 (с:1Н); 5,06 (м:1Н); 6,75 - 6,90 (м:3Н); 7,15 - 7,35 (м:8Н)]. Приклад 33 (RS)-N-{1-[(4-хлорфеніл)піридин-3-ілметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід може бути отриманий у такий спосіб. До суміші 0,2г 3-[бром-(4-хлорфеніл)метил]піридину і 0,22г гідрохлориду Nазетидин-3-іл-N-(3,5-дифторфеніл)метилсульфонаміду в 10см 3 ацетонітрилу додають 0,2г карбонату калію і 23мг йодиду калію, після чого кип'ятять суміш протягом 3 годин. Після додавання 0,2г карбонату калію кип'ятять суміш ще 15 годин. Після охолодження до 21°С видаляють фільтрацією нерозчинний матеріал і насухо випарюють фільтрат при 40°С та тиску 2,7кПа. Одержують 170мг безбарвного лаку, що очищають хроматографією в патроні із силікагелем (SIL-020-005, FlashPack, Jones Chromatography Limited, New Road, Hengoed, Mid Glamorgan, CF82 8AU, Великобританія), елююючи сумішшю циклогексан/етилацетат 1/1 (6см 3/хв, фракції по 5см 3). Фракції з Rf=5/57 (циклогексан/етилацетат, пластинка із силікагелем, Merck 1.05719, Merck Kga, 64271 Darmstadt, Німеччина) поєднують і насухо випарюють при тиску 2,7кПа і 40°С, що дає 100мг (RS)-N-{1-[(4-хлорфеніл)піридин-3-ілметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонаміду, що плавиться при 110°С. [Спектр ЯМР 1Н (300 МГц, (CD3)2SO d6, δ у м.ч.): 2,77 (м:2Н); 2,98 (с:3Н); 3,38 (м:2Н); 4,50 (с:1Н); 4,70 (м:1Н); 7,11 (м:2Н); 7,20-7,40 (м:2Н); 7,34 (д, J=8Гц:2Н); 7,41 (д, J=8Гц:2Н); 7,72 (д ушир., J=8Гц:1Н); 8,40 (дд, J=5 і 1,5Гц:1Н); 8,58(д, J=1,5Гц:1Н)]. Обидва ізомери (RS)-N-{1-[(4-хлорфеніл)піридин-3-ілметил]азетидин-3-іл}-N-(3,5дифторфеніл)метилсульфонаміду можуть бути розділені на нерухомої хіральної фазі CHIRACEL OD. Перший ізомер: Спектр ЯМР 1Н (300 Мгц, CDCI3, δ у м.ч.): 2,82 (с:3Н); 2,87 (м:2Н); 3,53 (м:2Н); 4,29 (с:1Н); 4,47 (м:1Н); 6,80 (м:3Н); 7,19 (дд, J=8 і 5Гц:2Н); 7,20-7,35 (м:4Н); 7,62 (д ушир., J=8Гц:1Н); 8,45 (д ушир, J=5Гц:1Н); 8,59 (з ушир.:1Н)]. Другий ізомер: Спектр ЯМР 1Н (300 Мгц, CDCI3, δ у м.ч.): 2,82 (с:3Н); 2,87 (м:2Н); 3,54 (м:2Н); 4,29 (с:1Н); 4,48 (м:1Н); 6,80 (м:3Н); 7,19 (дд, J=8 і 5Гц:1Н); 7,25-7,35 (м:4Н); 7,62 (дт, J=8 і 2Гц:1Н); 8,46 (дд, J=5 і 2Гц:1Н); 8,59 (д ушир., J=2Гц:1Н)]. Гідрохлорид N-азетидин-3-іл-N-(3,5-дифторфеніл)метилсульфонаміду може бути отриманий у такий спосіб. У 500см 3 гідрогенізаторі гідрують протягом 4 годин розчин 1г N-(1-бензгідрилазетидин-3-іл)-N-(3,5дифторфеніл)метилсульфонаміду в суміші 2,5см 3 1Μ солянії кислоти і 0,41см 3 оцтової кислоти в присутності 0,161г гідроксиду паладію під тиском 30 бар водню. Каталізатор видаляють фільтрацією через шар целіту, після чого фільтрат насухо випарюють при 40°С и тиску 2,7кПа, одержуючи 630мг Ν-азетидин-3-іл-N-(3,5дифторфеніл)метилсульфонаміду, що плавиться при 216°С. N-(1-бензгідрилазетидин-3-іл)-N-(3,5-дифторфеніл)метилсульфонамід може бути отриманий повторенням послідовності операцій, описаної в прикладі 13 (метод 2), у такий спосіб. До розчину 2г 1-бензгідрилазетидин3-олу в 100см 3 тетрагідрофурану послідовно додають 0,86г N-(3,5-дифторфеніл)метилсульфонаміду, 3,28г трифенілфосфіну і потім 2мл діетилазодикарбоксилату, спостерігається підвищення температури від 22 до 29°С, а також утворення осаду після завершення додавання діетилазодикарбоксилату. Суміш залишають на 20 годин при 22°С, видаляють осад фільтрацією і насухо випарюють фільтрат при 40°С та тиску 2,7кПа. Залишок 20хв розтирають з 5см 3 метанолу при 21°С, одержуючи 1,07г N-(1-бензгідрил-азетидин-3-іл)-N-(3,5дифторфеніл)метилсульфонаміду в виді білої аморфної твердої речовини. 1-бензгідрилазетидин-3-ол може бути отриманий відповідно до послідовності операцій, описаної KATRITZKY A.R. зі співроб., J. Heterocycl. Chem.,271 (1994). 3-[Бром-(4-хлорфеніл)метил]піридин одержують у такий спосіб. До 1,5г (4-хлорфеніл)пірид-3-илметанолу додають 3,5см 3 48%-ого розчину бромистоводневої кислоти в оцтовій кислоті і 1см 3 ацетилброміду. Отриману в такий спосіб суміш, що має бурштиновий колір, кип'ятять 4 години, потім охолоджують до 20°С та насухо випарюють при 40°С тиску 2,7кПа, одержуючи 1,53г 3-[бром-(4-хлорфеніл)метил]піридину (Rf=75/90, 254 нм, пластинки із силікагелем, тип 1.05719, Merck Kga, 64271 Darmstadt, Німеччина). (4-Хлорфеніл)пірид-3-илметанол одержують у такий спосіб. До розчину 3г 3-піридоксаля в тетрагідрофурані при 5°С додають 20см 3 1Μ розчину 4-хлорфенілмагнійброміду в діетиловому е фірі. Після охолодження до 20°С продовжують реакцію протягом 15 годин при перемішуванні. Після цього додають 20см 3 насиченого розчину хлориду амонію і потім 20см 3 етилацетату. С уміш розділяють на фази й органічні фази екстрагують додатковими 20см 3 етилацетату. Органічні екстракти поєднують і висушують над сульфатом магнію, після чого насухо випарюють при 40°С та тиску 2,7кПа. Отриманий залишок хроматографують на силікагелі (Amicon, 20-45 mм, 50г силікагелю, стовпчик діаметром 5см), елююючи сумішшю від 80/20 до 50/50 під тиском аргону 0,4 бар. Фракції, що містять сполуку з Rf=13/53 (пластинки із силікагелем, Merck 1.05719, Merck Kga, 64271 Darmstadt, Німеччина) поєднують і насухо випарюють при 40°С тиску 2,7кПа, одержуючи 2,53г (4-хлорфеніл)пірид-3-илметанолу. Приклад 34 N-{1-[Біс(4-фторфеніл)метил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід одержують у такий спосіб. До суміші 0,2г 4,4'-дифторбензгідрилхлориду і 0,26г гідрохлориду N-азетидин-3-іл-N-(3,5дифторфеніл)метилсульфонаміду в 10см 3 ацетонітрилу додають 0,36г карбонату калію і 27мг йодиду калію, після чого кип'ятять суміш протягом 3 годин. Після охолодження до 21°С видаляють фільтрацією нерозчинний матеріал і насухо випарюють суміш при 40°С та тиску 2,7кПа. Залишок розтирають з 30см 3 етилацетату і видаляють твердий матеріал фільтрацією. Фільтрат насухо випарюють при 40°С та тиску 2,7кПа, одержуючи 90мг блідо-жовтої твердої речовини, що очищають хроматографією в патроні BondElut SCX, що містить 2г щеплені оксиди кремнію (1225-6019, Varian Associates, Inc, 24201 Frampton Avenue, Harbor City, CA90710, USA), елююючи 2 Μ метанольним розчином аміаку. Фракції з Rf 16/82 (циклогексан/етилацетат 7/3, пластинка із силікагелем, тип 1.05719, Merck Kga, 64271 Darmstadt, Німеччина) поєднують і випарюють при тиску 2,7кПа і 40°С, одержуючи 243мг N-{1-[біс(4-фторфеніл)метил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонаміду, що плавиться при 98°С. [Спектр ЯМР 1Н (300 Мгц, (CD3)2SO d6, δ у м.ч.): 2,74 (т ушир., J=7Гц:2Н); 3,00 (с:3Н); 3,37 (т ушир., J=7Гц:2Н); 4,43 (с:1Н); 4,69 (м:1Н); 7,05-7,20 (м:6Н); 7,28 (тт, J=9 і 2,5Гц:2Н); 7,40 (м:4Н)]. Приклад 35 (RS)-N-{1-[Біс(4-хлорфеніл)пірид-4-илметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід може бути отриманий у такий спосіб. До суміші приблизно 100мг (4-піридил)-(4-хлорфеніл)хлорметану, 143мг Nазетидин-3-іл-N-(3,5-дифторфент)метилсульфонамід, 17мг йодиду калію і 200мг карбонату калію в 5см 3 ацетонітрилу перемішують приблизно 18 годин при температурі близької до 20°С. Після цього реакційну суміш кип'ятять 3 години, додають 17мг йодиду калію і продовжують кип'ятіння ще 2 години. Після охолодження до температури близької до 20°С реакційну суміш фільтрують на пористому склі. Твердий матеріал обполіскують ацетонітрилом і потім 2 рази 3см 3 етилацетату. Об'єднаний фільтрат насухо випарюють при зниженому тиску. Одержують 230мг блідо-жовтої пасти, що очищають за допомогою препаративної хроматографії в тонкому шарі силікагелю [4 препаративні пластинки Mreck Kieselgel 60F254; 20x20см, товщина 0,5мм], елююючи сумішшю метанол/дихлорметан (5/95 за об'ємом). Після елюювання зони, що відповідає цільовому продукту, фільтрації на пористому склі і розпарюванні розчинників при зниженому тиску і температурі близької до 40°С одержують 12мг (RS)-N-{1-[біс(4-хлорфеніл)пірид-4-илметил]азетидин-3-іл}-N-(3,5дифторфеніл)метилсульфонаміду. [Спектр ЯМР 1Н (300 МГц, CDCI3, δ у м.ч.): 2,82 (с:3Н); 2,96 (м:2Н); 3,50-3,80 (м:2Н); 4,33 (м:1Н); 4,54 (м:1Н); 6,82 (м:3Н); 7,20-7,45 (м:6н); 8,53 (д ушир., J=5,5Гц:2Н)]. Обидва ізомери (RS)-N-{1-[біс(4-хлорфеніл)пірид-4-илметил]азетидин-3-іл}-N-(3,5дифторфеніл)метилсульфонаміду можуть бути розділені на нерухомі хіральні фази CHIRACEL OD. Перший ізомер: Спектр ЯМР 1Н (300 Мгц, CDCI3, δ у м.ч.): 2,83 (с:3Н); 2,87 (т ушир., J=7,5Гц:2Н); 3,51 (м:1Н); 3,60 (м:1Н); 4,24 (с:1Н); 4,50 (м:1Н); 6,82 (м:3Н); 7,20-7,35 (м:6н); 8,50 (д ушир., J=5,5Гц:2Н)]. Другий ізомер: Спектр ЯМР 1Н (300 Мгц, CDCI3, δ у м.ч.): 2,83 (с:3Н); 2,88 (т, J=7,5Гц:2Н); 3,51 (м:1Н); 3,61 (м:1Н); 4,25 (с:1Н); 4,51 (м:1Н); 6,81 (м:3Н); 7,20-7,35 (м:6н); 8,50 (д ушир., J=5,5Гц:2Н)]. (4-піридил)-(4-хлорфеніл)хлорметан може бути отриманий у такий спосіб. До суспензії 100мг (4-піридил)-4хлорфеніл)метанолу в 2см 3 толуолу, охолодженої до температури близької до 0°С, додають 0,0598см 3 тіонілхлориду. Залишають реакційне середовище на 2 години при температурі близької до 0°С та потім на 1 годину при температурі близької до 20°С та випарюють при зниженому тиску. Одержують приблизно 100мг (4піридил)-(4-хлорфеніл)хлорметану у виді білої твердої речовини. (4-Піридил)-4-хлорфеніл)метанол може бути отриманий у такий спосіб. До розчину 2г 4-(4хлорбензоил)піридину в 160см 3 етанолу додають при температурі близької до 20°С 348мг тетрагідробориду натрію. Після 2 годин перемішування при температурі близької до 20°С додають 90мг тетрагідробориду натрію. Через 1,5 години (при тій же температурі) реакційне середовище розбавляють 200см 3 дихлорметану і 200см води. рН водної фази доводять до величини 5 додаванням приблизно 13см 3 1 н. соляної кислоти. Після поділу фаз водн у фазу 3 рази екстрагують 100см 3 дихлорметану. Органічні фази поєднують, висушують над сульфатом магнію, фільтрують і випарюють при зниженому тиску. Одержують 2г (4-піридил)-4хлорфеніл)метанолу у виді білого порошку. Приклад 36 До розчину 330мг N-{1-[біс(4-хлорфеніл)метил]азетидин-3-іл}(3,5-дифторбензил)аміну в 25см 3 тетрагідрофурану додають при кімнатній температурі в атмосфері аргону 24,4мг 75%-ний дисперсії гідриду натрію в мінеральній олії. Суміш перемішують 1 годину при кімнатній температурі і додають 59мм 3 метилхлорформіату і продовжують перемішування протягом 18 годин в тих же умовах. До реакційної суміші додають 0,3см 3 дистильованої води і відганяють тетрагідрофуран на роторному випарнику. Отриманий залишок екстрагують дихлорметаном, органічну фазу висушують над сульфатом магнію, фільтрують і насухо випарюють при зниженому тиску (2,7кПа). Отриманий залишок очищають флеш-хроматографією на колонці із силікагелем [елюент: дихлорметан/метанол (97,5/2,5 за об'ємом). Одержують 328мг метилового ефіру {1[біс(4-хлорфеніл)метил]азетидин-3-іл}-(3,5-дифторбензил)карбамінової кислоти у виді безбарвної олії. [Спектр ЯМР 1Н (300 Мгц, CDCI3 , δ у м.ч.): 2,97 (м:2Н); 3,39 (м:2Н); 3,71 (с:3Н); 4,24 (з ушир.:1Н); 4,45 (м:1Н); 4,57 (с:2Н); 6,65-6,80 (м:3Н); 7,15-7,30 (м:8Н)]. Приклад 37 (RS)-N-{1-[(4-хлорфеніл)піримідин-5-ілметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонамід може бути отриманий повторенням послідовності операцій, описаної в прикладі 33, виходячи з 0,16 (RS)-5-[бром-(4хлорфеніл)метил]піримідину, 0,131г гідрохлориду N-азетидин-3-іл-N-(3,5-дифторфеніл)метилсульфонаміду в 5см 3 ацетонітрилу, 303мг карбонату калію і 95мг йодиду калію. Одержують 26мг (RS)-N-{1-[(4хлорфеніл)піримід-5-илметил]азетидин-3-іл}-N-(3,5-дифторфеніл)метилсульфонаміду у виді жовтої пінистої маси. [Спектр ЯМР 1Н (400 Мгц, CDCI3, δ у м.ч.): 2,83 (с:3Н); 2,91 (м:2Н); 3,57 (м:2Н); 4,31 (с:1Н); 4,50 (м:1Н); 6,75-6,90 (м:3Н); 7,29 (с:4Н); 8,71 (с:2Н); 9,08 (с:1Н)]. Лікарські засоби за винаходом складаються зі сполуки формули І або ізомеру чи солі цієї сполуки в чистому стані або у виді композиції, в якій ця сполука асоційована з будь-яким іншим фармацевтичним сумісним продуктом, що може бути інертним чи фізіологічно активним. Лікарські засоби за винаходом можуть застосовуватися перорально, парентерально, ректально або місцево. Як тверді композиції для перорального застосування можуть використовува тися таблетки, пігулки, порошки (желатинові капсули, крохмальні облатки) чи гранули. Активний початок за винаходом змішують у цих композиціях в струмі аргону з одним чи декількома інертними розріджувачами, такими як крохмаль, целюлоза, сахароза, лактоза чи кремнезем. Ці композиції, крім розріджувачів можуть також містити інші речовини, наприклад, один чи кілька мастильних агентів, таких як стеарат магнію чи тальк, барвник, оболонку (драже) чи лак. Як рідкі композиції для перорального застосування можуть використовуватися фармацевтично прийнятні розчини, суспензії, емульсії, сиропи й еліксири, що містять інертні розріджувачі, такі як вода, етанол, гліцерин, рослинні олії чи парафінова олія. Ці композиції можуть містити і відмінні від розріджувачів речовини, наприклад змочувальні, підсолоджуючі, загущаючі, ароматизуючі чи стабілізуючі продукти. Стерильні композиції для парентерального застосування можуть бути переважно водними чи неводними розчинами, суспензіями чи емульсіями. Як розчинник чи носій може бути використана вода, пропіленгліколь, поліетиленгліколь, рослинні олії, зокрема, маслинова олія, прийнятні для ін'єкції органічні складні ефіри, наприклад етилолеат, чи інші придатні органічні розчинники. Ці композиції можуть також містити допоміжні засоби, зокрема, змочувальні агенти, ізотонізатори, емульгатори, диспергенти і стабілізатори. Стерилізація може бути здійснена безліччю способів, наприклад асептичною фільтрацією, введенням у композицію агентів, що стерилізують, опроміненням чи нагріванням. Вони можуть бути також отримані у виді твердих стерильних композицій, що можуть бути розчинені безпосередньо перед застосуванням у стерильній воді або будь-якому іншому придатному для ін'єкцій стерильному середовищу. Композиції для ректального застосування являють собою супозиторії чи ректальні капсули, що крім активного продукту містять наповнювачи, такі як олія какао, напівсинтетичні гліцериди чи поліетиленгліколі. Композиції для місцевого застосування можуть, наприклад, являти собою креми, лосьйони, очні примочки, рідини для полоскання порожнини рота, краплі для носа чи аерозолі. В області терапії людини сполуки за винаходом можуть бути, зокрема, використані для лікування і попередження психозів, включаючи шизофренію, тривожних станів, депресії, епілепсії, нейродегенерації, мозжечкових і спиномозжечкових розладів, порушення когнітивних функцій, черепномозкової травми, панічних приступів, периферичних нейропатій, глауком, мігрені, хвороби Паркінсона, хвороби Альцгеймера, хореї Гентингтона, синдрому Рейно, тремору, обсесивно-компульсивного синдрому, старечого слабоумства, порушень тимусу, синдрому Турета, уповільненої дискінезії, двохполюсних розладів, рака, порушень рухового апарата під впливом лік, дистоній, ендотоксемічних шоків, геморагічних шоків, гіпотензії, безсоння, імунологічних захворювань, розсіяного склерозу, блювот, астми, порушень апетиту (булімія, анорексія), ожиріння, порушень пам'яті, порушень проходу по кишечнику, при скасуванні хронічного лікування, при лікуванні синдрому скасування алкоголю чи лік (наприклад, опіоїдів, барбітуратів, коноплі, кокаїну, амфетамінів, фенцикліду, галюциногенів, бензодіазепінів), таких як аналгетики чи підсилювачі анальгетичной активності наркотичних і ненаркотичних лік. Дози залежать від бажаного ефекту, від тривалості лікування і від використовуваного способу введення. Звичайно вони лежать у межах від 5 до 1000мг на добу при пероральному введенні в дорослого, у той час як разові дози варіюють від 1 до 250мг активної речовини. У загальному випадку лікарю варто визначати придатне дозування в залежності від віку, ваги й інших факторів, що відносяться до лікування лікуємого індивідуму. Композиції за винаходом ілюструють наступні приклади: Приклад А Використовуючи звичайні методи, готують желатинові капсули з дозою 50мг активного продукту, що мають наступний склад: Сполука формули І 50мг Целюлоза 18мг Лактоза 55мг Колоїдний кремнезем 1мг Карбоксиметилкрохмаль натрієвий 10мг Тальк 10мг Стеарат магнію 1мг Приклад В Використовуючи звичайні методи, готують таблетки з дозою 50мг активного продукту, що мають наступний склад: Сполука формули І 50мг Лактоза 104мг Целюлоза 40мг Полівідон 10мг Карбоксиметилкрохмаль натрієвий 22мг Тальк 10мг Стеарат магнію 2мг Колоїдний кремнезнем 2мг Суміш гідроксиметилцелюлози, гліцерину й оксиду ти тану (72/3,5/24,5) у достатній кількості до 245мг у кінцевій таблетці з оболонкою. Приклад С Готують розчин для ін'єкцій, що містить 10мг активного продукту, що має наступний склад: Сполука формули І 10мг Бензойна кислота 80мг Бензиловий спирт 0,06мл Бензоат натрію 80мг 95%-ий етанол 0,4мл Гідроксид натрію 24мг Пропіленгліколь 1,6мл Вода в достатній кількості до 4мл
ДивитисяДодаткова інформація
Назва патенту англійськоюA pharmaceutical composition containing azetidine derivatives, azetidine derivatives and preparation thereof
Назва патенту російськоюФармацевтическая композиция, которая содержит производные азетидина, производные азетидина и их получение
МПК / Мітки
МПК: A61P 25/16, A61P 11/00, A61P 25/12, A61K 31/425, C07D 403/06, A61K 31/506, A61P 15/08, A61P 25/20, A61P 25/18, A61P 3/04, A61K 31/4725, A61P 25/32, A61K 31/427, A61P 27/06, A61P 25/00, A61K 31/4427, A61K 31/433, C07D 417/12, A61P 25/06, A61P 35/00, C07D 403/12, A61P 25/36, A61P 25/30, A61P 25/04, A61P 5/00, A61K 31/4523, A61P 9/00, A61P 25/24, A61K 31/397, A61K 31/4709, C07D 401/12, A61P 25/22, A61P 1/00, A61P 37/00, A61P 25/28, C07D 205/00
Мітки: одержання, фармацевтична, містить, композиція, азетидину, похідні
Код посилання
<a href="https://ua.patents.su/20-73554-farmacevtichna-kompoziciya-shho-mistit-pokhidni-azetidinu-pokhidni-azetidinu-i-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція, що містить похідні азетидину, похідні азетидину і їх одержання</a>
Попередній патент: Похідні піперазину
Наступний патент: Пристрій для контролю психофізіологічного стану оператора
Випадковий патент: Абонентський пристрій, базова станція і спосіб передачі у системі радіозв'язку












