Спосіб одержання збагаченого b-аномером гемцитабіну гідрохлориду (варіанти)
Формула / Реферат
1. Спосіб одержання збагаченого β-аномером гемцитабіну гідрохлориду формули І
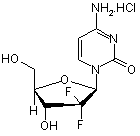 , І
, І
який відрізняється тим, що включає операції, при яких:
a) забезпечують розчин гемцитабіну гідрохлориду у воді;
b) підвищують концентрацію вказаної сполуки в даному розчині для ініціації процесу осадження;
c) виділяють вказану сполуку, збагачену β-аномером.
2. Спосіб за п. 1, який відрізняється тим, що при здійсненні операції підвищення концентрації видаляють частину води як розчинника.
3. Спосіб за п. 1, який відрізняється тим, що відношення води як розчинника до вихідної сполуки змінюють від 12:1 до 3:1.
4. Спосіб за п. 1, який відрізняється тим, що початковий розчин обробляють активованим вугіллям.
5. Спосіб за п. 1, який відрізняється тим, що операцію підвищення концентрації продовжують доти, поки відношення води як розчинника до вихідної сполуки не стане нижче 3:1.
6. Спосіб за п. 1, який відрізняється тим, що сполуку, збагачену β-аномером, виділяють при температурі від 0 °С до 10 °С.
7. Спосіб за п. 6, який відрізняється тим, що сполука, збагачена β-аномером, містить не менше 99,7 % β-аномеру, виміряного методом рідинної хроматографії високого тиску.
8. Спосіб за п. 6, який відрізняється тим, що сполука, збагачена β-аномером, містить не менше 99,9 % даного β-аномеру, виміряного методом рідинної хроматографії високого тиску.
9. Спосіб одержання збагаченого β-аномером гемцитабіну гідрохлориду формули І
 , І
, І
який відрізняється тим, що проводять реакцію етил 2,2-дифторо-3-гідрокси-3-(2',2'-диметилдіоксалан-4'-іл)пропіонату з іодином в нижчому спирті з подальшою азеотропною дистиляцією з одержанням 2-дезокси-2,2-дифторо-1-оксорибози формули VB
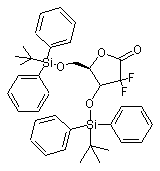 , VB
, VB
після чого проводять реакцію одержаної 2-дезокси-2,2-дифторо-1-оксорибози формули VB з трет-бутилдифенілсилілхлоридом для одержання 3,5-біс-(трет-бутилдифенілсилілокси)-2-дезокси-2,2-дифторорибози формули VIB
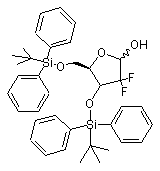 , VIB
, VIB
далі забезпечують захист гідроксильної групи в одержаній 3,5-біс-(трет-бутилдифенілсилілокси)-2-дезокси-2,2-дифторорибозі формули VIB для одержання 3,5-біс-(трет-бутилдифенілсилілокси)-1-метансульфонілокси-2-дезокси-2,2-дифторорибози формули VIIB
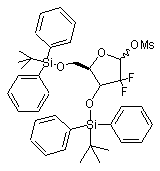 VIIB
VIIB
шляхом використання метансульфонілхлориду, а також проводять операцію, при якій забезпечують конденсацію одержаної 3,5-біс-(трет-бутилдифенілсилілокси)-1-метансульфонілокси-2-дезокси-2,2-дифторорибози формули VIIB зі сполукою дисилілу формули VIII
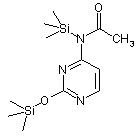 VIII
VIII
для одержання 1-[2'-дезокси-2',2'-дифторо-3',5'-біс(трет-бутилдифенілсилілокси)рибофуранозо]-N-ацетилцитозину формули IX
 , IX
, IX
і операцію, при якій забезпечують конверсію одержаного 1-[2'-дезокси-2',2'-дифторо-3',5'-біс(трет-бутилдифенілсилілокси)рибофуранозо]-N-ацетилцитозину формули IX в гемцитабіну гідрохлорид формули І
 , І
, І
а для збагачення гемцитабіну гідрохлориду β-аномером
a) забезпечують розчин гемцитабіну гідрохлориду у воді;
b) підвищують концентрацію вказаної сполуки в даному розчині для ініціації процесу осадження;
c) виділяють вказану сполуку, збагачену β-аномером.
Текст
1. Спосіб одержання збагаченого β-аномером гемцитабіну гідрохлориду формули І C2 2 82595 1 N O F O OH F , який відрізняється тим, що включає операції, при яких: a) забезпечують розчин гемцитабіну гідрохлориду у воді; b) підвищують концентрацію вказаної сполуки в даному розчині для ініціації процесу осадження; c) виділяють вказану сполуку, збагачену βаномером. OH F (19) H H 3 82595 4 O Si O O Si O O F F Si Si O Si O O (VIII) O N для одержання 1-[2'-дезокси-2',2'-дифторо-3',5'біс(трет-бутилдифенілсилілокси)рибофуранозо]N-ацетилцитозину формули IX O NH N O O Si O OH F F CH3 N (VB) , після чого проводять реакцію одержаної 2дезокси-2,2-дифторо-1-оксорибози формули VB з трет-бутилдифенілсилілхлоридом для одержання 3,5-біс-(трет-бутилдифенілсилілокси)2-дезокси-2,2-дифторорибози формули VIB N (VIB) N (IX) F F O Si Si , далі забезпечують захист гідроксильної групи в одержаній 3,5-біс-(трет-бутилдифенілсилілокси)2-дезокси-2,2-дифторорибозі формули VIB для одержання 3,5-біс-(трет-бутилдифенілсилілокси)1-метансульфонілокси-2-дезокси-2,2дифторорибози формули VIIB , і операцію, при якій забезпечують конверсію одержаного 1-[2'-дезокси-2',2'-дифторо-3',5'біс(трет-бутилдифенілсилілокси)рибофуранозо]N-ацетилцитозину формули IX в гемцитабіну гідрохлорид формули І NH2 .HCl N HO O Si O O O F OMs F F (VIIB) Si шляхом використання метансульфонілхлориду, а також проводять операцію, при якій забезпечують конденсацію одержаної 3,5-біс-(третбутилдифенілсилілокси)-1-метансульфонілокси-2дезокси-2,2-дифторорибози формули VIIB зі сполукою дисилілу формули VIII У зв'язку з даною заявкою заявляються права на пріоритет, що належить [індійським патентним заявкам №№ 183/СНЕ/2006 і 874/СНЕ/2006, які подані 6 лютого 2006р. і 18 травня 2006p.], відповідно, та включені в дану заявку в усій повноті методом посилання, та [попередній заявці США №60/804,836, яка подана 15 червня 2006р.] та включена до даної заявки в усій повноті методом посилання. Даний винахід відноситься до способу приготування гемцитабін-гідрохлориду. Більш N O (І) H F OH , а для збагачення гемцитабіну гідрохлориду βаномером a) забезпечують розчин гемцитабіну гідрохлориду у воді; b) підвищують концентрацію вказаної сполуки в даному розчині для ініціації процесу осадження; c) виділяють вказану сполуку, збагачену βаномером. конкретно, винахід відноситься до способу, який забезпечує отримання гемцитабін-гідрохлориду, вільного від технологічних домішок (забруднень, що виникають в процесі виготовлення продукту). Гемцитабін-гідрохлорид відомий як хімічне з'єднання під назвою 2-деокси-2-, 2*дифтороцитидин- моногідрохлорид (b-аномер) (далі по тексту - гемцитабін-гідрохлорид) і має структурну формулу І наступного вигляду: 5 82595 6 очищення гемцитабін-гідрохлориду відносно специфіки його аномерної чистоти. Спосіб включає операції розчинення із співвідношенням 1:1a/b аномерної сполуки в гарячій воді/ацетоні при зворотному стоці і охолоджування розчину від -10 до 50°С для осадження необхідного продукту. Випавший в осадок гемцитабін-гідрохлорид збирається і підлягає подальшим технологічним операціям повторення вказаного вище процесу для отримання гемцитабін-гідрохлориду з чистотою, приблизно, 99%. Способи виробництва гемцитабіну також добре відомі з рівня техніки. Наприклад, [патент Гемцитабін-гідрохлорид є нуклеозидним США №4,808,614] розкриває гемцитабінаналогом, що проявляє протипухлинну активність, гідрохлорид, композиції, що містять гемцитабіні відомий на ринку під брендовим найменуванням гідрохлорид і їх використовування для лікування GEMZARÒ у вигляді ін'єкційного розчину. Ампула герпес-вірусних інфекцій. В ньому також описаний Gemzar містить еквівалент гемцитабінспосіб приготування гемцитабін-гідрохлориду по гідрохлориду в кількості до 200мг або 1г приведеній нижче схемі 1. безосновної речовини (freebase). З рівня техніки добре відомі способи збільшення кількості b-аномера. Наприклад, [патент США №5,945,547] розкриває спосіб Схема 1: В описі способу згідно з [патентом США №4,808,614] розкрито використовування реактивів гідролізу, наприклад, слабо кислотних іонообмінних смол (слабо кислотних іонітів), для здійснення процесу перетворення (конверсії) сполуки по формулі III у сполуку по формулі IV. Крім того, [патент США №5,223,608] розкриває спосіб одержання гемцитабін-гідрохлориду шляхом використовування таких реагентів гідролізу, як сильні кислоти, для приготування 2деокси-2,2-дифторо-D-еритро-пентофураноза-1улоз-3, 5-дибензоата по формулі VA. Процес представлено на схемі II 7 82595 8 [Заявка РСТ, № публікації 2005/095430 А1], розкриває спосіб одержання гемцитабінгідрохлориду. У вказаній заявці описано використовування реагентів гідролізу, подібних сильним кислотам, для приготування 2-деокси-2, 2-дифторо-D-еритро-пентофураноза-1-улоз-3, 5дибензоата по формулі VA. Крім того, в заявці описаний процес очищення сполуки по формулі VA. Дана заявка також розкриває спосіб очищення гемцитабін-гідрохлориду шляхом розчинення 95% поліпшеного b-аномера гемцитабін-гідрохлориду у воді, який виділено (отримано в чистому вигляді) шляхом використовування розчинників, подібних ізопропіловому спирту, ацетонітрилу або ацетону. Процес показано на схемі III Описані способи відображають основні напрямки в розвитку технології приготування гемцитабін-гідрохлориду. При здійсненні даних способів використані слабо кислотні іонообмінні смоли і сильні кислоти як засоби гідролізу в процесі формування незахищеного і захищеного лактону. Обидва засоби гідролізу страждають недоліком, який полягає у виникненні проблем при 9 82595 10 vi. зняття захисту зі сполуки по формулі ЇХ, формуванні лактонового кільця. При цьому існує використовуючи відповідний реагент, з подальшим небезпека утворення небажаних продуктів реакції, проведенням реакції з хлористоводородною які можуть зіграти роль забруднюючих речовин, (соляною) кислотою у присутності відповідного що часто призводить до повернення лактону в органічного розчинника, з метою забезпечення стан його прекурсору з відкритим ланцюгом через гемцитабін-гідрохлориду по формулі І. його (лактону) чутливість до дії сильних кислот і Ще один аспект даного винаходу забезпечує смол. одержання кристалічного гемцитабінДаний винахід відноситься до способу гідрохлориду, відмінного системою ліній приготування проміжних речовин і до поліпшення порошкової дифракції рентгенівського проміння технологічного процесу очищення, з метою («XRPD»). графіком диференціальної скануючої отримання заданого b-аномера гемцитабінкалориметрії («DSC») та/або спектром поглинання гідрохлориду, в основному, вільного від aінфрачервоного випромінювання («IR»). аномера. Ще один аспект даного винаходу забезпечує Відповідно до даного винаходу, створено одержання гемцитабін-гідрохлориду, в основному, ефективний спосіб приготування гемцитабінвільного від залишкових розчинників. гідрохлориду і його посередників із заданою Фіг.1 - система ліній порошкової дифракції чистотою і продуктивністю, за рахунок рентгенівського випромінювання, що відноситься використовування поліпшених технологічних до гемцитабін-гідрохлориду, приготованого по процесів приготування. Спосіб відрізняється технології, описаній в прикладі 8. простотою, екологічністю, економічністю, Фіг.2 - диференціальна скануюча калориметрія надійністю і технологічністю. зразка гемцитабін- гідрохлориду, приготованого по Даний винахід забезпечує спосіб очищення технології, описаній в прикладі 8. гемцитабін-гідрохлориду, з метою одержання Фіг.3 інфрачервоний спектр зразка гемцитабін-гідрохлориду, поліпшеного в частині гемцитабін- гідрохлориду, приготованого по його b-аномера. технології, описаній в прикладі 8. В одному з прикладів здійснення спосіб Фіг.4 термогравіметрична графічна очищення гемцитабин-гидрохлорида, поліпшеного характеристика зразка гемцитабін- гідрохлориду, в частині його b-аномера, включає операції, при приготованого по технології, описаній в прикладі 8. яких: Фіг.5 - рідинна хроматографія високого тиску а) забезпечують розчин гемцитабін(розрізняння) зразка гемцитабін- гідрохлориду, гідрохлориду в розчиннику, який складається, в приготованого по технології, описаній в прикладі 8. основному, з води; В способі по [патенту США №5,945,547] b) підвищують концентрацію гемцитабінвикористовують ацетон/воду. Винахідники із гідрохлориду в даному розчині для ініціації здивуванням відкрили, що використовування води процесу осадження; без ацетону веде до забезпечення більш високої с) виділяють в чистому вигляді вказану аномерной чистоти. сполуку, поліпшену в згаданій її частині b-аномера; Таким чином, даний винахід забезпечує спосіб В іншому аспекті даний винахід відноситься до очищення гемцитабін-гідрохлориду, з метою способу приготування гемцитабін-гідрохлориду і отримання гемцитабін-гідрохлориду, поліпшеного його проміжних речовин. в частині його b-аномера. В одному з прикладів здійснення спосіб В одному з прикладів здійснення даного приготування гемцитабін-гідрохлориду по формулі винаходу спосіб очищення гемцитабінl включає операції, при яких виконують: гідрохлориду, поліпшеного в частині його bі. конверсію сполуки по формулі III в сполуку аномера, включає операції, при яких: по формулі IV. використовуючи реагенти a) забезпечують розчин гемцитабіндециклізації, у присутності відповідного гидрохлориду в розчиннику, що складається, в органічного розчинника з подальшою азеотропною основному, з води; дистиляцією; оксигруп сполуки по формулі IV. ii. захист b) підвищують концентрацію гемцитабінвикористовуючи відповідні окси-захисні реагенти, у гідрохлориду в даному розчині для ініціації присутності відповідного органічного розчинника процесу осадження; при заданій температурі, з метою забезпечення c) виділяють в чистому вигляді вказану сполуки по формулі VB; сполуку, поліпшену в згаданій її частині b-аномера; ііі. відновлення речовини по формулі VB, Операція а) включає забезпечення розчину використовуючи відповідний вiдновлюючий гемцитабін-гідрохлориду в розчиннику, що реагент, у присутності відповідного органічного складається, в основному, з води. розчинника, з метою забезпечення сполуки по Розчин гемцитабін-гідрохлориду може бути формулі VIB; iv. захист сполуки по формулі VIB, отриманий шляхом розчинення гемцитабінвикористовуючи алкіл-або арил-сульфонілгідрохлориду у воді. Прийнятна будь-яка форма хлориди, у присутності відповідної основи і гемцитабін-гідрохлориду для утворення такого відповідного органічного розчинника, з метою розчину, наприклад будь-яка кристалічна або забезпечення сполуки по формулі VIIB; аморфна форма гемцитабін-гідрохлориду. ν. конденсацію сполуки по формулі VIIB із Гемцитабін-гідрохлорид може бути сполукою по формулі VIII у присутності приготований для використовування в операції відповідного органічного розчинника і відповідних забезпечення розчину по будь-якому із способів, основ, з метою забезпечення сполуки по формулі IX; і 11 82595 12 шлам. В основному, процес концентрації відомих з рівня техніки, або відповідно до згаданих припинитися, коли відношення розчинника до вище технологій. гемцитабін-гідрохлориду досягне значення від 1:1 Концентрація аномерної сольової суміші у воді до 1:5. не є критичною до тих пір, поки використовується Далі реактивна маса може утримуватися при така кількість води, якої достатньо для температурі, нижчій за температуру, при якій забезпечення повного розчинення. Кількість здійснюється концентрація, наприклад, нижче за вживаної води зберігається невеликою, щоб проміжок температур, приблизно, від 40°С до 45°С уникнути надмірної втрати продукту під час протягом періоду часу, який потрібний для більш кристалізації і виділення продукту в чистому повного виділення продукту. Точна температура вигляді. Кількість води, використаної для охолоджування і тривалість часу, необхідні для виділення бета-аномера, складає, приблизно, від повної кристалізації, можуть бути легко визначені 3-до12-кратної вагової/об'ємної кількості кваліфікованим фахівцем в даній області техніки і гемцитабін-гідрохлориду. Розчин може бути приготований при будуть також залежати від таких параметрів, як температурі, приблизно, від 25°С до 100°С. вид концентрації і температура розчину або Залежно від кількості узятого розчинника, процес шламу. розчинення може відбуватися при температурах від 25°С до 100°С. В деяких випадках для здійсОперація с) включає виділення b-аномера. нення процесу розчинення необхідний підігрів, і Виділення твердої фракції може розчинення може відбуватися при температурах здійснюватися з використанням звичайних від 50°С до 100°С. технологій, наприклад, шляхом фільтрації, Як альтернатива, розчин може бути декантування, центрифугування і іншими подібниоброблений активованим вугіллям, з метою ми методами або шляхом фільтрування в посилення інтенсивності кольору сполуки, з атмосфері інертних газів з використанням таких подальшою фільтрацією через яке-небудь газів, як азот і інші інертні гази. Вологий коржик, отриманий в результаті середовище, наприклад, через прожарений виконання операції с), може бути згодом осушений розжареним потоком шар диатомовой землі в лотковій сушарці, вакуумній печі, повітряній печі, (Hyflow) для видалення вуглецю. сушарці з псевдозрідженим шаром, випарній Переважна кількість активованого вугілля, сушарці і в інших подібних пристроях. Сушка може використаного при виділенні бета-аномера з здійснюватися при температурі, приблизно, від поліпшеним кольором, складає, приблизно, від 0,1 35°С до 70°С. Сушка може здійснюватися до 10 (вага/вага) активованого вугілля на 1 грам протягом будь-якого заданого періоду часу від 1 години до 20 годин. аномерної a/b - суміші. В окремих прикладах здійснення винаходу Обробка вуглецем може здійснюватися або описаний вище спосіб по даному винаходу може при температурі розчинення, або після бути пристосований до процесу формування бази охолоджування розчину до більш низької для безперервної кристалізації. Чистота продукту, температури. Як альтернатива, розчин може бути отриманого в результаті операції с), перевіряється відфільтрований шляхом проходження через на визначення процентного вмісту домішок альфапапір, скловолокно або інший мембранний матеріаномера. Якщо за наслідками рідинної ал, або крізь освітлюючий засіб, наприклад, целіт. хроматографії високого тиску (розрізнення) вміст Залежно від використовуваного устаткування, домішок не знижується до заданих рівнів нижче концентрації і температури розчину, пристрій 0,1%, то операції від а) до с) повторюються на фільтрації може вимагати попереднього підігріву, вологому матеріалі, отриманому в результаті щоб уникнути передчасної кристалізації. операції с). Якщо в результаті операції с) Концентрація розчину може складати, досягається задана чистота, цикл припиняється. приблизно, від 1г/мл до 20г/мл розчинника, або Таким чином, встановлюється цикл операцій, може коливатися від 1g/ml до 5g/ml. які можуть повторюватися невизначену кількість Операція b) включає підвищення концентрації разів, забезпечуючи відповідність процесу по гемцитабін-гідрохлориду у вказаному розчині, з винаходу до безперервного процесу. При цьому метою ініціації осадження згаданого b-аномера. очевидне досягнення реальної комерційної Операція концентрації може виконуватися вигоди. Очищений гемцитабін-гідрохлорид, отриманий відповідним методом випаровування, методом з використанням способу, що заявляється, містить дистиляції в атмосфері або у вакуумі. менше 0,1% або менше 0,01% будь-якої домішки Дистиляція розчинника може проводитися у цитозина і a-аномера. вакуумі від 100мм ртутного стовпа до 600мм Гемцитабін-гідрохлорід, отриманий з ртутного стовпа при температурі, приблизно, від використанням способу, що заявляється, був 40°С до 70°С. Поки концентрація відбувається без перевірений по методу рідинної хроматографії зростання рівнів домішок, може бути використана високого тиску (розрізнення) (HPLC) за способом, будь-яка температура і будь-які умови вакууму. описаним у [фармакопеї США (USP) 29; NF 24; Концентрація розчину може відбуватися до 2006; стр. No. 990-991]. Результати перевірочних тих пір, поки не почнеться осадження гемцитабіндосліджень надані в Таблиці. гідрохлориду з розчину, що перетворює розчин на 13 82595 14 15 82595 16 розчинниками, як метанол, етанол, n-пропанол, ізопропанол, n-бутанол і подібні ним речовини; такими вуглеводнями, як n-гексан, циклогексан, nгептан, толуол, хлоробензол, 1,2-дихлоробензол, ксилоли і інші подібні речовини; Операція іі. включає захист оксигруп сполуки по формулі IV, використовуючи відповідні оксиВ одному з аспектів даний винахід відноситься захисні реагенти, у присутності відповідного до способу приготування гемцитабін-гідрохлориду органічного розчинника при заданій температурі, з і його проміжних речовин. метою забезпечення сполуки по формулі VB. В одному з прикладів здійснення спосіб В прикладі здійснення даного винаходу приготування гемцитабін-гідрохлориду по формулі захисною групою, використовуваною для захисту І включає операції, при яких виконують: оксигрупи сполуки по формулі IV, є третинний і. конверсію сполуки по формулі III в сполуку бутил-дифенілсиліл-хлорид, що забезпечує по формулі IV, використовуючи реагенти сполуку по формулі VB. дециклізації, у присутності відповідного органічного розчинника з подальшою азеотропною дистиляцією; оксигруп сполуки по формулі IV, іі. захист використовуючи відповідні окси-захисні реагенти, у присутності відповідного органічного розчинника при заданій температурі, з метою забезпечення сполуки по формулі VB; ііі. відновлення речовини по формулі VB, використовуючи відповідний відновлюючий реагент, у присутності відповідного органічного Перелік відповідних окси-захисних груп, які розчинника, з метою забезпечення сполуки по можуть бути використані в згаданій вище реакції, формулі VIB; iv, захист сполуки по формулі VIB, включає, але не обмежується такими оксивикористовуючи алкіл-або арил-сульфонілзахисними групами, як, силілові окси-захисні групи, хлориди, у присутності відповідної основи і наприклад, третинний бутил-дифенілсиліл, відповідного органічного розчинника, з метою триметилсилілхлорид, ізопропілдиметилсілил, забезпечення сполуки по формулі VIIB; метилдиізопропілсиліл, триізопропілсиліл і подібні ν. конденсацію сполуки по формулі VIIB із їм речовини, форміл, 2-хлорацетил, бензил, сполукою по формулі VIII у присутності дифенілметил, трифенілметил, 4-нітробеніл, відповідного органічного розчинника і відповідних феноксикарбоніл, t-бутил, метоксиметил, основ, з метою забезпечення сполуки по формулі феноксиацетил, изобутирил, eтоксикарбоніл, IX; vi. зняття захисту із сполуки по формулі IX, бензилоксикарбоніл та інші подібні їм речовини. використовуючи відповідний реагент, з подальшим Прийнятними, але не обмежуючими об'єм проведенням реакції з хлористоводородною захисту сновами, які можуть бути використані в (соляною) кислотою у присутності відповідного даному випадку, є: органічні основи, наприклад, органічного розчинника, з метою забезпечення піридин, тризтиламін, імідазол, 2,6-лутидин, 2,3гемцитабін-гідрохлориду по формулі І. лутидин, 3,5-лутидин і подібні ним речовини. Операція і. включає конверсію сполуки по Перелік прийнятних розчинників, які можуть формулі III в сполуку по формулі IV, бути використані у вказаній вище реакції, включає використовуючи реагенти дециклізації, у але не обмежується такими ефірами, як присутності відповідного органічного розчинника з тетрагідрофуран, 1,4-диоксан, диeтиловий ефір, і подальшою азеотропною дистиляцією 1,2-диметоксиeтан і інші подібні речовини; такими вуглеводнями, як n-гексан, циклогексан, n-гептан, толуол, хлоробензол, 1,2-дихлоробензол, ксилоли і інші подібні їм речовини; такими апротонними полярними розчинниками, як Ν,Ν-диметилформамід (DMF), диметил-сульфоксид, диметилацетамід, ацетонітрил і інші подібні їм речовини; таким кетоном, як ацетон, метил-ізобутил-кетон, Прийнятний діапазон температур для метил-терт(третинний)-бутил-кетон і інші подібні їм проведення цієї реакції складає, приблизно, від речовини, або їх сумішами. Прийнятними 20°С to 70°С. температурами для проведення даної операції є Додатково, реакційна маса піддається температури в діапазоні, приблизно, від 5°С до азеотропній дистиляції після додавання іодину і 50°С. Операція ііі забезпечує відновлення речовини спиртового розчину. Дистиляція може проводитися по формулі VB з використанням відповідного при температурі, приблизно, від 50°С до 150°С. відновлюючого реагенту у присутності Перелік відповідних розчинників, які можуть відповідного органічного розчинника, з метою бути використані для проведення реакції, включає, забезпечення сполуки по формулі VIB; але не обмежується такими спиртовими 17 82595 18 такими складними ефірами, як eтилацетат, ізопропілацетат і інші подібні їм речовини, таким кетоном, як ацетон, метил-ізобутил-кетон, метилтерт(третинний)-бутил-кетон і інші подібні їм речовини, або їх сумішами. Відповідними температурами для проведення подібної реакції є температури в діапазоні від 0°С до 50°С. Операція ν. полягає в здійсненні конденсації сполуки по формулі VIIB із сполукою по формулі VIII у присутності відповідного органічного Відповідними, але не обмежуючими об'єм розчинника і відповідних основ, з метою захисту відновлюючими реагентами, які можуть забезпечення сполуки по формулі IX; бути використані в даній операції, є натрій-біс(2метоксизтокси)алюмінійгідрид (вітрид), натрійборогідрид (NaBH4), літійалюмінійгідрид (LiАlН4), диізобутилалюмінійгідрид (DIBAL-H). Перелік прийнятних розчинників, які можуть бути використані у вказаній вище реакції, включає але не обмежується такими спиртами, як метанол, етанол, n-пропанол, ізопропіловий спирт, nбутанол і іншими подібними речовинами, такими ефірами, як тетрагідрофуран, 1,4-діоксан, дізтиловьій ефір, і 1,2- диметоксиeтан і інші подібні Перелік прийнятних розчинників, які можуть речовини; такими вуглеводнями, як n-гексан, бути використані у вказаній вище реакції, включає циклогексан, n-гептан, толуол, хлоробензол, 1,2але не обмежується такими ефірами, як дихлоробензол, ксилоли і інші подібні їм речовини; тетрагідрофуран, 1,4-диоксан, дізтиловий ефір, і або їх сумішами. 1,2-диметоксиетан і інші подібні речовини; такими Прийнятними температурами для проведення вуглеводнями, як n-гексан, циклогексан, n-гептан, даної операції є температури в діапазоні, толуол, хлоробензол, 1,2-дихлоробензол, ксилоли приблизно, від - 50°С до 100°С. і інші подібні їм речовини; такими складними Операція iv. забезпечує захист сполуки по ефірами, як етилацетат, ізопропілацетат і інші формулі VIB, використовуючи алкіл- або арилподібні їм речовини, таким кетоном, як ацетон, сульфоніл-хлориди, у присутності відповідної метил-ізобутил-кетон, метил-терт(третинний)основи і відповідного органічного розчинника, з бутил-кетон і інші подібні їм речовини, або їх метою забезпечення сполуки по формулі VIIB; сумішами. Відповідними, але не обмежуючими об'єм В одному з прикладів здійснення винаходу, з захисту основами, які можуть бути використані для метою забезпечення умов для сполуки по формулі ведення даної операції, є такі органічні основи, як VIIB, захисною групою, використовуваною для піридин, триетиламін, гексаметилдизилазан, захисту гідроксильної групи сполуки по формулі триметилсилілтрифлат і подібні їм речовини. VIB, є метан-сульфонілхлорид. Відповідними температурами для проведення подібної реакції є температури в діапазоні від 20°С до 100°С. Операція vi. включає зняття захисту із сполуки по формулі IX, використовуючи відповідний реагент, з подальшим проведенням реакції з хлористоводородною (соляною) кислотою у присутності відповідного органічного розчинника, з метою забезпечення гемцитабін-гідрохлорида по формулі І. Відповідні реагенти, які можуть бути Відповідними, але не обмежуючими об'єм використані для зняття захисту, вибирають з групи захисту захисними групами, які можуть бути речовин, що включають терт-бутил-амоній, аміак, використані для захисту гідроксильної групи, є ацетилхлорид, розбавлення (розчин) алкіл-та-арил-сульфонілхлориди, наприклад, хлористоводородної кислоти (соляної кислоти) і метан-сульфонілхлорид, бензол-сульфонілхлорид подібні їм речовини. і подібні їм речовини. Перелік прийнятних розчинників, які можуть Перелік прийнятних розчинників, які можуть бути використані у вказаних вище реакціях, бути використані у вказаній вище реакції, включає включає але не обмежується таким осаджувачем, але не обмежується такими ефірами, як як вода; такими спиртами, як метанол, етанол, тетрагідрофуран, 1,4-диоксан, діетиловий ефір, і етанол-гідрохлорид, n-пропанол, изопропанол, 1,2-диметоксиeтан і інші подібні речовини; такими ізопропіловьій спирт, n-бутанол і інші подібні вуглеводнями, як n-гексан, циклогексан, n-гептан, речовини; такими галогенізованими розчинниками, толуол, хлоробензол, 1,2-дихлоробензол, ксилоли як дихлорометан, дихлороетан, хлороформ і інші, і інші подібні їм речовини; такими апротонними подібні їм речовини; такими ефірами, як полярними розчинниками, як Ν,Ν-диметилтетрагідрофуран, 1,4-діоксан, діетиловьій ефір, і формамід (DMF), диметил-сульфоксид, диметил1,2-диметоксиетан і інші подібні речовини; такими ацетамід, ацетонітрил і інші подібні їм речовини; вуглеводнями, як n-гексан, циклогексан, n-гептан, 19 82595 20 толуол, хлоробензол, 1,2-дихлоробензол, ксилоли Кристалічний гемцитабін-гідрохлорид, і інші подібні їм речовини; такими апротонними отриманий відповідно до даного винаходу, полярними розчинниками, як Ν,Ν-диметилвідрізняється своєю власною системою XRPD. Усі формамід (DMF), диметил-сульфоксид, диметилдані XRPD, наведені в даному описі, були ацетамід, ацетонітрил і інші подібні їм речовини; одержані, використовуючи Сu Kб такими складними ефірами, як eтилацетат, випромінювання з довжиною хвилі 1,541Å на ізопропилацетат і інші подібні їм речовини, таким дифрактометрі, принцип роботи якого заснований кетоном, як ацетон, метил-ізобутил-кетон, метилна порошковій дифракції рентгенівського терт(третинний)-бутил-кетон і інші подібні їм випромінювання (Bruker Axe D8 Advance Powder Xречовини, або їх сумішами. ray Diffractometer.) Кристалічний гемцитабін-гідрохлорид Як альтернатива, одна або декілька операцій, відрізняється системою ліній порошкової від і) до iv), в технологічному ряді процесу можуть дифракції рентгенівського випромінювання (XRPD) здійснюватися без виділення проміжних сполук. В з характеристичними піками, приблизно в 9,57; одному з прикладів здійснення операцію і) 11,35; 13,74; 14,38; 15,29; 19,09; 20,36; 21,15; проводять без виділення проміжної сполуки, при 22,755; 22,98; 23,36; 24,02; 26,58; 27,56; 28,29; цьому за даною операцією слідує виділення 29,19; 30,74; 31,66; 34,.45; 35,42; 37,1; 37,96; 41,99; сполуки по формулі VB. 44,023 ± 0,2 градусів, дві тета. Відповідною температурою для проведення Диференціальні скануючі калориметричні реакції є температура в діапазоні, приблизно, від дослідження проводилися на моделі DSC Q1000 10°С до 70°С. ТА приладів з ухилом 5°С/мин., часом модуляції Вологий коржик, отриманий на різних стадіях 60 секунд і температурою модуляції ±1°С обробки, може бути в подальшому висушений. Початкова температура 0°С, кінцева Сушку можуть здійснювати в лотковій сушарці, у температура - 200°С. Кристалічний гемцитабін-гідрохлорид має вакуумній печі, повітряної печі, в сушарці з характеристичну криву диференціальної скануючої псевдозрідженим шаром, в розпилювальних калориметрії яка, в основному, відповідає Фіг.2, де сушарках, в сушарках-випарниках і інших зображена ендометрична крива при 259-274°С. пристроях. Сушка може виконуватися при Інфрачервоний спектр (IR) гемцитабінтемпературі, приблизно, від 35°С до 70°С. Сушка гідрохлорида був зареєстрований на може виконуватися протягом будь-якого заданого спектрофотометрі моделі Perkin Elmer System періоду часу в діапазоні від 1 до 20 годин. Spectrum, між 450см-1 і 4000см-1, з роздільною Весь процес може бути відображений схемою спроможністю 4см-1 в гранулі броміду калія, IV. концентрація сполуки, що піддається випробуванню, складає 1% по масі. Кристалічний гемцитабін-гідрохлорид характеризується інфрачервоним спектром з характеристичними піками, які описані приблизними значеннями 3392, 3259, 3117, 3078, 1679, 1535,1283,1199, 1065, 856, 814 ±1 см-1. Ще в одному прикладі здійснення даного винаходу забезпечується гемцитабін-гідрохлорид, в основному, вільний від залишкових розчинників. Гемцитабін-гідрохлорид, отриманий з використанням даного винаходу, має процентний вміст залишкового розчинника в межах міжнародних норм, визначених Міжнародною Конференцією по Гармонізації Технічних Вимог до реєстрації фармацевтичних засобів, призначених для лікування людей. Рівень вмісту розчинників залежить від типу розчинника, але не перевищує 5000 частинок на 1млн. (ppm) або 4000 частин на 1млн. (ppm), або 3000 частин на 1млн. (ppm) Гемцитабін-гідрохлорид, отриманий відповідно до даного винаходу, містить менше 100ppm або менше 500ppm ацетону, менше 100ppm або менше 500ppm ізопропола, менше 100ppm або менше 500ppm дихлорометану. Певні специфічні аспекти і приклади здійснення даного винаходу можуть бути більш детально пояснені з посиланнями на наступні Ще один аспект даного винаходу забезпечує приклади, які приведені тільки з метою ілюстрації і отримання кристалічного гемцитабін-гідрохлорида, жодною мірою не обмежують об'єм захисту даного відмінного системою ліній порошкової дифракції винаходу. 1 Приклад рентгенівського випромінювання («XRPD»), Спосіб приготування 3,5-біс(третичний-бутилграфіком диференціальної скануючої калориметрії дифеніл-силілокси)-2-деокси-2,2-дифторо-1(«DSC») та/або спектром поглинання оксорибози (формула VB) інфрачервоного випромінювання («IR»). 21 82595 22 екстрагували за допомогою 3х500мл етилацетату, 100,3г етил 2,2-дифторо-3-окси-3 (2,2після чого послідувала сепарація органічних і диметилдіоксалан-4-іл) пропіонату по формулі III, водних шарів. Органічний шар піддавали повній 2000мл метанолу і 10,02г лодину були завантажені дистиляції для отримання 103,5г заданої сполуки. в чисту і суху з круглим дном пробірку з Мас: 664,4 (Μ+ΝΗ4) атомних одиниць маси подальшим негайним струшуванням протягом 12 (a.m.u.) і 1Н NMR: 0.9ррm (9Н), 1.1 (9Н), 5.1 ррm годин. Розчин 22,5г натрий-тіосульфату в 225мл води був доданий до вказаної вище реактивної (1Н) d значення. маси при температурі, приблизно, 25-35°С Приклад 3 протягом, приблизно, 30 хвилин з подальшою Спосіб приготування 3,5-біс(третичний-бутилдистиляцією 1000мл метанолу, узятого з дифеніл-силілокси)-1-метан-силокси-2-деокси-2,2реактивної суміші при температурі, приблизно, 80дифторорибози (формула VIIB) 95°С. Одночасно 500мл толуолу завантажували в 103г 3,5-біс(третичний-бутил-дифенілотриману реактивну масу, а 500мл розчинника силілокси)-2-деокси-2,2-дифторорибози (формула відділяли методом дистиляції під атмосферним VIB), 1030мл дихлорометану і 55,5мл тиском при 95°С. Вказану вище операцію триетиламину завантажували в пробірку з круглим повторювали 5 разів при температурі 120°С і дном в атмосфері азоту при одночасному забезпечували вакуум від 650 до 750мм для перемішуванні. Реактивну масу охолоджували до повного видалення толуолу, з метою отримання 0-5°С з подальшим додаванням 18,6мл метансполуки 2-деокси-2,2-дифторо-1-оксорибози по сульфоніл-хлориду до згаданої вище маси при 0°С формулі IV. Отриманий залишок розчиняли в 1325мл N, Nпротягом 10 хвилин. Реактивній масі давали диметил-формаміду (DMF) в атмосфері азоту при можливість нагрітися до температури 25-35°С і температурі, приблизно, 25-35°С. 80,5г імідазолу і струшували під тиском протягом, приблизно, 3-4 303мл третинного-бутил-дифеніл-силіл-хлориду годин до тих пір, поки не був витрачений вихідний (TBDPSi-Cl) завантажували в отриману реактивну матеріал. Факт завершення реакції перевіряли, суміш при 25-35°С з подальшим негайним використовуючи тонкошарову хроматографію. До струшуванням при температурі, приблизно, 25отриманої реактивної маси додавали 300мл води і 35°С протягом 12 годин (over night). Факт виділяли шляхом сепарації два шари з подальшим завершення реакції був перевірений, екстрагуванням водяного шара знову до 300mlвикористовуючи метод тонкошарової дихлорометану. Отримані органічні шари хроматографії, і суміш охолоджували, приблизно, піддавали повній дистиляції у вакуумі, з метою до 10-15°С. 2600мл води додавали при отримання 111,0г заданої сполуки. Мас: температурі 10° при одночасному перемішуванні з 742.2(M+NH4) атомних одиниць маси (a.m.u.) і 1Н подальшим екстрагуванням за допомогою NMR: 5.9ppm (1Н), 0.8 (9Н), 1.1ppm (9Н), 3.1ppm 2х500мл дихлорометану. Органічні і водні шари (3Н)Приклад 4 d значення. розділяли (відділяли один від одного), після чого Спосіб приготування [2'-деокси-2',2'-дифтороорганічний шар промивали 500мл води, а потім 3',5'-рибофураноза 3,5-біс(третинний-бутилорганічний шар дистилювали в умовах вакууму дифеніл-силілокси)-N-ацетилцитоцину (формула при температурі 50°С. Отриманий сировинний IX) матеріал очищали колонковою хроматографією з 92,98г N-ацетилцитозина і 1925мл толуолу використанням петролейного ефіру і етилзавантажували в пробірку з круглим дном в ацетатних розчинних систем, з метою отримання атмосфері азоту. 204,6мл гексаметил-дизилазана 100г чистої заданої сполуки. Мас: 662.4(Μ+ΝΗ4) атомних одиниць маси (HMDS) також додавали у згадану вище пробірку (a.m.u.) і 1 Н NMR: 0.8 частинок на млн. (ppm) (9H), протягом 5 хвилин при 25-35°С з подальшою 1.1ppm (9Н), 4.5ppm (2Н), 3.4ppm (1Н), 3.7ppm (9H) дистиляцією 20% розчину у вакуумі при d значення. температурі, приблизно, 65°С, і реактивній масі Приклад 2 давали можливість остигнути до температури, Спосіб приготування 3,5-біс(третичний-бутилприблизно, 50°С. 41мл триметил-силіл-хлориду дифеніл-силілокси)-2-деокси-2,2-дифторорибози додавали до згаданої вище реактивної суміші з (формула VIB) подальшим підігрівом реактивної маси, з метою 100г 3,5-біс(третичний-бутил-дифенілзабезпечення зворотного стоку, і підтримували силілокси)-2-деокси-2,2-дифторо-1-оксорибози реактивну масу в стані зворотного стоку протягом (формула VB) і 1000мл тетрагідрофурану (THF) 2-3 годин під тиском. 585мл толуолу шляхом були завантажені в пробірку з круглим дном в дистиляції витягували з реактивної суміші з атмосфері азоту при температурі, приблизно, 25подальшим додаванням 1375мл толуолу, і 35°С з одночасним перемішуванням. Реактивну реактивну масу охолоджували до 25-35°C. суміш охолоджували до температурі від -45 до 102,3мл триметилсилілтрифлата (TMS трифлата) 50°С після чого додавали 75,4мл натрій-біс (2додавали до згаданої вище реактивної маси метоксиетокси) гідриду алюмінія (вітриду) протягом 5-10 хвилин і реактивну масу струшували протягом, приблизно, 5-10 хвилин з подальшим протягом, приблизно, 20-30 хвилин. Розчин струшуванням під тиском. Факт завершення сполуки, підданої дії метилсульфонілу (mesylated), реакції був перевірений, використовуючи по формулі VIIB, в 550мл толуолу додавали до тонкошарову хроматографію. Після завершення згаданої вище отриманої силілированої реактивної реакції 200мл насиченого розчину хлориду амонія маси при температурі 25-35°С, після чого додавали до отриманої реактивної маси при реактивну масу нагрівали до температури температурі, приблизно, -45°С з подальшим утворення зворотного стоку і утримували розділенням на два шари. Отриманий водний шар реактивну масу під тиском протягом 15 годин. 23 82595 24 6,4л,(3 об'єми) демінералізованої води Реактивну масу охолоджували до температури, поміщали в реактор і нагрівали до температури, приблизно, 25-35°С з одночасним приблизно, 80-85°С. 6,6кг сировинного гемцитабінперемішуванням, після чого протягом 10 хвилин гідрохлориду, що містить в співвідношенні 1:1 до неї додавали 40мл метанолу. З отриманої реактивної маси виділяли методом дистиляції суміш a/b - аномерної солі, приготованої HPLC розчинник в кількості до 50% від його повного методом, додавали у вище згаданий реактор при об'єму при температурі, приблизно, 50°С в умовах одночасному перемішуванні до утворення вакууму з подальшим охолоджуванням реактивної прозорого розчину. Реактивний розчин охолоджумаси до 0-5°С протягом 15-20 хвилин. Отримана вали, приблизно, до 20-25°С з подальшою смоляниста реактивна маса була декантована, фільтрацією відокремленого твердого продукту в органічний шар був промитий 700мл насиченого атмосфері азоту. Тверду речовину промивали 5л розчину NaHCO3 і розділеній на два шари. ацетону. Отриманий твердий продукт висушували Органічний шар бло піддано дистиляції в умовах методом відсмоктування вологи протягом, вакууму, з метою отримання 134г заданого приблизно, 1 години під тиском в атмосфері азоту, продукту. з метою отримання 2,7кг гемцитабін-гідрохлориду. Приклад 5 Чистота по HPLC: 98,1%. Спосіб приготування гемцитабін-гідрохлориду % a-аномера: 1,7%. по формулі І Приклад 7 133г 1-[2'-деокси-2',2'-дифторо-3',5'Очищення гемцитабін-гідрохлориду рибофураноза-3,5-біс(третинний-бутил-дифеніл860мл очищеної води поміщали в реактор силілокси)-N-ацетилцитоцину по формулі IX, який разом з 86г сировинного гемцитабін-гідрохлориду, був приготований, при здійсненні прикладу 4, що містить в співвідношенні 1:1 суміш a/b завантажували в пробірку з круглим дном в аномерной солі. Суміш нагрівали до температури, атмосфері азоту. Додавали 7,5 літрів метанолу, і приблизно, 35-40°С при одночасному реактивний розчин охолоджували до 0-5°С з перемішуванні до утворення прозорого розчину. подальшим додаванням до реактивного розчину До реактивної маси додавали 0,1 об'єму 1330мл аміаку. Отриманий розчин концентрували активованого вугілля при 35-40°С з при 50°С до мінімальної кількості і реактивну масу перемішуванням протягом, приблизно, 30 хвилин. екстрагували за допомогою 12 літрів eтилацетата Реактивну масу фільтрували через Hyflow з з подальшою концентрацією органічного шара при подальшою промивкою 3´30мл демінералізованої 50°С. 1180мл тетрагідрофурану (THF) і 79,8мл води при кімнатній температурі. Отриманий TBAF (тетра n-бутиламмонійфториду) вводили у фільтрат концентрували до 3 об'ємів реактивної вказану вище отриману реактивну масу при 25маси при 45-50°С у вакуумі 600мм ртутного 30°С і перемішували протягом, приблизно, 1 стовпа, після чого охолоджували до 15-20°С з години. Факт завершення реакції перевіряли, одночасним струшуванням/перемішуванням використовуючи метод тонкошарової протягом 30 хвилин при температурі 15-20°С. хроматографії, після чого реактивну масу Реактивну масу фільтрували з подальшою концентрували у вакуумі при температурі 50°С. До промивкою 50мл ацетону при 15-20°С і отриманої реактивної маси додавали висушували методом відсмоктування вологи демінералізовану воду, після чого водний шар протягом 30 хвилин. Отриману тверду масу промивали дихлорометаном. концентрували при Отриманий водяний шар висушували при температурі 35-40°С протягом, температурі 55°С, з метою отримання 72% aприблизно, 4 годин у вакуумі 600-620мм ртутного аномера і 24% b-аномера. 190мл ізопропілового стовпа, з метою отриманняa-аномера - 6,8%. Чистота по HPLC: 95,6% % 31г гемцитабінспирту додавали до отриманої сировинної маси, гідрохлориду. Приклад 8 після чого реактивну масу нагрівали до 60°С і Очищення гемцитабін-гідрохлориду додавали 25мл концентрованої соляної кислоти. 342мл (12 об'ємів) очищеної води поміщали в Отриману реактивну масу охолоджували до 10реактор разом з 28,5г гемцитабін-гідрохлориду, що 15°С і перемішували, приблизно, протягом 3 годин має чистоту 95,6%, і нагрівали до температури 35при 10°С. Отриманий твердий продукт 40°С при одночасному струшуванні/перемішуванні фільтрували, з ціллю отримання 69,9% a-аномера до формування прозорого розчину. 0,1 об'єму and 28,48% b-аномера, а отриманий фільтрат активованого вугілля додавали до реактивної концентрували при 45°C. До отриманого суміші при температурі 35-40°С з перемішуванням сировинного фільтрату додавали ацетон і протягом 30 хвилин. Реактивну масу фільтрували перемішували протягом однієї ночі. Отриманий через Hyflow з подальшою промивкою 3x25мл твердий продукт фільтрували, з ціллю отримання демінералізованої води при кімнатній температурі. Отриманий фільтрат концентрували до 2 об'ємів 2% a-аномера і 71% b-аномера. Отриманий реактивної маси при 45-50°С у вакуумі 600-620мм твердий продукт розчиняли (розбавляли) у ртутного стовпа, після чого охолоджували до 25деміниралізованій воді (qty) і завантажували 30°С. Реактивну масу фільтрували з подальшою активоване вугілля, з подальшим перемішуванням промивкою 31мл ацетону при 25-300°С. Описаний протягом 30-45 хвилин. Отриману реактивну масу процес повторювали ще раз і під кінець отриману фільтрували, а отриманий фільтрат тверду масу висушували при температурі 35-40°С концентрували до мінімальної кількості, з метою протягом, приблизно, 4 годин у вакуумі 600-620мм отримання 700мг заданої сполуки. по b-аномеру. Чистота по HPLC: 95% чистота ртутного стовпа, з метою отримання 24г Приклад 6 гемцитабін-гідрохлориду. Очищення гемцитабін-гідрохлориду Чистота по HPLC: 99,96%. 25 82595 % a-аномера - 0,01%. Обертання площини поляризації світла: [a]D20 (10мг/мл водного розчину): +47,1°. 26 27 Комп’ютерна верстка О. Гапоненко 82595 Підписне 28 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of в-anomer enriched gemcitabine hydrochloride (variants)
Автори англійськоюRaju P.V.
Назва патенту російськоюСпособ получения обогащенного b-аномером гемцитабина гидрохлорида (варианты)
Автори російськоюРаджу П. В.
МПК / Мітки
МПК: C07H 19/067, A61P 35/00, C07H 19/073
Мітки: варіанти, збагаченого, b-аномером, одержання, гемцитабіну, спосіб, гідрохлориду
Код посилання
<a href="https://ua.patents.su/14-82595-sposib-oderzhannya-zbagachenogo-b-anomerom-gemcitabinu-gidrokhloridu-varianti.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання збагаченого b-аномером гемцитабіну гідрохлориду (варіанти)</a>
Попередній патент: Спосіб вимірювання рівня рідких середовищ і ультразвуковий рівнемір
Наступний патент: Спосіб визначення мінімальної флегматизувальної концентрації газової вогнегасної речовини
Випадковий патент: Спосіб лікування хворих на контузійну травму ока