Фармацевтичні препарати, що містять легколетучі силікони
Формула / Реферат
1. Трансдермалыний препарат, що містить фармацевтично активний інгредієнт, який відрізняється тим, що частинки активного інгредієнта покриті легколетучими силіконами або їх сумішшю, і ці покриті частинки диспергують в водній гелевій або кремовій основі.
2. Композиція за п. 1, яка відрізняється тим, що активний інгредієнт є ацикловір, піроксикам, мелоксикам, ібупрофен, диклофенаку натрієва або калієва сіль, клотримазол, біфоназол, метронідазол, ніфедипін, нітрогліцерин або цетиризин.
3. Композиція за п. 1, яка відрізняється тим, що летючий силіконовий компонент є гексаметилдисилоксан і/або октаметилтрисилоксан і/або декаметил пентацикосилоксан.
4. Композиція за п. 1, яка відрізняється тим, що водна гелева основа є карбоксивініловий полімер, гідроксипропілметилцелюлоза або їх суміш.
5. Спосіб одержання композиції за п. 1, який відрізняється тим, що частинки активного інгредієнта покривають легколетучими силіконами або їх сумішшю, і одержану суміш розподіляють в водній гелевій або кремовій основі, так, щоб частинки в водній гелевій або в кремовій основі були оточені силіконовим покриттям.
Текст
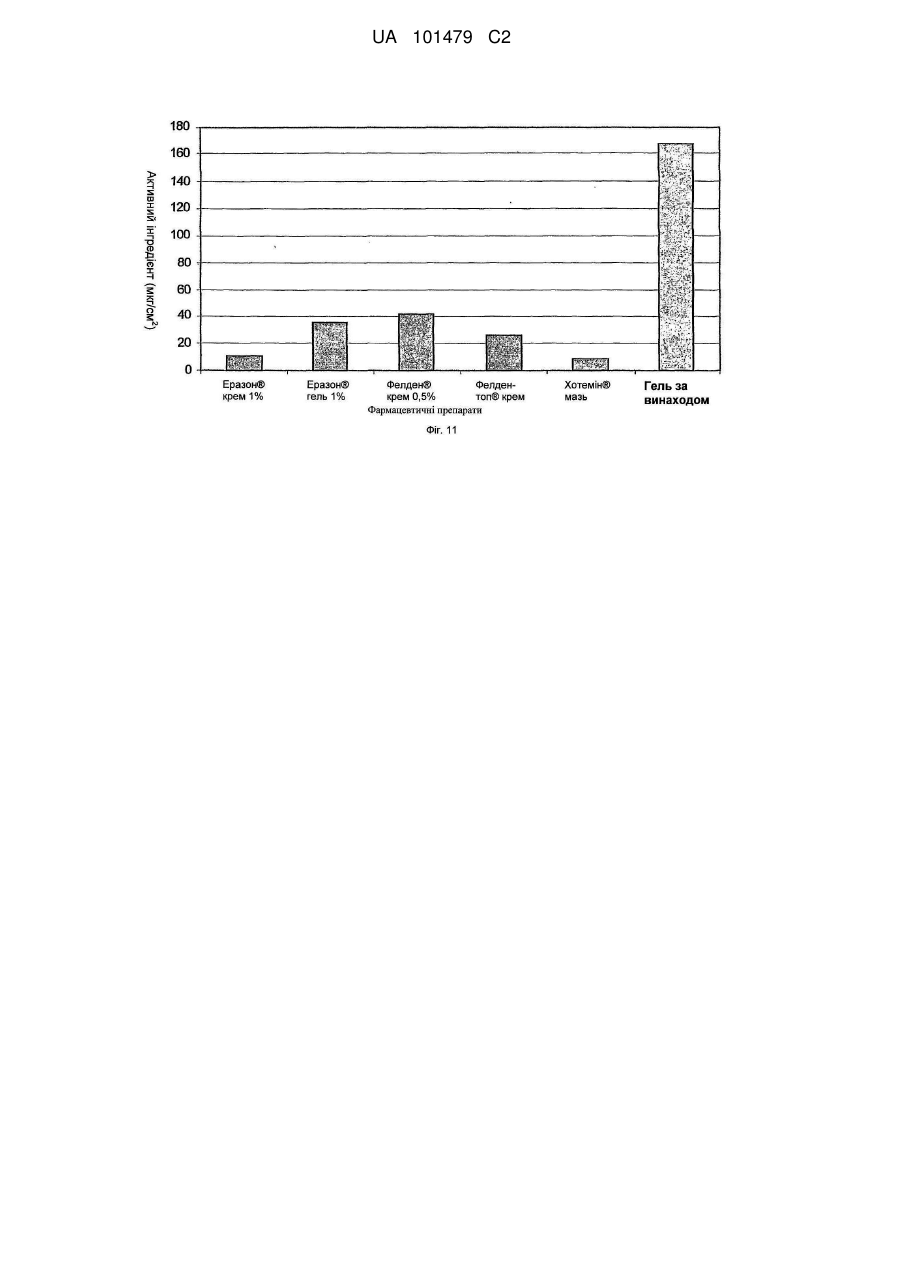
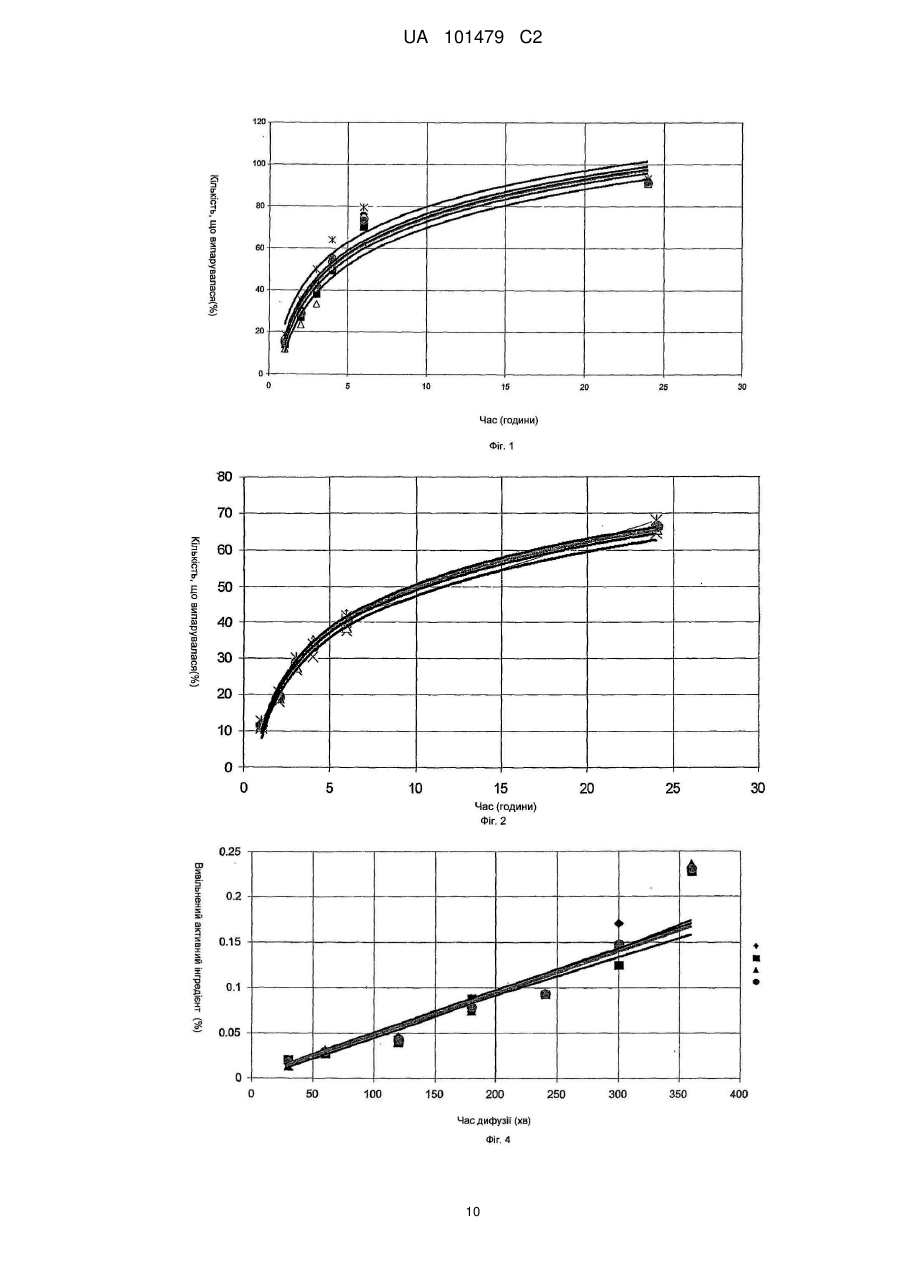
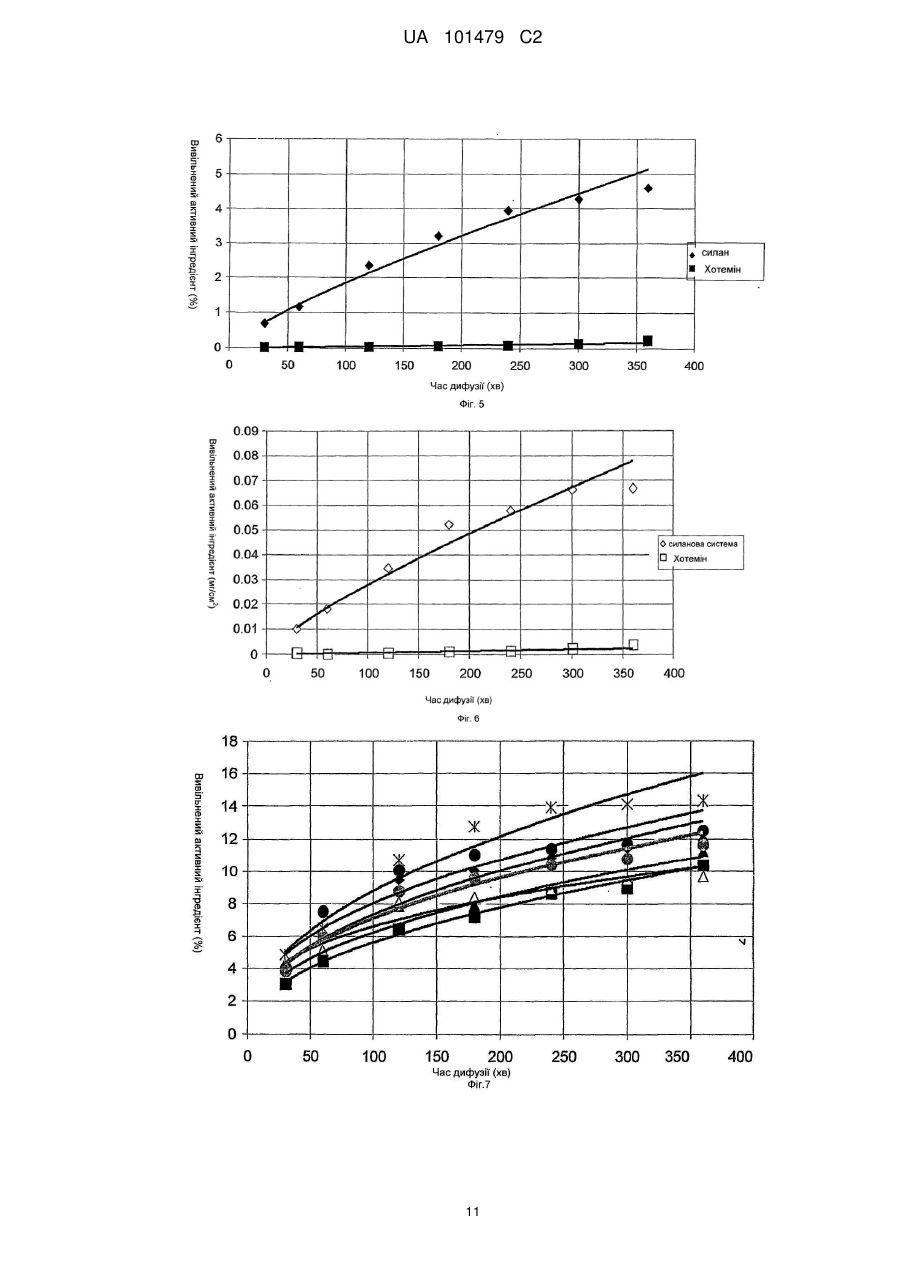
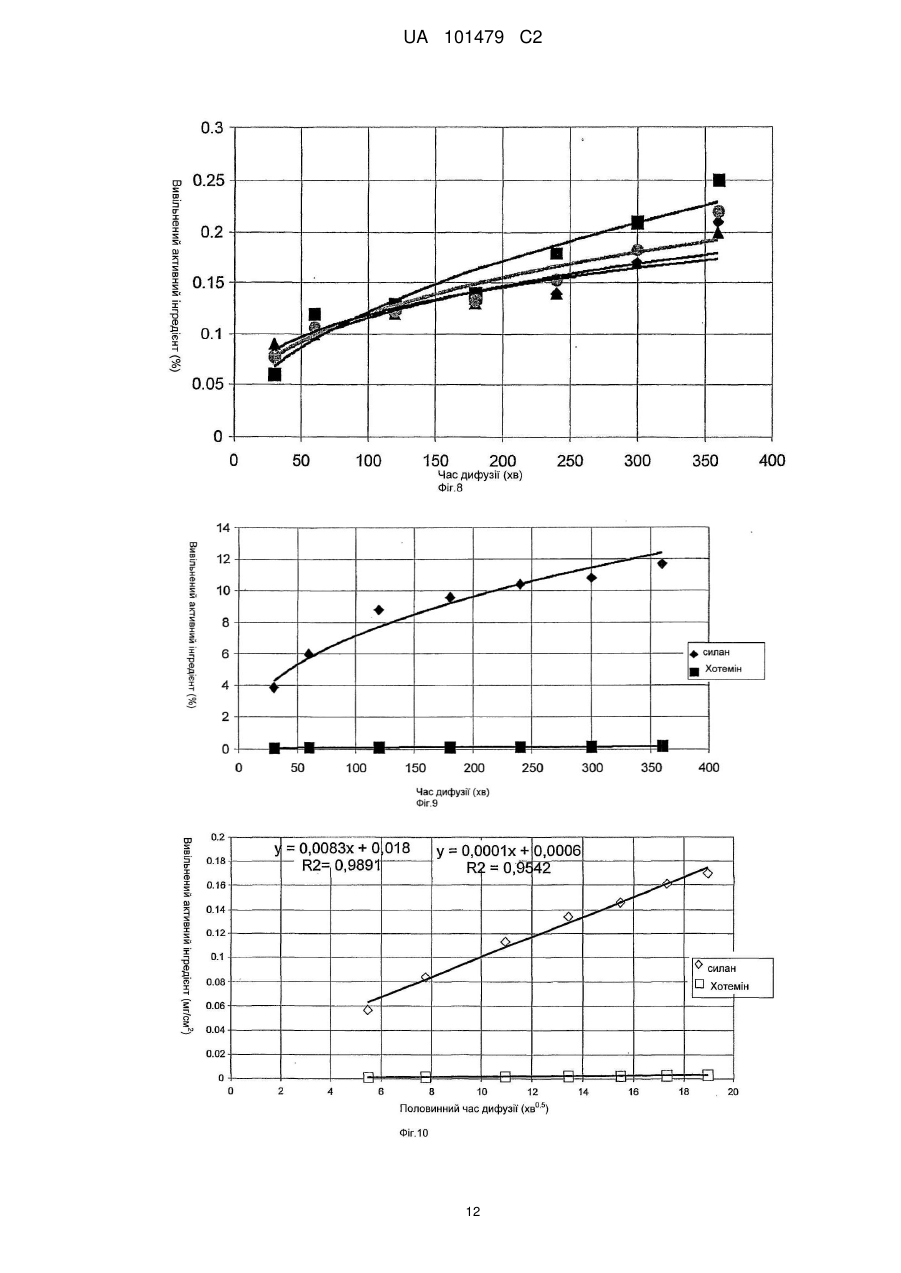
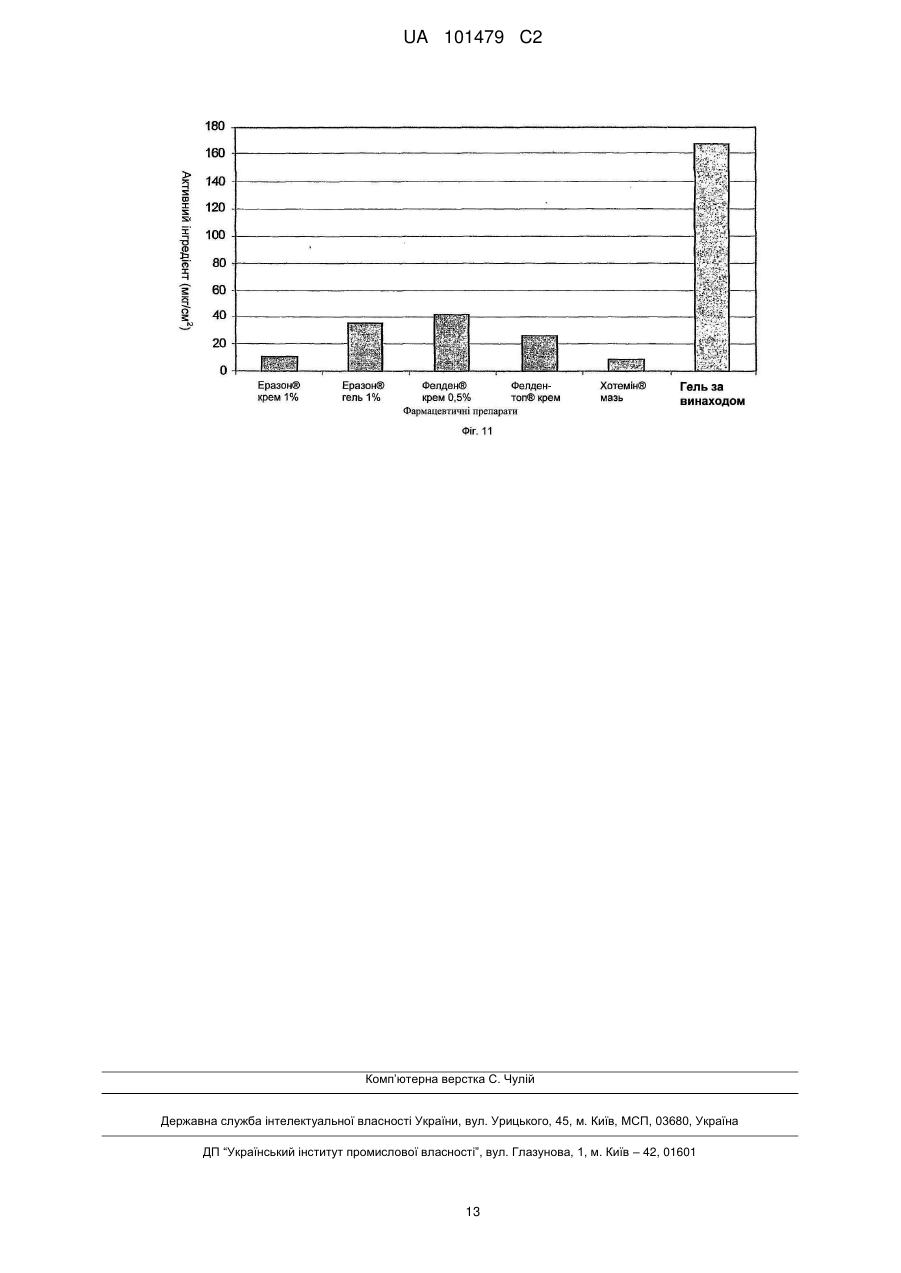
Реферат: Винахід належить до медицини та стосується трансдермального препарату, що містить фармацевтично активний інгредієнт, де частинки активного інгредієнта покриті легколетучими силіконами або їх сумішшю, і ці покриті частинки диспергують в водній гелевій або кремовій основі та способу отримання такої композиції. UA 101479 C2 (12) UA 101479 C2 UA 101479 C2 5 10 15 20 25 30 35 40 45 50 55 Об'єктом даного винаходу є трансдермальний препарат, що містить фармацевтично активний інгредієнт, де частинки активного інгредієнта покриті легколетучими силіконами або їх сумішшю, і ці покриті частинки дисперговані на гелевій або кремовій основі. Летючий силіконовий компонент є гексаметилдисилоксан і/або октаметилтрисилоксан і/або декаметилпентациклосилоксан. Наступним об'єктом даного винаходу є спосіб одержання таких фармацевтичних композицій. Застосування похідних силікону в медицині почалося з 1930-х років, і з тих пір їх широко застосовують. Що стосується групи похідних силікону, застосування силіконових полімерів дійсно широко поширено в області фармацевтики, оскільки вони мають декілька вигідних характеристик, таких як висока гнучкість, термостійкість, сприятлива хімічна стійкість, вони є індиферентними для людського організму, вони не проявляють взаємодії з ним при фармацевтичному застосуванні. Силіконові полімери - поліорганосилоксани - є полімерні сполуки, де органічні хімічні групи приєднані до силоксанових ланцюгів (-Si-O-Si-). Шляхом гідролізу або конденсації хлорсиланових мономерів можуть бути одержані різні силіконові полімери. Ці полімери складають три основні групи залежно від їх структури: - силіконові масла і натуральні еластомери з лінійною структурою, - силіконові смоли з розгалуженою структурою, - силіконові смоли з поперечною зшитою структурою (більшість силіконових смол мають зшиту структуру). З силіконових полімерів можуть бути одержані не тільки силіконові масла з різним ступенем в'язкості, але також жирні силікони, протипінні засоби, опалубні мастила і агенти, що додають гідрофобність. Силіконові гуми одержують з силіконових каучуків за допомогою різних способів вулканізації і зшивання. Смоли можна застосовувати як формувальні порошки, формувальні смоли, акрилові емульсії, лаки (розчинів з різними розчинниками) і пігментні фарбники або смоли, модифіковані органічними компонентами. Силіконові полімери є важливими базовими матеріалами для самоклеючих матеріалів (СКМ), медичних і хірургічних імплантатів, протезів, що застосовуються в терапії, і різних трансдермальних терапевтичних системах (ТТС). З числа силіконових масел найчастіше застосовують в терапії диметилполісилоксани. Ці силіконові масла мають дуже сильні протипінні властивості, які є наслідком їх низького поверхневого натягу (приблизно 20 мН/м, в порівнянні з поверхневим натягом води 85 мН/м). Ці перевагу використовують при застосуванні силіконового масла в спреях для лікування набряку легенів. У разі набряку легенів сильно пінистий слиз, що виділяється з легенів і створює бар'єр для нормальної вентиляції і поглинання кисню, може викликати аноксію або асфіксію за відсутності лікування. Гідрофобні характеристики силіконових масел застосовують у фармацевтичних препаратах для лікування пролежнів і виразок у пацієнтів, яким доводиться залишатися в одному і тому ж лежачому положенні протягом тривалого періоду. Одну з підгруп силіконових масел складають легколетучі силікони. Легколетучі силікони є фармацевтичними носіями, які здатні до повного випаровування з поверхні шкіри людини протягом шести годин. Фармацевтичне застосування цих носіїв не вичерпується цією можливістю. Об'єктом даного винаходу є трансдерамльний фармацевтичний препарат, де частинки активного інгредієнта покриті гексаметилдисилоксаном, октаметилтрисилоксаном і декаметилпентациклосилоксаном. Ці легколетучі силіконові масла широко застосовують в косметичній промисловості, і також відоме їх фармацевтичне застосування. У патентах США №№ US 4355046 і US 5336692 описане застосування розчинників гексаметилдисилоксану, октаметилтрисилоксану і декаметилпентациклосилоксану в мазях, що мають вазелінову основу. Ці мазі застосовують в косметиці і медицині. Згідно даних патентів легколетучі силоксани служать виключно для одержання доброго розподілу на поверхні шкіри людини, але не для досягнення хімічної і мікробіологічної стабільності. Тип і композиція фармацевтичних препаратів, а також мазева основа, які приведені в цих описах, відрізняються від об'єкту даного винаходу. У патенті США № US 5210103 гексаметилсилоксан використовують як робочий газ в пінках для шкіри для зовнішнього застосування (наприклад, вагінального). Європейський патент № ЕР 914082 відноситься до антиперспірантної композиції, що містить летючі силікони. Дані силікони забезпечують відповідну консистенцію композиції і запобігають протіканню препарату з упаковки. 1 UA 101479 C2 5 10 15 20 25 30 35 40 45 50 55 60 При одержані крему Діпролен® (Schering Plough) і Дексеріл® (Pierre Fabre Sante) декаметилпентациклосилоксан використовують для забезпечення естетичних властивостей препарату. У всіх згаданих вище документах описані косметичні композиції, де летючі силоксани використовують для забезпечення відповідної консистенції композицій і естетичних властивостей продуктів. Летючі силоксани рідко застосовують у фармацевтичних композиціях як інгредієнти. Композиція фармацевтичних препаратів, що згадується в літературі, відрізняється від об'єкту даного винаходу, і у фармацевтичних композиціях попереднього рівня техніки, як і в косметичних виробах, летючі силоксани служать для одержання доброго розподілу на поверхні шкіри. В той же час, згідно даного винаходу летючі силіконові масла забезпечують хімічну і мікробіологічну стабільність і добру біодоступність композиції згідно даного винаходу. Основними вимогами до фармацевтичних мазей і кремів, що містять активний інгредієнт, є: добра стабільність, тривалий термін зберігання, відповідна проникність активного інгредієнта з трансдермальної системи, добра консистенція і легкість нанесення на шкіру. Недолік мазей, що мають жирну або масляну основу, полягає в тому, що проникнення активного інгредієнта є повільним, а кількість активного інгредієнта, що вивільняється, низьким, оскільки в ліпофільній фазі розчинність мазі є високою, особливо у разі активних інгредієнтів, що мають низьку розчинністю у воді, і, отже, розподіл є нерівномірним, і мазева основа містить більше активного інгредієнта. Прикладами активних інгредієнтів з низькою розчинністю у воді є ацикловір, піроксикам, мелоксикам, ібупрофен, диклофенаку натрієва і калієва солі, клотримазол, біфоназол, метронідазол, ніфедипін, нітрогліцерин і цетиризін. Прикладами кремів, що містять приведені вище активні інгредієнти, є Зовіракс® (ацикловір), Фелден® (піроксикам), Хотемін® крем (піроксикам), Канестен® крем (Клотримазол), Мікоспор® крем (буфоназол) або Розекс® крем (метронідазол). З літератури відомі композиції гелів, що містять активний інгредієнт в суспендованій формі, де вивільнення активного інгредієнта є адекватним, але в процесі зберігання можуть виникати проблеми із стабільністю. Ці проблеми викликані хімічними і мікробіологічними реакціями в областях контакту на різних поверхнях, які можуть змінювати хімічний стан активного інгредієнта. Такого роду проблеми із стабільністю можуть спостерігатися, наприклад, при зберіганні крему Хотемін®, що містить піроксикам, емульсивного гелю Вольтарен® (диклофенак) або гелю Розекс®, що містить метронідазол. Метою даного винаходу є розробка фармацевтичного препарату, що має кращу біодоступність, ніж мазі, що мають жирні або масляні основи, і деякі гелі, а також дозволяючого уникнути проблем із стабільністю, емульсивних гелів, що спостерігаються при зберіганні, або гелів, містять активний інгредієнт в суспендованій формі. Несподівано виявлено, що вищеописані цілі можуть бути досягнуті за рахунок фармацевтичного препарату, де як адьюванти використовують летючі силіконові масла. Для поліпшення властивостей стабільності і проникності мазей і гелів, що містять вищезазначені активні інгредієнти, автори винаходу використовували суміші силіконових масел з різною летючістю у відповідним чином підібраних співвідношеннях. Об'єктом даного винаходу є трансдермальний препарат, що містить фармацевтично активний інгредієнт, де частинки активного інгредієнта покриті легколетучими силіконами або їх сумішшю, і ці покриті частинки диспергують в гелевій або кремовій основі. Фармацевтичний препарат згідно даного винаходу містить ацикловір, піроксикам, мелоксикам, ібупрофен, диклофенаку натрієву сіль і диклофенаку калієву сіль, клотримазол, буфоназол, метронідазол, ніфедипін, нітрогліцерин або цетиризін як активні інгредієнти; гексаметилдисилоксан і/або октаметилтрисилокеан і/або декаметилпентациклосилоксан як летючі силоксанові адьюванти; карбоксивініловий полімер, гідроксипропілметилцелюлозу або їх суміш як мазевої основи. Наступним об'єктом даного винаходу є спосіб одержання таких фармацевтичних композицій шляхом покриття частинок активного інгредієнта легколетучими силіконами або їх сумішшю і диспергування одержаної суміші в гелевій або кремовій основі таким чином, що частинки в гелевій або кремовій основі опиняються оточеними силіконовим покриттям. Суть винаходу полягає в тому, що тверді частинки активного інгредієнта, включені в гель, покриті летючими силіконовими маслами, які випаровуються з поверхні шкіри в ході застосування. Активний інгредієнт і інші інгредієнти гелю залишаються на поверхні шкіри і швидко адсорбуються за допомогою фізіологічних транспортних систем (дифузії, пенетрації, проникності) шкіри. 2 UA 101479 C2 5 10 15 20 25 30 35 40 45 50 55 60 Стабільність може бути підвищена за допомогою силіконового покриття, яке утворює так звану "третю фазу" в гелях. Дана "третя фаза" не взаємодіє ні з активним інгредієнтом, ні з іншими адьювантами гелю. Силіконові масла утворюють покриття навколо частинок активного інгредієнта, яке захищає активний інгредієнт від хімічних і мікробіологічних дій, забезпечуючи фармацевтичній композиції добру хімічну і мікробіологічну стабільність. При нанесенні гелю на шкіру силіконова сполука випаровується, таким чином, вона не вступає ні в яку взаємодію з людським організмом. Частинки активних інгредієнтів залишаються на поверхні шкіри і вивільняються в організмі. Після випаровування адьюванта частинки активного інгредієнта можуть легше і ефективно вивільнятися в шарах шкіри. Найбільш придатними силіконовими маслами для покриття активного інгредієнта трансдермальної композиції згідно даного винаходу є гексаметилдисилокеан, октаметилтрисилоксан і декаметилпентациклосилоксан. Переважні властивості фармацевтичної композиції згідно даного винаходу продемонстровані приведеними нижче експериментами. Опис графічних матеріалів: Фіг. 1: На фіг. 1 продемонстрована кінетика випаровування з системи, що містить силан, яка вивчена в експериментах по зниженню маси. П'ять зразків зберігали в ексикаторі із стандартною вологістю і вимірювали на аналітичних вагах через певні інтервали. Результати п'яти вимірювань продемонстровані кривими. Чорними рисками позначена крива, що демонструє середнє значення. Фіг. 2: На фіг. 2 продемонстрована кінетика випаровування з системи, що містить силан, яка вивчена в експериментах із зниження маси. Три зразки зберігали в ексикаторі із стандартною вологістю і вимірювали на аналітичних вагах через певні інтервали. Результати трьох вимірювань продемонстровані кривими. Чорними рисками позначена крива, що демонструє середнє значення. Фіг. 3: Фіг. 3 відноситься до вивільнення піроксикама з силанової композиції через ліпофільну мембрану. Тут продемонстровані результати експериментів дифузії через неполярну мембрану. Чорними рисками позначена крива, що демонструє середнє значення шести вимірювань. Фіг. 4: Фіг. 4 відноситься до вивільнення піроксикама з мазі Хотемін® через ліпофільну мембрану. Тут продемонстровані результати експериментів дифузії через неполярну мембрану. Чорними рисками позначена крива, що демонструє середнє значення трьох вимірювань. Фіг. 5: Фіг. 5 відноситься до порівняльного тесту, який демонструє вивільнення піроксикама з силанової системи і з крему Хотемін® через ліпофільну мембрану. На фіг. 5 показаний відсоток вивільненого активного інгредієнта в порівнянні із загальною кількістю у разі двох композицій. Фіг. 6: Фіг. 6 відноситься до порівняльного тесту, який демонструє вивільнення піроксикама з силанової системи і з крему Хотемін® через ліпофільну мембрану. На фіг. 6 продемонстрована 2 вивільнена кількість активного інгредієнта на певній поверхні шкіри в мг/см у разі двох композицій. Фіг. 7: Фіг. 7 відноситься до вивільнення піроксикама з силанової композиції через напівполярну мембрану. Тут продемонстровані результати експериментів дифузії через напівполярну мембрану. Чорними рисками позначена крива, що демонструє середнє значення п'яти вимірювань. Фіг. 8: Фіг. 8 відноситься до вивільнення піроксикама з мазі Хотемін® через напівполярну мембрану. Тут продемонстровані результати експериментів дифузії через напівполярну мембрану. Чорними рисками позначена крива, що демонструє середнє значення трьох вимірювань. Фіг. 9: Фіг. 9 відноситься до порівняльного експерименту, який демонструє вивільнення піроксикама з "силанової системи" і композиції Хотемін® через напівполярну мембрану. Фіг. 10: Фіг. 10 відноситься до порівняльного експерименту, який демонструє вивільнення піроксикама з "силанової системи" і композиції Хотемін® через напівполярну мембрану. На фіг. 3 UA 101479 C2 5 10 15 20 25 30 35 40 45 50 55 10 продемонстрована кількість вивільненого активного інгредієнта на певній поверхні шкіри в 2 мг/см по відношенню до половинного часу дифузії. (Q корінь (t)) Фіг. 11: Фіг. 11 відноситься до порівняльного тесту, в якому досліджували вивільнення піроксикама з шести різних фармацевтичних препаратів. Час дифузії складав шість годин. Тест на хімічну стабільність Одна з проблем хімічної стабільності фармацевтичних препаратів гелевого типу, що містять активний інгредієнт у диспергуючій формі, викликана взаємодіями, в точках контакту поверхонь, які можуть привести до зміни хімічного стану активного інгредієнта. Поліморфна форма І піроксикама є білою речовиною з кристалічною структурою, колір якої стає яскраво-жовтим при розчиненні у воді або в інших розчинниках. У разі традиційних мазей і гелів, що містять цей активний інгредієнт, вищеописані хімічні взаємодії змінюють інтенсивність кольору фармацевтичного препарату. Виявлено, що, в протилежність препаратам у вигляді крему і гелю згідно попереднього рівня техніки колір водного гелю згідно даного винаходу, що містить активний інгредієнт, покритий летючими силіконовими маслами (гексаметилдисилоксаном і/або октаметилтрисилоксаном, або їх сумішшю в співвідношенні 1:1), не міняється. Фармацевтичні препарати згідно даного винаходу були досліджені за допомогою тестів на стабільність з додержанням поточних правил ІСН (International Conference of Harmonization - Міжнародна конференція з гармонізації технічних вимог до реєстрації лікарських засобів для людини), і білий колір препаратів не мінявся під час експериментів. Активний інгредієнт покривають летючими силіконовими маслами у такий спосіб, що інші інгредієнти препарату гелю не приводяться в контакт з активним інгредієнтом, унаслідок чого препарат має добру хімічну стабільністю. Експерименти із зниження маси Основна вимога для доброї біодоступності полягає в тому, що активний інгредієнт повинен добре вивільнятися з фармацевтичного препарату. Активний інгредієнт композиції згідно даного винаходу вивільняється після випаровування силіконових масел, що служать покриттям. Цей процес продемонстрований зниженням маси препарату. Як порівняння автори винаходу використовували крем Хотемін®, який є кремом на жировій основі. Інгредієнтами крему Хотемін® 1% є: метил-пара-гідроксибензоат, макрогол целилстеариловий ефір, сорбітанстеарат, стеаринова кислота, цетилстеариловий спирт, білий вазелін, рідкий вазелін, дистильована вода. Зразки зберігали в ексикаторі стандартної вологості, і їх вимірювали на аналітичних вагах через певні інтервали. На фіг. 1 і 2 продемонстровано зниження маси і його відношення до часу. Результати вимірювань показують, що випаровування походить швидше з системи, що містить летючі силікони, ніж з порівняльного препарату. Після двадцяти чотирьох годин на вагах залишається тільки активний інгредієнт і невелика кількість полімерного адьюванта. Порівняльна мазь має нижчі зниження маси; тільки 60% всієї маси випарувалося. Експерименти, що відносяться до транспорту через біологічні мембрани Іншою основною умовою доброї біодоступності є легка дифузія активного інгредієнта після вивільнення через біологічну мембрану за допомогою активного або пасивного транспорту. Транспорт активного інгредієнта через неполярну і напівполярну біологічні мембрани (наприклад, через шкіру) досліджували за допомогою апарату, функціонуючого за принципом комірки вертикальної дифузії, розробленою Hanson Company (Hanson Microette TM Topical & Transdermal Diffuson Cell System, Hanson Research Corporation). Порівняльною композицією в експериментах є мазь Хотемін®. Дифузія через неполярну мембрану Досліджували дифузію через неполярну мембрану, оскільки верхній шар шкіри (роговий шар) має ліпофільні неполярні властивості завдяки хімічним характеристикам його компонентів. Отже, в роговий шар здатні проникати перш за все лікарські засоби, розчинні в даному шарі, а також лікарські засоби, що мають неполярні характеристики. На фіг. 3 показані результати експериментів, проведених з використанням мембрани, просоченою ізопропілмиристатом. На фіг. 4 продемонстровано вивільнення порівняльної композиції, а фіг. 5 і 6 є порівняльними прикладами. На фіг. 5 показаний вивільнений відсоток активного інгредієнта в порівнянні із загальною кількістю, а на фіг. 6 продемонстрована кількість активного інгредієнта, вивільнена на певній 2 поверхні шкіри в мг/см . 4 UA 101479 C2 5 10 Зазвичай процес, що відбувається в часі, описують середньоквадратичною функцією. Загальна формула середньоквадратичної функції є: Q=Q0t (1), де Q є вивільненою кількістю активного інгредієнта за час t, Q0 є вивільненою кількістю активного інгредієнта при t=0 (воно зазвичай дорівнює 0), і m є градієнтом лінеаризованої функції. Якщо m дорівнює 1, кількість вивільненого активного інгредієнта збільшується лінійно за часом, але зазвичай m має нижче значення, ніж 1. Коли m дорівнює приблизно 0,5, Q виражається лінійною функцією як функція t0,5. Лінійні градієнти (кутовий коефіцієнт) залежать від константи швидкості вивільнення. При математичній оцінці функцій можна встановити, що середньоквадратична функція рівняння (1) може бути точно приведена у відповідність з точками вимірювання. У таблиці 1 2 показані константи Q0, m і R , що є ступенем регресії. Таблиця 1 Кінетика вивільнення піроксикама. Константи середньоквадратичної функції, приведені у відповідність з точками вимірювання, і значення коефіцієнта кореляції Експеримент № Система, що містить силікон Вимірювання 1 Вимірювання 2 Вимірювання 3 Вимірювання 4 Вимірювання 5 Вимірювання 6 Середнє значення Порівняльна композиція Вимірювання 1 Вимірювання 2 Вимірювання 3 Середнє значення 15 20 25 30 35 2 Q0 m R 0,061 0,025 0,039 0,031 0,069 0,063 0,047 0,754 0,909 0,791 0,839 0,752 0,779 0,798 0,982 0,986 0,973 0,979 0,994 0,984 0,988 0,0006 0,0007 0,0003 0,0005 0,948 0,927 1,065 0,975 0,934 0,926 0,953 0,945 Значення таблиці 1 показують, що кінетика процесу точно описується середньоквадратичною функцією. Значення Q0 складає близько 0, значення m складає від 0,5 до 1, отже, процес є нелінійним за часом, і інтенсивність процесу безперервно знижується. Середньоквадратичне перетворення не проводили, оскільки значення m є відмінним від 0,5. Протягом експерименту тривалістю шість годин вивільнення активного інгредієнта із зразка, що містить силіконове масло, складало приблизно 5%. З порівняльної композиції в ході експерименту вивільнялося менше 1 % (максимальне вивільнення активного інгредієнта складало приблизно 0,2%). Що стосується результатів експериментів авторів винаходу, можна зробити висновок, що композиція, одержана відповідно до даного винаходу, здатна вивільняти значно більше активного інгредієнта, ніж порівняльна композиція. Дифузія через напівполярну мембрану У експериментах по транспорту через напівполярну мембрану створена модель надходження в живу клітину і проходження через живу клітину, що є умовою фармакологічної ефективності. Напівполярну мембрану одержували шляхом просочення її етиловим спиртом. Результати експериментів авторів винаходу продемонстровані на фіг. 7-10. Порівняння вивільнення активних інгредієнтів з композиції згідно даного винаходу і з мазі Хотемін®: При дослідженні кінетики процесу виявили, що значення m рівне ~ 0,5 в рівнянні (1), і тому провели середньоквадратичне перетворення. Результати, продемонстровані на фіг. 11, і 2 значення R лінії регресії проявляють близьку відповідність. У таблиці 2 показані значення Q0, m 2 іR . 5 UA 101479 C2 Таблиця 2 Вивільнення активного інгредієнта через напівполярну мембрану Експеримент № Система, що містить силікон Вимірювання 1 Вимірювання 2 Вимірювання 3 Вимірювання 4 Вимірювання 5 Вимірювання 6 Середнє значення Порівняльна композиція Вимірювання 1 Вимірювання 2 Вимірювання 3 Середнє значення 5 10 15 20 25 30 Q0 m R 0,932 0,644 0,843 1,032 1,369 1,191 0,990 0,449 0,471 0,435 0,465 0,343 0,415 0,429 0,945 0,994 0,894 0,961 0,949 0,895 0,962 0,024 0,013 0,031 0,021 0,340 0,494 0,249 0,373 0,923 0,922 0,903 0,941 Відношення між композицією, що містить силікон, і порівняльною композицією - маззю Хотемін® - складає 50:1, тобто, вивільнена кількість активного інгредієнта в п'ятдесят разів більша, ніж вивільнена кількість активного інгредієнта з порівняльної композиції. Порівняння вивільнення активних інгредієнтів композиції згідно даного винаходу і інших трансдермальних фармацевтичних препаратів, що містять піроксикам: Дифузію композиції згідно даного винаходу через напівполярну мембрану порівнювали з приведеними нижче препаратами: Еразон® 1% крем Еразон® 1% гель Фелден® 0,5% гель Feldene-top Creme® Хотемін® мазь. Приведені вище композиції містять піроксикам, але їх носії і інгредієнти є відмінними від композиції згідно винаходу. Зроблено відкриття, що вивільнення активного інгредієнта з композиції, що містить летючі силікони, краще, ніж з досліджених вище кремів і гелів. (Див. фіг. 11). Фармацевтична композиція згідно винаходу додатково проілюстрована за допомогою приведених нижче прикладів без обмеження об'єму даного винаходу цими прикладами. У прикладах носії на основі силіконової рідини є метилсилоксани, а саме, гексаметилдисилоксан і/або октаметилтрисилоксан, або їх суміші відносно 1:1. У прикладах в'язкість силоксанових розчинів складає 0,65 сСт або 100 сСт. Приклади Приклад 1 Композиція гелю, що містить піроксикам, як активний інгредієнт: Піроксикам 0,500 г Силіконова рідина0,65 сСт 0,500 г Силіконова рідина 100 сСт 2,150 г Карбопол 980NF 0,250 г Триетаноламін 0,200 г Гідроксипропілметилцелюлоза 1,000 г Дистильована вода, до 50,000 г Згідно рецептурі з приведеного вище прикладу готували партію гелю масою 7 кг в апараті Brogtech, придатному для виготовлення мазей. 1.1. Спосіб одержання суспензії, що містить активний інгредієнт: Порошок піроксикама, подрібнений на мікронному колоїдному млині (70,0 г), змішують з силіконовою рідиною 0,65 сСт (301,0 г) і силіконовою рідиною 100 сСт (70,0 г) в хімічному стакані на 800 мл і поміщають суміш в апарат Ultra-Turrax при 4000 об/хв. протягом п'яти хвилин. Одержану суспензію зберігають без доступу повітря до застосування. 1.2. Спосіб одержання основи гелю: 6 UA 101479 C2 5 10 15 20 25 30 35 40 45 Дистильовану воду (6000 г), наливають в апарат Brogtech, і температуру встановлюють 25 °C. У змішувач з якірною мішалкою в положенні 4 до суміші поступово додають гідроксипропілметилцелюлозу (140,0 г), і перемішують її при такій же швидкості в об/хв. до повного розчинення мазевої основи (приблизно півтори години). Після розчинення до реакційної суміші додають Карбопол 980 NF (35,0 г) і перемішують її протягом чотирьох годин. Суміш нейтралізують розчином триетаноламіну (28,0 г) і дистильованої води (100,0 г), і перемішують до тих пір, поки суміш не набуває гелевидної консистенції. 1.3. Спосіб одержання кінцевого продукту (композиції лікарський засіб-гель): До основи гелю, одержаної у відповідності до п. 1.2., поступово додають суспензію лікарського засобу у відповідності до п. 1.1, і гель доповнюють до 7,00 кг дистильованою водою. Одержаний гель гомогенізують протягом п'яти хвилин у вбудованому гомогенізаторі апарату Brogtech при 1200 об/хв. при максимальному діаметрі щілин (1,5 мм). Приклад 2 Композиція гелю, що містить клотримазол як активний інгредієнт: Клотримазол 0,200 г Силіконова рідина 0,65 сСт 1,000 г Силіконова рідина 100 сСт 0,200 г Карбопол 980 NF 0,100 г Триетаноламін 0,200 г Гідроксипропілметилцелюлоза 0,400г Дистильована вода, до 20,000 г Згідно рецептурі з приведеного вище прикладу готували партію гелю масою 7 кг в апараті Brogtech, придатному для виготовлення мазей. 2.1. Спосіб одержання суспензії, що містить активний інгредієнт: Порошок клотримазолу, подрібнений в мікронному колоїдному млині (70,0 г) змішують з силіконовою рідиною 0,65 сСт (350,0 г) і силіконовою рідиною 100 сСт (70,0 г) в хімічному стакані на 800 мл, і суміш гомогенізують в апараті Ultra-Turrax при 4000 об/хв. протягом п'яти хвилин. Одержану суспензію зберігають без доступу повітря до використання. 2.2. Спосіб одержання основи гелю: Дистильовану воду (6000 г), поміщають в апарат Brogtech, і температуру встановлюють 25 °C. У змішувач з якірною мішалкою в положенні 4 до суміші поступово додають гідроксипропілметилцелюлозу (140,0 г), і перемішують її при такій же швидкості в об/хв. до повного розчинення мазевої основи (приблизно півтори години). Після розчинення до реакційної суміші додають Карбопол 980 NF (35,0 г) і перемішують її протягом чотирьох годин. Суміш нейтралізують розчином триетаноламіну (28,0 г) і дистильованої води (100,0 г), і перемішують до тих пір, поки суміш не набуває гелевидної консистенції. 2.3. Спосіб одержання кінцевого продукту (композиції гелю): До основи гелю, одержаної у відповідності до п. 2.2., поступово додають суспензію лікарського засобу у відповідності до п. 2.1, і гель доповнюють до 7,00 кг дистильованою водою. Одержаний гель гомогенізують протягом п'яти хвилин у вбудованому гомогенізаторі апарату Brogtech при 1200 об/хв. при максимальному діаметрі щілин (1,5 мм). Приклад 3 Композиція гелю, що містить метронідазол, як активний інгредієнт: Метронідазол 1,000 г Силіконова рідина 0,65 сСт 2,000 г Силіконова рідина 100 сСт 0,200 г Карбопол 980 NF 0,250 г Триетаноламін 0,200 г Гідроксипропілметилцелюлоза 0,400г Дистильована вода, до 20,000 г Згідно рецептурі з приведеного вище прикладу готували партію гелю масою 7 кг в апараті Brogtech, придатному для виготовлення мазей. 3.1. Спосіб одержання суспензії, що містить активний інгредієнт: Порошок метронідазола, подрібнений в мікронному колоїдному млині (350,0 г), змішують з силіконовою рідиною 0,65 сСт (700,0 г) і силіконовою рідиною 100 сСт (70,0 г) в хімічному стакані на 800 мл, і суміш гомогенізують в апараті Ultra-Turrax при 4000 об/хв. протягом п'яти хвилин. Одержану суспензію зберігають без доступу повітря до використання. 3.2. Спосіб одержання основи гелю: Дистильовану воду (5500 г), поміщають в апарат Brogtech, і температуру встановлюють 25 °C. У змішувач з якірною мішалкою в положенні 4 до суміші поступово додають 7 UA 101479 C2 5 10 15 20 25 30 35 40 45 50 гідроксипропілметилцелюлозу (140,0 г), і перемішують її при такій же швидкості в об/хв. до повного розчинення мазевої основи (приблизно півтори години). Після розчинення до реакційної суміші додають карбопол 980 NF (35,0 г) і перемішують її протягом чотирьох годин. Суміш нейтралізують розчином триетаноламіну (28,0 г) і дистильованої води (100,0 г), і перемішують до тих пір, поки суміш не набуває гелевидної консистенції. 3.3. Спосіб одержання кінцевого продукту (композиції гелю): До основи гелю, одержаної у відповідності до п. 3.2., поступово додають суспензію лікарського засобу у відповідності до п. 3.1, і гель доповнюють до 7,00 кг дистильваною водою. Одержаний гель гомогенізують протягом п'яти хвилин у вбудованому гомогенізаторі апарату Brogtech при 1200 об/хв. при максимальному діаметрі щілин (1,5 мм). Одержаний гель зберігають без доступу повітря або поміщають в повітронепроникну упаковку (металевий тюбик). Приклад 4 Композиція гелю, що містить цетиризін, як активний інгредієнт: Цетірізін 0,200 г Ментол 0,200 г Етиловий спирт 0,200 г Силіконова рідина 0,65 сСт 1,000 г Силіконова рідина 100 сСт 0,200 г Карбопол 980 NF 0,250 г Триетаноламін 0,200 г Дистильована вода, до 20,000 г Згідно рецептурі з приведеного вище прикладу готували партію гелю масою 7 кг в апараті Brogtech, придатному для виготовлення мазей. 4.1. Спосіб одержання суспензії, що містить активний інгредієнт: Порошок цетиризіна, подрібнений в мікронному колоїдному млині (70,0 г), змішують з силіконовою рідиною 0,65 сСт (350,0 г) і силіконовою рідиною 100 сСт (70,0 г) в хімічному стакані на 800 мл, і суміш гомогенізують в апараті Ultra-Turrax при 4000 об/хв. протягом п'яти хвилин. Одержану суспензію зберігають без доступу повітря до використання. 4.2. Спосіб одержання розчину ментолу: Ментол (70,0 г) розчиняють в етиловому спирті в хімічному стакані на 300 мл. Його зберігають без доступу повітря до використання. 4.3. Спосіб одержання основи гелю: Дистильовану воду (6000 г), наливають в апарат Brogtech, і температуру встановлюють 25 °C. У змішувачі з якірною мішалкою в положенні 4 до суміші поступово додають гідроксипропілметилцелюлозу (140,0 г), і перемішують її при такій же швидкості в об/хв. до повного розчинення мазевої основи (приблизно півтори години). Після розчинення до реакційної суміші додають карбопол 980 NF (35,0 г) і перемішують її протягом чотирьох годин. Суміш нейтралізують розчином триетаноламіну (28,0 г) і дистильованої води (100,0 г), і перемішують до тих пір, поки суміш не набуває гелевидної консистенції. 4.4. Спосіб одержання кінцевого продукту (композиції гелю): До основи гелю, одержаної у відповідності до п. 4.2., поступово додають суспензію лікарського засобу у відповідності до п. 4.1, і гель доповнюють до 7,00 кг дистильованою водою. Одержаний гель гомогенізують протягом п'яти хвилин у вбудованому гомогенізаторі апарату Brogtech при 1200 об/хв. при максимальному діаметрі щілин (1,5 мм). Одержаний гель зберігають без доступу повітря або поміщають в повітронепроникну упаковку (металевий тюбик). Дослідження властивостей проникності і абсорбції препарату згідно даного винаходу Ефекти препаратів згідно даного винаходу досліджували з використанням приведеного нижче способу. Експерименти з препаратом проведені з використанням Препарату 1, в якому використані активні інгредієнти, перераховані в таблиці 1. Фізіологічні властивості препаратів гелів, одержаних у такий спосіб, протестовані за допомогою аналізу проникності мембрани in vitro. Апарат, використаний для дослідження проникності мембрани, включає відкритий проникний осередок, що має визначену площу поверхні і об'єм, розміщену в камері з контрольованими умовами (температурою, потоком повітря, відносною вологістю, освітленням), що має систему контролю, придатну для підтримки такого контрольованого навколишнього середовища, систему подачі, придатну для забезпечення потоку акцепторної фази, осередок для зразка і аналітичну систему тестування. 8 UA 101479 C2 5 10 15 Вираз "відкритий осередок" означає, що зразок, що наноситься на поверхню осередку, знаходиться в безпосередньому контакті з навколишнім повітрям. Під час тестування препаратів згідно даного винаходу не застосовували ні потік повітря, ні дію світла. Вимірювання проводили при освіженні навколишнього середовища і при температурі 2 32 °C. Осередок, використовуваний в дослідженні, має певну площу поверхні 10,00 см і об'єм 3 3,00 см . Використовували мембрану Cellaftate товщиною 30 мкм. Зразок препарату, що тестували, приблизно 0,5 г вимірювали з аналітичною точністю і переносили на поверхню осередку, що моделює область нанесення на шкіру. Під час тестів акцепторний розчин (0,9 мас. % розчин хлориду натрію) доставляли через проникний осередок і кількісно визначали концентрацію активного інгредієнта у витікаючій рідині, що покидає осередок. Вимірювання продовжували протягом шести годин. Потім визначали частку активного інгредієнта, що пройшов через мембрану, використовуючи профіль його концентрації у витікаючій рідині. Частка абсорбованого активного інгредієнта щодо кількості, нанесеної на мембрану, служить як оцінка ступеня абсорбції в умовах реального часу. Даним способом автори винаходу визначили, що відносна абсорбована кількість активних інгредієнтів для тестованих активних інгредієнтів була низькою (тобто нижче 1%), що вказує на те, що препарат є таким, що не абсорбується. Проте ця кількість придатна для прояву місцевої або локальної дії. У таблиці 1 продемонстровані відносні абсорбовані кількості декількох активних інгредієнтів, включених в препарат згідно даного винаходу. 20 Таблиця 1 Активний інгредієнт Еконазол (основа) Ацикловір Сульфадимідин Альбумін-таннат Концентрація (%мас/мас) 1,00% 5,00% 5,00% 0,50% Відносна абсорюована кількість за шість годин* 0,03% 0,05% 0,01% 0,00% * - відсоток сумарної маси активного інгредієнта, присутнього в зразку (приблизно 0,5 г гелю) ФОРМУЛА ВИНАХОДУ 25 30 35 1. Трансдермалыний препарат, що містить фармацевтично активний інгредієнт, який відрізняється тим, що частинки активного інгредієнта покриті легколетучими силіконами або їх сумішшю, і ці покриті частинки диспергують в водній гелевій або кремовій основі. 2. Композиція за п. 1, яка відрізняється тим, що активний інгредієнт є ацикловір, піроксикам, мелоксикам, ібупрофен, диклофенаку натрієва або калієва сіль, клотримазол, біфоназол, метронідазол, ніфедипін, нітрогліцерин або цетиризин. 3. Композиція за п. 1, яка відрізняється тим, що летючий силіконовий компонент є гексаметилдисилоксан і/або октаметилтрисилоксан і/або декаметил пентацикосилоксан. 4. Композиція за п. 1, яка відрізняється тим, що водна гелева основа є карбоксивініловий полімер, гідроксипропілметилцелюлоза або їх суміш. 5. Спосіб одержання композиції за п. 1, який відрізняється тим, що частинки активного інгредієнта покривають легколетучими силіконами або їх сумішшю, і одержану суміш розподіляють в водній гелевій або кремовій основі, так, щоб частинки в водній гелевій або в кремовій основі були оточені силіконовим покриттям. 9 UA 101479 C2 10 UA 101479 C2 11 UA 101479 C2 12 UA 101479 C2 Комп’ютерна верстка С. Чулій Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 13
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical formulations comprising highly volatile silicones
Автори англійськоюMikulasik, Endre, Fazekas Patrik
Назва патенту російськоюФармацевтические препараты, содержащие легколетучие силиконы
Автори російськоюМикуласик Эндре, Фазекас Патрик
МПК / Мітки
МПК: A61K 31/196, A61K 47/48, A61K 47/02, A61K 9/06
Мітки: фармацевтичні, містять, легколетучі, препарати, силікони
Код посилання
<a href="https://ua.patents.su/15-101479-farmacevtichni-preparati-shho-mistyat-legkoletuchi-silikoni.html" target="_blank" rel="follow" title="База патентів України">Фармацевтичні препарати, що містять легколетучі силікони</a>
Попередній патент: Сполуки, корисні як інгібітори raf-кінази
Наступний патент: Ячмінь з низьким вмістом гордеїнів та спосіб виробництва продукту харчування або напою на основі солоду
Випадковий патент: Парова воскотопка