Спосіб підвищення біодоступності інгібітора протеази ns3/4а вірусу гепатиту с
Формула / Реферат
1. Спосіб підвищення біодоступності інгібітора протеази NS3/4A вірусу гепатиту С формули І у пацієнта, який включає спільне введення пацієнту сполуки формули І
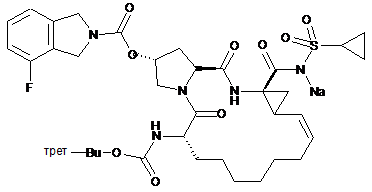 (I),
(I),
та інгібітора монооксигенази цитохрому Р450, де інгібітор монооксигенази присутній в кількості, достатній для підвищення рівнів в крові І, де інгібітор монооксигенази цитохрому Р450 являє собою ритонавір.
2. Спосіб за пунктом 1, де сполука формули І та ритонавір знаходяться в окремих дозованих формах.
3. Спосіб за пунктом 2, де окремі дозовані форми вводять практично одночасно.
4. Спосіб за пунктом 1, де сполуку формули І та ритонавір вводять в одній дозованій формі.
5. Спосіб лікування інфекції, викликаної вірусом гепатиту С у пацієнта, який цього потребує, що включає введення пацієнту, який цього потребує, сполуки формули І, вільної основи або її фармацевтично прийнятної солі та інгібітора монооксигенази цитохрому Р450 або його фармацевтично прийнятної солі, де інгібітор монооксигенази цитохрому Р450 являє собою ритонавір або його фармацевтично прийнятну сіль.
6. Спосіб за пунктом 5, де спосіб включає спільне введення разом із сполукою формули І та ритонавіром, принаймні одного додаткового засобу, вибраного із імуномодулюючого засобу та/або антивірусного засобу, та/або іншого інгібітора протеази NS3/4A HCV, та/або інгібітора NS5B полімерази, та/або інгібітора вірусу широкого спектра дії, та/або інгібітора іншого цитохрому Р-450.
7. Застосування R7227 та інгібітора монооксигенази цитохрому Р450, де кількість інгібітора монооксигенази цитохрому Р450 достатня для підвищення рівнів в крові R7227 в порівнянні із рівнями в крові R7227 за відсутності інгібітора монооксигенази цитохрому Р450 для підвищення біодоступності інгібітора протеази NS3/4A вірусу гепатиту С R7227, де інгібітор монооксигенази цитохрому Р450 являє собою ритонавір або його фармацевтично прийнятну сіль.
8. Застосування R7227 та інгібітора монооксигенази цитохрому Р450, де кількість інгібітора монооксигенази цитохрому Р450 достатня для підвищення рівнів в крові R7227 в порівнянні із рівнями в крові R7227 за відсутності інгібітора монооксигенази цитохрому Р450 для приготування лікарського засобу для підвищення біодоступності інгібітора протеази NS3/4A вірусу гепатиту С R7227, де інгібітор монооксигенази цитохрому Р450 являє собою ритонавір або його фармацевтично прийнятну сіль.
9. Застосування за пунктом 7 або 8, де R7227 та ритонавір знаходяться в окремій дозованій формі.
10. Застосування за пунктом 7 або 8, де R7227 та ритонавір вводяться одночасно.
11. Застосування за пунктом 7 або 8 R7227 та ритонавіру та принаймні одного додаткового засобу, вибраного із імуномодулюючого засобу; антивірусного засобу; іншого інгібітора протеази NS3/4A HCV, інгібітора NS5B полімерази, інгібітора вірусу широкого спектра дії та інгібітора іншого цитохрому Р-450.
12. Фармацевтична композиція, яка містить сполуку формули І або її вільну основу, або іншу фармацевтично прийнятну сіль та інгібітор монооксигенази цитохрому Р450 або його фармацевтично прийнятну сіль, де інгібітор монооксигенази цитохрому Р450 відповідно до пункту являє собою ритонавір або його фармацевтично прийнятну сіль та принаймні один фармацевтично прийнятний наповнювач, розчинник або носій.
13. Фармацевтична композиція за пунктом 12, де інгібітор монооксигенази цитохрому Р450 являє собою ритонавір або його фармацевтично прийнятну сіль.
14. Набір, який містить інгібітор NS3 протеази вірусу гепатиту С відповідно до формули І та ритонавір.
15. Фармацевтична упаковка, яка містить сполуку відповідно до формули І, ритонавір та інформаційну інструкцію, яка містить вказівки щодо застосування інгібіторів.
Текст
Реферат: Винахід належить до способу підвищення біодоступності інгібітора протеази NS3/4A вірусу гепатиту С формули І, який включає спільне введення пацієнту UA 103801 C2 (12) UA 103801 C2 O O N O O O O S N F N H N трет O N H Na Bu O O (І), який включає спільне введення пацієнту вказаного інгібітора та інгібітора монооксигенази цитохрому Р450 ритонавіру. UA 103801 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується покращеного способу або введення сполуки відповідно до формули I для лікування HCV (вірусу гепатиту С) шляхом спільного введення з ритонавіром. Винахід також стосується фармацевтичних композицій, які містять сполуку формули I та ритонавір. Вірус гепатиту C (HCV) є основною причиною хронічних захворювань печінки в усьому світі. (Boyer, N. та ін., J. Hepatol. 2000 32:98-112). За оцінками Всесвітньої Організації Охорони здоров’я (ВООЗ), понад 170 мільйонів людей у всьому світі (або приблизно 3% світової популяції) інфіковано одноланцюговою рибонуклеїновою кислотою (РНК) HCV. (G.M. Lauer та B.D. Walker, N. Engl. J. Med. 2001 345:41–52) Приблизно в однієї п’ятої хронічно інфікованих пацієнтів із HCV з часом розвивається цироз печінки, зумовлюючи різноманітні захворювання та смертність, включаючи печінкову недостатність та печінково-клітинний рак (T.J. Liang та ін. Ann. Intern. Med. 2000 132:296-305; M.W. Fried та ін. N. Engl. J. Med. 2002 347:975-982). HCV інфекція є основним показом для трансплантації печінки в США (NIH Consensus Statement on Management of Hepatitis C. 2002 June 10-12 19(3):146; http://www.ncbi.nlm.nih.gov/pubmed/14768714). HCV класифікується як представник сімейства вірусів Flaviviridae, яке включає роди флавівірусів, пестивірусів, та гапацейвірусів, які включають віруси гепатиту (Rice, C. M., Flaviviridae: The viruses and their replication. В: Fields Virology, редактори: B. N. Fields, D. M. Knipe та P. M. Howley, Lippincott-Raven Publishers, Philadelphia, Pa., розділ 30, 931-959, 1996). HCV представляє собою оболонковий вірус, що містить позитивно-полярний одноланцюговий РНК геном із розміром приблизно 9,4 кб. Вірусний геном складається із висококонсервативної 5' нетрансльованої ділянки (UTR), довгої відкритої рамки зчитування, яка кодує поліпротеїновий попередник - приблизно 3011 амінокислот та короткої 3' UTR. При генетичному аналізі HCV було ідентифіковано шість основних генотипів, які послідовності ДНК який відрізняються на 30%. Було виокремлено понад 30 підтипів. В США приблизно 70% інфікованих особин мають інфекцію типу 1a та 1b. Тип 1b є найбільш переважним підтипом в Азії. (X. Forns та J. Bukh, Clinics in Liver Disease 1999 3:693-716; J. Bukh та ін., Semin. Liv. Dis. 1995 15:41-63). На превеликий жаль, інфекція 1 є більш резистентною до терапії в порівнянні з типом 2 або 3 генотипів (N. N. Zein, Clin. Microbiol. Rev., 2000 13:223-235). Геном HCV кодує поліпротеїн 3010-3033, амінокислот (Q. L. Choo, та ін., Proc. Natl. Acad. Sci. USA, 1991 88:2451-2455; N. Kato та ін., Proc. Natl. Acad. Sci. USA 1990 87:9524-9528; A. Takamizawa та ін., J. Virol. 1991 65:1105-1113). Структурні білки вірусів включають нуклеокапсидний коровий білон (C) та два оболонкові глікопротеїни, E1 та E2. HCV також кодує дві протеази, цинк-залежну металопротеїназу, яка кодується NS2-NS3 ділянкою, та серинпротеазу, яка кодується в NS3 ділянці. NS3 протеаза HCV представляє собою серинову протеазу, яка допомагає процесингу більшості вірусних ферментів, і, таким чином, розглядається як важлива для реплікації та інфекційності вірусу. Ці протеази відповідають за розщеплення специфічних ділянок поліпротеїну-попередника в зрілі пептиди. Карбоксильна половина неструктурного білка 5, NS5B, містить РНК-залежну РНК-полімеразу. В даний час доступна обмежена кількість дозволених терапій для лікування HCV інфекції. Нові та існуючі терапевтичні підходи для лікування HCV інфекції та інгібування активності NS5B полімерази HCV були оглянуті в: R. G. Gish, Sem. Liver. Dis., 1999 19:5; Di Besceglie, A. M. та Bacon, B. R., Scientific American, October: 1999 80-85; G. Lake-Bakaar, Curr. Drug Targ. Infect. Dis. 2003 3(3):247-253; P. Hoffmann та ін., Exp. Opin. Ther. Patents 2003 13(11):1707-1723; M. P. Walker та ін., Exp. Opin. Investing. Drugs 2003 12(8):1269-1280; S.-L. Tan та ін., Nature Rev. Drug Discov. 2002 1:867-881; J. Z. Wu та Z. Hong, Curr. Drug Targ-Infect. Dis. 2003 3(3):207-219. Рибавірин (амід 1-((2R,3R,4S,5R)-3,4-дигідрокси-5-гідроксиметил-тетрагідро-фуран-2-іл)-1H® [1,2,4]триазол-3-карбонової кислоти; Virazole ) представляє собою синтетичний, антифірусний нуклеозидний аналог широкого спектру дії, який не індукує інтреферону. Рибавірин має активність in vitro по відношенню до деяких ДНК- та РНК-вірусів, включаючи Flaviviridae (Gary L. Davis. Gastroenterology 2000 118:S104-S114). Незважаючи на те, що при монотерапії рибавірин зменшує рівні в сироватці амінотрансферази до норми у 40% пацієнтів, він не знижує рівні в сироватці РНК HCV. Рибавірин також проявляє суттєву токсичність і відомо, що він індукує анемію. Вірамідин представляє собою проліки рибавірину, що перетворюються в рибавірин за допомогою аденозин-дезамінази в гепатоцитах. (J. Z. Wu, Antivir. Chem. Chemother. 2006 17(1):33-9) Інтерферони (IFN) доступні для лікування хронічного гепатиту приблизно впродовж десяти років. IFN представляють собою глікопротеїни, які продукуються імунними клітинами у відповідь на вірусну інфекцію. Розрізняють два відмінні типи інтерферонів: тип 1 включає деякі альфаінтерферони та один бета-інтерферон, тип 2 включає гамма-інтерферон. Інтерферони 1 типу 1 UA 103801 C2 5 10 15 20 25 30 35 40 45 50 55 60 продукуються в основному інфікованими клітинами та захищають сусідні клітини від інфікування de novo. IFN інгібують реплікацію вірусів для багатьох вірусів, включаючи HCV, і при застосуванні у вигляді монотерапії для лікування інфекції гепатиту C, IFN пригнічують рівні РНК HCV до рівнів, які неможливо виявити. Додатково, IFN нормалізує рівні амінотрансферази в сироватці. На жаль, ефекти IFN є тимчасовими. Призупинення терапії приводить до рівня рецидиву 70% і лише 10-15% проявляють стійку вірусологічну відповідь з нормальними рівнями аланін-трансферази в сироватці. (Davis, Luke-Bakaar, вище) Комбінована терапія HCV за допомогою рибавірину та інтерферону- на даний час є стандартом лікування пацієнтів із HCV, які раніше не приймали дані препарати. Комбінування рибавірину та PEG-IFN (нижче) приводить до стійкої вірусологічної відповіді (SVR) , що визначається як неможливість виявити рибонуклеїнову кислоту вірусу гепатиту C (HCV РНК) через 24 тижні після завершення терапії (M.W. Fried та ін. вище) у 54-56% пацієнтів із типом 1 HCV. SVR підходить у 80% для типу 2 та 3 HCV. (Walker, вище) Крім того, PEG-IFN вводять за допомогою ін’єкції, та гематологічні та системні токсичності PEG-IFN та RBV складно переносяться багатьма пацієнтами при необхідності тривалого (аж до 48 тижнів) лікування. В даний час, не існує SOC лікування для пацієнтів, у яких або спостерігається рецидив або відсутня відповідь на (нереспондери) лікування PEG-IFN /RBV. Враховуючи значне поширення CHC захворювання у всьому світі, висока частота відмов при лікуванні із даним SOC, та толерантності, які супроводжують даний SOC, існує важлива нереалізована медична проблема поліпшення та розширення терапевтичних можливостей для цих популяцій пацієнтів. Ефективність імунного захисту організму затримується здатністю HCV порушувати, обходити, та протидіяти імунним реакціям організму, не лише забезпечуючи тривалу вірусну інфекцію, але також досить часто резистентність до антивірусної дії IFN терапії (M.Gale, Jr. та E.M. Foy, Nature 2005. 436:939–945). Таким чином, стратегія, яка націлена на сам вірус, може поліпшити результати терапії в порівнянні з існуючими в даний момент можливостями терапії. Зараз ідентифіковані різні потенціальні нові молекулярні мішені для розробки лікарських засобів як анти-HCV терапевтичні засоби, не обмежуючись лише ними, NS2-NS3 аутопротеаза, NS3 протеаза, NS3 геліказа та NS5B полімераза. РНК-залежна РНК-полімераза є абсолютно необхідною для реплікації одноланцюгового, позитивно-полярного, РНК геному. Цей фермент викликає надзвичайний інтерес серед медичних хіміків. Інгібітори полімерази HCV представляють собою іншу мішень для відкриття лікарських засобів та сполук на стадії розробки, включаючи R-1626, R-7128, IDX184/IDX102, PF-868554 (Pfizer), VCH-759 (ViroChem), GS-9190 (Gilead), A-837093 та A-848837 (Abbot), MK-3281 (Merck), GSK949614 та GSK625433 (Glaxo), ANA598 (Anadys), VBY 708 (ViroBay). Інгібітори NS3 протеази HCV також були ідентифіковані як потенційно придані для лікування HCV. Інгібітори протеази на стадіях клінічних випробувань включають VX-950 (Telaprevir, Vertex), SCH503034 (Broceprevir, Schering), TMC435350 (Tibotec/Medivir) та ITMN-191 (Intermune). Інші інгібітори протеази на більш ранніх стадіях розробки включають MK7009 (Merck), BMS-790052 (Bristol Myers Squibb), VBY-376 (Virobay), IDXSCA/IDXSCB (Idenix), BI12202 (Boehringer), VX-500 (Vertex), PHX1766 Phenomix). В одному аспекті даного винаходу забезпечується спосіб підвищення біодоступності та або рівня в крові інгібітора NS3 протеази вірусу гепатиту С відповідно до формули I у пацієнта, який включає спільне введення пацієнту сполуки формули I та інгібітора монооксигенази цитохрому P450. В іншому аспекті даного винаходу забезпечується фармацевтична композиція, яка містить сполуку формули I та інгібітор монооксигенази цитохрому P450. Терміни, виражені в формі одними або множини, як використовується в даній заявці, стосуються одного або декількох таких об’єктів; наприклад, сполука стосується однієї або декількох сполук або принаймні однієї сполуки. Як такі, терміни у формі однини чи множини, “один або більше”, та “принаймні один” можуть застосуватися в даній заявці взаємозамінно. Як використовується в даному винаході, чи в перехідній фразі чи в пункті формули винаходу, терміни "включає (включають)" та "що включає" слід розуміти у загальноприйнятому значенні. Таким чином, терміни слід інтерпретувати синонімічно з фразами "що має принаймні" або "що включає принаймні". При застосуванні в контексті процесу, термін "що включає" означає, що процес включає принаймні одну вказану стадію, але може включати додаткові стадії. При застосуванні в контексті сполуки або композиції, термін "що включає" означає, що сполука або композиція включає принаймні одну із вказаних характерних особливостей або компонентів, але також може включати додаткові характерні особливості або компоненти. Термін “необов’язковий” або “необов’язково”, як використовується в даному винаході, означає, що подія або обставина, описана далі, може не відбутися, і що опис включає приклади, 2 UA 103801 C2 5 10 15 20 25 30 35 40 45 50 коли подія чи обставина відбувається, і приклади, в яких не вона відбувається. Як використовується в даному винаході, перелік числового діапазону для змінних означає, що винахід може реалізовуватися на практиці із значенням змінної, що дорівнює будь-якому значенню у вказаному інтервалі. Таким чином, для змінної, яка за своєю природою дискретна, значення змінної може дорівнювати будь-якому цілому значенні числового діапазону, включаючи кінцеві точки діапазону. Аналогічно до цього, для змінної, яка за своєю природою безперервна, значення змінної може дорівнювати будь-якій дійсній величині числового інтервалу, включаючи кінцеві точки діапазону. Для прикладу, змінна, яка описана як має значення в інтервалі від 0 до 2, може мати значення 0, 1 або 2 для змінних, які за своєю природою дискретні, та може мати значення 0,0, 0,1, 0,01, 0,001, або будь-яке інше дійсне значення для змінних, які за своєю природою безперервні. Існує потреба в композиціях та терапевтичних комбінаціях для лікування HCV. Доведено, що комбінована хіміотерапія є ефективною для лікування HCV, проте, дотримання пацієнтами схеми лікування поліпшується при зменшенні кількості доз та частоти введення. Удосконалення сполук та схем застосування будуть корисними в анти-HCV терапіях. Даний винахід забезпечує спосіб введення сполуки формули I (R7227) та CYP 3A4 інгібітора, який збільшує біодоступність R7227 та зменшує кількість R7227, яку слід вводити. Сполука I (R7227) є надзвичайно ефективним та селективним макроциклічним, пептидоміметичним інгібітором активності протеази NS3/4A, вибраним для удосконалення як пероральний засіб для лікування HCV інфекції завдяки ефективності, яка проявляється відносно інгібування NS3/4A протеази. R7227 проявляє суттєвий вплив на печінку тварин, яка є основним або єдиним сайтом реплікації HCV у людей, та має прийнятний токсикологічний профіль. R7227 є надзвичайно ефективним інгібітором NS3/4A протеолізу із 50% інгібуючою концентрацією (IC50) ≤ 0,225 нM та високим ступенем специфічності для призначеної мішені. В дослідженнях ефективності на клітинах із застосуванням генотипу 1 HCV реплікону, R7227 має IC50 1,77 нM. R7227 додатково проявляє синергетичні антивірусні ефекти із кон’югованим із поліетиленгліколем (“пегільованим”) інтерфероном альфа-2a (PEG-IFN-2a, Pegasys®, Roche) в аналогічному дослідженні на клітинах, що підтверджує корисність R7227 для терапії HCV. O O O S N OO O N I Na F N N OH H N трет-Bu-O O Було встановлено, що цитохроми, особливо CYP3A4 ізоформа, метаболізують R7227, що зумовлює потребу в більш частому введені та в більш високих рівнях доз для підтримання терапевтично ефективних рівнів в крові. На ранніх доклінічних стадіях, фенотипування цитохрому P450 з використанням хімічних інгібіторів свідчить про те, що множинні CYP ізоферменти, включаючи 3A4, 2C19, 1A2, 2D6, та 2C9, приймають участь в метаболізмі (R7227). Подальші експерименти із рекомбінантними CYP свідчать про те, що лише CYP3A4 метаболізує R7227 до такого рівня, що може впливати на фармакокінетику. Таким чином, інгібітор монооксигенази цитохрому P450 в кількості, ефективній для інгібування метаболізму інгібітора протеази, може підвищувати біодоступність R7227 в порівнянні з введенням за відсутності CYP інгібітора. Деякі лікарські засоби метаболізуються ферментами цитохрому P450. Ці ферменти зазвичай окислюють лікарські засоби, що приводить до несприятливих фармакокінетичних характеристик (наприклад, знижені рівні в крові, знижений період напівжиття). В цих випадках інгібування метаболізму лікарського засобу може призвести до поліпшення фармакокінетичного профілю лікарського засобу. (див., наприклад, патент US № 6,037,157; D. E. Kempf та ін. Antimicrob. Agents Chemother., 1997 41:654-660; W.J. Curatolo та G. Foulds, патентна публікація US 2004/0091527 та M.G. Cordingley, патентна публікація US US2004/0152625).. Для встановлення того факту, що комбінована терапія із антагоністом цитохрому P450 буде поліпшувати фармакокінетику лікарського засобу, повинні бути з’ясовані метаболічні шляхи. Цитохром P450 (CYP P450) представляє собою дуже велике та різноманітне суперсімейство гемопротеїнів. Як екзогенні, так і ендогенні сполуки є субстратами для ізоформ цитохрому P450. Цитохром P450 3A4 (CYP3A4; EC 1.14.13.97), є одним із найбільш важливих ферментів, задіяних в метаболізм ксенобіотиків в організмі. CYP3A4 задіяний в окислення 3 UA 103801 C2 5 10 15 20 25 30 35 40 45 50 55 60 найрізноманітніших субстратів всіх типів CYP. Хоча CYP3A4 виявлений головним чином в печінці, він також присутній в інших органах та тканинах організму. Будь-який CYP інгібітор, який поліпшує фармакокінетику релевантної NS3 протеази, може застосовуватися в способі відповідно до даного винаходу. Ці CYP інгібітори включають, але не обмежуючись лише ними, ритонавір (WO 94/14436), кетоконазол, тролеандоміцин, 4-метил піразол, циклоспорін, клометіазол, цитимедин, ітраконазол, флуконазол, міконазол, флувоксамін, флуоксетин, нефазодон, сетралін, індінавір, нелфінавір, ампренавір, фосампренавір, саквінавір, лопінавір, делавірдин та еритроміцин. Переважний CYP інгібітор представляє собою ритонавір. Ритонавір представляє собою ефективний інгібітор активності CYP3A4 та він в даний час використовується в низьких нетерапевтичних дозах (наприклад, 100 мг два рази на добу) для підвищення або “бустерування” PK інших інгібіторів HIV протеази (PI). Враховуючи значне поширення спільного інфікування HIV/HCV, R7227 може застосовуватися для лікування HCV в пацієнтів, інфікованих одночасно HIV/HCV, які отримували ритонавір-бустовані HIV PI, що призводить до можливих взаємодій між ритонавір-бустованими HIV PI та R7227. Проте, додатково до інгібуючого впливу на 3A4, ритонавір, ймовірно, індукує активності інших ферментів, включаючи CYP 1A2, 2C9, та 2C19. Незважаючи на те, що при однократному введенні, інгібуючий вплив ритонавіру головним чином буде приводити до підвищених рівнів R7227, хронічне дозування, прогнозоване при терапії HCV, може індукувати інші ізоформи, які можуть окислювати R7227, коригуючи бажаний інгібуючий вплив. В одному варіанті здійснення даного винаходу забезпечується спосіб підвищення біодоступності інгібітора протеази NS3/4A вірусу гепатиту С R7227 у пацієнта, який цього потребує, який включає введення R7227 та інгібітора монооксигенази цитохрому P450, де кількість інгібітора монооксигенази цитохрому P450 достатня для підвищення рівнів в крові R7227 в порівнянні з рівнями в крові за відсутності інгібітора монооксигенази цитохрому P450. В іншому варіанті здійснення даного винаходу забезпечується спосіб підвищення біодоступності R7227 у пацієнта, який включає введення R7227 та ритонавіру. Ритонавір ® випускається Abbott Laboratories під торгівельною назвою NORVIR як інгібітор HIV протеази (Реєстраційний номер Chemical Abstract 1555213-67-5). В іншому варіанті здійснення даного винаходу забезпечується спосіб підвищення біодоступності R7227 у пацієнта, який включає спільне введення R7227 та ритонавіру, де R7227 та ритонавір знаходяться в окремій дозованій формі. Дози кожного з них можна приймати або приблизно в один і той самий час або дози можна приймати через різні інтервали. В іншому варіанті здійснення даного винаходу забезпечується спосіб підвищення біодоступності R7227 у пацієнта, який включає спільне введення R7227 та ритонавіру, де R7227 та ритонавір вводяться одночасно. R7227 та ритонавір можуть бути присутні в одному препараті для покращення зручності для пацієнта. В іншому варіанті здійснення даного винаходу забезпечується спосіб підвищення біодоступності R7227 у пацієнта, який включає спільне введення R7227 та ритонавіру, де R7227 та ритонавір вводять в одній дозованій формі. В іншому варіанті здійснення даного винаходу забезпечується спосіб підвищення біодоступності R7227 у пацієнта, який включає спільне введення дози від 25 до 600 мг/добу, переважно від 25 до 500 мг/добу R7227 та від 50 до 400 мг/добу ритонавіру. В іншому варіанті здійснення даного винаходу забезпечується спосіб підвищення біодоступності R7227 у пацієнта, який включає спільне введення дози від 50 до 300 мг/добу R7227 та від 100 до 200 мг/добу ритонавіру. В іншому варіанті здійснення даного винаходу забезпечується спосіб лікування HCV, який включає введення пацієнту, який цього потребує, сполуки формули I, або вільної основи або її іншої фармацевтично прийнятної солі, та інгібітора монооксигенази цитохрому P450. В іншому варіанті здійснення даного винаходу забезпечується спосіб лікування HCV, який включає введення пацієнту, який цього потребує, сполуки формули I, або вільної основи або її іншої фармацевтично прийнятної солі, та ритонавіру. Доведено, що комбінована терапія є цінним компонентом антивірусної терапії, і, отже, лікування HCV з використанням R7227 та ритонавіру може включати введення іншого компоненту, включаючи додатковий агент, вибраний із імуномодулюючого засобу; антивірусного засобу; іншого інгібітора HCV протеази; інгібітора іншої мішені в життєвому циклі HCV; такого як інгібітор HCV полімерази або їх комбінацій. В іншому варіанті здійснення даного винаходу забезпечується спосіб лікування HCV, який включає спільне введення разом із сполукою формули I та ритонавіром принаймні одного додаткового засобу, вибраного із імуномодулюючого засобу та/або антивірусного засобу та/або 4 UA 103801 C2 іншого інгібітора протеази NS3/4A HCV та/або інгібітора NS5B полімерази та/або інгібітора вірусу широкого спектру дії та/або інгібітора іншого цитохрому P-450. В іншому варіанті здійснення даного винаходу забезпечується спосіб лікування HCV, де спосіб включає спільне введення сполуки формули II (R7128) разом із R7227 та ритонавіром. NH2 N i-Pr-C(O)O O N O Me 5 10 15 20 25 30 35 40 45 50 i-Pr-C(O)O F II В ще іншому варіанті здійснення даного винаходу забезпечується спосіб лікування HCV, де спосіб включає спільне введення -, - або -інтерферону та/або тимозину та/або рибавірину та/або R7128 разом із R7227 та ритонавіром. В іншому варіанті здійснення даного винаходу забезпечується застосування R7227 та інгібітора монооксигенази цитохрому P450, де кількість інгібітора монооксигенази цитохрому P450 достатня для підвищення рівнів в крові R7227 в порівнянні із рівнями в крові за відсутності інгібітора монооксигенази цитохрому P450 для підвищення біодоступності інгібітора протеази NS3/4A вірусу гепатиту С R7227, або для приготування лікарського засобу для підвищення біодоступності інгібітора протеази NS3/4A вірусу гепатиту С R7227. В іншому варіанті здійснення даного винаходу забезпечується застосування R7227 та ритонавіру для підвищення біодоступності R7227, або для приготування лікарського засобу для підвищення біодоступності R7227. Ритонавір випускається Abbott Laboratories під торгівельною ® назвою NORVIR як інгібітор HIV протеази (Реєстраційний номер Chemical Abstract 1555213-675). В іншому варіанті здійснення даного винаходу забезпечується застосування R7227 та ритонавіру для приготування лікарського засобу для підвищення біодоступності R7227, де R7227 та ритонавір знаходяться в окремій дозованій формі. Дози кожного з них можна приймати або приблизно в один і той самий час або дози можна приймати через різні інтервали. В іншому варіанті здійснення даного винаходу забезпечується застосування R7227 та ритонавіру для приготування лікарського засобу для підвищення біодоступності R7227, де R7227 та ритонавір вводяться одночасно. R7227 та ритонавір можуть бути присутні в одному препараті для покращення зручності для пацієнта. В іншому варіанті здійснення даного винаходу забезпечується застосування R7227 в комбінації із ритонавіром для підвищення біодоступності R7227, де R7227 та ритонавір вводять в одній дозованій формі, або для приготування лікарського засобу для підвищення біодоступності R7227, де R7227 та ритонавір вводять в одній дозованій формі. В іншому варіанті здійснення даного винаходу забезпечується застосування R7227 та ритонавіру для приготування лікарського засобу, що включає спільне введення дози від 25 до 600 мг/добу, переважно від 25 до 500 мг/добу R7227 та від 50 до 400 мг/добу ритонавіру. В іншому варіанті здійснення даного винаходу забезпечується застосування R7227 та ритонавіру для приготування лікарського засобу для підвищення біодоступності для спільного введення дози від 50 до 300 мг/добу R7227 та від 100 до 200 мг/добу ритонавіру. В іншому варіанті здійснення даного винаходу забезпечується застосування сполуки формули I, вільної основи або її іншої фармацевтично прийнятної солі, та інгібітора монооксигенази цитохрому P450 для лікування HCV, або для приготування лікарського засобу для лікування HCV. В іншому варіанті здійснення даного винаходу забезпечується застосування сполуки формули I, вільної основи або її іншої фармацевтично прийнятної солі, та ритонавіру для лікування HCV, або для приготування лікарського засобу для лікування HCV. Доведено, що комбінована терапія є цінним компонентом антивірусної терапії, і, отже, лікування HCV з використанням R7227 та ритонавіру може включати спільне введення іншого компоненту, включаючи додатковий агент, вибраний із імуномодулюючого засобу; антивірусного засобу; іншого інгібітора протеази HCV; інгібітора іншої мішені в життєвому циклі HCV; такого як інгібітор HCV полімерази або їх комбінацій. В іншому варіанті здійснення даного винаходу забезпечується застосування сполуки формули I та ритонавіру в комбінації із принаймні одним додатковим засобом, вибраним із імуномодулюючого засобу та/або антивірусного засобу та/або іншого інгібітора протеази NS3/4A HCV та/або інгібітора NS5B полімерази та/або інгібітора вірусу широкого спектру дії та/або 5 UA 103801 C2 інгібітора іншого цитохрому P-450 для лікування HCV, або для приготування лікарського засобу для лікування HCV. В іншому варіанті здійснення даного винаходу забезпечується застосування сполуки формули II (R7128) NH2 N i-Pr-C(O)O O N O Me 5 10 15 20 25 30 35 40 45 50 i-Pr-C(O)O F II разом із R7227 та ритонавіром для лікування HCV, або для приготування лікарського засобу для лікування HCV. В ще іншому варіанті здійснення даного винаходу забезпечується застосування -, - або інтерферону та/або тимозину та/або рибавірину та/або R7128 разом із R7227 та ритонавіром для лікування HCV, або для приготування лікарського засобу для лікування HCV. В іншому варіанті здійснення даного винаходу забезпечується фармацевтична композиція, яка містить R7227 або її фармацевтично прийнятну сіль, інгібітор монооксигенази цитохрому P450 або його фармацевтично прийнятну сіль, та принаймні один фармацевтично прийнятний наповнювач, розчинник або носій. В іншому варіанті здійснення даного винаходу забезпечується фармацевтична композиція, яка містить R7227, або вільну основу або її іншу фармацевтично прийнятну сіль, інгібітор монооксигенази цитохрому P450, та принаймні один фармацевтично прийнятний наповнювач, розчинник або носій. В ще іншому варіанті здійснення даного винаходу забезпечується , яка включає R7227, або вільну основу або її іншу фармацевтично прийнятну сіль, інгібітор монооксигенази цитохрому P450, інгібітор HCV полімерази R7128 та принаймні один фармацевтично прийнятний наповнювач, розчинник або носій. В іншому варіанті здійснення даного винаходу забезпечується фармацевтична композиція, яка містить R7227, або вільну основу або її іншу фармацевтично прийнятну сіль, ритонавір, або його фармацевтично прийнятну сіль, та принаймні один фармацевтично прийнятний наповнювач, розчинник або носій. В іншому варіанті здійснення даного винаходу забезпечується набір, який містить інгібітор NS3 протеази вірусу гепатиту С відповідно до формули I та ритонавір. У варіанті здійснення даного винаходу забезпечується фармацевтична упаковка, яка містить сполуку відповідно до формули I, ритонавір, та необов’язково інформаційну вкладку, яка містить вказівки щодо застосування інгібіторів. Було описано, що ритонавір в низькій дозі підвищує експозицію мідазоламу, найбільш чутливого субстрату CYP3A зонду, приблизно в 7 разів. (A.A. Mathias та ін., Clin. Pharmacol. ® Ther. 2009 85(1)64-70). За допомогою SimCYP симуляції (SymCYP Limited, Blades Enterprise Centre, John Street, Sheffield S2 4SU, UK) передбачають, що ритонавір може підвищувати експозицію R7227 в інтервалі приблизно 2- та 4-рази, враховуючи той факт, що вклад CYP3A в сумарну елімінацію R7227 становить 50% та 100%, відповідно. При спільному введенні із ритонавіром в цьому дослідженні, передбачене 4-х кратне підвищення в R7227 експозиції є все ще суттєво нижчим, ніж ті, що спостерігаються при найбільше безпечній та переносимій дозі 1600 мг в SAD дослідженні на здорових добровольцях. Багатократні дози ритонавіру 100 мг кожні 12 годин суттєво підвищують R7227 AUC0→ , Cmax, та C12h приблизно в 5,5-рази, 3,25-рази, та від 27- до 42-разів, відповідно. Вплив багатократних доз ритонавіру на R7227 C12h є меншим, ніж такий при однократному впливу великої дози ритонавіру, можливо, внаслідок індукції CYP ферментів під впливом ритонавіру після багатократного дозування, що коректує в деякій мірі однократний вплив великої дози ритонавіру на CYP 3A4. Таким чином, фармакокінетика R7227 суттєво покращується шляхом спільного введення ритонавіру. Сполуки відповідно до даного винаходу можуть бути приготовлені в різноманітних дозованих формах для перорального введення та з носіями. Пероральне введення може у формі таблеток, таблеток з оболонкою, драже, твердих та м’яких желатинових капсул, розчинів, емульсій, сиропів, або суспензій. Сполуки відповідно до даного винаходу є ефективними при введенні за допомогою інших шляхів введення, включаючи безперервне (внутрішньовенне вливання) місцеве парентеральне, внутрішньом’язеве, внутрішньовенне, підшкірне введення, 6 UA 103801 C2 5 10 15 20 25 30 35 40 45 50 55 60 та введення за допомогою супозиторіїв, а також інші шляхи введення. Переважним способом введення є загалом пероральний, використовуючи загальноприйняте добові режими дозування, які можна корегувати відповідно до ступеня ураження та відповіді пацієнта на активний компонент. Сполука або сполуки відповідно до даного винаходу, а також їх фармацевтично прийнятні солі, разом із одним або більшою кількістю загальноприйнятих наповнювачів, носіїв, або розріджувачів, можна готувати у формі фармацевтичних композицій та одиниць дозування. Фармацевтичні композиції та одиничні дозовані форми можуть містити загальноприйняті наповнювачі у загальноприйнятих співвідношеннях, без або із додатковими активними сполуками або началами, та одиничні дозовані форми можуть містити будь-яку підходящу ефективну кількість активного компонента, відповідно до призначеного застосовуваного добового діапазону дозування. Фармацевтичні композиції можуть застосовуватися у вигляді твердих речовин, таких як таблетки або заповнені капсули, напівтверді речовини, порошки, препарати із сповільненим вивільненням, або рідини, такі як розчини, суспензії, емульсії, еліксири, або заповнені капсули для перорального застосування; або у формі супозиторіїв для ректального або вагінального введення; або у формі стерильних розчинів для ін’єкції для парентерального застосування. Типові препарати будуть містити від приблизно 5% до приблизно 95% активної сполуки або сполук (мас./мас.). Термін "препарат" або "дозована форма" охоплює як тверді, так і рідкі препарати активної сполуки та для фахівця в даній галузі буде зрозуміло, що активний компонент може існувати в різних препаратах залежно від цільового органу або тканини та від бажаної дози та фармакокінетичних параметрів. Термін “наповнювач”, як використовується в даному винаході, стосується сполуки, яка використовується для приготування фармацевтичної композиції, в цілому безпечної, нетоксичної та ні біологічно, ні іншим чином небажаної, та включає наповнювачі, які прийнятні для ветеринарного застосування, а також для фармацевтичного застосування у людей. Сполуки відповідно до даного винаходу можуть вводитися самостійно, але, як правило, їх вводять в суміші з одним або декількома фармацевтичними наповнювачами, розріджувачами або носіями, вибраними відповідно до призначеного шляху введення та стандартної фармацевтичної практики. “Фармацевтично прийнятний” означає, що він корисний для приготування фармацевтичної композиції, і є в цілому безпечним, нетоксичним, та ні біологічно ні іншим чином небажаним та включає ті компоненти, для прийнятні для фармацевтичного застосування у людей. Форма "фармацевтично прийнятної солі" активного компонента також може початково надавати бажану фармакокінетичну властивість для активного компоненту, яка відсутня в несольовій формі, та може навіть позитивно впливати на фармакодинаміку активного компоненту відносно його терапевтичної активності в організмі. Фраза “фармацевтично прийнятна сіль” сполуки означає сіль, яка є фармацевтично прийнятною та яка сприяє бажаній фармакологічній активності вихідної сполуки. Такі солі включають: (1) солі приєднання кислот, утворені із неорганічними кислотами, такими як соляна кислота, бромистоводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота, та інші; або утворені із органічними кислотами, такими як оцтова кислота, пропіонова кислота, гексанова кислота, циклопентанпропіонова кислота, гліколева кислота, піровиноградна кислота, молочна кислота, малонова кислота, янтарна кислота, яблучна кислота, малеїнова кислота, фумарова кислота, винна кислота, лимонна кислота, бензойна кислота, 3-(4-гідроксибензоїл)бензойна кислота, корична кислота, мигдалева кислота, метансульфонова кислота, етансульфонова кислота, 1,2етан-дисульфонова кислота, 2-гідроксіетансульфонова кислота, бензолсульфонова кислота, 4хлорбензолсульфонова кислота, 2-нафталінсульфонова кислота, 4-толуолсульфонова кислота, камфорсульфонова кислота, 4-метилбіцикло [2.2.2]-окт-2-ен-1-карбонова кислота, глюкогептонова кислота, 3-феніл пропіонова кислота, триметилоцтова кислота, третинна бутилоцтова кислота, луарилсірчана кислота, глюконова кислота, глютамінова кислота, гідроксинафтойна кислота, салціцилова кислота, стеаринова кислота, муконова кислота, та інші; або (2) солі, утворені, коли кислотний протон, присутній у вихідній сполуці, або замінений на іон металу, наприклад, іон лужного металу, іон лужноземельного металу, або іон алюмінію; або координований із органічною основою, такою як етаноламін, діетаноламін, триетаноламін, трометамін, N-метилглюкамін, та інші. Препарати у вигляді твердих форм включають порошки, таблетки, пілюлі, капсули, саше, супозиторії,та диспреговані гранули. Твердим носієм може бути одна або декілька речовин, які також можуть діяти як розріджувачі, ароматизатори, солюбілізатори, змащувальні речовини, суспендуючі речовини, сполучні, консерванти, засоби для розпадання таблеток, або інкапсулюючий матеріал. В порошках, носій зазвичай представляє собою тонкоподрібнену 7 UA 103801 C2 5 10 15 20 25 30 35 40 45 50 55 60 тверду речовину, яка представляє собою суміш із тонкоподрібненим активним компонентом. В таблетках, активний компонент зазвичай змішаний із носієм, який має необхідну зв’язувальну здатність в підходящих пропорціях та стиснутий до бажаної форми та розміру. Підходящі носії включають, але не обмежуючись лише ними, карбонат магнію, стеарат магнію, тальк, цукор, лактоза, пектин, декстрин, крохмаль, желатин, трагакантова камедь, метилцелюлоза, натрій карбоксиметилцелюлоза, низькоплавкий віск, олія какао, та інші. Препарати у вигляді твердих форм можуть включати, додатково до активного компоненту, барвники, ароматизатори, стабілізатори, буфери, штучні та природні підсолоджувачі, дисперганти, загусники, солюбілізатори, та інші. Рідкі препарати, які також придатні для перорального введення, включають рідкі препарати, включаючи емульсії, сиропи, еліксири, водні розчини, водні суспензії. Вони включають препарати в твердій формі, які призначені для перетворення в препарати в рідкій формі незадовго до застосування. Емульсії можуть бути приготовлені в розчинах, наприклад, у водних розчинах пропіленгліколю, або можуть містити емульгуючі агенти, такі як лецитин, сорбіт моноолеат, або гуміарабік. Водні розчини можуть бути приготовлені шляхом розчинення активного компоненту у воді та додавання підходящих барвників, ароматизаторів, стабілізаторів, та загусників. Водні суспензії можуть бути приготовлені шляхом диспергування тонкоподрібненого активного компоненту у воді із в’язкою речовиною, такою як природні або синтетичні смоли, камеді, метилцелюлоза, натрій карбоксиметилцелюлоза, та інші добре відомі суспендуючі засоби. Сполуки відповідно до даного винаходу можуть бути приготовлені для парентерального введення (наприклад, шляхом ін’єкції, наприклад, болюсної ін’єкції або безперервної інфузії) та можуть бути представлені в одиничній дозованій формі в ампулах, попередньо заповнених шприцах, інфузій у невеликому об’ємі або в багатодозових контейнерах із доданим консервантом. Композиції можуть бути у формі суспензій, розчинів, або емульсій в масляних або водних носіях, наприклад, розчинів в водному поліетиленгліколі. Приклади масляних або неводних носіїв, розріджувачів, розчинників або додаткові компоненти, включають пропіленгліколь, поліетиленгліколь, рослинні олії (наприклад, оливкова олія), та ін’єковані органічні складні ефіри (наприклад, етилолеат), та можуть містити протокольні агенти, такі як консерванти, змочувальні, емульгуючі або суспендуючі, стабілізуючі та/або диспергуючі засоби. Альтернативно, активний компонент може бути в формі порошку, отриманого шляхом асептичної ізоляції стерильного твердого компоненту або ліофілізації із розчину для відновлення перед застосуванням із підходящим носієм, наприклад, стерильною апірогенною водою. Сполуки відповідно до даного винаходу можуть бути приготовлені для введення у вигляді супозиторіїв. Низькоплавкий віск, такий як суміш гліцеридів жирних кислот або олію какао спочатку розплавляють і активний компонент диспергують гомогенно, наприклад, шляхом перемішування. Потім розплавлену гомогенну суміш вливають в форми підходящого розміру, дозволяють охолоджувати, та отвердівати. Сполуки відповідно до даного винаходу можуть бути приготовлені для вагінального введення. Песарії, тампони, креми, гелі, пасти, піни або спреї містять, додатково до активного компонента, такі носії, які відомі як підходящі в даній галузі техніки. При необхідності, препарати можуть бути приготовлені із ентеросолюбільним покриттям, адаптованим для введення із уповільненим або контрольованим вивільненням активного компонента. Наприклад, сполуки відповідно до даного винаходу можуть бути приготовлені в трансдермальних або підшкірних засобах доставки лікарських засобів. Ці системи доставки сприятливі, коли необхідне уповільнене вивільнення сполуки та коли дотриманням пацієнтом схеми лікування є вирішальним. Сполуки в трансдермальних системах доставки часто приєднують до твердої основи, яка прилипає до шкіри. Сполуку, яка представляє інтерес, також можна поєднувати із посилювачем проникнення, наприклад, Азон (1-додецилаза-циклопентан2-он). Системи доставки із контрольованим вивільненням вставляють підшкірно в підшкірний шар за допомогою хірургічного втручання або ін’єкції. Підшкірні імпланти інкапсулюють сполуку в розчинній в ліпідах мембрані, наприклад, силіконовому каучуку, або біорозкладному полімері, наприклад, полімолочній кислоті. Підходящі препарати, а також фармацевтичні носії, розріджувачі та наповнювачі описані в Remington: The Science and Practice of Pharmacy 1995, під редакцією E. W. Martin, Mack Publishing Company, 19-те видання, Easton, Pennsylvania. Кваліфікований фахівець в даній галузі техніки може модифікувати препарати з урахуванням відомостей, розкритих в описі, для забезпечення різноманітних препаратів для переважного шляху введення без надання композиціям відповідно до даного винаходу нестабільності або зниження їх терапевтичної 8 UA 103801 C2 5 10 15 20 25 30 35 40 45 50 55 60 активності. Модифікацію сполук відповідно до даного винаходу для надання їм більшої розчинності в воді або іншому наповнювачі, наприклад, легко можна здійснювати шляхом незначних модифікацій (утворення солі, естерифікації і т.д.), які добре відомі кваліфікованому спеціалісту в даній галузі. Також фахівцю в даній галузі добре відомо, як модифікувати шляхи введення та схему дозування конкретної сполуки для керування фармакокінетичними параметрами даних сполук для забезпечення максимального сприятливого ефекту для пацієнтів. Способи, описані в даній заявці, включають введення комбінацій інгібітора протеази NS3/4A вірусу гепатиту С та інгібітора монооксигенази цитохрому P450. Таке введення позначається в даному винаході як спільне введення. Спільне введення включає введення кожного інгібітора в одній дозованій формі або в різних дозованих формах. При введенні в різних дозованих формах, інгібітори можуть вводитися в один час або в різні періоди часу та в будь-якому порядку. Таким чином, даний винахід забезпечує способи, в яких CYP інгібітор вводять разом із інгібітором NS3/4A протеази вірусу гепатиту С в одній дозованій формі або в окремих дозованих формах. Якщо CYP інгібітор та інгібітор протеази вводять в окремих дозованих формах, то кожен інгібітор можна вводити приблизно одночасно. Альтернативно, CYP інгібітор можна вводити в будь-який період часу приблизно при введенні інгібітора протеази. Таким чином, CYP інгібітор можна вводити перед, разом із, або після інгібітора NS3/4A протеази. Часовий період введення повинен бути таким, щоб CYP інгібітор впливав на метаболізм інгібітора протеази. Наприклад, якщо інгібітор протеази вводять першим, то CYP інгібітор слід вводити до того, як інгібітор протеази метаболізується та/або екскретується Термін "терапевтично ефективна кількість", як використовується в даному винаході, означає кількість, необхідну для зменшення симптомів захворювання у індивідуума. Рівень терапевтичної ефективності при терапії HCV, як правило, визначається шляхом вимірювання рівнів вірусної РНК. Дозу слід корегувати відповідно до індивідуальних потреб в кожному конкретному випадку. Це дозування може змінюватися в широких межах залежно від різноманітних факторів, таких як тяжкість захворювання, яке підлягає лікуванню, вік та загальний стан здоров’я пацієнта, інші лікарські засоби, якими лікують пацієнта, шлях та форма введення та уподобання та досвід лікуючого лікаря. Рівні дозування в діапазоні від приблизно 100 та до приблизно 800 мг на добу, переважно в діапазоні від приблизно 200 до приблизно мг на добу інгібітора NS3 протеази придатні для запобігання та лікування HCV опосередкованого захворювання. Для CYP інгібітора, типовими будуть рівні дозування від приблизно 50 до приблизно 400 мг на добу. Більш типовими будуть рівні дозування від приблизно 100 до приблизно 200 мг на добу. Типово, фармацевтичні композиції відповідно до даного винаходу будуть вводитися від приблизно 1 до приблизно 2 разів на добу. Кількість активного компонента, яку можна об’єднувати із матеріалом носія для одержання одиничної дозованої форми, буде змінюватися залежно від господаря, який підлягає лікуванню, та конкретного шляху введення. Як правило, лікування починають із невеликих дозувань, які менші за оптимальну дозу сполуки. Після цього, дозу підвищують невеликими інкрементами до досягнення оптимального ефекту у індивідуального пацієнта. Кваліфікований фахівець в даній галузі для лікування захворювань, описаних в даному винаході, зможе, без надмірних експериментів та на основі його особистих знань, досвіду та розкриття даного винаходу, визначити терапевтично ефективну кількість сполук відповідно до даного винаходу для даного захворювання та пацієнта. Переважні дозовані форми ритонавіру описані L. A. Al-Razzak та ін. в патенті US № 5,484,801, опублікованому 16 січня 1996 р., патенті US № 5,948,436, опублікованому 7 вересня 1999 р., WO 95/07696, опублікованій 23 березня 1995 р., та WO 95/09614, опублікованій 13 квітня 1995 р. Способи, описані в даній заявці, включають введення комбінацій інгібітора NS3 протеази вірусу гепатиту С та інгібітора монооксигенази цитохрому P450. Таке введення позначається в даній заявці як спільне введення. Спільне введення включає введення кожного інгібітора в одній дозованій формі або в різних дозованих формах. При введенні в різних дозованих формах, інгібітори можуть вводитися в один час або в різні періоди часу та в будь-якому порядку. Таким чином, даний винахід забезпечує способи, в яких CYP інгібітор вводять разом із інгібітором NS3/4A протеази вірусу гепатиту С в одній дозованій формі або в окремих дозованих формах. Якщо CYP інгібітор та інгібітор протеази вводять в окремих дозованих формах, то кожен інгібітор можна вводити приблизно одночасно. Альтернативно, CYP інгібітор можна вводити в будь-який період часу приблизно при введенні інгібітора протеази. Таким чином, CYP інгібітор можна вводити перед, разом із, або після інгібітора NS3/4A протеази. Часовий період введення 9 UA 103801 C2 5 10 15 20 25 30 35 40 45 50 55 повинен бути таким, щоб CYP інгібітор впливав на метаболізм інгібітора протеази. Наприклад, якщо інгібітор протеази вводять першим, то CYP інгібітор слід вводити до того, як інгібітор протеази метаболізується та/або екскретується. Доведено, що комбінована терапія є цінним компонентом антивірусної терапії і, отже, лікування HCV за допомогою R7227 та ритонавіру може включати введення іншого компоненту, включаючи додатковий агент, вибраний із імуномодулюючого засобу; антивірусного засобу; іншого інгібітора HCV протеази; інгібітор HCV полімерази або іншої мішені в життєвому циклі HCV або їх комбінацій. Фармацевтичні композиції можуть назначатися пацієнту у вигляді "упаковки для пацієнта", що містять весь курс лікування в одній упаковці, зазвичай в блістерній упаковці. Упаковки для пацієнта мають переваги в порівнянні із традиційними формами ліків, де фармацевти розподіляють потребу пацієнта в фармацевтичному препараті із поставки без упаковки, в якій пацієнт завжди має доступ до інструкції з застосування препарату, що міститься в упаковці для пацієнта, що звичайно відсутня в традиційних формах препаратів. Показано, що включення інструкції щодо застосування препарату поліпшує дотримання пацієнтом схеми лікування з вказівками лікуючого лікаря. Введення комбінації відповідно до винаходу за допомогою єдиної упаковки для пацієнта, або упаковок для пацієнта кожного препарату, що містяться разом із інструкціями для пацієнта щодо коректного застосування винаходу, представляє собою бажану додаткову характерну особливість даного винаходу, яка може покращити дотримання пацієнтом схеми лікування. Відповідно до подальшого аспекту винаходу, забезпечується упаковка, що містить принаймні інгібітор NS3 протеази та CYP 3A4 інгібітор відповідно до винаходу та інформаційну інструкцію, яка містить вказівки щодо застосування комбінації відповідно до винаходу. В альтернативному варіанті здійснення даного винаходу, фармацевтична упаковка додатково включає один або більше додаткових агентів, як описано в даній заявці. Додатковий агент або агенти можуть забезпечуватися в одній упаковці або в окремих упаковках. Інший аспект даного винаходу стосується упакованого набору для пацієнта для застосування для лікування HCV інфекції або для запобігання HCV інфекції, що включає: один або багато фармацевтичних препаратів кожного фармацевтичного компоненту; контейнер, що вміщує фармацевтичний (і) препарат (и) при зберіганні та перед введенням; та інструкції щодо здійснення введення ліків для ефективного лікування або запобігання HCV інфекції. Таким чином, даний винахід забезпечує набори для одночасного або послідовного введення інгібітора NS3/4A протеази та CYP інгібітора (та необов’язково додаткового агента) або їх похідних, приготовлені загальноприйнятим способом. Типово, такий набір буде включати, наприклад, композиції кожного інгібітора та необов’язково додаткового (их) агента (ів) в фармацевтично прийнятному носії (та в одному або в багатьох фармацевтичних препаратах) та написані інструкції для одночасного або послідовного введення. В іншому варіанті здійснення, забезпечується упакований набір, який містить одну або більше дозованих форм для самостійного введення; контейнер, переважно запечатаний, для вміщування дозованих форм при зберіганні та перед застосуванням; та інструкції для пацієнта для здійснення введення лікарського засобу. Інструкції звичайно представляють собою написані інструкції на листку-вкладці, мітці, та/або на інших компонентах набору, та дозовану форму або форми, як описано в даному винаході. Кожна дозована форма може бути індивідуально упакована, як в листовій упаковці з металевої фольги-пластикового ламінату, де кожна дозована форма відділена від інших в індивідуальних чарунках або пухирцях, або дозовані форми можуть міститися в одному контейнері, а також в пластиковому флаконі. Набори відповідно до даного винаходу типово будуть включати засоби для упаковки індивідуальних компонентів набору, тобто дозованих форм, контейнери, та письмові інструкції із застосування. Такі засоби для упаковки можуть бути представлені в формі картонної або паперової коробки, пластикового мішечка або мішечка з фольги і т.ін. Для більш повного розуміння даного винаходу, представлені наступні приклади приготування та тестування. Ці приклади представлені лише для ілюстрації та не повинні розглядатися як такі, які якимось чином обмежують обсяг винаходу. Приклад Поліпшення фармаконінетики R7227 у здорових дорослих осіб Суб’єктів піддавали скринінгу для участі в даному дослідженні за 21 день до дозування. Дослідження проводили на 14 здорових добровольцях (n=14 на групу). Схема дозування проілюстрована нижче: 10 UA 103801 C2 Таблиця 1 Процедура 1 Дозування R7227 2 Дозування ритонавіру PK збір 1 2 5 10 15 20 25 30 35 40 1 x 2 24 год. PK День дослідження 3 4-11 x x x 48 год. PK 12 x x 48 год. PK R7227 100 мг однократна пероральна доза Ритонавір 100 мг пероральна доза кожні 12 год. R7227 препарат - R7227 був приготовлений в прозорих 10 розміру овальних м’яких желатинових капсулах в кількості 100 мг на капсулу (еквівалент безводної вільної вислоти). Капсулу заповнювали розчином, що містить R7227-001, поліетиленгліколь PEG400 (Macrogol 400), та бутилований гідрокситолуол (BHT). Всі наповнювачі були фармакопейної якості (NF або EP). Желатин типу 195 (NF, EP) застосовували для основної гелевої маси для оболонки капсули, із невеликими кількостями сорбітолової рідини 85/70/00 (NF, EP) та води (USP), які застосовували як пластифікатори. Всі досліджувані медикаменти застосували із їжею. В дні введення R7227 (окремо або із ритонавіром), досліджувані медикаменти вводили після завершення стандартного сніданку із високим вмістом жирів та сніданки в інші дні були ідентичними. R7227 вводили перорально у вигляді однократної дози 100 мг м’якої желатинової капсули в дні 1, 3 та 12. В дні 3 та 12, R7227 вводили із ранковою дозою ритонавіру. Ритонавір 100 мг вводили перорально два рази на день (кожні 12 години) від дня 3 до дня 12. Зразки крові (5 мл) збирали для визначення концентрацій в плазмі R7227 (та метаболітів, коли аналізи були доступними) відповідно до наступної схеми В день 1, PK зразки (5 мл) збирали перед R7227 дозування (перед використанням препарату) та через 0,5, 1, 1,5, 2, 2,5, 3, 3,5, 4, 6, 8, 12, та 24 годин після R7227 дозування; В дні 3 та 12, PK зразки (5 мл) збирали перед R7227 дозуванням (перед використаннями препарату) та через 0,5, 1, 1,5, 2, 2,5, 3, 3,5, 4, 6, 8, 12, 24 , 36, та 48 годин після R7227 дозування. Первинні PK параметри R7227, які визначали, представляли собою C max та AUC0→. Вторинні PK параметри R7227, які визначали, включали T max та AUC0 →last, CL/F, t1/2, C12hr та C24h. Дисперсійний аналіз (ANOVA) застосовували до логарифмічно перетворених первинних фармакокінетичних параметрів. Двосторонні 90% довірчі інтервали для співвідношення середніх геометричних первинних параметрів (AUC0→ та Cmax R7227) отримували для наступних порівнянь: (R7227 + Ритонавір) день 3 відносно R7227 день 1 та (R7227 + Ритонавір) день 12 відносно R7227 день 1 Дисперсійний аналіз (ANOVA) застосовували для аналізу всіх первинних досліджуваних параметрів, використовуючи наступну модель: Yij = + i + sj + ij де Yij представляє собою PK параметр, який аналізують, представляє собою загальне середнє значення перетворюваної змінної, i, фіксований вплив лікування; sj випадковий вплив суб’єкта; ij (похибка). Випадкові відхилення ij розглядали як незалежні та нормально 2 розподіляли із нульовим середнім та звичайною дисперсією . Порівнянні між групами 2 R7227+Ритонавір - R7227, залишкову дисперсію , та 90% довірчі інтервали для порівняння між групами оцінювали із моделі ANOVA. Для логарифмічно перетворених змінних (AUC 0→ та Cmax), співвідношення справжнього середнього значення для групи та довірчих інтервалів для відповідного співвідношення середніх значень неперетворюваних змінних розраховували шляхом потенціювання меж середніх квадратичних відхилень та довірчих інтервалів для перетворюваних значень, відповідно. 11 UA 103801 C2 Таблиця 2 R7227 PK (одиниці) Геометричне середньоквадратичне Співвідношення GLSM (90% (GLSM) CI) День 12 День 3 (із День 3 День 1 (із День 12 Ритонавіром, відносно дня (окремо) Ритонавіром, відносно дня 1 багатократна 1 одна доза) доза) 5,70 (4,07, 5,50 (4,05, 14,4 82, 79,4 7,99) 7,48) 3,14 (1,87, 3,25 (2,12, 8,40 26,4 27,3 5,25) 4,96) 50,6 (25,6, 26,9 (17,7, 0,02 1,00 0,53 100) 41,0) 65,2 (34,8, 0,01 0,55 0,36 42,4 (25,7,70,0) 122) N AUC0→ нггод/мл Cmax (нг/мл) C12h (нг/мл) C12h (нг/мл) 12 12 a 8 12 b a Не-пропущено, не-BLQ (0,010 нг/мл) дані для всіх трьох днів лікування. (BLQ = Нижче межі кількісного визначення) b Включають екстрапольовані C12h значення від 4 суб’єктів із BLQ значеннями в день 1 5 10 Представлений вище винахід описаний більш докладно шляхом ілюстрацій, та прикладів, для пояснення та розуміння. Для фахівця в даній галузі очевидно, що зміни та модифікації при практичному здійсненні винаходу підпадають під обсяг пунктів формули винаходу. Таким чином, слід розуміти, що представлений вище опис слід розглядати як ілюстративний та необмежувальний. Отже, обсяг даного винаходу слід визначати не з посиланням на представлений вище опис, а визначати із посиланням на подані нижче пункти формули винаходу, разом із повним обсягом еквівалентів, які охоплюються такими пунктами формули. Всі патенти, патентні заявки та публікації, процитовані в даній заявці, таким чином включені як посилання в повному обсязі для всіх цілей в такому ж ступені, якби кожен індивідуальний патент, патентна заявка або публікації були індивідуально представлені. ФОРМУЛА ВИНАХОДУ 15 1. Спосіб підвищення біодоступності інгібітора протеази NS3/4A вірусу гепатиту С формули І у пацієнта, який включає спільне введення пацієнту сполуки формули І O O N O O O O S N F N H N трет O N H Na Bu O O 20 25 (I), та інгібітора монооксигенази цитохрому Р450, де інгібітор монооксигенази присутній в кількості, достатній для підвищення рівнів в крові І, де інгібітор монооксигенази цитохрому Р450 являє собою ритонавір. 2. Спосіб за пунктом 1, де сполука формули І та ритонавір знаходяться в окремих дозованих формах. 3. Спосіб за пунктом 2, де окремі дозовані форми вводять практично одночасно. 4. Спосіб за пунктом 1, де сполуку формули І та ритонавір вводять в одній дозованій формі. 5. Спосіб лікування інфекції, викликаної вірусом гепатиту С у пацієнта, який цього потребує, що включає введення пацієнту, який цього потребує, сполуки формули І, вільної основи або її 12 UA 103801 C2 5 10 15 20 25 30 35 фармацевтично прийнятної солі та інгібітора монооксигенази цитохрому Р450 або його фармацевтично прийнятної солі, де інгібітор монооксигенази цитохрому Р450 являє собою ритонавір або його фармацевтично прийнятну сіль. 6. Спосіб за пунктом 5, де спосіб включає спільне введення разом із сполукою формули І та ритонавіром, принаймні одного додаткового засобу, вибраного із імуномодулюючого засобу та/або антивірусного засобу, та/або іншого інгібітора протеази NS3/4A HCV, та/або інгібітора NS5B полімерази, та/або інгібітора вірусу широкого спектра дії, та/або інгібітора іншого цитохрому Р-450. 7. Застосування R7227 та інгібітора монооксигенази цитохрому Р450, де кількість інгібітора монооксигенази цитохрому Р450 достатня для підвищення рівнів в крові R7227 в порівнянні із рівнями в крові R7227 за відсутності інгібітора монооксигенази цитохрому Р450 для підвищення біодоступності інгібітора протеази NS3/4A вірусу гепатиту С R7227, де інгібітор монооксигенази цитохрому Р450 являє собою ритонавір або його фармацевтично прийнятну сіль. 8. Застосування R7227 та інгібітора монооксигенази цитохрому Р450, де кількість інгібітора монооксигенази цитохрому Р450 достатня для підвищення рівнів в крові R7227 в порівнянні із рівнями в крові R7227 за відсутності інгібітора монооксигенази цитохрому Р450 для приготування лікарського засобу для підвищення біодоступності інгібітора протеази NS3/4A вірусу гепатиту С R7227, де інгібітор монооксигенази цитохрому Р450 являє собою ритонавір або його фармацевтично прийнятну сіль. 9. Застосування за пунктом 7 або 8, де R7227 та ритонавір знаходяться в окремій дозованій формі. 10. Застосування за пунктом 7 або 8, де R7227 та ритонавір вводяться одночасно. 11. Застосування за пунктом 7 або 8 R7227 та ритонавіру та принаймні одного додаткового засобу, вибраного із імуномодулюючого засобу; антивірусного засобу; іншого інгібітора протеази NS3/4A HCV, інгібітора NS5B полімерази, інгібітора вірусу широкого спектра дії та інгібітора іншого цитохрому Р-450. 12. Фармацевтична композиція, яка містить сполуку формули І або її вільну основу, або іншу фармацевтично прийнятну сіль та інгібітор монооксигенази цитохрому Р450 або його фармацевтично прийнятну сіль, де інгібітор монооксигенази цитохрому Р450 відповідно до пункту являє собою ритонавір або його фармацевтично прийнятну сіль та принаймні один фармацевтично прийнятний наповнювач, розчинник або носій. 13. Фармацевтична композиція за пунктом 12, де інгібітор монооксигенази цитохрому Р450 являє собою ритонавір або його фармацевтично прийнятну сіль. 14. Набір, який містить інгібітор NS3 протеази вірусу гепатиту С відповідно до формули І та ритонавір. 15. Фармацевтична упаковка, яка містить сполуку відповідно до формули І, ритонавір та інформаційну інструкцію, яка містить вказівки щодо застосування інгібіторів. Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 13
ДивитисяДодаткова інформація
Назва патенту англійськоюMethods for improving pharmacorinetics
Автори англійськоюTran, Jonathan Q.
Автори російськоюТран Джонатан К.
МПК / Мітки
МПК: A61K 31/404, A61P 31/12, A61K 31/426
Мітки: вірусу, протеази, спосіб, підвищення, інгібітора, біодоступності, гепатиту
Код посилання
<a href="https://ua.patents.su/15-103801-sposib-pidvishhennya-biodostupnosti-ingibitora-proteazi-ns3-4a-virusu-gepatitu-s.html" target="_blank" rel="follow" title="База патентів України">Спосіб підвищення біодоступності інгібітора протеази ns3/4а вірусу гепатиту с</a>
Попередній патент: Сорбційно-ємнісний датчик вологості газів
Наступний патент: Спосіб ідентифікації індивідуальної функції перетворення багатопараметричного сенсора
Випадковий патент: Адаптер












