Композиція для лікування есенціальної тромбоцитемії
Формула / Реферат
1. Фармацевтична композиція без шлункового покриття, яка містить анагрелід НСl, незалежний від рН полімер і фармацевтично прийнятну водорозчинну кислоту, у якій незалежний від рН полімер вибраний з групи поліакрилових кислот, похідних целюлози або поліакриламідів, і в якій кількість незалежного від рН полімеру по масі більше у 1,5-2,5 рази, ніж анагреліду.
2. Фармацевтична композиція за пунктом 1, яка відрізняється тим, що анагрелід НСl перебуває у формі частинок, причому щонайменше 90 % згаданих частинок є меншими ніж 10 мкм у діаметрі.
3. Фармацевтична композиція за пунктом 1 або 2, яка відрізняється тим, що містить анагрелід НCl у кількості від 0,5 і до 5 мг, краще від 1 і до 3,5 мг, краще від 2 і до 3 мг, ще краще у кількості приблизно 2,3 мг.
4. Фармацевтична композиція за одним з пунктів 1-3, яка відрізняється тим, що у ній поліакрилова кислота присутня в кількості від 1 і до 10 мг, краще від 2,5 і до 5 мг, краще від 3 і до 4 мг.
5. Фармацевтична композиція за одним з пунктів 1-4, яка відрізняється тим, що у ній фармацевтично прийнятна водорозчинна кислота вибирається із групи адипінової кислоти, аскорбінової кислоти, лимонної кислоти, фумарової кислоти, яблучної кислоти, бурштинової кислоти, виннокам'яної кислоти або їх суміші.
6. Фармацевтична композиція за кожним з пунктів 1-5, яка відрізняється тим, що у ній присутня водорозчинна кислота в кількості від 5 і до 40 мг, краще від 10 і до 20 мг, краще від 15 і до 19 мг.
7. Фармацевтична композиція за кожним з пунктів 1-6, яка відрізняється тим, що у ній анагрелід має середній розмір частинки приблизно 5 мкм.
8. Фармацевтична композиція за кожним з пунктів 1-7, яка відрізняється тим, що містить мікрокристалічну целюлозу.
9. Фармацевтична композиція за кожним з пунктів 1-8, яка відрізняється тим, що у ній мікрокристалічна целюлоза присутня у кількості від 10 і до 150 мг, краще між 25 і 100 мг, краще від 70 і до 80 мг.
10. Фармацевтична композиція за кожним з пунктів 1-9, яка відрізняється тим, що характеризується вивільненням in vitro щонайменше 45 % через 8 годин.
11. Фармацевтична композиція за кожним з пунктів 1-10, яка відрізняється тим, що містить анагрелід НСl, поліакрилову кислоту, лимонну кислоту, мікрокристалічну целюлозу й стеарат магнію.
12. Фармацевтична композиція за кожним з пунктів 1-11, яка відрізняється тим, що має форму таблеток.
13. Застосування фармацевтичної композиції за кожним з пунктів 1-12 для приготування медикаменту для лікування есенціальної тромбоцитемії.
Текст
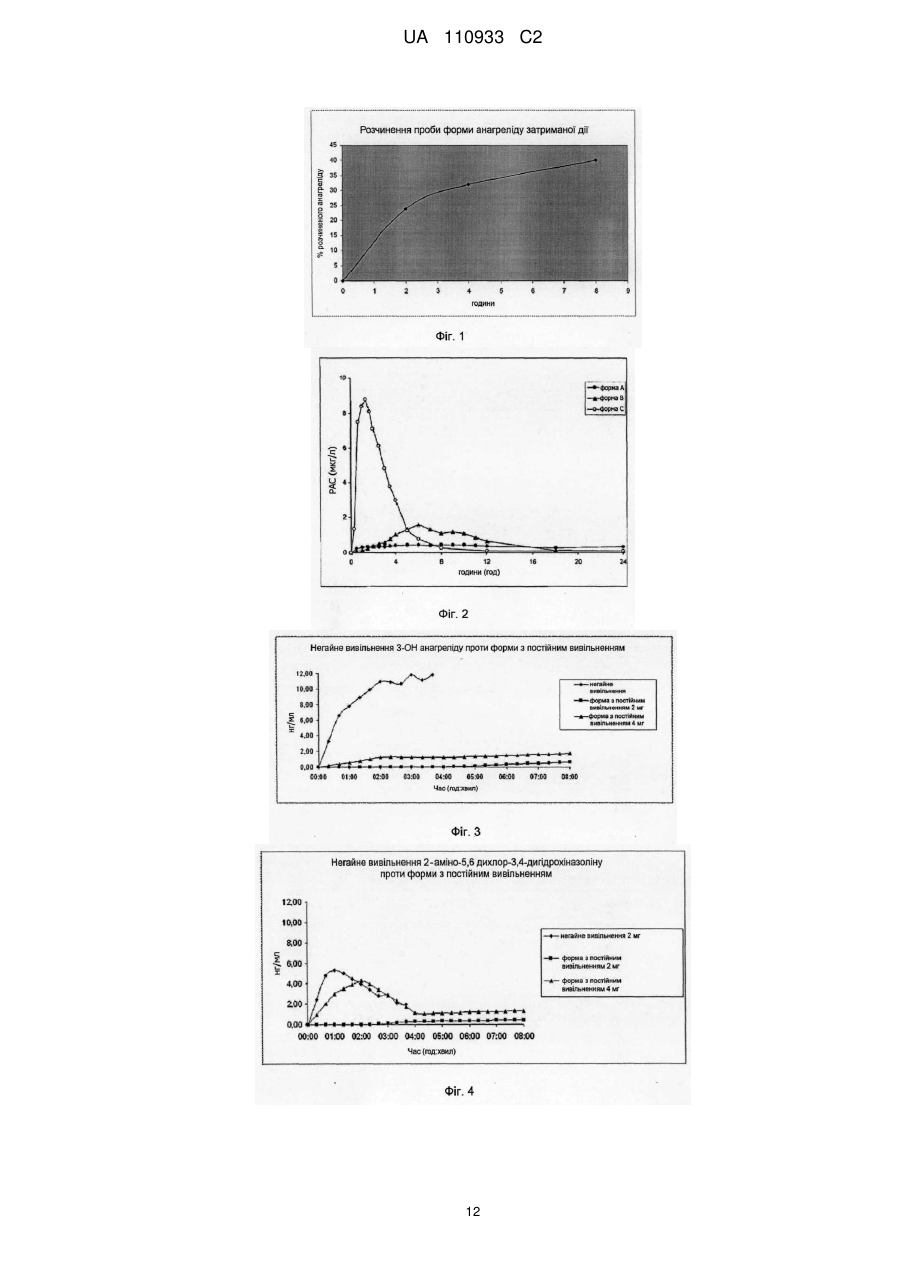
Реферат: Винахід стосується фармацевтичної композиції без шлункового покриття, яка містить анагрелід НСl, незалежний від рН полімер у кількості по масі більше у 1,5-2,5 рази, ніж анагреліду, і вибраний з групи поліакрилових кислот, похідних целюлози або поліакриламідів, і фармацевтично прийнятну водорозчинну кислоту. Винахід також стосується застосування цієї композиції для лікування есенціальної тромбоцитемії. UA 110933 C2 (12) UA 110933 C2 UA 110933 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки, до якої відноситься винахід Даний винахід відноситься до нової фармацевтичної композиції, яка включає гідрохлорид анагреліду в комбінації з незалежним від рH полімером і фармацевтично прийнятною водорозчинною кислотою та її застосування для лікування есенціальної тромбоцитемії. Попередній рівень техніки Первинна тромбоцитемія - це гематопоетичне клональне або поліклональне мієлопроліферативне захворювання, яке діагностується у 12% пацієнтів з тромбоцитозом. Есенціальна тромбоцитемія (ЕТ) – це діагноз 45% пацієнтів з первинним тромбоцитозом (1). Щоб чітко диференціювати ET від справжньої поліцитемії (PV) і мієло-фіброзу (MF), дослідницькою групою Polycythaemia vera були розроблені діагностичні критерії (2), і пізніше вони були вдосконалені в діагностичному керівництві Всесвітньої організації охорони здоров'я (WHO) (3, 4). Діагностичне керівництво WHO вдосконалило діагностичні критерії PVSG для ET шляхом використання гістопатології кісткового мозку і щільності ретикулярних волокон (ретикулін і колаген) для диференціювання ET від ранніх префібротичних стадій ідіопатичного мієлофіброзу (IMF) (5, 6, 7). У пацієнтів з вторинним тромбоцитозом кількість тромбоцитів, яка перевищує 1.500.000/мкл є незалежним чинником ризику тромбоемболічних і геморагічних проявів (8). Додатковими незалежними чинниками ризику є наявність в анамнезі тромбоемболії або кровоточивості, капілярних симптомів і вік більше 65 років (9, 10, 11, 12, 13). Клінічні прояви варіюють від м'яких симптомів, таких як головний біль, запаморочення і розлади зору, до ускладнень, які несуть загрозу життю, таких як тромбоз, геморагія та інсульт. Ризик тромботичних епізодів оцінюється на рівні 6,6% на пацієнта на рік, він зростає до 15% на пацієнта на рік у пацієнтів старше 60 років (14) і є найбільш великим для пацієнтів з оклюзивними епізодами в анамнезі (10). Зазвичай прийнято вважати, що пацієнти з високим ризиком повинні отримувати лікування, яке знижує кількість тромбоцитів. На момент діагностики приблизно 50% пацієнтів мають в анамнезі тромбоз або геморагію і потрапляють в категорію високого ризику. (15). Маючи на увазі всі незалежні чинники ризику, такі як число тромбоцитів більше ніж 1,500000/мкл, вік більше 65 років і серцево-судинних чинників ризику, більше 50% пацієнтів з діагнозом ET потребують лікування. Крім того, симптоматичні пацієнти, які мають менше 900,000/мкл тромбоцитів, знаходяться в групі ризику ускладнень і потребують лікування. (16). Тромбоз крупних судин може відбутися у молодих пацієнтів з кількістю тромбоцитів меншою, ніж 900,000/мкл (17). Було показано, що зменшення кількості тромбоцитів знижує ризик клінічних ускладнень (18). Таким чином, число тромбоцитів може служити сурогатним маркером клінічних ускладнень. Існує зростаюча кількість свідчень того, що молоді пацієнти і пацієнти з кількістю тромбоцитів, меншою, ніж 900,000/мкл, мають позитивні результати лікування завдяки зниженню ризику клінічних ускладнень і прогресуючого захворювання судин. Останніми роками в першу чергу застосовувалися два основні варіанти лікування, гідроксисечовиною (HU) і α-інтерфероном. Проте у гідроксисечовини є недоліки: 1) HU не є вибірковою щодо зниження числа тромбоцитів і діє також на інші компоненти крові; 2)зростає число повідомлень про спричинені HU важкі побічні ефекти, включаючи лейкемію. Це особливо небезпечно, якщо молоді пацієнти отримують лікування протягом тривалого часу; 3) деякі пацієнти нечутливі до лікування HU. Альфа-інтерферон вимагає підшкірного введення, має множинні ефекти на інші кліткипопередники і погано переноситься багатьма особами (19). Анагрелід (імідазо(2,1-b)хіназолін-2(3H)-он,6,7-дихлоро-1,5-дигідромоногідро-хлорид) на даний час зареєстрований як друга лінія вибору лікування для пацієнтів з тромбоцитемією. Механізм його дії вибірковий для мегакаріоцитів і тромбоцитів. Його можна вводити орально. Немає даних про довготривалу мутагенність і лейкемогенність. Анагрелід ліцензійовано в США з 1997 і в Європі з 2001 року. Затверджені на даний час терапевтичні показання анагреліду при EU такі: «для зменшення підвищеного числа тромбоцитів у пацієнтів з ризиком есенціальної тромбоцитемії, які не переносять застосовану терапію або у випадку, якщо підвищений рівень тромбоцитів не знижується під дією прийнятного рівня застосованої терапії». (http://www.emea.eu.int/humandocs/Humans/EPAR/xagrid/Xagrid.htm). Анагрелід був початково розроблений як інгібітор агрегації тромбоцитів. Спосіб його дії включає інгібування ферментативної активності фосфодієстерази циклічного AMP (20). Проте ця активність не опосередкує зниження тромбоцитів. Вибіркова активність щодо зниження числа тромбоцитів обмежена для людей, спостерігається при набагато менших дозах (21) і 1 UA 110933 C2 5 10 15 20 25 30 35 40 45 50 55 60 опосередкована інгібуванням дозрівання мегакаріоцитів. (22, 23). Анагрелід не впливає на утворення колонії мегакаріоцитів і на виживання тромбоцитів при терапевтичних концентраціях (22). Точний механізм дії на даний час невідомий. Проте метаболіти анагреліду проявляють високу активність, щодо зниження тромбоцитів, і тому ймовірно, впливають на його дію. (24, 25, 26). Сучасні дані і баланс ризику-виграшу для більшості пацієнтів свідчать на користь анагреліду як придатного лікарського засобу для великої популяції пацієнтів. Ця популяція включає пацієнтів з чинниками ризику молодше 60 років, які відмовляються починати лікування агентами, що викликають потенційний ризик лейкозу, такими як гідроксисечовина. Анагрелід інтенсивно метаболізує in vivo, і за допомогою HPLC аналізу можна виявити в сечі більше 5 його метаболітів (27). Були ідентифіковані два з цих метаболітів, а саме, біологічно активний 3-гідроксианагрелід і неактивний 2-аміно-5,6-дихлоро-3,4-дигідрохіназолон (так званий RL 603)(26). Проведені нещодавно передклінічні і клінічні дослідження фармакологічних аспектів анагреліду ставлять важливі питання, які стосуються способу його дії і профілю безпеки (26, 28, 29, 30, 31). Було зроблено припущення, що щонайменше, один вже ідентифікований метаболіт, а саме 3-гідроксианагрелід, бере участь в основних фармакологічних ефектах in vivo, а саме, зниженні вмісту тромбоцитів і інгібіторній активності фосфодіестерази (PDE) 3, тоді як RL 603 не має таких властивостей (24). Анагрелід швидко перетворюється на 3-гідроксианагрелід, який досягає максимальних значень в плазмі приблизно на 45 хвилин пізніше, ніж початкова речовина. Мабуть, обидві сполуки вносять внесок до фармакологічної активності in vivo. Як анагрелід, так і 3-гідроксианагрелід швидко виділяються з крові і дані про їх накопичення відсутні. Досягнення оптимального контролю тромбоцитів займає від декількох днів до тижнів. (29, 30). Тому малоймовірно, що зменшення рівня тромбоцитів опосередковане прямою фармакологічною активністю. На даний час невідома молекулярна мішень на мега-каріоцитах, яка опосередковує тривалий ефект зниження тромбоцитів, проте вона може включати модуляцію функціонування c-MPL, що призводить до зміни спорідненості до тромбопоетину (28). Цю гіпотезу підтверджує той факт, що після припинення дії анагреліду на тромбоцити потрібно від 4 до 7 днів для повернення до початкових показників. Навпаки, було показано, що молекулярною мішенню, яка опосередковує гострі ефекти анагреліду на серцево-судинну систему і агрегацію тромбоцитів, є залежна від cAMP PDE 3 (20). Головний біль, запаморочення і сильне серцебиття є побічними ефектами, які часто зустрічаються, і спостерігаються у приблизно 15 - 44% пацієнтів протягом перших тижнів лікування і, ймовірно, опосередковані м'якими серцево-судинними і мозковими ефектами терапевтичних доз анагреліду. Поліпшення стану через 2-3 тижні після цих побічних ефектів співпадає з розвитком тахіфілаксії (29), яка спостерігається також з іншими інгібіторами PDE 3 (32). Проте швидкість і тяжкість серцево-судинних побічних ефектів, наприклад, гіпотензії, зростає із збільшенням дози понад 5 міліграмів, дозволяючи припустити наявність кореляції з рівнем в плазмі анагреліду або, що істотніше, 3-гідроксианагреліду (29). Описані випадки оборотної серцевої недостатності гіперсистоли у пацієнтів, які отримували анагрелід. (33, 34). Ризик серцевої недостатності після тривалого лікування спостерігали також у пацієнтів, які отримували мілринон, інший позитивний інотропний інгібітор PDE 3 (35). Проте 3гідроксианагрелід є значно потужнішим інгібітором PDE 3, ніж анагрелід (26). Можна припускати, що 3-гідроксианагрелід, в першу чергу, опосередковує серцево-судинні побічні ефекти у пацієнтів, яких лікують анагрелідом. Зокрема, такі небажані серцево-судинні побічні ефекти, як прискорене серцебиття, запаморочення або головний біль, можуть бути викликані безпосередньо 3-гідроксианагрелідом. Ці ефекти викликають біль у пацієнтів, особливо на початку курсу терапії, і можуть бути причиною того, що до 28% пацієнтів переривали терапію (29, 30). Показано, що при використанні різних лікарських форм анагреліду спостерігаються різні побічні ефекти, тому швидкості переривання терапії анагрелідом змінювалися в інтервалі від 8 до 28% (29, 30, 31). Різні фармакокінетичні властивості можуть корелювати з фармакодинамічними відмінностями в перенесенні і зниженні кількості тромбоцитів. Затримка швидкості адсорбції анагреліду буде пов'язана з пониженням максимального і повного рівня анагреліду, а також із значно меншими значеннями вмісту в плазмі 3-гідроксианагреліду. Тому можна чекати значно меншої швидкості PDE 3-залежних побічних ефектів. У US 6287599 і US 2004/0062800 описані фармацевтичні композиції з постійним вивільненням і пониженими значеннями pH-залежних профілів розчинення. Серед інших пігулок, які містять анагрелід, описані пігулки, які містять по 2,44 міліграм/пігулку анагреліду HCl, покриті добре відомим шлунковим покриттям еудрагітом. 2 UA 110933 C2 5 10 15 20 25 30 35 40 45 50 55 60 WO2005/112917A1 описує композиції, які містять вибрані сполуки, які інгібірують цитокіни, для лікування мієлопроліферативних захворювань, в яких як другий активний агент присутній анагрелід. У US2007/104782A1 і WO2007/016350A2 описані таблетовані форми з незалежним від pH вивільненням і з покращеними механічними властивостями, які містять співполімер метакрилової кислоти. US2005/0249814A1 і US2005/0008704A1 описує лікарські форми, які включають сполуки, що містить щонайменше один фрагмент карбонової кислоти і які характеризуються швидким розчиненням при контакті з фізіологічними розчинниками. US2004/0028729A1 описує фармацевтичний препарат для модифікованого вивільнення, який містить багато несферичних ядер неправильної форми. Описано анагрелід в комбінації з іншими добавками разом з еудрагітом. Сутність винаходу Метою даного винаходу є створення доступних нових композицій анагреліду з властивостями вивільнення, які не залежать від рН, які можна використовувати для запобігання і лікування симптомів, що відносяться до хронічних мієлопроліферативних захворювань, таких як есенціальна тромбоцитемія, але які б не мали деяких з добре відомих побічних ефектів лікування анагрелідом, що приписуються його основному метаболіту, 3-гідроксианагреліду. Мета досягається шляхом застосування втілень даної заявки. Винахід відноситься до нових форм анагреліду, які забезпечують уповільнене вивільнення активного інгредієнта анагреліду. Було показано, що фармацевтична композиція без шлункового покриття, яке містить анагрелід HCl, яка містить незалежний від рН полімер і фармацевтично прийнятну водорозчинну кислоту, проявляє стійкі і стабільні властивості вивільнення при введенні пацієнтові. Конкретно, анагрелід HCl знаходиться у формі часток, серед яких, щонайменше, 90% згаданих часток менші ніж 10 мкм в діаметрі. Згідно втіленню винаходу анагрелід HCl міститься в кількості від 0,5 і до 5 міліграмів, бажано, від 1 і до 3,5 міліграмів, бажано, від 2 і до 3 міліграмів, бажано, в кількості приблизного 2,3 міліграми. Конкретно, анагрелід може мати середній розмір часточок приблизно 5 мкм. Відповідно до іншого втілення незалежний від рН полімер може міститися в кількості, приблизно в 1,5 - 2,5 разів більшій, ніж фармацевтично активний агент (мас./мас.). У композиції незалежний від pH полімер може бути, наприклад, обраний з групи TM поліакрилатів, похідних целюлози або поліакриламідів, бажано, це Карбопол . Поліакрилат в композиції запропонованій винаходом може бути включений в кількості від 1 і до 10 міліграмів, бажано, від 2,5 і до 5 міліграмів, бажано, від 3 і до 4 міліграмів. Фармацевтична композиція запропонована винаходом може, крім того, включати фармацевтично прийнятну водорозчинну кислоту, яка може бути вибрана з групи адипінової кислоти, аскорбінової кислоти, лимонної кислоти, фумарової кислоти, яблучної кислоти, бурштинової кислоти, винно-кам'яної кислоти або їх суміші, не обмежуючись ними, які відповідно до специфічного втілення, можуть бути присутніми в кількості від 5 і до 40 міліграмів, бажано, від 10 і 20 міліграмів, бажано, від 15 і 19 міліграмів. Крім того, композиція запропонована винаходом може містити мікрокристалічну целюлозу, зокрема в кількості від 10 і до 150 міліграмів, бажано, від 25 і до 100 міліграмів, бажано, від 70 і до 80 міліграмів. Несподівано, але було показано, що композиція характеризується вивільненням in vitro щонайменше 45% через 8 годин без якого-небудь шлункового покриття. У альтернативному втіленні пропонується композиція, яка містить анагрелід HCl, поліакрилат, лимонну кислоту, мікрокристалічну целюлозу і стеарат магнію. Краще, щоб відповідна композиція була у формі пігулок. Згідно подальшому втіленню винаходу, відповідна композиція може бути використана для приготування медикаменту для лікування есенціальної тромбоцитемії. Короткий опис фігур Фігура 1: крива розчинення анагреліду сповільненої дії. Фігура 2: типові значення вмісту в плазмі в порівнянні з лікарською формою негайного вивільнення. Геометричні середні значення концентрації анагреліду в плазмі – PAC (мкг/л) проти кривих залежності від часу після одноразового орального прийому дози 2 міліграми анагреліду 28 особами. Фігура 3: 3OH анагреліду негайного вивільнення проти лікарської форми постійного вивільнення. Фігура 4: 2-аміно 5,6-дихлоро-3,4-дигідрохіназолін негайного вивільнення проти лікарської 3 UA 110933 C2 5 10 15 20 25 30 35 40 45 50 55 60 форми постійного вивільнення. Докладний опис винаходу Винахід пропонує фармацевтичну композицію, яка проявляє властивості постійного вивільнення без шлункового покриття і яка містить гідрохлорид анагреліду в комбінації з полімером, який проявляє властивості набрякання, які не залежать від рН і фармацевтично прийнятну і водорозчинну кислоту. За допомогою винаходу було показано, що, хоча призначена для введення лікарська форма композиції не покрита шлунковим покриттям, рН-залежний активний агент анагрелід HCl не вивільняється відразу, але характеризується уповільненим (затриманим) вивільненням. Терміни «постійне» і «уповільнене» вивільнення і «затримане» вивільнення використовують в даній заявці як взаємозамінні. Термін «без шлункового покриття», який використовується відповідно до даного винаходу, означає, що на поверхні композиції немає захисного шару, що захищає згадану композицію від кислот або кислих умов, присутніх в шлунку або кишківнику. Багато активних інгредієнтів вимагають захисного герметичного покриття, що підвищує їх стабільність і поліпшує їх механічні властивості. Прикладом добре відомих шлункових покривних агентів служить, наприклад, еудрагіт™, який є торговою маркою для полі(метакрилової) кислоти, етил акрилату, альгінату натрію, карбоксиметилцелюлози натрію. Стандартними лікувальними формами анагреліду HCl є пігулки або капсули з шлунковим покриттям для запобігання швидкому і повному розчиненню в порожнині шлунку, що може привести до небажаного збільшення метаболітів і може привести до небажаних побічних ефектів медикаменту. Авторами було несподівано виявлено, що винайдений препарат може не мати шлункового покриття на поверхні пігулок або капсул, але демонструє затримане розчинення із-за специфічної композиції, яка містить незалежний від pH полімер і фармацевтично прийнятну водорозчинну кислоту. Крім того, лікувальна форма запропонована винаходом демонструє затримане, але постійне вивільнення анагреліду не тільки в шлунково-кишкових відділах з високою кислотністю, але також вивільнення і адсорбцію анагреліду в шлунково-кишкових відділах з меншою кислотністю або з нейтральними або основними значеннями рН, наприклад, рН вище, ніж 5,5. Вивільнення анагреліду HCl з композиції запропонованої винаходом не залежить від рН, тобто воно відбувається не тільки при pH 9, але також при значеннях рН від 4 і 9, забезпечуючи таким чином розчинність у всьому інтервалі фізіологічних значень рН шлунково-кишкового тракту. Терміни «незалежний» або «незалежний від рН полімер», відповідно до втілення, означає, що колоїдна дисперсія згаданого полімеру не залежить від рН, тобто він диспергує не тільки при високих і низьких значеннях рН, а саме, при pH 9, але і від pH 4 і 9. Жоден рН - залежний полімер, який використовується для фармацевтичних композицій, не може застосовуватися для даного винаходу. Конкретно, незалежний від рН полімер відповідно до даного винаходу може бути полімером, який не містить залишків поліакрилату. Конкретно, згадані полімери можуть бути поліакриловими кислотами, похідними целюлози або поліакриламідами. Конкретніше, полімери вибирають з групи поліакрилова кислота 971P (Карбопол™) або гідроксиетилцелюлоза. Найбільш бажаними є інкапсульовані полімери типу, наприклад, Карбополу™. Полімери і гідроксиетилцелюлоза при гідратуванні набрякають і утворюють колоїдні дисперсії. Співвідношення між анагрелідом HCl і полімером є важливим внаслідок його впливу на властивості вивільнення композиції. Важливо встановити вагове співвідношення полімеру і агента, при якому властивості вивільнення анагреліду HCl підтримуються, але не повністю інгібуються. Відповідно до конкретного втілення винаходу кількість незалежного від рН полімеру приблизно в 1,5 - 2,5 разів більша від кількості фармацевтично активного агента (мас./мас.). Як приклад автори винаходу показали, що 10-разовий надлишок полімеру в порівнянні з анагрелідом HCl призводить до сильного інгібування вивільнення анагреліду HCl, приводячи таким чином до того, що швидкість вивільнення анагреліду через 16 годин складає тільки приблизно 30%. Конкретно, незалежний від pH полімер, особливо, поліакрилова кислота може бути присутньою в композиції в кількості від 1 і до 10 міліграмів, бажано, від 2,5 і до 5 міліграмів, бажано, від 3 і до 4 міліграмів. Відповідно до окремого втілення винаходу кількість поліакрилової кислоти більше, ніж в 1,5 і менше, ніж в 2,5 разів є більшою, ніж фармацевтично активного агента (мас./мас.). Завдяки присутності водорозчинної кислоти у фармацевтичній композиції запропонованій даним винаходом підтримується кисле мікрооточення усередині лікарської форми. 4 UA 110933 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фармацевтично прийнятна і водорозчинна кислота може збільшувати швидкість розчинення і може, наприклад, бути обраною з групи адипінової кислоти, аскорбінової кислоти, лимонної кислоти фумарової кислоти, яблучної кислоти, бурштинової кислоти, вино-камінної кислоти або їх суміші. Бажано, це лимонна кислота. Водорозчинна кислота може бути присутньою в такій кількості, щоб підтримувати кисле мікрооточення в препараті, наприклад, вона може бути присутньою в композиції в кількості від 5 і до 40 міліграмів, бажано, від 10 і до 20 міліграмів, бажано, від 15 і до 19 міліграмів. Анагренлід міститься у формі гідрохлориду анагреліду в кількості від 0,5 і до 5 міліграмів, бажано, від 1 і до 3,5 міліграмів, бажано, від 2 і до 3 міліграмів, бажано, в кількості приблизного 2,3 міліграм. Терміни анагрелід, часточки анагреліду і анагрелід HCl – це терміни, які використовуються для активної сполуки імідазо-(2,1-b) хіназолін-2(3Н)-oн,6,7-дихлоро-1,5дигідромоногідрохлориду відповідно до даного винаходу. Анагрелід HCl відповідно до даного винаходу може знаходитися у формі тонко подрібненого анагреліду з розміром часточок менше 15 мкм, бажано, менше 10 мкм. Бажано, гідрохлорид анагреліду в композиції запропонованій винаходом присутній у формі часточок, причому, щонайменше, 90% згаданих часточок анагреліду менші від 10 мкм в діаметрі. Використання дрібних часточок анагреліду діаметром менше 15 мкм, зокрема менше 10 мкм, зазвичай є більш бажаним для фармацевтичних препаратів в порівнянні з високо гомогенним розподілом і/або постійним вивільненням активного інгредієнта анагреліду, що забезпечується при введенні. Відповідно до окремого втілення винаходу середній розмір часточки анагреліду в препараті дорівнює приблизно 5 мкм. Термін «середній розмір часточки анагреліду в препараті дорівнює приблизно 5 мкм» означає відповідно до даного винаходу що, щонайменше, 50% часточок є меншими від 5 мкм і, щонайменше, 90% є меншими від 10 мкм в діаметрі. У техніці подрібнення відоме як процес зменшення середнього діаметру часточок твердого матеріалу. Відповідно до даного винаходу «подрібнення» виконується відомими способами – способом суперкритичних розчинів, способом суперкритичного анти-розчинника і способом часточок з розчинів, насичених газом. В деяких випадках фармацевтична композиція запропонована винаходом може містити також агенти, які збільшують об'єм. Ці агенти включають, не обмежуючись ними, мікрокристалічну целюлозу, ксиліт, маніт, стеарат магнію, етилацетат, крохмалі, лактозу, сахарозу, сульфат кальцію, декстрозу, сорбіт, целюлозну пудру, зокрема в кількостях від 0,01 і до 5 міліграмів, бажано, від 0,25 і до 1 міліграма. Фармакологічна композиція запропонована винаходом може містити також дезинтегруючі агенти. Вказані агенти включають, не обмежуючись ними, мікрокристалічну целюлозу, крохмалі, карбоксиметилкрохмаль натрію, кроскармелозу натрію, кросповідон. Конкретно, композиція містить мікрокристалічну целюлозу. Мікрокристалічна целюлоза може бути присутньою в кількостях від 10 і до 150 міліграмів, бажано, в кількостях від 25 і до 100 міліграмів, бажано, в кількостях від 70 і до 80 міліграмів. Композиція даного винаходу може також включати, не обмежуючись ними, інші сполуки подібні до речовин, які перешкоджають адгезії, полегшують ковзання, змащувальних речовин і зв'язуючих речовин. Відповідно до конкретного втілення винаходу композиція містить анагрелід HCl, поліакрилову кислоту, лимонну кислоту, мікрокристалічну целюлозу і, щонайменше, один агент, який збільшує об'єм і за необхідності очищену воду. У іншому варіанті композиція може включати анагрелід HCl, поліакрилову кислоту, мікрокристалічну целюлозу, очищену воду, водорозчинну кислоту, обрану з поміж адипінової кислоти, аскорбінової кислоти, лимонної кислоти, фумарової кислоти, яблучної кислоти, бурштинової кислоти, винно-кам'яної кислоти або їх суміші і за необхідності стеарат магнію. Відповідно до конкретного втілення фармацевтична композиція включає анагрелід HCl, поліакрилову кислоту, лимонну кислоту, очищену воду і стеарат магнію. Конкретніше, фармацевтична композиція включає анагрелід HCl, поліакрилову кислоту, лимонну кислоту, очищену воду і стеарат магнію, де анагрелід HCl, знаходиться у формі часточок, причому щонайменше, 90% цих часточок менші, ніж 10 мкм в діаметрі. Конкретніше, пропонується композиція, в якій анагрелід HCl міститься в кількості від 0,5 і 5 міліграмів, бажано, від 1 і 3,5 міліграмів, бажано, від 2 і 3 міліграмів, бажано, в кількості приблизного 2,3 міліграм; де в деяких випадках анагрелід HCl знаходиться у формі часточок, 5 UA 110933 C2 5 10 15 20 25 30 35 40 45 50 55 60 причому щонайменше, 90% цих часточок менші, ніж 10 мкм в діаметрі і Поліакрилова кислота присутня в кількості від 1 і 10 міліграмів, бажано, від 2,5 і до 5 міліграмів, бажано, від 3 і до 4 міліграмів, і передбачається, що кількість поліакрилату в 1,5 - 2,5 разу більша, ніж анагреліду і Лимонна кислота присутня в кількості від 5 і до 40 міліграмів, бажано, від 10 і до 20 міліграмів, бажано, від 15 і до 19 міліграмів, і стеарат магнію присутній в кількості від 0,01 і до 5 міліграмів, бажано, від 0,1 і до 2,5 міліграмів, бажано, від 0,25 і до 1 міліграма і мікрокристалічна целюлоза присутня в кількості від 10 і до 150 міліграмів, бажано, в кількості від 25 і до 100 міліграмів, бажано, в кількості від 70 і до 80 міліграмів. Конкретніше, фармацевтична композиція включає анагрелід HCl в кількості від 2 і до 3 міліграмів, поліакрилову кислоту в кількості від 3 і до 4 міліграмів, лимонну кислоту від 15 і до 19 міліграмів, мікрокристалічну целюлозу в кількості від 70 і до 80 міліграмів, очищену воду і стеарат магнію в кількості від 0,25 і до 1 міліграма. Було показано, що композиція запропонована винаходом характеризується гарними властивостями регульованого і постійного вивільнення активного агента. Композиції, які містять анагрелід HCl і які застосовуються на даний час - це препарати з негайним вивільненням, в яких більше 90% анагреліду вивільняється in vitro протягом перших десяти хвилин. Нова форма анагреліду, навпаки, вивільняє тільки приблизно 14-20% анагреліду протягом першої години in vitro, і для вивільнення приблизно 90% in vitro потрібно до 16 годин. Відповідно до даного винаходу терміни «затримане» або «постійне» вивільнення означає, що для вивільнення або розчинення приблизно 85% активного агента буде потрібно, щонайменше, 15 хвилин. Швидкість розчинення визначають відповідно до Європейської фармакопейної монографії 2.9.3. Тест на розчинність для твердих дозованих форм, розділ «Затримане вивільнення твердих дозованих форм», спосіб A. Швидкість розчинення визначають за таблицею 2.9.3.2 тієї ж монографії з: 0.1 M HCl: 15-35% через 2 год. Рівні L1, L2 або L3 повинні задовольнятися Фосфатний буфер, pH 6.8: 30-50% через 8 год. (повний час) Рівні L1, L2 або L3 повинні задовольнятися Конкретно, фармацевтична композиція запропонована даним винаходом викликає пік концентрації в плазмі, який дорівнює, щонайменше, 0,2 мкг/л, бажано, щонайменше, 0,5 мкг/л, бажано, щонайменше, 0,75 мкг/л після 6 годин в умовах голодування і пік концентрації в плазмі 0,75 мкг/л, бажано, 1,5 мкг/л, бажано, 2,43 мкг/л при оральному введенні in vivo за умови прийому їжі. Композиція запропонована винаходом може бути введена орально, наприклад, у формі пігулок або капсул. Відповідно до даного винаходу, пігулки – це специфічна фармацевтична форма для орального прийому. Конкретно, для кращої переносимості і для зменшення негативних побічних ефектів, а також у випадку необхідності довготривалого лікування бажано мати медикамент, який характеризується постійним вивільненням, що приводить до затриманого, але постійного надходження анагреліду. Очевидно, що при використанні винайденої фармакологічної композиції приблизно через 30 хвилин, бажано, через 4 години, краще, через 6 годин після прийому композиції пацієнтом анагрелід може бути визначений в плазмі у вигляді пікового значення. Конкретніше, композиція запропонована винаходом підтримує вивільнення in-vitro щонайменше 45% через 8 годин. Конкретно, для кращого перенесення і для зменшення негативних побічних ефектів 3гідроксианагреліду бажано мати медикамент, який характеризується постійним вивільненням і відповідною затримкою надходження анагреліду і отже, меншим рівнем пікового значення 3гідроксианагреліду в плазмі. Винайдена композиція пропонує зменшення пікових значень 3гідроксианагреліду в плазмі приблизно на 2,5%, бажано приблизно на 5%, бажано, щонайменше, на 10% у порівнянні з формами з негайним вивільненням анагреліду. Крім того композиції запропоновані даним винаходом, які містять анагрелід HCl, краще переносяться, оскільки концентрація анагреліду НCl є невисокою із-за стабільних характеристик вивільнення винайденого медикаменту, що не сприяють небажаному накопиченню метаболіту 3-гідроксианагреліду. Завдяки новим характеристикам вивільнення винайдені композиції є особливо корисними 6 UA 110933 C2 5 10 15 20 25 30 35 40 45 50 55 60 для першої лінії лікування есенціальної тромбоцитемії, але можуть використовуватися також для другої лінії лікування. Особливо бажаною є винайдена композиція для лікування пацієнтів із вперше поставленим діагнозом, оскільки небажані серцево-судинні побічні ефекти, такі як прискорене серцебиття, запаморочення або головний біль, зазвичай відбуваються протягом перших тижнів лікування і можуть привести до раннього припинення терапії анагрелідом або зменшення прихильності пацієнта до лікування. У альтернативному варіанті, композицію запропоновану винаходом можна також вводити пацієнтам, які не переносять поточну терапію або за відсутності зниження підвищеного вмісту тромбоцитів при прийнятному рівні поточній терапії, яку вони отримують. Рекомендована початкова доза становить 2 міліграма/день протягом 1 тижня і дозу щонеділі корегують, допоки не буде досягнуте оптимальне контрольне значення тромбоцитів. Звичайне зменшення числа тромбоцитів досягається при дозуванні 1-3 міліграмів/день. Бажану дозу анагреліду HCl зручно представити у вигляді одиничної дози або у вигляді декількох доз з відповідними інтервалами часу. Конкретно, композицію, яка містить анагрелід HCl, можна вводити кілька разів на день, допоки не буде досягнуте зменшення числа тромбоцитів особливо при введенні вранці і ввечері. Для нової форми істотним є введення дози «за умови прийому їжі» (після сніданку або обіду), оскільки після їжі швидкість всмоктування зростає. Описані тут приклади є ілюстративними у відношенні до даного винаходу і не покликані його обмежувати. Може бути представлено багато модифікацій і варіацій, описаної і проілюстрованої техніки без зміни духу і меж винаходу. Відповідно, слід розуміти, що приклади є тільки ілюстраціями і не встановлюють обмежень винаходу. Приклади Приклад 1 Дослідження розчинення in vitro: Аналіз виконували згідно Європейській фармакопеї (спосіб 2.9.3 (36)) «тест на розчинність для твердих дозованих форм» за допомогою методу розмішування, який вимагає, щоб тверду дозовану форму поміщали в апарат, який містить відповідне середовище (500 мл) при 37+/0,5 °C за певної діючої швидкості мішалки. Форма анагреліду HCl містила наступні інгредієнти: 2,2 міліграм анагреліду HCl поліакрилову кислоту лимонну кислоту мікрокристалічну целюлозу очищену воду стеарат магнію. Умови розчинення: Прилад: Sotax AT7 smart або еквівалентний прилад Температура: 37 °C 0.5 °C Апарат: Мішалка 75 оборотів за хвилину Середовище: 750 мл HCl 0.1 моль/л; буфер, доведений до етапу 2 через 2 години Фільтр: Whatman GF/D (2,7 мкм скляний волокнистий або еквівалентний до нього) Відбір проб: Проби відбирають через 2 год., 4 год. і 8 год. (колектор фракцій 1 мл об'єм проби, видалений об'єм заміщали) Процедура розчинення: Етап 1 (HCl 0,1 моль/л): Переносили по 750 мл HCl 0.1 моль/л у всі колби для розчинення і нагрівали до 37 °C 0,5 °C. Додавали одну пігулку анагреліду і починали розчинення при 75 оборотах за хвилину. Проби (1 мл) відбирали автоматично з кожної колби через 2 години, і видалений об'єм замінювали 1 мл HCl 0.1 моль/л. Етап 2 (Доведення буфера до pH 6.8): Через 2 години від відбору проб доводили буфер. Потім 200 мл фосфату натрію 0,25 моль/л нагрівали до 37 °C і в кожну колбу додавали по 50 мл додецил сульфату натрію. Доводили pH до 6,8 ± 0,05 за допомогою HCl 2 моль/л або NаOH 2 моль/л. Ця процедура не переривала тестування на розчинність. Проби (1 мл) автоматично відбирали з кожної колби через 4 і 8 годин після початку етапу 1, і видалений об'єм замінювали 1 мл HCl 0,1 моль/л. HPLC параметри для розчинення: HPLC-колонка: MZ LiChrospher-60-RP-Select-B-5 мкм, 250 x 4,6 мм 7 UA 110933 C2 5 10 15 20 25 30 35 40 45 Довжина хвилі детектора: 254 нм (16); Отн. 450 нм (80) Швидкість протікання: 1,75 мл/хв. Температура колонки: 30 °C Температура зразка: 20 °C Ін’єктований об'єм: 20 мкл Рухомі фази: 30% ацетонітрил : 70% фосфатний буфер pH 3,0 (ізократичні) Результати представлені на Фігурі 1. Показано постійне розчинення форми анагреліду запропонованої даним винаходом при рН 6,8. Приклад 2. Дослідження фармакокінетики: Дослідження фармакокінетики виконували для порівняння біодоступності існуючої (C) і нової форми (A, B) анагреліду при дворазовому прийомі одиничної дози, подвійному-сліпому перехресному дослідженні (період відмивання 7 днів) при дозуванні 2 мг (при оральному прийомі у вигляді одиничної дози). Волонтерами були 28 здорових чоловіків і жінок в умовах голодування із критеріями включення й виключення згідно з рекомендаціями відповідних керівництв (37). Проводили клінічний і лабораторний скринінг, реєстрували основні показники організму й виконували фізичне обстеження. Згідно з оцінкою, розмір проби від, щонайменше, 28 осіб становив >0,8 при CV
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel composition for treatment of essential thrombocythemia
Автори англійськоюWidmann, Rudolf, Strieder, Georg
Автори російськоюВидман Рудольф, Штридер Георг
МПК / Мітки
МПК: A61K 47/38, A61K 9/22, A61K 31/517, A61K 47/34, A61P 7/00
Мітки: лікування, композиція, тромбоцитемії, есенціальної
Код посилання
<a href="https://ua.patents.su/15-110933-kompoziciya-dlya-likuvannya-esencialno-trombocitemi.html" target="_blank" rel="follow" title="База патентів України">Композиція для лікування есенціальної тромбоцитемії</a>
Попередній патент: Біспецифічне двовалентне антитіло анти-vegf/анти-ang-2
Наступний патент: Композиції шортенінгів і способи їх отримання та застосування
Випадковий патент: Транспортний пакет силікатної цегли