Низькомолекулярні органічні сполуки з антитуберкульозною дією на основі гідразиду ізонікотинової кислоти
Номер патенту: 117279
Опубліковано: 26.06.2017
Автори: Ярмолюк Сергій Миколайович, Старосила Сергій Анатолійович, Волинець Галина Петрівна, Тукало Михайло Арсентійович, Бджола Володимир Григорович, Тарнавський Сергій Степанович, Гудзера Ольга Йосипівна
Формула / Реферат
Низькомолекулярні органічні сполуки з антитуберкульозною дією на основі гідразиду ізонікотинової кислоти, які відрізняються тим, що містять нові замісники загальної формули:
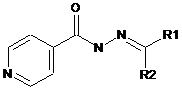 ,
,
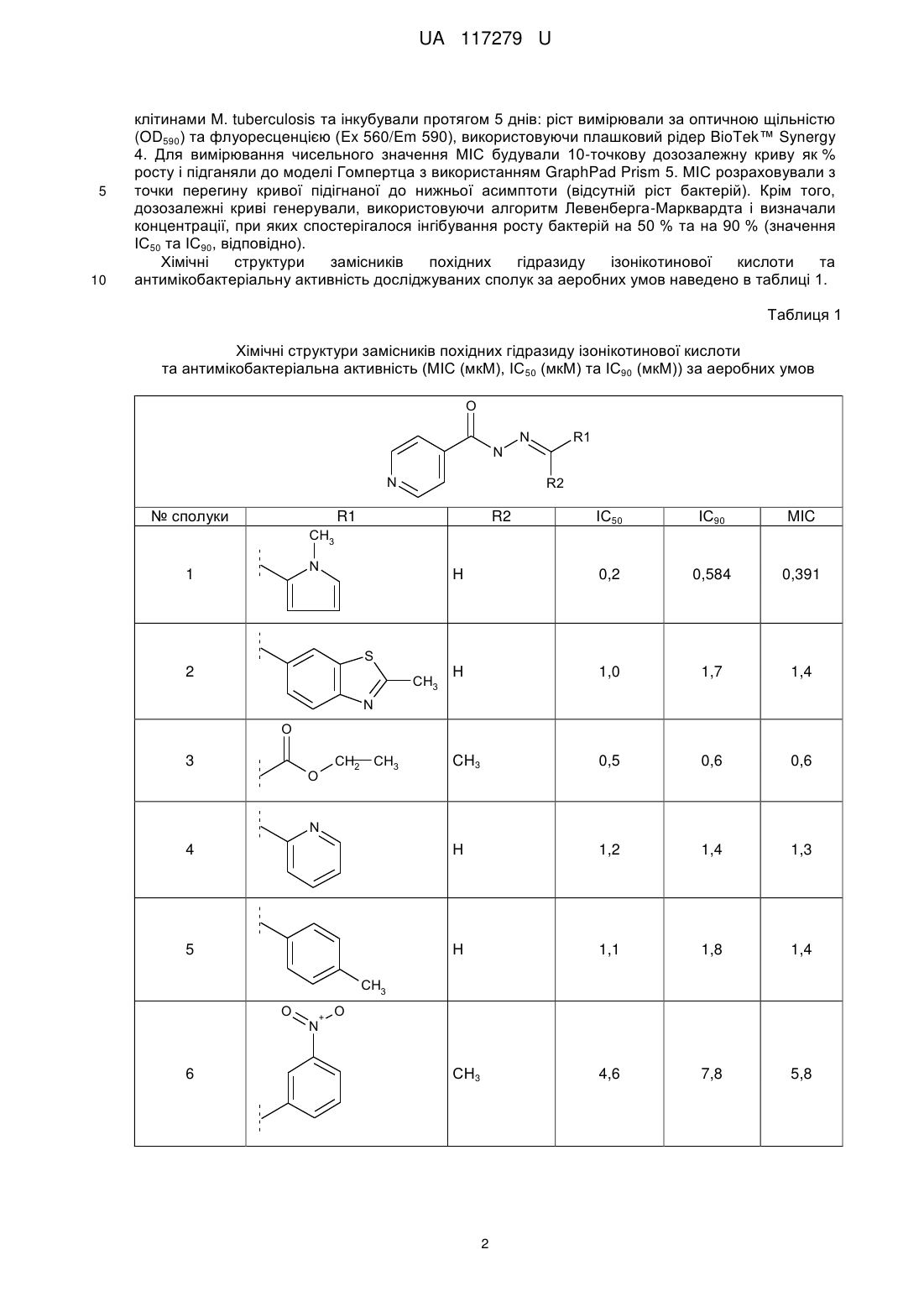
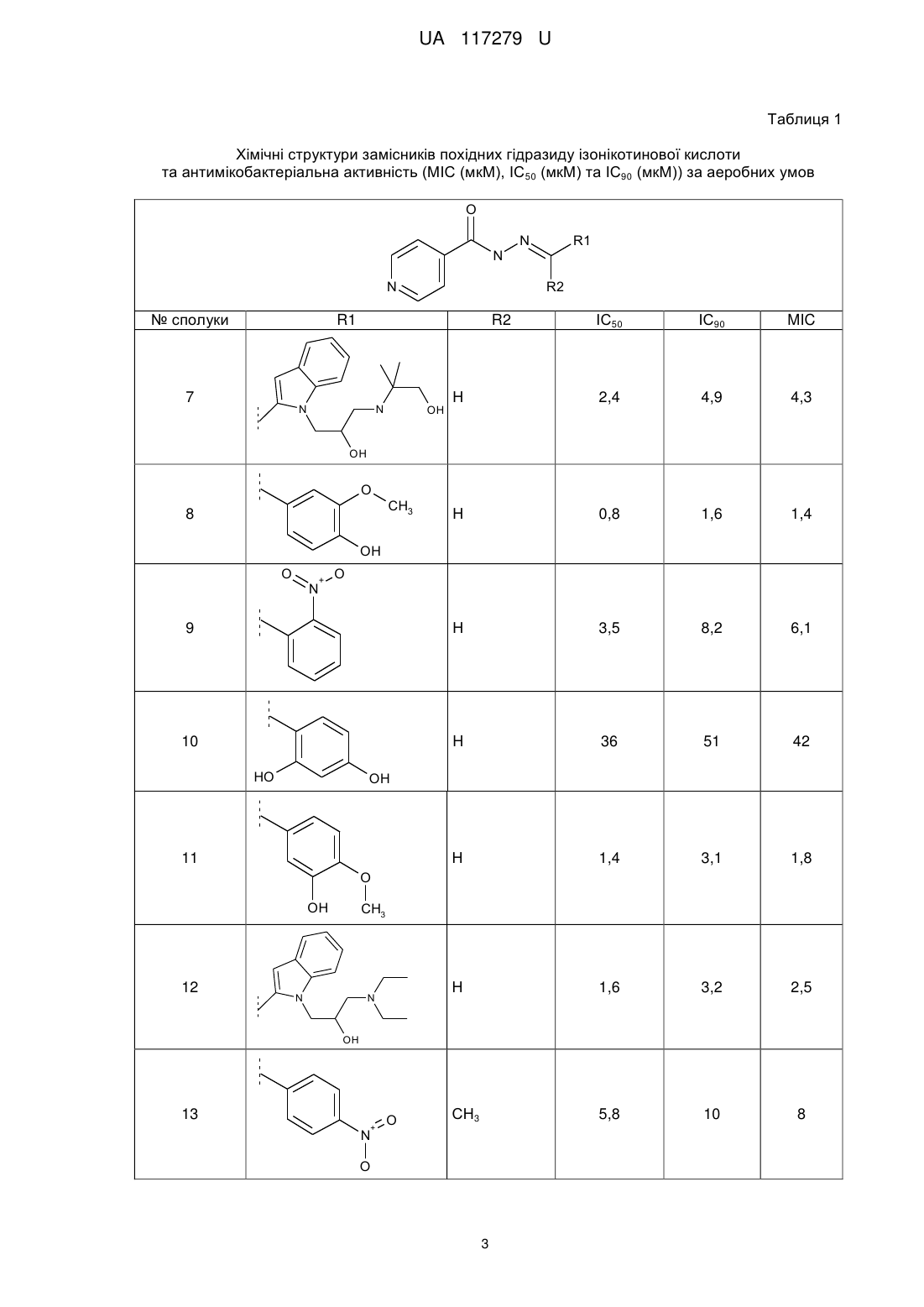
де R2 - Н, R1 - 3-метокси-4-гідроксифеніл, 6-бензотіазол-2-метил, 2-нітрофеніл, 2,4-дигідроксифеніл, 2-піридин, 1-метил-1H-пірол, 3-гідрокси-4-метоксифеніл, 4-метилфеніл, 1Н-індол-3-іл-1-(3-діетиламіно-пропан-2-ол), 1Н-індол-3-іл-1-(3-(пропіламіно-2-диметил-3-ол)пропан-2-ол), та R2 - СН3, R1 - карбетокси, 4-нітрофеніл, 3-нітрофеніл, 4-н-гексилфеніл.
Текст
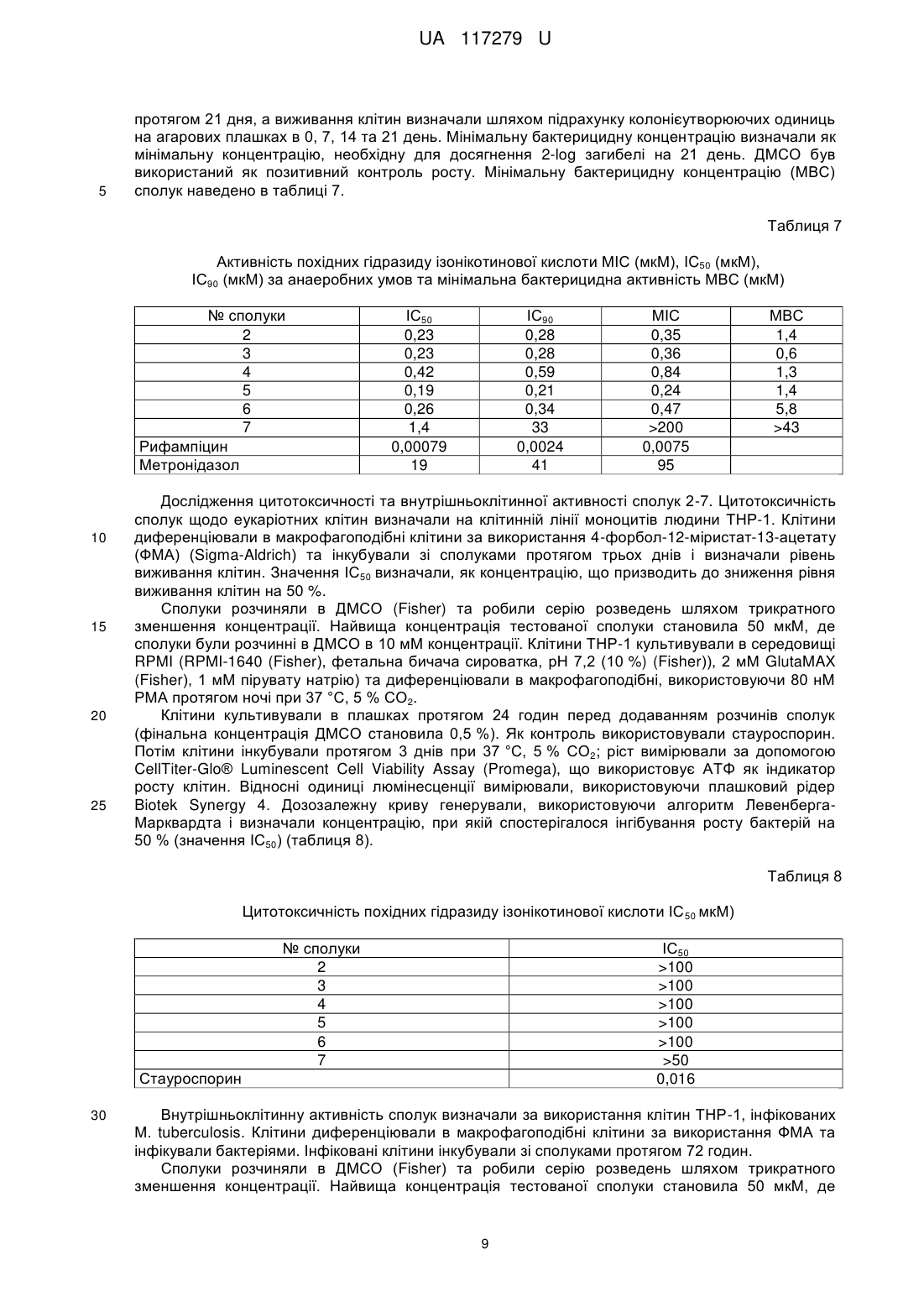
Реферат: Низькомолекулярні органічні сполуки з антитуберкульозною дією на основі гідразиду ізонікотинової кислоти. Вони містять нові замісники загальної формули: O N N N R1 R2 , де R2 - Н, R1 - 3-метокси-4-гідроксифеніл, 6-бензотіазол-2-метил, 2-нітрофеніл, 2,4дигідроксифеніл, 2-піридин, 1-метил-1H-пірол, 3-гідрокси-4-метоксифеніл, 4-метилфеніл, 1Ніндол-3-іл-1-(3-діетиламінопропан-2-ол), 1Н-індол-3-іл-1-(3-(пропіламіно-2-диметил-3ол)пропан-2-ол), та R2 - СН3, R1 - карбетокси, 4-нітрофеніл, 3-нітрофеніл, 4-н-гексилфеніл. UA 117279 U (12) UA 117279 U UA 117279 U 5 10 15 Пропонована корисна модель належить до класу гідразиду ізонікотинової кислоти та його застосування в терапії. Більш конкретно ця модель пропонує нові похідні гідразиду ізонікотинової кислоти, що мають антитуберкульозну активність. Запропоновані сполуки є корисними як фармацевтичні агенти для лікування туберкульозу. Відомі лікарські препарати гідразиду ізонікотинової кислоти - ізоніазид, фтивазид, метазид, опініазид, етіонамід, протіонамід, однак основною проблемою їх використання є розвиток стійкості мікобактерій до цих препаратів у більшості пацієнтів, що призводить до втрати ефективності лікування. Серед всіх вищеперерахованих лікарських препаратів ізоніазид проявляє бактерицидну дію на мікобактерії в стадії розмноження та бактеріостатичну - в стадії спокою. Ізоніазид найефективніший із препаратів гідразиду ізонікотинової кислоти при будь-якій формі та локалізації активного туберкульозу як у дорослих, так і в дітей. Однак, при монотерапії ізоніазидом до нього швидко (у 70 % випадків) розвивається стійкість. В основу корисної моделі поставлено задачу розробити нові похідні гідразиду ізонікотинової кислоти, що мають антибактеріальну активність щодо штамів Μ tuberculosis, резистентних до ізоніазиду. Поставлена задача вирішується запропонованими низькомолекулярними органічними сполуками з антитуберкульозною дією на основі гідразиду ізонікотинової кислоти, а відповідно до пропозиції, вони містять нові замісники загальної формули: O N N 20 25 30 35 40 45 50 55 N R1 R2 , де R2 - Н, R1-3-метокси-4-гідроксифеніл, 6-бензотіазол-2-метил, 2-нітрофеніл, 2,4дигідроксифеніл, 2-піридин, 1-метил-1Н-пірол, 3-гідрокси-4-метоксифеніл, 4-метилфеніл, 1Ніндол-3-іл-1-(3-діетиламіно-пропан-2-ол), 1Н-індол-3-іл-1-(3-(пропіламіно-2-диметил-3ол)пропан-2-ол) та R2 - СН3, R1 - карбетокси, 4-нітрофеніл, 3-нітрофеніл, 4-н-гексилфеніл. Запропоновані речовини відрізняються за хімічною структурою замісників R1 та R2 від відомих у літературі [1-9]. Заявлені низькомолекулярні сполуки з антитуберкульозною активністю одержували наступним чином: суміш 1 ммоль гідразиду ізонікотинової кислоти, 1 ммоль відповідного альдегіду або ацетофенону у 75 мл водно-спиртового (1:1) розчину кип'ятили 20-60 хвилин до утворення осаду. Далі реакційну суміш охолоджували та осад відфільтровували. Виходи 1 складали 52-87 %. Структуру синтезованих речовин встановлювали за допомогою спектрів HЯМР, записаних у ДМСО-D6 на приладі "Varian MercuryVRX-400" з робочою частотою 400 МГц і внутрішнім стандартом - ТМС. Одержані результати свідчать про відповідність синтезованих низькомолекулярних органічних сполук заявленим. Дослідження антимікобактеріальної активності сполук за аеробних умов Антимікробну активність сполук щодо штаму М. tuberculosis H37Rv, який культивували за аеробних умов, оцінювали шляхом визначення мінімальної інгібувальної концентрації (МІС) сполуки, тобто концентрації, що повністю припиняла ріст бактерій. Метод ґрунтувався на вимірюванні росту бактерій у рідкому середовищі флуоресцентного репортерного штаму H37Rv, де показниками були або оптична щільність або флуоресценція. Використання двох параметрів оцінки мінімізує проблеми, викликані преципітацією сполуки або автофлуоресценцією. Розраховували значення ІС50 - концентрацію сполуки, при якій ріст мікроорганізмів інгібується на 50 % та ІС90 - концентрацію сполуки, при якій ріст мікроорганізмів інгібується на 90 %. МІС визначали шляхом вимірювання бактеріального росту через 5 днів за присутності досліджуваних сполук. Сполуки розчиняли в ДМСО (Fisher) та робили серію розведень шляхом двократного зменшення концентрації. Речовини розводили в середовищі 7H9-Tw-OADC (4,7 г/л поживного середовища Middlcbrook 7H9 Base (VWR), Tween 80 (Fisher) (0,05 %), Middlebrook OADC Supplement (VWR) (10 %)) у 96-лункових плашках (фінальна концентрація ДМСО становила 2 %). Найвища концентрація сполуки становила 200 мкМ у випадку якщо речовини були розчинні в ДМСО в 10 мМ концентрації. Для сполук із поганою розчинністю найвища концентрація була нижчою в 50 разів, ніж стокова концентрація, наприклад, 100мкМ для 5 мМ стокового розчину в ДМСО, 20 мкМ для 1 мМ стокового розчину. Для високоактивних сполук досліди повторювали при нижчих початкових концентраціях. Кожна плашка містила декілька контролів (лише середовище/ДМСО, без бактеріальних клітин), відсутність росту (100 мкМ рифампіцину (Sigma-Aldrich)) та максимальний ріст (лише ДМСО). Плашки інокулювали 1 UA 117279 U 5 10 клітинами М. tuberculosis та інкубували протягом 5 днів: ріст вимірювали за оптичною щільністю (OD590) та флуоресценцією (Ex 560/Em 590), використовуючи плашковий рідер BioTek™ Synergy 4. Для вимірювання чисельного значення МІС будували 10-точкову дозозалежну криву як % росту і підганяли до моделі Гомпертца з використанням GraphPad Prism 5. МІС розраховували з точки перегину кривої підігнаної до нижньої асимптоти (відсутній ріст бактерій). Крім того, дозозалежні криві генерували, використовуючи алгоритм Левенберга-Марквардта і визначали концентрації, при яких спостерігалося інгібування росту бактерій на 50 % та на 90 % (значення ІС50 та ІС90, відповідно). Хімічні структури замісників похідних гідразиду ізонікотинової кислоти та антимікобактеріальну активність досліджуваних сполук за аеробних умов наведено в таблиці 1. Таблиця 1 Хімічні структури замісників похідних гідразиду ізонікотинової кислоти та антимікобактеріальна активність (МІС (мкМ), ІС50 (мкМ) та ІС90 (мкМ)) за аеробних умов O N N № сполуки N R1 R2 ІС50 ІС90 MIC Η 0,2 0,584 0,391 Η 1,0 1,7 1,4 CH3 0,5 0,6 0,6 4 Η 1,2 1,4 1,3 5 Η 1,1 1,8 1,4 СН3 4,6 7,8 5,8 R1 R2 CH3 N 1 S 2 CH3 N O 3 O CH2 CH3 N CH3 O 6 + N O 2 UA 117279 U Таблиця 1 Хімічні структури замісників похідних гідразиду ізонікотинової кислоти та антимікобактеріальна активність (МІС (мкМ), ІС50 (мкМ) та ІС90 (мкМ)) за аеробних умов O N N № сполуки N R1 R2 ІС50 ІС90 MIC Η 2,4 4,9 4,3 Η 0,8 1,6 1,4 9 Η 3,5 8,2 6,1 10 H 36 51 42 Η 1,4 3,1 1,8 Η 1,6 3,2 2,5 СН3 5,8 10 8 R1 7 R2 N N OH OH O 8 CH3 OH O + N O HO OH 11 O OH 12 CH3 N N OH 13 + N O O 3 UA 117279 U Таблиця 1 Хімічні структури замісників похідних гідразиду ізонікотинової кислоти та антимікобактеріальна активність (МІС (мкМ), ІС50 (мкМ) та ІС90 (мкМ)) за аеробних умов O N N N № сполуки R2 R2 СН3 ІС50 ІС90 MIC 1,8 R1 14 R1 2,7 2,6 C6H13 5 10 15 20 Дослідження активності сполуки 1 відносно до резистентних штамів М. tuberculosis. Тестування сполуки 1 щодо резистентних штамів М. tuberculosis проводили в 96-лункових плашках. До лунок додавали по 100 мкл поживного середовища Middlebrook 7Н12 (0,47 г поживного бульйону 7Н9, 0,1 г казитону, 100 мл дистильованої води, 0,1 мл пальмітинової кислоти (5,6 мг/мл вільної кислоти в етанолі), 0,5 г розчину БСА (50 мг/мл у воді), 0,1 мл розчину каталази (4 мг/мл у воді)). Сполуку розчиняли в ДМСО і розводили в середовищі Middlebrook 7H12 до концентрації 100 мкг/мл у 7Н12. До лунки із середовищем додавали 100 мкл розчину сполуки і робили двократне розведення вздовж ряду лунок плашки. Із останньої лунки відбирали 100 мкл розчину і виливали. Потім до лунок додавали по 100 мкл розчину 5 мікроорганізмів. Концентрація клітин М. tuberculosis у плашці становила 5,0 × 10 КУО/мл. Використовували ізоніазид-резистентний штам М. tuberculosis (SRI 1367) (INH-R), рифампінрезистентний штам Μ. tuberculosis (SRI 1369) (RIF-R) та моксіфлоксацин-резистентний штам Μ. tuberculosis (SRI 4000) (OFX-R). Плашки інкубували 7 днів при 37 °C (із вологістю). На 7 день плашки аналізували візуально та визначали абсорбцію за допомогою платкового рідера EnVision. Значення МІС - це найнижча концентрація (мкг/мл) сполуки, що інгібує ріст мікроорганізмів. Використовували наступні контролі: 1) лише середовище (контроль на стерильність); 2) мікроорганізм у середовищі (негативний контроль); 3) позитивний контроль (замість досліджуваної сполуки додавали рифампін та ізоніазид). Результати вважали коректними, якщо позитивний контроль - рифампін проявляв активність у діапазоні значень МІС від 0,05 до 0,2 мкг/мл, а ізоніазид - у діапазоні значень МІС від 0,025 до 0,05 мкг/мл. Мінімальну інгібувальну концентрацію сполуки 1 (МІС, мкМ) щодо штамів М. tuberculosis наведено в таблиці 2. 25 Таблиця 2 МІС сполуки 1 відносно до штамів М. tuberculosis (мкг/мл) № сполуки 1 рифампін ізоніазид H37Rv 0,25 0,05 >100 INH-R 0,032 0,05 >100 RIF-R 0,03 >100 0,05 OFX-R 0,032 0,39 >100 INH-R- ізоніазид-резистентний штам М. tuberculosis (SRI 1367) RIF-R - рифампін-резистентний штам Μ. tuberculosis (SRI 1369) OFX-R - моксіфлоксацин-резистентний штам М. tuberculosis (SRI 4000) 30 Дослідження внутрішньоклітинної активності сполуки 1 Досліджували інгібувальну активність сполуки 1 щодо штаму М. tuberculosis H37RV, фагоцитованого макрофагами J774.A1. J774.A1 - це адгерентна макрофагова клітинна лінія, отримана з миші, що використовується для визначення інгібування внутрішньоклітинних 4 UA 117279 U 2 5 10 15 20 25 30 35 40 патогенів. Клітини вирощували в культуральній колбі об'ємом 225 см у середовищі RPMI 1640, що містило 10 % FBS при 37 °C за наявності 5 % СО2. Неадгерентні клітини видаляли шляхом заміни наявного середовища свіжим поживним середовищем, а адгерентні клітини зішкрібали. Визначали концентрацію клітин, використовуючи МіШроге cell counter і розчиняли суспензію 5 клітин до концентрації 2,0 × 10 клітин/мл. 1 мл суспензії макрофагів додавали в кожну лунку 12лункових плашок та інкубували протягом 24 годин, щоб клітини прикріпилися до стінок. Потім замінювали наявне середовище на середовище RPMI 1640 із 1 % FBS (для того щоб обмежити проліферацію клітин) та інкубували протягом 24 годин. Визначали кількість клітин на лунку та розраховували кількість М. tuberculosis, необхідну для досягнення множинності інфекції 10. Суспендували бактерії в середовищі RPMI 1640 із 1 % FBS та підганяли до щільності, розрахованої на попередньому етапі. Розливали по 1 мл бактеріальної суспензії у лунки та інкубували протягом 4 годин щоб дозволити макрофагам фагоцитувати мікобактерії (інфекційний період). Потім видаляли супернатант і двічі промивали стерильним PBS для того, щоб повністю позбутися позаклітинних бактерій. Під час інфекційного періоду сполуку розводили в середовищі RPMI 1640 із 1 % FBS і по 1 мл розчину додавали в кожну лунку з клітинами та інкубували протягом 4 днів. Потім видаляли середовище і кожну лунку тричі промивали PBS. Макрофаги лізували заміною середовища росту одним мілілітром додецил сульфату натрію (0,25 %) у PBS. Із кожної лунки видаляли 100 мкл лізату, розводили у стерильному PBS і висівали на плашки із агаром Middlebrook 7H10. Плашки інкубували протягом 16-21 дня при 37 °C і потім підраховували кількість колоній. Для того, щоб визначити відсоток зниження внутрішньоклітинної кількості мікобактерій, ділять число колоній з лунок на кількість колоній у негативному контролі і множать результати на 100. Передбачуване зниження у виживанні для рифампіну становить 0 при 0,01 мкг/мл, 0,5-1,0 log зниження при 0,1 мкг/мл та 2-3 log зниження при 1 мкг/мл. Для сполуки 1 використовували концентрації 1, 0,1 та 0,01 мкг/мл. Результати дослідження внутрішньоклітинної активності сполуки 1 наведено в таблиці 3. Дослідження цитотоксичності сполуки 1. Готували 96-лункові плашки з неінфікованими 4 макрофагами. У кожну лунку висівали 0,1 мл 5,0 × 10 клітин (макрофагів)/мл у середовищі RPMI 1640 (+10 % FBS). Включали одну колонку лунок, що містили лише середовище і одну колонку лунок, що містили клітини в середовищі. Плашки інкубували протягом 3 днів при 37 °C із 5 % СО2. Видаляли середовище, яке містило FBS. Готували розведення сполуки в середовищі RPMI 1640 (без FBS). Додавали сполуку в об'ємі 0,1 мл у концентраціях 1, 0,1 та 0,01 мкг/мл. Плашки інкубували додатково протягом 3 днів при 37 °C із 5 % СО2. Після інкубації до кожної лунки додавали 0,01 мл (10 мкл) реагенту МТТ, включаючи контроль. Повертали плашку в інкубатор на 2-4 години при 37 °C із 5 % СО2. Періодично клітини переглядали під інвертованим мікроскопом на наявність пурпурного преципітату. За наявності останнього додавали 0,1 мл детергента до кожної лунки. Залишали накриту плашку в темряві на 2-4 години при кімнатній температурі. Потім вимірювали абсорбцію при 570 нм у плашковому рідері. Відсоток виживання макрофагів для позитивного контролю рифампіну повинен становити >90 % при найнижчій концентрації. Результати дослідження цитотоксичності сполуки 1 наведено в таблиці 3. Таблиця 3 Внутрішньоклітинна активність сполуки 1 у макрофагах та її цитотоксичність Логарифмічна Логарифмічна Логарифмічна редукція редукція редукція МТТ % МТТ % МТТ % активності активності активності виживання виживання виживання Сполука бактерії в бактерії в бактерії в (низька (середня (висока макрофагах макрофагах макрофагах концентрація) концентрація) концентрація) (низька (середня (висока концентрація) концентрація) концентрація) 1 2,02 2,26 2,43 100 96 83 Рифампін (позитив1,06 2,39 2,86 95 85 73 ний контроль) Дослідження зв'язування з протеїнами плазми крові сполуки 1. 5 UA 117279 U 5 10 15 Зв'язування з протеїнами плазми крові людини досліджуваної сполуки 1 визначали за допомогою рівноважного діалізу. Сполуку тестували з використанням напівпроникної мембрани, яка розділяє два об'єми, що відповідно містять протеїн (плазма крові людини) і буфер. Молекули можуть проникати вільно, але білки не можуть проходити через мембрану. Досліджувану сполуку змішували з плазмою крові людини і вносили до приладу. Після врівноваження при 37 °C з PBS, досліджувану речовину в кожному компартменті визначали кількісно за допомогою LC-MS/MS. Сполуку додавали до плазми крові при фіксованій концентрації 5 мкМ. Суміш піддавали діалізу в приладі RFD (Rapid Equilibrium Dialysis, Пірс) проти PBS та інкубували на орбітальному шейкері протягом 4 год. при 37 °C. Збирали аліквоти плазми і PBS; однаковий об'єм PBS додавали до зразків плазми крові і однаковий об'єм плазми додавали до зразків PBS. Три об'єми метанолу (містить внутрішній стандарт зв'язування - пропранолол (Sigma)) додавали для осадження білків і вивільнення сполуки. Кожну сполуку тестували два рази. Зразки центрифугували, супернатант відновлювали і аналізували за допомогою LC-MS/MS. Кожний зразок включав варфарин (Sigma) як високозв'язувальний контроль. Відсоток зв'язування з білками плазми крові для сполуки 1 наведено в таблиці 4. Таблиця 4 Зв'язування з протеїнами плазми крові сполуки 1, % № сполуки 1 Пропранолол Варфарин 20 25 30 35 40 45 Зв'язування з протеїнами плазми крові, % 42,1 75,6 99,4 Дослідження проникності сполуки 1 через моношар клітин Сасо-2. Проникність сполуки 1 оцінювали з використанням моношару клітин Сасо-2. Проникність сполуки визначали в обох напрямках. Для напрямку проникності А-Б, досліджувану сполуку додавали до апікальної сторони моношару клітин Сасо-2 і визначали транспорт сполуки до базальної сторони. Для напрямку проникності Б-А, досліджувану сполуку додавали до базальної сторони моношару клітин Сасо-2 і визначали транспорт сполуки до апікальної сторони. Дослідження проводили протягом 2 годин два рази. Кількість сполуки, наявної в кожному компартменті визначали кількісно за допомогою LC-MS/MS. Сасо-2 клітини трипсинізували, ресуспендували в середовищі і наносили на 96-лункову плашку Millipore 96-well Сасо-2 plate. Клітини росли та диференціювалися протягом трьох тижнів. Додавання поживних речовин проводили з інтервалом у два дні. Для дослідження проникності від апікальної до базолатеральної (А→Б) сторони, сполуки додавали до апікальної (А) сторони і проникнення сполуки визначали на базолатеральній (Б) стороні; для дослідження проникності від базолатеральної до апікальної (Б→А) сторони, сполуки додавали до базолатеральної (Б) сторони і проникнення сполуки визначали на апікальній (А) стороні. У кожному експерименті як контроль використовували атенолол (МР Biomedicals) (низька проникність), пропранолол (Sigma) (висока проникність) та талінолол (TRC) (P-gp- залежний транспорт). Якісний контроль. Сторона А містила 100 мкМ барвника Lucifer yellow (Sigma) у транспортному буфері із рН 6,5 (1,98 г/л глюкози у 10 мМ HEPES (Sigma), 1Х Hank's Balanced Salt Solution (Lonza)), а В сторона містила транспортний буфер із рН 7,4 (1,98 г/л глюкози у 10 мМ HEPES (Sigma), 1Х Hank's Balanced Salt Solution (Lonza)). Caco-2 клітини інкубували з цими буферами 1 або 2 години, буфер приймаючої сторони аналізували за допомогою LC-MS/MS. Аліквоти клітинних буферів аналізували за рівнем флуоресценції для визначення транспорту непроникного барвника Lucifer yellow з метою підтвердження того, що моношар клітин Сасо-2 правильно сформувався. В таблиці 5 дані представлені як проникність сполуки Рарр=(dQ/dt) /(C0A dQ/dt - рівень проникнення С0 - початкова концентрація сполуки А - площа моношару 6 UA 117279 U Таблиця 5 Проникнення через моношар клітин Сасо-2 сполуки 1 № сполуки 1 1 5 10 15 20 25 30 35 40 45 Тривалість дослідження (год.) 1 2 -6 А→В Рарр (10 см/с) 26,6 20,3 В→А Рарр -6 (10 см/с) 24,7 16,0 Рівень витікання 0,93 0,79 Дослідження інгібувальної активності сполуки 1 до шести ізоформ цитохрому Р450. Сполуку 1 тестували на здатність інгібувати шість ізоформ ензиму Р450-CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 і CYP3A4. Для кожного аналізу мікросоми печінки людини інкубували зі специфічним субстратом кожної ізоформи CYP за присутності сполуки. Формування метаболітів для кожної ізоформи визначали кількісно за допомогою LC-MS/MS як ступінь активності ензиму. Розраховували ферментативну активність і визначали IC50. Сполуку розчиняли в суміші ацетонітрил: ДМСО (9:1). Кінцевий вміст ДМСО в реакційній суміші був однаковий у всіх розчинах, які використовували в аналізі, і становив 10 хвилин при -20 °C. Вносили додатковий об'єм води, центрифугували для відділення преципітованого протеїну і супернатант аналізували за допомогою LC-MS/MS для кількісного визначення вихідної сполуки, що залишилася. Проводили контрольну реакцію без НАДФН (контрольний буфер) для того щоб визначити деградацію сполуки, що не залежить від НАДФН. Верапаміл (Sigma) та декстрометофарм (Sigma) вносили як контрольні сполуки. Аналіз даних. Дані конвертували у % сполуки, що залишилася в порівнянні з нульовою точкою часу. Дані були встановлені на моделі розпаду першого порядку для визначення часу піврозпаду сполуки. Характеристичний кліренс (CLint.) розраховували, виходячи з часу піврозпаду та концентрації протеїну: CLint. = ln(2)/(Т1/2 [мікросомний протеїн]) Т1/2=0.693/-к CLint. = характеристичний кліренс; Т1/21 = час піврозпаду; k = зсув Дані стосовно мікросомальної стабільності для сполуки 1 наведено в таблиці 6. 7 UA 117279 U Таблиця 6 Мікросомна стабільність in vitro сполуки 1, час напіврозпаду (Т1/2 (хв)) № сполуки 1 5 10 15 20 25 30 35 40 45 50 Концентрація (μΜ) 1 НАДФН- залежний час НАДФН- незалежний час напіврозпаду Т1/2 напіврозпаду Т1/2 149 >180 Таким чином, метаболізм сполуки 1 відбувається за НАДФН-залежним шляхом. Дослідження цитотоксичності сполуки 1 щодо еукаріотних клітин HepG2 Цитотоксичність сполуки щодо еукаріотних клітин визначали за використання клітин печінки людини HepG2 (ATCC). Клітини HepG2 інкубували зі сполукою протягом 72 годин і визначали життєздатність клітин. IC50 встановлювали як концентрацію сполуки, що призводить до зниження виживання клітин на 50 % через 72 години інкубації. Цитотоксичність сполуки визначали шляхом вимірювання життєздатності клітин HepG2 через 3 дні інкубації в присутності тестованої речовини. Сполуку серійно розчиняли в ДМСО. Найвища концентрація сполуки становила 100 мкМ, де сполука була розчинна в ДМСО при 10 мМ концентрації. Клітини HepG2 культивували в середовищі DMEM (середовище DMEM з високим рівнем глюкози (Invitrogen), 1Х розчин пеніциліну-стрептоміцину (Fisher), 2 мМ Corning Glutogro supplement (Fisher), 1 мМ пірувату натрію (Fisher), фетальна бичача сироватка (10 %) (Fisher)), висівали в 384-лункові плашки для аналізу, що містила сполуку та інкубували протягом 24 год. при 37 °C, 5 % СО2. Після додавання сполуки клітини інкубували ще протягом 72 годин. Кінцева концентрація ДМСО складала 1 %. Життєздатність клітин визначали за допомогою CellTiter-Glo® Luminescent Cell Viability Assay (Promega), вимірюючи відносні одиниці люмінесценції (RLU). Дозо-залежну криву відгуку будували з використанням алгоритму Левенберга-Марквардта. IC50 визначали як концентрацію сполуки, що призводить до зниження життєздатності клітин на 50 %. Як контроль використовували стауроспорин (Santa Cruz Biotechnology). Сполука 1 виявилася не цитотоксичною (IC50 >100 мкМ), тоді як значення IC50 стауроспорину, що є позитивним контролем, становить 0,045 мкМ. Дослідження антимікобактеріальної активності сполук 2-7 за умов низького вмісту Оксигену. Антимікробну активність сполук щодо штаму Mycobacterium tuberculosis H37Rv за умов гіпоксії визначали методом LORA (low oxygen recovery assay). Бактерії спочатку адаптували до умов низького вмісту Оксигену і потім експонували до сполук при гіпоксії. Це супроводжувалося певним періодом росту за аеробних умов, а ріст вимірювали, використовуючи люмінесценцію. Сполуки розчиняли в ДМСО (Fisher) та робили серію розведень шляхом двократного зменшення концентрації. Речовини розводили в середовищі Dubos-Tw-Albumin (DTA) (6,5 г/л поживного середовища Dubos Broth Base (Fisher), Dubos medium albumin (Fisher) (10 %), Tween 80 (Fisher) (0,05 %)) у 96-лункових плашках (фінальна концентрація ДМСО становила 2 %). Найвища концентрація сполуки становила 200 мкМ у випадку, якщо речовини були розчинні в ДМСО в 10 мМ концентрації. Клітини М. tuberculosis, що конститутивно експресують оперон luxABCDE інокулювали в середовище DTA в газонепроникних скляних пробірках та інкубували 18 днів для досягнення умов гіпоксії (модель гіпоксії Вейна). За відсутності Оксигену бактерії перебувають у нереплікуючому стані. Їх інокулювали в плашки із середовищем, що містило сполуки та інкубували за анаеробних умов протягом 10 днів, а потім інкубували протягом 28 годин за аеробних умов. Крім того, нереплікуючі бактерії інокулювали в плашки із середовищем, що містило сполуки та інкубували за аеробних умов протягом 5 днів. Ріст в обох випадках вимірювали за показниками люмінесценції. Рифампіцин (Sigma-Aldrich) та метронідазол (SigmaAldrich) використовували як позитивні контролі загибелі М. tuberculosis за аеробних та анаеробних умов, відповідно. Антимікобактеріальну активність досліджуваних сполук за умов гіпоксії наведено в таблиці 7. Дослідження мінімальної бактерицидної концентрації сполук 2-7 Бактерицидну активність сполук досліджували щодо штаму М. tuberculosis H37Rv, який вирощували за аеробних умов у середовищі 7H9-Tw-OADC. Обрахунок живих клітин проводили через 3 тижні експозиції до сполук для визначення рівня загибелі. Клітини М. tuberculosis вирощували за аеробних умов до логарифмічної фази та інокулювали в рідке середовище, що містило чотири різні концентрації сполук із максимальною концентрацією ДМСО 2 %. Для сполук зі значенням МІС>20 μΜ, відібрані концентрації були 10Х МІС, 5Х МІС, 1Х МІС і 0,25Х МІС (200, 100, 20 і 5 μΜ). Культури інкубували зі сполуками 8 UA 117279 U 5 протягом 21 дня, а виживання клітин визначали шляхом підрахунку колонієутворюючих одиниць на агарових плашках в 0, 7, 14 та 21 день. Мінімальну бактерицидну концентрацію визначали як мінімальну концентрацію, необхідну для досягнення 2-log загибелі на 21 день. ДМСО був використаний як позитивний контроль росту. Мінімальну бактерицидну концентрацію (МВС) сполук наведено в таблиці 7. Таблиця 7 Активність похідних гідразиду ізонікотинової кислоти МІС (мкМ), IC50 (мкМ), ІС90 (мкМ) за анаеробних умов та мінімальна бактерицидна активність МВС (мкМ) № сполуки 2 3 4 5 6 7 Рифампіцин Метронідазол 10 15 20 25 ІС50 0,23 0,23 0,42 0,19 0,26 1,4 0,00079 19 ІС90 0,28 0,28 0,59 0,21 0,34 33 0,0024 41 МІС 0,35 0,36 0,84 0,24 0,47 >200 0,0075 95 МВС 1,4 0,6 1,3 1,4 5,8 >43 Дослідження цитотоксичності та внутрішньоклітинної активності сполук 2-7. Цитотоксичність сполук щодо еукаріотних клітин визначали на клітинній лінії моноцитів людини ТНР-1. Клітини диференціювали в макрофагоподібні клітини за використання 4-форбол-12-міристат-13-ацетату (ФМА) (Sigma-Aldrich) та інкубували зі сполуками протягом трьох днів і визначали рівень виживання клітин. Значення ІС50 визначали, як концентрацію, що призводить до зниження рівня виживання клітин на 50 %. Сполуки розчиняли в ДМСО (Fisher) та робили серію розведень шляхом трикратного зменшення концентрації. Найвища концентрація тестованої сполуки становила 50 мкМ, де сполуки були розчинні в ДМСО в 10 мМ концентрації. Клітини ТНР-1 культивували в середовищі RPMI (RPMI-1640 (Fisher), фетальна бичача сироватка, рН 7,2 (10 %) (Fisher)), 2 мМ GlutaMAX (Fisher), 1 мМ пірувату натрію) та диференціювали в макрофагоподібні, використовуючи 80 нМ РМА протягом ночі при 37 °C, 5 % СО2. Клітини культивували в плашках протягом 24 годин перед додаванням розчинів сполук (фінальна концентрація ДМСО становила 0,5 %). Як контроль використовували стауроспорин. Потім клітини інкубували протягом 3 днів при 37 °C, 5 % СО2; ріст вимірювали за допомогою CellTiter-Glo® Luminescent Cell Viability Assay (Promega), що використовує АΤΦ як індикатор росту клітин. Відносні одиниці люмінесценції вимірювали, використовуючи плашковий рідер Biotek Synergy 4. Дозозалежну криву генерували, використовуючи алгоритм ЛевенбергаМарквардта і визначали концентрацію, при якій спостерігалося інгібування росту бактерій на 50 % (значення ІС50) (таблиця 8). Таблиця 8 Цитотоксичність похідних гідразиду ізонікотинової кислоти ІС 50 мкМ) № сполуки 2 3 4 5 6 7 ІС50 >100 >100 >100 >100 >100 >50 0,016 Стауроспорин 30 Внутрішньоклітинну активність сполук визначали за використання клітин ТНР-1, інфікованих М. tuberculosis. Клітини диференціювали в макрофагоподібні клітини за використання ФМА та інфікували бактеріями. Інфіковані клітини інкубували зі сполуками протягом 72 годин. Сполуки розчиняли в ДМСО (Fisher) та робили серію розведень шляхом трикратного зменшення концентрації. Найвища концентрація тестованої сполуки становила 50 мкМ, де 9 UA 117279 U 5 10 сполуки були розчинні в ДМСО в 10 мМ концентрації. Клітини ТНР-1 культивували в середовищі RPMI (RPMI-1640 (Fisher), фетальна бичача сироватка, рН 7,2 (10 %) (Fisher)), 2 мМ GIutaMAX (Fisher), 1 мМ пірувату натрію) та диференціювали в макрофагоподібні, використовуючи 80 нМ РМА протягом ночі при 37 °C, 5 % СО2. Клітини ТНР-1 інфікували люмінесцентним штамом H37R.V (що конститутивно експресує luxABCDE), та інкубували протягом ночі при 37 °C, 5 % СО2. Інфіковані клітини відновлювали за допомогою розчину Accutasc/EDTA (Fisher), двічі відмивали фосфатним буфером для видалення позаклітинних бактерій та висівали в плашки. До клітин додавали розчини сполук (кінцева концентрація ДМСО становила 0,5 %). Плашки інкубували протягом 72 год. при 37 °C, 5 % СО2. Як контроль використовували ізоніазид. Кількість живих бактеріальних клітин визначали за рівнем люмінесценції. Відносні одиниці люмінесценції визначали за використання платкового рідера Biotek Synergy 2. Дозозалежну криву генерували, використовуючи алгоритм Левенберга-Марквардта і визначали концентрації, при яких спостерігалося інгібування росту бактерій на 50 % та на 90 % (значення ІС50 та ІС%, відповідно) (табл. 9). 15 Таблиця 9 Внутрішньоклітинна активність (ІС50, IC90 (мкМ)) похідних гідразиду ізонікотинової кислоти № сполуки 2 3 4 5 6 7 ІС50 >100 >100 >100 >100 >100 0,19 0,315 Ізоніазид 20 25 30 35 40 ІС90 0,30 0,38 Дослідження антибактеріальної активності сполук 2-7 щодо резистентних штамів М. Tuberculosis. Активність сполук щодо п'яти резистентних штамів М. tuberculosis визначали за аеробних умов. Використовували два ізоніазид-резистентні штами (INH-R1 і INH-R2), два рифампіцинрезистентні штами (RIF-R1 і RIF-R2) та флуорохінолон-резистентний штам (FQ-R1). Метод ґрунтується на вимірюванні росту бактерій в рідкому середовищі за показником оптичної густини. INH-R1 був отриманий із H37Rv (мутація гену katG (Y155*)), INH-R2 - штам АТСС35822. RIF-R1 був отриманий із H37Rv (мутація гену rpoB (S522L)), RIF-R2 - штам АТСС35828. FQ-R1 був отриманий із H37Rv (мутація гену gyrВ (D94N)). Мінімальну інгібувальну концентрацію сполуки визначали шляхом вимірювання бактеріального росту через п'ять днів за присутності досліджуваної сполуки. Сполуки розчиняли в ДМСО (Fisher) та робили серію розведень шляхом двократного зменшення концентрації. Речовини розводили в середовищі 7H9-Tw-OADC у 96-лункових плашках (фінальна концентрація ДМСО становила 2 %). Найвища концентрація сполуки становила 200 мкМ у випадку, якщо речовини були розчинні в ДМСО в 10 мМ концентрації. Кожна плашка містила декілька контролів (лише середовище/ДМСО, без бактеріальних клітин), відсутність росту (100 мкМ рифампіцину (Sigma-Aldrich)) та максимальний ріст (лише ДМСО). Планшети інокулювали клітинами М. tuberculosis та інкубували протягом 5 днів: ріст вимірювали за оптичною щільністю (OD590). Для вимірювання чисельного значення МІС будували 10-точкову дозозалежну криву як % росту і підганяли до моделі Гомпертца з використанням GraphPad Prism 5. МІС розрахували з точки перегину кривої, підігнаної до нижньої асимптоти (відсутній ріст бактерій). Крім того, дозозалежні криві генерували, використовуючи алгоритм Левенберга-Марквардта і визначали концентрації, при яких спостерігали інгібування росту бактерій на 50 % та на 90 % (значення ІС50 та ІС90, відповідно). Мінімальну інгібувальну концентрацію похідних гідразиду ізонікотинової кислоти (МІС, мкМ) щодо резистентних штамів М. tuberculosis наведено в таблиці 10, ІС50 (мкМ) - в таблиці 11, ІС90 (мкМ) - в таблиці 12. 10 UA 117279 U Таблиця 10 Мінімальна інгібувальна концентрація (МІС, мкМ) похідних гідразиду ізонікотинової кислоти відносно до резистентних штамів М. tuberculosis № сполуки 2 3 4 5 6 7 рифампіцин рифампіцин ізоніазид ізоніазид левофлоксацин левофлоксацин INH-R1 >200 >200 >200 >200 >200 >200 0,016 0,020 >200 >200 1,4 1,4 INH-R2 >200 >200 >200 >200 >200 >200 0,0058 0,011 >200 >200 2,1 2,3 RIF-R1 0,93 0,40 0,82 0,37 1,8 0,42 3,6 3,0 0,32 0,36 1,4 1,3 RIF-R2 1,9 0,91 1,8 1,7 7,2 0,87 >50 >50 0,66 0,71 1,4 1,6 FQ-R1 2,1 0,82 1,6 0,83 6,3 0,89 0,018 0,015 0,64 0,80 24 26 INH-R1 - ізоніазид-резистентний штам H37Rv (мутація гену katG (Y155*)), INH-R2 - ізоніазид-резистентний штам H37Rv (ATCC35822) RIF-R1 - рифампіцин-резистентний штам H37Rv (мутація гену rpoB (S522L)) RIF-R2 - рифампіцин-резистентний штам H37Rv (ATCC35828) FQ-R1 - флуорохінолон-резистентний штам H37Rv (мутація гену gyrB (D94N)). Таблиця 11 ІС50 похідних гідразиду ізонікотинової кислоти відносно до резистентних штамів М. tuberculosis (мкМ) № сполуки 2 3 4 5 6 7 рифампіцин рифампіцин ізоніазид ізоніазид левофлоксацин левофлоксацин INH-R1 >200 >200 >200 >200 >200 >200 0,0092 0,011 >200 >200 0,94 0,80 INH-R2 >200 >200 >200 >200 >200 >200 0,0041 0,0057 >200 >200 1,2 1,4 RIF-R1 0,28 0,19 0,37 0,21 1,2 0,36 1,7 1,3 0,28 0,25 0,79 0,87 RIF-R2 1,4 0,46 0,92 0,66 3,8 0,83 >50 >50 0,64 0,74 0,89 1,1 INH-R1 - ізоніазид-резистентний штам H37Rv (мутація гену katG (Y155*)), INH-R2 - ізоніазид-резистентний штам H37Rv (ATCC35822) RIF-R1 - рифампіцин-резистентний штам H37Rv (мутація гена rро В (S522L)) RIF-R2 - рифампіцин-резистентний штам H37Rv (ATCC35828) FQ-R1 - флуорохінолон-резистентний штам H37Rv (мутація гена gyrB (D94N)). 11 FQ-R1 1,3 0,39 0,72 0,37 3,3 0,59 0,0095 0,0094 0,47 0,49 14 15 UA 117279 U Таблиця 12 ІС90 похідних гідразиду ізонікотинової кислоти по відношенню до резистентних штамів М. tuberculosis (мкМ) № сполуки 2 3 4 5 6 7 рифампіцин рифампіцин ізоніазид ізоніазид левофлоксацин левофлоксацин INH-R1 >200 >200 >200 >200 >200 >200 0,022 0,024 >200 >200 1,5 1,5 INH-R2 >200 >200 >200 >200 >200 >200 0,0071 0,012 >200 >200 2,3 2,3 RIF-R1 0,75 0,21 0,44 0,37 1,8 0,42 4,3 3,4 0,31 0,36 1,5 1,3 RIF-R2 3,6 0,86 1,9 1,8 7,9 1,4 >50 >50 0,97 1,0 1,5 1,9 FQ-R1 2,8 0,46 1,1 0,42 7,8 0,89 0,025 0,024 0,63 0,86 23 24 INH-R1 - ізоніазид-резистентний штам H37Rv (мутація гена katG (Y155*)), INH-R2 - ізоніазид-резистентний штам H37Rv (ATCC35822) RIF-R1 - рифампіцин-резистентний штам H37Rv (мутація гена rpoB (S522L)) RIF-R2 - рифампіцин-резистентний штам H37Rv (ATCC35828) FQ-R1 - флуорохінолон-резистентний штам H37Rv (мутація гену gyrB (D94N)). 5 10 15 20 25 30 35 Таким чином, досліджувані похідні гідразиду ізонікотинової кислоти проявляють високу антитуберкульозну активність щодо патогенного штаму Mycobacterium tuberculosis H37Rv за аеробних та анаеробних умов і мають внутрішньоклітинну активність на макрофагоподібних клітинах. Крім того, сполука 1 з хімічною назвою (1-метил-1H-пірол-2-ілметилен)-гідразид ізонікотинової кислоти є ефективною стосовно ізоніазид-, рифампіцин- та флуорохінолінрезистентних штамів мікобактерій та характеризується хорошими ADME властивостями (рівень зв'язування з протеїнами плазми крові становить 42,1 %, сполука є проникною через моношар клітин Сасо-2, інгібує лише одну з досліджуваних ізоформ цитохрому Р450-CYP2C19) та має низьку цитотоксичність стосовно еукаріотних клітин HepG2 (>100 μΜ). Перераховані властивості дозволяють використовувати цю сполуку у фармацевтиці як препарат для лікування мультирезистентних форм туберкульозу. Джерела інформації: 1. Judge V. Isoniazid: the magic molecule /V. Judge, B. Narasimhan, M. Ahuja. //Med. Chem. Res. - 2012. - Vol. 21. - P. 3940-3957. 2. Preparation and antitubercular activities in vitro and in vivo of novel Schiff bases of isoniazid /[M. Hearn, M. Cynamon, M. Chen et al.]. //Eur. J. Med. Chem. - 2009. - Vol. 44. - P. 4169-4178. 3. Synthesis, toxicity, and antituberculosis activity of isoniazid derivatives containing sterically hindered phenols. /[Y. Oludina, A. Voloshina, M. Kulik et al.]. //Pharm Chem J. - 2014. - Vol. 48. - P. 57. 4. Anti-tuberculosis activity of lipophilic isoniazid derivatives and their interactions with first-line anti-tuberculosis drugs /[T. Parumasivam, H. Kumar, P. Ibrahim et al.]. //J. Pharm. Res. - 2013. - Vol. 7. - P. 313-317. 5. Synthesis and bioevaluation of some new isoniazid derivatives /[L. Matei, С Bleotu, I. Baciu et al.]. //Bioorg. Med. Chem. - 2013. - Vol. 21. - P. 5355-5361. 6. Synthesis of highly potent novel anti-tubercular isoniazid analogues with preliminary pharmacokinetic evaluation /[A. Ramani, A. Monika, V. Indira et al.]. // Bioorg. Med. Chem. Lett. 2012. - Vol. 22. - P. 2764-2767. 7. Synthesis and evaluation of isonicotinoyl hydrazone derivatives as antimycobacterial and anticancer agents /[H. Kumar, T. Parumasivam, F. Jumaat et. al]. //Med. Chem. Res. - 2014. Vol. 23. P. 269-279. 8. Potent antimycobacterial activity of the pyridoxal isonicotinoyl hydrazone analog 2pyridylcarboxaldehyde isonicotinoyl hydrazone: a lipophilic transport vehicle for isonicotinic acid hydrazide /[S. Ellis, D. Kalinowski, L. Leotta et al.]. //Моl Pharm. - 2014. - Vol. 85. - P. 269-278. 12 UA 117279 U 9. Synthesis and evaluation of copper(II) complexes with isoniazid-derived hydrazones as anticancer and antitubercular agents /[G. Firmino, M. de Souza, С Pessoa et al.]. //Biometals. - 2016. - doi: 10.1007/s10534-016-9968-7. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 5 Низькомолекулярні органічні сполуки з антитуберкульозною дією на основі гідразиду ізонікотинової кислоти, які відрізняються тим, що містять нові замісники загальної формули: O N N 10 N R1 R2 , де R2 - Н, R1 - 3-метокси-4-гідроксифеніл, 6-бензотіазол-2-метил, 2-нітрофеніл, 2,4дигідроксифеніл, 2-піридин, 1-метил-1H-пірол, 3-гідрокси-4-метоксифеніл, 4-метилфеніл, 1Ніндол-3-іл-1-(3-діетиламінопропан-2-ол), 1Н-індол-3-іл-1-(3-(пропіламіно-2-диметил-3-ол)пропан2-ол), та R2 - СН3, R1 - карбетокси, 4-нітрофеніл, 3-нітрофеніл, 4-н-гексилфеніл. Комп’ютерна верстка О. Рябко Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 13
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07D 213/00
Мітки: ізонікотинової, гідразиду, сполуки, органічні, антитуберкульозною, основі, низькомолекулярні, кислоти, дією
Код посилання
<a href="https://ua.patents.su/15-117279-nizkomolekulyarni-organichni-spoluki-z-antituberkuloznoyu-diehyu-na-osnovi-gidrazidu-izonikotinovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Низькомолекулярні органічні сполуки з антитуберкульозною дією на основі гідразиду ізонікотинової кислоти</a>
Попередній патент: Мостовий засіб з регульованою технологічною колією
Наступний патент: Пристрій для відбору проб води
Випадковий патент: Спосіб профілактики тромбозу синтетичного судинного шунта