Низькомолекулярні органічні сполуки з антитуберкульозною дією на основі тіосемикарбазону бензальдегідів
Номер патенту: 116134
Опубліковано: 10.05.2017
Автори: Бджола Володимир Григорович, Крикливий Іван Андрійович, Тукало Михайло Арсентійович, Волинець Галина Петрівна, Тарнавський Сергій Степанович, Старосила Сергій Анатолійович, Гудзера Ольга Йосипівна, Ярмолюк Сергій Миколайович
Формула / Реферат
Низькомолекулярні органічні сполуки з антитуберкульозною дією на основі тіосемикарбазону бензальдегідів загальної формули:
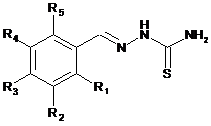 ,
,
де R1 - водень; фтор; хлор; гідроксильна група; пентоксигрупа;
R2 - водень; хлор; етоксигрупа; пропоксигрупа; нітрогрупа;
R3 - водень; бром; нітрогрупа; диметиламін; гідроксильна група; бензилокси; 4-хлорбензилокси; етоксигрупа; пропоксигрупа; 4-бромбензилокси; пентоксигрупа; 4-метилбензилокси; 3-метилбензилокси; 2-фенілетокси;
R4 - водень; етоксигрупа; бром; нітрогрупа; метоксигрупа; ізопропоксигрупа;
R5 - водень; хлор; метоксигрупа; хлор, гідроксильна група.
Текст
Реферат: Низькомолекулярні органічні сполуки з антитуберкульозною дією на основі тіосемикарбазону бензальдегідів загальної формули: R5 R4 N R3 R1 R2 H N NH2 S , де R1 - водень; фтор; хлор; гідроксильна група; пентоксигрупа; R2 - водень; хлор; етоксигрупа; пропоксигрупа; нітрогрупа; R3 - водень; бром; нітрогрупа; диметиламін; гідроксильна група; бензилокси; 4-хлорбензилокси; етоксигрупа; пропоксигрупа; 4-бромбензилокси; пентоксигрупа; 4-метилбензилокси; 3метилбензилокси; 2-фенілетокси; R4 - водень; етоксигрупа; бром; нітрогрупа; метоксигрупа; ізопропоксигрупа; R5 - водень; хлор; метоксигрупа; хлор, гідроксильна група. UA 116134 U (12) UA 116134 U UA 116134 U 5 10 15 20 25 30 Корисна модель належить до класу тіосемикарбазону бензальдегідів та його застосування в терапії. Більш конкретно ця модель пропонує похідні бензальдегід тіосемикарбазону, що мають антитуберкульозну активність. Запропоновані сполуки є корисними як фармацевтичні агенти для лікування туберкульозу. Відомими аналогами є препарати першої лінії протитуберкульозної терапії такі як ізоніазид (гідразид ізонікотинової кислоти), що пригнічує ріст Mycobacterium tuberculosis зі значенням МІС=0,1 мкг/мл, рифампіцин, який має антимікобактеріальну активність зі значенням МІС=0,5 мкг/мл та етамбутол (МІС=4 мкг/мл) [1]. Відомими аналогами є протитуберкульозні ліки другої лінії такі як стрептоміцин (2,0 мкг/мл), аміносаліцилова кислота (0,5-2,0 мкг/мл), етіонамід (0,63-1,25 мкг/мл), циклосерин (12,5-50 мкг/мл), гентаміцин (2,0-4,0 мкг/мл), канаміцин (1,2-5,0 мкг/мл), тобраміцин (4,0-8,0 мкг/мл), кларитроміцин (8,0-16 мкг/мл), тіацетазон (0,125-2,0 мкг/мл), піриметамін (МІС > 100 мкг/мл). Відомими аналогами є антитуберкульозні препарати другої лінії терапії серед похідних флуорохінолону - спарфлоксацин (МІС=0,08 мкМ), моксифлоксацин (МІС=0,16 мкМ), гатифлоксацин (МІС=1,25 мкМ), левофлоксацин (МІС=1,25 мкМ), ципрофлоксацин (МІС=1,51 мкМ), офлоксацин (МІС=2,5 мкМ) [2], DC-159а (МІС=0,14 мкМ) [3], серед похідних оксазолідинону - лінезолід (МІС = 1,5-2,97 мкМ) [4], серед похідних етилендіаміну - SQ-109 (МІС=0,7-1,56 мкМ) [5]. Однак, недоліком усіх аналогів вищеперерахованих лікарських препаратів є зниження їх ефективності при лікуванні туберкульозу у зв'язку з виникненням стійкості у Mycobacterium tuberculosis. У 2012 році вперше за сорок років Управлінням США по контролю за харчовими продуктами і лікарськими засобами (FDA) був схвалений новий протитуберкульозний препарат - бедахілін, з комерційною назвою Сіртуро, що пригнічує ріст М. tuberculosis зі значенням МІС у діапазоні від 0,05 до 0,12 мкМ, залежно від штаму [6] і призначений для лікування мультирезистентної форми туберкульозу. Однак, нещодавно з'явилися опубліковані дані стосовно резистентності і до Сіртуро [7]. В основу корисної моделі поставлена задача розробити нові низькомолекулярні сполуки, що мають антибактеріальну активність щодо штамів М. tuberculosis, резистентних до існуючих антибіотиків. Поставлена задача вирішується тим, що низькомолекулярні органічні сполуки на основі тіосемикарбазону бензальдегідів загальної формули: R5 R4 N R3 R1 H N NH2 S R2 35 40 45 50 де R1 - водень; фтор; хлор; гідроксильна група; пентоксигрупа; R2 - водень; хлор; етоксигрупа; пропоксигрупа; нітрогрупа; R3 - водень; бром; нітрогрупа; диметиламін; гідроксильна група; бензилокси; 4хлорбензилокси; етоксигрупа; пропоксигрупа; 4-бромбензилокси; пентоксигрупа; 4метилбензилокси; 3-метилбензилокси; 2-фенілетокси; R4 - водень; етоксигрупа; бром; нітрогрупа; метоксигрупа; ізопропоксигрупа; R5 - водень; хлор; метоксигрупа; хлор, гідроксигрупа. Запропоновані речовини відрізняються за хімічною структурою від відомих у літературі [8-11] та мають кращу антитуберкульозну активність. Заявлені низькомолекулярні сполуки з антитуберкульозною активністю одержували наступним чином: 1 ммоль тіосемикарбазиду розчиняли при нагріванні у 100 мл етанолу та додавали 1 ммоль відповідного альдегіду. Реакційну суміш кип'ятили до випадіння осаду (приблизно 20-40 хв), потім охолоджували, осад відфільтровували, двічі промивали по 20 мл етанолу та висушували. Структуру синтезованих речовин встановлювали за допомогою 1 спектрів H-ЯМР, записаних у ДМСО-D6 на приладі "Varian MercuryVRX-400" з робочою частотою 400 МГц і внутрішнім стандартом - ТМС. Одержані результати свідчать про відповідність синтезованих низькомолекулярних органічних сполук заявленим. Дослідження антимікобактеріальної активності сполук за аеробних умов Антимікробну активність сполук щодо штаму М. tuberculosis H37Rv, який культивували за аеробних умов, оцінювали шляхом визначення мінімальної інгібувальної концентрації (МІС) 1 UA 116134 U 5 10 15 20 25 сполуки, тобто концентрації, що повністю припиняла ріст бактерій. Метод ґрунтувався на вимірюванні росту бактерій у рідкому середовищі флуоресцентного репортерного штаму H37Rv, де показниками були або оптична щільність, або флуоресценція. Використання двох параметрів оцінки мінімізує проблеми, викликані преципітацією сполуки або автофлуоресценцією. Розраховували значення ІС50 - концентрацію сполуки, при якій ріст мікроорганізмів інгібується на 50 % та ІС90 - концентрацію сполуки, при якій ріст мікроорганізмів інгібується на 90 %. МІС визначали шляхом вимірювання бактеріального росту через 5 днів за присутності досліджуваних сполук. Сполуки розчиняли в ДМСО (Fisher) та робили серію розведень шляхом двократного зменшення концентрації. Речовини розводили в середовищі 7H9-Tw-OADC (4,7 г/л поживного середовища Middlebrook 7H9 Base (VWR), Tween 80 (Fisher) (0,05 %), Middlebrook OADC Supplement (VWR) (10 %)) у 96-лункових плашках (фінальна концентрація ДМСО становила 2 %). Найвища концентрація сполуки становила 200 мкМ у випадку, якщо речовини були розчинні в ДМСО в 10 мМ концентрації. Для сполук із поганою розчинністю найвища концентрація була нижчою в 50 разів, ніж стокова концентрація, наприклад, 100 мкМ для 5 мМ стокового розчину в ДМСО, 20 мкМ для 1 мМ стокового розчину. Для високоактивних сполук досліди повторювали при нижчих початкових концентраціях. Кожна плашка містила декілька контролів (лише середовище/ДМСО, без бактеріальних клітин), відсутність росту - (100 мкМ рифампіцину (Sigma-Aldrich)) та максимальний ріст (лише ДМСО). Плашки інокулювали клітинами М. tuberculosis та інкубували протягом 5 днів: ріст вимірювали за оптичною щільністю (OD590) та флуоресценцією (Ex 560/Em 590), використовуючи плашковий рідер BioTek™ Synergy 4. Для вимірювання чисельного значення МІС будували 10-точкову дозо-залежну криву як % росту і підганяли до моделі Гомпертца з використанням GraphPad Prism 5. МІС розраховували з точки перегину кривої підігнаної до нижньої асимптоти (відсутній ріст бактерій). Крім того, дозо-залежні криві генерували, використовуючи алгоритм Левенберга-Марквардта і визначали концентрації, при яких спостерігалося інгібування росту бактерій на 50 % та на 90 % (значення ІС50 та ІС90, відповідно). Хімічні структури замісників похідних бензальдегід тіосемикарбазону та антимікобактеріальну активність досліджуваних сполук за аеробних умов наведено в таблиці 1. Таблиця 1 Хімічні структури замісників похідних тіосемикарбазону бензальдегідів МІС (мкМ), ІС 5о (мкМ) та ІС9о (мкМ) за аеробних умов R5 R4 N R3 H N NH2 S R1 R2 № сполуки 1 2 R1 R2 R3 R4 R5 IC50 IC90 MIC Η Η Η Η Вr ΝΟ2 Η Η Η Η 0,29 0,65 0,93 3,7 0,86 3,2 3 Η Η N Η Η 0,11 0,33 0,32 4 Η Η ОН Η Η 0,6 1,7 1,5 5 Η O ОН Η Η 0,94 3,2 2,8 6 Η O O Η Η 0,3 0,87 0,78 7 Η O O Η Η 1,3 2,3 2,2 2 UA 116134 U Продовження таблиці 1 8 Η O 9 Η O 10 Η 11 Η 12 Η 13 Η Η 14 Η O Η 0,15 0,57 0,54 Η Η 0,028 0,2 0,22 Η Η 0,14 0,53 0,48 Η Η 1,4 3 2,9 Η Η 0,28 0,53 0,43 Η Η 0,056 0,14 0,14 Η 0,25 0,81 0,71 Η 0,51 0,97 0,83 Η Η 0,091 0,18 0,18 Η Η Η Η Cl Η 2,3 >200 1,1 6,5 >200 3,5 6,3 >200 3,2 3,5 17 16 O Η O Η O СН3 O C O O Η Η O Η 15 Η O O 16 Η Η 17 18 19 F Cl Η Η Сl Η Η Η Η 20 Η Η Η 21 Η O ОН Br Η 3,7 20 19 22 Η O ОН ΝΟ2 Η 82 >200 >200 23 24 F ОН Η Br Η ОН Η Br Cl Η 2,7 21 8,7 42 9 36 25 Η O ОН Br Η 6,3 20 19 26 Η Η NO2 Η 1,9 100 ΝΑ 27 Η Η Η ОН 2,7 4,8 4,6 Η Η Η 12 20 17 28 O O O O Η O 3 O UA 116134 U Продовження таблиці 1 29 ОН 30 Η ΝO2 31 Η Η 32 Η Η Η Η 17 88 51 O Η 64 140 200 O O Η 1,7 3,3 3,2 Η 130 200 200 NO2 ОН O N 5 10 15 20 25 30 35 Η N Дослідження антимікобактеріальної активності сполук за умов низького вмісту Оксигену Антимікробну активність сполук щодо штаму Mycobacterium tuberculosis H37Rv за умов гіпоксії визначали способом LORA (low oxygen recovery assay). Бактерії спочатку адаптували до умов низького вмісту Оксигену і потім експонували до сполук при гіпоксії. Це супроводжувалося певним періодом росту за аеробних умов, а ріст вимірювали, використовуючи люмінесценцію. Сполуки розчиняли в ДМСО (Fisher) та робили серію розведень шляхом двократного зменшення концентрації. Речовини розводили в середовищі Dubos-Tw-Albumin (DTA) (6,5 г/л поживного середовища Dubos Broth Base (Fisher), Dubos medium albumin (Fisher) (10 %), Tween 80 (Fisher) (0,05 %)) у 96-лункових плашках (фінальна концентрація ДМСО становила 2 %). Найвища концентрація сполуки становила 200 мкМ у випадку, якщо речовини були розчинні в ДМСО в 10 мМ концентрації. Клітини М. tuberculosis, що конститутивно експресують оперон luxABCDE інокулювали в середовище DTA в газонепроникних скляних пробірках та інкубували 18 днів для досягнення умов гіпоксії (модель гіпоксії Вейна). За відсутності Оксигену бактерії перебувають у нереплікуючому стані. Їх інокулювали в плашки із середовищем, що містило сполуки та інкубували за анаеробних умов протягом 10 днів, а потім інкубували протягом 28 годин за аеробних умов. Крім того, нереплікуючі бактерії інокулювали в плашки із середовищем, що містило сполуки та інкубували за аеробних умов протягом 5 днів. Ріст в обох випадках вимірювали за показниками люмінесценції. Рифампіцин (Sigma-Aldrich) та метронідазол (SigmaAldrich) використовували як позитивні контролі загибелі М. tuberculosis за аеробних та анаеробних умов, відповідно. Антимікобактеріальну активність досліджуваних сполук за умов гіпоксії наведено в таблиці 2. Дослідження мінімальної бактерицидної концентрації сполук Бактерицидну активність сполук досліджували щодо штаму М. tuberculosis H37Rv, який вирощували за аеробних умов у середовищі 7H9-Tw-OADC. Обрахунок живих клітин проводили через 3 тижні експозиції до сполук для визначення рівня загибелі. Клітини М. tuberculosis вирощували за аеробних умов до логарифмічної фази та інокулювали в рідке середовище, що містило чотири різні концентрації сполук із максимальною концентрацією ДМСО 2 %. Для сполук зі значенням МІС > 20 μΜ, відібрані концентрації були 10Х МІС, 5Х МІС, 1Х МІС і 0.25Х МІС (200, 100, 20 і 5 μΜ). Культури інкубували зі сполуками протягом 21 дня, а виживання клітин визначали шляхом підрахунку колоніє-утворюючих одиниць на агарових плашках в 0, 7, 14 та 21 день. Мінімальну бактерицидну концентрацію визначали як мінімальну концентрацію, необхідну для досягнення 2-log загибелі на 21 день. ДМСО був використаний як позитивний контроль росту. Мінімальну бактерицидну концентрацію (МВС) сполук наведено в таблиці 2. 4 UA 116134 U Таблиця 2 Активність похідних тіосемикарбазону бензальдегідів МІС (мкМ), ІС50 (мкМ), ІС90 (мкМ) за анаеробних умов та мінімальна бактерицидна активність МВС (мкМ) № сполуки 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Рифампіцин Метронідазол 5 10 15 20 ІС50 0,8 3,9 0,33 0,45 0,43 0,072 2,3 0,17 0,015 0,062 4,3 0,062 0,022 0,018 0,23 0,027 0,0013 19 ІС90 26 45 16 42 32 1,9 48 1,4 0,46 1,6 19 0,66 0,15 0,11 3,8 0,13 0,016 79 МІС >200 >200 >200 >200 >200 71 >200 15 20 58 92 8,9 1,2 0,74 82 0,68 0,07 200 МВС >8,6 >32 3,2 >15 >28 >7,8 >22 >5,4 >2,2 >4,8 >29 >4,3 >1,4 >7,9 >8,3 >1,8 Дослідження цитотоксичності та внутрішньоклітинної активності Цитотоксичність сполук щодо еукаріотичних клітин визначали на клітинній лінії моноцитів людини ТНР-1. Клітини диференціювали в макрофагоподібні клітини за використання 4форбол-12-міристат-13-ацетату (ФМА) (Sigma-Aldrich) та інкубували зі сполуками протягом трьох днів і визначали рівень виживання клітин. Значення ІС50 визначали як концентрацію, що призводить до зниження рівня виживання клітин на 50 %. Сполуки розчиняли в ДМСО (Fisher) та робили серію розведень шляхом трикратного зменшення концентрації. Найвища концентрація тестованої сполуки становила 50 мкМ, де сполуки були розчинні в ДМСО в 10 мМ концентрації. Клітини ТНР-1 культивували в середовищі RPMI (RPMI-1640 (Fisher), фетальна бичача сироватка, рН 7,2 (10 %) (Fisher)), 2 мМ GlutaMAX (Fisher), 1 мМ пірувату натрію) та диференціювали в макрофагоподібні, використовуючи 80 нМ РМА протягом ночі при 37 °C, 5 % СО2. Клітини культивували в плашках протягом 24 годин перед додаванням розчинів сполук (фінальна концентрація ДМСО становила 0,5 %). Як контроль використовували стауроспорин. Потім клітини інкубували протягом 3 днів при 37 °C, 5 % СO2; ріст вимірювали за допомогою CellTiter-Glo® Luminescent Cell Viability Assay (Promega), що використовує АТФ як індикатор росту клітин. Відносні одиниці люмінесценції вимірювали, використовуючи плашковий рід ер Biotek Synergy 4. Дозозалежну криву генерували, використовуючи алгоритм ЛевенбергаМарквардта і визначали концентрацію, при якій спостерігалося інгібування росту бактерій на 50 % (значення IC50) (таблиця 3). Таблиця 3 Цитотоксичність похідних тіосемикарбазону бензальдегідів (ІС 50, мкМ) № сполуки 1 2 3 4 5 6 7 ІС50 39 >50 >50 >50 >50 16 7,1 5 UA 116134 U Продовження таблиці 3 8 9 10 11 12 13 14 15 16 Стауроспорин 5 10 15 20 >50 >50 >50 >50 3,5 8,0 45 10 3,9 0,016 Внутрішньоклітинну активність сполук визначали за використання клітин ТНР-1, інфікованих М. tuberculosis. Клітини диференціювали в макрофагоподібні клітини за використання ФМА та інфікували бактеріями. Інфіковані клітини інкубували зі сполуками протягом 72 годин. Сполуки розчиняли в ДМСО (Fisher) та робили серію розведень шляхом трикратного зменшення концентрації. Найвища концентрація тестованої сполуки становила 50 мкМ, де сполуки були розчинні в ДМСО в 10 мМ концентрації. Клітини ТНР-1 культивували в середовищі RPMI (RPMI-1640 (Fisher), фетальна бичача сироватка, рН 7,2 (10 %) (Fisher)), 2 мМ GlutaMAX (Fisher), 1 мМ пірувату натрію) та диференціювали в макрофагоподібні, використовуючи 80 нМ РМА протягом ночі при 37 °C, 5 % СО2. Клітини ТНР-1 інфікували люмінесцентним штамом H37R.V (що конститутивно експресує luxABCDE) та інкубували протягом ночі при 37 °C, 5 % СО2. Інфіковані клітини відновлювали за допомогою розчину Accutase/EDTA (Fisher), двічі відмивали фосфатним буфером для видалення позаклітинних бактерій та висівали в плашки. До клітин додавали розчини сполук (кінцева концентрація ДМСО становила 0,5 %). Плашки інкубували протягом 72 год. при 37 °C, 5 % СО2. Як контроль використовували ізоніазид. Кількість живих бактеріальних клітин визначали за рівнем люмінесценції. Відносні одиниці люмінесценції визначали за використання плашкового рідера Biotek Synergy 2. Дозозалежну криву генерували, використовуючи алгоритм Левенберга-Марквардта і визначали концентрації, при яких спостерігалося інгібування росту бактерій на 50 % та на 90 % (значення IC50 та ІС90, відповідно) (табл. 4). Таблиця 4 Внутрішньоклітинна активність (ІС50, IC90 (мкМ)) похідних тіосемикарбазону бензальдегідів № сполуки 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Ізоніазид ІС50
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07C 281/00, C07C 337/00
Мітки: бензальдегідів, сполуки, основі, органічні, антитуберкульозною, низькомолекулярні, дією, тіосемикарбазону
Код посилання
<a href="https://ua.patents.su/14-116134-nizkomolekulyarni-organichni-spoluki-z-antituberkuloznoyu-diehyu-na-osnovi-tiosemikarbazonu-benzaldegidiv.html" target="_blank" rel="follow" title="База патентів України">Низькомолекулярні органічні сполуки з антитуберкульозною дією на основі тіосемикарбазону бензальдегідів</a>
Попередній патент: Спосіб одержання мінеральної кормової добавки для сільськогосподарських тварин “сапоніт с”
Наступний патент: Барабан шахтної підйомної машини
Випадковий патент: Спосіб визначення ртуті












