Похідні фенілімідазолідинів, що мають антиандрогенну активність, спосіб їх одержання та фармацевтична композиція
Номер патенту: 45299
Опубліковано: 15.04.2002
Автори: ГУБЕ Франсуа, ГАЙАР-КЕЛЛІ МАРТІН, ФІЛІБЕР Даніель, ТОЙЧ Жан-Жорж
Формула / Реферат
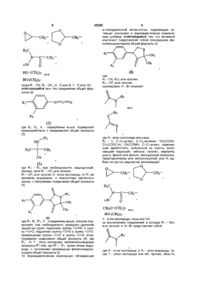
1. Производные фенилимидазолидина общей формулы (I)
где
R1 - CN, NO2 или галоген,
R2 – СF3 или галоген,
группировка -А—В- означает
или
где Х - атом кислорода или серы,
R3 - Н, С1-С9-алкил, C1-C5-алкенил, СН2СООН, СН2СООС2H5, CH2CONH2, С1-С3-алкил, содержащий заместитель, выбранный из группы, включающей гидроксил, метокси, галоген, меркапто, циано, фенил или фенил, замещенный галогеном, трифторметилом или метоксигруппой, или R3 выбран из группы радикалов, включающей
или
,
Y - атом кислорода, серы или NH,
за исключением соединений, в которых R1 – NO2 или галоген, и -А—В- представляет собой
где Х - атом кислорода, а R3 - атом водорода, тогда Y - атом кислорода или NH, причем, если R3 выбран из группы радикалов, включающей
или
,
тогда R1 - CN, R2 – СF3, Х - О или S, Y - О или NH,
обладающие антиандрогенной активностью.
2. Производные фенилимидазолидина по п. 1, отличающиеся тем, что Y - О, за исключением тех соединений, в которых R1 – NO2 или галоген, и -А—В- представляет собой
где X - атом кислорода, а R3 - атом водорода.
3. Производные фенилимидазолидина по любому из пп. 1 или 2, отличающиеся тем, что -А—В- представляет собой
где Х - атом серы.
4. Производные фенилимидазолидина по любому из пп. 1-3, отличающиеся тем, что R1 -CN или галоген.
5. Производные фенилимидазолидина по п. 4, отличающиеся тем, что R1 - Сl.
6. Производные фенилимидазолидина по любому из пп. 1 или 2, отличающиеся тем, что -А—В- означает
или
где R3 – С1-С4-алкил.
7. Производные фенилимидазолидина по любому из пп. 1-4, отличающиеся тем, что выбраны из группы, включающей
4-(5-оксо-2-тиоксо-3,4,4-триметил-1-имидазолидинил)-2-трифторметилбензонитрил, 4-(4,4-диметил-5-оксо-2-тиоксо-1-имидазолидинил)-2-трифторметилбензонитрил, 4-(4,4-диметил-3-(2-гидроксиэтил)-5-оксо-2-тиоксо-1-имидазолидинил)-2-трифторметилбензонитрил,
3-(3,4-дихлорфенил)-2-тиоксо-1,5,5-триметил-4-имидазолидинон.
8. Производное фенилимидазолидина по любому из пп. 1, 2 или 6, отличающееся тем, что представляет собой 1 -(4-нитро-3-трифторметилфенил)-3,4,4-триметил-2,5-имидазолидиндион.
9. Способ получения производных фенилимидазолидина общей формулы (I)
где
R1 - CN, NO2 или галоген,
R2 – СF3 или галоген,
группировка -А—В- означает
или
где X - атом кислорода или серы,
R3 - Н, С1-С9-алкил, C1-C5-алкенил, СН2СООН, СН2СООC2,H5, CH2CONH2, С1-С3-алкил, содержащий заместитель, выбранный из группы, включающей гидроксил, метокси, галоген, меркапто, циано, фенил или фенил, замещенный галогеном, трифторметилом или метоксигруппой, или R3 выбран из группы радикалов, включающей
или
,
Y - атом кислорода, серы или NH,
за исключением соединений, в которых R1 – NO2 или галоген, и -А—В- представляет собой
где Х - атом кислорода, а R3 - атом водорода, тогда Y - атом кислорода или NH, причем, если R3 выбран из группы радикалов, включающей
или
,
тогда R1 - CN, R2 - СF3, Х - О или S, Y - О или NH,
отличающийся тем, что соединение общей формулы (2)
где R1, R2, Х - определены выше, подвергают взаимодействию с соединением общей формулы (3)
где R'3 - R3, при необходимости, защищенный, причем, если R1 – NO2 или галоген,
R2 – СF3 или галоген, Х - атом кислорода, то R'3 не является водородом, в присутствии третичного амина, с получением соединения общей формулы (4)
где R1, R2, R'3, Х - определены выше, которое подвергают, при необходимости, реакциям удаления защитных групп, гидролиза группы >C=NH в группу >С=O, гидролиза группы >C=S в группу >С=O, превращение группы >С=O в группу >C=S, алкилирования соединения общей формулы (4), где R'3 - Н, Y - атом кислорода, галогенпроизводным формулы R"3-Hal, где R"3 - R'3, кроме атома водорода, с получением производных фенилимидазолидина общей формулы (I).
10. Фармацевтическая композиция, обладающая антиандрогенной активностью, содержащая активный компонент и фармацевтически приемлемые добавки, отличающаяся тем, что активный компонент представляет собой производное фенилимидазолидина общей формулы (I)
где
R1 - CN, NO2 или галоген,
R2 – СF3 или галоген,
группировка -А—В- означает
или
где Х - атом кислорода или серы,
R3 - Н, С1-С9-алкил, С1-С5-алкенил, CH2СООН, CH2СООC2H5, CH2СОNH2, С1-С3-алкил, содержащий заместитель, выбранный из группы, включающей гидроксил, метокси, галоген, меркапто, циано, фенил или фенил, замещенный галогеном, трифторметилом или метоксигруппой, или R3 выбран из группы радикалов, включающей
или
,
Y - атом кислорода, серы или NH,
за исключением соединений, в которых R1 – NO2 или галоген, и -А—В- представляет собой
где X - атом кислорода, а R3 - атом водорода, тогда Y - атом кислорода или NH, причем, если R3 выбран из группы радикалов, включающей
или
,
тогда R1 - CN, R2 - СF3, Х - О или S, Y - О или NH, в фармацевтически эффективном количестве.
Текст
1 Производные фенилимидазолидина общей формулы (І) Н3С f-\... І-Рг о еи5о-(сн2)2 или НО-(СН 2 ) 5 Y - атом кислорода, серы или NH, за исключением соединений, в которых F или галоген, и -А—В- представляет собой - NO2 О Y со где Ri - CN, NO2 или галоген, R2 - CF3 или галоген, группировка -А—В- означает где X - атом кислорода, а R3 - атом водорода, тогда Y - атом кислорода или NH, причем, если R3 выбран из группы радикалов, включающей сн2 СН'; "О Н3С \ или х-Рг -сО еи5о-(сн2)где X - атом кислорода или серы, R3 - Н, d-Сэ-алкил, С г С 5 -алкенил, СН2СООН, СН2СООС2Н5, CH2CONH2, СгСз-алкил, содержащий заместитель, выбранный из группы, включающей гидроксил, метокси, галоген, меркапто, циано, фенил или фенил, замещенный галогеном, трифторметилом или метоксигруппой, или R3 вы или НО-(СН 2 ) 5 тогда Ri - CN, R2 - CF3, X - О или S, Y - О или NH, обладающие антиандрогеннои активностью 2 Производные фенилимидазолидина по п 1, отличающиеся тем, что Y - О, за исключением тех соединений, в которых Ri - NO2 или галоген, и -А—В- представляет собой ю 45299 СНз Y где X - атом кислорода, a R3 - атом водорода 3 Производные фенилимидазолидина по любому из пп 1 или 2, отличающиеся тем, что -А—Впредставляет собой где X - атом серы 4 Производные фенилимидазолидина по любому из пп 1-3, отличающиеся тем, что R1 -CN или галоген 5 Производные фенилимидазолидина по п 4, отличающиеся тем, что Ri - СІ 6 Производные фенилимидазолидина по любому из пп 1 или 2, отличающиеся тем, что -А—Возначает или а) где Ri - CN, NO2 или галоген, R2 - CF3 или галоген, группировка -А—В- означает или где X - атом кислорода или серы, R3 - Н, d-Сэ-алкил, С г С 5 -алкенил, СН2СООН, СН2СООС2,Н5, CH2CONH2, СгСз-алкил, содержащий заместитель, выбранный из группы, включающей гидроксил, метокси, галоген, меркапто, циано, фенил или фенил, замещенный галогеном, трифторметилом или метоксигруппой, или R3 выбран из группы радикалов, включающей сн2где R3 - СгС4-алкил 7 Производные фенилимидазолидина по любому из пп 1-4, отличающиеся тем, что выбраны из группы, включающей 4-(5-оксо-2-тиоксо-3,4,4-триметил-1имидазолидинил)-2-трифторметилбензонитрил, 4(4,4-диметил-5-оксо-2-тиоксо-1-имидазолидинил)2-трифторметилбензонитрил, 4-(4,4-диметил-3-(2гидроксиэтил)-5-оксо-2-тиоксо-1имидазолидинил)-2-трифторметилбензонитрил, 3-(3,4-дихлорфенил)-2-тиоксо-1,5,5-триметил-4имидазолидинон 8 Производное фенилимидазолидина по любому из пп 1,2 или 6, отличающееся тем, что представляет собой 1 -(4-нитро-Зтрифторметилфенил)-3,4,4-триметил-2,5имидазолидиндион 9 Способ получения производных фенилимидазолидина общей формулы (I) н 3 с\ i-Rr s /-* о но-(сн 2 ) 5 или HO-(CH 2 ) 5 Y - атом кислорода, серы или NH, за исключением соединений, в которых Ri - NO2 или галоген, и -А—В- представляет собой где X - атом кислорода, a R3 - атом водорода, тогда Y - атом кислорода или NH, причем, если R3 выбран из группы радикалов, включающей -О. О )—сн2 СНч Н3С \ Г 45299 антиандрогеннои активностью, содержащая активный компонент и фармацевтически приемлемые добавки, отличающаяся тем, что активный компонент представляет собой производное фенилимидазолидина общей формулы (I) с—сн2 i-Pr о Y (D или НОЧСН 2 ) 5 тогда Ri - CN, R2 - CF3, X - О или S, Y - О или NH, отличающийся тем, что соединение общей формулы (2) где Ri - CN, NO2 или галоген, R2 - CF3 или галоген, группировка -А—В- означает или (2) где R-і, R2, X - определены выше, подвергают взаимодействию с соединением общей формулы (3) HN Н3С— "СНз СН (3) где R'a - R3, при необходимости, защищенный, причем, если Ri - NO2 или галоген, R2 - CF3 или галоген, X - атом кислорода, то R's не является водородом, в присутствии третичного амина, с получением соединения общей формулы (4) СНз Y (4) где R-і, R2, R^, X - определены выше, которое подвергают, при необходимости, реакциям удаления защитных групп, гидролиза группы >C=NH в группу >С=О, гидролиза группы >C=S в группу >С=О, превращение группы >С=О в группу >C=S, алкилирования соединения общей формулы (4), где R^ - Н, Y - атом кислорода, галогенпроизводным формулы R''3-Hal, где R''3 - R'3, кроме атома водорода, с получением производных фенилимидазолидина общей формулы (I) 10 Фармацевтическая композиция, обладающая где X - атом кислорода или серы, R3 - Н, d-Сэ-алкил, С г С 5 -алкенил, СН2СООН, СН2СООС2Н5, CH2CONH2, СгС 3 -алкил, содержащий заместитель, выбранный из группы, включающей гидроксил, метокси, галоген, меркапто, циано, фенил или фенил, замещенный галогеном, трифторметилом или метоксигруппой, или R3 выбран из группы радикалов, включающей 2 [/ Н3С \ N—С i-Pr сн2 СН2 О сн 3 о-(сн 2 ) 2 - или НО-(СН 2 ) 5 Y - атом кислорода, серы или NH, за исключением соединений, в которых или галоген, и -А—В- представляет собой - NO2 где X - атом кислорода, a R3 - атом водорода, тогда Y - атом кислорода или NH, причем, если R3 45299 выбран из группы радикалов, включающей \ сн2Н3С \ i-Pr сн 3 о-(сн 2 )2 или НО-(СН 2 ) 5 тогда Ri - CN, R2 - CF3, X - О или S, Y - О или NH, в фармацевтически эффективном количестве с—сн 2 о Изобретение относится к новым фенилимидазолидинам, проявляющим антиандрогенную активность, к способу их получения и к фармацевтическим композициям на их основе В патенте Франции 2329276 описаны имидазолидины, обладающие антиандрогенной активностью Заявитель разработал новые производные фенилимидазолидинов, активность которых значительно превышает активность аналогичных соединений Изобретение, в частности, касается фенилимидазолидинов общей формулы (1) •СН, V — сн,V—с—сн,/ " _/ II сн,-о-(оа,- или нечен,). Y - атом кислорода, серы или NH, за исключением соединений, в которых Ri - NO2 или галоген, и -А-В- представляет собой X N' где X - атом кислорода, R3 - атом водорода и Y - атом кислорода или NH, причем если R3 выбран из группы радикалов, включающей Cri, t-Pr 6 с н 3 O-tCHj),-или т о Ri = CN, R2 ™ C F 3 , К = О или S, Y = О или МН. (1) где Ri - CN, NO2 или галоген, R2 - CF3 или галоген, группировка -А-В- означает или где X - атом кислорода или серы, R3 - Н, d-Сэ-алкил, С г С 5 -алкенил, СН2СООН, СН2СООС2Н5, CH2CONH2, СгСз-алкил, содержащий заместитель, выбранный из группы, включающей гидроксил, метокси, галоген, меркапто, циано, фенил или фенил, замещенный галогеном, трифторметилом или метоксигруппой, или R3 выбран из группы радикалов, включающей Изобретение относится, в частности, к соединениям формулы (1), в которой Y означает атом кислорода, за исключением соединений, в которых группа -А-В- означает радикал в котором X - атом кислорода, R3 - атом водорода, R2 - атом галогена или трифторметил, a Ri нитрогруппа или атом галогена Среди названных соединений более конкретно изобретение относится к соединениям, в которых группа -А-В- представляет собой радикал в котором X обозначает атом серы, a R3 имеет указанное выше значение Среди этих соединений еще более конкретно 9 45299 изобретение относится к соединениям, в которых Ri обозначает радикал циано или атом галогена, в частности, хлор Изобретение относится также к соединениям формулы (1), в которой группа -А-В- обозначает радикал 10 (4) или в которых R3 обозначает радикал алкил или алкенил, содержащий не более 4 атомов углерода Среди соединений, которым отдается предпочтение в изобретении, можно назвать более конкретно следующие соединения 4-(5-оксо-2-тиоксо-3,4,4-триметил-1имидазолидинил)-2-(три-фторметил)-бензонитрил, 4-(4,4-диметил-5-оксо-2-тиоксо-1имидазолидинил)-2-(трифтор-метил)-бензонитрил, 4-[4,4-диметил-3-(2-гидроксиэтил)-5-оксо-2тиоксо-1-имидазолидинил]-2-(трифторметил)бензонитрил, 3-(3,4-дихлорфенил)-2-тиоксо-1,5,5-триметил4-имидазолидинон, 1-(4-нитро-3-{трифторметил)-фенил)-3,4,4триметил-2,5-имидазолидиндион, 4-[[4,5-дигидро-4,4-диметил-5-оксо-2(фенилметил)-тио]-1Н-имидазол-1-ил]-2(трифторметил)-бензонитрил Изобретение относится также к способу получения фенил-имидазолидинов общей формулы (1), описанной выше, заключающемуся в том, что в присутствии третичного амина соединение общей формулы (2) (2) где R-і, R2 и X имеют указанное выше значение, подвергают взаимодействию с соединением общей формулы (3) Н 3 С—С—СН 3 СН (3) где R'3 имеет значения R3, при необходимости защищенный, причем если Ri обозначает NO2 или галоген, R2 обозначает трифторметил или галоген, X обозначает атом кислорода, то R'3 не является водородом, с получением соединения общей формулы (4) где Ri, R2, R'3 и X имеют определенное выше значение, которое подвергают, при необходимости, реакциям удаления защитных групп, гидролиза группы >C=NH в группу >С=О, гидролиза группы >C=S в группу >С=О, превращения группы >С=О в группу >C=S, алкилирования соединения общей формулы (4), где R'3 обозначает атом водорода, Y - атом кислорода, галогенпроизводным формулы R'VHal, где R''3 имеет значения R'3, кроме атома водорода, с получением производных фенилимидазолидина общей формулы (1) Взаимодействие соединения формулы (2} с соединением формулы (3) производится, предпочтительно, в органическом растворителе, таком как тетрагидрофуран или дихлорэтан, однако, можно также использовать этиловый эфир или изопропиловый эфир Работают в присутствии третичного амина, такого кактриэтиламин или пиридин или метилэтилпиридин Реактивными функциями, которые может содержать R3 и которые иногда могут быть защищены в соединении формулы (3) или (4), являются гидрокси- или аминофункциями Для защиты таких функций используют обычные защитные группировки Можно, например, назвать следующие защитные группировки аминогруппы трет-бутил, три хлорацетил, хлорацетил, бензгидрил, тритил, формил, бензилоксикарбонил В качестве защитной группировки гидроксигруппы можно назвать такие радикалы, как формил, хлорацетил, тетрагидро-пиранил, триметил, трет-бутил диметилсилил Разумеется возможно использование других известных в химии пептидов защитных группировок Удаление защитных группировок можно проводить, как указано в патенте BF № 2499995 Предпочтение отдается способу удаления путем кислого гидролиза при помощи кислот, выбранных среди хлористоводородной, бе н зол сул ьфо но вой или парато-луолсульфоновой, муравьиной или трифторуксусной кислот Предпочтение отдается хлористоводородной кислоте Возможная реакция гидролиза группы >C=NH в кетоновую группу, также проводится, предпочтительно, при помощи кислоты, такой как водный раствор хлористоводородной кислоты, например, в режиме дефлегмации В случае, если гидролиз группы >C=NH в кетоновую группу производится на молекуле, содержащей также группу >C=S, то такая группа может превратиться в группу >С=О Свободная группа ОН, которую может содержать R3, может, в таком случае, превратиться в группу SH 11 45299 12 Реакция превращения одной или более групп честве активного начала используется >С=О в группу >C=S осуществляется с помощью соединение общей формулы (1) в эффективном реактива Лавессона, который является торговым количестве продуктом и использование которого описано, Более конкретно, в качестве активного начала например, в публикации Bull Soc Chim Belg vol предпочитают использовать следующие соедине87, пЗ, (1987) p 229 ния Если хотят превратить две функции >С=О в 4-(5-оксо-2-тиоксо-3,4, 4-триметил-1две функции >C=S, то процесс производят в приимидазолидинил)-2(три-фторметил)сутствии избытка реагента Лавессона То же пробензонитрил, исходит в случае, если исходное соединение со4-(4,4-диметил-5-оксо-2-тиоксо-1держит функцию >C=S и функцию >С=О, т к имидазолидинил)-2-(трифтор-метил)-бензонитрил, происходит превращение данной функции >С=О в 4-[4,4-диметил-3-(2-гидроксиэтил)-5-оксо-2функцию >C=S тиоксо-1-имидазо-лидинил]-2-(трифторметил)бензонитрил, Зато, если исходное соединение содержит две функции >С=О, то для получения соединения, 3-(3,4-дихлорфенил)-2-тиоксо-1,5,5-триметилсодержащего только одну функцию >C=S, процесс 4-имидазолидинон, ведут при недостатке реактива Лавессона Полу1-(4-нитро-3-(трифторметил)-фенил)-3,4,4чают, как правило, смесь трех соединений, среди триметил-2,5-имидазолидиндион, которых два включают функцию >С=О и функцию 4-[[4,5-дигидро-4,4-диметил-5-оксо-2>C=S, а третье - две функции >C=S Данные со(фенилметил)-тио]-1Н-имидазол-1-ил]-2единения можно разделить обычными методами, (трифторметил)-бензонитрил например, при помощи хроматографии Такие композиции могут вводиться парентеральным, оральным, подъязычным, ректальным Взаимодействие соединений формулы (4) с или топическим путем реактивом формулы Hal-R'3 производится в присутствии такого сильного основания, как гидрид Данные композиции могут быть представлены натрия или калия Процесс можно производить в виде растворов или впрыскиваемых суспензий, путем реакции фазового перехода в присутствии таблеток, пилюль, капсул, сиропов, свечей, мазей, четвертичных аммониевых солей, например, помад и жидких смесей для наружного применетрет бутиламмония Защитные группировки, котония Такие лекарственные формы получают обычрые может содержать заместитель R''3 могут быть, ными способами Активную основу можно соединапример, одной из вышеуказанных защитных нять обычно со связующим веществом, таким как групп для R3 Реакции удаления защитных группитальк, гуммиарабик, лактоза, крахмал, стеарат ровок производятся в указанных условиях магния, масло-какао, водные или не водные носители, жиры животного или растительного происПример удаления хождения, парафиновые производные, диолы, трет бутилдиметилсилильной группы с помощью различные увлажняющие вещества, диспергаторы хлористоводородной кислоты описан в примерах или эмульгаторы, консерванты Соединения согласно изобретению обладают ценными фармакологическими свойствами, было Обычно применяемая доза изменяется в заотмечено, в частности, что данные соединения висимости от пациента Она, например, может ингибируют воздействие андрогенных веществ на составлять от 10мг до 500мг в день оральным пупериферийные рецепторы тем Представленные в экспериментальной части Следующие примеры иллюстрируют изобреопыты иллюстрируют такую антиандрогенную актение, но не ограничивают его тивность Пример 1 Антиандрогенная активность соединений со1-(4-нитро-3-(трифторметил)-фенил) -3,4, 4гласно изобретению позволяет их использовать в триметил-2, 5-имидазолидиндион качестве средства для лечения аденом и неоплаК суспензии, содержащей 492мг 50%-ного гидзий предстательной железы, а также для борьбы с рида натрия в жидком масле и Зсм3 диметилфордоброкачественной гипертрофией простаты мамида добавляют при 23 - 26°С раствор, содержащий 3,17г 1-(3'-трифторметил-4-нитрофенил)Данные свойства делают соединения общей 4,4-диметилимидазолин-2,5-диона и 32см димеформулы (1) также приемлемыми для лечения тилформамида, смесь перемешивают в течение доброкачественных и злокачественных опухолей, 15 минут и добавляют раствор 0,7см3 раствора клетки которых содержат, в том числе, андрогенметилиодида в 2см 3 диметилформамида В теченые рецепторы Можно, особенно, назвать раконие 25 минут перемешивают при 24 - 28°С, затем вые заболевания груди, мозга, кожи и яичников, а сливают в 200г смеси (1-1) воды со льдом Смесь также рак мочевого пузыря, лимфатической сисэкстрагируют эфиром, промывают насыщенной темы, почек, печени хлоридом натрия водой, сушат, фильтруют, высуСоединения общей формулы (1) изобретения шивают досуха при пониженном давлении и полумогут найти также применение в лечении гирсучают 3,6г целевого продукта, т пл 116°С тизма, акне, себореи, андрогенного облысения, гипертризоза Была получена аналитическая проба путем перекристаллизации в изопропиловом спирте с Они также могут использоваться в ветеринапоследующим выделением 2,73г целевого прории дукта, т пл - 116°С Настоящее изобретение касается фармацевтической композиции, содержащей активное начаЭлементный анализ C13H12F3N3O4 = 331,25 ло и фармацевтические добавки, в которой в каРассчитано С% 47,14, Н% 3,65, F% 17,20, N% 45299 14 13 12,68, Аромат соед (1615, 1596, 1497см 1) Найдено 47,0,3,5, 17,1, 12,5, Пример 5 5,5-Диметил-3-(4-нитро-3-трифторметил)ИК спектр (СНСІз) фенил)-1-(2-пропенил)-2,4-имидазолидиндион С=О(1780, 1727см1) Аромат соед (1615, 1596, 1497см 1) Работают, как в примере 1, но исходят из 1г 1(3'-трифторметил-4-нитрофенил)-4,4-диметилNO2(1545, 1357 см 1 ) имидазолин-2,5-диона, используя 166мг 50%-ного Пример 2 гидрида натрия в жидком масле и 0,35см3 аллил5,5-Диметил-1-этил-3-(4-нитро-3бромида После хроматографии на кремнеземе (трифторметил)-фенил)-2,4-имидазолидиндион (элюент метиленхлорид-ацетон 99 - 1) получают Работают, как в примере 1, но исходят из 1г 11,19г продукта, который перекристаллизовывают в (3'-три-фторметил-4'-нитрофенил)-4, 4-диметилизопропаноле и выделяют 1,01 г целевого проимидазолин-2, 5-диона с использованием 0,33см3 дукта, т пл - 105°С этилиодида и 166мг 50%-ного гидрида натрия в жидком масле Получают 1,19 г целевого продукЭлементный анализ C15H14F3N3C4 = 357,29 та, т пл = 1 1 0 - 1 1 1 °С Вышеуказанный продукт Рассчитано С% 50,42, Н% 3,95, F% 15,95, N% перекристаллизовывают в изопропаноле Полу11,76, чают 934мг целевого продукта, т пл = 110 Найдено 50,4,3,8, 15,8, 11,7, 11ГС ИК спектр (СНСІз) Элементный анализ C14H14F3N3O4 = 345,28 С=О(1779, 1724см1) Рассчитано С% 48,70, Н% 4,09, F% 16,51, N% NO2(1545, 1358см1) 12,17, Аромат соед (1615, 1596, 1497см 1) Найдено 48,6,4,0, 16,8, 12,1 СН=СН2(1643, 930см 1 ) Пример 6 ИК спектр (СНСІз) 5,5-Диметил-3-(4-нитро-3-трифторметил)С=О (1777см 1 , 1724см 1 (F)) фенил)-1-метил-фенил-2,4-имидазолидиндион NO2(1545, 1356см1) Аромат соед {1614, 1596, 1497см 1) Работают, как в примере 1, но исходят из 2г 1(3'-трифторметил-4-нитрофенил)-4,4-диметилПример 3 имидазолин-2,5-диона, используя 332мг 50%-ного 5,5-Диметил-3-(4-нитро-3-(трифторметил)гидрида натрия в жидком масле и 0,71см3 бензилфенил-1-пропил-2,4-имидазолидин-дион бромида После хроматографии на кремнеземе Работают, как в примере 1, но исходят из 1г 1(элюент метиленхлорид-ацетон 99 - 1) получают (3'-трифторметил-4-нитрофенил)-4,4-диметил2,375г целевого продукта, который перекристалимидазолин-2,5-диона, используя 155мг 50%-ного лизовывают в изопропаноле и выделяют 2,165г гидрида натрия в жидком масле и 0,35см3 1целевого продукта, т пл - 99°С иодпропана После хроматографии на кремнеземе (элюент ацетон-метиленхлорид 1-99) получают Элементный анализ C19H16F3N3C4 = 407,3 1,087г сырого продукта, т пл = 102°С После пеРассчитано С% 56,02, Н% 3,96, F% 10,31, N% рекристаллизации в изопропаноле выделяют 14,00, 945мг целевого продукта, т пл = 102°С Найдено 56,1,3,8, 10,2, 13,9, Элементный анализ C15H16F3N3C4 = 359,31 ИК спектр Рассчитано С% 50,14, Н% 4,49, F% 15,86, N% С=О (1799см 1 (т), 1723см 1 (F)) 11,69, Аромат соед (1608см1) Найдено 50,1,4,4, 15,9, 11,5, + (1594см 1 (т)) NO2 (1545см 1 (F)) (1497см1) ИК спектр (СНСІз) 1 Пример 7 С=О(1778, 1724см ) NO 2 (1544, 1358см1) 4-(4,4-диметил-5-имино-2-оксо-1имидозолидинил)-2-(трифторметил)-бензонитрил Аромат соед (1615, 1596, 1497см 1) Пример 4 В раствор 2,63г 2-амино-2-цианопропана и 5,5-Диметил-1 -(1 -метил-этил)-3-(4-нитро-336см3 1,2-дихлорэтана в 0,9см тризтиламина (трифторметил)-фенил)-2, 4-имидазолидинион вводят при 5°С раствор 6,6г 4-изоцианата 2(трифторметил)-бензонитрила, полученного как Работают, как в примере 1, но исходят из 1г 1указано ниже в "Приготовлении" в 10см3 дихлорэ(3'-трифторметил-4-нитрофенил)-4,4-диметилтана В течение 16 часов перемешивают при комимидазолин-2,5-диона, используя 166мг 50%-ного натной температуре Выпаривают досуха и хромагидрида натрия в жидком масле и 0,4см3 2тографируют остаток на кремнеземе (элюент иодпропана в течение 18 часов при 50°С После метиленхлорид-ацетон 85 - 15), получают 3,54г хроматографии на кремнеземе (злюент метиленцелевого продукта, т пл - 228°С хлорид-ацетон 99 - 1} получают 685мг целевого продукта, т пл = 130°С Полученный выше проБыла получена аналитическая проба путем дукт перекристаллизовывают в изопропаноле и перекристаллизации 300мг вышеуказанного провыделяют 661мг целевого продукта, т пл = 130°С дукта в изопропаноле с выделением 267мг целевого продукта, т пл - 228°С Элементный анализ C15H16F3N3C4 = 359,31 Рассчитано С% 50,14, Н% 4,49, F% 15,86, N% Элементный анализ C13H11F3N4O = 296,25 11,69, Рассчитано С% 52,71, Н% 3,74, F% 19,24, N% 18,91, Найдено 50,1,4,4, 16,2, 11,6, Найдено 52,7,3,6, 19,1, 18,6, ИК спектр (СНСІз) С=О(1779, 1771, 1723см1) ИК спектр (Вазелиновое масло) NO 2 (1544, 1361см1) NH/OH (3340, 3290см 1) 15 45299 16 цию в количестве 105мг гидрида натрия и, 15 миC = N 2240см 1 нут спустя, вводят 145мг бромуксусной кислоты В C=O1760см 1 течение 30 минут перемешивают, затем сливают в 1 C=N 1655см раствор, состоящий из 50см3 воды и 5см3 2 н расАромат соед (1606, 1570, 1502см 1) твора хлористоводородной кислоты Экстрагируют Приготовление 4-изоцианат 2эфиром, промывают насыщенным раствором хло(трифторметил)-бензонитрила ристого натрия, высушивают, фильтруют и выпа3 К 33,6см раствора фосгена в толуоле с конривают досуха, получают 1,22г сырого продукта, центрацией 1,93моль/л, охлажденного до 0 - 5°С, который хроматографируют на кремнеземе (элюдобавляют в течение 20 минут Юг 4-циано-Зент метиленхлорид-метанол-уксусная кислота 90 3 (трифторметил)-анилина, растворенного в 30см -10 - 0,5) Получают 367мг целевого продукта этилацетата В течение 30 минут перемешивают при 0 - 5°С, затем доводят до 25°С Затем нагреИК спектр C - N 2238см 1 вают смесь до температуры дистилляции, возмеС=О гидантоина и кислоты (1784, 1725, щая отогнанный объем толуолом, пока темпера1710см1) тура дистилляции не достигнет 110°С Затем Аромат соед (1616, 1580, 1508см 1) нагревают с обратным холодильником и проводят УФ-спектр кипячение до прекращения выделения хлористоэтанол, 0,1 н раствор HCI водородной кислоты (т е в течение 4 час 30 мимакс 258нм s = 13300 нут) Затем доводят смесь до комнатной темпераneper 277нм s= 5000 туры, обезвоживают нерастворенный продукт neper 285нм s= 2600 белого цвета в атмосфере азота над сульфатом этанол, 0,1 нм раствор NaOH натрия, промывают его 3 раза 10см толуола и макс 287 нм s = 19100 выпаривают досуха при пониженном давлении макс 342нм s = 1900 Затем нагревают продукт до 60°С в течение часа, Пример 10 создают атмосферу аргона и выделяют 11,6г це3-(4-циано-3-(трифторметил)-фенил)-5,5левого продукта диметил-2,4-ди-оксо-1-имидазолидинэтилацетат ИК спектр К суспензии, состоящей из 100мг 50%-ного -N=C=O 2268см 1 гидрида натрия в жидком масле и Зсм3 диметил1 -CN 2233см формамида, добавляют 600мг продукта, полученПример 8 ного в примере 8, растворенного в 6см3 диметил4-(4,4-диметил-2,5-диоксо-1-имидазолидинил)формамида Перемешивают в течение 15 минут, 2-(трифтор-метил)-бензонитрил затем медленно, не превышая 30°С, добавляют В течение 35 минут нагревают в режиме де0,25см3 этил б ром ацетата В течение 30 минут пефлегмации суспензию из 2,76г продукта, полученремешивают, сливают на 5г смеси воды со льдом ного в примере 7, в 60см3 50%-ного раствора хло(1-1), добавляют 0,5г монокалийфосфата и экстраристоводородной кислоты Реакционную массу гируют эфиром Органическую фазу промывают выливают в ЮОг смеси воды со льдом и экстрагиводой, высушивают и выпаривают досуха с полуруют этилацетатом Затем промывают водой, сучением 1,1 г сырого продукта, который хроматошат, выпаривают досуха и получают 2,70г целеграфируют на кремнеземе (элюент метиленхлового продукта, т пл =210°С рид-ацетон 97 - 3) Получают 709мг целевого продукта, т пл -152°С Была получена аналитическая проба путем перекристаллизации 440мг вышеуказанного проБыла получена аналитическая проба путем дукта в изопропаноле с выделением 383мг целеперекристаллизации вышеуказанного продукта в вого продукта, т пл =210-211 °С изопропаноле с выделением 667мг целевого проЭлементный анализ C13H10F3N3O2 = 297,24 дукта, т пл - 152°С Рассчитано С% 52,53, Н% 3,39, F% 19,17, N% Элементный анализ C17H14F3N3O4 = 383,33 14,14, Рассчитано С% 53,21, Н% 4,21, F% 14,83, N% Найдено 52,4,3,2, 19,4, 13,9, 10,96, ИК спектр (СНСІз) Найдено 53,3,4,0, 14,9, 10,8, C N 1 ИК спектр (СНСІз) = 2245см С= N о о о с 1 С=О(1788, 1722см1) 2225см Аромат соед (1610, 1572, 1502см 1) Имидазолидин (1786, 1729см 1) NH (макс) 3340см 1 CO2Et 1751см 1 Пример 9 Аромат соед (1616, 1572, 1505см 1) 3-(4-циано-3-(трифторметил)-фенил)-5,5Пример 11 диметил-2,4-ди-оксо-1-имидазолидинуксусная ки4-(5-имино-2-тиоксо-3,4, 4-триметил-1слота имидазолидинил)-2-(трифторметил)-бензонитрил К суспензии, состоящей из 210мг гидрида наа) Приготовление изотиоцианата трия (50% в жидком масле) и Зсм3 диметилфорК раствору, состоящему из 22см3 дистиллиромамида, добавляют раствор 600мг продукта, пованной воды и 1см3 тиофосгена, медленно добавлученного в примере 8, в 6см 3 ляют 2,23г 1-трифторметил-4-аминобензонитрила, диметилформамида, перемешивают в течение 15 перемешивают в течение часа, затем экстрагируминут, затем добавляют 290мг бромуксусной киют трихлорметаном, промывают соленой водой, слоты и перемешивают в течение 16 часов при высушивают и выпаривают досуха при пониженкомнатной температуре Добавляют новую пор 45299 18 17 ном давлении с получением Зг продуїсга, испольИК спектр (СНСІз) зуемого в том же виде для получения имина С= N б) Получение имина Аромат соед + конъюгиров сист (1612, 1582, В течение 40 минут перемешивают в режиме 1508см1) дефлегмации Зг полученного выше продуїсга с CF 3 1178см 1 1,33см3 2-метиламино-2-цианопропана, 23см3 тетПример 14 рагидрофурана и 0,23 см 3 триэтиламина Остаток 4-(4,4-диметил-5-имино-2-тиоксо-1(3,07г) выпаривают досуха и хроматографируют имидазолидинил)-2-(трифторметил)-бензонитрил на кремнеземе (элюент циклогексан-этилацетат 1 К смеси 2,54г продукта полученного в приме- 1 , затем метиленхлорид-ацетон 95 - 5), получают ре 11 стадия а), с 20см тетрагидрофурана и 2,83г желаемого продукта, который перекристал0,2см3 триэтиламина добавляют 1г 2-амино-2лизовывают в изопропаноле с получением 2,63г цианопропана и 1см3 тетрагидрофурана с послецелевого продукта, т пл =173-174°С дующим перемешиванием смеси при комнатной Элементный анализ C14H13F3N4S = 326,35 температуре Затем выпаривают досуха и остаток Рассчитано С% 51,53, Н% 4,01, F% 17,17, N% (3,5г) хроматографируют на кремнеземе (элюент 17,46, S%9,82, этилацетат-циклогексан 7 - 3, затем циклогексанНайдено 51,7, 3,9, 17,2, 17,2, 9,9, этилацетат 1 - 1) и получают 940мг целевого проИК спектр дукта, из которых 300мг перекристаллизовывают в 1 C=NH (3308, 16979см ) изопропаноле с выделением 263мг продукта, т C=S + аромат соед (1608, 1575, 1505, пл =296°С 1 1488см ) Элементный анализ C13H11F3N4S = 312,32 С= N Рассчитано С% 50,00, Н% 3,55, F% 18,25, N% 17,94, S% 10,27, CF3 = 1185см 1 Пример 12 Найдено 49,9, 3,4, 18,3, 17,6, 10,4, 4-(5-оксо-2-тиоксо-3,4,4-триметил-1ИК спектр (Вазелиновое масло) имидазолидинил)-2-(трифторметил)-бензонитрил OH/NH 3260см 1 В течение 1 часа перемешивают в режиме С= N дефлегмации 2,21 г продукта, полученного в при3 C=S 1764см 1 мере 11, и 44см 50%-ного раствора соляной киАромат соед + С=С (1612, 1575, 1530, слоты Реакционную среду сливают в 200г смеси 1501см1) воды со льдом (1 - 1), экстрагируют метиленхлоНовая порция продукта была получена при ридом, промывают водой, насыщенной хлористым замене тетрагидрофурана на 1,2-дихлорэтан натрием, высушивают и выпаривают досуха с поЦелевой нерастворимый продукт выпадает в следующей хроматографией остатка на кремнеосадок Таким образом, получают целевой проземе (злюент циклогексан-этилацетат 1 - 1), полудукт с выходом 60% чают 2,1 г продукта, т пл = 171 °С, который Пример 15 перекристаллизовывают в изопропаноле и полу4-(4,4-диметил-5-оксо-2-тиоксо-1чают 1,99г целевого продукта, т пл =171 °С имидазолидинил)-2-(трифторметил)-бензонитрил Элементный анализ C14H12F3N3OS = 327,33 В течение 1 часа перемешивают в режиме Рассчитано С% 51,37, Н% 3,69, F% 12,84, N% дефлегмации 635мг продукта, полученного в при17,41, S%9,79 мере 14, и 14см3 разбавленной наполовину хлоНайдено 51,4, 3,5, 12,7, 17,6, 10,79, ристоводородной кислоты Затем охлаждают, доИК спектр (СНСІз) бавляют 100см3 воды и экстрагируют СО (1761, 1756см1) зтилацетатом, промывают соленой водой, сушат и 1 Аромат соед (1610, 1578, 1505см ) выпаривают досуха с получением 600мг продукта, С= N который хроматографируют на кремнеземе (элюент метиленхлорид-ацетон 95 - 5) и получают CF 3 1178см 1 590мг желаемого продукта, т пл = 190 - 191 °С, Пример 13 который перекристаллизовывают с получением 4-(2,5-дитиоксо-3, 4,4-триметил-1490мг целевого продукта, т пл =190-191 °С имидазолидинил)-2-(трифторметил)-бензонитрил В течение 24 часов перемешивают в режиме Элементный анализ C13H10F3N3OS = 313,30 дефлегмации 839мг продукта, полученного в приРассчитано С% 49,84, Н% 3,22, F% 18,19, N% мере 12, с 518мг реактива Лавессона и 4,7см то13,41, S% 10,23, луола Выпаривают досуха при пониженном давНайдено 49,6, 3,1, 18,4, 13,2, 10,0, лении с получением 1,36 г продукта, который ИК спектр (СНСІз) хромато-графируют на кремнеземе (элюент ме=C-NH 3430см 1 ти л енхл ори д-эти л ацетат 9 9 - 1 , затем циклогекС= N сан-этилацетат 85-15) Получают 783мг продукта, С=О1766см 1 который перекристаллизовывают в изопропаноле Конъюгиров сист + Аромат соед (1612, 1578, с получением 690мг целевого продукта, т пл 1505см1) 211 -212°С Пример 16 Элементный анализ C14H12F3N3S2" 343,40 5,5-Диметил-3-(4-нитро-3-(трифторметил)Рассчитано С% 48,97, Н% 3,52, F% 16,60, N% фенил)-1-пентил-2,4-имидазолидиндион 12,24, S% 18,67, Работают, как в примере 1, но исходят из 1г 1Найдено 49,0, 3,4, 16,6, 12,2, 18,6, 45299 20 19 (3'-трифторметил-4-нитрофенил)-4,4-диметилС=О 1760см 1 имидазолин-2,5-диона, используя 170мг гидрида " C = N 2235см 1 натрия и 47см3 1-бромопентана, после хроматоАромат соед (1615, 1580, 1508см 1) графии на кремнеземе (элюент метиленхлоридУФ-спектр (в этаноле) макс циклогексан 8 - 2) получают 1,23г целевого про2 2 8 H M S = 19400 дукта, который перекристаллизовывают в изопро2 5 6 H M S = 12100 паноле с получением 995мг продукта, т пл = 298нм s = 8600 84°С 390нм s = 70 Элементный анализ C17H20O4F3N3 = 387,35 Пример 20 Рассчитано С% 52,71, Н% 5,20, F% 14,71, N% 4-(4,5-дигидро-4,4-диметил-2-(метилтио)-510,85, оксо-1Н-имидазол-1-ил)-2-(трифторметил)Найдено 52,8,5,1, 14,8, 10,7, бензонитрил ИК спектр (СНСІз) 1 К суспензии, состоящей из 108мг 50%-ного С=О(1778, 1723см ) 1 гидрида натрия в жидком масле и 1,8см3 димеNO 2 (1544, 1360см ) тилформамида, добавляют раствор 626мг продукПример 17 та, описанного в примере 15, в 6см 3 диметилфор5,5-Диметил-3-(4-нитро-3-трифторметил)мамида Затем промывают с помощью 0,3см3 фенил)-1-нонил-2,4-имидазолидиндион диметил-формамида и перемешивают в течение Работают, как в примере 1, но исходят из 1г 110 минут после прекращения выделения водоро(3'-трифторметил-4-нитрофенил)-4,4-диметилда Затем добавляют по капле 0,19см3 метилиоимидазолин-2,5-диона, используя 170мг 50%-ного д и д а в і с м диметилформамида гидрида натрия в масле и 0,7см3 1-бромнонана После реакции в течение 45 минут полученПосле хроматографии на кремнеземе получают ный продукт сливают в 50г смеси воды со льдом, 1,08г целевого продукта, т пл = 63°С содержащей 0,5г первичного фосфата калия и Элементный анализ C21H28O4F3N3 = 443,46 экстрагируют 4 раза эфиром Органическую фазу Рассчитано С% 56,87, Н% 6,36, F% 12,85, N% промывают в соленой воде, высушивают над 9,48, сульфатом магния и выпаривают досуха ПолуНайдено 57,0, 6,5, 12,8, 9,5, ченные 668мг продукта очищают путем хроматоИК спектр (СНСІз) графии на кремнеземе (элюент CH2CI2С=О(1788, 1723см1) этилацетат 95 - 5) 1 NO 2 (1544, 1359см ) Получают 640 мг продукта, который снова Пример 18 хроматографируют на кремнеземе (элюент цикло4-(3,4,4-триметил-2,5-диоксо-1гексан-эти л-ацетат 7 - 3) и получают, после извлеимидазолидинил)-2-(трифторметил)-бензонитрил чения эфиром, 507мг целевого продукта, т пл = Работают, как в Примере 1, но исходят из 62°С 300мг продукта, описанного в примере 8, и полуИК спектр чают 275мг целевого продукта, т пл =158 С С=О 1747см 1 ИК спектр (СНСІз) С=О (1780, 1727см 1) C=N и аромат соед (1614, 1581, 1569, Аромат соед (1615, 1574, 1505см 1) 1503см1) C = N 2238см 1 УФ-спектр (этанол) Пример 19 макс 209нм є = 26000 4-(5-тиоксо-2-оксо-3,4,4-триметил-1neper 236нм є= 11500 имидазолидинил)-2-(трифторметил)-бензонитрил neper 264нм є= 8700 (продукт А), 4-(5-оксо-2-тиоксо-3,4,4-триметил-1Пример 21 имидазолидинил)-2-(трифторметил)-бензонитрил 4-[4,5-дигидро-4,4-диметил-5-оксо-2(продукт В), 4-(2,5-дитиоксо-3,4,4-триметил-1[(фенилметил)-тио]-1Н-имидазол-1-ил]-2имидазолидинил)-2-(трифторметил)-бензонитрил (трифторметил)-бензонитрил (продукт С) К 53мг гидрида натрия, суспендированного в Нагревают в течение 9 часов в режиме де0,5см3 диметилформамида, добавляют в течение флегмации суспензию, содержащую 230мг про5 минут 313мг 4-(4,4-диметил-5-оксо-2-тиоксо-1дукта, полученного в примере 18, 1,4см3 толуола и имидазолидинил)-2-(трифторметил)78мг реактива Лавессона, доводят ее до комнатбензонитрила, приготовленного, как указывается в ной температуры, затем выпаривают досуха Попримере 15, и растворенного в Зсм3 диметилфорлученные 330мг продукта очищают путем хромамамида Перемешивают в течение 10 минут, затографии на кремнеземе (элюент метиленхлоридтем добавляют 0,1см3 бромбензила и продолжают ацетон 99 -1) Получают по порядку элюирования перемешивание в течение 30 минут Реакционную - 46мг продукта С (Rf = 0,63, т пл = 170 среду сливают в воду со льдом, содержащую 171 °С), идентичного продукту, описанному в при500мг фосфата калия, экстрагируют эфиром, промере 13, мывают органическую фазу соленой водой, высушивают и выпаривают растворитель Получают - 26мг продукта В (Rf = 0,49, т пл = 170 450мг сырого продукта, который хроматографиру171 °С), идентичного продукту, описанному в приют на кремнеземе (элюент метиленхлоридмере 13, этилацетат 97,5 - 2,5) Получают 316мг целевого - 42мг продукта A (Rf = 0,34, т пл = 194°С) продукта Rf = 0,38 Физический анализ продукта А ИК спектр (СНСІз) Элементный анализ 45299 22 21 Рассчитано С% 59,54, Н% 4,0, F% 14,12, N% (элюент циклогексан-этилацетат 1 - 1) получают 10,41, 119мг продукта В, те 2,5-диоксо-3-(2меркаптоэтильное) производное, Rf = 0,35 и 569мг Найдено 59,6,4,0, 14,1, 10,2, продукта А, те 5-оксо-2-тиоксо-3-(2ИК спектр (СНСІз) С=О 1746см 1 гидроксиэтильное) производное, Rf = 0,14, т пл = 130°С С= N „ „ о е і 2236см Элементный анализ C15H14F3N3O2S = 357,36 Конъюгированная система + Аромат соед Рассчитано С% 50,42, Н% 3,95, F% 15,95, N% 1 1614, 1580, 1570, 1503, 1499см 11,76, S%8,97, Пример 22 Продукт А 4-[4,4-диметил-3-(2-гидроксиэтил)-5-имино-2Найдено 50,7, 4,0, 15,7, 11,5, 9,1, тиоксо-1-имидазолидинил]-2-(трифторметил)Продукт В бензонитрил Найдено 50,6, 3,8, 15,9, 11,6, 9,1, В течение 30 минут нагревают в режиме деИК спектр (СНСІз) флегмации раствор, содержащий 2,11 г изотиоПродукт А цианата, приготовленного на стадии а) примера ОН 3626см 1 11, с 1,18г смеси 2-[(2-гидроксиэтил)-амино]-2С= N „ „ о е і метилпропаннитрила и 2,2-диметилоксазолидина 2236см 3 1 (8 - 2) в 20см тетрагидрофурата в присутствии С=О 1763см 0,5см триэтиламина Аромат соед 1615, 1578, 1504см 1 Растворитель выпаривают, остаток хроматоПродукт В графируют на кремнеземе {элюент метиленхлоОтсутствие ОН рид-ацетон 95 - 5) и получают 1,26г сырого целеC = N 2228см 1 вого продукта и 686мг ІЧ-[4-цианоС=О 1780, 1726см 1 2(трифторметил)-фенил]-2,2-диметил-3Аромат соед 1615, 1578, 1505см 1 оксазолидинкарботиоамида Все 686мг продукта 3 3 Работают, как указано в примерах с 1 по 23 растворяют в 10см зтилацетата, добавляют 30см А} используя 4-(4,4-диметил-2,5-диоксо-1циклогексана, сгущают до 4см3, обезвоживают и имидазолидинил)-2-(трифторметил)-бензонитрил, высушивают с получением дополнительно 518мг полученный, как указывается в примере 8, и соотцелевого продукта Сырой продукт растворяют в ветствующие реагенты, были получены соедине20см3 изопропанола, концентрируют до объема ния следующих примеров 5см3, обезвоживают и высушивают Получают Пример 24 1,04г целевого продукта, т пл =181 °С 4-(4,4-диметил-2,5-диоксо-3-этил-1Элементный анализ имидазолидинил)-2-(трифторметил)-бензонитрил Рассчитано С% 50,55, Н% 4,24, F% 16,00, N% Т пл = 1 0 0 - 1 0 Г С 15,72, S9.00, Элементный анализ C15H14F3N3O2 = 325,29 Найдено 50,4, 4,1, 15,9, 15,6, 9,00, Рассчитано С% 55,39, Н% 4,34, F% 17,52, N% ИК спектр (СНСІз) 1 12,92, ОН 3630см Найдено 55,7,4,3, 17,6, 12,8, > = NH 3314, 1677см 1 ИК спектр (СНСІз} С= N C = N 2238см 1 Аромат соед 1611, 1576, 1504см 1 С=О 1777, 1724см 1 Приготовление 2-[(2-гидроксиэтил)-амино]-2Аромат соед 1617, 1575, 1505см 1 метилпропан-нитрила, использованного в примере Пример 25 22 в качестве исходного 3 4-(4,4-диметил-2,5-диоксо-3-(2-пропенил)-1Прикалывают 8см этаноламина при 20 - 30°С имидазолидинил)-2-(трифторметил)-бензонитрил к 12,3см3 ацетонциангидрина Перемешивают в Т пл = 109-110°С течение 18 часов, затем перегоняют при пониженЭлементный анализ C16H14F3N3O2 = 337,35 ном давлении и получают 2,Зг смеси, включающей Рассчитано С% 56,97, Н% 4,18, F% 16,90, N% целевой продукт и 2,2-диметилоксазолидин, кото12,46, рую используют в том же виде в описанном синНайдено 57,0,4,1, 16,2, 12,3, тезе ИК спектр (СНСІз) Пример 23 C 4-[4,4-диметил-3-(2-гидроксиэтил)-5-оксо-2= N 2238см 1 тиоксо-1-имидазолидинил]-2-(трифторметил)С=О 1728, 1725см 1 бензонитрил (продукт А) и 4-[4,4-диметил-2,5НС=СН2 1645см 1 диоксо-3-(2-меркаптоэтил)-1-имидазолидинил]-2Аромат соед 1616, 1575, 1505см 1 (трифторметил)-бензонитрил (продукт В) Пример 26 В течение 10 минут нагревают в режиме де4-(4,4-диметил-2,5-диоксо-3-(фенилметил)-1флегмации 680мг продукта, полученного в примеимидазолидинил)-2-(трифторметил)-бензонитрил ре 22, в 7см 3 воды в присутствии 7см 3 хлористоТ пл = 98 - 99°С водородной кислоты, затем смесь охлаждают до Элементный анализ C20H16F3N3O2 = 387,36 комнатной температуры, экстрагируют этилацетаРассчитано С% 62,01, Н% 4,16, F% 14,71, N% том, промывают органическую фазу в соленой 10,85, воде, высушивают и выпаривают растворитель Найдено 62,0,4,1, 14,7, 10,8, После хроматографии остатка на кремнеземе 23 ИК спектр (СНС13) =C-NH 3430см 1 C =N 2238см 1 С=О 1779, 1724см 1 Аромат соед 1615, 1605, 1575, 1504, 1497см і Пример 27 4-[4,4-диметил-2, 5-диоксо-3-[(4-фторфенил)метил]-1-имидазолидинил]-2-(трифторметил)бензонитрил Т пл = 101 -102°С Элементный анализ C20H15F4N3O2 = 405,35 Рассчитано С% 59,26, Н% 3,73, F% 18,75, N% 10,37, Найдено 59,26, 3,5, 18,9, 10,3, ИК спектр (СНСІ3} C =N 2238см 1 С=О 1780, 1724см 1 Аромат соед 1615, 1612, 1505см 1 Пример 28 4-[4,4-диметил-2,5-диоксо-3-[(4метоксифенил)-метил]-1-имидазолидинил]-2(трифторметил)-бензонитрил Т пл = 95 - 96°С Элементный анализ C21H18F3N3O3 = 417,39 Рассчитано С% 60,43, Н% 4,35, F% 13,65, N% 10,07, Найдено 59,1, 3,5, 18,9, 10,3, ИК спектр (СНСІ3) C =N 2238см 1 CO 1778, 1723см 1 Аромат соед 1615, 1584, 1514, 1505см 1 Пример 29 4-[4,4-диметил-2,5-диоксо-3-[[4(трифторметил)-фенил]-метил]-1имидазолидинил]-2-(трифторметил)-бензонитрил Т пл «89-90°С Элементный анализ C21H15F6N3O2 = 313,30 Рассчитано С% 55,39, Н% 3,32, F% 25,03, N% 9,23, Найдено 55,2, 3,2, 25,3, 9,2, ИК спектр (СНСІ3) C =N 2238см 1 С=О 1615, 1505см 1 Аромат соед 1615, 1505см 1 Пример ЗО 4-[4,4-диметил-2,5-диоксо-3-(2-эпоксиметил)1-имидазолидинил]-2-(трифторметил)бензонитрил Т пл = 112-113°С Элементный анализ C16H14F3N3O3 = 353,30 Рассчитано С% 54,39, Н% 3,99, F% 16,13, N% 11,89, Найдено 54,7,4,0, 16,1, 11,8, ИК спектр (СНСІ3) С= N -юог- 1 2235см С=О 1781, 1725см 1 Аромат соед 1615, 1576, 1505см 1 Пример 31 4-(4,4-диметил-2,5-диоксо-3-пропил-1Нимидазолидинил)-2-(трифторметил)-бензонитрил Т пл = 113-114°С Элементный анализ C16H16F3N3O2 = 339,32 45299 24 Рассчитано С% 56,64, Н% 4,75, F% 16,80, N% 12,38, Найдено 56,7,4,7, 16,7, 12,2, ИК спектр (СНСІ3) С= N „ „ о е і 2236см С=О 1778, 1725см 1 Аромат соед 1616, 1505см 1 Пример 32 4-(4,4-диметил-2,5-диоксо-3-(1-метилэтил)-1имидазолидинил)-2-(трифторметил)-бензонитрил Т пл = 138-139°С Элементный анализ C16H16F3N3O2 = 339,32 Рассчитано С% 56,64, Н% 4,75, F% 16,80, N% 12,38, Найдено 56,5,4,7, 17,1, 12,3, ИКспеісгр(СНСІз) С= N „ „ о е і 2236см С=О 1778, 1724см 1 Аромат соед 1616, 1575, 1505см 1 Б) Используя 4-(4,4-диметил-5-оксо-2-тиоксо1-имидазолидинил-2-(трифторметил)бензонитрил, полученный как указывается в примере 15, и соответствующие реагенты, были получены соединения следующих примеров Пример 33 4[4,5-дигидро-4,4-диметил-2-(нонилтио)-5оксо-1Н-имидазол-1-ил]-2-(трифторметил)бензонитрил Rf = 0,35 (элюент метиленхлорид-этилацетат 97,5 - 2,5) Пример 34 4-[4,5-дигидро-4,4-диметил-2-[(3гидроксипропил)-тио]-5-оксо-1 Н-имидазол-1 -ил]-2(трифторметил)-бензонитрил Rf = 0,17 (элюент метиленхлорид-этилацетат 8-2) Пример 35 [[1-[4-циано-3-(трифторметил)-фенил]-4,5дигидро-4,4-диметил-5-оксо-1Н-имидазол-2-ил]ти о]-этил ацетат Rf = 0,20 (элюент циклогексан-этилацетат 65 35) В) Используя полученный в примере 11 тиоцианат и соответствующие реагенты, были получены следующие соединения Пример 36 4-(4,4-диметил-3-этил-5-имино-2-тиоксо-1имидазолидинил)-2-(трифторметил)-бензонитрил Rf = 0,16 (элюент метиленхлорид-ацетон 95 5) Пример 37 4-(4,4-диметил-5-имино-3-пентил-2-тиоксо-1имидазолидинил)-2-(трифторметил)-бензонитрил Rf = 0,35 (элюент этилацетат-циклогексан 8 2) Г) Используя соответственно 4-(4,4-диметил3-этил-5-имино-2-тиоксо-1-имидазолидинил)-2(трифторметил)-бензонитрил, полученный, как указывается в примере 36, и 4-(4,4-диметил-5имино-3-пентил-2-тиоксо-1-имидазолидинил)-2(трифторметил)-бензонитрил, полученный, как указывается в примере 37, а также 50%-ную разбавленную хлористоводородную кислоту, были получены следующие соединения Пример 38 25 45299 26 4-(4,4-диметил-3-этил-5-оксо-2-тиоксо-186 - 87°С после хроматографии на кремнеземе (элюент циклогексан-этилацетат 7 - 3) имидазолидинил)-2-(трифторметил)-бензонитрил Rf = 0,38 (элюент этилацетат-циклогексан 1 б) Расщепление К 380мг полученного на предыдущей стадии 1) 3 3 продукта, растворенного в 4см метанола и 1см Пример 39 3 метиленхлорида, добавляют 1см 2 н хлористо4- (4, 4-диметил-5-оксо-3-пентил-2-тиоксо-1водородной кислоты Перемешивают 40 минут при имидазодинил)-2-(трифторметил)-бензонитрил 3 комнатной температуре, сливают в 15см воды, Т пл - 78°С, Rf = 0,66 (элюент этилацетатэкстрагируют метиленхлоридом, промывают в циклогексан 8 - 2) воде, высушивают и выпаривают растворитель Д) Используя полученный, как указывается в Остаток очищают путем хроматографии на кремпримере 20, 4-(4,5-дигидро-4,4-диметил-2неземе (элюент метиленхлорид-этилацетат 7 - 3), (метилтио)-5-оксо-1 Н-имидазол-1 -ил)-2Rf = 0,9, кристаллизуют в эфире с выделением (трифторметил)-бензонитрил, и полученный, как 270мг целевого продукта После перекристаллиуказывается в примере 21, 4-[4,5-дигидро-4,4зации в изопропанолет пл =109-110°С диметил-5-оксо-2-[(фенилметил)-тио]-1Нимидазол-1-ил]-2-(трифторметил)-бензонитрил и Элементный анализ реагент Лавессона, были получены следующие Рассчитано С% 52,79, Н% 4,23, F% 16,70, N% соединения 12,31, Пример 40 Найдено 52,5,4,2, 16,7, 12,1, 4-[4,5-дигидро-4,4-диметил-2-(метилтио)-5Поступая таким же образом, но используя в тиоксо-1 Н-имидазол-1-ил]-2-(трифторметил)качестве исходного 2-бромпропанол-третбензонитрил бутилдиметилсилилэфир, получают следующий продукт Rf = 0,36 (элюент метиленхлорид-этилацетат 97,5 - 2,5) Пример 44 Пример 41 4-[4,4-диметил-2,5-диоксо-3-(3гидроксипропил)-1-имидазолидинил]-24-[4,5-дигидро-4,4-диметил-2-[(фенилметил)(трифторметил)-бензонитрил тио]-5-тиоксо-1 Н-имидазол-1 -ил]-2(трифторметил)-бензонитрил Т пл = 131 - 132°С Rf = 0,13 (элюент СН2С2AcOEt 75 - 25) Rf = 0,62 (элюент метиленхлорид-этилацетат 98-2) Пример 45 Пример 42 4-[3-[2-(ацетилокси)-этил]-4, 4-диметил-2,53-[4-циано-3-(трифторметил)-фенил]-5,5диоксо-1-имидазолидинил]-2-(трифторметил)диметил-2,4-диоксо-г\1-метил-1\1-(1-метилэтил)-1бензонитрил имидазолидин ацетамид При комнатной температуре перемешивают в течение 30 минут 215мг полученного в примере 43 К 235мг приготовленной, как указывается в продукта, 15мг 4-диметил аминопиридина, 1см3 примере 9, 3-[4-циано-3-(трифторметил)-фенил]пиридина и 0,5см уксусного ангидрида Реакци5,5-диметил-2,4-диоксо-1-имидазолидинуксусной онную среду сливают в 20см3 водного раствора, кислоты, находящейся в суспензии в 4см метинасыщенного бикарбонатом натрия, перемешиваленхлорида, добавляют 0,1см3 N-метилют 20 минут, экстрагируют етилацетатом, промыморфолина Полученный раствор охлаждают до вают водой и выпаривают досуха Пиридин и ос10°С, по капле добавляют 0,1см3 изобутилхлортаточную уксусную кислоту удаляют путем формиата и в течение 25 минут перемешивают перегонки, остаток очищают хроматографией на при температуре -10°С Затем добавляют 0,15см3 кремнеземе (элюент метиленхлорид-этилацетат ІЧ-метил-ІЧ-изопропиламина, доводят в течение 40 65 - 35), полученный остаток извлекают изопропаминут до комнатной температуры, добавляют 5см 3 нолом, частично концентрируют, охлаждают водного насыщенного раствора бикарбоната нальдом, обезвоживают и получают, после сушки, трия, перемешивают 30 минут, экстрагируют ме21 Ог целевого продукта, т пл =99-100°С тиленхлоридом, промывают органическую фазу в воде, высушивают и выпаривают растворитель Элементный анализ при пониженном давлении После хроматографии Рассчитано С% 53,27, Н% 4,21, F% 14,87, N% на кремнеземе получают 147мг целевого про10,96, дукта Найдено 53,5,4,3, 15,2, 10,9, ИК спектр (СНСІз) С= N „ „ о е і 2236см 1 С=О 1661см Аромат соед 1615, 1575, 1505см 1 Пример 43 4-[4,4-диметил-2,5-диоксо-3-(2-гидроксиэтил)1-имидазолидинил]-2-(трифторметил)бенэонитрил а) Конденсация Работают, как в примере 9, но исходят из 900мг полученного в примере 8 продукта и 1,91 г 2бромэтанол-трет-бутилдиметилсилилэфира Получают 1 г силилокси-производного эфира Т пл Поступая, как в предыдущих примерах, были получены следующие соединения Пример 46 4-[4,4-диметил-2,5-диоксо-3-(5гидроксипентил)-1-имидазолидинил]-2(трифторметил)-бензонитрил Т пл = 101 -102°С Пример 47 4-[4,4-диметил-2,5-диоксо-3-(2-метоксиэтил)-1имидаэолидинил]-2-(трифторметил)-бензонитрил Т пл = 68 - 69°С Пример 48 4-[4,4-диметил-2,5-диоксо-3-(цианометил)-1имидазолидинил]-2-(трифторметил)-бензонитрил 27 45299 28 Т пл = 186-187°С диметил-5-имино-2-имидазолидинтион Пример 49 Т пл = 173-174°С 4-[4,4-диметил-2,5-диоксо-3-[(1,3-диоксалан-2Пример 57 ил)-метил]-1-имидазолидинил]-2-(трифторметил)3-(3,4-дихлорфенил)-3,5-дигидро-5,5-диметилбензонитрил 2-[(фенил-метил)-тио]-4Н-имидазол-4-он Т пл = 135-136°С ИК спектр (СНСІз) Пример 50 С=О 1736см 1 4-[4,4-диметил-2,5-диоксо-3-(2-хлорэтил)-1C=N и Аромат соед 1578, 1496см 1 имидазолидинил] -2-(трифторметил)-бензонитрил Пример 58 Т пл = 120-121 °С Была изготовлена таблетка следующего состава Пример 51 1-(3,4-дихлорфенил)-5-имино-3,4,4-триметил4-(5-оксо-2-тиоксо-3,4,4-триметил-12-имидазолидин-тион имидазолинил)-2-(три-фторметил)-бензонитрил 100мг, В течение 16 часов нагревают в режиме дефлегмации 2,4г изоцианата 3,4-дихлорфенила и Эксцип в дост к-ве для таблетки в законч 1,3см3 2-метиламино-2-цианопропана в 23см3 тетвиде - 300мг, 3 рагидрофурана в присутствии 0,23см триэтила(Состав эксципиента лактоза, крахмал, тальк, мина Растворитель удаляют при пониженном стеарат магния) давлении и очищают остаток путем хроматограФармакологическое изучение продуктов изофии на кремнеземе (элю-ент метиленхлоридбретения ацетон 96 - 4, затем этилацетат-циклогексан 1 -1) 1} Изучение сродства продуктов изобретения к После кристаллизации в эфире получают 2,54г андрогенному рецептору целевого продукта, т пл = 133°С Андрогенньй рецептор Пример 52 У крыс самцов вида Спрейг Доулей EOPS весом 180 - 200г, которых предварительно кастриро3-(3,4-дихлорфенил)-2-тиоксо-1,5,5-триметилвали за сутки и умертвили, извлекают простату, 4-имидазолидинон взвешивают и гомогенизируют с помощью гомогеВ течение 45 минут нагревают в режиме денизатора Поттера со стеклянными сосудами и флегмации 1,88г продукта, полученного в примере смесителем, при 0°С, в буферном растворе (Трис 51, суспензированного в 14см3 6 н раствора хлоЮммоль, сахароза 0,25моль, ФМСФ (фенилмеристоводородной кислоты, затем снова добавлятансульфонилфторид) 0,1ммоль, молибдат натрия ют 14см 6 н раствора хлористоводородной ки20ммоль, HCI рН = 7,4), к которому добавляют, по слоты и продолжают нагревание в течение 2 мере требования, раствор DTT (DL-дитиотрейтол), часов После нового добавления 4см3 6 н раствоиз расчета 1 г ткани на 8мл буферного раствора ра хлористоводородной кислоты и нагревания в режиме дефлегмации в течение 1 часа 30 минут и Затем гомогенат ультрацентрифугируют 45 доведения до комнатной температуры добавляют минут при температуре 0°С и скорости 105000д ЮОг льда и экстрагируют этилацетатом ОрганиАликвотные пробы всплывшей фракции (цитозоческую фазу промывают водой, высушивают и ля) подвергают инкубации в течение 30 минут и 24 выпаривают растворитель После хроматографии часов при 0°С и при постоянной концентрации (Т) на кремнеземе (элюент циклогексан-этилацетат 1 насыщенного тритием тестостерона в присутствии - 1) получают 1,84г целевого продукта После кривозрастающих концентраций (от 0 до 2500 10 9 М) сталлизации в изо-пропанолет пл = 129°С либо "холодного" тестостерона, либо исследуемого продукта Концентрацию связанного насыщенЭлементный анализ C12H12CI2N2OS = 3303,21 ного тритием тестостерона (В) измеряют, в каждой Рассчитано С% 47,54, Н% 3,99, Cl% 23,38, инкубированной пробе, путем адсорбции на углеN%9,24, S% 10,57, декстране Найдено 47,5, 3,8, 23,2, 9,3, 10,5, Расчет относительного связывающего сродИК спектр (СНСІз) ства (ОСС) С=О 1753см 1 C=S и Аромат соед 1595, 1570, 1496см 1 Для этой цели составляют следующие 2 кривые кривую зависимости процента связанного Работают, как в предыдущих примерах, но иснасыщенного тритием гормона В/Т от логарифма пользуя соответствующие продукты и реагенты, концентрации холодного контрольного гормона и были получены следующие соединения кривую В/Т в зависимости от логарифма конценПример 53 трации исследуемого холодного продукта Затем 3-(3,4-дихлорфенил)-3,5-дигидро-5,5-диметилопределяют прямую уравнения Iso - (В/Тнакс + 2-(метил-тио)-4Н-имидазол-4-он В/ТНИн)/2 Т пл = 110°С Пример 54 В/Тнакс - % связанного насыщенного тритием 1-(3,4-дихлорфенил)-3,4,4-триметил-2,5гормона при инкубации данного гормона с конценимидазолидин-дитион трацией (Т) Т пл «146°С В/Тнин- % связанного насыщенного тритием гормона при инкубации данного гормона с конценПример 55 трацией (Т) в присутствии большого избытка хо1-[4-хлор-3-(трифторметил)-фенил]-4,4лодного гормона (2500 10 9 М) диметил-2-тиоксо-5-имидазолидинон Пересечения прямой І50 и кривых позволяют Т пл = 176°С определить концентрации контрольного холодного Пример 56 гормона (СН) и исследуемого холодного продукта 1-[4-хлор-3-(трифторметил)-фенил]-4,4 29 45299 30 (СХ), ингибирующие на 50% связь насыщенного подопытных животных умерщвляют, извлекают у тритием гормона с рецептором Относительное них почки, которые гомогенизируют при 0°С посвязывающее сродство (ОСС) исследуемого просредством тефлон-стеклянной мельницы в 10-и дуісга определяется уравнением ОСС =100 (СН) / объемах буферного раствора Трис-НСІ 50мМ (рН (СХ) = 7,4), содержащего 250мМ пиридоксальфосфата, Были получены следующие, выраженные в 0,1 мМ ЭДТА (этилендиаминтетрауксусной кислоОСС, результаты ты) и 5мМ дитиотрейтола Затем гомогенат центрифугируют со скоростью 105000д в течение 45 Контрольный продую" (Тестостерон) 100 минут - Принцип анализа Инкубация 30 Инкубация 24 При температуре 37°С почечная орнитинминут часа декарбоксилаза Продую" в при27,5 3 превращает изотопную смесь холодного орнимере 1 тина и меченного тритием орнитина в холодной Продую" в при22 б путресцин и в меченный тритием путресцин мере 2 Путресцин затем собирают на избирательной Продую" в при21 5 ионообменной бумаге После сушки избыток немере 4 превращенного меченного тритием и холодного Продую" в при28 8 орнитина удаляют 3-мя промывками нашатырным мере 11 спиртом, с = 0,1 моль/л Бумагу высушивают, затем Продую" в приизмеряют радиоактивность после добавки сцин128 92 мере 12 тиллирующего вещества (Акуалайта - Aquahte) Продую" в при31 39 Результаты выражают в фмоль (1015моль) мере 13 образовавшегося меченного тритием путресциПродую" в прина/час/мг протеин 27 7 мере 14 Получают следующие результаты Продую" в приПродукт в примере 11 69 24 мере 15 Антагонизм (РО) Змг/кг 83% Продукт в примере 12 2) Определение андрогенной или антиандроАнтагонизм (РО) 0,1м г/кг 12% генной активности соединений согласно изобре0,3м г/кг 36% тения путем количественного анализа орнитин1м г/кг 68% декарбоксилази Змг/кг 94% - Протокол проведения опыта 10м г/кг 99% Мышам-самцам породы СУИСС (SWISS) 6Агонизм (РО) 10м г/кг 0% месячного возраста, кастрировванным за сутки, Продую" в примере 14 вводят оральным путем исследуемые соединения Антагонизм (РО) Змг/кг 87% (0,5%-ная метилцеллюлоза в суспензии), и одноПродую" в примере 15 временно осуществляют подкожную инъекцию Антагонизм (РО) 0,3м г/кг 4% тестостеронпропионата в объеме Змг/кг (раство1м г/кг 82% ренного в кунжутном масле, содержащем 5% бенЗаключение зилового спирта) для определения антиандрогенВышеописываемые опыты показали, что соной активности изучаемого продуїсга единения согласно изобретению обладают мощАгонистическую активность определяют в отстустной антиандрогенной активностью и лишены аговие тестостеронпропионата нистической активности Исследуемые соединения, а также тестостеронпропионат вводят в объеме 10мм/кг Через 16 часов после введения соединений ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна (044)456-20- 90 ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)216-32-71
ДивитисяДодаткова інформація
Автори англійськоюGoubet Francois, Philibert Daniel
Автори російськоюГубе Франсуа, Филибер Даниэль
МПК / Мітки
МПК: C07D 233/72, C07D 233/88, A61P 13/08, A61P 35/00, A61P 17/14, A61P 13/02, A61P 5/28, A61P 17/00, A61K 31/415, C07D 233/86, C07D 233/70, A61P 15/00, C07D 233/84
Мітки: фенілімідазолідинів, композиція, фармацевтична, активність, одержання, антиандрогенну, спосіб, похідні, мають
Код посилання
<a href="https://ua.patents.su/15-45299-pokhidni-fenilimidazolidiniv-shho-mayut-antiandrogennu-aktivnist-sposib-kh-oderzhannya-ta-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Похідні фенілімідазолідинів, що мають антиандрогенну активність, спосіб їх одержання та фармацевтична композиція</a>
Попередній патент: Вуглецевополімерний композиційний сорбційний матеріал та спосіб його отримання
Наступний патент: Макролідні антибіотики, спосіб їх одержання, композиції для лікування людей і тварин, композиція і спосіб боротьби з шкідниками сільського господарства
Випадковий патент: Спосіб виробництва м`ясних делікатесів до пива