Естрогенні засоби, спосіб їх отримання, фармацевтична композиція та спосіб лікування
Формула / Реферат
1. Производные индола, имеющие структуру:
или
где R1 выбран из Н, ОН или сложных эфиров С1-С4, либо из их простых алкиловых эфиров, или галогена;
R2, R3, R4, R5 и R6 независимо выбраны из Н, ОН или сложных эфиров С1-С4, либо из их простых алкиловых эфиров, галогена, цианогруппы, С1-С6-алкила или трифторметила, при условий что в случае, когда R1 представляет собой Н, R2 не является группой ОН;
n равно 2 или 3;
X выбран из Н, С1-С6-алкила, циано, нитро, трифторметила, галогена;
Z выбран из
или
Y выбран из:
а) группы
где R7 и R8 независимо друг от друга выбраны из группы, включающей Н, С1-С6-алкил, фенил, или объединены группой -(СН2)р-, где р является целым числом от 2 до 6, таким образом, что образуется кольцо, причем кольцо может быть необязательно замещено заместителями числом вплоть до трех, выбранными из группы, включающей гидроксил, галоген, С1-С4-алкил, тригалогенметил, С1-С4-алкокси, тригалогенметокси, С1-С4-алкилтио, С1-С4-алкилсульфинил, С1-С4-алкилсульфонил, гидрокси (С1-С4) алкил, -СО2Н, -CN, -CONH(С1-С4) алкил, NH2, С1-С4-алкиламино, ди-(С1-С4-алкил) амино, -NHSO2(С1-С4) алкил,
-NHCO(С1-С4) алкил и –NО2;
b) пяти-, шести- или семичленного насыщенного, ненасыщенного или частично ненасыщенного гетероцикла, содержащего до двух гетероатомов, выбранных из группы, включающей -О-, -NH-, -N(С1-С4-алкил)-, -N= и -S(О)m-, где m представляет собой целое число, равное 0-2, необязательно замещенного 1-3 заместителями, независимо выбранными из группы, включающей гидроксил, галоген, С1-С4-алкил, тригалогенметил, С1-С4-алкокси, тригалогенметокси, С1-С4-ацилокси, С1-С4-алкилтио, С1-С4-алкилсульфинил, С1-С4-алкилсульфонил, гидрокси(С1-С4) алкил, -СО2Н, -CN, -CONHR1, -NН2, С1-С4-алкиламино, ди-(С1-С4-алкил) амино, -NHSO2R1, -NHСOR1, NO2 и фенил, необязательно замещенный С1-С4-алкильными группами в количестве от 1 до 3;
с) бициклической кольцевой структуры, состоящей из пяти- или шестичленного гетероциклического кольца, сконденсированного с фенильным кольцом, причем указанное гетероциклическое кольцо содержит вплоть до двух гетероатомов, выбранных из группы, включающей -О-, -NH-, -N(С1-С4-алкил)- и –S(O)m-, где m представляет собой целое число, равное 0-2, необязательно замещенное 1-3 заместителями, независимо выбранными из группы, включающей гидроксил, галоген, С1-С4-алкил, тригалогенметил, С1-С4-алкокси, тригалогенметокси, С1-С4-ацилокси, С1-С4-алкилтио, С1-С4-алкилсульфинил, С1-С4-алкилсульфонил, гидрокси(С1-С4) алкил, -СО2Н, -CN, -CONHR1, -NH2, С1-С4-алкиламино, ди-(С1-С4-алкил) амино, -NHSO2R1, -NHCOR1, -NО2 и фенил, необязательно замещенный С1-С4-алкильными группами в количестве от 1 до 3;
или его фармацевтически приемлемая соль.
2. Соединение по п. 1, в котором:
R1 выбран из Н, ОН или сложных эфиров С1-С4, либо из их простых алкиловых эфиров, или галогена;
R2, R3, R4, R5 и R6 независимо выбраны из Н, ОН или сложных эфиров С1-С4, либо из их простых алкиловых эфиров, галогена, цианогруппы, С1-С6-алкила или трифторметила, при условии, что в случае, когда R1 - представляет собой Н, R2 не является группой ОН;
X выбран из Н, С1-С6-алкила, циано, нитро, трифторметила, галогена;
Y представляет собой группу
где R7 и R8 независимо друг от друга выбраны из Н, С1-С6-алкила или объединены группой -(СН2)р-, где р является целым числом от 2 до 6, таким образом, что образуется кольцо, причем кольцо является необязательно замещенным заместителями числом вплоть до трех, выбранными из группы, включающей гидроксил, галоген, С1-С4-алкил, тригалогенметил, С1-С4-алкокси, тригалогенметокси, С1-С4-алкилтио, С1-С4-алкилсульфинил, С1-С4-алкилсульфонил, гидрокси (С1-С4) алкил, -СО2Н, -СN, -CONH(С1-С4) алкил, -NН2, С1-С4-алкиламино, ди-(С1-С4-алкил) амино, -NHSO2(С1-С4) алкил, -NНСО(С1-С4) алкил и –NО2.
3. Соединение по п. 2, в котором R7 и R8 соединены вместе в виде группы -(СН2)p- с образованием кольца, где р является целым числом от 2 до 6, причем кольцо является необязательно замещенным 1-3 заместителями, выбранными из группы, содержащей С1-С3-алкил, трифторметил, галоген, водород, фенил, нитро или -СN.
4. Соединение по п. 1, представляющее собой одно из следующих :
5-бензилокси-2-(4-фторфенил)-3-метил-1Н-индол;
5-бензилокси-2-(4-бензилоксифенил)-3-метил)-1-илметил-(4-фенилбромид)индол;
5-бензилокси-2-(4-фторфенил)-3-метил)-1-илметил-(4-фенилбромид)индол;
2-(4-гидроксифенил)-3-метил)-1-илметил-(4-фенилбромид)индол-5-ол;
(Е)-N,N-диэтил-3-{4-[5-гидрокси-2-(4-гидроксифенил)-3-метилиндол-1-илметил]фенил}акриламид;
1(Е)-N-трет-бутил-3-{4-[5-гидрокси-2-(4-гидроксифенил)-3-метилиндол-1-илметил]фенил}акриламид;
(Е)-пирролидино-3-{4-[5-гидрокси-2-(4-гидроксифенил)-3-метилиндол-1-илметил]фенил}акриламид;
(Е)-N,N-диметил-3-{4-[5-гидрокси-2-(4-гидроксифенил)-3-метилиндол-1-илметил]фенил}акриламид;
(Е)-N,N-дибутил-3-{4-[5-гидрокси-2-(4-гидроксифенил)-3-мeтилиндoл-1-илмeтил]фенил}акриламид;
(Е)-N-бутил,N’-метил-3-{4-[5-гидрокси-2-(4-гидроксифенил)-3-метилиндол-1-илметил]фенил}акриламид;
(Е)-морфолино-3-{4-[5-гидрокси-2-(4-гидроксифенил)-3-метилиндол-1-илметил]фенил}акриламид;
(Е)-3-{4-[5-гидрокси-2-(4-гидроксифенил)-3-метилиндол-1-илметил]фенил}акриламид;
(Е)-N’-метил-3-{4-[5-гидрокси-2-(4-гидроксифенил)-3-метилиндoл-1-илмeтил]фенил}акриламид;
(Е)-N,N-дибутил-3-{4-[5-гидрокси-2-(4-фторфенил)-3-метилиндол-1-илметил]фенил}акриламид;
(Е)-N-бутил,N’-метил-3-{4-[5-гидрокси-2-(4-фторфенил)-3-метилиндол-1-илметил]фенил}акриламид;
2-(4-гидроксифенил)-3-метил-1-[4-(3-N,N-диметил-1-илпроп-1-инил)бeнзил]-1H-индoл-5-oл;
2-(4-гидроксифенил)-3-метил-1-[4-(3-пиперидин-1-илпроп-1-инил)бензил]-1Н-индол-5-ол;
2-(4-гидроксифенил)-3-метил-1-[4-(3-пирролидин-1-илпроп-1-инил)бензил]-1Н-индол-5-ол;
или его фармацевтически приемлемая соль.
5. Способ лечения или предотвращения разрежения кости (остеопороза), лечения или предотвращения состояний или синдромов заболевания, которые вызываются или связаны с недостатком эстрогена у млекопитающих, лечения или предотвращения сердечно-сосудистого заболевания у млекопитающих, включающий введение млекопитающему, которое в этом нуждается, эффективного количества соединения по любому из пп. 1-4 или его фармацевтически приемлемой соли.
6. Фармацевтическая композиция, включающая соединение по любому из пп. 1-4 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или эксципиент.
7. Способ получения соединения формулы 1, включающий один из следующих методов:
а) взаимодействие соединения формулы:
где R1-R6 и Х определены, как указано в п. 1, с акриламидом формулы:
где Y определен, как указано в п. 1, с получением соединения формулы 1, где Z представляет собой -СН=СН-СОY; или
b) взаимодействие соединения формулы:
,
где R1-R6 и Х определены, как указано в п. 1, с соединением формулы:
,
где n и Y определены, как указано в п. 1, с получением соответствующего соединения формулы 1, где Z представляет собой
Текст
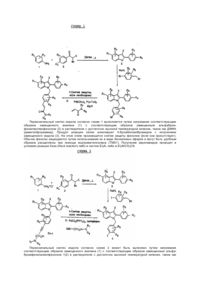
Настоящее изобретение касается новых соединений 3- [4-(2-фенил-индол-1-илметил) -фенил] акриламида и новых соединений 2-фенил-1- [4- (амино-1-ил-алк-1-инил) бензил] -1Н-индол-5-ола, которые применимы в качестве эстрогенных агентов, а также фармацевтических композиций и способов лечения, в которых используются эти соединения. Использование гормонозамещающей терапии для предотвращения разрежения костей (остеопороза) у женщин в постклимактерический период хорошо обосновано. Обычный порядок лечения требует введения в организм добавочного эстрогена с использованием подобных составов, содержащих эстрон, эстриол, этинилэстрадиол или сопряженные эстрогены, выделенные из источников природного происхождения (Premarin производства Wyeth-Ayerst). Для некоторых пациентов терапия может быть противопоказана из-за пролиферационного воздействия, которое несбалансированные эстрогены (эстрогены, взятые не в сочетании с прогестинами) оказывают на ткань матки. Эта пролиферация связана с повышенным риском эндометриоза и/или рака внутренней поверхности матки. Воздействие несбалансированных эстрогенов на ткань молочной железы менее очевидно, но оно имеет какое-то значение. Необходимость в эстрогенах, которые поддерживают сохранение костей, при минимизации в то же время пролиферативного влияния на матку и молочную железу, является очевидной. Показано, что некоторые антиэстрогены нестероидного характера поддерживают массу костей в исследованиях на модели крыс, подвергнутых овариэктомии, а также в клинических испытаниях на людях. Например, тамоксифен (tamoxifen) является полезным паллиативным средством для лечения рака молочной железы. Было продемонстрировано, что у людей он оказывает влияние на кости подобно агонистам эстрогена. Однако он также является частичным агонистом в отношении матки и это служит причиной определенного беспокойства. Показано, что ралоксифен (raloxifen), антиэстроген на основе бензотиофена, стимулирует рост матки у подвергнутых овариэктомии крыс в меньшей степени, чем тамоксифен, сохраняя в то же время способность сберегать кости. Подходящим обзором избирательных к тканям эстрогенов является следующий: Tissue-Selective Actions Of Estroqen Analogs, Bone Vol. 17, N 4, October 1995, 181S-190S. Об использовании индолов в качестве антагонистов эстрогена сообщается в Von Anqerer, Chemical abstrscts, Vol.99, N.7 (1983), Abstract N. 53886u. См. также J.Med.Chem. 1990, 33, 2635-2640; J.Med.Chem. 1987, 30, 131-136. См. также Ger. Offen., DE 3821148,AI 891228 и WO 96/03375. Дополнительно см. WO, A, 93 23374 (Otsuka Pharmaceutical Factory, Inc.). Работа Фон Ангерера (Von Anqerer) ограничена алифатическими цепями, связанными с азотом индола и, тем самым, связанными с основным амином (или амидом), или бензильными группами, не имеющими основных аминов. Мировой патент, принадлежащий Otsuka (Япония) состоит из соединений, относящихся к настоящему изобретению, за исключением того, что группа R3 (показанная в формуле 1) определяется как -SR, где R представляет алкил. Кроме того, в соединениях патента отсутствуют идущие от азота индола цепи той же структуры, что представлены в настоящем изобретении, как в формуле изобретения, так и в примерах. Родственный патент WO A 93 10741 описывает 5-гид-роксииндолы. WO A 93 17383 (Kar Bio AB) описывает соединения с алифатической цепью. В WO A 93 17383 (Kar Bio AB) описываются антиэстрогены на основе индола с длинными неразветвленными цепями. В другом родственном патенте Wo A 93 10741 описываются 5-гид-роксииндолы с широким набором различных побочных цепей. В WO 93/23374 (Otsuka Pharmaceutical, Japan) описываются соединения, сохраняющие структурное подобие с таковыми согласно настоящему изобретению, за исключением того, что элемент их структуры, обозначаемый в представленных ниже формулах 1 и П как R3, определяется как тиоалкил, и указанный источник не описывает таких соединений, имеющих цепи, соединенные с атомом азота в индоле, имеющих такую же структуру, как соединения, разработанные в настоящем изобретении. Соединения общего структурного типа, изображаемого формулами (1) и (П), являются агонистами / антагонистами к эстрогену, пригодными для лечения заболеваний, связанных с недостатком эстрогена. У соединений согласно настоящему изобретению проявляется сильное связывание с рецептором эстрогена. Доказано, что эти соединения являются антиэстрогенами с малой собственной эстрогенностью. В исследованиях на модели крыс, подвергнутых за три дня до этого овариэктомии, соединения формулы (1) способны противодействовать эффектам, вызываемым 17β-эстрадиолом, проявляя в то же время слабое раздражающее влияние на матку в том случае, когда они введены сами по себе. Настоящее изобретение включает соединения формул (1) и (П), данных ниже: (I) Или (II) где: R1 выбран из H, ОН или сложных эфиров С 1-С4. либо из них простых алкиловых эфиров, или галогена; R2, R3, R4, R5 и R6, независимо выбраны из Н, ОН или сложных эфиров С1-С4 - либо из их простых алкиловых эфиров, галогена, цианогруппы, С1-С6 - алкила или трифторметила, при условии, что в случае, когда R, представляет собой H, R2 не является группой ОН; n равно 2 или 3; x выбран из числа групп Н, С1-С6,-алкил, циано, нитро, трифторметил, галоген; Z выбран из У выбран из: а) группы где R7 и R8 независимо друг от друга выбраны из группы, включающей Н, С1-С6, - алкил, фенил или объединены группой -(СН2)р-, где p является целым числом от 2 до 6, таким образом, что образуется кольцо, причем кольцо может быть необязательно замещенным заместителями числом вплоть до трех, выбранными из группы, включающей гидроксил, галоген, С1-С4-алкил, тригалогенметил, С1-С4-алкокси, тригалогенметокси, С1-С4-алкилтио, С1-С4-алкилсульфинил, С1-С4-алкипсульфонип, гидрокси (С1-С4) алкил, - С02Н, - СN, - СОNН (С1-С4) алкил, - NН2, С1-С4 - алкиламино, ди - (С1-С4-алкил) амино, -NSH02 (С1С4) алкил, -NНСО (С1-С4) алкил и -N02; b) пяти-, шести- или семичленного насыщенного, ненасыщенного или частично ненасыщенного гетероцикла, содержащего до двух гетероатомов, выбранных из группы, включающей -О-, -NН-, -N(С1-С4-алкил)-, -N= и -S(O)m-, где m представляет собой целое число, равное 0-2, необязательно замещенного 1-3 заместителями, независимо выбранными из группы, включающей гидроксил, галоген, С1-С4-алкил, тригалогенметил, С1-С4-алкокси, тригалогенметокси, С1-С4-ацилокси, С1С4-алкилтио, С1-С4-алкилсульфинил, С1-С4-алкилсульфонил, гидрокси (С1-С4) алкил, -С02Н, -CN, CONHRi1,-NH2 (С1-С4) - алкиламино, ди-(С1-С4-алкил) амино, -NHSO2R1, -NHSOR1, -NO2 и фенил, необязательно замещенный C1-С4-алкильными группами в количестве от 1 до 3; с) бициклической кольцевой структуры, состоящей из пяти или шестичленного гетероциклического кольца, сконденсированного с фенильным кольцом, причем указанное гетероциклическое кольцо содержит до двух гетероатомов, выбранных из группы, включающей -О-, -NH-, -М(С1-С4-алкил) - и -S(O)m-, где m представляет собой целое число, равное 0-2, необязательно замещенного 1-3 заместителями, независимо выбранными из группы, включающей гидроксил, галоген, С1-С4-алкил, тригалогенметил, С1-С4-алкокси, тригалогенметокси, С1-С4-ацилокси, С1С4-алкилтио, С1-С4-алкилсульфинил, С1-С4-алкилсульфонил, гидрокси (С1-С4) алкил, -С02Н, -CN, -CONHR1, NH2, С1-С4 алкиламино, ди-(С1-С4-алкил) амино, -NHS02R1, -NHCOR1, -N02 и фенил, необязательно замещенный С1-С4-алкильными группами в количестве от 1 до 3; и их фармацевтически приемлемые соли. Кольца, образованные совместно R7 и R8, как упомянуто выше могут включать, не будучи, однако, ограниченными этим, азиридиновые, азетидиновые, пирролидиновые, пиперидиновые или гексаметиленаминовые кольца. Кроме того, является предпочтительным, чтобы, когда R7 и R8, объединены вместе в виде группы – (СН2)p -, образованное образом таким образом кольцо было необязательно замещенным 1-3 заместителями выбранными из группы, содержащей С 1-С3,-алкил, трифторметил, галоген, фенил, нитро и -СN. Наиболее предпочтительными соединениями согласно настоящему изобретению являются соединения, имеющие структурные формулы (1) или (П), указанные выше, в которых R1 представляет собой ОН; R2-R6 определены, как указано выше; X выбран из группы, содержащей Сl, NO2, СN, CF3 или СН3; а у представляет собой группу и R7 и R8 объединены вместе в виде группы -(СН2)p -, где p является целым числом от 4 до 6, с образованием кольца, необязательно замещенного заместителями числом до трех, выбранными из группы, содержащей водород, гидроксил, галоген, С1,-С4-алкил, тригалогенметил, С1-С4-апкокси, тригалогенметокси, С1-С4-алкилтио, С1-С4-алкилсупьфинил, С1-С4-алкилсульфонил, гидрокси (C1-C4) алкил, -С02Н, -СN, -СОNН (С1-С4) алкил, -NH2, С1-С4-алкипамино, ди-(С1-С4-алкил) амино, -NHSO2 (С1-С4) алкил, -NHCO (С1-С4) алкила и -NO2; и их фармацевтически приемлемые соли. Изобретение включает формы приемлемых солей, образуемые путем реакции присоединения, либо неорганических, либо органических кислот. Применимы неорганические кислоты, такие как соляная кислота, бромоводородная кислота, иодоводородная кислота, серная кислота, фосфорная кислота, азотная кислота, а также применимыми являются органические кислоты, такие как уксусная кислота, пропионовая кислота, лимонная кислота, малеиновая кислота, яблочная кислота, винная кислота, фталевая кислота, янтарная кислота, метансульфоновая кислота, толуолсульфоновая кислота, нафталинсульфоновая кислота, камфорсульфоновая кислота, бензолсульфоновая кислота. Известно, что соединения, в которых имеется основной азот, могут образовывать комплексы со многими различными кислотами (как протонными, так и непротонными), и обычно является предпочтительным ввести соединение согласно настоящему изобретению в форме кислотно-аддитивной соли. Соединения согласно изобретению являются частичными агонистами эстрогена и проявляют высокое сродство к рецептору эстрогена. Однако, в отличие от многих эстрогенов, эти соединения не вызывают возрастания массы сырой ткани матки. При нахождении в матке эти соединения являются антиэстрогенами и могут полностью противодействовать трофическим воздействиям агонистов эстрогена в ткани матки. Эти соединения применимы при лечении или предотвращении состояний или синдромов заболеваний у млекопитающих, которые вызываются или связаны с недостатком эстрогена. Представленные соединения обладают способностью вести себя подобно агонистам эстрогена, снижая уровень холестерина и предотвращая разрежение кости. Следовательно, эти соединения применимы для печения многих заболеваний, включая остеопороз, гипертрофию простаты, бесплодие, рак молочной железы, рак внутренней поверхности матки, сердечно-сосудистые заболевания, контрацепцию, болезнь Альцгеймера и меланому. Кроме того, эти соединения могут использоваться для гормонозамещающей терапии в случаях женщин, находящихся в постклимактерическом периоде, или в случае других состояний, связанных с недостатком эстрогена, когда может быть полезной добавка эстрогена в организм. Соединения согласно настоящему изобретению могут также применяться в методах лечения разрежения кости, являющегося результатом дисбаланса у данного индивида между образованием новых костных тканей и рассасыванием более старых тканей, что ведет к сеточному разрежению кости. Такое истощение кости наступает у ряда индивидуумов, в частности, у женщин в постклимактерическом периоде, женщин, подвергшихся гистерэктомии, пациентов, которые подвергаются, или которые были подвергнуты различным видам расширенной кортикостероидной терапии, пациентов, испытывающих гонадную дисгенезию, и пациентов, страдающих от синдрома Кушинга. Использование этих соединений может также относиться к случаям специальной необходимости в восстановлении костей у пациентов с переломами костей, нарушенной структурой костей, и пациентов, подвергшихся хирургическому лечению, относящемуся к костям, и/или имплантации протезов. В дополнение к тем проблемам, которые описаны выше, эти соединения могут использоваться при печении остеоартрита, болезни Педжета, остеомаляции (размягчения костей), рака внутренней поверхности матки, множественной миеломы и других форм рака, оказывающих разрушительное влияние на ткани кости. Понятно, что способы печения перечисленных здесь заболеваний включают введение пациенту, который требует такого лечения, фармацевтически эффективного количества одного или более соединений согласно настоящему изобретению или его фармацевтически приемлемой соли. Настоящее изобретение включает также фармацевтические композиции, в которых используется одно или несколько из представленных соединений и/или их фармацевтически приемлемых солей, наряду с одним или несколькими фармацевтически приемлемыми носителями, эксципиентами и т.п. Понятно, что дозировка, режим и способ введения этих соединений будут изменяться в соответствии с заболеванием и с индивидуумом, который подвергается печению, и будут устанавливаться занимающимся этим вопросом практикующим врачом. Предпочтительным является, чтобы введение одного или нескольких из приведенных здесь соединений начиналось с низкой дозы и повышалось до тех пор, пока не будут достигнуты желаемые эффекты. Эффективное введение этих соединений может быть осуществлено в дозе, составляющей от около 0,1мг/день до около 1000мг/день. Предпочтительно, введение будет составлять от около 50мг/день до около 600мг/день, в разовой дозе или разделенное на две или большее число доз. Такие дозы могут вводиться любым способом, пригодным для того, чтобы направить описываемые здесь активные соединения в кровоток реципиента, включая пероральное, парентеральное (включая внутривенные, внутрибрюшинные и подкожные инъекции) и чрескожное введение. Следует понимать, что для целей настоящего описания понятие "чрескожное введение" включает любые способы введения через поверхность тела и внутренние покровы, включая эпителиальные и слизистые ткани. Введение такими способами можно проводить с использованием настоящих соединений или ихфармацевтически приемлемых солей, находящихся в лосьонах, кремах, пенах, пластырях, суспензиях, растворах и суппозиториях (ректальных и вагинальных). Составы для перорального введения, содержащие активные соединения согласно настоящему изобретению, могут содержать любые традиционно используемые пероральные формы, включая таблетки, капсулы, трансбуккальные формы, пастилки, лепешки и пероральные жидкости, суспензии или растворы. Капсулы могут содержать смеси активного соединения (соединений) с инертными наполнителями и/или разбавителями, такими как фармацевтически приемлемые крахмалы (например, кукурузный, картофельный крахмал, или тапиока), сахара, искусственные подсластители, порошкообразные целлюлозы, такие как кристаллические и микрокристаллические целлюлозы, различные виды муки, желатина, камеди и т.п. Пригодные составы в виде таблеток могут быть изготовлены стандартными способами спрессовывания, влажного гранулирования или сухого гранулирования, и в них могут использоваться фармацевтически приемлемые разбавители, связующие агенты, смазывающие вещества, измельчители, суспендирующие агенты или стабилизаторы, включая стеарат магния, стеариновую кислоту, тальк, лаурилсульфат натрия, микрокристаллическую целлюлозу, кальциевую соль карбоксиметил-целллюпозы, поливинилпирролидон, желатин, альгиновую кислоту, аравийскую камедь, ксантановую камедь, цитрат натрия, сложные силикаты, карбонат кальция, глицин, декстрин, сахарозу, сорбит, дикальцийфосфат, сульфат кальция, лактозу, каолин, маннит, хлорид натрия, тальк, безводные крахмалы и порошкообразный сахар, но не ограничиваясь указанными веществами. В описываемых здесь пероральных составах могут использоваться стандартные технологии, обеспечивающие задержку высвобождения или высвобождение в определенное время, чтобы изменить поглощение активного соединения (соединений). Составы для введения в виде суппозиториев могут быть изготовлены из традиционных веществ, включая масло какао, с добавлением или без добавления восков, чтобы изменить температуру плавления суппозиториев, и глицерина. Могут также использоваться растворимые в воде основы для суппозиториев, такие как полиэтиленгликоли различной молекулярной массы. Настоящее изобретение предусматривает также способ получения соединения формулы 1, который включает один из следующих методов: а) взаимодействие соединения формулы; где R1 -R, и X определены, как указано выше, с акриламидом формулы; где У определен как указано выше, с получением соединения формулы 1, где Z представляет собой СН=СН-СОУ; или в) взаимодействие соединения формулы; где R1-R6 и х определены как указано выше, с соединением формулы; где n и У определены как указано выше, с получением соответствующего соединения формулы 1, где Z представляет собой —С≡С—(CH2)n—Y. Соединения согласно настоящему изобретению могут быть удобным образом синтезированы в соответствии с общим направлением согласно схемам 1 и 2, данным ниже. Первоначальный синтез индола согласно схеме 1 выполняется путем нагревания соответствующим образом замещенного анилина (1) с соответствующим образом замещенным альфабромфенилпропиофеноном (2) в растворителе с достаточно высокой температурой кипения, таком как ДМФА (диметилформамид). Продукт реакции затем алкилируют 4-бромбензилбромидом с получением замещенного индола (3). На этом этапе производится снятие защиты фенолов (если она присутствует). Обычно фенолы защищаются путем использования их в виде бензиловых эфиров и могут быть удобным образом расщеплены при помощи иодтриметилсилана (TMS1). Получение акриламидов проводят в условиях реакции Хека (Heck reaction) либо в чистом Et3N, либо в Et3N/CH3CN. Первоначальный синтез индола согласно схеме 2 может быть выполнен путем нагревания соответствующим образом замещенного анилина (1) с соответствующим образом замещенным альфабромфенилалкилфеноном 1(2) в растворителе с достаточно высокой температурой кипения, таком как ДМФА. Продукт реакции затем алкилируют 4-иодбензилбромидом с получением замещенного индола (3). На этом этапе производится снятие защиты фенолов (если она присутствует). Обычно фенолы защищаются путем использования их в виде бензиловых эфиров и могут быть удобным образом расщеплены при помощи TMS1. Пропаргиламины обычно получают из алкинилбромида или алкинилтозилата путем замещения соответствующих амином. Реакция замещения выполняется in situ без выделения пропаргиламина. Соединения, замещенные в 3-положении иными, чем алкил, группами, могут быть получены путем получения в начале индола, замещенного в 3-положении группой -Н. Затем индол может быть подвергнут электрофильной реакции галогенирования, формилирования и т.п. с получением других 3-замещенных соединений. Растворители использовавшиеся в описываемых здесь реакциях, представляли собой безводные растворители фирмы Ald-rich Sure Seal ТМ, использовавшиеся без дальнейшей очистки. Применялись обычно реагенты производства фирмы Aldrich, которые использовались без дальнейшей очистки. Все реакции проводились в атмосфере азота. Хроматографию проводили с использованием силикагеля с размером зерна 230-400 меш (Merck Grade 60, Aldrich Chemical Company). Тонкослойную хроматографию выполняли на пластинках Silica Gel 60F254 производства ЕМ Science. Спектры 1H ЯМР получали на приборе Bruker АМ-400 в ДМСО (диметилсульфоксиде), и химические сдвиги даны в мпн-1. Температуры плавления определяли на приборе Томаса-Хувера (Thomas-Hoover apparatus), и они являются нескорректированными. ИК-спектры записывали на спектрофотометре Perkin-Elmer с дифракционной решеткой или на спектрофотометре Perkin-Elmer 784. Масс-спектры записывали на массспектрометре Kratos MS50 или на масс-спектрометре Finniqan 8230. Элементные анализы выполняли на элементном анализаторе Perkin-Elmer 2400. Полученные значения элементного анализа находятся в пределах отклонения в 0,4% от теоретического. Настоящее изобретение иллюстрируется далее следующими примерами, не являющимися ограничивающими. Пример 1 1 5-Бензилокси-2-(4-бензилоксифенил)-3-метил-1Н-индол Колбу заполняли 4-бензилоксианилином (45г, 0,23ммоль), 4'-бензипокси-2-бромфенилпропиофеноном (21г, 0,066ммоль) и диметилформамидом (ДМФА) (50мл). Реакционную смесь нагревали с обратным холодильником в течение 30 минут, после чего охлаждали до комнатной температуры, а затем проводили распределение между этилацетатом (EtOAc) (250мл) и 1 н. НСl (води.) (100мл). EtOAc промывали NaHC03 (води.) и рассолом, сушили над MqSO4. Раствор упаривали, и остаток поглощали СН2Сl2 и добавляли гексан с выпадением в осадок 25г неочищенного продукта в виде твердой фазы. Твердую фазу растворяли в СН2Сl2 и выпаривали на силикагеле и хроматографировали с использованием смеси СН2Сl2/гексан (1:5) с получением 9,2г светло-коричневой твердой фазы (33%): Т.пл.=150-152°С; 1H ЯМР (ДМСО) 10,88 (с, 1Н), 7,56 (д, 2Н, J=8,8 Гц), 7,48 (д, 4Н, J=7,9 Гц), 7,42-7,29 (м, 6Н), 7,21 (д, 1Н, J=7,0 Гц), 7,13 (д, 2Н, J=8,8 Гц), 7,08 (д, 1Н, J=2,2 Гц), 6,94 (дд, 1Н, J=8,8, 2,4 Гц), 5,16 (с, 2Н), 5,11 (с, 2Н), 2,33 (с, ЗН); ИК (КВr) 3470, 2880, 2820, 1620 см-1; MS el (масс-спектрометрия с электронной ионизацией) m/z 419. Пример 2 5-Бензилокси-2-(4-фторфенил)-3-метил-1Н-индол Указанное в заголовке соединение было получено подобно (3): Т.пп.=132°С; 1Н ЯМР (ДМСО) 11,0 (с, 1Н), 7,68-7,64 (м, 2Н), 7,49-7,47 (м, 2Н), 7,41-7,31 (м, 5Н), 7,23 (д, 1Н, J=8,8 Гц), 7,10 (д, 1Н, J=2,4 Гц), 6,82 (дд, 1Н, J=8,8, 2,4 Гц), 5,11 (с, 2Н), 2,34 (с, 3Н); MS El m/z 331; CHN (элементный состав) рассчитан для C22H18FNO. Пример 3 5-Бензилокси-2- (4-бензипоксифенил) -3-метил) -1-илметил-(4-фенилбромид)-индол Раствор 60% NаН (0,17г, 7,1ммопь) в ДМФА (20мл) охлаждали до О°С и обрабатывали путем добавления по каплям бензилоксииндола 1 (2,5г, 5,94ммоль) в ДМФА (10мл).Через 15 минут добавляли по каплям 4'-бромбензилобромид (1,63г, 6,53ммоль) в ДМФА (10мл). Реакционную смесь перемешивали в течение 5 минут при О°С и затем дополнительно 20 минут при комнатной температуре. Реакционную смесь разбавляли эфиром (300мл) и промывали NН4Сl (2x25мл), затем NaHCO3 (1x25мл) и рассолом (25мл). Органические экстракты сушили над MqSO. и упаривали. Остаток кристаллизовали из смеси тетрагидрофуран/гексан с получением 2,7г (77%) соединения 2: Т.пп.=144-146°С; 1Н ЯМР (CDCl3) 7,51-7,36 (м, 8Н), 7,34 (д, 4Н, J=8,6 Гц), 7,20 (д, 2Н, J=8,8 Гц), 7,15 (д, 1Н, J=2,4 Гц), 7,03-7,00 (м, ЗН), 6,89 (дд, 1Н, J=8,8, 2,4 Гц), 6,80 (д, 2Н, J=8,6 Гц), 5,14 (с, 2Н), 5,12 (с, 2Н), 5,09 (с, 2Н), 2,25 (с, 3Н); ИК (КВr) 3400, 3020, 1600см-1; МS el m/z 587. Пример 4 5-Бензилокси-2-(4-фторфенил)-3-метил)-1-илметил-(4-фенилбромид)-индол Указанное в заголовке соединение было получено подобно соединению (5): Т.пл. =139-139,5°С; 1Н ЯМР (ДМСО) 7,49-7,46 (м, 2Н), 7,41-7,37 (м, 6Н), 7,33-7,27 (м, 4Н), 7,24 (д, 1Н, J=8,8 Гц), 7,16 (д, 1Н, J=2,2 Гц), 6,84 (дд, 1Н, J=8,8, 2,4 Гц), 6,73 (д, 1Н, J=8,6 Гц), 5,2 (с, 2Н), 5,12 (с, 2Н),2,15 (с, 3Н); ИК (КВr) 2920, 1630 см-1; МS el m/z (499/501, присутствует Вr); CHN рассчитан для C29H23BrFNO. Пример 5 2-(4-гидроксифенил)-3-метил)-1-илметил-(4-фенилбромид)-индол-5-оп Раствор, состоящий из соединения 5 (0,5г, 0,85ммоль) в СН2С12 (10мл) обрабатывали путем добавления по каплям 3,5 эквивалента TMS1 (0,47мл, 3,0ммоль) при комнатной температуре. Через пару часов реакцию останавливали, добавляли 2,2 эквивалента TMSl и реакционную смесь нагревали с обратным холодильником в течение 5 часов. Реакционную смесь охлаждали до 0°С и медленно добавляли метанол, чтобы загасить реакцию. Реакционную смесь разбавляли эфиром (25мл) и промывали NаНСО3 (25мл), 10% Na2SO3 (25мл) и рассолом. Эфирный спой сушили над MqSO4 и упаривали на силикагеле. Хроматография смесью ЕtОАс/гексан (от 1:4 до 1:1) давала 0,25г соединения 3 (71%): Т.пл.=83-86°С; 1Н ЯМР (GDC13) 2 линии H из фенолов ушир. (>10), с 7,35 (д, 2Н, J=9,0 Гц), 7,15 (д, 2Н, J=8,8 Гц), 7,01 (дд, 1Н, J=2,4, 0,4 Гц), 6,86 (д, 2Н, J=8,8 Гц), 6,80 (д, 1Н, J = 8,6 Гц), 6,72 (дд, 1Н, J =8,6, 2,4 Гц), 5,10 (с, 2Н), 4,88 (с, 1Н), 4,50 (с, 1Н), 2,21 (с, 3Н); MS el m/z. 407/409, содержит Вr; ИК 3390, 2900, 1600 см-1; CHN рассчитан для С22Н18ВгNО + 0,25 EtOAc. Пример 6 2-(4-фторфенил)-3-метил)-1-илметил-(4-фенилбромид) индол-5-оп Указанное в заголовке соединение было получено подобно соединению 7 и выделено в виде пены. 1H ЯМР (ДМСО) 8,79 (с, 1Н), 7,39-7,34 (м, 4Н), 7,32-7,30 (м, 3Н), 7,11 (д, 1H,J=8,8 Гц), 6,85 (д, 1Н, J=2,2 Гц), 6,74 (д, 1Н, J=2,4 Гц), 6,63 (дд, 1Н, J=8,6, 2,2 Гц), 5,16 (с, 2Н), 2,11 (с, 3Н); ИК (КВr) 3400, 2900, 1630см-1; MS el m/z 409/411 содержит Вr. Общая методика получения индолсодержащих акриламидов Раствор соединения из примера 3 в Et3N обрабатывали три-о-толилфосфином (10% мольн.), проводили глубокую продувку акриламида (1,25 эквивалента) N2 и добавляли Pd(OAc)2 (2,5% мольн.). Реакционную смесь нагревали при 100-110°С в герметизированной трубке до завершения реакции в соответствии с данными анализа методом тонкослойной хроматографии. Неочищенный продукт реакции упаривали и либо непосредственно кристаллизовали, либо хроматографировали на силикагеле. Пример 7 (Е)-N,N-Диэтил-3- { 4- [5-гидрокси-2- (4-гидроксифенил) -3-метилиндол-1-ипметил] фенил } акриламид Т.пл.=160-165°С; 1Н ЯМР 9,67 (с, 1Н), 8,72 (с, 1Н), 7,50 (д, 2Н, J=8,1 Гц), 7,37 (д, 1Н, J=15,4 Гц), 7,17 (д, 2Н, J=8,3 Гц), 7,06 (д, 1Н, J=8,8 Гц), 6,97 (д, 2Н, J=15,4 Гц), 6,86-6,82 (м, 5Н), 6,58 (дд, 1Н, J=8,6, 2,2 Гц), 5,19 (ушир, с, 2Н), 3,47-3,42 (м, 2Н), 3,34-3,30 (м, 2Н), 2,09 (с, 3Н), 1,10 (т, 3Н, J=7,0 Гц), 1,03 (т, 3Н, 1=7,0 Гц); ИК (КВr) 3300, 295О, 1660, 1580 см-1; MS (el) m/z 454; СНN рассчитан для C29H30 N2O3+0,15 CH2Cl2+0,30 Н2O. Пример 8 1 (Е) -N-трет-бутил - 3 {-4- [5-гидрокси-2- (4-гидроксифенил) -3-метилиндол-1-илметил] фенил} акриламид Т.пл.=168-170°С; 1Н ЯМР 9,66 (с, 1Н), 8,71 (с, 1Н), 7,66 (с, 1Н), 7,34 (д, 2Н, J=8,3 Гц), 7,24 (д, 1Н, J=15,8 Гц), 7,15 (д, 2Н, J=8,3 Гц), 7,05 (д, 1H,J=8,6 Гц), 6,85-6,82 (м, 5Н), 6,59-6,56 (м, 1Н), 6,55 (д, 1Н, J=16,0 Гц), 5,18 (с, 2Н), 2,11 (с, 3Н), 1,28 (с, 9Н); ИК (КВr) 3350, 2950, 1660, 1620 см-1: МS (el) m/z 454; СNН рассчитан для C29H30 N2O3 + 0,4 Н2O. Пример 9 (Е) -Пирролидино-3- { 4- [5-гидрокси-2- (4-гидроксифенил) -3-метилиндол-1-илметил] фенил } акриламид Т.пл.=170-175°С; 1Н ЯМР 9,67 (с, 1Н), 8,71 (с, 1Н), 7,49 (д, 2Н, J=8,1 Гц), 7,35 (д, 1Н; J=15,4 Гц), 7,16 (д, 2Н, J=8,6 Гц), 7,05 (Д, 1Н, J=8,8 Гц), 6,88-6,81 (м, 6Н), 6,57 (дд, 1Н, J=8,6, 2,2 Гц), 5,19 (ушир, с, 2Н) , 3,56 (т, 2Н, J=6,6 Гц), 3,35 (м, 2Н), 2,11 (с, 3Н), 1,87 (п, 2Н, J=7,0 Гц), 1,77 (п, 2Н, J=7,0 Гц); МS m/z 452; СНN рассчитан для C29H28N2O3+0,1 МеОН+1,3 Н2O. Пример 10 (Е) -N,N-Диметил-3-{4- [5-гидрокси-2- (4-гидроксифенил) -3-метилиндол-1-илметил] фенил } акриламид Т.пл.=278-280°С; 1Н ЯМР (ДМСО) 9,65 (с, 1Н), 8,70 (с, 1Н), 7,50 (д, 2H, J=8,1 Гц), 7,33 (д, 1Н, J=15,4 Гц), 7,15 (д, 2Н, J =8,6 Гц), 7,07 (д, 1Н, Л=15,6 Гц), 7,05 (д, 1Н, J=8,8 гц), 6,85-6,80 (м, 5Н), 6,57 (дд, 1Н, J =8,6, 2,4 Гц), 5,19 (с, 2Н), 3,09 (с, 3Н), 2,88 (с, 3Н), 2,11 (с, 3Н); MS el m/z 426; ИК (КВr) 3410, 3220, 1650, 1580 см1 ; CHN рассчитан дня C27H26 N2O3+0,5 Н2O. Пример 11 (Е) -N,N-Дибутил-3-{4- [5-гидрокси-2- (4-гидроксифенил) -3-метилиндол-1-илметил] фенил } акриламид Т.пл.=126-128°С: 1Н ЯМР (ДМСО) 9,65 (с, 1Н), 8,70 (с, 1Н), 7,48 (д, 2H,J=8,3 Гц), 7,36 (д, 1Н, J=15,2 Гц), 7,16 (д, 2Н, J=8,6 Гц), 7,05 (д, 1Н, J=8,6 Гц), 6,97 (д, 1Н, J=15,2 Гц), 6,86-6,81 (м, 5Н), 6,57 (дд, 1Н, J =8,8, 2,4 Гц), 5,19 (с, 2Н), 3,39 (т, 2Н, J=7,0 Гц), 3,29 (т, 2Н, J=7,2 Гц), 2,11 (с, 3Н), 1,48-1,43 (м, 4Н), 1,29-1,20 (м, 4Н),0,87 (т, 6Н), J=7,2 Гц); MS el m/z 510; ИК (КВr) 3300, 2920, 2900, 2850, 1650, 1625, 1580см; CHN рассчитан для С33Н38N2O3. Пример 12 (Е) -N-Бутил, N'-метил-3-{4-[5-гидрокси-2- (4-гидрокси-фенил)-3-метилиндол-2-илметил] фенил} акриламид Т.пл.=240-242°С; 1Н ЯМР (ДМСО) 9,66 (с, 1Н), 8,70 (с, 1Н), 7,50 (д, 2Н, J =8,1 Гц), 7,38-7,32 (м, 1Н), 7,16 (д, 2Н, J=6,8 Гц), 7,06-7,01 (м, 2Н) , 6,85-6,81 (м, 5Н) , 6,57 (дд, 1Н, J=8,6, 2,2 Гц), 5,19 (с, 2Н), 3,44, 3,33 (2 т, 2Н, J=7,2 Гц), 3,06, 2,87 (2 с, 3Н), 2,11 (с, 3Н), 1,45 (м, 2Н), 1,24 (п, 2Н, J=7,5 Гц), 0,87 (т, 3Н, J =7,2 Гц); MS el m/z 468; ИК (КВr) 3300, 1660, 1590см-1; CHN рассчитан для C30H32 N2O3+0,2 H2O. Пример 13 (Е) –Морфолино -3-{4- [5-гидрокси-2-(4-гидроксифенил)-3-метилиндол-1-илметил] фенил} акриламид Т.пл.=165-167°С; 1Н ЯМР (ДМСО) 9,66 (с, 1Н), 8,71 (с, 1Н), 7,52 (д, 2Н, J =8,1 Гц), 7,39 (д, 1Н, J =15,4 Гц), 7,15 (д, 2Н, J=8,6 Гц), 7,12 (д, 1Н, J =15,4 Гц), 7,06 (д, 1Н, J=8,6 Гц), 6,85-6,81 (м, 5Н) , 6,57 (дд, 1Н, J=8,6, 2,2 Гц), 5,19 (с, 2Н), 3,65-3,64 (м, 2Н), 3,59-3,53 (м, 6Н), 2,11 (с, 3Н); ИК (КВr) 3330, 1650, 1620, 1580 см-1; МS (бомбардировка быстрыми атомами) m/z 469 (М+Н+); СНN рассчитан для C29H28 N2O4 + 0,5 H2O Пример 14 (Е) -3-{4- [5-гидрокси-2- (4-гидроксифенил) -3-метилиндол-1-илметил] фенил} акриламид Т.пл.=161-163°С, 1Н ЯМР (ДМСО) 9,65 (с, 1Н), 8,70 (с, 1Н), 7,48 (с, 1Н), 7,37 (д, 2Н, J=8,35 Гц), 7,30 (д, 1Н, J=15,8 Гц), 7,14 (д, 2Н, J=8,35 Гц), 7,04 (д, 2H,J=8,6 Гц), 6,85-6,81 (м, 5Н), 6,57 (дд, 1Н, J=8,8, 2,4 Гц), 6,48 (д,1Н, J=15,8 Гц), 5,18 (с, 2Н), 2,10 (с, 3Н); ИК (КВr) 3320, 3180, 1660, 1580см-1; МS (бомбардировка быстрыми атомами) m/z 399 (М+Н+); CHN рассчитан для C25H22 N2O3+1,3 H2O Пример 15 (E) -N, Метил-3- {4- [5-гидрокси-2-(4-гидроксифенил) -3-метилиндол-1-илметил] фенил} акриламид Т.пл.=155-158°С; 1Н ЯМР (ДМСО) 9,64 (с, 1Н), 8,70 (с, 1Н), 7,99 (кв, 1Н, J=4,4 Гц), 7,37 (д, 2Н, 3=8,1 Гц), 7,30 (д, 1Н, J=15,8 Гц), 7,14 (д, 2Н, 3=8,6 Гц), 7,03 (д, 1Н, J=8,6 Гц), 6,85-6,81 (м, 5Н), 6,57 (дд, 1Н, J=8,6, 2,4 Гц), 6,48 (д, 1Н, J=15,8 Гц), 5,18 (с, 2Н), 2,66 (д, 3Н, J=4,6 Гц), 2,10 (с, 3Н); ИК (КВr) 3400, 1660, 1620 см-1; MS el m/z 412; CHN рассчитан для C26H24N2O2. Пример 16 (Е) -N, М-Дибутил-3-{4- [5-гидрокси-2- (4-фторфенил) -3-метилиндол-1-илметил] фенил} акриламид Т.пл.=180°С; 1Н ЯМР (ДМСО) 8,77 (с, 1Н) , 7,48 (д, 2Н, J=8,4 Гц), 7,41-7,38 (м, 3Н), 7,38-7,29 (м, 3Н), 7,13 (д,1Н, J=8,8 Гц), 6,97 (д, 1Н, J=15,4 Гц), 6,85 (д, 1H,J=2,4 Гц), 6,80 (д, 2Н, J =8,1 Гц), 5,2 (с, 2Н), 3,403,36 (м, 2Н), 3,30-3,27 (м, 2Н), 2,10 (с, 3Н), 1,50-1,40 (м, 4Н), 1,29-1,21 (м, 4Н), 0,86 (т, 6Н), J =7,2 Гц); ИК (КВr) 3180, 2950, 2900, 2850, 1650, 1590 см-1; MS el m/z 512: СHN рассчитан для C33H37N2O2. Пример 17 (Е) -N-Бутил, N′-метил-3- {4- [5-гидрокси-2- (4-фторфенил) -3-метилиндол-1-илметил] фенил} акриламид Т.пп.=153-153,5°С; 1Н ЯМР (ДМСО) 8,77 (с, 1Н), 7,50 (д, 2Н, J=8,1 Гц), 7,42-7,36 (м, 2Н), 7,35-7,28 (м, 3Н), 7,13 (д, 1H,J=8,8 Гц), 7,03 (дд, 1Н, J=15,4, 2,6 Гц), 6,84 (д, 1Н, J=2,4T4), 6,80 (д, 2Н, J=8,1 Гц) , 6,62 (дд, 1Н, J=8,8, 2,4 Гц), 5,21 (с, 2Н), 3,44, 3,41 (2 т, 2H,J=7,0 Гц), 3,06, 2,87 (2 с, 3Н), 2,10 (с, 3Н), 1,49-1,42 (м, 2Н), 1,27-1,20 (м, 2Н), 0,86 (т, 3Н); ИК (КВr) 3300, 2950, 2860, 1645, 1580 см-1; MS el т/z 470; СНN рассчитан для С30H31FN2O2. Пример 18 5-Бензилокси-2-(4-бензилоксифенил)-3-метил-1Н-индол Колбу заполняли 4-бензилоксианилином (45г, 0,23моль), 4'-бензилокси-2-бромфенилпропиофеноном (21г, 0,066ммопь) и диметилформамидом (ДМФА) (50мл). Реакционную смесь нагревали с обратным холодильником в течение 30 минут, после чего охлаждали до комнатной температуры, а затем проводили распределение между EtOAc (250мл) и 1н. НС1 (води.) (100мл). EtOAc промывали NаНСО3, (води.) и рассолом, сушили над МgSO4. Раствор упаривали и остаток поглощали СН2Сl2 и добавляли гексан с выпадением в осадок 25г неочищенного продукта в виде твердой фазы. Твердую фазу растворяли в СH2СІ 2 и выпаривали на силикагеле и хроматографировали с использованием смеси СН2Сl2/гексан (1:5) с получением 9,2 г светло-коричневой твердой фазы (33%): Т.пп.=150-152°С; H ЯМР (ДМСО) 10,88 (с, 1Н), 7,56 (д, 2Н, J=8,8 Гц), 7,48 (д, 4Н, Л=7,9 Гц), 7,42-7,29 (м, 6Н) , 7,21 (д, 1Н, J=7,0 Гц), 7,13 (д, 2Н, .1=8,8 Гц), 7,08 (д, 1H,J=2,2 Гц), 6,94 (дд, 1Н, J=8,8, 2,4 Гц), 5,16 (с, 2Н), 5,11 (с, 2Н), 2,33 (с, 3Н); ИК (КВr) 3470, 2880, 2820, 1620см-1; MS el т/z 419. Пример 19 5-Бензилокси-2-(4-бензилоксифенил)-3-метил)-1-илметил-(4-фенилиодид)-индол Раствор соединения 4 (3,0г, 7,4ммопь) в ДМФА (25мл) обрабатывали NaH (60% дисперсия, 0,21г, 8,9ммопь) и перемешивали при комнатной температуре в течение 15 минут. Добавляли 4иодбромбензилбромид и реакционную смесь перемешивали в течение 1 часа. Реакционную смесь выпивали в воду и экстрагировали EfOAc, сушили над MgSO4 и упаривали. Растирание неочищенного продукта с эфиром давало 2,2г продукта в виде белого твердого вещества: Т.пл.=153-15б°С; H ЯМР (ДМСО) 7,54 (д, 2Н, J=8,6 Гц), 7,52-7,45 (м, 4Н), 7,37-7,29 (м,6Н), 7,27 (д, 2Н, J=8,8 Гц), 7,17 (д, 1Н, J=9,0 Гц), 7,13 (д, 1Н, J=2,2 Гц), 7,10 (д, 2Н, J=8,8 Гц), 6,81 (дд, 1Н, J=8,8, 2,4 Гц), 6,60 (д, 2Н, J=8,3 Гц), 5,18 (с, 2Н) , 5,12 (с, 2Н) , 5,11 (с, 2Н) , 2,15 (с, 3Н); MS el m/z 635. Пример 20 2-(4-Гидроксифенил)-3-метил)-1-илметил-(4-фенилиодид)-индол-5-ол Раствор соединения 4 (2,2г, 3,5ммоль) в СНСl- обрабатывали иодтриметилсиланом (1,04мл, 7,0ммоль) и реакционную смесь нагревали с обратным холодильником. Через 2 часа добавляли дополнительно 3 эквивалента иодтриметилсилана и реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Реакцию гасили добавлением МеОН (5мл). Органический спой промывали водным 10% раствором Nа2SО3, НСl (1M) и сушили над MgSO. Раствор упаривали и хроматографировали на силикагеле смесью EtOAc/гексан (3:7) с получением соединения 4а в виде пены (1,2г): H ЯМР 9,65 (с, 1Н), 8,71 (с, 1Н), 7,54 (д, 2Н, J=8,3 Гц), 7,12 (д, 2Н, J=8,3 Гц), 7,02 (д, 1Н, J=8,6 Гц), 6,84-6,80 (м, 3Н), 6,61 (д, 2Н ,J=8,3 Гц), 6,57 (дд, 1Н, J=6,4 Гц), 5,12 (с, 2Н), 2,09 (с, 3Н); МS el m/z 455. Общая методика приготовления индолсодержащих пропаргиламинов Указанные в заголовках примеров 21-23 соединения получали с использованием раствора, содержащего 10-кратный мольный избыток вторичного амина в ДМФА, охлажденного до 0°С и обработанного пропаргилбромидом (3 эквивалента, 80% раствор в толуоле). Через 1 ч выдерживания при 0°С реакционной смеси давали нагреться до комнатной температуры в течение 1 ч. Добавляли индопиодид (4а, 1 эквивалент), после чего добавляли CU(1)1 (0,1 эквивалента) Pd(PPh3)2Cl2 (0,035 эквивалента). Реакционную смесь затем перемешивали 16-48 часов и обрабатывали путем выливания в воду и экстракции в EtOAc. EtOAc упаривали и хроматографировали на силикагеле, используя в качестве элюирующей системы смесь EtOAc/гексан. Пример 21 2- (4-Гидроксифенил) -3-метил-1- [4- (3-N,N-диметил-1-илпроп-1-инил) бензил.]-1Н-индол-5-ол Т.пл.=173-176°С; 1Н ЯМР (ДМСО) 9,64 (с, 1Н), 8,70 (с, 1Н), 7,25 (д, 2Н, J=8,1 Гц), 7,12 (д, 2Н, 1=8,3 Гц), 7,03 (д, 1Н, J=8,6 Гц), 6,83-6,78 (м, 5Н) , 6,57 (дд, 1H,J=8,8, 2,4 Гц), 5,17 (с, 2Н), 3,39 (с, 2Н), 2,19 (с, 6Н), 2,10 (с, 3Н); ИК (КВr) 3390, 1490 см-1; MS esl 411 (М+Н1). Пример 22 2- (4-Гидроксифенил) - 3-метил-1 – [.4- (3 -пиперидин-1 -илпрол-1 -инил) бензил] -1Н-индол-5-ол Т.пл.=118-123°С; 1Н ЯМР (ДМСО) 9,65 (с, 1Н), 8,71 (с, 1Н), 7,24 (д, 2Н, J=8,1 Гц), 7,12 (д, 2Н, J=8,6 Гц), 7,02 (д, 1Н, J=8,6 Гц), 6,83-6,80 (м, 5Н), 6,57 (дд, 1Н, J=8,6, 2,2 Гц), 5,17 (с, 2Н), 3,39 (с, 2Н), 2,41 (м, 4Н), 2,10 (с, 3Н), 1,48 (п, 4Н, J=5,7 Гц), 1,36-1,33 (м, 2Н); ИК (КВr) 3400, 2920, 1620, 1420 см-1; МS El m/z 450; CHN рассчитан для C30H30N2O2+0,25 H2O. Пример 23 2-(4-Гидроксифенил)-3-метил-1-[4-(3-пирролидин-1-илпроп-1-инил) бензил]-1Н-идол-5-ол (5с) Т.пл.=174-176°С; 1Н ЯМР (ДМСО) 9,64 (с, 1Н), 8,70 (с, 1Н), 7,23 (д, 2Н, 1=8,3 Гц), 7,11 (д, 2Н, J=8,6 Гц), 7,02 (д, 1Н, J=8,8 Гц), 6,84 (м, 5Н), 6,57 (дд, 1Н, J=8,6, 2,2 Гц), 5,17 (с, 2Н), 3,53 (с, 2Н), 2,53-2,51 (м, 4Н), 2,09 (с, 3Н), 1,69-1,66 (м, 4Н); ИК (КВr) 3400, 2920, 2900, 1620 см-1;MS ei m/z 436; CHN рассчитан для C29H28N2O2+0,7 H2O Биологические методы Испытание на связывание рецептора эстрогена in vitro Приготовление рецептора Клетки яичника китайского хомячка, дающие сверх экспрессию рецептора эстрогена, выращивали в чашках площадью 150мм2 в составе из модифицированной по способу Дульбекко среды Игла F12 + 10% очищенной покрытым декстраном древесным углем фетальной коровьей сыворотки. Чашки дважды промывали физиологическим раствором с фосфатным буфером и один раз - 10мМ Tris-HCl, pH 7,4, 1мМ этипендиамминтетрауксусной кислотой (ЭДТК). Клетки собирали из культуры путем соскоба с поверхности и затем суспензию клеток помещали на лед. Клетки разрушали при помощи портативной механизированной дробилки, применяя обработку в два захода по 10 секунд. Сырой (неочищенный) препарат центрифугировали при 12000 g в течение 20 минут, после чего проводили вращение в течение 60 минут при 100000 g с получением свободного от рибосом цитозоля. Затем цитозоль замораживали и хранили при -80°С. Концентрацию белка в цитозоле оценивали с использованием испытания ВСА со стандартным белком сравнения. Условия испытания на связывание Конкурентный анализ выполняли в 96-пуночном планшете (полистирол), который связывает (иммобилизует) 30% при 500-кратной концентрации конкурента. Описание этих методов см. в Hulme, E.G., ed. 1992. Receptor-Liqand Interactions: A Practical Approach. IRL Press, New York. (см. в особенности главу 8). Щелочно-фосфатазный анализ клеток Ишикавы Сохранение и обработка клеток Клетки Ишикавы сохраняли в составе из модифицированной по способу Дульбекко среды Игла F12 (50%:50%), содержащей феноловый красный, +10% фетальной коровьей сыворотки, и среду дополняли 2мМ Гпутамаксом (Glutamax), 1% Pen/Strap и 1мМ пируватом натрия. За пять дней перед началом каждого эксперимента (обработки клеток) среду заменяли на соетав из не содержащей феноловый красный модифицированной по способу Дульбекко среды Игла F12+10% очищенной покрытым декстраном древесным углем сыворотки. В день перед обработкой клетки собирали из культуры, используя 0,5% трипсин/ЭДТК, и 4 помещали с плотностью 5x10 клеток на ячейку в 96-луночный планшет для культивирования тканей. Испытуемые соединения дозировали в концентрации 10-6,10-7 и 10-8М в дополнение к комбинации 10-6M (соединение) + 10-9M 17β-эстрадиол, чтобы оценить способность соединений к выполнению функции антиэстрогенов. Клетки обрабатывали в течение 48 часов перед испытанием. Каждый 96-луночный планшет содержал контрольный образец 17β-эстрадиола. Число популяций для образца при каждой дозе составляло n=8. Щелочно-фосфатазный анализ По окончании 48 ч среду отсасывали и клетки промывали три раза физиологическим раствором с фосфатным буфером. К каждой лунке добавляли 50мкп лизисного буфера (0,1M Tris-НС1, pH 9,8, 0,2% Triton X-100). Планшеты выдерживали при –80°С в течение, как минимум, 15 минут. Планшеты размораживали при 37°С, после чего добавляли 150мл 0,1 M Tris-HCl, pH 9,8, содержащего 4мМ паранитрофенилфосфат (pNPP), к каждой лунке (конечная концентрация пара-нитрофенилфосфата 3мМ). Расчеты спектральной поглощательной способности и наклонов кривых проводили с использованием программы KineticCalc Application (Bio-Tek Instruments, Inc., Winooski, VT). Результаты выражены в виде среднее значение +/- стандартное отклонение скорости ферментативной реакции (наклон), усредненной по линейной части кинетической кривой реакции (считывание показаний оптической плотности каждые 5 минут в течение 30-минутного периода считывания показаний спектральной поглощательной способности). Результаты для соединений суммированы в виде значения отклика, выраженного в процентах по отношению к 1нМ 17β-эстрадиолу. Различные соединения испытывали на эстрогенную активность методом щелочной фосфатазы, и рассчитывали соответствующие значения эффективной дозы ED50 (95% С.І.)- В следующем списке перечислены соединения, использовавшиеся в качестве эталонов: 1β-эстрадиол 0,03нМ 17а-эстрадиол 1,42нМ эстриол 0,13нМ эстрон 0,36нМ Описание таких методов представлено в работах Holinka, С.F., Hata, H., Kuramoto, H. and Gurpide, E. (1986). Effects of steroid hormones and antisteroids on alkaline phosphatase activity in human endometrial cancer cells (Ishikawa Line). Cancer Research, 46:2771-2774, и Littlefield, B.A., Gurpide, E., Markiewicz, L., McKinley, B. and Hochberq, R.B. (1990). A simple and sensitive microtiter plate estroqen bioassay based Qn stimulation alkaline phosphatase in Ishikawa cells; Estroqen action of D5 adrenal steroids. Endocrinoloqy, 6:27572762. Испытание на трансфекцию 2Х VIT ERE Сохранение и обработка клеток Клетки яичника китайского хомячка, которые были подвергнуты устойчивой трансфекции рецептора эстрогена человека, сохраняли состав из в модифицированной по способу Дульбекко среде Игла + 10% фетальной коровьей сыворотки. За 48 часов до обработки питательную среду заменяли на состав из не содержащей феноловый красный модифицированной по способу Дульбекко среды Игла F12 + 10% очищенной покрытым декстраном древесным углем фетальной коровьей сыворотки (среда для обработки). Клетки помещали с плотностью 5000 клеток на лунку в 96-луночный планшет, содержащий 200мкл среды на лунку. Трансфекция с фосфатом кальция Репортер-ДНК, т.е., перемещаемую ДНК (плазмида Promega pGL2, содержащая две парных копии вителлогенина ERE в присутствии минимального промотора типа тимидинкиназы, управляющего геном люциферин-монооксигеназы) объединяли с экспрессирующей В-галактозидазу плазмидой pCH110 (Pharmacia) и носителем ДНК (pTZISU) в следующем соотношении: 10мкг репортер-ДНК 5мкг ДНК рСН110 5мкг pTZ18U 20мкг ДНК на 1мл трансфекционного раствора ДНК (20мкг) растворяли в 500мкп 250мМ стерильного СаСl2 и по каплям добавляли 500мкп 2 X HeBS (0,28M NaCl, 50мМ N-2-гидроксиэтилпиперазин-N'-2-этансульфоновая кислота, 1,5мМ Na2 HPO4, pH 7,05) и инкубировали при комнатной температуре в течение 20 минут. 20мкл этой смеси добавляли к каждой лунке с клетками и оставляли для воздействия на клетки в течение 16 часов. По окончании этой инкубации осадок удаляли, клетки промывали средой, производили замену на свежую среду для обработки и обрабатывали клетки либо носителем, 1нМ 17β-эстрадиопом, 1мкМ соединением, либо комбинацией 1мкМ соединения + 1нМ 17β-эстрадиопа (испытания на антагонизм к эстрогену). Обработку при каждом варианте условий выполняли в 8 лунках (n=8), которые инкубировали в течение 24 часов перед испытанием на люциферин-монооксигеназу. Испытание на люциферин-монооксигеназу По прошествии 24 часов воздействия на соединения среду удаляли и каждую лунку промывали 2кратно 125мкл физиологического раствора с фосфатным буфером, не содержащего Mg++ и Са++. После удаления физиологического раствора с фосфатным буфером в каждую лунку добавляли 25мкл лизисного буфера Promeqa и оставляли на 15 минут при комнатной температуре/а затем на 15 минут при -80°С и на 15 минут при 37°С. 20мкл лизата перемещали в непрозрачный 96-пуночный планшет для оценки активности люциферин-монооксигеназы, а остальной лизат (5мкл) использовали для оценки активности Вгалактозидазы (нормализации трансфекции). Субстрат люциферана (Promega) автоматически добавляли к каждой лунке в виде аликвоты в 100мкл при помощи люминометра и в течение 10 секунд после добавления считывали полученный световой поток (в относительных световых единицах). Испытание на В-галактозидазу К оставшимся 5мкп лизата добавляли 45мкл физиологического раствора с фосфатным буфером. Затем добавляли 50мкл буфера Promeqa для испытания 2Х на В-галактозидазу, хорошо перемешивали и инкубировали при 37°С в течение 1 часа. Для каждого отдельного эксперимента подготавливали планшет, содержащий калибровочную кривую (значения от 0,1 до 1,5 миллиединиц, взятые троекратно каждое). Планшеты анализировали на спектрофотометрическом планшет-ридере Molecular Devices при 410 нм. Оптические плотности в качестве неизвестных величин преобразовывали в миллиединицы активности путем математической экстраполяции калибровочной кривой. Анализ результатов Данные испытания на люциферин-монооксигеназу получали в виде относительных световых единиц, которые накапливались в течение 10 секунд измерений и автоматически преобразовывались в файл JMP (SAS Ine), где производилось вычитание значений фона в относительных световых единицах. Данные пробы на В-галактозидазу автоматически импортировались в файл и эти значения делились на значения относительных световых единиц, чтобы провести нормализацию данных. Средние значения и стандартные отклонения определяли из n=8 для каждого варианта обработки, активность соединений сравнивали с 17β-эстрадиолом для каждого планшета. Величину активности в процентах по отношению к 17β-эстрадиолу рассчитывали с использованием формулы % = ((контрольное значение для эстрадиола)/ (значение для соединения)) х 100. Эти методики описаны в работе Tzukerman, М.Т., Esty, A., Santiso-Mere, D., Danielian, P., Parker, M.G., Stein, R.В., Pike, J.W. and McDonnel, D.P. (1994).Трансактивационная способность рецептора эстрогена человека определялась как в клеточном окружении, так и в окружении промотора, и была опосредована двумя функционально различными внутримолекулярными областями (см. Molecular Endocrinology, 8:21-30). Утеротрофическое / антиутеротрофическое биологическое испытание на крысах Эстрогенные и антиэстрогенные свойства соединений определяли в утеротрофическом испытании (4 дня) на незрелых крысах (как описано ранее в работе L.J. BlacK and R.L. Goode, Life Sciences,26, 1453 (1980). Незрелые крысы линии Sprague Dawley) (самки, возраст 18 дней) подвергались испытаниям группами по шесть особей. Животные подвергались обработке путем ежедневной внутрибрюшинной инъекции 10мкг соединения, 100мкг соединения, (100мкг соединения + 1мкг 17β-эстрадиола) для проверки на антиэстрогенность, и 1мкг 17β-эстради-ола, совместно с 50% ДМСО/50% физиологического раствора в качестве носителя инъекции. На 4-й день животных умерщвляли путем асфиксии СО 2 и их матки удаляли и снимали избыток липида, удаляли все виды жидкости и определяли вес сырой ткани. Небольшую часть одного рога подвергали гистологическим исследованиям, а остаток использовали для выделения всей РНК для того, чтобы оценить экспрессию гена 3 компонента хромосомного набора.
ДивитисяДодаткова інформація
Назва патенту англійськоюOestrogen remedies, method of production thereof, pharmaceutical composition and method of treatment
Назва патенту російськоюЭстрогенные средства, способ их получения, фармацевтическая композиция и способ лечения
МПК / Мітки
МПК: C07D 209/12, C07D 209/10, A61K 31/403, A61K 31/404, A61K 31/40, A61K 31/535
Мітки: засоби, спосіб, композиція, естрогенні, лікування, отримання, фармацевтична
Код посилання
<a href="https://ua.patents.su/15-47413-estrogenni-zasobi-sposib-kh-otrimannya-farmacevtichna-kompoziciya-ta-sposib-likuvannya.html" target="_blank" rel="follow" title="База патентів України">Естрогенні засоби, спосіб їх отримання, фармацевтична композиція та спосіб лікування</a>
Попередній патент: Фармацевтична аерозольна композиція (варіанти), спосіб виготовлення такої композиції, спосіб лікування респіраторних захворювань
Наступний патент: Спосіб збору та накопичення вимірювальних даних, пристосованих і/або не пристосованих до перевіряння, та пристрій для його здійснення
Випадковий патент: Спосіб лікування хронічного неспецифічного виразкового коліту