9a-заміщені естратриєни як естрогени вибірної дії
Номер патенту: 78062
Опубліковано: 15.02.2007
Автори: Фрітцемайер Карл-Хайнріх, Мун Петер, Коземунд Дірк, Хілліш Александер, Мюллер Герд
Формула / Реферат
1. 9a-заміщені похідні естра-1,3,5(10)-триєнів загальної формули І
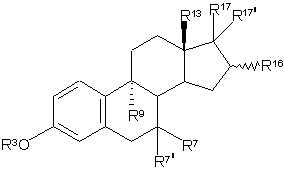 ,(I)
,(I)
у якій залишки R3, R7, R7', R9, R13, R16, R17 і R17' мають незалежно один від одного наступні значення:
R3 означає атом водню або групу R18, де
R18 являє собою прямоланцюговий або розгалужений, насичений або ненасичений вуглеводневий залишок, який містить до 6 атомів вуглецю, трифторметильну групу, арильний, гетероарильний або аралкільний залишок або арильний або гетероарильний залишок, заміщений метилом, етилом, трифторметилом, пентафторетилом, трифторметилтіо-, метокси-, етокси-, нітро-, ціаногрупою, галогеном (фтором, хлором, бромом, йодом), гідрокси-, аміно-, моно(С1-8алкіл)аміно- або ді(С1-8алкіл)аміногрупою, де обидві алкільні групи є ідентичними або різними, ді(аралкіл)аміногрупою, де обидві аралкільні групи є ідентичним або різними, карбоксилом, карбоксіалкоксигрупою, С1-20ацилом або С1-20ацилоксигрупою, ацильний залишок COR19, де R19 являє собою прямоланцюговий або розгалужений, насичений або до трикратно ненасичений, частково або повністю галогенований вуглеводневий залишок, який містить до 10 атомів вуглецю, або
R18 являє собою групу R20SO2-, де
R20 являє собою групу R21R22N, у якій
R21 і R22 незалежно один від одного означають атом водню, С1-5 алкільний залишок, групу C(O)R23, у якій
R23 являє собою прямоланцюговий або розгалужений, насичений або до трикратно ненасичений, частково або повністю галогенований вуглеводневий залишок, який містить до 10 атомів вуглецю, циклопропільну, -бутильну, -пентильну, -гексильну або –гептильну групу, С4-15циклоалкілалкільний залишок з 3-7 атомами вуглецю в циклоалкільному фрагменті і з алкільним фрагментом, який містить до 8 атомів вуглецю, або арильний, гетероарильний чи аралкільний залишок,
або арильний або гетероарильний залишок, заміщений метилом, етилом, трифторметилом, пентафторетилом, трифторметилтіо-, метокси-, етокси-, нітро-, ціаногрупою, галогеном (фтором, хлором, бромом, йодом), гідрокси-, аміно-, моно(С1-8алкіл)аміно- або ді(С1-8алкіл)аміногрупою, де обидві алкільні групи є ідентичними або різними, ді(аралкіл)аміногрупою, де обидві аралкільні групи є ідентичним або різними, карбоксилом, карбоксіалкоксигрупою, С1-20ацилом або С1-20ацилоксигрупою, або разом з N-атомом означають поліметиленіміногрупу з 4-6 атомами вуглецю або морфоліногрупу,
R7 і R7' кожен незалежно один від одного означає атом водню або атом галогену,
R9 являє собою прямоланцюговий або розгалужений алкенільний або алкінільний залишок з 2-6 атомами вуглецю, який може бути частково або повністю фторований, або етинільний чи проп-1-інільний залишок,
R13 являє собою метильну групу або етильну групу,
R16 являє собою гідроксигрупу або групу R18O-, R20SO2- або OC(O)R23, де R18, R20 і R23 кожний має значення, вказане при розкритті значень радикала R3,
R17 і R17' кожен незалежно один від одного означає атом водню або атом галогену.
2. Сполуки загальної формули І за п. 1, у якій R3 означає атом водню.
3. Сполуки загальної формули І за п. 1 або 2, у якій R7 означає атом водню або атом фтору в a-положенні, R9 являє собою вінільну, етинільну або проп-1-інільну групу, R16 означає гідроксигрупу, a R17 означає атом водню або атом фтору в a-положенні.
4. Сполуки загальної формули І за п. 1 або 2, у якій R16 означає групу R18-O- або R19SO2-O-, де R18 і R19 кожний має значення, вказане при розкритті значень радикала R3.
5. Естратриєни загальної формули І за п. 1 або 2 із групи, яка включає:
9a-вінілестра-1,3,5(10)-триєн-3,16α-діол,
9a-алілестра-1,3,5(10)-триєн-3,16α-діол,
18а-гомо-9a-вінілестра-1,3,5(10)-триєн-3,16a-діол,
18а-гомо-9a-алілестра- 1,3,5(10)-триєн-3,16a-діол,
3-метокси-9a-вінілестра-1,3,5(10)-триєн-16a-ол,
9a-аліл-3-метоксіестра-1,3,5(10)-триєн-16a-ол,
18а-гомо-3-метокси-9a-вінілестра-1,3,5(10)-триєн-16a-ол,
18а-гомо-9a-аліл-3-метоксіестра-1,3,5(10)-триєн-16a-ол,
9a-(2',2'-дифторвініл)естра-1,3,5(10)-триєн-3,16a-діол,
9a-(2',2'-дифторвініл)-3-метоксіестра-1,3,5(10)-триєн-16a-ол,
16a-гідрокси-9a-вінілестра-1,3,5(10)-триєн-3-ілсульфамат,
9a-аліл-16a-гідроксіестра-1,3,5(10)-триєн-3-ілсульфамат,
18а-гомо-16a-гідрокси-9a-вінілестра-1,3,5(10)-триєн-3-ілсульфамат,
18а-гомо-9a-аліл-16a-гідроксіестра-1,3,5(10)-триєн-3-ілсульфамат,
9a-вінілестра-1,3,5(10)-триєн-3,16a-діілдисульфамат,
9a-алілестра-1,3,5(10)-триєн-3,16a-діілдисульфамат,
18а-гомо-9a-вінілестра-1,3,5(10)-триєн-3,16a-діілдисульфамат,
18а-гомо-9a-алілестра-1,3,5(10)-триєн-3,16a-діілдисульфамат,
16a-гідрокси-9a-вінілестра-1,3,5(10)-триєн-3-іл-(N-ацетил)сульфамат,
9a-аліл-16a-гідроксіестра-1,3,5(10)-триєн-3-іл-(N-ацетил)сульфамат,
18а-гомо-16a-гідрокси-9a-вінілестра-1,3,5(10)-триєн-3-іл-(N-ацетил)сульфамат,
18а-гомо-9a-аліл-16a-гідроксіестра-1,3,5(10)-триєн-3-іл-(N-ацетил)сульфамат,
9a-(проп-(Z)-еніл)естра-1,3,5(10)-триєн-3,16a-діол,
9a-(н-пропіл)естра-1,3,5(10)-триєн-3,16a-діол,
9a-етинілестра-1,3,5(10)-триєн-3,16a-діол,
9a-вінілестра-1,3,5(10)-триєн-3,16a-діолдіацетат,
18а-гомо-9a-вінілестра-1,3,5(10)-триєн-3,16a-діолдіацетат,
16a-валероїлокси-9a-вінілестра-1,3,5(10)-триєн-3-ол,
16a-ацетокси-9a-вінілестра-1,3,5(10)-триєн-3-ол,
18а-гомо-16a-ацетокси-9a-вінілестра-1,3,5(10)-триєн-3-ол,
7a-фтор-9a-вінілестра-1,3,5(10)-триєн-3,16a-діол,
7a-фтор-9a-алілестра-1,3,5(10)-триєн-3,16a-діол,
17b-фтор-9a-вінілестра-1,3,5(10)-триєн-3,16a-діол,
17b-фтор-9a-алілестра-1,3,5(10)-триєн-3,16a-діол,
18а-гомо-7a-фтор-9a-вінілестра-1,3,5(10)-триєн-3,16a-діол,
18а-гомо-7a-фтор-9a-алілестра-1,3,5(10)-триєн-3,16a-діол,
18a-гомо-17b-фтор-9a-вінілестра-1,3,5(10)-триєн-3,16a-діол,
18a-гомо-17b-фтор-9a-алілестра-1,3,5(10)-триєн-3,16a-діол.
6. Фармацевтична композиція, яка містить принаймні одну сполуку за будь-яким з пп. 1-5, а також фармацевтично прийнятний носій.
7. Застосування сполук загальної формули І за будь-яким з пп. 1-5 для одержання відповідних лікарських засобів.
8. Застосування за п. 7 для лікування зумовлених недостатністю естрогенів захворювань і хворобливих станів у жінок і чоловіків.
9. Застосування за п. 7 для лікування нездужань у пери- і постменопаузальний період.
10. Застосування за п. 7 для лікування in vitro жіночої безплідності.
11. Застосування за п. 7 для лікування in vivo жіночої безплідності.
12. Застосування за п. 7 для терапії зв'язаних з гормональною недостатністю нездужань при дисфункції яєчників, зумовленої хірургічним втручанням, медикаментозним лікуванням або якими-небудь іншими причинами.
13. Застосування за п. 7 для гормонзамісної терапії (ГЗТ).
14. Застосування за п. 13 у комбінації із селективними модуляторами естрогенних рецепторів (СМЕР), наприклад ралоксифеном.
15. Застосування за п. 7 для профілактики і терапії зменшення кісткової маси, зумовленого гормональною недостатністю.
16. Застосування за п. 7 для профілактики і терапії остеопорозу.
17. Застосування за п. 7 для профілактики і терапії серцево-судинних захворювань.
18. Застосування за п. 7 для запобігання і лікування гіперплазії передміхурової залози.
19. Застосування за п. 18 у комбінації з антиестрогенами і селективними модуляторами естрогенних рецепторів (СМЕР) для профілактики і терапії гіперплазії передміхурової залози.
20. Застосування за п. 7 для лікування захворювань імунної системи.
21. Застосування за п. 20 для лікування аутоімунних захворювань.
22. Застосування за п. 21 для лікування ревматоїдного артриту.
23. Застосування за п. 21 для лікування множинного склерозу.
Текст
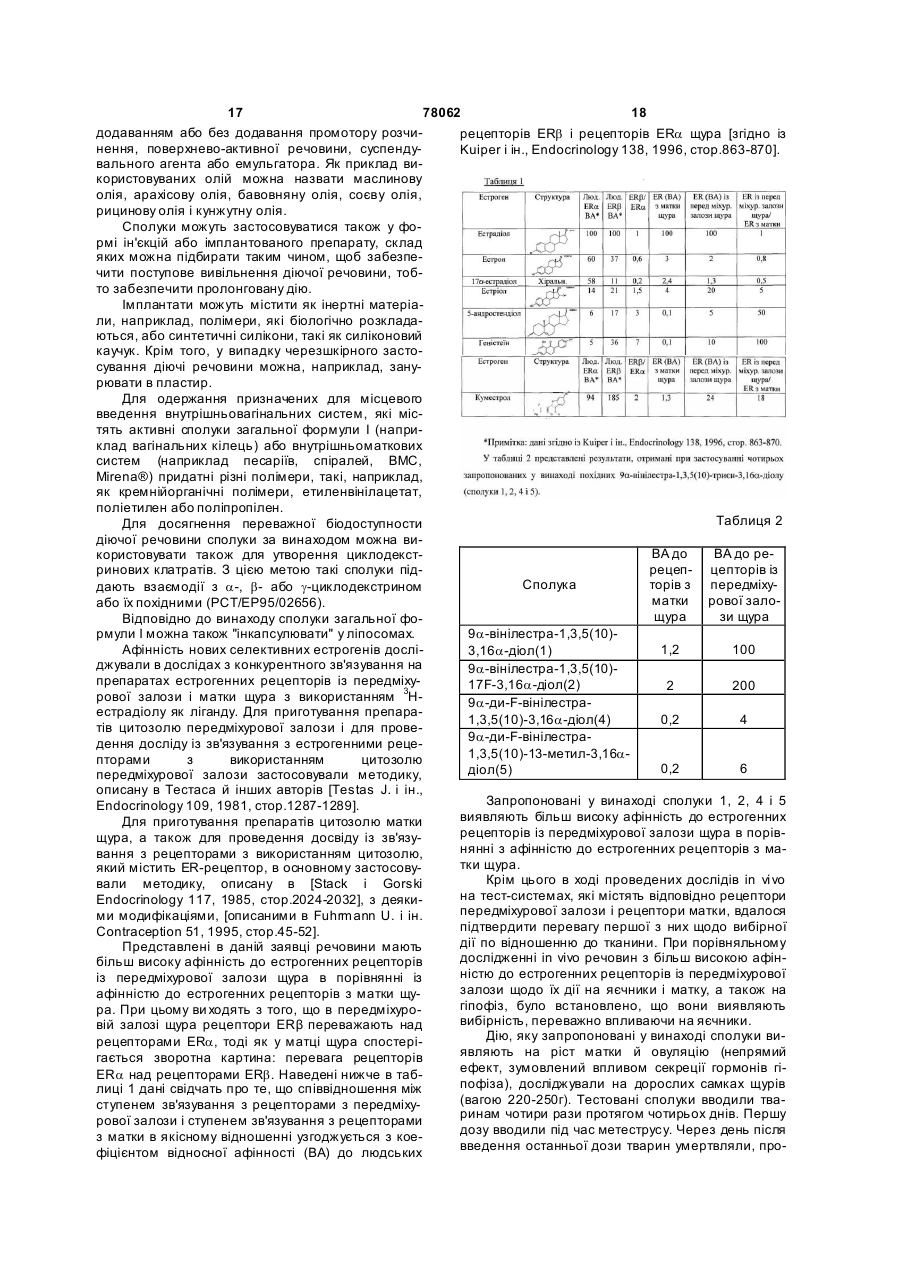
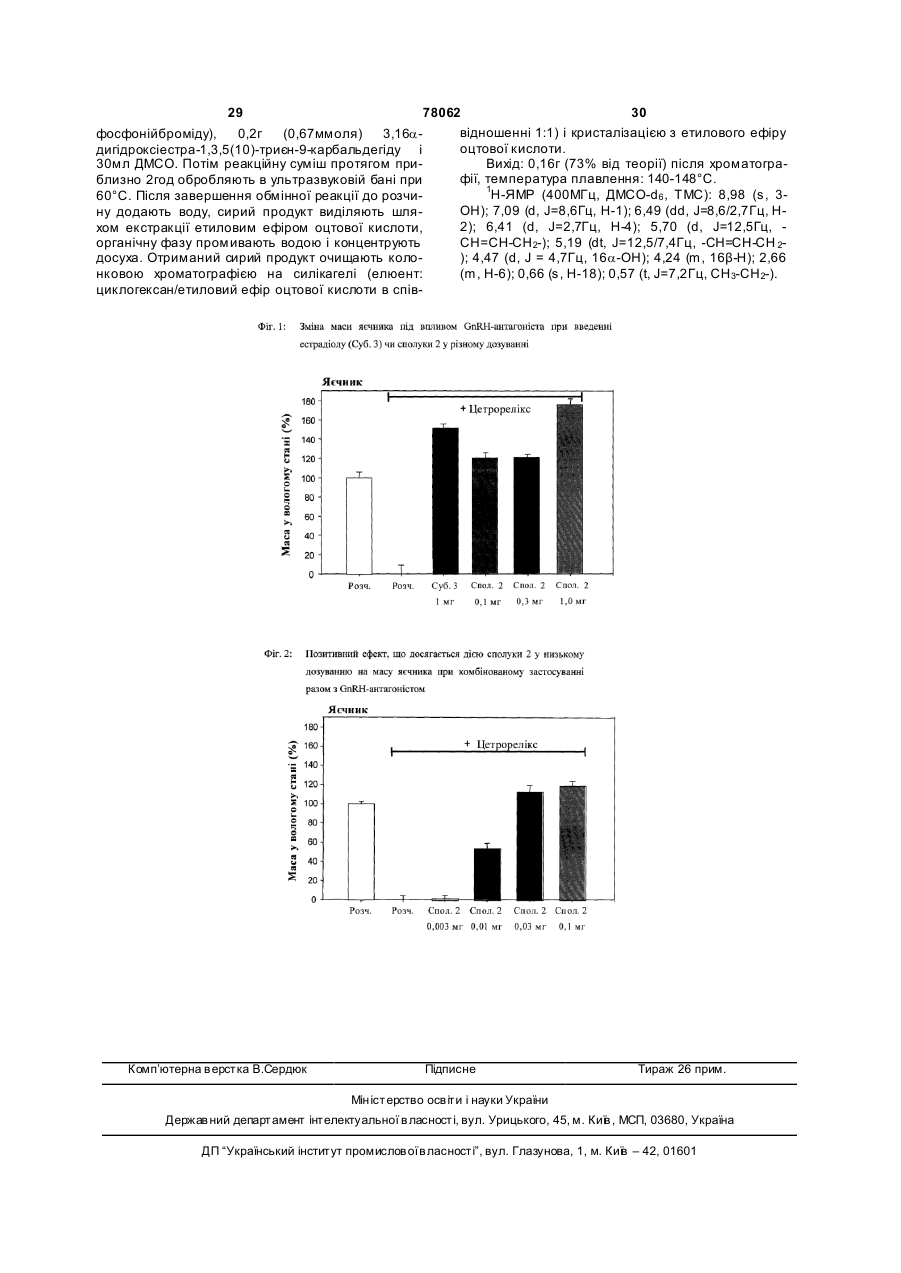
9a-заміщені похідні естра-1,3,5(10)-триєнів загальної формули І C2 2 (19) 1 3 78062 4 хлором, бромом, йодом), гідрокси-, аміно-, мо18а-гомо-9a-вінілестра-1,3,5(10)-триєн-3,16aно(С1-8алкіл)аміно- або ді(С 1-8алкіл)аміногрупою, діілдисульфамат, де обидві алкільні групи є ідентичними або різни18а-гомо-9a-алілестра-1,3,5(10)-триєн-3,16aми, ді(аралкіл)аміногрупою, де обидві аралкільні діілдисульфамат, групи є ідентичним або різними, карбоксилом, кар16a-гідрокси-9a-вінілестра-1,3,5(10)-триєн-3-іл-(Nбоксіалкоксигрупою, С1-20ацилом або С 1ацетил)сульфамат, 20ацилоксигрупою, або разом з N-атомом означа9a-аліл-16a-гідроксіестра-1,3,5(10)-триєн-3-іл-(Nють поліметиленіміногрупу з 4-6 атомами вуглецю ацетил)сульфамат, або морфоліногрупу, 18а-гомо-16a-гідрокси-9a-вінілестра-1,3,5(10)7 7' R і R кожен незалежно один від одного означає триєн-3-іл-(N-ацетил)сульфамат, атом водню або атом галогену, 18а-гомо-9a-аліл-16a-гідроксіестра-1,3,5(10)R9 являє собою прямоланцюговий або розгалужетриєн-3-іл-(N-ацетил)сульфамат, ний алкенільний або алкінільний залишок з 2-6 9a-(проп-(Z)-еніл)естра-1,3,5(10)-триєн-3,16a-діол, атомами вуглецю, який може бути частково або 9a-(н-пропіл)естра-1,3,5(10)-триєн-3,16a-діол, повністю фторований, або етинільний чи проп-19a-етинілестра-1,3,5(10)-триєн-3,16a-діол, інільний залишок, 13 9a-вінілестра-1,3,5(10)-триєн-3,16a-діолдіацетат, R являє собою метильну групу або етильну 8а-гомо-9a-вінілестра-1,3,5(10)-триєн-3,16aгруп у, діолдіацетат, R16 являє собою гідроксигрупу або груп у R18O-, 16a-валероїлокси-9a-вінілестра-1,3,5(10)-триєн-3R20SO2- або OC(O)R23, де R18 , R20 і R23 кожний має ол, значення, вказане при розкритті значень ради3 16a-ацетокси-9a-вінілестра-1,3,5(10)-триєн-3-ол, кала R , 18а-гомо-16a-ацетокси-9a-вінілестра-1,3,5(10)R17 і R17' кожен незалежно один від одного означає триєн-3-ол, атом водню або атом галогену. 2. Сполуки загальної формули І за п.1, у якій R3 7a-фтор-9a-вінілестра-1,3,5(10)-триєн-3,16a-діол, означає атом водню. 7a-фтор-9a-алілестра-1,3,5(10)-триєн-3,16a-діол, 3. Сполуки загальної формули І за п.1 або 2, у якій 17b-фтор-9a-вінілестра-1,3,5(10)-триєн-3,16a-діол, R7 означає атом водню або атом фтору в a17b-фтор-9a-алілестра-1,3,5(10)-триєн-3,16a-діол, положенні, R9 являє собою вінільну, етинільну або 18а-гомо-7a-фтор-9a-вінілестра-1,3,5(10)-триєн16 проп-1-інільну групу, R означає гідроксигрупу, a 3,16a-діол, R17 означає атом водню або атом фтору в a18а-гомо-7a-фтор-9a-алілестра-1,3,5(10)-триєнположенні. 3,16a-діол, 4. Сполуки загальної формули І за п.1 або 2, у якій 18a-гомо-17b-фтор-9a-вінілестра-1,3,5(10)-триєн16 18 19 18 R означає групу R -O- або R SO2-O-, де R і 3,16a-діол, 19 R кожний має значення, вказане при розкритті 18a-гомо-17b-фтор-9a-алілестра-1,3,5(10)-триєн3 значень радикала R . 3,16a-діол. 5. Естратриєни загальної формули І за п.1 або 2 із 6. Фармацевтична композиція, яка містить пригрупи, яка включає: наймні одну сполуку за будь-яким з пп.1-5, а також 9a-вінілестра-1,3,5(10)-триєн-3,16α-діол, фармацевтично прийнятний носій. 9a-алілестра-1,3,5(10)-триєн-3,16α-діол, 7. Застосування сполук загальної формули І за 18а-гомо-9a-вінілестра-1,3,5(10)-триєн-3,16a-діол, будь-яким з пп.1-5 для одержання відповідних лі18а-гомо-9a-алілестра- 1,3,5(10)-триєн-3,16a-діол, карських засобів. 3-метокси-9a-вінілестра-1,3,5(10)-триєн-16a-ол, 8. Застосування за п.7 для лікування зумовлених 9a-аліл-3-метоксіестра-1,3,5(10)-триєн-16a-ол, недостатністю естрогенів захворювань і хворобли18а-гомо-3-метокси-9a-вінілестра-1,3,5(10)-триєнвих станів у жінок і чоловіків. 16a-ол, 9. Застосування за п.7 для лікування нездужань у пери- і постменопаузальний період. 18а-гомо-9a-аліл-3-метоксіестра-1,3,5(10)-триєн10. Застосування за п.7 для лікування in vitro жіно16a-ол, чої безплідності. 9a-(2',2'-дифторвініл)естра-1,3,5(10)-триєн-3,16a11. Застосування за п.7 для лікування in vivo жінодіол, чої безплідності. 9a-(2',2'-дифторвініл)-3-метоксіестра-1,3,5(10)12. Застосування за п.7 для терапії зв'язаних з триєн-16a-ол, гормональною недостатністю нездужань при дис16a-гідрокси-9a-вінілестра-1,3,5(10)-триєн-3функції яєчників, зумовленої хірургічним втручанілсульфамат, ням, медикаментозним лікуванням або якими9a-аліл-16a-гідроксіестра-1,3,5(10)-триєн-3небудь іншими причинами. ілсульфамат, 13. Застосування за п.7 для гормонзамісної терапії 18а-гомо-16a-гідрокси-9a-вінілестра-1,3,5(10)(ГЗТ). триєн-3-ілсульфамат, 14. Застосування за п.13 у комбінації із селектив18а-гомо-9a-аліл-16a-гідроксіестра-1,3,5(10)ними модуляторами естрогенних рецепторів триєн-3-ілсульфамат, (СМЕР), наприклад ралоксифеном. 9a-вінілестра-1,3,5(10)-триєн-3,16a15. Застосування за п.7 для профілактики і терапії діілдисульфамат, зменшення кісткової маси, зумовленого гормона9a-алілестра-1,3,5(10)-триєн-3,16aльною недостатністю. діілдисульфамат, 5 78062 6 16. Застосування за п.7 для профілактики і терапії 20. Застосування за п.7 для лікування захворюостеопорозу. вань імунної системи. 17. Застосування за п.7 для профілактики і терапії 21. Застосування за п.20 для лікування аутоімунсерцево-судинних захворювань. них захворювань. 18. Застосування за п.7 для запобігання і лікуван22. Застосування за п.21 для лікування ревматоїдня гіперплазії передміхурової залози. ного артриту. 19. Застосування за п.18 у комбінації з антиестро23. Застосування за п.21 для лікування множинногенами і селективними модуляторами естрогенних го склерозу. рецепторів (СМЕР) для профілактики і терапії гіперплазії передміхурової залози. Даний винахід стосується нових сполук як фармацевтичних діючих речовин, які in vitro мають більш високу афінність до естрогенних рецепторів у препаратах із передміхурової залози щура в порівнянні з афінністю до естрогенних рецепторів у препаратах з матки щура і дія яких in vi vo переважно спрямована на яєчник, а не на матку, одержання таких сполук, їх терапевтичного застосування і фармацевтичних лікарських форм, які містять ці нові сполуки. Подібні хімічні сполуки являють собою стероїдні естрогени нового типу з вибірною дією по відношенню до певних тканин. Ефективність естрогенів при лікуванні обумовлених гормональною недостатністю симптомів, таких як припливи, атрофія органів-мішеней для естрогенів і нетримання, так само як і успішне застосування естрогенотерапії для запобігання зменшення кісткової маси в жінок у пери- і постменопаузальний період є підтвердженим і загальновизнаним фактом [Grady і ін., Ann. Intern. Med. 117, 1992, стор.1016-1037]. Так само в літературних джерелах підтверджується і той факт, що естрогензамісна терапія в жінок у постменопаузальний період або у жінок з обумовленою іншими причинами дисфункцією яєчників дозволяє знизити ризик серцево-судинних захворювань у порівнянні з жінками, які не піддавалися естрогенотерапії (Grady і ін., див. ви ще). При традиційній естроген- або гормонзамісній терапії (ГЗТ) природні естрогени, такі як естрадіол і кон'юговані естрогени з кінської сечі, застосовують або індивідуально, або в комбінації з відповідним гестагеном. Замість природних естрогенів можуть застосовуватися також отримані етерифікацією похідні, такі, наприклад, як 17bестрадіолвалерат. Оскільки естрогени, які використовують при гормонзамісній терапії, виявляють стимулюючу дію на ендометрій, що підвищує ризик раку ендометрія [Harlap S., Am. J. Obstet. Gynecol. 166, 1992, стор.1986-1992], переважно застосовують комбіновані препарати на основі естрогену/гестагену. Хоча гестагенний компонент у подібній комбінації і запобігає гіпертрофії ендометрія, проте застосування такої комбінації, що містить гестаген, пов'язано з можливістю появи небажаних проміжних кровотеч. Новою альтернативою комбінованим препаратам на основі естрогену/гестагену є естрогени з вибірною дією (далі селективні естрогени). Доте пер під селективними естрогенами маються на увазі такі сполуки, які внаслідок їх часткової антиутеротрофної (тобто антиестрогенної) ефективності впливають подібно до естрогенів на головний мозок, кісткову тканину і судинну систему, не виявляючи при цьому проліферативної дії на ендометрій. Один із класів речовин, які частково відповідають за своїми властивостями тому набору властивостей, які повинен мати селективний естроген, утворюють так звані "селективні модулятори естрогенних рецепторів" (СМЕР) [R.F. Kauffman, H.U. Bryant, DN AP 8(9), 1995, стор.531-539]. При цьому мова йде про часткові агоністах естрогенних рецепторів, які належать до підтипу естрогенних рецептор-альфа "ERa". Однак подібні речовини неефективні при терапії гострих приступів таких хворобливих станів, які проявляються в постменопаузальний період, як, наприклад, припливи. Як приклад одного зі СМЕРів можна назвати ралоксифен, який порівняно недавно був дозволений до застосування при такому показанні, як остеопороз. У [заявці DE-A 19906159] описуються запропоновані в ній як фармацевтичні діючі речовини нові сполуки, які in vitro мають більш високу афінність до естрогенних рецепторів у препаратах із передміхурової залози щура і дія яких in vivo переважно спрямована на яєчник, а не на матку, одержання таких сполук, їх терапевтичне застосування і фармацевтичні лікарські форми, які містять ці нові сполуки. Вказані сполуки являють собою 16aі 16b-гідроксіестра-1,3,5(10)-триєни, які на стероїдному скелету можуть нести ще які-небудь замісники, а у В-, С-і/або D-кільцях можуть мати один або декілька додаткових подвійних зв'язків. Для лікування в жінок порушень репродуктивної здатності (фертильності), причиною яких у багатьох випадках є дисфункція яєчників, обумовлена хірургічним втр учанням, медикаментозною терапією або іншими факторами, завдяки застосуванню нових селективних естрогенів також відкриваються нові багатообіцяючі можливості терапії. Лікування фертильності in vitro є методом, який добре зарекомендував себе і широко практикується протягом понад 20 років. Також відомі численні методи лікування обумовленої дисфункцією яєчників безплідності за допомогою екзогенних гонадотропінів. При цьому передбачається, що завдяки введенню в організм гонадотропінів, таких як фолікулостимулювальний гормон (ФСГ), буде досягнута необхідна стимуляція яєчників, що забез 7 78062 8 печить дозрівання здорових фолікулів. дотропінами ініціювати in vivo дозрівання фолікуФолікул являє собою структурний компонент лів і стимулювати їх ріст при безплідності, обумовяєчника і виконує дві функцій: він є місцезнахоленій дисфункцією яєчників, за допомогою дженням ооцитів і створює в такий спосіб умови і відповідних діючих речовин. можливість для їх росту і дозрівання. ФолікулогеЕстрогенний рецептор-бета (ER-β) нез включає період розвитку яєчникового фолікула Декілька років тому назад був виявлений друпочинаючи від примордіальної стадії і закінчуючи гий підтип естрогенних рецепторів, які позначили стадією антрального фолікула, який поступово як естрогенні рецептор-бета (ER-β) [Kuiper і ін., сформувався, тобто завершальною стадією перед Ргос. Natl. Acad. Sci. 93, 1996, стор.5925-5930; овуляцією. Лише антральний фолікул, який досяг Mosselman, Dijkema, Febs. Letters 392, 1996, оптимального ступеня розвитку, може забезпечити стор.49-53; Tremblay і ін., Molecular Endocrinology вихід зрілої яйцеклітини з яєчника (тобто овуля11, 1997, стор.353-365]. Характер експресії рецепцію). торів ER-β відрізняється від такого рецепторів ERa У пацієнток з обумовленою дисфункцією яєч[Kuiper і ін., Endocrinology 138, 1996, стор.863-870]. ників безплідністю (причиною якої є синдром поліТак, зокрема, у передміхуровій залозі щура рецепкістозних яєчників (СПКЯ)) порушене дозрівання тори ΕR-β переважають над рецепторами ERa, фолікулів, що зв'язано як з гормональними й овутоді як у матці щура спостерігається зворотна карляторними розладами, так і з недорозвиненістю тина: перевага рецепторів ERa над рецепторами яйцеклітин. У цих випадках число первинних і втоERβ. У яєчниках були виявлені найвищі концентринних фолікулів приблизно в два рази перевищує рації мРНК рецепторів ERβ [Couse і ін., їх кількість у нормально функціонуючому яєчнику Endocrinology 138, 1997, стор.4612-4613]. [Hughesden і ін., Obstet. Gynecol. Survey 37, 1982, До переліку інших органів і систем організму з стор.59-77]. порівняно високим рівнем експресії рецепторів За деякими даними ранні стадії розвитку фоліERβ належать кісткова тканина [Onoe Y. і ін., кулогенезу (які торкаються стадії розвитку фолікуEndocrinology 138, 1997, стор. 4509-4512], судинна лів від примордіальних до антральних) не залесистема [Register T.C., Adams M.R., Journ. Steroid. жать від гонадотропінів. Разом з тим на Molec. Biol. 64, 1998, стор.187-191], сечостатевий сьогоднішній день немає однозначних доказів тотракт [Kuiper GJ.M. і ін., Endocrinology 138, 1997, го, наскільки великий вплив відомих паракринних і стор.863-870], шлунково-кишковий тракт аутокринних факторів на ранню стадію фолікуло[Campbell-Thopson, BBRC 240, 1997, стор.478-483], генезу [Elvin і ін., Моl. Cell Endocrinology 13, 1999, а також яєчко [Mosselmann S. і ін., Febs. Letters стор.1035-1048; McNatty і ін., Journ. Reprod. Fertil. 392, 1996, стор.49-53], включаючи сперматиди Suppl. 54, 1999, стор.3-16]. [Shugrue і ін., Steroids 63, 1998, стор.498-504]. ПоГонадотропіни, такі як ФСГ, беруть участь у дібний розподіл рецепторів у тканинах свідчить дозріванні фолікулів головним чином на завершапро те, що естрогени регулюють функції органів льних стадіях фолікулогенезу, тобто в розвитку від через рецептори ERβ. Функціональна роль рецепраннього антрального фолікула до зрілого, здатноторів ERβ у цьому відношенні підтверджується го до овуляції фолікула. також дослідженнями на ERa-нокаутних (ERKO-), Безплідність in vivo і in vitro лікують переважно відповідно на ΕRβ-нокаутних (bERKO-) мишах: у за допомогою гонадотропінів (ФСГ і антиестрогеERKO-мишей після оваріектомії спостерігається нів) [White і ін., Journ. Clin. Endocrinol. Metab. 81, зменшення кісткової маси, запобігти якому можна 1996, стор.3821-3824]. При лікуванні безплідності за рахунок естрогенного заміщення [Kimbro і ін., in vitro ооцити з метою забезпечити можливість їх Abstract OR7-4, Endocrine Society Meeting New дозрівання in vitro до моменту утворення здатної Orleans, 1998]. Так само естрадіол інгібує у кроводо запліднення яйцеклітини дістають із антральносних судинах самок ERKO-мишей проліферацію них фолікулів, які знаходяться на передовуляційклітин середньої оболонки кровоносних судин і ній стадії. Після запліднення і завершення стадії клітин гладенької мускулатури [lafrati M.D. і ін., переддембріонального розвитку в матку жінки імNature Medicine 3, 1997, стор.545-548]. Приблизно плантують від одного до трьох ембріонів. така захисна дія естрадіолу реалізується в ERKOЛікування за допомогою екзогенних гонадотмишей через рецептори ЕRb. Різна функціональна ропінів у багатьох відношеннях пов'язано з чисспрямованість обох рецепторів ERa і ERb була ленними ризиками і побічними діями. Найбільший підтверджена успішними експериментами на ризик полягає в небезпеці надмірної стимуляції aERKO- і bERKO-мишах. Відповідно до отриманих яєчників, що в особливо важких випадках може результатів рецептори ERa відіграють важливу являти серйозну загрозу для життя (синдром гіроль у матці дорослих особин, у тканині молочної перстимуляції яєчників (СГСЯ)). До побічних дій залози, при негативній регуляції активності гонаслід віднести не в останню чергу і значні витрати, дотропінів, тоді як рецептор ERa в основному бепов'язані з лікуванням безплідності, які доводиться ре участь у процесах, зв'язаних з фізіологією яєчнести подружнім парам. Лікуванню гонадотропінаників, у таких насамперед, як фолікулогенез і ми приписують і такі негативні побічні дії, як збільовуляція [Couse і ін., Endocrine Reviews 20, 1999, шення ваги, одутлість, нудота, блювота і невідостор.358-417]. мий раніше довгостроковий ("відкладений") ризик Спостереження, які проводилися на bERKOонкологічних захворювань. мишах вказують на той факт, що рецептори ERb Один з можливих підходів, який дозволив би виконують певну функцію в передміхуровій залозі і уникнути вказаних недоліків і ризиків, полягає в сечовому міхурі: у самців мишей старшого віку тому, щоб до початку лікування екзогенними гона 9 78062 10 R R R ' виявляються симптоми гіперплазії передміхурової залози і сечового міхура [Krege J.H. і ін., Proc. Natl. R Acad. Sci. 95, 1998, стор.15677-15682]. Крім цього (I) в самок [Lubahn D.B. і ін., Proc. Natl. Acad. Sci. 90, R 1993, стор.11162-11166] і в самців ERKO-мишей RO R R' [Hess R.A. і ін., Nature 390, 1997, стор.509-512], а у якій залишки R3, R7, R7' , R9, R13, R16, R17 і R17' також у самок bERKO-мишей [Krege J.H., Proc. незалежно один від одного мають наступні знаNatl. Acad. Sci. 95, 1998, стор.15677-15682] виявчення: ляються порушення репродуктивної функції, тобто R3 означає атом водню або групу R18, де безплідність. Дані спостереження підтверджують R18 являє собою прямоланцюговий або розгалуважливу роль естрогенів, яку вони відіграють у жений, насичений або ненасичений вуглеводневий збереженні яєчком і яєчниками їх функції, так само залишок, який містить до 6 атомів вуглецю, трияк і в збереженні репродуктивної здатності. фторметильну групу, арильний, гетероарильний Вибірну дію естрогенів на визначені органиабо аралкільний залишок або арильний або гетемішені можна забезпечити з урахуванням різного роарильний залишок, заміщений метилом, етилом, розподілу обох підтипів ER-рецепторів у тканинах, трифторметилом, пентафторетилом, трифтормевідповідно в органах за рахунок застосування літилтіо-, метокси-, етокси-, нітро-, ціаногрупою, гагандів, специфічних по відношенню до одного з логеном (фтором, хлором, бромом, йодом), гідропідтипів вказаних рецепторів. Речовини з перевакси-, аміно-, моно(С1-8алкіл)аміно- або ди(С1жною спрямованістю дії на ERb-рецептори, а не на 8алкіл)аміногрупою, де обидві алкільні групи є ідеERa-рецептори, виявленої в досліді in vitro із зв'янтичними або різними, ди(аралкіл)аміногрупою, де зування з рецепторами, описані в Kuiper і ін. автообидві аралкільні групи є ідентичним або різними, рів [Kuiper і ін., Endocrinology 138, 1996, стор.863карбоксилом, карбоксіалкоксигрупою, С1-20ацилом 870]. Що стосується вибірної дії лігандів, специфіабо С1-20ацилоксигрупою, ацильний залишок чних по відношенню до відповідного підтипу естроCOR19, де R19 являє собою прямоланцюговий або генних рецепторів, на чутливі до естрогенів парарозгалужений, насичений або до трикратно ненаметри in vivo, то на сьогоднішній день які-небудь сичений, частково або повністю галогенований конкретні дані про цю дію відсутні. вуглеводневий залишок, який містить до 10 атомів З урахуванням вищевикладеного в основу давуглецю, або ного винаходу була покладена задача одержати R18 являє собою груп у R20SO 2-, де сполуки, які in vitro мали б вибірність по відношенR20 являє собою груп у R21R22N, у якій ню до зв'язування з естрогенними рецепторами в R21 і R22 незалежно один від одного означають препаратах із передміхурової залози і матки щура. атом водню, С1-5алкільний залишок, групу C(O)R23, При створенні винаходу передбачалося, що ці у якій сполуки повинні in vitro виявляти більш високу R23 являє собою прямоланцюговий або розгаафінність до естрогенних рецепторів у препаратах лужений, насичений або до трикратно ненасичеіз передміхурової залози щура в порівнянні з ний, частково або повністю галогенований вуглеафінністю до естрогенних рецепторів у препаратах водневий залишок, який містить до 10 атомів з матки щура. Далі передбачалося, що специфічні вуглецю, циклопропільну, -бутильну, -пентильну, по відношенню до ЕRb-рецепторів сполуки повинні гексильну або –гептильну груп у, С4in vivo ініціювати в яєчку дію, яка сприяє розвитку і 15циклоалкілалкільний залишок з 3-7 атомами вугзбереженню фертильності. Одночасно з цим такі лецю в циклоалкільному фрагменті і з алкільним сполуки повинні були мати вибірну дію, переважно фрагментом, який містить до 8 атомів вуглецю, спрямовану на яєчники, а не на матку. Крім того, або арильний, гетероарильний або аралкільний при створенні винаходу передбачалося, що запрозалишок, або арильний або гетероарильний залипоновані в ньому сполуки повинні мати певну зашок, заміщений метилом, етилом, трифторметихисну дію для запобігання обумовленого гормоналом, пентафторетилом, трифторметилтіо-, метокльною недостатністю зменшення кісткової маси, си-, етокси-, нітро-, ціаногрупою, галогеном переважну у порівнянні з дією, яка стимулює (фтором, хлором, бромом, йодом), гідрокси-, аміматку. но-, моно(С 1-8алкіл)аміноабо ди(С1Крім цього при створенні винаходу передба8алкіл)аміногрупою, де обидві алкільні групи є ідечалося запропонувати такий взаємозв'язок між нтичними або різними, ди(аралкіл)аміногрупою, де хімічною структурою і характерною для неї дією, обидві аралкільні групи є ідентичним або різними, яка дозволила б одержувати сполуки з описаним карбоксилом, карбоксіалкоксигрупою, С1-20ацилом вище набором фармакологічних властивостей. або С1-20 ацилоксигрупою, або разом з N-атомом Відповідно до винаходу запропоновані в ньому означають поліметиленіміногрупу з 4-6 атомами сполуки при обумовленій дисфункцією яєчників або вуглецю морфоліногрупу, безплідності повинні активно сприяти своєю дією R7 і R7' кожен незалежно один від одного ознана яєчники поліпшенню репродуктивної функції чає атом водню або атом галогену, при одночасно зниженому впливі на матку. R9 являє собою прямоланцюговий або розгаВказана задача вирішується відповідно до вилужений алкенільний або алкінільний залишок з 2находу за допомогою запропонованих у ньому 9a6 атомами вуглецю, який може бути частково або заміщених естра-1,3,5(10)-триєнових похідних заповністю фторований, або етинільний або проп-1гальної формули І інільний залишок, R13 являє собою метальну гр упу або етильну 13 17 17 16 9 3 7 7 11 78062 12 груп у, 16a-ацетокси-9a-вінілестра-1,3,5(10)-триєн-3-ол, R16 являє собою гідроксигрупу або гр упу R 18O-, 18а-гомо-16a-ацетокси-9a-вінілестра-1,3,5(10)R20SO2- або OC(O)R 23 , де R18 , триєн-3-ол, 7a-фтор-9a-вінілестра-1,3,5(10)-триєнR20 і R23 кожний має значення, вказане при 3,16a-діол, 7a-фтор-9a-алілестра-1,3,5(10)-триєн3 розкритті значень радикала R , 3,16a-діол, 17b-фтор-9a-вінілестра-1,3,5(10)17 17' R і R кожен незалежно один від одного триєн-3,16a-діол, 17b-фтор-9a-алілестра-1,3,5(10)означає атом водню або атом галогену. триєн-3,16a-діол, 18а-гомо-7a-фтор-9a-вінілестраR18 у кожному випадку може знаходитися в a1,3,5(10)-триєн-3,16a-діол, 18а-гомо-7a-фтор-9aабо β-положенні. алілестра-1,3,5(10)-триєн-3,16a-діол, 18а-гомоВідповідно до одного з варіантів здійснення 17b-фтор-9a-вінілестра-1,3,5(10)-триєн-3,16a-діол, винаходу до переважних належать гонатриєнові 18а-гомо-17b-фтор-9a-алілестра-1,3,5(10)-триєнпохідні, де R7 і R7' означають атом водню, R9 являє 3,16a-діол. собою вінільну, етинільну або проп-1-інільну, груІнші можливі варіанти здійснення винаходу пу, R16 означає гідроксигрупу, a R17 і R17' кожний представлені в залежних пунктах формули винаозначає атом водню. ходу. Переважні далі наступні комбінації схем заміВуглеводневий залишок R18 може являти сощення атомами галогену, переважно фтору, біля 17 бою, наприклад, метил, етил, пропіл, ізопропіл, С-атома в положенні 7 і 17: або 7-моно 7-ди, a R і бутил, трет-бутил, пентил, ізопентил, неопентил R17' кожний означає водень, або 17-моно 17-ди і R7 7' або гексил. і R кожний означає водень, а також 7-моно/17Алкоксигрупи OR18 у сполуках загальної формоно, 7-моно/17-ди, 7-ди/17-моно, 7-ди/17-ди. У мули І можуть містити відповідно 1-6 атомів вуглемонофторзаміщених сполуках переважно полоцю, переважні при цьому метокси-, етокси-, пропоження 7a, відповідно положення 17β. кси-, ізопропокси- і трет-бутилоксигрупи. Відповідно до іншого варіанта здійснення ви16 Як представники С 1-5алкільних залишків R21 і находу переважні насамперед сполуки, де R яв18 20 R22 можна назвати метил, етил, пропіл, ізопропіл, ляє собою групу R O- або R SO 2-O-, при цьому бутил, ізобутил, трет-бутил, пентил, ізопентил і R18 і R20 кожний має значення, вказане при рознеопентил. критті значень радикала R3. Як представники прямоланцюгових або розгаДо переважних згідно із даним винаходом налужених вуглеводневих залишків R23 , які містять лежать наступні сполуки: 9a-вінілестра-1,3,5(10)від 1 до максимум 10 атомів вуглецю, можна натриєн-3,16a-діол, 9a-алілестра-1,3,5(10)-триєнзвати, наприклад, метил, етил, пропіл, ізопропіл, 3,16a-діол, 18а-гомо-9a-вінілестра-1,3,5(10)-триєнбутил, ізобутил, трет-бутил, пентил, ізопентил, 3,16a-діол, 18а-гомо-9a-алілестра-1,3,5(10)-триєннеопентил, гептил, гексил і децил, переважний з 3,16a-діол, 3-метокси-9a-вінілестра-1,3,5(10)них метил, етил, пропіл і ізопропіл. триєн-16a-ол, 9a-аліл-3-метоксіестра-1,3,5(10)Як С 3-7циклоалкільну групу можна назвати цитриєн-16a-ол, 18а-гомо-3-метокси-9a-вінілестраклопропільну, -бутильну, -пентильну, -гексильну 1,3,5(10)-триєн-16a-ол, 18а-гомо-9a-аліл-3або -гептильну гр упу. метоксіестра-1,3,5(10)-триєн-16a-ол, 9a-(2',2'С4-15циклоалкілалкільний залишок містить у дифторвініл)естра-1,3,5(10)-триєн-3,16a-діол, 9aциклоалкільному фрагменті 3-7 атомів вуглецю, (2',2'-дифторвініл)-3-метоксіестра-1,3,5(10)-триєнтиповими представниками є безпосередньо вказані вище циклоалкільні групи, алкільний фрагмент 16a-ол, 16a-гідрокси-9a-вінілестра-1,3,5(10)-триєняких містить до 8 атомів вуглецю. Як приклад С43-ілсульфамат, 9a-аліл-16a-гідроксіестра15циклоалкілалкільного залишку можна назвати 1,3,5(10)-триєн-3-ілсульфамат, 18а-гомо-16aциклопропілметильну, циклопропілетильну, циклогідрокси-9a-вінілестра-1,3,5(10)-триєн-3пентилметильну, циклопентилпропільну й інші ілсульфамат, 18а-гомо-9a-аліл-16a-гідроксіестраподібні групи. 1,3,5(10)-триєн-3-ілсульфамат, 9a-вінілестраПід арильним залишком у контексті даного 1,3,5(10)-триєн-3,16a-діілдисульфамат, 9aопису мається на увазі фенільний, 1- або 2алілестра-1,3,5(10)-триєн-3,16a-діілдисульфамат, нафтильний залишок, переважний з них феніль18а-гомо-9a-вінілестра-1,3,5(10)-триєн-3,16aний залишок. діілдисульфамат, 18а-гомо-9a-алілестра-1,3,5(10)Поняття "арил" у всі х випадках включає також триєн-3,16a-діілдисульфамат, 16a-гідрокси-9aгетероарильний залишок. Як приклади гетероаривінілестра-1,3,5(10)-триєн-3-іл-(Nльного залишку можна назвати 2-, 3- або 4ацетил)сульфамат, 9a-аліл-16a-гідроксіестрапіридиніл, 2- або 3-фурил, 2- або 3-тієніл, 2- або 31,3,5(10)-триєн-3-іл-(N-ацетил)сульфамат, 18апіроліл, 2-, 4- або 5-піримідиніл і 3- або 4гомо-16a-гідрокси-9a-вінілестра-1,3,5(10)-триєн-3піридазиніл. іл-(N-ацетил)сульфамат, 18а-гомо-9a-аліл-16aЯк замісники, які можуть використовуватися в гідроксіестра-1,3,5(10)-триєн-3-іл-(Nарильному або гетероарильному залишку, можна ацетил)сульфамат, 9a-(проп-(Z)-еніл)естраназвати, наприклад, метальну, етильну, трифторметильну, пентафторетильну, трифторметилтіо-, 1,3,5(10)-триєн-3,16a-діол, 9a-(н-пропіл)естраметокси-, етокси-, нітро-, ціаногрупу, галоген 1,3,5(10)-триєн-3,16a-діол, 9a-етинілестра(фтор, хлор, бром, йод), гідрокси-, аміно-, моно(С11,3,5(10)-триєн-3,16a-діол, 9a-вінілестра-1,3,5(10)8алкіл)аміно- або ди(С 1-8алкіл)аміногрупу, де обидтриєн-3,16a-діолдіацетат, 18а-гомо-9a-вінілестраві алкільні групи є ідентичними або різними, 1,3,5(10)-триєн-3,16a-діолдіацетат, 16aди(аралкіл)аміногрупу, де обидві аралкільні групи валероїлокси-9a-вінілестра-1,3,5(10)-триєн-3-ол, 13 78062 14 є ідентичний або різними, карбоксил, карбоксилаУ даному описі розглядаються стероїди, оснолкоксигрупу, С1-20ацил або С1-20ацилоксигрупу. ву яких утворює скелет 9a-заміщених естраПід аралкільним залишком мається на увазі 1,3,5(10)-триєнів і які призначені для лікування залишок, який містить у кільці 14, переважно 6-10, опосередковуваних естрогенними рецепторамиС-атомів, а в алкільному ланцюзі - 1-8, переважно бета розладів і хворобливих станів як селективні 1-4, С-атомів. Відповідно до цього як аралкільні естрогени, які мають in vitro вибірність по віднозалишки можуть розглядатися, наприклад, фенішенню до їх зв'язування з естрогенними рецептолетил, нафтилметил, нафтилетил, фурилметил, рами в препаратах із передміхурової залози і маттієнілетил або піридилпропіл. ки щура і які виявляють in vivo переважну дію на Алкільні групи, відповідно вуглеводневі залишяєчники, а не на матку. Крім того, вказані сполуки ки можуть бути частково або повністю заміщені 1-5 мають певну захисну дію для запобігання зумоватомами галогену, гідроксигрупами або С1леного гормональною недостатністю зменшення кісткової маси. 4алкоксигрупами. Під С2-6алкенільним залишком у першу чергу Відповідно до винаходу було встановлено, що мається на увазі вінільний або алільний залишок. 9a-заміщені естра-1,3,5(10)-триєни загальної фоПід С2-6алкінільним залишком переважно мається рмули І придатні як селективні естрогени для лікуна увазі етинільний або проп-1-інільний залишок. вання різних хворобливих станів і розладів, пов'яЯк С1-10ацильні залишки можуть розглядатися заних з більш високим вмістом у відповідній мішені ацетил, пропіоніл, бутирил, валероїл, ізовалероїл, або у відповідному органі-мішені естрогенних репівалоїл, гексаноїл, октил, ноніл або деканоїл. цепторів-бета в порівнянні із вмістом у них естроОдна або обидві гідроксильні групи біля Сгенних рецепторів-альфа. атомів 3 і 16 можуть бути етерифіковані аліфатичВинахід стосується також фармацевтичних ною, прямоланцюговою або розгалуженою, насипрепаратів, які містять принаймні одну сполуку ченою або ненасиченою C1-14моно- або полікарбозагальної формули І (або її фізіологічно сумісні новою кислотою або ж ароматичною карбоновою адитивні солі з органічними і неорганічними кислокислотою. Як подібні прийнятні для етерифікації тами), і застосування сполук загальної формули І карбонових кислот можуть розглядатися серед для одержання відповідних лікарських засобів, інших монокарбонові кислоти, такі як мурашина насамперед лікарських засобів, призначених для кислота, оцтова кислота, пропіонова кислота, масвикористання при вказаних нижче показаннях. ляна кислота, ізомасляна кислота, валеріанова Описані в даній заявці естрогени можуть застосокислота, ізовалеріанова кислота, півалінова кисловуватися як єдиний компонент у складі фармацевта, лауринова кислота, міристинова кислота, акритичної композиції або в комбінації насамперед з лова кислота, пропіонова кислота, метакрилова гестагенами. Особливо переважною є комбінація кислота, кротонова кислота, ізокротонова кислота, селективних естрогенів із селективними по відноолеїнова кислота і елаїдинова кислота. Переважна шенню до рецепторів ERa антиестрогенами, які для етерифікації валеріанова кислота або півалімають вибірну дію по відношенню до периферичнова кислота. ної системи, тобто які не проходять через гематоДля етерифікації можуть використовуватися енцефалічний бар'єр, а також із селективними також дикарбонові кислоти, такі як щавлева кисломодуляторами естрогенних рецепторів (СМЕР). та, малонова кислота, янтарна кислота, глутарова Запропоновані у винаході сполуки з вибірною дією кислота, адипінова кислота, пімелінова кислота, по відношенню до рецепторів ERb можуть насампробкова кислота, азелаїнова кислота, себациноперед застосовуватися для одержання лікарських ва кислота, малеїнова кислота, фумарова кислота, засобів, призначених для лікування порушень ремуконова кислота, цитраконова кислота або мезапродуктивної функції (фертильності), для запобіконова кислота, і ароматичні карбонові кислоти, гання і терапії гіперплазії передміхурової залози, такі як бензойна кислота, фталева кислота, ізодля запобігання і лікування перепадів настрою в фталева кислота, терефталева кислота, нафтойна жінок і чоловіків, зумовлених гормональною недокислота, о-, м- і п-толуїлова кислота, гідратропова статністю, а також для використання в гормонзамікислота, атропова кислота, корична кислота, нікосній терапії (ГЗТ) чоловіків і жінок. тинова кислота або ізонікотинова кислота. ПереТерапевтичний продукт, який містить естроген важна етерифікація з використанням бензойної і чистий антиестроген для одночасного, послідовкислоти. ного або окремого застосування при селективній Запропоновані у винаході ефіри 9a-заміщених естрогенній терапії нездужань у перименопаузаестратриєнів мають як пролікарські засоби у порільний або постменопаузальний період, описаний у внянні з неетерифікованими діючими речовинами [заявці ЕР-А 0346014]. багато переваг щодо режиму їх введення в оргаЗапропоновані у винаході сполуки й фармаконізм, принципу їх дії, їх ефективності і тривалості їх логічні засоби, які містять ці сполуки, завдяки їх дії. вибірній дії по відношенню яєчників у порівнянні з Фармакокінетичними і фармакодинамічними дією по відношенню до матки особливо придатні перевагами відрізняються насамперед запропонодля лікування зумовленої хірургічним втручанням, вані у винаході сульфамати 9a-заміщених естратмедикаментозною терапією або якими-небудь інриєнів. Подібні ефекти, але які досягаються при шими причинами дисфункції яєчників, такої як жівикористанні інших стероїдних сульфаматів, були ноча безплідність, для стимуляції фолікулогенезу, описані раніше [Journ. Steroid Biochem. Molec. Biol. для лікування тільки з метою поліпшення ферти55, 1995, стор.395-403; Exp. Opinion Invest. Drugs льності, для підвищення ефективності лікування 7, 1998, стор.575-589]. фертильності in vitro (ЛФІВ) у сполученні з ліку 15 78062 16 ванням in vivo і для лікування оваріальних розлавими причинами дисфункцій або захворювань у дів, зумовлених віком ("пізня фертильність"), а чоловіків. Насамперед ці сполуки можуть застосотакож для терапії захворювань яєчників, таких як вуватися для запобігання і лікування вікового знисиндром полікистозного яєчника, синдром передження секреції андрогенів, таких як тестостерон і часного згасання функції яєчників і порушення дигідроепіандростерон (ДГЕА), а також гормону овуляції. росту. Ще одна можливість застосування сполук заМедикамент, який містить сполуки за винахогальної формули І полягає в тому, що їх викорисдом, може застосовуватися далі для лікування товують у сполученні із селективними модулятозапальних захворювань і захворювань імунної сирами естрогенних рецепторів (СМЕР), наприклад з стеми, насамперед аутоімунних захворювань у ралоксифеном, а саме: насамперед при гормончоловіків, таких, наприклад, як ревматоїдний артзамісній терапії (ГЗТ) і для лікування гінекологічрит, множинний склероз і хвороба Крона, так само них розладів. як і інших запальних захворюваннях кишечнику, а Запропоновані у винаході сполуки придатні також запальних захворювань дихальних шляхів, далі як окремий компонент для лікування нездулегень і бронхів. жань у пери- і постменопаузальний період, насамКількість відповідної сполуки загальної форперед таких, як припливи, порушення сну, дратівмули І, що призначається, змінюється в широких ливість, перепади настрою, нетримання, атрофія межах і визначається досягненням необхідного піхви і психічні розлади, зумовлені дефіцитом горефекту. Залежно від стану, який підлягає лікуванмонів. Так само вказані сполуки можуть застосовуню, і методики введення ця кількість призначуваватися для заміщення гормонів і для терапії зв'яної сполуки може становити від 0,01мкг/кг до заних з гормональною недостатністю нездужань 100мг/кг ваги тіла, переважно від 0,04мкг/кг до при дисфункції яєчників, зумовленої хірургічним 1мг/кг ваги тіла, у день. Для людини це відповідає втр учанням, медикаментозною терапією або якидобовій дозі від 0,8мкг до 8г, переважно від 3,2мкг ми-небудь іншими причинами. до 80мг. Одна уніфікована доза містить відповідно Крім того, запропоновані у винаході сполуки до винаходу від 1,6мкг до 2000мг однієї або декіможуть застосовуватися для профілактики зумовлькох сполук загальної формули І. леного недостатністю гормонів зменшення кісткоЗапропоновані у винаході сполуки і їх кислотвої маси й остеопорозу, для запобігання захворюно-адитивні солі придатні для одержання фармавань серцево-судинної системи, насамперед цевтичних складів і композицій. Фармацевтичні ангіопатії, такої як атеросклероз, артеріальної гісклади, відповідно лікарські засоби містять як діюпертонії і для запобігання зумовлених гормональчу речовину одну або декілька сполук за винахоною недостатністю нейродегенеративних захводом або їх кислотно-адитивні солі, при необхідносрювань, таких як хвороба Альцгеймера, а також ті в суміші з іншими фармакологічними, відповідно зв'язаних з недостатністю гормонів порушень пафармацевтично ефективними речовинами. Лікарм'яті і здатності до навчання. ські засоби виготовляють за відомою технологією, Вказані сполуки можуть застосовува тися далі використовуючи для цього звичайні, відомі допояк діюча речовина в препаратах, призначених для міжні фармацевтичні речовини, а також інші загалікування запальних захворювань і захворювань льноприйняті носії і розріджувачі. імунної системи, насамперед аутоімунних захвоЯк подібні носії і допоміжні речовини можуть рювань, таких, наприклад, як ревматоїдний артрозглядатися, наприклад, такі, які рекомендуються рит, множинний склероз, вовчак, хвороба Крона й або вказані як допоміжні речовини для викорисінші запальні захворювання кишечнику, запальних тання у фармацевтиці, косметиці і суміжних галузахворювань шкіри, таких як псоріаз, а також для зях у наступних літературних джерелах: [Ullmans лікування ендометріозу. Крім того, запропоновані у Encyklopadie der technischen Chemie, 1953, т.4, винаході сполуки ефективні також проти запальстор.1-39; Journal of Pharmaceutical Sciences, т.52, них захворювань дихальних шляхів, легень і брон1963, стор.918 і далі, Η. ν. Czetsch-Lindenwald, хів, таких, наприклад, як астма. Hilfsstoffe fur Pharmazie und angrenzende Gebiete; Медикамент, який містить вказані сполуки, Pharm. Ind., №2, 1961, стор.72 і далі: Dr. H.P. придатний для терапії і профілактики зумовлених Fiedler, Lexikon der Hilfsstoffe fur Pharmazie, дефіцитом естрогенів захворювань як жінок, так і Kosmetik und angrenzende Gebiete, вид-во Cantor чоловіків. KG, Aulendorf in Wurttemberg 1971]. При призначенні чоловікам сполуки за винахоСполуки можуть вводитися в організм перорадом насамперед можуть застосовува тися для тельно або парентерально, наприклад інтрапериторапії зумовленого гормональною недостатністю неально, внутрішньом'язово, підшкірно або череззменшення кісткової маси й остеопорозу, для зашкірно. Сполуки можуть також імплантуватися в побігання серцево-судинних захворювань, у першу тканину. Для перорального застосування можуть чергу ангіопатії, такої як атеросклероз, артеріальпризначатися капсули, пілюлі, таблетки, драже і ної гіпертонії і для запобігання зумовлених дефіт.п. Уніфіковані дози разом з діючою речовиною цитом гормонів нейродегенеративних захворюможуть містити фармацевтично прийнятний носій, вань, таких як хвороба Альцгеймера, і зв'язаних з такий, наприклад, як крохмаль, цукор, сорбіт, жегормональною недостатністю порушень пам'яті і латин, змащення, кремнієва кислота, тальк і інші. здатності до навчання, а також для запобігання і Для парентерального введення діючі речовини лікування гіперплазії передміхурової залози. можна розчиняти або суспендувати у відповідному Ще одна можливість застосування вказаних фізіологічно сумісному розріджувачі. Як розріджусполук - профілактика і терапія зумовлених віковачі в багатьох випадках використовують олії з 17 78062 18 додаванням або без додавання промотору розчирецепторів ERb і рецепторів ERa щура [згідно із нення, поверхнево-активної речовини, суспендуKuiper і ін., Endocrinology 138, 1996, стор.863-870]. вального агента або емульгатора. Як приклад використовуваних олій можна назвати маслинову олія, арахісову олія, бавовняну олія, соєву олія, рицинову олія і кунжутну олія. Сполуки можуть застосовуватися також у формі ін'єкцій або імплантованого препарату, склад яких можна підбирати таким чином, щоб забезпечити поступове вивільнення діючої речовини, тобто забезпечити пролонговану дію. Імплантати можуть містити як інертні матеріали, наприклад, полімери, які біологічно розкладаються, або синтетичні силікони, такі як силіконовий каучук. Крім того, у випадку черезшкірного застосування діючі речовини можна, наприклад, занурювати в пластир. Для одержання призначених для місцевого введення внутрішньовагінальних систем, які містять активні сполуки загальної формули І (наприклад вагінальних кілець) або внутрішньоматкових систем (наприклад песаріїв, спіралей, BMC, Mirena®) придатні різні полімери, такі, наприклад, як кремнійорганічні полімери, етиленвінілацетат, поліетилен або поліпропілен. Таблиця 2 Для досягнення переважної біодоступности діючої речовини сполуки за винаходом можна виВА до ВА до рекористовувати також для утворення циклодекстринових клатратів. З цією метою такі сполуки підрецеп- цепторів із Сполука торів з передміхудають взаємодії з a-, b- або g-циклодекстрином матки рової залоабо їх похідними (РСТ/ЕР95/02656). щура зи щура Відповідно до винаходу сполуки загальної формули І можна також "інкапсулювати" у ліпосомах. 9a-вінілестра-1,3,5(10)Афінність нових селективних естрогенів дослі1,2 100 3,16a-діол(1) джували в дослідах з конкурентного зв'язування на 9a-вінілестра-1,3,5(10)препаратах естрогенних рецепторів із передміху17F-3,16a-діол(2) 2 200 рової залози і матки щура з використанням 3Н9a-ди-F-вінілестраестрадіолу як ліганду. Для приготування препара1,3,5(10)-3,16a-діол(4) 0,2 4 тів цитозолю передміхурової залози і для прове9a-ди-F-вінілестрадення досліду із зв'язування з естрогенними реце1,3,5(10)-13-метил-3,16aпторами з використанням цитозолю 0,2 6 діол(5) передміхурової залози застосовували методику, описану в Тестаса й інших авторів [Testas J. і ін., Запропоновані у винаході сполуки 1, 2, 4 і 5 Endocrinology 109, 1981, стор.1287-1289]. виявляють більш високу афінність до естрогенних Для приготування препаратів цитозолю матки рецепторів із передміхурової залози щура в порівщура, а також для проведення досвіду із зв'язунянні з афінністю до естрогенних рецепторів з мавання з рецепторами з використанням цитозолю, тки щура. який містить ER-рецептор, в основному застосовуКрім цього в ході проведених дослідів in vi vo вали методику, описану в [Stack і Gorski на тест-системах, які містять відповідно рецептори Endocrinology 117, 1985, стор.2024-2032], з деякипередміхурової залози і рецептори матки, вдалося ми модифікаціями, [описаними в Fuhrmann U. і ін. підтвердити перевагу першої з них щодо вибірної Contraception 51, 1995, стор.45-52]. дії по відношенню до тканини. При порівняльному Представлені в даній заявці речовини мають дослідженні in vivo речовин з більш високою афінбільш високу афінність до естрогенних рецепторів ністю до естрогенних рецепторів із передміхурової із передміхурової залози щура в порівнянні із залози щодо їх дії на яєчники і матку, а також на афінністю до естрогенних рецепторів з матки щугіпофіз, було встановлено, що вони виявляють ра. При цьому ви ходять з того, що в передміхуровибірність, переважно впливаючи на яєчники. вій залозі щура рецептори ΕRβ переважають над Дію, яку запропоновані у винаході сполуки вирецепторами ERa, тоді як у матці щура спостеріявляють на ріст матки й овуляцію (непрямий гається зворотна картина: перевага рецепторів ефект, зумовлений впливом секреції гормонів гіERa над рецепторами ERb. Наведені нижче в табпофіза), досліджували на дорослих самках щурів лиці 1 дані свідчать про те, що співвідношення між (вагою 220-250г). Тестовані сполуки вводили тваступенем зв'язування з рецепторами з передміхуринам чотири рази протягом чотирьох днів. Першу рової залози і ступенем зв'язування з рецепторами дозу вводили під час метеструсу. Через день після з матки в якісному відношенні узгоджується з коевведення останньої дози тварин умертвляли, профіцієнтом відносної афінності (ВА) до людських 19 78062 20 водили розтин і підраховували кількість яйцеклітин лука 2 також має помітну позитивну дію по відноу тр убі (аналіз впливу на овуляцію), а також визнашенню до яєчника, яка виявляється в стимуляції чали масу матки. дозрівання фолікулів, що дозволяє застосовувати Отримані дані свідчать про те, що естрадіол її так само і для лікування різних порушень репрозалежно від введеної дози інгібує овуляцію і стидуктивної системи в жінок або жіночої безплідмулює збільшення маси матки при ED50, що дорівності. нює 0,004мг/кг ваги тіла, тоді як запропонована у Для синтезу запропонованих у винаході сполук винаході сполука 1 при введенні її в дозі, що стазагальної формули І можна використовувати нановить до 0,4мг/кг ваги тіла, ніяк не впливає на самперед два загальні підходи. овуляцію і масу матки. Відповідно до одного з них для модифікацій Сполуки випробували in vivo на гіпофізектомодеяких положень стероїдного скелета можуть заваних, молодих (не досягли зрілого віку) самках стосовуватися в першу чергу 3,16-захищені похідні щурів. За допомогою цього модифікованого відпоестра-1,3,5(10)-триєн-3,16x-діолів, а за певних відним чином оперативного методу тваринам ввоумов також вільні діоли. дили GnRH-антагоніст. Мета подібного експериІнший підхід допускає застосування модифікоменту полягала в тому, щоб з'ясувати, чи ваних відповідним чином аналогів естронів, багато стимулює застосовувана речовина проліферацію з яких можна одержувати за відомими методами (дозрівання) фолікулів у яєчнику. Вимірюваним [приклади подібних методів синтезу див. у Journ. параметром при цьому є маса яєчника. Chem. Soc. Perk. 1, 1973, стор.2095 для С-атома в З піддослідних тварин формували групи з п'яположенні 9; Steroids 54, 1989, стор.71 для Стьох довільно вибраних особин (вагою 40-50г) у атома в положенні 7], за рахунок переміщення кожній. Тварин містили в макролонових клітках у (транспозиції) кисневої функції [Z. Chem., 1970, приміщеннях зі штучним кліматом в умовах відпостор.221] від С(17) до С(16), і такий підхід дозвовідного світлового режиму (10год. у темряві, 14год. ляє змінювати можливості одержання запропонопри нормальному освітленні), при цьому тварини ваних у винаході сполук. мали вільний доступ до стандартного корму (альтУ випадку 3-метилового ефіру після переверумін) і підкисленої водопровідної води. При піддення кетону в сульфонілгідразон, у найпростішошкірному введенні тестовану сполук у, так само як і му випадку взаємодією з фенілсульфонілгідразиконтрольна речовина (естрадіол Е2) розчиняли в дом, у результаті реакції деструкції утворюється суміші бензилбензоату і рицинової олії (об'ємне С(16)-С(17)олефін [Z. Chem. 10, 1970, стор.221 і співвідношення 1:4). далі; Liebigs Ann. Chem., 1981, стор.1973 і далі], до У молодих самок щура в день 0 видаляли гіякого шляхом регіо-/стереоконтрольованого синпофіз і в період часу з 1-го по 4-ий день включно тезу приєднують гіпобромід. Після відновного диїм підшкірно вводили (однократно щодня) естрадігалогенування і видалення захисної групи в С(3) ол, запропоновану у винаході сполуку 1, відповідодержують 16β-спирт, який за відомими методами но сполуку 2 або тільки розчинник (рицинова можна переводити в 16a-епімер. олія/бензилбензоат). За допомогою вказаного моВідповідно до іншого варіанта введення гідродифікованого методу тваринам одночасно зі споксильної групи біля С-атома в положенні 16 здійслукою 2, відповідно з розчинником і контрольною нюють гідроборування 16(17)-подвійного зв'язку речовиною естрадіолом протягом усіх чотирьох стерично утр удненими боранами. Відомо, що ця днів вводили цетрорелікс у дозі реакція приводить до утворення оксигенованих у 0,5мг/тварина/день. В обох випадках тварин через положенні 16 продуктів [Indian Journ. Chem. 9, 24год. після введення останньої дози умертвляли і 1971, стор.287-288]. Відповідно до цієї взаємодії визначали масу їх яєчника. естра-1,3,5(10),16-тетраєнів, наприклад, з 9У гіпофізектомованих тварин, яким протягом 4 борабіцикло[3.3.1]нонаном після окислення лужднів підшкірно вводили сполуку 1 у дозі ним пероксидом водню одержують 16a0,5мг/тварина/день, спостерігається збільшення гідроксіестратриєни. У менш значних кількостях маси яєчника, порівнянне з ефектом естрадіолу при цій реакції утворяться епімерні 16bпри його введенні в дозі 0,1мг/тварина/день. Розгідроксистероїди. Після відщеплення 3чинник не дає ніякого ефекту. метоксигрупи одержують естра-1,3,5(10)-триєнТаким чином, запропонована у винаході спо3,16a-діоли. За рахунок інверсії конфігурації біля лука 1 має вибірність дії, яка переважно спрямоС-атома в положенні 16, наприклад за реакцією вана на яєчник, а не на матку і гіпофіз, і завдяки Міцунобу [Synthesis 1, 1980], також можна одержусвоїй стимулюючій по відношенню до фолікулів вати 16b-гідроксіестратриєни. ефективності винятково успішно може застосовуІнші можливості одержання проміжних С(16)ватися при такому переважному показанні, яким є С(17)олефінів також описані в [заявці DE 19906159 жіноча безплідність. А1]. У тварин, яким поряд з GnRH-антагоністом Фторзамісники вводять за реакціями нуклеовводили сполуку 2, ця сполука вже в концентрації фільного заміщення гідроксильних груп фторамі0,1-0,3мг/тварина/день виявляла таку ж дію на новими реагентами [Org. React. 21, 1974, стор.158яєчник, що і естрадіол при його застосуванні в дозі 173]. Якщо гідроксильні групи попередньо перево1мг/тварина/день (див. Фіг.1). Навіть при більш дять у відповідні тозилати, то в цих випадках фтонизькому дозуванні (0,01, 0,03мг/тварина/день) ровані сполуки одержують взаємодією з фторидом сполука 2 впливає на яєчник і дозволяє усунути тетра-н-бутиламонію [Journ. Chem. Res. (Μ), 1979, антагоністичний ефект цетрореліксу (див. Фіг.2). стор.4728-4755]. Так само можливе одержання Таким чином, запропонована у винаході спофторованих сполук взаємодією відповідних спир 21 78062 22 тів із трифторидом діетиламіносірки (ТДАС) [US наявних гідроксильних груп піддають сульфамої3976691]. Гемінальні дифтористі сполуки можна луванню. Після цього сульфаматні групи при неодержувати, наприклад, реакцією карбонільних обхідності можна переводити з використанням сполук з тетрафторидом сірки [US 3413321] або з необхідного ацилхлориду в присутності основи у трифторидом діетиламіносірки (ТДАС) [патент US відповідні (N-ацил)сульфамати. Одержувані в ре3979691]. Для синтезу запропонованих у винаході зультаті оксосульфамати або оксо(Nацил)сульфамати за рахунок відновлення пере9a-заміщених 17b-фторестра-1,3,5(10)-триєн-3,16діолів 17-оксоестра-1,3,5(10)-триєни переводять у творять у відповідні гідроксисульфамати або гідрокси(N-ацил)сульфамати [Steroids 61, 1996, 17,17-дифторестра-1,3,5(10)-триєни [US 3976691]. стор.710-717]. Як відновники при цьому доцільно Одержувані таким шляхом 17,17-дифторестравикористовува ти борогідрид натрію і боран1,3,5(10)-триєни за рахунок обробки оксидом алюдиметилсульфідний комплекс. мінію перетворять у 17-фторестра-1,3,5(10)тетраєни [US 3413321]. Ще одна можливість одеНижче винахід більш докладно пояснюється на прикладах. ржання фторолефінів полягає в тому, що відповідні кетони піддають взаємодії з трифторидом діетиАналогічно до побудови 9a-вінільного угруполаміносірки (ТДАС) у присутності полярних вання з використанням реагентів-гомологів по відкаталізаторів, таких як димляча сірчана кислота ношенню до реагентів, описаних у прикладах, мо[US 4212815]. Взаємодією 17-фторестражна одержувати й інші сполуки загальної фор1,3,5(10),16-тетраєнів з боранами і наступним окимули І. сленням лужним пероксидом водню одержують Етерифікацію вільних гідроксильних груп до простого і/або складного ефіру здійснюють за ме17b-фторестра-1,3,5(10)-триєн-16a-оли [Org. тодами, добре відомими фахівцями. React. 13, 1963, стор.1-54]. Приклад 1 Для синтезу запропонованих у винаході 9a9a-вінілестра-1,3,5(10)-триєн-3,16a-діол алкеніл-, відповідно 9a-алкінілзаміщених естраСтадія 1 1,3,5(10)-триєн-3,16a- діолів спочатку одержують 9a-ціано-3-метоксіестра-1,3,5(10)-триєн-16aзахищені в положенні 3 і 16 3,16-дигідроксіестраілацетат 1,3,5(10)-триєни. Потім взаємодією з триметилсиДо суспензії з 2,13г (6,49ммоля) 3лілціанідом у присутності перхлорату літію ввометоксіестра-1,3,5(10)-триєн-16(-ілацетату, 2,07мл дять регіо- і стереоселективним шляхом 9a(16,54ммоля) триметилсилілціаніду і 0,14г перхлоціаноугруповання [Synlett, 1992, стор.821-822]. рату літію в 100мл метиленхлориду при перемішуПісля відщеплення захисних груп 9a-ціаносполуку ванні додають по краплях розчин 2,21г шляхом відновлення спочатку переводять у 9a(9,73ммоля) 2,3-дихлор-5,6-диціано-1,4формільну сполуку, яку потім за реакцією Віттіга бензохінону в 80мл метиленхлориду. Реакційна [Org. React., тім 14, стор.270] переводять у 9aсуміш забарвлюється при цьому в зелений колір. алкеніл-, відповідно 9a-алкінілзаміщену сполуку. Через 1год, протягом якої реакція продовжується Запропоновані у винаході сульфамати естратпри кімнатній температурі, до суміші примішують риєнів можна одержувати за відомою технологією розчин гідрокарбонату натрію. Відділену органічну з відповідних гідроксистероїдів шляхом етерифіфазу промивають водою і концентрують у вакуумі. кації сульфамоїлхлоридами в присутності основи На завершення суміш, яка містить продукти, хро[Z. Chem. 15, 1975, стор.270-272; Steroids 61, 1996, матографують на силікагелі (елюент: циклогекстор.710-717]. сан/етиловий ефір оцтової кислоти в співвідноУ результаті наступного ацилювання сульфашенні 6:1). Таким шляхом одержують 0,44г (21%) матної групи одержують запропоновані у винаході 9a-ціано-3-метоксіестра-1,3,5(10)-триєн-16a(N-ацил)сульфамати, для яких уже були підтверілацетату. джені позитивні з погляду фармакокінетики власСтадія 2 тивості [див. DE 19540233 А1]. 9a-ціано-3-гідроксіестра-1,3,5( 10)-триєн-16aРегіоселективну етерифікацію полігідроксиілацетат льованих стероїдів N-заміщеними і NДо розчину 0,59г (1,67ммоля) 9a-ціано-3незаміщеними сульфамоїлхлоридами здійснюють метоксіестра-1,3,5(10)-триєн-16a-ілацетату в 30мл після часткового захисту тих гідроксильних груп, ацетонітрилу додають при перемішуванні в атмоякі не повинні піддаватися етерифікації, тобто засфері аргону 7,51г (50,1ммоля) йодиду натрію і лишитися неетерифікованими. Як захисні групи з 8,87мл (70,14ммоля) триметиленхлорсилану. Чепридатною для цієї мети вибірною реакційною рез приблизно 3год при 60-70°С реакція завершуздатністю зарекомендували себе силілові ефіри, ється. Реакційний розчин зливають у розчин гідрооскільки в умовах утворення сульфамату вони сульфіту натрію й екстрагують етиловим ефіром залишаються стабільними, а їх повторне відщепоцтової кислоти. Органічну фазу декілька разів лення для регенерування іншої(-их) ще збережепромивають водою, сушать над MgSO4 і концентної(-их) у молекулі гідроксильної(-их) гр упи(груп) рують досуха у вакуумі. Сирий продукт хроматогне зачіпає сульфаматної групи (Steroids 61, 1996, рафують на силікагелі (елюент: циклогекстор. 710-717). сан/етиловий ефір оцтової кислоти в Запропоновані у винаході сульфамати з одніспіввідношенні 4:1). Таким шляхом одержують єю додатковою гідроксильною групою в молекулі 0,43г (76%) необхідного продукту. можна також одержувати виходячи з прийнятних Стадія 3 для таких цілей гідроксистероїдкетонів. Спочатку 3,16a-дигідроксіестра-1,3,5(10)-триєн-9залежно від поставленої мети одну або декілька 23 78062 24 карбонітрил (0,45ммоля) перхлорату літію і 0,71мл (5,66ммоля) триметилсилілціаніду поміщають у 10мл метилен0,43г (1,27ммоля) 9a-ціано-3-гідроксіестрахлориду (молекулярне сито) і в атмосфері інертно1,3,5(10)-триєн-16a-ілацетату перемішують при го газу о холоджують при перемішуванні до темпекімнатній температурі протягом 2год з 1,0г ратури порядку -70°С. Потім протягом 1год по (7,24ммоля) карбонату калію в 40мл метанолу краплях додають 0,77г (3,39ммоля) 2,3-дихлор-5,6(при вмісті 1% води). Потім метанол відганяють у диціано-1,4-бензохінону, розчиненого в 65мл мевакуумі й органічному залишку розчиняють у метиленхлориду. Приблизно через 1год (нагрівання тиленхлориді. Органічну фазу промивають водою і до кімнатної температури) реакційний розчин зміконцентрують. У результаті одержують 3,5г(93%) шують з розчином гідрокарбонату натрію і продук9a-ціаноестра-1,3,5(10)-триєн-3,16a-діолу. ти реакції екстрагують метиленхлоридом. ОтримаСтадія 4 ний після концентрування органічних фаз сирий 3,16a-дигідроксіестра-1,3,5(10)-триєн-9продукт очищають за допомогою хроматографії. карбальдегід Після хроматографії на силікагелі (елюент: циклоСуспензію з 100мг (0,34ммоля) 3,16aгексан/етиловий ефір оцтової кислоти в співвіднодигідроксіестра-1,3,5(10)-триєн-9-карбонітрилу в шенні 4:1) одержують 0,74г (68% від теорії) необ40мл толуолу о холоджують при перемішуванні до хідного продукту. температури порядку -20°С. Після додавання Стадія 2 0,9мл (1,35ммоля) діізобутилалюмогідриду су3,16a-дигідрокси-18а-гомоестра-1,3,5(10)спензію після закінчення приблизно 10хв змішують триєн-9-карбальдегід з розчином гідрокарбонату натрію, фільтрують 1,3г (2,7ммоля) 3,16a-біс[(пергідропіран-2через целіт і осад на фільтрі (який є одночасно і іл)окси]-18а-гомоестра-1,3,5(10)-триєн-9фільтрувальним середовищем) екстрагують етикарбонітрилу розчиняють у 40мл толуолу і при ловим ефіром оцтової кислоти. Об'єднані органічні кімнатній температурі змішують в атмосфері інерфази промивають водою. Після концентрування тного газу з 7,2мл (10,8молячи) розчину діізобутирозчину у вакуумі одержують 84,6мг пінистої речолалюмогідрату (1,5-молярного в толуолі). Через вини світло-жовтого кольору. Кількість продукту, 30хв, протягом яких продовжується реакція, до який міститься в суміші, відповідає виходу, що розчину додають суміш з 30мл метанолу і 5мл становить приблизно 52% від теорії, і без подальрозведеної соляної кислоти (співвідношення комшої хроматографічної переробки продукт викориспонентів у суміші 1:1). Потім реакційний розчин товують на наступній стадії. концентрують у вакуумі і залишок, який утворився, Стадія 5 розчиняють в етиловому ефірі оцтової кислоти. 9a-вінілестра-1,3,5(10)-триєн-3,16a-діол Отриману органічну фазу екстрагують водою і В атмосфері інертного газу 3,1г (7,9ммоля) промивають розчином гідрокарбонату натрію. Пістрифенілметилфосфоніййодиду і 0,24г (8ммоля) ля сушіння розчину і концентрування у вакуумі гідриду натрію (80%-ного в парафіновому маслі) у одержують 0,73г (86% від теорії) жовтих кристалів. 20мл ДМСО піддають взаємодії в ультразвуковій Стадія 3 бані при температурі порядку 55°С. Через 10хв до 9a-вініл-18а-гомоестра-1,3,5(10)-триєн-3,16aрозчину додають 80мг (0,16ммоля, приблизно діол 60%-ного) 3,16a-дигідроксіестра-1,3,5(10)-триєн-9В атмосфері інертного газу 13,7г (34,8ммоля) карбальдегіду і реакцію продовжують далі протятрифенілметилфосфоніййодиду і 1,0г (34,8ммоля) гом 60хв при тій же температурі порядку 55°С в гідриду натрію (приблизно 80%-ного в парафіноультразвуковій бані. Після додавання води екстравому маслі) у 80мл ДМСО піддають взаємодії в гують етиловим ефіром оцтової кислоти. Зібрані ультразвуковій бані при температурі порядку 50°С. органічні фази промивають водою й органічною Через 30хв до розчину додають 0,73г (2,3ммоля) фазою концентрують у вакуумі. Сирий продукт 3,16a-дигідрокси-18а-гомоестра-1,3,5(10)-триєн-9очищають колонковою хроматографією на силікакарбальдегіду, розчиненого в 10мл ДМСО, і реакгелі (елюент: циклогексан/етиловий ефір у співвідцію продовжують протягом наступних 60хв в ультношенні 2:1) і наступною перекристалізацією з развуковій бані. Після додавання води екстрагухлороформу. ють етиловим ефіром оцтової кислоти, органічну Вихід: 24мг (50%), температура плавлення: 88фазу промивають, сушать і концентрують. Сирий 95°С. 1 продукт очищають колонковою хроматографією на Н-ЯМР (400МГц, ДМСО-d6 , ТМС): 9,00 (s, 3силікагелі (елюент: циклогексан/етиловий ефір ОН); 6,98 (d, J=8,6Гц, Н-1); 6,49 (dd, J=8,6/2,7Гц, Ноцтової кислоти в співвідношенні 2:1) і кристаліза2); 6,41 (d, J=2,7Гц, Н-4); 6,25 (dd, J=17,2/10,5Гц, цією з хлороформу. СН=СН2); 5,00 (dd, 10,5/1,9Гц, -СН=CH2); 4,47 (d, Вихід: 0,59г (81% від теорії) після хроматогра4,69Гц, 16a-ОН); 4,45 (dd, 17,2/1,9Гц, -СН=СН 2); фії, температура плавлення: 214-220°С. 4,24 (m, 16β-Η); 2,68 (m, Н-6); 0,69 (s, Η-18). 1 Н-ЯМР (400МГц, ДМСО-d6 , ТМС): 9,00 (s, 3Приклад 2 ОН); 6,96 (d, J=8,6Гц, Н-1); 6,49 (dd, J=8,6/2,7Гц, Н9a-вініл-18а-гомоестра-1,3,5(10)-триен-3,16a2); 6,41 (d, J=2,7Гц, Н-4); 6,29 (dd, J=17,2/10,5Гц, діол СН=СН2); 5,00 (dd, J=10,5/1,9Гц, -СН=CH2); 4,48 (d, Стадія 1 J=4,7Гц, 16a-ΟΗ); 4,43 (dd, J=17,2/1,9Гц, -CH=CH2; 3,16a-біс[(гіергідропіран-2-іл)окси]-18а4,18 (m, 16β-Η); 2,68 (m, H-6); 0,72 (t, J=6,8Гц, гомоестра-1,3,5(10)-триєн-9-карбонітрил Η-18a). 1,03г (2,26ммоля) 3,16a-біс[(пергідропіран-2Приклад 3 іл)окси]-18а-гомоестра-1,3,5(10)-триєну, 48,2мг 9a-(2',2'-дифторвініл)естра-1,3,5(10)-триєн 25 78062 26 Вихід: 58% від теорії. 3,16a-діол Стадія 2 Стадія 1 3,16a-біс[(пергідропіран-2-іл)окси]естра3,16a-дигідрокси-18а-гомоестра-1,3,5(10)триєн-9-карбальдегід 1,3,5(10)-триєн-9-карбонітрил У результаті хімічного перетворення 3,16aУ результаті хімічного перетворення 3,16aбіс[(пергідропіран-2-іл)окси]-18а-гомоестрабіс[(пергідропіран-2-іл)окси]естра-1,3,5(10)-триєну, яке здійснюють аналогічно до прикладу 1, стадія 1, 1,3,5(10)-триєн-9-карбонітрилу, яке здійснюють аналогічно до прикладу 1, стадія 2, одержують одержують 3,16a-біс[(пергідропіран-23,16a-дигідрокси-18а-гомоестра-1,3,5(10)-триєн-9іл)окси]естра-1,3,5(10)-триєн-9-карбонітрил. карбальдегід. Вихід: 58% від теорії. Вихід: 87% від теорії. Стадія 2 Стадія 3 3,16a-дигідроксіестра-1,3,5(10)-триєн-99a-(2',2'-дифторвініл)-18а-гомоестра-1,3,5(10)карбальдегід триєн-3,16a-діол У результаті хімічного перетворення 3,16aбіс[(пергідропіран-2-іл)окси]естра-1,3,5(10)-триєнУ результаті хімічного перетворення 3,16a9-карбонітрилу, яке здійснюють аналогічно до придигідрокси-18а-гомоестра-1,3,5(10)-триєн-9карбальдегіду, яке здійснюють в умовах і за метокладу 1, стадія 2, одержують 3,16aдикою, аналогічних для стадії 4 у прикладі 1 і при дигідроксіестра-1,3,5(10)-триєн-9-карбальдегід. Вихід: 83% від теорії. тих же молярних співвідношеннях, одержують 9aСтадія 3 (2',2'-дифторвініл)-18а-гомоестра-1,3,5(10)-триєн9a-(2',2'-дифторвініл)естра-1,3,5(10)-триєн3,16a-діол. Сирий продукт очищають колонковою хрома3,16a-діол тографією на силікагелі (елюент: циклогекУ інертизовану (тобто після продування інертним газом) колбу поміщають 1,5мл диметоксіетану сан/етиловий ефір оцтової кислоти в співвідношенні 2:1) і кристалізацією з етилового ефіру (молекулярне сито), 0,3мл пентану і 0,13мл оцтової кислоти. (0,77ммоля) діетил(дифторметил)фосфонату і Вихід: 12% від теорії, температура плавлення: охолоджують до температури порядку -75°С. Після 225-232°С. додавання 0,72мл (1,07ммоля) трет-бутиллітію 1 (1,5-молярного в пентані) і через 30хв, протягом Н-ЯМР (400МГц, ДМСО-d6 , ТМС): 9,06 (s, 3ОН); 7,08 (d, J=8,6Гц, Н-1); 6,50 (dd, J=8,6/2,7Гц, Няких відбувається реакція, до розчину додають 2); 6,41 (d, J=2,7Гц, Н-4); 4,78 (dd, J=21,5/14,8Гц, 0,14г (0,31ммоля) 3,16a-дигідроксіестра-1,3,5(10)CH=CF2); 4,47 (d, J=4,50Гц, 16a-ΟΗ); 4,18 (m, 16βтриєн-9-карбальдегіду, розчиненого в суміші з Η); 2,68 (m, H-6); 0,72 (t, J=6,8Гц, Η-18a). 1,5мл диметоксіетану і 0,3мл пентану. Далі розчин Приклад 5 до повного завершення обмінної реакції нагрівають зі зворотним холодильником. Після додавання 17b-фтор-9a-вінілестра-1,3,5(10)-триєн-3,16aцього розчину в охолоджений розчин хлориду діол амонію екстрагують етиловим ефіром оцтової кисСтадія 1 лоти. Органічну фазу концентрують під вакуумом, 3,16a-біс[(пергідропіран-2-іл)окси]-17βутворений залишок розчиняють у 5мл метанолу і фторестра-1,3,5(10)-триєн-9-карбонітрил змішують з 0,5мл розведеної соляної кислоти (у У результаті хімічного перетворення 3,16aспіввідношенні 1:1). Потім до реакційного розчину біс[(пергідропіран-2-іл)окси]-17b-фторестрадодають етиловий ефір оцтової кислоти, органічну 1,3,5(10)-триєну, яке здійснюють аналогічно до фазу промивають розчином гідрокарбонату натрію прикладу 2, стадія 1, одержують 3,16aі концентрують під вакуумом. Отриманий сирий біс[(пергідропіран-2-іл)окси]-17b-фторестрапродукт очищають колонковою хроматографією на 1,3,5(10)-триєн-9-карбонітрил. силікагелі (елюент: циклогексан/етиловий ефір Вихід: 45% від теорії. оцтової кислоти в співвідношенні 2:1). Стадія 2 Вихід: 22мг (21% від теорії). 3.16a-дигідрокси-17β-фторестра-1.3,5(10)1 Н-ЯМР (400МГц, ДМСО-d6 , ТМС): 9,08 (s, 3триєн-9-карбальдегід ОН); 7,10 (d, J=8,6Гц, Н-1); 6,51 (dd, J=8,6/2,3Гц, НУ результаті хімічного перетворення 3,16a2); 6,41 (d, J=2,3Гц, Н-4); 4,76 (dd, J=25,4/10,9Гц, біс[(пергідропіран-2-іл)окси]-17b-фторестраCH=CF2); 4,51 (d, J=4,69Гц, 16a-ΟΗ); 4,25 (m, 16β1,3,5(10)-триєн-9-карбонітрилу, яке здійснюють Η); 2,68 (m, H-6); 0,68 (s, H-18). аналогічно до прикладу 2, стадія 2, одержують Приклад 4 3,16a-дигідрокси-17b-фторестра-1,3,5(10)-триєн-99a-(2',2'-дифторвініл)-18а-гомоестра-1,3,5(10)карбальдегід. триєн-3,16a-діол Вихід: 83% від теорії. Стадія 1 Стадія 3 3,16a-біс[(пергідропіран-2-іл)окси|-18а17b-фтор-9a-вінілестра-1,3,5(10)-триєн-3,16aгомоестра-1,3,5(10)-триєн-9-карбонітрил діол У результаті хімічного перетворення 3,16aУ результаті хімічного перетворення 3,16aбіс[(пергідропіран-2-іл)окси]-18а-гомоестрадигідрокси-17b-фторестра-1,3,5(10)-триєн-91,3,5(10)-триєну, яке здійснюють аналогічно до карбальдегіду, яке здійснюють аналогічно до приприкладу 1, стадія 1, одержують 3,16aкладу 2, стадія 3, одержують 17b-фтор-9aбіс[(пергідропіран-2-іл)окси]-18а-гомоестравінілестра-1,3,5(10)-триєн-3,16a-діол. Сирий про1,3,5(10)-триєн-9-карбонітрил. 27 78062 28 дукт очищають колонковою хроматографією на іл)окси]естра-1,3,5(10)-триєн-9-карбонітрил. силікагелі (елюент: циклогексан/етиловий ефір Вихід: 61% від теорії. оцтової кислоти в співвідношенні 2:1) і кристалізаСтадія 2 цією з хлороформу. 3,16a-дигідроксіестра-1,3,5(10)-триєн-9Вихід: 51% від теорії, температура плавлення: карбальдегід 94-98°С. У результаті хімічного перетворення 3,16a1 Н-ЯМР (400МГц, ДМСО-d6 , ТМС): 9,02 (s, 3біс[(пергідропіран-2-іл)окси]естра-1,3,5(10)-триєнОН); 6,97 (d, J=8,2Гц, Н-1); 6,51 (dd, J=8,2/2,7Гц, Н9-карбонітрилу, яке здійснюють аналогічно до при2); 6,42 (d, J=2,7Гц, Н-4); 6,22 (dd, J=17,2/10,5Гц, кладу 2, стадія 2, одержують 3,16aСН=СН2); 5,09 (d, J=5,5Гц, 16a-ΟΗ); 5,01 (dd, дигідроксіестра-1,3,5(10)-триєн-9-карбальдегід. J=10,5/1,9Гц, -СН=CH2); 4,45 (dd, J=17,2/1,9Гц, Вихід: 87% від теорії. CH=CH2); 4,35 (dd, J=55,1/4,7Гц, Η-17a); 4,11 (m, Стадія 3 16β-Η); 2,68 (m, H-6); 0,79 (d, J=1,9Гц, Η-18). 9a-(гекс-1'-еніл)естра-1,3,5(10)-триєн-3,16aПриклад 6 діол 17,17-дифтор-9a-вінілестра-1,3,5(10)-триєнУ інертизовану колбу поміщають 8,68г 3,16b-діол (20ммолів) пентилтрифенілфосфонійброміду+амід Стадія 1 натрію (у 1г міститься 2,3ммоля пентилтрифеніл3,16a-біс[(пергідропіран-2-іл)окси|-17,17фосфонійброміду), 0,2г (0,67ммоля) 3,16aдифторестра-1,3,5(10)-триєн-9-карбонітрил дигідроксіестра-1,3,5(10)-триєн-9-карбальдегіду і 30мл ДМСО. Потім реакційну суміш протягом приУ результаті хімічного перетворення 3,16aблизно 2год обробляють в ультразвуковій бані при біс[(пергідропіран-2-іл)окси]-17,17-дифторестра60°С. Після завершення обмінної реакції до розчи1,3,5(10)-триєну, яке здійснюють аналогічно до ну додають воду, сирий продукт виділяють шляприкладу 2, стадія 1, одержують 3,16aхом екстракції етиловим ефіром оцтової кислоти, біс[(пергідропіран-2-іл)окси]-17,17-дифторестраорганічну фазу промивають водою і концентрують 1,3,5(10)-триєн-9-карбонітрил. досуха. Отриманий сирий продукт очищають колоВихід: 46% від теорії. нковою хроматографією на силікагелі (елюент: Стадія 2 циклогексан/етиловий ефір оцтової кислоти в спів3,16a-дигідрокси-17,17-дифторестра-1,3,5(10)відношенні 1:1) і кристалізацією з етилового ефіру триєн-9-карбальдегід оцтової кислоти. У результаті хімічного перетворення 3,16aВихід: 0,18г (75% від теорії) після хроматограбіс[(пергідропіран-2-іл)окси]-17,17-дифторестрафії, температура плавлення: 166-168°С. 1,3,5(10)-триєн-9-карбонітрилу, яке здійснюють 1 Н-ЯМР (400МГц, ДМСО-d6 , ТМС): 8,97 (s, 3аналогічно до прикладу 2, стадія 2, одержують ОН); 7,08 (d, J=8,6Гц, Н-1); 6,49 (dd, J=8,6/2,7Гц, Н3,16a-дигідрокси-17,17-дифторестра-1,3,5(10)2); 6,41 (d, J=2,7Гц, Н-4); 5,73 (d, J=12,5Гц, триєн-9-карбальдегід. СН= СН-СН2-); 5,20 (dt, J=12,5/7,4Гц, -СН=СН-СН 2Вихід: 88% від теорії. ); 4,48 (d, J=4,7Гц, 16a-ОН); 4,24 (m, 16β-Η); 2,66 Стадія 3 (m, H-6); 0,68 (t, J=7,0Гц, CH3-CH2-); 0,66 (s, Η-18). 17,17-дифтор-9a-вінілестра-1,3,5(10)-триєнПриклад 8 3,16a-діол 9a-(бут-1'-еніл)естра-1,3,5(10)-триєн-3,16aУ результаті хімічного перетворення 3,16aдіол дигідрокси-17,17-дифторестра-1,3,5(10)-триєн-9Стадія 1 карбальдегіду, яке здійснюють аналогічно до при3,16a-біс[(пергідропіран-2-іл)окси]естракладу 2, стадія 3, одержують 17,17-дифтор-9a1,3,5(10)-триєн-9-карбонітрил вінілестра-1,3,5(10)-триєн-3,16a-діол. Сирий проУ результаті хімічного перетворення 3,16aдукт очищають колонковою хроматографією на біс[(пергідропіран-2-іл)окси]естра-1,3,5(10)-триєну, силікагелі (елюент: циклогексан/етиловий ефір яке здійснюють аналогічно до прикладу 2, стадія 1, оцтової кислоти в співвідношенні 2:1) і кристалізаодержують 3,16a-біс[(пергідропіран-2цією з хлороформу. іл)окси]естра-1,3,5(10)-триєн-9-карбонітрил. Вихід: 75% від теорії. 1 Вихід: 52% від теорії. H-ЯМР (400МГц, CDC13, TMC): 7,08 (d, Стадія 2 J=8,6Гц, Н-1); 6,63 (dd, J=8,6/2,7Гц, Н-2); 6,54 (d, 3,16a-дигідроксіестра-1,3,5(10)-триєн-9J=2,7Гц, Н-4); 6,23 (dd, J=17,2/10,5Гц, -СН=СН 2); карбальдегід 5,08 (dd, J=10,5/1,9Гц, -СН H2); 4,48 (dd, С = У результаті хімічного перетворення 3,16aJ=17,2/1,9Гц, -СН=СН 2); 4,44 (m, 16β-Η); 2,79 (m, біс[(пергідропіран-2-іл)окси]естра-1,3,5(10)-триєнH-6); 0,95 (d, J=1,9 Гц, Н-18). 9-карбонітрилу, яке здійснюють аналогічно до приПриклад 7 кладу 2, стадія 2, одержують 3,16a9a-(гекс-1'-еніл)естра-1,3,5(10)-триєн-3,16aдигідроксіестра-1,3,5(10)-триєн-9-карбальдегід. діол Вихід: 87% від теорії. Стадія 1 Стадія 3 3,16a-біс[(пергідропіран-2-іл)окси]естра9a-(бут-1'-еніл)естра-1,3,5(10)-триєн-3,16a1,3,5(10)-триєн-9-карбонітрил діол У результаті хімічного перетворення 3,16aУ інертизованую колбу поміщають 8,68г біс[(пергідропіран-2-іл)окси]естра-1,3,5(10)-триєну, (20ммолів) пропілтрифенілфосфонійброміду+амід яке здійснюють аналогічно до прикладу 2, стадія 1, натрію (у 1г міститься 2,3ммоля пропілтрифенілодержують 3,16a-біс[(пергідропіран-2 29 78062 30 відношенні 1:1) і кристалізацією з етилового ефіру фосфонійброміду), 0,2г (0,67ммоля) 3,16aоцтової кислоти. дигідроксіестра-1,3,5(10)-триєн-9-карбальдегіду і 30мл ДМСО. Потім реакційну суміш протягом приВихід: 0,16г (73% від теорії) після хроматографії, температура плавлення: 140-148°С. близно 2год обробляють в ультразвуковій бані при 1 Н-ЯМР (400МГц, ДМСО-d6 , ТМС): 8,98 (s, 360°С. Після завершення обмінної реакції до розчиОН); 7,09 (d, J=8,6Гц, Н-1); 6,49 (dd, J=8,6/2,7Гц, Нну додають воду, сирий продукт виділяють шля2); 6,41 (d, J=2,7Гц, Н-4); 5,70 (d, J=12,5Гц, хом екстракції етиловим ефіром оцтової кислоти, органічну фазу промивають водою і концентрують СН= СН-СН2-); 5,19 (dt, J=12,5/7,4Гц, -СН=СН-СН 2досуха. Отриманий сирий продукт очищають коло); 4,47 (d, J = 4,7Гц, 16a-ОН); 4,24 (m, 16β-Η); 2,66 нковою хроматографією на силікагелі (елюент: (m, H-6); 0,66 (s, Η-18); 0,57 (t, J=7,2Гц, CH3-CH2-). циклогексан/етиловий ефір оцтової кислоти в спів Комп’ютерна в ерстка В.Сердюк Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською9a-substituted estratrienes as estrogens of selective action
Назва патенту російською9a-замещенные эстратриены в качестве эстрогенов избирательного действия
Автори російськоюHILLISCH, Alexander
МПК / Мітки
МПК: C07J 63/00, A61P 5/30, A61P 15/00, A61P 37/06, C07J 1/00, A61P 13/08, A61K 31/4535, C07J 41/00, A61P 29/00, A61P 25/00, A61K 31/565, A61P 19/10, A61P 37/04
Мітки: дії, естратриєни, 9a-заміщені, вибірної, естрогени
Код посилання
<a href="https://ua.patents.su/15-78062-9a-zamishheni-estratriehni-yak-estrogeni-vibirno-di.html" target="_blank" rel="follow" title="База патентів України">9a-заміщені естратриєни як естрогени вибірної дії</a>
Попередній патент: Засіб для лікування запальних захворювань пародонта
Наступний патент: Гербіцидна композиція та спосіб боротьби з бур’янами
Випадковий патент: Низькочастотна запобіжна муфта