Застосування циклічних біоізостерів похідних пуринової системи для лікування розладів, викликаних порушеннями нітрергічної і дофамінергічної систем
Номер патенту: 85389
Опубліковано: 26.01.2009
Автори: Журавльов Сєргєй Владіміровіч, Жілов Валєрій Хажмуратовіч, Полосін Владімір Міхайловіч, Марков Алєксандр Ніколаєвіч
Формула / Реферат
1. Застосування циклічних біоізостерів похідних пуринової системи, що мають загальну структурну формулу:
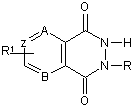 ,
,
де R = 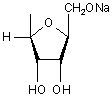 , Li, Na, K,
, Li, Na, K,
R1 = -Н, -NH2, -Вr, -Сl, -ОН, -СООН,
В = -N=, -CH=, Z = -СН=, -N=,
A = -N= при B = -N=, Z = -CH-,
А = -СН= при B = -N=, Z = -CH-,
А = -СН= при В = -N=, Z = -N-,
А = -СН= при В = -СН=, Z = -СН=,
А = -СН= при В = -СН=, Z = -N=
та їх фармакологічно прийнятних солей як активних інгредієнтів, що мають активність відносно нітрергічної та дофамінергічної систем, у фармацевтичній композиції для лікування розладів, викликаних порушеннями нітрергічної системи та/або дофамінергічної системи організму, що містить активний інгредієнт у кількості, достатній для дії на зазначені системи, у фармацевтично прийнятному носії.
2. Застосування за п. 1, яке відрізняється тим, що активний інгредієнт є похідним піридо[2,3-d]-6Н-піридазин-5,8-діону, який має загальну формулу:
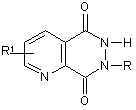 ,
,
де R =  , атом Li, Na, K,
, атом Li, Na, K,
R1 = -H, -NH2, -Br, -ОН, -СООН.
3. Застосування за п. 1, яке відрізняється тим, що активний інгредієнт вибраний з групи, що включає:
7-(![]() -D-рибофуранозил)піридо[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (1),
-D-рибофуранозил)піридо[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (1),
4-аміно-7-(![]() -D-рибофуранозил)піридо[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (2),
-D-рибофуранозил)піридо[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (2),
3-бром-7-(![]() -D-рибофуранозил)піридо[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (3),
-D-рибофуранозил)піридо[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (3),
4-гідрокси-7-(![]() -D-рибофуранозил)піридо[2,3-d]-6Н-піридазин-5,8-діону динатрієву сіль (4),
-D-рибофуранозил)піридо[2,3-d]-6Н-піридазин-5,8-діону динатрієву сіль (4),
3-карбокси-7-(![]() -D-рибофуранозил)піридо[2,3-d]-6Н-піридазин-5,8-діону динатрієву сіль (5),
-D-рибофуранозил)піридо[2,3-d]-6Н-піридазин-5,8-діону динатрієву сіль (5),
піридо[2,3-d]-6Н-піридазин-5,8-діону літієву сіль (6),
піридо[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (7),
піридо[2,3-d]-6Н-піридазин-5,8-діону калієву сіль (8).
4. Застосування за п. 1, яке відрізняється тим, що активний інгредієнт є похідним бензо[d]-3Н-піридазин-1,4-діону, який має загальну формулу:
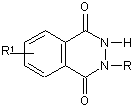 ,
,
де R =  , атом Li, Na, K,
, атом Li, Na, K,
R1 = -H, -NH2, -Сl, -ОН, -СООН.
5. Застосування за п. 1, яке відрізняється тим, що активний інгредієнт вибраний з групи, що включає:
2-(![]() -D-рибофуранозил)бензо[d]-3Н-піридазин-1,4-діону натрієву сіль (9),
-D-рибофуранозил)бензо[d]-3Н-піридазин-1,4-діону натрієву сіль (9),
5-аміно-2-(![]() -D-рибофуранозил)бензо[d]-3Н-піридазин-1,4-діону натрієву сіль (10),
-D-рибофуранозил)бензо[d]-3Н-піридазин-1,4-діону натрієву сіль (10),
6-аміно-2-(![]() -D-рибофуранозил)бензо[d]-3Н-піридазин-1,4-діону натрієву сіль (11),
-D-рибофуранозил)бензо[d]-3Н-піридазин-1,4-діону натрієву сіль (11),
5-хлор-2-(![]() -D-рибофуранозил)бензо[d]-3Н-піридазин-1,4-діону натрієву сіль (12),
-D-рибофуранозил)бензо[d]-3Н-піридазин-1,4-діону натрієву сіль (12),
5-гідрокси-2-(![]() -D-рибофуранозил)бензо[d]-3Н-піридазин-1,4-діону динатрієву сіль (13),
-D-рибофуранозил)бензо[d]-3Н-піридазин-1,4-діону динатрієву сіль (13),
5-амінобензо[d]-3Н-піридазин-1,4-діону літієву сіль (14),
5-амінобензо[d]-3Н-піридазин-1,4-діону натрієву сіль (15),
6-амінобензо[d]-3Н-піридазин-1,4-діону калієву сіль (16),
5-гідроксибензо[d]-3Н-піридазин-1,4-діону динатрієву сіль (17),
6-карбоксибензо[d]-3Н-піридазин-1,4-діону динатрієву сіль (18).
6. Застосування за п. 1, яке відрізняється тим, що активний інгредієнт є похідним піразино[2,3-d]-6Н-піридазин-5,8-діону, який має загальну формулу:
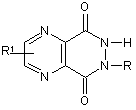 ,
,
де R =  , атом Li, Na, K,
, атом Li, Na, K,
R1 = -Н, -NH2, -Вr, -ОН, -СООН.
7. Застосування за п. 1, яке відрізняється тим, що активний інгредієнт вибраний з групи, що включає:
7-(![]() -D-рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (19),
-D-рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (19),
2-аміно-7-(![]() -D-рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (20),
-D-рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (20),
3-аміно-7-(![]() -D-рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (21),
-D-рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (21),
3-бром-7-(![]() -D-рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (22),
-D-рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (22),
2-гідрокси-7-(![]() -D-рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8-діону динатрієву сіль(23),
-D-рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8-діону динатрієву сіль(23),
2-карбокси-7-(![]() -D-рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8-діону динатрієву сіль (24),
-D-рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8-діону динатрієву сіль (24),
піразино[2,3-d]-6Н-піридазин-5,8-діону літієву сіль (25),
піразино[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (26),
3-бромпіразино[2,3-d]-6Н-піридазин-5,8-діону калієву сіль (27),
2-амінопіразино[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (28).
8. Застосування за п. 1, яке відрізняється тим, що активний інгредієнт є похідним піримідо[4,5-d]-6Н-піридазин-5,8-діону, який має загальну формулу:
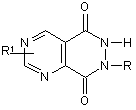 ,
,
де R =  , атом Li, Na, K,
, атом Li, Na, K,
R1 = -H, -NH2, -Вr, -ОН -СООН.
9. Застосування за п. 1, яке відрізняється тим, що активний інгредієнт вибраний з групи, що включає:
7-(![]() -D-рибофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (29),
-D-рибофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (29),
2-аміно-7-(![]() -D-рибофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (30),
-D-рибофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (30),
4-аміно-7-(![]() -D-рибофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (31),
-D-рибофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (31),
2-бром-7-(![]() -D-рибофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (32),
-D-рибофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (32),
4-гідрокси-7-(![]() -D-рибофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (33),
-D-рибофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (33),
4-карбокси-7-(![]() -D-рибофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (34),
-D-рибофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (34),
піримідо[4,5-d]-6Н-піридазин-5,8-діону літієву сіль (35),
2-амінопіримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (36),
4-бромпіримідо[4,5-d]-6Н-піридазин-5,8-діону калієву сіль (37).
10. Застосування за п. 1, яке відрізняється тим, що активний інгредієнт використовують як нейропротектор у фармацевтичній композиції для захисту нервової системи.
11. Застосування за п. 1, яке відрізняється тим, що активний інгредієнт використовують у фармацевтичній композиції для поліпшення когнітивної функції і нормалізації психофізіологічного стану.
12. Застосування за п. 1, яке відрізняється тим, що активний інгредієнт використовують у фармацевтичній композиції анксіолітичної та антидепресивної дії.
13. Застосування за п. 1, яке відрізняється тим, що активний інгредієнт використовують у фармацевтичній композиції для лікування захворювань, вибраних з групи, що включає: розлади, викликані зловживанням речовинами, такі як залежності від наркотиків, алкоголю і нікотину; порушення сну; сексуальні розлади, в тому числі сексуальні дисфункції; гастроінтестинальні порушення; психози; афективні розлади; неорганічні психози; розлади особистості; психіатричні розлади настрою; шизофренію і шизоафективні розлади; полідипсію; біполярні розлади; дисфоричну манію; тривожність і пов'язані з нею захворювання; ожиріння; бактеріальні інфекції центральної нервової системи, такі як менінгіт; порушення навчання; порушення пам'яті; хворобу Паркінсона; нейровироджені захворювання, наприклад хворобу Альцгеймера; депресію; екстрапірамідальні побічні ефекти нейролептиків; гіпоталамо-гіпофізарні розлади; судинні та серцево-судинні захворювання; дистонію; дискінезії; гіперкінези; деменцію; ішемію; рухові порушення; гіпертензію і захворювання, викликані гіперактивною імунною системою, такі як алергії та запалення, у ссавців, включаючи людину, в ефективній для лікування кількості.
Текст
1. Застосування циклічних біоізостерів похідних пуринової системи, що мають загальну структурну формулу: O 2 3 4-аміно-7-( b -D-рибофуранозил)піридо[2,3-d]-6Нпіридазин-5,8-діону натрієву сіль (2), 3-бром-7-( b -D-рибофуранозил)піридо[2,3-d]-6Нпіридазин-5,8-діону натрієву сіль (3), 4-гідрокси-7-( b -D-рибофуранозил)піридо[2,3-d]6Н-піридазин-5,8-діону динатрієву сіль (4), 3-карбокси-7-( b -D-рибофуранозил)піридо[2,3-d]6Н-піридазин-5,8-діону динатрієву сіль (5), піридо[2,3-d]-6Н-піридазин-5,8-діону літієву сіль (6), піридо[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (7), піридо[2,3-d]-6Н-піридазин-5,8-діону калієву сіль (8). 4. Застосування за п. 1, яке відрізняється тим, що активний інгредієнт є похідним бензо[d]-3Нпіридазин-1,4-діону, який має загальну формулу: O N O O H N R1 R , CH2ONa H HO OH де R = , атом Li, Na, K, R1 = -H, -NH2, -Сl, -ОН, -СООН. 5. Застосування за п. 1, яке відрізняється тим, що активний інгредієнт вибраний з групи, що включає: 2-( b -D-рибофуранозил)бензо[d]-3Н-піридазин-1,4діону натрієву сіль (9), 5-аміно-2-( b -D-рибофуранозил)бензо[d]-3Нпіридазин-1,4-діону натрієву сіль (10), 6-аміно-2-( b -D-рибофуранозил)бензо[d]-3Нпіридазин-1,4-діону натрієву сіль (11), 5-хлор-2-( b -D-рибофуранозил)бензо[d]-3Нпіридазин-1,4-діону натрієву сіль (12), 5-гідрокси-2-( b -D-рибофуранозил)бензо[d]-3Нпіридазин-1,4-діону динатрієву сіль (13), 5-амінобензо[d]-3Н-піридазин-1,4-діону літієву сіль (14), 5-амінобензо[d]-3Н-піридазин-1,4-діону натрієву сіль (15), 6-амінобензо[d]-3Н-піридазин-1,4-діону калієву сіль (16), 5-гідроксибензо[d]-3Н-піридазин-1,4-діону динатрієву сіль (17), 6-карбоксибензо[d]-3Н-піридазин-1,4-діону динатрієву сіль (18). 6. Застосування за п. 1, яке відрізняється тим, що активний інгредієнт є похідним піразино[2,3-d]-6Нпіридазин-5,8-діону, який має загальну формулу: 85389 4 O N N N O O H N R1 R , CH2ONa H HO OH де R = , атом Li, Na, K, 1 R = -Н, -NH2, -Вr, -ОН, -СООН. 7. Застосування за п. 1, яке відрізняється тим, що активний інгредієнт вибраний з групи, що включає: 7-( b -D-рибофуранозил)піразино[2,3-d]-6Нпіридазин-5,8-діону натрієву сіль (19), 2-аміно-7-( b -D-рибофуранозил)піразино[2,3-d]-6Нпіридазин-5,8-діону натрієву сіль (20), 3-аміно-7-( b -D-рибофуранозил)піразино[2,3-d]-6Нпіридазин-5,8-діону натрієву сіль (21), 3-бром-7-( b -D-рибофуранозил)піразино[2,3-d]-6Нпіридазин-5,8-діону натрієву сіль (22), 2-гідрокси-7-( b -D-рибофуранозил)піразино[2,3-d]6Н-піридазин-5,8-діону динатрієву сіль(23), 2-карбокси-7-( b -D-рибофуранозил)піразино[2,3-d]6Н-піридазин-5,8-діону динатрієву сіль (24), піразино[2,3-d]-6Н-піридазин-5,8-діону літієву сіль (25), піразино[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (26), 3-бромпіразино[2,3-d]-6Н-піридазин-5,8-діону калієву сіль (27), 2-амінопіразино[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (28). 8. Застосування за п. 1, яке відрізняється тим, що активний інгредієнт є похідним піримідо[4,5-d]-6Нпіридазин-5,8-діону, який має загальну формулу: O R1 N N N N O O H R , CH2ONa H HO OH де R = , атом Li, Na, K, 1 R = -H, -NH 2, -Вr, -ОН -СООН. 9. Застосування за п. 1, яке відрізняється тим, що активний інгредієнт вибраний з групи, що включає: 7-( b -D-рибофуранозил)піримідо[4,5-d]-6Нпіридазин-5,8-діону натрієву сіль (29), 5 85389 6 2-аміно-7-( b -D-рибофуранозил)піримідо[4,5-d]-6Нпіридазин-5,8-діону натрієву сіль (30), 4-аміно-7-( b -D-рибофуранозил)піримідо[4,5-d]-6Нпіридазин-5,8-діону натрієву сіль (31), 2-бром-7-( b -D-рибофуранозил)піримідо[4,5-d]-6Нпіридазин-5,8-діону натрієву сіль (32), 4-гідрокси-7-( b -D-рибофуранозил)піримідо[4,5-d]6Н-піридазин-5,8-діону натрієву сіль (33), 4-карбокси-7-( b -D-рибофуранозил)піримідо[4,5-d]6Н-піридазин-5,8-діону натрієву сіль (34), піримідо[4,5-d]-6Н-піридазин-5,8-діону літієву сіль (35), 2-амінопіримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (36), 4-бромпіримідо[4,5-d]-6Н-піридазин-5,8-діону калієву сіль (37). 10. Застосування за п. 1, яке відрізняється тим, що активний інгредієнт використовують як нейропротектор у фармацевтичній композиції для захисту нервової системи. 11. Застосування за п. 1, яке відрізняється тим, що активний інгредієнт використовують у фармацевтичній композиції для поліпшення когнітивної функції і нормалізації психофізіологічного стану. 12. Застосування за п. 1, яке відрізняється тим, що активний інгредієнт використовують у фарма цевтичній композиції анксіолітичної та антидепресивної дії. 13. Застосування за п. 1, яке відрізняється тим, що активний інгредієнт використовують у фармацевтичній композиції для лікування захворювань, вибраних з групи, що включає: розлади, викликані зловживанням речовинами, такі як залежності від наркотиків, алкоголю і нікотину; порушення сну; сексуальні розлади, в тому числі сексуальні дисфункції; гастроінтестинальні порушення; психози; афективні розлади; неорганічні психози; розлади особистості; психіатричні розлади настрою; шизофренію і шизоафективні розлади; полідипсію; біполярні розлади; дисфоричну манію; тривожність і пов'язані з нею захворювання; ожиріння; бактеріальні інфекції центральної нервової системи, такі як менінгіт; порушення навчання; порушення пам'яті; хворобу Паркінсона; нейровироджені захворювання, наприклад хворобу Альцгеймера; депресію; екстрапірамідальні побічні ефекти нейролептиків; гіпоталамо-гіпофізарні розлади; судинні та серцево-судинні захворювання; дистонію; дискінезії; гіперкінези; деменцію; ішемію; рухові порушення; гіпертензію і захворювання, викликані гіперактивною імунною системою, такі як алергії та запалення, у ссавців, включаючи людину, в е фективній для лікування кількості. Винахід відноситься до медицини, зокрема до лікарських засобів з направленою дією на найважливіші медіаторні системи організму, зокрема для лікування різних захворювань, пов'язаних з порушеннями нітрергічної та дофамінергічної систем організму. До таких розладів відносяться неврологічні, нервово-психічні та серцево-судинні захворювання та розлади, викликані зловживанням речовинами, зокрема наркотиками, порушення когнітивної функції та психофізіологічного стану. Відомо, що цілий ряд захворювань нервової системи і серцево-судинних захворювань, зловживання речовинами - наркотиками, алкоголем, нікотином та іншими речовинами, а також різні психічні розлади пов'язані з порушенням функціонування нейромедіаторних систем. Стан цих важливих систем значною мірою обумовлює психофізіологічний стан людини і практично всі функції центральної та периферичної нервової системи в нормі і при патології. До цих систем, зокрема, відносяться нітрергічна і дофамінергічна системи. Оксид азоту NO - низькомолекулярний газ вільнорадикальної природи - легко проникає крізь клітинні мембрани і компоненти міжклітинної речовини, виконуючи при цьому важливу роль у самих різних фізіологічних процесах. Вплив NO на стан клітини значною мірою залежить від кількості газу. У невеликих кількостях, продукованих, головним чином, нейрональною і ендотеліальною ізоформами NO-синтази, дія NO пов'язана, головним чином, з впливом на гемову гр упу розчинної форми ферменту гуанілатциклази. Активований фермент синтезує циклічний гуанозин монофосфат (далі цГМФ), який регулює роботу мембранних іонних каналів, процеси фосфорилування білків, активність фосфодіестерази та інші реакції. У великих концентраціях, продукованих макрофагальною ізоформою NO-синтази, NO може створювати на клітини токсичний ефект, пов'язаний як з безпосередньою дією на Fe-вмісні ферменти, так і з утворенням сильного окисника - вільнорадикальної сполуки пероксинітриту (ONOO-), який утворюється при взаємодії NO із супероксид-радикалом (О2). Токсичний ефект оксиду азоту виявляється насамперед в інгібуванні мітохондріальних ферментів, що приводить до зниження виробляння аденозинтрифосфату (далі АТФ), а також ферментів, які беруть учать в реплікації ДНК. Здатність пероксинітриту і безпосередньо NO ушкоджувати ДНК приводить до активації захисних механізмів, зокрема активації ферменту полі(АДФ-рибоза) синтетази, що, в свою чергу, приводить до зниження рівня АТФ і може призвести до загибелі клітини. NO синтезується в клітині з L-аргініну ферментом NO-синтазою (далі NOC), який перетворює Lаргінін в NO і цитрулін. Цей синаптичний шлях реалізується, зокрема, в серцево-судинній і центральній нервовій системі (далі ЦНС), де NO виконує функцію сигнальної молекули, включаючи нейромедіаторну функцію. Нейромедіаторна функція NO полягає в тому, що він синтезується при збудженні нейрона і, дифундуючи в сусідні клітини, активізує в них утворення цГМФ, здатного впливати на провідність іонних каналів, і, таким чином, змінювати електрогенез нейронів. Разом з цим NO в центральній нервовій системі здійснює новий, не синаптичний і не опосередкований рецепторами, шлях міжнейронних комунікацій (Kiss J.P., Vi zi E.S. 7 85389 Nitric oxide: a novel link between synaptic and nonsynaptic transmission. Trends Neurosci., 2001, Apr., 24 (4): 211-5). Вплив штрергічної системи на функції центральної нервової системи здійснюється як безпосередньо, так і опосередковано через інші нейромедіаторні системи. Наприклад, глутамат і його рецептори опосередковують найважливіші функції центральної нервової системи, включаючи пам'ять, а також впливають на розвиток депресії та антидепресантну активність. NO і синтаза оксиду азоту є важливими компонентами системи передачі сигналу в глутаматергічному синапсі (Paul LA, Skolnik P. Glutamate and depression: clinical and preclinical studies. Ann. NY Acad. Sci., 2003, Nov.; 1003 : 250-72). Показано, що активність моноаміноксидази - ключового ферменту метаболізму моноамінів у мозку, пов'язана з кількістю NO в клітині (Girgin Sagin F., Sozmen E.Υ., Ersoz В., Mentes G. Link between monoamine oxidase and nitric oxide. Neurotoxicology, 2004, Jan., 25 (1-2) : 91-9). NO впливає на функцію моноамінергічних транспортерів (Vizi E.S. Role of high-aftmity receptors and membrane transporters in nonsynaptic communication and drug action in the central nervous system. Pharmacol. Rev., 2000, Mar., 52 (1) : 63-89). NO полегшує вивільнення багатьох моноамінів, особливо дофаміну, а також, у разі необхідності, блокує пресинаптичне зворотне захоплення дофаміну. Таким чином, NO збільшує тривалість життя дофаміну в синапсі. У зв'язку з участю дофаміну в рухови х і психологічних процесах, нітрергічні впливи на ці процеси привертають все більшу увагу (Liu Y. Nitric oxide influences dopaminergic processes. Adv. Neuroimmunol., 1996, 6 (3) : 25964). NO опосередковує багато поведінкових і нейроендокринних реакцій організму, зокрема агресивну та імпульсивну поведінку. NO відіграє важливу роль у функціонуванні серотонінових рецепторів мозку (Chiavegatto S., Nelson R.J. Interaction of nitric oxide and serotonin in aggressive behavior. Honn. Behav., 2003, Sep., 44 (3) : 233-41). Моноамінергічні системи і система NO гіпоталамуса, лімбічних і стовбурови х стр уктур приймають участь в регуляції статевої поведінки, контролюють віддання переваги певному партнеру, сексуальне бажання, ерекцію, копуляцію, еякуляцію, оргазм і сексуальне задоволення (Pfaus J.G. Neurobiology of sexual behavior. Curr. Opin. Neurobiol., 1999, Dec, 9 (6) : 751-8). Відомо, що NO виконує важливу роль у формуванні залежності від різних препаратів, включаючи опіоїди, етанол, психостимулятори і нікотин. Зокрема, NO бере участь у прояві та розвитку симптомів відміни наркотичного засобу. Наприклад, активізація ошатного рецептора μ3 супроводжується вивільненням NO в клітинах ендотелію, гранулоцитах, моноцитах і мікроглії (Stefano G.B. Autoimmunovascular regulation: morphine and anandamide and ancondamide stimulated nitric oxide release. J. Neuroimmunol., 1998, Mar., 15, 83 (1-2) : 70-6), NO відіграє важливу роль у розвитку залежності від сполук різних класів, що викликають залежність. Таким чином, модуляція системи NO 8 може бути потенційною терапевтичною мішенню для лікування залежностей різного роду (Tayfun Uzbay I, Oglesby M.W. Nitric oxide and substance dependence. Neurosci. Biobehav. Rev., 2001, Jan., 25 (1) : 43-52). NO бере участь в регуляції нейротрансмісії в центральній нервовій системі, зокрема, опосередковуючи несинаптичні взаємодії, регулюючи моноамінергічні системи -дофамінергічну, норадренергічну. Таким чином, дисфункція системи NO безпосередньо пов'язана з основними нейропсихіатричними захворюваннями, наприклад депресією, хворобою Паркінсона та іншими (Kiss J.P. Role of nitric oxide in the regulation of monoaminergic neurotransmission. Brain Res. Bull., 2000, Aug., 52 (6) : 459-66). Підвищений рівень моноаміноксидази, окиснювальний стрес, ексайтотоксичність і надмірний синтез NO є характерними для нейродегенеративних захворювань, таких як хвороба Альцгеймера та хвороба Паркінсона, інсульт та інші (Mandel S., Grunblatt E., Riederer P., Gerlach M, Levites Y., Youdim M.B. Neuroprotective strategies in Parkinson's disease: an update on progress. CNS Drags, 2003, 17(10) : 729-62). В основі розвитку залежностей і психозів лежить поведінкова синситизація, опосередкована активацією дофамінових рецепторів D1, а також NMDA-рецепторів з наступним підвищенням активності NOC (Ujike H. Advanced findings on the molecular mechanisms for behavioral sensitization to psychostimulants. Nippon Yakurigaku Zasshi., 2001, Jan., 117(1): 5-12). Надмірне вивільнення NO з кровоносних судин, периваскулярних нервових закінчень або мозку вважають молекулярним механізмом, який запускає спонтанні болі при мігрені (Olesen J., Jansen-Olesen I. Nitric oxide mechanisms in migraine. Pathol. Biol., Paris, 2000, Sep., 48 (7) : 64857). Дофамін (далі DA) - найважливіший нейромедіатор і нейромодулятор, який відіграє важливу роль в організмі. В центральній нервовій системі DA бере участь в контролі руху, когнітивних функцій, емоційності, нейроендокринної секреції та функції клітин сітківки. На периферії DA бере участь в регуляції гомеостазу, судинного тонусу і секреції гормонів. В центральній нервовій системі дофамінові рецептори широко представлені в різних зонах мозку (Missale С, Nash S.R., Robinson S.W., Jaber Μ., Caron M.G. Dopamine receptors: from structure to function. Physiol. Rev., 1998, Jan., 78 (1) : 189-225). Різні фізіологічні функції DA опосередковані принаймні п'ятьма сімействами рецепторів DA:D1 - D5. Дисфункція цих рецепторів спостерігається при різних розладах і захворюваннях центральної нервової системи, зокрема хворобі Паркінсона (Zawilska J.B. Dopamine receptors structure, characterization and function. Postepy, Hig. Med. Dosw., 2003, 57 (3): 293-322). Дофаміновий сигналінг в певних відділах мозку є ключовим елементом розвитку наркотичної залежності (Fagen Z.M., Mansvelder H.D., Keath J.R., McGehee D.S. Short- and long-term modulation of synaptic inputs to brain reward areas by nicotine. 9 85389 Ann., N Y Acad. Sci., 2003, Nov., 1003 : 185-95). Взаємодія з рецепторами DA лежить в основі гострих е фектів амфетаміну і кокаїну (Ujike H. Molecular biology of drug dependence and behavioral sensitization. Seishin Shinkeigaku Zasshi., 2002, 104 (11) : 1055-68; Wolf M.E., Mangiavacchi S., Sun X. Mechanisms by which dopamine receptors may influence synaptic plasticity. Ann. NY Acad. Sci., 2003, Nov., 1003 : 241-9). Дофамінові агоністи опосередковують залежність від алкоголю, нікотину та стимуляторів (Kosten T.R., George T.P., Kosten T. A. The potential of dopamine agonists in drug addiction. Expert Opin. Investig. Drugs, 2002, Apr., 11 (4) : 491-9). Існує гіпотеза, що порушення дофамінергічної системи лежать в основі шизофренії (Pearlson G.D. Neurobiology of schizophrenia. Ann. Neurol, 2000, Oct., 48 (4) : 556-66). Дофамінова гіпотеза шизофренії постулює дисбаланс кіркової/підкіркової дофамінової системи і порушення функціонування дофамінових рецепторів Dl (AbiDargham A., Moore Η. Prefrontal DA transmission at Dl receptors and the pathology of schizophrenia. Neuroscientist, 2003, Oct., 9 (5) : 404-16). Разом з шизофренією етіологія й інших психотични х захворювань пов'язана з порушенням регуляції дофамінової системи мозку (Conley R.R., Kelly D.L. Current status of antipsychotic treatmnet. Curr. Drug Target CNS. Neurol. Disord., 2002, Apr., 1 (2) : 1238). Дофамінові механізми опосередковують етіологію і прояви тривожності (Taylor D.P., Riblet L.A., Stanton H.C., Eison A.S., Eison MS., Temple DL Jr. Dopamine and antianxiety activity. Pharmacol. Biochem. Behav., 1982, 17, Suppl. 1 : 25-35), і багато препаратів з антипсихотичною дією модулюють активність дофамінових рецепторів D2 (Kapur S., Мато D. Half a century of antipsychotics and still a central role for dopamine D2 receptors. Prog. Neuropsychopharmacol. Biol. Psychiatry, 2003, Oct., 27 (7) : 1081-90). Таким чином, у розвитку багатьох патологій порушення нітрергічної системи безпосередньо пов'язані з порушеннями дофамінергічної системи. Ці патології включають хімічні залежності - розлади, викликані зловживанням речовинами, такі як залежності від наркотиків, алкоголю і нікотину, порушення сну, сексуальні розлади, включаючи сексуальні дисфункції, гастроінтестинальні порушення, психози, афективні розлади, неорганічні психози, розлади особи, психіатричні розлади настрою, шизофренію та шизоафективні розлади, полідипсію, біполярні розлади, дисфоричну манію, тривожність і пов'язані з нею захворювання, ожиріння, бактеріальні інфекції центральної нервової системи, такі як менінгіт, порушення навчання, порушення пам'яті, хвороба Паркінсона, депресію, екстрапірамідальні побічні ефекти нейролептиків, гшоталамо-гіпофізарні розлади, судинні та серцево-судинні захворювання, дистонію, дискінезії, гіперкінези, деменцію, ішемію, рухові порушення, гіпертензію і захворювання, викликані гіперактивною імунною системою, такі як алергії та запалення, у ссавців, включаючи людину. Розробка лікарських препаратів для лікування розладів, викликаних порушеннями функції нітрер 10 гічної та дофамінергічної систем, шляхом нормалізації цих систем є досить актуальною задачею. Відомі трициклічні аміни з центральною дофамінергічною активністю (US, 4612316, А), а також дигідропіридин карбоксаміди, дигідрохінолін і ізохінолін карбоксаміди (US, 4727079, А), нові похідні амінотриазолів і амінооксазолів (US, 4904676, А), що мають мозок-специфічну дофамінергічну активність. Відомо застосування бензотіопіранопіридинонів для індукції антипсихотичної, антидепресантної та антидофамінергічної активності у теплокровних тварин (US, 4547507, А). Відомо застосування фенолдопан 4',8-бісгідросульфату та його солей як препаратів з продофамінергічною активністю (US, 4600714, А). Запропоновано застосування (1,2,5,6тетрагідро-1-алкіл-3-піридиніл)-2-тиазоламінів і 4(гексагідро-1-алкіл-3-піридиніл)-2-тиазоламінів з передбачуваною антипсихотичною активністю для лікування психозів, підвищеного кровяного тиску, хвороби Паркінсона, гіперпролактинемії, сексуальних розладів і акромегалії (US, 46508054, А). Відомі заміщені 1-(алкоксифеніл)піперазини часткові агоністи дофаміну, які запропоновано використовува ти для лікування порушень регуляції дофаміну і лікування хвороби Паркінсона, шизофренії і наркоманії (US, 5281594, А). Запропоновані похідні бензимідазолону з центральною дофамінергічною активністю (US, 5889010, A; US, 5883094, А), а також Ν,Ν'двузаміщені похідні бензимідазолону (US, 6521623, А), які, можливо, можуть бути застосовані для лікування широкого спектра захворювань нервової системи. В згаданих аналогах представлени тільки дані зв'язування відповідних сполук з рецепторами дофаміну, але в жодному випадку не доведена наявність специфічної терапевтичної активності в моделях на тваринах або в клінічних випробуваннях. Метою даного винаходу є створення лікарського засобу для корекції порушень нітрергічної і дофамінергічної систем і розладів, викликаних порушеннями цих систем, зокрема захворювань нервової та серцево-судинної систем, включаючи розлади, викликані зловживанням речовинами, порушення когнітивної функції та психо фізіологічного стану. При створенні даного винаходу було поставлене завдання виявлення біологічно активних сполук, що мають здатність нормалізувати роботу як нітрергічної, так і дофамінергічної систем, шляхом регулювання рівня NO в клітині за рахунок корекції активності різних ізоформ NO-синтази, а також шляхом зв'язування активних форм азоту, що надмірно утворюються, зокрема піроксинітриту або NO-радикала. Як біологічно активні сполуки, що мають необхідні для здійснення зазначеного завдання властивості, були розглянуті циклічні біоізостери похідних пуринової системи, що мають загальну структурну формулу: 11 85389 , де R=Li,Na,K, R1=-Η, -NH2, -Вr, -Cl, -OH, -COOH, В=-N=, -CH=, Ζ=-CH=,-N=, A=-N= при В=-N=, Ζ=-CH-, A=-CH= при B=-N=, Z=-CH-, A=-CH= при В=-N=, Ζ=-Ν=, A =-CH= при В=-CH=, Ζ=-СН=, А=-СН= при В=-СН=, Ζ=-Ν= та їх фармакологічно прийнятні солі, що мають нормалізуючу дію на внутрішньоклітинні процеси, зокрема на нітрергічні механізми клітин (PCT/RU03/00346). Автори припустили, що конденсовані піридазиндіонові системи мають специфічну нейротропну активність, при цьому позитивний ефект пов'язаний з нормалізацією зазначеними сполуками порушених функцій нітрергічної і дофамінергічної систем. Ме ханізми впливу циклічних біоізостерів похідних пуринової системи на нітреріічну систему можуть включати зміни рН в клітині, які впливають на активність синтази оксиду азоту, безпосередня взаємодія цих сполук з оксидом азоту і пероксинітритом в клітині і поза клітиною, що впливає як на нітрергічну систему в цілому, так і на вільнорадикальний гомеостаз біологічного об'єкта. Зазначені сполуки можуть також диференційовано модулювати активність різних ізоформ синтази оксиду азоту, що значною мірою забезпечує зміну функціонального стану клітин, органів, тканин і, в решті решт, цілого організму. Вплив сполук згідно з винаходом на дофамінову систему може здійснюватись за рахунок зміни розподілу електронної густини в білкових молекулах дофамінових рецепторів або за рахунок зміни властивостей оточуючи х рецептори мембран. Додатковий вплив цих сполук на інші типи рецепторів, наприклад аденозинові, може опосередковано модулювати активність дофамінових рецепторів. Були досліджені похідні піридо[2,3-d]-6Нпіридазин-5,8-діону, циклічного біоізостеру похідних пуринової системи, в яких піридинове кільце сконденсоване з піридазиндіоновим кільцем, що мають загальну формулу: R1 = -Η, -NH 2, -Вr, -ОН, -СООН, зокрема: 7-(b-D-рибофуранозил)піридо[2,3-d]-6Нпіридазин-5,8-діону натрієва сіль (1), 4-аміно-7-(b-D-рибофуранозил)піридо[2,3-d]6Н-піридазин-5,8-діону натрієва сіль (2), 12 3-бром-7-(b-D-рибофуранозил)піридо[2,3-d]6Н-тридазин-5,8-діону натрієва сіль (3), 4-гідрокси-7-(b-D-рибофуранозил)піридо[2,3d]-6Н-піридазин-5,8-діону динатрієва сіль (4), 3-карбокси-7-(b-D-рибофуранозил)піридо[2,3d]-6Н-піридазин-5,8-діону динатрієва сіль (5), піридо[2,3-d]-6Н-піридазин-5,8-діону літієва сіль (6), піридо[2,3-d]-6Н-піридазин-5,8-діону натрієва сіль (7), піридо[2,3-d]-6Н-піридазин-5,8-діону калієва сіль (8). А також були досліджені похідні бензо[d]-3Нтридазин-1,4-діону, циклічного біоізостеру похідних пуринової системи, в яких бензольне кільце сконденсоване з піридазиндіоновим кільцем, що мають загальну формулу: R1=-Η, -NH2, -Cl, -ОН, -СООН, зокрема: 2-(b-D-рибофуранозил)бензо[d]-3Н-піридазин1,4-діону натрієва сіль (9), 5-аміно-2-(b-D-рибофуранозил)бензо[d]-3Нпіридазин-1,4-діону натрієва сіль (10), 6-аміно-2-(b-D-рибофуранозил)бензо[d]-3Нтридазин-1,4-діону натрієва сіль (11), 5-хлор-2-(b-D-рибофуранозил)бензо[d]-3Нтридазин-1,4-діону натрієва сіль (12), 5-гідрокси-2-(b-D-рибофуранозил)бензо[d]-3Нтридазин-1,4-діону динатрієва сіль (13), 5-аміно-бензо[d]-3Н-піридазин-1,4-діону літієва сіль (14), 5-аміно-бензо[d]-3Н-піридазин-1,4-діону натрієва сіль (15), 6-аміно-бензо[d]-3Н-піридазин-1,4-діону калієва сіль (16), 5-гідрокси-бензо[d]-3Н-піридазин-1,4-діону динатрієва сіль (17), 6-карбокси-бензо[d]-3Н-піридазин-1,4-діону динатрієва сіль (18). Були також досліджені похідні шразино[2,3-d]6Н-піридазин-5,8-діону, циклічного біоізостеру похідних п уринової системи, в яких піразинове кільце сконденсоване з піридазиндіоновим кільцем, що мають загальну формулу: R1=-Η, -ΝΗ2, -Вr, -ОН, -СООН, зокрема: 7-(b-D)-рибофуранозил)піразино[2,3-d]-6Нпіридазин-5,8-діону натрієва сіль (19), 2-аміно-7-(b-D)-рибофуранозил)піразино[2,3d]-6Н-піридазин-5,8-діону натрієва сіль (20), 13 85389 3-аміно-7-(b-D)-рибофуранозил)тразино[2,3-d]6Н-піридазин-5,8-діону натрієва сіль (21), 3-бром-7-(b-D)-рибофуранозил)піразино[2,3-d]6Н-піридазин-5,8-діону натрієва сіль (22), 2-гідрокси-7-(b-D)рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8діону динатрієва сіль (23), 2-карбокси-7-(b-D)рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8діону динатрієва сіль (24), піразино[2,3-d]-6Н-піридазин-5,8-діону літієва сіль (25), піразино[2,3-d]-6Н-піридазин-5,8-діону натрієва сіль (26), 3-бром-піразино[2,3-d]-6Н-піридазин-5,8-діону калієва сіль (27),2-аміно-піразино[2,3-d]-6Н-піридазин-5,8-діону натрієва сіль (28). Також були досліджені похідні піримідо[4,5-d]6Н-піридазин-5,8-діону, циклічного біоізостеру похідних пуринової системи, в яких піримідинове кільце сконденсоване з піридазиндіоновим кільцем, що мають загальну формулу: R1 = -Η, -ΝΗ2, -Вr, -ОН, -СООН, зокрема: 7-(b-D)-рибофуранозил)піримідо[4,5-d]-6Нпіридазин-5,8-діону натрієва сіль (29), 2-аміно-7-(b-D)-рибофуранозил)піримідо[4,5d]-6Н-піридазин-5,8-діону натрієва сіль (30), 4-аміно-7-(b-D)-рибофуранозил)тримідо[4,5-d]6Н-піридазин-5,8-діону натрієва сіль (31), 2-бром-7-(b-D)-рибофуранозил)піримідо[4,5-d]6Н-піридазин-5,8-діону натрієва сіль (32), 4-гідрокси-7-(b-D)рибофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8діону натрієва сіль (33), 4-карбокси-7-(b-D)рибофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8діону натрієва сіль (34), піримідо[4,5-d]-6Н-піридазин-5,8-діону літієва сіль (35), 2-аміно-піримідо[4,5-d]-6Н-тридазин-5,8-діону натрієва сіль (36), 4-бром-піримідо[4,5-d]-6Н-тридазин-5,8-діону калієва сіль (37). Сполуки 1-8, що є похідними піридо[2,3-d]-6Нпіридазин-5,8-діону, отримували конденсацією орто-дикарбоксизаміщених піридинів з гідразингідратом в середовищі оцтової кислоти (Taguchi Hiroshi. A new fluorometric assay method for guinolinic acid. Analitic Biochemistry, 1983, 131 (1), p. 194197). Сполуки 9-18, що є похідними бензо[2,3-d]-3Нпіридазин-1,4-діону (фталазиндіону), отримували конденсацією орто-фталевої кислоти з гідразингідратом в середовищі оцтової кислоти (Huntress E.H., Stanley L.N., Parker A.S. The Preparation of 3 14 Aminophtalhydrazide for Use in the Demonstration of Chemiluminescence, J. Am. Chem. Soc, 1994, v. 56, p. 241-242). Сполуки 19-28, що є похідними піразино[2,3-d]6Н-шридазин-5,8-діону, отримували конденсацією орто-дикарбоксизаміщених піразинів з гідразингідратом в середовищі оцтової кислоти (ZyczynskaBaloniak I., Czajka R., Zinkowska E. Synthesis of Derivatives of 4-Hydroxypyra zine-[2,3-d]pyridazine-lone. Polish Journal of Chemistry. 1978, v. 52, p. 2461-2465; Kormendy K., RuffF. Pyridazines Condensed with a Heteroring. III., Acta ChimikaHungarika. 1990, 127 (2), p. 253-262). Сполуки 29-37, що є похідними піримідо[4,5-d]6Н-піридазин-5,8-діону, отримували конденсацією орто-дикарбоксизаміщених піримідинів з гідразингідратом в середовищі оцтової кислоти (Yurugi S., Hieda Μ. Studies on the Synthesis of N- Heterocyclic Compounds. Chemistry, Pharmaceutic Bull., 1972, v. 20 (7), p. 1522-1527, ibid., p. 1513-1521). Поставлене завдання було вирішене виявленням біологічної активності зазначених вище циклічних біоізостерів пуринової системи та їх фармакологічно прийнятних солей на нітрергічні та дофамінергічні механізми клітин організму, що мають порушення таких систем. Далі винахід пояснюється наступними прикладами, що не обмежують предмет винаходу, які ілюструють в експериментах in vivo на моделях різних патологій ефект застосування зазначених сполук при розладах, викликаних порушенням нітрергічної та дофамінергічної систем організму тварин. 1. Вплив сполук згідно з винаходом на розлади, викликані морфіновою абстиненцією. Були досліджені ефекти дії сполук №№ 1, 4, 6, 10, 11, 18, 21, 24, 26, 32, 35, 37 згідно з винаходом на поведінкові показники, а також на нітрергічну систему мозку тварин, у яких за відомою моделлю, визнаною також моделлю героїнової абстиненції людини, був змодельований стан фізичної залежності від морфіну - морфінової абстиненції. Фізичну залежність від морфіну моделювали на 27 групах самців-щурів Wistar масою 250-350 г віком 6 місяців: - тваринам групи № 1 (n = 7) морфін не вводили, і вони були контролем; - тваринам групи № 2 (n = 7) вводили морфіну гідрохлорид до досягнення вираженого абстинентного синдрому; - тваринам груп №№ 3-14 (n = 7) вводили одну із сполук піридошридазиндіонового ряду - 1 або 4, або 6 згідно з винаходом (групи №№ 3, 4, 5), або одну із сполук бензопіридазиндіонового ряду - 10 або 11, або 18 згідно з винаходом (групи №№ 6, 7, 8), або одну із сполук піразиношридазиндіонового ряду - 21 або 24, або 26 згідно з винаходом (групи №№ 9,10, 11), або одну із сполук тримідинопіридазиндіонового ряду -32 або 35, або 37 (групи №№ 12,13,14); - тваринам груп №№ 15-26 (n =7) вводили морфіну гідрохлорид до досягнення вираженого абстинентного синдрому і потім: в кожній групі - по одній із сполук згідно з винаходом за схемою, аналогічною для груп №№ 3-14. 15 85389 Ін'єкції морфіну гідрохлориду здійснювали внутрішньочеревинно за модифікованою схемою: протягом 6 днів два рази на добу (в 10.00 і 20.00) в зростаючих дозах від 10-100 мг/кг: 1 день - по 10 мг/кг, 2 день - по 20 мг/кг, 3 день - по 40 мг/кг, 4 день - по 60 мг/кг, 5 день - по 80 мг/кг, 6 день - по 100 мг/кг. Ін'єкції сполук згідно з винаходом проводили тричі внутрішньом'язово в дозі 20 мкг протягом доби, наступної після останньої дози морфіну. (Dum J., Blasig J., Herz Α.: Buprenorphine: demonstration of physical dependence liability. Eur. J. Pharmacol., 1981, V. 70, p. 293-300; Rahman S., Ali Khan R., Kumar A. Experimental study of the morphine de-addiction properties of Depphinium denudatum Wall, BMC Complement Altern. Med., 2002, V. 29, p. 1-6). Через 36 годин після останньої ін'єкції в групах оцінювали рухові та вегетативні ознаки поведінки тварин за ознаками, що є специфічними ознаками абстиненції, в тесті "відкрите поле" (арена діаметром 120 см і висотою стінок 40 см). Вираженість абстинентного синдрому оцінювали протягом 5 хвилин за рядом специфічних для синдрому відміни рухови х ознак: обтрушування за типом "мокрого собаки", корчі, жування, скрегіт зубами, струшування передніми лапами, та вегетативних ознак: діарея, птоз, ринорея, пілоерекція, 16 диспное, писк при торканні, агресивність (Blasig J., Herz Α., Reinhold Κ., Zieglgansberger S. Development of physical dependence on morphine in respect to time and dosage and quantification of the precipitated withdrawal syndrome in rats. Psychopharmacologia, Berlin, 1973, V. 33, p. 1938; Rahman S., Ali Khan R., Kumar A. Experimental study of the morphine de-addiction properties of Depphinium denudatum Wall, BMC Complement Altern. Med., 2002, V. 29, p. 1-6). Спостережувані ознаки реєстрували кількісно (якщо це було можливо) з подальшим присвоєнням кожній ознаці індексу (який залежить від специфічності ознаки) і підраховуванням суми балів. Вираженість абстинентного синдрому представляли у вигляді суми балів. Результати обробляли із застосуванням непараметричного статистичного аналізу з використанням тесту Манна-Уітні. На фіг. 1 показана діаграма впливу морфіну та сполук згідно з винаходом на поведінкові реакції досліджуваних тварин, на якій вплив оцінений за усередненою для ряду сполук сумою Μ балів на основі зазначених індексів ознак абстинентного синдрому для тварин груп №№ 1-27. В табл. 1 наведеш усереднені відносні дані. Таблиця 1 Вплив сполук згідно з винаходом на розвиток морфінової абстиненції Специфічні ознаки абстиненції Індекс Достовірні відмінності (критерій Хигрец - квадрат) у прояві ознак абстиненції Морфін Морфін Морфін Морфін (Морфін + (Морфін + (Морфін + Контроль - (Морфін + спосполука 10 сполука 21 сполука 32 морфін лука 1 або 4, або 11, або або 24, або або 35, або або 6) 18) 26) 37) "мок2 0,0002 1,0000 0,7562 0,7821 1,0000 обтрушування рого собаки" корчі жування скрегіт зубами струшування передніми лапами писк при торканні діарея птоз ринорея пілоерекція диспное агресивність 2 2 2 2 0,0507 0,0308 0,1266 0,0180 0,7821 0,1888 0,7144 0,7821 0,7546 0,1032 0,8652 0,8217 0,3456 0,1975 0,2994 0,6745 0,5578 0,1888 0,7003 0,9321 1 1 2 3 2 2 1 0,0053 0,0075 0,0053 0,2994 0,5770 0,0053 0,5770 0,1888 0,0046 0,0201 0,3017 0,1847 0,0722 0,8327 0,1342 0,0032 0,0320 0,4032 0,2567 0,0834 0,8456 0,1968 0,0067 0,0105 0,2131 0,2567 0,0567 0,7921 0,2035 0,0001 0,0232 0,2935 0,2345 0,0685 0,8456 Із табл. 1 видно, що з ознак, які характеризують розвиток абстинентного синдрому, сполуки згідно з винаходом найбільш ефективно купірували діарею, птоз і диспное. При цьому вони впливали і на судомну активність, викликану відміною морфіну. Таким чином, вдалося виявити певні компоненти морфінової абстиненції, чутливі до корекції сполуками згідно з винаходом. 2. Вплив сполук згідно з винаходом на нітрергічні показники в мозку. 2.1. Отримання матеріалу для біохімічних досліджень Після вищеописаних експериментів у щурів вилучали мозок і одразу поміщали його в льодовий 0,9%-ний розчин хлориду натрію. Із мозку після охолодження виділяли такі структури: кору великих півкуль, гіпокамп, середній мозок, стриатум, стовбур мозку, гіпоталамус і мозочок. Виділену тканину гомогенізували в гомогенізаторі Potter S протягом 3 хвилин при 1500 об/хв в 4-5 об'ємах 20 мМ HEPES (рН 7,5) при 4°С. Супернатанти 17 85389 центрифугували 30 хвилин при 11000g при 4°С, і частину отриманих супернатантів відбирали для визначення нітратів і нітритів (NOX), а в решту додавали охолоджений 20 мМ HEPES (рН 7,5), що містить 0,5 мМ етилендіамінтетраацетату (EDTA), 1 мМ дитіотреїтолу (DDT), 1 мМ фенілметилсульфонілфториду (FMSF), апротинін і лейпептин в концентрації по 5 мкг/мл, і використовували для визначення активності ферменту синтази оксиду азоту (NOC). 2.2. Визначення нітратів/нітритів (NOX) Для оцінки інтенсивності метаболізму оксиду азоту щурів проводили кількісне визначення стабільних метаболітів оксиду азоту - нітритів і нітратів (NOX) флюорометричним методом за інтенсивністю флюоросценції нафтотриазолу, продукту реакції 2,3-діамінонафталіну (DAN) і нітриту в кислому середовищі (Misko T.R., Schilling R.J., Salvemini D. et al. A fluorometric assay for the measurement of nitrite in biological samples. Anal. Biochem., 1993, V. 214, p. 11-16) з модифікаціями (Lei В., Adachi Ν., Nagaro Т., Arai Т. Measurement of total nitric oxide metabolite (NO(x)(-)) levels in vivo. Brain. Res. Protoc, 1999, V. 4, p. 415-419). Депротеїнізовані при 100°С супернатанти мозку поміщали в нітрит-регенеруючу систему, що містить 0,125 Ед/мл нітратредуктази, 25 мкМ NADFN і 25 мкМ FAD, приготованих в 20 мМ ТрісНСІ буфері рН 7,6 і інкубували 30 хвилин при 37°С. Для окиснення NADFN використовували систему лактатдегідрогеназа (LDG)/nipyBaT. Потім додавали 316,0 мкМ розчину ДАН в 0,62 Μ НС1 пта інкубували 10 хв в темряві. Для стабілізації флюоросценції нафтотриазолу, що утворився, додавали 280 мМ NaOH. Інтенсивність флюоросценції вимірювали на спектрофлюорометрі Hitachi F-3000 при довжині хвилі збудження 365 нм та емісії 405 нм. Для розрахунку концентрації NOX- в мозку був використаний стандартний розчин нітрату натрію. Концентрацію NOX- виражали в нмоль/мг білка. 18 2.3. Визначення активності синтази оксиду азоту Активність синтази оксиду азоту (NOC) визначали радіометричним методом за швидкістю накопичення L-цитруліну в реакції окиснення [3Н]Lаргініну, що її каталізує NOC (Bredt and Snyder. Nitric oxide mediates glutamate-linked enhancement of cGMP levels in the cerebellum. Proc. Natl. Sci., USA, 1989, V. 86, p. 9030-9033). Утворення Lцитруліну в цій реакції еквівалентно біосинтезу оксиду азоту. Реакцію ініціювали додаванням супернатанта мозку в реакційне середовище, що містило 2 мкКю/мл [3H]L-apriHiHy, 20 мМ HEPES (рН 7,4), 0,2 мМ СаСl2,5 мкМ FAD, 5 мкМ ФМН, 1мМ NADFN, 50 мкМ ВН4 при дослідженні супернатантів мозку. Після 15-60 хвилин інкубації при 37°С у зразки додавали суспензію Dowex 50WX8-400 (Nа+форма), яка сорбуе [3H]L-аргініл, що не прореагував, але не [3H]L-цитрулін. Після сорбції радіоактивність зразків визначали на сцинтиляційному лічильнику SL-4000 ("Intertechnique"). Активність Са2+-залежної і Са2+-незалежної ізоформ NOC визначали за різницею швидкостей утворення [3H]L-цитрулін у в трьох паралельних зразках, що містять 2 мМ EDTA (хелатор Са2+), 2 мМ EDTA + 2 мМ L-NAME (інгібітор всіх ізоформ NOC) та без інгібіторів. Активність ферменту виражали в пмоль [3H]L-цитрулін у, накопиченого за 1 хвилину на мг білка в супернатанті. 2.4. Кількісне визначення білка Вміст білка в пробах визначали за методом Бредфорда (Bradford MM. A rapid and sensitive method for quantitation of microgram quantities of protein using the principle of protein binding. Anal. Biochem., 1976, V. 72, p. 248-254) з використанням барвника Кумасі блакитного. Статистичний аналіз проводили методами, адекватними для конкретного вибирання. Дані представлені у вигляді середнього ± похибка середнього. Таблиця 2 Вплив морфіну і сполук згідно з винаходом на показники нітрергічної системи в мозку Показник у відділі мозку Група №1 (контроль) Нітрити, нмоль/мг білка: Кора великих 4,63±0,29 півкуль Мозочок 6,37±0,64 Стовбур 8,24±1,02 Стриатум 7,25±0,66 Гіпокамп 4,39±0,23 Середній мозок 5,66±0,19 Гіпоталамус 6,57±0,50 Група №2 (морфін) Групи №№3-14 (сполука з групи 1, 4, 6, 10, 11, 18, 21, 24,26,32, 35, 37) Групи Групи №№15-17 №№18-20 (морфін + (морфін + сполука 1 сполука 10 або 4, або або 11, або 6) 18) Групи Групи №№21-23 №№24-27 (морфін + (морфін+ сполука 21 сполука 32 або 24, або або 35, або 26) 37) 5,31±0,29 4,31±0,37 4,72±0,37 4,93±0,39 4,62±0,27 4,84±0,31 6,07±0,42 7,63±0,96 4,92±0,43 6,45±0,69 9,41±1,20 4,62±0,71 6,66±0,63 6,31±0,58 6,11±0,29 6,47±0,72 6,65±0,70 6,77±0,83 5,46±0,44 6,57±0,72 3,57±0,42 5,44±0,43 5,50±0,48 6,57±0,88 5,85±0,47 6,99±0,82 3,57±0,42 5,24±0,49 5,75±0,39 6,91±0,58 5,76±0,49 7,07±0,85 3,57±0,42 5,27±0,41 5,99±0,58 6,87±0,75 5,93±0,54 6,87±0,81 3,57±0,42 5,31±0,33 5,95±0,52 6,77±0,46 19 85389 20 Продовження табл. 2 Показник у відділі мозку Група №1 (контроль) Група №2 (морфін) Активність NOC, пмоль/хв/мг білка: Стриатум 1,73±0,07 1,19±0,14 Середній мозок 2,18±0,09 3,08±0,09 Гіпокамп 2,55±0,12 3,10±0,20 Гіпоталамус 5,37±0,20 3,42±0,54 Групи №№3-14 (сполука з групи 1, 4, 6, 10, 11, 18, 21, 24,26,32, 35, 37) 1,26±0,08 2,60±0,29 3,09±0,16 5,45±0,24 Як видно з результатів, наведених в табл. 2, в мозку морфін специфічно впливав на накопичення нітритів і активність NOC: в стриатумі та гіпоталамусі спостерігалося зниження нітрергічних показників, а в середньому мозку і гіпокампі - їх підвищення (Р
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of cyclic bioisosters derivatives of purine system for treatment of disorders caused by abnormalities of nitrergic and dopaminergic systems
Автори англійськоюZhylov Valerii Khazhmuratovych, Zhuravliov Serhei Vladimirovich, Markov Aleksandr Nikolaevich, Polosin Vladimir Mikhailovich
Назва патенту російськоюПрименение циклических биоизостеров производных пуриновой системы для лечения расстройств, вызванных нарушениями нитрэргической и дофаминергической систем
Автори російськоюЖИЛОВ Валерий Хажмуратович, Журавлев Сергей Владимирович, Марков Александр Николаевич, Полосин Владимир Михайлович
МПК / Мітки
МПК: A61K 31/00
Мітки: нітрергічної, систем, викликаних, порушеннями, біоізостерів, лікування, системі, застосування, пуринової, розладів, циклічних, похідних, дофамінергічної
Код посилання
<a href="https://ua.patents.su/15-85389-zastosuvannya-ciklichnikh-bioizosteriv-pokhidnikh-purinovo-sistemi-dlya-likuvannya-rozladiv-viklikanikh-porushennyami-nitrergichno-i-dofaminergichno-sistem.html" target="_blank" rel="follow" title="База патентів України">Застосування циклічних біоізостерів похідних пуринової системи для лікування розладів, викликаних порушеннями нітрергічної і дофамінергічної систем</a>
Попередній патент: Жорстка пачка для стрижнеподібних курильних виробів
Наступний патент: Циклічні біоізостери похідних пуринової системи і фармацевтична композиція на їх основі
Випадковий патент: Спосіб одержання d-валеролактону на твердому cu-вмісному каталізаторі












