Похідні фенілпентадієноїлу та їх застосування як антагоністів par 1
Номер патенту: 97370
Опубліковано: 10.02.2012
Автори: Перес Мішель, Ламот Марі, Ле Гран Бруно, Летьєн Робер
Формула / Реферат
1. Сполуки загальної формули (І):
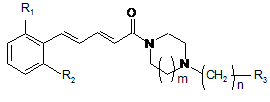 , I
, I
де:
R1 та R2, ідентичні або різні, являють собою:
атом водню або атом галогену, CN або NO2, причому R1 та R2 не є атомами водню одночасно;
m означає: 1 або 2;
n означає: 0,1 або 2;
R3 являє собою:
фенільний радикал, заміщений або не заміщений одним або декількома радикалами, вибраними з атома галогену, гідроксильної групи або С1-С6алкільної групи; С2-С6алкільну групу, заміщену або не заміщену одним або декількома радикалами, вибраними з атома галогену або гідроксильної групи; циклоалкільну групу; піридин; тіофен; пірол, заміщений або не заміщений С1-С6алкільною групою; тіазол або фуран;
або їх терапевтично прийнятні солі або сольвати.
2. Сполуки за п. 1, які відрізняються тим, що R1 є нітрогрупою, R2 є атомом водню, m дорівнює 1, n дорівнює 0, і R3 є фенільною групою, заміщеною одним або декількома атомами галогенів або однією або декількома С1-С6алкільними групами, циклоалкільною групою або піридином.
3. Сполуки за п. 1, які відрізняються тим, що R1 є ціаногрупою, R2 є атомом водню, m дорівнює 1, n дорівнює 0, і R3 є фенільною групою, заміщеною одним або декількома атомами галогенів або однією або декількома С1-С6алкільними групами, циклоалкільною групою або піридином.
4. Сполука за п. 1, яка відрізняється тим, що вона вибрана з:
2-[5-оксо-5-(4-піридин-2-ілпіперазин-1-іл)-пента-1,3-дієніл]-бензонітрилу;
2-[5-(4-циклопентилпіперазин-1-іл)-5-оксопента-1,3-дієніл]-5-бензонітрилу;
2-[5-(4-циклогексилпіперазин-1-іл)-5-оксопента-1,3-дієніл]-бензонітрилу;
2-{5-[4-(3-хлорпропіл)-піперазин-1-іл]-5-оксопента-1,3-дієніл}-бензонітрилу;
2-{5-[4-(3-хлорфеніл)-піперазин-1-іл]-5-оксопента-1,3-дієніл}-бензонітрилу;
2-{5-[4-(2-гідроксифеніл)-піперазин-1-іл]-5-оксопента-1,3-дієніл}-бензонітрилу;
2-{5-[4-(2,4-диметилбензил)-[1,4]діазепан-1-іл]-5-оксопента-1,3-дієніл}-бензонітрилу;
2-{5-[4-(2-метилбензил)-[1,4]діазепан-1-іл]-5-оксопента-1,3-дієніл}-бензонітрилу;
5-(2-хлорфеніл)-1-(4-циклопентилпіперазин-1-іл)-пента-2,4-дієн-1-ону;
5-(2-хлорфеніл)-1-(4-циклогексилпіперазин-1-іл)-пента-2,4-дієн-1-ону;
5-(2-хлорфеніл)-1-(4-циклогептилпіперазин-1-іл)-пента-2,4-дієн-1-ону;
5-(2-хлорфеніл)-1-[4-(3-хлорпропіл)-піперазин-1-іл]-пента-2,4-дієн-1-ону;
5-(2-хлорфеніл)-1-(4-піридин-2-ілпіперазин-1-іл)-пента-2,4-дієн-1-ону;
5-(2-хлорфеніл)-1-[4-(2-метилбензил)-[1,4]діазепан-1-іл]-пента-2,4-дієн-1-ону;
5-(2-хлорфеніл)-1-[4-(2-фторбензил)-[1,4]діазепан-1-іл]-пента-2,4-дієн-1-ону;
5-(2-нітрофеніл)-1-(4-фенілпіперазин-1-іл)-пента-2,4-дієн-1-ону;
1-(4-циклогексилпіперазин-1-іл)-5-(2-нітрофеніл)-пента-2,4-дієн-1-ону;
1-(4-циклопентилпіперазин-1-іл)-5-(2-нітрофеніл)-пента-2,4-дієн-1-ону;
1-[4-(4-фторфеніл)-піперазин-1-іл]-5-(2-нітрофеніл)-пента-2,4-дієн-1-ону;
1-[4-(3-хлорпропіл)-піперазин-1-іл]-5-(2-нітрофеніл)-пента-2,4-дієн-1-ону;
5-(2-нітрофеніл)-1-(4-піридин-2-ілпіперазин-1-іл)-пента-2,4-дієн-1-ону;
1-(4-циклопентилметилпіперазин-1-іл)-5-(2-нітрофеніл)-пента-2,4-дієн-1-ону;
5-(2-нітрофеніл)-1-(4-тіофен-3-ілметилпіперазин-1-іл)-пента-2,4-дієн-1-ону;
1-[4-(4-фторбензил)-піперазин-1-іл]-5-(2-нітрофеніл)-пента-2,4-дієн-1-ону;
1-(4-бутилпіперазин-1-іл)-5-(2-нітрофеніл)-пента-2,4-дієн-1-ону;
1-[4-(3-хлорфеніл)-піперазин-1-іл]-5-(2-нітрофеніл)-пента-2,4-дієн-1-ону;
5-(2,6-дифторфеніл)-1-(4-фенілпіперазин-1-іл)-пента-2,4-дієн-1-ону;
1-(4-циклогексилпіперазин-1-іл)-5-(2,6-дифторфеніл)-пента-2,4-дієн-1-ону;
1-[4-(3-хлорпропіл)-піперазин-1-іл]-5-(2,6-дифторфеніл)-пента-2,4-дієн-1-ону;
1-(4-циклопентилпіперазин-1-іл)-5-(2,6-дифторфеніл)-пента-2,4-дієн-1-ону;
5-(2,6-дифторфеніл)-1-[4-(4-фторбензил)-піперазин-1-іл]-пента-2,4-дієн-1-ону;
1-(4-циклопентилпіперазин-1-іл)-5-(2-фторфеніл)-пента-2,4-дієн-1-ону;
1-(4-циклогексилпіперазин-1-іл)-5-(2-фторфеніл)-пента-2,4-дієн-1-ону;
5-(2-фторфеніл)-1-(4-піридин-2-ілпіперазин-1-іл)-пента-2,4-дієн-1-ону;
5-(2-фторфеніл)-1-(4-фенілпіперазин-1-іл)-пента-2,4-дієн-1-ону;
1-[4-(3-хлорпропіл)-піперазин-1-іл]-5-(2-фторфеніл)-пента-2,4-дієн-1-ону;
та їх терапевтично прийнятних солей та сольватів.
5. Сполуки за будь-яким з пп. 1-4, які відрізняються тим, що їх використовують як лікарські засоби.
6. Спосіб одержання сполук загальної формули (І) за будь-яким з пп. 1-4, в якому здійснюють конденсацію проміжної сполуки загальної формули (II):
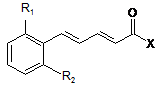 , II
, II
де R1 та R2 є такими самими, як в описі загальної формули (І) в п. 1, X може являти собою відхідну групу, таку як хлор, або X може являти собою гідроксильну групу,
з аміном загальної формули (III)
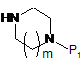 , III
, III
де Р1 являє собою захисну групу;
одержана проміжна сполука загальної формули (IV)
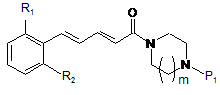 , IV
, IV
де R1, R2 та Р1 є такими самими, як визначено вище,
дає сполуки загальної формули (І) після депротекції і реакції одержаного аміну або з реагентом загальної формули R3(CH2)nY, де R3 та n є такими самими, як визначено в описі загальної формули (І) в п. 1, а Y являє собою відхідну групу, наприклад - Сl, Br, I, OSO2CH3, OSO2CF3 або О-тозил, або з альдегідом формули R3-(CH2)n-1-CHO, де R3 і n є такими самими, як визначено вище.
7. Спосіб одержання сполук загальної формули (І) за будь-яким з пп. 1-4, в якому здійснюють конденсацію проміжної сполуки загальної формули (II):
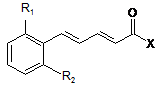 , II
, II
де R1 та R2 є такими самими, як визначено в описі загальної формули (І) в п. 1, X може являти собою відхідну групу, таку як хлор, або X може бути гідроксильною групою,
з аміном загальної формули (V)
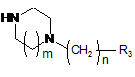 , V
, V
де m, n та R3 є такими самим, як визначено в описі загальної формули (І) п. 1,
в результаті якої одержують сполуки загальної формули (І).
8. Фармацевтична композиція, яка містить як активний продукт щонайменше одну сполуку за будь-яким з пп. 1-4 в комбінації з фармацевтично прийнятним носієм.
9. Застосування сполуки за будь-яким з пп. 1-4 для виготовлення лікарського засобу проти агрегації тромбоцитів.
10. Застосування сполуки за будь-яким з пп. 1-4 для виготовлення лікарського засобу для лікування і/або профілактики артеріальних або венозних тромбозів.
11. Застосування сполуки за будь-яким з пп. 1-4 для виготовлення лікарського засобу для лікування і/або профілактики стабільної стенокардії, порушень серцевого ритму, церебральних судинних явищ, серцевої недостатності, гіпертензії або інфаркту міокарда.
12. Застосування сполуки за будь-яким з пп. 1-4 для виготовлення лікарського засобу для лікування і/або профілактики гострих коронарних синдромів.
13. Застосування сполуки за будь-яким з пп. 1-4 для виготовлення лікарського засобу для лікування рестенозу.
14. Застосування сполуки за будь-яким з пп. 1-4 для виготовлення лікарського засобу для лікування і/або профілактики фібриляції передсердь і ремоделювання міокарда.
15. Застосування сполуки за будь-яким з пп. 1-4 для виготовлення лікарського засобу для лікування і/або профілактики запальних захворювань, легеневих захворювань, шлунково-кишкових захворювань, розвитку фіброзу у пацієнтів з хронічним захворюванням печінки або шкірних хвороб.
16. Застосування сполуки за будь-яким з пп. 1-4 для виготовлення лікарського засобу для лікування і/або профілактики раку.
17. Продукт, який містить щонайменше одну сполуку за будь-яким з пп. 1-4 та інший серцево-судинний агент, у вигляді комбінованого продукту для одночасного, роздільного або відстроченого застосування при лікуванні серцево-судинних захворювань.
18. Продукт за п. 16, який відрізняється тим, що інший серцево-судинний агент являє собою агент проти агрегації тромбоцитів, такий як аспірин, клопідогрел, тиклопідин, абциксимаб, тирофібан або ептифібатид.
19. Застосування сполуки загальної формули І як антагоніста PAR 1 для виготовлення лікарського засобу для лікування і/або профілактики фібриляції передсердь.
Текст
1. Сполуки загальної формули (І): 2 3 2-[5-(4-циклопентилпіперазин-1-іл)-5-оксопента1,3-дієніл]-5-бензонітрилу; 2-[5-(4-циклогексилпіперазин-1-іл)-5-оксопента-1,3дієніл]-бензонітрилу; 2-{5-[4-(3-хлорпропіл)-піперазин-1-іл]-5-оксопента1,3-дієніл}-бензонітрилу; 2-{5-[4-(3-хлорфеніл)-піперазин-1-іл]-5-оксопента1,3-дієніл}-бензонітрилу; 2-{5-[4-(2-гідроксифеніл)-піперазин-1-іл]-5оксопента-1,3-дієніл}-бензонітрилу; 2-{5-[4-(2,4-диметилбензил)-[1,4]діазепан-1-іл]-5оксопента-1,3-дієніл}-бензонітрилу; 2-{5-[4-(2-метилбензил)-[1,4]діазепан-1-іл]-5оксопента-1,3-дієніл}-бензонітрилу; 5-(2-хлорфеніл)-1-(4-циклопентилпіперазин-1-іл)пента-2,4-дієн-1-ону; 5-(2-хлорфеніл)-1-(4-циклогексилпіперазин-1-іл)пента-2,4-дієн-1-ону; 5-(2-хлорфеніл)-1-(4-циклогептилпіперазин-1-іл)пента-2,4-дієн-1-ону; 5-(2-хлорфеніл)-1-[4-(3-хлорпропіл)-піперазин-1іл]-пента-2,4-дієн-1-ону; 5-(2-хлорфеніл)-1-(4-піридин-2-ілпіперазин-1-іл)пента-2,4-дієн-1-ону; 5-(2-хлорфеніл)-1-[4-(2-метилбензил)[1,4]діазепан-1-іл]-пента-2,4-дієн-1-ону; 5-(2-хлорфеніл)-1-[4-(2-фторбензил)-[1,4]діазепан1-іл]-пента-2,4-дієн-1-ону; 5-(2-нітрофеніл)-1-(4-фенілпіперазин-1-іл)-пента2,4-дієн-1-ону; 1-(4-циклогексилпіперазин-1-іл)-5-(2-нітрофеніл)пента-2,4-дієн-1-ону; 1-(4-циклопентилпіперазин-1-іл)-5-(2-нітрофеніл)пента-2,4-дієн-1-ону; 1-[4-(4-фторфеніл)-піперазин-1-іл]-5-(2нітрофеніл)-пента-2,4-дієн-1-ону; 1-[4-(3-хлорпропіл)-піперазин-1-іл]-5-(2нітрофеніл)-пента-2,4-дієн-1-ону; 5-(2-нітрофеніл)-1-(4-піридин-2-ілпіперазин-1-іл)пента-2,4-дієн-1-ону; 1-(4-циклопентилметилпіперазин-1-іл)-5-(2нітрофеніл)-пента-2,4-дієн-1-ону; 5-(2-нітрофеніл)-1-(4-тіофен-3-ілметилпіперазин-1іл)-пента-2,4-дієн-1-ону; 1-[4-(4-фторбензил)-піперазин-1-іл]-5-(2нітрофеніл)-пента-2,4-дієн-1-ону; 1-(4-бутилпіперазин-1-іл)-5-(2-нітрофеніл)-пента2,4-дієн-1-ону; 1-[4-(3-хлорфеніл)-піперазин-1-іл]-5-(2-нітрофеніл)пента-2,4-дієн-1-ону; 5-(2,6-дифторфеніл)-1-(4-фенілпіперазин-1-іл)пента-2,4-дієн-1-ону; 1-(4-циклогексилпіперазин-1-іл)-5-(2,6дифторфеніл)-пента-2,4-дієн-1-ону; 1-[4-(3-хлорпропіл)-піперазин-1-іл]-5-(2,6дифторфеніл)-пента-2,4-дієн-1-ону; 1-(4-циклопентилпіперазин-1-іл)-5-(2,6дифторфеніл)-пента-2,4-дієн-1-ону; 5-(2,6-дифторфеніл)-1-[4-(4-фторбензил)піперазин-1-іл]-пента-2,4-дієн-1-ону; 1-(4-циклопентилпіперазин-1-іл)-5-(2-фторфеніл)пента-2,4-дієн-1-ону; 1-(4-циклогексилпіперазин-1-іл)-5-(2-фторфеніл)пента-2,4-дієн-1-ону; 97370 4 5-(2-фторфеніл)-1-(4-піридин-2-ілпіперазин-1-іл)пента-2,4-дієн-1-ону; 5-(2-фторфеніл)-1-(4-фенілпіперазин-1-іл)-пента2,4-дієн-1-ону; 1-[4-(3-хлорпропіл)-піперазин-1-іл]-5-(2фторфеніл)-пента-2,4-дієн-1-ону; та їх терапевтично прийнятних солей та сольватів. 5. Сполуки за будь-яким з пп. 1-4, які відрізняються тим, що їх використовують як лікарські засоби. 6. Спосіб одержання сполук загальної формули (І) за будь-яким з пп. 1-4, в якому здійснюють конденсацію проміжної сполуки загальної формули (II): R1 O X R2 , II де R1 та R2 є такими самими, як в описі загальної формули (І) в п. 1, X може являти собою відхідну групу, таку як хлор, або X може являти собою гідроксильну групу, з аміном загальної формули (III) HN N m P1 , III де Р1 являє собою захисну групу; одержана проміжна сполука загальної формули (IV) R1 O N N m R2 P1 , IV де R1, R2 та Р1 є такими самими, як визначено вище, дає сполуки загальної формули (І) після депротекції і реакції одержаного аміну або з реагентом загальної формули R3(CH2)nY, де R3 та n є такими самими, як визначено в описі загальної формули (І) в п. 1, а Y являє собою відхідну групу, наприклад - Сl, Br, I, OSO2CH3, OSO2CF3 або О-тозил, або з альдегідом формули R3-(CH2)n-1-CHO, де R3 і n є такими самими, як визначено вище. 7. Спосіб одержання сполук загальної формули (І) за будь-яким з пп. 1-4, в якому здійснюють конденсацію проміжної сполуки загальної формули (II): R1 O X R2 , II де R1 та R2 є такими самими, як визначено в описі загальної формули (І) в п. 1, X може являти собою відхідну групу, таку як хлор, або X може бути гідроксильною групою, з аміном загальної формули (V) 5 97370 6 ,V де m, n та R3 є такими самим, як визначено в описі загальної формули (І) п. 1, в результаті якої одержують сполуки загальної формули (І). 8. Фармацевтична композиція, яка містить як активний продукт щонайменше одну сполуку за будьяким з пп. 1-4 в комбінації з фармацевтично прийнятним носієм. 9. Застосування сполуки за будь-яким з пп. 1-4 для виготовлення лікарського засобу проти агрегації тромбоцитів. 10. Застосування сполуки за будь-яким з пп. 1-4 для виготовлення лікарського засобу для лікування і/або профілактики артеріальних або венозних тромбозів. 11. Застосування сполуки за будь-яким з пп. 1-4 для виготовлення лікарського засобу для лікування і/або профілактики стабільної стенокардії, порушень серцевого ритму, церебральних судинних явищ, серцевої недостатності, гіпертензії або інфаркту міокарда. 12. Застосування сполуки за будь-яким з пп. 1-4 для виготовлення лікарського засобу для лікування і/або профілактики гострих коронарних синдромів. 13. Застосування сполуки за будь-яким з пп. 1-4 для виготовлення лікарського засобу для лікування рестенозу. 14. Застосування сполуки за будь-яким з пп. 1-4 для виготовлення лікарського засобу для лікування і/або профілактики фібриляції передсердь і ремоделювання міокарда. 15. Застосування сполуки за будь-яким з пп. 1-4 для виготовлення лікарського засобу для лікування і/або профілактики запальних захворювань, легеневих захворювань, шлунково-кишкових захворювань, розвитку фіброзу у пацієнтів з хронічним захворюванням печінки або шкірних хвороб. 16. Застосування сполуки за будь-яким з пп. 1-4 для виготовлення лікарського засобу для лікування і/або профілактики раку. 17. Продукт, який містить щонайменше одну сполуку за будь-яким з пп. 1-4 та інший серцевосудинний агент, у вигляді комбінованого продукту для одночасного, роздільного або відстроченого застосування при лікуванні серцево-судинних захворювань. 18. Продукт за п. 16, який відрізняється тим, що інший серцево-судинний агент являє собою агент проти агрегації тромбоцитів, такий як аспірин, клопідогрел, тиклопідин, абциксимаб, тирофібан або ептифібатид. 19. Застосування сполуки загальної формули І як антагоніста PAR 1 для виготовлення лікарського засобу для лікування і/або профілактики фібриляції передсердь. Даний винахід стосується похідних фенілпентадієноїлу, способу їх одержання, фармацевтичних композицій, які містять ці похідні, і застосування цих похідних як лікарських засобів для лікування і/або профілактики артеріальних і венозних тромбозів, гострих коронарних синдромів, рестенозу, стабільної стенокардії, порушень серцевого ритму, інфаркту міокарду, гіпертензії, серцевої недостатності, інсульту, запальних захворювань, легеневих захворювань, шлунково-кишкових захворювань, розвитку фіброзу у хворих з хронічними захворюваннями печінки, раку і шкірних хвороб. Даний винахід також стосується комбінацій сполук згідно з даним винаходом з іншими серцево-судинними засобами. Тромбоз вважається первинним фактором оклюзії судин, яка є причиною багатьох патофізіологічних ускладнень. Тому антитромботична терапія має виняткову важливість, оскільки вона здатна знизити ризик смертності від серцево-судинних захворювань і коронарних явищ. Хоча було показано, що значну антитромботичну активність для людини має декілька типів молекул, все ж зберігається потреба в нових молекулах, які мали б переваги в порівнянні з існуючими сполуками, частина з яких негативно впливає на час кровотечі або має інші небажані побічні ефекти (наприклад - ризик виникнення виразок шлунку при прийомі аспірину). Нещодавно був клонований рецептор 1 типу (PAR-1), що активувався протеазою, (Vu et al, Cell, 1991, 64: 1057-1068) і з'ясований його механізм дії (Coughlin et al, J. Clin. Invest. 1992, 89(2): 351-355). Цей рецептор, присутній, перш за все, на поверхні тромбоцитів, а також на поверхні ендотеліальних клітин (O'Brien et al, J. Biol. Chem. 2000, 275: 13502-13509), гладком'язових клітин (Hamilton et al, Br. J. Pharmacol. 2000, 130: 181-188) та фібробластів (Hung et al, J. Cell. Biol. 1992, 116(3): 827832), активується тромбіном, і тому його також називають тромбіновим рецептором. N-терміналь білка розщеплюється тромбіном між аргініном в положенні 41 і серіном в положенні 42 з вивільненням нового кінця, який після фолдинга буде діяти на активний центр як агоніст рецептора (Vu et al., Nature, 1991, 353, 674-677). Що стосується тромбоцитів, то цей специфічний механізм активації PAR-1 рецептора призводить до опосередкованої тромбіном агрегації тромбоцитів. Блокування цієї активації, наприклад - антагоністами PAR-1 рецептора, може інгібувати опосередковану тромбіном агрегацію тромбоцитів (Ahn et al, Drug of the Future, 2001, 26: 1065-1085). Тому блокування цих рецепторів може бути використане для лікування або профілактики тромбозу (Derian et al, J. Pharmacol. Exp. Ther., 2003, 855-861), гострих коронарних синдромів (Ossovskaya et al, Physiol. Rev., 2004, 84: 579-621) та рестенозу (Maryanoff et al, Curr. Med. Chem. Cardiovasc. Hematol. Agents, 2003, 13-36) і може зменшити некрози міокарду під час інфаркту або реперфузії HN N m CH2 n R3 7 (Steinberg et al., Моl. Pharmacol, 2005, 67: 2-11). На рівні легень активність антагоніста PAR-1 може запобігти виникненню деяких запальних захворювань (Moffatt et al., Curr. Op. Pharmacol., 2004, 221229). На рівні шлунково-кишкового тракту активність антагоніста PAR-1 може запобігти виникненню деяких запальних захворювань (Vergnolle et al, J. Clin. Invest., 2004, 1444-1456). Антагоністи PAR1 рецептора можуть також бути використані для лікування фіброзів у пацієнтів з хронічним захворюванням печінки (Fiorucci et al, Hepatology, 2004, 39: 365-375). Їх можна також використовувати як протиракові агенти, оскільки вони регулюють проліферацію клітин та утворення метастазів (Evanram et al., Nat. Med., 1998, 909-914; Boire et al, Cell., 2005, 120: 303-313). Нарешті, антагоністи PAR-1 можуть представляти інтерес в дерматології для лікування деяких шкірних хвороб (Schechter et al, J. Cell. Physiol., 1998, 176: 365-373; Algermissen et al, Arch. Dermatol. Res., 200, 292: 488-495; Meyer-Hoffert et al, Exp. Dermatol., 2004, 13: 234-241). Даний винахід стосується нового класу антагоністів PAR-1, які відрізняються від антагоністів попереднього рівня техніки іншою хімічною структурою та явними біологічними особливостями. Сполуки згідно з даним винаходом мають загальну формулу (І): де: R1 та R2, ідентичні або різні, являють собою: атом водню або атом галогену, CN або NO2, причому R1 та R2 не є атомами водню одночасно; m означає: 1 або 2; n означає: 0, 1 або 2; R3 являє собою: фенільний радикал, заміщений або не заміщений одним або декількома радикалами, вибраними з атома галогену, гідроксильної групи або С1С6 алкільної групи; С2-С6 алкільну групу, заміщену або не заміщену одним або декількома радикалами, вибраними з атома галогену або гідроксильної групи; циклоалкільну групу; піридин; тіофен; пірол, заміщений або не заміщений С1-С6алкільною групою; тіазол або фуран; або їх терапевтично прийнятні солі або сольвати. У наведених вище визначеннях: 97370 8 Всі комбінації замісників або змінних можливі в тих випадках, коли вони дають стабільні сполуки. Термін «галоген» означає фтор, хлор, бром або йод. Термін «алкільна група» означає лінійні або розгалужені, насичені або ненасичені аліфатичні вуглеводневі ланцюги, які містять задане число атомів вуглецю. Термін «циклоалкільна група» означає циклічні вуглеводневі ланцюги, які містять від 3 до 10 атомів вуглецю. Терапевтично прийнятні солі сполук згідно з даним винаходом включають стандартні нетоксичні солі сполук згідно з даним винаходом, наприклад - солі, утворені органічними або неорганічними кислотами. Як приклад можна назвати наступні солі: солі неорганічних кислот, таких як хлористоводнева, бромистоводнева, фосфорна і сірчана кислоти, а також солі органічних кислот, таких як оцтова, трифтороцтова, пропіонова, бурштинова, фумарова, яблучна, винна, лимонна, аскорбінова, малеїнова, глутамінова, бензойна, саліцилова, толуолсульфонова, метансульфонова, стеаринова і молочна кислоти. Ці солі можуть бути синтезовані із сполук згідно з даним винаходом, які містять основну частину, і відповідних кислот з використанням стандартних хімічних способів. Терапевтично прийнятні сольвати сполук згідно з даним винаходом включають стандартні сольвати, наприклад - сольвати, одержані під час останньої стадії одержання сполук згідно з даним винаходом внаслідок присутності розчинників. Як приклад можна навести сольвати внаслідок присутності води або етанолу. Серед сполук загальної формули (І) згідно з даним винаходом особливо корисним класом сполук є сполуки загальної формули (І), де R] є нітрогрупою, R.2 є воднем, m дорівнює 1, п дорівнює 0, a R3 є фенільною групою, заміщеною одним або декількома атомами галогенів або однією або декількома С\-С(, алкільними групами, циклоалкільною групою або піридином. Серед сполук загальної формули (І) згідно з даним винаходом другий особливо корисний клас сполук відповідає сполукам загальної формули (І), де R1 є ціаногрупою, R2 є атомом водню, m дорівнює 1, n дорівнює 0, а R3 є фенільною групою, заміщеною одним або декількома атомами галогенів або однією або декількома С1-С6 алкільними групами, циклоалкільною групою або піридином. Даний винахід також стосується одержання сполук загальної формули (І) стандартними способами, описаними у наведених нижче схемах синтезу і доповненими, якщо це необхідно, будьякою стандартною технікою, описаною в літературі, відомій фахівцям в даній галузі техніки, або представленою в розділі, присвяченому експериментам. 9 Схема 1 ілюструє перший загальний спосіб, який може бути використаний для одержання сполук загальної формули (І). У загальних формулах, наведених вище, R1, R2, R3 є такими самими, як в наведеному раніше описі загальної формули (І). Проте на Схемі 1, наведеній вище, n означає лише 1 або 2, Р1 означає захисну групу, а X може означати таку групу, як атом хлору або гідроксильна група. Вихідна сполука загальної формули (II) може бути одержана з використанням способів і методик, відомих фахівцям в даній галузі техніки. Особливо переважний спосіб полягає в реакції бензилгаліду з трифенілфосфіном в полярному розчиннику, такому як диметилформамід (ДМФ) або диметилсульфоксид (ДМСО), при температурі в діапазоні від 20°С до 100°С із одержанням фосфонієвої солі. Фосфонієву сіль можна потім депротонувати з використанням основи, наприклад - NaH, в розчиннику, такому як диметилформамід (ДМФ) або тетрагідрофуран (ТГФ), при температурі в діапазоні від -20°С та 40°С, після чого провести реакцію , ненасиченим альдегідом, що несе складний ефір, наприклад - етильний ефір (2Е)-4-оксобут-2еноату. Одержаний складний ефір (суміш Z/E та Е/Е ізомерів) спочатку ізомеризують за допомогою обробки йодом в полярному розчиннику, наприклад - у ацетонітрилі, із одержанням виключно Е/Е ізомеру, а потім омилюють за допомогою обробки мінеральною основою, такою як КОН, NaOH або LiOH, в полярному розчиннику, наприклад - у воді, етанолі або ТГФ, при температурі в діапазоні від 20°С до 100°С із одержанням сполук (II), в яких X є гідроксильною групою. Другий особливо переважний спосіб полягає в реакції ароматичного альдегіду з фосфонатом, наприклад з етильним ефіром 4-(діетоксифосфорил) буту-2еноату, у присутності основи, наприклад - NaH, Cs2CO3 або К2СО3, в розчиннику, наприклад - у ТГФ, дихлорметані або дихлоретані, при температурі в діапазоні від -20°С до 100°С. Одержаний складний ефір (суміш Z/E та Е/Е ізомерів) спочатку ізомеризують за допомогою обробки йодом в полярному розчиннику, наприклад - у ацетонітрилі, із одержанням виключно Е/Е ізомеру, а потім омилюють за допомогою обробки мінеральною основою, такою як КОН, NaOH або LiOH, в полярному розчиннику, наприклад - у воді, етанолі або ТГФ, при температурі в діапазоні від 20°С до 97370 10 100°С із одержанням сполук (II), в яких X є гідроксильною групою. Третій особливо переважний спосіб полягає в реакції ароматичного ,ненасиченого альдегіду з етильним ефіром (діетоксифосфорил)ацетату у присутності основи, наприклад - NaH, Cs2CO3 або К2СО3, в розчиннику, наприклад - у ТГФ, дихлорметані або дихлоретані, при температурі в діапазоні від -20°С до 100°С. Одержаний складний ефір можна омилити за допомогою обробки мінеральною основою, такою як КОН, NaOH або LiOH, в розчиннику, наприклад - у воді, етанолі або ТГФ, при температурі в діапазоні від 20°С до 100°С із одержанням сполук (II), в яких X є гідроксильною групою. Четвертий особливо переважний спосіб полягає в реакції ароматичної сполуки, що несе на собі галоген, наприклад - бром або йод, з (Е)-пента2,4-дієноїльним складним ефіром, наприклад метильним або етильним складним ефіром (Е)пента-2,4-дієноату, у присутності паладієвого каталізатора, наприклад - паладію ацетату, фосфіну, наприклад - три-о-толілфосфіну або трифенілфосфіну, у присутності основи, наприклад Et3N або iPr2NEt, у відкритому або герметично закритому реакторі, без розчинника або в розчиннику, такому як ДМФ, ДМСО або ДМА, при температурі в діапазоні від 20°С до 120°С. Одержаний таким чином складний ефір (переважно Е/Е ізомер) можна омилити за допомогою обробки мінеральною основою, такою як КОН, NaOH або LiOH, в розчиннику, наприклад - у воді, етанолі або ТГФ, при температурі в діапазоні від 20°С до 100°С із одержанням сполук (II), в яких X є гідроксильною групою. В цьому випадку першою стадією є реакція конденсації між карбоновою кислотою (II) та аміном (III). Цю реакцію можна провести з використанням способів і методик, відомих фахівцям в даній галузі техніки. Особливо переважний спосіб полягає в реакції цих двох молекул у присутності 1-(3-диметиламінопропіл)3-етилкарбодііміду (ЕДК), 3-гідрокси-1,2,3бензотриазин-4(3Н)-ону і третинного аміну, такого як діізопропілетиламін, в полярному апротоному розчиннику, такому як дихлорметан, при температурі в діапазоні від -15°С та 40°С. Карбонову кислоту можна також перетворити в хлорид кислоти (тоді X відповідає хлору) за допомогою обробки реагентом, наприклад - тіонілхлоридом, при температурі в діапазоні від 20°С до 100°С. В 11 97370 12 цьому випадку перша стадія полягає в реакції між хлоридом кислоти та аміном. Цю реакцію можна провести з використанням способів і методик, відомих фахівцям в даній галузі техніки. Особливо переважний спосіб полягає в реакції цих двох молекул у присутності органічної або неорганічної основи, наприклад – Et2N, iPr2NEt, піридину, NaH, Cs2CO3 або К2СО3, в розчиннику, такому як ТГФ, дихлорметан, ДМФ або ДМСО, при температурі в діапазоні від -20°С до 100°С. Після депротекції проміжної сполуки (IV) з використанням способів і методик, відомих фахівцям в даній галузі техніки («Protective Groups in Organic Synthesis», T.W. Greene, John Wiley & Sons, 1981 та «Protective Groups», P.J. Kocienski, Thieme Verlag, 1994), одержана проміжна сполука може реагувати з реагентом, який має формулу R3(CH2)nY, де Y являє собою відхідну групу, наприклад - СІ, Br, I, OSO2CH3, OSO2CF3 або Отозильну групу. В цьому випадку реакцію прово дять у присутності органічної або неорганічної основи, наприклад - Et3N, iPr2NEt, NaH, Cs2CO3 або К2СО3, здатної утримуватися на смолі, такій як PS-DIEA або МР-карбонат, в полярному безводному розчиннику, такому як дихлорметан, ТГФ, ДМФ або ДМСО, при температурі в діапазоні від -20°С до 100°С. Інший спосіб одержання полягає в проведенні реакції амінування з використанням альдегіду, який має формулу R3(СН2)n-1-СНО, в якій R3 і n є такими, як визначено раніше, з депротектованим аміном загальної формули (IV) і відновником, таким як NaBH4, NaBH3CN або NаВН(ОАс)3, здатним утримуватися на смолі, такій як МР-BH3CN, в полярному розчиннику, такому як 1,2-дихлоретан, дихлорметан, ТГФ, ДМФ або МеОН, при рН, який можна регулювати додаванням кислоти, такої як оцтова кислота, і при температурі в діапазоні від -20°С до 100°С. Схема 2 ілюструє другий загальний спосіб, який можна використовувати для одержання сполук загальної формули (І). У загальних формулах, наведених вище, R1, R2, R3 та n є такими самими, як в описі загальної формули (І). X може означати функціональну групу, таку як хлор або гідроксил. Вихідну сполуку загальної формули (II) можна одержати з використанням способів і методик, відомих фахівцям в даній галузі техніки, зокрема - способів та методик, описаних вище. У випадку, якщо X є хлором, синтез полягає в реакції між хлоридом кислоти та аміном. Цю реакцію можна провести з використанням способів і методик, відомих фахівцям в даній галузі техніки. Особливо переважний спосіб полягає в реакції цих двох молекул у присутності органічної або неорганічної основи, наприклад - Et3N, iPr2NEt, піридину, NaH, Cs2CO3 або К2СО3, в розчиннику, такому як ТГФ, дихлорметан, ДМФ або ДМСО, о при температурі в діапазоні від -20 С до 100°С. У випадку, якщо X є гідроксильною групою, синтез полягає в конденсації карбонової кислоти (II) та аміну (V). Реакцію можна провести з використанням способів і методик, відомих фахівцям в даній галузі техніки. Особливо переважний спосіб полягає в конденсації карбонової кислоти загальної формули (II) з аміном загальної формули (III) у присутності 1-(3-диметиламінопропіл)-3етилкарбодііміду (ЕДК), 3-гідрокси-1,2,3бензотриазин-4(3Н)-ону і третинного аміну, наприклад - діізопропілетиламіну, у полярному апротонному розчиннику, такому як дихлорметан, при температурі в діапазоні від -15°С до 40°С. Якщо бажано виділити сполуку загальної формули (І), яка містить, щонайменше, одну основ ну функціональну групу в стані солі за рахунок додавання кислоти, такий результат можна одержати за допомогою обробки вільної основи загальної формули (І) (у якій присутня, щонайменше, одна функціональна група з основними властивостями) підходящою кислотою, переважно - у еквівалентній кількості. Наведені нижче приклади ілюструють даний винахід, ніякою мірою не обмежуючи його обсяг. Опис прикладів здійснення винаходу Приклад 1 2[5-Оксо-5-(4-піридин-2-іл-піперазин-1-іл)пента-1,3-дієніл]-бензонітрил Приклад 1А: Етил-5-(2-ціанофеніл)-пента-2,4дієноат 2-Бромметилбензонітрил (3 г, 15,3 ммоль) у вигляді розчину в ДМФ (50 мл) при 80°С обробили трифенілфосфіном (4,42 г, 16,83 ммоль). Після перемішування протягом 3 годин температуру суміші знизили до кімнатної температури і додали етильний ефір 4-оксобут-2-еноату (2,16 г, 16,83 ммоль) та етильний ефір 4-оксобут-2еноату (2,16 г, 16,83 ммоль). Після 16 годин перемішування при кімнатній температурі суміш випарували насухо, перенесли в етилацетат і 13 промили водою. Органічну фазу висушили над Na2SO4, профільтрували і випарували насухо. Одержаний сироп очистили за допомогою хроматографії на колонці з діоксидом кремнію та елюювали з використанням суміші EDP/AcOEt в співвідношенні 9/1. Продукт 1А виділили у вигляді жовтого сиропу (2,73 г, 71%) у вигляді суміші Е/Е та Z/E ізомерів. + Мас-спектр (ESI+): m/z 228 (М+Н ). Приклад 1В: Етил-(2Е, 4Е)-5(2-ціанофеніл)пента-2,4-дієноат Сполуку 1А (2,34 г, 10,3 ммоль) у вигляді розчину в ацетонітрилі (14 мл) обробили при кімнатній температурі йодом (15,0 мг, 0,06 ммоль). Після перемішування протягом 3 годин суміш випарували насухо, перенесли в дихлорметан і промили розчином Na2SO3, профільтрували і випарували насухо. Продукт 1В виділили у вигляді твердої речовини (2,26 г, 97%) і використовували без подальшої обробки для наступної стадії. 1 -1 Н-ЯМР, ДМСО-d6 (млн. ): 1,25 (t, 3Н); 4,16 (q, 2H); 6,21 (d, 1H); 7,34 (m, 2H); 7,50 (m, 2Н); 7,74 (t, 1H); 7,87 (d, 1H); 7,96 (d, 1H). Приклад 1С: 5-(2-Ціанофеніл)-пента-2,4діенова кислота Сполуку 1В (2,0 г, 8,82 ммоль) у вигляді розчину в етанолі (50 мл) обробили 1N розчином поташу (13,2 мл, 13,2 ммоль). Після 1,5 годин перемішування із зворотним холодильником суміш випарували насухо, перенесли у воду та обробили 1N HCl до одержання кислотного рН. Осад, що утворився, відфільтрували, промили водою і висушили під вакуумом до одержання чистого продукту 1С (1,63 г, 93%). 97370 14 Мас-спектр (ESI-): m/z 198 (М-Н ). Приклад 1: 2-[5-Оксо-5-(4-піридин-2-ілпіперазин-1-іл)-пента-1,3-дієніл]-бензонітрил Кислоту 1С (700 мг, 3,51 ммоль) у вигляді розчину в дихлорметані (10 мл) у присутності діізопропілетиламіну (DIEA) (1,2 мл, 7,02 ммоль) обробили при кімнатній температурі 1-(3диметиламінопропіл)-3-етилкарбодііміду (EDCI) гідрохлоридом (807 мг, 4,21 ммоль), 3-гідрокси1,2,3-бензотриазин-4(3Н)-оном (НООВТ) (686 мг, 4,21 ммоль) і потім - 1-піридин-2-іл-піперазином (642 мкл, 4,21 ммоль). Після перемішування протягом 16 годин реакційну суміш розбавили дихлорметаном і промили 1N розчином соди і водою. Органічну фазу висушили над MgSO4, профільтрували і випарували насухо. Одержаний сироп очистили за допомогою хроматографії на колонці з діоксидом кремнію та елюювали сумішшю петролейного ефіру/AcOEt в співвідношенні 1/2. Продукт 1 виділили у вигляді жовтої твердої речовини (910 мг, 75%). Цей продукт перенесли в етилацетат, потім одержали сіль за допомогою додавання розчину НСl в ефірі із одержанням відповідного гідрохлориду у вигляді жовтої твердої речовини. 1 -1 H-ЯМР, ДМСО-d6 (млн. ): 3,81 (широка смуга S, 8Н); 6,94 (m, 2Н); 7,18 (m, 1Н); 7,38 (m, 3Н); 7,51 (t, 1H); 7,74 (t, 1H); 7,86 (d, 1H); 7,91 (d, 1H); 7,96 (t, 1H); 8,06 (d, 1H). + Мас-спектр (ESI+): m/z 345 (М+Н ). Приклади 2-8 Сполуки 2-8 були синтезовані з проміжного продукту 1С і відповідних амінів в умовах, описаних при одержанні сполуки 1. 15 Приклад 9 5-(2-Хлорфеніл)-1-(4-циклопентилпіперазин1-іл)-пента-2,4-дієн-1-он Приклад 9А: Етил-5-(2-хлорфеніл)-пента-2,4дієноат Етил-4-(діетоксифосфорил)-бут-2-еноат (3,92 г, 15,65 ммоль) у розчині ТГФ (79 мл) при 0°С обробили гідридом натрію (60% в маслі) (630 мг, 15,7 ммоль). Після 30 хвилин перемішування при 0°С додали 2-хлорбензальдегід (2,0 г, 14,22 ммоль) і збовтували суміш протягом 16 годин, поступово підвищуючи температуру від 0°С до кімнатної температури. Потім суміш випарували насухо, перенесли в AcOEt і промили водою. Органічну фазу висушили над MSO4, профільтрували і випарували насухо. Одержаний сироп очистили за допомогою хроматографії на колонці з діоксидом кремнію та елюювали сумішшю 97370 16 EDP/CH2CI2 в співвідношенні 2/1. Продукт 9А був виділений у вигляді жовтого масла (1,1 г, 33%). Приклад 9В: 5-(2-Хлорфеніл)-пента-2,4дієнова кислота Сполуку 9А (2,1 г, 8,87 ммоль) у вигляді розчину в ТГФ (20 мл) обробили 1N розчином LiOH (35 мл, 35,4 ммоль). Після перемішування протягом 2 годин при кімнатній температурі і протягом 1 години із зворотним холодильником суміш випарували насухо, перенесли у воду та обробили 4N розчином НСl до кислотного рН. Осад, що утворився, відфільтрували, промили водою і потім висушили під вакуумом із одержанням чистого продукту 9В (1,70 г, 92%). Мас-спектр (ESI-): m/z 207 (М-Н ). Приклад 9: 5-(2-Хлорфеніл)-1-(4циклопентилпіперазин-1-іл)-пента-2,4-дієн-1-он Сполуку 9 одержали з проміжного продукту 9В (67,0 мг, 0,32 ммоль) і циклопентилпіперазину (101,3 мг, 0,45 ммоль) в умовах, описаних для одержання сполуки 1 з 1С. Чистий продукт був виділений у вигляді гідрохлориду (99 мг, 81%). + Мас-спектр (ESI+): m/z 345 (М+Н ). Приклади 10-15 Сполуки 10-15 були синтезовані з проміжного продукту 9В і відповідних амінів в умовах, описаних для одержання сполуки 1 з 1С. 17 Приклад 16 5-(2-Нітрофеніл)-1-(4-фенілпіперазин-1-іл)пента-2,4-дієн-1-он Приклад 16А: Етил-5-(2-нітрофеніл)-пента2,4-дієноат 3-(2-нітрофеніл)-пропеналь (4,0 г, 22,5 ммоль) у вигляді розчину в толуолі (67 мл) обробили етил-(трифенілфосфораніл)-ацетатом (8,25 г, 23,7 ммоль). Після перемішування протягом 2 днів із зворотним холодильником суміш випарували насухо, очистили за допомогою хроматографії на колонці з діоксидом кремнію та елюювали сумішшю EDP/AcOEt в співвідношенні 2/1. 97370 18 Продукт 16А був виділений у вигляді жовтої твердої речовини (4,96 г, 90%). 1 Н-ЯМР, ДМСО-d6 (мли ): 1,24 (t, 3Н); 4,16 (q, 2H); 6,19 (d, 1H); 7,17 (dd, 1H); 7,35 (d, 1H); 7,45 (dd, 1H); 7,59 (t, 1H); 7,77 (t, 1H); 7,89 (d, 1H); 8,00 (d, 1H). + Мас-спектр (ESI+): m/z 248 (М+Н ) 15. Приклад 16В: 5-(2-Нітрофеніл)-пента-2,4дієнова кислота Проміжну сполуку 16А (2,59 г, 10,5 ммоль) омилили в умовах, описаних для одержання сполуки 1с з 1В. Чистий продукт був виділений у вигляді білої твердої речовини (2,27 г, 99%). Мас-спектр (ESI-): m/z 218 (М-Н ). Приклад 16: 5-(2-Нітрофеніл)-1-(4фенілпіперазин-1-іл)-пента-2,4-дієн-1-он Сполука 16 була одержана з проміжної сполуки 16В (404 мг, 1,84 ммоль) і фенілпіперазину (415 мкл, 2,20 ммоль) в умовах, описаних для одержання сполуки 1 з 1С. Чистий продукт був виділений у вигляді гідрохлориду 9621 мг, 87%). 1 -1 H-ЯМР, ДМСО-d6 (млн. ): 3,29 (широка смуга s, 4H); 3,82 (широка смуга s, 4H); 6,94 (d, 1H); 19 7,00 (t, 1H); 7,20 (m, 4H); 7,32 (m, 3Н); 7,57 (t, 1H); 7,75 (t, 1H); 7,87 (d, 1H); 7,99 (d, 1H). + Мас-спектр (ESI+): m/z 364 (М+Н ). Приклади 17-26 97370 20 Сполуки 17-26 були синтезовані з проміжної сполуки 16В і відповідних амінів в умовах, описаних для одержання сполуки 1 з 1С. 21 Приклад 27 5-(2,6-Дифторфеніл)-1-(4-фенілпіперазин-1іл)-пента-2,4-дієн-1-он Приклад 27А: Етил-5-(2,6-дифторфеніл)пента-2,4-дієноат Етил-(діетоксифосфорил)-ацетат (3,72 мл, 18,7 ммоль) у вигляді розчину в ТГФ (114 мл) обробили гідридом натрію (60% в маслі) (819 мг, 20,4 ммоль) при кімнатній температурі протягом 5 хвилин. Потім по краплях додали 3-(2,6дифторфеніл)-пропеналь (2,87 г, 17,0 ммоль) у вигляді розчину в ТГФ (29 мл). Після 3 годин перемішування при кімнатній температурі суміш випарували насухо, перенесли в етилацетат і промили водою. Органічну фазу висушили над 97370 22 Na2SO4, профільтрували і випарували насухо. Одержану жовту тверду речовину без подальшої обробки використовували в наступній реакції. Приклад 27В: 5-(2, 6-Дифторфеніл)-пента2,4-дієнова кислота Проміжну сполуку 27В (3,28 г, 13,76 ммоль) омилили в умовах, описаних для одержання сполуки 1С з 1В. Чистий продукт був виділений у вигляді бежевої твердої речовини (2,56 г, 88%). Мас-спектр (ESI-): m/z 209 (М-Н ). Приклад 27: 5-(2,6-Дифторфеніл)-пента-2,4дієнова кислота Сполука 27 була одержана з проміжної сполуки 27В (60 мг, 0,285 ммоль) і фенілпіперазину (68,1 мкл, 0,342 ммоль) в умовах, описаних для одержання сполуки 1 з 1С. Чистий продукт був виділений у вигляді бежевого порошку (72 мг, 79%), + Мас-спектр (ESI+): m/z 355 (М+Н ). Приклади 28-31 Сполуки 28-31 були синтезовані з проміжної сполуки 27В і відповідних амінів в умовах, описаних для одержання сполуки 1 з 1С. 23 Приклад 32 1-(4-Циклопентилпіперазин-1-іл)-5-(2фторфеніл)-пента-2,4-дієн-1-он Приклад 32А: Етил-5-(2-фторфеніл)-пента2,4-дієноат Проміжна сполука 32А одержана з 3-(2дифторфеніл)-пропеналю та етил(діетоксифосфорил)-ацетату в умовах, описаних для одержання сполуки 27А. + Мас-спектр (ESI+): m/z 221 (М+Н ) Похідні згідно з даним винаходом є антагоністами PAR-1 рецептора, оскільки результати, одержані на моделях, описаних нижче, демонструють наступне: У різних типах клітин активація PAR-1 рецептора пептидом SFLLR (селективним агоністом PAR-1) запускає внутрішньоклітинний сигнальний каскад, що призводить до виділення кальцію з 97370 24 Приклад 32В: 5-(2-Фторфеніл)-пента-2,4Дієнова кислота Проміжна сполука 32В була одержана із сполуки 32А в умовах, описаних для одержання сполуки 27В. Мас-спектр (ESI-): m/z 191 (М-Н ). Приклад 32: 1- (4-Циклопентилпіперазин-і-іл) -5-(2-фторфеніл)-пента-2,4-дієн-1-он Сполука 32 була одержана з проміжної сполуки 32В (100,0 мг, 0,52 ммоль) і циклопентилпіперазину (165,3 мг, 0,73 ммоль) в умовах, описаних для одержання сполуки 1 з 1С. Чистий продукт був виділений у вигляді білого порошку (122 мг, 64%). + Мас-спектр (ESI+): m/z 329 (М+Н ). Приклади 33-36 Сполуки 33-36 були синтезовані з проміжної сполуки 32В і відповідних амінів в умовах, описаних для одержання сполуки 1 з 1С. ендоплазматичного ретикулума. Клітини яєчника китайського хом'яка (СНО) стійко експресують PAR-1 рецептор. У цій клітинній лінії виділення кальцію внаслідок активації рецепторів SFLLR вимірювали за допомогою флуориметричної методики (флуориметричний пристрій візуалізації для зчитування планшетів, або FLIPR) з використанням селективного датчика кальцію (Fluo-3АМ). 25 97370 Випромінювання флуоресценції з фармакологічної точки зору пропорційне ефективності PAR-1 агоніста та його концентрації. Сполуки, описані в даному винаході, показали, що вони здатні виступати як антагоністи PAR-1 рецепторів і таким чином знижувати виділення кальцію, викликане агоністом. Матеріали: Культуральне середовище: F-12 за Хемом (Ham, R.G., Proc. Natl. Acad. Sci., 1965, 53: 288) з додаванням 10% плодової сироватки корів та антибіотика (Пробеніцид, 2,5 мМ). Флуоресцентний зонд: Fluo-3АМ (4 мкМ; Teflabs, Остин, Техас, США). Агоніст: SFLLR-NH2 (серин, фенілаланін, лейцин, лейцин, аргінін). Способи: СНО-клітини культивували в 96ямковому планшеті (по 60000 клітин на комірку) у присутності 200 мкл культурального середовища протягом 24 годин. Клітини інкубували з флуоресцентним зондом на кальцій протягом 1 години при 37°С. Потім клітини промивали протягом 10 хвилин перед вимірюванням сигналу. Потім ін'єктували PAR-1 антагоніст (від 0,01 мкМ до 10 мкМ). Планшети поміщали в FLIPR (Molecular Devices, Об'єднане Королівство) для вимірювання флуоресценції на двох довжинах хвиль (488 нм та 540 нм: Sullivan et al, Calcium Signaling Protocols, 1999, 125-136). Вимірювання проводили за 5 хвилин до додавання антагоніста і через 10 хвилин після його введення. Максимальну флуоресценцію за вирахуванням вихідної флуоресценції вимірювали на 4 різних довжинах хвиль. Аналіз виконували двічі. У цих умовах похідні згідно з даним винаходом були ідентифіковані як антагоністи PAR-1 рецепторів (антагонізм >60% кальцієвого сигналу при 10 мкМ). Криві «доза-реакція» (від 0,01 мкМ до 32 мкМ), одержані з використанням SFLLR агоніста, дали можливість визначити ефективну концентрацію, що викликає ефект, який дорівнює 50% від максимального ефекту (EC50). Ефективність (рА2) деяких з антагоністів PAR-1, описаних в даному винаході, була розрахована з використанням способу Arunlakshana та Schild (Brit. J. Pharmacol., 1959, 14: 48-58) по зсувах ЕС50, що спостерігалися при трьох концентраціях. Результати: Декілька наведених нижче прикладів, вибраних із сполук згідно з даним винаходом, ілюструють абсолютно неочікувану здатність цих сполук бути антагоністами PAR-1 рецепторів. Приклад 1 2 9 16 18 21 рА2 6,5 6,63 6,64 7,23 7,16 7,11 Активність проти агрегації тромбоцитів та антитромботична активність антагоністів PAR-1 була показана на моделі артеріального тромбозу у морської свинки, яка була піддана дуже силь 26 ному гемодинамічному зсувному напруженню. У судинному руслі пошкодження ендотелію викликає внутрішньосудинне утворення збагаченого тромбоцитами тромбу, який поступово закупорює весь просвіт судин. Процес агрегації тромбоцитів ефективно активується тромбіном через PAR-1 рецептори. Сполуки, описані в даному винаході, показали, що вони здатні надавати антагоністичний ефект на PAR-1 рецептори і за рахунок цього затримувати утворення тромбу. Матеріали: Дослідження були виконані на морських свинках (PAR-1 рецептори яких схожі з рецепторами людини). Опромінення світлом зеленого лазера у присутності фотосенсибілізуючого агента (бенгальський рожевий, введений внутрішньовенно) ушкоджує епітелій сонних артерій. Кровотік через сонні артерії кількісно оцінювали з використанням датчика потоку Transonic. Вимірювали час, необхідний для повного закупорювання сонної артерії (об'ємна швидкість кровотоку дорівнює 0). Способи: Після знеболювання тварини (60 мг/кг пентобарбіталу) висікали 5 мм сонної артерії і на 4 мм вище артерії поміщали лазер. Датчик потоку, розміщений вище за течією, вимірює час оклюзії. Бенгальський рожевий (20 мг/кг) вводили внутрішньовенно, а судину опромінювали випромінюванням з довжиною хвилі 514 нм (протягом 3 хвилин). Антагоністи PAR-1 вводили внутрішньовенно болюсно (протягом 2 хвилин безпосередньо перед введенням бенгальського рожевого) з подальшою 15-хвилинною перфузією, яку починали одночасно з включенням лазера. Результати: Деякі сполуки, описані в даному винаході, продемонстрували, що вони здатні після внутрішньовенного введення в дозах від 0,16 мг/кг до 2,5 мг/кг збільшувати час до утворення тромбу на 10-90% в порівнянні з тваринами, що одержували лише розріджувач. Похідні згідно з даним винаходом можна також використовувати для лікування фібриляції передсердь. У випадку постінфарктного об'ємного перевантаження порожнини серця праве і ліве вушка передсердь розширюються, що утворює основу для виникнення фібриляції передсердь. Порушення гомеостазу в порожнині розширеного вушка у пацієнта, страждаючого на фібриляцією передсердь, призводить до аномальної концентрації тромбіну. Автори винаходу продемонстрували, що ця акумуляція тромбіну відповідальна за апрегуляцію PAR-1, який може запустити проліферацію фібробластів та утворення тромбоцитарного тромбу. Відповідно до свого механізму дії антагоністи PAR-1 можуть запобігти дилатації передсердь, проліферації фібробластів та утворенню тромбу у вушку передсердя у пацієнта, страждаючого на фібриляцію передсердь. В результаті антагоніст PAR-1 являє собою ефективний профілактичний і/або лікувальний засіб для фібриляції передсердь. Сполуки, описані в даному винаході, продемонстрували, що 27 вони здатні надавати антагоністичний ефект на PAR-1 рецептори і запобігати дилатації передсердь. Матеріали: Дослідження були виконані на щурах-самцях. Для експерименту були вибрані щури з масою тіла 180-200 г, оскільки вони краще за все переносили хірургічну операцію. Вимірювання різних порожнин в міокарді були виконані з використанням ехокардіографії на наркотизованих тваринах. Методи: Тварину наркотизували 3,5%-ною сумішшю ізофлурану з киснем (Aerrane, Baxter Laboratories). Торакотомію розміром близько 2 см виконували перпендикулярно грудині на рівні четвертого міжреберного проміжку у напрямку до лівої передньої лапи. Лігатуру (шовк 4-0, голка СС1, Ethicon) накладали навколо лівої коронарної артерії на відстані 1 мм від її початку. Навколо лівої коронарної артерії зав'язували хірургічний вузол, досить тугий для повного перетиснення судини. Безперервна реєстрація електрокардіограми давала можливість підтвердити правильність розміщення лігатури. Через два місяці після процедури тварин знову наркотизували для вимірювання ехокардіографії розмірів порожнин серця і вимірювання швидкості кровотоку в міокарді з використанням імпульсної доплерографії. Після цього тварин піддавали евтаназії за допомогою передозування пентобарбіталу натрію (160 мг/кг, внутрібрюшинно) для виконання різних гістологічних вимірювань. Тваринам щодня перорально вводили продукти, які є антагоністами PAR-1, починаючи з 24 годин після інфаркту і до умертвіння тварини. Результати: Було продемонстровано, що деякі сполуки, описані в даному винаході, здатні після перорального введення в дозах 10-100 мг/кг/день протягом 60 днів зменшувати на 20-90% поверхню вушка передсердя (виміряну за допомогою ехокардіографії) в порівнянні з тваринами, які не одержували лікування. Даний винахід також стосується фармацевтичних композицій, які містять як активний інгредієнт сполуку загальної формули (І) або її фармацевтично прийнятну сіль в суміші або у поєднанні з підходящим наповнювачем. Такі композиції можуть, наприклад, мати форму твердих або рідких композицій, емульсій, лосьйонів або кремів. Як тверді композиції для перорального введення можуть бути використані таблетки, пілюлі, порошки (у желатинових капсулах або в пакетиках) або гранули. У таких композиціях активний інгредієнт згідно з даним винаходом змішують з одним або декількома інертними розріджувачами, такими як крохмаль, целюлоза, сахароза, лактоза або діоксид кремнію, під потоком аргону. Такі композиції можуть також включати в себе інші речовини, окрім розріджувачів, наприклад - одну або декілька змащувальних речовин, таких як 97370 28 стеарат магнію або тальк, барвник, покриття (для пілюль, покритих цукром) або лак. Як рідкі композиції для орального введення можна використовувати наступне: фармацевтично прийнятні розчини, суспензії, емульсії, сиропи та еліксири, які містять інертні розріджувачі, такі як вода, етанол, гліцерин, рослинні олії або рідкий парафін. Такі композиції можуть, окрім розріджувачів, містити інші речовини, наприклад - зволожувачі, підсолоджувачі, загусники, смакові або стабілізуючі домішки. Стерильні композиції для парентерального введення можуть бути, переважно, водними або неводними розчинами, суспензіями або емульсіями. Як розчинник або носій можна використовувати наступне: воду, пропіленгліколь, поліетиленгліколь, рослинні олії, конкретніше - оливкову олію, придатні для ін'єкцій складні органічні ефіри, наприклад - етилолеат, або інші підходящі органічні розчинники. Такі композиції можуть також містити домішки, конкретніше - змочувальні агенти, ізотонічні агенти, емульгатори, дисперганти і стабілізатори. Стерилізацію можна виконати декількома способами, наприклад - за допомогою стерилізуючої фільтрації, включення в композицію стерилізуючих засобів, опромінення або нагрівання. Такі композиції можна також приготувати у вигляді стерильних твердих композицій, які можна розчинити в стерильній воді або в будьякому іншому стерильному середовищі, підходящому для ін'єкцій, безпосередньо перед застосуванням. Композиції для ректального введення являють собою супозиторії або ректальні капсули, які містять, окрім активного продукту, наповнювачі, такі як олія какао, напівсинтетичні гліцериди або поліетиленгліколі. Композиції для місцевого введення можуть являти собою, наприклад, креми, лосьйони, очні краплі, ополіскувачі для рота, краплі в ніс або аерозолі. Дози залежать від бажаного ефекту, тривалості лікування та шляху введення і звичайно лежать в діапазоні від 0,001 г до 1 г (переважно від 0,005 г до 0,75 г) в день, переважно - при оральному шляху введення дорослим людям, при цьому разові дози варіюють від 0,1 мг до 500 мг активної речовини. Звичайно підходяще дозування визначає лікуючий лікар залежно від віку, ваги пацієнта та інших специфічних факторів у кожному конкретному випадку. Згідно з особливим варіантом здійснення даний винахід також стосується продуктів, які містять сполуку загальної формули (І) та інший серцево-судинний агент, тобто комбінованих продуктів для одночасного, роздільного або відстроченого за часом використання для лікування серцево-судинних захворювань, причому інший серцево-судинний агент може бути антитромбоцитарним засобом, таким як аспірин, клопідогрел, тиклопідин, абциксимаб, тирофібан або ептифібатид. 29 Комп’ютерна верстка Мацело В. 97370 Підписне 30 Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPhenylpentadienoyl derivatives and their use as par 1 antagonists
Автори англійськоюPerez Michel, Lamothe Marie, Le Grand Bruno, Letienne Robert
Назва патенту російськоюПроизводные фенилпентадиеноила и их применение в качестве антагонистов par 1
Автори російськоюПерес Мишель, Ламот Мари, Ле Гран Бруно, Летьен Робер
МПК / Мітки
МПК: C07D 213/74, A61K 31/496, C07D 295/10, A61P 9/00, A61P 7/00, C07D 333/36, C07D 213/61
Мітки: антагоністів, похідні, застосування, фенілпентадієноїлу
Код посилання
<a href="https://ua.patents.su/15-97370-pokhidni-fenilpentadiehnolu-ta-kh-zastosuvannya-yak-antagonistiv-par-1.html" target="_blank" rel="follow" title="База патентів України">Похідні фенілпентадієноїлу та їх застосування як антагоністів par 1</a>
Попередній патент: Протипухлинні сполуки дигідропіран-2-ону та фармацевтична композиція на їх основі
Наступний патент: Пристрій для обробки волосся
Випадковий патент: Спосіб забарвлення напівтонких зрізів












