Протипухлинні сполуки дигідропіран-2-ону та фармацевтична композиція на їх основі
Номер патенту: 97369
Опубліковано: 10.02.2012
Автори: Коельо Молінеро Лаура, Рейєс Бенітес Хосе Фернандо, Гаррансо Гарсіа-Ібаррола Марія, Санчес Санчо Франсіско, Фернандес Родрігес Рохеліо, Франсесч Сольосо Франсіско, Родрігес Вісенте Альберто, Мурсія Перес Кармен, Мартін Лопес Ма Хесус, Куевас Марчанте Марія дель Кармен
Формула / Реферат
1. Сполука загальної формули I
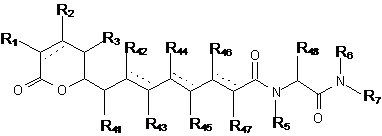 , (І)
, (І)
де R1 вибирають з водню, ORa, OCORa, OCOORa, NRaRb, NRaCORb і NRaС(NRa)NRaRb;
кожен R2 і R3 незалежно вибирають з водню, заміщеного або незаміщеного C1-C12алкілу, заміщеного або незаміщеного C2-C12алкенілу і заміщеного або незаміщеного C2-C12алкінілу;
кожен R41, R42, R43, R44, R45, R46, R47 і R48 незалежно вибирають з водню, заміщеного або незаміщеного C1-C12алкілу, заміщеного або незаміщеного C2-C12алкенілу і заміщеного або незаміщеного C2-C12алкінілу;
кожен R5, R6 і R7 незалежно вибирають з водню, CORa, COORa, заміщеного або незаміщеного C1-C12алкілу, заміщеного або незаміщеного C2-C12алкенілу і заміщеного або незаміщеного C2-C12алкінілу, або R5 і R48 разом з відповідними атомом N і атомом C, до яких вони приєднані, можуть утворювати заміщену або незаміщену гетероциклічну групу;
кожен Ra і Rb незалежно вибирають з водню, заміщеного або незаміщеного C1-C12алкілу, заміщеного або незаміщеного C2-C12алкенілу, заміщеного або незаміщеного C2-C12алкінілу, заміщеного або незаміщеного C6-C18арилу і заміщеної або незаміщеної гетероциклічної групи; і
кожна пунктирна лінія означає необов'язковий додатковий зв'язок;
де групи, вказані як заміщені, заміщені в одному або більше доступних положеннях групами, що вибрані з OR', =O, SR', SOR', SO2R', NO2, NHR', N(R')2, =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галогену, COR', COOR', OCOR', OCONHR', OCON(R')2, захищеної OH, заміщеного або незаміщеного C6-C18арилу і заміщеної або незаміщеної гетероциклічної групи, де кожну з R' груп незалежно вибирають з групи, що включає водень, OH, NO2, NH2, SH, CN, галоген, COH, COалкіл, CO2H, заміщений або незаміщений C1-C12алкіл, заміщений або незаміщений C2-C12алкеніл, заміщений або незаміщений C2-C12алкініл, заміщений або незаміщений C6-C18арил і заміщену або незаміщену гетероциклічну групу; де, якщо такі групи самі заміщені, замісники вибирають з представленого вище списку;
де гетероциклічні групи містять від 1 до 3 окремих або конденсованих кілець і від 5 до близько 18 атомів в кільці;
або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
2. Сполука за п. 1, що має формулу II
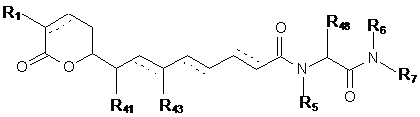 , (ІІ)
, (ІІ)
де R1, R41, R43 і R48, R5, R6 і R7 такі, як визначені у п. 1, або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
3. Сполука за п. 1, де R2 і R3 кожен незалежно вибирають з водню і заміщеного або незаміщеного С1-С6алкілу, або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
4. Сполука за п. 3, де R2 і R3 є воднем, або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
5. Сполука за будь-яким з попередніх пунктів, де R1 вибирають з водню, ORa і OCORa, де Ra вибирають з водню і заміщеного або незаміщеного С1-С6алкілу, або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
6. Сполука за п. 5, де R1 є воднем або метокси, або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
7. Сполука за будь-яким з пп. 1 і 3-6, де R42, R44, R45, R46 і R47 групи незалежно вибирають з водню і заміщеного або незаміщеного C1-C6алкілу, або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
8. Сполука за п. 7, де R42, R44, R45, R46, R47 групи незалежно вибирають з водню, заміщеного або незаміщеного метилу, заміщеного або незаміщеного ізопропілу і заміщеного або незаміщеного трет-бутилу, або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
9. Сполука за п. 8, де R42, R44, R45, R46 і R47 є воднем, або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
10. Сполука за будь-яким з попередніх пунктів, де R41, R43 і R48 групи незалежно вибирають з водню і заміщеного або незаміщеного C1-C6алкілу, або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
11. Сполука за п. 10, де групи R41, R43 і R48 незалежно вибирають з водню, заміщеного або незаміщеного метилу, заміщеного або незаміщеного ізопропілу і заміщеного або незаміщеного трет-бутилу, або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
12. Сполука за п. 11, де R41 і R43 є метилом, або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
13. Сполука за п. 12, де R48 вибирають з ізопропілу, трет-бутилу і бензилу, або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
14. Сполука за будь-яким з попередніх пунктів, де R5 і R6 кожен незалежно вибирають з групи, що включає водень і заміщений або незаміщений С1-С6алкіл, або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
15. Сполука за п. 14, де R5 і R6 є воднем, або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
16. Сполука за будь-яким з попередніх пунктів, де R7 вибирають з водню, заміщеного або незаміщеного C1-C12алкілу і заміщеного або незаміщеного C2-C12алкенілу, або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
17. Сполука за п. 16, де R7 вибирають з водню і заміщеного C2-C12алкенілу, або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
18. Сполука за п. 17, де R7 є алкенільною групою, що заміщена в одному або більше положеннях галогеном, OR', =O, OCOR', OCONHR', OCON(R')2 і захищеним OH, де кожну з груп R' незалежно вибирають з водню, заміщеного або незаміщеного C1-C12алкілу, заміщеного або незаміщеного C2-C12алкенілу, заміщеного або незаміщеного C2-C12алкінілу і заміщеного або незаміщеного C6-C18арилу, або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
19. Сполука за будь-яким з попередніх пунктів, де додатковий зв'язок присутній у всіх місцях, позначених пунктирною лінією, або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
20. Сполука за п. 1 або 2, що вибрана з групи сполук наступних формул:
 ,
,
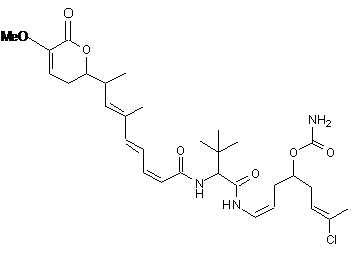 ,
,
 ,
,
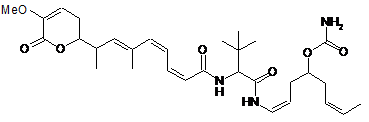 ,
,
 ,
,
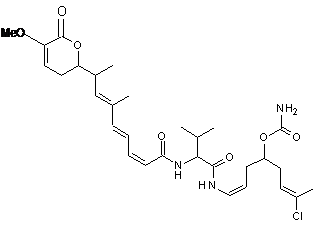 ,
,
 ,
,
 ,
,
або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
21. Сполука за п. 1 або 2, що має наступну формулу
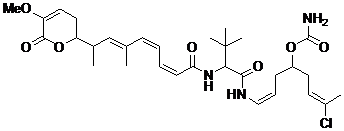 ,
,
або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
22. Сполука за п. 1 або 2, що має наступну формулу
 ,
,
або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
23. Сполука за п. 1 або 2, що має наступну формулу
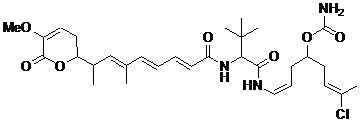 ,
,
або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
24. Сполука за п. 1 або 2, що має наступну формулу
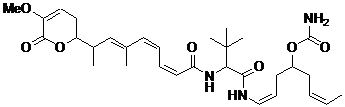 ,
,
або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
25. Сполука за п. 1 або 2, що має наступну формулу
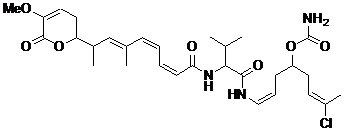 ,
,
або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
26. Сполука за п. 1 або 2, що має наступну формулу
 ,
,
або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
27. Сполука за п. 1 або 2, що має наступну формулу
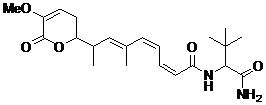 ,
,
або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
28. Сполука за п. 1 або 2, що має наступну формулу
 ,
,
або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
29. Сполука за п. 1 або 2, що вибрана з групи сполук наступних формул:
 ,
,
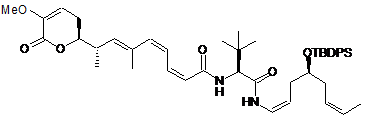 ,
,
 ,
,
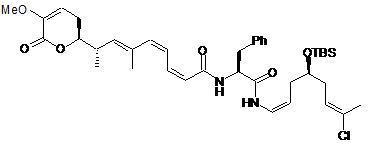 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
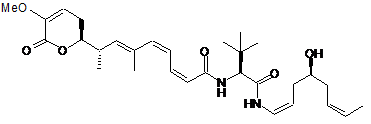 ,
,
 ,
,
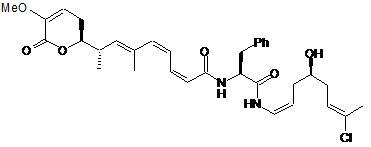 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
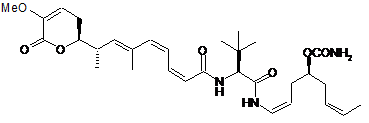 ,
,
 ,
,
 ,
,
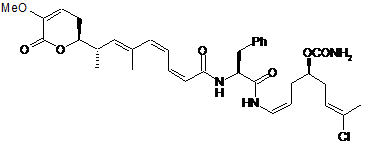 ,
,
 ,
,
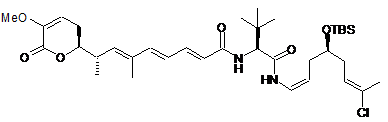 ,
,
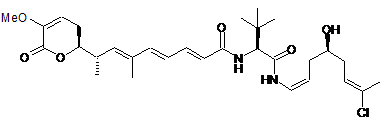 ,
,
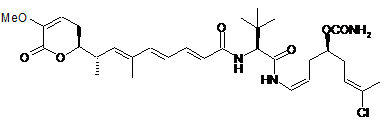 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
30. Сполука за п. 1 або 2, що має наступну формулу
 ,
,
або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
31. Сполука за п. 1 або 2, що має наступну формулу
 ,
,
або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
32. Сполука за п. 1 або 2, що має наступну формулу
 ,
,
або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
33. Сполука за п. 1 або 2, що має наступну формулу
 ,
,
або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
34. Сполука за п. 1 або 2, що має наступну формулу
 ,
,
або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
35. Сполука за п. 1 або 2, що має наступну формулу
 ,
,
або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
36. Сполука за п. 1 або 2, що має наступну формулу
 ,
,
або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
37. Сполука за п. 1 або 2, що має наступну формулу
 ,
,
або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
38. Сполука за п. 1 або 2, що має наступну формулу
 ,
,
або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
39. Фармацевтична композиція, що містить сполуку за будь-яким з попередніх пунктів або її фармацевтично прийнятну сіль, таутомер або стереоізомер і фармацевтично прийнятний розріджувач або носій.
40. Сполука за будь-яким з пп. 1-38 або її фармацевтично прийнятна сіль, таутомер або стереоізомер для застосування як лікарського засобу.
41. Сполука за будь-яким з пп. 1-38 або її фармацевтично прийнятна сіль, таутомер або стереоізомер для застосування при лікуванні раку.
42. Композиція за п. 39 для застосування як лікарського засобу.
43. Композиція за п. 39 для застосування при лікуванні раку.
44. Застосування сполуки за будь-яким з пп. 1-38 або її фармацевтично прийнятної солі, таутомеру або стереоізомера для одержання лікарського засобу для лікування раку.
45. Застосування композиції за п. 39 для одержання лікарського засобу для лікування раку.
Текст
1. Сполука загальної формули I C2 2 (19) 1 3 3. Сполука за п. 1, де R2 і R3 кожен незалежно вибирають з водню і заміщеного або незаміщеного С1-С6алкілу, або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 4. Сполука за п. 3, де R2 і R3 є воднем, або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 5. Сполука за будь-яким з попередніх пунктів, де R1 вибирають з водню, ORa і OCORa, де Ra вибирають з водню і заміщеного або незаміщеного С1С6алкілу, або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 6. Сполука за п. 5, де R1 є воднем або метокси, або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 7. Сполука за будь-яким з пп. 1 і 3-6, де R42, R44, R45, R46 і R47 групи незалежно вибирають з водню і заміщеного або незаміщеного C1-C6алкілу, або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 8. Сполука за п. 7, де R42, R44, R45, R46, R47 групи незалежно вибирають з водню, заміщеного або незаміщеного метилу, заміщеного або незаміщеного ізопропілу і заміщеного або незаміщеного трет-бутилу, або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 9. Сполука за п. 8, де R42, R44, R45, R46 і R47 є воднем, або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 10. Сполука за будь-яким з попередніх пунктів, де R41, R43 і R48 групи незалежно вибирають з водню і заміщеного або незаміщеного C1-C6алкілу, або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 11. Сполука за п. 10, де групи R41, R43 і R48 незалежно вибирають з водню, заміщеного або незаміщеного метилу, заміщеного або незаміщеного ізопропілу і заміщеного або незаміщеного третбутилу, або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 12. Сполука за п. 11, де R41 і R43 є метилом, або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 13. Сполука за п. 12, де R48 вибирають з ізопропілу, трет-бутилу і бензилу, або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 14. Сполука за будь-яким з попередніх пунктів, де R5 і R6 кожен незалежно вибирають з групи, що включає водень і заміщений або незаміщений С1С6алкіл, або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 15. Сполука за п. 14, де R5 і R6 є воднем, або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 16. Сполука за будь-яким з попередніх пунктів, де R7 вибирають з водню, заміщеного або незаміщеного C1-C12алкілу і заміщеного або незаміщеного C2-C12алкенілу, або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 17. Сполука за п. 16, де R7 вибирають з водню і заміщеного C2-C12алкенілу, або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 18. Сполука за п. 17, де R7 є алкенільною групою, що заміщена в одному або більше положеннях галогеном, OR', =O, OCOR', OCONHR', OCON(R')2 і 97369 4 захищеним OH, де кожну з груп R' незалежно вибирають з водню, заміщеного або незаміщеного C1-C12алкілу, заміщеного або незаміщеного C2C12алкенілу, заміщеного або незаміщеного C2C12алкінілу і заміщеного або незаміщеного C6C18арилу, або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 19. Сполука за будь-яким з попередніх пунктів, де додатковий зв'язок присутній у всіх місцях, позначених пунктирною лінією, або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 20. Сполука за п. 1 або 2, що вибрана з групи сполук наступних формул: MeO O NH2 O O O O O N H HN Cl , MeO , NH2 MeO O O O O O N H O HN Cl MeO O , NH2 O O O O N H O HN , MeO O NH2 O O O O N H O HN Cl MeO , , 5 97369 або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 25. Сполука за п. 1 або 2, що має наступну формулу MeO O O O O N H NH2 6 MeO , O NH2 O O O MeO N H O O NH2 O O N H HN Cl , або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 21. Сполука за п. 1 або 2, що має наступну формулу MeO O HN Cl , або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 26. Сполука за п. 1 або 2, що має наступну формулу O O O MeO O NH2 NH2 O O O N H O O O O O HN Cl , або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 27. Сполука за п. 1 або 2, що має наступну формулу MeO O O O O O O O O N H HN Cl , або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 23. Сполука за п. 1 або 2, що має наступну формулу NH2 , або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 28. Сполука за п. 1 або 2, що має наступну формулу MeO O O O O O N H O O HN MeO NH2 O O O N H O O N H HN O Cl , або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 24. Сполука за п. 1 або 2, що має наступну формулу O NH2 O NH2 MeO O N H NH2 O O O N H HN Cl , або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 22. Сполука за п. 1 або 2, що має наступну формулу MeO O O Cl , або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 29. Сполука за п. 1 або 2, що вибрана з групи сполук наступних формул: MeO O O O OTBS N H O O HN O Cl HN , , 7 97369 8 MeO MeO O O O O OTBDPS O O O N H OH O N H HN HN , MeO Cl , Cl , Cl , Cl , MeO O O O OTBS N H O O O Ph O HN Cl OH O N H HN , MeO O O MeO Ph O N H OTBS O O O HN OH Cl O , O N H HN MeO O O OTBS O N H O O O O OH O N H HN Cl HN , MeO O O O OTBS N H O O OCONH2 N H O HN , MeO Cl , MeO O O OH N H O O O O OCONH2 N H HN Cl O HN , MeO O O HN Cl O O Cl , MeO O O OH N H O O O OCONH2 O O N H HN Cl HN , , MeO MeO O O O O OH N H O O OCONH2 N H O O HN HN , Cl , 9 97369 MeO 10 MeO OCONH2 O O O O N H O O Cl Ph O OCONH2 HN MeO Cl , O OCONH2 HN O O , OTBS O , OH O N H HN Cl MeO O O , O O OCONH2 N H HN Cl , MeO O O , O O OCONH2 N H O O N H O O HN Cl , або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 34. Сполука за п. 1 або 2, що має наступну формулу NH2 , MeO O HN , або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 33. Сполука за п. 1 або 2, що має наступну формулу MeO O O MeO NH2 O HN MeO O OCONH2 N H OCONH2 O Cl , або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 32. Сполука за п. 1 або 2, що має наступну формулу O N H O O N H O O O HN Cl MeO MeO O N H HN , або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 31. Сполука за п. 1 або 2, що має наступну формулу O N H MeO O O Cl Cl O O N H O O O O OCONH2 O HN Cl , або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 30. Сполука за п. 1 або 2, що має наступну формулу MeO O O O , O N H O O N H MeO O O H N MeO O OCONHPh N H OCONH2 O O HN O O N H Cl , H N O Cl , або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 11 97369 12 35. Сполука за п. 1 або 2, що має наступну формулу 38. Сполука за п. 1 або 2, що має наступну формулу MeO MeO O O Ph O OCONH2 O N H , або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 36. Сполука за п. 1 або 2, що має наступну формулу MeO O OCONH2 O N H O HN Cl , або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 37. Сполука за п. 1 або 2, що має наступну формулу MeO O O O OCONH2 N H O O OCONHPh N H HN Cl O O O HN Cl , або її фармацевтично прийнятна сіль, таутомер або стереоізомер. Даний винахід стосується нових протипухлинних сполук, фармацевтичних композицій, що містять їх, їх застосування як протипухлинних агентів. У 1990 році, Gunasekera SP et al. описали виділення нового полігідроксильованого лактону, (+)дискодермолід, з глибоководної карибської губки Discodermia dissoluta (Gunasekera SP et al. J. Org. Chem. 1990, 55, 4912-4915 and J. Org. Chem. 1991, 56, 1346). O HN Cl , або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 39. Фармацевтична композиція, що містить сполуку за будь-яким з попередніх пунктів або її фармацевтично прийнятну сіль, таутомер або стереоізомер і фармацевтично прийнятний розріджувач або носій. 40. Сполука за будь-яким з пп. 1-38 або її фармацевтично прийнятна сіль, таутомер або стереоізомер для застосування як лікарського засобу. 41. Сполука за будь-яким з пп. 1-38 або її фармацевтично прийнятна сіль, таутомер або стереоізомер для застосування при лікуванні раку. 42. Композиція за п. 39 для застосування як лікарського засобу. 43. Композиція за п. 39 для застосування при лікуванні раку. 44. Застосування сполуки за будь-яким з пп. 1-38 або її фармацевтично прийнятної солі, таутомеру або стереоізомера для одержання лікарського засобу для лікування раку. 45. Застосування композиції за п. 39 для одержання лікарського засобу для лікування раку. Ця сполука належить до потужних протипухлинних агентів (Hung DT et al. Chem. Biol. 1996, 3, 287-293 and ter Haar Ε et al. Biochemistry 1996, 35, 243-250), які мають дію, подібну до дії клінічно перевіреного протиракового агента паклітаксел (Schiff PB et al. Nature 1979, 277, 665-667). Обидва натуральних продукти придушують клітинний цикл у Μ фазі, сприяють утворенню мікротрубочок і здійснюють однакову інгібуючу дію на рак молочної залози (ІС50 2,4 нМ і 2,1 нМ, відповідно). З іншого боку, деякі незвичайні лінійні дипептиди, що містять функціональну групу Nациленамід, були виділені з міксобактерій, які належать до роду Chondromyces (Kunze В et al. J. Antibiot. 1994, 47, 881-886 and Jansen R et al. J. Org. Chem. 1999, 1085-1089). Більш конкретно, ці сполуки є крокацинами А, В. С і D, і є групою інгібіторів транспорту електронів. 13 Крокацини A-D помірно інгібують ріст деяких грампозитивних бактерій і є потужними інгібіторами тваринних клітинних культур і деяких дріжджів і грибів. Найбільш активним є крокацин D, що демонструє МІС 1,4 нг/мл проти грибів Saccharomyces cerevisiae і сильну токсичність (ІС50 0,06 мг/л) до клітинної культури фібробластів мишей L929. Рак є основною причиною загибелі тварин і людини. Великі спроби робилися і робляться для одержання протипухлинного агента, активного і безпечного для введення пацієнтам, які страждають на рак. Проблема, що вирішується даним винаходом, полягає в одержанні сполук, які корисні для лікування раку. В одному аспекті, даний винахід пов'язаний зі сполуками загальної формули І або їх фармацевтично прийнятними солями, похідними, таутомерами, проліками або стереоізомерами. де R1 вибирають з водню, ORa, OCORa, OCOORa, NRaRb, NRaCORb і NRaC(NRa)NRaRb; кожен R2 і R3 незалежно вибирають з водню, заміщеного або незаміщеного С1-С12 алкілу, заміщеного або незаміщеного С2-С12 алкенілу і заміщеного або незаміщеного С2-С12 алкінілу; кожен R41, R42, R43, R44, R45, R46, R47 і R48 незалежно вибирають з водню, заміщеного або незаміщеного С1-С12 алкілу, заміщеного або незаміщеного С2-С12 алкенілу і заміщеного або незаміщеного С2-С12 алкінілу; кожен R5, R6 і R7 незалежно вибирають з водню, CORa, COORa, заміщеного або незаміщеного С1-С12 алкілу, заміщеного або незаміщеного С2-С12 алкенілу і заміщеного або незаміщеного С2-С12 алкінілу, або R5 і R48 разом з відповідним атомом N і атомом С, до яких вони приєднані, можуть утворювати заміщену або незаміщену гетероциклічну групу; кожен Ra і Rb незалежно вибирають з водню, заміщеного або незаміщеного С1-С12 алкілу, заміщеного або незаміщеного С2-С12 алкенілу, заміщеного або незаміщеного С2-С12 алкінілу, заміщеного або незаміщеного арилу і заміщеної або незаміщеної гетероциклічної групи; і кожна пунктирна лінія означає необов'язковий додатковий зв'язок. 97369 14 В іншому аспекті, даний винахід стосується сполук формули І або їх фармацевтично прийнятних солей, похідних, таутомерів, проліків або стереоізомерів, для застосування як лікарський засіб, зокрема, як лікарський засіб для лікування раку. В іншому аспекті, даний винахід також стосується застосування сполук формули І або їх фармацевтично прийнятних солей, похідних, таутомерів, проліків або стереоізомерів для лікування раку, або для одержання лікарського засобу, переважно, для лікування раку. Іншими аспектами даного винаходу є способи лікування і сполуки для застосування у цих способах. Тому даний винахід також стосується способу лікування будь-якого ссавця, зокрема, людини, ураженого раком, що включає введення ураженому раком пацієнту терапевтично ефективної кількості сполуки, визначеної вище. В іншому аспекті, даний винахід стосується фармацевтичних композицій, що містять сполуки формули І або їх фармацевтично прийнятні солі, похідні, таутомери, проліки або стереоізомери, разом з фармацевтично прийнятним носієм або розріджувачем. Даний винахід також стосується виділення сполук формули І з губки сімейства Raspailiidae, рід Lithoplocamia, вид lithistoides, способу їх одержання і утворення похідних цих сполук. Даний винахід стосується сполук загальної формули І як описано вище. У цих сполуках замісники можуть бути вибрані відповідно до наступних принципів: Алкільні групи можуть бути розгалужені або нерозгалужені, і, переважно, мають від 1 до близько 12 атомів вуглецю. Один більш переважний клас алкільних груп містить від 1 до близько 6 атомів вуглецю. Навіть більш переважні алкільні групи містять 1, 2, 3 або 4 атоми вуглецю. Метил, етил, пропіл, ізопропіл і бyтил, включаючи третбутил, втор-бутил, ізобутил, є особливо переважними алкільними групами у сполуках відповідно до даного винаходу. Інший переважний клас алкільних груп містить від 6 до близько 10 атомів вуглецю; і навіть більш переважно, 7, 8 або 9 атомів вуглецю. Гептил, октил і ноніл є найбільш переважними алкільними групами у цьому класі. Переважні алкенільні і алкінільні групи у сполуках відповідно до даного винаходу можуть бути розгалуженими або нерозгалуженими, містити один або більше ненасичених зв'язків і від 2 до близько 12 атомів вуглецю. Один більш переважний клас алкенільних і алкінільних груп містить від 2 до близько 6 атомів вуглецю. Навіть більш переважними є алкенільні і алкінільні групи, що містять 2, 3 або 4 атоми вуглецю. Інший переважний клас алкенільних і алкінільних груп містить від 4 до близько 10 атомів вуглецю, ще більш переважно, від 6 до близько 10 атомів вуглецю; і навіть більш переважно, 7, 8 або 9 атомів вуглецю. Придатні арильні групи у сполуках відповідно до даного винаходу включають сполуки з одним або декількома кільцями, включаючи сполуки з декількома кільцями, що містять окремі і/або конденсовані арильні групи. Типові арильні групи містять від 1 до 3 окремих або конденсованих кілець і 15 від 6 до близько 18 атомів вуглецю у кільці. Переважно, арильні групи містять від 6 до близько 10 атомів вуглецю у кільці. Особливо переважні арильні групи включають заміщений або незаміщений феніл, заміщений або незаміщений нафтил, заміщений або незаміщений біфеніл, заміщений або незаміщений фенантрил і заміщений або незаміщений антрил. Придатні гетероциклічні групи включають гетероароматичні і гетероаліциклічні групи, що містять від 1 до 3 окремих або конденсованих кілець і від 5 до близько 18 атомів у кільці. Переважно, гетероароматичні і гетероаліциклічні групи містять від 5 до близько 10 атомів у кільці. Придатні гетероароматичні групи у сполуках відповідно до даного винаходу містять один, два або три гетероатоми, вибрані з Ν, Ο або S атомів і включають, наприклад, кумарил, включаючи 8-кумарил, хіноліл, включаючи 8-хіноліл, піридил, піразиніл, піразоліл, піримідиніл, фурил, піроліл, тієніл, тіазоліл, ізотіазоліл, триазоліл, тетразоліл, ізоксазоліл, оксазоліл, імідазоліл, індоліл, ізоіндоліл, індазоліл, індолізиніл, фталазиніл, птеридиніл, пуриніл, оксадіазоліл, тіадіазоліл, фуразаніл, піридазиніл, триазиніл, цинолініл, бензімідазоліл, бензофураніл, бензотіофеніл, бензотіазоліл, бензоксазоліл, хіназолініл, хіноксалініл, нафтиридиніл і фуропіридил. Придатні гетероаліциклічні групи у сполуках відповідно до даного винаходу містять один, два або три гетероатоми, вибрані з атомів Ν, Ο або S, і включають, наприклад, піролідиніл, тетрагідрофураніл, дигідрофураніл, тетрагідротієніл, тетрагідротіопіраніл, піперидил, морфолініл, тіоморфолініл, тіоксаніл, піперазиніл, азетидиніл, оксетаніл, тієтаніл, гомопіперидил, оксепаніл, тієпаніл, оксазепініл, діазепініл, тіазепініл, 1,2,3,6тетрагідропіридил, 2-піролініл, 3-піролініл, індолініл, 2Н-піраніл, 4Н-піраніл, діоксаніл, 1,3діоксоланіл, піразолініл, дитіаніл, дитіоланіл, дигідропіраніл, дигідротієніл, дигідрофураніл, піразолідиніл, імідазолініл, імідазолідиніл, 3азабіцикло[3.1.0]гексил, 3-азабіцикло[4.1.0]гептил, 3Н-індоліл і хінолізиніл. Зазначені вище групи можуть бути заміщені в одному або більше доступних положеннях придатними групами, такими як OR', =O, SR', SOR', SO2R', NO2, NHR', N(R')2, =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCON(R')2, захищена ОН, заміщений або незаміщений арил і заміщена або незаміщена гетероциклічна група, де кожну з R' груп незалежно вибирають з групи, що включає водень, ОН, NO2, NH2, SH, CN, галоген, СОН, СОалкіл, СО2Н, заміщений або незаміщений С1-С12 алкіл, заміщений або незаміщений C2-C12 алкеніл, заміщений або незаміщений С2-С12 алкініл, заміщений або незаміщений арил і заміщену або незаміщену гетероциклічну групу. Якщо такі групи заміщені самі, замісники можуть бути вибрані з представленого вище списку. Придатні галогенові замісники у сполуках відповідно до даного винаходу включають F, СІ, Вr і І. Придатні захисні групи для ОН добре відомі фахівцю у даній галузі техніки. Загальний огляд захисних груп в органічній хімії представлений у 97369 16 Wuts, PGM and Greene TW Protecting Groups in th Organic Synthesis, 4 Ed. Wiley-Interscience, і у rd Kocienski PJ Protecting Groups, 3 Ed. Georg Thieme Verlag. У цих посиланнях представлені розділи, що описують захисні групи для ОН. Усі ці джерела включені повністю за допомогою посилань. Приклади таких захищених ОН включають прості ефіри, силілефіри, складні ефіри, сульфонати, сульфенати і сульфінати, карбонати і карбамати. При застосуванні простих ефірів захисні групи для ОН можуть бути вибрані з групи, що включає метил, метоксиметил, метилтіометил, (фенілдиметилсиліл)метоксиметил, бензилоксиметил, п-метоксибензилоксиметил, [(3,4диметоксибензил)окси]метил, пнітробензилоксиметил, о-нітробензилоксиметил, [(R)-1-(2-нітрофеніл)етокси]метил, (4метоксифенокси)метил, гваяколметил, [(пфенілфеніл)окси]метил, трет-бутоксиметил, 4пентенілоксиметил, силоксиметил, 2метоксіетоксиметил, 2-ціаноетоксиметил, біс(2хлоретокси)метил, 2,2,2-трихлоретоксиметил, 2(триметилсиліл)етоксиметил, метоксиметил, обіс(2-ацетоксіетокси)метил, тетрагідропіраніл, фтористий тетрагідропіраніл, 3бромтетрагідропіраніл, тетрагідротіопіраніл, 1метоксициклогексил, 4-метокситетрагідропіраніл, 4-метокситетрагідротіопіраніл, 4метокситетрагідротіопіраніл S,S-діоксид, 1-[(2хлор-4-метил)феніл]-4-метоксипіперидин-4-іл, 1(2-фторфеніл)-4-метоксипіперидин-4-іл, 1-(4хлорфеніл)-4-метоксипіперидин-4-іл, 1,4-діоксан-2іл, тетрагідрофураніл, тетрагідротіофураніл, 2,3,3а,4,5,6,7,7а-октагідро-7,8,8-триметил-4,7метанобензофуран-2-іл, 1-етоксіетил, 1-(2хлоретокси)етил, 2-гідроксіетил, 2-брометил, 1-[2(триметилсиліл)етокси]етил, 1-метил-1метоксіетил, 1-метил-1-бензилоксіетил, 1-метил-1бензилокси-2-фторетил, 1-метил-1-феноксіетил, 2,2,2-трихлоретил, 1,1-діанізил-2,2,2-трихлоретил, 1,1,1,3,3,3-гексафтор-2-фенілізопропіл, 1-(2ціаноетокси)етил, 2-триметилсилілетил, 2(бензилтіо)етил, 2-(фенілселеніл)етил, трет-бутил, циклогексил, 1-метил-1'-циклопропілметил, аліл, преніл, цинаміл, 2-феналіл, пропаргіл, пхлорфеніл, п-метоксифеніл, п-нітрофеніл, 2,4динітрофеніл, 2,3,5,6-тетрафтор-4(трифторметил)феніл, бензил, п-метоксибензил, 3,4-диметоксибензил, 2,6-диметоксибензил, онітробензил, п-нітробензил, пентадієнілнітробензил, пентадієнілнітропіпероніл, галобензил, 2,6дихлорбензил, 2,4-дихлорбензил, 2,6дифторбензил, п-ціанобензил, фтористий бензил, 4-фтористий алкоксибензил, триметилсилілксиліл, п-фенілбензил, 2-феніл-2-пропіл, пациламінобензил, п-азидобензил, 4-азидо-3хлорбензил, 2-трифторметилбензил, 4трифторметилбензил, п-(метилсульфініл)бензил, п-силетанілбензил, 4-ацетоксибензил, 4-(2триметилсиліл)етоксиметоксибензил, 2нафтилметил, 2-піколіл, 4-піколіл, 3-метил-2піколіл N-оксидо, 2-хінолінілметил, 6-метокси-2-(4метилфеніл-4-хінолінметил, 1-піренілметил, дифенілметил, 4-метоксидифенілметил, 4фенілдифенілметил, п,п'-динітробензгідрил, 5 17 дибензосуберил, тирфенілметил, трис(4-третбутилфеніл)метил, α-нафтилдифеніл-метил, пметоксифенілдифенілметил, ди(пметоксифеніл)фенілметил, три(пметоксифеніл)метил, 4-(4'бромфенацилокси)фенілдифенілметил, 4,4',4"трис(4,5-дихлорфталімідофеніл)метил, 4,4',4"трис(левуліноїлоксифеніл)метил, 4,4',4"трис(бензоїлоксифеніл)метил, 4,4'-диметокси-3"[N-(імідазолілметил)]тритил, 4,4'-диметокси-3"-[N(імідазолілетил)карбамоїл]тритил, біс(4метоксифеніл)-1'-піренілметил, 4-(17тетрабензо[а,с,g,i]фторенілметил)-4,4"диметокситритил, 9-антрил, 9-(9-феніл)ксантеніл, 9-фенілтіоксантил, 9-(9-феніл-10-оксо)антрил, 1,3бензодитіолан-2-іл і 4,5-біс(етоксикарбоніл)-[1,3]діоксолан-2-іл, бензізотіазоліл S,S-діоксид. У випадку силілефірів, захисна група для ОН може бути вибрана з групи, що включає триметилсиліл, триетилсиліл, триізопропілсиліл, диметилізопропілсиліл, діетилізопропілсиліл, диметилгексилсиліл, 2-норборнілдиметилсиліл, третбутилдиметилсиліл, трет-бутилдифенілсиліл, трибензилсиліл, три-п-ксилілсиліл, трифенілсиліл, дифенілметилсиліл, ди-трет-бутилметилсиліл, біс(трет-бутил)-1-піренілметоксисиліл, трис(триметил-силіл)силіл, (2гідроксистирил)диметилсиліл, (2гідроксистирил)діізопропілсиліл, третбутилметоксифенілсиліл, третбутоксидифенілсиліл, 1,1,3,3-тетраізопропіл-3-[2(трифенілметокси)етокси]дисилоксан-1-іл і фтористий силіл. У випадку застосування складних ефірів як захисні групи для ОН, вони можуть бути вибрані з групи, що включає форміат, бензоїлформіат, ацетат, хлорацетат, дихлорацетат, трихлорацетат, трихлорацетамід, трифторацетат, метоксіацетат, трифенілметоксіацетат, феноксіацетат, п-хлорфеноксіацетат, фенілацетат, дифенілацетат, 3-фенілпропіонат, бісфтористий ланцюговий пропаноїл, 4-пентеноат, 4оксопентаноат, 4,4-(етилендитіо)пентаноат, 5[3біс(4метоксифеніл)гідроксиметилфенокси]левулінат, півалоат, 1-адамантоат, кротонат, 4метоксикторонат, бензоат, п-фенілбензоат, 2,4,6триметилбензоат, 4-бромбензоат, 2,5дифторбензоат, п-нітробензоат, піколінат, нікотинат, 2-(азидометил)бензоат, 4-азидобутират, (2азидометил)фенілацетат, 2{[(тритилтіо)окси]метил}бензоат, 2-{[(4метокситритилтіо)окси]метил}бензоат, 2{[метил(тритилтіо)аміно]метил}бензоат, 2-{{[(4метокситритил)тіо]метил-аміно}метил}бензоат, 2(алілокси)фенілацетат, 2(пренілоксиметил)бензоат, 6(левулінілоксиметил)-3-метокси-2-нітробензоат, 6(левулінілоксиметил)-3-метокси-4-нітробензоат, 4бензилоксибутират, 4-триалкілсилілоксибутират, 4-ацетокси-2,2-диметилбутират, 2,2-диметил-4пентеноат, 2-йодбензоат, 4-нітро-4метилпентаноат, о-(дибромметил)бензоат, 2формілбензолсульфонат, 4(метилтіометокси)бутират, 2(метилтіометоксиметил)бензоат, 2 97369 18 (хлорацетоксиметил)бензоат, 2-[(2хлорацетокси)етил]бензоат, 2-[2(бензилокси)етил]бензоат, 2-[2-(4метоксибензилокси)етил]бензоат, 2,6-дихлор-4метилфеноксіацетат, 2,6-дихлор-4-(1,1,3,3тетраметилбутил)феноксіацетат, 2,4-біс(1,1диметилпропіл)феноксіацетат, хлор дифеніл ацетат, ізобутират, моносукциноат, (Е)-2-метил-2бутеноат, о-(метоксикарбоніл)бензоат, α-нафтоат, нітрат, алкіл Ν,Ν,Ν',Ν'-тетраметилфосфордіамідат і 2-хлорбензоат. У випадку сульфонатів, сульфенатів і сульфінатів, захисна група для ОН може бути вибрана з групи, що включає сульфат, алілсульфонат, метансульфонат, бензилсульфонат, тозилат, 2-[(4-нітрофеніл)етил]сульфонат, 2трифторметилбензолсульфонат, 4монометокситритилсульфенат, алкіл 2,4динітрофенілсульфенат, 2,2,5,5тетраметилпіролідин-3-он-1-сульфінат, борат і диметилфосфінотіоліл. У випадку карбонатів, захисна група для ОН може бути вибрана з групи, що включає метилкарбонат, метоксиметилкарбонат, 9-фторенілметилкарбонат, етилкарбонат, брометилкарбонат, 2(метилтіометокси)етилкарбонат, 2,2,2трихлоретилкарбонат, 1,1-диметил-2,2,2трихлоретилкарбонат, 2(триметилсиліл)етилкарбонат, 2-[диметил(2нафтилметил)силіл]етилкарбонат, 2(фенілсульфоніл)етилкарбонат, 2(трифенілфосфоніл)етилкарбонат, цис-[4[[(метокситритил)сульфеніл]окси]тетрагідрофуран-3-іл]оксикарбонат, ізобутилкарбонат, трет-бутилкарбонат, вінілкарбонат, алілкарбонат, цинамілкарбонат, пропаргілкарбонат, пхлорфенілкарбонат, п-нітрофенілкарбонат, 4етокси-1-нафтилкарбонат, 6-бром-7гідроксикумарин-4-ілметилкарбонат, бензилкарбонат, о-нітробензилкарбонат, пнітробензилкарбонат, п-метоксибензилкарбонат, 3,4-диметоксибензилкарбонат, антрахінон-2ілметилкарбонат, 2-данзилетилкарбонат, 2-(4нітрофеніл)етил-карбонат, 2-(2,4динітрофеніл)етилкарбонат, 2-(2нітрофеніл)пропілкарбонат, алкіл 2-(3,4метилендіокси-6-нітрофеніл)пропілкарбонат, 2ціано-1-феніл етилкарбонат, 2-(2-піридил)аміно-1феніл етилкарбонат, 2-[N-метил-N-(2піридил)]аміно-1-феніл етилкарбонат, фенацилкарбонат, 3',5'-диметоксибензоїнкарбонат, метил дитіокарбонат і S-бензилтіокарбонат. І у випадку карбаматів, захисна група для ОН може бути вибрана з групи, що включає диметилтіокарбамат, Nфенілкарбамат, N-метил-N-(онітрофеніл)карбамат. Згадування цих груп не повинне розглядатися як обмеження обсягу даного винаходу, тому що вони зазначені тільки як ілюстрація захисних груп для ОН, але інші групи, що мають зазначену функцію, можуть бути відомі фахівцю у даній галузі техніки, і вони також розглядаються як такі, що входять в обсяг даного винаходу. Термін "фармацевтично прийнятні солі, похідні, проліки" стосується будь-якої фармацевтично прийнятної солі, складного ефіру, сольвату, гідра 19 ту або будь-якої іншої сполуки, яка, при введенні пацієнту, здатна давати (безпосередньо або опосередковано) описану тут сполуку. Однак, має бути зрозуміло, що нефармацевтично прийнятні солі також попадають в обсяг даного винаходу, тому що вони можуть застосовуватися для одержання фармацевтично прийнятних солей. Одержання солей, проліків і похідних може проводитися способами, відомими у даній галузі техніки. Наприклад, фармацевтично прийнятні солі представлених тут сполук синтезують з вихідної сполуки, що містить основну або кислотну групу, звичайними хімічними методами. Звичайно такі солі, наприклад, одержують взаємодією вільної кислоти або основи цих сполук зі стехіометричною кількістю відповідної основи або кислоти у воді або в органічному розчиннику, або в їх суміші. Звичайно переважне водне середовище, таке як простий ефір, етилацетат, етанол, ізопропанол або ацетонітрил. Приклади кислотно-адитивних солей включають мінеральні кислотно-адитивні солі, такі як, наприклад, гідрохлорид, гідробромід, гідройодид, сульфат, нітрат, фосфат, і органічні кислотноадитивні солі, такі як, наприклад, ацетат, трифторацетат, малеат, фумарат, цитрат, оксалат, сукцинат, тартрат, малат, манделат, метансульфонат і п-толуолсульфонат. Приклади основноадитивних солей включають неорганічні солі, такі як, наприклад, солі натрію, калію, кальцію і амонію, і органічні основно-адитивні солі, такі як, наприклад, солі етилендіаміну, етаноламіну, Ν,Νдіалкіленетаноламіну, триетаноламіну і солі основних амінокислот. Сполуки відповідно до даного винаходу можуть бути у кристалічній формі або у вигляді вільних сполук, або у вигляді сольватів (наприклад, гідратів) і мається на увазі, що обидві форми включені в обсяг даного винаходу. Способи сольватації широко відомі у даній галузі техніки. Будь-яка сполука, що є проліками сполуки формули І, попадає в обсяг і суть даного винаходу. Термін «проліки» застосовують у його найширшому значенні і він охоплює такі похідні, які перетворюються in vivo у сполуки відповідно до даного винаходу. Такі похідні легко розпізнаються фахівцями у даній галузі техніки і включають, наприклад, сполуки, в яких вільна гідроксигрупа перетворюється у похідне складного ефіру. Будь-яка сполука, зазначена тут, представляє конкретну сполуку, а також визначені варіанти або форми. Зокрема, зазначені тут сполуки можуть мати асиметричні центри і, тому, існують у різних енантіомерних формах. Всі оптичні ізомери і стереоізомери зазначених тут сполук їх суміші включені в обсяг даного винаходу. Таким чином, будьяка дана сполука, зазначена тут, представляє будь-який рацемат, одну або більше енантіомерних форм, одну або більше діастереомерних форм, одну або більше атропізомерних форм їх суміші. Зокрема, сполуки відповідно до даного винаходу, представлені зазначеною вище формулою І, можуть включати енантіомери в залежності від їх асиметрії, або діастереоізомери. Стереоізомерія біля подвійного зв'язку також можлива, тому у деяких випадках молекула може існувати як (Е) 97369 20 ізомер або (Z)-ізомерp. Якщо молекула містить декілька подвійних зв'язків, кожен подвійний зв'язок буде мати власну ізомерію, що може бути однаковою або відмінною від стереоізомерії інших подвійних зв'язків у молекулі. Окремі ізомери і суміші ізомерів попадають в обсяг даного винаходу. Далі, зазначені тут сполуки можуть існувати у вигляді геометричних ізомерів (тобто цис і транс ізомерів), у вигляді таутомерів або атропізомерів. Більш конкретно, термін «таутомер» стосується одного з двох або більше структурних ізомерів сполуки, що існують у рівновазі і легко перетворюються з однієї ізомерної форми в іншу. Звичайні таутомерні форми включають амін-імін, амід-імід, кето-енол, лактам-лактим, і т.д. Додатково, будьяка зазначена тут сполука представляє гідрати, сольвати і поліморфи, їх суміші, коли такі форми існують у середовищі. Крім того, зазначені тут сполуки можуть існувати у мічених ізотопами формах. Усі геометричні ізомери, таутомери, атропізомери, гідрати, сольвати, поліморфи і мічені ізотопами форми зазначених тут сполук попадають в обсяг даного винаходу. Для більш конкретного опису, деякі кількісні вирази, подані тут, не позначені терміном «близько». Зрозуміло, що, незалежно від того, застосовується термін «близько» недвозначно або ні, кожна зазначена тут кількість стосується фактичного даного значення, а також стосується приблизних значень такого даного значення, що обґрунтовано передбачаються фахівцем у даній галузі техніки, включаючи еквіваленти і наближені значення, що виникають через експериментальні умови і/або умови вимірювання для такого даного значення. У сполуках загальної формули І, особливо переважним R1 є водень, ORa і OCORa, де Ra вибирають з водню і заміщеного або незаміщеного С 1C12 алкілу. Особливо переважним Ra є водень і заміщений або незаміщений С1-С6 алкіл; і навіть більш переважним є водень, метил, етил, пропіл, ізопропіл і бутил, включаючи трет-бутил. Водень, ОН і метокси є найбільш переважними R1 групами. Особливо переважними R2 і R3 є водень і заміщений або незаміщений С1-С12 алкіл. Більш переважними R2 і R3 є водень і заміщений або незаміщений С1-С6 алкіл, і навіть більш переважно, водень. Особливо переважними R41, R42, R43, R44, R45, R46, R47 і R48 є водень і заміщений або незаміщений С1-С12 алкіл. Більш переважними R41, R42, R43, R44, R45, R46, R47 і R48 є водень і заміщений або незаміщений С1-С6 алкіл, і навіть більш переважним є водень^ заміщений або незаміщений метил, заміщений або незаміщений етил, заміщений або незаміщений пропіл, заміщений або незаміщений ізопропіл і заміщений або незаміщений бутил, включаючи заміщений або незаміщений третбутил, заміщений або незаміщений ізобутил і заміщений або незаміщений втор-бутил. Переважними замісниками зазначених груп є OR', =O, SR', SOR', SO2R', NO2, NHR', N(R')2, =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCON(R')2, захищений ОН, заміщений або незаміщений арил і заміщена або незаміщена гетероциклічна група, 21 де кожну з R' груп незалежно вибирають з групи, що включає водень, ОН, NO2, NH2, SH, CN, галоген, СОН, СОалкіл, СООН, заміщений або незаміщений C1-C12 алкіл, заміщений або незаміщений С2-С12 алкеніл, заміщений або незаміщений С2-С12 алкініл, заміщений або незаміщений арил і заміщену або незаміщену гетероциклічну групу. Якщо такі групи самі заміщені, замісники можуть бути вибрані з представленого вище списку. Навіть більш переваленими замісниками зазначених вище груп є ОН, SCH3, SH, NH2, NHC(=NH)NH2, CONH2, СООН, феніл, п-, м- або о-гідроксифеніл, індоліл, включаючи 1-, 2- і 3-індоліл, та імідазоліл, включаючи 4- і 5-імідазоліл. Водень, метил, ізопропіл, трет-бутил і бензил є найбільш переважними R41, R42, R43, R44, R45, R46, R47 і R48 групами. Більш конкретно, особливо переважні R42, R44, R45, R46 і R47 є воднем. Особливо переважні R41 і R43 є метилом. І особливо переважний R48 є ізопропілом, трет-бутилом або бензилом. Особливо переважними R5 і R6 є водень і заміщений або незаміщений С1-С12 алкіл. Більш переважними R5 і R6 є водень і заміщений або незаміщений С1-C6 алкіл; і навіть більш переважними є водень, метил, етил, пропіл, ізопропіл і бутил, включаючи трет-бутил. Водень є найбільш переважним. В іншому варіанті винаходу, також переважно, щоб R5 і R48 разом з відповідними N атомом і С атомом, до яких вони приєднані, утворювали заміщену або незаміщену гетероциклічну групу. Переважною гетероциклічною групою є піролідиніл, включаючи 1-, 2- і 3-піролі дині л. Особливо переважним R7 є водень, заміщений або незаміщений С1-С12 алкіл і заміщений або незаміщений C2-C12 алкеніл, і більш переважним, є водень, заміщений С1-С12 алкіл і заміщений С2-С12 алкеніл. Переважний заміщений алкіл і заміщений алкеніл може бути присутнім не тільки в одному, але і у двох або більше замісниках. Більш переважними алкільними групами є такі, які містять від 6 до близько 10 атомів вуглецю; і навіть більш переважно, 7, 8 або 9 атомів вуглецю. Гептил, октил і ноніл є найбільш переважними алкільними групами. З іншого боку, більш переважними алкенільними групами є такі, які містять від 6 до близько 10 атомів вуглецю; і навіть більш переважно, 7, 8 або 9 атомів вуглецю. Окта-1,6-дієніл, окта-1,5-дієніл, окта-1,4-дієніл, окта-1,3-дієніл, нона-1,7-дієніл, нона-1,6-дієніл, нона-1,5-дієніл, нона-1,4-дієніл, нона-1,3-дієніл, гепта-1,5-дієніл, гепта-1,4-дієніл, гепта-1,3-дієніл є найбільш переважними алкенільними групами. Переважними замісниками для зазначених алкільних і алкенільних груп є OR', =O, SR', SOR', SO2R', NO2, NHR', N(R)2, =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR, OCONHR, OCON(R')2, захищений ОН, заміщений або незаміщений арил і заміщена або незаміщена гетероциклічна група, де кожну з R' груп незалежно вибирають з групи, що включає водень, ОН, NO2, NH2, SH, CN, галоген, СОН, СОалкіл, СООН, заміщений або незаміщений С1-С12 алкіл, заміщений 97369 22 або незаміщений С2-С12 алкеніл, заміщений або незаміщений С2-С12 алкініл, заміщений або незаміщений арил, і заміщену або незаміщену гетероциклічну групу. Якщо такі групи самі є заміщеними, замісники можуть бути вибрані з представленого вище списку. Більш переважними замісниками для зазначених вище алкільних і алкенільних труп є галоген, OR', =O, OCOR', OCONHR', OCON(R')2 і захищений ОН, де кожну з R' груп переважно вибирають з водню, заміщеного або незаміщеного С1-С12 алкілу, заміщеного або незаміщеного С2-С12 алкенілу, заміщеного або незаміщеного С2-С12 алкінілу і заміщеного або незаміщеного арилу. Навіть більш переважними замісниками для зазначених алкільних і алкенільних груп є галоген, OR', =O, OCONHR', OCON(R')2 і захищений ОН, де захисну групу для ОН переважно вибирають з триметилсилілу, триетилсилілу, триізопропілсилілу, диметилізопропілсилілу, діетилізопропілсилілу, диметилгексилсилілу, 2-норборнілдиметилсилілу, третбутилдиметилсилілу, трет-бутилдифенілсилілу, трибензилсилілу, три-п-ксилілсилілу, трифенілсилілу, дифенілметилсилілу, ди-третбутилметилсилілу, біс(трет-бутил)-1піренілметоксисилілу, трис(триметилсиліл)силілу, (2-гідроксистирил)диметилсилілу, (2гідроксистирил)діізопропілсилілу, третбутилметоксифенілсилілу, третбутоксидифенілсилілу, 1,1,3,3-тетраізопропіл-3-[2(трифенілметокси)етокси]дисилоксан-1-ілу і фтористого силілу, і де кожну з R' груп більш переважно, вибирають з водню, незаміщеного С1-С6 алкілу і заміщеного або незаміщеного арилу. СІ, ОН, =О, OCONH2, ОСОNHфеніл і захищений ОН, де захисну групу для ОН переважно вибирають з триметилсилілу, триетилсилілу, триізопропілсилілу, диметилізопропілсилілу, діетилізопропілсилілу, диметилгексилсилілу, 2-норборнілдиметилсилілу, трет-бутилдиметилсилілу, третбутилдифенілсилілу, трибензилсилілу, три-пксилілсилілу, трифенілсилілу, дифенілметилсилілу, ди-трет-бутилметилсилілу, біс(трет-бутил)-1піренілметоксисилілу, трис(триметилсиліл)силілу, (2-гідроксистирил)диметилсилілу, (2гідроксистирил)діізопропілсилілу, третбутилметоксифенілсилілу, третбутоксидифенілсилілу, 1,1,3,3-тетраізопропіл-3-[2(трифенілметокси)етокси]дисилоксан-1-ілу і фтористого силілу, є найбільш переважними замісниками для таких алкільних і алкенільних груп. Особливо переважною є присутність одного або більше додаткових зв'язків у місцях, позначених пунктирною лінією. Більш переважною є присутність додаткового зв'язку у всіх місцях, позначених пунктирною лінією. Крім того, стереохімія кожного подвійного зв'язку може існувати як (Е) або (Z). Окремі ізомери і суміші ізомерів попадають в обсяг даного винаходу. Більш конкретно, у даному винаході представлені сполуки загальної формули II або їх фармацевтично прийнятні солі, похідні, таутомери, проліки або стереоізомери 23 де R1 вибирають з водню, ORa, OCORa, OCOORa, NRaRb, NRaCORb і NRaC(NRa)NRaRb; кожен R41, R43 і R48 незалежно вибирають з водню, заміщеного або незаміщеного С1-C12 алкілу, заміщеного або незаміщеного С2-С12 алкенілу і заміщеного або незаміщеного С2-С12 алкінілу; кожен R5, R6 і R7 незалежно вибирають з водню, CORa, COORa, заміщеного або незаміщеного С1-C12 алкілу, заміщеного або незаміщеного С2-С12 алкенілу і заміщеного або незаміщеного С2-С12 алкінілу, або R5 і R48 разом з відповідними атомом N і атомом С, до яких вони приєднані, можуть утворювати заміщену або незаміщену гетероциклічну групу; кожен Ra і Rb незалежно вибирають з водню, заміщеного або незаміщеного С1-С12 алкілу, заміщеного або незаміщеного С2-С12 алкенілу, заміщеного або незаміщеного С2-С12 алкінілу, заміщеного або незаміщеного арилу і заміщеної або незаміщеної гетероциклічної групи; і кожна пунктирна лінія представляє необов'язковий додатковий зв'язок. У сполуках загальної формули II, особливо переважним R1 є водень, ORa і OCORa, де Ra вибирають з водню і заміщеного або незаміщеного С1-C12 алкілу. Особливо переважним Ra є водень і заміщений або незаміщений С1-C6 алкіл; і навіть більш переважним є водень, метил, етил, пропіл, ізопропіл і бутил, включаючи трет-бутил. Водень, ОН і метокси є найбільш переважними R1. Особливо переважними R41, R43 і R48 є водень і заміщений або незаміщений С1-С12 алкіл. Більш переважними R41, R43 і R48 є водень і заміщений або незаміщений С1-С6 алкіл, і навіть більш переважним є водень, заміщений або незаміщений метил, заміщений або незаміщений етил, заміщений або незаміщений пропіл, заміщений або незаміщений ізопропіл і заміщений або незаміщений бутил, включаючи заміщений або незаміщений трет-бутил, заміщений або незаміщений ізобутил і заміщений або незаміщений втор-бутил. Переважними замісниками зазначених груп є OR', =О, SR', SOR', SO2R', NO2, NHR', N(R')2, =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCON(R')2, захищений ОН, заміщений або незаміщений арил і заміщена або незаміщена гетероциклічна група, де кожну з груп R' незалежно вибирають з групи, що включає водень, ОН, NO2, NH2, SH, CN, галоген, СОН, СОалкіл, СООН, заміщений або незаміщений С1-C12 алкіл, заміщений або незаміщений C2-C12 алкеніл, заміщений або незаміщений С2-С12 алкініл, заміщений або незаміщений арил і заміщену або незаміщену гетероциклічну групу. Якщо такі групи заміщені самі, замісники можуть бути вибрані з представленого вище списку. Навіть більш переважними замісниками зазначених вище груп є ОН, SCH3, SH, NH2, NHC(=NH)NH2, CONH2, 97369 24 СООН, феніл, п-, м- або о-гідроксифеніл, індоліл, включаючи 1-, 2- і 3-індоліл, імідазоліл, включаючи 4- і 5-імідазоліл. Водень, метил, ізопропіл, третбутил і бензил є найбільш переважними R41, R43 і R48 групами. Більш конкретно, особливо переважними R41 і R43 є метил, і особливо переважним R48 є ізопропіл, бутил або бензил. Особливо переважними R5 і R6 є водень і заміщений або незаміщений С1-С12 алкіл. Більш переважними R5 і R6 є водень і заміщений або незаміщений С1-С6 алкіл; і навіть більш переважними є водень, метил, етил, пропіл, ізопропіл і бутил, включаючи трет-бутил. Водень є найбільш переважним. В іншому варіанті даного винаходу також переважно, щоб R5 і R48 разом з відповідними атомом N і атомом С, до яких вони приєднані, утворювали заміщену або незаміщену гетероциклічну групу. Переважною гетероциклічною групою є піролідиніл, включаючи 1-, 2- і 3 -піролідиніл. Особливо переважним R7 є водень, заміщений або незаміщений С1-C12 алкіл і заміщений або незаміщений С2-С12 алкеніл, і, більш переважно, є водень, заміщений С1-C12 алкіл і заміщений С2-С12 алкеніл. Більш переважними алкільними групами є такі, які містять від 6 до близько 10 атомів вуглецю; і навіть більш переважно, 7, 8 або 9 атомів вуглецю. Гептил, октил і ноніл є найбільш переважними алкільними групами. З іншого боку, більш переважними алкенільними групами є такі, які містять від 6 до близько 10 атомів вуглецю; і навіть більш переважно, 7, 8 або 9 атомів вуглецю. Окта1,6-дієніл, окта-1,5-дієніл, окта-1,4-дієніл, окта-1,3дієніл, нона-1,7-дієніл, нона-1,6-дієніл, нона-1,5дієніл, нона-1,4-дієніл, нона-1,3-дієніл, гепта-1,5дієніл, гепта-1,4-дієніл, гепта-1,3-дієніл є найбільш переважними алкенільними групами. Переважними замісниками для зазначених алкільних і алкенільних груп є OR', =О, SR', SOR', SO2R', NO2, NHR', N(R')2, =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCON(R')2, заміщений ОН, заміщений або незаміщений арил і заміщена або незаміщена гетероциклічна група, де кожну з груп R' незалежно вибирають з групи, що включає водень, ОН, NO2, NH2, SH, CN, галоген, СОН, СОалкіл, СООН, заміщений або незаміщений С1-C12 алкіл, заміщений або незаміщений С2-С12 алкеніл, заміщений або незаміщений С2-С12 алкініл, заміщений або незаміщений арил і заміщену або незаміщену гетероциклічну групу. Якщо такі групи самі заміщені, замісники можуть бути вибрані з представленого вище списку. Більш переважними замісниками для зазначених вище алкільних і алкенільних груп є галоген, OR', =О, OCOR', OCONHR', OCON(R')2 і захищений ОН, де кожну з груп R' переважно вибирають з водню, заміщеного або незаміщеного С1-C12 алкілу, заміщеного або незаміщеного С2-С12 алкенілу, заміщеного або незаміщеного С2-С12 алкінілу і заміщеного або незаміщеного арилу. Навіть більш переважними замісниками для таких алкільних і алкенільних груп є галоген, OR', =О, OCONHR', OCON(R')2 і захищений ОН, де захисну групу для ОН переважно вибирають з триметилсилілу, триетилсилілу, триізо 25 97369 26 пропілсилілу, диметилізопропілсилілу, діетилізопропілсилілу, диметилгексилсилілу, 2норборнілдиметилсилілу, третбутилдиметилсилілу, трет-бутилдифенілсилілу, трибензилсилілу, три-п-ксилілсилілу, трифенілсилілу, дифенілметилсилілу, ди-третбутилметилсилілу, біс(трет-бутил)-1піренілметоксисил ілу, трис(триметил-силіл)силілу, (2-гідроксистирил)диметилсилілу, (2гідроксистирил)діізопропіл-силілу, третбутилметоксифенілсилілу, третбутоксидифенілсилілу, 1,1,3,3-тетраізопропіл-3-[2(трифенілметокси)етокси] дисилокcан-1-ілу і фтористого силілу, і де кожну групу R' більш переважно вибирають з водню, незаміщеного С1-С6 алкілу і заміщеного або незаміщеного арилу. СІ, ОН, =О, OCONH2, ОСОNHфеніл і захищений ОН, де захисну групу для ОН переважно вибирають з триметилсилілу, триетилсилілу, триізопропілсилілу, диметилізопропілсилілу, діетилізопропілсилілу, диметилгексилсилілу, 2-норборнілдиметилсилілу, трет-бутилдиметилсилілу, третбутилдифенілсилілу, трибензилсилілу, три-пксилілсилілу, трифенілсилілу, дифенілметилсилілу, ди-трет-бутилметилсилілу, біс(трет-бутил)-1піренілметоксисилілу, трис(триметилсиліл)силілу, (2-гідроксистирил)диметилсилілу, (2гідроксистирил)діізопропілсилілу, третбутилметоксифенілсилілу, третбутоксидифенілсилілу, 1,1,3,3-тетраізопропіл-3-[2(трифенілметокси)етокси]дисилоксан-1-ілу і фтористого силілу, є найбільш переважними замісниками для таких алкільних і алкенільних груп. Особливо переважною є присутність одного або більше додаткових зв'язків у місцях, позначених пунктирною лінією. Більш переважною є присутність додаткового зв'язку у всіх місцях, позначених пунктирною лінією. Крім того, стереохімія кожного подвійного зв'язку може існувати як (Е) або (Z). Окремі ізомери і суміші ізомерів попадають в обсяг даного винаходу. Особливо переважними сполуками відповідно до даного винаходу є наступні: Сполуки 1-8 виділяють з губки сімейства Raspailiidae, рід Lithoplocamia, вид lithistoides. Зразок Lithoplocamia lithistoides зберігається в "Instituto de Ciencias del Mar у Limnologia" у Universidad Nacional Autonoma de Mexico у Мазальтан у Мексиці, з порядковим номером LEB-ICMLUNAM-11-2004. Цю губку збирають вручну плавці з аквалангом на Мадагаскарі (S 17° 06,071'/Е 49° 51,385') на глибині від 6 до 20 м, і вона має наведений нижче опис: Сімейство Raspailiidae: Raspailiidae Hentschel, 1923, являють собою губки, що мають покриті кіркою, масивні, часточкові, віялоподібні або розгалужені форми росту, звичайно з дуже щетинистою поверхнею. Звичайно є присутнім адаптований ектосомальний скелет, що складається з кистей або невеликих тонких голок (Hooper & Wiedenmayer 1994: фіг. 17) або оксеан (Hooper & Wiedenmayer 1994: фіг. 5), оточений окремими довгими товстими голками або оксеанами. Хоаносомальний скелет варіюється від стиснутого осьо 27 97369 вого скелету до пір'ясто-сітчастих або винятково сітчастих структур. Волокна спонгіну звичайно повністю оточені порожніми шипами (хоаносомальні голки, оксеани або обидва види). Особлива категорія шипоподібних голок (Hooper & Wiedenmayer 1994: фіг. 22) або модифікації голок (наприклад, фіг. 22-25, 28), покритих шипами волокон, стирчать під прямим кутом до волокон. Мікросклери звичайно відсутні, хоча у деяких родах можуть бути окремі рафіди (Hooper & Wiedenmayer 1994: фіг. 109) або пучки (trichodragmata; Hooper & Wiedenmayer 1994: фіг. 110). Распаїліди широко поширені на глибині від мілководдя до, принаймні, 2460 м (Hartman 1982). Рід Lithoplocamia, вид lithistoides являє собою покриті кіркою масивні форми росту, хоаносомальний скелет являє собою щільну ізодиктіальну l II III IV V VI VII VIII де R, R , R , R , R , R , R , R і R є бажаною групою або придатною захисною групою, за необхідності. Цей спосіб може включати наступні ключові стадії: a) Амідування йодалкеніл похідного (фрагмент D) фрагментом С з подальшим застосуванням стандартних методик (Kozawa Y et al. Teтpahedron Lett. 2002, 43, 111) для одержання відповідного енаміду (фрагмент CD). 28 або нерівномірно субізодиктіальну сітчасту структуру акантостронгілід, в 1 або 2 розмірних категоріях, без осьового стискання, без шипастих акантоголок, з екстраосьовими радіальними ділянками гладких голок і звичайно без спеціалізованого ектосомального скелету распаїлід (хоча, якщо вони присутні, ектосомальні шипи являють собою довгі тонкі оксеани); мікросклери відсутні. Зразки Lithoplocamia lithistoides також збирають у Кенії (S 04°40'5,5"/Е 39°26'4,3", і S 03°38'36,5"/Е 39°53'53,8") і Танзанії (S 08°55'31,7"/Е 39°34'53,5", і S 05°24,2007Е 39°47,730') на глибині від 30 до 40 м. Крім того, сполуки відповідно до даного винаходу можуть бути одержані синтезом. Наприклад, сполука 1 може бути одержана об'єднанням різних фрагментів, як показано на схемі 1. b) Реакція сполучення Стілла між фрагментом А і фрагментом В з подальшим застосуванням відомих методик органічного синтезу (Scott WJ et al. J. Am. Chem. Soc. 1984, 106, 4630; Labadie J W et al. J. Org. Chem. 1983, 48, 4634-4642; Farina V et al. Organic Reactions 1998, Wiley) для одержання лінійного полієну (фрагмент АВ). c) Фрагменти АВ і CD можуть бути з'єднані із застосуванням стандартних методик (Bodanszky Μ and Bodanszky A, The Practice of Peptide Synthesis, 29 Springer-Verlag, 1993) з одержанням вуглецевого скелету сполуки 1. ll d) Зняття захисту зі спирту OR з подальшою лактонізацією може бути проведене відомими методами органічного синтезу (Greene and Wuts, rd Protective Groups in Organic Synthesis, 3 ed., Wiley-Interscience; Burke and Danheiser, Handbook of Reagents for Organic Synthesis: Oxidizing and Reducing Agents, Wiley; Pla D et al. J. Org. Chem. 2005, 70, 8231). III e) Нарешті, 3Няття захисту зі спирту OR з подальшим утворенням карбамату може бути проведене стандартними методами (Love В et al. Organic Syntheses, Coll. Vol. 5, p. 162; Vol. 48, p. 32; Muller Ε et al. Methoden der Organischen Chemie th (Houben-Weyl), 4 ed., Vol. 8, G. Thieme, Stuttgart, 1952, p. 137) з одержанням сполуки 1. Послідовність стадій може бути змінена для одержання кінцевої сполуки. Наприклад, фрагмент ВС може бути одержаний на першій стадії, потім приєднаний до фрагментів А і D з одержанням вуглецевого скелету сполуки 1. Так само, сполука 1 може бути одержана послідовним поєднанням фрагментів А, В, С і D у будь-якому порядку. Інший варіант дій включає одержання лактонової групи фрагмента А до його поєднання з будь-яким іншим фрагментом. Аналоги сполуки 1 можуть бути синтезовані способом, еквівалентним тому, що описаний для сполуки 1, шляхом вибору придатних замісників у проміжних сполуках у кожному випадку. За необхідності на замісниках можуть застосовуватися придатні захисні групи для того, щоб не були порушені реакційноздатні групи. Синтез може проводитися із застосуванням попередників замісників, які можуть бути перетворені на придатній стадії у бажаний замісник. Насиченість або ненасиченість кільцевої структури може бути введена або видалена як частина синтезу. Вихідні матеріали і реагенти можуть бути модифіковані за бажанням для того, щоб забезпечити синтез необхідної сполуки. Крім того, зі сполуки 1 також можуть бути синтезовані аналоги із застосуванням звичайних методів синтезу в органічній хімії, які відомі фахівцям у даній галузі техніки. Зазначений вище шлях синтезу може бути модифікований за бажанням для одержання стереоспецифічних сполук, а також сумішей стереоізомерів. Можливо синтезувати визначені стереоізомери або визначені суміші різними методами, включаючи застосування стереоспецифічних реагентів або введення хіральних центрів у сполуки під час синтезу. Можливе введення одного або більше стереоцентрів під час синтезу, а також інвертування існуючих стереоцентрів. Крім того, можливо розділяти стереоізомери відразу ж після синтезу сполуки із застосуванням стандартних методик розділення, відомих фахівцю у даній галузі техніки. Важливою характеристикою описаних вище сполук формул І і II є їх біоактивність і, зокрема, їх цитотоксична і антимітотична дія. У даному винаході представлені нові фармацевтичні композиції сполук загальної формули І і II, що мають цитотоксичну і антимітотичну дію, їх 97369 30 застосування як протипухлинних агентів. Таким чином, у даному винаході також представлені фармацевтичні композиції, що містять сполуку відповідно до даного винаходу, її фармацевтично прийнятну сіль, похідне, таутомер, проліки або стереоізомер, і фармацевтично прийнятний носій. Приклади фармацевтичних композицій включають будь-які тверді (таблетки, пігулки, капсули, гранули і т.д.) або рідкі (розчини, суспензії або емульсії) композиції для перорального, місцевого або парентерального введення. Введення сполук або композицій відповідно до даного винаходу може проводитися будь-яким придатним способом, таким як внутрішньовенне вливання, пероральні препарати і внутрішньочеревинне, і внутрішньовенне введення. Переважно, щоб час вливання складав аж до 24 годин, більш переважно, 1-12 годин, найбільш переважно, 1-6 годин. Особливо бажаний більш короткий час вливання, що дозволяє проводити лікування без необхідності залишатися у лікарні на ніч. Однак, за необхідності вливання може проводитися протягом від 12 до 24 годин або навіть довше. Вливання може проводитися з придатними інтервалами, наприклад, від 1 до 4 тижнів. Фармацевтичні композиції, що містять сполуки відповідно до даного винаходу, можуть доставлятися із застосуванням ліпосомного або наносферичного інкапсулювання, у композиціях з уповільненим виділенням або іншими стандартними засобами доставки. Точна доза сполук варіюється відповідно до конкретної композиції, способу введення і конкретного місця впливу, пацієнта і пухлини, що лікується. Також повинні прийматися до уваги інші фактори, такі як вік, маса тіла, стать, режим харчування, час введення, швидкість виведення, стан пацієнта, комбінація лікарських засобів, реакції чутливості і тяжкість захворювання. Введення може проводитися безперервно або періодично із застосуванням максимальної переносимої дози. Сполуки і композиції відповідно до даного винаходу можуть застосовуватися з іншими лікарськими засобами для проведення комбінованої терапії. Інші лікарські засоби можуть бути частиною однієї композиції або являти собою окрему композицію для введення одночасно або в інший час. Протипухлинна дія цих сполук включає, але не обмежена ними, вплив на рак легенів, рак товстої кишки, рак молочної залози і рак шийки матки. ПРИКЛАДИ ПРИКЛАД 1: ОПИС МОРСЬКОГО ОРГАНІЗМУ І МІСЦЕ ЗБИРАННЯ Lithoplocamia lithistoides збирають вручну плавці з аквалангом на Мадагаскарі (S 17°06,071'/Е 49°51,385') на глибині від 6 до 20 м. Тваринний матеріал ідентифікований Jose Luis Carballo (Universidad Autónoma de Mejico). Зразок поміщений на збереження в "Instituto de Ciencias del Mar у Limnologia" у Universidad Nacional Autónoma de Mexico у Мазальтан у Мексиці, з порядковим номером LEB-ICML-UNAM-11-2004. ПРИКЛАД 2: ВИДІЛЕННЯ СПОЛУКИ 1 Заморожений зразок прикладу 1 (61 г) нарізають і екстрагують Н2О (3×200 мл) і потім сумішшю МеОН:дихлорметан (1:1, 3×200 мл) при кімнатній 31 97369 температурі. Об'єднані органічні екстракти концентрують з одержанням 1,11 г неочищеного продукту. Цей матеріал піддають VLC на Lichroprep RP18 зі ступінчастим градієнтом від Н2О до МеОН. Сполуку 1 (1,6 мг) виділяють з фракцій, елюйованих МеОН із застосуванням напівпрепаративноХ ВЕРХ з оберненою фазою (SymmetryPrep С18 32 7 мкм, 7,8×150 мм, градієнт H2O:MeCN від 35 до 100% MeCN за 30 хв., УФ визначення, потік 2,5 мл/хв., кт 14,4 хв.). Сполука 1: аморфна біла речовина. + (+)HRESIMS m/z 606,2940 [М+Н] (Розрах. для 35 1 13 С31Н45 СlN3О7 606,2946); H (500 МГц) і С ЯМP (125 МГц) див. таблицю 1. Таблиця 1 1 Дані H і № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 1 Η (Мультиплетність, J) 5,63 (дд, 6,5, 2,6) 2,45 (ддд, 17,3, 11,5, 2,6) 2,37 (ддд, 17,3, 6,5, 4,1) 4,24 (ддд, 11,5, 7,1,4,1) 2,85 (ддкв., 9,8, 7,1, 6,7) 5,29 (д, 9,8) 6,17 (д, 11,6) 7,30 (дд, 11,6, 11,6) 6,91 (дд, 11,6, 11,6) 5,70 (д, 11,6) 6,51 (д, 9,5) 4,41 (д, 9,5) 8,78 (д, 10,8) 13 С ЯМР для сполуки 1 (CDCI3) 13 1 13 С 161,6 145,2 108,2 26,1 № 18 19 20 21 Η (Мультиплетність, J) 6,84 (ушир.дд, 10,8, 9,7) 4,80 (м) 2,46 (м) 2,09 (ддд, 14,1, 8,4, 8,1) 4,41 (м) С 124,5 105,0 30,7 74,9 81,9 37,1 134,1 133,7 140,2 124,6 137,6 120,7 166,3 60,8 168,2 22 23 24 25 26 27 28 29 30 31 32 33 2,33 (м), 2Н 5,61 (ушир.т, 6,8) 2,06 (с), 3Н 3,66 (с), 3Н 1,15 (д, 6,7), 3Н 1,82 (с), 3Н 1,04 (с), 3Н 1,04(с), 3Н 1,04 (с), 3Н 33,0 122,4 132,0 21,0 55,4 16,3 17,1 34,7 26,7 26,7 26,7 157,2 ПРИКЛАД 3: ВИДІЛЕННЯ СПОЛУК 2, 3, 4, 5, 6 І7 Другу групу зразків Lithoplocamia lithistoides (7,66 кг) розтирають і ретельно екстрагують сумішшю МеОН:дихлорметан (1:1, 14 л, 2×5 л, 4 л). Розчинник видаляють у вакуумі, і водний розчин, що залишився, екстрагують ЕtOАс (12 л, 3×8 л). Органічний шар випарюють з одержанням неочищеного залишку 21,71 г. Цей матеріал піддають хроматографії на колонці RP-18 зі ступінчастим градієнтом від Н2О:МеОН (4:6) до МеОН. Фракції, елюйовані Н2О:МеОН (2:8, 430 мг), об'єднують і піддають препаративній ВЕРХ (Atlantis dC18, OBD, 5 мкм, 19×150 мм, ізократичне Н2О:МеОН (39:61), потік: 20 мл/хв., УФ визначення) з одержанням чистих сполук 1 (160,8 мг), 2 (13,2 мг) і 7 (1,8 мг), і сумішей 3 і 4 (11,4мг) і 5 і 6 (10,0 мг). Чисті сполуки 3 (5,1 мг) і 4 (2,6 мг) одержують після кінцевого очищення суміші напівпрепаративною ВЕРХ (X-Terra Prep RP-18, 10 мкм, 10×150 мм, градієнт Н2О:МеОН для від 50 до 70% МеОН за 70 хв., потік: 2,5 мл/хв., УФ визначення). Сполуки 5 (3,6 мг) і 6 (1,0 мг) розділяють із застосуванням того ж ме тоду напівпрепаративної ВЕРХ (X-Terra Prep RP18, 10 мкм, 10×150 мм, ізократичне Н2О:МеОН (45:55), потік: 2,5 мл/хв., УФ визначення). Сполука 2: аморфна біла тверда речовина. + + 1 МС (ЕР) m/z 606,3 [М+Н] , 628,3 [M+Na] ; H (500 13 МГц) і С ЯМР (125 МГц) див. таблицю 2. Сполука 3: аморфна біла тверда речовина. + (+)HRESIMS m/z 628,2774 [M+Na] (Розрах. для 35 1 13 C31H44 ClN3O7Na 628,2760); Н (500 МГц) і С ЯМР (125 МГц) див. таблицю 3. Сполука 4: аморфна біла тверда речовина. + (+)HRESIMS m/z 594,3152 [M+Na] (Розрах. для 1 13 C31H45N3O7Na 594,3150); Н (500 МГц) і С ЯМР (125 МГц) див. таблицю 4. Сполука 5: аморфна біла тверда речовина. + + 1 МС (ЕР) m/z 592,3 [М+Н] , 614,3 [M+Na] ; H (500 13 МГц) і С ЯМР (125 МГц) див. таблицю 5. Сполука 6: аморфна біла тверда речовина. + + 1 МС (ЕР) m/z 592,3 [М+Н] , 614,3 [M+Na] ; Н (500 13 МГц) і С ЯМР (125 МГц) див. таблицю 6. Сполука 7: аморфна біла тверда речовина. + (+)HRESIMS m/z 427,2207 [M+Na] (Розрах. для 1 13 C22H32N2O5Na 427,2203); Н (500 МГц) і С ЯМР (125 МГц) див. таблицю 7. 33 97369 34 Таблиця 2 1 Дані H і № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 1 13 С ЯМР для сполуки 2 (CDCI3) 13 Н (Мультиплетність, J) С 161,5 145,2 108,1 26,6 81,6 37,4 136,5 135,6 145,0 124,2 142,5 119,0 166,5 60,7 168,3 5,61 (дд, 6,4, 3,1) 2,41 (ддд, 17,1, 11,3, 3,0) 2,34 м 4,18 (ддд, 11,3, 7,8, 4,3) 2,88 (ддкв, 10,0, 7,8, 6,7) 5,46 (ушир.д, 10,0) 6,41 (д, 15,5) 7,60 (дд, 15,5, 11,4) 6,49 (дд, 11,4, 11,3) 5,63 (д, 11,3) 6,39 (д, 9,4) 4,44 (д, 9,4) 8,50(ушир.д, 10,8) № 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 1 Н (Мультиплетність, J) 6,83 (ддд, 10,8, 8,9, 1,2) 4,80 (м) 2,43 (м) 2,12 (м) 4,50 (м) 2,36 (м), 2Н 5,61 (ушир.т, 6,5) 2,07 (д, 1,0), 3Н 3,65 (с), 3Н 1,16 (д, 6,7), 3Н 1,86 (д, 1,0), 3Н 1,05 (с), 3Н 1,05 (с), 3Н 1,05 (с), 3Н 13 С 124,4 105,5 30,6 74,9 33,2 122,2 132,1 21,0 55,4 16,5 13,1 34,6 26,6 26,6 26,6 157,0 Таблиця 3 1 Дані H і № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 1 Н (Мультиплетність, J) 5,61 (дд, 6,3, 3,0) 2,39 (м) 2,37 (м) 4,21 (ддд, 10,9,7,6,4,7) 2,90 (ддкв., 10,0, 7,6, 6,6) 5,46 (ушир.д, 10,0) 6,51 (д, 15,3) 6,27 (дд, 15,3, 11,1) 7,25 (дд, 14,8, 11,1) 5,96 (д, 14,8) 6,39 (д, 9,3) 4,43 (д, 9,3) 8,82 (д, 10,7) 13 С ЯМР для сполуки 3 (CDCI3) 13 С 161,5 145,3 108,1 26,3 81,7 37,4 136,4 135,1 144,1 125,2 141,9 122,9 166,0 60,8 168,3 № 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 1 Н (Мультиплетність, J) 6,83 (ушир.дд, 10,7, 9,6) 4,81 (м) 2,47 (м) 2,10 (м) 4,43 (м) 2,34 (м), 2Н 5,62 (ушир.т, 6,5) 2,07 (с), 3Н 3,65 (с), 3Н 1,15 (д, 6,6), 3Н 1,83 (д, 1,0), 3Н 1,03(с), 3Н 1,03 (с), 3Н 1,03 (с), 3Н 13 C 124,4 105,4 30,8 75,0 33,0 122,4 132,0 21,0 55,4 16,6 12,9 35,1 26,6 26,6 26,6 157,9 35 97369 36 Таблиця 4 1 Дані Н і № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 1 13 С ЯМР для сполуки 4 (CDCI3) 13 H (Мультиплетність, J) С 161,6 145,2 108,2 26,1 81,9 37,1 134,1 133,8 140,2 124,4 137,5 120,8 166,3 60,7 168,2 5,63 (дд, 6,6, 2,7) 2,44 (м) 2,39 (м) 4,25 (ддд, 11,3, 7,0, 4,0) 2,85 (ддкв., 9,9, 7,0, 6,7) 5,29 (д, 9,9) 6Д5 (д, 11,6) 7,31 (дд, 11,6, 11,6) 6,90 (дд, 11,6, 11,6) 5,72(ушир.д, 11,6) 6,53 (д, 9,6) 4,44 (д, 9,6) 8,69 (д, 10,4) № 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 1 Н (Мультиплетність, J) 6,82 (ддд, 10,4, 9,1, 0,9) 4,82 (м) 2,46 (м) 2,12 (ддд, 14,1, 8,0, 8,0) 4,45 (м) 2,35 (м), 2Н 5,40 (м) 5,60 (м) 1,63 (дд, 6,8, 1,0), 3Н 3,66 (с), 3Н 1,15 (д, 6,7), 3Н 1,82 (с), 3Н 1,04 (с), 3Н 1,04 (с), 3Н 1,04(с), 3Н 13 С 124,2 105,8 30,9 75,6 31,4 124,9 127,1 13,0 55,4 16,4 17,1 34,8 26,7 26,7 26,7 157,6 Таблиця 5 1 Дані H і № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 1 13 С ЯМР для сполуки 5 (CDCI3) Η (Мультиплетність, J) 5,64 (дд, 6,6, 2,6) 2,48 (ддд, 17,4, 12,0, 2,6) 2,37 (ддд, 17,4,6,6,3,9) 4,28 (ддд, 12,0,6,6,3,9) 2,85 (ддкв., 9,7, 6,6, 6,7) 5,31 (д, 9,7) 6,17 (д, 11,5) 7,31 (дд, 11,5, 11,5) 6,93 (дд, 11,5, 11,5) 5,73 (д, 11,5) 6,54 (д, 9,2) 4,46 (дд, 9,2, 6,4) 13 1 13 C 161,7 145,1 108,3 26,0 № 17 18 19 20 Н (Мультиплетність, J) 8,69 (д, 10,7) 6,84 (ддд, 10,7,9,8,0,9) 4,80 (м) 2,45 (м) 2,10 (ддд, 15,0, 7,1,6,2) С 124,5 105,2 30,7 81,9 37,0 134,1 133,6 140,3 124,5 137,6 120,5 166,5 58,5 169,1 21 22 23 24 25 26 27 28 29 30 31 32 4,44 (м) 2,33 (м), 2Н 5,60 (ушир.т, 7,1) 2,06 (с), 3Н 3,66 (с), 3Н 1,15 (д, 6,7), 3Н 1,82(ушир.с), 3Н 2,22 (м) 1,00 (д, 6,8), 3Н 0,96 (д, 6,8), 3Н 74,8 33,0 122,4 132,0 21,0 55,4 16,2 17,1 31,1 19,3 18,0 157,4 37 97369 38 Таблиця 6 1 Дані H і № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 13 1 С ЯМР для сполуки 6 (CDCI3) 13 Η (Мультиплетність, J) 5,61 (дд, 6,8, 2,8) 2,41 (м), 2Н 4,18 (ддд, 11,6, 7,7, 4,2) 2,88 (ддкв., 10,0, 7,7, 6,6) 5,47 (ушир.д, 10,0) 6,41 (д, 15,4) 7,61 (дд, 15,4, 11,3) 6,49 (дд, 11,3, 11,3) 5,63 (д, 11,3) 6,34 (д, 8,9) 4,42 (дд, 8,9, 7,1) С 161,5 145,2 108,2 26,6 81,6 37,4 136,5 135,5 145,0 124,2 142,5 118,9 166,6 58,6 169,0 № 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 1 Η (Мультиплетність, J) 8,59 (д, 10,8) 6,84 (ушир.дд, 10,8, 8,7) 4,81 (м) 2,42 (м) 2,13 (ддд, 14,1, 7,5, 7,2) 4,49 (м) 2,35 (м), 2Н 5,61 (м) 2,07 (с), 3Н 3,65 (с), 3Н 1,15 (д, 6,6), 3Н 1,86 (с), 3Н 2,20 (м) 1,01 (д, 6,7), 3Н 0,98 (д, 6,8), 3Н 13 C 124,5 105,5 30,6 74,7 33,1 122,3 132,1 21,0 55,4 16,5 13,1 30,9 19,3 18,2 157,0 Таблиця 7 1 Дані Н і № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 1 13 С ЯМP для сполуки 7 (CDCI3) Η (Мультиплетність, J) 5,62 (дд, 6,1, 3,2) 2,43 (м) 2,38 (м) 4,21 (ддд, 12,0, 7,0, 4,8) 2,86 (ддкв., 9,9, 7,0, 6,6) 5,29 (д, 9,9) 6,17 (д, 11,6) 7,26 (дд, 11,6, 11,5) 6,90 (дд, 11,5, 11,5) 5,67 (д, 11,5) 6,22 (д, 9,2) 4,34 (д, 9,2) 3,66 (с), 3Н 1,17 (д, 6,6), 3Н 1,85 (с), 3Н 1,05(с), 3Н 1,05 (с), 3Н 1,05(с), 3Н 13 C 161,5 145,3 108,1 26,3 81,8 37,4 134,2 134,1 140,2 124,1 137,4 120,8 166,2 59,8 172,5 55,4 16,7 17,2 34,5 26,6 26,6 26,6 39 97369 ПРИКЛАД 4: ВИДІЛЕННЯ СПОЛУКИ 8 Фракцію, що містить сполуку 1 (61,6 мг), одержану методом екстрагування, описаним у прикладі 3, далі очищають напівпрепаративною ВЕРХ (Symmetryprep С-18, 7 мкм, 7,8×150 мм, ізократичне H2O:CH3CN (55:45), потік: 2,3 мл/хв., УФ визна 40 чення) і 0,9 мг сполуки 8 одержують в очищеній формі. Сполука 8: аморфна біла тверда речовина. + + 1 МС (ЕР) m/z 606,2 [М+Н] , 628,3 [M+Na] ; H (500 13 МГц) і С ЯМР (125 МГц) див. таблицю 8. Таблиця 8 1 Дані Н і № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 1 Η (Мультиплетність, J) 5,66 (ушир.т, 4,6) 2,45 (м), 2Н 4,21 (ддд, 7,7, 7,7, 7,7) 2,85 (ддкв., 10,0, 7,7, 6,7) 5,35 (д, 10,0) 6,16 (д, 11,7) 6,06 (дд, 11,7, 11,7) 7,71 (дд, 14,7, 11,7) 5,95 (д, 14,7) 6,35 (д, 9,5) 4,47 (д, 9,5) 8,65 (д, 10,8) 13 С ЯМР для сполуки 8 (CDCI3) 13 C 161,6 145,2 108,4 26,6 81,7 37,4 135,1 134,6 140,6 125,6 137,9 124,5 166,0 61,0 168,3 № 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 1 Н (Мультиплетність, J) 6,83 (ддд, 10,8, 8,7, 1,0) 4,80 (м) 2,11 (ддд, 14,2, 8,1, 7,8) 2,45 (м) 4,46 (м) 2,34 (т, 6,7), 2Н 5,60 (тд, 7,8, 1,2) 2,06 (с), 3Н 3,66 (с), 3Н 1,17 (д,6,7), 3Н 1,91 (д, 0,7), 3Н 1,04 (с), 3Н 1,04 (с), 3Н 1,04(с), 3Н 13 C 124,4 105,2 30,7 75,0 33,0 122,3 132,0 21,0 55,4 16,6 17,0 34,8 26,6 26,6 26,6 157,1 ПРИКЛАД 5: СИНТЕЗ ФРАГМЕНТА А На схемі 2 представлено декілька прикладів синтезу фрагмента А відповідно до номенклатури, представленої на схемі 1. 41 Синтез проміжної сполуки 9 До розчину, що має температуру 0°С, (2S,3S)3,5-біс{[(трет-бутил)диметилсиліл]окси}-4метилпентан-1-олу (P. Phukan, S. Sasmal and Μ. Ε. Maier Eur, J. Org. Chem. 2003, 1733-1740) (50 г, 0,14 моль) у суміші дихлорметан/ДМСО (331 мл/149 мл), Et3N (96,1 мл, 0,69 моль) додають через додавальну лійку. Через 10 хв. SO3Pyr (54,8 г, 0,34 моль) додають порціями, і розчин перемішують протягом ще 2 год. при температурі 0°С. Потім його розбавляють дихлорметаном (800 мл) і гасять НСI (0,5N, 800 мл). Органічний шар декантують, сушать над MgSO4 і концентрують у вакуумі. Очищення хроматографією на колонці (гексан/ЕtOАс 100:0 до 10:1) дає 45 г (вихід: 90%) альдегіду 9. 1 H-ЯМР (CDCI3, 300 МГц) δ: 9,79 (с, 1H), 4,30 (м, 1H), 3,65 (м, 2Н), 2,51 (м, 1Н), 1,69 (м, 2Н), 1,04 (д, 3Н, J=6,9 Гц), 0,85-0,88 (м, 18Н), 0,03-0,07 (м, 12Н). 13 С-ЯМР (CDCI3, 75 МГц) δ: 205,4, 69,4, 59,6, 51,7, 37,5, 26,1, 26,0, 18,4, 18,2, 8,0, -4,3, -4,5, -5,2. Синтез проміжної сполуки 10 У розчин альдегіду 9 (45 г, 0,12 моль) у толуолі (625 мл) додають карбоетоксіетилідентрифенілфосфоран (113 г, 0,31 моль) і суміш нагрівають при температурі 60°С протягом більше 17 год. Потім розчинник видаляють при зниженому тиску, масло, що залишилося, очищають хроматографією на колонці (гексан/ЕtOАс 100:0 до 10:1) з одержанням 53,3 г (вихід: 96%) складної ефірної 1 сполуки 10. H-ЯМР (CDCI3, 300 МГц) δ: 6,71 (дд, 1H, J=1,5, 10,2 Гц), 4,19 (м, 2Н), 3,77 (м, 1H), 3,66 (м, 2Н), 2,61 (м, 1H), 1,85 (д, 3Н, J=1,5 Гц), 1,68 (м, 2Н), 1,30 (т, 3Н, J=7,2 Гц), 0,98 (д, 3Н, 6,9 Гц), 0,90 (м, 18Н), 0,05 (м, 12Н). 97369 42 13 С-ЯМР (CDCI3, 75 МГц) δ: 168,3, 145,4, 126,7, 72,2, 60,4, 59,7, 38,4, 38,0, 25,9, 18,2, 18,1, 14,3, 14,3, 12,6, -4,4, -4,6, -5,4. Синтез проміжної сполуки 11 До охолодженого до температури -78°С розчину складного ефіру 10 (46,7 г, 0,105 моль) у безводному ТГФ (525 мл) в атмосфері аргону додають гідрид діізобутилалюмінію (DIBAL) 1М у толуолі (23 мл, 0,231 моль) протягом 10 хвилин, і суміш перемішують при температурі -78°С. Через 4 години реакцію гасять МеОН (10 мл) і додають насичений розчин виннокислого калію-натрію (800 мл) і розбавляють ЕtOАс (1000 мл). Цю суміш перемішують протягом 2 год., і потім органічний шар декантують. Водний залишок екстрагують додатковим ЕtOАс (2×400 мл) і об'єднані органічні шари сушать (Na2SO4) і розчинник випарюють. Одержане масло очищають хроматографією на колонці (гексан/ЕtOАс 20:1 до 10:1) з одержанням 32,5 г (вихід: 77%) спирту 11. 1 Н-ЯМР (CDCI3, 300 МГц) δ: 5,31 (д, 1H, J=9,6 Гц), 3,98 (м, 2Н), 3,66 (м, 3Н), 2,49 (м, 1H), 1,67 (с, 3Н), 1,70-1,62 (м, 2Н), 0,91 (д, 3Н, J=6,9 Гц), 0,88 (м, 18Н), 0,03 (м, 12Н). 13 С-ЯМР (CDCI3, 75 МГц) δ: 133,9, 129,8, 73,1, 69,1, 59,9, 37,8, 37,5, 25,9, 18,3, 18,1, 15,9, 13,9, 4,4, -4,4, -5,3. Синтез проміжної сполуки 12 До розчину спирту 11 (31,2 г, 77,5 ммоль) в етиловому ефірі (387 мл) в атмосфері аргону додають МnО2 (101 г, 1,16 моль) і суміш перемішують при кімнатній температурі протягом 2 годин. Цю суміш фільтрують через колонку з силікагелем, елююючи ЕtOАс (3 л) і одержаний розчин сушать при зниженому тиску з одержанням 29,1 г (вихід: 94%) альдегіду 12. 43 97369 44 1 Н-ЯМР (CDCI3. 300 МГц) δ: 9,37 (с, 1H), 6,44 (д, 1Н, J=9,6 Гц), 3,82 (дд, 1H, J=6,3, 10,8 Гц), 3,65 (м, 2Н), 2,82 (м, 1H), 1,74 (с, 3Н), 1,67 (м, 2Н), 1,02 (д, 3Н, J=6,9 Гц), 0,86 (с, 18Н), 0,04-0,01 (м, 12Н). 13 С-ЯМР (CDCI3, 75 МГц) δ: 195,4, 157,8, 138,3, 134,5, 72,0, 59,5, 36,7, 37,5, 25,8, 18,2, 18,1, 14,3, 9,4, -4,4, -4,5, -5,4. Синтез проміжної сполуки 13 До суспензії йодиду йодметилтрифенілфосфонію (Gilbert Stork, KZ. Tetrahedron letters 1989, 30(17), 2173) (96,3 г, 181,7 ммоль) у ТГФ (727 мл) при температурі 0°С, повільно додають 1М розчин гексаметилдисилазану натрію (NaHMDS) (181,7 мл, 181,7 ммоль) через додавальну лійку протягом 10 хвилин. Після перемішування протягом ще 5 хв. розчин охолоджують до температури -78°С і потім додають 1,3-диметил-3,4,5,6-тетрагідро-2(1Н)піримідинон (DMPU) (43,9 мл, 363,4 ммоль) через канюлю, з подальшим додаванням альдегіду 12 (29,1 г, 72,7 ммоль), розчиненого у ТГФ (727 мл). Температуру підтримують на рівні -78°С при одночасному перемішуванні реакційної суміші протягом 2 годин. Додають гексан (1 л), і одержану суспензію фільтрують через целіт і промивають додатковим гексаном (3 л). Фільтрат випарюють при зниженому тиску і одержане масло очищають хроматографією на колонці (гексан/ЕtOАс 100:0 до 20:1) з одержанням 32 г (вихід: 84%) йодиду 13. 1 H-ЯМР (CDCI3, 300 МГц) δ: 6,73 (д, 1Н, J=8,4 Гц), 6,09 (дд, 1H, J=8,4, 1,2 Гц), 5,57 (дд, 1Н, J=9,6, 1,2 Гц), 3,63-3,71 (м, 3Н), 2,58 (м, 1Н), 1,90 (с, 3Н), 1,70 (м, 2Н), 0,96 (дд, 3Н, J=6,6, 1,2 Гц), 0,88 (с, 18Н), 0,04 (м, 12Н). 13 С-ЯМР (CDCI3, 75 МГц) δ: 142,3, 138,1, 131,8, 74,6, 72,9, 59,8, 38,1, 37,9, 26,0, 18,3, 18,2, 15,7, 15,7, -4,4, -5,2, -5,2. Синтез проміжної сполуки 14 До розчину йодиду 13 (12 г, 22,9 ммоль) у ЕtOН (114 мл) додають п-толуолсульфонат піридинію (PPTS) (2,01 г, 8,0 ммоль) і реакційну суміш перемішують при кімнатній температурі протягом 25 годин. Потім розчинник видаляють при зниженому тиску і одержане масло очищають хроматографією на колонці (гексан/ЕtOАс 10:1) з одержанням 8,7 г (вихід: 93%) спирту 14. 1 Н-ЯМР (CDCI3, 300 МГц) δ: 6,69 (д, 1H, J=8,4 Гц), 6,12 (д, 1H, J=8,4 Гц), 5,47 (д, 1H, J=9,9 Гц), 3,67-3,87 (м, 4Н), 2,71 (м, 1Н), 1,89 (с, 3Н), 1,731,86 (м, 2Н), 1,01 (д, 3Н, J=6,9 Гц), 0,91 (с, 9Н), 0,087-0,115 (м, 6Н). 13 С-ЯМР (CDCI3, 75 МГц) δ: 142,4, 136,4, 132,6, 75,8, 75,2, 60,0, 38,1, 36,4, 26,1, 18,2, 17,1, 16,0, 4,1, -4,2. Синтез проміжної сполуки 15 До розчину, що має температуру 0°С, спирту 14 (8,7 г, 21,2 ммоль) у суміші дихлорметан/ДМСО (50,9 мл/22,9 мл), додають Et3N (14,8 мл, 106 ммоль) через лійку. Через 10 хвилин SO3Pyr (8,43 г, 53,0 моль) додають порціями, і розчин перемішують протягом ще 2 год. при 0°С. Потім його розбавляють дихлорметаном (800 мл) і гасять НСI (0,5N, 50 мл). Органічний шар декантують, сушать над MgSO4 і концентрують у вакуумі. Очищення хроматографією на колонці (гексан/ЕtOАс 10:1) дає 6,9 г (вихід: 80%) альдегіду 15. 1 H-ЯМР (CDCI3, 300 МГц) δ: 9,89 (т, 1Η, J=1,5 Гц), 6,67 (д, 1H, J=8,4 Гц), 6,13 (д, 1H, J=8,4 Гц), 5,43 (д, 1H, J=10,2 Гц), 3,98 (м, 1Н), 2,59-2,69 (м, 3Н), 1,85 (с, 3Н), 1,01 (д, 3Н, J=6,6 Гц), 0,86 (с, 9Н), 0,06 (с, 3Н), 0,03 (с, 3Н). 13 С-ЯМР (CDCI3, 75 МГц) δ: 201,8, 141,9, 135,2, 133,3, 76,3, 71,9, 49,3, 39,3, 25,8, 18,0, 16,7, 15,9, 4,4, -4,5. Синтез проміжної сполуки 16а До розчину діетил(метокси[метоксикарбоніл]метил)фосфонату (5,51 г, 14,45 ммоль) і 18-краун-6 (11,5 г, 43,34 ммоль) у сухому ТГФ (390 мл), що перемішується в атмосфері аргону при температурі -78°С, по краплях додають 0,5 Μ розчин біс(триметилсиліл)аміду калію (KHMDS) (43,34 мл, 21,67 ммоль). Через 15 хв. по краплях додають альдегід 15 (5,9 г, 14,45 ммоль) у сухому ТГФ протягом 30 хв. і перемішують при -78°С протягом 90 хв. Потім реакцію гасять насиченим розчином NH4CI (200 мл), нагрівають до кімнатної температури і розбавляють дихлорметаном (1000 мл). Органічну фазу сушать (Na2SO4) і випарюють при зниженому тиску. Очищення хроматографією на колонці (гексан/Еt2О 20:1) дає чисті 4,2 г (59%) (Е)16а. 1 Н-ЯМР (CDCI3, 300 МГц) δ: 6,70 (д, 1Н, J=8,4 Гц), 6,08 (д, 1Н, J=8,4 Гц), 5,47 (д, 1Н, J=9,9 Гц), 5,37 (т, 1H, J=7,2 Гц), 3,78 (с, 3Н), 3,60 (с, 3Н), 3,60 (м, 1H), 2,79 (м, 1Н), 2,52-2,67 (м, 2Н), 1,83 (с, 3Н), 0,99 (д, 3Н, J=6,6 Гц), 0,89 (с, 9Н), 0,05 (с, 3Н), 0,04 (с, 3Н). 13 С-ЯМР (CDCI3, 75 МГц) δ: 163,7, 145,9, 142,1, 137,3, 132,1, 110,4, 75,4, 74,8, 55,4, 51,9, 38,1, 32,3, 25,9, 18,1, 16,5, 15,7, -4,3, -4,5. Синтез проміжної сполуки 16b До розчину етил[біс(2,2,2трифторетокси)фосфініл]ацетату (0,16 мл, 0,66ммоль) і 18-краун-6 (350 мг, 1,32 ммоль) у сухому ТГФ (2,4 мл), що перемішується в атмосфері 45 аргону при 0°С по краплях додають KHMDS (1,23 мл, 0,62 ммоль). Через 30 хв. по краплях додають альдегід 15 (180 мг, 0,44 ммоль) у сухому ТГФ і перемішують при -78°С протягом 60 хв. Потім реакцію гасять насиченим розчином NH4Cl, нагрівають до кімнатної температури і розбавляють ЕtOАс. Органічну фазу сушать (Na2SO4) і випарюють при зниженому тиску. Очищення хроматографією на колонці (гексан/ЕtOАс 100:1 до 15:1) дає 172 мг (вихід: 82%) (Z)-16b. 1 Н-ЯМР (CDCI3, 300 МГц) δ: 6,70 (д, 1H, J=8,7 Гц), 6,44-6,36 (м, 1Н), 6,09 (д, 1H, J=8,7 Гц), 5,865,81 (м, 1H), 5,47 (д, 1H, J=9,9 Гц), 4,14 (кв, 2Н, J=7,2 Гц), 3,69-3,64 (м, 1H), 3,06-3,00 (м, 1 Η), 2,852,75 (м, 1H), 2,59-2,51 (м, 1Н), 1,84 (с, 3Н), 1,28 (т, 3Н, J=7,2 Гц), 1,00 (д, 3Н, J=6,6 Гц), 0,89 (с, 9Н), 0,06 (с, 3Н), 0,05 (с, 3Н). + МС (ЕР) m/z 501,0 [M+Na] Синтез проміжної сполуки 17а До розчину складного ефіру 16а (4,15 г, 8,39 ммоль) у МеОН (125 мл) при кімнатній температурі додають НСI 37% (1,04 мл) і реакційну суміш перемішують протягом 6 годин. Потім суміш нейтралізують насиченим розчином NaHCO3 (pH 7-8) і органічний розчинник випарюють при зниженому тиску. Одержану суспензію екстрагують дихлорметаном (3×200 мл), сушать і випарюють. Фільтрація хроматографією на колонці (гексан/ЕtOАс 10:1 до 2:1) дає 2,76 г (вихід: 94%) лактону 17а. 97369 46 1 Н-ЯМР (500 МГц, CDCI3) δ: 6,68 (д, 1H, J=9,0 Гц), 6,20 (д, 1Н, J=8,5 Гц), 5,63 (дд, 1Н, J=2,5, 6,5 Гц), 5,43 (д, 1Н, J=10,0 Гц), 4,19 (м, 1H), 3,65 (с, 3Н), 2,84 (м, 1H), 2,55 (м, 1H), 2,43 (дк, J=1H, 3,0, 12,0, 15,0, 18,0 Гц), 1,87 (с, 3Н), 1,16 (д, 3Н, J=6,5 Гц). 13 С-ЯМР (125 МГц, CDCI3) δ: 161,6, 145,2, 141,8, 134,4, 132,7, 108,3, 81,7, 77,4, 55,4, 37,1, 26,6, 16,5, 16,1. Синтез проміжної сполуки 17b До розчину складного ефіру 16b (172 мг, 0,36 ммоль) у МеОН (4,5 мл) при кімнатній температурі додають НСI 37% (0,03 мл) і реакційну суміш перемішують протягом 3 годин. Потім суміш нейтралізують насиченим розчином NaHCO3 (pH 7-8) і органічний розчинник випарюють при зниженому тиску. Одержану суспензію екстрагують дихлорметаном, сушать і випарюють. Очищення хроматографією на колонці (гексан/ЕtOАс 10:1 до 5:1) дає 70 мг (вихід: 61%) лактону 17b. 1 H-ЯМР (CDCI3, 300 МГц) δ: 6,91-6,85 (м, 1H), 6,68 (д, 1H, J=8,4 Гц), 6,62 (д, 1H, J=8,4 Гц), 6,02 (дд, 1H, J=2,7, 9,6 Гц), 5,45 (д, 1Н, J=9,9 Гц), 4,19 (м, 1H), 3,65 (с, 3Н), 4,26-4,18 (м, 1H), 2,92-2,79 (м, 1H), 2,57-2,48 (м, 1H), 2,39-2,28 (м, 1H), 1,88 (с, 3Н), 1,17(д, 3Н, J=6,6Гц). ПРИКЛАД 6: СИНТЕЗ ФРАГМЕНТА D На схемі 3 представлено декілька прикладів синтезу фрагмента D відповідно до номенклатури, наведеної на схемі 1. 47 97369 48 Синтез проміжної сполуки 19 До розчину проміжної сполуки 18 (72,3 г) у дихлорметані (ДХМ) (918 мл) при кімнатній температурі порціями додають 3-хлорпербензойну кислоту (m-СРВА) (100 г, 0,58 моль), і суміш перемішують при кімнатній температурі протягом 18 год. Білий осад гасять насиченим розчином NaHCO3, екстрагують ДХМ (3×250 мл) і знову промивають насиченим водним розчином NaHCO3 (3×250 мл). Органічні шари об'єднують, сушать над Na2SO4 і концентрують у вакуумі. Одержане масло очищають на силікагелі (гексан-AcOEt; 15:1) з одержанням епоксиду у вигляді безбарвного масла (64,5 г, 82%). До розчину рацемічного епоксиду (30 г) у безводному ТГФ (7,5 мл) додають комплекс (R,R)Co(ll) (448 мг, 0,74 ммоль), потім АсОН (0,14 мл). Розчин охолоджують до 0°С і по краплях додають воду (1,2 мл). Реакційну суміш нагрівають до кімнатної температури і перемішують протягом 18 год. Після цього леткі речовини концентрують у вакуумі і неочищений залишок завантажують безпосередньо у колонку з силікагелем. Флешхроматографія із застосуванням гексану/ЕtOАс (15:1 до 12:1) як елюенту дає хіральний епоксид (+)-19 (13,6 г, вихід: 46%) у вигляді безбарвного масла. [α]D=+14,1 (c=1, CHCl3). 1 H ЯМР (CDCI3, 300 МГц) δ: 3,74 (т, 2Η, J=6,3 Гц), 3,01 (м, 1H), 2,74 (т, 1H, J=4,6 Гц), 2,48 (дд, 1H, J=5,1, 3,1 Гц). 1,70 (м, 2Н), 0,87 (с, 9Н), 0,04 (с, 6Н). 13 С ЯМР (CDCI3, 75 МГц) δ: 60,2, 50,2, 47,3, 36,1, 26,1, 18,4, -5,2. Синтез проміжної сполуки 20 Пропін конденсують при температурі -78°С і розчиняють у безводному ТГФ (165 мл). По краплях додають н-бутиллітій в атмосфері Аr протягом більше 30 хв., і одержану білу суспензію перемішують протягом додаткових 30 хв. при температурі -78°С. Потім по краплях додають розчин (+) (R)2-[2-(тpeт-бутилдиметилсилілокси)етил]оксирану 19 (23,7 г) у безводному ТГФ (125 мл) з подальшим додаванням BF3OEt2. Суміш перемішують протягом 1 год. при -78°С і протягом ще однієї години при 0°С. Реакцію гасять насиченим водним розчином NH4Cl (150 мл) і екстрагують Et2O (3×150 мл). Об'єднані органічні шари сушать над NaSO4, фільтрують і концентрують. Флеш-хроматографія (гексан/ЕtOАс 10:1 до 1:1) дає 22,7 г (вихід: 80%) спирту 20 у вигляді безбарвного масла. [α]D=+5,6 (c=0,1, CHCl3). 1 H-ЯМР (500 МГц, CDCI3) δ: 3,75-3,90 (м, 3Н), 3,47 (д, 1H, J=2,7 Гц, ОН), 2,34 (м, 2Н), 1,79 (т, 3Η, J=2,4 Гц), 1,75 (м, 2Η), 0,89 (с, 9Н), 0,07 (с, 6Н). 13 С-ЯМР (125 МГц, CDCI3) δ: 77,8, 75,8, 70,7, 62,4, 37,6, 27,6, 26,1, 18,3, 3,7, -5,3, -5,4. + + МС (ЕР) m/z 243,2 [М+Н] , 265,2 [M+Na] Синтез проміжної сполуки 21а Розчин проміжної сполуки 20 (22,7 г) і пметоксибензилтрихлорацетімідату (РМВТСА) у ДХМ обробляють Sc(OTf)3. Суміш перемішують при кімнатній температурі протягом 2 год. (Перевірка ТШХ) і реакцію концентрують у вакуумі і очищають хроматографією на колонці (гексан/ЕtOАс 50:1 до 15:1) з одержанням сполуки 21а у вигляді жовтого масла (18,3 г; вихід: 55%). 1 Н ЯМР (CDCI3, 300 МГц) δ: 7,25 (д, 2Н, J=8,7 Гц), 6,90 (д, 2Н, J=8,7 Гц), 4,45 (м, 2Н), 3,80 (с, 3Н), 3,65 (м, 3Н), 2,40 (м, 2Н), 1,82 (м, 2Н), 1,79 (т, 3Η, J=2,4 Гц), 0,92 (с, 9Н), 0,05 (с, 6Н). Синтез проміжної сполуки 21b Розчин спирту 20 (2,88 г, 11,9 ммоль), третбутилдифенілсилілхлориду (4,39 мл, 16,89 ммоль) і 4-(диметиламіно)піридину (43,6 мг) в Ν,Νдиметилформаміді (ДМФ) (14 мл) перемішують протягом ночі при кімнатній температурі. Суміш розбавляють водою і екстрагують Еt2О, і органічну фазу промивають насиченим розчином солі, сушать над Na2SO4, фільтрують і концентрують. Флеш-хроматографія (Гексан/ЕtOАс, 95:1) дає силіловий ефір 21b (5,3 г, вихід: 93%) у вигляді безбарвної рідини. 1 Н ЯМР (CDCI3, 300 МГц) δ: 7,70-7,66 (м, 4Н), 7,40-7,34 (м, 6Н), 3,99-3,95 (м, 1H), 3,70-3,62 (м, 2Н), 2,23-2,22 (м, 2Н), 1,84-1,81 (м, 2Н), 1,69 (т, 3Н, J=2,7 Гц), 1,05 (с, 9Н), 0,84 (с, 9Н), 0,01 (с, 6Н). 13 С-ЯМР (CDCI3, 75 МГц) δ: 136,1; 134,6; 129,7; 127,8; 77,8; 76,2; 69,9; 60,1; 39,6; 27,5; 27,2; 26,2; 19,6; 18,5; 3,7; -5,1. Синтез проміжної сполуки 22а До розчину сполуки 21а у безводному толуолі в атмосфері Аr і при температурі 0°С додають реагент Шварца гідрид хлориду (біс(циклопентадієніл)цирконію(ІV), Cp2ZrHCl) і реакційну суміш перемішують протягом 5 хв. при кімнатній температурі. Температуру реакції підвищують до 50°С протягом 20 хв. і перемішують при 50°С протягом 2,30 год. Протягом цього часу реакційний розчин стає помаранчевим. Реакцію охолоджують до 0°С і додають N-хлорсукцинімід однією порцією. Перемішування продовжують протягом 30 хв. при кімнатній температурі, і реакційну суміш розбавляють гексаном/EtOAc (95:5; 500 мл). Видалення твердої речовини фільтрацією і випарювання летких речовин дає сполуку 22а у вигляді жовтого масла, яке застосовують без подальшого очищення (15,1 г; вихід: 86%). [α]D=+20,5 (c=1 ,CHCl3). 1 Н ЯМР (CDCI3, 300 МГц) δ: 7,25 (д, 2Н, J=8,7 Гц), 6,87 (д, 2Н, J=8,7 Гц), 5,64 (тд, 1Н, J=7,8, 0,9 Гц), 4,45 (кв, 2Н, J=11,1 Гц), 3,80 (с, 3Н), 3,70 (м, 49 2Н), 3,62 (м, 1H), 2,27 (т, 2Н, J=6,9 Гц), 2,03 (с, 3Н), 1,70 (м, 2Н), 0,89 (с, 9Н), 0,05 (с, 6Н). 13 С ЯМР (75 МГц, CDCI3) δ: 159,4, 130,9, 130,7, 129,6, 124,2, 114,0, 75,2, 71,4, 59,8, 55,5, 37,7, 33,8, 26,1, 21,2, 18,5, -5,1. Синтез проміжної сполуки 22b Колбу, що містить суміш сполуки 21b (4,73 г, 9,85 ммоль), хінолін (0,582 мл, 4,92 ммоль) і каталізатор Ліндлара (2,18 г) в етилацетаті вакуумують і промивають Н2. Реакційну суміш перемішують при кімнатній температурі в атмосфері Н2 (1 атм.) протягом 2 год. і потім фільтрують через шар целіту. Шар промивають етилацетатом і об'єднані фільтрати промивають 0,1% НСI. Органічний шар сушать над Na2SO4, фільтрують і концентрують з одержанням проміжної сполуки 22b (4,27 г, вихід: 90%) у вигляді безбарвного масла, яке застосовують без подальшого очищення. 1 Н ЯМР (CDCI3, 300 МГц) δ: 7,70-7,67 (м, 4Н), 7,44-7,36 (м, 6Н), 5,48 (м, 1Н), 5,36-5,27 (м, 1H), 3,95-3,87 (м, 1H), 3,71-3,55 (м, 2Н), 2,16 (дд, 2Н, J=6,9, 6,3 Гц), 1,73-1,66 (м, 2Н), 1,41 (дд, 3Н, J=6,6, 1,2 Гц), 1,05 (с, 9Н), 0,84 (с, 9Н), -0,02 (с, 6Н). 13 С-ЯМР (CDCI3, 75 МГц) δ: 136,2; 134,8; 129,8; 127,8; 126,4; 125,8; 70,9; 60,4; 39,6; 34,8; 27,3; 26,2; 19,7; 18,5; 13,1; -5,1. Синтез проміжної сполуки 23а До розчину сполуки 22а (23 г) у безводному ТГФ в атмосфері Аr і при температурі 0°С по краплях додають фторид трибутиламонію (TBAF) протягом 20 хв. (розчин стає червоним). Реакційну суміш перемішують при кімнатній температурі протягом 2 год. і потім гасять насиченим водним розчином NH4Cl (200 мл). Об'єднані шари розділяють, і водну фазу ретельно екстрагують ЕtOАс (3×150 мл). Об'єднані органічні шари сушать над NaSO4, фільтрують і концентрують. Флеш-хроматографія (гексан/ЕtOАс 4:1 до 1:1) дає 23а у вигляді безбарвного масла (11,9 г; вихід: 73%). 1 H ЯМР (CDCI3, 300 МГц) δ: 7,25 (д, 2Н, J=8,7 Гц), 6,86 (д, 2Н, J=8,7 Гц), 5,62 (т, 1H, J=7,8 Гц), 4,45 (м, 2Н), 3,80 (с, 3Н), 3,70 (м, 3Н), 2,35 (м, 2Н), 2,03 (с, 3Н), 1,75 (м, 2Н). Синтез проміжної сполуки 23b PPTS (837,7 мг, 3,33 ммоль) додають однією порцією до розчину 22b (4 г, 8,33 ммоль) в етанолі (80 мл). Реакційну суміш перемішують при кімнатній температурі протягом 7 год. і потім концентрують. Залишок розбавляють у ДХМ і промивають насиченим розчином NaHCO3. Органічний шар екстрагують, сушать над Na2SO4, фільтрують і 97369 50 концентрують. Флеш-хроматографія (Гексан/ЕtOАс, 95:1) дає силіловий ефір 23b (2,12 г, вихід: 69%) у вигляді безбарвного масла. 1 Н ЯМР (CDCI3, 300 МГц) δ: 7,73-7,69 (м, 4Н), 7,44-7,36 (м, 6Н), 5,44-5,38 (м, 1H), 5,21-5,17 (м, 1H), 4,01-3,94 (м, 1H), 3,84-3,76 (м, 1Н), 3,69-3,64 (м, 1H), 2,32-2,14 (м, 2Н), 1,89-1,78 (м, 1Н), 1,701,60 (м, 1H), 1,37 (д, 3Н, J=6,9 Гц), 1,07 (с, 9Н). 13 С-ЯМР (CDCI3, 75 МГц) δ: 136,2; 134,1; 130,0; 127,8; 126,3; 125,9; 72,3; 60,1; 37,7; 34,3; 27,2; 19,5; 13,0. Синтез проміжної сполуки 24а (Діацетоксийод)бензол (ВАIB) (11,5 г, 35,7 ммоль) додають до розчину спирту 23а (9,2 г, 32,4 ммоль) і 1-оксилу 2,2,6,6-тетраметилпіперидину (TEMPO) (515 мг, 3,3 ммоль) у безводному дихлорметані (92 мл). Реакційну суміш перемішують при кімнатній температурі протягом 20 год. доти, доки не перестане визначатися спирт (ТШХ), і потім суміш гасять насиченим водним розчином NH4Cl і екстрагують ДХМ (3×100 мл). Об'єднані органічні фази сушать над Na2SO4, фільтрують і концентрують. Залишок очищають флеш-хроматографією (гексан/ЕtOАс 4:1 до 1:1) з одержанням сполуки 24а у вигляді безбарвного масла (6,3 г; вихід: 70%). 1 Н ЯМР (CDCI3, 300 МГц) δ: 9,78 (с, 1Н), 7,25 (д, 2Н, J=8,7 Гц), 6,85 (д, 2Н, J=8,7 Гц), 5,64 (т, 1H, J=7,8 Гц), 4,45 (кв, 2Н, J=11,1 Гц), 4,02 (м, 1H), 3,80 (с, 3Н), 2,60 (м, 2Н), 2,35 (м, 2Н), 2,03 (с, 3Н). 13 С ЯМР (CDCI3, 75 МГц) δ: 201, 159,6, 132,1, 130,1, 129,7, 122,8, 114,1, 73,3, 71,5, 55,5, 48,3, 33,5, 21,3. Синтез проміжної сполуки 24b ВАIB (1,97 г, 6,11 ммоль) додають до розчину спирту 23b (2,05 г, 5,56 ммоль) і TEMPO (86,87 мг, 0,56 ммоль) у 25 мл ДХМ. Реакційну суміш перемішують при кімнатній температурі протягом 16-18 год. доти, доки спирт не перестане визначатися (ТШХ), і потім гасять насиченим водним розчином NH4Cl, і екстрагують ДХМ. Об'єднані органічні фази сушать над Na2SO4, фільтрують і концентрують. Залишок очищають флеш-хроматографією (гексан/ДХМ 5:1 до 1:2) з одержанням сполуки 24b (1,733 мг, вихід: 79%) у вигляді безбарвного масла. 1 Н ЯМР (CDCI3, 300 МГц) δ: 9,72 (т, 1Η, J=2,7 Гц), 7,74-7,67 (м, 4Н), 7,48-7,37 (м, 6Н), 5,56-5,45 (м, 1Н), 5,32-5,23 (м, 1Н), 4,29-4,20 (м, 1H), 2,512,48 (м, 2Н), 2,31-2,27 (м, 2Н), 1,43 (дд, 3Н, J=6,9, 1,5 Гц), 1,06 (с, 9Н). 13 С-ЯМР (CDCI3, 75 МГц) δ: 202,3; 136,1; 134,0; 130,1; 127,9; 127,4; 125,1; 69,4; 50,1; 35,1; 27,2; 19,5; 13,1. 51 Синтез проміжної сполуки 25а До суспензії йодиду йодметилтрифенілфосфонію (16,6 г; 31 ммоль) у безводному ТГФ (126 мл) при кімнатній температурі повільно додають 1М розчин NaHMDS у ТГФ (31,27 мл). Після перемішування протягом 2 хв. жовту суміш охолоджують до -78°С і потім додають розчин 24а (6,3 г, 22 ммоль) у ТГФ (82 мл). Реакційну суміш перемішують при температурі -78°С протягом 2 год., і при кімнатній температурі протягом 5 хв., розбавляють гексаном і фільтрують через шар целіту. Шар промивають гексаном, і об'єднані фільтрати випарюють при зниженому тиску, і одержане масло очищають хроматографією на колонці (гексан/ЕtOАс 12:1 до 8:1) з одержанням 25а у вигляді жовтого масла (5,6 г; вихід: 62%) 1 H ЯМР (CDCI3, 300 МГц) δ: 7,25 (д, 2Н, J=8,7 Гц), 6,85 (д, 2Н, J=8,7 Гц), 6,25 (м, 2Н) 5,64 (т, 1Η, J=7,8 Гц), 4,42 (м, 2Η), 3,80 (с, 3Н), 3,55 (м, 1H), 2,40 (м, 2Н), 2,25 (м, 2Н), 2,03 (с, 3Н). Синтез проміжної сполуки 25b До суспензії йодметилтрифенілфосфорану (3,32 г, 6,38 ммоль) у ТГФ (60 мл) при кімнатній температурі повільно додають 6,83 мл 1М розчину NaHMDS (6,38 ммоль) у ТГФ. Після перемішування протягом 2 хв. жовту суміш охолоджують до температури -78°С, і потім додають 24b (1,67 г, 4,56 ммоль) у ТГФ (40 мл). Реакційну суміш перемішують при температурі -78°С протягом 90 хв., потім при кімнатній температурі протягом 5 хв., розбавляють гексаном і фільтрують через шар целіту/SiО2. Шар промивають гексаном/ЕtOАс (10:1 до 5:1) з одержанням сполуки 25b (2 г, вихід: 89%) у вигляді безбарвного масла, яке застосовують без подальшого очищення. 1 H ЯМР (CDCI3, 300 МГц) δ: 7,70-7,66 (м, 4Н), 7,45-7,34 (м, 6Н), 6,21-6,31 (м, 2Н), 5,49-5,43 (м, 1Н), 5,35-5,27 (м, 1H), 3,94-3,75 (м, 1Н), 2,30-2,27 (м, 2Н), 2,24-2,04 (м, 2Н), 1,43 (д, 3Н, J=6,6 Гц), 1,06 (с, 9Н). 13 С-ЯМР (CDCI3, 75 МГц) δ: 138,2; 136,2; 134,3; 129,9; 127,8; 126,4; 126,0; 84,1; 71,9; 41,6; 34,5; 27,2; 19,6; 13,2. 97369 52 Синтез проміжної сполуки 25с 2,3-Дихлор-5,6-диціано-п-бензохінон (DDQ) (3,6 г, 16 ммоль) додають до розчину сполуки 25а (5 г; 12 ммоль) у ДХМ-Н2О (20:1) в атмосфері Аr при кімнатній температурі. Через 1:30 год. (ТШХ гексан/ЕtOАс 4:1 показує відсутність вихідного матеріалу) реакційну суміш гасять виливанням в Et2O (200 мл) і промиванням 1М NaOH (3×50 мл) і насиченим розчином солі (50 мл). Органічну фазу сушать над Na2SO4, фільтрують і концентрують. Хроматографічний розподіл пметоксибензальдегіду проводять через відновлення до п-метоксибензилового спирту. Наприкінці розчин залишку, одержаний у МеОН з NaBH4 в атмосфері Аr, зберігають при кімнатній температурі протягом 1 год. Потім реакційну суміш гасять виливанням в Еt2О (100 мл) і промиванням 1М НСI (40 мл) і насиченим розчином солі (40 мл). Органічну фазу сушать над Na2SO4, фільтрують і концентрують. Одержане масло очищають на силікагелі (гексан/ЕtOАс 10:1 до 4:1) з одержанням вторинного спирту у вигляді безбарвного масла (2,8 г; вихід: 80%). До розчину вторинного спирту (2,8 г; 10 ммоль) у безводному ДХМ, в атмосфері Аr і при температурі 0°С по краплях додають 2,6-лутидину з подальшим додаванням третбутилдиметилсилілтрифторметансульфонату (TBSOTf) (ТШХ гексан/ДХМ 4:1 показує відсутність вихідного матеріалу). У цей момент неочищену суміш гасять 0,5М НСI (25 мл) і екстрагують ДХМ (2×25 мл). Об'єднані органічні шари промивають насиченим водним розчином NaНСО3 і насиченим розчином солі. Органічну фазу сушать над NaSO4, фільтрують і концентрують. Флеш-хроматографія (гексан/ЕtOАс 100:1 до 20:1) дає сполуку 25с у вигляді безбарвного масла (3,14 г; вихід: 80%). 1 Н ЯМР (CDCI3, 300 МГц) δ: 6,25 (м, 2Н) 5,64 (т, 1Н, J=7,8 Гц), 3,82 (м, 1Н), 2,38 (т, 2Η, J=6,0 Гц), 2,20 (т, 2Η, J=6,3 Гц), 2,03 (с, 3Н), 0,86 (с, 9Н), 0,05 (с, 6Н). 13 С ЯМР (CDCI3, 75 МГц) δ: 137,7, 130,9, 124,3, 84,6, 70,6, 42,5, 36,6, 25,9, 21,3, 18,2, -4,4. ПРИКЛАД 7: СИНТЕЗ ФРАГМЕНТА BCD На схемі 4 представлено декілька прикладів синтезу фрагмента BCD відповідно до номенклатури, наведеної на схемі 1. 53 Синтез проміжної сполуки 26а Повторно герметизовану пробірку Шленка завантажують йодидом міді (І) (148 мг, 0,78 ммоль), карбонатом калію (1,076 г, 7,78 ммоль) і Вос-третЬеиС(ШН2 (одержаний за методикою, описаною у Pozdnev, V. F., TeTpahedron Letters 1995, 36, 71157118) (0,96 г, 4,15 ммоль), вакуумують і заповнюють аргоном. Ν,Ν'-диметилетилендіамін (DMEDA) (0,166 мл, 1,55 ммоль), вінілйодид 25с (1,04 г, 2,59 ммоль) і сухий ДМФ (15 мл) додають в атмосфері аргону. Пробірку Шленка герметично закривають, нагрівають до температури 90°С протягом 16-18 год. і охолоджують до кімнатної температури. Одержану суміш розбавляють EtOАс і гасять водою. Органічний шар промивають водою і сушать над Na2SO4. Розчинник видаляють при зниженому тиску і залишок очищають флеш-хроматографією на силікагелі (гексан/ЕtOАс, 20:1 до 15:1). Проміжну сполуку 26а (670 мг, вихід, 53%) одержують у вигляді масла. 1 H ЯМР (CDCI3, 300 МГц) δ: 7,72 (д, 1Н, J=9,9 Гц), 6,70 (т, 1H, J=9,6 Гц), 5,54 (т, 1Η, J=7,8 Гц), 5,35 (д, 1Н, J=9,0 Гц), 4,76 (кв, 1Н, J=7,8 Гц), 3,89 (д, 1H, J=9,0 Гц), 3,73-3,68 (м, 1Н), 2,12 (м, 4Н), 1,98 (с, 3Н), 0,971 (с, 9Н), 0,84 (с, 9Н), 0,02 (с, 3Н),0,01 (с, 3Н). 13 С ЯМР (CDCI3, 75 МГц) δ: 168,9, 156,0, 131,1, 123,9, 122,6, 108,2, 79,9, 71,6, 62,5, 36,5, 34,8, 33,8, 28,1, 26,7, 25,9, 21,2, 18,3, -4,3, -4,4. 97369 54 Синтез проміжної сполуки 26b Повторно герметизовану пробірку Шленка завантажують йодидом міді (І) (232,4 мг, 1,22 ммоль), карбонатом калію (1,688 г, 12,23 ммоль) і Вос-трет-LeuCONH2 (2,474 г, 6,12 ммоль), вакуумують і заповнюють аргоном. Ν,Ν'диметилетилендіамін (DMEDA) (0,26 мл, 2,45 ммоль), вінілйодид 25b (2 г, 4,08 ммоль) і сухий ДМФ (35 мл) додають в атмосфері аргону. Пробірку Шленка герметично закривають, нагрівають до температури 90°С протягом 16-18 год. і охолоджують до кімнатної температури. Одержану суміш розбавляють ЕtOАс і гасять водою. Органічний шар промивають водою і сушать над Na2SO4. Розчинник видаляють при зниженому тиску і залишок очищають флеш-хроматографією на силікагелі (гексан/ЕtOАс, 20:1 до 15:1). Проміжну сполуку 26b (1,06 г, вихід, 44%) одержують у вигляді масла. 1 H ЯМР (CDCI3, 300 МГц) δ: 7,70-7,67 (м, 4Н), 7,43-7,35 (м, 6Н), 7,13 (д, 1H, J=10,5 Гц), 6,67 (дд, 1H, J=10,2, 9,6 Гц), 5,56-5,45 (м, 1Н), 5,36-5,28 (м, 2Н), 4,86-4,78 (м, 2Н), 3,88-3,77 (м, 1Н), 2,26-2,04 (м, 4Н), 1,44 (д, 3Н, J=6,9 Гц), 1,43 (с, 9Н), 1,06 (с, 9Н), 0,96 (с, 9Н). 55 Синтез проміжної сполуки 26с Повторно герметизовану пробірку Шленка завантажують йодидом міді (І) (40,4 г, 0,213 ммоль), карбонатом калію (294 г, 2,13 ммоль) і Boc-ValCONH2 (одержаний за методикою, описаною у Pozdnev, V. F., TeTpahedron Letters 1995, 36, 71157118) (230 мг, 1,06 ммоль), вакуумують і заповнюють аргоном. Ν,Ν'-диметилетилендіамін (DMEDA) (45 мкл, 0,426 ммоль), вінілйодид 25с (283 мг, 0,71 ммоль) і сухий ДМФ (35 мл) додають в атмосфері аргону. Пробірку Шленка герметично закривають, нагрівають до температури 90°С протягом 16-18 год. і охолоджують до кімнатної температури. Одержану суміш розбавляють EtOAc і гасять водою. Органічний шар промивають водою і сушать над Na2SO4. Розчинник видаляють при зниженому тиску і залишок очищають флеш-хроматографією на силікагелі (гексан/ЕtOАс, 7:1 до 3:1). Проміжну сполуку 26с (270 г, вихід, 77%) одержують у вигляді масла. 1 H ЯМP (CDCI3, 300 МГц) δ: 7,80 (д, 1H, J=9,3 Гц), 6,79-6,73 (м, 1H), 5,58 (т, 1H, J=7,5 Гц), 5,02 (ушир.с, 1H), 4,85-4,76 (м, 1H), 3,93 (дд, 1Н. J=8,4, 6,0 Гц), 3,80-3,73 (м, 1H), 2,12-2,22 (м, 5Н), 2,02 (с, 3Н), 1,45 (с, 9Н), 0,98 (д, 3Н, J=6,9 Гц), 0,93 (д, 3Н, J=6,9 Гц), 0,89 (с, 9Н), 0.07 (с, 3Н), 0,06 (с, 3Н). 13 С ЯМР (CDCI3, 75 МГц) δ: 169,3, 131,1, 124,0, 122,7, 108,9, 71,6, 36,5, 33,8, 30,6, 28,5, 26,1, 21,3, 19,6, 18,3, 17,9, -4,3, -4,4. Синтез проміжної сполуки 26d Повторно герметизовану пробірку Шленка завантажують йодидом міді (І) (14,2 мг, 0,075 ммоль), карбонатом калію (104 мг, 0,75 ммоль) і Fmoc-Phe-CONH2 (одержаний за методикою, описаною у Pozdnev, V. F., Teтpahedron Letters 1995, 36, 7115-7118) (145 мг, 0,375 ммоль), вакуумують і заповнюють аргоном. Ν,Ν'-диметилетилендіамін (16 мкл, 0,15 ммоль), вінілйодид 25с (100 мг, 0,25 ммоль) і сухий ДМФ (2,5 мл) додають в атмосфері аргону. Пробірку Шленка герметично закривають, нагрівають до температури 90°С протягом 16-18 год. і охолоджують до кімнатної температури. Одержану суміш розбавляють EtOAc і гасять водою. Органічний шар промивають водою і сушать над Na2SO4. Розчинник видаляють при зниженому тиску і залишок очищають флеш-хроматографією на силікагелі (гексан/ЕtOАс, 4:1 до 1:1). Проміжну сполуку 26d (46 мг, вихід, 42%) одержують у вигляді масла. 1 H ЯМР (CDCI3, 300 МГц) δ: 9,19 (д, 1Н, J=11,1 Гц), 7,36-7,21 (м, 5Н), 6,77 (ддд, 1Н, J=10,2, 9,3, 0,9), 5,60 (ушир.т, 1H, J=7,8 Гц), 4,82-4,78 (м, 1Н), 97369 56 3,79-3,71 (м, 1H), 3,67 (дд, 1Н, J=9,6, 3,9 Гц), 3,32 (дд, 1H, J=13,8, 3,9 Гц), 2,69 (дд, 1Н, J=13,8, 9,6 Гц), 2,20-2,11 (м, 4Н), 1,99 (с, 3Н), 0,89 (с, 9Н), 0,05 (с, 3Н), 0,04 (с, 3Н). 13 С ЯМР (CDCI3, 75 МГц) δ: 171,9, 137,9, 130,9, 129,5, 129,1, 127,2, 124,1, 122,5, 107,9, 71,4, 56,6, 40,9, 36,3, 33,6, 26,1, 21,3, 18,3, -4,4, -4,5. + + МС (ЕР) m/z 437,1 [М+Н] , 459,0 [M+Na] Синтез проміжної сполуки 27а Розчин аміно-захищеного похідного 26а (670 мг, 1,33 ммоль) в етиленгліколі (30 мл) нагрівають при температурі 200°С протягом 10-20 хв. Потім реакційну суміш охолоджують при кімнатній температурі, розбавляють ДХМ, гасять насиченим розчином солі і виливають у воду. Декілька крапель 3М NaOH додають доти, доки рН розчину не стане рівним рН 14 і потім ретельно екстрагують ДХМ. Об'єднані органічні фази сушать над Na2SO4, фільтрують і концентрують у вакуумі з одержанням первинного аміну 27а (510 мг, вихід: 95%) у вигляді жовтого масла, яке застосовують без подальшого очищення. 1 Н ЯМР (CDCI3, 300 МГц) δ: 8,77 (д, 1H, J=9,9 Гц), 6,71 (т, 1Η, J=9,6 Гц), 5,56 (т, 1H, J=7,8 Гц), 4,71 (м, 1H), 3,72 (м, 1H), 3,14 (с, 1Н), 2,14 (м, 4Н), 1,97 (с, 3Н), 0,97 (с, 9Н), 0,84 (с, 9Н), 0,02 (с, 6Н). 13 С ЯМР (CDCI3, 75 МГц) δ: 171,2, 131,0, 124,1, 122,5, 107,1, 71,5, 64,3, 36,2, 34,5, 33,8, 26,5, 26,0, 21,2, 18,2, -4,4, -4,5. Синтез проміжної сполуки 27b Розчин аміно-захищеного похідного 26b (847 мг, 1,43 ммоль) в етиленгліколі (50 мл) нагрівають при температурі 200°С протягом 10-20 хв. Потім реакційну суміш охолоджують при кімнатній температурі, розбавляють ДХМ, гасять насиченим розчином солі і виливають у воду. Декілька крапель 3М NaOH додають доти, доки рН розчину не стане рівним рН 14 і потім ретельно екстрагують ДХМ. Об'єднані органічні фази сушать над Na2SO4, фільтрують і концентрують у вакуумі з одержанням первинного аміну 27b (435 мг, вихід: 62%) у вигляді білої піни після очищення флешхроматографією (гексан/ЕtOАс 10:1 до 1:2). 1 Н ЯМP (CDCI3, 300 МГц) δ: 8,50 (д, 1H, J=10,8 Гц), 7,70-7,66 (м, 4Н), 7,45-7,33 (м, 6Н), 6,67 (дд, 1Н, J=11,1, 9,3 Гц), 5,48-5,40 (м, 1H), 5,36-5,28 (м, 1H), 4,79 (дд, 1H, J=16,2, 7,5 Гц), 3,87-3,79 (м, 1H), 3,08 (с, 1H), 2,22-2,14 (м, 4Н), 1,43 (д, 3Н, J=6,9 Гц), 1,05 (с, 9Н), 0,97 (с, 9Н). 13 С-ЯМР (CDCI3, 75 МГц) δ: 171,0; 136,1; 134,5; 129,8; 127,8; 126,3; 126,2; 122,1; 107,6; 72,6; 64,4; 34,0; 34,4; 32,8; 27,2; 26,9; 19,6; 13,2. 57 97369 58 Синтез проміжної сполуки 27с Розчин аміно-захищеного похідного 26с (255 мг, 0,52 ммоль) в етиленгліколі (15 мл) нагрівають при температурі 200°С протягом 10-20 хв. Потім реакційну суміш охолоджують при кімнатній температурі, розбавляють ДХМ, гасять насиченим розчином солі і виливають у воду. Декілька крапель 3М NaOH додають доти, доки рН розчину не стане рівним рН 14 і потім ретельно екстрагують ДХМ. Об'єднані органічні фази сушать над Na2SO4, фільтрують і концентрують у вакуумі з одержанням первинного аміну 27с (170 мг, вихід: 85%) у вигляді жовтого масла, яке застосовують без подальшого очищення. 1 H ЯМР (CDCI3, 300 МГц) δ: 9,27 (д, 1Н, J=10,2 Гц), 6,76 (дд, 1Н, J=11,1, 9,6 Гц), 5,61 (т, 1H, J=7,8 Гц), 4,80-4,72 (м, 1Н), 3,81-3,73 (м, 1Н), 3,31 (д, 1H, J=3,6 Гц) 2,44-2,33 (м, 1Н), 2,20-2,16 (м, 4Н), 2,03 (с, 3Н), 1,59 (ушир.с, 2Н), 1,00 (д, 3Н, J=6,9 Гц), 0,89 (с, 9Н), 0,82 (д, 3Н, J=6,9 Гц), 0,05 (с, 6Н). 13 С ЯМР (CDCI3, 75 МГц) δ: 172,1, 131,1, 124,1, 122,5, 107,4, 71,5, 36,5, 33,7, 30,8, 26,0, 21,3, 20,0, 16,1, -4,3, -4,4. Синтез проміжної сполуки 28а До розчину аміну 27а (918 мг, 2,27 ммоль) у ДХМ/ДМФ (10:1, 39,6 мл) додають розчин (Z)-3трибутилстанілакрилової кислоти (1028 мг, 2,84 ммоль) у сухому ДХМ в атмосфері аргону і потім охолоджують при температурі 0°С. Діізопропілетиламін (DIPEA) (0,6 мл, 3,4 ммоль), 1-гідроксі-7азабензотриазол (HOAt) (310 мг, 2,27 ммоль) і гексафторфосфат N,N,N',N'-Teтpaметил-O-(7азабензотриазол-1-іл)уронію (HATU) (860 мг, 2,27 ммоль) додають до розчину і через 30 хв. холодну баню видаляють. Реакційну суміш перемішують при кімнатній температурі протягом 2 год., гасять насиченим водним розчином NH4Cl, виливають у воду і екстрагують ДХМ. Об'єднані органічні фази сушать над Na2SO4, фільтрують і концентрують. Залишок очищають флеш-хроматографією (гексан/ЕtOАс 20:1 до 15:1) з одержанням аміду 28а (1110 мг; вихід: 66%) у вигляді масла. 1 Н ЯМP (CDCI3, 300 МГц) δ: 7,63 (д, 1H, J=10,5 Гц), 6,97 (д, 1Н, J=12,3 Гц), 6,75 (д, 1H, J=12,3 Гц), 6,72 (т, 1H, J=9,5 Гц), 6,50 (д, 1H, J=9,0 Гц), 5,56 (т, 1Η, J=6.6 Гц), 4,83 (кв, 1H, J=9,0 Гц), 4,41 (д, 1H, J=9,6 Гц) 3,76 (м, 1Н), 2,17 (м, 4Н), 2,01 (с, 3Н), 1,45 (м, 6Н), 1,25 (м, 8Н), 1,0 (с, 9Н), 0,88 (с, 9Н), 0,84 (м, 13Н), 0,06 (с, 6Н). Синтез проміжної сполуки 28b До розчину аміну 27b (575 мг, 1,17 ммоль) у ДХМ/ДМФ (4:1, 12,5 мл) додають розчин (Z)-3трибутилстанілакрилової кислоти (505,6 мг, 1,4 ммоль) у сухому ДХМ в атмосфері аргону, і потім охолоджують до 0°С. DIPEA (0,243 мл, 1,76 моль), 7-гідроксибензотриазол (HOBt) (189,2 мг, 1,4 ммоль) і HATU (532,28 мг, 1,4 ммоль) додають до розчину і через 30 хв. холодну баню видаляють. Реакційну суміш перемішують при кімнатній температурі протягом 2 год., гасять насиченим водним розчином NH4CI, виливають у воду і екстрагують ДХМ. Об'єднані органічні фази сушать над Na2SO4, фільтрують і концентрують. Залишок очищають флеш-хроматографією (гексан/EtOAc 20:1 до 15:1) з одержанням аміду 28b (780,4 мг; вихід: 77%) у вигляді білої піни. 1 Н ЯМР (CDCI3, 300 МГц) δ: 7,70-7,68 (м, 4Н), 7,43-7,36 (м, 6Н), 7,02 (д, 1Н, J=12,3 Гц), 7,00 (д, 1H, J=10,8 Гц), 6,75 (д, 1H, J=12,3 Гц), 6,66 (т, 1Н, J=9,3 Гц), 6,26 (д, 1H, J=9,6 Гц), 5,57-5,34 (м, 1H), 5,38-5,28 (м, 1Н), 4,83 (дд, 1H, J=16,5, 7,8 Гц), 4,31 (д, 1Н, J=9,6 Гц), 3,89-3,82 (м, 1Н), 2,26-2,02 (м, 4Н), 1,50-1,42 (м, 6Н), 1,43 (д, 3Н, J=6,9 Гц), 1,331,20 (м, 6Н), 1,06 (с, 9Н), 0,96 (с, 9Н), 0,95-0,83 (м, 15Н). 13 С-ЯМР (CDCI3, 75 МГц) δ: 168,0; 166,2; 153,8; 136,3; 136,1; 134,3; 130,0; 127,8; 126,7; 126,0; 121,6; 109,0; 72,6; 60,7; 35,7; 34,0; 32,7; 29,5; 27,7; 27,2; 26,7; 19,5; 14,0; 13,2; 11,8. Синтез проміжної сполуки 28с До розчину аміну 27с (170 мг, 0,437 ммоль) у ДХМ/ДМФ (10:1, 7,7 мл) додають розчин (Z)-3трибутилстанілакрилової кислоти (197,2 мг, 0,546 ммоль) у сухому ДХМ в атмосфері аргону, і потім охолоджують при температурі 0°С. До розчину додають DIPEA (0,11 мл, 0,655 ммоль), HOAt (59,4 мг, 0,437 ммоль) і HATU (166 мг, 0,437 ммоль) і через 30 хв. холодну баню видаляють. Реакційну суміш перемішують при кімнатній температурі протягом 2 год., гасять насиченим водним розчином NH4Cl, виливають у воду і екстрагують ДХМ. Об'єднані органічні фази сушать над Na2SO4, фільтрують і концентрують. Залишок очищають флешхроматографією (гексан/ЕtOАс 20:1 до 15:1) з одержанням аміду 28с (250 мг, вихід: 78%) у вигляді білої піни. 1 H ЯМР (CDCI3, 300 МГц) δ: 7,94 (д, 1H, J=10,8 Гц), 7,00 (д, 1H, J=12,3 Гц), 6,75 (д, 1Н, J=12,3 Гц), 6,72 (т, 1Н, J=9,5 Гц), 6,50 (д, 1H, J=9,0 Гц), 5,56 (т, J=6,6 Гц, 1H), 4,83 (кв, 1H, J=9,0 Гц), 4,41 (т, 1Н, J=9,0 Гц), 3,76 (м, 1Н), 2,17 (м, 4Н), 2,01 (с, 3Н), 1,45 (м, 7Н), 1,25 (м, 8Н), 0,88 (с, 9Н), 0,84 (м, 19Н), 0,06 (с, 6Н). 59 13 С-ЯМР (СDCl3, 75 МГц) δ: 169,2, 166,8, 153,8, 136,2, 131,1, 123,9, 122,6, 108,7, 71,6, 59,2, 36,5, 33,7, 31,4, 29,5, 29,4, 27,6, 26,1, 21,3, 19,5, 18,5, 18,3, 14,0, 11,8, -4,3, -4,4. Синтез проміжної сполуки 28d До розчину аміну 26d (44 мг, 0,1 ммоль) у ДХМ/ДМФ (10:1, 1,3 мл) додають розчин (Z)-3трибутилстанілакрилової кислоти (45 мг, 0,125 ммоль) у сухому ДХМ в атмосфері аргону, і потім охолоджують при температурі 0°С. До розчину додають DIPEA (26 мкл, 0,15 ммоль), HOAt (13,6 мг, 0,1 ммоль) і HATU (38 мг, 0,1 ммоль) і через 30 хв. холодну баню видаляють. Реакційну суміш перемішують при кімнатній температурі протягом 2 год., гасять насиченим водним розчином NH4Cl, виливають у воду і екстрагують ДХМ. Об'єднані органічні фази сушать над Na2SO4, фільтрують і концентрують. Залишок очищають флешхроматографією (гексан/ЕtOАс 20:1 до 15:1) з одержанням аміду 28d (60 мг, вихід: 80%) у вигляді масла. 1 Н ЯМР (CDCI3, 300 МГц) δ: 7,43 (д, 1Н, J=10,8 Гц), 7,34-7,22 (м, 5Н), 7,02 (д, 1Н, J=12,3 Гц), 6,70 (д, 1Н, J=12,3 Гц), 6,66 (дд, 1Н, J=9,9, 9,3 Гц), 6,34 (д, 1Н, 1=7,8Гц), 5,51 (дд, 1Н, J=8,1, 7,5 Гц), 4,814,71 (м, 2Н), 3,68-3,59 (м, 1H), 3,18 (дд, 1H, J=13,5, 6 Гц), 2,69 (дд, 1Н, J=13,5, 8,4 Гц), 2,11-2,04 (м, 2Н), 2,01 (с, 3Н), 1,96-1,87 (м, 1Н), 1,80-1,70 (м, 1H), 1,53-1,43 (м, 8Н), 1,31-1,24 (м, 10Н), 0,89-0,85 (м, 9Н), 0,88 (с, 9Н), 0,04 (с, 3Н), 0,01 (с, 3Н). 97369 60 13 С ЯМР (CDCI3, 75 МГц) δ: 168,5, 166,5, 154,4, 136,7, 135,9, 131,0, 129,5, 129,1, 127,4, 124,0, 122,3, 108,8, 71,5, 55,1, 38,8, 36,6, 33,3, 29,5, 29,4, 27,6, 26,0, 21,3, 18,2, 14,0, 11,8, -4,3, -4,5. + + МС (ЕР) m/z 781,2 [М+Н] , 803,2 [M+Na] Синтез проміжної сполуки 28е До розчину аміну 27а (30 мг, 0,075 ммоль) у ДХМ/ДМФ (10:1, 1 мл) додають розчин (Е)-3трибутилстанілакрилової кислоти (33,5 мг, 0,095 ммоль) у сухому ДХМ в атмосфері аргону, і потім охолоджують при температурі 0°С. До розчину додають DIPEA (19 мкл, 0,11 ммоль), HOAt (10 мг, 0,075 ммоль) і HATU (27,5 мг, 0,075 ммоль) і через 30 хв. холодну баню видаляють. Реакційну суміш перемішують при кімнатній температурі протягом 2 год., гасять насиченим водним розчином NH4Cl, виливають у воду і екстрагують ДХМ. Об'єднані органічні фази сушать над Na2SO4, фільтрують і концентрують. Залишок очищають флешхроматографією (гексан/EtOAc 6:1) з одержанням аміду 28е (25 мг, вихід: 45%) у вигляді масла. 1 H ЯМР (CDCI3, 300 МГц) δ: 7,68 (д, 1Н, J=9,2 Гц), 7,52 (д, 1H, J=18,9 Гц), 6,73 (т, 1H, J=9,2 Гц), 6,28 (д, 1Н, J=10,8 Гц), 6,25 (д, 1H, J=18,9 Гц), 5,60 (т, 1H, J=7,2 Гц), 4,83 (кв, 1H, J=9,2 Гц), 4,40 (д, 1H, J=9,6 Гц), 3,77 (м, 1H), 2,17 (м, 4Н), 2,01 (с, 3Н), 1,45 (м, 6Н), 1,25 (м, 8Н), 1,0 (с, 9Н), 0,88 (с, 9Н), 0,84 (м, 13Н), 0,06 (с, 6Н). ПРИКЛАД 8 На схемі 5 представлений синтез декількох сполук відповідно до даного винаходу.
ДивитисяДодаткова інформація
Назва патенту англійськоюAntitumoral dihydropyran-2-one compounds and pharmaceutical composition based thereon
Автори англійськоюMartin Lopez Ma Jesus, Coello Molinero Laura, Reyes Benitez Jose Fernando, Rodriguez Vicente, Alberto, Garranzo Garcia-Ibarrola, Maria, Murcia Perez, Carmen, Francesch Solloso Andres, Sanchez Sancho, Francisco, Cuevas Marchante, Maria del Carmen, Fernandez Rodriguez Rogelio
Назва патенту російськоюПротивоопухолевые соединения дигидропиран-2-она и фармацевтическая композиция на их основе
Автори російськоюМартин Лопес Ма Хесус, Коэльо Молинеро Лаура, Рейес Бенитес Хосе Фернандо, Родригес Висенте Альберто, Гаррансо Гарсиа-Ибаррола Мария, Мурсия Перес Кармен, Франсесч Сольосо Франсиско, Санчес Санчо Франсиско, Куэвас Марчанте Мария дель Кармен, Фернандес Родригес Рохелио
МПК / Мітки
МПК: A61K 31/351, C07D 309/32, A61P 35/00
Мітки: основі, дигідропіран-2-ону, сполуки, композиція, фармацевтична, протипухлинні
Код посилання
<a href="https://ua.patents.su/43-97369-protipukhlinni-spoluki-digidropiran-2-onu-ta-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Протипухлинні сполуки дигідропіран-2-ону та фармацевтична композиція на їх основі</a>
Попередній патент: Склад сталі з високими характеристиками високотемпературної корозії окисними середовищами (варіанти) та її застосування, безшовна труба або арматура, створена з цієї сталі
Наступний патент: Похідні фенілпентадієноїлу та їх застосування як антагоністів par 1
Випадковий патент: Комбікорм для годівлі курей-несучок












