Спосіб одержання 2-ацетокси-5-(2-фтор-альфа-циклопропілкарбонілбензил)-4,5,6,7-тетрагідро-4н-тієно[3,2-с] піридину
Номер патенту: 108868
Опубліковано: 25.06.2015
Автори: Дебрецені Йожеф, Сіладьі Еріка, Ньюлаші Балінт, БАРКОЦІ Йожеф, Надь Кальман, Грегор Тамаш, Мезеі Тібор, Пандур Ангела, Волк Балаж, Шлегель Петер, Немет Габор, Мольнар Єнікьйо, Ружич Дьйордь, Порч-Маккаі Марта
Формула / Реферат
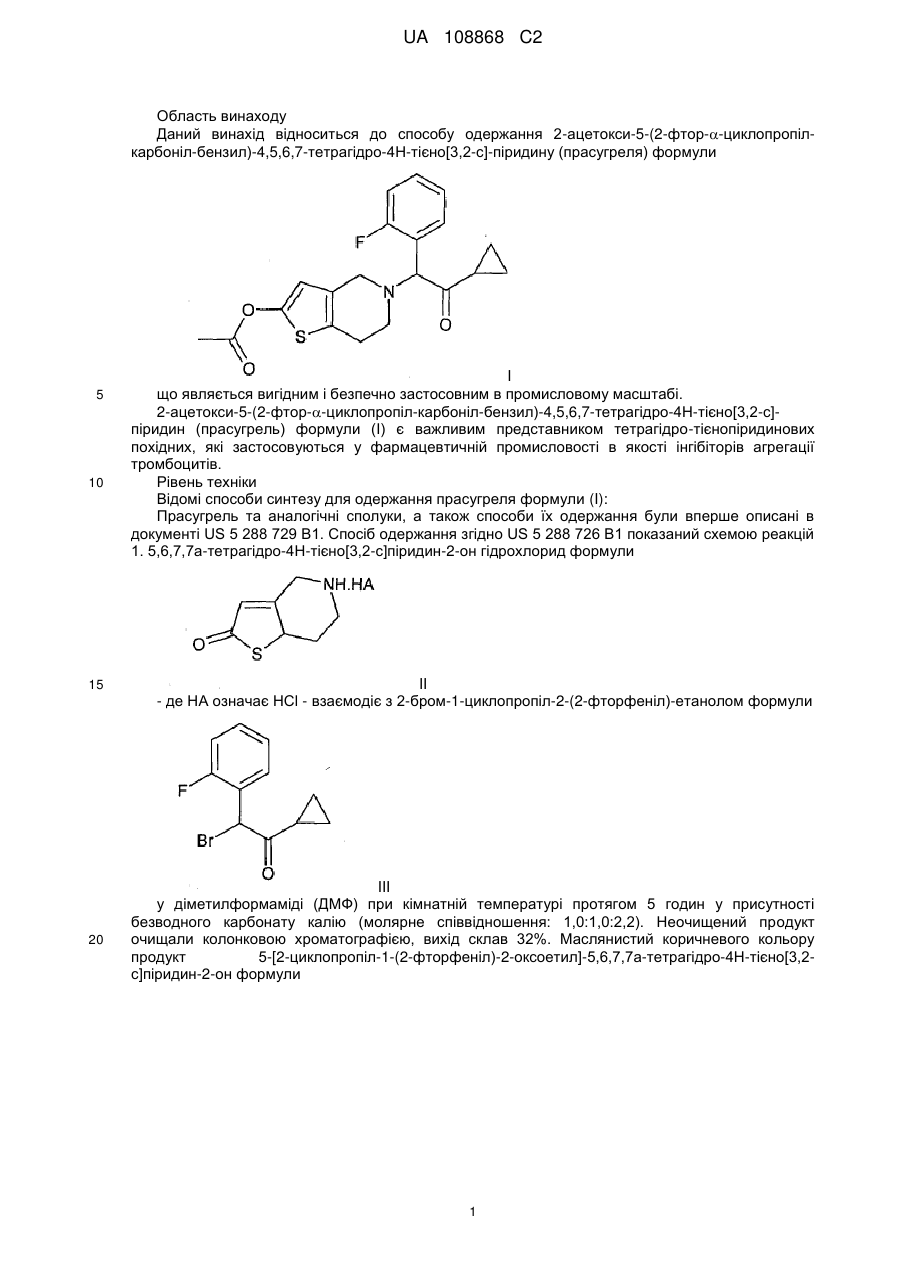
1. Спосіб одержання 2-ацетокси-5-(2-фтор-a-циклопропілкарбонілбензил)-4,5,6,7-тетрагідро-4Н-тієно[3,2-с]піридину (прасугрелю) формули (І) шляхом взаємодії 5,6,7,7а-тетрагідро-4Н-тієно[3,2-с]піридин-2-ону формули (II) з 2-бром-1-циклопропіл-2-(2-фторфеніл)етаноном формули (III) або з 2-хлор-1-циклопропіл-2-(2-фторфеніл)етаноном формули (ІIIа) і ацилування одержаної сполуки 5-[2-циклопропіл-1-(2-фторфеніл)-2-оксоетил]-5,6,7,7а-тетрагідро-4Н-тієно[3,2-с]піридин-2-ону формули (IV) в присутності органічної основи і агента ацилування, причому реакцію виконують в одній ємності, без виділення сполуки формули (IV).
2. Спосіб за п. 1, який відрізняється тим, що реакції приєднання і ацилування виконують у присутності однієї і тієї ж органічної основи.
3. Спосіб за п. 1 або 2, який відрізняється тим, що органічною основою є триетиламін, N,N-діізопропілетиламін або піридин.
4. Спосіб за п. 1, який відрізняється тим, що прасугрель формули (І) очищають шляхом перекристалізації з органічного розчинника або суміші розчинників.
5. Спосіб за п. 4, який відрізняється тим, що як органічний розчинник використовують етанол.
Текст
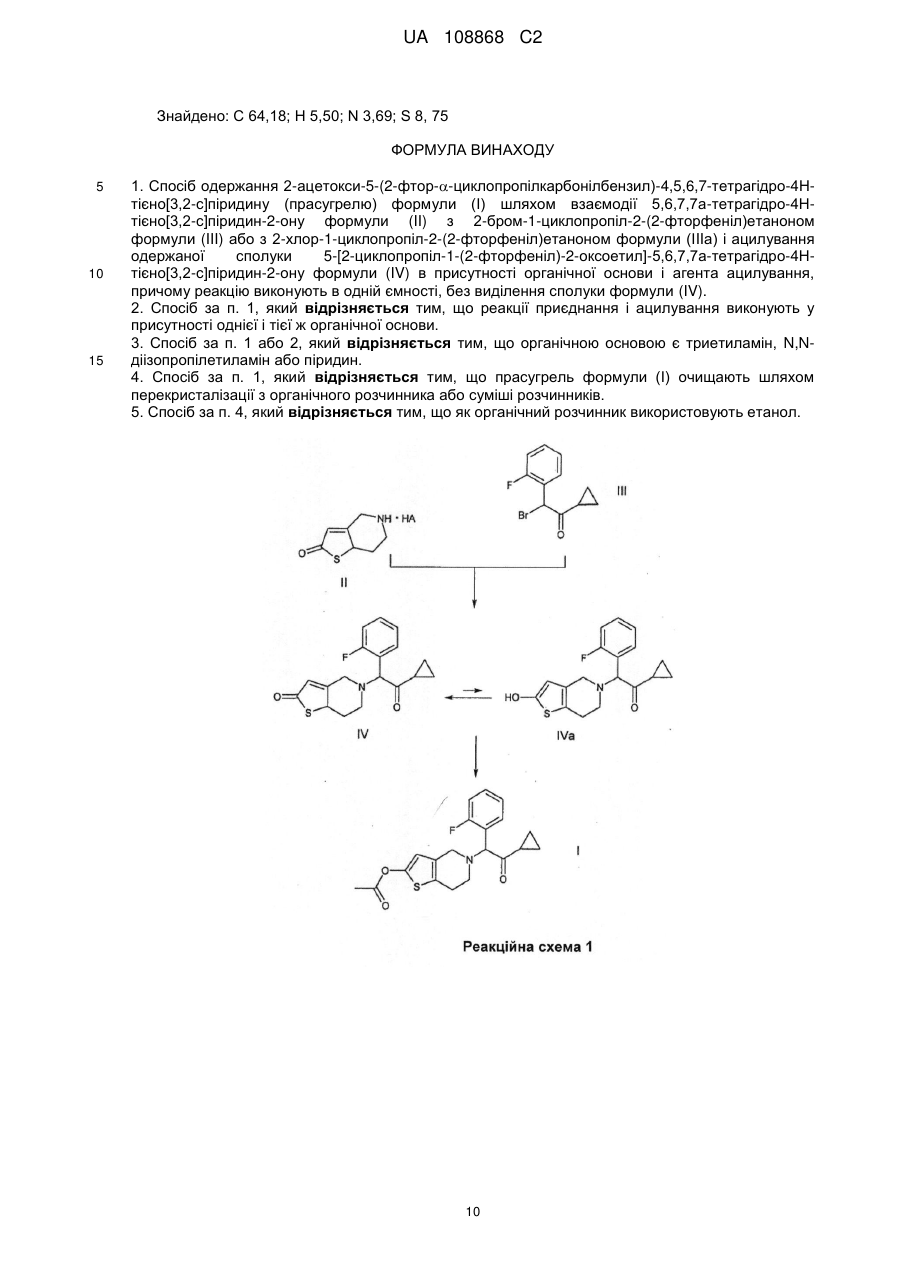
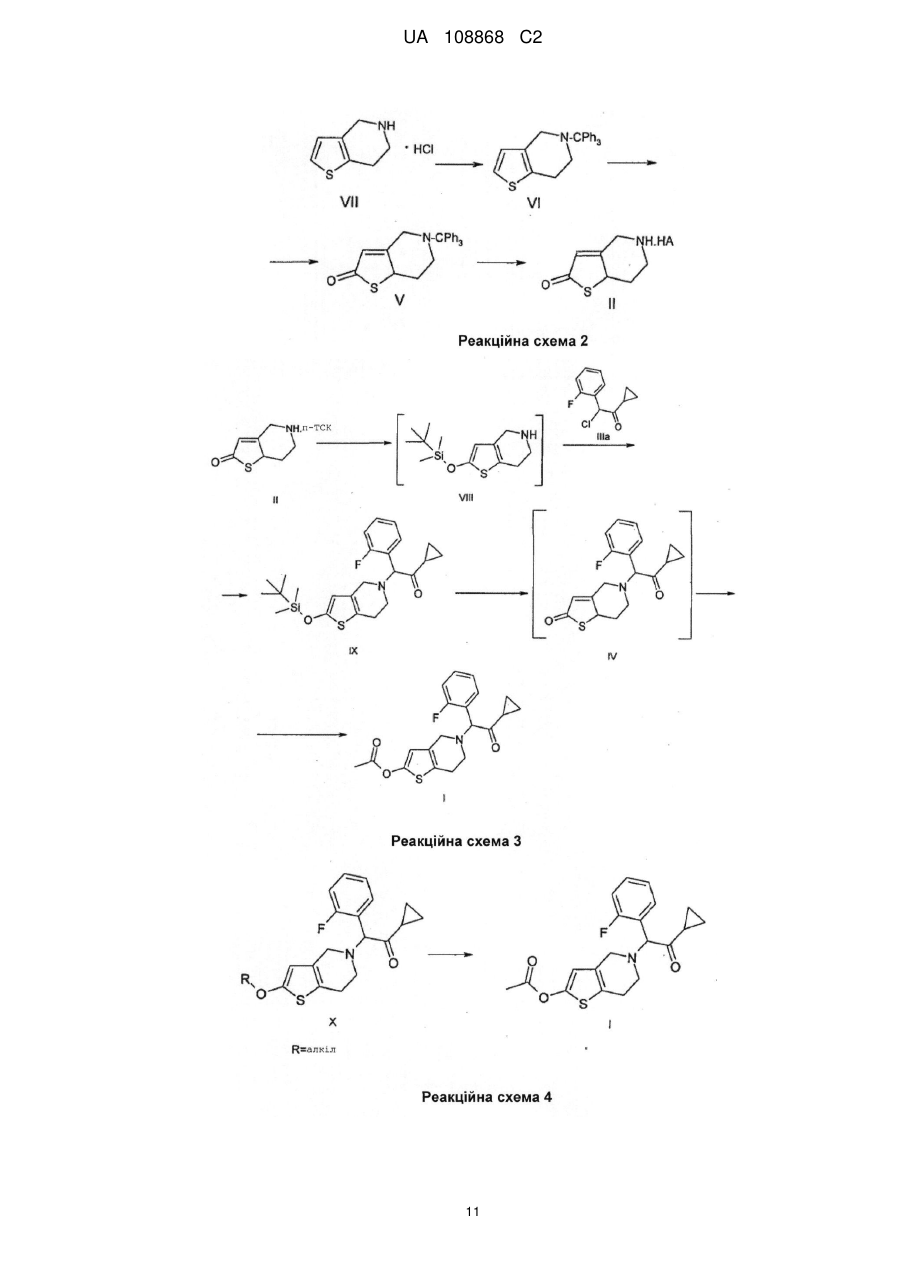
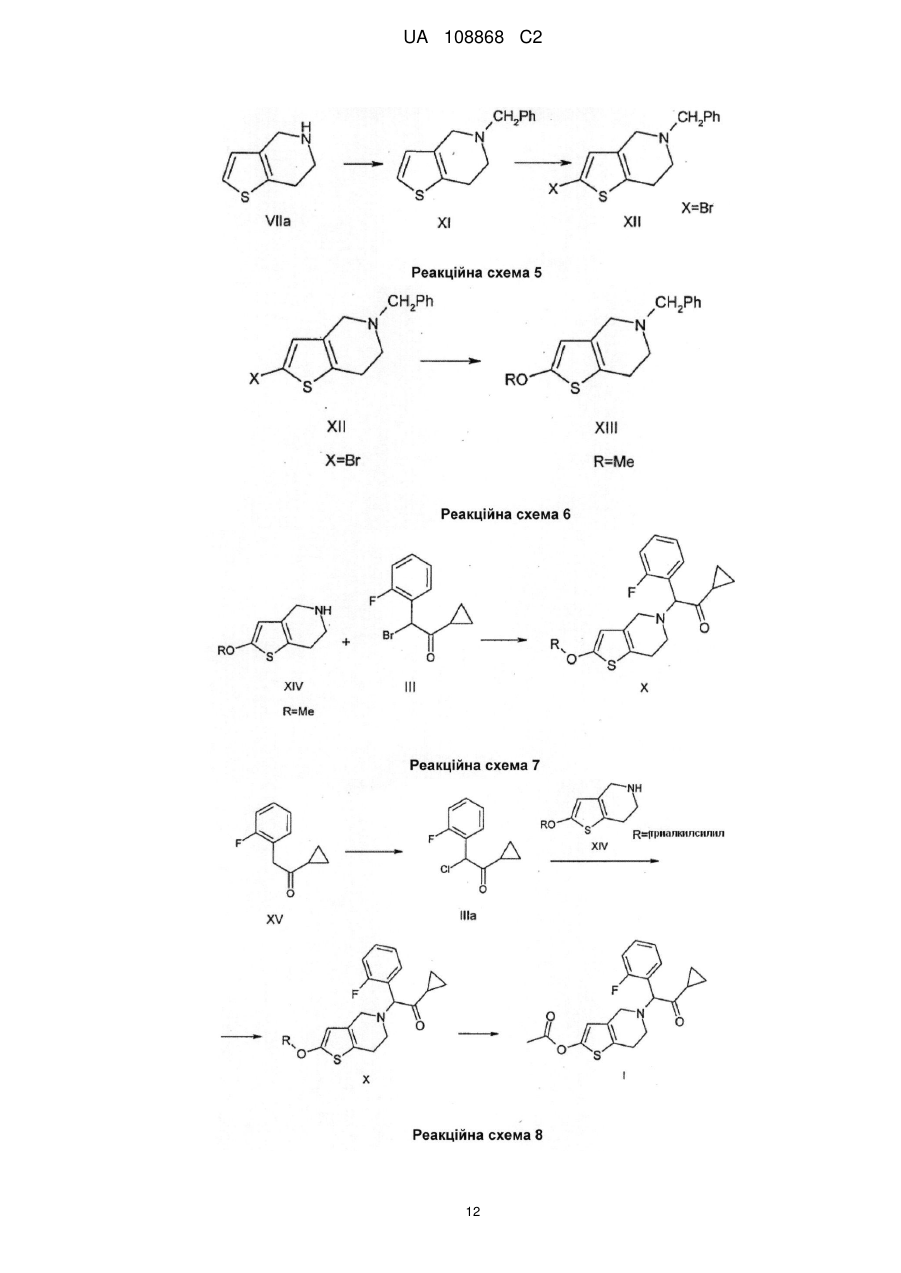
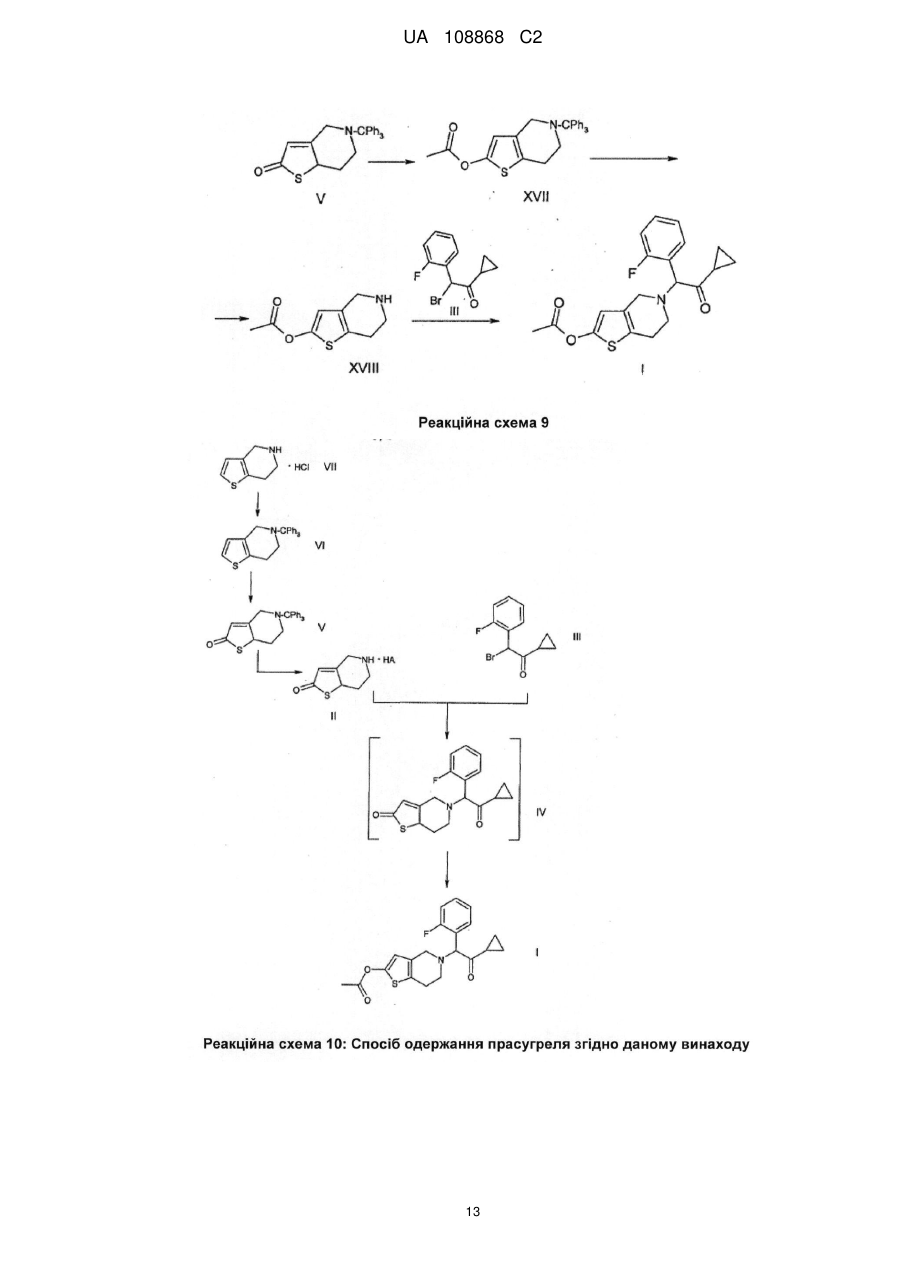
Реферат: Даний винахід полягає в способі одержання 2-ацетокси-5-(2-фтор-циклопропілкарбонілбензил)-4,5,6,7-тетрагідро-4Н-тієно[3,2-с]-піридину (прасугрелю) формули (І) в одній ємності шляхом взаємодії 5,6,7,7а-тетрагідро-4Н-тієно[3,2-с]піридин-2-ону формули (II) з 2-бром-1-циклопропіл-2-(2-фторфеніл)етаноном формули (III) або з 2-хлор-1-циклопропіл2-(2-фторфеніл)етаноном формули (ІIIа) і ацилування одержаної сполуки формули (IV), причому реакцію виконують у присутності органічної основи з агентом ацилування без виділення сполуки формули (IV). UA 108868 C2 (12) UA 108868 C2 Приєднання і ацилування виконують у присутності тієї ж органічної основи, такої як триетиламін, N,N-діізопропілетиламін або піридин. Після завершення способу прасугрель формули (І) очищають перекристалізацією з органічного розчинника або суміші розчинників. UA 108868 C2 Область винаходу Даний винахід відноситься до способу одержання 2-ацетокси-5-(2-фтор--циклопропілкарбоніл-бензил)-4,5,6,7-тетрагідро-4Н-тієно[3,2-с]-піридину (прасугреля) формули 5 10 15 20 I що являється вигідним і безпечно застосовним в промисловому масштабі. 2-ацетокси-5-(2-фтор--циклопропіл-карбоніл-бензил)-4,5,6,7-тетрагідро-4Н-тієно[3,2-с]піридин (прасугрель) формули (I) є важливим представником тетрагідро-тієнопіридинових похідних, які застосовуються у фармацевтичній промисловості в якості інгібіторів агрегації тромбоцитів. Рівень техніки Відомі способи синтезу для одержання прасугреля формули (I): Прасугрель та аналогічні сполуки, а також способи їх одержання були вперше описані в документі US 5 288 729 В1. Спосіб одержання згідно US 5 288 726 В1 показаний схемою реакцій 1. 5,6,7,7а-тетрагідро-4Н-тієно[3,2-с]піридин-2-он гідрохлорид формули II - де НА означає HCl - взаємодіє з 2-бром-1-циклопропіл-2-(2-фторфеніл)-етанолом формули III у діметилформаміді (ДМФ) при кімнатній температурі протягом 5 годин у присутності безводного карбонату калію (молярне співвідношення: 1,0:1,0:2,2). Неочищений продукт очищали колонковою хроматографією, вихід склав 32%. Маслянистий коричневого кольору продукт 5-[2-циклопропіл-1-(2-фторфеніл)-2-оксоетил]-5,6,7,7а-тетрагідро-4Н-тієно[3,2с]піридин-2-он формули 1 UA 108868 C2 5 10 15 20 25 30 35 40 45 IV змішували з відповідним 2-гідрокси таутомером. Маслянистий продукт кристалізувався з диізопропілового ефіру з невстановленим виходом. На останній стадії синтезу до суміші формули (IV) і розчину діметилу-формаміду і оцетового ангідриду додали гідрид натрію. Перед обробкою реакційну суміш перемішували протягом 3 годин при кімнатній температурі. Неочищений продукт очищали колонковою хроматографією. Після упарювання маслянистий продукт кристалізували з диізопропілового ефіру, вихід основи прасугреля склав 65%, обчислений з проміжної сполуки формули (IV), і дуже малий, 21%, обчислений із сполуки формули (II). Одержання вихідного матеріалу 5,6,7,7а-тетрагідро-4Н-тієно[3,2-с]піридин-2-он гідрохлориду формули II, де НА означає HСl, не описано в US 5 288 726 В1, в описі лише приведені посилання на відомі способи без будь-яких подробиць. Згадувані документи (M.Podesta et.al., Eur. J. Med. Chem. - Chim.Ther. 9 (5), 487-490 (1974); а також заявка на патент Японії Kokai № Sho 61-246186) не розкривають будь-які способи одержання ключової проміжної сполуки формули (II) (НА = HСl). У деяких інших заявках зроблені посилання на спосіб синтезу за реакційною схемою 2. Недолік способу, що описаний в US 5 288 726 В1 полягає в тому, що сполуки формули (IV) і прасугрель формули (I) одержують з реакційної суміші колонковою хроматографією. Відомо, що колонкова хроматографія вимагає великої кількості розчинника, тим самим ускладнено збільшення масштабів і, в даному випадку, призводить до низького виходу. Інший недолік способу, що описаний вище полягає у застосуванні гідриду натрію на стадії ацилування одержання кінцевого продукту. Застосування гідриду натрію в промислових масштабах небезпечно і пов'язане з необхідністю виконання жорстких вимог безпеки. Ще один недолік застосування гідриду натрію полягає в обробці парафіну, що застосовується на стадії суспендування. Спосіб, описаний в ЕР 1 098 132 В1 аналогічний способу, описаному в основному патенті. 5,6,7,7а-тетрагідро-4Н-тієно[3,2-с]піридин-2-он гідрохлорид формули (II) (НА = HСl) взаємодіє з 2-бром-1-циклопропіл-2-(2-фторфеніл)-етаноном формули (III) в діметилформаміді при кімнатній температурі, але на відміну від основного патенту як основа використовується гідрокарбонат калію, і також з іншим молярним співвідношенням (1,0:0,93:2,8). Реакційну суміш перемішують протягом 2 годин при кімнатній температурі, продукт розподіляється між водою і етилацетатом, і після упарювання продукт очищають хроматографією. Продукт кристалізується з диізопропілового ефіру. Таким чином, вихід проміжної сполуки формули (IV) становить 35%. Ацилування подібне до описаного в основному патенті, проте для хроматографії в якості елюента застосовували суміш толуолу і етилацетату в співвідношенні 3 до 1 замість 100 до 3. Вихід останньої стадії склав також 65%, а вихід двох стадій разом склав 23%. У документі WO2007/115305 А1 описаний спосіб, загалом аналогічний описаному в основному патенті. Описаний спосіб базується на тих же невигідних стадіях, як і в основному патенті, і призводить до таких же низьких виходів. Згідно із способом, що описаний в документі US 5 874 581 В1 прасугрель формули (I) одержують виходячи з 5,6,7,7а-тетрагідро-4Н-тієно[3,2-с]піридин-2-он толуол-4-сульфоната формули II (НА = п-толуолсульфонат, п-ТСК), причому карбонільна група в положенні 2 являється силілюваною, і проміжна сполука із захисною групою формули VIII зв'язується з відповідним галогенідом кетона, зняття захисної групи і О-ацилування 2 UA 108868 C2 5 10 15 20 25 30 утвореної in situ проміжної сполуки формули (IV) виконується в одну стадію. Спосіб показаний на реакційній схемі 3. Докладний спосіб полягає в наступному: сіль толуол-4-сульфоната формули (II) взаємодіє з трет-бутил-діметил-хлорсіланом в присутності триетиламіну в розчиннику дихлорметан протягом 3 годин при кімнатній температурі, і утворюється 2-(трет-бутіл-діметилсилілокси)4,5,6,7-тетрагідротієно[3,2-с]піридин толуол-4-сульфонат. Одержана сполука далі взаємодіє з 2хлор-1-циклопропіл-2-(2-фторфеніл-етаноном формули IIIа без стадії виділення у присутності іодіду натрію, шляхом додавання триетиламіну при 45°С і перемішуванні протягом 12 годин. Після закінчення реакції 2-(трет-бутил-діметилсилілокси)-5(-циклопропілкарбоніл-2-фторбензол)-4,5,6,7-тетрагідротієно[3,2-с]піридин формули IX кристалізується з ацетонітрилу. Вихід склав 73,3%. Зняття захисної сілильної групи виконували в ТГФ (тетрагідрофурані) в присутності триетиламіну і 4-діметиламінопіридині та ацетильованого оцтовим ангідридом при перемішуванні протягом 4,5 годин при кімнатній температурі без виділення проміжної сполуки. Вихід основи прасугреля склав 91%, розрахований на останній стадії реакції. Вихід, розрахований для солі толуол-4-сульфонати формули (II) (НА = HCl) склав 66,7%. У способі згідно US 5874581 В1 трет-бутилдіметилсилілоксі група успішно застосовувалася для захисту 2-оксо групи з метою зниження побічних продуктів заміщення оксо-групи. Так, вихід, розрахований для солі толуол-4сульфонати формули (II) (HA = HCl) вище, в порівнянні з таким для способу, що описаний в основному патенті. Крім того, для одержання продукту використовується більш кращий і простий спосіб в порівнянні з колонковою хроматографію. Однак недоліком способу, описаного в US 5 874 581, являється введення двох додаткових стадій. Тому синтетичний шлях являється дорогим і його застосування в промисловому масштабі утруднене внаслідок використання третбутил-діметилсілана, чутливого до води і токсичного 4-діметиламіно-піридину. У документах CN 101250192А, CN 101245072A, CN 101245073A і CN 101250193A описані такі ж нові способи одержання прасугреля, з різними певними проміжними сполуками. У документі CN 10250192А описано одержання основи прасугреля з проміжної сполуки формули 3 UA 108868 C2 5 10 15 20 25 XI де оксо-група захищена алкільною групою. Спосіб показаний на реакційній схемі 4. Захисну групу знімають, застосовуючи кислу і м'яку реакційну середу. Перевага способу полягає у відсутності необхідності застосування низької температури, легко займистих або вибухових речовин, крім того, спосіб забезпечує високий вихід. Згідно CN 101245072A (китайська заявка) при взаємодії з бензолом 4,5,6,7-тетрагідротієно[3,2-с]піридину формули VIIa вихід проміжної сполуки формули (XI) становить 98,7%. Проміжна сполука 2-бром-N-бензил формули XII одержують бромуванням сполуки формули (IX) з виходом 97,8% відповідно реакційній схемі 5. Сполуки формули (XII) переводять в прасугрель формули (I) за кілька додаткових стадій. Документ CN 101245073А описує покращений варіант способу, описаного в CN 101245072A, де атом брому в 2-бром похідної формули (XII) заміщений алкокси групою (переважно метокси групою) з метилатом натрію, вихід становить 82,2%. Одержана 2-алкокси перехідна сполука формули XIII переводять в прасугрель формули (I) за декілька додаткових стадій відповідно до схеми реакції 6. У CN 101250193А 2-алкокси проміжна сполука утворюється шляхом приєднання 2-алкокси4,5,6,7-тетрагідро-тієно[3,2-с]піридину формули XIV з 2-бром-1-циклопропіл-2-(2-фторфеніл)-етаноном формули (III) в присутності солі Cu (I) і солі йоду (реакційна схема 7). Перевага способу полягає у відсутності необхідності 4 UA 108868 C2 5 10 15 20 25 30 35 40 застосування низької температури, легкозаймистих або вибухових реагентів, також спосіб забезпечує високий вихід. Недоліки способів, описаних в CN 101250192A, CN 10124572A, CN 101245073A і CN 101250193A полягають в економічній складності виконання стадії деалкілування алкокси групи (переважно зняття метокси групи). Ще один недолік полягає в тому, що сполука тіофену, що одержується в процесі гідрогенізації захисної бензільної групи на атомі азоту, може діяти як каталізаторна отрута. У документі WO 2008/108291 описаний спосіб одержання прасугреля зі зниженою кількістю домішка 3-хлорпропіл шляхом розкриття кільця при хлоруванні циклопропільного кільця прасугреля. 1-циклопропіл-2-(2-фторфеніл)-етанон формули (XV) XV хлорують в положенні 2 при зниженій температурі, одержана проміжна сполука формули (IIIa) приєднується до похідної 5,6,7,7а-тетрагідро-4Н-тієно[3,2-с]піридин-2-она формули (XIV, R = триалкіл-силіл), із захистом на атомі кисню. У документі EP 2 003 136 А1 описаний спосіб одержання основи прасугреля високої чистоти, а також його солей приєднання кислоти (переважно гідрохлориду) зі зниженим вмістом домішки диацетилу формули (IV). Спосіб, описаний в WO 96/11203, використовується для одержання прасугреля через утворення солі та очищення основи. Шляхом приєднання використовували 2хлор-1-циклопропіл-2-(2-фторфеніл)-етанон формули (IIIa), що утворюється в результаті галогенування відповідного кетону формули (XV) з газоподібним хлором, з виходом 80%. Основу прасугреля високої чистоти перекристалізовують. Для перекристалізації застосовуються кілька розчинників, переважно ацетонітрил. У способі використовуються відомі синтетичні схеми і проміжні сполуки. Недолік цього способу полягає у використанні газоподібного хлору, що являється отруйним, складним в обігу і утилізації. В WO 2009/006859 описаний спосіб, де сіль 5,6,7,7а-тетрагідро-4Н-тієно[3,2-с]піридин-2-он формули (II) приєднується до певного 2-метокси похідної формули XVI замість 2-бром-1-циклопропіл-2-(2-фторфеніл)-етанона формули (III). Після одержання проміжної сполуки формули (IV) шляхом колонкової хроматографії, вихід склав 23,7% за однією з версій і 65,4% за іншою. Проміжну сполуку формули (XVI) одержували з 2-фтор-бензальдегіду і триметилсиліл-ціаніду в кілька стадій, застосовуючи дорогі реагенти, причому вихід склав 38,5%. Неочищену маслянисту сполуку формули (II) одержували після ацилювання і подальшої колонкової хроматографії, кристалічну сполуку одержали шляхом кристалізації діетилового ефіру, причому вихід склав 29,2%. Спосіб являється неекономічним і кінцевий продукт в кожній версії одержують колонковою хроматографією. Опис не розкриває будь-які дані про чистоту кінцевого продукту. WO 2009/062044 описує два синтетичних способи одержання прасугреля. Один із способів забезпечує одержання 4,6% обчислених для 4,5,6,7-тетрагідро-тієно[3,2-с]піридин гідрохлориду формули (VII) або 3,7% з урахуванням стадії кристалізації з застосуванням способу, описаного в основному патенті з невеликими змінами. Інший спосіб показаний на реакційній схемі 9. 5тритіл-5,6,7,7а-тетрагідро-4Н-тієно[3,2-с]піридин-2-он формули 5 UA 108868 C2 V ацетілюють з одержанням сполуки формули XVII і знімають захисну групу з атома азоту. Утворювана після похідна формули 5 10 15 20 25 30 35 40 XVIII далі зв'язується з бром-кетоном формули (III). Вихід складає 4,1%, обчислений для гідрохлорида 4,5,6,7-тетрагідро-тієно[3,2-с]піридину формули (VII) або 3,1% з урахуванням стадії перекристалізації. Дане значення нижче, ніж в попередньому варіанті способу. У WO 2009/066326 описаний спосіб основного патенту, покращений і допрацьований для великих масштабів. Сіль 5,6,7,7а-тетрагідро-4Н-тієно[3,2-с]піридин-2-она формули (II) і 2-бром1-циклопропіл-2-(2-фторфеніл)-етанон формули (III) зв'язують у присутності карбонату калію. Утворену сполуку формули (IV), одержують у вигляді масла і далі ацетилюють у присутності речовини, що зв'язує кислоту, - диізопропілу-етилу-аміну (ДІПЕА). Найбільший вихід, обчислений для 4,5,6,7-тетрагідро-тієно[3,2-с]піридину гідрохлориду формули (VII) склав 19,3% або 13% з врахуванням кінцевої стадії очищення. Недолік способу полягає у використанні двох різних основ на двох стадіях, а необхідність виділення проміжної сполуки формули (VII) відсутня, що дозволяє економити трудові ресурси і понизити витрати на розчинники. Відомі способи очищення прасугреля включають наступні. Згідно з документом US 5288726 B1 неочищений прасугрель, одержаний колонковою хроматографією, являє собою маслянистий продукт. Після перекристалізації з диізопропілового ефіру одержують кристалічний прасугрель. Кінцевий продукт характеризується температурою 1 плавлення і Н-ЯМР спектром. У документі ЕР 2003136 А1 заявлений прасугрель високої чистоти, одержаний перекристалізацією з будь-якого органічного розчинника. Придатні розчинники включають аліфатичні вуглеводні, такі як гексан, циклогексан, гептан, петролейний ефір; ароматичні вуглеводні, такі як бензол, толуол, ксилол; галогеновані вуглеводні, такі як дихлорметан, хлороформ, чотирихлористий вуглець, 1,2-дихлоретан, хлорбензол, дихлорбензол, прості ефіри, такі як диетиловий ефір, диізопропіловий ефір, ТГФ, діоксану, диметоксіетан, діметиловий ефір диетилен гліколю; кетони, такі як ацетон, етилметилкетон, диетилкетон; складні ефіри, такі як етил-, пропіл-, і бутилацетат; кислоти, такі як оцтова кислота, пропіонова кислота; нітрили, такі як ацетонітрил, пропіонітріл. Кращим розчинником являється ацетонітрил. Згідно WO 2009/062044 основу прасугреля очищають перекристалізацією з метанолу з виходом 76,4% і чистотою 99,2%, виміряної ВЕРХ (високоефективна рідинна хроматографія). Чистота продукту не відповідає вимогам Фармакопеї. Згідно WO 2009/066326 основу прасугреля очищають перекристалізацією із суміші етилацетат-циклогексан, з виходом 67,3% і чистотою, збільшеною від 96,5% до 99,8%, визначеної ВЕРХ. Інший спосіб очищення полягає в осадженні основи прасугреля з його солі фумарату, в етилацетаті, з водним карбонатом натрію. Після упарювання органічної фази у вакуумі вихід склав 52,5% і чистота прасугреля 88,89% згідно з даними ВЕРХ. Вихід, обчислений для 4,5,6,7-тетрагідро-тієно [3,2-с] піридин гідрохлориду формули (VII) склав 19,3% або 13% при врахуванні стадії очищення. Стислий опис винаходу Даний винахід пропонує спосіб одержання 2-ацетоксі-5-(2-фтор--циклопропіл-карбонілбензил)-4,5,6,7-тетрагідро-4Н-тієно[3,2-с]-піридина (прасугреля) формули (I) в одній ємкості 6 UA 108868 C2 5 10 15 20 25 30 35 40 45 50 55 60 шляхом взаємодії 5,6,7,7а-тетрагідро-4Н-тієно[3,2-с]піридин-2-он формули (II) з 2-бром-1циклопропіл-2-(2-фторфеніл)-етаноном формули (III) або з 2-хлор-1-циклопропіл-2-(2фторфеніл)-етаноном формули (IIIa) і ацилуванням одержаної сполуки формули (IV), причому реакцію виконують у присутності органічної основи з агентом ацилування без виділення сполуки формули (IV). Приєднання і ацилування виконують у присутності тієї ж органічної основи, подібної триетиламіну, N,N-диізопропіл-етиламін або піридину. По завершенні процесу прасугрель формули (I) очищають перекристалізацією з органічного розчинника або суміші розчинників. Детальний опис винаходу Мета даного винаходу - надати економічний, простий спосіб одержання прасугреля формули (I), що не вимагає застосування колонкової хроматографії, що застосовується в промисловому масштабі і забезпечує високі виходи, з застосуванням будь-якої солі 5,6,7,7атетрагідро-4Н-тієно[3,2-с]піридин-2-она формули (II) як вихідної сполуки, переважно сіль птолуолсульфонат, що протікає через утворення проміжної сполуки 5-[2-циклопропіл-1-(2фторфеніл)-2-оксоетил]-5,6,7,7а-тетрагідро-4Н-тієно[3,2-с]піридин-2-она формули (IV). Мета даного винаходу - спосіб одержання прасугреля формули (I) в одній ємності з солі 5,6,7,7а-тетрагідро-4Н-тієно[3,2-с]піридин-2-она формули (II), причому переважна сіль являється п-толуолсульфонат, і що протікає через проміжну сполуку 5-[2-циклопропіл-1-(2фторфеніл)-2-оксоетил]-5,6,7,7а-тетрагідро-4Н-тієно[3,2-с]піридин-2-он формули (IV). Спосіб показаний на реакційній схемі 10. Всі відомі способи являють собою двостадійні способи одержання прасугреля формули (I) з п-толуолсульфонату 5,6,7,7а-тетрагідро-4Н-тієно[3,2-с]піридин-2-она формули (II), де проміжну сполуку 5-[2-циклопропіл-1-(2-фторфеніл)-2-оксоетил]-5,6,7,7а-тетрагідро-4Н-тієно[3,2с]піридин-2-он формули (IV) виділяють. У відомих способах використовується дві різні основи в двох стадіях. У більшості способів при ацилуванні використовується легкозаймистий гідрид натрію. Несподівано було виявлено, що два процеси, повністю відмінних з хімічної точки зору, можна виконувати способом, виконуваним в одній ємності, тим самим спосіб більш економний і вимагає менших витрат в порівнянні з відомими способами. Одержання проміжної сполуки формули (IV) являється складним внаслідок схильності сполуки до кето-енольної таутомерії, а кето-форма утворює діастереомерну суміш, яка складно кристалізується через сумішеву природу. Перевага способу за даним винаходом полягає у збільшені безпеки шляхом заміни гідроксиду натрію будь-якою іншою органічною основою. Несподівано було виявлено, що дві стадії можна виконувати в одному і тому ж органічному розчиннику (ДМФ) та в присутності однієї і тієї ж основи, всупереч тому факту, що використовувана органічна основа істотно більш слабка в порівнянні з гідроксидом натрію. Будь-який третинний амін (наприклад триетиламін, N,N-диізопропіл-етиламін, піридин і т.д.) можна переважно використовувати в якості основи замість раніше використовуваного карбонату калію і гідрокарбонату (в реакції приєднання) а також гідриду натрію (при ацилуванні). Реакційна суміш розділяється між органічним розчинником, який не змішується з водою, і після одержання з органічної фази продукт одержують у вигляді кристалічної сполуки. Кінцевий продукт очищають перекристалізацією з органічного розчинника, без використання колонкової хроматографії. Згідно зі способом за даним винахом, п-толуолсульфонат 5,6,7,7а-тетрагідро-4Н-тієно[3,2с]піридин-2-она формули (II) (НА = п-П-ТСК) і 2-бром-1-циклопропіл-2-(2-фторфеніл)-етанон формули (III) перемішують в органічному розчиннику (переважно в ДМФ, ТГФ, толуолі, ацетонітрилу) при додаванні 1-3 моль еквівалентів, переважно 2-2,5 моль еквівалентів аміну при 20-50°С, переважно при 20-30°С, протягом 1-3, переважно 1-2 годин. Реакційну суміш потім розділяють між водою і етилацетатом, і органічну фазу сушать і упарюють. Продукт, що залишився, розчиняють в органічному розчиннику (переважно в ДМФ, ТГФ, толуолі, ацетонітриле) без виділення кристалічного 5-[2-циклопропіл-1-(2-фторфеніл)-2-оксоетил]5,6,7,7а-тетрагідро-4Н-тієно[3,2-с]піридин-2-она формули (IV). 1-2 еквівалента, переважно 1-1,5 еквівалента аміну і 1-3 еквівалента, переважно 1-2 еквівалента ангідриду оцтової кислоти додають до реакційної суміші і далі перемішують при 20-50°С, переважно при 20-30°С, протягом 0,5-5 годин, переважно 1-3 годин. Реакційну суміш далі розділяють між водою і етилацетатом, і органічну фазу сушать і упарюють. Залишковий продукт перекристалізують з відповідного органічного розчинника (ацетонітрилу, диізопропілового ефіру, етанолу), з суміші органічного розчинника і води, або з суміші відповідних органічних розчинників (толуол-етилацетат, гексанетилацетат). 7 UA 108868 C2 5 10 15 20 25 30 35 40 45 50 55 60 Згідно з іншим варіантом способу за даним винаходом, п-толуолсульфонат 5,6,7,7атетрагідро-4Н-тієно[3,2-с]піридин-2-она формули (II) (НА = п-П-ТСК) і 2-бром-1-циклопропіл-2-(2фторфеніл)-етанон формули (III) перемішують в органічному розчиннику (переважно в ДМФ, ТГФ, толуолі, ацетонітрилі) при додаванні 3-4 моль еквівалентів аміну при 20-50°С, переважно при 20-30°С, протягом 1-3, переважно 1-2 годин, потім 1-3 еквівалента, переважно 1-2 еквівалента ангідриду оцтової кислоти додають в реакційну суміш і її продовжують перемішувати при 20-50°С, переважно при 20-30°С, протягом 0,5-5 годин, переважно 1-3 годин. Реакційну суміш потім розділяють між водою і етилацетатом, і органічну фазу сушать і упарюють. Залишковий продукт перекрісталізують з відповідного органічного розчинника (ацетонітрилу, диізопропілового ефіру, етанолу), з суміші органічного розчинника і води, або з суміші відповідних органічних розчинників (толуол-етилацетат, гексан-етилацетат). Несподівано було виявлено, всупереч очікуванням, що під час перекристалізації прасугреля формули (I) з спирту (наприклад, метанолу, етанолу, 2-пропанолу, переважно етанолу), трансестеріфікація не відбувається, і суміш 5-[2-циклопропіл-1-(2-фторфеніл)-2-оксоетил]-5,6,7,7атетрагідро-4Н-тієно[3,2-с] піридин-2-он формули (IV) і етилацетату не утворюється. Кількість проміжної сполуки (IV) (що містить 0,3-0,5% діастереомерної суміші) складає менше 0,3%, тому чистота кінцевого продукту складає більше 99,80% згідно даним ВЕРХ (високоефективна рідинна хроматографія). Спосіб за даним винаходом забезпечує одержання прасугреля з чистотою 99,80% згідно з даними ВЕРХ, із загальним виходом 45,7% прасугреля формули (I) з використанням вихідної сполуки формули (VII), і 46% прасугреля, обчисленого для проміжної сполуки формули (II). Наведені результати показують, що спосіб за даним винаходом забезпечує істотно більший вихід в порівнянні з відомими способами. Спосіб за цим винаходом готовий для використання в промислових масштабах і не вимагає спеціальних або екстремальних умов (реакції), а також апаратів. У способі за даним винаходом немає необхідності в застосуванні низької температури (-78°С), небезпечних для навколишнього середовища, отруйних, високо корозійних сполук, або великої кількості розчинників, або інших технологій, що ускладнюють збільшення масштабу (таких як колонкової хроматографії). Спосіб за цим винаходом показаний на реакційній схемі 10. Винахід далі пояснюється в Прикладах, що не обмежують обсяг даного винаходу. Приклади Приклад 1 Одержання 5-тритіл-4,5,6,7-тетрагідро-тієно[3,2-с]піридину формули (VI) 3 3 530 см ацетонітрила і 108,0 см (81,8 г; 0,63 моль) N,N-диізопропілетиламіну додали до 52,7 г (0,30 моль) 4,5,6,7-тетрагідро-тієно[3,2-с]піридин гідрохлориду (VII). При перемішуванні до суспензії додали 87,0 г (0,312 моль) тритіл хлориду. Суміш перемішували протягом 3 годин і осаджені кристали відфільтрували. Одержану таким чином проміжну сполуку можна застосовувати в подальших стадіях синтезу без додаткового очищення. Вихід: 108,0 г (94%) безбарвного кристалічного продукту. 1 Н-ЯМР (ДМСО-d6, 500 МГц): 7,46 (6Н, m); 7.31 (6H, m); 7.21 1Н, d, J=5,0 Гц); 7,18 (3H, m); 6,72 (1H, d, J=5,0 Гц); 3,28 (2H, s), 2,94 (2H, m); 2,45 (2H, m). 13 C-NMR (DMSO-d6, 125 MHz): 142,3; 134,6; 132,9; 128,9; 127,8; 126,3; 125,8; 123,0; 76,8; 47,5; 46,7; 25,9. Елементний аналіз [обчислений виходячи з формули С26H23NS (М: 381,54)] Обчислено: С 81,85; Н 6,08; N 3.67; S 8.40 Знайдено: С 81,64; Н 6,19; N 3.65; S 8.31 Приклад 2 Одержання 5-тритил-5,6,7,7а-тетрагідро-4Н-тієно[3,2-с]піридин-2-она формули (V) 3 750 см тетрагідрофурану додали до 95,3 г (0,25 моль) 5-трітил-4,5,6,7-тетрагідро-тієно[3,23 с]піридину (VI). Розчин охолодили до - 40°С і додали по краплях 150 см (0,375 моль) 2,5 М розчину гексану-бутилу-літію в атмосфері аргону. Розчин потім нагріли до +10°С і перемішували протягом 30 хвилин при даній температурі. Розчин далі охолодили до - 40°С і по краплях 3 3 додали розчин 86,2 см (0,375 моль) триізопропіл-бората і 200 см ТГФ. Далі розчин знову нагріли до +10°С і перемішували протягом 1 годин при цій температурі. 3 Розчин потім знову охолодили до - 40°С і повільно по краплях додали 53,75 см 35 мас.% розчину пероксиду водню. Розчин залишили повільно нагріватися до кімнатної температури, далі перемішували протягом 1 години при даній температурі. 3 При перемішуванні і охолодженні додали 300 см води. Фази розділили, органічну фазу сушили над MgSO4 і потім упарили у вакуумі. Залишковий твердий продукт змішали з гептаном. Випадені кристали відфільтрували і промили гексаном. Одержаний таким чином продукт можна використовувати в подальших стадіях синтезу без додаткового очищення 8 UA 108868 C2 5 10 15 20 25 30 35 40 45 50 55 60 Вихід: 91,4 г (92%) безбарвного кристалічного продукту. Тпл.: 194-200°С -1 ІК (КBr, см ): 3442, 3054, 2823, 1681, 1488, 1447, 1096. 1 Н-ЯМР (ДМСО-d6, 500 Гц): 7,46 (6H, m); 7,30 (6H, m); 7,19 (3H, m); 6,07 (1H, s); 4,13 (1H, dd, J=12,1; 2,8 Гц); 3,98 (1H, dd, J=12,1; 6,3 Гц);), 3,34 (1H, dd, J=12,2; 3,2 Гц); 2,40 (1H, m); 2,18 (1H, d, J=12,1 Гц); 2,10 (1H, dd, О=12,2; 3,8 Гц); 1,68 (1H, dt, J=12,1; 1,8 Гц). 13 C-ЯМР (ДМСО-d6, 125 МГц): 199,1; 169,8; 129,0; 127,8; 126,5; 125,7; 77,5; 51,6; 50,7; 47,6; 35,2. Елементний аналіз [обчислений виходячи з формули C26H23NOS (М: 397,54)] Обчислено: С 78,55; Н 5,83; N 3,52; S 8,07 Знайдено: C 78,15; Н 5,50; N 3,31; S 7,70 Приклад 3 Одержання 5,6,7,7а-тетрагідро-4Н-тієно[3,2-с]піридин-2-он толуол-4-сульфонату формули II 3 (НА=п-ТСК) 1300 см тетрагідрофурану додали до 86,7 г (0,218 моль) 5-тритил-5,6,7,7атетрагідро-4Н-тієно[3,2-с]піридин-2-ону (V), а також при інтенсивному перемішуванні додали 41,5 г (0,218 моль) толуол-4-сульфонат-моногідрат. Реакційну суміш перемішували протягом 2 годин при кімнатній температурі. Реакційну суміш охолоджували у крижаній бані до 0-5°С, перемішували протягом 3-4 годин, фільтрували і промивали тетрагідрофурані. Одержаний таким чином продукт можна застосовувати в наступних стадіях синтезу без додаткового очищення. Вихід: 68,2 г (96%) безбарвного, кристалічного продукту. Тпл.: 198-200°С -1 ІК (KBr, см ): 3441, 3015, 2827, 1697, 1591, 1446, 1203, 1164, 1123, 1032, 1008. 1 H-ЯМР (ДМСО-d6, 500 МГц): 9,30 (1H, bs); 8,98 (1H, bs); 7,53 (2H, d, J=8,1 Гц); 7,14 (2H, d, J=8,1 Гц); 6,45 (1H, t, J=1,5 Гц); 4,74 (1H, dd, J=12,1; 5.3 Гц); 4,40 (1H, d, J=13.9 Гц); 4,01 (1H, d, J=13.7 Гц); 3,46 (1H, d, J=1 1,5 Hz); 3,28 (1H, t, J=13,0 Гц); 2,59 (1H, m); 2,39 (3H, s); 1,88 (1H, m). 13 C-NMR (ДМСО-d6, 125 МГц): 197,4; 163,9; 144,9; 138,5; 129,3; 128,5; 125,6; 47,7; 44,0; 42,6; 30,8,21,0. Елементний аналіз [обчислений виходячи з формули C14H17NO4S2 (М: 327,42)] Обчислено: С 51,36; Н 5,23; N 4,28; S 19,59 Знайдено: C 51,17; Н 5,25; N 4,13; S 19,63 Приклад 4 Одержання 2-ацетоксі-5-(2-фтор--циклопропіл-карбоніл-бензил)-4,5,6,7-тетрагідро-4Нтієно[3,2-с]піридину (прасугрель, I) 3 160 см ДМФ додали до 65,5 г (0,2 моль) 5,6,7,7а-тетрагідро-4Н-тієно[3,2-с]піридин-2-он 3 пара-толуолсульфоната (II, Ha=п-П-ТСК). До розчину додали 75,3 см (56,9 г; 0,44 моль) N,Nдиізопропілетиламін (ДІПЕА), далі протягом близько 30 хвилин по краплях додавали 55,4 г 2бром-1-циклопропіл-2-(2-фторфеніл)-етанон (III) (з вмістом основної речовини 92,8%), 3 розчиненого в 94 см (88,7 г) діметилформаміду. Суміш перемішували протягом 1 години при кімнатній температурі. 3 До реакційної суміші додали 37,65 см (28,43 г, 0,22 моль) ДІПЕА, потім при інтенсивному 3 перемішуванні по краплях додали 28,4 см (30,6 г: 0,30 моль) ангідриду оцтової кислоти. Суміш перемішували протягом 1 години при кімнатній температурі. Реакційну суміш влили в суміш крижаної води і етилацетату. Фази розділили, водну фазу екстрагували етилацетатом. Об'єднані органічні фази сушили над MgSO4. Розчинник упарили в вакуумі, потім до залишкового продукту додали етанол. Після охолодження до 0-5°С кристали, що випали в осад відфільтрували, промили етанолом. Вихід склав 44,7 г (60,0%) неочищеної основи прасугреля. Неочищений продукт кристалізували з 5 кратного обсягу етанолу. Вихід: 41,1 г (55,0%) безбарвного кристалічного продукту, чистота за ВЕРХ більше 99,8%. Вихід для повного способу синтезу, обчислений для 4,5,6,7-тетрагідро-тієно[3,2-с]піридин гідрохлорида формули (VII) склав 45,7%. Тпл.: 120-121°С -1 ІК (KBr, см ): 3388, 2920, 2767, 1758, 1704, 1586, 1488, 1369, 1217, 1194, 1127, 1011. 1 Н-ЯМР (CDCl3, 500 Мгц): 7,47 (1H, td, J= 7,5; 1,8Гц); 7,30 (1H, m); 7,16 (1H, td, J= 7,5; 1,1 Гц); 7,10 (1H, td, J=8,2; 1,1 Гц); 6,26 (1H, s); 4,82 (1H, s); 3,56 (1H, d, J=14,3 Гц); 3,48 (1H, d, J=14,3 Гц); 2,90 (1H, m); 2,78 (3H, m); 2,28 (1H, m); 2,23 (3H, s); 1,05 (1H, m); 1,00 (1H, m); 0,84 (2H, m). 13 C-ЯМР (CDCI3, 125 Гц): 207,4; 167,5; 161,1; 149,4; 130,4; 129,7; 129,3; 125,6; 124,2; 122,0; 115,6; 112,8; 71,5; 50,3; 48,3,24,9; 20,4; 18,1,11,8,11,3. Елементний аналіз [обчислений виходячи з формули C20H20FNO3S (М: 373,45)] Обчислено: С 64,33; Н 5,40; N 3,75; S 8,59 9 UA 108868 C2 Знайдено: C 64,18; Н 5,50; N 3,69; S 8, 75 ФОРМУЛА ВИНАХОДУ 5 10 15 1. Спосіб одержання 2-ацетокси-5-(2-фтор--циклопропілкарбонілбензил)-4,5,6,7-тетрагідро-4Нтієно[3,2-с]піридину (прасугрелю) формули (І) шляхом взаємодії 5,6,7,7а-тетрагідро-4Нтієно[3,2-с]піридин-2-ону формули (II) з 2-бром-1-циклопропіл-2-(2-фторфеніл)етаноном формули (III) або з 2-хлор-1-циклопропіл-2-(2-фторфеніл)етаноном формули (ІIIа) і ацилування одержаної сполуки 5-[2-циклопропіл-1-(2-фторфеніл)-2-оксоетил]-5,6,7,7а-тетрагідро-4Нтієно[3,2-с]піридин-2-ону формули (IV) в присутності органічної основи і агента ацилування, причому реакцію виконують в одній ємності, без виділення сполуки формули (IV). 2. Спосіб за п. 1, який відрізняється тим, що реакції приєднання і ацилування виконують у присутності однієї і тієї ж органічної основи. 3. Спосіб за п. 1 або 2, який відрізняється тим, що органічною основою є триетиламін, N,Nдіізопропілетиламін або піридин. 4. Спосіб за п. 1, який відрізняється тим, що прасугрель формули (І) очищають шляхом перекристалізації з органічного розчинника або суміші розчинників. 5. Спосіб за п. 4, який відрізняється тим, що як органічний розчинник використовують етанол. 10 UA 108868 C2 11 UA 108868 C2 12 UA 108868 C2 13 UA 108868 C2 Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 14
ДивитисяДодаткова інформація
Назва патенту англійськоюImproved process for preparing a pharmaceutical compound
Автори англійськоюPorcs-Makkay, Marta, Gregor, Tamas, Volk, Balazs, Nemeth, Gabor, Barkoczy, Jozsef, Nyulasi, Balint, Mezei, Tibor, Ruzsics, Gyorgy, Pandur, Angela, Szilagyi, Erika, Nagy, Kalman, Slegel, Peter, Molnar, Eniko, Debreczeni, Jozsef
Автори російськоюПорч-Маккаи Марта, Грегор Тамаш, Волк Балаж, Немет Габор, Баркоци Йожеф, Ньюлаши Балинт, Мезеи Тибор, Ружич Дьйордь, Пандур Ангела, Силадьи Эрика, Надь Кальман, Шлегель Петер, Мольнар Енькьйо, Дебрецени Йожеф
МПК / Мітки
МПК: C07D 495/04
Мітки: спосіб, піридину, одержання, 2-ацетокси-5-(2-фтор-альфа-циклопропілкарбонілбензил)-4,5,6,7-тетрагідро-4н-тієно[3,2-с
Код посилання
<a href="https://ua.patents.su/16-108868-sposib-oderzhannya-2-acetoksi-5-2-ftor-alfa-ciklopropilkarbonilbenzil-4567-tetragidro-4n-tiehno32-s-piridinu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 2-ацетокси-5-(2-фтор-альфа-циклопропілкарбонілбензил)-4,5,6,7-тетрагідро-4н-тієно[3,2-с] піридину</a>
Попередній патент: Похідні азолу, спосіб їх одержання (варіанти), проміжні продукти, засіб для сільського господарства і садівництва
Наступний патент: Шихта для виготовлення карбідкремнієвих виробів на глиноземовмісній зв’язці
Випадковий патент: Спосіб відбору пацієнтів для проведення реваскуляризаційних процедур після перенесеного інфаркту міокарда