Спосіб отримання похідних n-нафтоілгліцину
Номер патенту: 3590
Опубліковано: 27.12.1994
Автори: Франгеско Белліні, Недумпарамбіл Абрахам Абрахам, Леслі Джордж Хамбер, Аді Трежарівала, Казімір Сестан
Формула / Реферат
Способ получения производных N-нафтоилглицина общей формулы
где r1 - водород, низший алкил, 2-пропенил, фенилметил; R2 - водород, метил; R3 - водород, 4-бром, 4-хлор, 6-метоксигруппа, 5-галоген, 5-трифторметил, 5-цианогруппа, 5-С1-С3-алкил, 5-метоксигруппа; R4 и r5- водород или R3 и R4 — заместители нафталинного кольца, находящиеся в разных положениях и представляющие собой 4,6-диметоксигруппу, 5 - бром -6-метил, 5-иод-6-низший алкоксил, 5-бром-6-низшийалкоксил, 5,7-дихлор, 5-трифторметил-6-метоксигруппа, 5-(трифторметилтио) -6-метоксигруппа, 5-бром - 6 - метоксигруппа, 5 - бром - 6 - мегоксипропоксигруппа, 5 - бром - 6 - (трифтор- метилфенилметокси) группа; R5 - водород; R3 - 4-метоксигруппа; R4 - 5-трифторметил; R5 - 6-метоксигруппа, отличающийся тем, что амидоэфир общей формулы
где R1, R3, R4, R5 имеют указанные значения; R2 - метил, подвергают взаимодействию с 2-5 молярными эквивалентами пентасульфида фосфора в среде безводного инертного растворителя при 80-150 0С и полученный при этом продукт выделяют или подвергают щелочному гидролизу при 20-100 °С.
Текст
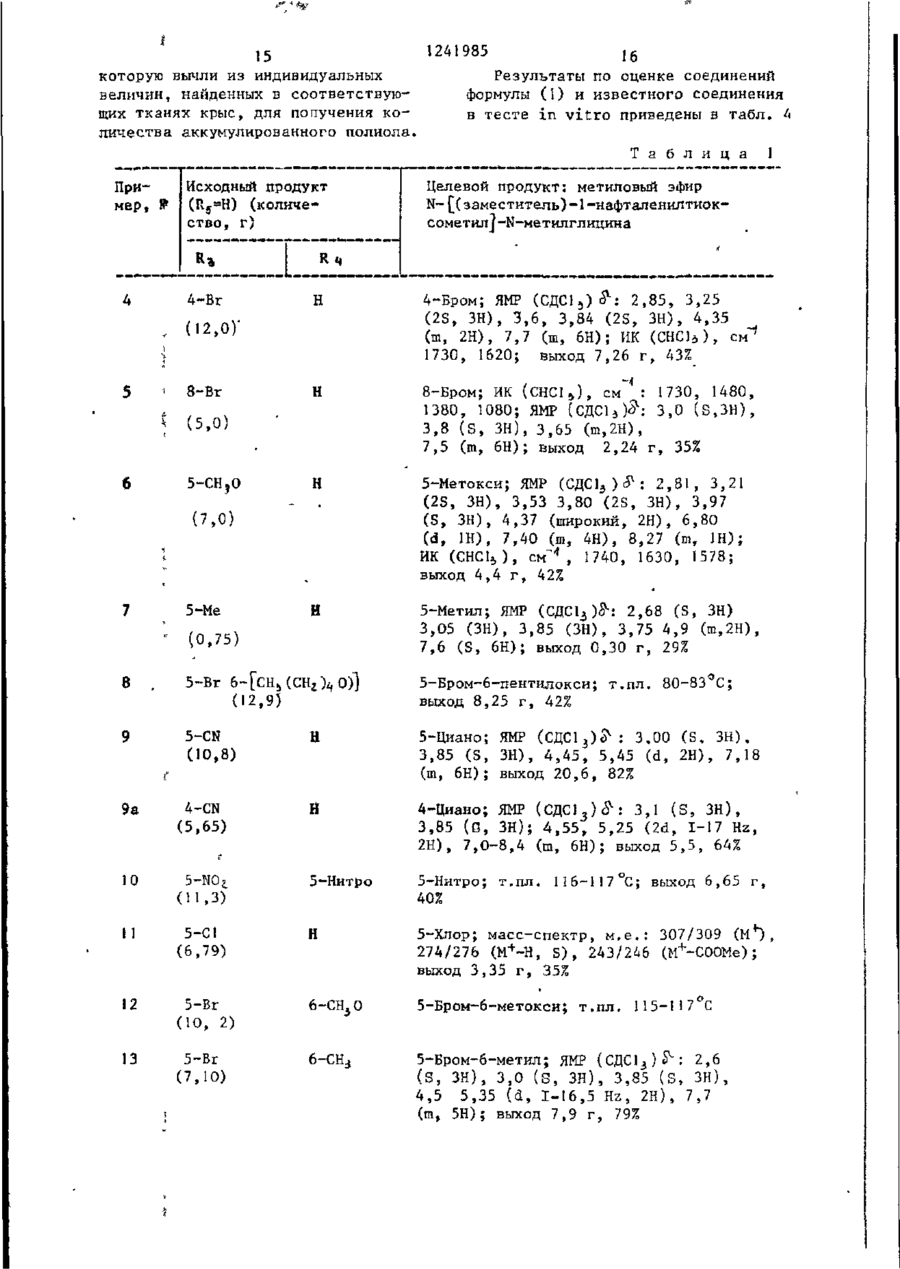
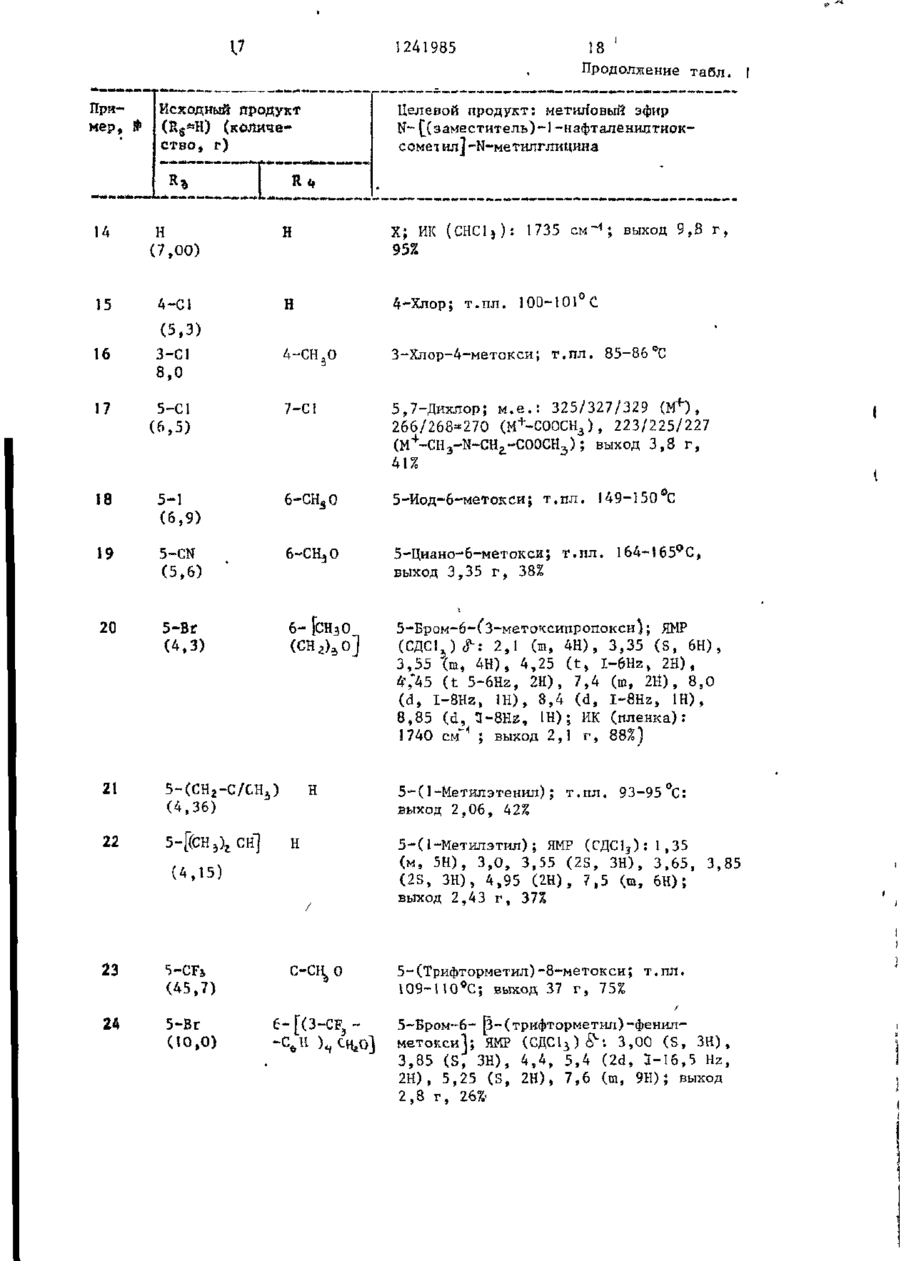
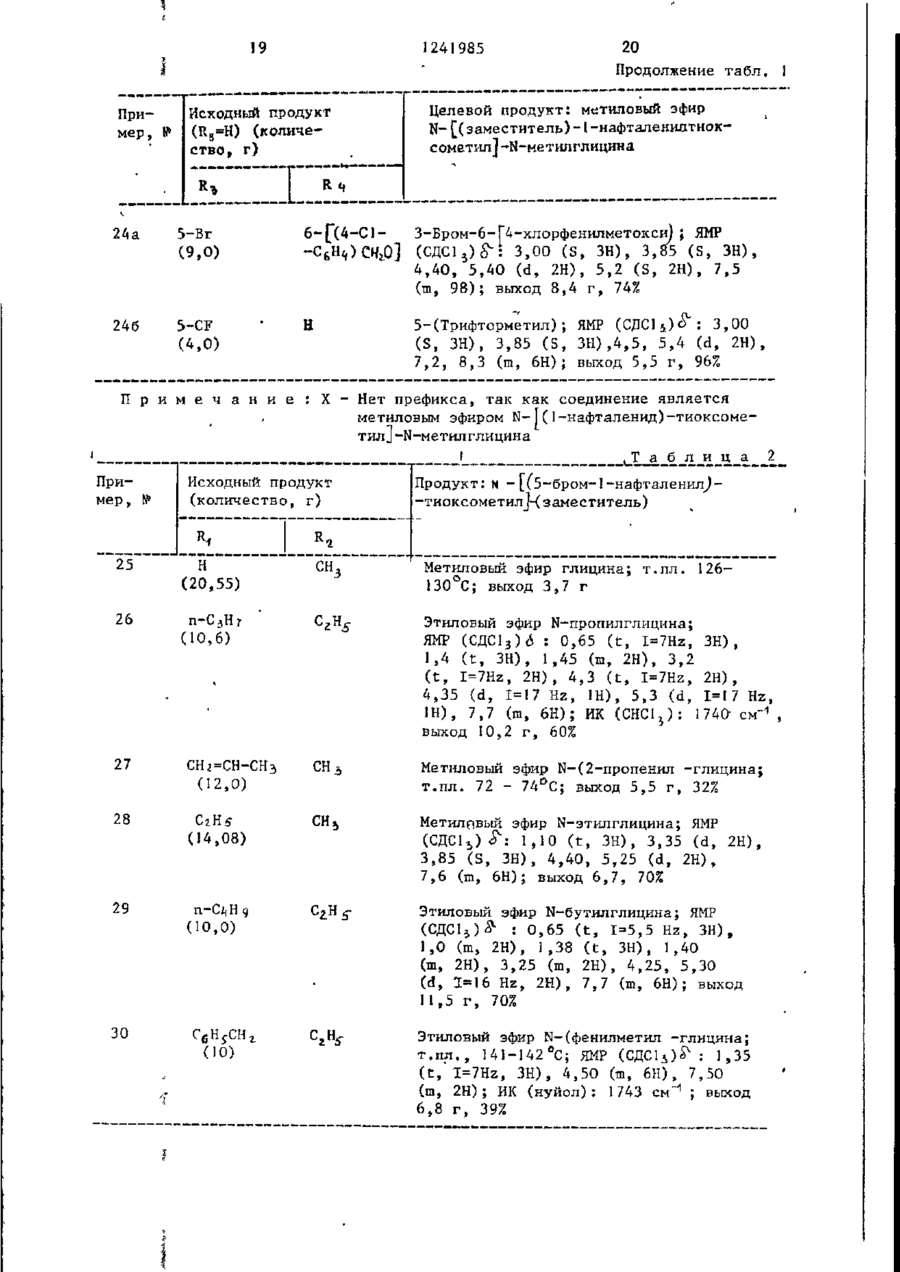
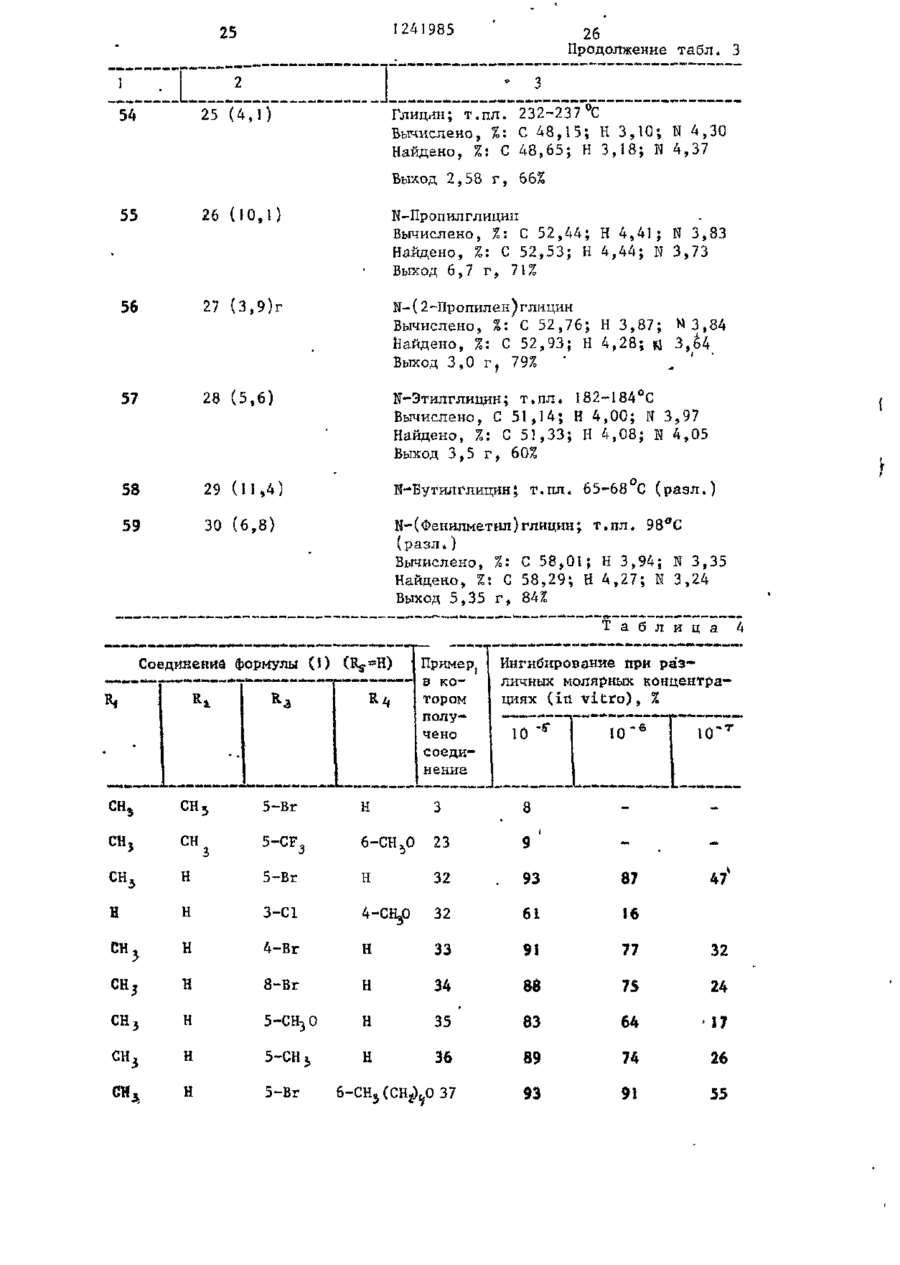
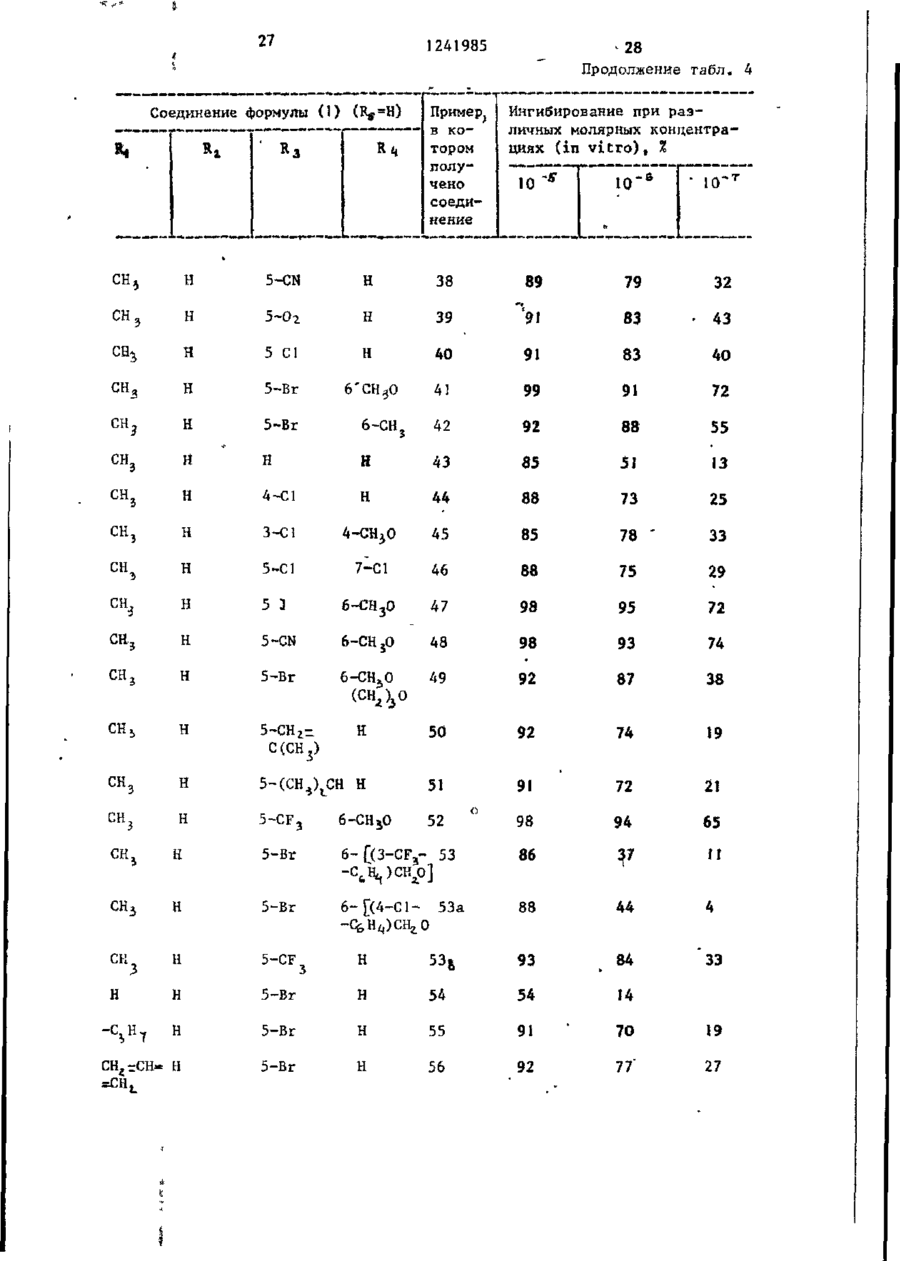
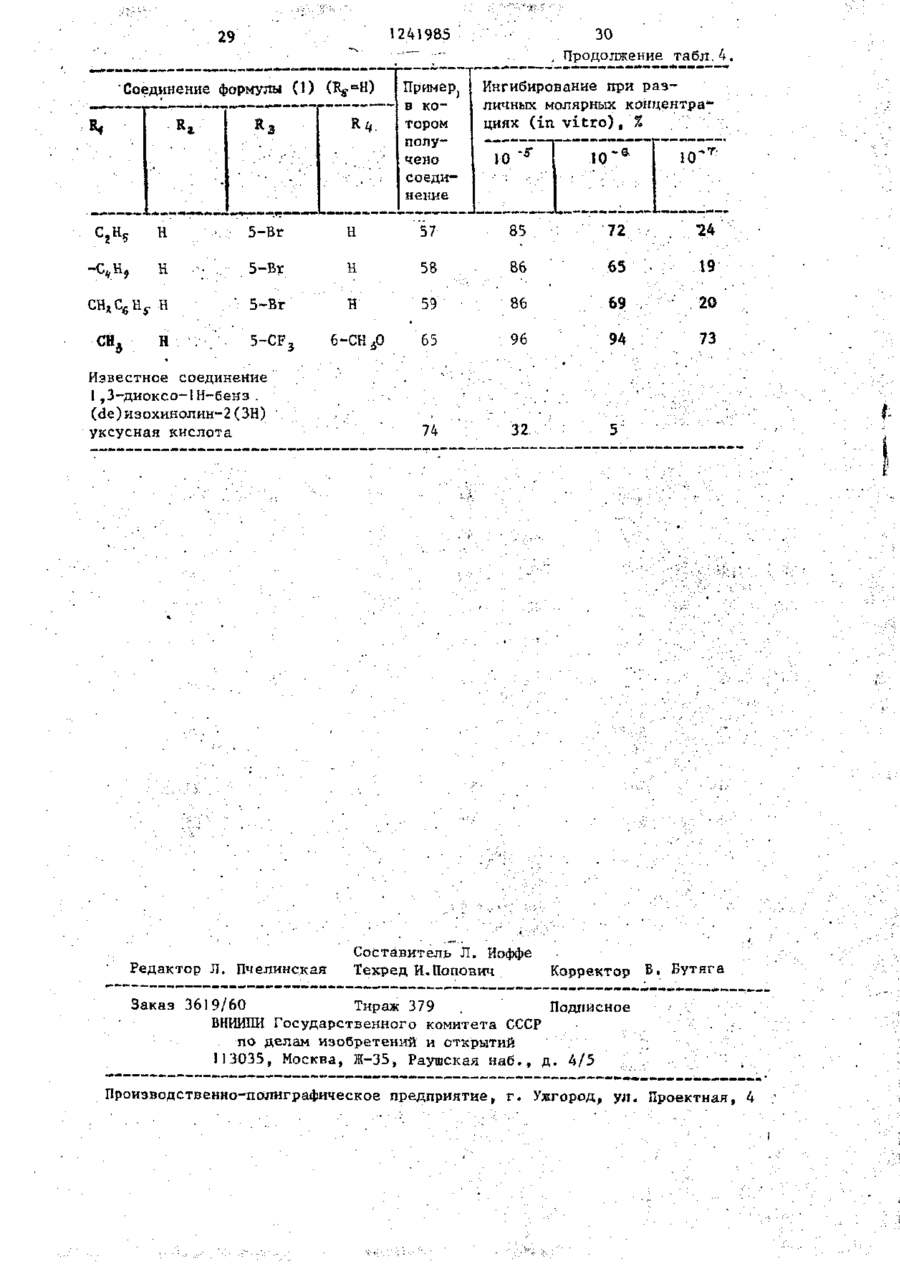
СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ N-ІІАФТОИЛГЛИДИНА общей формулы где R, - водород, низший алкил, 2-пропенил, фенилметил; R t - водород, метил; R, - водород, 4-бром, 4-хлор, 6-метоксигруппа, 5-галоген, 5-трифторметил, 5-цианогруппа, 5-С^ — C j алкил, 5-метоксигруппа; R , и Rg- - водород ; или R 3 и Rij - заместители нафталинч ного кольца, находящиеся в разных положениях и представляющие собой 4,6диметоксигруппу, 5-бром-6-метил, 5-иод-6~низший алкоксил, 5-бром-б-низший алкоксил, 5,7-дихлор, 5-трифторметил-6-метоксигруппа, 5-(трифторметилтио)-6-метоксигруппа, 5-бром-6-метоксигруппа, 5-бром-6~метоксипропоксигруппа, 5-бром~6-(трифторметилфенилметокси)группа; Ъ-5 - водород; К 3 - 4-метоксигрупяа', Ял - 5~трифторметіш; R f " 6-метоксигруппа, о т л и ч а ю щ и й с я тем, что амидоэфир общей формулы о O=C--N(Bi)-CH2.COOR2 где R^ , R^, RZj, R^ имеют указанные значения; R 2 - метил, подвергают взаимодействию с 2-5 молярными эквивалентами пентасульфида фосфора в среде безводного инертного растворителя при 80-150 С и полученный при этом продукт выделяют или подвергают щелочному гидролизу при 20-100 °С. П р и о р и т е т по п р и з н а к а м : 02.03.8] при всех значениях радикалов, оговоренных в формуле изобретения, кроме случая, когда Rij и R^ 5-(трифторметилтио)-6-метоксигруппа. 15.10.81 при R 3 и Rx, - 5-(трифторметилтно)-6-метоксигруппа. 1 124198-5 мывные воды объединяют и подкисляют Изобретение относится к производ(рН 3) 6 н. водным НС1. Полученный ным N-нафтоилглицина, обладающим гитвердый продукт объединяют, промыпогликемическим действием, поскольку они являются эффективными ингибитовают водой и сушат. рами альдоза - редуктазы. Соединения Получают 9,7 г (80%) целевого в соответствии с предлагаемым спососоединения, т.пл. 138-140 С. бом имеют следующую структурную форП р и м е р 1а. 5-(1-Метилэтил)мулу -1-нафталинкарбоновая кислота,Гидрируют 4,36 г 5-(1-метилэте]0 нил)-1-нафталинкарбоновой кислоты по примеру 1, растворенной в 150 мл этанола, используя в качестве катагде R, - водород, низший алкил, 2лизатора 5%-ный палладий на угле, -пропеиил, фенилметил; при 20-°С. Поглощение водорода заканt5 -R^ - водород, метил; чивается через 3 ч. Катализатор R 5 - водород, 4-бром, 4-хлор, отфильтровывают. Фильтрат выпари6-метоксигруппа, 5-галоген, 5-тривают. фторметил, '5-цианогруппа, 5-нитрогруппа, 5-алкил-С>1-Сі, 5-метоксигруппа; Кц H R J - водород или R 3 и Ri( - заместители нафталинного кольца, находящиеся в разных положениях и представляющие собой 4,6-диметоксигруппу, 5-бром-6-метил, 5-иод-6-низший алкоксил, 5-бром-6-низший алкоксил, 5,7-дихлор, Получают 4,15 г (94%) целевого соединения, т.пл. 3 48-150°С. 20 П р и м е р 16. 5-Бром-6-метокси~1-нафталинкарбоновая кислота. Раствор 2,49 мл (45 моль) брома в 50 мл ледяной уксусной кислоты 25 прибавляют по каплям к перемешиваемому раствору 8,9 г (44 ммоль) 6-метокси-1-нафталинкарбоновой кислоты в 300 мл ледяной уксусной кислоты на ледяной бане. Полученный осадок со5-(трифторметилтио)-6-метоксигруппа, бирают, промывают уксусной кислотой, 5-бром-6-метоксигруппа,-5-бром-630 а затем водой и перекристаллизовыва-метоксипропоксигруппа, 5-бром~6ют из ледяной уксусной кислоты. -(трифторметилфенилметокси)группа; R5 - водород; Получают 9,7 г (79%) целевого Rj - 4-метоксигруппа, соединения. Rif - 5-трифторметил; • П р и м е р 1в. 5-Бром-6-метил-135 _т Rf - 6-метоксигрупла. -нафталинкарбоновая кислота. Цель изобретения - получение ноПроцесс ведут по примеру 16, однавых производных N-нафтоилглицина, кр используют 10 г 6-метил-1-нафтаобладающих повышенной гипогликемилинкарбоновой кислоты и 2,9 мл брома. ческой активностью. После кристаллизации из смеси П р и м е р 1. 5-(1-Метилэтенил)-этанол-метанол (3:1)получают 7,2 г -1-нафталинкарбоновая кислота. (50%) целевого соединения, т.пл. Раствор 1-бром~5-(1-метилэтилен)253-255°С, ЯМР (ДМСО - d 9 ) ; 2, 6 -нафталина (14,21 г) в 140 мл диэти(S, З Н ) ; 8,0 (m, 5H); 10,5( широлового эфира прибавляют по каплям кий 1Н) . 45 в атмосфере азота к смеси этилмагП р и м е р 1г. З-Хлор-4-метоксинийбромида (приготовленного из -1-нафталинкарбоновая кислота. 2,94 г магния и 4,29 мл этилбромида) 15,5 г (70,2 ммоль) З-хлор-4-метв 30 мл диэтилового эфира при О °С. окси-1-нафталинкарбоксальдегида приСмесь перемешивают при 20 С в течебавляют к суспензии окиси серебра ние 18 ч, а затем кипятят с обратным 5 0 в 10%-ной гидроокиси натрия (16,9 г холодильником в течение 1 ч. Охлажгидроокиси натрия в 170 мл воды) и денный раствор выливают в избыток 100 мл диоксана. Смесь перемешивают твердой двуокиси углерода. Смесь и нагревают 7 ч при 80 С. Осадок растворяют в диэтиловом эфире. Поудаляют фильтрованием через диатоми55 лученный раствор промывают 2 н.водтовую землю. Прозрачный фильтрат выным раствором серной кислоты, рассопаривают досуха. Остаток растворяют лом и 10%-ным водным раствором бив воде. Раствор подкисляют. Полученкарбоната натрия (4х), Основные проный осадок отфильтровывают и раство З 124 985 4 -2-(1Н)-он) целевого соединения, рягат в этилацетате. Полученный растт.пл. 253-254 °С. вор экстрагируют насыщенным раствором бикарбоната натрия. Объединенные П р и м е р 1е. 5-Иод~6-метоксиводные экстракты подкисляют. Полу. -1-нафталиикарбоновая кислота. ченный осадок отфильтровывают и пе7,08 г иода и 2,78 г йодной кисрекристаллизовывают из этанола лоты прибавляют к перемешиваемому 'воды.' раствору 15 г (69,4 ммоль) метилового эфира 6-метокси-1-нафталинкарбоПолучают 7,3 г (44%) целевого новой кислоты в 110 мл 80%-ной уксоединения, т.ил. 187-189°С. сусной кислоты и 0,97 мл 98%-ной П р и м е р 1д. 5,7-Дихлор-!-наф- 1 серной кислоты. Раствор нагревают талинкарбонова'я кислота. при 50 С в течение 5 ч, охлаждают 36,8 г (278 ммоль) сульфурилхлои выливают в 100 мл воды. После рида прибавляют по каплям к перемедобавления бисульфита натрия для разшиваемой суспензии 20 г (119 ммоль) ложения непрореагировавшего иода собенз (с,чрз глицина получают мешивают в течение 1 ч при 20 С, 5,1 г (51%) этилового эфира N-[(3затем охлаждают до 0 С. К охлажден-хлор-4-меточси-і-нафталенил -тиоксоной смеси прибавляют 7,25 г (52 ммоль/ метчл]-глицина (ИК{СНСJ^), см" хлоргидрата метиловor о эфира N-мєтил 1241985 10 3420; 3340; 1740; 1665) через этисушат над сульфатом магния, фильтловый эфир К-[(3-хлор-4-метокси-1руют и выпаривают досуха. Остаток -нафталенил)-карбонил]-глицина, кристаллизуют из этанола - воды. т . п л . 140-141°С. Получают 3,25 г (92%) целевого с о е динения, т . п л . 205 С. И р и м е р 32. W- [(5-Бром-1-нафталечил)~тиоксометил~]-Н-метііл глицин Аналогично, используя метиловый ( I , Rj =CHj ; R^,, RA И Rr-^H и R =5~Br) эфир її-[[5-(трифтррметил)-6-метокси25 мл I H.водного раствора гидро-1-наЛталеиил]-карбонил(-W-метилглиокиси натрия прибавляют к суспензии циїїа по примеру 2, получают И- [\з7,3 г (20,7 ммоль} метилового эфира 10 -(трифторметил)-б-метокси-і-нафталеN-L(5-6poM-l-нафталенил)-тиоксоменил]-карбонил] -И-метилглицин. тил] -N-метилглицина по примеру 3 Выход 77% (440 мг), т.пл. 174в 75 мл метанола. Смесь перемешивают 175 °С. при 20-22 °С в течение 2,5 ч , нейтраП р и м е р 61. 4,6-Диметокси-ілизуют до рН 7 водной соляной к и с 15 нафталинкарбоновая кислота (Rj ~ лотой и концентрируют при пониженном и Rf=H). =4-СН ь О Р,=6-СН,0 . - 5 ^ э_ давлении для удаления метанола. ОсПоток газообразного хлора пропустаточный раствор подкисляют до рН 2, кают через охлажденный раствор добавляя водную соляную кислоту, и 17,28 г (0,432 моль) гидроокиси экстрагируют этилацетатом. Экстракт натрия в 24 мл воды, содержащей сушат над сульфатом магния и выпари- 20 100 г льда, до тех пор, пока раствают досуха. Остаток кристаллизуют вор не поглотит 12,7 г (0,18 моль) из эгилацетата - г е к с а н а . хлора. К раствору хлора прибавляют 9,2 г (0,04 моль) твердого 4,6~диПолучают 5,3 г (85%) целевого с о е метокси-!-нафталенил -этанола при динения, т . п л . 181°С. 25 20-22°С. Смесь перемешивают при Аналогично, используя вместо ме65 °С в течение 1 ч, охлаждают на тилового эфира N-[(5-6poM-l-нафталеледяной бане и обрабатывают 5 г бинил) -тирксометил_)-Н-метилглицина сульфита натрия в 20 мл воды. Смесь (5,1 г) этиловый эфир N - Ц З - х л о р нейтрализуют добавлением разбавлен-4-метокси-1-нафталенил)-тиоксоме30 ной соляной кислоты. Полученный осатил]-глицина по примеру 3 1 , получают док собирают, промывают водой, суН-[(3~хлор-4~метокси-1-нафталенил)шат над ?±05 и перекристаллизовыва-тиоксометил]-глицин. Выход 0,8 г ют из метанола. (17%), т . п л . 217°С. Вычислено, %: С 5 4 , 2 8 ; Н 3 , 9 1 ; N 4,52 Найдено, %: С 5 4 , 2 6 ; Н 4,06; N 4,62 Аналогично примеру 32 получают соответствующие соединения формулы ( ї ) , представленные в табл. 3 (R 2 - низший алкил). 35 40 П р и м е р 60. Н- [(5-Бром-1-нафталенил)-N-метилглицин] (R =СНо, 45 R 3 =5-Br и Лц и R 5 =H). В 50 мл метанола суспендируют 3,7 г (11,0 ммоль) метилового эфира N- [_(5-бром-1 -нафталенил) -карбонил]-И-метилглицина по примеру 2. К этой 50 суспензии прибавляют 13,2 мл 1 н . р а с твора в воде гидроокиси натрия. Смесь перемешивают при 20-22°С в течение 1,5 ч. Смесь нейтрализуют водной с о ляной кислотой и концентрируют при 55 пониженном давлении для удаления метанола. Остаточный раствор подкисляют водной соляной кислотой и экстрагируют этилацетатом. Экстракт Получают 7,0 г (76%) 2,6-диметокси-1-нафталиикарбоновой кислоты, т-.пл. 227-229°С. Вычислено, %: С 67,23; Н 5,21; ' Найдено, %: С 67,15; Н 5,23 ЇЇ р и м е р 62. А,6-Диметокси-5-(трифторчетил)-1-нафталинкарбоновая кислота (R3=4-CtL0; R/,=CFU R = =б-сн 3 о). 98,5 г (0,425 моль) 4,6-диметокси-1-нафталинкарбоновои кислоты по примеру 61 прибавляют к охлажденному льдом раствору 59,5 г (0,5 моль) SOCl^ в 225 мл безводного метанола. Смесь кипятят с обратный холодильником в течение 1 8 ч . Прибавляют другую порцию (35,5 мл) S O C ^ и продолжают кипятить с обратным холодильником еще 7 ч . Смесь экстрагируют диэтиловым эфиром. Эфирный экстракт промывают водой, затем водным раствором бикарбоната натрия, сушат над сульфатом натрия и выпаривают досуха. 1! ! 241985 12 Твердый остаток кристаллизуют из 10 мин. Полученный прозрачный раст720 ил метанола. вор охлаждают на ледяной бане и подкисляют 2 н. водной соляной кисПолучают 64,5 г (61%) метилового лотой до рН 3. Осадок собирают, проэфира 4,б-диметокси-1-нафталинкарбомывают водой и сушат над Р^О^-. новой кислоты, т.пл, 102-304°С. Получают 2,7 г С 100%) целевого 4,93 г (0,02 моль) этого соеди1 соединения, м.е. 300 ( М ) . нения суспендируют в 20%-нои (объем/ объем) водной уксусной кислоте и П р и м е р 63. 5-(Трифторметил0,279 мл концентрированной серной тио)-6-метокси-і-нафталинкарбоновая кислоты. Смесь перемешивают и нагре- 10 кислота (R^-5-CF^S; R^=6-CH 0 и R^= вают при 60 С. К смеси прибавляют =Н). 2 г (0,008 моль) иода и 2,76 г Нагревают гомогенную смесь 1,84 г (0,012 моль) периодной кислоты. Ре(29 ммоль) медного порошка и акционную смесь перемешивают 1 ч при 3,27 г ' (8 ммоль) И (FJ>)^ при 80этой же температуре, охлаждают, вы100 °С в течение 2,5 ч. После этого 15 ливают в воду и экстрагируют хлороповышают температуру до 150 С в теформом. Хлороформный экстракт промычение 30 мин. Спесь, содержащую вают водным раствором бисульфита CuSCF 5 , охлаждают до комнатной темнатрия;промывают водой и сушат над пературы примерно 22-24°С . К смесульфатом натрия. Хлороформный экстси прибавляют раствор 1,87 г ракт выливают в колонку с 250 г сили- 20 (5,4 ммоль) метилового эфира 5-иодкагеля (приготовленного с 10% (объем/ -б-метокси-1-нафталинкарбоновой объем) этилацетата с гексаном). Кокислоты по примеру 1е в 10 мл перелонку элюируют 1,5 л той же системы гнанного ДМФ. Полученную смесь перастворителей, а затем 20% (объем/ ремешивают при 110-120 С в течение объем ) этилацетата в гексане. Объе- 25 3 ч, затем 18 ч при комнатной темдиняют соответствующие фракции и пературе. Смесь выливают в воду. получают 1,4 г 80% чистого метиловоРазбавленную смесь экстрагируют го эфира 5~иод-4,6-диметокси-1-наф3 раза диэтиловым эфиром. Экстракт талинкарбоновой кислоты. Чистое соепромывают водой, сушат над сульфатом 30 магния и выпаривают досуха. динение (1,04 г, 14%, т.пл. 120122°С) получают при перекристаллизаПолучают 1,7 г (99%) соответствуции из этилацетата - гексана. ющего метилового эфира целевого соединения в виде твердого остатка, Смесь 7,1 г ( 0,019 моль) этого т.пл. 93-94°С. соединения, 4,5 г свежеприготовлен35 Смешивают 2,45 г (7,7 ммоль) этоного порошка меди, 8,5 г трифтормего сложного эфира, растворенного в тилиодида 0,43 моль и 35 мл сухого G0 мл 2-метоксиэтанола, с 15,5 мл пиридина нагревают в течение 20 ч 1 н.водного раствора гидроокиси натпри 120°С в автоклаве. После охлажрия. Полученный раствор перемешидения до 22-24 °С смесь обрабатывают вают при комнатной температуре в тетолуолом. Толуольную суспензию фильтчение 24 ч, охлаждают на ледяной руют. Фильтрат выпаривают досуха при бане, подкисляют до рН 3 добавляя пониженном давлении. Остаток раст1 н. соляную кислоту, и разбавляют воряют в хлороформе. Отфильтровывают водой. Собирают полученный твердый из хлороформного раствора нераствори45 продукт, промывают водой и кристалмый материал. Фильтрат пропускают челизуют из этанола. рез колонку с 75 г силикагеля, коПолучают 1,7 г (74%) целевого лонку элюируют хлороформом. Чистые соединения, т.ил, 204-205 С. фракции объединяют и кристаллизуют П р и м е р 64. Аналогично примеиз смеси этилацетата и гексана. 50 рам 2 и 3, используя 8,6 г 4,6-диПолучают 2,83 г (47%) метиловометокси-1-нафталинкарбоновой кислоты го эфира 4 ,6-диметокси-5-'(трифторпо примеру 6І, получают метилошлй метил)-1-нафталинкарбоновой кислоэфир Й- [(4,6~диметокси-1-нафталеты, т,пл. 120-123 С. нил)-тиоксометил]-М-метилглицииа Суспензию 2,83 г (0,009 моль) 55 (R, и R =CH ; R =4-CH O; fy-6-CHjO ' этого соединения в 16,2 мл метанола t 5 3 5 и R =H), т.пл. 1О5-!О7°С, выход и 5,4 мл 4 н.водного раствора гид6,9 г (56% для двух стадий), через роокиси натрия кипятят с обратным метиловый эфир її- [.(4,6--диметоксихолодильником в азоте в течение . i 14 . 13 • 1241 985 -диметокси-5-(трифторметил)-1-нафта- 1-нафталенил) ~карбонил]-Н.-метилглиленил] -тиоксометилV-N-метилглицин. цин. Вычислено, %: С 52,70; Н 4,16; •Используя 5,4 г 6-метокси-1-наф- • талинкарбоновой кислоты, получают • • N 3,61 метиловый эфир N-[(б-метокси-1-нафНайдено, %: О 52,83; Н 4,46; талєнил) -тиоксометил!-N-метилглицина N 3,57. (Rfl и R2_=CH3; Ку=6-метокси; R 4 и К^.Из 1,55 г 'метилового эфира N=Н), ЯМР (СДС1 3 )^ : 3,02 (S, ЗН) , -(4,б-диметокси-5-трифторметил-1 3,86 (S, ЗН), 3,89 (S, ЗН), 4,53 и -иафталеиил)~тиоксометил-Ы-метил4,35 (d, J=I7 Hz, 2H), 6,90-8,10 глицина получают 0,6 г (51%) ЇЇ10 (m, 6Н), выход 6,2 г (76% для двух ~ ||5-(трифторметилтио)-6-метоксистадий) , ч е р е з метиловый- эфир N~1-нафталенил]-тиоксометил!-її-метилглицин, Г..ПЛ. 168— 169°С . - [(6-метокси-1-нафталенил)-карбонил]Эксперименты по выявлению способ-N-метилглицина. ности соединений формулы (JJ ингибиПри использовании 2,7 г 4,6-ди15 ровать альдоза-редуктазу и испольметокси-5-(трифторметил)-1-иафт ал инзованию их для предотвращения, сникарбоновой кислоты по примеру 62' жения и облегчения диабетических осполучают метиловый эфир N- [ ( 4 , 6 ложнений проводили с использованием -диметокси-5-трифторметил)-1-нафтагалактоземических крыс. , ленил j-тиоксометил] -N-метилглицина 20 (R,, и R^=CH3O; R 3 =4-CH 3 0; R ^ 5 - C F 3 ; • Использовали четыре группы из шесR y =6-CH 3 ), ЯМР (СДС13) с^:3,0 (S, ЗН), ти самцов крыс весом 50-70 г вида 3,7 (S, ЗН), 3,85 (S, ЗН), 3,95 (S, Спраге-Даулэй. Крыс первой группы, ЗН), 4,35 и 5,45 (2d, С = 17 Hz, 2Н) , Г контрольной, кормили смесью лабора6 , 8 - 8 , 2 (м, 4Н, выход 1,4 г (51% для 25 торного корма (лабораторный корм двух с т а д и й ) , через метиловый эфир для грызунов Пурина) и глюкозы при N- [4,б-диметокси-5-(трифторметил)концентрации 20% (объем/объем). -2-нафталенил^]-Н~метилглицина. Крыс в необработанной галактоземи- ческой группе кормили аналогичной ; Используя 1,7 г 5-(трифторметилсмесью, но с применением галактозы тио)-6-метокси-1-нафталйнкарбоновую 30 вместо глюкозы. Крыс третьей группы кислоту по примеру 6 3 , получают 1,6г кормили составом полученным при сме(76%) метилового эфира М-([5~(тришивании заданного количества испыфторметилтио)~6-метокси-1-нафталетуемого соединения с галактозосодер-. нил j-тиоксометил]-N-метилглицина жащей смесью. Концентрация галакто- ', (Кл и К ^ С І Ц ; R 3 =5-CF 3 S; R =6-СН,О; 35 зы в смеси для подвергающихся лече- І R =Н), т . п л . 121-123*С, через мению крысявляется такойже,как идля нетиловый эфир N- [ [[5-(трифторметилтио).обработанных.галактозимических крыс. -6-метокси-і-нафталенил j - к а р б о н и л | Через четыре дня животных обез- j -N-метилглицина. главили, вынули глазные яблоки и П р и м е р 65. Аналогично приме: 40 прокололи их бритвенным лезвием. ру 32, используя одно из сложноэфирВысвобожденные хрусталики осторожно ных соединений (R - низший алкил) перекатили на фильтровальную бумапо примеру 64, получают соответстгу и взвесили. Седалищные нервы бывующие соединения R^ - водородом), ли полностью иссечены и взвешены. например N- [(4,6~диметокси-1-нафта45 Обе ткани были заморожены (их можно ленил )-тиоксометил ]-N-метилглицин. хранить до двух недель для проведеВычислено, %: С 6 0 , 1 7 ; Н 5,36; ния анализа на дулцитол). N 4,38 їїолиол определяли модификацией Найдено, %: С 5 8 , 3 8 ; Н 5,20; опытов M.Kraml и L. Cosyns, заменив N 4,80. Из 6,4 г метилового эфира N - [ ( 4 , 6 - 50 реагенты:в качестве промывающей смеси использовали 5%-ный (объем/вес) -диметокси-1-нафталенил)-тиоксомеводный раствор трихлоруксусной кистил] -N-метилглицина получают 3,3 г лоты; сохраняемый раствор готовили (56%) N-Г(6-метокси-1-нафталенил)растворением 25 мг дулцитола в 100 мл -тиоксометил_|^-метилглицина, т.пл. С 55 водного раствора трихлоруксусной 153-154 С. кислоты. Для каждого эксперимента Из 6,2 г метилового эфира N - [ ( 6 найдена средняя величина в тканн -метокси-1 -нафталенил).-тиоксометил1 -, крыс, питавшихся глюкозной диетой, -N-метилглицина получают N-[[(4,6 1241985 15 которую вычли из индивидуальных величин, найденных в соответствующих тканях крыс, для получения количества аккумулированного полиола, 16 Результаты по оценке соединений формулы (I) и известного соединения в тесте in vitro приведены в табл. Т а б л и ц а Исходный продукт (Itg^H) (количество, г) Пример, 4 4-Br . (12,0)' * 8-Br \ 5 H (5,0) 6 5-CH,0 (7,0) 7 5-Ме ' н н * И (0,75) 8 5-Вг 6- [сн5 (СНг)^О)1 (1 2,9) 9 5-CN (10,8) ы с 9а 4-CN (5,65) 10 и 1 Целевой продукт: метиловый эфир N-[( заместитель)-1-нафталенилтиоксометил]-N-метилглицина 4-Бром; ЯМР (CflClj)^: 2,85, 3,25 (2S, ЗН), 3,6, 3,84 (2S, ЗН), 4,35 (т, 2Н), 7,7 (т, 6Н); ИК (CHCla), см.* 1730, 1620; выход 7,26 г, 43% 8-Бром; ИК (CHC1 S ), см : 1730, 1480, 1380, 1080; ЯМР (СДСІ*)^: 3,0 (S,3H), 3,8 (S, ЗН), 3,65 (т,2Н), 7,5 (т, 6Н); выход 2,24 г, 35% 5-Метокси; ЯМР (СДС1Э ) & : 2,81, 3,21 (2S, ЗН), 3,53 3,80 (2S, ЗН), 3,97 (S, ЗН), 4,37 (широкий, 2Н), 6,80 (d, 1Н), 7,40 (ш, 4Н), 8,27 (и, 1Н); ИК (СНС1 6 ), см" 1 , 1740, 1630, 1578; выход 4,4 г, 42% 5-Метил; ЯМР (СДС13 )$*: 2,68 (S, ЗН) 3.05 (ЗН), 3,85 (ЗН), 3,75 4,9 (га,2Н), 7.6 (S, 6H); выход 0,30 г, 29% 5-Бром-6-пентилокси; т.пл. 80-83 С; выход 8,25 г, 42% 5-Циано; ЯМР ( С Д С 1 3 ) ^ : 3,00 (S, З Н ) . 3,85 (S, ЗН), 4,45, 5,45 (d, 2H), 7,18 (m, 6 H ) ; выход 20,6, 82% 4-Циано; ЯМР ( С Д С ^ ) ^ : 3,1 (S, З Н ) , 3,85 (В, ЗН); 4,55, 5,25 (2d, I-17 Hz, 2Н), 7,0-8,4 (т, 6Н); выход 5,5, 64% 5-Нитро 5-Нитро; т.пл. II6-117 °С; выход 6,65 г, 40% (11,3) 11 5-С1 (6,79) Н 5-Хлор; масс-спектр, м.е.: 307/309 274/276 (М + -Н, S ) , 243/246 (М + -С00Ме); выход 3,35 г, 35% 12 5-Бг (Ю, 2) б-сн3о 5-Бром-6-метокси; т.пл. 115-117 С 13 5-Вг (7,10) 6-СН3 5-Бром-6-метил; ЯМР ( С Д С 1 3 ) ^ : 2,6 (S, З Н ) Э 3,0 (S, ЗН), 3,85 (S, З Н ) , 4,5 5,35 (d, 1-16,5 Hz, 2H), 7,7 (m, 5H); выход 7,9 г, 79% 241985 Пример» Исходный продукт (RS*H) (количество, г) R: г 18 ' Продолжение табл. Целевой продукт: метиловый эфир N-[(заместитель)-!-нафталенилтноксокетил]-Н-метилглицина н H H X; И (CHClj): 1735 с м ; выход 9,8 К 95% н 4-Хпор; т . п л . (7,00) 15 4-С1 (5,3) 16 3-Cl 8,0 17 5-Cl (6,5) 100-101° С 3-Хлор~4-метокси; 7-С1 г, т . п л . 85-86 °С + 5,7-Дихлор; м . е . : 325/327/329 (М ) , + 266/268*270 (М -СООСН3), 223/225/227 + (М -СН 3 -К-СН г »С00СН 3 ); выход 3,3 г, 41% 5-Иод-6-метокси; т . п л . 149-150°С 18 5-1 (6,9) 19 5-CN (5,6) 6-СН3 0 5-Циано-б-метокси; т . п л . выход 3,35 г , 38% 20 5-Br (4,3) 6 5-Бром-6-Сз~метоксипропокси); Я Р М (СДС1 )
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparation of n-naphthoylglycine derivatives
Назва патенту російською?????? ???????? ??????????? n-??????????????
МПК / Мітки
МПК: C07C 65/00, C07C 63/00
Мітки: n-нафтоілгліцину, отримання, спосіб, похідних
Код посилання
<a href="https://ua.patents.su/16-3590-sposib-otrimannya-pokhidnikh-n-naftoilglicinu.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання похідних n-нафтоілгліцину</a>
Попередній патент: Спосіб пакування безпіддонного штабеля штучних речей та установка для його здійснення
Наступний патент: Спосіб отримання заміщенних 1,2,4,9-тетрагідропірано /3,4-b/ індол-1-уксусних кислот чи його фармацевтичноприйнятних солів
Випадковий патент: Самозмащувальний антифрикційний матеріал на основі бронзи та графіту