Похідні імідазотриазинонів і фармацевтична композиція на їх основі
Номер патенту: 75149
Опубліковано: 15.03.2006
Автори: Буркхардт Нільс, Хендрікс Мартін, Катберт Найджел Дж., Шлеммер Карл-Хайнц, Стертон Грехем, Нівьонер Маріа Терезіа, Гілен Хайке, Алонсо-Алія Крістіна, БІШОФФ Хільмар, Гайсс Фолькер, Шаусс Дагмар, Фітцджеральд Мері
Формула / Реферат
1. Сполуки загальної формули (І)
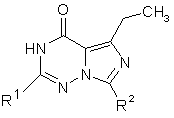 ,
,
в якій
R1 означає (С6-С10)-арил, який є необов'язково заміщеним однаковими або різними залишками, що вибирають з групи, яка містить галоген, (С1-С4)-алкіл, трифторметил, ціано, нітро і трифторметокси, або
означає (С1-С8)-алкіл, який є необов'язково заміщеним 3-10-членним карбоциклілом, або
означає 3-10-членний карбоцикліл, який є необов'язково заміщеним однаковими або різними (С1-С4)-алкільними залишками, і
R2 означає 4-трет-бутилциклогекс-1-ил, і
їх солі, гідрати і/або сольвати.
2. Сполуки згідно з пунктом 1, де R1 означає нафтил або означає феніл, який є необов'язково заміщеним однаковими або різними атомами галогену.
3. Сполуки згідно з пунктом 1 або 2, де R2 означає цис-4-трет-бутилциклогекс-1-ил.
4. Сполуки згідно з будь-яким одним з пунктів 1 - 3 для терапевтичного і/або профілактичного застосування.
5. Фармацевтична композиція, що містить принаймні одну сполуку згідно з будь-яким одним з пунктів 1 - 3 і фармацевтично прийнятний розріджувач.
Текст
1. Сполуки загальної формули (І) 2 (19) 1 3 75149 4 нюючих протеаз у легені, як припускають, призвоми. дить до незворотної обструкції дихальних шляхів, Фізіологічно прийнятні солі є переважними в що спостерігається при COPD. Зокрема, дія проконтексті представленого винаходу. теаз у руйнуванні матриксу легені призводить до Фізіологічно прийнятними солями також мозменшення альвеоли і є, ймовірно, основною прижуть бути солі сполук цього винаходу з неорганіччиною розвитку довгострокового розладу функції ними або органічними кислотами. Переважними легені, що спостерігається при цьому захвосолями є солі з неорганічними кислотами, такими рюванні. як, наприклад, хлорводнева кислота, бромводнева Лікування з використанням інгібітору ФДЕ 4, як кислота, фосфорна кислота або сірчана кислота, і очікувалось, призводить до зменшення кількості або солі з органічними карбоновими або сульфоклітин запалення в легені при обох цих захворюновими кислотами, такими як, наприклад, оцтова ваннях [М. S. Barnette, "PDE 4 inhibitors in asthma кислота, малеїнова кислота, фумарова кислота, and chronic obstructive pulmonary disease", in: яблучна кислота, лимонна кислота, винна кислота, Progress in Drug Research, Birkhauser Verlag, Basel, етансульфонова кислота, бензолсульфонова кис1999, pp.193-229; H. J. Dyke і J. G. Montana, "The лота, толуолсульфонова кислота або нафталіндиtherapeutic potential of PDE 4 inhibitors", Exp. Opin. сульфонова кислота. Переважними солями піриInvest. Drugs 8, 1301-1325 (1999)]. динію є солі в комбінації з галогеном. В той же час, інгібітори ФДЕ 4 також мають Сполуки згідно з цим винаходом можуть існупобічні ефекти, такі як блювота, було показано, що вати в стереоізомерних формах, які або ведуть ці побічні проявлення корелюються із спорідненіссебе як відображення і дзеркальне відображення тю до високоспоріднених сайтів зв'язування роліп(енантіомери), або які не є відображенням і дзерраму, і блювота зменшується у сполук із зменшекальним відображенням (діастереомери). Цей виною спорідненістю до цих сайтів зв'язування [J. нахід стосується енантіомерів і рацематів, також Med. Chem. 1996, 39,120-125]. як і чистих діастереомерів і їх сумішей. Рацемати, [WO 99/24433 і WO 99/67244] описують 2подібно як і діастереомери, можуть бути розділені феніл-імідазотриазинони, як проміжні сполуки для на стереохімічні окремі форми використовуючи синтезу 2відомі методики. (аміносульфонілфеніл)імідазотриазинонів, що є Особливо переважними сполуками загальної інгібіторами цГМФ-метаболізуючих фосфорформули (І) є сполуки, в яких R1 означає 1-нафтил діетераз. або 3-галогенфеніл. [Патент US 4,278,673] описує 2Гідрати сполук винаходу є стехіометричними арилімідазотриазинони з активністю, яка полягає у композиціями сполук з водою, наприклад, гемі-, інгібуванні цАМФ фосфодіетерази, для лікування моно- або дигідрати. астми. Сольвати сполук винаходу і їх солі є стехіомеПредставлений винахід стосується сполук затричними композиціями сполук з розчинниками. гальної формули (І) (С1-С8)-алкіл і (С1-С4)-алкіл загалом представляють собою нерозгалужений або розгалужений алкіл з 1-8 або 1-4 атомами вуглецю, відповідно. (l) Алкільні залишки можуть бути насиченими або частково ненасиченими, тобто, містити один або більшу кількість подвійних або потрійних і/або потв якій рійних зв'язків. Насичені алкільні залишки є переR1 означає (С6-С10)-арил, який є, необов'язковажними. Наступні алкільні залишки згадаються як во, заміщеним однаковими або різними залишкаприклади: метил, етил, н-пропіл, ізопропіл, аліл, ми, що вибирають з групи, яка містить галоген, пропаргіл, трет.бутил, пентил, гексил, гептил і ок(С1-С4)-алкіл, трифторметил, ціано, нітро і трифтотил. рметокси або означає (С1-С8)-алкіл, який є, необо(С6-С10)-Арил загалом представляє собою в'язково, заміщеним 3- - 10-членним карбоцикліароматичний залишок з 6-10 атомами вуглецю. лом, або Феніл і нафтил є переважними. означає 3- -10-членний карбоцикліл, який є, 3- - 10-членний карбоцикліл загалом предстанеобов'язково, заміщеним однаковими або різнивляє собою моно- або поліциклічний карбоциклічми (С1-С4)-алкільними залишками, і ний залишок з 3-10 кільцевими атомами. 3- - 8R2 означає 4-трет.-бутилциклогекс-1-ил, членний карбоцикліл є переважним. Моно- і біцикІнше втілення винаходу стосується сполук залічні карбоциклічні залишки є переважними. Особгальної формули (І), в якій ливо переважними є моноциклічні карбоциклічні R1 означає нафтил, або залишки. Карбоциклічні залишки можуть бути наозначає феніл, який є, необов'язково, заміщесиченими або частково ненасиченими. Насичені ним однаковими або різними атомами галогену і карбоциклічні залишки є особливо переважними. R2 має значення вказане вище. Особливо переважними є (С3-С10)-циклоалкільні і Інше втілення винаходу стосується сполук за1 (С4-С7)-циклоалкільні залишки. Наступні карбоцикгальної формули (І), в якій R має значення вказалільні залишки згадаються як приклади: циклопроне вище, і R2 означає цис-4-трет.-бутилциклогекспіл, циклобутил, циклопентил, циклопентеніл, цик1-ил. логексил, циклогептил, норборн-1-іл, норборн-2-іл, Сполуки цього винаходу також можуть бути норборн-7-іл, норборн-2-ен-7-іл, циклооктил, кубіл, присутні у формі їх солей, гідратів і/або сольватів. циклононіл, циклодецил, декалініл, адамант-1-ил, Загалом, тут можуть бути згадані солі з органіадамант-2-ил. чними або неорганічними основами або кислота 5 75149 6 Галоген загалом представляє собою фтор, (VI) хлор, бром і йод. Фтор, хлор і бром є переважними. Фтор і хлор є особливо переважними. в якій Якщо не вказане інше, коли групи сполук виR2 є таким як визначено вище, і находу є, необов'язково, заміщеними, зазвичай є Τ представляє відхідну групу, переважно хлор. переважним заміщення до трьох разів однаковими Спосіб згідно з винаходом можна проілюструабо різними залишками. вати використовуючи наступну схему, як наприКрім того, винахід забезпечує спосіб одержанклад: ня сполук загальної формули (І) згідно з винаходом, який характеризується тим, що сполуки загальної формули (II) (II) в якій R2 є таким як визначено вище і L представляє нерозгалужений або розгалужений алкіл, що має до 4 атомів вуглецю, конденсують з сполуками загальної формули (III) (III) в якій R1 є таким як визначено вище, переважно використовуючи етанол як розчинник, у сполуки загальної формули (IV), (IV) в якій R1 і R2 є такими як визначено вище, які можна, необов'язково, після виділення піддати реакції з дегідратуючим агентом, переважно окситрихлоридом фосфору, з одержанням сполук загальної формули (І). Сполуки загальної формули (IV) можна одержати альтернативно шляхом [А] конденсування сполук загальної формули (llа), (IIa) в якій L є таким як визначено вище, з сполуками загальної формули (III) у сполуки загальної формули (IVa), (IVa) в якій R1 є таким як визначено вище, переважно використовуючи етанол як розчинник, [Б] з наступним гідролізом сполук загальної формули (IVa) у сполуки загальної формули (V), (V) в якій R1 є таким як визначено вище, [В] і в кінці кінців конденсуванням сполук загальної формули (V) з сполуками загальної формули (VI), Розчинниками які є придатними для окремих стадій є звичайні органічні розчинники, які не змінюються за умов реакції. Переважними розчинниками є етери, такі як діетиловий етер, діоксан, тетрагідрофуран, диметиловий етер гліколю або вуглеводні, такі як бензол, толуол, ксилен, гексан, циклогексан або фракції нафти, або галогеновані вуглеводні, такі як дихлорметан, трихлорметан, тетрахлорид вуглецю, дихлоретан, трихлоретилен або хлорбензол, або етилацетат, диметилформамід, триаміж гексаметилфосфорної кислоти, ацетонітрил, ацетон, диметоксиетан або піридин. Також можна використати суміш згаданих вище розчинників. Особлива перевага віддається етанолу для реакції ll/lla+lll IV/IVa і дихлоретану для циклізації IV I. Температура реакції зазвичай може змінюватись у відносно широкому інтервалі. Загалом, реакцію проводять в інтервалі від -20°С до 200°С, переважно від 0°С до 100°С. Стадії способу згідно з винаходом зазвичай проводять при атмосферному тиску. Однак, також можна працювати при тиску вище атмосферного або при тиску нижче атмосферного (наприклад, в інтервалі від 0,5 до 5бар). Сполуки загальної формули (IVa) переважно гідролізують у сполуки загальної формули (V) у кислому середовищі як, наприклад, при кип'ятінні з 2N хлорводневою кислотою. Сполуки загальної формули (V) конденсують з сполукою загальної формули (VI) у сполуку загальної формули (IV) в інертних розчинниках, якщо прийнятно, в присутності основи. Розчинниками, які є придатними для окремих 7 75149 8 стадій, є звичайні органічні розчинники, які не зміабо хлорбензол, або етилацетат, диметилформанюються за умов реакції. Переважними розчиннимід, триаміж гексаметилфосфорної кислоти, ацеками є етери, такі як діетиловий етер, діоксан, теттонітрил, ацетон, диметоксиетан або піридин. Тарагідрофуран, диметиловий етер гліколю або кож можна використати суміш згаданих вище вуглеводні, такі як бензол, толуол, ксилен, гексан, розчинників. Особливо переважним є використанциклогексан або фракції нафти, або галогеновані ня дихлорметану на першій стадії і суміші тетрагівуглеводні, такі як дихлорметан, трихлорметан, дрофурану і піридину на другій стадії. тетрахлорид вуглецю, дихлоретан, трихлоретилен Придатними основами зазвичай є гідриди луабо хлорбензол, або етилацетат, диметилформажних металів або алкоксиди лужних металів, такі мід, триаміж гексаметилфосфорної кислоти, ацеяк, наприклад, гідрид натрію або трет-бутоксид тонітрил, ацетон, диметоксиетан або піридин. Такалію, або циклічні аміни, такі як, наприклад, піпекож можна використати суміш згаданих вище ридин, піридин, диметиламінопіридин або (С1-С4)розчинників. алкіламіни, такі як, наприклад, триетиламін. ПереПридатними основами зазвичай є гідриди лувага надається триетиламіну, піридину і/або димежних металів або алкоксиди лужних металів, такі тиламінопіридину. як, наприклад, гідрид натрію або трет-бутоксид Основу зазвичай використовують в кількості калію, або циклічні аміни, такі як, наприклад, піпевід 1моль до 4моль, переважно від 1,2моль до ридин, піридин, диметиламінопіридин або (С1-С4)3моль, в кожному випадку виходять з 1моль споалкіламіни, такі як, наприклад, триетиламін. Перелуки формули (V). вага надається триетиламіну, піридину і/або димеТемпература реакції зазвичай може змінюватиламінопіридину. тись у відносно широкому інтервалі. Загалом, реаОснову зазвичай використовують в кількості кцію проводять в інтервалі від -20°С до 200°С, певід 1моль до 4моль, переважно від 1,2моль до реважно від 0°С до 100°С. 3моль, в кожному випадку виходять з 1моль споСполуки загальної формули (VI) і (VIII) відомі луки формули (V). per se, або вони можуть бути одержані за допомоТемпература реакції зазвичай може змінювагою відомих методик. тись у відносно широкому інтервалі. Загалом, реаСполуки загальної формули (III) відомі або кцію проводять в інтервалі від -20°С до 200°С, пеможуть бути одержані за допомогою реакції сполук реважно від 0°С до 100°С. загальної формули (IX) Деякі сполуки загальної формули (II) відомі, R1-Y (IX) або вони є новими, і вони можуть бути одержані в якій шляхом R1 є таким як визначено вище, і перетворення сполук загальної формули (VI) Υ представляє собою ціано, карбоксил, метокR2-CO-T (VI) сикарбоніл або етоксикарбоніл, з хлоридом алюв якій мінію в толуолі в присутності триметилалюмінію в R2 є таким як визначено вище і гексані при температурі від -20°С до кімнатної теΤ представляє собою галоген, переважно мператури, переважно при 0°С і атмосферному хлор, тиску, і взаємодії одержаного амідину, якщо приспочатку за допомогою реакції з αйнятно in situ, з гідратом гідразину. аміномасляною кислотою в інертних розчинниках, Сполуки загальної формули (IX) відомі per se, якщо прийнятно в присутності основи, і триметилабо вони можуть бути одержані за допомогою вісилілхлоридом у сполуки загальної формули (VII), домих методик. Сполуки загальної формули (І) інгібують ФДЕ (VII) 4, що знаходяться в мембранах нейтрофілів людини і проявляють особливо прийнятний профіль в якій зв'язування високоспоріднених сайтів ФДЕ 4, зв'я2 R є таким як визначено вище, зування яке відповідає за побічні ефекти подібні і подальшої взаємодії з сполукою формули блювоті. Одним з виміряних функціональних нас(VIII) лідків цього інгібування було інгібування продукування аніону пероксиду шляхом стимулювання (VIII) нейтрофілів людини. Сполуки загальної формули (І), крім того, мов якій жуть бути використані для лікування запальних L є таким як визначено вище, процесів, особливо гострих і хронічних запальних в інертних розчинниках, якщо прийнятно, в процесів, і/або імунних захворювань. присутності основи. Сполуки винаходу переважно придатні для ліСполуки загальної формули (На) можна одеркування і попередження запальних процесів, тобжати аналогічно. то, гострих і хронічних запальних процесів і/або Розчинниками які є придатними для окремих імунних захворювань, таких як емфізема, альвеостадій є звичайні органічні розчинники, які не зміліт, легеневий шок, всі види хронічного обструктинюються за умов реакції. Переважними розчиннивного захворювання легені (COPD), респіраторний ками є етери, такі як діетиловий етер, діоксан, тетдистрессиндром дорослих (ARDS), астма, бронхіт, рагідрофуран, диметиловий етер гліколю або кістозний фіброз, еозинофільна гранулома, артевуглеводні, такі як бензол, толуол, ксилен, гексан, ріосклероз, артроз, запалення гастроінтестинальциклогексан або фракції нафти, або галогеновані ного тракту, міокардит, захворювання, що викливуглеводні, такі як дихлорметан, трихлорметан, кають розлади резорбції кісток, реперфузивне тетрахлорид вуглецю, дихлоретан, трихлоретилен 9 75149 10 ушкодження,хв.ороба Крона, виразковий коліт, льні лейкоцити) легко виділяються з периферійної системний червоний вовчак, цукровий діабет типу крові. Фосфодіетераза в цих клітинах переважно І, псоріаз, анафілактичний пурпурний нефрит, хрозосереджена в мембранній фракції. Інгібуюча акнічний гломерулонефріт, запальне захворювання тивність сполук проти цього приготування добре кишечнику, атопічний дерматит, інші доброякісні і корелюється з протизапальною активністю, що злоякісні проліферативні захворювання шкіри, вимірюється шляхом інгібування продукування алергічний риніт, алергічний кон'юнктивіт, весінній пероксиду. кон'юнктивіт, артеріальний рестеноз, сепсис і сепКров відбирали у здорових пацієнтів шляхом тичний шок, синдром токсичного шоку, реакція пункції вени і нейтрофіли очищали за допомогою трансплантат проти хазяїна, відторгнення алоосадження декстраном і центрифугування з градітрансплантату, лікування цитокінобумовленої хроєнтом густини на Ficoll Histopaque і ресуспендунічної дегенерації тканин, ревматоїдний артрит, вання в забуференому середовищі. артрит, ревматоїдний спондиліт, остеоартрит, ко2. Дослідження PMN фосфодіетерази людини ронарна недостатність, міалгія, розсіяний склероз, Здійснювали часткове фракціонування PMN малярія, СНІД, кахесія, попередження росту пухлюдини, по суті, як описано Souness і Scott лин і інвазії тканини, лейкемія, депресія, порушен[Biochem. J. 291, 389-395 (1993)]. Розділені фракції ня пам'яті і гострий інсульт. Сполуки винаходу таобробляли ванадат натрію/глутатіон як описано кож є придатними для зменшення ушкоджуваності авторами проявляючи дискретні стереоспецифічні інфарктованих тканин після реоксигенації. місця на фосфодіетеразі. Прототипічний інгібтор Сполуки формули (І) винаходу можуть бути ФДЕ 4, поліпрам, мав IC50 значення в інтервалі використані як активні компоненти при одержанні 450нМ-500нМ, таким чином виражаючи це пригомедикаментів. Для цього, вони можуть бути переттування як так звану "низкоспоріднену" [L] форму. ворені у звичайні рецептури, такі як таблетки, табЦі підготовлені приклади мали значення ІС50 в летки з покриттям, аерозолі, пігулки, гранули, симежах від 0,11нМ до 10,000нМ. ропи, емульсії, суспензії і розчини, відомим чином, 3. Інгібування FMLP-стимульованого продукуіз застосуванням інертних, не токсичних, фармавання аніонів радикалу пероксиду цевтично придатних носіїв або розчинників. ПереНейтрофіли (2,5 105мл) змішували з цитохроважно, сполуки винаходу використовують тут в мом С (1,2мг/мл) в лунках мікротитрованого плантакій кількості, що їх концентрація в загальній сушету. Сполуки згідно з винаходом додавали до міші становить приблизно від 0,5 до приблизно диметилсульфоксиду (ДМСО). Концентрація спо90ваг.%, концентрація, inter alia, буде залежати від лук знаходилась в інтервалі від 2,5нМ до 10мкМ, відповідних призначень медикаменту. концентрація ДМСО становила 0,1% об./об. у всіх Згадані вище рецептури одержують, наприлунках. Після додавання цитокалазину b (5мкг мл 1 клад, шляхом витягування активної сполуки з роз) планшет інкубували протягом 5хв. при 37°С. чинників і/або екціпієнтів, що мають згадані вище Нейтрофіли потім стимулювали додаванням 4 108 властивості, де, якщо прийнятно, можуть бути доΜ FMLP (N-Форміл-Met-Leu-Phe) і вимірювали дані додаткові емульсифікатори або диспергатори, продукування пероксиду як відновлення інгібуючої у випадку використання види як розчинника, альздатності пероксиддисмутази цитохрому С шлятернативно органічному розчиннику. хом контролювання OD550 в спектрометрі Введення проводять звичайним чином, переThermomax в мікротітрованому планшеті. Розраважно, орально, трансфермально або парентераховували початкові значення використовуючи кінельно, наприклад перлінгвально, букально, внутрітичну розрахункову програму Softmax. Пусті лунки шньовенно, назально, ректально або за містити 200 одиниць пероксиддисмутази. допомогою інгаляції. Інгібування продукування пероксиду розрахоУ випадку призначення людям при оральному вували наступним чином: введенні доцільні дозування становить від 0,001 {1 (Rx Rb)] 1( 100 до 50мг/кг, переважно 0,01мг/кг-20мг/кг. У випадку (Ro Rb) парентерального введення, такого як, наприклад, Rx = Значення лунки, що містить сполуку згідвнутрішньовенно або через слизову оболонку, но з винаходом назально, букально або за допомогою інгаляції, Ro = Значення в контрольній лунці доцільне дозування становить від 0,001 до Rb = Значення вмісту пероксиддисмутази, що 0,5мг/кг. Незважаючи на це, у деяких випадках містить пуста лунка буває необхідно змінити зазначені кількості, а саПідготовленні приклади мали значення ІС50 в ме, у залежності від ваги тіла або способу введенінтервалі від 0,1нМ до 10000нМ. ня, від індивідуальної відповіді на медикамент, від 4. Дослідження зв'язування сайтів зв'язування виду рецептури, від часу прийому або інтервалу, в роліпраму (високоспоріднені сайти ФДЕ 4; "Н-ФДЕ якому відбувається введення ліків. Так, у деяких 4 форма") в мембранах мозку щурів випадках досить менших доз, ніж вищезгадані міАктивність сполук по відношенню до високоснімальні кількості, у той час як в інших випадках поріднених сайтів ФДЕ 4 ("Н-ФДЕ 4 форма") легко повинна бути перевищена вищезгадана верхня розрахувати шляхом визначення їх здатності замімежа. У випадку уведення відносно великих кільнювати [Н]-роліпрам в його сайті зв'язування в костей рекомендується розподілити їх на кілька мембранах мозку щурів. Активність в цих сайтах, окремих доз протягом дня. як припускають, є мірою можливості виникнення Опис тестування сторонніх ефектів (наприклад, стимулювання сек1. Одержання PMN людини ретування шлункової кислоти, нудота і блювота). PMN людини (поліморфонуклеарнонейтрофі 11 75149 12 Дослідження сайту зв'язування роліпраму проциклогексан і етилацетат. Якщо не вказане інше, водили, по суті, використовуючи методику реакції проводили в атмосфері аргону і безводноSchneider et al. [Eur. J. Pharmacol. 127, 105-115 му середовищі. (1986)]. Скорочення: 5. Ліпополісахарид (LPS) індукований приток ВЕРХ = високоефективна рідинна хроматогнейтрофілу в легені щура Інтраназальне введення рафія LPS щурам викликає значний приток нейтрофілів у МС = масспектроскопія легені, що вимірюється за допомогою гістологічноЯМР = ядерний магнітний резонанс го або біохімічного (по вмісту мієлопероксиду в РХ-МС = рідинна хроматографія з масспектроклітинному осаді) аналізу рідини бронхоальвеоляскопією рного лаважу через 24г. Щурів обробляли сполуГХ-МС = газова хроматографія з масспектроскою, що тестується, або розчинником, вводячи їх копією орально за 1г. і через 6г. після інтраназального МеОН = метанол введення LPS. Через 24 години тварин умертвляДМФА = Ν,Ν-диметилформамід ли і їх легені промивали PBS (саліном забуфереДМСО = диметилсульфоксид ним фосфатом). Аналізували кількість нейтрофілів Вихідні сполуки і загальну кількість клітин. ПРИКЛАД 1А 6. Викликання блювоти у мавпочки 2-(Ацетиламіно)бутанова кислота Розчинник або сполуку, що досліджується, вводили пероральним шляхом мавпочкам. Спостерігали за тваринами фіксуючи блювотні епізоди або ненормальну поведінку протягом 1г. після 163г (1,58моль) 2-амінобутанової кислоти розвведення. В деяких експериментах, якщо не спочиняли в оцтовій кислоті і по краплям додавали стерігалось відповіді, досліджували окрему групу 242г (2,37моль) оцтового ангідриду. Суміш перетварин з дозою на ½ рази вищою, до моменту фікмішували протягом 2г. при 100°С до завершення сування початку блювоти або ненормальної повереакції, потім розчин упарювали до суха у вакуумі. дінки. Найвищу дозу, при якій не спостерігається Твердий залишок суспендували у етилацетаті, ненормальної поведінки або блювотних проявфільтрували і промивали діетиловим етером. лень, реєстрували як NOEL. Вихід: 220г (96%) Матеріали і способи 1 Н-ЯМР (Метанол-d4): δ=0,97 (т, 3Н), 1,65-1,93 (м, 2Н), 1,99 (с, 3Н), 4,29 (к, 1Н) м.ч.. РХ-МС спосіб А: ПРИКЛАД 2А РХ-параметри розчин А ацетонітрил розчин Б 0,3г 30% НСІ/1 вода Етил 3-(ацетиламіно)-2-оксопентаноат градієнт: РХ-МС спосіб Б: РХ-параметри градієнт: ГХ-МС спосіб А: Колонка: Газ носій: Режим: Температурний режим: температура колонки 50°С; колонка Symmetry C18 2,1 150мм час [хв] % А % Б потік [мл/хв.] 0 10 90 0,9 3 90 10 1,2 6 90 10 1,2 розчин А ацетонітрил/0,1% мурашина кислота розчин Б вода/0,1% мурашина кислота температура колонки 40°С; колонка Symmetry C18 2,1 50мм час [хв] % А % Б потік [мл/хв.] 0 10 90 0,5 4 90 10 0,5 6 90 10 0,5 6,1 10 90 1,0 7,5 10 90 0,5 НР-5 30м 320мкм 0,25мкм Гелій Постійний потік, початковий потік: 1,5мл/хв. початкова температура: 60°С початковий час: 1хв. швидкість: 14°С/хв. до 300°С, потім 300°С 2хв. Якщо не вказане інше, використовували наступні хроматографічні умови: хроматографію проводили на силікагелі Si 60; для флеш хроматографії, зазвичай використовували умови описані Still, J. Org. Chem. 43, 2923 (1978); як елюенти використовували суміші дихлорметан і метанол або 9,2г (63,4ммоль) 2-(Ацетиламіно)бутанової кислоти суспендували в 120мл тетрагідрофурану і кип'ятили із зворотнім холодильником разом з 15,0г (190ммоль) піридину і невеликою кількістю Ν,Ν-диметиламінопіридину. Під час нагрівання по краплям додавали 17,3г (127ммоль) етилхлор(оксо)ацетату. Реакційну суміш нагрівали із зворотнім холодильником до завершення виділення газу. Після охолодження до кімнатної температури, реакційну суміш додавали до льодяної вода і органічну фазу екстрагували етилацетатом. Висушені органічні фази упарювали до суха у вакуумі, розчиняли в етанолі і розчин безпосередньо використовували на наступній стадії. ПРИКЛАД 3А 3-Бромбензолкарбоксімідаміду гідрохлорид 1,18г (22ммоль, 2екв.) хлориду амонію суспендували в 40мл сухого толуолу в атмосфері аргону і суміш охолоджували до 0°С. По краплям додавали 11мл (22ммоль, 2екв.) 2М розчину триметилалюмінію в гексані і реакційну суміш перемішували при кімнатній температурі до завершення виділення газу. Після додавання 2,0г (11ммоль, 13 75149 14 1екв.) 3-бромбензонітрилу, суміш перемішували пропорційні кількості інших реагентів. на 80°С бані протягом ночі. її потім охолоджували Вихід: 24,5г (47%) до 0°С і додавали 50мл метанолу з наступним РХ-МС (спосіб А): час утримання 0,40хв., m/z перемішуванням 1 годину при кімнатній темпера166 [М+Н] турі. Після фільтрування, тверду речовину промиПРИКЛАД 9А вали метанолом декілька разів, розчин упарювали 1-Нафталінкарбоксімідаміду гідрохлорид до суха у вакуумі і залишок промивали метанолом. Вихід: 2,02г (78%) 1 Н-ЯМР (ДМСО-d6, 300МГц): δ=7,6 (м, 1Н), 7,8 (м, 1Н), 8,0 (м, 1Н), 8,1 (с, 1Н) м.ч.. ПРИКЛАД 4А 14г (261ммоль, 2екв.) хлориду амонію суспен4-Фторбензолкарбоксімідаміду гідрохлорид дували в 150мл сухого толуолу в атмосфері аргону і суміш охолоджували до 0°С. По краплям додавали 130мл (260ммоль, 2екв.) 2М розчину триметилалюмінію в гексані і реакційну суміш перемішували при кімнатній температурі до завершення виділення газу. Після додавання 20г (130ммоль, 1екв.) 1-ціанонафталіну, суміш переАналогічно методиці Прикладу 3А, використомішували на 80°С бані протягом ночі. Суміш оховували 2,0г (16,5ммоль) 4-фторбензонітрилу і пролоджували і виливали в суспензію силікагелю в порційні кількості інших реагентів. Вихід: 2,9г метиленхлориді. Після фільтрування, тверду ре(100%) 1 човину промивали метанолом декілька разів, розН-ЯМР (ДМСО-d6, 200МГц): δ=7,5 (м, 2Н), 8,0 чин упарювали до суха у вакуумі і залишок проми(м, 2Н) м.ч.. вали метанолом. Об'єднані фільтрати об'єднували ПРИКЛАД 5А Циклопропанкарбоксімідаміду гіі перемішували в суміші метиленхлориду, що місдрохлорид тить 10% метанолу. Вихід: 9,88г (37%) 1 Н-ЯМР (ДМСО-d6, 300МГц): δ=7,6-7,8 (м, 4Н), 8,0 (д, 1Н), 8,1 (м, 1Н), 8,2 (д, 1Н) м.ч., 9,5 (ш с, 4Н) Аналогічно методиці Прикладу 3А, використом.ч.. вували 6,71г (100ммоль) циклопропанкарбонітрилу ПРИКЛАД 10А і пропорційні кількості інших реагентів. N-{1-[3-(3-Бромфеніл)-5-оксо-4,5-дигідро-1,2,4Вихід: 7,3г (61%) триазин-6-іл]пропіл}ацетамід ГХ/МС (спосіб А): час утримання 3,42хв., m/z 85,1 [М+Н] ПРИКЛАД 6А Циклопентанкарбоксімідаміду гідрохлорид Аналогічно методиці Прикладу 3А, використовували 7,51г (79,0ммоль) циклопентанкарбонітрилу і пропорційні кількості інших реагентів. Вихід: 3,9г (33%) РХ-МС (спосіб А): час утримання 0,42хв., m/z 113 [М+Н] ПРИКЛАД 7А 2,2-Диметилпропанімідаміду гідрохлорид Аналогічно методиці Прикладу 3А, використовували 8,31г (100ммоль) півалонітрилу і пропорційні кількості інших реагентів. Неочищений продукт використовували на наступній стадії без подальшого очищення. Вихід: 6г неочищеного продукту ПРИКЛАД 8А 3-Нітробензолкарбоксімідаміду гідрохлорид Аналогічно методиці Прикладу 3А, використовували 30,0г (203ммоль) 3-нітробензонітрилу і 2,02 (8,6ммоль, 1екв.) 3бромбензолкарбоксімідаміду гідрохлориду суспендували в 50мл етанолу і додавали 1,47г (10,2ммоль, 1,2екв.) гідрату гідразину. Після перемішування при кімнатній температурі протягом 1 години, додавали 2,59г (13ммоль, 1,5екв.) сполуки Прикладу 2А розчиненої в 10мл етанолу. Реакційну суміш перемішували при 80°С (температура бані) протягом 4 годин і потім при кімнатній температурі протягом ночі. Суміш упарювали до суха у вакуумі і продукт очищали за допомогою хроматографії (флеш, або колонкова хроматографія, або препаративна ВЕРХ). Вихід: 758мг (25%) 1 Н-ЯМР (ДМСО-d6, 200МГц): δ=0,9 (т, 3Н), 1,6 (м, 1Н), 1,8 (м, 1Н), 1,9 (с, 3Н), 4,9 (м, 1Н), 7,5 (м, 1Н), 7,8 (м, 1Н), 8,0 (м, 1Н), 8,2 (м, 2Н), 14,1 (ш с, 1Н) м.ч.. ПРИКЛАД 11А N-{1-[3-(4-Фторфеніл)-5-оксо-4,5-дигідро-1,2,4триазин-6-іл]пропіл}ацетамід Аналогічно методиці Прикладу 10А, використовували 2,0г (11,4ммоль) 4 15 75149 16 фторбензолкарбоксімідаміду гідрохлориду і прореагентів. порційні кількості інших реагентів. Вихід: 1,17г (46%) 1 Вихід: 1,47г (44%) Н-ЯМР (ДМСО-d6, 200МГц): δ=0,9 (т, 3Н), 1,2 1 Н-ЯМР (ДМСО-d6, 300МГц): δ=0,9 (т, 3Н), 1,6 (м, 3Н), 1,5 (м, 3Н), 1,8 (м, 4Н), 1,9 (с, 3Н), 2,5 (м, (м, 1Н), 1,8 (м, 1Н), 1,9 (с, 3Н), 4,9 (м, 1Н), 7,5 (м, 1Н), 4,8 (м, 1Н), 8,1 (д, 1Н), 13,4 (ш с, 1Н) м.ч.. 2Н), 8,1 (м, 3Н), 14,1 (ш с, 1Н) м.ч.. ПРИКЛАД 16А ПРИКЛАД 12А N-{1-[3-(4-Бромфеніл)-5-оксо-4,5-дигідро-1,2,4N-{1-[3-(3-Фторфеніл)-5-оксо-4,5-дигідро-1,2,4триазин-6-іл]пропіл}ацетамід триазин-6-іл]пропіл}ацетамід Аналогічно методиці Прикладу 10А, використовували 2,0г (11,4ммоль) 3фторбензолкарбоксімідаміду гідрохлориду і пропорційні кількості інших реагентів. Вихід: 781мг (23%) 1 Н-ЯМР (ДМСО-d6, 300МГц): δ=0,9 (т, 3Н), 1,6 (м, 1Н), 1,8 (м, 1Н), 1,9 (с, 3Н), 4,9 (м, 1Н), 7,5 (м, 1Н), 7,7 (м, 1Н), 7,8 (м, 1Н), 7,9 (м, 1Н), 8,2 (д, 1Н), 14,1 (ш с, 1Н) м.ч.. ПРИКЛАД 13А N-{1-[3-(3-Хлорфеніл)-5-оксо-4,5-дигідро-1,2,4триазин-6-іл]пропіл}ацетамід Аналогічно методиці Прикладу 10А, використовували 1,5г (7,9ммоль) 3хлорбензолкарбоксімідаміду гідрохлориду і пропорційні кількості інших реагентів. Вихід: 441мг(18%) 1 Н-ЯМР (ДМСО-d6, 300МГц): δ=0,9 (т, 3Н), 1,6 (м, 1Н), 1,8 (м, 1Н), 1,9 (с, 3Н), 4,9 (м, 1Н), 7,6 (м, 1Н), 7,7 (м, 1Н), 8,0 (м, 1Н), 8,1 (м, 1Н), 8,2 (д, 1Н), 14,1 (ш с, 1Н) м.ч.. ПРИКЛАД 14А N-{1-[3-(2-Бромфеніл)-5-оксо-4,5-дигідро-1,2,4триазин-6-іл]пропіл}ацетамід Аналогічно методиці Прикладу 10А, використовували 1,64г (7,0ммоль) 2бромбензолкарбоксімідаміду гідрохлориду і пропорційні кількості інших реагентів. Вихід: 1,0г (41%) РХ/МС (В): МС (ЕС+): 351 (М+Н), час утримання 2,34хв. ПРИКЛАД 15А N-[1-(3-Циклогексил-5-оксо-4,5-дигідро-1,2,4триазин-6-іл)пропіл]ацетамід Аналогічно методиці Прикладу 10А, використовували 1,50г (9,2ммоль) циклогексанкарбоксімідаміду гідрохлориду і пропорційні кількості інших Аналогічно методиці Прикладу 10А, використовували 10,2г (43,3ммоль) 4бромбензолкарбоксімідаміду гідрохлориду і пропорційні кількості інших реагентів. Вихід: 5,23г (34%) 1 Н-ЯМР (400МГц, CD3OD): δ=1,01 (т, 3Н), 1,661,79 (м, 1Н), 1,91-2,06 (м, 4Н, с при 1,99), 5,02-5,09 (м, 1Н), 7,75 (д, 2Н), 7,93 (д, 2Н) м.ч.. ПРИКЛАД 17А N-[1-(3-Циклопропіл-5-оксо-4,5-дигідро-1,2,4триазин-6-іл)пропіл]ацетамід Аналогічно методиці Прикладу 10А, використовували 7,30г (60,5ммоль) циклопропанкарбоксімідаміду гідрохлориду і пропорційні кількості інших реагентів. Неочищений продукт використовували на наступній стадії без подальшого очищення. Вихід: 4,9г (34%) неочищеного матеріалу ПРИКЛАД 18А N-[1-(3-Циклoпeнтил-5-oкco-4,5-дигiдpo-1,2,4тpиaзин-6-iл)пpoпiл]aцeтaмiд Аналогічно методиці Прикладу 10А, використовували 3,50г (23,6ммоль) циклопентанкарбоксімідаміду гідрохлориду і пропорційні кількості інших реагентів. Вихід: 1,7г (27%) РХ/МС (спосіб А): час утримання 1,60хв., m/z 265 [М+Н] ПРИКЛАД 19А N-[1-(3-трет-Бутил-5-оксо-4,5-дигідро-1,2,4триазин-6-іл)пропіл]ацетамід Аналогічно методиці Прикладу 10А, використовували 6,0г (11,0ммоль) 2,2диметилпропанімідаміду гідрохлориду і пропорційні кількості інших реагентів. Вихід: 1,77г (64%) РХ/МС (спосіб А): час утримання 1,59хв., m/z 253 [М+Н] ПРИКЛАД 20А Ν-{1-[3-(3-Нітрофеніл)-5-оксо-4,5-дигідро-1,2,4триазин-6-іл]пропіл}ацетамід 17 75149 18 кімнатної температури, суміш нейтралізували 10% NaOH і, після додавання етанолу, упарювали до суха у вакуумі. Залишок обробляли метанолом і фільтрат відокремлювали від солі. Фільтрат упарювали до суха у вакуумі і продукт очищали за допомогою хроматографії (флеш, або колонкова Аналогічно методиці Прикладу 10А, викорисхроматографія, або препаративна ВЕРХ). товували 35,0г (174ммоль) 3Вихід: 320мг (49%) нітробензолкарбоксімідаміду гідрохлориду і про1 Н-ЯМР (ДМСО-d6, 200МГц): δ=0,9 (т, 3Н), 1,9 порційні кількості інших реагентів. (м, 2Н), 4,3 (д/д, 1Н), 7,4 (м, 1Н), 7,6 (м, 1Н), 8,1 (ш Вихід: 13,6г (25%) 1 с, 2Н), 8,2 (м, 1Н), 8,4 (м, 1Н) м.ч.. Н-ЯМР (200МГц, CDCI3): δ=0,97 (т, 3Н), 1,83ПРИКЛАД 24А 2,08 (м, 5Н, с при 2,02), 5,09 (м, 1Н), 7,76 (т, 1Н), 6-(1-Амінопропіл)-3-(4-фторфеніл)-1,2,48,45 (д, 1Н), 8,58 (д, 1Н), 9,12 (с, 1Н) м.ч.. триазин-5(4Н)-он ПРИКЛАД 21А N-[1-(5-оксо-3-феніл-4,5-дигідро-1,2,4-триазин6-іл)пропіл]ацетамід Аналогічно методиці Прикладу 10А, використовували 7,26г (46,8ммоль) бензолкарбоксімідаміду гідрохлориду і пропорційні кількості інших реагентів. Вихід: 10,1г (80%) 1 Н-ЯМР (ДМСО-d6, 300МГц): δ=0,9 (т, 3Н), 1,5 (м, 1Н), 1,8 (м, 1Н), 1,9 (с, 3Н), 4,9 (м, 1Н), 7,5 (м, 3Н), 8,1 (м, 3Н), 14,1 (ш с, 1Н) м.ч.. ПРИКЛАД 22А N-{1-[3-(1-Нафтил)-5-оксо-4,5-дигідро-1,2,4триазин-6-іл]пропіл}ацетамід 1,0г (4,84ммоль, 1екв.) 1Нафталінкарбоксімідаміду гідрохлориду суспендували в 2мл ДМСО і додавали 0,29г (5,81ммоль, 1,2екв.) гідрату гідразину. Після перемішування при кімнатній температурі протягом 16 годин додавали 1,45г (7,3ммоль, 1,5екв.) сполуки Прикладу 2А розчиненої в 10мл етанолу. Реакційну суміш перемішували при кипінні із зворотнім холодильником протягом 1 години і потім при 60°С (температура бані) протягом 4 годин і потім при кімнатній температурі протягом ночі. Суміш упарювали до суха у вакуумі і продукт очищали за допомогою флеш хроматографії. Вихід: 7,1г (70%) 1 Н-ЯМР (ДМСО-d6, 300МГц): δ=1,0 (т, 3Н), 1,61,7 (м, 2Н), 1,9 (с, 3Н), 5,0 (м, 1Н), 7,5-8,2 (м, 8Н), 14,0 (ш с, 1Н) м.ч.. ПРИКЛАД 23А 6-(1-Амінопропіл)-3-(3-бромфеніл)-1,2,4триазин-5(4Н)-он 749мг (2,13ммоль) Прикладу 10А кип'ятили із зворотнім холодильником в 20мл 2N хлорводневої кислоти протягом 18 годин. Після охолодження до Аналогічно методиці Прикладу 23А, використовували 1,46г (5,0ммоль) Прикладу 11А і пропорційні кількості інших реагентів. Вихід: 970мг (78%) РХ/МС (А): МС (ЕСІ): 249 (М+Н), час утримання 0,50хв. ПРИКЛАД 25А 6-(1-Амінопропіл)-3-(3-фторфеніл)-1,2,4триазин-5 (4Н)-он Аналогічно методиці Прикладу 23А, використовували 1,1г (3,8ммоль) Прикладу 12А і пропорційні кількості інших реагентів. Вихід: 594мг(63%) РХ/МС (А): МС (ЕСІ): 249 (М+Н), час утримання 0,49хв. ПРИКЛАД 26А 6-(1-Амінопропіл)-3-(3-хлорфеніл)-1,2,4триазин-5(4Н)-он Аналогічно методиці Прикладу 23А, використовували 419мг (1,4ммоль) Прикладу 13А і пропорційні кількості інших реагентів. Вихід: 280мг (77%) 1 Н-ЯМР (ДМСО-d6, 300МГц): δ=0,9 (т, 3Н), 1,9 (м, 1Н), 2,0 (м, 1Н), 4,3 (д/д, 1Н), 7,5 (м, 2Н), 8,2 (ш м, 4Н) м.ч.. ПРИКЛАД 27А 6-(1'-Амінопропіл)-3-(2-бромфеніл)-1,2,4триазин-5 (4Н)-он Аналогічно методиці Прикладу 23А, використовували 1,00г (2,85ммоль) Прикладу 14А і пропорційні кількості інших реагентів. Вихід: 152мг (17%) 1 Н-ЯМР (ДMCO-d6, 300МГц): δ=0,9 (т, 3Н), 1,9 19 75149 (м, 1Н), 2,0 (м, 1Н), 4,3 (д/д, 1Н), 7,3 (м, 1Н), 7,4 (м, 1Н), 7,5 (м, 1Н), 7,7 (м, 1Н) м.ч.. ПРИКЛАД 28А 6-(1-Амінопропіл)-3-циклогексил-1,2,4-триазин5(4Н)-он Аналогічно методиці Прикладу 23А, використовували 1,14г (4,10ммоль) Прикладу 15А і пропорційні кількості інших реагентів. Вихід: 128мг (13%) 1 Н-ЯМР (ДMCO-d6, 300МГц): δ=0,9 (т, 3Н), 1,3 (м, 3Н), 1,5 (м, 2Н), 1,7 (м, 1Н), 1,8 (їй, 4Н), 2,6 (м, 1Н), 4,3 (м, 1Н)м.ч.. ПРИКЛАД 29А 6-(1-Амінопропіл)-3-(4-бромфеніл)-1,2,4триазин-5(4Н)-он Аналогічно методиці Прикладу 23А, використовували 5,0г (14,2ммоль) Ν-{1-[3-(4-бромфеніл)-5оксо-4,5-дигідро-1,2,4-триазин-6іл]пропіл}ацетаміду і пропорційні кількості інших реагентів. Вихід: 3,4г (77%) 1 Н-ЯМР (300МГц, CD3OD): δ=1,02 (т, 3Н), 1,872,22 (м, 5Н, с при 1,96), 4,42-4,53 (т, 1Н), 7,63 (д,2Н), 8,09 (д, 2Н) м.ч.. ПРИКЛАД 30А 6-(1-Амінопропіл)-3-циклопропіл-1,2,4-триазин5(4Н)-он Аналогічно методиці Прикладу 23А, використовували 4,90г (20,7ммоль) N-[1-(3-циклопропіл-5оксо-4,5-дигідро-1,2,4-триазин-6іл)пропіл]ацетаміду і пропорційні кількості інших реагентів. Вихід: 1,6г (40%) РХ/МС (спосіб А): час утримання 0,36хв., m/z 195 [М+Н] ПРИКЛАД 31А 6-(1-Амінопропіл)-3-трет-бутил-1,2,4-триазин-5 (4Н)-он Аналогічно методиці Прикладу 23А, використовували 1,77г (4,42ммоль) N-[1-(3-трет-бутил-5оксо-4,5-дигідро-1,2,4-триазин-6іл)пропіл]ацетаміду і пропорційні кількості інших реагентів. Вихід: 850мг (91%) 1 Н-ЯМР (400МГц, CD3OD): δ=0,99 (т, 3Н), 1,34 (с, 9Н), 1,82-2,12 (м, 2Н), 4,34 (т, 1Н) м.ч.. ПРИКЛАД 32А 6-(1-Амінопропіл)-3-циклопентил-1,2,4триазин-5(4Н)-он 20 Аналогічно методиці Прикладу 23А, використовували 1,65г (6,24ммоль) N-[1-(3-циклопентил-5оксо-4,5-дигідро-1,2,4-триазин-6іл)пропіл]ацетаміду і пропорційні кількості інших реагентів. Вихід: 900мг (65%) 1 Н-ЯМР (300МГц, CD3OD): δ=0,99 (т, 3Н), 1,642,11 (м, 10Н), 3,03 (квін., 1Н), 4,30 (τ, 1Н)м.ч.. ПРИКЛАД 33А 6-(1-Амінопропіл)-3-(3-нітрофеніл)-1,2,4триазин-5(4Н)-он Аналогічно методиці Прикладу 23А, використовували 13,5г (42,5ммоль) Ν-{1-[3-(3-нітрофеніл)5-оксо-4,5-дигідро-1,2,4-триазин-6іл]пропіл}ацетаміду і пропорційні кількості інших реагентів. Вихід: 6,2г (41%) РХ/МС (спосіб А): час утримання 0,497хв., m/z 276 [М+Н] ПРИКЛАД 34А 6-(1-Амінопропіл)-3-феніл-1,2,4-триазин-5 (4Н)-он Аналогічно методиці Прикладу 23А, використовували 10,00г (36,7ммоль) Прикладу 21А і пропорційні кількості інших реагентів. Вихід: 6,7г (77%) 1 Н-ЯМР (ДМСО-d6, 200МГц): δ=0,9 (т, 3Н), 1,9 (м, 2Н), 4,1 (м, 1Н), 4,3 (дд, 1Н), 7,4 (м, 3Н), 8,2 (м, 2Н), 8,3 (шс, 2Н) м.ч.. ПРИКЛАД 35А 6-(1-Амінопропіл)-3-(1-нафтил)-1,2,4-триазин-5 (4Н)-он Аналогічно методиці Прикладу 23А, використовували 700мг (2,17ммоль) Прикладу 22А і пропорційні кількості інших реагентів. Вихід: 557мг (91%) 1 Н-ЯМР (ДМСО-d6, 300МГц): δ=0,9 (т, 3Н), 1,82,2 (м, 2Н), 4,4 (д/д, 1Н), 7,4-8,7 (м, 10Н)м.ч.. ПРИКЛАД 36А N-{1-[3-(3-Бромфеніл)-5-оксо-4,5-дигідро-1,2,4триазин-6-іл]пропіл}-4-третбутилциклогексанкарбоксамід 500мг (1,62ммоль, 1екв.) Прикладу 23А су 21 75149 22 спендували в 40мл дихлорметану, додавали трет-бутил-1,2,4-триазин-5(4Н)-ону, 200мг 0,48мл (3,44ммоль, 2екв.) триетиламіну і 328мг (1,00ммоль) 4-трет(1,62ммоль) 4-третбутилциклогексанкарбонілхлориду і пропорційні бутилциклогексанкарбонілхлориду. Реакційну сукількості інших реагентів. Неочищений продукт міш перемішували при кімнатній температурі до використовували на наступній стадії без подальзавершення реакції (1-2 години). Реакційну суміш шого очищення. додавали до такого ж об'єму 1N хлорводневою Вихід: 377мг неочищеного продукту. кислотою, органічну фазу промивали 1N хлорводПРИКЛАД 40А невою кислотою і насиченим водним розчином 4-трет-Бутил-N-[1-(5-оксо-3-феніл-4,5-дигідрохлориду натрію, сушили над сульфатом натрію і 1,2,4-триазин-6-іл)пропіл]циклогексанкарбоксамід упарювали до суха. Продукт використовували без подальшого очищення або очищали за допомогою хроматографія (флеш, або колонкова хроматографія, або препаративна ВЕРХ). РХ/МС (А): МС (ЕСІ): 475, 477 (М+Н), час Аналогічно методиці Прикладу 36А, викорисутримання 3,17, 3,20хв. товували 100мг (0,43ммоль) Прикладу 34А, 100мг ПРИКЛАД 37А (0,48ммоль) 4-трет4-трет-Бутил-N-[1-(3-циклопропіл-5-оксо-4,5бутилциклогексанкарбонілхлориду і пропорційні дигідро-1,2,4-триазин-6кількості інших реагентів. Одержували суміш ізоіл)пропіл]циклогексанкарбоксамід мерів. Вихід: 150мг (87%) РХ/МС (А): МС (ЕСІ): 397 (М+Н), час утримання 4,14хв. ПРИКЛАД 41А цис-4-трет-Бутил-N-{1-[3-(1-нафтил)-5-оксоАналогічно методиці Прикладу 36А, викорис4,5-дигідро-1,2,4-триазин-6-іл]пропіл}товували 250мг (1,29ммоль) 6-(1-амінопропіл)-3циклогексанкарбоксамід циклопропіл-1,2,4-триазин-5(4Н)-ону, 260мг (1,29ммоль) 4-третбутилциклогексанкарбонілхлориду і пропорційні кількості інших реагентів. Неочищений продукт використовували на наступній стадії без подальДо розчину 252мг (1,37ммоль) цис-4-третшого очищення. бутилциклогексанкарбонової кислоти і 185мг Вихід: 464мг неочищеного продукту (1,37ммоль) 1-гідрокси-1Н-бензотриазолу в 9мл ПРИКЛАД 38А дихлорметану і 1мл ДМФА додавали при 0°С спо4-трет-Бутил-N-[1-(3-циклопентил-5-оксо-4,5чатку 0,23мл N-етилдіізопропіламіну і потім 300мг дигідро-1,2,4-триазин-6(0,91ммоль) Прикладу 35А. Через 10 хвилин розіл)пропіл]циклогексанкарбоксамід чин залишали нагріватись до кімнатної температури і перемішували протягом ночі. Розчин розводили дихлорметаном і двічі промивали 1N НСІ розчином і потім 5% розчином бікарбонату натрію. Органічну фазу сушили над сульфатом натрію, фільтрували і упарювали до суха. Залишок очиАналогічно методиці Прикладу 36А, викорисщали за допомогою препаративної ВЕРХ. товували 200мг (0,90ммоль) 6-(1-амінопропіл)-3Вихід: 215мг (53%) циклопентил-1,2,4-триазин-5(4Н)-ону, 180мг 1 Н-ЯМР (ДМСО-d6, 200МГц): δ=0,8 (с, 9Н), 1,0 (0,90ммоль) 4-трет(т, 3Н), 1,2-2,2 (м, 12Н), 5,0 (м, 1Н), 7,5-8,3 (м, 8Н), бутилциклогексанкарбонілхлориду і пропорційні 14,1 (ш с, 1Н) м.ч.. кількості інших реагентів. Неочищений продукт ПРИКЛАД 42А використовували на наступній стадії без подальцис-4-трет-Бутилциклогексанкарбонової кисшого очищення. лоти Вихід: 350мг неочищеного продукту ПРИКЛАД 39А 4-трет-Бутил-N-[1-(3-трет-бутил-5-оксо-4,5дигідро-1,2,4-триазин-6іл)пропіл]циклогексанкарбоксамід Розділення за допомогою препаративної ВЕРХ цисі транс-4-третбутилциклогексанкарбонову кислоту проводили за наступних умов: Аналогічно методиці Прикладу 36А, використовували 210мг (1,00ммоль) 6-(1-амінопропіл)-3 23 Подача: Колонка: Нерухома фаза: Рухома фаза: Потік: Об'єм введення: Довжина хвилі: Температура: 75149 24 10г ізомерної суміші цис- і транс-4-трет-бутил-цикло-гексанкарбонової кислоти розчиненої в 500мл ізо-гексан (80%)/трет-бутилметиловий етер (20%) 330 100мм; Self Packing Device NW 100; Merck LiChrospher Si 60, 12мкм, Merck ізо-гексан/трет-бутилметиловий етер (4/1об./об.)+0,25об.% оцтової кислоти 150мл/хв 70мл (=1,4г сполуки) 210нМ 25°С. Зразок проганяли через цю колонку повторно вводячи через кожні 30 хвилин. Спочатку елюювали цис-ізомер. цис-ізомер: Тпл.: 118°С. 1 Н-ЯМР (300МГц, ДМСО): δ=0,9 (т, 3Н), 1,0 (м, 3Н), 1,4 (м, 2Н), 1,6 (м, 1Н), 2,1 (м, 2Н), 2,5 (м, 1Н),12,0(с, 1Н)м.ч.. транс-ізомер: Тпл.: 172°С. 1 Н-ЯМР (300МГц, ДМСО): δ=0,9 (т, 3Н), 1,0 (м, 3Н), 1,3 (м, 2Н), 1,7 (м, 1Н), 1,9 (м,2Н), 2,1 (м, 1Н), 11,9 (с, 1Н) м.ч.. ПРИКЛАД 43А цис-4-трет-Бутилциклогексанкарбонілхлорид 2,0г (10,85ммоль) цис-4-третБутилциклогексанкарбонової кислоти (Приклад 42А) розчиняли в 50мл дихлорметану, додавали 1,65г (13,02ммоль) етандіоїлдихлориду і розчин перемішували при кімнатній температурі протягом однієї години. Суміш потім перемішували при температурі кипіння із зворотнім холодильником протягом двох годин і після охолодження до кімнатної температури, упарювали до суха у вакуумі. Залишок потім розчиняли в толуолі два рази і знову упарювали до суха у вакуумі. Залишок використовували на наступній стадії без подальшого очищення. ПРИКЛАД 44А 4-Нітробензолкарбоксімідаміду гідрохлорид Аналогічно методиці Прикладу 3А, використовували 10,0г (67,5ммоль) 4-нітробензонітрилу і пропорційні кількості інших реагентів. Вихід: 12,64г (93%) 1 Н-ЯМР (ДМСО-d6, 200МГц): δ=8,1 (м, 2Н), 8,4 (м, 2Н) м.ч.. ПРИКЛАД 45А 3-Ціанобензолкарбоксімідаміду гідрохлорид Аналогічно методиці Прикладу 3А, використо вували 20,0г (125,9ммоль) 3-ціанобензойної кислоти і пропорційні кількості інших реагентів. Вихід: 4,27г (17%) 1 Н-ЯМР (ДМСО-d6, 300МГц): δ=7,8 (м, 1Н), 8,1 (м, 1Н), 8,2 (м, 1Н), 8,3 (м, 1Н), 9,4 (ш с, 4Н) м.ч.. ПРИКЛАД 46А N-{1-[3-(4-Метилфеніл)-5-оксо-4,5-дигідро1,2,4-триазин-6-іл]пропіл}ацетамід Аналогічно методиці Прикладу 10А, використовували 3,0г (17,6ммоль) 4метилбензолкарбоксімідаміду гідрохлориду і пропорційні кількості інших реагентів. Вихід: 2,74г (54%) 1 Н-ЯМР (ДMCO-d6, 400МГц): δ=0,9 (т, 3Н), 1,6 (м, 1Н), 1,9 (м, 1Н; с, 3Н), 2,4 (с, 3Н), 4,9 (м, 1Н), 7,4 (м, 2Н), 7,9 (м, 2Н), 14,0 (с, 1Н) м.ч.. ПРИКЛАД 47А N-{1-[3-(4-Нітрофеніл)-5-оксо-4,5-дигідро-1,2,4триазин-6-іл]пропіл}ацетамід Аналогічно методиці Прикладу 10А, використовували 7,29г (36,16ммоль) Прикладу 44А і пропорційні кількості інших реагентів. Вихід: 3,35г (29%) 1 Н-ЯМР (ДМСО-d6, 400МГц): δ=0,9 (т, 3Н), 1,6 (м, 1Н), 1,9 (м, 1Н; с, 3Н), 5,0 (м, 1Н), 8,1 (д, 1Н), 8,3 (м, 2Н), 8,4 (м, 2Н) м.ч.. ПРИКЛАД 48А N-{1-[3-(3-Ціанофеніл)-5-оксо-4,5-дигідро-1,2,4триазин-6-іл]пропіл}ацетамід Аналогічно методиці Прикладу 10А, використовували 4,27г (23,5ммоль) Прикладу 45А і пропорційні кількості інших реагентів. Вихід: 2,41г (34%) 1 Н-ЯМР (ДМСО-d6, 300МГц): δ=0,9 (т, 3Н), 1,6 (м, 1Н), 1,9 (м, 1Н; с, 3Н), 4,9 (м, 1Н), 7,8 (м, 1Н), 8,1 (м, 2Н), 8,3 (м, 1Н), 8,4 (м, 1Н), 14,2 (ш с, 1Н) м.ч.. ПРИКЛАД 49А 6-(1-Амінопропіл)-3-(4-метилфеніл)-1,2,4триазин-5 (4Н)-он 25 75149 26 ли в 20мл дихлоретану і додавали 276мг (2,72ммоль) триетиламіну і 552мг (2,72ммоль) цис4-трет.-бутилциклогексанкарбонілхлориду. Суміш перемішували при кімнатній температурі протягом однієї години, потім додавали 279мг (1,82ммоль) Аналогічно методиці Прикладу 23А, викорисоксихлориду фосфору. Суміш перемішували при товували 2,74г (9,57ммоль) Прикладу 46А і пропокип'ятінні із зворотнім холодильником протягом 3 рційні кількості інших реагентів. Продукт викорисгодин. Після охолодження до кімнатної температутовували на наступній стадії без подальшого ри додавали етилацетат і насичений NaHCO3 очищення. (вод). Органічну фазу промивали насиченим 1 Н-ЯМР (ДМСО-d6, 300МГц): δ=0,9 (т, 3Н), 1,8 NaHCO3 (вод), водою і насиченим водним розчи(м, 1Н), 1,9 (м, 1Н), 2,3 (с, 3Н), 4,1 (д/д, 1Н), 7,2 (м, ном хлориду натрію, сушили над сульфатом на2Н), 8,1 (м, 2Н) м.ч.. трію і упарювали до суха у вакуумі. Продукт очиПРИКЛАД 50А щали за допомогою хроматографії. 6-(1-Амінопропіл)-3-(4-нітрофеніл)-1,2,4Вихід: 127мг (16%) цис-продукту триазин-5(4Н)-он МС (ЕСІ): 442, 444 (М+Н). ПРИКЛАД 54А цис-4-трет-Бутил-N-[1-(5-оксо-3-феніл-4,5дигідро-1,2,4-триазин-6іл)пропіл]циклогексанкарбоксамід Аналогічно методиці Прикладу 23А, використовували 3,33г (10,51ммоль) Прикладу 47А і пропорційні кількості інших реагентів. Вихід: 1,29г (45%) РХ/МС (А): МС (ЕСІ): 276 (М+Н), час утриман1,3г (5,65ммоль) Прикладу 34А суспендували ня 0,49хв. в 50мл 1,2-дихлоретану, додавали 0,94мл ПРИКЛАД 51А (6,78ммоль) триетиламіну і 1,26г (6,21ммоль) цис3-[6-(1-Амінопропіл)-5-оксо-4,5-дигідро-1,2,44-трет.-бутилциклогексанкарбонілхлориду (Приктриазин-3-іл]бензонітрил лад 43А). Реакційну суміш перемішували при кім Аналогічно методиці Прикладу 23А, використовували 2,41г (8,11ммоль) Прикладу 48А і пропорційні кількості інших реагентів. Вихід: 1,1г (53%) РХ/МС (А): МС (ЕСІ): 256 (М+Н), час утримання 1,27хв. ПРИКЛАД 52А 4-трет-Бутил-N-{1-[3-(4-метилфеніл)-5-оксо4,5-дигідро-1,2,4-триазин-6-іл]пропіл}циклогексанкарбоксамід Аналогічно методиці Прикладу 37А, використовували 800мг (3,27ммоль) Прикладу 49А, 730мг (3,60ммоль) 4-третбутилциклогексанкарбонілхлориду і пропорційні кількості інших реагентів. Продукт використовували на наступній стадії без подальшого очищення. РХ/МС (А): МС (ЕСІ): 411 (М+Н), час утримання 3,09хв. ПРИКЛАД 53А цис-7-(4-трет-Бутилциклогексил)-4-хлор-5етил-2-(4-нітрофеніл)імідазо[5,1-f]-[1,2,4]триазин 500мг (1,82ммоль) Прикладу 50А суспендува натній температурі протягом ночі. Реакційну суміш розводили дихлорметаном, промивали насиченим бікарбонатом натрію, органічну фазу сушили над сульфатом магнію, фільтрували і упарювали до суха. Вихід: 2,2г (98,3%) РХ/МС: МС (ЕСІ): 397 (М+Н), час утримання 4,14хв. ПРИКЛАДИ ОДЕРЖАННЯ ПРИКЛАД 1 2-(3-Бромфеніл)-7-(4-трет-бутилциклогексил)5-етилімідазо[5,1-f][1,2,4]триазин-4(3Н)-он 770мг (1,62ммоль, 1екв.) Прикладу 36А суспендували в 70мл дихлоретану і додавали 373мг (2,45ммоль, 1,5екв.) оксихлориду фосфору. Суміш перемішували при кип'ятінні із зворотнім холодильником протягом 3 годин. Потім додавали ще 373мг оксихлориду фосфору і перемішували при кип'ятінні із зворотнім холодильником протягом ночі. Після охолодження до кімнатної температури, додавали етилацетат і насичений NaHCO3 (вод). Органічну фазу промивали насиченим NaHCO3 (вод), водою і насиченим водним розчином хлориду натрію, сушили над сульфатом натрію і упарювали до суха у вакуумі. Продукт очищали і ізомери розділяли за допомогою хроматографії (флеш, або колонкова хроматографія, або препаративна ВЕРХ). Вихід. 156мг (21%) цис-ізомер 1 Н-ЯМР (ДМСО-d6, 300МГц): δ=0,8 (с, 9Н), 1,1 27 75149 28 (м, 2Н), 1,2 (т, 3Н), 1,5 (м, 2Н), 1,7 (м, 2Н), 2,2 (м, Аналогічно методиці Прикладу 1, 350мг 2Н), 2,9 (к, 2Н), 3,5 (м, 1Н), 7,5 (м, 1Н), 7,8 (м, 1Н), (0,90ммоль) неочищеного 4-трет-бутил-N-[1-(38,0 (м, 1Н), 8,1 (м, 1Н), 11,8 (с, 1Н)м.ч.. циклопентил-5-оксо-4,5-дигідро-1,2,4-триазин-6ПРИКЛАД 2 іл)пропіл]циклогексанкарбоксаміду, 140мг 7-(4-трет-Бутилциклогексил)-2-циклопропіл-5(0,90ммоль) оксихлориду фосфору перемішували етилімідазо[5,1-f][1,2,4]триазин-4(3Н)-он при кипінні із зворотнім холодильником протягом 3 годин, використовуючи- пропорційні кількості розчинників. Ізомери розділяли за допомогою хроматографії. Вихід: 21мг (6,3%) цис-ізомер (Приклад 5) 1 Н-ЯМР (200МГц, ДMCO-d6): δ=0,82 (с, 9Н), 0,98-1,12 (м, 1Н), 1,18 (т, 3Η), 1,44-2,01 (м, 14Н), Аналогічно методиці Прикладу 1, 464мг 2,05-2,20 (м, 2Н), 2,77-2,98 (м, 3Н), 3,40 (м, 1Н) (1,29ммоль) неочищеного 4-трет-бутил-М-[1-(3м.ч.. циклопропіл-5-оксо-4,5-дигідро-1,2,4-триазин-6Вихід: 31мг (17%) транс-ізомер (Приклад 6) 1 іл)пропіл]циклогексанкарбоксаміду, 200мг Н-ЯМР (200МГц, ДМСО-d6): δ=0,86 (с, 9Н), (1,29ммоль) оксихлориду фосфору перемішували 1,03-1,26 (м, 5Н, т при 1,17), 1,45-2,18 (м, 14Н), при кипінні із зворотнім холодильником протягом 3 2,74-3,03 (м, 3Н) м.ч.. годин, використовуючи пропорційні кількості розПРИКЛАДИ 7 і 8 чинників. Одержану суміш розділяли на ізомери за 7-(4-трет-Бутилциклогексил)-5-етил-2допомогою хроматографії на силікагелі використофенілімідазо[5,1-f][1,2,4]триазин-4(3Н)-он вуючи в якості елюенту циклогексан/етилацетат 5/1, 2/1. Вихід: 20мг (4,5%) цис-ізомер 1 Н-ЯМР (200МГц, ДМСО-d6): δ=0,82 (с, 9Н), 0,93-1,11 (м, 5Н), 1,18 (т, 3Н), 1,44-2,18 (м, 9Н), 2,83 (к, 2Н), 3,33 (м, 1Н), 11,62 (с, 1Н, NH) м.ч.. ПРИКЛАДИ 3 і 4 Спосіб а) 2-трет-Бутил-7-(4-трет-бутилциклогексил)-5Аналогічно методиці Прикладу 1, 150мг етилімідазо[5,1-f][1,2,4]триазин-4(3Н)-он (0,39ммоль) Прикладу 40А, 250мг (1,61ммоль) оксихлориду фосфору перемішували при кипінні із зворотнім холодильником протягом 3 годин, використовуючи пропорційні кількості розчинників. Ізомери розділяли за допомогою хроматографії. Вихід: 26мг (18%) транс-ізомер (Приклад 7) 1 Н-ЯМР (300МГц, ДМСО): δ=0,87 (с, 9Н), 1,031,28 (м, 3Н), 1,23 (т, 3Н), 1,52-1,72 (м, 2Н), 1,78Аналогічно методиці Прикладу 1, 377мг 1,93 (м, 2Н), 1,99-2,10 (м, 2Н), 2,90 (к, 2Н), 3,07(1,00ммоль) неочищеного 4-трет-бутил-N-[1-(33,21 (м, 1Н), 7,51-7,67 (м, 3Н), 7,93-8,02 (м, 2Н), трет-бутил-5-оксо-4,5-дигідро-1,2,4-триазин-611,95(с, 1Н) м.ч.. іл)пропіл]циклогексанкарбоксаміду, 184мг Вихід: 11мг (8%) цис-ізомер (Приклад 8) (1,20ммоль) оксихлориду фосфору перемішували 1 Н-ЯМР (300МГц, ДМСО): δ=0,83 (с, 9Н), 1,00при кипінні із зворотнім холодильником протягом 3 1,16 (м,1Н), 1,22 (т, 3Н), 1,44-1,79 (м, 6Н), 2,11-2,23 годин, використовуючи пропорційні кількості роз(м, 2Н), 2,90 (к, 2Н), 3,49-3,59 (м, 1Н), 7,47-7,60 (м, чинників. Одержану суміш розділяли на чисті цис- і 3Н), 7,91-7,98 (м, 2Н) м.ч.. транс-ізомери за допомогою хроматографії на сиСпосіб б) для одержання Прикладу 8 лікагелі використовуючи в якості елюенту циклоге7-(цис-4-трет-Бутилциклогексил)-5-етил-2ксан/етилацетат 10/1,5/1. фенілімідазо[5,1-f][1,2,4]триазин-4(3Н)-он Вихід: 22мг (6,13%) цис-ізомер (Приклад 3) 1 Н-ЯМР (200МГц, ДМСО-d6): δ=0,82 (с, 9Н), 0,95-1,12 (м, 1Н), 1,18 (т, 3Н), 1,28 (с, 9Н), 1,461,72 (м, 6Н), 2,09-2,23 (м, 2Н), 2,85 (к, 2Н), 3,43 (м, 1Н), 11,22 (с, 1Η, ΝΗ) м.ч.. Вихід: 60мг (17%) транс-ізомер (Приклад 4) 1 Н-ЯМР (200МГц, ДМСО-de): δ=0,87 (с, 9Н), 0,93-1,12 (м, 3Н), 1,18 (т, ЗН), 1,03 (с, 9Н), 1,482,2г (5,55ммоль, 1екв.) Прикладу 54А суспен2,07 (м, 6Н), 2,83 (к, 2Н), 2,98 (м, 1Н) м.ч.. дували в 50мл дихлоретану і додавали 3,62г ПРИКЛАДИ 5 і 6 (23,2ммоль, 4екв.) оксихлориду фосфору. Суміш 7-(4-трет-Бутилциюіогексил)-2-циклопентил-5перемішували при кип'ятінні із зворотнім холодиетилімідазо[5,1-f][1,2,4]триазин-4(3Н)-он льником протягом 4 годин. Після охолодження до кімнатної температури, додавали дихлорметан і органічну фазу гасили водою, промивали водою, сушили над сульфатом магнію і упарювали до суха у вакуумі. Твердий залишок промивали діетиловим етером, фільтрували і сушили. Вихід: 1,02г (49%) 29 75149 30 Н-ЯМР ідентичний приведеному вище (динітрофеніл)імідазо[5,1-f][1,2,4]триазин-4(3Н)-он віться спосіб а). Спосіб в) для одержання Прикладу 8 20,45г (0,09моль) 6-(1-Амінопропіл)-3-феніл1,2,4-триазин-5(4Н)-ону (Приклад 34А) розчиняли в дихлоретані, додавали 502г (5,08моль) триетиламіну і 19,8г (0,10моль) цис-4-третбутилциклогексанкарбонілхлориду. Розчин пере598мг (1,35ммоль) Прикладу 53А суспендувамішували при кип'ятінні із зворотнім холодильнили в метанолі і додавали 10мл гідроксиду натрію ком протягом трьох годин, потім додавали 20,42г (10% у воді). Суміш перемішували при кипінні із (0,13моль) оксихлориду фосфору. Розчин перемізворотнім холодильником протягом ночі. Після шували при кип'ятінні із зворотнім холодильником охолодження до кімнатної температури, метанол протягом ще 4 годин і після охолодження до кімнаупарювали у вакуумі, залишок розчиняли в етилатної температури додавали воду, гідроксид натрію цетаті, органічну фазу промивали водою і насичеі потім дихлорметан. Органічну фазу упарювали ним водним розчином хлориду натрію, сушили над до суха у вакуумі і залишок розтирали з діетилосульфатом натрію і упарювали до суха у вакуумі. вим етером і фільтрували. Тверду речовину розВихід: 580мг (кількісно) 1 чиняли в метанол (75%)/дихлорметан (25%), дихН-ЯМР (ДМСО-d6, 300МГц): δ=0,8 (с, 9Н), 1,1 лорметан упарювали у вакуумі, і кристалізований (м, 1Н), 1,2 (т, 3Н), 1,5-1,7 (м, 6Н), 2,2 (м, 2Н), 2,9 продукт фільтрували і сушили. (к, 2Н), 3,6 (м, 1Н), 8,2 (м, 2Н), 8,4 (м, 2Н), 12,1 (с, Вихід: 17,8г (52%) 1Н) м.ч.. 1 Н-ЯМР ідентичний приведеному вище (диПРИКЛАДИ 12 і 13 віться спосіб а). 7-(4-трет-Бутилциклогексил)-5-етил-2-(3ПРИКЛАД 9 фторфеніл)імідазо[5,1-f][1,2,4]триазин-4(3Н)-он 7-(цис-4-трет-Бутилциклогексил)-5-етил-2-(1нафтил)імідазо[5,1-f][1,2,4]триазин-4(3Н)-он 1 Розчин 200мг (0,45ммоль) Прикладу 41А і 104мг (0,67ммоль) оксихлориду фосфору в 10мл 1,2-дихлоретану перемішували при кип'ятінні із зворотнім холодильником протягом 4 годин. Після обробки аналогічно до методики приведеної в Прикладі 1, одержували твердий продукт. Вихід: 172мг (89%) Температура плавлення: 203°С. 1 Н-ЯМР (ДМСО-d6, 200МГц): δ=11,9 (с, 1Н), 8,3-7,5 (м, 7Н), 3,5 (м, 1Н), 2,9 (к, J=7,5Гц, 2Н), 2,1 (м, 2Н), 1,7-1,5 (м, 6Н), 1,3 (т, J=7,5Гц, 3Н), 1,0 (м, 1Н), 0,8 (с, 9Н) м.ч.. ПРИКЛАД 10 7-(цис-4-трет-Бутилциклогексил)-5-етил-2-(4метилфеніл)імідазо[5,1-f][1,2,4]-триазин-4(3Н)-он Аналогічно методиці Прикладу 1, 1750мг (4,26ммоль) Прикладу 52А, 980мг (6,39ммоль) оксихлориду фосфору перемішували при кипінні із зворотнім холодильником протягом ночі, використовуючи пропорційні кількості розчинників. Вихід: 40мг (2%) 1 Н-ЯМР (ДМСО-d6, 300МГц): δ=0,8 (т, 9Н), 1,1 (м, 1Н), 1,2 (т, 3Н), 1,6 (м, 6Н), 2,2 (м, 2Н), 2,4 (с, 3Н), 2,9 (к, 2Н), 3,5 (м, 1Н), 7,4 (м, 2Н), 7,9 (м, 2Н), 11,7 (с, 1Н) м.ч.. ПРИКЛАД 11 7-(цис-4-трет-Бутилциклогексил)-5-етил-2-(4 500мг (2,01ммоль) Прикладу 25А суспендували в 20мл дихлоретану і додавали 306мг (3,02ммоль) триетиламіну і 408мг (2,01ммоль) 4трет.-бутилциклогексанкарбонілхлориду. Суміш перемішували при кімнатній температурі протягом однієї години, потім додавали 463мг (3,02ммоль) оксихлориду фосфору. Суміш перемішували при кип'ятінні із зворотнім холодильником протягом 3 годин. Після охолодження до кімнатної температури, додавали етилацетат і насичений NaHCO3 (вод). Органічну фазу промивали насиченим NaHCO3 (вод), водою і насиченим водним розчином хлориду натрію, сушили над сульфатом натрію і упарювали до суха у вакуумі. Продукт очищали за допомогою хроматографії. Вихід: 33мг (4%) цис-продукт (Приклад 12) 1 Н-ЯМР (ДМСО-d6, 200МГц): δ=0,8 (с, 9Н), 1,0 (м, 1Н), 1,2 (т, 3Н), 1,5-1,7 (м, 6Н), 2,2 (м, 2Н), 2,9 (к, 2Н), 3,6 (м, 1Н), 7,5 (м, 1H), 7,6 (м, 1Н), 7,8 (м, 2Н), 12,0 (ш с, 1Н) м.ч.. Вихід: 29мг (4%) транс-продукт (Приклад 13) 1 Н-ЯМР (ДМСО-d6, 200МГц): δ=0,8 (с, 9Н), 1,1 (м, 1Н), 1,2 (т, 3Н), 1,6 (м, 4Н), 1,9 (м, 2Н), 2,0 (м, 2Н), 2,9 (к, 2Н), 3,1 (м, 1Н), 7,5 (м, 1Н), 7,6 (м, 1Н), 7,8 (м, 2Н) м.ч.. ПРИКЛАД 14 цис-3-[7-(4-трет-Бутилциклогексил)-5-етил-4оксо-3,4-дигідроімідазо[5,1-f][1,2,4]-триазин-2іл]бензонітрил 31 75149 32 Аналогічно методиці Прикладів 12 і 13, викоВихід: 0,70г (41%) 1 ристовували 1,09г (4,27ммоль) Прикладу 51А, Н-ЯМР (ДМСО-d6, 300МГц): δ=0,8 (с, 9Н), 1,1 0,86г (4,27ммоль) цис-4-трет(м, 1Н), 1,2 (т, 3Н), 1,5-1,7 (м, 6Н), 2,2 (м, 2Н), 2,9 бутилциклогексанкарбонілхлориду і пропорційні (к, 2Н), 3,6 (м, 1Н), 7,7 (м, 1Н), 8,0 (м, 1Н), 8,3 (м, кількості інших реагентів. 1Н), 8,4 (м, 1Н), 11,9 (с, 1Н) м.ч.. Комп’ютерна верстка Т. Чепелева Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюImidazotriazinones derivatives and pharmaceutical composition based thereon
Автори англійськоюHendrix, Martin, Bischoff Chilmar, Schlemmer, Karl-Heinz
Назва патенту російськоюПроизводные имидазотриазинонов и фармацевтическая композиция на их основании
Автори російськоюБишофф Хильмар
МПК / Мітки
МПК: C07D 253/00, A61P 37/02, A61P 11/00, A61P 11/06, C07D 487/04, A61K 31/53, A61P 29/00
Мітки: імідазотриазинонів, композиція, фармацевтична, основі, похідні
Код посилання
<a href="https://ua.patents.su/16-75149-pokhidni-imidazotriazinoniv-i-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Похідні імідазотриазинонів і фармацевтична композиція на їх основі</a>
Попередній патент: Спосіб ремонту поліетиленових газопроводів
Наступний патент: Шихта для виготовлення вогнетривких виробів
Випадковий патент: Фліпчарт розкладний "ig-равлик"












