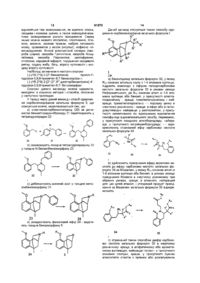
Похідні бензазоцинолу та фармацевтична композиція на їх основі
Номер патенту: 61973
Опубліковано: 15.12.2003
Автори: Картер Адріан, Пшорн Уве, Бехтель Вольф-Дітріх, Паллук Райнер, Вайзер Томас, Грауерт Маттіас
Формула / Реферат
1. Похідні бензазоцинолу загальної формули (I):
 , (І)
, (І)
де
Х означає простий зв'язок, -О-, алкілен із 1-4 атомами вуглецю, розгалужений або нерозгалужений алкіленовий місток із 1-8 атомами вуглецю, який у будь-якому місці може містити один або два атоми кисню;
R1 - водень, метил, етил, феніл;
R2 - водень, метил;
R3 - водень, фтор, хлор, бром;
R4 - водень, метил, етил;
R5 - водень, метил, етил;
R6 - водень, метил, етил;
R7 - трет.-бутил, циклогексил, феніл, незаміщений або заміщений однаковими або різними радикалами R9 і R10, при цьому
R9 - водень, метил, фтор, хлор, бром; і
R10 - водень, метил, фтор, хлор, бром;
при необхідності у формі окремих оптичних ізомерів, сумішей окремих енантіомерів або рацематів, а також у формі вільних основ або відповідних кислотно-адитивних солей із фармакологічно прийнятними кислотами.
2. Похідні бензазоцинолу загальної формули І згідно з п. 1, де
Х означає -О-, алкілен із 1-3 атомами вуглецю або О-алкілен з 1-4 атомами вуглецю, а R1 - R7 мають вказані в п.1 значення;
при необхідності у формі окремих оптичних ізомерів, сумішей окремих енантіомерів або рацематів, а також у формі вільних основ або відповідних кислотно-адитивних солей із фармакологічно прийнятними кислотами.
3. Похідні бензазоцинолу загальної формули I згідно з п. 1, де
R4 і R5 - незалежно один від одного водень або метил, при цьому, принаймні, один з цих радикалів означає метил;
при необхідності у формі окремих оптичних ізомерів, сумішей окремих енантіомерів або рацематів, а також у формі вільних основ або відповідних кислотно-адитивних солей із фармакологічно прийнятними кислотами.
4. Похідне бензазоцинолу загальної формули I згідно з п. 1, яке є (-)-(1R,2"S)-2-(2"-бензилокси)пропіл-4'-гідрокси-5,9,9-триметил-6,7-бензоморфаном у формі вільної основи або відповідної кислотно-адитивної солі з фармакологічно прийнятними кислотами.
5. Похідне бензазоцинолу загальної формули I згідно з п. 1, яке є (-)-(1R,2"S)-2-[2"-(2"',6"'-дифторбензил)окси]пропіл-4'-гідрокси-5,9,9-триметил-6,7-бензоморфаном у формі вільної основи або відповідної кислотно-адитивної солі з фармакологічно прийнятними кислотами.
6. Фармацевтична композиція для блокування залежного від напруги натрієвого каналу, що містить одну із сполук згідно з одним із пп. 1-5 або одну з її кислотно-адитивних солей, разом із звичайними допоміжними речовинами і носіями.
7. Фармацевтична композиція згідно з п. 6, що являє собою розчин для інфузій.
8. Фармацевтична композиція згідно з п. 6, що містить активну речовину в кількості від 0,001 до 20 ваг.% композиції.
9. Фармацевтична композиція згідно з п. 7, яка відрізняється тим, що містить активну речовину в кількості від 0,001 до 10 ваг.% композиції.
10. Фармацевтична композиція згідно з п. 8, яка відрізняється тим, що містить активну речовину в кількості від 0,01 до 5 ваг.% композиції.
Текст
УКРАЇНА UA (11)61973 (із) С2 (51)7 C07D221/26, А61К31/435, 31/485 МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ ОПИС ДО ПАТЕНТУ НА ВИНАХІД (54) ПОХІДНІ БЕНЗАЗОЦИНОЛУ ТА ФАРМАЦЕВТИЧНА КОМПОЗИЦІЯ НА IX ОСНОВІ (21)2000042088 (22)09 09 1998 (24)15 12 2003 (86) РСТ/ЕР98/05734, 09 09 1998 (31)197 40 110 4 (32)12 09 1997 (33) DE (46) 15 12 2003, Бюл № 12, 2003 р (72) Грауерт Маттіас , DE, Картер Адріан , GB, Бехтель Вольф-Дітріх , DE, Вайзер Томас , DE, Паллук Райнер , DE, Пшорн Уве , DE (73) БЬОРІНГЕР ІНГЕЛЬХАЙМ ФАРМА ГМБХ УНД КО КГ, DE (56) ЕР 0521422 А, 07 01 1993 ЕР 0006449 А, 09 01 1980 DE 2948308 А, 19 06 1980 DE 19528472 А, 06 02 1997 1 ПОХІДНІ бензазоцинолу загальної формули (І) Де X означає простий зв'язок, -О-, алкілен із 1-4 атомами вуглецю, розгалужений або нерозгалужений алкіленовий місток із 1-8 атомами вуглецю, який у будь-якому МІСЦІ може містити один або два атоми кисню, R1 - водень, метил, етил, феніл, R2 - водень, метил, R3 - водень, фтор, хлор, бром, R4 - водень, метил, етил, R5 - водень, метил, етил, R6 - водень, метил, етил, R7 -трет-бутил, циклогексил, феніл, незаміщений або заміщений однаковими або різними радикалами R91 R10, при цьому R9 - водень, метил, фтор, хлор, бром, і R10 - водень, метил, фтор, хлор, бром, при необхідності у формі окремих оптичних ізомерів, сумішей окремих енантюмерів або рацематів, а також у формі вільних основ або ВІДПОВІДНИХ кислотно-адитивних солей із фармакологічно прийнятними кислотами 2 ПОХІДНІ бензазоцинолу загальної формули І згідно з п 1, де X означає -О-, алкілен із 1-3 атомами вуглецю або О-алкілен з 1-4 атомами вуглецю, a R1 - R7 мають вказані в п 1 значення, при необхідності у формі окремих оптичних ізомерів, сумішей окремих енантюмерів або рацематів, а також у формі вільних основ або ВІДПОВІДНИХ кислотно-адитивних солей із фармакологічно прийнятними кислотами 3 ПОХІДНІ бензазоцинолу загальної формули І згідно з п 1, де R4 і R5 - незалежно один від одного водень або метил, при цьому, принаймні, один з цих радикалів означає метил, при необхідності у формі окремих оптичних ізомерів, сумішей окремих енантюмерів або рацематів, а також у формі вільних основ або ВІДПОВІДНИХ кислотно-адитивних солей із фармакологічно прийнятними кислотами 4 Похідне бензазоцинолу загальної формули І згідно з п 1, яке є (-)-(1R,2"S)-2-(2"бензилокси)пропіл-4'-пдрокси-5,9,9-триметил-6,7бензоморфаном у формі вільної основи або відповідної кислотно-адитивної солі з фармакологічно прийнятними кислотами 5 Похідне бензазоцинолу загальної формули І згідно з п 1, яке є (-)-(1R,2"S)-2-[2"-(2'",61"дифторбензил)окси]пропіл-4'-пдрокси-5,9,9триметил-6,7-бензоморфаном у формі вільної основи або відповідної кислотно-адитивної солі з фармакологічно прийнятними кислотами 6 Фармацевтична композиція для блокування залежного від напруги натрієвого каналу, що містить одну із сполук згідно з одним із пп 1-5 або одну з и кислотно-адитивних солей, разом із звичайними допоміжними речовинами і носіями 7 Фармацевтична композиція згідно з п 6, що являє собою розчин для інфузій 8 Фармацевтична композиція згідно з п 6, що містить активну речовину в КІЛЬКОСТІ ВІД 0,001 до 20 ваг % композиції О C O О> (О З 61973 4 9 Фармацевтична композиція згідно з п 7, яка 10 Фармацевтична композиція згідно з п 8, яка відрізняється тим, що містить активну речовину в відрізняється тим, що містить активну речовину в КІЛЬКОСТІ від 0,001 до 10 ваг % композиції КІЛЬКОСТІ ВІД 0,01 до 5 ваг % композиції Винахід стосується нових похідних бензоморфану, що мають фармакологічну активність, більш конкретно, похідних бензазоцинолу, що є блокаторами залежного від напруги натрієвого каналу лежно один від одного водень або метил, при цьому, принаймні, один з цих радикалів означає метил, при необхідності у формі окремих оптичних ізомерів, сумішей окремих енантюмерів або рацематів, а також у формі вільних основ або ВІДПОВІДНИХ кислотно-адитивних солей із фармакологічно прийнятними кислотами Для солеутворення придатні як неорганічні, так і органічні кислоти Переважно викоритсовують галогенводневі кислоти, наприклад, хлорводневу кислоту або бромводневу кислоту, фумарову або дигліколеву кислоту Особлива перевага надається наступним сполукам (-)-(Ш2"3)-2-(2"-бензилокси)пропіл-4'-гідрокси5,9,9-триметил-6,7-бензоморфану і (-)-(1R,2"S)-2-[2"-(2'",6'"дифторбензил)окси]пропіл-4'-пдрокси-5,9,9триметил-6,7-бензоморфану у формі вільних основ або ВІДПОВІДНИХ адитивних солей із фармакологічно прийнятними кислотами Додатковим об'єктом винаходу є фармакологічна композиція для блокування залежного від напруги натрієвого каналу, що містить одну із сполук загальної формули (І) або одну з її кислотноадитивних солей, разом із звичайними допоміжними речовинами і носіями Заміщені 1,2,3,4,5,6-гексапдро-2,6-метано-Збензазоцин-10-оли формули (І) можна одержати за допомогою відомих способів, наприклад, міжнародна заявка WO 97/06146 Одержання заміщених 1,2,3,4,5,6-гексапдро2,6-метано-3-бензазоцин-10-олів формули (І) розкривається на наступних Схемах Основними сполукими є нор-бензоморфани 2а - 5а, які на схемі зображені у вигляді ВІДПОВІДНИХ ()-енантюмерів ВІДОМІ ПОХІДНІ бензазоцинолу, що є антагоніс тами рецептору NMDA (див заявку ЕР521422, що опублікована 7 січня 1993 р) їх здатність блокувати залежний від напруги натрієвий канал є незадовільною Задачею винаходу є розробка нових похідних безазоцинолу, що мають властивість блокатору залежного від напруги натрієвого каналу Поставлена задача вирішується запропонованими похідними бензазоцинолу загальної формули (І) и Н X означає простий зв'язок, -О-, алкілен із 1-4 атомами вуглецю, розгалужений або нерозгалужений алкіленовий місток із 1-8 атомами вуглецю, який у будь-якому МІСЦІ може містити один або два атоми кисню, R1 - водень, метил, етил, феніл, R2 - водень, метил, R3 - водень, фтор, хлор, бром, R4 - водень, метил, етил, 5 R - водень, метил, етил, R6 - водень, метил, етил, R7 - трет-бутил, циклогексил, феніл, незаміщений або заміщений однаковими або різними радикалами R91 R °, при цьому R9 - водень, метил, фтор, хлор, бром, і R10 - водень, метил, фтор, хлор, бром, при необхідності у формі окремих оптичних ізомерів, сумішей окремих енантюмерів або рацематів, а також у формі вільних основ або ВІДПОВІДНИХ кислотно-адитивних солей із фармакологічно прийнятними кислотами Переважними заміщеними 1,2,3,4,5,6гексапдро-2,6-метано-3-бензазоцин-10-олами є сполуки загальної формули І, в якій X означає -О-, алкілен із 1-3 атомами вуглецю або О-алкілен з 14 атомами вуглецю, a R -R7 - мають вказані вище значення, при необхідності у формі окремих оптичних ізомерів, сумішей окремих енантюмерів або рацематів, а також у формі вільних основ або ВІДПОВІДНИХ кислотно-адитивних солей із фармакологічно прийнятними кислотами, або сполуки формули (І), в яких R4 і R5 неза СХЕМА 1 Синтез (-)-2а при R=H описаний у німецькій викладеній заявці DE 195 28 472 Сполука За може бути отримана за аналогією із сполукою 2а Вихідною сполукою є піперидон 6, який утворюється при синтезі 2 як проміжний продукт, що, наприклад, вступає в реакцію обміну не з ВІДПОВІДНИМ метильним похідним, як це вже відомо з практики, а з етилтрифенілфосфонієвою сіллю (див 61973 ще, тетрапдрофураном, реакційну суміш СХЕМА 2нагрівають до температури утворення флегми і розбавляють сумішшю етилового ефіру 2бромпропюнової кислоти загальної формули 3 з ометоксибензилціанідом із наступним нагріванням О Н „N, краще до температури утворення флегми Після охолодження відфільтровують цинковий порошок і для відновлення іміногрупи змішують із селективним відновним засобом - краще, комплексним похідним лужного боропдриду, краще, ціаноборопдридом натрію - і потім обробляють алканолом, краще, спиртом із 1-4 атомами вуглецю з прямим або розгалуженим ланцюгом, краще, етанолом Потім реакційну суміш змішують із водяним розчином основного реагенту, краще, розчином аміаку, краще концентрованим розчином аміаку, і відо(-HQ О-Зз кремлюють органічну фазу від реакційної суміші Сполуку 4а одержують із 2Після сушіння і концентрування у вакуумі залишок метоксибензил ціаніду (11) і 2-бромпропюновоі обробляють інертним розчинником - краще аліфакислоти (12) за аналогією зі способом, описаним у тичним або ароматичним вуглеводнем, краще, міжнародній заявці WO 97/06146 толуолом - і екстрагують водяним розчином кислоти, краще, мінеральною кислотою, краще, 2N соляною кислотою На закінчення водяну фазу під дією водяного розчину основи - переважно, розчину аміаку, краще концентрованого розчину аміаку, переводять у основу і потім екстрагують органічним екстрагентом, який не змішується з водою краще галоідовуглеводнем, найкраще, дихлорметаном Отриманий екстракт сушать і виділяють похідне ефіру 3 - аміно -2- метилбутанової кислоти загальної формули 4 схему 2) Для цього, наприклад, на першій стадії здійснюють обмін 2-метоксибензилціаніду (11) із 2етиловим ефіром бромпропюнової кислоти (12), при цьому утворюється відповідне заміщене похідне ефіру З-амшо-2-метилбутановоі кислоти (13) (тому що в бажаному вихідному продукті відсутня спиртова компонента в ефірній частині структури, то в цьому випадку можна використовувати як алкілові ефіри з 1-8 атомами вуглецю, так і бензиловий ефір) Г 1 1 1 2 1 3 Для проведення реакції обміну типу реакції Реформатського спочатку при обраних умовах реакції беруть алкілгалоідсилан - краще триалкілхлорсилан, найкраще три мети лхлорси лан - і цинковий порошок в інертному розчиннику, краще в ефірі або галоідовуглеводні, краще, у дихлорметані Після розведення цієї суміші полярним інертним розчинником, краще, циклічним ефіром, кра На другій стадії реакції отриманий таким способом етиловий ефір З-аміно-2-метилбутановоі кислоти 13 і етиловий ефір акрилової кислоти (тому що в бажаному кінцевому продукті відсутня спиртова компонента в ефірній частині молекулярної структури, то в цьому випадку можна використовувати як алкілові ефіри з 1-8 атомами вуглецю, так і бензиловий ефір) перетворюють у ВІДПОВІДНИЙ етиловий ефір 3-(2-етоксикарбонілетил)-амшо -2-метил бутан о во і кислоти 14 13 « Для проведення даної реакції приєднання Міхаеля етиловий ефір З-амшо-2-метилбутановоі кислоти 13 з етиловим ефіром акрилової кислоти розчиняють при обраних умовах реакції в інертному реакційному середовищі, краще, в алканолі з 14 атомами вуглецю з прямим або розгалуженим ланцюгом, найкраще, в етанолі, і нагрівають переважно, до температури утворення флегми По закінченні реакції розчинник видаляють у вакуумі і виділяють отриманий етиловий ефір 3-(2 етоксикарбонілетил) аміно -2-метилбутановоі кислоти 14 На заключній третій стадії реакції здійснюють циклізацію отриманого на попередній стадії ефіру 3-(2-етоксикарбонілетил) амшо-2-метилбутановоі кислоти 14 з утворенням ВІДПОВІДНОГО похідного піперидону15 14 ефір піпєридину Для проведення циклізації здійснюють конденсацію ефіру за Дикманом, для чого ефір 3-(2етоксикарбонілетил) амшо-2-метилбутановой кислоти 14 розчиняють в умовах циклізації в інертному розчиннику, краще в аліфатичному або ароматичному вуглеводні, найкраще толуолі, у присутності основного реагенту, краще, лужного алкоголяту з прямим або розгалуженим ланцюгом з 1-4 атомами вуглецю, найкраще, трет -бутилату калію, нагрівають до температури утворення флегми і при цій температурі відокремлюють компоненти реакційної суміші, які випаровуються, шляхом дистиляції - наприклад, азеотропної дистиляції По закінченні реакції реакційну суміш пдролізують і змішують із водяним розчином кислотного реагенту, наприклад, із водяними мінеральними кислотами, краще, із концентрованою соляною кислотою Після ЦЬОГО додають інертний екстрагент, що не змішується з водою, краще діалкіловий ефір, найкраще, діетиловий ефір, після чого обробляють водяним розчином основного реагенту, краще, водяним розчином аміаку, найкраще, концентрованим розчином аміаку Після відокремлення органічної фази, а також повного екстрагування водяної фази об'єднані органічні екстракти промивають водою, сушать, концентрують у вакуумі і виділяють кінцевий ефір піперидону Як альтернатива можлива вищеописана конденсація за Дикманом із застосуванням чотирихлористого титану в галоідовуглеводні - переважно у дихлорметані [М N Deshmukh та ш Synth Commun 25(1995) 177] На 4-й стадії реакції отримане таким способом похідне піперидону (ефір піперидону) омилюють у лужному або кислому середовищі до ВІДПОВІДНОГО похідного З-метил-4-піперидону і декарбоксилгають ефір піпєридину 15 Для цього ефір піперидону в полярному розчиннику, що містить воду, або в суміші розчинників 61973 8 - краще, у суміші апканолу з 1-4 атомами вуглецю з прямим або розгалуженим ланцюгом і води, найкраще, у суміші етанол/вода, нагрівають з основним або кислотним реагентом, краще, із лужним гідроксидом або з мінеральною кислотою, найкраще, із гідроксидом натрію або, у випадку застосування кислоти, наприклад, із соляною або сірчаною кислотою, переважно до температури утворення флегми Після проведення омилення реакційне середовище відокремлюють у вакуумі і залишок обробляють розчинником, придатним для наступного солеутворення, краще, полярним органічним розчинником, найкраще ацетоном, при цьому відповідна кислотно - адитивна сіль випадає в осад Наступна реакція Віттіга із застосуванням метилтрифенілфосфонійброміду призводить на наступній стадії до утворення ВІДПОВІДНОГО 4метилен-піперидинпохідного 16, що може бути виділене у формі кислотно - адитивної солі, краще, у формі галоідоводню, найкраще, у формі пдрохлориду 16 15 Для проведення реакції Віттіга похідне 3метилпіперидону у формі кислотно-адитивної солі, наприклад - у формі пдрохлориду, розчиняють у воді і змішують з основним реагентом або, краще, із його водяним розчином, найкращий для використання концентрований водяний розчин аміаку Водяну фазу екстрагують органічним розчинником, що не змішується з водою, - краще галоідоалканом, найкраще з дихлорметаном Після сушіння і концентрування у вакуумі залишок в умовах реакції Віттіга розчиняють в інертному реакційному середовищі - краще, у циклічному ефірі, найкраще, у тетрапдрофурані - і проводять реакцію з реагентом Віттіга, що генерує метиленову групу із метилтрифенілфосфонійгалогенідом, найкраще, з метилтрифенілфосфонійбромідом - у присутності основного реагенту, краще, лужного алкоголяту, найкраще, трет-бутилату калію, і в залежності від реакційної здатності використовуваного едукту проводять реакцію при температурі від 0 до 80°С, краще, від 20 до 60°С, найкраще при температурі приблизно 40°С Після проведення реакції суміш обробляють водою і органічним розчинником, що не змішується з водою краще, галоідоалканом, найкраще, дихлорметаном, і потім органічну фазу відокремлюють Після повної екстракції водяної фази і сушіння об'єднаних екстрактів екстрагент відокремлюють, залишок розчиняють у придатному для утворення кислотноадитивної солі розчиннику, краще, використовувати для цих цілей алканол із розгалуженим або нерозгалуженим ланцюгом із 1-4 атомами вуглецю, найкращий ізо-пропанол, і обробляють найбільш придатною для цих цілей кислотою, переважно, мінеральною кислотою, наприклад, галоідоводне 61973 10 нової кислоти, найкраще, етиловим ефіром оцтовою кислотою, найкраще, концентрованою солявої кислоти Очищену таким чином водяну фазу ною кислотою, і відокремлюють кислотно- адитивпідлуговують шляхом застосування концентровану сіль продукту реакції Віттіга 16, що викристаліного розчину аміаку і екстрагують органічним роззувалася чинником, краще, галоідовуглеводнем, найкраНа наступній стадії реакції здійснюють форміщий, дихлорметан Після сушіння і лування піперидину по атому азоту, наприклад, нконцентрування об'єднаних органічних екстрактів бутилформіатом, в результаті чого одержують виділяють, наприклад, ВІДПОВІДНИЙ (-)-4'-метоксивідповідне похідне №форміл-3-метил-4-метилен5,9-диметил-6,7-бензоморфан (19) піперидину На цій стадії можна здійснити розподіл, якщо це ще не відбулося, суміші стереоізомерів При цьому поділ можна проводити описаними вище способами, що призводять до розподілу оптичних ізомерів На наступній стадії в отриманому (-)-4'метокси-5,9-диметут-6,7-бензоморфані (19) у кис16 1? лому середовищі, краще, у мінеральній кислоті, Для цього похідне піперидину 16, отримане на наприклад, галоідоводневій кислоті, переважно, у попередній стадії, наприклад, у формі пдрогалогебромистоводневій кислоті, відбувається розщепніду, спочатку переводять у відповідну вільну ослення ефіру й утворення ВІДПОВІДНОГО фенолу нову шляхом розчинення його у воді й обробки основним реагентом - краще, водяним розчином основи, найкраще, концентрованим розчином аміаку, і вільну основу піперидину екстрагують органічним розчинником, краще, галогенованим вуглеводнем, найкраще дихлорметаном Після сушіння екстракту і відгонки екстрагенту вільну основу виділяють органічним розчинником - наприклад, вуглеводнем, краще, алкіларилом, найкраще, толуо19 4А лом, обробляють засобом для формілування Розщеплення відбувається в кислому середокраще алкілформіатом, найкраще, бутилформіавищі, причому найбільш себе виправдало застосутом, і виділяють отриманий продукт реакції 17 вання для цих цілей мінеральних кислот НайПри наступній за цим реакції здійснюють цикбільш придатною для цих цілей виявилася лізацію в присутності ВІДПОВІДНИХ кислот Льюіса бромистоводнева кислота У результаті реакції наприклад мінеральних кислот, у першу чергу, омилення можна одержати продукт омилення, бромистоводневої кислоти і переважно, сульфокинаприклад, у формі його пдроброміду слот, або алюміній (НІ) галогенідів, наприклад, Сполуку 5 одержують, як це зображено на трихлористого алюмінію - нарешті на 8 стадії реасхемі 4 кції відбувається утворення структури бензоморфанутипу 18 На наступній за цим стадії реакції в результаті відщеплення формольної групи відбувається утворення ВІДПОВІДНОГО 4'-метокси-5,9-диметил-6,7 бензоморфану (19) Для цього формілбензоморфан 18 розчиняють у полярному розчиннику, переважно, в алканолі, найкращий, н- пропанол, і обробляють кислотним реагентом, переважно водяним розчином мінеральної кислоти, краще концентрованою соляною кислотою, а потім нагрівають Після видалення формільної групи і концентрування реакційну суміш обробляють водою і екстрагують розчинником, що не змішується з водою, краще ефіром карбо СХЕМА 4 Введення N-замісника відбувається шляхом перетворення вихідних сполуквід 2а до 5а під дією засобів, що ацилюють, у проміжну сполуку 25 із наступнимвідновленням, або за допомогою прямого алкілування вихідних сполук від 2а до 5азасобами, що алкілують, або шляхом перетворення їх під дією альдегідів усполуки 26 із наступним відновленням На схемі 5 як приклад вихідної сполуки наведена вихідна сполука (-)-2а 11 61973 12 льненню глутамату [С Р Taylor і В S Meldruwi, СХЕМА5 TIPS 16 (1995) 309, J Urenjak і Т Р Obrenovitch Am Soc Phar Exp Ther 48 (1996) 21)] Випадково було встановлено, що сполуки розглянутого винаходу загальної формули І на відміну від відомих сполук [ЄР-В-0521422] не мають ніякої 3 спорідненості стосовно NMDA-рецептору (Кі [ Н] МК 801 >10000нм) До того ж виявилося, що сполуки розглянутого винаходу є блокаторами залежного від напруги натрієвого каналу Мова йде при цьому про сполуки, що витискають батрахотоксин (ВТХ) при високій конкурентній або неконкурентно спорідненості в МІСЦІ зв'язування в натрієвому каналі Такі речовини виявляють при блокаді натрієвих каналів "залежність від застосування", тобто, для зв'язування речовин у натрієвому каналі натрієві канали повинні бути спочатку активовані Максимальна блокада натрієвих каналів досягається лише після кількаразової стимуляції натрієвих каналів До того ж речовини краще зв'язуються в тих натрієвих каналах, які неодноразово були активовані Завдяки цьому речовини мають мож(+26 ливість стати активними краще в тих частинах тіСполуки даного винаходу можуть бути заміла, у яких найбільшою мірою виражена патологія щені в бензоморфановій частині відомими репоУ якості тест-системи для виявлення дії, що селективними методами Прикладом уведення блокує натрієвий канал, слугує ВТХ-зв'язування в замісника R3 в сполуку загальної формули І є спонатрієвому каналі [SW/ Postma & W A Catteral, лука (-)-2Ь, наведена на схемі 6 Мої Pharmacol 25, 219-224 (1984)], а також експеримент фіксації потенціалу або петч-кламп метод, на прикладі якого може бути показано, що сполуки даного винаходу при «залежному від використання» способі блокують електрично стимульований натрієвий канал [WA Catteral, Trends Pharmacol Sci ,8, 57-65(1987)] Крім того, була виявлена нейрозахисна дія сполук розглянутого винаходу шляхом блокади вивільнення глутамату, що індукує вератридин [S Villauneva, P Frenz, Y Dragmc F Orrego, Brain Res 461, 377-380 (1988)] Вератридин являє собою токсин, який постійно відчиняє натрієвий канал Останнє обумовлює посилене проникнення ІОНІВ натрію в клітину Через описану вище ПОСЛІДОВНІСТЬ виявлене посилене проникнення натрію БІОЛОГІЧНІ властивості призводить до підвищеного вивільнення глутамату Встановлено, що виникаючі внаслідок гіпоглів нейронній тканині Сполуки розглянутого винакемії, гіпоксії, аноксії і ішемії ушкодження клітини і ходу протидіють підвищеному вивільненню глутазниження и функцій засновані частково на підвимату, тобто є антагоністами щеній синаптичній активності Шляхом ряду експеАнтиконвульсивні властивості сполук даногоо риментів можна показати, що подібні гіпоглікемічні винаходу були підтверджені на прикладі судом, і ппоксичні стани призводять до великої деполяривикликаних у мишей електрошоком максимальної зації ушкоджених клітин Внаслідок виниклої деповеличини [М A Rogawski & R J Porter, Pharmacol ляризації спостерігається патогенне збільшення Rev, 42, 223-286 (1990)], нейрозахисні властивості внутрішньоклітинного кальцію, а в нейронних ткабули підтверджені захисною дією на моделі криси нинах відбувається додаткове посилене вивільМСАО - [U Pschorn & A J Carter, J, Stroke, Cereнення амінокислот Залежний від напруги натрієbrovascular Diseases, 6, 93-99 (1996)] вий канал грає ключову роль у цій ПОСЛІДОВНОСТІ Так, наприклад, шляхом його блокади можна заВідомо, ЩО блокатор натрієвого каналу може побігти деполяризаці клітин, завдяки чому знижубути використаний для лікування циклофренії (мається проникнення кальцію в нейронні тканини ніакально депресивний психоз) \}Л Calabrese, C крізь кальцієві канали, які знаходяться в залежносBowden, M J Woyshville y Phsychopharmacology ті від напруги, і крізь NMDA-рецепторні канали The fourth generation of progress (Eds D E ВІоом Подальше зниження проникнення ІОНІВ натрію в & J Kupfer) 1099-1111, Raven Press Ltd New York] клітину перешкоджає протитечійній роботі кальРезультати підтверджують, що 1,2,3,4,5,6цій/натрієвого обміну і проникненню кальцію в клігексапдро-2,6-метано-3-бензазоцин-10-ол загальтину У нейронній тканині зниження проникнення ної формули І можна використовувати при захвоІОНІВ натрію в клітину продовжує перешкоджати рюваннях, пов'язаних із функціональними порупротитечійній роботі переносника глутамату і вивішеннями, обумовленими перезбудженням До них 61973 14 13 відносяться такі захворювання, як аритмія, спазм, Даний винахід стосується також способу одесерцева і мозкова ішемія, а також нейродегенераржання норбензоморфанів загальної формули І тивні захворювання різного походження Серед Н інших можна назвати епілепсію, гіпоглікемію, ГІПОКСІЮ, аноксію, мозкові травми, набряк головного мозку, крововилив у мозок (інсульт), асфіксію новонароджених, бічний амютропний склероз (хвороба Шарко), хвороба Гунтінгтона, хвороба Альцгеймера, хвороба Паркінсона, циклофренію, ГІПОТОНІЮ, серцевий інфаркт, порушення серцевого ритму, грудну жабу, біль, втрату чутливості і місцеву втрату чутливості Найбільш активними є наступні сполуки 1 (-)-(1 Р,2"3)-2-(2"-бензилокси) пропіл-4 пдрокси-5,9,9-триметил-6,7-бензоморфан і (-)-(1Р,2"3)-2-[2"-(2'",6"'-дифторбензил)окси]-4'пдрокси-5,9,9-триметил-6,7- бензоморфан Сполуки даного винаходу можна одержати, виходячи із існуючих методів і способів, описаних у наступних прикладах У першу чергу даний винахід і спосіб одержання норбензоморфанов загальної формули 5, що описується нижче, характеризується тим, що а) о-метоксихлорбензилхлорид (20) за допомогою бензилпіридинійброміду 21 перетворюють у тетрапдропіридин 22 Де а) бензилціанід загальної формули 32, у якому R30 означає алкільну групу з 1-4 атомами вуглецю, піддають взаємодії з ефіром галоідокарбонової кислоти загальної формули 33 в умовах реакції Реформатського, де R40 означає алкіл із 1-8 атомами вуглецю або бензил, у присутності алкілгалоїдосилану - краще, триалкілхлорсилану і найкраще, триметилхлорсилану - і порошку цинку в інертному розчиннику - краще, в ефірі або в галоідовуглеводні, найкраще, у дихлорметані, у присутності селективного по відношенню відновлення імінофункцм відновлювального засобу, переважно, у присутності похідного алкілборпдриду, найкраще, у присутності натрійціанборпдриду, - і відокремлюють отриманий ефір карбонової кислоти загальної формули 34 20 21 d) ізомеризують похідне тетрагідропіридину 22 у похідне N-бензилбензоморфану 23 32 с) дебензилують змінний азот у похідне метоксибензоморфану 24 33 Ь) здійснюють приєднання ефіру акрилової кислоти до ефіру карбонової кислоти загальної формули 34 за Міхаелем, у якому Rso означає алкіл із 1-8 атомами вуглецю або бензил, в умовах реакції приєднання Міхаеля в інертному розчиннику при обраних умовах, краще, в алканолі, найкращий для цих цілей етанол, і утворений продукт приєднання за Міхаелем загальної формули 35 відокремлюють d) розщеплюють феноловий ефір 24 і виділяють похідне бензоморфану 5 35 с) отриманий таким способом діефір карбонової кислоти загальної формули 35 в інертному розчиннику- краще, в аліфатичному або ароматичному вуглеводні, найкраще толуол - у присутності основної сполуки, краще, у присутності лужних алкоголятів спиртів з прямим або розгалуженим 15 61973 16 ланцюгом з 1-4 атомами вуглецю, найкраще, у 38" або ізомерна суміш 38 після вивільнення із присутності трет-бутилату калію, конденсують в кислотно- адитивної солі, що не містить енантюумовах ефірної конденсації за Дикманом і отримамерів, піддають взаємодії в інертному розчиннику не похідне піперидону загальної формули 36 видіз реагентом Віттіга, що генерує СЬЬ = або СНзляють СН= групу, краще, етилтрифенілфосфонійгалогенідом або метилтрифенілфосфонійгалогенідом, найграще, із метилтрифенілфосфонійбромідом або з етилтрифенілфосфонійбромідом, у присутності основного реагенту - краще, у присутності лужного алкоголяту, найкраще, трет -бутилату калію - в інертному реакційному середовищі- краще в циклічному ефірі, найкраще, у тетрапдрофурані, і виділяють отриманий продукт реакції 39 або ВІДПОВІДНИЙ стереоізомер у формі ВІДПОВІДНІЙ кис лотно- адитивній солі 35 36 d) похідне піперидону 36 у кислотному або лужному середовищі - краще, у присутності лужного гідроксиду або мінеральної кислоти, найкраще, у присутності гідроксиду натрію, у полярному розчиннику або суміші розчинників, краще, у суміші спиртів із 1-4 атомами вуглецю з прямим або розгалуженим ланцюгом і води, найкраще, у суміші етанолу і води - омилюють при нагріванні з утворенням ВІДПОВІДНОГО похідного піперидону - ефіру загальної формули 37 і декарбоксилують, виділяючи за певних умов із застосуванням кислоти відповідну кислотно- адитивну сіль 36 37 є) у разі потреби, отриману таким способом суміш стереоізомерів після виділення у визначених умовах енантюмерних вільних основ розчиняють в інертному у відношенні розділення стереоізомерів реакційному середовищі і додають ВІДПОВІДНИЙ стереоізомер органічної кислоти, здатної утворювати сіль із стереоізомером із енантюмерної суміші, і виділяють бажаний стереоізомер у формі його адитивної солі з оптично активною кислотою =СН, або СН,-СН 38 д) отриманий у результаті реакції Віттіга алкен 39 спочатку звільняють від кислотно-адитивної солі і вільну основу 39 розчиняють в органічному розчиннику -краще, у галоідовуглеводні, найкраще, у дихлорметані, далі проводять реакцію формілування засобом для формілування - краще, із н-бутилформіатом - по піперидиновому азоту і виділяють продукт реакції 40 або ВІДПОВІДНИЙ стереоізомер R=CH2 або СНСН3 сн, або 3S 40 h) отримане таким способом формольне похідне 40 або ВІДПОВІДНИЙ стереоізомер розчиняють при використанні мінеральної кислоти або кислоти Льюіса - краще хлориду алюмінію (III) - в інертному розчиннику, краще, у галоідовуглеводні, найкраще в дихлорметані, циклізують і виділяють отриманий продукт циклізації 41 37 са, або си-щ 40 f) отримані таким чином стереоізомер 38' або 41 і) отримане в результаті циклізації похідне бензоморфану розчиняють у полярному розчиннику - краще, в алканолі з 1-4 атомами вуглецю, найкраще, у н-пропанолі - і здійснюють реакцію з використанням кислотної сполуки, краще, із водяним розчином мінеральної кислоти, найкраще, з кон 17 61973 центрованою соляною кислотою, і отриманий у результаті деформілування норбензоморфан 42 виділяють у формі кислотно- адитивної солі 18 або вступає в реакцію обміну ної формули НС (O)-R', у якій і отриману основу Шіффа 26 луки (-)-2хх-, як це зображено з альдегідом загаль1 2 7 R' означає CR R R , відновлюють до сповище HC(O)-R' 42 41 j) якщо на цій стадії ще не відбулося розділення стереоізомерів, то стереоізомери розділяють відомим методом, і після виділення вільної бензоморфанової основи розщеплюють фенольний ефір кислотною сполукою, краще, мінеральною кислотою і найкраще, бромистоводневою кислотою, із подальшим виділенням продукту розщеплення 43 43 І) у даному випадку в умовах електрофільного заміщення вводять замісник R3 R' (-І-2ХХ 42 43 к) продукт розщеплення 43 взаємодіє із сполукою формули Z-CHRs-R1 із заміщенням по атому азоту вторинного аміну, де Z означає групу, що видаляється, краще, галоген, такий як хлор, бром, йод, або органічний сульфонат, краще, трифторметансульфонат, і R' означає - CR 1 R 2 R 7 , Z-CHR.-R (-)-2хх або вступає в реакцію обміну із сполукою формули YC (О) R' із заміщенням по атому азоту вторинного аміну, де Y означає групу, що видаляється, краще, галоген, такий як хлор, бром, йод, або органічний сульфонат, краще, три фтор метан сульфонат, і R1 означає -CR 1 R 2 R 7 , і карбонільна сполука відновлюється до зображеної вище сполуки (-)-2хх CEO1R' YC(O)R' 43 25 і* і З даного опису фахівець одержить представлення про ІНШІ, різні способи Треба, однак, підкреслити, що дані приклади і їх опис не мають на меті обмежити винахід, а лише пояснюють і роз'ясняють винахід Це стосується також змісту Німецької патентної заявки DE 197 40 110 4, на основі якої встановлюється пріоритет даної заявки Приклади Приклад 1 Етиловий ефір 3-амшо-4-(2метоксифеніл)-2-метилбутановоі кислоти (13) До 150г цинку в 1,5л абсолютного дихлорметану в атмосфері азоту додають 15мл триметилхлорсилану і перемішують протягом ЗО хвилин при кімнатній температурі Далі додають 900мл абсолютного тетрапдрофурану ЛТФ) і нагрівають до температури 42°С Додають по краплях суміш, що містить 147г (1,0моль) 2-метоксибензилціаніду (11) і 362г (2,0моль) етилового ефіру 2бромпропюнової кислоти в 100мл ТГФ і потім нагрівають із зворотним холодильником ще 2 години при флегмоутворенні Далі охолоджують, декантують від надлишку цинку і обробляють 70г(1,8моль) бромпдриду натрію при температурі 5°С Потім додають по краплях 250мл етанолу (спостерігається газоутворення) Далі реакцію продовжують ще 3 години при темепратуре 5°С, повільно додають 1л 2N соляної кислоти, фази відокремлюють і дворазово екстрагують водяну фазу 200мл дихлорметану 3 об'єднаної органічної фази відкачують у вакуумі розчинник, залишок обробляють льодом і толуолом і концентрованим амонієм доводять до лужної реакції середовища Фази розділяють і водяну фазу дворазово екстрагують 800мл толуолу Об'єднані органічні фази сушать сірчанокислим магнієм і відкачують розчинник у вакуумі Вихід 1 4 9 Г ( 6 1 % ) масла Приклад 2 Етиловий ефір 3-(2 20 19 61973 етоксикарбонілетил) амшо-4-(2-метокси-феніл)-2Аналогічно прикладу 5 одержують ІЧ-форміл-2метилбутанової кислоти (14) 148г(0,6моль) Етило(2-метоксифеніл) метил-З-метил-4-метиленвого ефіру 3-амшо-4-(2-метоксифеніл)-2піперидин (17), використовуючи 8г(34ммоль) 2-(2метилбутанової кислоти (13) і 119г(1,2моль) етиметоксифеніл) метил-З-метил-4-метиленлового ефіру акрилової кислоти розчиняють у піперидину (16) у якості основи і ЗОмл н250мл абсолютного етанолу і нагрівають із зворобутилформіату Вихід 9,1г(100%) у ВИГЛЯДІ масла тним холодильником протягом 6 годин при флегПриклад 6 N-бензил -2-(2-метоксифеніл) мемоутворенні Потім концентрують у вакуумі Залитил-4-метил-піпери-З-ден (22) шок ще раз обробляють ЗООмл толуолу і повторно 6,0г(250ммоль) Магнієвої стружки і трохи йоду концентрують у вакуумі У результаті виділяють попередньо вносять у 150мл ефіру Після ЦЬОГО 210г(100%) бажаного продукту у вигляді масла додають по краплях 31,32г(200ммоль) 2метоксибензилхлориду в 50мл ефіру таким чином, Приклад 3 2-(2-метоксифеніл) метил-3-м етил щоб суміш злегка кипіла Витримують у такому 4-піперидон (15) 210г (О.бмоль) етилового ефіру 3стані 1 годину Отриманий таким чином реактив (2-етоксикарбонілетил) амшо-4-(2-меток-сифеніл)Гріньяра швидко по краплях додають в охолодже2-метил бутан о во і кислоти (14) розчиняють у 3 л ну до -Ю°С суспензію 52,8г (200ммоль) Ы-бензилтолуолу і відокремлюють приблизно ЮОмл суміші 4 металпіридинброміду в ЮОмл ефіру в атмосфері розчинник/вода Потім охолоджують до 70°С, доазоту Після ЦЬОГО реакцію продовжують 2,5 годидать 80г (0,7моль) трет-бутилату калію і нагрівани Потім усю реакційну суміш додають до 200мл ють протягом ЗО хвилин до 105°С, причому ета10%-ного розчину хлориду амонію Органічну фазу нол, що утворився, відганяють Потім відокремлюють і водний розчин ще ДВІЧІ екстрагуохолоджують і відкачують розчинник у вакуумі ють ЮОмл ефіру Об'єднані органічні фази сушать Залишок обробляють 400мл етанолу і 200мл 40%сульфатом магнію і розчинник видаляють у вакууного розчину їдкого натра і кип'ятять із зворотним мі Щоб уникнути окислення видалення розчинника холодильником протягом 3 годин Спирт відкачуведуть у роторному випарнику в атмосфері азоту ють у вакуумі і водяну фазу екстрагують тричі Залишок відразу ж розчиняють у 250мл метанолу і 400мл діетилового ефіру Об'єднані органічні фази додають 9,5г (250ммоль) борпдриду натрію і 20мл сушать сірчанокислим магнієм і відкачують роз2N їдкого натра Протягом ночі перемішують при чинник у вакуумі Вихід складає 109г(78%) у викімнатній температурі і концентрують у вакуумі гляді масла Водний залишок ДВІЧІ екстрагують в 150мл ефіру і Приклад 4 (+)-4 Етилен-2-(2-метоксифеніл) об'єднану органічну фазу концентрують у вакуумі + метил-3,3-диметил-піперидин (( )-7) Залишок обробляють етилацетатом і екстрагують 74,2г(200ммоль) Етил-трифенілфосфонійброміду п'ятиразово 150мл 2N соляної кислоти Об'єднану суспендують у 200мл абсолютного тетрапдрофуводяну фазу доводять їдким натром до лужної рану і додають в атмосфері азоту 80мл 2.5N розреакції і ДВІЧІ екстрагують 200мл етилацетату Об'чину н-бутиллітію в гексані Перемішують протягом єднані органічні фази сушать сірчанокислим магніЗО хвилин при 30°С, потім додають розчин, що єм (MgSO4) і розчинник відкачують у вакуумі Замістить 23г(93ммоль) піперидону (+)-6 у ЮОмл лишок очищають, проводячи фільтрацію крізь ТГФ Реакція продовжується ще 12 годин при кім200мл силікагелю і використовуючи в якості елююнатній температурі, додають ЮОмл води і відкавального засобу ефір Одержують 31г(51%) бажачують у вакуумі ТГФ Залишок екстрагують тричі ного продукту у вигляді масла 200мл оптового ефіру і об'єднані органічні екстракти промивають 50мл води, сушать сірчанокислим Приклад 7 (-)-5-Етил-2-форміл-4'-метокси-9,9магнієм і розчинник відкачують у вакуумі Залишок диметил-6,7-бензоморфан ((-)-9) 3,6г(12,6ммоль) очищають, використовуючи колонку міттєвого ви(+)-4-Етилен-г\І-форміл-2-(2-метоксифеніл) метилпаровування (ЗООмл силікагелю, 4л циклогек3,3-диметил-піперидину (8) змішують із 35мл месан/етилацетат 3 1) Бажаний продукт виділяють у тансульфонової кислоти і перемішують протягом З вигляді масла з виходом 17,4г(72%) годин при температурі 80°С Потім охолоджують і виливають реакційну суміш на 50гльоду НейтраАналогічно прикладу 4 одержують 2-(2лізують амонієм і екстрагують дворазово ЮОмл метоксифеніл) метил-З-метил-4-метилен етилацетату Об'єднані органічні екстракти ще раз піперидин (16), використовуючи 20,1г (56ммоль) промивають 50мл води, сушать сірчанокислим метил-трифенілфосфонійброміду, 6,3г(56ммоль) магнієм і розчинник відкачують у вакуумі Залишок трет -бутилату калію і 11 г(47ммоль) 2-(2очищають, пропускаючи крізь колону миттєвого метоксифеніл) метил-З-метил-4- піперидон (15) у випаровування 50мл силікагелю, елюювальний 200мл абсолютного ТГФ Продукт кристалізують у засіб 750мл циклогексану/оцтового ефіру 3 1 Вівигляді оксалату з ацетону Вихід 13,1г(87%), докремлюють бажаний продукт у вигляді масла, Тпл 145°С вихід 2,1г(58%) Аналогічно прикладу 7 одержують Приклад 5 (+)-4-Етилен-М-форміл-2-(2І\І-форміл-4'-метокси-5,9 -диметил-6,7-метилметоксифеніл) метил-3,3-диметил-піперидин ((+)4-бензоморфан (18), використовуючи 8) 5,0г(19ммоль) -І\І-форміл-2-(2-метоксифеніл) ме3,5г(12,6ммоль) (+)-4-Етилен-2-(2тил-3-метил -4-метилен -піперидину (17) і ЗОмл метоксифеніл) метил-3,3-диметил-піперидину (7) метансульфонової кислоти Виділяють 4,8г(96%) перемішують протягом 4 годин при температурі бажаного продукту (масло) у вигляді суміші з 90% 80°С з 20мл н-бутилформіату а-епімеру і 10% р-епімеру N-Бензил -4і-метокси-9Потім окачують вакуумним насосом Залишаметил-6,7-бензоморфан-оксалат (23 ОХ), викорисється 3,6г(100%) бажаного продукту у вигляді мастовуючи 31г (100м моль) N-бензил -2-(2ла 22 21 61973 метоксифеніл) метил-4-метил -піпери-3-дену (22) і жують 1,5г(78%) бажаного продукту у вигляді пдЮОмл метансульфонової кислоти Залишок розроброміду (аморфний осад) чиняють у ЮОмл метанолу і кип'ятять протягом Аналогічно прикладу 11 одержують 4'короткого часу з бОгактивованого вугілля і гарячим пдрокси-9-метил-6,7-бензоморфан-пдробромід просмоктують крізь силікагель Розчинник відка(5аВг), чують у вакуумі, залишок розчиняють в ефірі і при розчиняючи 9,5г(31ммоль) 4'-мето кс и-9-мети лобробці щавлевою кислотою випадає оксалат 6,7-бензоморфан-оксалату (24ОХ) у невеликій Одержують 30г (75%) продукту, Т пл 152°С (МК1КІЛЬКОСТІ води з наступним переведенням у вільну 11) основу, використовуючи 7гкарбонату калію Екстрагують тричі 200мл етилацетату і відкачують розПриклад 8 4'-Метокси-9-метил-6,7чинник з об'єднаної органічної фази Потім оброббензоморфан-оксалат (24 ОХ) Розчиняють 30г 75 ляють ЗОмл 48%-ного розчину бромистоводневої (ммоль) N-бензил -4'-метокси-9-метил-6,7кислоти Одержують 6,1г(70%) бажаного пдробробензоморфан-оксалату (23 ОХ) у 600мл метанолу і міду, Т пл 227°С гідрують при температурі 60°С і тиску 5 бар, використовуючи Зг10% паладію на вугіллі ( Pd/вупллі) Приклад 12 (-)-(1R, 9a, 2"3)-2-(2"-Бензилокси) Охолоджують до 5°С і відсмоктують продукт, що протіл-4'-пдрокси-5,9-диметил-6,7-бензоморфанвипав в осад Одержують 17г(56%) продукту, пдрохлорид ((-)-4ЬСІ) Тпл 250°С(МК1-15) 0,75г(2,5ммоль) (-)-4'-Гідрокси-5,9-диметилПриклад 9 (-)-5-Етил-4'-метокси-9,9-диметил6,7-бензоморфан-пдробромщу ((-)-4аВг) суспен6,7-бензоморфан ((-)-10) дують у 15мл дихлорметану і змішують із Змл N2,0г(6,9ммоль) (-)-5-Етил-2-форміл-4'-метоксиметилморфоліну Через ЗО хвилин охолоджують 9,9-диметил-6,7-бензоморфану (9) розчиняють у до -5°С і повільно по краплях додають розчин 1,1г ЗОмл н-пропанолу і Юмл концентрованої соляної (5,5ммоль) хлориду (-)-3-2-бензилоксипропюновоі кислоти і нагрівають протягом 2 години в мікрокислоти у Юмл дихлорметану Перемішують ще хвильовій печі потужністю 300 ватт Потім розчинпротягом ЗО хвилин при температурі 5°С, обробник відкачують у вакуумі, залишок обробляють ляють 20мл 2N соляної кислоти і відокремлюють 15мл крижаної води і екстрагують ДВІЧІ 20МЛ ОЦТОорганічну фазу Органічну фазу сушать сірчанокиВОГО ефіру Водяну фазу нейтралізують концентслим магнієм, розчинник відкачують у вакуумі, а рованим амонієм і екстрагують тричі 20мл оцтовозалишок розчиняють у 40мл ТГФ До цього розчиго ефіру Об'єднані органічні екстракти сушать ну додають 0,5г(13ммоль) ЛІТІЙ алюміній гідриду сірчанокислим магнієм і розчинник відкачують у (L1AIH4), при цьому температура підвищується до вакуумі Залишок розчиняють в ацетоні і під дією 35°С Реакцію продовжують ще ЗО хвилин, змішусоляної кислоти випадає в осад пдрохлорид Виють із 0,4мл води і 0,2мл 5 N їдкого натра і відохід 1,7г(82%), Тпл>250°С, [a] d 25 = (-) 43,0° (С=1 у кремлюють від неорганічного осаду Осад промиметанолі) Аналогічно прикладу 9 одержують 4'вають 100мл ТГФ і об'єднані органічні фази метокси-5,9-диметил-6,7-бензоморфан (19), концентрують у вакуумі Залишок розводять у ЮОмл ефіру, сушать сірчанокислим магнієм і під використовуючи 4,8г(18ммоль) І\І-форміл-4'дією соляної кислоти випадає пдрохлорид Крисметокси-5,9-диметил-6,7-бензоморфану (18), 50мл тали відокремлюють і промивають ацетоном Вин-пропанолу і 50мл концентрованої соляної кислохід 0,6г(55%), Тпл 227°С, [a] d 25 = (-)13,3°(C=1 у ти Нагрівають протягом 8 годин із зворотним хометанолі) лодильником Вихід 2,9Г(57%) Одиничну пробу за допомогою щавлевої кислоти переводять у ВІДПОАналогічно прикладу 12 одержують ВІДНИЙ оксалат (НВ), що має точку плавлення (-)-(1Р,9а,2"Р)-2-(2"-бензилокси)пропіл-4'229°С пдрокси-5,9-диметил-6,7-бензоморфан- пдрохлоПриклад 10 (-)-(1R, 9 а)-4'-Метокси-5,9рид С(-4сСІ), диметил-6,7-бензоморфан ((-)-19) використовуючи 0,75г(2,5ммоль) (-)-4'9 5г (41 ммоль) 4'-Метокси-5,9-диметил-6,7пдрокси-5,9-диметил-6,7-бензоморфан- пдрохлобензоморфану (19) розчиняють у 80мл етанолу і риду ((-)-4аВг) і 1,1г(5,5ммоль) хлориду (+J-R-2змішують із 6,2г(41ммоль) R-(+)-BHHHOHD КИСЛОТОЮ бензилоксипропюнової кислоти Кристали, що випали в осад, відсмоктують і двоВихід 0,7Г(65%), Т П Л 217°С, [a] d 25 = (-) разово перекристалізовують із метанолу Вихід 76,1 °(С= 1 у метанолі) 2 6г (17%), Тпл236°С, и > 98% ( визначають за (-)-(1 R, 9а-4'-Гідрокси-5,9-диметил-2-[2-(2допомогою ЯМР-спектроскопм, використовуючи фенокси)етокси]етил-6,7-бензоморфанвільну основу з додаванням Shift-реагента) Тартпдрохлорид ((-)-4dCI), рат розчиняють уводі, за допомогою карбонату використовуючи 0,75г(2,5ммоль)(-)-4'-пдроксикалію одержують вільну основу, екстрагують ДВІЧІ 5,9-диметил-6,7-бензоморфан-пдроброміду ((-)50мл етилацетату Об'єднані органічні екстракти 4аВг) і 1,1г(5,5ммоль) фе но кс и етокс и ацетил хлосушать сірчанокислим магнієм і розчинник відкариду чують у вакуумі Одержують 1,6ГВІЛЬНОІ основи Вихід 0,2Г (20%) аморфного порошку Приклад 11 (-)-0 R , 9а)-4'-Пдрокси-5,9(-)-(1 R, 2"3)-2-(2"-Бензилокси) пропіл-4'диметил-6,7-бензоморфан-пдробромід ((-)-4аВг) пдрокси-5,9,9-триметил-6,7-бензоморфан1,5г(6,5ммоль) (-)-4'-Метокси-5,9-диметил-6,7пдрохлорид ((-)-2ЬСІ), бензоморфану ((-)-19) нафівають із 15мл 48%-ного використовуючи 1,6г(6,9ммоль) 4'-пдроксирозчину бромистоводневої кислоти протягом 2 5,9,9-триметил-6,7-бензоморфану ((-)-2а) і годин із зворотним холодильником Потім концен2,3г(11,6ммоль) хлориду (-J-S-2- бензилоксипропітрують у вакуумі і залишок розводять ТГФ ОдерОНОВОІ КИСЛОТИ 24 23 61973 25 Дифторбензил)окси)пропіл-4'-пдрокси-5,9,9Вихід 2,1Г(73%), Т ПЛ 254°С, [a] d = (-) 20,7° триметил-6,7-бензоморфан пдрохлорид ((-)-2hCI), (С=1 у метанолі) використовуючи 1,5г(6,5ммоль) (-)-4'-пдрокси(+)-(1S,2"R)-2-(2"-BeH3m-ioKCH)nponin-4'5,9,9-триметил-6,7-бензоморфану ((-)-2а) і пдрокси-5,9,9-триметил-6,7-бензоморфан2,4пклориду (10,2ммоль) (-)-S-2-(2',6'пдрохлорид ((+) -2ЬСІ), дифторбензил)оксипропюновоі кислоти використовуючи 1,5г(6,5ммоль) (+)-4'-пдрокси25 5,9,9-триметил-6,7-бензоморфану ((+)-2а) і Вихід 2,0Г(68%), Т ПЛ 245°С, [a]d =(-) 272,3° 1,5г(7,6ммоль) хлориду (+)-R-2(С=1 у метанолі) бензилоксипропюнової кислоти 25 Дихлорбензил)окси)пропіл-4'-пдрокси-5,9,9Вихід 1,4Г(52%), Т ПЛ 256°С, [a] d = (+) 20,3° (С=1 у метанолі) триметил-6,7-бензоморфан пдрохлорид ((-)-2іСІ), використовуючи 2,3г(1 Оммоль) (-)-4'-пдрокси(-)-(1R,2"R)-2-(2"-BeH3HnoKCH)npomn-4'5,9,9-триметил-6,7-бензоморфану ((-)-2а) і пдрокси-5,9,9-триметил-6,7-бензоморфан3,2пклориду (12м моль) (-)-S-2-(2',6'пдрохлорид ((-)-2сСІ), дихлорбензил)оксипропюновоі кислоти використовуючи 1,6г(6,9ммоль) (-)-4'-пдрокси25 5,9,9-триметил-6,7-бензоморфану ((-)-2а) і Вихід 2,8Г(58%), Т ПЛ 260°С, [a] d = (-) 14,1° 1,5г(7,6ммоль) хлориду (+J-R-2- бензилоксипропю(С=1 у метанолі) нової кислоти (-)-(Ш,2"3)-2-(2"-(2'"-Метилбензил)окси)пропіл4'-пдрокси-5,9,9-триметил-6,7- бензоморфан пдВихід 1,7Г(59%), Т ПЛ 245°С, [a] d 25 = (-) 96,5° рохлорид ((-)-2jCI), (С=1 у метанолі) використовуючи 0,8г(3,4ммоль) (-)-4'-пдрокси(+)-(1 S, 2"3)-2-(2"-бензилокси) пропіл-415,9,9-триметил-6,7-бензоморфану ((-)-2а) і пдрокси-5,9,9-триметил-6,7-бензоморфан пдро1,4пклориду (6,5ммоль) (-)-8-2-(2'хлорид ((+)-2сСІ), метилбензил)оксипропюновоі кислоти використовуючи 1,6г(6,9ммоль) (+)-4'-пдрокси5,9,9-триметил-6,7-бензоморфану ((+)-2а) і Вихід 0,8Г(55%) Т ПЛ 249°С, [a] d 25 = (-) 10,9° 2,3г(11,6ммоль) хлориду (-J-S-2- бензилоксипропі(С=1 у метанолі) ОНОВОІ КИСЛОТИ (-)-(Ш,2"3)-2-(2"-Циклогексилметокси)пропіл4'-пдрокси-5,9,9-триметил-6,7-бензоморфан пдроВихід 2,0Г(70%), Т ПЛ 245°С, [a] d 25 = (-) 97,8° хлорид ((-)-2кСІ), (С=1 у метанолі) використовуючи 1,9г(8,2ммоль) (-)-4'-пдрокси(-)-(1R, 2"S)- 2-(2"-(2'"- Фторбензил) окси) про5,9,9-триметил-6,7-бензоморфану ((-)-2а) і 2,0 піл-4'-пдрокси-5,9,9-триметил 6,7гхлориду (1 Оммоль) (-)-S-2-(2'бензоморфанпдрохлорид ((-)-2dCI), циклогексилметокси)пропюновоі кислоти використовуючи 0,8г(3, 4ммоль) (-)-4'-пдрокси5,9,9-триметил-6,7-бензоморфану ((-)-2а) і Вихід 1,8Г(52%), Т ПЛ 249°С, [a] d 25 = (-)24,6° 1,4г(6,5ммоль) хлориду (-)-S-2-(2'(С=1 у метанолі) фторбензил)оксипропюновоі кислоти (-)-(Ш,2'К)-2-(2"-Циклогексилметокси)пропіл4'-пдрокси-5,9,9-триметил-6,7-бензоморфанВихід 0,9Г(61%), Т ПЛ 212°С, [a]d25=(-)24,7° пдрохлорид ((-)-2іСІ), (С=1 у метанолі) використовуючи 1,9г(8,2ммоль)(-)-4'-пдрокси(-)-(1R, 2'К)-2-(2"-(2'"-Фторбензил)окси)пропт5,9,9-триметил-6,7-бензоморфану ((-)-2а) і 4'-Гідрокси-5,9,9-триметил-6,7-бензоморфан пдро2,0г1 Оммоль) (+ R-2-(2'- циклогексилметокси) хлохлорид ((-)-2еСІ), риду пропюнової кислоти використовуючи 0,5г(2,3ммоль) (-)-4'-пдрокси5,9,9-триметил-6,7-бензоморфану ((-)-2а) і Вихід 1,7Г(49%), Т ПЛ 140°С, [a] d 25 = (-) 92,2° О.бгхлориду (З.Оммоль) (+)-R-2-(2'(С=1 у метанолі) фторбензил)оксипропюновоі кислоти (-)-(1 R)- 4'-Гідрокси-2-(5"-фенокси) феніл5,9,9-триметил-6,7-бензоморфан-пдрохлорид ((-)Вихід 0,7Г(70%), Т ПЛ 145°С, [a] d 25 = (-) 88,4° 2тСІ), (С=1 у метанолі) використовуючи 3,9г(13ммоль) (-)-4'-Гідрокси(-)-(1R, 2"3)-2-(2"-(4'"-Фторбензил)окси)пропіл5,9,9-тримегил-6,7-бензоморфану ((-)-2а) і 4'-пдрокси-5,9,9-триметил-6,7-бензоморфан пдро3,2г(15ммоль) 5-фенокси хлориду пентанової кисхлорид ((-)-2fCI), використовуючи 0,8г(3,4ммоль) (лоти )-4'-пдрокси-5,9,9-триметил-6,7-бензоморфану ((-)2а) і 1,4пклориду (6,5ммоль) (-)-5-2-(4'Вихід 2,4Г(44%), Т ПЛ 149°С [a] d 25 = (-) 74,6° фторбензил)оксипропюновоі кислоти (С= 1 у метанолі) (-)-(Ш)-4'-Гідрокси-2-(2"-(2тВихід 1,0Г(68%), Т ПЛ 250°С, [a] d 25 = (-) 21,9° феніл)етокси)етил-5,9,9-триметил-6,7(С=1 у метанолі) бензоморфан-пдрохлорид ((-)-2пСІ), (-)-(Ш,2'К)-2-(2"-(4"'-Фторбензил)окси)пропілвикористовуючи 2,0г(8,7ммоль)(-)-4'-Гідрокси4'-пдрокси-5,9,9-триметил-6,7- бензоморфан пд5,9,9-триметил-6,7-бензоморфану ((-)-2а) і рохлорид ((-) 2qCI), 2,2г(11ммоль) хлориду 2-фенілетоксиоцтовоі кисвикористовуючи 0,5г(2,3ммоль) (-)-4'-пдроксилоти 5,9,9-триметил-6,7-бензоморфану ((-)-2а) і О.бпклориду (З.Оммоль) (+)-В-2-(4'Вихід 1,7Г(48%), Т ПЛ 204°С [a] d 25 = (-) 72,4° (С=1 у метанолі) фторбензил)оксипропюновоі кислоти (-)-(Ш-)-4'-Пдрокси-2-(4"-фенокси)бутил-5,9,9Вихід 0,9Г(58%), Т ПЛ 128°С, [a] d 25 = (-) 95,4° триметил-6,7-бензоморфан- пдрохлорид ((-)-2оСІ), (С=1 у метанолі) використовуючи 1,0г(4,3ммоль) (-)4'-пдрокси 26 25 61973 5,9,9-триметил-6,7-бензоморфану ((-)-2а) і тат/циклогексан 1 3) Повторно під дією соляної 1,2г(6ммоль) хлориду 4-феноксимасляноікислоти кислоти висаджують пдрохлорид Одержують 25 25 0,Зг(5%) (+)-5сСІ, Т пл 241 °С, [a] d = (+) 52,4° Вихід 0,7Г(39%), Т ПЛ 250°С, [a] d = (-) 82,8° (С= 1 у метанолі) (С=1 у метанолі) Аналогічно прикладу 13 одержум ють (-)-(1 R) -(2 - Бензилокси)етил-4'-пдрокси-5,9,91 триметил-6,7-бензоморфан-пдрохлорид ((-)-2рСІ), (+)-(1R,2"S)-2-[2"-(2'",6 " 1 використовуючи 2,Зг(10ммоль)(-)-4' Пдроксидифторбензилокси)пропіл-4 -пдрокси-5-метил-6,75,9,9-триметил-6,7-бензоморфану ((-)-2а) і бензоморфан-пдрохлорид ((+)-5dCI) і (+)-(1S,2"S)4,3г(22ммоль) 2-бензилоксиацетилхлориду 2-(2"-(2'", 6"'-дифторбензилокси) пропіл- 4'- пдро25 Вихід 2,5 г(62%), Т пл 253°С, [a]d =(-) 78,1° кси-5-метил-6,7-бензоморфан-пдрохлорид ((+)(С= 1 у метанолі) 5еСІ), використовуючи 4,0г(14ммоль) 4'-пдрокси-5(-)-(1 R) -2-(2"-( 2"'6'"-Дифторбензилокси)етилметил-6,7-бензоморфан-пдро-броміду (5а Вг) і 4'-пдрокси-5,9,9-триметил-6,7-бензоморфан3,0г(14ммоль) (+) R-2-(2', б'-дифторбензилокси) пдрохлорид ((-)-2qCI), пропюнової кислоти Одержують 0,Зг(5%) (+)25 використовуючи 1,2г(5ммоль)(-)- 4'- пдрокси5dCI), Тпл 122°С, [a] d = (+) 20,9°(С=1 у метано5,9,9-триметил-6,7-бензоморфану ((-)-2а) і лі), і 1,8г(30%) суміші (+) - 5dCI і (+) -5еСІ, Тпл 25 1,1г(5ммоль) 2-(2',6'194°С, [a] d = (+) 42,2° (С=1 у метанолі) дифторбензилоксиацетилхлориду Приклад 14 (-)-(1R)4'-Пдрокси-5,9,9Вихід 1,5Г(68%), Т ПЛ 246°С, [a] d 25 = (-) 71,0° триметил-2-[2"-(2'"-фенокси) етокси] етил-6,7(С=1 у метанолі) бензоморфан-пдрохлорид ((-)-2иСІ) 1 (-)-(Ш)-2-(3"-(2'",6"'-Дифторфеніл) пропіл-4 1,5г(6,5ммоль) (-)-4'-Гідрокси-5,9,9-триметилпдрокси-5,9,9-триметил-6,7-бензомор-фан6,7-бензоморфану ((-)-2а) і 1,5г(7,5ммоль) 2-(2пдрохлорид ((-)-2гС1), фенокси) етокси-етилхлориду розчиняють у 20мл диметил-формаміду (ДМФ) додають каталітичну використовуючи 1,9г(8,2ммоль)(-)-4'-ПдроксиКІЛЬКІСТЬ йодистого калію і Ігкарбонату калію Су5,9,9-триметил-6,7-бензоморфану ((-)-2а) і міш перемішують протягом 5 годин при 130°С, 1,7г(8,3ммоль) 3-(2',6'-хлориду дифторфенілпропірозчинник відкачують у вакуумі Залишок обробонової кислоти ляють ЮОмл води, тричі екстрагують ЮОмл етиВихід 1,6Г(46%), Т ПЛ >250°С, [a]d25=(-) 68,6° лацетату й об'єднані органічні екстракти промива(С=1 у метанолі) ють ще раз 50мл води, сушать сірчанокислим Приклад 13 (+)-0R, 2"5)-2-(2"магнієм, розчинник відкачують у вакуумі Залишок Бензилокси)пропіл-4'-пдрокси-5-метил-6,7розчиняють у 40мл ефіру і під дією соляної кислобензоморфан-пдрохлорид ((+)-5ЬСІ) і (+)-(18,2"S)ти випадає в осад пдрохлорид 2-(2"-бензилокси)-пропіл-4' пдрокси-5-метил-6,7бензоморфан-пдрохлорид ((+)-5сСІ) Вихід 1,4Г(50%) Т П Л 190°С, [a] d 25 = (-) 81,1° (С= 1 у метанолі) 5,1г(17ммоль) 4'Пдрокси-9-метил-6,7бензоморфан-пдробромщу (5а Вг) і 1,7г(17ммоль) Аналогічно прикладу 14 одержують N-метилморфолшу розчиняють у 20мл ДМФ і охо(+)-(18)-4'-пдрокси-5,9,9-триметил-2-[2"-(2'"лоджують до - 5°С Потім ПОВІЛЬНО ПО краплях дофенокси)етокси]етил-6,7-бензоморфандають приготовлений при -5°С розчин пдрохлорид ((+)-2vCI), 3,5г(19ммоль) (-) -S-2 - бензилоксипропюнової використовуючи 1,5г(6,5ммоль) (+)-4'-пдроксикислоти, 1,8г(19ммоль) метилового ефіру хлорму5|9,9-триметил-6,7-бензоморфану ((+) -2а) і рашиної кислоти і 2,0г(19ммоль) N1,5г(7,5ммоль) 2-( 2-фенокси) етокси- етилхлориметилморфоліну у 20мл дихлорметану Реакцію ДУ продовжують при кімнатній температурі протягом Вихід 1,8Г(64%), Т П Л 190°С, [a] d 25 = (+) 81,0° години, розчинник відкачують у вакуумі, обробля(С = 1 у метанолі) ють 60мл дихлорметану, екстрагують ДВІЧІ 20МЛ (-)-(1 R, 2"3)-2-[2"-(2'"-Ціанобензил)окси]пропіл2N соляної кислоти і один раз 20мл води Органіч4'-пдрокси-5,9,9-триметил-6,7-бензоморфанну фазу сушать сірчанокислим магнієм і відкачупдрохлорид ((-)-2wCI), ють у вакуумі розчинник Після додавання невеливикористовуючи 0,8г(3,4ммоль) (-)-4'-Гідроксикої КІЛЬКОСТІ ефіру викристалізовується продукт з 5,9,9-триметил-6,7-бензоморфану ((-)-2а) і Т пл 110°С, який відкачують і обробляють 80мл 1,0г(3,7ммоль) 2-(2'-ціанобензил) оксипропілового тетрапдрофурану ЛТФ) До цього розчину додаефіру S-метансульфоновоі кислоти Вихід ють 0,8г(21ммоль) літійалюмшійпдриду (ЬАІЬЦ), 0,2г(13%), Тпл 234°С при цьому температура підвищується до 35°С (-)-(1R)- 2-[2"-(2'"-Циклогексилокси) етокси] Реакцію продовжують 1 годину, потім додають етил-4'-пдрокси-5,9,9-триметил 6,7-бензоморфан25мл води і 25мл 40%-ного розчину тартрату напдрохлорид ((-)-2хСІ), трію Органічну фазу відокремлюють, водяну фазу використовуючи 1,0г(4,3ммоль) (-)-4'-пдроксиДВІЧІ екстрагують ЮОмл ефіру і об'єднані органічні 5,9,9-триметил-6,7-бензоморфану ((-)-2а) і фази концентрують у вакуумі Залишок обробля1,1г(5,4ммоль) 2-( 2'-циклогексилокси) етокси) ють ЮОмл ефіру, сушать сірчанокислим магнієм і етилхлориду під дією соляної кислоти висаджують пдрохлорид Вихід 0,7Г(37%) Т П Л 204°С, [a] d 25 = (-) 71,1° Кристали відокремлюють і перекристалізовують із (С= 1 у метанолі) ізопропанолу Одержують 1,1г(17%) (+) 5ЬСІ, Т пл (-)-(1 R)-2-{2"-[2"1-(2,6-Дифтopфeнoкcи) етокси] 246°С, [a] d (+)11,8° (С=1 у метанолі) Маточник етил}-4'-Гідрокси-5,9,9-триметил-6,7бензоморконцентрують, виділяють основу і здійснюють фан-пдрохлорид ((-)-2уСІ), хроматографію (ЗООгсилікагелю, етилацевикористовуючи 2,3г(10ммоль) (-)-4'-пдрокси 28 27 61973 5,9,9-триметил-6,7-бензоморфану ((-)-2а) і Вихід 0,9Г(56%), Т ПЛ, 250°С, [250°С, [a] d 25 = (-) 71,1° лію Суміш перемішують протягом 7 годин при (С=1 у метанолі) 110°С, розчинник відкачують у вакуумі Залишок (-)-(1 R)-2-[2"-(2'"-TpeT -бутилокси)етокси] етилрозводять у ЮОмл води, тричі екстрагують ЮОмл 4'-пдрокси-5,9,9-триметил-6,7бензоморфанетилацетату і об'єднані органічні екстракти промипдрохлорид ((-)-2асСІ), вають ще раз 50мл води, сушать сірчанокислим використовуючи 1,5г(6,4ммоль) (-)-4'-пдроксимагнієм, розчинник відкачують у вакуумі Залишок 5,9,9-триметил-6,7-бензоморфану ((-)-2а) і очищають у колоні миттєвого одноразового випа1,4г(7,7ммоль) 2-(2'-трет-бутилокси) етокси) етилровування (120мл силікагелю, етилацехлориду тат/циклогексан 1 1) і перемішують із 50мл концеВихід 0,8Г(30%), Т ПЛ 209°С, [a] d 25 = (-) 72,4° нтрованої соляної кислоти протягом ЗО хвилин при (С=1 у метанолі) температурі утворення флегми Потім розбавляПриклад 15 (-)-(1 Р)-5-Етил-4'-пдрокси-9,9ють 150мл крижаної води, одноразово струшують диметил-2-(2-(2-фенокси)етокси)-етил-6,7із 50мл етилацетату (органічну фазу відкидають), бензоморфан-пдрохлорид (ЗЬСІ) доводять до лужної реакції концентрованим амо1,0г(3,4ммоль) (-)-5-Етил-4'-метокси-9,9нієм Екстрагують тричі ЮОмл етилацетату, об'єддиметил-6,7-бензоморфану (10) нагрівають із нані органічні екстракти сушать сірчанокислим 20мл 48%-ноі бромистоводневої кислоти протягом магнієм, розчинник відкачують у вакуумі Залишок 2 годин із зворотним холодильником Потім концерозчиняють у Юмл етанолу і під дією соляної киснтрують у вакуумі і залишок дворазово розчиняють лоти випадає в осад пдрохлорид Вихід 0,7г(27%) 20мл етанолу і знову концентрують Обробляють Т пл 112°С, [a] d 25 = (-) 75,8° (С=1 у метанолі) 20мл диметилформаміду (ДМФ), додають 800мг (4,0ммоль) 2-(2-фенокси) етокси-етилхлориду в Приклад 19 (-)-(1R, 2"3)-2-(2"-бензилокси) Юмл ДМФ, каталітичну КІЛЬКІСТЬ ЙОДИСТОГО калію і пропіл-З'-хлор 4'-пдрокси-5,9,9-триметил-6,7Ігкарбонату калію Суміш перемішують протягом 4 бензоморфан-пдрохлорид ((-)-2aqCI) і (-)-(1R, 2"S)годин при 80°С, розчинник відкачують у вакуумі 2-(2"-бензилокси) пропіл-1'-хлор-4'-Гідрокси-5,9,9Залишок обробляють ЮОмл води, тричі екстрагутриметил-6,7-бензоморфан-пдрохлорид ((-)2апСІ) ють ЮОмл етилацетату і об'єднані органічні екстЗг (7,3ммоль) (-)-(1R 2"S)-2-(2"- Бензилокси) проракти промивають ще раз 50мл води, сушать сірпіл-4'-пдрокси-5,9,9-триметил-6,7-бензоморфанчанокислим магнієм, розчинник відкачують у пдрохлориду ((-)-2ЬСІ) і 1,0г(7,3ммоль) Nвакуумі Залишок розчиняють у 40мл ефіру і під хлорсукциміду суспендують у 70мл крижаної оцтодією соляної кислоти випадає пдрохлорид Вихід вої кислоти і перемішують протягом 24 годин при 1,0г(66%) Т пл 90°С (із розкладанням) кімнатній температурі, причому суспензія переходить у розчин Потім суміш концентрують у вакууПриклад 16 (-)-(1 R)-4'-riflpoKCH-2-(2"мі, залишок розбавляють ЮОмл крижаного 2N їдфентетил)-5,9,9-триметил-6,7-бензоморфанкого натрію і струшують із ЮОмл етилацетату пдрохлорид ((-)-2adCI) Об'єднані органічні фази сушать сірчанокислим 1,0г(4,3ммоль) (-)-4'-Гідрокси-5,9,9-триметилмагнієм і розчинник відкачують у вакуумі Потім 6,7-бензоморфану ((-)-2а) і 1,0г (8,3ммоль) фенізалишок хроматографують на силікагелі (180г силацетальдегьду розчиняють у 20мл метанолу, лікагелю, циклогексан/етилацетат 51) ЦІЛЬОВІ пропускають крізь молекулярне сито і перемішуфракції концентрують, залишок розчиняють у 15мл ють протягом 3 годин при температере утворення ацетону і під дією соляної кислоти випадає в осад флегми Потім відфільтровують за допомогою мопдрохлорид Одержують 0,4г(12%) (-)- 2aqCI), лекулярного сита, і фільтрат змішують із Тпл 204°С, [a] d 2 -(-) 21,5° (С=1 у метанолі), і 0,6г(9,5ммоль) ціанборпдриду натрію і 1,2мл кри0,6г(18%) (-)- 2ahCI),Тпл 258°С, [a] d 25 = (-) 4,6° жані оцтової кислоти Витримують 12 годин, роз(С=1 у метанолі) бавляють 20мл 4N соляної кислоти і концентрують у вакуумі Залишок розбавляють невеликою КІЛЬКІНижче наведені деякі приклади для приготуСТЮ ацетону і кристали відсмоктують вання фармацевтичних композицій із використай 29 ням активної діючої речовини Таблетки Активна речовина ВІДПОВІДНО ДО за гальної формули І Стеарат магнію Лактоза 20мг 1 мг 190мг Розчин для ІН'ЄКЦІЙ Активна речовина ВІДПОВІДНО ДО загальної формули і Хлорид натрію Бензил ідєнхлорид Вода для ІН'ЄКЦІЙ 0,3мг 0,8г 0,01мг ДО ЮОМЛ Аналогічний наведеному вище розчин придатний для назального застосування у вигляді спрея, або в сполученні з пристроєм, що забезпечує подачу розчину у вигляді аерозолю з розміром часточок краще між 2 і 6цМ у легені Розчин для вливань (інфузії) У 5% ваг розчині ксиліту, що містить активну речовину в концентрації, наприклад 2мг/мл, встановлюють рН порядку 4, використовуючи натрійацетатний буфер Комп'ютерна верстка С Волобуев ЗО Подібні розчини для інфузії можуть містити активну речовину загальної формули І у КІЛЬКОСТІ ВІД 0,001 до 20% ваг, краще від 0,001 до 10% ваг і найкраще від 0,01 до 5% ваг відносно до загальної маси фармацевтичної композиції Капсули для інгаляцій Тверді желатинові капсули за певних умов заповнюють активною речовиною загальної формули І у мікронізованій формі (розмір часточок від 2 до 6цМ) із додаванням мікронізованих носив, таких як наприклад лактоза Для інгаляцій використовують звичайні порошкові інгалятори Кожну капсулу заповнюють, наприклад, активною речовиною в КІЛЬКОСТІ від 0,2 до 20мг і лактозою від 0 до 40мг Аерозоль для інгаляцій Активна речовина відповідне до загальної формули І 1 частина Соєвий лецитин 0, 2 частини Газоутворююча суміш до 100 частин 61973 Підписано до друку 06 10 2003 Тираж39 прим Міністерство освіти і науки України Державний департамент інтелектуальної власності, Львівська площа, 8, м Київ, МСП, 04655, Україна ТОВ "Міжнародний науковий комітет", вул Артема, 77, м Київ, 04050, Україна
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted 1,2,3,4,5,6-hexahydro-2.6-methano-3-benzazocine-10-oles, a method for producing the same and the use thereof as medicaments
Автори англійськоюGrauert Matthias, Pschorn Uwe
Назва патенту російськоюЗамещенные 1,2,3,4,5,6-гексагидро-2,6-метано-3-бензазоцин-10-олы, способ их получения и их применение в качестве лекарственного средства
Автори російськоюГрауэрт Маттиас, Пшорн Уве
МПК / Мітки
МПК: A61P 25/14, A61P 25/18, A61P 25/16, A61P 9/06, A61P 9/02, A61P 9/00, C07D 221/26, A61P 25/00, A61P 25/08, A61K 31/439, A61P 9/10, A61P 25/28
Мітки: композиція, фармацевтична, бензазоцинолу, похідні, основі
Код посилання
<a href="https://ua.patents.su/15-61973-pokhidni-benzazocinolu-ta-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Похідні бензазоцинолу та фармацевтична композиція на їх основі</a>
Попередній патент: Спосіб очистки стічних вод
Наступний патент: Візок вантажного вагона
Випадковий патент: Спосіб визначення пізніх передчасних пологів у вагітних