Похідні піперидину з аналгезивною дією, спосіб їх отримання та фармацевтична композиція на їх основі
Формула / Реферат
1. Сполука загальної формули (І)
,(I)
де R1 вибирають з водню, розгалуженого або нерозгалуженого С1-С6-алкілу, С1-С6-алкенілу, С3-С8-циклоалкілу, С4-С8-(алкілциклоалкілу), де алкіл являє собою С1-С2-алкіл, і циклоалкіл являє собою С3-С6-циклоалкіл;
С6-С10-арилу або гетероарилу, що має від 5 до 10 атомів, вибраних з С, S, N і О; де арил або гетероарил може бути необов'язково і незалежно заміщений 1 або 2 замісниками, незалежно вибраними з водню, СН3, -(СН2)pСF3, галогену, -CONR5R4, -COOR5, -COR5, -(CH2)pNR5R4, -(СН2)pСН3(CН2)pSОR5R4, -(CH2)pSO2R5 і -(СН2)pSO2NR5, де R4 і R5, кожен незалежно, такі, як визначено вище для R1, та p дорівнює 0, 1 або 2;
(С1-С2-алкіл)-(С6-С10-арилу) або (С1-С2-алкіл)гетероарилу, причому гетероарильні частини мають від 5 до 10 атомів, вибраних з С, S, N і О, і де арил або гетероарил може бути необов'язково і незалежно заміщений 1 або 2 замісниками, незалежно вибраними з водню, СН3, -(CH2)qCF3, галогену, -CONR5R4, -COOR5, -COR5, -(CH2)qNR5R4, -(CH2)qCH3(CH2)qSOR5R4, -(CH2)qSO2R5, -(CH2)qSO2NR5 і -(CH2)pOR5, де R4 і R5, кожен незалежно, такі, як визначено вище для R1, і q дорівнює 0, 1 або 2; та
,
,
,
де R18, R19, R20, R21, R22, R23, R24 і R25, кожен незалежно, являють собою водень, С1-С6-алкіл або С1-С6-алкеніл;
R2 і R3, кожен незалежно, являють собою водень або С1-С6-алкіл;
А вибирають з
,
,
,
,
,
,
де R8, R9, R10, R11, R12, R13, R14, R15, R16 і R17, кожен незалежно, такі, як визначено вище для R1, і де фенільне кільце кожного замісника А може бути необов'язково і незалежно заміщеним по будь-якому положенню фенільного кільця 1 або 2 замісниками Z1 та Z2, які, кожен незалежно, вибирають з водню, СН3, -(CH2)qCF3, галогену, -CONR6R7, -COOR6, -COR6, -(CH2)rNR6R7, -(СН2)rСН3(СН2)rSОR6, -(CH2)rSO2R6 і -(СН2)rSO2NR6R7, де R6 і R7, кожен незалежно, такі, як визначено вище для R1, та r дорівнює 0, 1 або 2;
Q являє собою С5-С6-гідроарильний або гетерогідроароматичний радикал, що має 5 або 6 атомів, вибраних з С, S, N і О; С5-С6-циклоалкіл або гетероциклоалкіл, що має 5 або 6 атомів, вибраних з С, S, N і О; і де кожен Q необов'язково може бути заміщений замісником Z1 та Z2, як визначено вище;
В являє собою заміщену чи незаміщену ароматичну, гетероароматичну, гідроароматичну або гетерогідроароматичну частину, що має від 5 до 10 атомів, вибраних з С, S, N та О, і необов'язково та незалежно заміщену 1 або 2 замісниками, незалежно вибраними з водню, СН3, -(СН2)tСF3, галогену, -(СН2)tСОNR5R4, -(СН2)tNR5R4, -(CH2)tCOR5, -(CH2)tCOOR5, -OR5, -(CH2)tSOR5, -(CH2)tSO2R5 і -(СН2)tSО2NR5R4, де R4 і R5, кожен незалежно, такі, як визначено вище для R1, та t дорівнює 0, 1, 2 або 3; і R4 і R5, кожен незалежно, такі, як визначено вище для R1, а також фармацевтично прийнятні солі сполук формули (І) та їх ізомери, гідрати, ізоформи та проліки.
2. Сполука формули (І) за п. 1, де
А вибирають з
,
,
,
,
,
,
де R8, R9, R10, R11, R12, R13, R14, R15, R16 і R17, кожен незалежно, такі, як визначено вище для R1, і де фенільне кільце кожного замісника А може бути необов'язково і незалежно заміщене по будь-якому положенню фенільного кільця 1 або 2 замісниками Ζ1 та Ζ2, які, кожен незалежно, вибирають з водню, СН3, -(CH2)qCF3, галогену, -CONR6R7, -COOR6, -COR6, -(СН2)rNR6R7, -(СН2)rСН3(СН2)rSОR6, -(CH2)rSO2R6 і -(СН2)rSO2NR6R7, де R6 і R7, кожен незалежно, такі, як визначено вище для R1, і r дорівнює 0, 1 або 2;
Q вибирають з морфоліну, піперидину, та піролідину; R1, R4 і R5, кожен незалежно, вибирають з водню, розгалуженого або нерозгалуженого С1-С4-алкілу, С3-С5-циклоалкілу, С4-С8-(алкілциклоалкілу), де алкіл являє собою С1-С2-алкіл, і циклоалкіл являє собою С3-С6-циклоалкіл; С6-С10-арилу або гетероарилу, що має від 5 до 6 атомів, вибраних з С, S, N і О; і де арил або гетероарил може бути необов'язково і незалежно заміщений 1 або 2 замісниками, незалежно вибраними з водню, СН3, -(CH2)pCF3, галогену, -CONR5R4, -COOR5, -COR5, -(СН2)pNR5R4, -(СН2)pСН3(СН2)pSОR5R4, -(CH2)pSO2R5 і -(СН2)pSO2NR5, де R4 і R5, кожен незалежно, такі, як визначено вище для R1, та p дорівнює 0, 1 або 2;
В вибирають з фенілу, нафтилу, індолілу, бензофуранілу, дигідробензофуранілу, бензотіофенілу, пірилу, фуранілу, хінолінілу, ізохінолінілу, циклогексилу, циклогексенілу, циклопентилу, циклопентенілу, інданілу, інденілу, тетрагідронафтилу, тетрагідрохінілу, тетрагідроізохінолінілу, тетрагідрофуранілу, піролідинілу і індазолінілу, кожен з яких необов'язково і незалежно заміщений 1 або 2 замісниками, незалежно вибраними з водню, СН3, СF3, галогену, -(CH2)qCONR5R4, -(СН2)qNR5R4, -(CH2)qCOR5, -C(CH2)qCO2R5 та -OR5, де q дорівнює 0 або 1, і де R4 та R5 такі, як визначено вище;
R2 і R3, кожен незалежно, являють собою водень або метил.
3. Сполука формули (І) за п. 2, де А являє собою
,
де R8 та R9 обидва являють собою етил, і де фенільне кільце необов'язково та незалежно, може бути заміщеним по будь-якому положенню фенільного кільця двома замісниками Z1 і Z2, які, кожен незалежно, вибирають з водню, СН3, -(CH2)qCF3, галогену, -CONR6R7, -COOR6, -COR6, -(CH2)rNR6R7, -(СН2)rСН3(CH2)rSOR6, -(CH2)rSO2R6 і -(CH2)rSО2NR6R7, де R6 і R7, кожен незалежно, такі, як визначено вище для R1, та r дорівнює 0, 1 або 2;
R1 вибирають з водню, метилу, етилу, -CH2CH=CH2, -CH2-циклопропілу, -СН2-арилу або СН2-гетероарилу, причому гетероарильні частини мають від 5 до 6 атомів, вибраних з С, S, N і О;
В вибирають з фенілу, нафтилу, індолілу, бензофуранілу, дигідробензофуранілу, бензотіофенілу, фуранілу, хінолінілу, ізохінолінілу, циклогексилу, циклогексенілу, циклопентилу, циклопентенілу, інданілу, інденілу, тетрагідронафтилу, тетрагідрохінілу, тетрагідроізохінолінілу, тетрагідрофуранілу та індазолінілу, кожен з яких необов'язково і незалежно заміщений 1 або 2 замісниками, незалежно вибраними з водню, СН3, СF3, галогену, -(CH2)qСОNR5R4, -(CH2)qNR5R4, -(CH2)qCOR5, -(CH2)qCO2R5 і -OR5, де q дорівнює 0 або 1, та де R4 і R5 такі, як визначено вище;
R2 і R3, кожен незалежно, являють собою водень або метил.
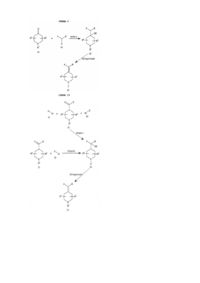
4. Сполука формули (І) за п. 1, що являє собою:
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
де R являє собою морфолін, піперидин або піролідин,
;
;
;
;
;
;
;
;
та
.
5. Сполука за п. 1, яку вибирають з
та
.
6. Сполука за будь-яким з попередніх пунктів у формі її гідрохлоридної, сульфатної, тартратної чи цитратної солі.
7. Сполука за будь-яким з пунктів 1 - 6 для використання в терапії.
8. Сполука за п. 7, де терапія являє собою втамування болю.
9. Сполука за п. 7, де терапію спрямовано на шлунково-кишкові порушення.
10. Сполука за п. 7, де терапію спрямовано на спинні ушкодження.
11. Сполука за п. 7, де терапію спрямовано на порушення симпатичної нервової системи.
12. Сполука за будь-яким з пп. 1 - 7, яка додатково відрізняється тим, що її мічено ізотопом.
13. Мічена ізотопом сполука формули (І) за п. 1.
14. Діагностичний агент, який включає сполуку формули (І) за п. 1.
15. Фармацевтична композиція, яка включає сполуку формули (І) за п. 1 як активний інгредієнт разом з фармакологічно та фармацевтично прийнятним носієм.
16. Спосіб одержання сполуки формули (І) за п. 1, який включає
а) взаємодію кетону формули (І)
, (І)
де R1, R2 і R3 такі, як визначено в формулі (І) в п. 1, і Χ являє собою групу, що відходить, з металорганічним реагентом формули (j) або (k)
(j)
або
, (k)
де А та В такі, як визначено в формулі (І) в п. 1, та Μ являє собою групу металу; і де взаємодію необов'язково проводять в присутності розчинника, з одержанням сполуки формули (h)
, (h)
де А, В, R1, R2 і R3 такі, як визначено в формулі (І) в п. 1, і де R1 може бути також трет-бутоксикарбонілом;
b) дегідратацію сполуки формули (h) з одержанням сполуки формули (І) за п. 1.
17. Сполука формули
, (h)
де А, В, R2 і R3 такі, як визначено в формулі (І) в п. 1.
18. Сполука формули (h) за п. 17, де А являє собою
,
де R8 і R9 обидва являють собою етильну групу, і Z1 та Z2 такі, як визначено в п. 1.
19. Сполука за п. 18, яка являє собою:
;
;
;
;
;
;
;
;
.
20. Спосіб лікування болю, який включає введення ефективної кількості сполуки формули (І) за п. 1 суб'єкту, який потребує втамування болю.
21. Спосіб лікування шлунково-кишкових порушень, який включає введення ефективної кількості сполуки формули (І) за п. 1 суб'єкту, який страждає на зазначене шлунково-кишкове порушення.
22. Спосіб лікування спинних ушкоджень, який включає введення ефективної кількості сполуки формули (І) за п. 1 суб'єкту, який страждає на зазначене спинне ушкодження.
Текст
Даний винахід стосується нових сполук, способу їх одержання, їх використання і фармацевтичних композицій, що містять нові сполуки. Нові сполуки можна використовувати в терапії, особливо для лікування болю. Засновки здійснення винаходу і відомий рівень техніки d-рецептор було ідентифіковано як такий, що відіграє роль в багатьох функціях організму, таких як серцево-судинна і больова системи. Ліганди для d-рецептора можуть, отже, знайти потенційне застосування як аналгезивні і/або антигіпертензивні засоби. Було також виявлено, що ліганди для d-рецептора мають імуномодулюючу активність. Зараз ідентифіковані, принаймні, три різні популяції опіоїдних рецепторів (μ, δ і æ), і всі три виявляються як в центральній, так і периферійній нервових системах багатьох видів тварин, включаючи людину. Аналгезію спостерігали на різних моделях тварин, коли були активовані один чи кілька з цих рецепторів. За рідким винятком, доступні нині селективні опіоїдні δ-ліганди є за природою пептидними сполуками і не придатні для введення у системні способи. Деякі непептидні δ-антагоністи стали доступними протягом останнього часу (див. Takemori and Portoghese, 1992, Ann. Rev. Pharmacol. Tox., 32: 239-269.). Ці сполуки, наприклад, налтриндол, характеризуються досить слабкою (тобто слабшою в 10 разів) селективністю зв'язування δ-peцептора порівняно з μ-рецептором і не виявляють аналгезивної активності, факт, який передбачає необхідність розробки високоселективних непептидних S-лігандів. Таким чином, проблемою, що лежить в основі даного винаходу, було одержання нових аналгетиків, що мають підвищену аналгезивну дію, а також покращений профіль побічної дії порівняно з сучасними μагоністами і значну пероральну ефективність. Аналгетики, що були ідентифіковані і описані у відомому рівні техніки, мають багато недоліків, які виявляються в тому, що вони мають погану фармакокінетику і не справляють аналгезивної дії при введенні у системні способи. Крім того, документально підтверджено, що більш прийнятні сполуки, описані у відомому рівні техніки, справляють також значну судорожну дію при системному введенні. Названу вище проблему вирішено шляхом розробки нових сполук, які мають кільце піперидину з екзоциклічним подвійним зв'язком, як буде описано нижче. Опис винаходу Нові сполуки відповідно до цього винаходу мають загальну формулу (І) (I) де R1 вибирають з водню, розгалуженого або нерозгалуженого С 1-С6-алкілу, С1-С6-алкенілу, С3-С8циклоалкілу, С4-С8-(алкілциклоалкілу), де алкіл являє собою С 1-С2-алкіл, і циклоалкіл являє собою С 3-С6циклоалкіл; С6-С10-арилу або гетероарилу, що має від 5 до 10 атомів, вибраних з С, S, N і О; де арил або гетероарил може бути необов'язково і незалежно заміщений 1 або 2 замісниками, незалежно вибраними з водню, СН3, (CH2)pCF3, галогену, -CONR 5R4, -COOR 5, -COR 5 , -(CH2)pNR5R4, -(CH2)pCH3(CH2)pSOR5R 4, -(CH2)pSO 2R5 і (CH2)pSO2NR5, де R4 і R5, кожен незалежно такі, як визначено вище для R1, та р дорівнює 0, 1 або 2; (С1-С2-алкіл) - (С6-С10-арилу) або (С1-С2-алкіл) гетероарилу, причому гетероарильні частини мають від 5 до 10 атомів, вибраних з С, S, N і О; і де арил або гетероарил може бути необов'язково і незалежно заміщений 1 або 2 замісниками, незалежно вибраними з водню, СН3, -(CH2)q CF3, галогену, -CONR 5R4 , -COOR 5, -COR 5 , {CH2)q NR5R4, -(CH2)qCH3(CH2)q SOR5R4, -(CH2)q SO2R5 і -(CH2)pOR5, де R4 і R5, кожен незалежно, такий, як визначено вище для R1, і q дорівнює 0, 1 або 2; та де R18, R19, R20, R21 , R22, R23, R 24 і R 25, кожен незалежно, являють собою водень, С1-С6-алкіл або С1-С6-алкеніл; R2 і R3, кожен незалежно, являють собою водень або С1-С6-алкіл; А вибирають з де R8, R9, R10, R11 , R12 , R13, R14, R15 , R16 і R17 , кожен незалежно, такі як визначено вище для R1, і де фені льне кільце кожного замісника А може бути необов'язково і незалежно заміщеним по будь-якому положенню фенільного кільця 1 або 2 замісниками Z1 та Z2, які, кожен незалежно, вибирають з водню, СН3, (CH2)q CF3, галогену, -CONR6R7, -COOR 6 , -COR 6, - (CH2) rNR6R7, -(CH2)rCH3(CH2)rSOR6, -(CH2)rSO2R6 і -(CH2)rSO2NR6R7, де R6 і R7, кожен незалежно, такі, як визначено вище для R 1, та г дорівнює 0, 1 або 2; Q являє собою С5-С6-гідроарильний або гетерогідроароматичний радикал, що має 5 або 6 атомів, вибраних з С, S, N і О; C5-С6-циклоалкіл або гетероциклоалкіл, що має 5 або б атомів, вибраних з С, S, N і О; і де кожен Q необов'язково може бути заміщений Z1 та Z 2, як визначено вище; В являє собою заміщену або незаміщену ароматичну, гетероароматичну, гідроароматичну або гетерогідроароматичну частину, що має від 5 до 10 атомів, вибраних з С, S, N та О, і необов'язково та незалежно заміщену 1 або 2 замісниками, незалежно вибраними з водню, СН3, -(CH2)tCF3, галогену, -(СН2) 5 4 5 4 5 5 5 5 5 5 4 4 tCONR R , -(CH 2)tNR R , -(CH 2)tCOR , -(СН 2) tCOOR , -OR , -(CH 2)tSOR , -(CH 2)tSO 2R і - (CH 2)tSO2NR R , де R 5 4 5 і R , кожен незалежно, такі, як визначено вище для R, і t дорівнює 0, 1, 2 або 3; і R і R , кожен незалежно, такі, як визначено вище для R1. До обсягу даного винаходу включені також фармацевтично прийнятні солі сполук формули (І), а також їх ізомери, гідрати, ізомерні форми та проліки. Більш прийнятні сполуки винаходу являють собою сполуки формули (І), де А вибирають з де R8, R9, R10 , R11 , R12, R 13, R 14, R15, R16 і R17, кожен незалежно, такі як визначено вище для R1, і де фенільне кільце кожного замісника А може бути необов'язково і незалежно заміщене по будь-якому положенню фенільного кільця 1 або 2 замісниками Z1 та Z2, які, кожен незалежно, вибирають з водню, СНз, -(CH2)q CF3, галогену, -CONR6R7, -COOR 6, -COR 6, -(СН2) rNR6R7, -(CH2)rCH3(CH2)rSOR6, -(CH2)rSO2R6 i - (CH2) rSO2NR6R7, де R6 i R7, кожен незалежно, такі, як визначено вище для R 1, і r дорівнює 0, 1 або 2; Q вибирають з морфоліну, піперидину, та піролідину; R1, R4 і R5, кожен незалежно, вибирають з водню, розгалуженого або нерозгалуженого С 1-С4-алкілу, С3-С5-циклоалкілу, С4-С8-(алкілциклоалкілу), де алкіл являє собою С 1-С2-алкіл, і циклоалкіл являє собою С 3-С6-циклоалкіл; С6-С10-арилу або гетероарилу, що має від 5 до 6 атомів, вибраних з С, S, N і O; і де арил або гетероа-рил може бути необов'язково і незалежно заміщений 1 або 2 замісниками, незалежно вибраними з водню, СН3, -(CH2)pCF3 , галогену, -CONR 5R4, -COOR 5, -COR 5, (CH2)pNR5R4, - (CH2)pCH3 (CH2)pSOR5R4, -(CH2)pSO 2R5 і - (CH2)pSO2NR5, де R4 і R5, кожен незалежно, такі, як визначено вище для R1, та ρ дорівнює 0, 1 або 2; В вибирають з фенілу, на фтилу, індолілу, бензофуранілу, дигідробензофуранілу, бензотіофенілу, пірилу, фуранілу, хінолінілу, ізохінолінілу, циклогексилу, циклогексенілу, циклопентилу, циклопентенілу, інданілу, інденілу, тетрагідронафтилу, тетрагідрохінілу, тетрагідроізохінолінілу, тетрагідрофуранілу, піролідинілу і індазолінілу, кожен з яких необов'язково і незалежно заміщений 1 або 2 замісниками, незалежно вибраними з водню, СН3, CF3, галогену, -(СН2)q CONR5R4, -(СН2)q NR5R4, -(CH2)q COR5, -C(CH2)q CO2R5 та -OR5, де q дорівнює 0 або 1, і де R4 і R5 такі, як визначено вище; R2 і R3, кожен незалежно, являють собою водень або метил. Особливо прийнятні сполуки винаходу являють собою сполуки формули (І), де А являє собою де R8 та R9 , обидва являють собою етил, і де фенільне кільце необов'язково та незалежно, може бути заміщеним по будь-якому положенню фенільного кільця двома замісниками Z1 і Z2, які, кожен незалежно, вибирають з водню, СН3, -(CH2)q CF3, галогену, -CONR6R7, -COOR 6, -COR 6, -(CH2)rNR6R7, - (CH2) rCH3 (CH2) 6 6 6 7 6 7 1 r SOR , -(CH 2)r SO2R і -(CH 2)r SO2NR R , де R і R , кожен незалежно, такі, як визначено вище для R , та r дорівнює 0, 1 або 2; R1 вибирають з водню, метилу, етилу, -СН2СН=СН2, -СН2-циклопропіл, -СН2-арил або СН 2-гетероарил, причому гетероарильні частини мають від 5 до 6 атомів, вибраних з С, S, N і О; В вибирають з фенілу, нафтилу, індолілу, бензофуранілу, дигідробензофуранілу, бензотіофенілу, фуранілу, хінолінілу, ізохінолінілу, циклогексилу, циклогексенілу, циклопентилу, циклопентенілу, інданілу, інденілу, тетрагідронафтилу, тетрагідрохінілу, тетрагідроізохінолінілу, тетрагхдрофуранілу та індазолінілу, кожен з яких необов'язково і незалежно заміщений 1 або 2 замісниками, незалежно вибраними з водню, СН3, CF3, галогену, -(СН2)q CONR5R4, -(СН2)q NR5R4, -(СН2)q COR5, -(СН2)q CO2R5 і -OR5, де q дорівнює 0 або 1, і де R4 і R5 такі, як визначено вище; R2 і R3, кожен незалежно, являє собою водень або метил. Замісники А і В, відповідно, можуть бути необов'язково заміщені в будь-якому положенні кільця. Термін "галоген" означає хлор, фтор, бром і йод. Термін "арил" означає ароматичне кільце, що має від 6 до 10 атомів вуглецю, таке як феніл і нафтил. Термін "гетероарил" означає ароматичне кільце, в якому один чи кілька з 5-10 атомів в кільці являють собою атоми, які не є вуглецем, такі як N, S та О. Термін "гідроароматичний" означає частково або повністю насичене ароматичне кільце, що має 5-10 атомів у кільці. Термін "гетерогідроароматичнии" означає частково або повністю насичене ароматичне кільце, в якому один чи кілька з 5-10 атомів в кільці є атомами, які не є вуглецем, такими як N, S і О. Термін "ізомери" означає сполуки формули (І), які відрізняються положенням їх функціональної групи і/або орієнтацією. Термін "орієнтація" означає стереоізомери, діастереоізомери, регіоізомери та енантіомери. Термін "ізоформи" означає сполуки формули (І), які відрізняються кристалічною решіткою, такі як кристалічна сполука та аморфні сполуки. Термін "проліки" означає фармакологічно прийнятні похідні, наприклад, складні ефіри і аміди, такі, що продукт біоперетворення такої похідної, який утворюється, є активним лікарським засобом. Публікацію Goodman and Gilmans, The Pharmacological basis of Therapeutics, 8 th ed., McGraw-Hill, Jnt. Ed. 1992, "Biotransformation of Drugs, p.13-15, що описує проліки взагалі, включено сюди як посилання. Нові сполуки даного винаходу корисні в терапії, особливо для лікування різних хворобливих станів, таких як хронічний біль, гострий біль, біль при раку, біль, викликаний ревматоїдним артритом, мігрень, вісцеральний біль тощо. Цей перелік, однак, не повинен тлумачитись як вичерпний. Сполуки винаходу корисні як імуномодулятори, особливо при аутоімунних хворобах, таких як артрит, при трансплантації шкіри, органів-трансплантатів і для аналогічних хірургічни х потреб, для колагенових хвороб, різних алергії, для використання як протипухлинних засобів та антивірусних агентів. Сполуки винаходу корисні при хворобливих станах, де має місце дегенерація або дисфункція опіоїдних рецепторів, або опіоїдні рецептори втягнуті в цю парадигму. Це застосування може включати використання мічених ізотопами варіантів сполук винаходу в діагностичних методиках і в застосуваннях для одержання зображень, таких як позитронна емісійна томографія (ПЕТ). Сполуки винаходу можна використовувати для лікування діареї, депресії, нетримання сечі, різних психічних хвороб, кашлю, набряку легень, різних шлунково-кишкових порушень, спінального ушкодження та звикання до надмірного вживання лікарських засобів, включаючи лікування алкогольної, нікотинової, опіоїдної та інших залежностей, і порушень симпатичної нервової системи, наприклад, гіпертензії. Сполуки винаходу корисні як аналгезивний агент для застосування під час загальної анестезії і для надання допомоги контрольованою анестезією. Комбінації агентів з різними властивостями часто використовують для досягнення балансу дій, необхідних для підтримання анестезованого стану (наприклад, амнезії, аналгезії, м'язової релаксації і садативного ефекту). До цієї комбінації входять анестетики, які вводяться інгаляцією, снотворні засоби, анксіолітики, нейром'язові блокатори та опіоїди. Сполуки даного винаходу в міченій ізотопом формі можна використовувати як діагностичний агент. До обсягу даного винаходу включено також використання будь-якої з сполук наведеної вище формули (І) для виготовлення лікарського засобу для лікування будь-якого з зазначених ви ще станів. Наступним аспектом винаходу є спосіб лікування суб'єкту, який хворіє на будь-який з зазначених вище станів, що включає введення ефективної кількості сполуки поданої вище формули (І) пацієнту, який потребує такого лікування. Способи одержання Сполуки даного винаходу можна одержати, як описано нижче. Як показано вище на схемах І і II, сполуки наведеної вище формули (І) можна одержати дегідратацією гідрокси-сполук (g) або (h), де R1, R2, R3, А та В такі, як визначено вище у формулі (І) . Подальшу дегідратацію гідроксильних сполук (g) або (h), де R1, R2, R3, А та В такі, як визначено вище в формулі (І), можна проводити без розчинників або в розчиннику, такому як вода, спирти, складні ефіри, НМРА, ди хлорметан, толуол, прості ефіри, кетони, карбонові кислоти, або в суміші розчинників в присутності кислот Бронстедта або Льюїса, таких як сірчана кислота, хлористоводнева кислота, трифтороцтова кислота, трихлорид алюмінію, ZnCl2 чи подібні, або в присутності оксидів металів, таких як Аl2О3, Cr2O 3, TiO 2, WO 3, P2O 5 чи подібні, або в присутності інших дегідратуючи х агентів, таких як І2, ди-метилсульфоксид, KHSO4 , CuSO4, фталевий ангідрид чи подібні. Замісники R1, R2 і R3 та замісники на А та В сполуки (І), як визначено вище, можна модифікувати у способи, відомі у цій галузі і проілюстровані в літературі, див., наприклад/ Protecting groups by Green, or Modern Synthesis Reactions by House, що добре відомі фахівцю у цій галузі, після або в процесі одержання (І) з (g) та (h). Як показано в способі по схемі І, сполуки формули (g), як описано вище, можна одержати реакцією між кетоном формули (с), де R1, R2 і R3 такі, як визначено в формулі (І), і сполукою формули (e), де А та В такі, як визначено в формулі (І), та X являє собою підхожу груп у, таку як Н, СІ, Br, I, OSO2R або подібні. Реакцію можна проводити без розчинників або в органічному розчиннику, такому як ТГФ, толуол, простий ефір, диметилсульфоксид, або суміші розчинників обробкою підхожим металом, таким як магній, літій, мідь, церій чи подібні, або обробкою галогенідом металу, таким як Sml2, СrСl2 чи подібні, або обробкою металоорганічними агентами, такими як алкілмагнійгалогеніди, алкіллітій чи подібні. R1, R2 і R3 та замісники на А та В сполуки формули (g), як визначено вище, можна модифікувати у способи, відомі у цій галузі, після або в процесі реакції металоорганічних сполук (March, J., Advanced Organic Chemistry, 4 th Ed, John Willey and Sons, 1992). Сполуки формул (с) або (є) можуть бути комерційно доступні або їх можна одержати у способи, відомі в даній галузі (March, J., Advanced Organic Chemistry, 4th Ed, John Willey and Sons, 1992). Як показано в способі b на схемі (II), сполуки формули (h), як описано вище, можна одержати реакцією між кетоном формули (і), де R1, R2 і R3 та В такі, як визначено в формулі (І), і металоорганічним реагентом формули (j), де А такий, як визначено в формулі (І), і Μ являє собою групу підхожого металу, такого як магній, літій, цинк, мідь, церій або подібні. Реакцію можна проводити без розчинників або в органічному розчиннику, такому як ТГФ, толуол, прості ефіри, диметилсульфоксид, або в сумішах розчинників. Як показано в способі с на схемі II, сполуки формули (h) можна також одержати реакціями між карбонільною сполукою формули (І), де R1, R2 і R3 такі, як визначено в формулі (І), і X являє собою підхожу груп у, що відходить, таку як СІ, Вr, ОН, OR, SR, NR 2, N(OR')R або подібні, і металоорганічними реагентами формул (j) та (k), де А і В такі, як визначено в формулі (І), і Μ являє собою груп у підхожого металу, такого як магній, літій, цинк, мідь, церій чи подібні. Реакції можна проводити без розчинників або в розчинниках, таких як ТГФ, толуол, прості ефіри, диметилформамід, діоксан, диметилсульфоксид, або в сумішах розчинників. R1, R2 і R3 та замісники на А та В сполук (h), як визначено вище, можна модифікувати у способи, відомі у цій галузі та проілюстровані в літературі, див., наприклад, Protecting groups by Green, or Modern Synthesis Reactions by House, що добре відомі фахівцю у цій галузі, після або в процесі реакцій меτалоорганічних сполук. Сполуки формул (і), (j), (k) та (l) можуть бути комерційно доступні або їх можна одержати у способи, відомі в цій галузі (March, J., Ad vanced Organic Chemistry, 4 th Ed, John Willey and Sons, 1992). Як показано вище на схемі III, сполуки наведеної вище формули (І) можна одержати сполученням за Сузукі вінілгалогеніду (о) (X=Вr, І) з бороновою кислотою, боронатним ефіром (р) в присутності основи, такої як Na2CO3, K2CO 3, К 3РО4 , триетиламін, CsF, NaOH, або алкоксидів і паладієвого каталізатора, такого як (PPh3)4Pd, біс(дибензиліденацетон)Pd(O), Pd на вугіллі з PPh3; в якості каталізатора можна також використовува ти сполуки Pd(II), в тому числі (PPh3)2PdCl2, 1,4-біс (дифенілфосфінобутан)паладій(II)хлорид, ацетат паладію, біс(ацетонітрил)паладій (II) хлорид, дихлор[1,1'-біс(дифенілфосфіно)фероцен]паладій (II) та ацетат паладію-три (о-толіл) фосфін, де R1, R2 , R3, А та В такі, як визначено вище в формулі (І). Сполучення за Сузукі можна проводити в толуолі, ксилолі, анізолі, ДМФ, ТГФ, спиртах, прости х е фірах, воді або в суміші розчинників. Сполуки формули (p), де В такий, як визначено в формулі (І), і Ζ являє собою В(ОН)2, можуть бути комерційно доступними, або їх можна одержати гідролізом боронатного ефіру. Сполуки формули (р), де В такий, як визначено в формулі (І), і Ζ являє собою В(OR)2 (R=Me, Et), можна одержати реакцією сполуки формули В-М і В(OR)3, де R=Me або Et, і Μ являє собою групу підхожого металу, такого як літій чи магній або подібне. Сполуки формули (р), де В такий, як визначено в формулі (І), і Ζ являє собою 9борабіцикло[3.3.1]нонан (9-ББН), можна одержати реакцією алк-1-іну з борабіцикло[3.3.1]нонаном. Замісники R1, R2 і R3 та замісники на А та В сполуки формули (І) , як визначено вище, можна модифікувати у способи, відомі у цій галузі та проілюстровані в літературі, див., наприклад, Protecting groups by Green, or Modern Synthesis Reactions by House, що добре відомі фахівцю у цій галузі, після або в процесі одержання (І) з (о) та (р). Як показано на схемі III, сполуки формули (о), де X являє собою Вr або І, можна одержати галогенуванням і відщепленням алкену формули (n), R1, R2, R3 і А такі, як визначено в формулі (І). Галогенування можна проводити в розчиннику, такому як дихлорметан, хлороформ, тетрахлорид вуглецю, дихлоретан або оцтова кислота, з використанням молекулярного брому чи йоду в якості галогенуючого агента. Наступну стадію відщеплення проводять у розчиннику, такому як вода, спирти, ДМФ або прості ефіри, з використанням основи, такої як гідроксид натрію, гідроксид калію, алкоксиди металів чи триетиламін. Як показано на схемі III, сполуки формули [n), як описано вище, можна одержати реакцією Вітига кетону формули (с), де R1, R2 і R3 такі, як визначено в формулі (І), і реагенту формули (m), де А такий, як визначено в формулі (І), і Υ являє собою підхожу фосфонатну або фосфонієву сіль. Реакцію Вітига можна проводити в різних умовах, відомих у цій галузі і проілюстрованих в літературі (March, J., Advanced Organic Chemistry, 4th Ed, John Willey and Sons, 1992). Реагенти формули (с) і (m) можуть бути комерційно доступними, або їх можна одержати у способи, відомі у цій галузі (March, J., Advanced Organic Chemistry, 4th Ed, John Willey and Sons, 1992). Як показано на наведеній вище схемі IV, сполуки формули (u) можна одержати дегідратацією гідроксисполуки (t), де R1, R2, R3, R12, R13 і В такі, як визначено вище. Дегідратацію можна проводити без розчинника або в розчиннику, такому як вода, спирти, складні ефіри, НМРА, ди хлорметан, толуол, прості ефіри, кетони, карбонові кислоти, або в суміші розчинників в присутності кислот Бронстедта або Льюїса, таких як сірчана кислота, хлористоводнева кислота, трифтороцтова кислота, трихлорид алюмінію, ZnCl2 чи подібні, або в присутності оксидів металів, таких як Аl2О3, Сr2О 3, ТіО 2, WO 3, P2O 5 чи подібні, або в присутності інших дегідратуючи х агентів, таких як І2, диметилсульфок-сид, KHSO4 , CuSO4, фталевий ангідрид чи подібні. Замісники R1, R2 і R3 та замісник В сполуки (и), як визначено вище, можна модифікувати у способи, відомі у цій галузі і проілюстровані в літературі, див., наприклад, Protecting groups by Green, or Modern Synthesis Reactions by House, що добре відомі фахівцю у цій галузі, після або в процесі одержання (u) з (t) . Як показано на наведеній вище схемі IV, сполуки формули (t), можна одержати з сполуки (s), де R 1, R2, R3, R13 та В такі, як визначено вище, з використанням реакції алкілування алкілгалогенідом, таким як МеІ, в присутності основи, такої як гідроксид натрію, і агента переносу фаз, такого як Bu4NHSO4. Сполуки формули (s) можна одержати, реакцією між кетоном формули (r), де R 1, R2, R3, R13 такі, як визначено вище, і металорганіч-ним реагентом формули (k), де В такий, як визначено в формулі (І), та Μ являє собою гр упу підхожого металу, такого як магній, літій, цинк, мідь, церій або тому подібне. Реакцію можна проводити без розчинника або в розчинниках, таких як ТГФ, прості ефіри, диметилформамід, діоксан, диметилсульфоксид, або в суміші розчинників. Замісники R1, R2, R 3, R13 сполуки (s) , як визначено вище, можна модифікувати у способи, відомі в даній області і які проілюстровано в літературі, див., наприклад, Protecting groups by Green, or Modern Synthesis Reactions by House, що добре відомі фахівцю у цій галузі, після або в процесі одержання (s) з (r) і (k). Як показано на схемі IV, сполуку формули (r) можна одержати реакціями між карбонільною сполукою формули (І), де R1, R2 і R3 такі, як визначено в формулі (І), та X являє собою підхожу групу, що відходить, таку як СІ, Br, OH, OR, SR, NR2, N(OR 1)R чи подібні, і металорганічним реагентом, одержаним спочатку обробкою основою, такою як NaH, сполуки (q) , де R13 такий, як визначено вище, з подальшим πереметалізуванням з використанням алкіллітію, такого як BuLi. Реакцію можна проводити в розчинниках, таких як ТГФ, толуол, прості ефіри, диметилформамід, діоксан, або в суміші розчинників. Замісники R1, R2, R3 , R13 сполуки (r), як визначено вище, можна модифікувати у способи, відомі в цій галузі та проілюстровані в літературі, див., наприклад, Protecting groups by Green, or Modern Synthesis Reactions by House, що добре відомі фахівцю у цій галузі, після або в процесі одержання (r) з (q) та (l). Як показано на схемі IV, сполуки формули (q) можна одержати ацилуванням 4-йоданіліну з використанням або ацилангідриду, або ацилхлориду в органічному розчиннику, такому як дихлорметан. Замісник R13 сполуки (q) такий, як визначено раніше. Винахід далі описано більш докладно за допомогою наведених далі прикладів, які не повинні ніяким чином розглядатись як такі, що обмежують винахід. А) С хема синтезу сполук прикладів 1-7 Сполуки прикладів 1-7 одержували відповідно до наведеної далі методики, показаної на поданій нижче схемі 1. Аr=1-нафтил, (4); Аr=2, 6-диметилфеніл, (5) Аr=феніл, (6) Приклад 1 Аr=1-нафтил, (7) Приклад 2 Аr=2,6-диметилфеніл,(8)Приклад 3 Аr=Ph, R=PhCH 2, (10) Приклад 5 Аr=Ph, R=циклопропілметил, (12) Приклад 7 Аr=Ph, R=2, 3-епоксипропіл, (11) Приклад 6 Аr=1-нафтил, R=аліл, (9) Приклад 4 (і) Одерокання N-трет-бутаксилкарбоніл-N-метил-N-метоксилізоніпекотаміду (сполука 2) Суміш етилізоніпекотату (сполука І) (4,71г 30,0ммоль) , ди-трет-бутилдикарбонату (6,55г, 30,0ммоль) і Nа2СО3 (4,77г, 45ммоль) в Н2О-ТГФ (90/10мл) кип'ятили із зворотним холодильником протягом 2 годин. Реакційну суміш екстрагували етилацетатом (150мл) . Органічний шар промивали сольовим розчином, сушили над MgSO4. Вилучення розчинників давало N-трет-бутоксилкарбонілетилізоніпекотат (7,67г): δΗ (400МГц, CDCl3) 1,25 (т, J=7,2Гц, 3Н), 1,45 (с, 9Н), 1,62 (м, 2Η), 1,87 (м, 2Η), 2,43 (м, 1Η), 2,84 (м, 2Η) , 4,02 (м, 2Η), 4,13 (кв, J=7,2Гц, 2Н); δС-13 (100МГц, CDCl3) δ: 14,0, 27,8, 28,2, 40,9, 42,9, 60,2, 79,2, 154,4, 174,2. Вищезазначений N-трет-бутоксилкарбонілетилізоніпекотат розчиняли в ТГФ (60мл) і змішували з NHMe(OMe)HCl (4,39г, 45,0ммоль). Суміш обробляли ізо-PrMgCl (2,0Μ в ТГФ, 45мл, 90ммоль) при -20°С і одержаний розчин перемішували впродовж 1 години при -5°С і потім гасили водним розчином NH4Cl і екстрагували етилацетатом (2x100мл) . Об'єднані органічні шари промивали сольовим розчином, сушили над MgSO4 . Вилучення розчинників давало N-трет-бутоксилкарбоніл-N'-метил-N'-метоксилізоніпекотамід (сполуку 2) (8,0г, 98%). δΗ (400МГц, CDCl3) 1,30 (с, 9H), 1,54 (м, 4Н), 2,65 (м, 3Н), 3,02 (с, 3Н), 3,56 (с, 3Н), 3,99 (шир.с, 2Н); δС-13 (100МГц, CDCl3) δ: 27,7, 28,1, 32,0, 37,8, 43,1, 61,3, 79,1, 154,4, 176,0. (іі) Одержання 4-(4'-N,N-діетиламінокарбонілбензоїл)-N-трет-бутоксилкарбонілпіперидину (сполука 3) До розчину 4-йод-N,N-діетилбензаміду (9,09г, 30,0ммоль) і ТМЕДА (6,96г, 60,0ммоль) в сухому ТГФ (60мл) додавали трет-бутиллітій (35,0мл, 1,7М, 60,0ммоль) при -78°С. Через 30 хвилин краплями додавали N-третбутоксилкарбоніл-N'-метил-N'-метоксилізоніпекотамід (сполуку 2) (8,0г, 29,4ммоль) в ТГФ (10мл). Реакційну суміш нагрівали до кімнатної температури і потім гасили водним розчином NH4CI, нейтралізували хлористоводневою кислотою (концентрованою, 20мл) при 0°С та екстрагували етилацетатом (2х100мл). Об'єднані органічні шари промивали сольовим розчином, сушили над MgSO 4. Вилучення розчинників давало сирий продукт, який очищали на колонці з силікагелем з елююванням МеОН-СН 2Сl2 (2:98), одержуючи 4-(4'N',N'-діетиламінокарбонілбензоїл)-N-трет-бутоксилкабонілпіперидин (сполуку 3) (3,15г, 28%): δн (400МГц, CDCl3) 1,08 (шир.с, 3Н), 1,23 (шир.с, 3Н), 1,43 (с, 9Н), 1,61 (м, 2Н), 1,80 (м, 2Н), 2,89 (м, 2Н), 3,20 (шир.с, 2Н), 3,40 (м, 1Н), 3,53 (шир.с, 2Н), 4,11 (шир.с, 2Н), 7,44 (д, J=8,0Гц, 2Н), 7,94 (д, J=8,0Гц, 2Н). (iiі) Одержання 4-(α-гідроксил-α(4-N-трет-бутоксилкарбонілпіперидиніл)-α-(1-нафтил)метил)-N,Nдіетилбензаміду (сполука 4) До розчину 1-бромнафталіну (0,52г, 2,5ммоль) в сухому ТГФ (10мл) додавали н-бутиллітій (1,1мл, 2,5М, 2,75ммоль) при -78°С. Через 30 хвилин краплями додавали 4-(4'-N',N'-діетиламінокарбонілбензоїл)-N-третбутоксилкарбонілпіперидин (сполуку 3) (776мг, 2,0ммоль) в ТГФ (2мл). Реакційну суміш нагрівали до кімнатної температури і потім гасили водним розчином NH4CI та екстрагували етилацетатом (2х50мл). Об'єднані органічні шари промивали сольовим розчином, сушили над MgSO4. Вилучення розчинників давало сирий продукт, який очищали на колонці з силікагелем з елююванням МеОН-СН2СІ2 (0,5:99,5→5:95), одержуючи 4-(αгідроксил-α-(4-N-трет-бутоксилкарбонілпіперидиніл)-α-(1-нафтил)метил)-Ν,Ν-діетилбензамід (сполуку 4) (760мг, 74%). Т. пл. 121-124°С (СН2Сl2); Νmax см -1 3402, 2960, 1685, 1626, 1425, 1283, 1160; Елементний аналіз. Розраховано для C32H40N2O4 0,50 H2О: С 73,11%; Η 7,86%; Ν 5,33%. Знайдено С 72,86%; Η 7,64%; Ν 5,26%; δH (400МГц, CDCl3) 1,03 (шир.с, 3Н), 1,16 (шир.с, 3Н), 1,18-1,35 (м, 3Н), 1,95 (м, 1Н), 2,60 (м, 2Н), 2,75 (шир.с, 2Н), 3,15 (шир.с, 2Н), 3,42 (шир.с, 2Н), 4,10 (шир.с, 2Н), 7,10-7,50 (м, 7Н), 7,75 (м, 3Н), 8,27 (шир.с, 1Н); δC-13 (100МГц, CDCl3) δ: 12,8, 14,1, 27,1, 27,2, 28,4, 39,2, 43,3, 45,4, 79,3, 80,4, 124,1, 124,9, 125,2, 125,3, 126,0, 127,3, 128,8, 129,2, 131,4, 135,0, 135,2, 139,4, 146,5, 154,6, 171,0. (iν) Одержання 4-(α-гідроксгт-α-(4-N-третбутоксилкарбонілпіперидиніл)-2,6-диметилбензил)-N,Nдіетилбензаміду (сполука 5) Одержували у спосіб, описаний для сполуки 4, за винятком використання 2-бром-м-ксилолу (749мг, 76%): Т. пл. 92-96°С (СН2Сl2); vmax (KBr) см -1 3451, 2970, 1690, 1631, 1425, 1165; Елементний аналіз. Розраховано для C30H42N2O 4·0,50 H2O: С 71,54%, Η 8,61%; Ν 5,56%. Знайдено: С 71,70%; Η 8,34%; Ν 5,62%. δH (400МГц, CDCl3) 1,10 (шир.с, 3Н), 1,21 (шир.с, 3Н), 1,32 (м, 2Н), 1,43 (с, 9Н), 1,69 (м, 1Н), 1,77 (м, 1Н), 2,32 (с, 6Н), 2,47 (с, 1Н), 2,75 (м, 3Н), 3,25 (шир.с, 2Н), 3,51 (шир.с, 2Н), 4,13 (шир.с, 2Н), 6,91 (м, 2Н), 7,00 (м, 1Н), 7,26 (д, J=8,4Гц, 2Н), 7,39 (д, J=8,4Гц, 2Н); δC-13 (100МГц, CDCl3) δ: 12,6, 14,0, 25,0, 27,7, 28,2, 39,1, 42,9, 43,1, 44,4, 53,3, 79,1, 83,0, 125,8, 126,3, 127,2, 131,2, 135,3, 136,7, 142,9, 147,8, 154,5, 170,7. Приклад 1 Одержання N,N-діетил-4-(фенілпіперидин-4-іліденметил) бензаміду (сполука 6) До розчину 4-(α-гідроксил-α-(4-N-трет-бутоксилкарбонілпіперидиніл)бензил)-Ν,N-діетилбензаміду (932мг, 2,0ммоль) в сухому дихлорметані (10мл) при кімнатній температурі додавали трифтороцтову кислоту (10,0мл). Реакційну суміш перемішували протягом 16 годин при кімнатній температурі та потім концентрували. Залишок розчиняли в AcOEt (100мл) . Одержаний розчин промивали 1 н розчином NaOH, водним розчином NH 4CI і сольовим розчином, сушили над MgSO4 . Вилучення розчинників давало сирий продукт, який очищали на колонці з силікагелем з елююванням МеОН-СН 2Сl2 (20:80), одержуючи (α-феніл-α-(4-Ν',Ν'-діетиламінокарбонілфеніл))-4-метиленпіперидин (сполука 6) (632мг, 91%): δH (400МГц, CDCl3) 1,08 (шир.с, 3Н), 1,17 (шир.с, 3Н), 2,29 (м, 4Н), 2,86 (м, 4Н), 2,94 (шир.с, 1Н), 3,24 (шир.с, 2Н), 3,47 (шир.с, 2Н), 7,09 (м, 4Н), 7,15 (м, 1Н), 7,24 (м, 4Н); δC-13 (100МГц, CDCl3) δ: 12,6, 14,1, 32,7, 32,8, 39,1; 43,2, 47,9,. 126,0, 126,4, 127,9, 129,6, 134,9, 135,4, 135,9, 141,7, 143,2, 171,1. Сіль HCl: т. пл. 110-120°С (AcOEt-простий ефір-СН 2Сl2); vmax (KBr) см -1 3440, 2970, 1617, 1438, 1289. Елементний аналіз. Розраховано для C23H28N2O·1,0 НСІ·0 ,50 СН2СІ2·0,25 Н2О: С 65,35%; Η 7,12%; Ν 6,49%. Знайдено: С 65,14%; Η 7,08%; Ν 6,55%. Приклад 2 Одержання Ν, Ν-діетил-4-(1-нафилпіперидин-4-іліденметил) бензаміду (сполука 7) Одержували у спосіб, описаний в прикладі 1, з використанням сполуки 4 (226мг, 71%): Т. пл. 80-85°С (МеОН-СН 2Сl2); vmax (KBr) см -1 3052, 2970, 1628, 1431, 1286. Елементний аналіз. Розраховано для C27H30N2O·0,20 СН2СІ2: С 78,62%; Η 7,37%; Ν 6,74%. Знайдено: С 78,63%; Η 7,07%; Ν 6,54%. δH (400МГц, CDCl3) 1,06 (шир.с, .Н), 1,16 (шир.с, 3Н), 2,00 (м, 2Н), 2,53 (м, 2Η), 2,64 (шир.с, ΝΗ), 2,77 (м, 2Н), 2,97 (м, 2Н), 3,20 (шир.с, 2Η), 3,47 (шир.с, 2Н), 7,26 (м, 5Н), 7,43 (м, 3Н), 7,74 (м, 2Н), 8,0(м, 1Н); δC-13 (100МГц, CDCl3) δ: 12,8, 14,1, 32,6, 33,5, 39,1, 43,2, 47,9, 48,2, 125,5, 125,7, 125,8, 126,1, 127,1, 127,2, 129,1, 131,9, 132,5, 133,8, 135,1, 138,3, 139,8, 142,6, 171,1. Приклад 3 Одержання N,N-діетил-4- (2,6-диметилфенілпіперидин-4-іліденметил)бензаміду (сполука 8) Одержували у спосіб, описаний в прикладі 1, з використанням сполуки 5 (242мг, 80%). Сіль НСl: розклад. ≥115°С (AcOEt-простий ефір-СН2Сl2); vmax (KBr) см -1 2970, 2725, 1590, 1464, 1290, 1101; Елементний аналіз. Розраховано для C25H32N2O·1,0 НСl·0,50 СН2СІ2·0,25 Н2О: С 65,94%; Η 7,60%; Ν 6,03%. Знайдено: С 65,98%; Η 7,37%; Ν 5,81%. Приклад 4 Одержання-N,Ν-діетил-4-(1-нафтил-N-алілпіперидин-4-іліденметил)бензаміду (сполука 9) Суміш (α-(1-нафтил)-α-(4-Ν',Ν'-діетиламінокарбонілфеніл))-4-метиленпіперидину (сполука 7) (125мг), алілброміду (90мг) і K2СО3 (138мг) в MeCN (10мл) перемішували протягом 14 годин при кімнатній температурі та потім гасили 1н розчином NH4OH, екстрагували AcOEt (100мл). Органічну фазу промивали водним розчином NH4CI і сольовим розчином, сушили над MgSO4. Вилучення розчинників давало сирий продукт, який очищали на колонці з силікагелем з елююванням МеОН-СН 2Сl2 (2:98), одержуючи (α-(1-нафтил)-α-(4-Ν',Ν'діетиламінокарбонілфеніл))-4-метилен-N-алілпіперидин (50мг, 36%): δH (400МГц, CDCl3) 1,08 (шир.с, 3Н), 1,19 (шир.с, 3Н), 2,08 (м, 2Н), 2,39 (м, 2Н), 2,61 (м, 4Н), 3,01 (м, 2Н), 3,24 (шир.с, 2Н), 3,52 (шир.с, 2Н), 5,13 (м, 2Н), 5,90 (м, 1Н), 7,27 (м, 5Н), 7,45 (м, 3Н), 7,80 (м, 2Н), 8,04 (м, 1Н); δC-13 (100МГц, CDCl3) δ: 12,8, 14,1, 30,9, 32,0, 39,1, 43,2, 54,7, 54,9, 61,5, 117,8, 125,4, 125,6, 125,8, 126,0, 127,1, 128,2, 129,1, 131,8, 132,4, 133,7, 135,0, 138,0, 139,8, 142,6, 171,1. Сіль НСl: т. пл. 110-120°С (AcOEt-простий ефір-СН 2Сl2); vmax (KBr) см -1 3416, 2961, 1620, 1430, 1288; Елементний аналіз. Розраховано для C30H34N2O·1,0 НСl·0,50 СН2Сl2·0,25 Н2О: С 70,17%; Η 7,05%; Ν 5,37%. Знайдено: С 70,15%; Η 6,92%; Ν 5,24%. Приклад 5 Одержання N,N-диетил-4-(феніл-N-бензилпіперидин-4-іліденметил)бензаміду (сполука 10) Одержували у спосіб, описаний в прикладі 4, з використанням сполуки 6 та бензилброміду (215мг, 98%): δH (400МГц, СDСІ3) 1,09 (шир.с, 3Н), 1,19 (шир.с, 3Н), 2,37 (м, 4Н), 2,47 (м, 4Н), 3,25 (шир.с, 2Н), 3,50 (шир.с, 4Н), 7,0-7,30 (м, 14Н); δC-13 (100МГц, CDCl3) δ: 12,7, 14,0, 31,6, 39,1, 43,1, 54,9, 55,0, 62,8, 125,9, 126,2, 126,8, 127.8, 128,0, 128,9, 129,6, 129,7, 134,9, 135,0, 136,3, 138,2, 141.9, 143,3, 171,0. Сіль НСl: т. пл. 230-245°С (AcOEt-простий ефір-СН 2Сl2); vmax (KBr) см -1 3423, 2976, 1624, 1434, 1288; Елементний аналіз. Розраховано для C30H34N2O·1,0 НСl·0,25 СН2Сl2·0,25 Н2О: С 72,55%; Η 7,25%; Ν 5,59%. Знайдено: С 72,38%; Η 7,16%; Ν 5,50%. Приклад 6 Одержання N,Nдиетил-4-(N-2,3-епоксипропілфенілпіперидин-4-іліденметил)бензаміду (сполука 11) Одержували у спосіб, описаний в прикладі 4, з використанням сполуки 6 і епібромгідрину (102мг, 84%) δH (400МГц, CDCl3) 1,10 (шир.с, 3Н), 1,20 (шир.с, 3Н), 2,28 (м, 1Н), 2,39 (м, 4Н), 2,45 (м, 1Н), 2,54 (м, 2Н), 2,61 (м, 2Н), 2,74 (м, 2Н), 3,09 (м, 1Н), 3,26 (шир.с, 2Н), 3,50 (шир.с, 2Н), 7,10 (м, 4Н), 7,15 (м, 1Н), 7,25 (м, 4Н); δC-13 (100МГц, CDCl3) δ: 12,8, 14,1, 31,4, 39,1, 43,2, 44,9, 50,1, 55,5, 60,8, 126,0, 126,4, 127,9, 129,6, 129,7, 135,0, 135,3, 135,7, 141,8, 143,2, 171,1. Приклад 7 Одержання N,N-діетил-4-(1-циклопропілметилфенілпіперидин-4-іліденметил)бензаміду (сполука 12) Одержували у спосіб, описаний в прикладі 4, з використанням сполуки 6 і циклопропілметилхлориду (104мг, 86%). δH (400МГц, CDCl3) 0,20 (м, 2Н), 0,59 (м, 2Н), 1,04 (м, 1Н), 1,14 (шир.с, 3Н), 1,24 (шир.с, 3Н), 2,48 (д, J=6,4 Гц, 2Н), 2,56 (шир.с, 4Н), 2,80 (шир.с, 4Н), 3,29 (шир.с, 2Н), 3,53 (шир.с, 2Н), 7,14 (м, 4Н), 7,22 (м, 1Н), 7,27 (м, 4Н); δC-13 (100МГц, CDCl3) δ: 4,18, 7,3, 12,8, 14,1, 30,3, 39,2, 43,2, 54,3, 62,7, 126,2, 126,6, 128,0, 129,5, 129,6, 134,1, 135,3, 136,3, 141,5, 142,9, 171,0. Сіль НСl: розклад. ≥100°С (AcOEt-простий ефір-СН2СІ2); vmax (KBr) см -1 3027, 2359, 1620, 1439, 958; Елементний аналіз. Розраховано для C27H34N2O·1,0 НСl·0,50 СН2Сl2·0,75 Н2О: С 66,73%; Η 7,64%; Ν 5,66%. Знайдено: С 66,60%; Η 7,45%; Ν 5,78%. В) Схема синтезу сполуки прикладу 8 Сполуку прикладу 8 одержували, використовуючи наведену далі методику, показану на поданій нижче схемі 2. (і) Одержання 4-(2-бензофуроїл)-N-трет-бупюксикарбонілпіпери-дину (сполука 13) До розчину 2,3-бензофурану (295мг, 2,5ммоль) в сухому ТГФ (10мл) при -78°С додавали трет-бутиллітій (1,5мл, 1,7М, 2,5ммоль). Через 30 хвилин краплями додавали N-трет-бутоксилкарбоніл-N-метил-Nметоксилізоніпекотамід (544мг, 2,0ммоль) в ТГФ (2мл), реакційну суміш нагрівали до кімнатної температури і потім гасили водним розчином NH4Cl та екстрагували етилацетатом (2x50мл). Об'єднані органічні шари промивали сольовим розчином, сушили над MgSO4. Вилучення розчинників давало сирий продукт, який очищали на колонці з силікагелем з елююванням МеОН-СН 2СІ2 (5:95), одержуючи 4-(2-бензофуроїл)-N-третбутоксилкарбонілпіперидин (13) (456мг, 69%): δH (400МГц, CDCl3) 1,46 (с, 9Н), 1,75 (м, 2Н), 1,91 (м, 2Н), 2,91 (м, 2Н), 3,37 (м, 1Н), 4,20 (шир.с, 2Н), 7,29 (м, 1Н), 7,46 (м, 1Н), 7,53 (с, 1Н), 7,56 (м, 1Н), 7,69 (м, 1Н); δC-13(100МГц, CDCl3) δ: 27,8, 28,3, 43,1, 44,4, 79,5, 112,3, 112,9, 123,1, 123,8, 126,9, 128,2, 151,8, 154,5, 155,5, 192,8. (ii) Одержання 4-(α-гідрокси-α(4-N-трет-бутоксилкарбонілпіперидиніл)-2-бензофурил)-N,N,-діетилбензаміду (сполука 14) Одержували у спосіб, описаний в прикладі 4, з використанням 4-йод-N,N,-діетилбензаміду (425мг, 61%) : Т. пл. 102-106°С (СН2Сl2); vmax (KBr) см -1 3362, 2970, 1690, 1617, 1425, 1288, 1160; δH (400МГц, CDCl3) 1,06 (шир.с, 3Н), 1,20 (шир.с, 3Н), 1,24 (м, 2Н), 1,46 (м, 11Н), 2,42 (м, 1Н), 2,58 (шир.с, 2Н), 3,20 (шир.с, 2Н), 3,50 (шир.с, 2Н), 4,05 (шир.с, 2Н), 4,37 (с, 1Н), 6,70 (с, 1Н), 7,16 (м, 2Н), 7,23 (д, J=8,0Гц, 2Н), 7,41 (д, J=7,6Гц, 1Н), 7,47 (д, J=7,6Гц, 1Н), 7,58 (д, J=8,0Гц, 2Н); δC-13 (100МГц, CDCl3) δ: 12,6, 13,9, 25,5, 26,3, 28,2, 39,0, 43,1, 44,9, 77,3, 79,0, 103,3, 110,9, 120,6, 122,5, 123,5, 125,6, 125,8, 127,9, 135,3, 144,0, 154,4, 154,5, 160,5, 170,9. Приклад 8 Одержання N,N-дiетил-4-(2-бензофурилпіперидин-4-іліденметил)бензаміду (сполука 15) Одержували у спосіб, описаний в прикладі 1, з використанням сполуки 14 (135мг, 88%): δH (400МГц, CDCl3) 1,20 (шир.с, 3Н), 1,24 (шир.с, 3Н), 2,36 (шир.с, 2Н), 3,00 (шир.с, 4Н), 3,15 (шир.с, 2Н), 3,33 (шир.с, 2Н), 3,56 (шир.с, 2Н), 4,45 (шир.с, 1Н), 6,25 (с, 1Н), 7,24 (м, 4Н), 7,41 (м, 4Н); δC-13 (100МГц, CDCl3) δ: 12,9, 14,2, 29,6, 32,0, 32,4, 39,3, 43,4, 47,2, 107,4, 111,0, 120,7, 122,7, 124,2, 126,0, 126,5, 128,2, 129,9, 136,1, 139,5, 140,5, 154,4, 156,2, 171,0. Сіль НСl: розклад. ≥120°С (AcOEt-простий ефір-СН2СІ2); Vmax (KBr) см -1 2977, 2801, 1586, 1449, 1257. С) Схема синтезу сполук прикладів 9-10 Сполуки прикладів 9 і 10 одержували, використовуючи методику, подану на схемі 3. (і) Одержання 4-(4-фторбєнзогл)-N-трет-бутоксикарбонілпіперидину (сполука 18) Суміш гідрохлориду 4-(4-фторбензоїл)піперидину (сполука 16) (2,44г, 10,0ммоль), ди-третбутилдикарбонату (2,18г, 10,0ммоль) і Na2CO3 (1,59г, 15ммоль) в Н2О-ТГФ (50/5мл) кип'ятили із зворотним холодильником протягом 1 години. Реакційну суміш екстрагували етилацетатом (2x100мл). Об'єднані органічні шари промивали сольовим розчином, сушили над MgSO4. Вилучення розчинників давало 4-(4-фторбензоїл)-Nтрет-бутоксил-карбонілпіперидин (ОВ 701-31, 2,28г, 74%); Т. пл. 80-83°С (СН2Сl2); vmax (KBr) см -1 2980, 2842, 1680, 1587, 1416, 1160; δH (400МГц, CDCl3) 1,44 (с, 9Н), 1,69 (м, 2Н), 1,79 (м, 2Н), 2,87 (м, 2Н), 3,34 (м, 1Н), 4,13 (шир.с, 2Н), 7,12 (м, 2Н), 7,95 (м, 2Н); δC-13 (100МГц, CDCl3) 5: 27,4, 28,4, 43,2, 43,4, 79,6, 115,8, 115,9, 130,8, 130,9, 132,2, 154,6, 164,4, 166,9, 200,4. (іі) Одержання 4-(4-хлорбензоїл)-N-трет-бутоксилкарбонілпіперидину (сполука 19) Одержували у спосіб, описаний для сполуки 18, з використанням сполуки 17 (1,23г, 85%): Т. пл. 122-125°С (СН2Сl2); vmax (KBr) см -1 2970, 2842, 1680, 1582, 1420, 1200; δH (400МГц, CDCl3) 1,47 (с, 9Н), 1,69 (м, 2Н), 1,81 (м, 2Н), 2,90 (м, 2Н), 3,36 (м, 1Н), 4,18 (шир.с, 2Н), 7,44 (м, 2Н), 7,88 (м, 2Н); δC-13 (100МГц, CDCl3) δ: 28,3; 28,4; 43,2; 43,4; 79,6; 129,0; 129,6; 134,1; 139,4; 154,6; 200,7. (iiі) Одержання 4-(α-гідрокси-α-(4-N-трет-бутоксилкарбонілпіперидиніл)-4-фторбензил)-N,Nдіетилбензаміду (сполука 20) Одержували у спосіб, описаний для сполуки 4, з використанням сполуки 18 та 4-йод-N,N-діетилбензаміду (454мг, 47%): Т. пл. 84-86°С (СН2Сl2); vmax (KBr) см -1 3421, 2970, 1685, 1612, 1430, 1288, 1165; δH (400МГц, CDCl3) 1,13 (шир.с, 3Н), 1,23 (шир.с, 3Н), 1,32 (м, 4Н), 1,44 (с, 9Н), 2,48 (м, 1Н), 2,68 (шир.с, 2Н), 3,26 (шир.с, 2Н), 3,54 (шир.с, 2Н), 3,57 (с, 1Н), 4,11 (шир.с, 2Н), 6,96 (м, 2Н), 7,27 (д, J=8,0Гц, 2Н), 7,44 (м, 2Н), 7,47 (д, J=8,0Гц, 2Н); δC-13 (100МГц, CDCl3) δ: 12,9; 14,0; 26,2; 28,2; 39,1; 43,2; 43,6; 44,3; 78,9; 79,1; 114,5; 114,7; 125,7; 126,1; 127,5; 127,6; 135,0; 141,2; 146,9; 154,5; 160,0; 162,5; 170,9. (iν) Одержання 4-(α-гідрокси-α-(4-N-трет-бутоксилкарбонілпіперидиніл)-4-хлорбензил)-N,Nдіетилбензаміду (сполука 21) Одержували у спосіб, описаний для сполуки 4, з використанням сполуки 19 та 4-йод-N,N-діетилбензаміду (626мг, 63%): Т. пл. 100-105°С (СН2Сl2); Vmax (KBr) см -1 3411, 2970, 1685, 1617, 1425, 1288, 1165, 1092; δH (400МГц, CDCl3) 1,08 (шир.с, 3Н), 1,20 (шир.с, 3Н), 1,33 (м, 4Н), 1,41 (с, 9Н), 2,44 (м, 1Н), 2,63 (шир.с, 2Н), 3,22 (шир.с, 2Н), 3,49 (шир.с, 2Н), 3,99 (с, 1Н), 4,05 (м, 2Н), 7,20 (м, 4Н), 7,39 (д, J=8,0Гц, 2Н), 7,44 (д, J=8,0Гц, 2Н); δC-13 (100МГц, CDCl3) δ: 12,5; 13,9; 25,9; 28,1; 39,0; 43,0; 44,1; 78,7; 79,0; 125,6; 126,0; 127,2; 127,8; 131,9; 134,8; 144,1; 146,6; 154,3; 170,7. Приклад 9 Одержання N,N-діетил-4-(4-фторфенілпіперидин-4-іліденметил)бензаміду (сполука 22) Одержували у спосіб, описаний в прикладі 1 (сполука 6), з використанням сполуки 20. 1 Н ЯМР (400МГц, CDCl3) δ 1,12 (3Н, шир.м, СН3СН2-), 1,24 (3Н, шир.м, СН3СН2-), 2,32 (4Н, м, піперидинСН-) , 2,54 (1Н, шир. м, ΝΗ) , 2,91 (4Н, м, піперидин-СН-), 3,27 (2Н, шир.м, CH2N-), 3,52 (2Н, шир.м, CH2N-) , 7,00 (2Н, м, АrН) , 7,09 (2Н, м, ArH), 7,11 (2Η, д, J=8,0Гц, ArH), 7,29 (2Н, д, J=8,0Гц, АrН). Приклад 10 Одержання N,N-діетил-4-(4-хлорфенілпіперидин-4-іліденметил)бензаміду (сполука 23) Одержували у спосіб, описаний в прикладі 1 (сполука 6), з використанням сполуки 21. 1 Н ЯМР (400МГц, CDCl3) δ 1,13 (3Н, шир.м, СН3СН2-), 1,22 (3Н, шир.м, СН3СН2-), 2,02 (1Н, шир.м, ΝΗ) , 2,30 (4Н, м, піперидин-СН-), 2,90 (4Н, м, піперидин-СН-), 3,28 (2Н, шир.м, CH2N-), 3,53 (2Н, шир.м, CH2N-), 7,04 (2Н, д, J=8,0Гц, ArH), 7,11 (2Н, д, J=8,0Гц, ArH), 7,25 (2H, д, J=8,0Гц, ArH), 7,30 (2Н, д, J=8,0Гц, ArH). Сіль НСl: т. пл. 115-120°С (Н2О-СН2СІ2); 14 (КВr) 3337, 2973, 1618, 1431, 1290, 1092 см -1. Елементний аналіз. Розраховано для C23H27CIN2O·1 ,0 НСl·1,20 Н2O: С 62,64%; Η 6,959б; N 6,35%. Знайдено: С 62,53%; Η 6,91%; Ν 6,30%. D) Схема синтезу сполуки прикладу 11 Приклад 11 Одержання N,N-дiетил-4-(феніл-N-алілпіперидин-4-іліденметил)бензаміду (сполука 25) 4-(α-гідрокси-α-(4-N-алілпіперидиніл)бензил)-Ν,Ν-діетил-бензамід (сполука 24) (81мг) розчиняли в СН 2СІ2 (10мл) і обробляли тіонілхлоридом (2мл) при кімнатній температурі. Реакційну суміш кип'ятили із зворотним холодильником протягом 2 годин і потім концентрували. Залишок розчиняли в етилацетаті (50мл) і одержаний розчин промивали NH4OH (1н), водним розчином NH4CI і сольовим розчином, сушили над MgSO4 . Вилучення розчинників давало сирий продукт, який очищали на колонці з силікагелем з елююванням МеОН-СН 2Сl2 (1:99→5:95), одержуючи (α-феніл-α-(4-Ν',Ν'-діетиламінокарбонілфеніл))-4-метилен-N-алілпіперидин (сполука 25, приклад 11) (32мг, 40%): δH (400МГц, CDCl3) 1,12 (шир.с, 3Н), 1,21 (шир.с, 3Н), 2,43 (м, 4Н), 2,55 (м, 4Н), 3,08 (д, J=6,8Гц, 2Н) , 3,25 (шир.с, 2Н), 3,53 (шир.с, 2Н), 5,18 (м, 2Н), 5,86 (м, 1Н), 7,12 (м, 4Н), 7,20 (м, 1Н), 7,27 (м, 4Н). Сіль НСl: т. пл. 85-95°С (AcOEt-CH 2Cl2); vmax (KBr) см -1 3491, 2971, 1624, 1428, 1289, 1096; Елементний аналіз. Розраховано для C26H32N2O·НСl·0,25 Н2O·0,25 СН2Сl2: С 69,95%; Η 7,60%; Ν 6,21%. Знайдено: С 70,00%; Η 7,73%; Ν 6,07%. Приклад 12 Одержання N,N-дiетил-4-(4-хлорфеніл-N-бензилпіперидин-4-іліденметил)бензаміду (сполука 26) Ν,N-дiетил-4-(4-хлорфеніл-N-бензилпіперидин-4-іліденметил)бензамід (110мг, 93%) одержували у спосіб, описаний в прикладі 4, з використанням сполуки 23 (96мг) і бензилброміду (43мг): 1 Н ЯМР (400МГц, CDCl3) δ 1,13 (3Н, шир.м, СН3СН2-), 1,23 (3Н, шир.м, СН3СН2-), 2,37 (4Н, м, піперидинСН-), 2,49 (4Н, м, піперидин-СН-), 3,28 (2Н, шир.м, CH3CH2N-), 3,53 (4Н, шир.м, PhCH2N і CH3CH2N-), 7,04 (2H, д, J=8,0Гц, ArH), 7,11 (2Н, д, J=8,0Гц, АrН), 7,25 (2Н, д, J=8,0Гц, АrН), 7,29 (7Н, м, АrН). Сіль (СНОНСО2Н)2: т. пл. 100-110°С (МеОН); 14 (КВr) 3368, 2977, 1728, 1603, 1433, 1290, 1087 см-1; Елементний аналіз. Розраховано для С 34Н33СlN2О7·1,50 Н2О: С 62,81%; Η 6,51%; N 4,31%. Знайдено: С 62,85%; Η 6,17%; Ν 4,21%. Приклад 13 Одержання N,N-дiетил-4-[(N-3-метил-2-бутеніл)фенілпіперидин-4-іліденметил]бензаміду (сполука 27) Одержували у спосіб, описаний в прикладі 4, з використанням 1-бром-3-метил-2-буτєну в якості алкілуючого реагенту. ІЧ (NaCl, плівка): сіль НСl v=3432, 2976, 1623, 1434 см -1. 1 H ЯМР: (основа) (CDCl3, ТМС) δ 1,10-1,30 (6Н, шир. OCNCH2CH3), 1,64 (3Н, с, =ССН 3), 1,73 (3Н, с, = ССН3), 2,40 (4Н, м, NCH2CH2), 2,52 (4Н, м, =ССН2), 3,0 (2Н, д, J=7,6 Гц, NCH2CH=C), 3,20-3,60 (4H, шир. OCNCH2CH3), 5,28 (1Η, м, NCH2CH=C), 7,16-7,45 (9Н, м, Аr) м.ч. Елементний аналіз. Розраховано для C28H36N2O·1,8 НСl: С 69,74%; Η 7,90%; Ν 5,81%. Знайдено: С 69,71%; Η 7,48%; Ν 5,58%. Приклад 14 Одержання N,N-дiетил-4-[ (1-циклогексилпіперидин-4-іліден) фенілметил]бензаміду (сполука 28) Суміш сполуки 6 (100мг, 0,29ммоль), циклогексанону (36мкл, 0,35ммоль) та Ті(ОРr-і)4 (0,17мл, 0,58ммоль) обробляли ультразвуком протягом 1 години і потім перемішували при кімнатній температурі протягом ночі в атмосфері азоту. С уміш розбавляли етанолом (5мл) і потім додавали NaBH4 (33мг, 87ммоль). Одержану суміш перемішували протягом 12 годин при кімнатній температурі. Для гасіння реакційної суміші додавали 2н NH3·Н2О, та суміш фільтрували крізь целіт. Фільтрат екстрагували кілька разів етилацетатом та об'єднані органічні фази промивали водою і сольовим розчином й сушили над Na2SO4. Концентрування у вакуумі і очищення MPLC (силікагель 60, елюювання сумішшю EtOAc:гептан, від 0:100 до 100:0) давали зазначену в заголовку сполуку (24мг, 20%). Т.пл. (сіль НСl): 105-109°С. ІЧ (сіль НСl, плівка) ν 3394 (ΝΗ), 1620 (CONEt2) см -1. 1 H ЯМР (вільний амін, 400МГц, CDCl3) δ 1,00-1,25 (17Н, м, NCHCH2CH2CH2CH2CH2, 2xСН3 та СН(СН)С=С), 1,60 (1Н, м, СН(СН)С=С), 1,75 (1Н, м, СН(СН)С=С), 1,80 (1Н, м, СН(СН)С=С), 2,30 (3Н, м, NCH2 і NCH) , 2,60 (2Н, м, NCH 2) , 3,20 (2Н, шир.с, NCH2CH3), 3,50 (2Н, шир.с, NCH 2CH3) , 7,00-7,30 (9Н, м, Аr). 13 С ЯМР (вільний амін, 100МГц, CDCl3) δ: 12,7; 14,1; 25,9; 28,7; 32,0; 39,1; 43,2; 50,7; 50,8; 63,6; 126,0; 126,3; 127,9; 129,7; 129,8; 134,7; 134,9; 136,9; 142,0; 143,4; 171,2. Елементний аналіз. Розраховано для C29H40N2OCI 2: С 69,17%; Η 8,01%; Ν 5,56%. Знайдено: С 69,17%; Η 7,82%; Ν 5,18%. Приклад 15 Одержання N,N-діетил-4-[(N-бутил)фенілпіперидин-4-іліденметил]бензаміду (сполука 29) Одержували у спосіб, описаний в прикладі 4, з використанням 1-йодбутану в якості алкілуючого реагенту. ІЧ (NaCl, плівка): (сіль НСl) v=3430, 2967, 2499, 1622, 1433 см-1. 1 H ЯМР (CDCl3, ТМС) δ 0,92 (3Н, τ, J=7,2Гц, СН2СН3), 1,10-1,26 (6Η, шир. OCNCH2CH3), 1,32 (2Η, м, СН2СН3), 1,53 (2Н, м, СН2СН2СН2), 2,42 (6Н, м, NCH2), 2,55 (4Н, м, =ССН2), 3,20-3,60 (4Н, шир. OCNCH2CH3), 7,10-7,31 (9Н, м, Аr) м.ч. Елементний аналіз. Розраховано для C27H36N2O·НСl·0,4 СН2Сl2·0,4 Н2О-: С 68,24%; Η 8,07%; Ν 5,81%. Знайдено: С 68,24%; Η 8,12%; Ν 5,89%. Приклад 16 Одержання N,N-діeфил-4-[(N-4-метоксибензил)фенілпіперидин-4-іліденметил]бензаміду (сполука 30) Сполуку заголовку (160мг, 68%) одержували у спосіб, описаний в прикладі 4, з використанням сполуки 6 (174мг) і 4-метоксибензилхлориду (78мг): 1 Н ЯМР (400МГц, CDCl3) δ 1,11 (3Н, шир. CH3CH2N-), 1,20 (3Н, шир. СН3СН2-), 2,38 (4Н, м, ССН2С), 2,46 (4Н, м, NCH2-), 3,26 (2Н, м, NCH2-), 3,47 (2Н, с, CH2N-), 3,49 (2Н, шир. CH3CH2N-), 3,77 (ЗН, С, ОСН3), 6,83 (2Н, д, J=8,0 Гц, АrН), 7,05-7,30 (11Н, м, АrН). Сіль НСl: т. пл. 100-110°С (СН2Сl2); ІЧ (КВr) 3425, 2974, 1618, 1515, 1434, 1255 см -1. Елементний аналіз. Розраховано для С 31Н36N2О2 ·1,0 НСl·0,35 СН2Сl2: С 70,41%; Η 7,11%; Ν 5,24%. Знайдено: С 70,46%; Η 7,10%; Ν 5,21%. Приклад 17 Одержання N,N-дiетил-4-[(N-2,4-дихлорбензил) фенілпіперидин-4-іліденметил]бензаміду (сполука 31) Сполуку заголовку (206мг, 81%) одержували у спосіб, описаний в прикладі 4, з використанням сполуки 6 (174мг) і а,2, 4-трихлортолуолу (98мг): 1 Н ЯМР (400МГц, CDCl3) δ 1,12 (3Н, шир. CH3CH2N-), 1,21 (3Н, шир. CH3CH2N-), 2,39 (4Н, м, ССН2С), 2,52 (4Н, м, NCH 2-), 3,28 (2Н, м, NCH2-), 3,53 (2Н, шир., CH3CH2N-), 3,57 (2Н, м, NCH 2-), 7,05-7,48 (12Н, м, АrН). Сіль НСl: т. пл. 95-110°С (СН2СІ2); ІЧ (КВr) 3408, 2976, 1620, 1472, 1436, 1288, 1101 см-1. Елементний аналіз. Розраховано для C30H32N2OCI2 ·1,0 НСl·0,30 СН2Сl2: С 63,91%; Η 5,95%; Ν 4,92%. Знайдено: С 63,81%; Η 6,03%; Ν 4,84%. Приклад 18 Одержання Ν,N-діетил-4-[(1-метилпіперидин-4-іліден)фенілметил]бенааміду (сполука 32) N,N-дiетил-4-[(піперидин-4-іліден)фенілметил]бензамід (0,34г, 1,0ммоль) розчиняли в ацетонітрилі (5мл) . При 25°C з перемішуванням додавали карбонат калію (0,14г, 1,0ммоль) та метилйодид (63мкл, 1,0ммоль). Через 30 хвилин реакційну суміш випарювали і вводили в колонку з силікагелем для очищення хроматографією з використанням від 0 до 10% МеОН (10% ΝΗ4ΟΗ) в СН2Сl2, одержуючи 48мг кінцевого продукту (28% перетворення вихідного матеріалу), який перетворювали на гідрохлоридну сіль обробкою НСl в простому ефірі. Т. пл. 110°С (розклад.). ІЧ (КВr) (см -1) : 2361, 1695, 1487, 1289. МС (вільний амін): 362, 318, 219, 189, 165, 144. 1 H ЯМР (амін, CDCl3): δ 1,1 (м, 6Н, амід-Ме), 2,40 (с, 3Н, MeN), 2,49, 2,60 (2м, 8Н, піперазин-Н), 3,40 (м, 4Н, амід-СН2), 7,08-7,34 (м, 9Н, АrН). Елементний аналіз. Розраховано для C24H30N2Ox0,1 H2Оx3,1 НСl: С 60,39%; Η 7,03%; Ν 5,87%. Знайдено: С 60,43%; Η 6,84%; Ν 5,45%. Приклад 19 Одержання N,N-діетил-4-[(N-трет-бутоксикарбонілпіперидин-4-іл)-8-хінолінілгідроксиметил]бензаміду (сполука 33) (До розчину 4-йод-N,N-дiетилбензамiду (1,52г, 5,0ммоль) і 8-бромхіноліну (1,0г) в сухому ТГФ (30мл) додавали при -78°С н-бутиллітій (7,0мл, 2,5М, 17,5ммоль). Через 10 хвилин краплями додавали N-третбутоксилкарбонілетилізоніпекотат (2) (0,77г, 3,0ммоль) в ТГФ (5мл). Реакційну суміш нагрівали до 0°С і потім гасили водним розчином NH 4CI та екстрагували ацетатом. (2x100мл). Об'єднані органічні шари промивали сольовим розчином, сушили над MgSO4 . Вилучення розчинників давало сирий продукт, який очищали на колонці з силікагелем з елююванням МеОН-СН 2Сl2 (2:98), одержуючи MTL 0599 (145мг, 9%): Т. пл. 100-105°С; ІЧ (NaCl) 2971, 1686, 1625, 1426, 1167 см-1. Елементний аналіз. Розраховано для C31H39N3O 4·0,20 Н2O: С 71,43%; Η 7,62%. Знайдено: С 71,50%; Η 7,75%. 1 Н ЯМР (400МГц, CDCl3) δ=1,07 (3Н, шир. СН3СН2-), 1,19 (3Н, шир. CH3CH2N-), 1,24 (1Н, м, піперидин-СН-), 1,43 (9Н, с, СНзС), 1,65 (1Н, м, піперидин-СН-), 1,89 (2Н, м, піперидин-СН-), 2,52 (1Н, м, піперидин-СН-), 2,64 (1Н, шир. піперидин-СН-), 2,78 (1Н, шир. піперидин-СН-), 3,22 (2Н, шир. СН3СН2-), 3,49 (2Н, шир, CH3CH2N-), 4,16 (2Н, шир. піперидин-СН-), 7,24 (2Н, д, J=8,0Гц, ArH), 7,35 (1Н, дд, J=8,0, 4,4Гц, АrН) , 7,55 (2Н, д, J=8,0Гц, ArH), 7,58 (1Н, д, J=8,0Гц, АrН), 7,71 (1H, д, J=8,0Гц, ArH), 7,80 (1H, д, J=8,0Гц, ArH), 8,14 (1H, д, J=8,0Гц, ArH), 8,69 (1H, м, ArH), 9,80 (1H, с, ОН). Приклад 20 Одержання N,N-дiетил-4-(8-хінолінілпіперидин-4-іліденметил)бензаміду (сполука 34) Суміш сполуки прикладу 19 (45мг), трифтороцтової кислоти (1,0мл) і трифторметансульфонової кислоти (1мл) кип'ятили із зворотним холодильником протягом 8 годин і потім концентрували. Залишок розчиняли в AcOEt (50мл). Одержаний розчин промивали 1н розчином NaOH, водним розчином NH4CI та сольовим розчином, сушили над MgSO4 . Вилучення розчинників давало сирий продукт, який очищали на колонці з силікагелем з елююванням NH4OH (1н)-МеОН-СН2Сl2 (2,5:17,5:80), одержуючи N,N-дiетил-4-(8хінолінілпіперидин-4-іліденметил)бензамід (29мг, 84%): 1 Н ЯМР (400МГц, CDCl3) δ=1,07 (3Н, шир. м, СН3СН2-), 1,20 (3Н, шир.м, СН3СH2-), 2,00 (2Н, м, піперидинСН-), 2,46 (1Н, с, ΝΗ), 2,52 (2Н, м, піперидин-СН-), 2,75 (1Н, м, піперидин-СН-), 2,92 (2Н, м, піперидин-СН-), 3,05 (1Н, м, піперидин-СН-), 3,22 (2Н, м, CH2N-), 3,49 (2Н, м, CH2N-), 7,23 (2Н, м, АrН), 7,32 (2Н, м, АrН), 7,36 (1Н, м, АrН), 7,49 (2Н, м, АrН), 7,72 (1Н, дд, J=6 ,4, 3,2Гц, АrН), 8,11 (1Н, дд, J=8,4, 1,6 Гц, АrН), 8,91 (1Н, дд, J=4,0, 1,6Гц, АrН). Сіль НСl: т. пл. >170°С (розклад.); ІЧ (КВr) 3410, 2973, 1614, 1551, 1436, 1284 см -1. Елементний аналіз. Розраховано для С 26Н29N3О·2,0 НСІ·0,50 СН2Сl2·0,75 Н2O: С 60,23%; Η 6,39%. Знайдено: С 60,27%; Η 6,42%. Приклад 21 Одержання N,N-δ1Я-дiетил-4-[(N-трет-бутокcикарбонілпіперидин-4-іл)-3метоксифенілгідроксиметил]бензаміду (сполука 35) Одержували у спосіб прикладу 19 з використанням 3-броманізолу, що давало названу в заголовку сполуку (226мг, 23%): Т. пл. 95-103°С; ІЧ (NaCl) 3422, 2973, 1684, 1614, 1429, 1289 см -1. Елементний аналіз. Розраховано для C29H40N2O 5·0,60 H2О: С 68,64%; Η 8,18%; Ν 5,52%. Знайдено: С 68,66%; Η 7,98%; Ν 5,64%; 1 Η ЯМР (400МГц, CDCl3) δ=1,07 (3Η, шир. CH3CH2N-), 1,19 (3Н, шир. CH3CH2N-), 1,31 (4Н, м, піперидинСН-) , 1,41 (9Н, с, СН3С), 2,46 (1Н, м, піперидин-СН-), 2,64 (2Н, шир. піперидин-СН-), 3,22 (2Н, шир. CH3CH2N-), 3,49 (2Н, шир. СН3СН2-), 3,65 (1Н, с, ОН), 3,72 (3Н, с, ОСН3), 4,06 (2Н, шир. піперидин-СН-), 6,69 (1Н, м, АrН), 7,01 (1Н, д, J=7,6Гц, ArH), 7,08 (1Н, с, ArH), 7,17 (1Н, д, J=8,0Гц, АrН), 7,21 (2Н, д, J=8,0Гц, АrН), 7,48 (2Н, д, J=8,0Гц, АrН) Приклад 22 Одержання N,N-діетил-4-(3-метоксифенілпіперидин-4-іліденметил)бензаміду (сполука 36) Одержували у спосіб, описаний в прикладі 1, з використанням сполуки 21 (100мг), що давало N,N-діетил4-(3-метоксифенілпіперидин-4-іліденметил)бензамід (75мг, 98%): 1 Н ЯМР (400МГц, CDCl3) δ 1,12 (3Н, шир. CH3CH2N-), 1,23 (3Н, шир. CH3CH2N-), 2,34 (4Н, м, піперидин-СН), 2,91 (4Н, шир. піперидин-СН-), 3,17 (1Н, с, ΝΗ), 3,27 (2Н, шир. CH3CH2N-), 3,52 (2Н, шир. CH3CH2N-), 3,76 (3Н, с, OСН3), 6,64 (1Н, с, АrН), 6,70 (1Н, д, J=8,0Гц, АrН), 6,76 (1Н, д, J=7,6Гц, АrН), 7,15 (2Н, д, J=8,0Гц, АrН), 7,22 (1Н, м, АrН), 7,29 (2Н, д, J=8,0Гц, АrН). Сіль НСl: т. пл. >90°С (розклад.); ІЧ (NaCl) 2970, 1621, 1430, 1287 см -1. Елементний аналіз. Розраховано для C24H30N2O2 ·НСl·1,70 Н2O: С 64,69%; Η 7,78%; Ν 6,29%. Знайдено: С 64,82%; Η 7,60% Ν 6,08%. Приклад 23 Одержання N,N-діетил-4-[(N-бензил)-3-метоксифенілпіперидин-4-іліденметил)бензаміду (сполука 37) Використовували спосіб, описаний у прикладі 4, із застосуванням сполуки прикладу 22 (38мг), одержуючи N,N-діетил-4-[(N-бензил)-3-метоксифенілпіперидин-4-іліденметил)бензамід (46мг, 98%) : 1 Н ЯМР (400МГц, CDCl3) δ 1,12 (3Н, шир. CH3CH2N-), 1,25 (3Н, шир. CH3CH2N-), 2,38 (4Н, м, піперидин-СН), 2,48 (4Н, шир. піперидин-СН-), 3,27 (2Н, шир. CH3CH2N-), 3,52 (2Н, с, PhCH 2N-), 3,53 (2Н, шир. CH3CH2N-), 3,75 (3Н, с, ОСН3) , 6,65 (1Н, с, АrН) , 6,69 (1Н, д, J=8,0Гц, ArH), 6,74 (1Н, д, J=7, 6Гц, ArH), 7,13 (2Н, д, J=8,0Гц, АrН), 7,13-7,32 (8Н, м, АrН). Сіль НСl: т. пл. 100-110°С (СН2Сl2); ІЧ (NaCl) 3421, 2972, 1619, 1430, 1287 см-1. Елементний аналіз. Розраховано для C31H36N2O 2·НСl·0,40 СН2Сl2: С 69,96%; Η 7,07%; Ν 5,20%. Знайдено: С 69,94%; Η 7,06%; Ν 5,15%. Приклад 24 Одержання N,N-діетил-4-[(N-трет-бутоксикарбонілпіперидин-4-іл)-3-фторфенілгідроксиметил]бензаміду (сполука 38) У спосіб прикладу 19 з використанням 3-бромфторбензолу одержували названу в заголовку сполуку (257мг, 27%): 1 H ЯМР (400 МГц, CDCl3) δ 1,03 (3Н, шир. CH3CH2N-), 1,15 (3Н, шир. CH3CH2N-), 1,19-1,29 (4Н, м, піперидин-СН-), 1,35 (9Н, с, СН3С), 2,39 (1Н, м, піперидин-СН-), 2,59 (2Н, шир. піперидин-СН-), 3,17 (2Н, шир. CH3CH2N-), 3,28 (1Н, с, ОН), 3,45 (2Н, шир. CH3CH2N-), 4,02 (2Н, шир. піперидин-СН-), 6,80 (1Н, м, АrН), 7,15 (3Н, м, АrН), 7,18 (2Н, д, J=8,0Гц, АrН), 7,39 (2Н, д, J=8,0Гц, АrН). Приклад 25 Одержання N,N-діетил-4-(3-фторфенілпіперидин-4-іліденметил) бензаміду (сполука 39) У спосіб прикладу 20 з використанням сполуки прикладу 24 (165мг) одержували N,N-діетил-4-(3фтор фенілпіперидин-4-іліденметил)бензамід (108мг, 87%): 1 Н ЯМР (400МГц, CDCl3) δ 1,08 (3Н, шир. CH3CH2N-), 1,19 (3Н, шир. CH3CH2N-), 2,09 (1Н, с, NH), 2,25 (4Н, м, піперидин-СН-), 2,84 (4Н, шир. піперидин-СН-), 3,23 (2Н, шир. CH3CH2N-), 3,47, (2Н, шир. CH3CH2N-), 6,74 (1Н, м, АrН), 6,86 (2Н, м, АrН), 7,06 (2Н, д, J=8,0Гц, АrН), 7,18 (1Н, м, АrН), 7,24 (2Н, д, J=8,0Гц, АrН). Сіль НСl: т. пл. >70°С (розклад.); 14 (NaCl) 2978, 1605, 1478, 1432, 1290 см-1. Елементний аналіз. Розраховано для C23H27N2OF·НСl·0,25 СН2Сl2·1,50 Н2О: С 61,89%; Η 7,04%; Ν 6,21%. Знайдено: С 61,97%; Η 6,95%; Ν 6,22%. Ε) Схема синтезу сполуки прикладу 26 Сполуку прикладу 2 6 одержували по методиці, як показано на наведеній нижче схемі 5. (і) Одержання 4'-йодацетаніліду (сполука 40) До розчину 4-йоданіліну (15г, 69ммоль) в сухому СН 2Сl2 (100мл) додавали оцтовий ангідрид (14,09г, 138 моль) при кімнатній температурі, реакційну суміш потім перемішували протягом 2 годин. Сірий осад, що утворився під час реакції, фільтрували, промивали простим ефіром і збирали, маточний розчин концентрували досуха і додавали AcOEt, одержаний осад фільтрували, промивали простим ефіром та об'єднували з попередньою твердою речовиною, що є цільовим продуктом (15,95г, 88,7%). 1 Н ЯМР (CDCl3) δ: 2,19 (3Н, с, СОСН3), 7,2 (1Н, с, шир. -ΝΗ), 7,23 (2Н, м, Аr), 7,61 (2Н, м, Аr). (іі) Одержання 4-(4-ацетомідобензоїл)-N-трет-бутоксилкарбонілпіперидину (сполука 41) До розчину 4'-йодацетаніліду (11,7г, 45ммоль) в сухому ТГФ (200мл) при 0°С додавали NaH (1,62г, 67,5ммоль), реакційну суміш перемішували протягом 30 хвилин в той час, як температура підвищувалася до кімнатної температури, потім повільно при -78°С додавали H-BuLi (1,6Μ у гептані, 54ммоль). Суміш перемішували протягом 15 хвилин, потім краплями через шприц додавали N-трет-бутоксилкарбонiл-N'-метилN'-метоксилі-зоніпекотамід (6,15г, 30ммоль) в ТГФ (10мл) . Реакційну суміш нагрівали до кімнатної температури і потім гасили водним розчином NH4Сl та екстрагували етилацетатом (2x100мл). Органічний шар промивали насиченим (водним) NH4Cl, сольовим розчином, сушили над MgSO4 та концентрували, одержуючи сирий продукт, який додатково очищали колонковою хроматографією на силікагелі з використанням МеОНСН2Сl2 (0:100 ~ 5:95), одержуючи цільовий продукт (9,02г, 87%). 1 Н Η ЯМР (CDC13) δ: 1,47 (9Н, с (СН3)3), 1,6-1,8 (4Н, м, піперидин), 2,21 (3Н, с, СОСН 3), 2,9 (2Н, м, піперидин), 3,37 (1Н, м, СОСН-), 4,15 (2Н, м, піперидин), 7,64 (2Н, м, Аr), 7,86 (1Н, с, шир., -C ONH), 7,91 (2Н, м, Аr). (iii) Одержання 4-(α-гідрокси-α(4-N-трет-бутоксилкарбонілпіперидиніл)-3-фторбензил)ацетаніліду (сполука 42) У спосіб, описаний для одержання сполуки 4, але при заміні 1-бромнафталіну на 3-фтор-1-йодбензол, одержували названу в заголовку сполуку (93%). 1 Н ЯМР (ДМСО-D6) δ: 1,2-1,3 (4Н, м, піперидин), 1,37 (9Н, с, (СН3)3), 2,0 (3Н, с, СОСН 3), 2,65 (3Н, шир., піперидин), 3,95 (2Н, м, піперидин), 6,98 (1Н, м, Аr), 7,21-7,50 (7Н, м, Аr), 9,85 (1Н, с, OC-NH). (iν) Одержання N-меттил-4(α-гідрокси-α-(4-N-трет.-бутоксилкарбонілпіперидиніл)-3фторбензил)ацетаніліду (сполука 43) До 2Μ (водного) розчину NaOH (10мл) додавали гідросульфат тетрабутиламонію (1,35г, 3,97ммоль), потім додавали 4-(α-гідрокси-α-(4-N-трет-бутоксилкарбонілпіперидиніл)-3-фторбензил)ацетанілід (825мг, 1,86ммоль) і метилйодид (769 мг, 5,4ммоль) в 10мл дихлорметану. Реакційну суміш потім кип'ятили із зворотним холодильником протягом 1 години, охолоджували до кімнатної температури. Шар дихлорметану збирали і випарювали до об'єму близько 1мл. Додавали етилацетат і осад відділяли фільтруванням. Органічну фазу промивали сольовим розчином і сушили над MgSO4, концентрували, одержуючи твердий матеріал, який додатково очищали MPLC з використанням МеОН-СН 2Сl2 (5:95), щоб одержати чисту, названу в заголовку сполуку (770мг, 93%). 1 Н ЯМР (CDCl3) δ: 1,2-1,5 (4Н, м, піперидин) , 1,42 (9Н, с, (СН3)3),1,83 (3Н, С, СОСН 3), 2,52 (1Н, м, -СН-СОН), 2,70 (2Н, м, піперидин), 2,86 (1Н, с, шир., -ОН), 3,21 (3Н, с, NCH3), 4,15 (2Н, с, шир., піперидин), 6,90 (1Н, м, Аr), 7,12-7,60 (7Н, м, Аr). Приклад 26 Одержання N-метил-4-(3-фторфенілпіперидин-4-іліденметил)ацетаніліду (сполука 44) До розчину N-метил-4-(α-гідрокси-α-(4-N-трет-бутоксилкарбонілпіперидиніл)-3-фторбензил)ацетаніліду (300мг, 0,657ммоль) в сухому ди хлорметані (5мл) додавали трифтороцтову кислоту (50мл) при кімнатній температурі. Реакційну суміш кип'ятили із зворотним холодильником протягом 4 годин і потім концентрували. Залишок розчиняли в AcOEt (50мл). Одержаний розчин промивали 2н (водним) NaOH, (водним) NH4Cl і сольовим розчином, сушили над MgSO4. Вилучення розчинників давало сирий продукт, який очищали MPLC з елююванням МеОН-СН 2Сl2-NH4ОН (5:95:1), одержуючи чистий продукт (176мг, 79%). Т. пл. 235-237°С (розклад.). ІЧ (NaCl, плівка) (сіль НСl) Vmax=2961, 2722, 2480, 1658, 1608, 1580, 1507, 1429, 1381 см -1. 1 Н ЯМР (CDCl3) δ: 1,89 (3Н, с, СОСН3), 1,95 (1Н, с, -ΝΗ), 2,32 (4Н, м, піперазин), 2,92 (4Н, м, піперазин), 3,26 (3Н, с, N-СН3), 6,81-7,28 (8Н, м, Аr). 13 С ЯМР: (CDCl3): 5 22,4, 33,2, 33,3, 37,0, 48,3, 113,3 (м, C-F), 116,5 (м, C-F), 125,4, 126,6, 129,5, 129,6, 130,9, 133,7, 137,7, 141,2, 142,8, 144,2, 161,3, 163,8, 170,4. Елементний аналіз: (%) Розраховано для C21H23N2FO·НСl: С 67,28; Η 6,45; Ν 7,47; Знайдено: С 66,88; Η 6,44; Ν 7,16. (F) Схема синтезу сполуки прикладу 27 Сполуку прикладу 27 одержували по методиці, як подано нижче на схемі 6 (і) Одержання N-трет-бутоксилкарбоніл-4-піперидону (сполуку 46) Суміш сполуки 45 (50г, 0,325моль) і ди-трет-бутилдикарб-онату (71г, 0,325моль) в 300мл дихлорметану перемішували при 0°С, краплями додаючи триетиламін (133г, 1,32моль). Суміш залишали для нагрівання до кімнатної температури і перемішували протягом 12 годин. Розчинник випарювали і сирий продукт розподіляли між водою (400мл) і діетиловим простим ефіром (400мл). Водну фазу промивали додатковою порцією діетилового простого ефіру (400мл). Об'єднаний ефір промивали водою (400мл) і сольовим розчином (400мл), сушили над MgSO4. Вилучення розчинника давало сполуку 46 у вигляді блідо-жовтого твердого матеріалу (55,3г, 85%). δH (400МГц, CDCl3) 1,50 (с, 9Н), 2,45 (τ, 4Η, J=6,1Гц), 3,72 (τ, 4Η, J=6, 1Гц). (ii) Одержання трет-бутилового ефіру 4-(4-метоксикарбонілбензиліден)піперидин-1-карбонової кислоти (сполука 49) Метил-4-(бромметил)бензоат (сполука 47) (11,2г, 49ммоль) розчиняли в 25мл триметилфосфіту та кип'ятили із зворотним холодильником в атмосфері N2 протягом 5 годин. Надлишок триметилфосфіту вилучали спільною перегонкою з толуолом, одержуючи сирий метиловий ефір 4(диметоксифосфорилметил)бензойної кислоти (сполука 48). δH (400МГц, CDCl3) 3,20 (д, 2H, J=22Гц), 3,68 (д, 3Н, 10,8Гц), 3,78 (д, 3Н, 11,2Гц), 3,91 (с, 3Н), 7,38 (м, 2Н), 8,00 (д, 2Н, J=8Гц). Сирий продукт (сполука 48) розчиняли в сухому ТГФ (200мл) в атмосфері N2 і охолоджували до -78°С. Краплями додавали діізопропіламід літію (32,7мл, 1,5Μ в гексанах, 49ммоль) . Розчин залишали для нагрівання до кімнатної температури. До реакційної суміші краплями додавали розчин сполуки 46 (9,76г, 49ммоль в 100мл сухого ТГФ) і суміш перемішували в а тмосфері N2 протягом 12 годин. До реакційної суміші додавали воду (300мл) і етилацетат (300мл) та екстрагували. Водну фазу промивали етилацетатом (2x300мл). Об'єднані шари етилацетату сушили над MgSO4 і випарювали, одержуючи сирий продукт, який очищали хроматографією на силікагелі (0-33% етилацетат в гексанах), одержуючи сполуку 49 у вигляді білого твердого матеріалу (5,64г, 35%) . δH (400МГц, CDCl3) 1,44 (с, 1Н), 2,31 (τ, J=5,5Гц, 2Н), 2,42 (τ, J=5,5Гц, 2H), 3,37 (τ, J=5,5Гц, 2H), 3,48 (τ, J=5,5Гц, 2Н), 3,87 (с, 3Н), 6,33 (с, 1Н), 7,20 (д, J=6,7Гц, 2Н), 7,94 (д, J=6,7Гц, 2Н). δC-13 (CDCl3) 28,3, 29,2, 36,19, 51,9, 123,7, 127,8, 128,7, 129,4, 140,5, 142,1, 154,6, 166,8 м.ч. vmax (NaCl) см -1 3424, 2974, 2855, 1718, 1688, 1606, 1427, 1362, 1276. Елементний аналіз. Розраховано для C19H25NO4: С 68,86%, Η 7,60%, Ν 4,23%; Знайдено: С 69,1%, Η 7,69%, Ν 4,25%. (iiі) Одержання трет-бутилового ефіру 4-бром-4-[бром-(4-метоксикарбонілфеніл)метил]піперидин-1карбонової кислопаг (сполука 50) До розчину сполуки 49 (5,2г, 16ммоль) в сухому дихлорметані (200мл) додавали К2СО3 (1,0г). Потім краплями при 0°С додавали розчин брому (2,9г, 18ммоль в 30мл DCM) і суміш перемішували протягом 1,5 годин при кімнатній температурі. К2СО3 вилучали фільтруванням і розчин випарювали досуха. Сирий продукт розчиняли в етилацетаті (200мл) та промивали водою (200мл) , 0,5Μ НСl (200мл) і сольовим розчином (200мл), сушили над MgSO 4. Розчинник випарювали, одержуючи сирий продукт, який перекристалізовували з метанолу, одержуючи сполуку 50 у вигляді білого твердого матеріалу (6,07г, 78%). δH (400МГц, CDCl3) 1,28 (с, 9Н), 1,75 (м, 2Н), 1,90 (м, 2Н), 2,1 (м, 4Н), 3,08 (шир. 4Н), 3,90 (с, 3Н), 4,08 (шир., 4Н), 5,14 (с, 1Н), 7,57 (д, J=8,4Гц, 2Н), 7,98 (д, J=8,4Гц, 2Н). δC-13 (400МГц, CDCl3) 28,3, 36,6, 38,3, 40,3, 52,1, 63,2, 72,9, 129,0, 130,3, 130,4, 141,9, 154,4, 166,3 м.ч. vmax (NaCl) см -1 3425, 2969, 1725, 1669, 1426, 1365, 1279, 1243. Елементний аналіз. Розраховано для C19H25Br2NO4 : С 46,6%, Η 5,13%, Ν 2,85%. Знайдено: С 46,64%, Η 5,16%, Ν 2,89%. (iv) Одержання трет-бутилового ефіру 4-[бром(4-карбоксифеніл)метилен]піперидин-1 карбонової кислоти (сполука 51) До розчину сполуки 50 (5,4г, 11ммоль) в метанолі (300мл) при 40°С додавали 2,0Μ NaOH (100мл). Реакційну суміш перемітували протягом 3 годин при 40°С. Сиру сіль виділяли фільтруванням. Твердий матеріал сушили протягом ночі у вакуумі. Суху сіль розчиняли в 40% суміші ацетонітрил/вода і рН розчину доводили до 2 з використанням концентрованої НСl. Цільовий продукт (7) (3,8г, 87%) виділяли у вигляді білого порошку фільтруванням. δH (400МГц, CDCl3) 1,45 (с, 9Н), 2,22 (дд, J=5,5Гц, 6,1Гц, 2Н), 2,64 (дд, J=5,5Гц, 6,1Гц, 2Н), 3,34 (дд, J=5,5Гц, 6,1Гц, 2Н), 3,54 (дд, J=5,5Гц, 6,1Гц, 2Н), 7,35 (д, J=6,7Гц, 2Н), 8,08 (д, J=6,7Гц, 2Н). δC-13 (400МГц, CDCl3) 28,3, 31,5, 34,2, 44,0, 115,3, 128,7, 129,4, 130,2, 137,7, 145,2, 154,6, 170,3. Елементний аналіз. Розраховано для С 18Н22ВrNO4 : С 54,56%, Η 5,60%, Ν 3,53%. Знайдено: С 54,66%, Η 5,68%, Ν 3,59%. (ν) Одержання трет-бутилового ефір у 4-[бром-(4-діетилкарбамоїлфеніл)метилен]піперидин-1-карбонової кислоти (сполука 52) До розчину сполуки 51 (1,0г, 2,5ммоль) в сухому ди хлорметані (10мл) при -20°С додавали ізобутилхлорформіат (450мг, 3,3ммоль). Через 20 хвилин при -20°С додавали діетиламін (4мл) і реакційну суміш залишали для нагрівання до кімнатної температури. Через 1,5 години розчинник випарювали і реакційну суміш розподіляли між етилацетатом та водою. Шар етилацетату промивали водою і сольовим розчином та сушили над MgSO4 і етилацетат вилучали випарюванням. Сирий продукт очищали хроматографією на силікагелі (0-60% етилацетат в гептанах), одержуючи продукт (сполука 52) у вигляді білих голок (800мг, 73%). δH (400МГц, CDCl3) 1,13 (шир., 3Н), 1,22 (шир., 3Н), 1,44 (с, 9Н), 2,22 (т, J=5,5Гц, 2Н), 2,62 (τ, J=5,5Гц, 2Н), 3,31 (τ, J=5,5Гц, 2Н), 3,52 (τ, J=5,5Гц, 2Н), 7,27 (д, J=7,9Гц, 2Н), 7,33 (д, J=7,9Гц, 2Н). δC-13 (400МГц, CDCl3) 12,71, 14,13, 28,3, 31,5, 34,2, 39,1, 43,2, 79,7, 115,9, 126,3, 129,3, 136,8, 137,1, 140,6, 154,6, 170,5. Елементний аналіз. Розраховано для С 22Н31ВrN2О3 : С 58,3%, Η 6,92%, Ν 6,21%. Знайдено: С 58,62%, Η 6,89%, Ν 6,21%. Приклад 27 Одержання N,N-дiетил-4-[піперидин-4-іліден-(3-трифторметилфеніл)метил]бензаміду (сполука 54, Аr=3трифторметилфеніл) (загальна методика) Сполучення за Сузукі сполуки 52 з різними бороновими кислотами з подальшим вилученням захисної групи у замісника проводили паралельно в невеликому масштабі. Реакції і рідинно-рідинну екстракцію проводили в пробірках для культур розміром 25x150мм. Методику типової реакції описано нижче. До розчину сполуки 52 (25мг, 57мкмоль) і тетра-кіс(трифенілфосфін)паладію(0) (5мг, 4,3мкмоль) в ксилолах (дегазовані, 0,5мл) додавали 3-трифторфенілборонову кислоту (28,5мг, 150мкмоль) в етанолі (дегазований, 0,5мл) , потім 150мкл 2Μ Na 2CO3 (водний) (300мкмоль). Реакційну суміш залишали для проходження реакції при 80°С протягом 1,5 годин в атмосфері Аr. Реакційну суміш розбавляли водою (1мл) і діетиловим простим ефіром (1мл) та перемішували з завихренням. Органічну фазу відділяли і випарювали, одержуючи сирий продукт (сполука 9, Аr=3-три фторметилфеніл). Вос-групу вилучали обробкою сирого продукту 1мл ТФО. Через 30 хвилин ТФО випарювали при кімнатній температурі, одержуючи сиру сіль ТФО. Сіль нейтралізували 1Μ ΝΗ4ΟΗ (1,0Μ) та екстрагували діетиловим простими ефіром (2x1мл) . Ефірну фазу підкислювали 4,0Μ НСl в діоксані (200мкл) і сіль НСl екстрагували водою (2x1мл). Водний розчин солі промивали діетиловим простим ефіром (2x1мл) і ліофілізували, одержуючи продукт (сполука 54, Аr=3-трифторметилфеніл) у вигляді білого порошку (10мг, 39%). 1 H ЯМР (CDCl3) (основа) δ 1,11 (шир., 3Н), 1,20 (шир., 3Н), 2,26 (т, J=5,6Гц, 2Н), 2,31 (τ, J=5,6Гц, 2Н), 2,882,91 (м, 4Н), 3,27 (шир. 2Н), 3,52 (шир. 2Н), 7,10-7,47 (м, 8Н). Елементний аналіз. Розраховано для C24H28N2OF3CIx1,80 Н2О: С 59,39%; Η 6,56%; Ν 5,77%. Знайдено: С 59,39%; Η 5,90%; Ν 5,77%. Приклади 28-52 По методиці, описаній для сполуки 54 прикладу 27, але з заміною 3-трифторметилфенілборонової кислоти на відповідні боронові кислоти були також одержані такі сполуки. Приклад 28 N,N-діетил-4-(3-нітрофенілпіперидин-4-іліденметил)бензамід (сполука 55) Використовували 3-нітрофенілборонову кислоту. 1 Н ЯМР (СВСІ3) (основа) δ: 1,11 (шир. 3Н), 1,21 (шир. 3Н), 2,27-2,34 (м, 4Н), 2,92 (т, J=6,0Гц, 4Н), 3,26 (шир. 2Н), 3,52 (шир. 2Н), 7,10 (д, J=8 ,4Гц, 2Н), 7,31 (д, J=8,4Гц, 2Н), 7,40-7,50 (м, 2Н), 7,95-8,08 (м, 2Н). Приклад 29 N,N-діетил-4-(4-толуіл[піперидин-4-іліденметил) бензамід (сполука 56) Використовували п-толуілборонову кислоту. 1 Н ЯМР (CDCl3) (основа) δ: 1,10 (шир. 3Н), 1,19 (шир. 3Н), 2,29 (с, 3Н), 2,26-2,31 (м, 4Н), 2,86-2,88 (м, 4Н), 3,25 (шир, 2Н), 3,49 (шир. 2Н), 6,95-7,28 (м, 8Н). Приклад 30 N,N-дхетил-4-(4-формілфенілпіперидин-4-іліденметил)бензамід (сполука 57) Використовували 4-формілфенілборонову кислоту. 1 Н ЯМР (CDCl3) (основа) δ: 1,10 (шир. 3Н), 1,20 (шир. 3Н), 2,28-2,33 (м, 4Н), 2,89-2,92 (м, 4Н), 3,25 (шир. 2Н), 3,50 (шир. 2Н), 7,08-7,79 (м, 8Н), 9,95 (с, 1Н) . Приклад 31 N,N-діетил-4-(3-хлор-4-фторфенілпіперидин-4-іліденметил) бензамід (сполука 58) Використовували 3-хлор-4-фторфенілборонову кислоту. 1 Н ЯМР (CDCl3) (основа) δ: 1,10 (шир. 3Н), 1,20 (шир. 3Н), 2,26-2,30 (м, 4Н), 2,86-2,91 (м, 4Н), 3,25 (шир. 2Н), 3,50 (шир. 2Н), 6,93-7,30 (м, 7Н). Приклад 32 N,N-дiетил-4-(фторфенілпіперидин-4-іліденметил)бензамід (сполука 59) Використовували 4-фторфенілборонову кислоту. 1 Н ЯМР (CDCl3) (основа) δ: 1,11/ (шир. 3Н), 1,16 (шир. 3Н), 2,25 (с, 4Н), 2,84 (с, 4Н), 3,20 (шир. 2Н), 3,47 (шир. 2Н), 6,92 (м, 2Н), 7,01 (м, 4Н), 7,23 (д, J=8,8 ц, 2Н). Приклад 33 N,N-дiетил-4-(2-фторфенілпіперидин-4-іліденметил) бензамід (сполука 60) Використовували 2-фторфенілборонову кислоту. 1 Н ЯМР (CDCl3) (основа) δ: 1,11 (шир. 3Н), 1,15 (шир. 3Н), 2,10 (т, J=5,2Гц, 2Н), 2,27 (τ, J=5,2Гц, 2Н), 2,83 (м, 4Н), 3,20 (шир. 2Н), 3,45 (шир. 2Н), 6,94-7,03 (м, 3Н), 7,10-7,23 (м, 5Н). Приклад 34 N,N-дiетил-4-(2,4-дихлорфенілпіперидин-4-іліденметил)бензамід (сполука 61) Використовували 2,4-дихлорфенілборонову кислоту. 1 Н ЯМР (ДМСО) (сіль НСl) δ: 1,07 (шир. 6Н), 2,24 (τ, 2Η), 2,50 (т, 2Н), 3,10 (т, 2Н), 3,30 (т, 2Н), 3,31 (шир. 2Н), 3,43 (шир. 2Н), 7,25 (д, J=8,4Гц, 2Н), 7,32 (д, J=8,4Гц, 2Н), 7,43 (д, J=8,0Гц, 1Н), 7,47 (д, J=8,0Гц, 1H), 7,68 (с, 1Н), 9,20 (шир. 2Н). Приклад 35 N,N-діетил-4-(3,5-дихлорфенілпіперидин-4-іліденметил) бензамід (сполука 62) Використовували 3,5-дихлорфенілборонову кислоту. 1 Н ЯМР (ДМСО) (сіль HCl) δ: 1,03 (шир. 6Н), 2,36-2,38 (м, 4Н), 3,0-3,2 (м, 4Н), 3,2 (шир. 2Н), 3,38 (шир. 2Н), 7,19 (с, 1Н), 7,21 (д, J=8,0Гц, 2H), 7,29 (д, J=8,0Гц, 2Н), 7,49 (с, 2Н), 9,10 (шир. 2Н). Приклад 36 N,N-діетил-4-(З-ацетилфенілпіперидин-4-іліденметил)бензамід (сполука 63) Використовували 3-ацетилфенілборонову кислоту. 1 H ЯМР (СDСІ3) (основа) δ: 1,11 (шир. 3Н), 1,20 (шир. 3Н), 2,26 (т, J=5,6Гц, 2Н), 2,32 (τ, J=5,6Гц, 2Н), 2,55 (с, 3Н), 2,92-2,88 (м, 4Н), 3,26 (шир. 2Н), 3,51 (шир. 2Н), 7,11 (д, J=8,0Гц, 2Н), 7,29 (д, J=8,0Гц, 2Н), 7,29 (д, J=7,2Гц, 1Н), 7,37 (τ, J=8,0Гц, 1Н), 7,70 (с, 1Н), 7,79 (д, J=7,2Гц, 1Н). Приклад 37 N,N-дiетил-4-(3,5-трифтормешилфенілпіперидин-4-іліденметил)бензамід (сполука 64) Використовували 3,5-трифторметилфенілборонову кислоту. 1 Н ЯМР (ДМСО) (сіль НСl) δ: 1,06 (шир. 3Н), 1,,08 (шир. 3Н), 2,33 (шир. 2Н), 2,41 (шир. 2Н), 3,12 (шир. 6Н) , 3,38 (шир. 2Н), 7,24 (д, J=7,6Гц, 2Н), 7,30 (д, J=7,6Гц, 2Н), 7,84 (с, 2Н), 8,00 (с, 2Н), 8,9 (шир. 2Н). Приклад 38 N,N-діетил-4-(3-тіофенілпіперидин-4-іліденметил) бензамід (сполука 65) Використовували 3-тіофенілборонову кислоту. 1 Н ЯМР (ДМСО) (сіль НСl) δ: 1,10 (шир. 6Н), 2,44 (τ, 2Η), 2,58 (т, 2Н), 3,10-3,15 (м, 4Н), 3,21 (шир. 2Н), 3,44 (шир. 2Н), 6,86 (д, J=4,8Гц, 1Н), 7,20 (д, J=8,0Гц, 2Н), 7,32 (д, J=8,0Гц, 2Н), 7,33 (с, 1Н), 7,52 (д, J=4,8Гц, 1Н). Приклад 39 N,N-діетил-4-(2-тіофенілпіперидин-4-іліденметил)бензамід (сполука 66) Використовували 2-тіофенілборонову кислоту. 1 Н ЯМР (CDCl3) (основа) δ: 1,12 (шир. 3Н), 1,20 (шир. 3Н), 2,24 (т, J=5,2Гц, 2Н), 2,50 (τ, J=5,2Гц, 2H), 2,85 (τ, J=5,6Гц, 2Н), 2,92 (τ, J=5,6Гц, 2H), 3,27 (шир. 2Н), 3,51 (шир. 2Н), 6,75 (д, J=3,6Гц, 1Н), 6,93 (τ, J=3,6Гц, 1Н) , 7,16 (д, J=7,2Гц, 2H), 7,21 (д, J=3,6Гц, 1Н), 7,30 (д, J=7,2Гц, 2Н). Приклад 40 N,N-діетил-4-(4-метилтіофенілпіперидин-4-іліденметил)бензамід (сполука 67) Використовували 4-метилтіофенілборонову кислоту. 1 Н ЯМР (CDCl3) (основа) δ: 1,11 (шир. 3Н), 1,20 (шир. 3Н), 2,32-2,75 (м, 4Н), 2,45 (с, 3Н), 2,90-2,87 (м, 4Н), 3,26 (шир. 2Н), 3,51 (шир. 2Н), 7,01 (д, J=6,0Гц, 2Н), 7,10 (д, J=6,0Гц, 2Н), 7,15 (д, J=6,8Гц, 2Н), 7,27 (д, J=6,8Гц, 2Н). Приклад 41 N,N-діетил-4-(3-амінофенілпіперидин-4-іліденметил)бензамід (сполука 68) Використовували 3-амінофенілборонову кислоту. 1 Н ЯМР (CDCl3) (основа) δ: 1,11 (шир. 3Н), 1,20 (шир. 3Н), 2,27-2,33 (м, 4Н) , 2,86-2,90 (м, 4Н), 3,27 (шир. 2Н), 3,51 (шир. 2Н), 3,57 (шир. 2Н), 3,68 (с, 1Н), 6,39 (с, 1Н) , 6,52 (дд, J=1,6Гц, J=7,6Гц, 2Н), 7,06 (τ, J=8,0Гц, 1Н), 7,12 (д, J=6,4Гц, 2H), 7,26 (д, J=6,4Гц, 2Н). Приклад 42 N,N-діетил-4-(4-трифшорметилфекілпіперидин-4-іліденметил)бензамід (сполука 69) Використовували 4-трифторметилфенілборонову кислоту. 1 Н ЯМР (ДМСО) (сіль НСl) δ: 1,05 (шир. 6Н), 2,35 (τ, 2Η), 2,40 (т, 2Н), 3,09 (м, 6Н), 3,35 (шир. 2Н), 7,17 (д, J=8,0Гц, 2Н), 7,28 (д, J=8,0Гц, 2Н), 7,35 (д, J=8,0Гц, 2Н), 7,67 (д, J=8,0Гц, 2Н), 8,71 (шир. 2Н). Приклад 43 N,N-діетил-4-(4-метоксифенілпіперидин-4-іліденметил) бензамід (сполука 70) Використовували 4-метоксифенілборонову кислоту. 1 Ε Я МР (CDCl3) (основа) δ: 1,12 (шир. 3Н), 1,19 (шир. 3Н), 2,29 (м, 4Н), 2,87 (м, 4Н), 3,27 (шир. 2Н), 3,51 (шир. 2Н), 3,77 (с, 3Н), 6,80 (м, 2Н), 7,00 (м, 2Н), 7,10 (д, J=8,4Гц, 2Н), 7,26 (д, J=8,4Гц). Приклад 44 N,N-діетил-4-(3,4-дихлорфенілпіперидин-4-іліденметил) бензамід (сполука 71) Використовували 3,4-дихлорфенілборонову кислоту. 1 Н ЯМР (CDCl3) (основа) δ: 1,12 (шир. 3Н), 1,20 (шир. 3Н), 2,28 (т, J=5,6Гц, 4Н), 2,89 (м, 4Н), 3,27 (шир. 2Н), 3,52 (шир. 2Н), 6,8-7,4 (м, 7Н). Приклад 45 N,N-діетил-4-(2-трифторметилфенілпіперидин-4-іліденметил)бензамід (сполука 72) Використовували 2-трифторметилфенілборонову кислоту. 1 Н ЯМР (CDCl3) (основа) δ: 1,05 (шир. 3Н), 1,16 (шир. 3Н), 1,95 (м, 2Н), 2,35-2,41 (м, 2Н), 2,7-2,9 (м, 4Н), 3,20 (шир. 2Н), 3,48 (шир. 2Н), 7,2-7,6 (м, 8Н). Приклад 46 N,N-діетил-4-(3-толуілпіперидин-4-іліденметил)бензамід (сполука 73) Використовували м-толілборонову кислоту. 1 Н ЯМР (CDCl3) (основа) δ: 1,11 (шир. 3Н), 1,19 (шир. 3Н), 2,28 (с, 3Н), 2,29 (м, 4Н), 2,89 (м, 4Н), 3,27 (шир. 2Н), 3,51 (шир. 2Н), 6,8-7,3 (м, 8Н). Приклад 47 N,N-діетил-4-(2-метоксифенілпіперидин-4-іліденметил)бензамід (сполука 74) Використовували 2-метоксифенілборонову кислоту. 1 Н ЯМР (CDCl3) (основа) δ: 1,09 (шир. 3Н), 1,18 (шир. 3Н), 2,10 (кв, J=4,8Гц, 2Н), 2,31 (кв, J=4,8Гц, 2Н), 2,82,9 (м, 4Н), 3,25 (шир. 2Н), 3,50 (шир. 2Н), 3,68(с, 3Н), 6,83-6,90 (м, 2Н), 7,0 (д, 1Н), 7,15-7,25 (м, 5Н). Приклад 48 N,N-діетил-4-(3-формілфенілпіперидин-4-іліденмеігил) бензамід (сполука 75) Використовували 3-формілфенілборонову кислоту. 1 H ЯМР (CDCl3) (основа) δ: 1,15 (шир. 3Н), 1,20 (шир. 3Н), 2,26-2,34 (м, 4Н), 2,90-2,92 (м, 4Н), 3,28 (шир. 2Н), 3,2 (шир. 2Н), 7,11-7,31 (м, 8Н), 9,96 (с, 1Н). Приклад 49 N,N-дiетил-4-(2-нафтилпіперидин-4-іліденметил)бензамід (сполука 76) Використовували 2-нафтилборонову кислоту. 1 Н ЯМР (CDCl3) (основа) δ: 1,11 (шир. 3Н), 1,20 (шир. 3Н), 2,35-2,39 (м, 4Н), 2,91-2,96 (м, 4Н), 3,27 (шир. 2Н), 3,51 (шир. 2Н), 7,16-7,40 (м, 5Н), 7,42-7,44 (м, 2Н), 7,57 (с, 1Н), 7,72-7,79 (м, 2Н). Приклад 50 N,N-дiетил-4-(2-формілфенілпіперидин-4-іліденметил)бензамід (сполука 77) Використовували 2-формілфенілборонову кислоту. 1 Н ЯМР (СВСІ3) (основа) δ: 1,09 (шир. 3Н), 1,18 (шир. 3Н), 1,70-2,10 (м, 2Н), 2,40-2,49 (м, 2Н), 2,76-2,84 (м, 2Н), 2,85-2,97 (м, 2Н), 3,23 (шир. 2Н), 3,48 (шир. 2Н), 7,13-7,40 (м, 6Н), 7,53-7,55 (м, 1Н), 7,90 (д, J=7,6Гц, 1Н), 10,27 (с, 1Н). Приклад 51 N,N-діетил-4-(4-ацетилфенілпіперидин-4-іліденметил) бензамід (сполука 78) Використовували 4-ацетилфенілборонову кислоту. 1 H ЯМР (CDCl3) (основа) δ: 1,11 (шир. 3Н), 1,20 (шир. 3Н), 2,30-2,35 (м, 4Н), 2,56 (с, 3Н), 2,92 (м, 4Н), 3,27 (шир. 2Н), 3,52 (шир. 2Н), 7,10-7,30 (м, 6Н), 7,87 (д, J=7,2Гц, 2Н). Приклад 52 N,N-дiетил-4-(3-трифторметилфенілпіперидин-4-іліленметил) бензамід (сполука 79) Використовували 3-трифторметилфенілборонову кислоту. 1 Н ЯМР (CDCl3) (основа) δ: 1,11 (шир. 3Н), 1,20 (шир. .Н), 2,26 (т, J=5,6Гц, 2Н), 2,31 (τ, J=5,6Гц, 2Н), 2,882,91 (м, 4Н), 3,27 (шир. 2Н), 3,52 (шир. 2Н), 7,10-7,47 (м, 8Н). Приклад 53 Одержання N,N-діетил-4-([1-(2,6-діаміногексаноїл)піперидин-4-іліден]фенілметил)бензаміду (сполука 80) L-Boc-лізин (Cbz) (0,38г, 1,0ммоль) розчиняли в сухому тетрагідрофурані (5мл) в атмосфері азоту при 15°С. Додавали N-метилморфолін (0,11мл, 1,0ммоль), потім ізобутилхлор формі-ат (0,13мл, 1ммоль). Після перемішування протягом 10 хвилин додавали N,N-дiетил-4-(фенілпіперидин-4-іліденметил)бензамід (сполуку 6) (0,35г, 1,0ммоль) в тетрагідрофурані (1мл) та температурі давали підвищитися до 25°С протягом 2 годин. Реакційну суміш випарювали на силікагелі. MPLC на силікагелі (від 0 до 100% етилацетат у гептані) давала 0,4г. Продукт (0,40г, 0,56ммоль) розчиняли в метиленхлориді (10мл) і обробляли трифтороцтовою кислотою (3мл) протягом 30 хвилин, потім леткі компоненти випарювали. Залишок розчиняли в оцтовій кислоті (25мл) та піддавали гідрогенолізу протягом 1,5 годин воднем (1атм) над паладієм на вугіллі (10%, 0,10г) . Розчинник випарювали і залишок очищали хроматографією на короткій колонці з оберненою фазою (RP-18), елююючи 030% ацетонітрилом у воді. Вільний амін екстрагували 5% розчином карбонат калію, метиленхлорид, одержуючи 123мг, і потім обробляли двома еквівалентами хлористоводневої кислоти в суміші метанол/вода. Ліофілізація давала дигідрохлоридну сіль. 1 Н ЯМР (вільний амін, CD3OD): δ=1,0-1,7 (м, 16Н, амід-Ме, піперидин-Н, лізин-Н), 2,3-2,7 і 3,0-4,5 (м, 11Н, амід-Η, піперидин-Н, лізин-Н), 4,8 (с, 4Н, 2 NH 2), 7,10-7,50 (м, 9Н, АrН). Елементний аналіз. Розраховано для C29H40N4O 2 x2,4 Н2Оx2 НСl: С 58,76%; Η 7,96%; Ν 9,43%. Знайдено: С 58,70%; Η 7,51%; Ν 9,33%. Приклад 54 Одержання фосфонооксиметилового ефіру 4-[(4-діетилкарбамоїлфеніл)фенілметилен]піперидин-1карбонової кислоти (сполука 81) N,N-діетил-4-(фенілпіперидин-4-іліденметил)бензамід (сполука 6) (0,62г, 1,8ммоль) розчиняли в метиленхлориді (10мл) і додавали 1,8-бісдіамінонафталін (0,42г, 2,0ммоль). Розчин охолоджували до 0°С і краплями додавали хлорметилхлорформіат (0,25г, 2,0ммоль) в метиленхлориді (1мл) . Після витримування протягом 2 годин при 25°С додавали додаткову порцію спочатку 1,8-бісдіамінонафталіну (0,21г, 1,0ммоль), потім хлорметилхлорформіату (0,12г, 1,0ммоль). Після загального часу витримування 4 години розчин промивали 1Μ НСl, сольовим розчином, сушили (МН+) ) і випарювали, одержуючи 0,62г. Залишок розчиняли в толуолі (25мл), додавали дибензилфосфат срібла (0,81г, 2,1ммоль) і суміш нагрівали 3 години при 80°С. Розчин фільтрували, потім промивали 5% розчином карбонату калію, сольовим розчином, сушили (К2СО3) і випарювали. MPLC на силікагелі (від 0 до 100% етилацетат в гептані) давала 0,66г (0,96ммоль, 54%). Залишок розчиняли в етилацетаті (50мл) і піддавали гідрогенолізу (1атм. водню) з паладієм на вугіллі (10%, 0,3г) протягом 2 годин. Після фільтрування і випарювання розчинника продукт обробляли двома еквівалентами гідроксиду натрію в суміші метанол/вода. Ліофілізація давала двонатрієву сіль продукту у вигляді білого твердого матеріалу. 1 Н ЯМР (D2 O): δ=1,03, 1,20 (2 м, 6Н, амід-Ме), 2,34 (м, 4Н, піперидин-Н), 3,19-3,61 (м, 8Н, амін-СН2, піперидин-Н), 5,44 (д, J=13Гц, 2Н, ОСН2О) , 7,18-7,36 (м, 9Н, АrН). Сполуки 80 і 81, відповідно, являють собою підхожі проліки сполук формули (І). (G) Схема синтезу сполук прикладів 55-57 Сполуки прикладів 55, 56 і 57 одержували згідно з методикою, що її подано нижче схеми 7. (і) Одержання трет-бутил 4-{бром[4-(морфолінокарбоніл)феніл]метилен}-1-піперидинкарбоксилату (сполука 82) До розчину сполуки 51, одержаного по схемі 6 (0,25г, 0,625ммоль) та свіжоперегнаного триетиламіну (0,5мл) в дихлорметані (12мл) додавали краплями при кімнатній температурі оксалілхлорид (0,38мл, 2,0М, 0,75ммоль). Розчин перемішували протягом 10 хвилин при кімнатній температурі і розчинник та надлишкові реагенти вилучали у вакуумі, одержуючи хлорангідрид у ви гляді сирого продукту, який використовували на наступній стадії без додаткової очистки. Морфолін (56мг, 0,65ммоль) додавали до розчину хлорангідриду (0,65ммоль) і триетиламіну (0,5мл) в дихлорметані (5мл). Реакційну суміш залишали для проходження реакції протягом однієї години при кімнатній температурі. Розчинник потім вилучали у вакуумі. Сирий продукт розподіляли між етилацетатом (25мл) і водою (25мл) . Водний шар промивали етилацетатом і об'єднані шари етилацетату промивали 2Μ NaOH (2х25мл), 2Μ HCl (2х25мл), сольовим розчином (1х25мл) та сушили над сульфатом магнію. Розчинник вилучали у вакуумі, одержуючи продукт (сполука 82) (294мг, вихід 97%). 1 H ЯМР CDCl3 (400МГц) 1,44 (с, 9Н), 2,21 (τ, J=5,6Гц, 2Н), 2,62 (τ, J=5,6Гц, 2Н), 3,31 (τ, J=5, 6Гц, 2Н), 3,52 (τ, J=5,6Гц, 2Н), 3,69 (шир., 8Н), 7,31 (д, J=6,4Гц, 2Н), 7,37 (д, J=6,4Гц, 2Н). (іі) Одержання трет-бутил 4-{бром-[4-(піперидинокарбоніл)феніл]метилен}-1-піперидинкарбоксилату (сполука 83) Використовували ту саму методику, як описано для одержання сполуки 82, але з застосуванням піперидину замість морфоліну. 1 H ЯМР CDCl3 (400МГц) 1,44 (с, 9Н), 1,51 (шир., 2Н), 1,66 (шир., 4Н), 2,21 (т, J=5,6Гц, 2Н), 2,62 (τ, J=5,6Гц, 2Н), 3,31 (τ, J=5,6Гц, 2H), 3,33 (шир., 2Н), 3,52 (τ, J=5,6Гц, 2Н), 3,68 (шир., 2Н), 7,26 (д, J=8,4Гц, 2Н), 7,35 (д, J=8,4Гц, 2Н). (iii) Одержання трет-бутил 4{бром-[4(тетрагідро-1Н-1-піролілкарбоніл)феніл]метилен}-1піперидинкарбоксилату (сполука 84) Використовували ту ж саму методику, як описано для одержання сполуки 82, але з застосуванням піролідину замість морфоліну. 1 Н ЯМР CDCд3 (400МГц) 1,44 (с, 9Н), 1,87 (к, J=6,8Гц, 2Н), 1,95 (к, J=6,8Гц, 2Н), 2,20 (т, J=5,6Гц, 2Н), 2,62 (т, J=5,6Гц, 2Н), 3,31 (т, J=5,6Гц, 2Н), 3,43 (т, J=6,8Гц, 2Н), 3,52 (т, 5,6Гц, 2Н), 3,63 (т, J=6,8Гц, 2Н), 7,27 (д, J=8,0Гц, 2Н), 7,47 (д, J=8,0Гц, 2Н). Приклад 55 Одержання 4-[(3-фторфеніл)піперидин-4-ілметил]фенілморфолін-4-ілметанону (сполука 85) До розчину сполуки 82 (37мг, 0,085ммоль) і тетракіс(трифенілфосфін)паладію(0) (5мг, 0,0043ммоль) в ксилолах (дегазовані, 0,5мл) додавали 3-фторфенілборонову кислоту (25мг, 0,18ммоль) в етанолі (дегазований, 0,5мл), потім 150мкл 2Μ Na2SO 4 (водний) (300мкмоль). Реакційну суміш залишали для проходження реакції при 80°С протягом 2 годин в атмосфері аргону. Реакційну суміш розбавляли водою (1мл) і діетиловим простим ефіром (1мл) та перемішували з завихренням. Органічну фаз у відділяли і випарювали, одержуючи сирий продукт, який використовували без додаткового очищення. Вос-групу вилучали обробкою сирого продукту 1мл ТФО. Через 30 хвилин при кімнатній температурі ТФО випарювали, одержуючи сиру сіль ТФО. Сіль нейтралізували 1Μ ΝΗ4ΟΗ (1,0Μ) та екстрагували діетиловим простим ефіром (2x1мл) . Ефірну фазу підкислювали 4,0Μ НСІ в діоксані (200мкл) і сіль НСІ екстрагували водою (2x1мл). Водний розчин солі промивали діетиловим простим ефіром (2х1мл) і ліофілізували, одержуючи продукт у вигляді білого порошку. 1 Н ЯМР CDCд3 (400МГц) δ 2,67 (м, 4Н), 3,19 (м, 4Н), 3,45 (шир., 2Н), 3,68 (шир., 6Н), 6,75 (д, J=9,6Гц, 1Н), 6,85 (д, J=8,0Гц, 1Н), 6,95 (м, 1Н), 7,11 (д, J=7,6Гц, 2Н), 7,25 (с, 1Н), 7,35 (д, J=7,6Гц, 2Н). Приклад 56 Одержання 4-[(3-фторфеніл)піперидин-4-ілметил]фенілпіперидин-4-ілметанону (сполука 86) Використовували методику, описану для одержання сполуки 85, але з використанням сполуки 83 в якості вихідного матеріалу. 1 Н ЯМР CDCl3 (400МГц) δ 1,51 (шир., 2Н), 1,65 (шир., 4Н), 2,60 (шир., 4Н), 3,14 (шир., 4Н), 3,33 (шир., 2Н), 3,68 (шир., 2Н), 6,67 (д, J=8,0Гц, 1Н), 6,86 (д, J=8,0Гц, 1Н), 6,93 (τ, J=8,0Гц, 1Η), 7,08 (д, J=8,4Гц, 2H), 7,25 (с, 1Н), 7,32 (д, J=8,4Гц, 2Н). Приклад 57 Одержання 4-[(3-фторфеніл)піперидин-4-ілметил]фенілпіролідин-1-ілметанону (сполука 87) Використовували методику, описану для одержання сполуки 85, але з використанням сполуки 84 в якості вихідного матеріалу. 1 Н ЯМР СОСІ 3 (400МГц) 5 1,84-1,89 (м, 2Н), 1,90-1,98 (м, 2Н), 2,60-2,63 (м, 4Н), 3,13-3,17 (м, 4Н), 3,41 (т, J=6,8Гц, 2Н), 3,62 (τ, J=6,8Гц), 6,73 (д, J=8,8Гц, 1Н) , 6,86 (д, J=7,2Гц, 1Н), 6,93 (м, 1Н) , 7,10 (д, J=8,0Гц, 2Н), 7,25 (с, 1Н), 7,45 (д, J=8,0Гц, 2Н). (Н) Схема синтезу сполук прикладів 58-68 Сполуки прикладів 58-68 одержали за методикою, наведеною нижче на схемах 8 (а)-(с) 97 (і) Одержання трет-бутилового ефіру 4-[бром-(4-етоксикарбоні-ламінофеніл)метил]піперидин1-карбонової кислоти (сполука 88) До суміші сполуки 51, одержаної по схемі 6 (0,25г, 0,625ммоль) в толуолі (5мл) додавали дифенілфосфорилазид (0,192г, 0,70ммоль) та триетиламін (0,1мл, 0,7ммоль). Після перемішування суміші в атмосфері аргону при 95°С протягом двох годин додавали надлишок безводного етанолу (2мл) і триетиламін (0,1мл) та розчин перемішували при 95°С протягом додаткових 5 годин. Після охолоджування до кімнатної температури реакційну суміш розподіляли між водою і діетиловим ефіром. Ефірний шар промивали водою, сушили над сульфатом магнію та випарювали у вакуумі, одержуючи продукт (сполука 88) у вигляді рудувато
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel compounds with analgesic action
Назва патенту російськоюНовые соединения с аналгезивным действием
МПК / Мітки
МПК: C07D 211/70, C07D 409/06, A61K 31/661, A61K 31/443, A61K 31/4427, C07D 211/46, C07D 211/22, C07D 405/06, C07F 9/59, A61K 31/4709, C07D 401/06, A61K 31/4409, A61K 31/4436, A61P 29/00
Мітки: основі, спосіб, композиція, піперидину, отримання, аналгезивною, похідні, фармацевтична, дією
Код посилання
<a href="https://ua.patents.su/35-65552-pokhidni-piperidinu-z-analgezivnoyu-diehyu-sposib-kh-otrimannya-ta-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Похідні піперидину з аналгезивною дією, спосіб їх отримання та фармацевтична композиція на їх основі</a>
Попередній патент: Спечений виріб з матеріалу на основі нітриду алюмінію та спосіб його виготовлення
Наступний патент: Спосіб розробки високого уступу
Випадковий патент: Спосіб комбінованої періодичної правки