Спосіб визначення функціональної активності популяції мікроводоростей chlorella vulgaris
Номер патенту: 75320
Опубліковано: 17.04.2006
Автори: Мацківський Володимир Іванович, Чернишов Сергій Іванович, Болдижева Тетяна Вікторівна
Формула / Реферат
1. Спосіб визначення функціональної активності популяції мікроводоростей Chlorella vulgaris, який включає відбір проби, поміщення її до термостатованої мікрокамери цитофлуориметра, освітлення проби світлом заданої інтенсивності та спектрального складу, вимір інтенсивності флуоресценції хлорофілу а клітин мікроводоростей, які ідентифікуються оператором шляхом сканування об'єктива фотоелектронного вимірювача світла за площиною мікрокамери із заданим розміром ділянки, що фотометрується, та подання результатів із наступною оцінкою функціональної структури популяції за вибраним критерієм, який відрізняється тим, що додатково вимірюють інтенсивність збуджуючого світла, а інтенсивність флуоресценції вимірюють двічі: в максимумі індукції при низькій, в границях від 0,5 до 2,0 Вт/м2, та насичуючій, в границях від 50 до 100 Вт/м2, інтенсивностях світла за результатами яких обчислюють величину ефективності первинних реакцій фотосинтезу за формулою
![]() ,
,
де ![]() - ефективність фотосинтезу (відн. од.);
- ефективність фотосинтезу (відн. од.);
![]() та
та ![]() - інтенсивність слабкого світла та світла що насичує, відповідно, Вт/м2;
- інтенсивність слабкого світла та світла що насичує, відповідно, Вт/м2;
![]() та
та ![]() - інтенсивність максимумів індукції флуоресценції при слабкому світлі та світлі, що насичує (ум. од.), які використовуються як критерій визначення функціональної активності мікроводоростей Chlorella vulgaris в популяції.
- інтенсивність максимумів індукції флуоресценції при слабкому світлі та світлі, що насичує (ум. од.), які використовуються як критерій визначення функціональної активності мікроводоростей Chlorella vulgaris в популяції.
2. Спосіб визначення функціональної активності популяції мікроводоростей Chlorella vulgaris за п. 1, який відрізняється тим, що вимір флуоресценції мікроводоростей Chlorella vulgaris проводять при безперервному освітленні кювети світлом низької інтенсивності, а повторні виміри флуоресценції при інтенсивностях насичуючого світла, ведуть шляхом освітлення камери протягом 1-3 сек., при цьому інтервали між освітленнями встановлюють в границях від 5 до 60 сек.
Текст
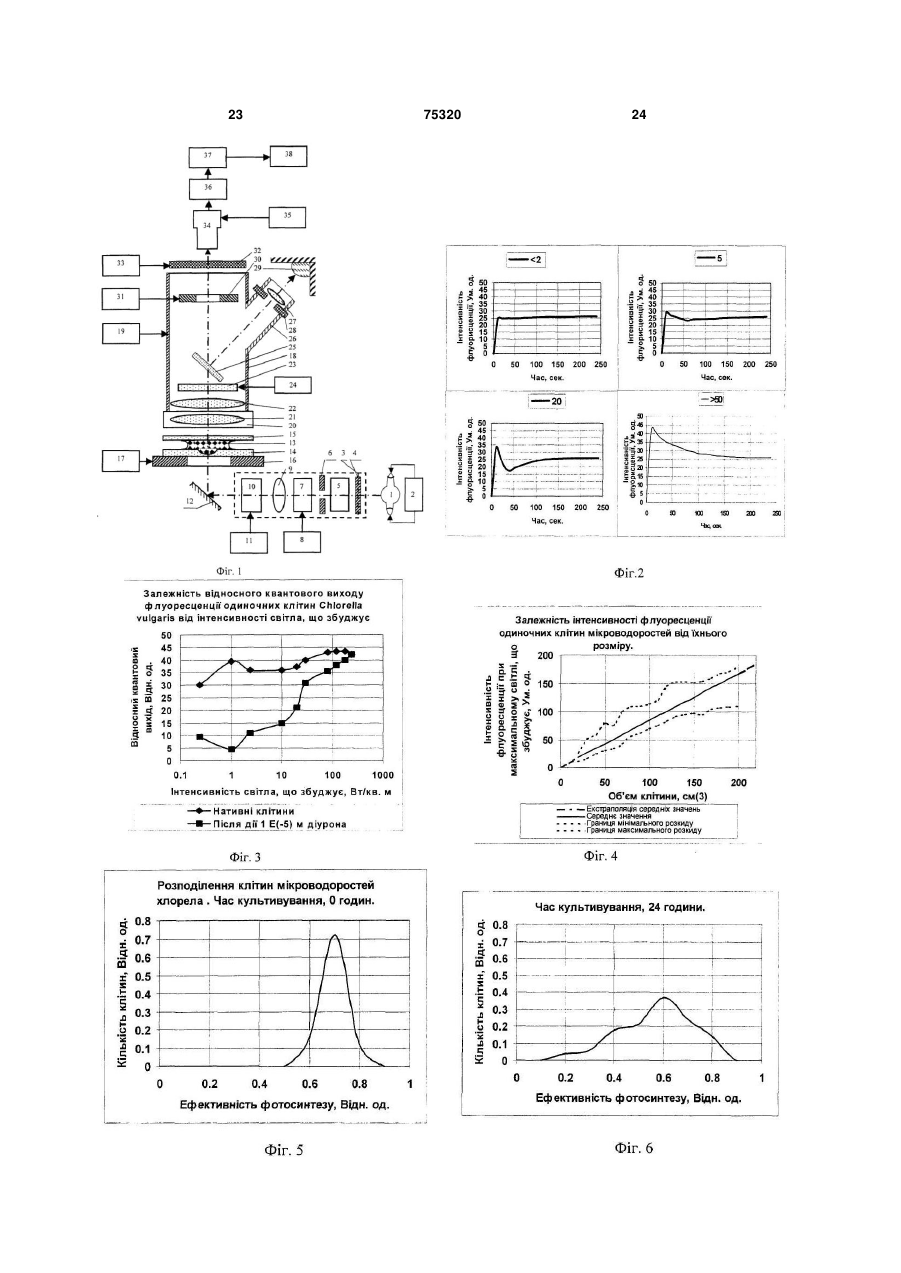
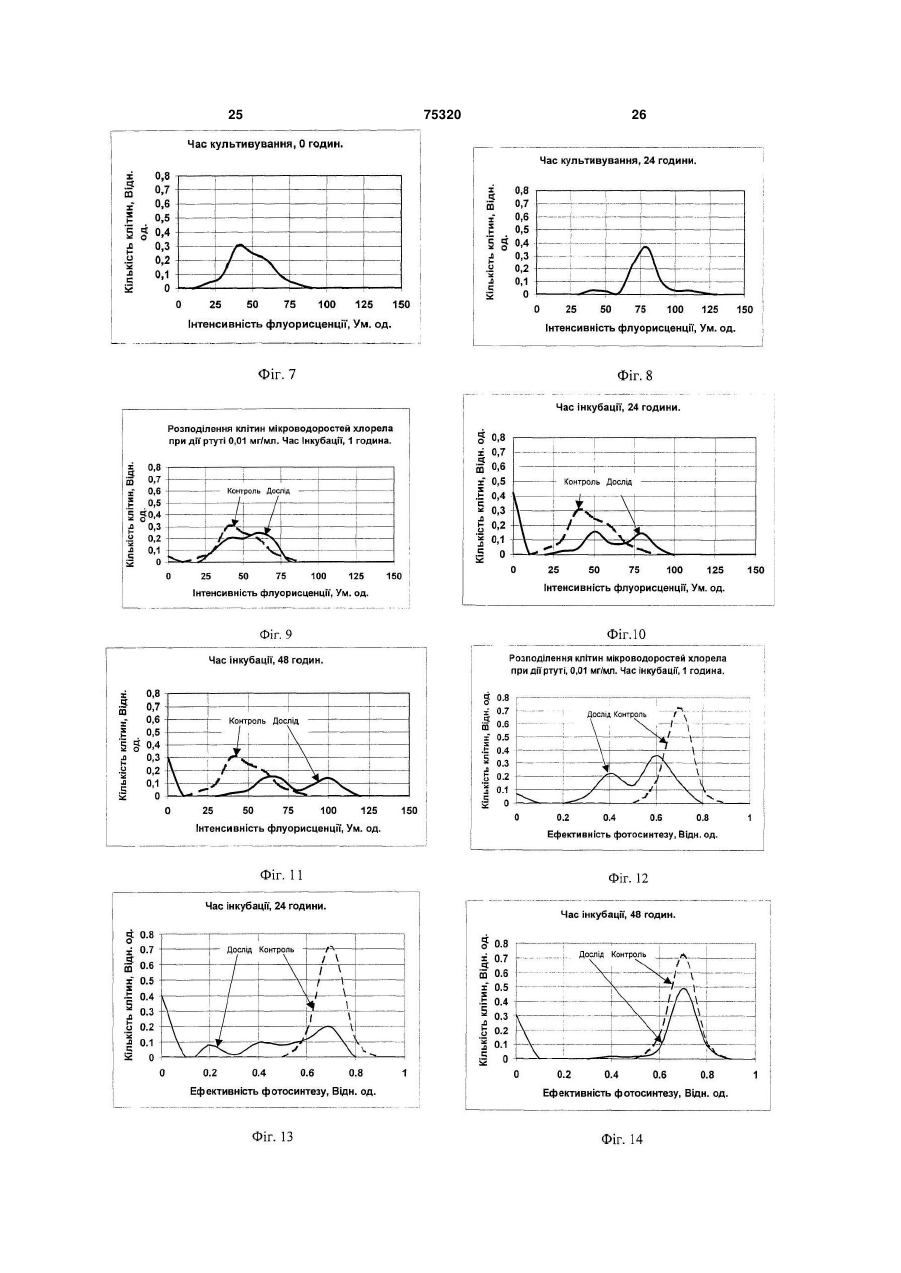
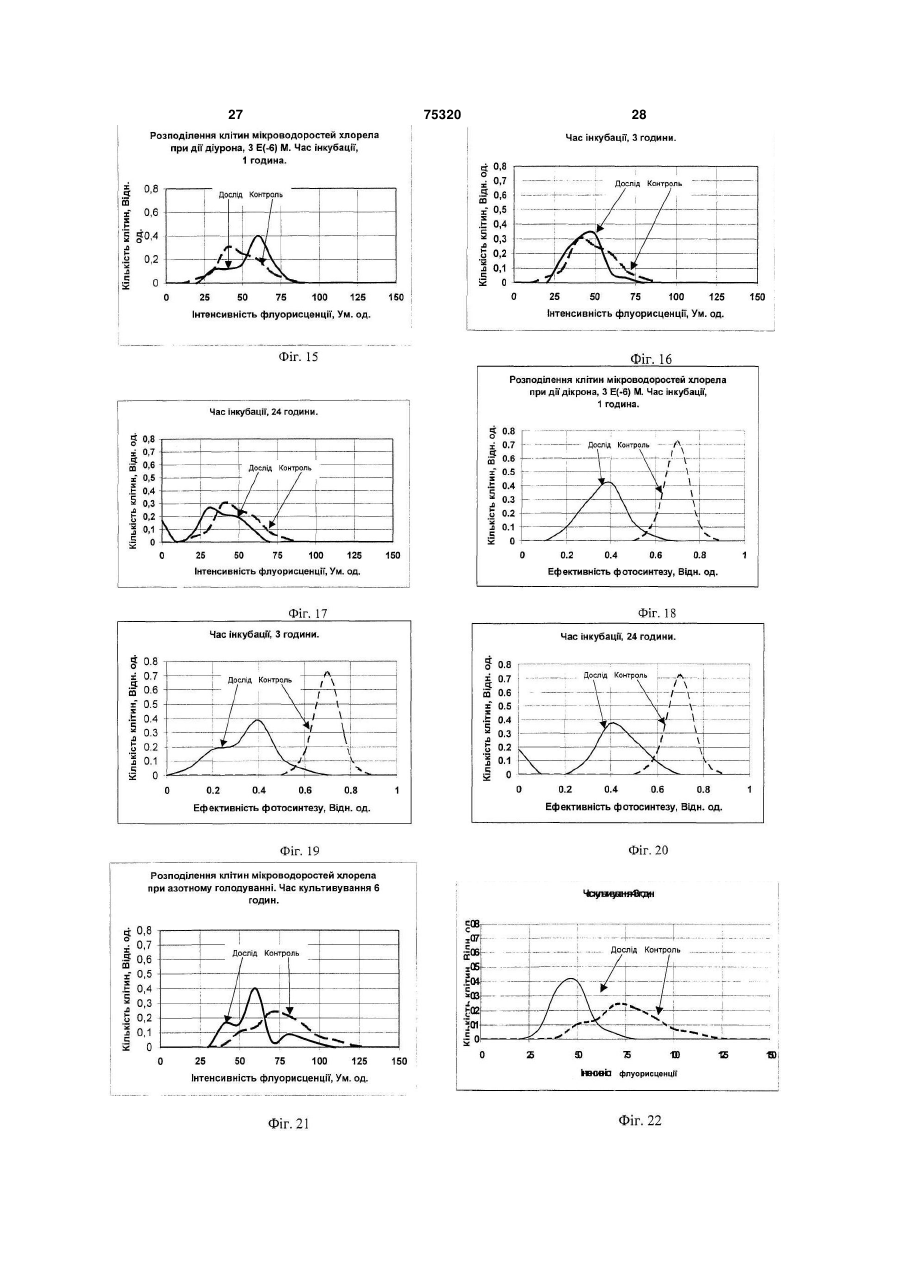
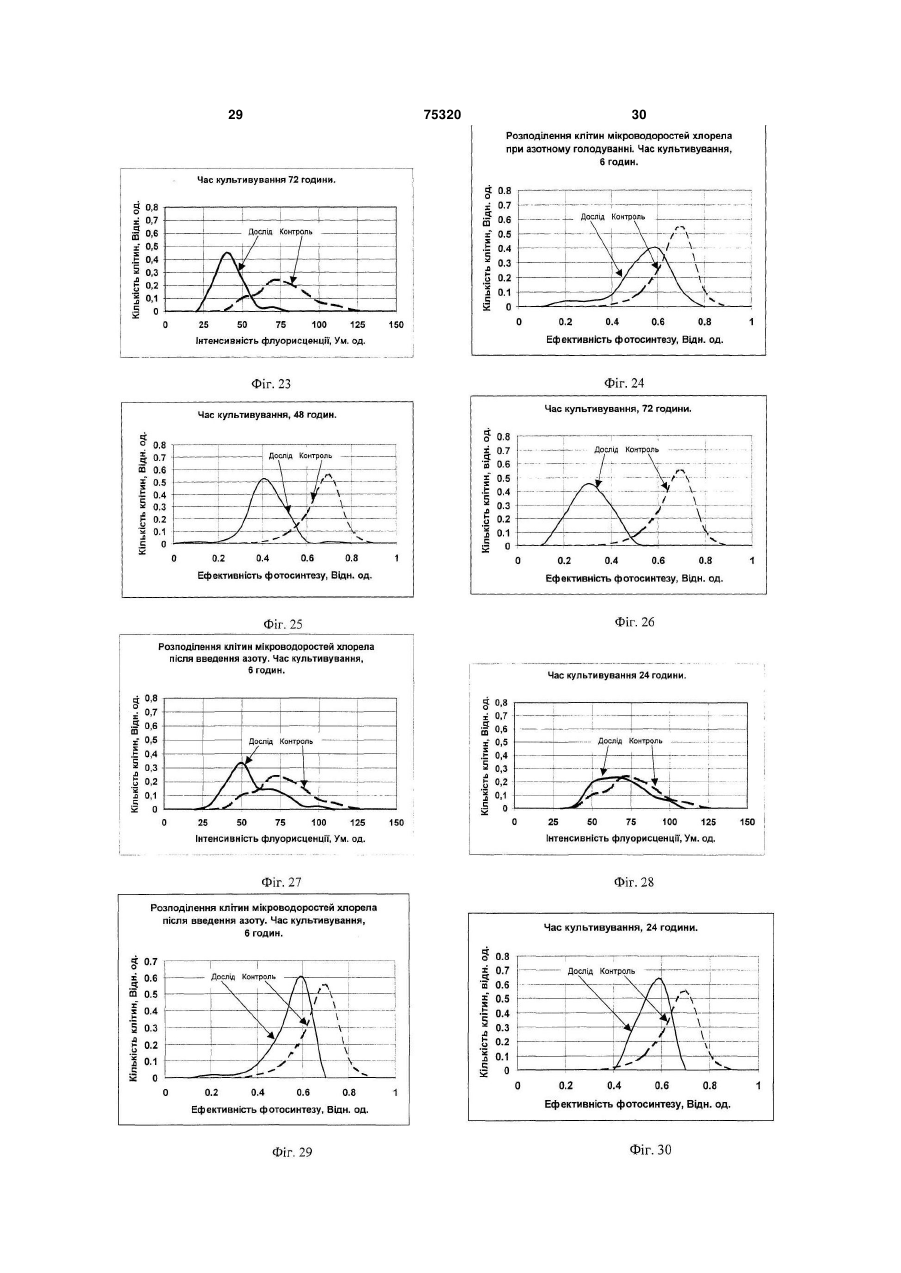
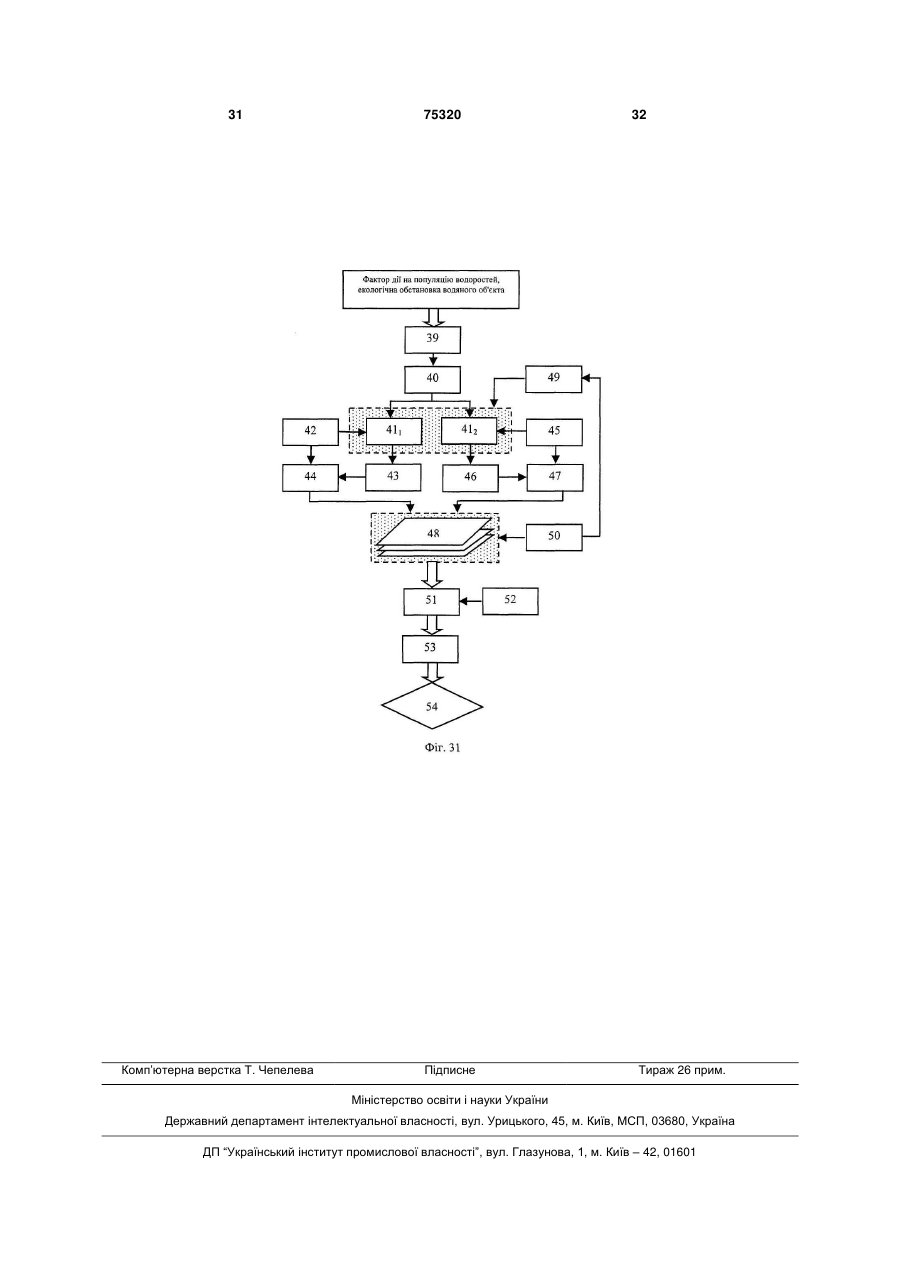
1. Спосіб визначення функціональної активності популяції мікроводоростей Chlorella vulgaris, який включає відбір проби, поміщення її до термостатованої мікрокамери цитофлуориметра, освітлення проби світлом заданої інтенсивності та спектрального складу, вимір інтенсивності флуоресценції хлорофілу а клітин мікроводоростей, які ідентифікуються оператором шляхом сканування об'єктива фотоелектронного вимірювача світла за площиною мікрокамери із заданим розміром ділянки, що фотометрується, та подання результатів із наступною оцінкою функціона льної структури популяції за вибраним критерієм, який відрізняється тим, що додатково вимірюють інтенсивність збуджуючого світла, а інтенсивність флуоресценції вимірюють двічі: в максимумі індукції при низькій, в границях від 0,5 до 2,0Вт/м2, та насичуючій, в границях від 50 до 100Вт/м2, інтенсивностях світла за результатами яких обчислюють величину ефективності первинних реакцій фотосинтезу за формулою Запропонований винахід відноситься до способів контролю функціонального стану мікроводоростей Chlorella vulgaris при рішенні задач біотестування та оцінки токсичності водяного середовища, як в лабораторних умовах, так і в природному середовищі та може бути використа ний, зокрема при формуванні регламенту контролю біомоніторингу. Відомий спосіб кількісної реєстрації інтенсивності флуоресценції мікроскопічних препаратів [1], згідно якого здійснюють відбір проби клітин з популяції, вводять її до вимірювальної камери на предметне скло (покрівне скло не обов'язкове) 1 I1 Ф2 , I2 Ф1 (13) 75320 (11) (19) UA - ефективність фотосинтезу (відн. од.); I1 та I2 - інтенсивність слабкого світла та світла що насичує, відповідно, Вт/м2; Ф1 та Ф2 - інтенсивність максимумів індукції флуоресценції при слабкому світлі та світлі, що насичує (ум. од.), які використовуються як критерій визначення функціональної активності мікроводоростей Chlorella vulgaris в популяції. 2. Спосіб визначення функціональної активності популяції мікроводоростей Chlorella vulgaris за п.1, який відрізняється тим, що вимір флуоресценції мікроводоростей Chlorella vulgaris проводять при безперервному освітленні кювети світлом низької інтенсивності, а повторні виміри флуоресценції при інтенсивностях насичуючого світла, ведуть шляхом освітлення камери протягом 1-3сек., при цьому інтервали між освітленнями встановлюють в границях від 5 до 60сек. C2 де 3 75320 4 предметного столику флуоресцентного мікроскоДо недоліків способа - прототипу необхідно пу, мікроскопіювання проби, опромінювання збувіднести: джуючим світлом, в заданому діапазоні спектру, - тривалість проведення дослідів при оцінці вимір інтенсивності флуоресценції нативного функціональної структури популяції мікровосвітіння клітин, що містять хлорофіл, у певній доростей; частині спектру, за яким визначають ступінь жит- відсутність комплексності оцінки як функціотєдіяльності клітин. До недоліків цього способу нальної характеристики параметрів життєдіяльслід віднести: ності клітин, що фотосинтезують, як на рівні її - неможливість виміру інтенсивності флуореенергетичної підсистеми - ефективності первинсценції та вмісту хлорофілу в одиничній клітині них реакцій фотосинтезу, так і структурної - вмісмікроводорості для оцінки стану популяції; ту хлорофілу в одиночних клітинах з урахуванням Відомий також спосіб оцінки рівню припустиїхнього розподілення в просторі та часі при дії мих дій пошкоджуючого фактору на організми, що факторів зовнішнього середовища. фотосинтезують [2], згідно якого з лабораторної У основу винаходу поставлена задача ствокультури мікроводоростей відбирають пробу для рити спосіб контролю функціональної структури оцінки їхнього стану. Контроль функціонального популяції мікроводоростей за показниками ефекпоказника водоростей здійснюють шляхом виміру тивності фотосинтезу та вмісту хлорофілу в одиповільної флуоресценції, яку визначають протяночних клітинах з використанням статистичних гом заданого часу з отриманням кривої індукції. методів обробки розподілень в умовах дії зовнішЕфективність фотосинтезу розраховують у виніх факторів в реальному масштабі часу. гляді різниці максимуму індукції та стаціонарного Технічний результат, що може бути отримарівню, який визначається через 3... 5 хвилин з ний при здійсненні винаходу полягає в тому, що моменту опромінювання клітин збуджуючим світз'являється можливість здійснити оперативний лом. Інтенсивність збуджуючого світла, встановконтроль стану популяції одноклітинних мікроволюють за величиною, яку знаходять із світлової доростей Chlorella vulgaris шляхом вимірювання залежності, а саме, на її плато. Показник ефектилюмінесцентних характеристик одиничних клітин, вності фотосинтезу оцінюють у відносних одиниза якими визначаються ефективності первинних цях у вигляді відношення стадій фотосинтезу та вмісту хлорофіла водоростей. дослід 1 Поставлена ціль досягається тим, що у відоконтроль мому способі визначення функціональної струкВ даному способі передбачений проточний тури популяції мікроводоростей Chlorella vulgaris, режим виміру, коли суспензія клітин безперервно який включає відбір проби, поміщення її до терпрокачується через вимірювальну камеру із помостатованої мікрокамери цитофлуориметра, верненням її до початкової ємності, у якій здійсосвітлення проби світлом заданої інтенсивності нюють інкубацію водоростей з токсикантом, що та спектрального складу, з виміром інтенсивності досліджується. флуоресценції хлорофілу а клітин мікроводоросНедоліками способа є: тей Chlorella vulgaris, які ідентифікуються опера- неможливість контролю функціональної тором, шляхом сканування об'єктива фотоелектструктури популяції одноклітиних мікроводоросронного вимірювача світла по площині тей з використанням методів статистичного анамікрокамери із заданим розміром ділянки, що лізу, так як в способі реалізований контроль сефотометрується, та поданні результатів із настуредніх величин флуоресценції водоростей за пною оцінкою функціональної структури популяції всією сукупністю клітин популяції; за обраним критерієм, згідно винаходу, вимірю- відсутність комплексності оцінки як функціоють інтенсивність збуджуючого світла, а інтенсинальної характеристики параметрів життєдіяльвність флуоресценції вимірюють двічі: в максиності клітин, що фотосинтезують, як на рівні її мумі індукції при низькій, в границях від 0,5 до енергетичної підсистеми - ефективності первин2,0Вт/м2, та, що насичує, в границях від 50 до них реакцій фотосинтезу, так і структурної - вміс100Вт/м2, інтенсивностях світла, за результатами ту хлорофілу в одиночних клітинах з урахуванням яких обчислюють величину ефективності первинїхнього розподілення в просторі та часі при дії них реакцій фотосинтезу, які використовуються в факторів зовнішнього середовища. якості критерію функціональної активності мікроНайбільш близьким до запропонованого споводоростей Chlorella vulgaris в популяції. собу, обраний прототипом є спосіб контролю фуНовим також є те, що виміри флуоресценції нкціональної структури популяції одиночноклімікроводоростей Chlorella vulgaris проводять при тинних водоростей [3], згідно якого у відомому безперервному освітлені кювети світлом низької способі здійснюють відбір проби, розміщують її у інтенсивності, а повторний вимір флуоресценції термостатованій мікрокамері цитофлуориметра, при інтенсивностях насичуючого світла, ведуть освітлюють проби світлом заданої інтенсивності шляхом засвітлення камери на протязі 1...3сек., та спектрального складу, вимірюють інтенсивпри цьому інтервали між засвітленнями встановність флуоресценції хлорофілу клітин мікроводолюють в границях від 5 до 60сек. ростей, які ідентифікуються оператором, шляхом В даний час розроблені флюорометричні месканування об'єктива фотоелектронного вимірютоди досліду, які дозволяють оцінювати ефективвача світла по площині мікрокамери з заданим ність первинних фотосинтетичних реакцій росрозміром ділянки фотометрування, та поданні линного організму [4, 8]. Інтенсивність результатів із наступною оцінкою функціональної флуоресценції хлорофілу фотосинтетичного апаструктури популяції за обраним критерієм. 5 75320 6 рату клітини залежить від стану, в якому знахоничної клітини водорості Chlorella vulgaris були диться реакційний центр II фотосистеми. Найвиконані виміри флуоресценції при збуджені світбільш часто оцінку ефективності роботи фотосилом, що значно відрізняється за інтенсивністю. нтетичного апарату проводять за співставленням Проведені експерименти показали можлиінтенсивностей флуоресценції в умовах, коли вість надійної реєстрації кривих індукцій флуоререакційні центри відкриті та закриті [6]. При цьому сценції від одиничних клітин мікроводоростей індукція флуоресценції - кінетична крива зміни Chlorella vulgaris Chlorella vulgaris, в широкому інтенсивності флуоресценції у відповідь на вмидіапазоні інтенсивностей світла. Індукційні криві кання світла, що збуджує, після тривалої темнеповністю відновлюються після 7 хвилин темневої вої адаптації рослинного об'єкту - дозволяє адаптації. На Фіг.2 подані характерні криві індукції отримати стан відкритих та закритих реакційних флуоресценції, отримані на одиночних клітинах. центрів та оцінити ефективність первинних стадій При цьому, в діапазоні від 2,0 до 50Вт/м2 фофотосинтезу [5]. Другим способом створення рма індукційних кривих різних клітин в значному умов, при яких реакційні центри закриті, є викоступені варіювала. Можна припустити, що ця різристання деяких похідних мочевини (наприклад, ниця зумовлена особливостями клітин в популямонурон або діурон), які блокують ланцюг фотоції. Очевидно, поглиблений аналіз індукційних синтетичного електронного транспорту [7]. В кривих флуоресценції дозволяє отримати інфорцьому випадку використовують відношення інтемацію про ефективність первинних процесів фонсивностей стаціонарних рівнів флуоресценції тосинтезу в одиночній клітині. Однак, необхідхлорофілу нативних та оброблених інгібітором ність проведення темрявної адаптації (не менше рослинних клітин. Цей метод використовували 7 хвилин) приводить до того, що час одного вимідля оцінки стану фотосинтетичного апарату суру перевищує 10 хвилин. Ця обставина ускладспензій одноклітинних водоростей [5, 22, 23]. Однює швидкий набір статистично достовірних ренак, ці методи не можна використовувати для зультатів. дослідження стану фотосинтетичного апарату Таким чином, оцінка ефективності функціонуодиночних клітин водоростей. Це зумовлено невання фотосинтетичного апарату клітини за індуобхідністю фіксації місця знаходження кожної кцією флуоресценції не відповідає поставленим клітини в нативному препараті. Але надійна фіквимогам. Крім того, такий аналіз ускладнений сація препарату без порушення його активності, великою варіабельністю індукційних кривих від особливо в умовах проточної камери, необхідної клітини до клітини та труднощами вибору критедля введення інгібітору, є практично неможливою рію форми. задачею. В той же час аналіз літературних даних Слід відмітити, що в умовах збудження флювказує на те, що вимір флуоресценції є найбільш оресценції малими ( 2,0Вт/м ) та великими зручним та інформативним методом оцінки стану (>50Вт/м2) інтенсивностями світла, всі клітини, одиничних клітин [3]. що досліджувалися, давали східну індукційну Враховуючи, що до цього часу не розроблені відповідь. Аналіз кривих індукції флуоресценції методичні прийоми об'єктивної оцінки ефективпри малому ( 2,0Вт/м2) та великому ( 50Вт/м2) ності первинних реакцій фотосинтезу одиничної світлі, що збуджує, вказує на можливість іншого клітини мікроводоростей Chlorella vulgaris, для підходу до оцінки ефективності первинних стадій оцінки стану всієї популяції, необхідно розглянути фотосинтезу одиночної клітини водорості. При можливості статистичних методів обробки імпенизьких інтенсивностях світла, що збуджує, 2 ричних даних функціональних характеристик ( 2,0Вт/м ) перемінна фаза в індукції флуоресодиничних клітин, що фотосинтезують, розподіценції практично відсутня. Очевидно, це відбувалених в просторі та часі, та адаптацію флюороється в зв'язку з тим, що таке мале завантаження метричних методів оцінки функціональної активелектротранспортного ланцюгу залишає практиності фотосинтетичного апарату одиничних чно всі реакційні центри відкритими (умови мініклітин водорості для оцінки стану популяцій мікмального тушіння флуоресценції хлорофілу за роводоростей Chlorella vulgaris при різних умовах рахунок електронного транспорту), а іонні потоки, культивування та дій хімічних факторів для оцінки що зв'язані з електронним транспортом, недостатоксичного ефекту. тні для виміру трансмембранних потенціалів, що Найбільш адекватним апаратом математичвпливають на квантовий вихід флуоресценції ного моделювання позначених процесів є теорія [16, 20]. біфуркацій дисипативних структур [4]. Разом з Інтенсивності збуджуючого світла, які наситим, корисними можуть виявитись й більш ордичують фотосинтез, ( 50Вт/м2) приводять до станарні засоби обробки обчислювальної інформану, коли максимальний рівень флюоресценції на ції, включаючи апроксимацію тригонометричними індукційній кривій відповідає створенню умов рядами функцій розподілення із наступним виявпрактично повної відсутності тушіння за рахунок ленням часової організації популяції мікроводоелектронного транспорту (закриті реакційні ростей Qalorella vulgaris, а також виявлення зацентри), а градієнти потенціалів на мембрані ще лежностей відповідних градієнтів від параметрів не сформувались та змін в системі міграції енеротриманих розподілень в конкретних задачах гії між фото системами ще не відбулося. Пода[10, 14]. льше зниження інтенсивності флуоресценції на Для вияснення можливості використання заіндукційній кривій, очевидно, зумовлене адапталежності люмінесценції від інтенсивності освітційними змінами фотосинтетичного апарату рослення, а також кривих індукції флуоресценції, у линної клітини до високої інтенсивності збуджуювизначенні стану фотосинтетичного апарату одичого світла. 7 75320 8 З розгляду кривих індукції флуоресценції при рофілу фотосинтетичного апарату. Слід відмітималій та великій інтенсивності збуджуючого світлі ти, що виміри, які проводили на малій інтенсиввипливає, що їхнє співставлення може дати інності світла не впливають на форму індукційної формацію про стан електротранспортного ланкривої, яку отримуємо слідом при великій інтенцюгу фотосинтезу, який визначає ефективність сивності світла. первинних процесів утилізації світла клітиною. Для перевірки спроможності запропонованої Для вибору необхідних умов виміру була досліметодики були проведені експерименти з співсджена залежність відношення інтенсивності флутавленням середніх значень квантової ефективоресценції до інтенсивності світла, (при постійності фотосинтезу в групах по 30...50 клітин та ному поглинанні об'єктом світла - це відношення значень цього ж параметру, що виміряний на відповідає квантовому виходу флуоресценції) від суспензії ( сусп.) з використанням діурона [23]. інтенсивності збуджуючого світла, Виміри інтенРозрахунок сусп. проводили за формулою: сивності люмінесценції проводили за її максимаІсусп. (2) сусп . 1 льним рівнем на кривій індукції. Ісусп. ДСМІ На Фіг.3 подані світлові криві квантового виде Іс/Іс+Д - відношення інтенсивностей флуоходу флуоресценції, які побудовані для нативних ресценції сусупензії клітин в нативному стані та клітин та клітин, що оброблені діуроном. При випісля додавання діурона. сокій інтенсивності світла, що збуджує, квантовий Виміри були проведені на клітинах як в станвихід флуоресценції фотосинтетичного апарату дартних умовах культивування, так і при різних клітин із заблокованим діуроном електронним діях. Отримані дані показують наявність лінійної транспортом та нативних клітин порівнюються. кореляції (з коефіцієнтом кореляції 0,86). Такий Це вказує на те, що при дії світла високої інтенвисокий коефіцієнт кореляції вказує на те, що сивності досягається насичення швидкостей фоспосіб, який пропонується, для оцінки ефективтосинтетичних реакцій та практично повністю ності первинних стадій фотосинтезу для одиничвідновлюється первинний акцептор фотосистеми них клітин Chlorella vulgaris є досить задовільним II. При низькій інтенсивності світла, квантовий та може бути використаний для визначення стану вихід флуоресценції істотно нижче для нативних популяції. У зв'язку з високим відтворенням меклітин, ніж для клітин, оброблених діуроном. тоду (час вимірів на одній клітині - менше 2 хвиВелике відхилення від середніх значень квалин) при досить великих виборках він може давантового виходу флуоресценції в області середніх ти статистично достовірні результати. інтенсивностей світла, пов'язано, очевидно, з Перевагою мікрофлуорисцентного методу є індивідуальними особливостями клітин, що проможливість одночасного виміру-вмісту хлорофілу являється у варіабельності форми кривих індукції в клітині. Це можливо у зв'язку з тим, що інтенсифлуоресценції. Відносно мале відхилення від вність флуоресценції при закритих центрах (в середніх значень квантових виходів флуоресценданому випадку - максимальний рівень флуоресції в областях відповідних інтенсивності світла, 2 2 ценції при високій інтенсивності світла) пропорщо дорівнює 0,7Вт/м та 140Вт/м дозволила виційна вмісту хлорофілу а в II фотосистемі [19, 21]. коритовувати їх для оцінки ефективності первинЯкщо припустити, що відношення компонентів них стадій фотосинтезу. Оцінку ефективності пігментного апарату ФС-І та ФС-ІІ, а також хлопервинних реакцій фотосинтезу на одиничній рофілів а та в - залишається постійним, то інтенклітині водорості проводили за виміром інтенсивсивність флуорисценції повинна бути пропорційності флуоресценції в умовах відкриття та зана вмісту хлорофілів в клітині [15]. Данні, криття реакційних центрів та співставленню відотримані при вивчені відношення інтенсивності ношення інтенсивностей флуоресценції та світла, флуоресценції окремих клітин та їхнього об'єму що збуджує. (див. Фіг.4) вказує на наявність лінійної кореляції Таким чином, були обрані умови виміру ефе(з коефіцієнтом кореляції 0,83), де також показані ктивності первинних стадій фотосинтезу за співспунктирними лініями інтервали розкиду эксперитавленням квантових виходів флуоресценції при 2 ментальних даних. З Фіг.4 бачимо, що розкид збуджені світлом інтенсивністю 0,7Вт/м та ефективності первинних реакцій фотосинтезу 140Вт/м2. Розрахунок цього параметру можна істотно залежить від об'єму клітин, та на цей біопроводити за формулою: логічний феномен ще треба відповісти в майбутI1 Ф2 1 (1) ньому, а поки ми можемо його інтерпретувати як I2 Ф1 наявність гетерогенності клітин в популяції. де η - ефективність фотосинтезу (Відн. од.); Таким чином, в результаті проведеного досІ1, І2 - інтенсивність флуоресценції (Ум. од.) ліду та з літературних джерел [3, 6, 9] нами був при збуджені клітини при інтенсивностях світла розроблений метод визначення ефективності Ф1=0,7Вт/м2, Ф2=140Вт/м2' первинних стадій фотосинтезу та вмісту хлороПри η=0 фотосинтетичний транспорт електфілу в одиночних клітинах водорості Chlorella ронів повністю блокований, а прямування η до vulgaris за виміром інтенсивності флуоресценції одиниці вказує на високу ефективність первинних при збуджені її світлом різної інтенсивності. стадій фотосинтезу. Додаткове вимірювання інтенсивності світла, Таким чином, відносно прості виміри інтенсизабезпечує підвищення точності оцінки функціовності флуоросценції клітини мікроводорості при нальної структури популяції, за рахунок урахумалій та великій інтенсивності світла за максивання помилок, пов'язаних із нестабільністю джемальним значенням інтенсивності флуоресценції рел світла. Крім того, знання величини дозволяють визначити функціональний стан хло 9 75320 10 інтенсивності світла, необхідне для обчислення вимогами затемнення в лабораторії, що веде до величини ефективності первинних реакцій фотонезручності проведення дослідів, стомленості синтезу (див. формулу 1), що характеризує енероператора. гозабезпеченість клітини. Цей показник є важлиВстановлення границі інтенсивності світла вим параметром в оцінці функціональної що насичує в границях від 50,0 до 100Вт/м , заструктури популяції мікроводоростей Chlorella безпечує підвищення точності виміру, так як при vulgaris, так як розвиток організму, швидкість його інтенсивностях світла нижче 50Вт/м2 спостерігарозмноження, стійкість до несприятливих дій у ється невідповідність квантових виходів флуорепереважаючій більшості випадків прямо пов'язасценції максимуму індукції флуоресценції, коли на з його енергозабезпеченістю. Порушення в всі реакційні центри фотосистеми II повністю засистемі енергозабезпечення завжди пагубні для чинені. Використання світла з інтенсивністю вище організму та часто виявляються головною причи100Вт/м2 призводить до фотодеструкції фотосинною зсувів екологічної рівноваги, що спостерігатетичного апарату мікроводоростей, що призвоються. дить до додаткових помилок, які мають динамічВимірювання інтенсивності флуоресценції ний характер. двічі в максимумі індукції при низькій та насичуюОбчислення величини ефективності первинчій інтенсивностях світлах забезпечує скорочення них реакцій фотосинтезу, за формулою (1) затривалості аналізу у порівнянні із відомими метобезпечує підвищення точності визначення ефекдами оцінки фотосинтетичної активності мікровотивності первинних реакцій фотосинтезу, так як доростей за індукцією флуоресценції [5], або за будь-яка зміна ефективності первинних процесів діурон стимульованого збільшення стаціонарного фотосинтезу призводить до зміни квантових вирівня флуоресценції [7]. Це відбувається за рахуходів флуоресценції [6]. Крім того, обчислення нок ліквідації необхідності витрат часу на темнеефективності фотосинтезу за формулою (1) дову адаптацію водоростей та на закінчення повнозволяє вилучити помилки, які пов'язані із варіаго процесу індукційного переходу, а також за бельністю вмісту хлорофілу а в клітині водорості, рахунок вилучення необхідної процедури промитак як Ф1 та Ф2 пропорційні кількості хлорофілу а вки камери, що виникає у випадку використання в клітині [15]. діурона в аналізах. При умовах збудження флуоВикористання в якості критерію функціональресценції малими (менше 2,0Вт/м2) та великими ної активності первинних реакцій фотосинтезу в інтенсивностями світла, (більше 50,0Вт/м2) споокремій клітині та спосіб його визначення, що стерігали індукції флуоресценції, які відновлюпропонується, відповідає критерію винаходу "ноються, що важливо для підвищення точності оцівизна". Відомі технічні рішення [9], в яких вимінки. рюють флуоресценцію кожної клітини за допомоДля визначення ефективності первинних гою цитофлуориметрів, проточних лазерних процесів фотосинтезу за результатами виміру аналізаторів мікрочастин, діфрактометрах та т.п. інтенсивності флуоресценції необхідно знати Однак, ці технічні рішення не дозволяють визнаквантовий вихід флуоресценції у двох станах чити функціональну структуру популяції мікровофотосинтетичного апарату: коли всі реакційні доростей за показником ефективності первинних центри фотосистеми II повністю відчинені; та процесів фотосинтезу. Це дозволяє зробити виколи всі вони повністю зачинені. Нами встановсновок про відповідність технічного рішення, що лено, що квантові виходи флуоресценції в макзаявляється, критерію "істотні різниці", так як при симумах індукційних переходів при збуджені ницьому досягається та реалізується можливість зькими або інтенсивностями світла, що визначення функціональної структури популяції насичують, відповідно дорівнюють квантовим мікроводоростей Chlorella vulgaris. виходам флуоресценції мікроводоростей Розглянемо далі вищевказані ознаки у частиChlorella vulgaris, коли у них всі реакційні центри ні, що відрізняється, згідно формули винаходу. фотосистеми II повністю відчинені та зачинені Безперервне освітлення кювети з клітинами (наприклад, при інгибіюванні електронного транмікроводоростей Chlorella vulgaris світлом низької спорту діуроном)/ Тому виміри максимумів індукінтенсивності забезпечує скорочення тривалості ції флуоресценції при двох світлових режимах є проведення досліду, так як при цьому всі клітини принципово необхідними для досягнення поставв популяції знаходяться в однакових умовах, а це леної цілі та рішення технічної задачі згідно визначить, що можна відразу робити виміри при находу, що розглядується. послідовному скануванні кювети. Підсвітлення Встановлення границі інтенсивності світла в кювети полегшує процес пошуку та ідентифікації границях від 0,5 до 2,0Вт/м2, забезпечує підвиклітин мікроводоростей Chlorella vulgaris, що тащення точності виміру, так як при інтенсивностях кож скорочує час проведення аналізу, при цьому світла вище 2,0Вт/м2 спостерігається невідповіду оператора знижується помилка неправильного ність квантових виходів флуоресценції максимувиміру та забезпечується можливість вибору рему індукції, коли всі реакційні центри фотосистепрезентативної вибірки для набору потрібної кіми II повністю відчинені, що збільшує помилку лькості даних при статистичному аналізі. виміру функціонального показника рослинної Повторний вимір флуоресценції при інтенсиклітини (ефективність фотосинтезу). Використанвностях світла, що насичує, ведуть шляхом засвіня світла з інтенсивністю менше 0,5Вт/м2 не дотлення камери на протязі 1...3сек. Це забезпечує цільно, так як при цьому знижується інтенсивність підвищення точності аналізу та скорочення часу флуоресценції, що випромінюється клітинами, та проведення досліду, так як за цей час всі реаквиникають труднощі її реєстрації, із підвищеними ційні центри фотосистеми II зачиняються та інду 11 75320 12 кція флуоресценції досягає свого максимального тей Chlorella vulgaris за показником інтенсивності значення. Засвітлення більше 3сек. не бажана, флуоресценції при дії ртуті, 0,01мг/л, час інкубатак як при цьому клітини в популяції, піддаються ції, 48 годин; світловій дії з рівнем, що перевищує фізіологічні на Фіг.12 - розподілення клітин мікроводоросграниці. Тривалість нижче 1сек. зумовлює підвитей Chlorella vulgaris за показником ефективності щення динамічної помилки за рахунок неповного фотосинтезу при дії ртуті, 0,01мг/л, час інкубації, закриття реакційних центрів фотосистеми II. 1 година; Встановлення інтервалу між двома засвітна Фіг.13 - розподілення клітин мікроленнями в границях від 5 до 60сек., забезпечує водоростей хлорела за показником ефективності підвищення точності визначення та скорочення фотосинтезу при дії ртуті, 0,01мг/л, час інкубації, проведення аналізу, так як за цей час відбуваєть24 години; ся повне повертання клітин мікроводоростей на Фіг.14 - розподілення клітин мікроводоросChlorella vulgaris до стану адаптації до низького тей Chlorella vulgaris за показником ефективності світла. При часі менше 5сек. в клітинах можуть фотосинтезу при дії ртуті, 0,01мг/л, час інкубації, накопичуватись зміни, які пов'язані з дією спала48 годин; хів світла, що насичує, що тягне за собою підвина Фіг.15 - розподілення клітин мікроводоросщення помилки оцінки функціонального стану тей Chlorella vulgaris за показником інтенсивності клітини. Часи більше 60сек. не доцільний, так як флуоресценції при дії діурона, 3-10-6, час інкубапри цьому істотно збільшується тривалість проції, 1 година; ведення всього аналізу, а це в свою чергу підвина Фіг.16 - розподілення клітин мікроводоросщує помилку виміру, яка пов'язана з обмеженістю тей Chlorella vulgaris за показником інтенсивності вимірювальної камери, ефектами пристінних флуоресценції при дії діурона, 3-10-6,час інкубаявищ, газообміну, втраті вологи та т.п. ції, 3 години; Таким чином, всі вищенаведені ознаки забезна Фіг.17 - розподілення клітин мікроводороспечують досягнення поставленої цілі, задовольтей Chlorella vulgaris за показником інтенсивності няють вимогам "істотні різниці". Не дотримання флуоресценції при дії діурона, 3-10-6, час інкубахоча б одного з пунктів частини формули винахоції, 24 години; ду, що заявляється, не дозволяє досягти точності на Фіг.18 - розподілення клітин мікроводоросаналізу, що вимагається та рішення поставленої тей Chlorella vulgaris за показником ефективності технічної задачі. фотосинтезу при дії діурона, 3-10-6, час інкубації, На Фіг.1 подана структурна схема пристрою 1 година; для визначення функціональної структури попуна Фіг.19 - розподілення клітин мікроляції мікроводоростей Chlorella vulgaris; водоростей хлорела за показником ефективності на Фіг.2 подані характерні криві індукції люміфотосинтезу при дії діурона, 3-10-6. Час інкубації, несценції одиночних клітин мікроводоростей 3 години; Chlorella vulgaris при різних інтенсивностях світна Фіг.20 - розподілення клітин мікроводоросла, що збуджує; тей хлорела за показником ефективності фотона Фіг.3 - світлова залежність квантового висинтезу при дії діурона, 3-10-6. Час інкубації, 24 ходу люмінесценції мікроводоростей Chlorella години; vulgaris, оброблених діуроном та стаціонарного на Фіг.21 - розподілення клітин мікроводоросрівню інтактних клітин; тей хлорела за показником інтенсивності флюона Фіг.4 подана залежність інтенсивності ресценції при азотному голодуванні. Час культифлуоресценції хлорофіла в рослинній клітині міквування, 6 годин; роводорості при інтенсивності світла, що насичує на Фіг.22 - розподілення клітин мікроводороста збуджує фотосинтез від об'єму клітин; тей за показником інтенсивності флуоресценції на Фіг.5 - розподілення клітин мікроводороспри азотному голодуванні. Час культивування, 48 тей Chlorella vulgaris за показником ефективності годин; фотосинтезу, час культивування, 0 годин; на Фіг.23 - розподілення клітин мікроводоросна Фіг.6 - розподілення клітин мікроводоростей Chlorella vulgaris за показником інтенсивності тей Chlorella vulgaris за показником ефективності флуоресценції при азотному голодуванні. Час фотосинтезу, час культивування, 24 години; культивування, 72 години; на Фіг.7 - розподілення клітин мікроводоросна Фіг.24 - розподілення клітин мікроводоростей Chlorella vulgaris за показником інтенсивності тей Chlorella vulgaris за показником ефективності флуоресценції, час культивування, 0 годин; фотосинтезу при азотному голодуванні. Час куна Фіг.8 -розподілення клітин мікроводоросльтивування, 6 годин; тей Chlorella vulgaris за показником інтенсивності на Фіг.25 - розподілення клітин мікроводоросфлуоресценції, час культивування, 24 години; тей Chlorella vulgaris за показником ефективності на Фіг.9 - розподілення клітин мікроводоросфотосинтезу при азотному голодуванні. Час кутей Chlorella vulgaris за показником інтенсивності льтивування, 48 годин; флуоресценції при дії ртуті, 0,01мг/л, час інкубана Фіг.26 - розподілення клітин мікроводоросції, 1 година; тей Chlorella vulgaris за показником ефективності на Фіг.10 - розподілення клітин мікроводоросфотосинтезу при азотному голодуванні. Час кутей Chlorella vulgaris за показником інтенсивності льтивування, 72 години; флуоресценції при дії ртуті, 0,01мг/л, час інкубана Фіг.27- розподілення клітин мікроводоросції, 24 години; тей Chlorella vulgaris за показника інтенсивності на Фіг.11 - розподілення клітин мікроводоросфлуоресценції після введення азоту. Час культи 13 75320 14 вування, 6 годин; 31. Блок керування мікроотвором, в якому віна Фіг.28 - розподілення клітин мікроводоросдсутній датчик контролю інтенсивності світлового тей Chlorella vulgaris за показником інтенсивності потоку, що подається на предметний столик. флуоресценції після введення азоту. Час культи32. Шторка. вування, 24 години; 33. Блок керування положенням шторки. на Фіг.29 - розподілення клітин мікроводорос34. Фотоелектронний помножувач (ФЕП). тей Chlorella vulgaris за показником ефективності 35. Блок живлення ФЕП. фотосинтезу після введення азоту. Час культиву36. Попередній підсилювач електричного сигвання, 6 годин; налу від ФЕП. на Фіг.30 - розподілення клітин мікроводорос37. Блок обробки інформації. тей Chlorella vulgaris за показником ефективності 38. Блок виводу інформації та реєстрації. фотосинтезу після введення азоту. Час культивуРозглянемо декілька прикладів, що демонвання, 24 години; струють можливості способу, який пропонується. на Фіг.31 подано алгоритм реалізації способу Приклад 1 визначення функціональної структури популяції Аналіз розподілення клітин мікроводоростей мікроводоростей. Chlorella vulgaris при різних умовах культивуванСпосіб визначення функціональної структури ня (явище старіння культури). популяції мікроводоростей Chlorella vulgaris можВ якості об'єкта досліду були використані кліна реалізувати за допомогою вимірювального тини культури зеленої водорості Chlorella vulgaris, комплексу на базі флуоресцентного мікроскопа з термофільний штам. Аналогічно бактеріологічно деякою його модифікацією, структурна схема чисту культуру водорості зберігали на косяках якого подана на Фіг.1, де вказані: 2%-ого агаризованого середовища Тамія 1. Джерело світла, що збуджує флуоресцен(рН6,0...6,8) та зрощували в колбах в люміностаті ції. на повітрі при 37°С та освітлені 8Вт/м2. Через 2. Блок живлення для джерела світла. тиждень культуту клітин після розведення сере3. Блок формування освітлення біологічного довищем Тамія поміщали до культиватора, який об'єкта. барботується повітрям. Для забезпечення відт4. Колектор. ворення результатів досліду проводили через 24 5. Кювета для поглинання інфрачервоного години після введення до культиватора клітин в випромінювання. кінцевій кількості біля 106кл/мл. На початок вимі6. Діафрагми. рів кількість клітин складала 6 106кл/мл. Для 7. Світлофільтри для виділення необхідної створення умов азотного голодування клітин у ділянки спектра збудження. експоненціальній фазі зростання культури прово8. Керування світлофільтрами збудження. дили осідання центрифугуванням на протязі 15 9. Лінзи. хвилин при 3000g, після чого відмивали 2 рази 10. Запираючі світлофільтри (нейтральні). середовищем, яке не містило азоту, після чого 11. Блок керування інтенсивністю збуджуючоотриману суспензію поміщали до культиватора го світла. (люміностат) на таке ж сере-довище. 12. Поворотне дзеркало. Мікрофлуориметричні виміри проводили на 13. Проба біологічного об'єкта. флуоресцентному мікроскопі, Люмам Ρ-3, облад14. Предметне скло для формування "повінаним флуоресцентною фотометричною насадльної краплини". кою ФМЕЛ-1А. Система реєстрації ефективності 15. Покривне скло для припинення випаровуоб'єкту забезпечувала часове розв'язання біля вання проби. 0,5сек. Збудження флуоресценції клітин в препа16. Предметний столик. раті проводили галогеновою лампою накалюван17. Блок керування положенням предметного ня КГМ 9-70. Необхідний для збудження спектрастолика в 2-х координатах. льний інтервал спектру за допомогою скляного 18. Тубус мікроскопа. світлофільтру СЗС-22. Послаблення інтенсивно19. Механізм керування положення тубуса сті світла, проводили нейтральними світлофільт(вертикальна). рами. Максимальне значення інтенсивності світ20. Зрачок об'єктива. ла, складало біля 240Вт/м2. В якості початкового 21. Об'єктив. фільтра використовували скляний світлофільтр 22. Лінзи для фокусування на ФЕП відобраКС-16. Діаметр фотометричної ділянки (в площижених дзеркалом промінів. ні препарату при використанні об'єктиву 40х) 23. Світлофільтри для виділення ділянки спескладав біля 12мкм, що дозволяло реєструвати ктра флуоресценції від біологічного об'єкта. сигнал від однієї клітини водорості. Лінійні розмі24. Блок керування світлофільтрами флуорери клітин визначали за допомогою окулярсценції (їх положення та зміна). мікрометру. Розрахунок об'єму клітин проводили, 25. Відображуюче напівпрозоре дзеркалоприпускаючи їх форму сферичною. Для забезпедільник променя світла. чення нерухомості об'єкту використовували спе26. Окуляр. ціальну скляну камеру глибиною біля 5мкм. Вста27. Фокусуюча лінза. новлення однакового світлового потоку 28. Діафрагма. проводили за допомогою фотодіода ФД-2, який 29. Око оператора. знаходився в площині об'єктиву, що дозволило 30. Мікроотвір для регулювання величини стандартизувати умови збудження у всіх серіях світлового потоку флуоресценції. вимірів. 15 75320 16 Результати дослідів оброблювали статистичдить до відновлення фотосинтетичної можливосно [11, 12,13, 18]. ті водоростей. Виміри ефективності первинних процесів фоПри дії 10-2мг/мл HgCl2 через 3 години зментосинтезу та вмісту хлорофілу в одиночних клітишуються середні значення ефективності фотосинах хлорели показали, що клітини мають істотну нтезу та флуоресценція в максимумі індукції. При різницю за обома параметрами. Діапазон, в якоцьому подальше культивування до 48 годин приму можуть знаходитись живі клітини водоростей водить до поширення розподілення вказаних поза ефективністю фотосинтезу лежить від 0,83 до казників в 1,6 разів. На Фіг.9, 10 та 11 подані екс0,14, а відновний вміст хлорофілу від 18 до 150. периментальні дані виміру флуоресценції, а на Величина η, що дорівнює 0,83, близька до теореФіг.12, 13 та 14 - ефективності фотосинтезу, де тично максимальної ефективності функціонуванграфіки, які виділені пунктирною лінією відобраня фотосинтетичного апарату. жають контрольні проби. Ефективність фотосинВміст хлорофілу в клітинах хлорели, подітезу при цьому декілька вища, ніж у контрольних клітин. Одночасний вимір приросту біомаси в лення якої відбувається звичайно на 4 8 повинно суспензії показує швидке зниження чисельності відрізнятись приблизно в 10 разів. Таким чином, клітин водоростей в культурі. Приріст біомаси результати наших вимірів відповідають загальчерез 24 години в контролі майже в 10 разів пеним уявленням про гетерогенність клітин різновіревищує приріст біомаси в досліді. Це можна кової популяції даного виду водоростей. інтерпретувати як гибель популяції. Однак, наявМетодика оцінки ефективності первинних ність в суспензії ефективних клітин, що фотосинстадій фотосинтезу та вмісту хлорофілу, одиночтезують (навіть дуже незначна кількість) дозвоної клітини, дозволила провести аналіз структури ляє прогнозувати слідком за фазою пригнічення популяції за цими параметрами. Розподілення росту значне збільшення кількості клітин після клітин водоростей, зрощених в різних умовах, зняття навантаження за рахунок швидкого розмістотно відрізняються від Гаусового розподіленноження стійких до дії даного токсиканта осіб. ня. Про це говорять значення критерію 2, який Дійсно, деяке пригнічення росту популяції змінюслужить показником відповідності даного розпоється через 6 годин збільшенням вмісту хлорофіділення гаусонському [13]. лу в суспензії. Профіль розподілення клітин істотно змінюПриклад 3 ється у випадку варіювання умов зрощування Дослід змін у в функціональній структурі покультури. Культивування на протязі 24 годин на пуляції мікроводоростей при дії несприятливих середовище, що не викликає дефіциту мінеральфакторів (органічної природи, гербіцидів - діурон ного живлення, приводить до деякого збільшення та дікват). середньоквадратичного відхилення (Фіг.5 та Фіг.6 Отримання початкової культури мікроводоро- за показником ефективності фотосинтезу, та стей Chlorella vulgaris та метод аналізу ефективФіг.7 й Фіг.8 - за показником інтенсивності флуоності первинних процесів фотосинтезу та вмісту ресценції) - за вмістом хлорофілу від 17 на почахлорофілу проводили аналогічно яків прикладі 1 тку до 19 через добу. Середній вміст хлорофілу в та 2. В даний час широко використовуються герклітині збільшується з 62 до 72. Середньоквадрабіциди, що пошкоджують рослини на рівні фототичне відхилення розподілення за ефективністю синтетичного апарату. фотосинтезу з величини σ=0,047 зростає до Діурон та дікват є типичними представниками σ=0,116 через 24 години. За цей час вміст хлогербіцидів із добре відомими механізмами дії. Ці рофілу в культурі збільшується в 5...6 разів. речовини були нами обрані для вияснення можПриклад 2 ливості використання методики контролю функДослід змін у функціональній структурі попуціональної структури популяції мікроводоростей. ляції мікроводоростей при дії несприятливих фаУ випадку дії на клітини високопотенціальнокторів (тяжких металів, HgCl2). го акцептора, діквата, який перехвачує електрони Використання суліми в якості несприятливого на акцепторній ділянці ФС І та передає їх до кисфактору, що діє, брали виходячи з того, що дія ню з утворенням супероксидного аніон-радікалу ртуті добре вивчена з відомим механізмом дії на на початкових етапах виявляється наступний біологічний об'єкт. Крім того, вибір діючої речовиефект. Дікват прискорює електронний транспорт ни ґрунтувався на його можливій участі у забрудта спрямовує його на деструкцію фотосинтетичнені зовнішнього середовища. Відомо, що суліма ного апарату. У зв'язку з цим ефективність перє токсичною речовиною широкого спектру дії та винних утилізацій енергії світла, що вимірюється одним з найбільш шкідливих забруднюючих семетодом, який пропонується, зростає відразу редовище агентів. У фотосинтетичному апараті після додавання діквату. Однак, в цьому випадку водоростей суліма насамперед інгібує електронвміст хлорофілу в клітинах значно знижується. ний транспорт на рівні пластоціаінину [17]. ДодаПри дії концентрації діквату 10-6М, через 3 вання до суспензії клітин мікроводорості хлорела -2 години у клітин середньоквадратичне відхилення (HgCl2) в кінцевій концентрації 3-10 мг/мл швидко розподілення за вмістом хлорофілу зменшується приводить до гибелі всієї культури водоростей. на 64% від контролю. Погіршується ефективність При цьому вже через 1 годину ефективність фофотосинтезу (η=0,35). В суспензії можна знайти тосинтезу значно знижується, а вміст хлорофілу в клітини із значенням η=0,18 та η=0,56. Середньоних падає. Через 3 години в пробі популяції воквадратичне відхилення розподілення за ефектидоростей практично не можна знайти клітин, здавністю фотосинтезу збільшується в 1,7 разів. Четних до ефективного фотосинтезу. Подальше рез 24 години середнє значення η=0,29, хоча культивування на відмічених клітинах не приво 17 75320 18 клітини за вмістом хлорофілу як і на початку, посклітині на 26% у порівнянні із контролем (див. тупаються контрольним. Фіг.21) при цьому також за показником ефективАналіз розподілення клітин зрощених в сереність фотосинтезу збільшується дисперсність довищі з діуроном в різних концентраціях покарозподілення (див. Фіг.24). Зменшується середзав, що концентрація 3-10-6Μ приводить до повіньоквадратичне відхилення та середнє значення льних змін параметрів розподілення та подальше ефективності фотосинтезу. У голодуючих клітин культивування не приводить до відновлення пона другу добу (див. Фіг.22) середнє значення вміпуляції. Декілька по-іншому ведуть себе клітини сту хлорофілу зменшується на 54%, погіршуютьпісля додавання діурону в концентрації 10-5М, ся показники ефективності фотосинтезу (див. при цьому різко змінюються параметри розподіФіг.25). Голодуючі на третю добу (див. Фіг.23 та лення за вмістом хлорофілу та ефективності фо26) клітини (Імах продовжує зменшуватись до 48% тосинтезу (див. Фіг.15, 16 та 17 - за інтенсивністю початкового рівню, η дорівнює при цьому 0,37). люмінесценції і Фіг.18, 19 та 20 - за ефективністю Однак, відразу після додавання азоту до жифотосинтезу, де графіки, які виділені пунктирною вильного середовища уже через 6 годин (див. лінією відображають контрольні проби). Середнє Фіг.29 та 27) починається відновлення фотосинзначення хлорофілу зменшується на 58%, клітитетичних функцій. За ефективністю фотосинтезу ни за розмірами, в основному, дуже мілкі, багато клітини майже досягають контрольного значення з клітин не світяться. Середньоквадратичне від(η=0,69). Небагато відстають значення величин хилення розподілення дорівнює 15. Ефективність за вмістом хлорофілу (61,5% від контролю). фотосинтезу падає на початку більш різко, ніж На другу добу після відновлення умов мінечерез 24 години (0,3 - відразу після додавання та рального живлення середнє значення за ефекти0,45 через 24 години). Накопичення біомаси в вністю досягає контрольного значення (див. досліді через 24 години майже в 15 разів постуФіг.30). Середньоквадратичне відхилення цього пається контрольній. Однак, навіть при дії таких розподілення значно нижче, ніж в контролі. За високих концентрацій гербіциду знаходяться клівмістом хлорофілу розподілення клітин на другу тини, які спроможні до ефективного фотосинтезу. добу за відношенням до контролю відновлюється І хоча загальна продуктивність та середнє знане в повній мірі (див. Фіг.29), що вказує на критичення відразу після введення гербіциду різко почність характеристик живильного середовища, нижує, можна очікувати, що популяція виявиться тому цей факт необхідно враховувати в біотехстійкою до такої дії токсиканта. нологіях промислового культивування масових Дійсно, після культивування на протязі двох культур мікроводоростей. Слід відмітити, що чемісяців на середовищі, яке містить діурон в конрез 6 годин голодування в розподіленнях з'яви-5 центрації 10 М, культура зберігалася та структулася група клітин із дуже низькою ефективністю ра нової популяції адаптованої до гербіциду мало фотосинтезу. Такі клітини виявлені також через 6 відрізняється від контрольної. Єдиною достовіргодин після додавання до середовища нітрату. А ною відміною є зменшення вмісту хлорофілу в через дві доби культивування після відновлення клітинах. умов мінерального живлення таких аномальних Отримані дані демонструють той факт, що клітин немає. Це говорить про те, що не всі клітигруповий відбір, який направлений на підвищення ни спроможні відновити свою фотосинтетичну стійкості до діурона із паралельним зберіганням активність. високої ефективності фотосинтетичної активності Через дві доби Імах=56. Ці результати дають водоростей може привести до отримання форм можливість припустити, що популяція складаєтьосіб та властивостей популяції в цілому, які місся із декількох субпопуляцій із різною стійкістю та тять в собі такі властивості, як висока ефективфункціональною надійністю показника життєдіяність фотосинтезу та стійкість у відношенні інгібільності. Дуже вірогідно, що їм властива рівна тору. чутливість до того чи іншого фактору середовиТаким чином, спосіб що розглядується має ща. велику діагностичну та прогностичну цінність, що Таким чином, в результаті проведених експедозволяє використовувати його не тільки в задариментів показано, що структура популяції за чах екологічного моніторингу, але й при скринінгу ефективністю та за вмістом хлорофілу при різних біологічної активності хімічних речовин та препадіях зовнішніх факторів істотно змінюється в рератів. зультаті реакцій популяції в короткострокових Приклад 4 дослідах випробувань та може явитись показниДослід змін у в функціональній структурі поком стану популяції в реальному масштабі часу. пуляції мікроводоростей при культивуванні в Висновки (за результатам прикладів 1, 2, 3 умовах азотного голодування. та 4). Для накопичення біомаси мікроводоростей 1. Співвідношення інтенсивностей флуоресChlorella vulgaris тa ефективної утилізації світлоценції хлорофілу одиночної клітини при певних вої енергії в середовищі культивування необхідна значеннях інтенсивностей збуджуючого світла присутність сполук азоту. В даний час проведені може характеризувати ефективність первинних широкі дослідження стану фотосинтетичного стадій фотосинтезу. апарату хлорели при азотному голодуванні. Екс2. Існує лінійна кореляція між об'ємом росперименти за впливом азотного голодування на линної клітини мікроводорості та інтенсивністю стан популяції показали, що виключення азоту із флуоресценції хлорофілу в ній при інтенсивності живильного середовища вже через 6 годин сузбуджуючого світла, яке насичує фотосинтез, проводжується зниженням вмісту хлорофілу в (коефіцієнт кореляції 0,83 при рівні значимості 19 75320 20 більше 0,99, див. Фіг.4). 42. Опромінювання клітини водоростей низь3. Розподілення клітин в популяції мікровокою інтенсивністю світла Ф1, що збуджує, в градоростей Chlorella vulgaris в процесі старіння зсуницях від 0,5 до 2,0Вт/м2 на протязі всього часу вається в бік зниження ефективності первинних виміру. стадій фотосинтезу. 43. Вимір інтенсивності флуоресценції її при 2 4. Аналіз розподілення функціональної струкінтенсивності світла ,від 0,5 до 2,0Вт/м на протятури мікроводоростей Chlorella vulgaris в популязі 1...3сек. ції дозволяє оцінити можливості адаптації та від44. Запам'ятовування значень величин інтенновлення популяції в умовах дії несприятливих сивності флуоресценції та інтенсивності світла І1 факторів зовнішнього середовища. При цьому та Ф1. розподілення істотно змінюються за своїм харак45. Зміна інтенсивності світла Ф2, до величин тером, що дозволяє використовувати цей біологів границях від 50 до 100Вт/м2, при цьому світло чний феномен для отримання математичних моперекрито і не опромінює клітину, що досліджуделей, що описують як стан популяції, так і їхній ється. розвиток. 46. Вимір інтенсивності флуоресценції І2 при 5. Дефіцит азоту в живильному середовищі інтенсивності світла в границях від 50 до інкубації приводить до зниження ефективності 100Вт/м2 через інтервал часу 1...3сек. після фотосинтезу та вмісту хлорофілу в клітині, а при опромінювання клітини водоростей на протязі тривалому дефіциті та гибелі частини клітин в 1...2сек. популяції. Введення азоту до середовища інку47. Запам'ятовування значень величин інтенбації у більшості клітин викликає швидке відновсивності флуоресценції та інтенсивності світла І2 лення ефективності фотосинтезу та повільне та Ф2. збільшення вмісту хлорофілу. Гетерогенність 48. Розрахунок показника вмісту хлорофілу клітин популяції, що пройшли етап азотного гота ефективності фотосинтезу за формулою: лоду, але відновилися після вводу до живильного I Ф 1 1 2 середовища необхідних азотних сполук, незначно I2 Ф1 менше, ніж в контрольній пробі. де І1та І2 - інтенсивність слабкого світла та 6. Аналіз функціональної структури популяції світла, що насичує, відповідно, Вт/м2; Ф1 та Ф2 мікроводоростей, в основу якого покладено виінтенсивність максимумів індукції флуоресценції значення розподілення клітин водоростей за при слабкому світлі та світлі, що насичує, відпоефективністю первинних стадій фотосинтезу та відно, Ум. од. вмісту хлорофілу, дозволяє прогнозувати розви49. Сканування мікрофлуориметром зразка ток популяцій з виявленням біфуркаційних перепроби мікроводоростей Chlorella vulgaris за певходів з одного стану до іншого. ною програмою з ціллю отримання репрезента7. Використання способу визначення функцітивної вибірки. ональної структури популяції мікроводоростей, 50. Встановлення циклів повторювання виміщо розглядується, дозволяє проводити оператирів на іншій клітині водоростей з отриманням ставний контроль стану в екологічному моніторингу тистики 30... 100од. контролю. або при біотестуванні контролю токсичності во51. Графічна побудова розподілення частоти дяного середовища, а також при організації техвиявлення клітин водоростей в залежності від нологічного контролю біотехнології зрощування встановленої величини ефективності фотосинтемікроводоростей. При цьому існує можливість зу та вмісту хлорофілу. організації автоматизованого методу дослідів. 52. Статистичний аналіз імперичного розпо8. Необхідно спеціально розглянути можлиділення функціональної структури популяції міквості статистичних методів математичного модероводоростей Chlorella vulgaris із встановленням лювання позначених процесів, в тому числі з обдостовірного інтервалу за одним з прийнятих ласті теорії біфуркацій дисипативних структур. критеріїв. Разом з тим, корисними можуть виявитись й 53. Оцінка функціональної структури популябільш ординарні засоби обробки обчислювальної ції мікро водоростей. інформації, включаючи апроксимацію тригономе54. Завершення програми. тричними рядами функцій розподілення із настуЗагальні висновки. пним виявленням часової організації популяції 1. Функціональна структура популяції мікромікроводоростей, а також дослідження залежносводоростей Chlorella vulgaris являє собою гетеротей відповідних градієнтів від параметрів отригенну систему за токсикорезистентністю до дії маних розподілень в конкретних задачах. хімічних факторів. Спосіб визначення функціональної структури 2. Гетерогенність токсикорезистентності напопуляції мікроводоростей Chlorella vulgaris здійлежить до фізіологічного поліморфізму популяцій снюється за алгоритмом, який поданий на мікроводоростей. Фіг.31, де: 3. Внутрішньовидовий поліморфізм є механі39. Відбір проби з природної або лабораторзмом пристосування популяції одноклітинних до но культивованої популяції мікроводоростей. токсичного фактору. 40. Ввід проби до вимірювальної камери для 4. В умовах тривалої дії токсикантів в екстремікроскопіювання та виміру флуоресценції. мальних умовах виявлені адаптивні реакції, які 411, 412. Наведення оптичної системи ФЕМ проявляються у підвищені стійкості популяції до на окрему клітину водоростей в умовах її опромідії металів та ін. токсикантів. нювання низькою інтенсивністю світла. 5. Адаптивні реакції необхідно враховувати 21 75320 22 при розробці регламентів зливу стічних вод до действиям.: Дисс. на соиск. уч. степени д. биол. водойми. наук. - М.: МГУ, 1990. -46с. Таким чином, запропонований спосіб до8. Мацкивский В.И. Перспективы использовазволяє: ния флуоресцентных методов анализа состояния 1. Здійснювати оперативний контроль. фитопланктона для экологического мониторинга. 2. Оцінювати поріг токсичної дії. - В сб.: Тез. докл. "V съезд Всесоюзного гидроби3. Надати оцінку резервних можливостей біоологического общества". - Тольятти, 1986. системи на популяційному рівні організації по С.198-199. забезпеченню цільової функції в умовах коротко9. Мацкивский В.И. Экспериментально - местрокової дії пошкоджуючих факторів. тодическое исследование действия загрязните4. Здійснювати оцінку ефективності дії хімічлей на гидробионты для разработки контроля них регуляторів, забезпечуваних токсикорезистекачества водной среды: Дисс. на соискание уч. нтність та стимуляції фотосинтетичної активності степени канд. биол. наук. - М.: МГУ, 1985. -167с. мікроводоростей. 10. Браунли К.А. Статистическая теория и Запропонований спосіб контролю може бути методология в науке и технике. -М.: Наука, 1977.реалізований у лабораторії фахівцем407с. мікробіологом або альгологом (лаборантом). 11. Лакин Г.Ф. Биометрия: Учеб. пособие для Тривалість аналізу однієї проби становить (з урабиол. спец. вузов.- М.: Высш. шк., 1990. - 352с. хуванням тривалості виміру показника для однієї 12. Глотов Н.В., Животовский Л.А., Хованов клітини водоростей, що дорівнює 1,5...2,0 хвилиН.В., Хромов-Борисов Н.Н. Биометрия: ни та кількість клітин, що аналізуються, для стаУчеб.пособие. - Л.: ЛГУ, 1982. - 264с. тистичної обробки, що дорівнює 30...100од.) від 13. Плохинский Н.А. Алгоритмы биометрии. 45 до 200 хвилин - не автоматизований режим М.: МГУ, 1980.- 150с. контролю (кількісний облік, розрахунок і аналіз 14. Голоскоков А.Е. Проверка статистических результатів), тобто його можна віднести до ексгипотез: Учеб. пособ. - X.: ХГПУ, 1998.- 184с. прес-способів контролю. 15. Бобров Ю.А., Савинов В.М. Определение Використання способу найбільш ефективно в концентрации хлорофилла флуоресцентным метоксикології та екологічному моніторингі, а також тодом. - В сб.: Планктон прибрежных вод Восточв біотехнології промислового культивування воного Мурмана. - Мурманск: Апатиты, 1982. -С.33доростей. 40. Джерела інформації 16. Гольд В.М., Гаевскмй Н.А., Григорьев 1. Сиренко Л.А., Марценюк И.И. О количестЮ.С., Гехман А.В., Попельницкий В.А. Теоретивенной регистрации интенсивности флуоресценческие основы и методы изучения флуоресценции микроскопических препаратов. - В сб.: Метоции хлорофилла. -Красноярск, изд-ио КГУ, 1984. ды изучения и практического использования 82с. почвенных водорослей. - К.: Наукова думка, 17. Клейтон Р. Фотосинтез. Физические ме1972. -С.118-124. ханизмы и химические модели. -М.:Мир, 1984.2. А.с. №1505471, СССР, A01N7/00, БИ 350с. N33/89 от 07.09.89. Способ оценки уровня допус18. Тейлор Дж. Введение в теорию ошибок. тимых воздействий повреждающего фактора на М.:, Мир, 1985. фотосинтезирующие организмы // 19. Bemecke С, Falke W., Schmidt С. Use of В.А.Веселовский, Т.В.Веселова, А.Б.Рубин, algae fluorescence for an automated biological В.И.Мацкивский, Г.В.Хомяков, Д.С.Чернавский. monitoring system. - Bull. Environ. Contam. Toxicol., 3. Погосян С.И., Лебедева Г.В., Резниченко 1982. - Vol.28.-№4.-P.385-395. Г.Ю. Связь функциональной структуры популя20. Havaux M., Lannoye R. In vitro chlorophyll ции одноклеточных водорослей с ее динамикой. fluorescence and delayed light emisson as rapid В кн.: Проблемы экологического мониторинга и screening techniques for stress tolerance in crop моделирования экосистем. - Л.: Гидрометеоизplants. - Z. Pflanzenzuchtg., 1985. - Bd.95. - S.1-13. дат, 1991. -Т.13. -С.280-297. 21. Lorenzen C.J. A method for continuous of in 4. Сверижев Ю.М. Нелинейные волны, дисvivo chlorophyll concentration. - Deep-Sea., 1966. сипативные структуры и катастрофы в экологии. Vol.13. - P.223-227. М.: Наука, 1987. - 366с. 22. Oguist G., Hagstrom Α., Alm P., 5. Тарусов Б.Н., Веселовский В.А. СверхслаSamuelsson G., Richardson K. Chlorophyll a бые свечения растений и их прикладное значеfluorescence an alternative method for estimating of ние. - М.: МГУ, 1978. - 151с. primary production. - Marine Biol., 1982. - Vol.68. 6. Веселовский В.А., Веселова Т.В. Люмине№1. - P.71-75. сценция растений. - М.: Наука, 1990. - 200с. 23. Samuelsson G., Oguist G. A method for 7. Веселовский В.А. Структурноstuding of photosynthetic capacities of unicellular функциональные изменения мембран растительalgae based on in vivo chlorophyll fluorescence. ной клетки при адаптации к повреждающим возPhysiol., 1977. - Vol.40. -P.315-319. 23 75320 24 25 75320 26 27 75320 28 29 75320 30 31 Комп’ютерна верстка Т. Чепелева 75320 Підписне 32 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for determining the functional activity of algae chlorella vulgaris
Автори англійськоюChernyshov Serhii Ivanovych, Chernyshov Sergii Ivanovych
Назва патенту російськоюСпособ определения функциональной активности микроводорослей chlorella vulgaris
Автори російськоюЧернышев Сергей Иванович, Чернышов Сергей Иванович
МПК / Мітки
МПК: G01N 1/24, C12R 1/89, C12N 1/12, G01N 1/02
Мітки: визначення, активності, vulgaris, спосіб, популяції, мікроводоростей, chlorella, функціонально
Код посилання
<a href="https://ua.patents.su/16-75320-sposib-viznachennya-funkcionalno-aktivnosti-populyaci-mikrovodorostejj-chlorella-vulgaris.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення функціональної активності популяції мікроводоростей chlorella vulgaris</a>