Четвертинні хелідонінові і алкалоїдні похідні, спосіб їх отримання і їх застосування у виробництві лікарських засобів
Формула / Реферат
1. Спосіб отримання продукту реакції алкалоїдів, який містить щонайменше одне похідне алкалоїду, до складу якого входить четвертинний азот, що включає наступні стадії:
a) одержують реакційну суміш, яка містить органічний розчинник і щонайменше один алкалоїд, присутній в рослині Chelidonium majus L. і, переважно, вибраний з групи, що складається з хелідоніну, протопіну, стилопіну, алокриптопіну, гомохелідоніну, хеламідину, хеламіну, L-спартеїну і оксихелідоніну, і алкілуючий агент, і проводять реакцію алкілування шляхом взаємодії щонайменше одного алкалоїду з алкілуючим агентом в присутності органічного розчинника, при якій утворюється щонайменше одне похідне алкалоїду, що містить четвертинний азот;
b) проводять щонайменше одну стадію промивання реакційної суміші водним розчинником або водою для видалення водорозчинних сполук, присутніх в реакційній суміші; і
c) проводять обробку промитої реакційної суміші сильною кислотою в газоподібній або рідкій формі, переважно, газоподібним хлористим воднем або розчином хлористого водню, для перетворення щонайменше одного четвертинного похідного алкалоїду у водорозчинну форму, зокрема у водорозчинну сіль;
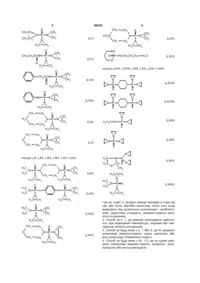
де органічний розчинник придатний для розчинення алкалоїдів, де алкілуючий агент є водорозчинним або розкладається на водорозчинні компоненти при контакті з водою і вибирають зі сполук LV, LVI, LVII, LVIII, LIX, LX:
 , (LV)
, (LV)
 , (LVI)
, (LVI)
 , (LVII)
, (LVII)
 , (LVIII)
, (LVIII)
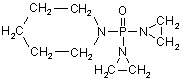 , (LIX)
, (LIX)
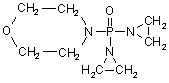 , (LX)
, (LX)
сполук LXI, LXII, LXIII, LXIV, LXV і LXVI:
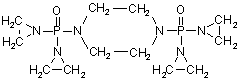 , (LXI)
, (LXI)
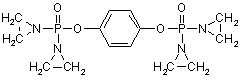 , (LXII)
, (LXII)
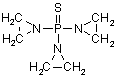 , (LXIII)
, (LXIII)
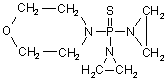 , (LXIV)
, (LXIV)
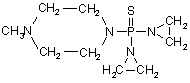 , (LXV)
, (LXV)
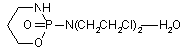 , (LXVI)
, (LXVI)
сполук LXVII, LXVIII, LXIX, LXX, LXXI і LXXII:
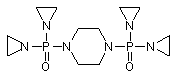 , (LXVII)
, (LXVII)
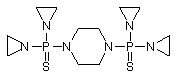 , (LXVIII)
, (LXVIII)
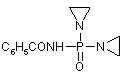 , (LXIX)
, (LXIX)
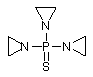 , (LXIX)
, (LXIX)
 , (LXXI)
, (LXXI)
 , (LXXII)
, (LXXII)
і де на стадії с) продукт реакції випадає в осад під час або після обробки кислотою, після чого осад відділяють від органічного розчинника і, необов'язково, додатково очищують, використовуючи органічні розчинники.
2. Спосіб за п. 1, де реакцію алкілування здійснюють при підвищеній температурі, зокрема при температурі кипіння розчинника.
3. Спосіб за будь-яким з п. 1 або 2, де як джерело алкалоїдів використовують суміш декількох або всіх алкалоїдів Chelidonium majus L.
4. Спосіб за будь-яким з пп. 1-3, де як єдине джерело алкалоїдів використовують хелідонін, оксихелідонін або метоксихелідонін.
5. Спосіб за будь-яким з пп. 1-4, де алкілуючий агент являє собою фізіологічно активний агент, переважно цитотоксичний агент.
6. Спосіб за будь-яким з пп.1-5, де органічний розчинник вибраний з групи, що складається з дихлорметану, трихлорметану, дихлоретану і трихлоретану.
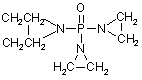
7. Спосіб за будь-яким з пп. 1-6, де алкілуючим агентом є трис(1-азиридиніл)фосфінсульфід (CAS 52-24-4).
8. Спосіб за будь-яким з пп. 1-7, де вказане похідне алкалоїду має четвертинний атом азоту, з яким як четвертий ліганд зв'язаний залишок, що походить з алкілуючого агента, і даний залишок переважно вибраний з групи, що складається з метильного, етильного і трис(1-азиридиніл)фосфінсульфідного залишку.
9. Спосіб за будь-яким з пп. 1-7, де вказане похідне алкалоїду містить четвертинний атом азоту і продукт розкладання, утворений внаслідок обробки кислотою, як четвертий ліганд біля вказаного атома азоту.
10. Продукт реакції алкалоїдів одержаний способом за п. 1, який містить щонайменше одне алкалоїдне похідне, інше, ніж сангвінарин і хлорид N-метілпротопіну, що має четвертинний азот, причому алкалоїд вибраний з групи алкалоїдів, присутніх в рослині Chelidonium majus L., і переважно вибраний з групи, що складається з хелідоніну, протопіну, стилопіну, алокриптопіну, гомохелідоніну, хеламідину, хеламіну, L-спартеїну і оксихелідоніну, для застосування як лікарський засіб або лікарський препарат.
11. Продукт реакції алкалоїдів за п. 10, отриманий за реакцією одного або більше алкалоїдів з алкілуючим агантом, де в похідному спочатку третинний азот присутній в четвертинній формі, з яким як четвертий ліганд зв'язаний залишок, що походить з алкілуючої речовини, і даний залишок переважно вибраний з групи, що складається з метильного, етильного і трис(1-азиридиніл)фосфінсульфідного залишку.
12. Продукт реакції алкалоїдів за п. 10 або 11, де щонайменше одне похідне алкалоїду присутнє в формі водорозчинної солі, переважно в формі гідрохлориду.
13. Продукт реакції алкалоїдів за будь-яким з пп. 10-12, причому хелідонін, оксихелідонін або метоксихелідонін присутній як єдине джерело алкалоїду.
14. Продукт реакції алкалоїдів за будь-яким з пп. 10-13, де даний продукт додатково включає щонайменше одну сполуку, вибрану з групи, що складається з третинних алкалоїдів, що не прореагували, алкілуючого агента, що не прореагував, і продуктів розкладання алкілуючого агента.
15. Похідне хелідоніну, де природно існуючий хелідонін присутній в кватернізованій формі відповідно до наступної формули (І)
 , (I)
, (I)
де як четвертий ліганд R1 до четвертинного азоту присутній метильний або етильний залишок, для застосування як лікарський засіб або лікарський препарат.
16. Похідне хелідоніну за п. 15 у водорозчинній формі, переважно у вигляді солі з сильною кислотою, найбільш переважно в формі гідрохлориду.
17. Похідне хелідоніну за п. 15 або 16, яке характеризується ЯМР спектром за фіг. 4, УФ спектром за фіг. 5, мас-спектром за фіг. 7 і 8 і елементним аналізом з таблиці 1.
18. Застосування продукту, одержаного способом за будь-яким з пп. 10-14, для виробництва фармацевтичної композиції для профілактики або лікування захворювання або патологічного стану організму, вибраного з групи, що складається з вірусної інфекції, раку, імунологічної дисфункції, метаболічної дисфункції і радіаційного ураження.
19. Застосування за п. 18, де захворювання вибране з групи, що складається з алергій, остеопорозу, шкірних пухлин, інфекцій, викликаних вірусом грипу, ревматичних захворювань, шрамів, післяопераційних ран, епілепсії і розсіяного склерозу.
20. Застосування за п. 18 або 19, де єдиним алкалоїдом є хелідонін і продукт реакції алкалоїдів характеризується ЯМР спектром за фіг. 4, УФ спектром за фіг. 5, мас-спектром за фіг. 7 і 8 і елементним аналізом з таблиці 1.
21. Застосування похідного хелідоніну за пп. 15-17 для виробництва фармацевтичної композиції для профілактики або лікування захворювання або патологічного стану організму, вибраного з групи, що складається з вірусної інфекції, раку, імунологічної дисфункції, метаболічної дисфункції і радіаційного ураження.
22. Застосування за п. 21, де захворювання вибране з групи, що складається з алергій, остеопорозу, шкірних пухлин, інфекцій, викликаних вірусом грипу, ревматичних захворювань, шрамів, післяопераційних ран, епілепсії і розсіяного склерозу.
Текст
1. Спосіб отримання продукту реакції алкалоїдів, який містить щонайменше одне похідне алкалоїду, до складу якого входить четвертинний азот, що включає наступні стадії: a) одержують реакційну суміш, яка містить органічний розчинник і щонайменше один алкалоїд, присутній в рослині Chelidonium majus L. і, переважно, вибраний з групи, що складається з хелідоніну, протопіну, стилопіну, алокриптопіну, гомохелідоніну, хеламідину, хеламіну, L-спартеїну і оксихелідоніну, і алкілуючий агент, і проводять реакцію алкілування шляхом взаємодії щонайменше одного алкалоїду з алкілуючим агентом в присутності органічного розчинника, при якій утворюється щонайменше одне похідне алкалоїду, що містить четвертинний азот; b) проводять щонайменше одну стадію промивання реакційної суміші водним розчинником або водою для видалення водорозчинних сполук, присутніх в реакційній суміші; і c) проводять обробку промитої реакційної суміші сильною кислотою в газоподібній або рідкій формі, переважно, газоподібним хлористим воднем або розчином хлористого водню, для перетворення щонайменше одного четвертинного похідного алкалоїду у водорозчинну форму, зокрема у водорозчинну сіль; де органічний розчинник придатний для розчинення алкалоїдів, де алкілуючий агент є водорозчинним або розкладається на водорозчинні компоненти при контакті з водою і вибирають зі сполук LV, LVI, LVII, LVIII, LIX, LX: UA (21) a200509763 (22) 12.03.2004 (24) 25.01.2010 (86) PCT/EP2004/002637, 12.03.2004 (31) 03006015.6 (32) 18.03.2003 (33) EP (46) 25.01.2010, Бюл.№ 2, 2010 р. (72) НОВІЦКІЙ ВАССІЛЬ, AT (73) НОВІЦКІЙ ВАССІЛЬ, AT (56) ZHAO Y ET AL: "Studies on the antimalarial activity of protopine derivatives" CHINESE PHARMACEUTICAL BULLETIN (YAOXUE TONGBAO), vol. 16, no. 6, June 1981 (1981-06), pages 7-10 TANAKA S ET AL: "Influence of natural and synthetic compounds on cell surface expression of cell adhesion molecules, ICAM-1 and VCAM-1" PLANTA MEDICA, THIEME, STUTTGART, DE, vol. 67, no. 2, 2001, pages 108-113 SCHMELLER T ET AL: "Biochemical activities of berberine, palmatine and sanguinarine mediating chemical defence against microorganisms and herbivores" PHYTOCHEMISTRY, PERGAMON PRESS, GB, vol. 44, no. 2, January 1997 (1997-01), pages 257-266 SLAVIK J ET AL: "Quaternary alkaloids from the roots of Argemone platyceras LINK et OTTO" COLLECTION OF CZECHOSLOVAK CHEMICAL COMMUNICATIONS, vol. 41, 1976, pages 285-9 TAKAO N ET AL: "Studien uber die Alkaloide de Pavaveraceen. Die Alkaloide von Corydalis incisa. (10). Uber die struktur des (+)-14-Epicorynolins" CHEMICAL AND PHARMACEUTICAL BULLETIN, vol. 21, 1973, pages 1096-1102 ULRICHOVA J ET AL: "Cytotoxicity of natural compounds in hepatocyte cell culture models. The case of quaternary benzo[c]phenanthridine alkaloids" 2 (19) 1 3 O CH2CH2 N P CH2CH2 89353 CH2 N CH2 N (LV) H2C CH2 O P , P CH2OCNH H2C CH2 N CH2 H 2C CH2 CH2 N CH2 P H2C H2C С H2С C N P (LIX) H2С C (LX) P P N N H2C CH2 O P N H2С C N N H2C CH2 N P СН2 N H 2C CH2 CH2 CH2 O N CH2 CH2 СН2 СН2 (LXI) H 2С C СН2 СН2 (LXII) , , P СН2 N N H2C CH2 P P (LXVIII) N , (LXIX) N , (LXIX) N , (LXIV) СН2 , N P CH O N S CH3 H 2C H2 C С , (LXIII) S N H2C СН2 N P S C6H5CONH H2C H2C CH2 H2C С N N N O CH2 O P , O S N N S O N N , N N CH2 (LXVI) (LXVII) N O O CH2 CH2 P , СН2 N N H2C H2C С CH2 H2 O N сполук LXI, LXII, LXIII, LXIV, LXV і LXVI: O N N S СН2 CH2 , N P O СН2 N N CH2 , CH2 O O (LXV) , СН2 N N CH2 N(CH2CH 2Cl)2 N N , P СН2 O (LVII) (LVIII) O H2C СН2 CH2 CH2 CH2 СН2 СН2 N СН2 N N N CH2 NH O P СН2 N P сполук LXVII, LXVIII, LXIX, LXX, LXXI і LXXII: N O H2C CH2 (LVI) O NH P N H2C CH2 CH2 N H2C CH2 S CH3N CH2 N O CH2 , O CH3CH2OCNH 4 CH2 (LXXI) , CH 2 N N P S (LXXII) N H2C CH2 , і де на стадії с) продукт реакції випадає в осад під час або після обробки кислотою, після чого осад відділяють від органічного розчинника і, необов'язково, додатково очищують, використовуючи органічні розчинники. 2. Спосіб за п. 1, де реакцію алкілування здійснюють при підвищеній температурі, зокрема при температурі кипіння розчинника. 3. Спосіб за будь-яким з п. 1 або 2, де як джерело алкалоїдів використовують суміш декількох або всіх алкалоїдів Chelidonium majus L. 4. Спосіб за будь-яким з пп. 1-3, де як єдине джерело алкалоїдів використовують хелідонін, оксихелідонін або метоксихелідонін. 5 89353 6 5. Спосіб за будь-яким з пп. 1-4, де алкілуючий складається з третинних алкалоїдів, що не прореагент являє собою фізіологічно активний агент, агували, алкілуючого агента, що не прореагував, і переважно цитотоксичний агент. продуктів розкладання алкілуючого агента. 6. Спосіб за будь-яким з пп.1-5, де органічний роз15. Похідне хелідоніну, де природно існуючий хечинник вибраний з групи, що складається з дихлолідонін присутній в кватернізованій формі відповірметану, трихлорметану, дихлоретану і трихлоредно до наступної формули (І) HO тану. 7. Спосіб за будь-яким з пп. 1-6, де алкілуючим O агентом є трис(1-азиридиніл)фосфінсульфід (CAS (I) 52-24-4). O + O 8. Спосіб за будь-яким з пп. 1-7, де вказане похідN CH3 не алкалоїду має четвертинний атом азоту, з яким O R1 , як четвертий ліганд зв'язаний залишок, що походе як четвертий ліганд R1 до четвертинного азоту дить з алкілуючого агента, і даний залишок переприсутній метильний або етильний залишок, для важно вибраний з групи, що складається з метилзастосування як лікарський засіб або лікарський ьного, етильного і трис(1препарат. азиридиніл)фосфінсульфідного залишку.16. Похідне хелідоніну за п. 15 у водорозчинній 9. Спосіб за будь-яким з пп. 1-7, де вказане похідформі, переважно у вигляді солі з сильною кислоне алкалоїду містить четвертинний атом азоту і тою, найбільш переважно в формі гідрохлориду. продукт розкладання, утворений внаслідок оброб17. Похідне хелідоніну за п. 15 або 16, яке харакки кислотою, як четвертий ліганд біля вказаного теризується ЯМР спектром за фіг. 4, УФ спектром атома азоту. за фіг. 5, мас-спектром за фіг. 7 і 8 і елементним 10. Продукт реакції алкалоїдів одержаний спосоаналізом з таблиці 1. бом за п. 1, який містить щонайменше одне алка18. Застосування продукту, одержаного способом лоїдне похідне, інше, ніж сангвінарин і хлорид Nза будь-яким з пп. 10-14, для виробництва фармаметілпротопіну, що має четвертинний азот, прицевтичної композиції для профілактики або лікучому алкалоїд вибраний з групи алкалоїдів, присування захворювання або патологічного стану ортніх в рослині Chelidonium majus L., і переважно ганізму, вибраного з групи, що складається з вибраний з групи, що складається з хелідоніну, вірусної інфекції, раку, імунологічної дисфункції, протопіну, стилопіну, алокриптопіну, гомохелідоніметаболічної дисфункції і радіаційного ураження. ну, хеламідину, хеламіну, L-спартеїну і оксихелі19. Застосування за п. 18, де захворювання вибдоніну, для застосування як лікарський засіб або ране з групи, що складається з алергій, остеополікарський препарат. розу, шкірних пухлин, інфекцій, викликаних вірусом 11. Продукт реакції алкалоїдів за п. 10, отриманий грипу, ревматичних захворювань, шрамів, післяза реакцією одного або більше алкалоїдів з алкіопераційних ран, епілепсії і розсіяного склерозу. луючим агантом, де в похідному спочатку третин20. Застосування за п. 18 або 19, де єдиним алканий азот присутній в четвертинній формі, з яким як лоїдом є хелідонін і продукт реакції алкалоїдів четвертий ліганд зв'язаний залишок, що походить характеризується ЯМР спектром за фіг. 4, УФ спез алкілуючої речовини, і даний залишок переважно ктром за фіг. 5, мас-спектром за фіг. 7 і 8 і елеменвибраний з групи, що складається з метильного, тним аналізом з таблиці 1. етильного і трис(1-азиридиніл)фосфінсульфідного 21. Застосування похідного хелідоніну за пп. 15-17 залишку. для виробництва фармацевтичної композиції для 12. Продукт реакції алкалоїдів за п. 10 або 11, де профілактики або лікування захворювання або щонайменше одне похідне алкалоїду присутнє в патологічного стану організму, вибраного з групи, формі водорозчинної солі, переважно в формі гідщо складається з вірусної інфекції, раку, імунолорохлориду. гічної дисфункції, метаболічної дисфункції і радіа13. Продукт реакції алкалоїдів за будь-яким з пп. ційного ураження. 10-12, причому хелідонін, оксихелідонін або мето22. Застосування за п. 21, де захворювання вибксихелідонін присутній як єдине джерело алкалоїране з групи, що складається з алергій, остеоподу. розу, шкірних пухлин, інфекцій, викликаних вірусом 14. Продукт реакції алкалоїдів за будь-яким з пп. грипу, ревматичних захворювань, шрамів, після10-13, де даний продукт додатково включає щоопераційних ран, епілепсії і розсіяного склерозу. найменше одну сполуку, вибрану з групи, що Даний винахід відноситься до галузі розробки лікарських засобів і охорони здоров'я і відноситься до алкалоїду хелідоніну і його похідних, причому азот в молекулі хелідоніну є четвертинним азотом. Даний винахід, крім того, відноситься до способу отримання цих сполук і до композицій, що містять такі сполуки і до їх застосування для лікування різних захворювань і патологічних станів організму. Фахівцям в даній галузі відомі алкалоїд хелідонін і композиції, що містить хелідонін, а також терапевтичне застосування хелідоніну або деякі похідні хелідоніну для лікування різних патологічних станів організму і захворювань, включаючи метаболічні дисфункції і пухлини. 7 89353 8 У DE 2028330 і US 3865830 описане отриманУ Lombardini J.B. et al., Biochemical ня тіофосфорамідізохінолінових адуктів по реакції Pharmacology 51 (1996) 151-157 описаний інгібуювибраних алкалоїдів Chelidonium majus L. з трис(1чий вплив сангвінарину на ферментативну активазиридиніл)фосфінсульфідом в органічному розність мітохондріальної кінази з серця щура. чиннику. У Ulrichova J. et al., Toxicology Letters 125 В AT 354644 і AT 377988 описані способи (2001) 125-132 описаний цитотоксичний вплив санотримання фосфорних похідних алкалоїдів шлягвінарину на гепатоцити в культурі клітин. хом реакції з канцеростатичними фосфорними Отримання ряду похідних алкалоїдів, відмінсполуками, які представлені у водорозчинній форних від похідних хелідоніну, також відоме з рівня мі шляхом перетворення їх в солі. Недоліком опитехніки. саних способів є те, що перетворення продуктів У Valpuesta Μ. et al., Tetrahedron 58 (2002) реакції у водорозчинну сіль є неповним і перева5053-5059 розкритий синтез декількох похідних жаюча частина продуктів реакції залишається неалкалоїдів цисі транс-N-метил-1розчинною у воді. метоксистилопінієвих солей - з алкалоїду культеУ US 5981512 описане використання речовин, ропіну, основного алкалоїду Romneya coulteri, в описаних в AT 377988 і AT 354644, для лікування органічних розчинниках. радіаційного ушкодження. У Slavik J. et al., Collection of Czechoslovak Сполуки, описані в названих патентах, волоChemical Communications 41 (1976) 285-289 роздіють різною цитостатичною і канцеростатичною крите виділення алкалоїдних похідних в формі активністю. Як було доведено, особливо терапевйодидів і перхлоратів з коріння Argemone тично перспективними є суміші алкалоїдів, зокреplatyceras LINK et OTTO. ма, всіх алкалоїдів Chelidonium majus L., фармакоУ Schmidt Ε., Achiv der Pharmazie 231 (1893) логічна активність яких була показана в декількох 168-183 розкрите отримання g-гомохелідоніндослідженнях з лікування раку. Реагент, що не метилйодиду шляхом нагрівання чистої основи в прореагував, видаляють з середовища синтезу надлишку метилйодиду і перекристалізації продукпісля завершення реакції. Оскільки трис(1ту реакції з спирту. азиридиніл)фосфінсульфід (який тут далі називаУ Такао N. et al., Chemical and Pharmaceutical ється також «тіотепа») розчинний в органічних Bulletin 21 (1973) 1096-1102 розкрите отримання розчинниках, таких як бензол, ефір або хлоро11-епікоринолін-йод метилату шляхом реакції алформ, в попередніх способах пропонується видакалоїду 11-епікориноліну з Corydalis incisa з меляти трис(1-азиридиніл)фосфінсульфід, що не тилйодидом в суміші органічних розчинників і пепрореагував, з суміші для синтезу шляхом промирекристалізації продукту реакції з суміші вання продуктів реакції ефіром. органічних розчинників. Хоча вищеназвані відомі способи виробництва У Danckwortt P.W., Archiv der Pharmazie 250 фармакологічно активних хелідонінових похідних, (1912) 590-646 розкрите отримання протопінв основному, є такими, що необхідне очищення метилйодиду шляхом реакції протопіну, розчинекінцевого продукту з використанням легкозаймисного в ацетоні, з надлишком метилйодиду і перетих, або навіть вибухонебезпечних розчинників, кристалізації продукту реакції з спирту. тепер виявлено, що очищення могло б також, і У Manske R.H.F. et al., Journal of the American навіть з кращими результатами, виконуватися з Chemical Society 64 (1942) 1659-1661 розкрите використанням водного розчинника. отримання метосульфату О-етилового ефіру хуУ Zhao Y. et al., Chinese Pharmaceutical Bulletin неманіну з алкалоїду хунеманіну, виділеного з (Yaoxue Tongbao) 16 (1981) 7-10 і базі даних Hunnemannia fumariaefolia Sweet. Chemical Abstracts (Online), Database accession no. У Redemann C.E. et al., Journal of the American 1982:173909 описане вивчення можливого фармаChemical Society 71 (1949) 1030-1034 розкрите кологічного впливу хлориду N-метилпротопіну на отримання декількох похідних алокриптопіну, де пацієнтів, страждаючих від малярії. алкалоїд алокриптопін витягують з Faraga coco і З рівня техніки відомо, що алкалоїд сангвінареакції проводять в органічному розчиннику. рин і його солі володіють широким спектром біолоУ Zhang G.-L. et al., Phytochemistry 40 (1995) гічної активності. 299-305 описана екстракція і структурний аналіз У Tanaka S. et al., Planta Med. 67 (2001) 108алкалоїду N-метилстилопіум-хлориду з китайської 113 описаний протизапальний ефект хлориду санлікарської рослини Dactylicapnos torulosa. гвінарину. Що стосується похідних хелідоніну, то вищезаУ Schmeller Т. et al., Phytochemistry 44 (1997) значені способи отримання різних похідних алка257-266 розкрита біохімічна активність сангвінарилоїдів не включають і не передбачають проведенну з опосередкування хімічного захисту рослин від ня стадії промивання з використанням водного мікроорганізмів, вірусів і травоїдних тварин. розчинника. У Walterova D. et al., Journal of Medicinal В одному з аспектів даний винахід відноситься Chemistry 24 (1981) 1100-1103 описаний інгібуючий до нового способу отримання продукту реакції вплив сангвінарину на ферментативну активність алкалоїдів, зокрема, хелідоніну, оксихелідоніну аланінової амінотрасферази печінки. або метоксихелідоніну з відповідними алкілуючими У Ishii Η. et al., Chemical and Pharmaceutical агентами, причому даний спосіб включає, щонайBulletin 33 (1985) 4139-4151 і Nakanishi T. et al., менше, одну стадію промивання водним розчинJournal of Natural Products 62 (1999) 864-867 опиником, переважно водою, після завершення реаксана протипухлинна активність сангвінарину. ції алкілування. 9 89353 10 Даний спосіб включає також стадію перетворення продуктів у водорозчинну форму збільшурення алкалоїдних похідних у водорозчинні солі ється у від 10 до 15 разів в порівнянні зі способом, для виготовлення ін'єкційних фармацевтичних де стадію промивання здійснюють, використовуюпрепаратів з низькою токсичністю і широким спекчи чисто органічний розчинник, помітно поліпшуютром терапевтичної дії. чи, таким чином, вихід кінцевого продукту. В іншому аспекті даний винахід відноситься до Даний спосіб можна використати, наприклад, водорозчинних продуктів реакції, наприклад, для реакцій алкілування алкалоїдів канцеростативключаючим хелідонінові похідні, причому спочатчними фосфоровмісними сполуками, названими в ку третинний азот в алкалоїдній молекулі перетвопункті 1 AT 377988, причому фосфорні сполуки, рений в четвертинний азот, і причому четвертий представлені на Фігурі 3 даної заявки, є особливо ліганд до четвертинного азоту є залишком нижчого придатними, і найбільш переважні, зокрема, ті, які алкілу, переважно, метильним або етильним замають азиридинову групу. лишком або заміщеним метильним або етильним Термін «хелідонін» відповідно до опису повизалишком, таким як, наприклад, залишок тіотепа. нен іілноситися до сполук, вибраних з групи, що У переважному втіленні четвертинні хелідонінові складається з хелідоніну, оксихелідоніну і метокпохідні мають таку природу, що селективно нагросихелідоніну, якщо інакше не указано, або не витімаджуються в тканинах-мішенях, особливо в ракокає з опису. вих тканинах. Придатним органічним розчинником за даним В іншому аспекті даний винахід відноситься до винаходом є будь-яка речовина, в якій алкалоїди, фармацевтичних композицій, що містять, щонайпризначені для реакції, розчиняються. Ці алкалоїменше, одне з четвертинних алкалоїдних похідних, ди можуть бути, наприклад, розчинені в органічзокрема, четвертинних хелідонінових похідних, що ному розчиннику, який полегшує реакцію або отримуються способом за даним винаходом. сприяє реакції алкілування, такому як розчинник, Даний винахід, крім того, відноситься до завибраний з групи, що складається з монохлорместосування продуктів реакції, що включають четтану, дихлорметану, трихлорметану, монохлоревертинні алкалоїдні похідні, як лікарські засоби тану, дихлоретану і трихлоретану. для використання в терапії і до застосування вкаРеакція алкілування алкалоїдів відбувається заних похідних для виробництва фармацевтичних при підвищеній температурі, переважно при темкомпозицій для терапевтичного лікування різних пературі кипіння розчинника. хвороб і патологічних станів організму. Продукт реакції, що виходить, перетворюють у Додаткові втілення даного винаходу викладені водорозчинну форму після промивання водою. Це в формулі винаходу. може бути здійснено способом, описаним в AT Спосіб за даним винаходом включає реакцію 377988 і AT 354644, перетворенням у водорозчиналкалоїду або суміші алкалоїдів в органічному ні солі, зокрема, в гідрохлориди, наприклад, шлярозчиннику з алкілуючим агентом, переважно, з хом пропущення сильної кислоти в рідкій або газоалкілуючим агентом, який сам володіє терапевтиподібній формі, такій як газ HCl, або додавання чною активністю, таким, наприклад, як цитотоксирозчину HCl в органічний розчин промитого продучні фосфораміди або похідні фосфорної кислоти, кту реакції, в процесі чого і після чого гідрохлориди що містять, щонайменше, одну азиридинову групу, випадають в осад. Мабуть, при цій обробці кислоа потім промивання продуктів реакції водою. Статою велика частина алкілуючого агента відщеплюдія промивання водою або еквівалентним водним ється від проміжного продукту реакції, що утворюрозчинником, наприклад м'яким розчином солі, ється між алкалоїдами і алкілуючим агентом, полегшує? серед іншого, подальшу стадію переутворюючи модифіковані алкалоїдні похідні, притворення погано розчинних або нерозчинних у воді чому спочатку третинні атоми азоту перетворюпродуктів реакції, тобто четвертинних алкалоїдних ються в четвертинні атоми азоту, де з четвертинпохідних, в розчинні у воді сполуки, наприклад, ним азотом зв'язаний водневий залишок або солі. Переважно, щоб у випадку, коли алкілуючий залишок, що походить з алкілуючого агента, як агент є цитотоксичною речовиною, він був також четвертий ліганд, причому залишок переважно розчинним у воді або, щонайменше, розкладався вибраний з групи, що складається з метилу, етилу при контакті з водою до водорозчинних компонені трис(1-азиридиніл)фосфінсульфідного залишку тів, щоб була можливість істотного видалення алабо з частини трис(1-азиридиніл)фосфінсульфіду. кілуючого засобу, що не прореагував, або його Для кращого розуміння, наступна формула (І) ілючастин з реакційної суміші за допомогою стадії струє типовий продукт реакції четвертинного алпромивання водою. калоїду за винаходом, як приклад якого наведений Стадія промивання водою дає можливість ісхелідонін: тотно спростити процес виробництва, оскільки більше немає необхідності вживати складні заходи безпеки, пов'язані з ризиком вибуху чистих органічних розчинників, наприклад, диметилового ефіру, що дозволяє легко здійснювати масштабування. Крім того, небажані водорозчинні компоненти, присутні в реакційній суміші, тим самим відділяють від продуктів реакції і видаляють. Несподівано було виявлено, що стадія промивання надає позиR1 = метил, етил, трис(1тивний вплив на структуру і склад продуктів реакції азиридиніл)фосфінсульфід, метил-R2, етил-R2, так, що ефективність подальшої стадії перетво 11 89353 12 причому R2 є частиною трис(1дається з суміші приблизно 60-70% алкалоїдів азиридиніл)фосфінсульфіду. Chelidonium, що не прореагували, з приблизно 30За елементним аналізом одного з продуктів 40% продуктів реакції з трис(1реакції, осадженого за даним винаходом (див. азиридиніл)фосфінсульфіду. приклад 3), видно, поза зв'язком з теорією, що, Третинні алкалоїди представляють основну щонайменше, частина алкілуючого агента або частину вихідних компонентів алкалоїдного екстпродуктів розкладання алкілуючого агента, отриракту, що отримується з Chelidonium majus L. Наманого шляхом обробки кислотою реакційної суприклад, в суміші для синтезу як вихідні компоненміші після припинення алкілування, наприклад, ти можуть міститися наступні третинні алкалоїди: реакції утворення четвертинної сполуки, може бухелідонін, протопін, стилопін, алокриптопін, aти присутня до деякої міри в кристалах осаду або гомохелідонін, хеламідин, хеламін, L-спартеїн, якось сильна зв'язана з кристалами, що перешкохелідимерин, дигідросангвінарин, оксисангварин, джає очищенню осаду промиванням органічними оксихелідонін і метоксихелідонін. розчинниками, такими як ефір і дихлорметан. ПроПісля припинення реакції алкілування четверте, можна довести, що продукт реакції є все ще тинні алкалоїди, що не прореагували (наприклад, повністю функціональним навіть в присутності берберин), по суті видаляються з реакційної суміші таких супроводжуючих речовин. за допомогою стадії промивання водою, тоді як Водорозчинна сіль продукту реакції придатна нерозчинні у воді алкалоїди і продукти реакції у для застосування в ін'єкційних розчинах. вигляді алкілованих алкалоїдів, що не прореагуваВ одному з втілень реакцію здійснюють з доли, залишаються в органічному розчиннику. У запомогою трис(1-азиридиніл)фосфінсульфіду (CAS лежності від природи органічного розчинника і/або №52-24-4), який за фармакопеєю відомий як тіотеалкілуючого агента, що використовується для реапа. Додатковими синонімами є ледертепа, онкотіокції алкілування, проміжний продукт реакції, що тепа, TESPA, теспамін, тіофосфамід, тіо-ТЕПА, виходить, може містити пов'язані з тіотепа сполутіотриетиленфосфорамід, тифосил, триазиридиніки, причому одна молекула тіотепа пов'язана з лфосфінсульфід, Ν,Ν',Ν''-три-1,2однією молекулою, двома або трьома молекулами етандіїлфосфоротіоїну триамід; Ν,Ν',Ν''-три-1,2хелідоніну, оксихелідоніну або метоксихелідоніну. етандіїлтіофосфорамід, Крім того, він може містити алкіловані алкалоїдні три(етиленіміно)тіофосфорамід; Ν,Ν',Ν"похідні, причому молекула алкалоїду, наприклад, триетилентіофосфорамід, триетилентіофосфоромолекула хелідоніну, оксихелідоніну або метокситриамід, м-триетилентиофосфорамід, мхелідоніну, зв'язана по його четвертинному азоту з трис(азиридін-1-іл)фосфінсульфід, триетилентіолінійним алкільним залишком з коротким ланцюфосфорамід, трис(1-азиридиніл)фосфінсульфор, гом, зокрема, з метильною або етильною групою. трис(етиленіміно)тіофосфат, TSPA і WR 45312. Ще додаткові сполуки реакції алкілування можуть У додатковому втіленні даного винаходу екстбути представлені в реакційній суміші після припиракт алкалоїдів, необов'язково всіх алкалоїдів нення реакції алкілування. Chelidonium majus L., в органічному розчиннику Продукт реакції, отриманий по реакції алкалоприводять у взаємодію з трис(1їдів Chelidonium majus L. загалом з тіотепа відпоазиридиніл)фосфінсульфідом (тіотепа), і продукт відно до даного винаходу, демонструє кращий реакції, що виходить, необов'язково присутній у спектр терапевтичної дії, ніж продукт реакції, вигляді суміші сполук, потім промивають, щонайотриманий при аналогічному процесі, коли стадію менше, один раз водою. Оскільки тіотепа розклапромивання здійснювали за допомогою органічнодається у воді, неперетворений залишок тіотепа, го розчинника, наприклад, діетилового ефіру. Щоприсутній в надлишку після реакції, може бути винайменше, деякі сполуки, представлені в продукті далений з органічної фази за допомогою цієї міри. реакції за даним винаходом, зокрема, - четвертинПереважно органічний розчин, що містить проміжні похідні хелідоніну, селективно нагромаджуються ний продукт реакції, тобто сполуку, утворену з алв ракових тканинах і руйнують ракові клітини шлякілуючого агента і алкалоїду, промивають декілька хом апоптозу, але в протилежність найбільш відоразів і кожний раз насичують водою. Особливо мим цитостатичним засобам, без ураження також переважно, коли промивання повторюють доти, здорових клітин. Це приводить до хорошої перепоки з продукту реакції не буде повністю видаленосимості лікування цим препаратом і його заганий надлишок високотоксичного тіотепа. льній зручності для терапевтичного і профілактичКрім того, деякі водорозчинні токсичні алкалоного використання у осіб з підвищеним ризиком їди, які сприяють побічним реакціям при медичнорозвитку рака внаслідок, наприклад, вікової схильму застосуванні і можуть навіть викликати цироз ності. Він простий в користуванні і не дає значних печінки, видаляють з водною фазою з суміші після побічних реакцій в терапевтичних дозах. синтезу, або знижують їх концентрацію. За допоПродукт реакції, отриманий по реакції алкаломогою випробування Ames показано, що продукт їдів Chelidonium majus L., загалом з тіотепа виявреакції даного втілення, отриманий за даним виляє біологічну активність з регуляції метаболізму і находом, не є мутагенним. придатний для профілактики і терапії метаболічКоли виходять з екстракту всіх алкалоїдів з них захворювань, таких як остеопороз, але також Chelidonium majus L., кінцевий продукт реакції є ревматичних захворювань, алергій, вірусних інфесумішшю алкалоїдів, що містить продукти реакції кцій, епілепсії, розсіяного склерозу, шрамів, пухлин тіотепа з алкалоїдами з більш високою молекуляшкіри, післяопераційних ран і радіаційного урарною вагою. Внаслідок процесу синтезу розчинження. ність алкалоїдів змінюється. Продукт реакції скла 13 89353 14 Екстракт висушеного коріння Chelidonium Алкалоїдний залишок розчиняють в дихлормеmajus L. можна використати як вихідний матеріал тані і додають трис(1-азиридичіл)фосфінсульфід. для синтезу. Коріння має більш високий вміст алСуміш нагрівають із зворотним холодильником при калоїдів, ніж листя або стебло. 80°С протягом 2 годин. Після охолоджування до Несподівано зовсім недавно було виявлено, кімнатної температури реакційну суміш освітлющо коли виходять з комерційно доступного хелідоють. Потім проводять фільтрування і фільтрат ніну, оксихелідоніну або метоксихелідоніну як єдидекілька разів промивають, наприклад, 3 рази або ного джерела алкалоїду, продукт реакції, отримабільше, 250мл води в розділовій лійці. ний по методу даного винаходу (див., наприклад, C) Реакція з HCl приклад 3, нижче), виявляє терапевтичні властиПромитий розчин переносять в скляну лабовості і дію, які, щонайменше, порівнянні з цими раторну склянку, перемішують і насичують газопопоказниками для продукту реакції, що виходить дібним HCl, причому гідрохлоридний комплекс при реакції алкілування алкалоїдів Chelidonium випадає в осад. Осаджений продукт відфільтроmajus L. за прикладом 1. вують і промивають діетиловим ефіром, сушать і Звичайні фармацевтичні допоміжні речовини, потім розчиняють у воді. зокрема, для розчинів, наприклад, ін'єкційних або На щурах було визначене значення LD50, що інфузійних розчинів, або для основи мазей, - комдорівнювало 485мг/кг для продукту реакції за припресів або супозиторіїв, придатні для лікарських кладом 1. Досліди на мишах і щурах показали, що засобів, які містять продукти реакції, отримані за продукт за даним винаходом модулює гормональданим винаходом. ну регуляцію тимусу і викликає синтез речовин, що Фіг.1 показує діаграму ВЕРХ з характерним володіють тимозиноподібною активністю у тварин, складом алкалоїдів загалом з коріння Chelidonium в яких видалений тимус. Цей ефект залежить від majus L. дози. Препарат збільшує число Т-лімфоцитів в Фіг.2 показує характерну картину ВЕРХ препапериферичній крові до 50% (4,04±0,43 х109/л до рату за прикладом 1. лікування, 6,24±0,73 х109/л після лікування), модуФіг.3 представляє вибрані фосфорні похідні, лює гуморальну імунну відповідь відносно проникпридатні як реагенти. нення антигену і природну кілерну клітинну активФіг.4 представляє спектр ядерного магнітного ність клітин селезінки (198,20±17,69% в порівнянні резонансу продукту реакції U-KRS. з 71,50±9,10% в контрольній групі) і підвищує поФіг.5 представляє УФ спектр продукту реакції тенціал вивільнення інтерферону з корпускул біU-KRS. лих кров'яних тілець при експериментах на твариФіг.6 представляє УФ спектр гідрохлориду хенах. Результати експериментів на тваринах лідоніну. підтверджуються клінічними спостереженнями. Фіг.7 представляє перший розділ мас-спектра Таким чином, у ракових пацієнтів також спостеріпродукту реакції U-KRS. гається поліпшення імунних параметрів. Фіг.8 представляє другий розділ мас-спектра Дози, що дорівнюють приблизно 5мг препарапродукту реакції U-KRS при високому розрізненні. ту з прикладу 1 на 70кг ваги тіла, можна викорисФіг.9 представляє мас-спектр гідрохлориду тати для профілактичного і імунологічного застохелідоніну. сування. Що стосується лікування раку, переважно Наступні приклади представлені для додатковводять 5мг препарату на 20кг ваги тіла. вої ілюстрації даного винаходу. Приклад 2: Характеристичні хроматограми Приклад 1 ВЕРХ A) Екстракція алкалоїдів Визначення здійснювали іон-парною хроматоa. 25г суміші солей алкалоїдів суспендують у графією із оберненою фазою в градієнтному реводі і переносять в ділильну лійку. Після додання жимі і при спектральному вимірюванні з викорис100мл дихлорметану ділильну лійку струшують. танням DAD детектора при 285нм. У той же час Потім органічну фазу відділяють і фільтрують в хроматограми отримували з використанням станскляний бутель. дартних алкалоїдів. Крім того, проводили аналіз b. 1N NaOH (pH 8-9) додають до водної фази ВЕРХ-МСД, який показав, що не було інших піків, доти, поки не з'явиться каламутність. Після доданкрім піків алкалоїдів. Діаграми ВЕРХ на Фігурах 1 і ня 100мл дихлорметану суміш струшують. Органі2 отримували на основі наступних експериментачну фазу потім відділяють і об'єднують з дихлорльних даних: метановою фазою зі стадії а. Цей процес Параметри хроматографії: повторюють, наприклад, 3 рази. Органічні фази Колонка: LiChrospher 60 RP Select В, 5мкм, фільтрують і об'єднують. 125x24мм ID с. Водну фазу доводять до рН 10 доданням Елюент: А) 200мл (ацетонітрил)+800мл (воNaOH. Після додання дихлорметану суміш струда)+1,5г (гексансульфонової кислоти)+0,3мл (85% шують, фільтрують і змішують з іншими органічфосфорної кислоти) ними фазами. Потім водну фазу доводять до рН В) 900мл (ацетонітрил)+100мл (води)+1,5г (ге13 за допомогою NaOH і повторюють екстрагуванксансульфонової кислоти)+0,3мл (85% фосфорної ня дихлорметаном. кислоти) d. Об'єднані органічні фази випаровують з Градієнт: 5хв. ізократично 100% А; отриманням маслянистої коричневої речовини. до 40% В протягом 24 хвилин; B) Реакція з трис(1до 100% В протягом 1хв.; азиридиніл)фосфінсульфідом 5хв. 100% В; 5хв. урівноваження з 100% А 15 89353 16 Визначення: УФ опромінення при 285нм 22,25 О Швидкість потоку елюювання: 1мл/хв., зупинка 19,6 після 35хв. 3,27 Ρ Об'єм інжекції: 10мкл 3,27 Підготовка зразка: 2,78 S Екстракт перед реакцією (Фігура 1): 25мг алка3,06 лоїдів розчиняють в 40мл метанолу за допомогою СІ 17,29 ультразвука, доводять до 50мл і фільтрують через мембранний фільтр. Наступні приклади показують різне застосуПродукт реакції (Фігура 2): Продукт реакції певання сполуки U-KRS, що отримується по методиретворювали в гідрохлоридну сіль, розчиняли у ці, описаній в прикладі 3. воді до концентрації 1мг/мл і доводили до рН між Приклад 4: 2,5 і 6,5. Селективне придушення росту клітин in vitro Приклад 3 протипухлинним лікарським засобом U-KRS Комерційно доступний очищений хелідонін Матеріали і методи (Sigma) піддавали взаємодії з трис(1Культуру клітин отримували в бутлях Roux при азаридиніл)фосфінсульфідом (=тіотепа) відповід37-37,5°С у вологій атмосфері, що містить 8% СО2. но до умов, описаних в прикладі 1. Після припиЗлиті культури знімали розчином з 0,01% трипсину нення реакції алкілування, подальшої стадії проі 0,2% ЕДТА в фосфатно-буферному фізіологічномивання і стадії перетворення з використанням му розчині (ФБФР) і розділяли у відношенні від 1:5 газоподібного HCl кінцевий продукт додатково до 1:25. обробляли таким чином: Людські ендотеліальні клітини виділяли з пуп340г обробленого HCl, отже водорозчинного кових вен за допомогою обробки колагеназою. продукту реакції розчиняли у воді і концентрували Культуральним середовищем для ендотеліальних до близькості до насичення, і залишали в спокої в клітин було МІ99, доповнене 15% інактивованою холодильнику при 8°С. Через декілька годин віднагріванням фетальної телячої сироватки, бувалося спонтанне випадання осаду, і збирали 200мкг/мл фактору росту ендотеліальних клітин і 264мг осаду (який тут далі називається U-KRS). 90мкг/мл гепарину. Осад складався із злегка жовтуватих гігроскопічФлуоресцентна мікроскопія них кристалів, що мають досить вузький інтервал Клітини підрощували в 35мм чашках і інкубутемператури плавлення, що являє собою 205вали з 100мкг/мл U-KRS протягом 30-60хв. Куль207°С (що вказує на досить хороший кристалічний туральне середовище аспірували, клітини промипродукт) і даючий флуоресценцію блакитним світвали двічі ФБФР. На клітини вміщували покрівні лом на опромінення УФ-світлом при 366нм. Були стекла і флуоресценцію збуджували з використантакож видні сліди жовтої, оранжевої і червоної ням конфокального лазерного скануючого мікрофлуоресцентних смуг. Продукт не рухався, коли скопа, обладнаного аргоновим лазерним джерейого піддавали тонкошаровій хроматографії, а лом. Світло, що випромінюється, проходило залишався на старті (Rf=0), за винятком слідів редетекцію в каналі фотопомножовуча. Сигнали вічовин, які пересувалися, щонайменше, з отримандображалися на відеомоніторі з використанням ням Rf>0,1. Із спектра ядерного магнітного резонапрограмного забезпечення для обробки зображеннсу (ЯМР) (Фігура 4) стає ясним, що U-KRS містить ня MRC 600. ароматичні кільця, порівнянні з кільцями, що місРезультати тяться в молекулі хелідоніну. УФ-спектр (Фігура 5) 1. В інтервалі концентрацій 20-40мкг/мл U-KRS показує максимуми поглинання при 148, 155, 160, було визначено 55% придушення росту ендотелі205, 230 і 282нм, дуже схожі на УФ спектр хелідоальних клітин. Ця концентрація вбивала клітини ніну (Фігура 6), що відрізняється від нього тільки лінії людської остеосаркоми. Гібриди двох типів тим, що пік U-KRS при 230нм з'являється при клітин показали приблизно ту ж чутливість, що і 240нм для хелідоніну. Це показує, що азот в Uнормальні клітини. KRS є четвертинним, тоді як в хелідоніні він є тре2. Завдяки його аутофлуоресценції, U-KRS тинним. можна виявити всередині клітин. Лазерний скануКрім того, деталі аналізу можуть бути виведені ючий мікроскоп показав високе поглинання U-KRS по мас-спектрограмам, представлених на Фігурі 7 і злоякісними клітинами. Фігурі 8 (U-KRS) і Фігурі 9 (хелідонін), і за резульПриклад 5: татом елементного аналізу U-KRS, виявляючи U-KRS як протираковий агент - Споживання наступний склад речовини (таблиця): кисню Матеріали і методи Таблиця Експерименти in vivo на мишах. Від двох до п'яти з контрольних тварин, які були в 8-денному Елементний склад U-KRS у % від загальної маси віці, кожному вводили ін'єкцією в/ч 50мкл асцитної суспензії мишачої пухлини Ерліха, свіжозабраної у Елемент % від загальної маси цілком дорослої тварини-донора. Контрольна гру45,70 па більше не отримувала якого-небудь впливу. С 45,05 Випробуваній групі робили ін'єкції 10мг U-KRS/кг в Η 5,84 абдомінальну ділянку відразу після імплантації 6,56 пухлини. Ν 6,37 17 89353 18 Результати фом EsB-, ЕВ, ZAC/1, P815 24 години при 37°С в Миші, яким імплантували пухлинні асцити, або 96 мікротитрувальних ямках. після внутрішньочеревинного, або після підшкірноКлітини WiDr інкубували по дещо іншій схемі го введення U-KRS, демонстрували більш довгий протягом 6 і 24 годин при концентраціях U-KRS 1, термін виживання, ніж тварини з імплантатами, 4, 8 і 14мкг/мл U-KRS. яких ніяк не лікували. Результати Кількісне визначення споживання кисню асциФлуорометричні оцінки показують більш сильтної суспензії пухлини за допомогою електрода in ну афінність U-KRS до елементів ядра ракових vitro давало коротке підвищення споживання після клітин, ніж до інших частин ракової клітини. Явище додання U-KRS з подальшим, однак, швидким флуоресценції може ясно показати сильне і швидзниженням, на відміну від того, що спостерігається ке зв'язування, що виявляється U-KRS в області у контрольної суспензії, не змішаної з U-KRS. пухлини і метастазів. Не спостерігалося токсичної Приклад 6: Модифікація антиноцицептивної дії дії на нормальні клітини, оброблені дозами, які є морфіну за допомогою U-KRS у гризунів 100-процентно придушуючими ріст ліній ракових Матеріали і методи клітин, перевірених до теперішнього часу. Тварини: Експерименти виконували на самцях Приклад 9: Вплив U-KRS на людські ксенотрамишей Albino Swiss і самцях щурів Wistar. нсплантати Лікування: U-KRS вводили в/ч в дозах, вихоМатеріал і метод дячи з 20мг/кг для мишей і 25мг/кг для щурів. Пухлинні клітини відбирали з ксенотранспланМетодики експерименту: в кожному експеритатів людської пухлини і серійно трансплантували менті чотирьом групам тварин вводили ін'єкцією 1) «голим» мишам. Ці клітини використовували в плацебо, 2) морфін, 3) U-KRS, 4) U-KRS і морфін. дослідженні утворення колоній in vitro. Пухлинні Результати клітини інкубували безперервно протягом, щонайРезультати показали, що одночасне введення менше, одного тижня з декількома концентраціями U-KRS і морфіну модифікувало дію наркотичного лікарського засобу U-KRS. Це було виконано з анальгетичного лікарського засобу. Воно давало шістьма різними типами, і утворення колоній оціантиноцицептивну дію при тесті відсмикування нювали для кожної пухлини. Дію лікарського засохвоста у щурів, що спостерігається як підвищення бу реєстрували як процентне відношення В/К (вилатентного періоду. пробування/контроль). Дані результати показують, що U-KRS, що Результати вводиться одночасно з морфіном, змінює чутлиБагато різних видів пухлин чутливі до U-KRS, в вість експериментальних тварин до ноцицептивної кореляції з різноманітністю перевірених з U-KRS. реакції в описаних випробуваннях. Дані випробуПухлиноцидні ефекти залежать, мабуть, від здатвання свідчать про те, що U-KRS може взаємодіяності імунного апарату до регенерації, стимуляція і ти з анальгетичними лікарськими засобами, які модуляція якої може бути виконана за допомогою використовують при раку. U-KRS. Приклад 7: Індукція бімодальної загибелі злоПриклад 10: Вплив U-KRS на лінії людських якісних клітин, що програмується за допомогою злоякісних клітин похідного U-KRS Матеріали і методи Матеріали і методи Використали чотири різних лінії злоякісних кліВикористали клітинну лінію еритролейкемії тин: 1) мишачої саркоми; 2) карциноми молочної К562 і U-KRS, отриману в чистій кристалічній форзалози жінки; 3) карциноми товстого кишечнику мі і розчинену у воді до концентрації 1,2мг/мл. людини; 4) людської меланоми. Вміст ДНК в клітинах К562, на які впливали ріУ культуральне середовище додавали похідні зними концентраціями U-KRS, аналізували, викоU-KRS і РР9АА02. ристовуючи йодид пропідію і потокову цитометрію. Після опромінення 200 клітин вміщували на Результати предметне скло і інкубували протягом одного тижРезультати цього дослідження показують, що ня, потім забарвлювали і підраховували. U-KRS індукує бімодальні програми загибелі кліРезультати тин, перша з яких, апоптоз, опосередковується Представлені тут результати показали, що почутливими до хінідину, залежними від Са2+ канахідні U-KRS і РР9АА02 діють на лінії людських лами К+; друга модальність, блістерна загибель злоякісних клітин синергічно як цитотоксичні речоклітин, опосередковується запобіганням утворенвини. ню мікроканальців і індукуванням, таким чином, Приклад 11: Індуковані зупинки росту G2/M і поліплоїдії. апоптоз у ліній клітин людської епідермоїдної карПриклад 8: Вплив U-KRS на ДНК, РНК і синтез циноми за допомогою U-KRS білка в злоякісних клітинах Матеріали і методи Матеріали і методи Первинні людські кератиноцити виділяли із Мічений 3Н-тимідин, 0,5мкКі в 20мкл середозразків шкіри новонароджених. Епідермальні шари вища; уридин, 0,5мкКі в 20мкл середовища, і лейтрипсинізували і суспензії одиночних клітин збирацин, 1,0мкКі в 20мкл середи, вміщували на 2-4 ли центрифугуванням. години в чотири ямки з різними концентраціями UРезультати KRS. Перед цим підрощували клітинні лінії гепатоU-KRS придушує розвиток клітинного циклу цитів морських свинок, гепатоцитів C1L, клітин залежним від дози чином. людських мигдалин, мишачих лімфом, мишачої Обробка U-KRS діє на розподіл в клітинному мієломи, клітин Yoshida, двох штамів HeLa, лімциклі і викликає апоптоз у клітин А431 і ME180. 19 89353 20 Експресія циклінів, CDK і CDK інгібітору р27 U-KRS, не було показано якої-небудь ушкоджуючої змінюється після впливу U-KRS. пов'язаної з лікарською речовиною дії. Приклад 12: Приклад 14: Антиметастазна дія U-KRS і його вплив на киВпливи U-KRS in vitro на фенотип нормальних сневий і енергетичний метаболізм у мишей з мелюдських лимфоцитів ланомою В-16 Матеріали і методи Матеріали і методи Дане дослідження виконували на лімфоцитах, Експеримент проводили на самцях мишей 133 виділених з периферичної крові 10 здорових добС57В/6. Метастазуючу меланому В-16 транспланровольців. Клітини виділяли центрифугуванням на тували в м'яз правої гомілки кожної миші. На десяградієнті щільності Ficoll-Paque. Життєздатність тий день після трансплантації пухлини тварин діклітин визначали фарбуванням 0,1% трипановим лили на дві групи. Першій групі вводили U-KRS у синім, і виявлено, що вона становила 95%. венозний синус ока в дозі 1мг/кг в об'ємі 0,05мл: 5 Субпопуляцію лімфоцитів підраховували за ін'єкцій один раз через два дні. Другій групі вводидопомогою імунофлуоресценції, використовуючи ли стерильний фізіологічний розчин у венозний моноклональні антитіла проти суми Т-клітин, Тсинус в тому ж режимі. хелперних клітин і Т-супресорних клітин. Потім Результати клітини обробляли кон'югованими з ФІТЦ F/ab/2 Дослідження показало, що через день після фрагментами кролячого протимишачого IgG, пропершої внутрішньовенної ін'єкції U-KRS індекси мивали ФБФР і вміщували на предметне скло, кисневого режиму в м'язовій тканині помітно повикористовуючи полівініловий спирт і гліцерин. У ліпшилися. Міра рівня рО2 підвищилася до максиконтрольних препаратах використовували ФБФР мума під час вдихання кисню, а міра рО2 знизилаабо нормальну мишачу сироватку замість монокся з максимума до початкового рівня після лональних антитіл. припинення інгаляції. У тварин експериментальної Результати групи деякі показники окислювального фосфориДане дослідження, що показує можливість лювання в мітохондріях печінки також поліпшилипрямого впливу U-KRS на Т-клітиннї субпопуляції, ся через день після введення препарату. Відомо, підтвердило більш ранні спостереження, що Uщо при прогресуванні злоякісного процесу рівень KRS міг бути хорошим стимулятором клітинного кисню і метаболізм знижується. У мишей, які імунітету у ракових хворих. отримували 5 ін'єкцій U-KRS, таке придушення Приклад 15: менш виражене. У тварин контрольної групи ріМітогенні властивості U-KRS відносно моноцивень кисневої напруженості в м'язовій тканині і тів периферичної крові людини міра доставки кисню в неї були статистично виМатеріали і методи щим. Узагальнюючи отримані дані, можна дійти Мононуклеарні клітини периферичної крові. висновку, що U-KRS у мишей з меланомою В/16 Кров розбавляли рівним об'ємом ФБФР, що місполіпшує доставку кисню в тканини, а також притить 1мМ ЕДТА, рН 7,5, і нашаровували на душує деструктивний ефект злоякісного процесу Histopaque 1077. Пробірки центрифугували при на біоенергетику організму. 2000об./хв. протягом 30хв. Шари на поверхні розПодальші приклади ілюструють властивості ділу, що містять лімфоцити, збирали і промивали імуномодуляції і регуляції метаболізму U-KRS, які три рази середовищем для культури тканин RPMI. роблять U-KRS особливо придатним для терапевРезультати тичного лікування алергічних реакцій, вірусних Було виявлено, що навіть короткий період позахворювань (ВІЛ, гепатит А, В і С, інфекції, виклипередньої обробки клітин U-KRS надавав сильний кані Е. соlі, грипу), остеопорозу, поліартриту, псосинергічний ефект на ФГА мітогенез, що приворіазу і інших захворювань або патологічних станів дить до значно більш високих показників стимуляорганізму. ції клітин, ніж показники тільки з ФГА. Більш того Приклад 13: було виявлено, що короткий період обробки клітин Посилення пухлиноцидної активності макроФГА майже обов'язковий для вияву U-KRS його фагів U-KRS мітогенної дії. Матеріали і методи Це дослідження показує значне збільшення Мишей BALB/c витримували зі спаровуванням циркулюючих лімфоцитів у хворих з розвиненими брат/сестра в лабораторії. Пухлину D1 DMBA/3 стадіями злоякісних захворювань, яких лікували Uзвичайним чином трансплантували мишам BALB/c KRS. шляхом п/ш ін'єкції. Пухлина ставала видимою Приклад 16: через п'ять днів після імплантації. Модулювання цитолітичної активності імунних Лікування U-KRS in vivo починали через п'ять ефекторних клітин і придушення росту пухлини за днів після підшкірної імплантації пухлини. Застодопомогою U-KRS in vivo совували три шляхи введення тобто внутрішньоМатеріали і методи венний, внутрішньочеревинний і підшкірний. Всі Пухлинні клітини: лінії клітин мастоцитоми три експериментальні групи, з, щонайменше, 10 Р815 і AKR лейкемії AKIL підтримували на середомишей кожна, отримували 5,0мк U-KRS в 0,15мл вищі DMEM, доповненому 9% фетальної бичачої ФБФР. Це дозування вибрали на основі попересироватки, що містить пеніцилін і стрептоміцини. дніх експериментів. Результати Результати Дане дослідження in vivo демонструє, що UШвидкість росту пухлини у мишей, що лікуваKRS є ефективним модулятором біологічної відполися, була значно знижена. У мишей, одержуючих віді, що посилює, до 48 разів, літичну активність 21 89353 22 Приклад 19: лімфоцитів селезінки, отриманих від алоімунізоваЕфект лікування U-KRS на ранній остеопороз них мишей. Літична активність клітин селезінки, Матеріали і методи оброблених IL-2, і лімфоцитів перитонеального U-KRS вводили внутрішньочеревинно в дозі ексудату була значно підвищена доданням U-KRS 30мг/кг через день протягом шести місяців самидо середовища для лізису, що опосередковується цям щурів з викликаним оваріектомією раннім осклітинами. теопорозом. Введення U-KRS починали на другий Результати, що розглядаються разом з тим, день після хірургічної операції. У кінці тривалого що U-KRS також збільшує цитолітичну активність лікування U-KRS у кожного щура випробовували лімфоцитів селезінки, показують, що терапевтичміцність обох плечових кісток і визначали деякі ний ефект U-KRS, що спостерігається in vivo, опопараметри стегнових кісток щурів. середковується стимуляцією цитолітичної активРезультати ності імунних ефекторних клітин. Результати показують, що зниження механічПриклад 17: ної міцності плечових кісток і деякі зміни в стегні, Вплив U-KRS на імунологічні параметри крові що викликаються оваріектомією, запобігалися шеin vitro і in vivo стимісячним лікуванням U-KRS. Матеріали і методи Приклад 20: Для цього дослідження використали 96 щурів Вплив препарату U-KRS на віруси грипу і бакWistar. Початковий вік становив 16 тижнів як для терії Е. соlі і S. aureus самців, так і для самиць щурів. Матеріали і методи U-KRS і ФГА випробовували в дослідженні з 3 Н-тимідином на Т-лімфоцитах для оцінки показВіруси грипу штаму APR/HON1/34 культивуваника стимуляції при дозах від 0,01 до 20мкг/мл. ли на 10-денних курячих ембріонах. Результати Використовували бактерії Е. соlі, отримані з U-KRS стимулює різні субпопуляції гематопоесвіжого клінічного матеріалу, і штам S. aureus тичних і імунологічних систем. При цьому експе209P, препарат U-KRS серії 290614. рименті індукувався ретикулоцитоз як можлива Результати ознака стимуляції деяких стовбурових клітин або Це дослідження підтверджує існування протизагальної активації еритропоетичної системи. інфекційної дії препарату U-KRS в інфікованому Оскільки не могло бути продемонстровано ніяких макроорганізмі. Цей вплив виявляється через стизмін абсолютного числа лейкоцитів, можна ствермуляцію деяких елементів імунної системи хазяїна джувати, що при дії U-KRS в цьому експерименті внаслідок повторної деструкції мікроорганізмів або виявлялися тільки сильні модулюючі властивості, клітин, інфікованих цими мікроорганізмами. наприклад, дислокація різних субпопуляцій, що Приклад 21: відбувається в цьому експерименті. Біологічна активність U-KRS відносно вірусу Стимуляцію, порівнянну зі стимуляцією, що грипу отримується при цих експериментах, спостерігали Матеріали і методи in vitro, включаючи апоптоз у ракових клітин. Вірус типу А, культура Port-Chalmers 1/73, анПриклад 18: тигенний різновид H3N2. Вірусом 1, 10 і 100 ЕID50 інфікували ембріони. U-KRS розчиняли de novo в Переважна дія U-KRS на антигенність овальрозчині Хенкса. буміну і антиовальбуміновий IgE антитільну відпоРезультати відь у мишей Було підтверджено, що U-KRS володіє дією, Матеріали і методи перешкоджаючою розвитку інфекційного процесу. Здатність U-KRS придушувати викликану оваПриклад 22: льбуміном сенсибілізацію випробовували на миДія U-KRS на ефекти опромінення шах BALB/c і F1 (BALB/c x C57BI/6J). U-RRS, ввеМатеріали і методи дений мишам в суміші з антигеном (овальбумін) і Самці мишей CBA/J вагою 16/20г. ад'ювантом (квасці), придушував сенсибілізацію Проводили короткочасне гама-опромінення мишей, що відображається в більш низькій антивсього тіла мишей дозами в інтервалі 6,0Гр до ОА IgE антитільній відповіді, і знижував виділення 7,5Γρ. Довготривале опромінення сукупною дозою викликаного антигеном гістаміну огрядними кліти8,75Гр виконували, використовуючи пристрій нами, виділеними з перитонеальної порожнини CEGO. сенсибілізованих мишей. Дію U-KRS на антигенU-KRS вводили внутрішньочеревинно в дозах ність овальбуміну (ОА) при анафілаксії випробову0,1, 1,4 і 12мг/кг ваги тіла. вали при гетерологічній пасивній шкірній анафілаРезультати ктичній (ПША) реакції у щурів. Здатність U-KRS модифікувати ефекти опроРезультати мінення вивчали на мишах CBA/J, використовуючи Результати показують, що ОА, приготований у дозування лікарського засобу від 0,1 до 12мг/кг. Uвигляді суміші з U-KRS, володів зниженою здатнісKRS, як виявлено, збільшує міру виживання митю реагувати з анти-ОА IgE антитілами, рівень шей на 50-60% при дозах опромінення від 5,00 до яких до природного ОА у мишей підвищувався, і 7Гр з відсутністю ефекту при дозі 7,5Гр. Зміна дофіксувався на поверхні огрядних клітин щурів при зування лікарського засобу не впливала на вихід гетерологічних реакціях ПША. Результати кажуть опромінення. про те, що попередня обробка U-KRS ОА може Основним підсумком даного дослідження є вивпливати на його антигенні властивості і на здатявлення того, що U-KRS здатний до модифікації ність реагувати з анти-ОА IgE антитілами, що виникли проти природних молекул IgE. 23 89353 24 ефектів опромінення, коли застосовується в пробуферним фізіологічним розчином і додавали свіфілактичному і лікувальному режимах. же середовище. Приклад 23: Результати Ефекти U-KRS проти іонізуючого опромінення Лікування U-KRS давало в результаті залежне Матеріали і методи від часу і дози зниження клоногенного виживання Карцинома молочних залоз, колоректальна клітин. Всі чотири перевірені лінії людських пухаденокарцинома, гліобластома і лінії клітин аденолинних клітин показали різну чутливість у віднокарциноми підшлункової залози. Препарат U-KRS. шенні U-KRS з до 100-кратно більш високого зниДію U-KRS на виживання клітин випробовуваження клоногенного виживання в порівнянні з ли при концентрації в інтервалі від 0,2мкг/мл. Час людськими фібробнастами протягом 24-годинної впливу був такий, що дорівнює 1, 3 і 24 годинам, інкубації. після чого клітини промивали фосфатно 25 89353 26 27 89353 28 29 89353 30 31 Комп’ютерна верстка О. Гапоненко 89353 Підписне 32 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюQuaternary chelidonine and alkaloid derivatives, process for their preparation and their use in manufacture of medicaments
Автори англійськоюNowicky Wassyl
Назва патенту російськоюЧетвертичные хелидониновые и алкалоидные производные, способ их получения и их применение в производстве лекарственных средств
Автори російськоюНовицкий Вассиль
МПК / Мітки
МПК: A61K 31/4741, A61K 31/00, A61K 31/14, C07F 9/6561, C07F 9/564
Мітки: похідні, отримання, засобів, застосування, лікарських, четвертинні, хелідонінові, виробництві, алкалоїдні, спосіб
Код посилання
<a href="https://ua.patents.su/16-89353-chetvertinni-khelidoninovi-i-alkalodni-pokhidni-sposib-kh-otrimannya-i-kh-zastosuvannya-u-virobnictvi-likarskikh-zasobiv.html" target="_blank" rel="follow" title="База патентів України">Четвертинні хелідонінові і алкалоїдні похідні, спосіб їх отримання і їх застосування у виробництві лікарських засобів</a>
Попередній патент: Спосіб введення літер алфавіту та пристрій для його здійснення
Наступний патент: Спосіб визначення відносної концентрації карбоксигемоглобіну в артеріальній крові
Випадковий патент: Спосіб одержання солей розувастатину