Застосування безсироваткового культурального середовища для одержання рекомбінантних димерних гонадотропінів
Формула / Реферат
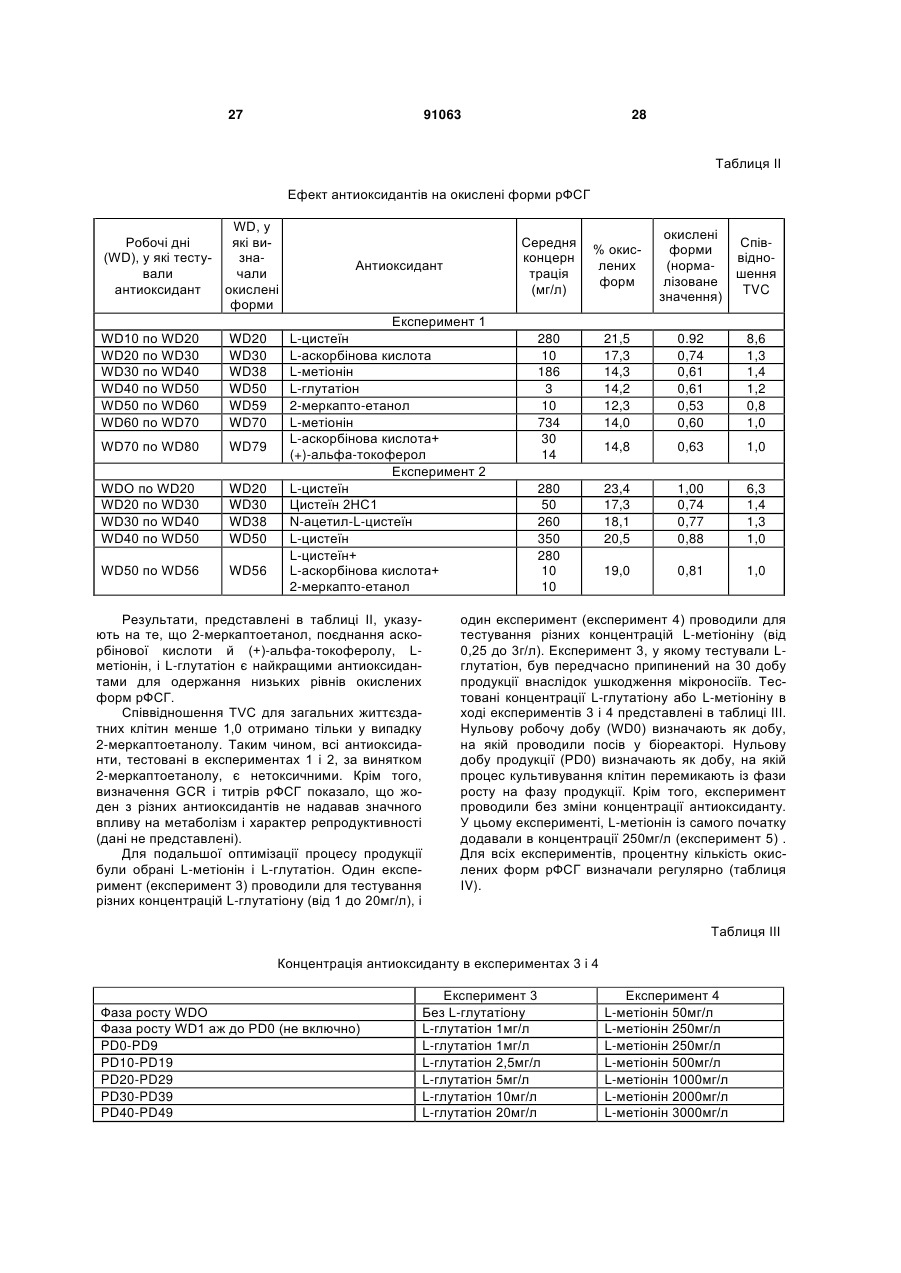
1. Застосування безсироваткового культурального середовища для одержання рекомбінантних димерних гонадотропінів, яке відрізняється тим, що зазначене культуральне середовище містить антиоксидант, вибраний із групи, що складається з:
- L-глутатіону в концентрації в діапазоні від приблизно 1 до приблизно 20 мг/л;
- 2-меркаптоетанолу в концентрації в діапазоні від приблизно 5 до приблизно 15 мг/л;
- L-метіоніну в концентрації в діапазоні від приблизно 200 до приблизно 400 мг/л; і
- поєднання аскорбінової кислоти в концентрації в діапазоні від приблизно 10 до приблизно 50 мг/л і (+)-альфа-токоферолу в концентрації в діапазоні від приблизно 5 до приблизно 25 мг/л.
2. Застосування за п. 1, де зазначений антиоксидант вибраний із групи, що складається з:
- L-глутатіону в концентрації приблизно 3 мг/л;
- 2-меркаптоетанолу в концентрації приблизно 10 мг/л;
- L-метіоніну в концентрації приблизно 250 мг/л; і
- поєднання аскорбінової кислоти в концентрації приблизно 30 мг/л і (+)-альфа-токоферолу в концентрації приблизно 14 мг/л.
3. Застосування за п. 1 або 2, де зазначене культуральне середовище являє собою середовище з певним хімічним складом.
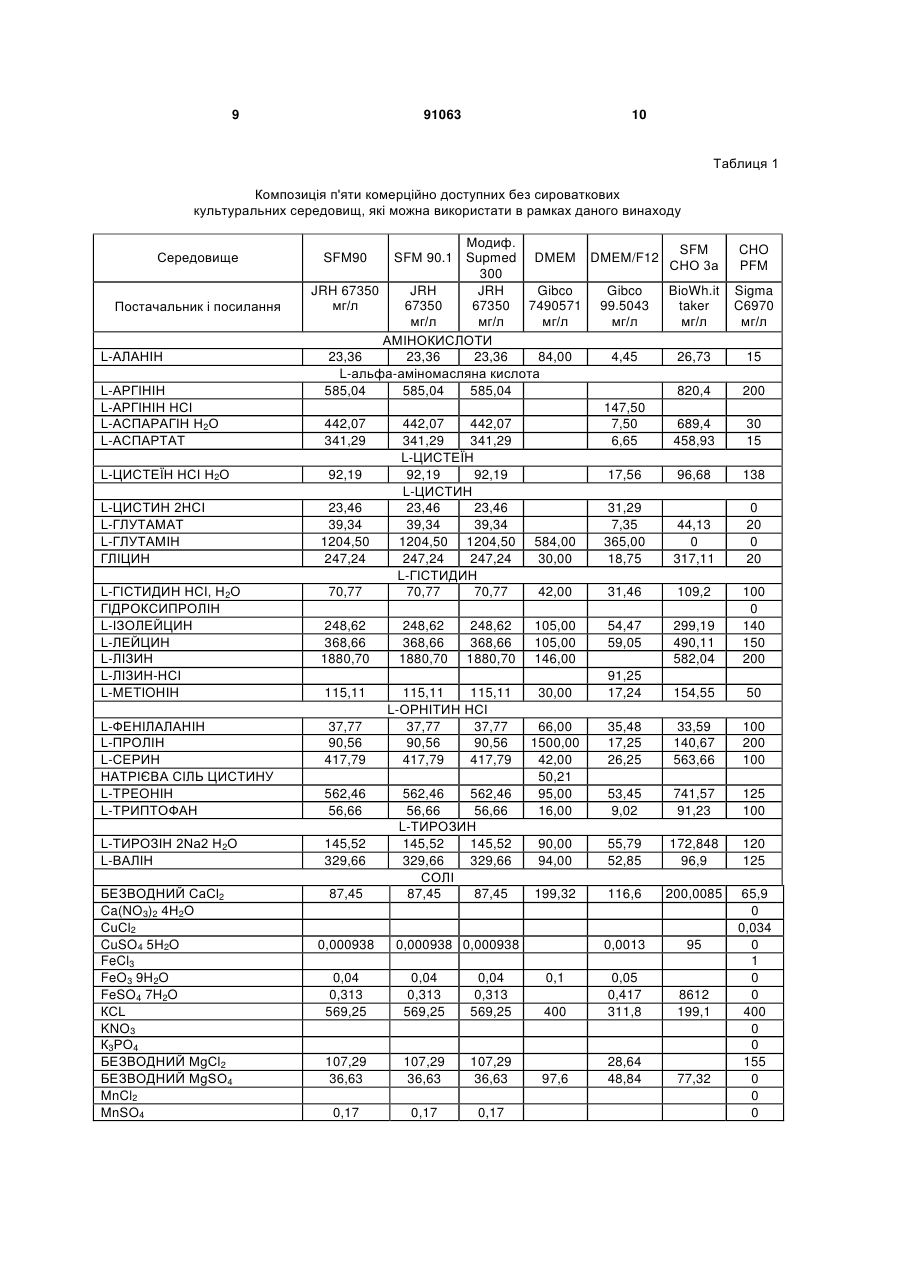
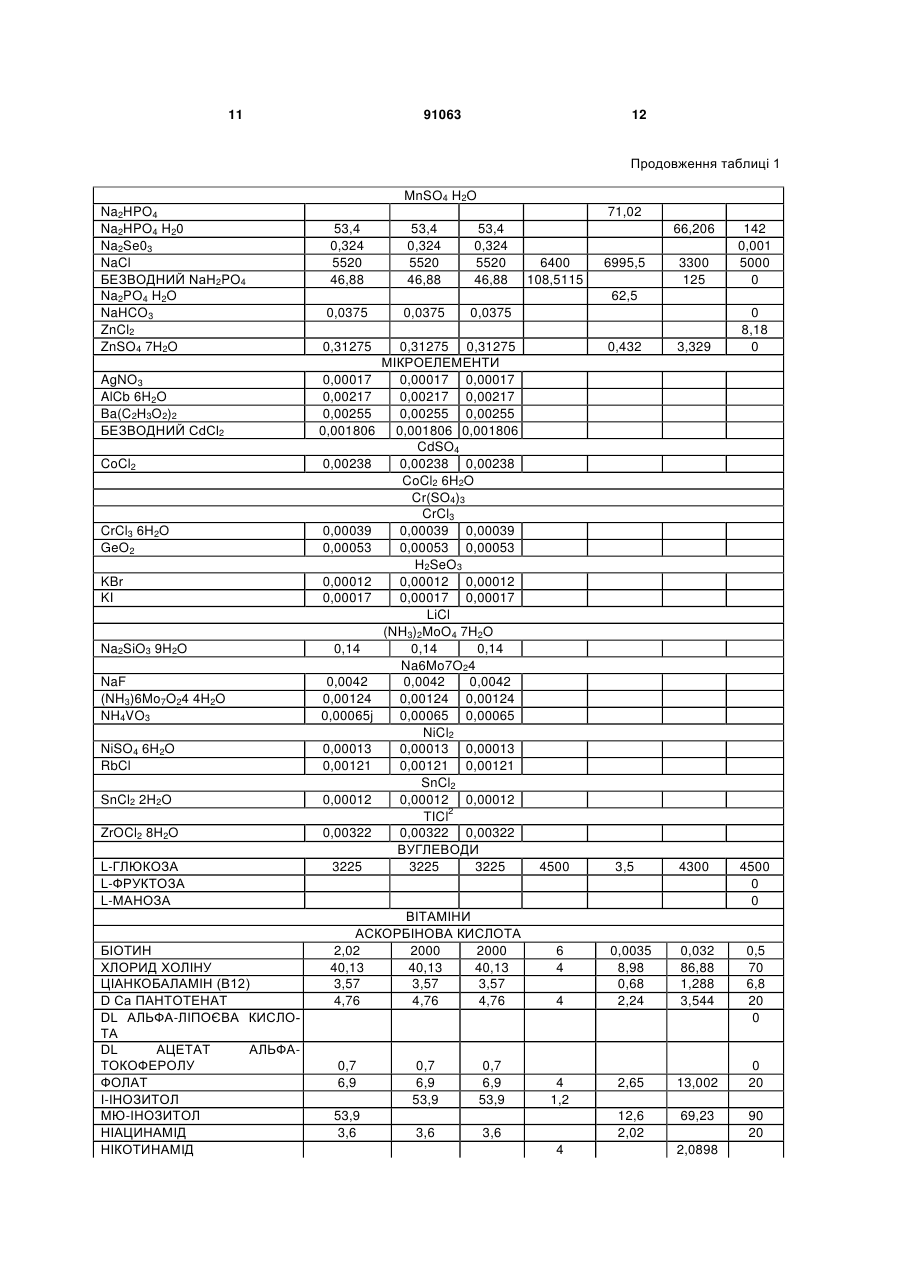
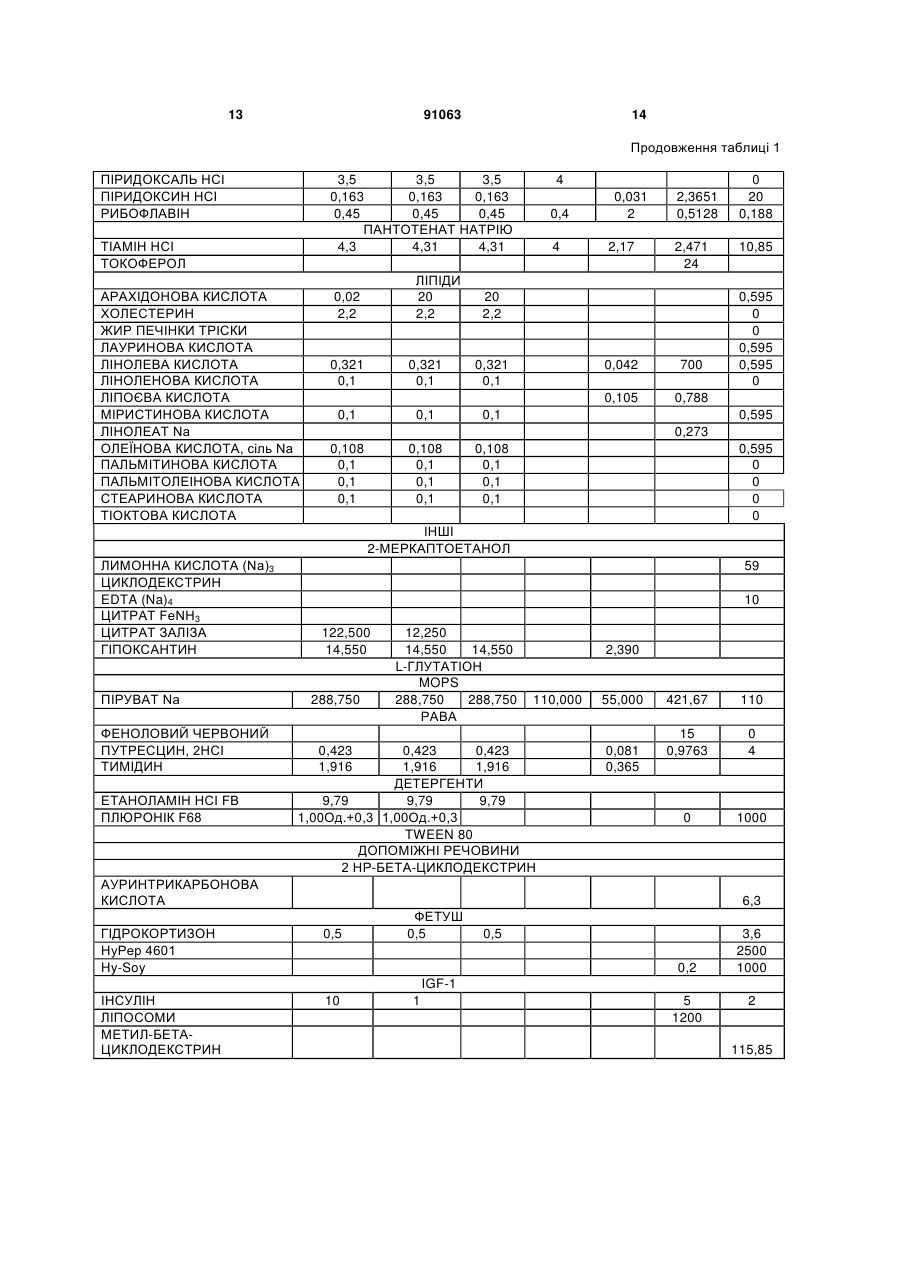
4. Застосування за будь-яким з пп. 1-3, де зазначене культуральне середовище вибране із групи, що складається з SFM 90, SFM 90.1, SupMed300, DMEM, DMEM/F12, SFM CHO 3а, CHP PFM, ProCHO 5, EX-CELL, CHO-CD3, CHO III PFM, CHO-S-SFM II, CHO-DHFR, SFM4CHO, Ultra CHO, HyQ PF CHO, HyQ SFX CHO, HyQ CDM4CHO, IS CHO-CD, IS CHO-V, і їхніх похідних.
5. Застосування за п. 4, де зазначений димерний гонадотропін являє собою фолікулостимулювальний гормон (ФСГ).
6. Застосування за будь-яким з пп. 1-5, де зазначений рекомбінантний димерний гонадотропін продукований у клітинах яєчника китайського хом'яка (CHO).
7. Спосіб зниження рівнів окислених форм рекомбінантного димерного гонадотропіну в ході процесу його виробництва, що включає стадію культивування клітин, які експресують зазначений рекомбінантний димерний гонадотропін, у безсироватковому культуральному середовищі, що містить антиоксидант.
8. Спосіб за п. 7, де зазначене культуральне безсироваткове середовище, що містить антиоксидант, являє собою середовище, як визначено в будь-якому із пп.1-4.
9. Спосіб за п. 7 або 8, де стадія культивування включає стадії:
a) інокуляції зазначених клітин у зазначене безсироваткове культуральне середовище;
b) фази росту; і
c) фази продукції.
10. Спосіб за будь-яким з пп. 7-9, де зазначений процес виробництва далі включає стадію збирання середовища, що містить зазначений рекомбінантний димерний гонадотропін.
11. Спосіб за будь-яким з пп. 7-10, де зазначений процес виробництва далі включає стадію очищення зазначеного рекомбінантного димерного гонадотропіну.
12. Спосіб за будь-яким з пп. 7-11, де зазначений процес виробництва далі включає стадію складання зазначеного рекомбінантного димерного гонадотропіну у фармацевтичну композицію.
13. Спосіб за будь-яким з пп. 7-12, який відрізняється тим, що щонайменше дві стадії зазначеного процесу виробництва проводять у присутності антиоксиданту.
14. Спосіб за будь-яким з пп. 7-13, де зазначений гонадотропін являє собою ФСГ.
15. Спосіб за будь-яким з пп. 7-14, де зазначений рекомбінантний димерний гонадотропін продукований клітинами CHO.
16. Безсироваткове культуральне середовище для одержання рекомбінантних димерних гонадотропінів, яке відрізняється тим, що зазначене культуральне середовище містить антиоксидант, вибраний із групи, що складається з:
- L-глутатіону в концентрації приблизно 3 мг/л;
- 2-меркаптоетанолу в концентрації приблизно 10 мг/л;
- L-метіоніну в концентрації приблизно 250 мг/л; і
- поєднання аскорбінової кислоти в концентрації в діапазоні від приблизно 10 до приблизно 50 мг/л і (+)-альфа-токоферолу в концентрації в діапазоні від приблизно 5 до приблизно 25 мг/л.
17. Культуральне середовище за п. 16, де зазначений антиоксидант являє собою поєднання аскорбінової кислоти в концентрації приблизно 30 мг/л і (+)-альфа-токоферолу в концентрації приблизно 14 мг/л.
18. Культуральне середовище за п. 16 або 17, де зазначене культуральне середовище являє собою середовище з певним хімічним складом.
Текст
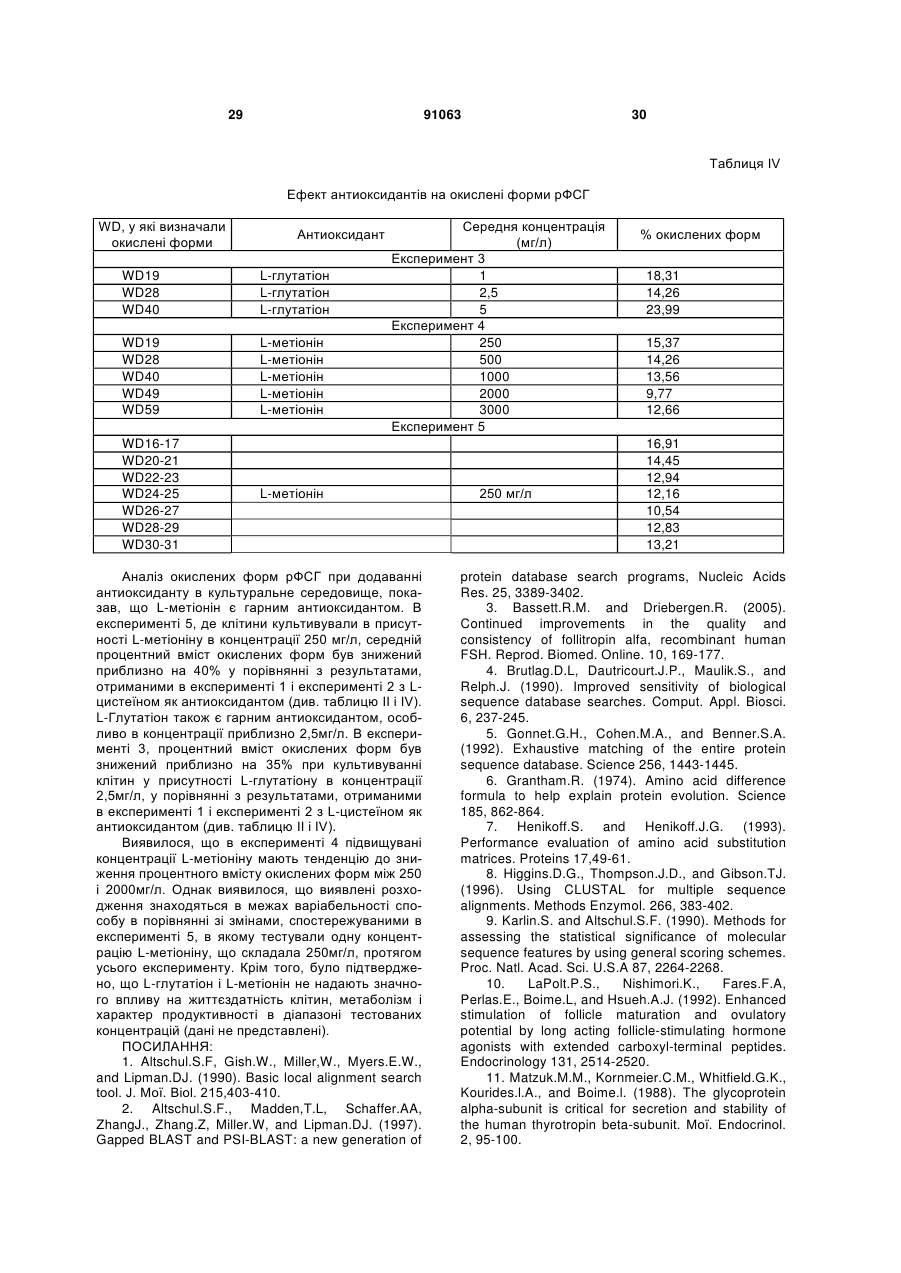
1. Застосування безсироваткового культурального середовища для одержання рекомбінантних димерних гонадотропінів, яке відрізняється тим, що зазначене культуральне середовище містить антиоксидант, вибраний із групи, що складається з: - L-глутатіону в концентрації в діапазоні від приблизно 1 до приблизно 20мг/л; 2 (19) 1 3 91063 4 9. Спосіб за п.7 або п.8, де стадія культивування включає стадії: a) інокуляції зазначених клітин у зазначене безсироваткове культуральне середовище; b) фази росту; і c) фази продукції. 10. Спосіб за будь-яким з пп.7-9, де зазначений процес виробництва далі включає стадію збирання середовища, що містить зазначений рекомбінантний димерний гонадотропін. 11. Спосіб за будь-яким з пп.7-10, де зазначений процес виробництва далі включає стадію очищення зазначеного рекомбінантного димерного гонадотропіну. 12. Спосіб за будь-яким з пп.7-11, де зазначений процес виробництва далі включає стадію складання зазначеного рекомбінантного димерного гонадотропіну у фармацевтичну композицію. 13. Спосіб за будь-яким з пп.7-12, який відрізняється тим, що щонайменше дві стадії зазначеного процесу виробництва проводять у присутності антиоксиданту. 14. Спосіб за будь-яким з пп.7-13, де зазначений гонадотропін являє собою ФСГ. 15. Спосіб за будь-яким з пп.7-14, де зазначений рекомбінантний димерний гонадотропін продукований клітинами CHO. 16. Безсироваткове культуральне середовище для одержання рекомбінантних димерних гонадотропінів, яке відрізняється тим, що зазначене культуральне середовище містить антиоксидант, вибраний із групи, що складається з: - L-глутатіону в концентрації приблизно 3мг/л; - 2-меркаптоетанолу в концентрації приблизно 10мг/л; - L-метіоніну в концентрації приблизно 250мг/л; і - поєднання аскорбінової кислоти в концентрації в діапазоні від приблизно 10 до приблизно 50мг/л і (+)-альфа-токоферолу в концентрації в діапазоні від приблизно 5 до приблизно 25мг/л. 17. Культуральне середовище за п.16, де зазначений антиоксидант являє собою поєднання аскорбінової кислоти в концентрації приблизно 30мг/л і (+)-альфа-токоферолу в концентрації приблизно 14мг/л. 18. Культуральне середовище за п.16 або 17, де зазначене культуральне середовище являє собою середовище з певним хімічним складом. Даний винахід стосується галузі виробництва рекомбінантних білків. Більш конкретно, він стосується застосування безсироваткового культурального середовища, що містить антиоксидант, для продукції рекомбінантних димерних гонадотропінів. Антиоксидант може бути вибраний із групи, що складається з L-глутатіону, 2-меркаптоетанолу, Lметіоніну й поєднання аскорбінової кислоти й (+)альфа-токоферолу. Даний винахід стосується одержання рекомбінантного фолікулостимулюючого гормону (ФСГ). ФСГ належить до класу гонадотропінів. ФСГ використовують для лікування безплідності й порушень репродуктивної системи в пацієнтів як жіночої, так і чоловічої статі. ФСГ використовують у жінок-пацієнток для індукції овуляції (01) і для контрольованої гіперстимуляції яєчників (СОН), наприклад, у допоміжних репродуктивних технологіях (ART). При типовій схемі лікування для індукції овуляції, пацієнтці вводять добові ін'єкції ФСГ або його похідного (приблизно від 75 до 300 ME РФСГ/доба) протягом періоду від приблизно 6 до приблизно 12 діб. У типовій схемі лікування для контрольованої гіперстимуляції яєчників, пацієнтці вводять добові ін'єкції ФСГ або його похідного (приблизно 150-600 ME РФСГ/доба) протягом періоду від приблизно 6 до приблизно 12 діб. Також ФСГ використовують для індукції сперматогенезу в чоловіків, що страждають на олігоспермію. Схема з використанням 150 ME ФСГ 3 рази на тиждень у поєднанні з 2500 ME hCG два рази на тиждень є успішною для досягнення поліпшення показників підрахунку сперматозоїдів у чоловіків, що страждають гіпогонадотропним гіпогонадизмом. Внаслідок значення ФСГ для лікування порушень ферти льності, бажаним є надання ФСГ із високою стабільністю й високо специфічною активністю. У природі, ФСГ продукується гіпофізом. Для фармацевтичного застосування, ФСГ можна одержувати рекомбінантними способами (рФСГ), або його можна виділяти із сечі жінок у постменопаузальному періоді (мФСГ). Для процесу виготовлення рФСГ необхідні дві основні стадії: культивування отриманої способами генетичної інженерії клітини, що експресує ФСГ, і очищення білка. Потім з метою одержання фармацевтичної композиції, білок поєднують із фармацевтично прийнятним носієм. Раніше для культивування клітин використовували культуральне середовище, доповнене сироваткою, що служила як універсальна харчова добавка для росту й підтримки всіх клітинних ліній ссавців. Однак поява BSE (бичачої спонгіформної енцефалопатії), трансмісивного нейродегенеративного захворювання великої рогатої худоби із тривалим латентним або інкубаційним періодом, викликало побоювання регулювальних органів, що стосуються використання отриманої із тварин сироватки при одержанні біологічно активних продуктів. Таким чином, у цей час є переважною продукція рекомбінантних білків з використанням безсироваткового середовища. Такі середовища добре відомі в даній галузі і їх комерційно виготовляють кілька компаній, наприклад, такі як Sigma, BioWhittaker, Gibco BRL, Cambrex і JRH. Однією із проблем, що зустрічаються при зберіганні рФСГ, є наявність окислених форм ФСГ. Для часткового рішення цієї проблеми у фармацевтичну композицію можна додавати антиоксидант із метою стабілізації білка ФСГ у процесі зберігання перед введенням пацієнту, що потребує ліку 5 вання. Наприклад, в ЕР 0853945 (Skrabanja and Van den Oetelaar, 1998) описані рідкі склади, що містять гонадотропін, змішані зі стабілізатором, наприклад, таким як цитрат натрію в концентрації 25-100 мм і L-метіонін у концентрації 1-10 мм. Показано, що такі склади дозволяють зберігати склади ФСГ протягом більш тривалих періодів часу. WO 92/15614 (Takruri H., 1992) також стосується способу інгібування окислювання поліпептиду в рідкій або напіврідкій фармацевтичній композиції, наприклад, такій як середовище для зберігання або водний офтальмічний розчин. Конкретно, в WO 92/15614 показано, що офтальмічний розчин або офтальмічна мазь, що містить L-метіонін у концентрації 10 мг/л стабілізує епідермальний фактор росту людини. Однак у зазначених вище документах описане застосування антиоксиданту тільки у фармацевтичному складі, але не в культуральному середовищі. Також у культуральне середовище можна додавати амінокислоти й сполуки, що проявляють антиоксидантну активність, або як харчові добавки, або для захисту клітинних ліній від загибелі клітин. Наприклад, у патенті США No. 4560655 описане безсироваткове середовище, що містить приблизно 30мг/л L-метіоніну, де зазначене середовище використовують для культивування клітин сім'яника свині, клітин мієломи AG 14 і клітин селезінки миші. В WO 95/12664 описаний спосіб, за допомогою якого в конкретній клітинній лінії можна подолати недолік, що є наслідком недостатніх кількостей різних обмежуючий ріст факторів, де один з них являє собою амінокислоту L-метіонін. Конкретно, в WO 95/12664 описаний спосіб адаптації клітинної лінії СНО E5F3G, що експресує MCSF людини, до росту при підвищеній щільності клітин. У цьому способі клітини СНО E5F3G вирощують у середовищі, що містить 104мг/л Lметіоніну (див. приклад і таблицю 2). Yun et al. описують, що додавання поєднання глутатіону й хелаторів заліза в культуральне середовище знижує загибель клітин СНО (Yun et al., 2003). Далі, Saito et al. описують, що для захисту клітинної лінії від загибелі в культуральному середовищі можна використовувати різні антиоксиданти (Saito et al., 2003). Однак в WO 95/12664, патенті США No. 4560655, Yun et al. і Saito et al. не описаний потенційний ефект (якщо він є) амінокислот, глутатіону й хелаторів заліза на рівень окислювання рекомбінантного білка, що продукується клітинною лінією. На закінчення, у цих документах описане тільки застосування L-метіоніну або глутатіону в поєднанні з хелаторами заліза для поліпшення росту й/або життєздатності клітин, що культивуються. WO 99/50390 стосується культурального середовища для продукції лейкоцитами інтерферона-а, де зазначене культуральне середовище містить метіонін. За допомогою ВЕРХ показано, що якість білка інтерферона- після очищення поліпшується при додаванні в культуральне середовище метіоніну. Автори винаходу в WO 99/50390 зробили припущення, що це поліпшення може бути наслідком зниження окислювання білка інтерферона- . Далі в WO 99/50390 зазначено, що занадто низька кількість метіоніну приводить до 91063 6 зниження ефекту й що занадто велика кількість викликає зниження виходу інтерферону. Конкретно, в WO 99/50390 описано, що діапазон приблизно від 50 до 100мг/л є особливо переважним діапазоном при продукції інтерфероналейкоцитами. Крім того, в WO 99/50390 описано тільки середовище для продукції інтерферона-а, що являє собою мономерний білок. В WO 99/50390 не згадується й не пропонується середовище для продукції димерних гормонів, наприклад, таких як ФСГ, що секретується винятково при димеризації (Matzuk et al., 1988). Таким чином, жоден зі згаданих вище документів не стосується застосування антиоксиданту в безсироватковому культуральному середовищі для зниження окислювання димерних гонадотропінів. В основі даного винаходу лежить несподіване відкриття, що вже в ході виробництва рФСГ в супернатанті клітинної культури з'являються окислені форми рФСГ. Більше того, продукція рФСГ у безсироватковому середовищі приводить до більш високих рівнів окислених форм, ніж продукція рФСГ в середовищі, що містить сироватку. У рамках даного винаходу було зненацька виявлено, що рівні окислених форм рФСГ можна знижувати не тільки в ході зберігання, але й у ході стадії культивування. Це зниження можна здійснювати без порушення продуктивності. Зниження проводять за допомогою додавання антиоксиданту в культуральне середовище. Конкретно, було виявлено, що доповнення безсироваткового середовища або (і) 2-меркаптоетанолом, або (іі) поєднанням аскорбінової кислоти й (+)-альфа-токоферолу, або (ііі) Lметіоніном, або (iv) L-глутатіоном, у ході культивування клітин, які експресують рФСГ, знижує рівні окислених форм рФСГ. Таким чином, у першому аспекті, цей винахід стосується застосування безсироваткового культурального середовища для одержання рекомбінантних димерних гонадотропінів, які відрізняються тим, що зазначене культуральне середовище містить антиоксидант, вибраний із групи, що складається з: - L-глутатіону в концентрації в діапазоні від приблизно 1 до приблизно 20мг/л; - 2-меркаптоетанолу в концентрації в діапазоні від приблизно 5 до приблизно 15мг/л; - L-метіоніну в концентрації в діапазоні від приблизно 200 до приблизно 500мг/л; і - поєднання аскорбінової кислоти в концентрації в діапазоні від приблизно 10 до приблизно 50мг/л і (+)-альфа-токоферолу в концентрації в діапазоні від приблизно 5 до приблизно 25мг/л. У другому аспекті цей винахід стосується способу зниження рівнів окислених форм рекомбінантного димерного гонадотропіну в ході процесу його виготовлення, який відрізняється тим, що клітини, які експресують зазначений рекомбінантний димерний гонадотропін, культивують у безсироватковому культуральному середовищі, що містить антиоксидант. Третій аспект цього винаходу стосується безсироваткового культурального середовища для одержання рекомбінантних димерних гонадотропі 7 нів, який відрізняється тим, що зазначене культуральне середовище містить антиоксидант, вибраний із групи, що складається з: - L-глутатіону в концентрації в діапазоні від приблизно 1 до приблизно 20мг/л; - 2-меркаптоетанолу в концентрації в діапазоні від приблизно 5 до приблизно 15мг/л; - L-метіоніну в концентрації в діапазоні від приблизно 200 до приблизно 500мг/л; і - поєднання аскорбінової кислоти в концентрації в діапазоні від приблизно 10 до приблизно 50мг/л і (+)-альфа-токоферолу в концентрації в діапазоні від приблизно 5 до приблизно 25мг/л. Даний винахід пов'язаний з відкриттям, що рівні окислених форм рФСГ можна значно знижувати при культивуванні клітин, що експресують рФСГ, у безсироватоковому середовищі, що містить антиоксиданти. Як показано в прикладі 3, для зниження рівнів окислених форм рФСГ у ході процесу культивування особливо переважними є або (і) 2-меркаптоетанол, або (іі) поєднання аскорбінової кислоти й (+)-альфа-токоферолу, або (ііі) Lметіонін, або (iv) L-глутатіон. Важливо, що цього зниження можна досягати без порушення життєздатності й метаболізму клітини, і без зниження титрів рФСГ. Таким чином, перший аспект даного винаходу стосується застосування безсироваткового культурального середовища для одержання рекомбінантних димерних гонадотропінів, який відрізняється тим, що зазначене культуральне середовище містить антиоксидант, вибраний із групи, що складається з: - L-глутатіону в концентрації в діапазоні від приблизно 1 до приблизно 20мг/л; - 2-меркаптоетанолу в концентрації в діапазоні від приблизно 5 до приблизно 15мг/л; - L-метіоніну в концентрації в діапазоні від приблизно 200 до приблизно 500мг/л; і - поєднання аскорбінової кислоти в концентрації в діапазоні від приблизно 10 до приблизно 50мг/л і (+)-альфа-токоферолу в концентрації в діапазоні від приблизно 5 до приблизно 25мг/л. Переважно, безсироваткове культуральне середовище відповідно до даного винаходу містить L-глутатіон у концентрації в діапазоні від приблизно 1, 1,5, 2 до приблизно 4, 5, 6, 7, 8, 9, 10, 15 або 20мг/л. Найбільше переважно, безсироваткове культуральне середовище містить L-глутатіон у концентрації приблизно 2,5 або 3мг/л. Як використовують у даному описі, термін "глутатіон" використовують взаємозамінно с терміном "L-глутатіон". Переважно, безсироваткове культуральне середовище відповідно до даного винаходу містить 2-меркаптоетанол у концентрації в діапазоні від приблизно 5, 6, 7, 8, 9 до приблизно 11, 12, 13, 14 або 15мг/л. Найбільше переважно, безсироваткове культуральне середовище містить 2меркаптоетанол у концентрації приблизно 10мг/л. Переважно, безсироваткове культуральне середовище відповідно до даного винаходу містить 91063 8 поєднання аскорбінової кислоти в концентрації в діапазоні від приблизно 10 до приблизно 50мг/л і (+)-альфа-токоферолу в концентрації в діапазоні від приблизно 5 до приблизно 25 мг/л. Більш переважно, таке середовище містить (+)-альфатокоферол у концентрації в діапазоні від приблизно 5, 8, 10 або 12 до приблизно 16, 18, 20, 22 або 25мг/л і аскорбінову кислоту в концентрації в діапазоні від приблизно 15, 20 або 25 до приблизно 35, 40 або 45мг/л. Найбільш переважно, таке безсироваткове культуральне середовище містить (+)-альфа-токоферол у концентрації приблизно 14мг/л і аскорбінову кислоту в концентрації приблизно 30мг/л. Як використовують у даному описі, термін "(+)-альфа-токоферол" використовують взаємозамінно з терміном "вітамін А", і термін "аскорбінова кислота" використовують взаємозамінно з терміном "L-аскорбінова кислота". Переважно, безсироваткове культуральне середовище відповідно до даного винаходу містить L-метіонін у концентрації в діапазоні від приблизно 200, 205, 210, 215, 220, 225, 230, 235, 240 або 245мг/л до приблизно 300, 325, 350, 375, 400, 425, 450, 475 або 500мг/л. Найбільш переважно, безсироваткове культуральне середовище містить Lметіонін у концентрації приблизно 250мг/л. Як використовують у даному описі, термін "метіонін" використовують взаємозамінно з терміном "Lметіонін". Будь-яке безсироваткове культуральне середовище можна доповнювати антиоксидантами відповідно до даного винаходу. Комерційно доступні безсироваткові середовища, які можна використовувати відповідно до даного винаходу включають, наприклад, SFM 90 (JRH, 67350), SFM 90.1 (JRH, 67350), Supmed300 або модифіковане Supmed300 (JRH, 67350), DMEM (Gibco, 7490571), DMEM/F12 (Gibco, 99.5043), SFM CHO 3a (BioWhittaker), CHO PFM (Sigma, C6970), ProCHO 5, середовища EX-CELL, такі як EX-CELL 302 (JRH, каталожний No. 143121000M) або EX-CELL 325 (JRH, каталожний No. 14335-1000M), CHO-CD3 (Sigma, каталожний No. C-1490), CHO III PFM (Gibco, каталожний No. 960334SA), CHO-S-SFM II (Gibco, каталожний No. 12052-098), CHO-DHFR (Sigma, каталожний No. C8862), ProCHO 5 (Cambrex, каталожний No. BE12766Q), SFM4CHO (HyClone, каталожний No. SH30549.01), Ultra CHO (Cambrex, каталожний No. 12-724Q), HyQ PF CHO (HyClone, каталожний No. SH30220.01), HyQ SFX CHO (HyClone, каталожний No. SH30187.01), HyQ CDM4CHO (HyClone, каталожний No. SH30558.01), IS CHO-CD (Irvine Scientific, каталожний No. #91119), IS CHO-V (Irvine Scientific, каталожний No. #9197) і їхні похідні. Композиція SFM 90, SFM 90.1, SupMed300, DMEM, DMEM/F12, SFM CHO 3а й СНР PFM, які можна використовувати відповідно до даного винаходу, представлена в таблиці 1, нижче. 9 91063 10 Таблиця 1 Композиція п'яти комерційно доступних без сироваткових культуральних середовищ, які можна використати в рамках даного винаходу Середовище Постачальник і посилання L-АЛАНІН L-АРГІНІН L-АРГІНІН НСІ L-АСПАРАГІН Н2О L-АСПАРТАТ L-ЦИСТЕЇН НСІ Н2О L-ЦИСТИН 2НСІ L-ГЛУТАМАТ L-ГЛУТАМІН ГЛІЦИН L-ГІСТИДИН НСІ, Н2О ГІДРОКСИПРОЛІН L-ІЗОЛЕЙЦИН L-ЛЕЙЦИН L-ЛІЗИН L-ЛІЗИН-НСІ L-METIOHIH Модиф. SFM SFM 90.1 Supmed DMEM DMEM/F12 CHO 3а 300 JRH 67350 JRH JRH Gibco Gibco BioWh.it мг/л 67350 67350 7490571 99.5043 taker мг/л мг/л мг/л мг/л мг/л АМІНОКИСЛОТИ 23,36 23,36 23,36 84,00 4,45 26,73 L-альфа-аміномасляна кислота 585,04 585,04 585,04 820,4 147,50 442,07 442,07 442,07 7,50 689,4 341,29 341,29 341,29 6,65 458,93 L-ЦИСТЕЇН 92,19 92,19 92,19 17,56 96,68 L-ЦИСТИН 23,46 23,46 23,46 31,29 39,34 39,34 39,34 7,35 44,13 1204,50 1204,50 1204,50 584,00 365,00 0 247,24 247,24 247,24 30,00 18,75 317,11 L-ГІСТИДИН 70,77 70,77 70,77 42,00 31,46 109,2 SFM90 248,62 368,66 1880,70 115,11 248,62 368,66 1880,70 145,52 329,66 БЕЗВОДНИЙ СаСl2 Ca(NO3)2 4Н2О СuСl2 CuSO4 5H2O FeCl3 FeO3 9H2O FeSO4 7H2O КСL KNO3 К3РO4 БЕЗВОДНИЙ MgCl2 БЕЗВОДНИЙ MgSO4 MnCl2 MnSO4 87,45 0,000938 30 15 138 0 20 0 20 154,55 50 66,00 1500,00 42,00 50,21 95,00 16,00 35,48 17,25 26,25 33,59 140,67 563,66 100 200 100 53,45 9,02 741,57 91,23 125 100 90,00 94,00 55,79 52,85 172,848 96,9 120 125 199,32 116,6 200,0085 0,0013 95 8612 199,1 77,32 65,9 0 0,034 0 1 0 0 400 0 0 155 0 0 0 30,00 L-TИPOЗІH 2Na2 Н2О L-ВАЛІН 200 91,25 17,24 115,11 115,11 L-ОРНІТИН НСІ 37,77 37,77 90,56 90,56 417,79 417,79 562,46 562,46 56,66 56,66 L-ТИРОЗИН 145,52 145,52 329,66 329,66 СОЛІ 87,45 87,45 0,000938 0,000938 562,46 56,66 15 299,19 490,11 582,04 105,00 105,00 146,00 37,77 90,56 417,79 Sigma C6970 мг/л 100 0 140 150 200 248,62 368,66 1880,70 L-ФЕНІЛАЛАНІН L-ПРОЛІН L-СЕРИН НАТРІЄВА СІЛЬ ЦИСТИНУ L-TPEOHIH L-ТРИПТОФАН CHO PFM 0,1 54,47 59,05 0,04 0,313 569,25 0,04 0,313 569,25 0,04 0,313 569,25 400 0,05 0,417 311,8 107,29 36,63 107,29 36,63 107,29 36,63 97,6 28,64 48,84 0,17 0,17 0,17 11 91063 12 Продовження таблиці 1 MnSO4 H2O Na2HPO4 Na2HPO4 H20 Na2Se03 NaCl БЕЗВОДНИЙ NaH2PO4 Na2PO4 H2O NaHCO3 ZnCl2 ZnSO4 7H2O 0,31275 AgNO3 AlCb 6H2O Ba(C2H3O2)2 БЕЗВОДНИЙ CdCl2 0,00017 0,00217 0,00255 0,001806 CoCl2 0,00238 CrCl3 6H2O GeO2 0,00039 0,00053 KBr KI 0,00012 0,00017 Na2SiO3 9H2O 71,02 53,4 0,324 5520 46,88 53,4 0,324 5520 46,88 53,4 0,324 5520 46,88 0,0375 0,0375 0,0375 3300 125 0,432 3,329 0 8,18 0 3,5 4300 4500 0 0 0,0035 8,98 0,68 2,24 0,032 86,88 1,288 3,544 0,5 70 6,8 20 0 2,65 13,002 12,6 2,02 6400 108,5115 142 0,001 5000 0 69,23 6995,5 62,5 0,14 NaF (NH3)6Mo7O24 4H2O NH4VO3 0,0042 0,00124 0,00065j NiSO4 6H2O RbCl 0,00013 0,00121 SnCl2 2H2O 0,00012 ZrOCl2 8H2O 0,00322 L-ГЛЮКОЗА L-ФРУКТОЗА L-MAHОЗA 3225 БІОТИН ХЛОРИД ХОЛІНУ ЦІАНКОБАЛАМІН (В12) D Са ПАНТОТЕНАТ DL АЛЬФА-ЛІПОЄВА КИСЛОТА DL АЦЕТАТ АЛЬФАТОКОФЕРОЛУ ФОЛАТ І-ІНОЗИТОЛ МЮ-ІНОЗИТОЛ НІАЦИНАМІД НІКОТИНАМІД 66,206 0,31275 0,31275 МІКРОЕЛЕМЕНТИ 0,00017 0,00017 0,00217 0,00217 0,00255 0,00255 0,001806 0,001806 CdSO4 0,00238 0,00238 CoCl2 6H2O Cr(SO4)3 CrCl3 0,00039 0,00039 0,00053 0,00053 H2SeO3 0,00012 0,00012 0,00017 0,00017 LiCl (NH3)2MoO4 7H2O 0,14 0,14 Na6Mo7O24 0,0042 0,0042 0,00124 0,00124 0,00065 0,00065 NiCl2 0,00013 0,00013 0,00121 0,00121 SnCl2 0,00012 0,00012 TICl2 0,00322 0,00322 ВУГЛЕВОДИ 3225 3225 ВІТАМІНИ АСКОРБІНОВА КИСЛОТА 2,02 2000 2000 40,13 40,13 40,13 3,57 3,57 3,57 4,76 4,76 4,76 0,7 6,9 53,9 3,6 0,7 6,9 53,9 0,7 6,9 53,9 3,6 4500 6 4 4 3,6 4 1,2 4 2,0898 0 20 90 20 13 91063 14 Продовження таблиці 1 ПІРИДОКСАЛЬ НСІ ПІРИДОКСИН НСІ РИБОФЛАВІН 3,5 3,5 3,5 0,163 0,163 0,163 0,45 0,45 0,45 ПАНТОТЕНАТ НАТРІЮ 4,3 4,31 4,31 ТІАМІН НСІ ТОКОФЕРОЛ АРАХІДОНОВА КИСЛОТА ХОЛЕСТЕРИН ЖИР ПЕЧІНКИ ТРІСКИ ЛАУРИНОВА КИСЛОТА ЛІНОЛЕВА КИСЛОТА ЛІНОЛЕНОВА КИСЛОТА ЛІПОЄВА КИСЛОТА МІРИСТИНОВА КИСЛОТА ЛІНОЛЕАТ Na ОЛЕЇНОВА КИСЛОТА, сіль Na ПАЛЬМІТИНОВА КИСЛОТА ПАЛЬМІТОЛЕІНОВА КИСЛОТА СТЕАРИНОВА КИСЛОТА ТІОКТОВА КИСЛОТА ЛІПІДИ 20 2,2 0,02 2,2 4 0,4 4 0,031 2 2,17 2,3651 0,5128 2,471 24 20 2,2 0,321 0,1 0,321 0,1 0,321 0,1 0,1 0,1 0,042 700 0,1 0,105 0 20 0,188 10,85 0,595 0 0 0,595 0,595 0 0,788 0,595 0,273 0,108 0,1 0,1 0,1 0,108 0,1 0,1 0,1 0,108 0,1 0,1 0,1 0,595 0 0 0 0 ІНШІ 2-МЕРКАПТОЕТАНОЛ ЛИМОННА КИСЛОТА (Na)3 ЦИКЛОДЕКСТРИН EDTA (Na)4 ЦИТРАТ FeNH3 ЦИТРАТ ЗАЛІЗА ГІПОКСАНТИН ПІPУBAT Na ФЕНОЛОВИЙ ЧЕРВОНИЙ ПУТРЕСЦИН, 2НСІ ТИМІДИН ЕТАНОЛАМІН НСІ FB ПЛЮРОНІК F68 59 10 122,500 14,550 288,750 12,250 14,550 14,550 L-ГЛУТАТІОН MOPS 288,750 288,750 РАВА 0,423 1,916 2,390 110,000 0,423 0,423 1,916 1,916 ДЕТЕРГЕНТИ 9,79 9,79 9,79 1,00Од.+0,3 1,00Од.+0,3 TWEEN 80 ДОПОМІЖНІ РЕЧОВИНИ 2 НР-БЕТА-ЦИКЛОДЕКСТРИН 55,000 0,081 0,365 421,67 110 15 0,9763 0 4 0 1000 АУРИНТРИКАРБОНОВА КИСЛОТА ГІДРОКОРТИЗОН НуРер 4601 Hy-Soy 6,3 0,5 ФЕТУШ 0,5 0,5 0,2 3,6 2500 1000 IGF-1 ІНСУЛІН ЛІПОСОМИ МЕТИЛ-БЕТАЦИКЛОДЕКСТРИН 10 1 5 1200 2 115,85 15 91063 16 Продовження таблиці 1 ПРИМАТОН ТРАНСФЕРИН Добавки ГЛУТАМІН Na2CO3 HEPES рекомендоване значення рН УСЬОГО (г/л) 2234,250 7 18545,60 2234,250 20444,32 У переважному варіанті здійснення даного винаходу, безсироваткове культуральне середовище являє собою середовище певного хімічного складу, тобто середовище, отримане з очищених інгредієнтів і, таким чином, точний склад якого відомий. Конкретно, середовище з певним хімічним складом не містить ні компонентів, отриманих із тварин, ні невизначених гідролізатів. Гонадотропіни, які можна продукувати відповідно до даного винаходу, включають лютеїнізуючий гормон (LH; реєстраційний номер ОМІМ No. 152780), фолікулостимулюючий гормон (ФСГ; реєстраційний номер ОМІМ No. 136530), хоріонічний гонадотропін, (CG; реєстраційний номер ОМІМ No. 118860) і тиреотропний гормон (TSH; реєстраційний номер ОМІМ No. 188540). Гонадотропіни являють собою димерні гормони. Кожний із цих гормонів складається з нековалентного димера із субодиниць альфа й бета. Альфа-субодиниця є однаковою для всіх 4 гормонів (реєстраційний номер ОМІМ No. 118850), а бета-субодиниця визначає ендокринну функцію димера (Talmadge et al., 1983). У найбільш переважному варіанті здійснення даного винаходу, гонадотропін являє собою ФСГ людини. Як використовують у даному описі, термін "ФСГ" стосується димерного білка, що складається з альфа-субодиниці, яка відповідає реєстраційному номеру SwissProt No. P01215, і бетасубодиниці, яка відповідає реєстраційному номеру SwissProt No. P01225. Оскільки ФСГ є розчинним секретованим білком, він вивільняється в супернатант клітинної культури або за допомогою його природного сигнального пептиду, або за допомогою гетерологічного сигнального пептиду, тобто сигнального пептиду, утвореного з іншого секретованого білка, що може бути більше ефективним у конкретній використовуваній експресуючій системі. Крім того, термін ФСГ включає варіанти по сплайсингу, алельні варіанти, мутеїни, функціональні похідні, активні фракції, злиті білки й білки із круговою перестановкою димерного білка, що складається з альфа-субодиниці, що відповідає реєстраційному номеру SwissProt No. P01215, і бета-субодиниці, що відповідає реєстраційному номеру SwissProt No. P01225. Як використовують у даному описі, термін "мутеїн" стосується аналогів ФСГ, в яких один або кілька амінокислотних залишків природного ФСГ або вірусного ФСГ заміщені іншими амінокислотними залишками, або вилучені, або до природної послідовності ФСГ доданий один або кілька аміно 1250 2100 4766 5000 3574,5 7,2-7,4 19431,07 16176,34 8840,29 27556,20 17292,18 2234,250 кислотних залишків, без істотної зміни активності отриманих продуктів у порівнянні із ФСГ дикого типу. Ці мутеїни одержують відомими способами синтезу і/або сайт-спрямованого мутагенезу, або будь-яким іншим способом, придатним для цього. Мутеїни відповідно до даного винаходу включають білки, кодовані нуклеїновою кислотою, такою як ДНК або РНК, що гібридизується із ДНК або РНК, що кодує ФСГ у строгих умовах. Термін "строгі умови" стосується умов гібридизації й наступного промивання, які фахівці в даній галузі звичайно відносять до "строгих" (див., наприклад, Ausubel et al., Current Protocols in Molecular Biology, вище, Interscience, N.Y., §§6.3 і 6.4, 1987, 1992). He обмежуючись цим, приклади строгих умов включають умови промивання на 12-20°С нижче обчисленої Тm досліджуваного гібрида, наприклад, в 2 SSC і 0,5% SDS протягом 5 хвилин, 2*SSC і 0,1% SDS протягом 15 хвилин; 0,1 SSC і 0,5% SDS при 37°С протягом 30-60 хвилин, а потім, 0,1 SSC і 0,5% SDS при 68°С протягом 30-60 хвилин. Фахівці в даній галузі розуміють, що умови строгості також залежать від довжини послідовності ДНК, олігонуклеотидного зонда (такий як 10-40 основ) або змішаних олігонуклеотидних зондів. Якщо використовують змішані зонди, то замість SSC переважним є застосування хлориду тетраметиламонію (ТМАС). Див. Ausubel, вище. У переважному варіанті здійснення, мутеїн ФСГ володіє щонайменше 40% Ідентичністю з послідовністю природного ФСГ. Більш переважно, він володіє щонайменше 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85% або, найбільше переважно, щонайменше 90%, 95%, 96%, 97%, 98% або 99% ідентичністю з нею. Ідентичність відбиває взаємозв'язок між двома або більше поліпегггидними послідовностями або двома або більше полінуклеотидними послідовностями, обумовлену порівнянням послідовностей. Як правило, ідентичність стосується точної відповідності нуклеотиду з нуклеотидом або амінокислоти з амінокислотою двох полінуклеотидних або двох поліпептидних послідовностей, відповідно, протягом довжини порівнюваних послідовностей. У випадку послідовностей, де відповідність є не повною, можна визначати "% ідентичності". Як правило, дві послідовності, що підлягають порівнянню, вирівнюють для забезпечення максимальної кореляції між послідовностями. Це включає вставку "делецій" або в одну, або в обидві послідовності, для підвищення ступеня вирівнювання. % Ідентичність можна визначати протягом повної 17 довжини кожної з порівнюваних послідовностей (так зване "глобальне вирівнювання"), що є особливо придатним для послідовностей однакової або дуже подібної довжини, протягом більше коротких, певних довжин (так зване "локальне вирівнювання"), що є більше придатним для послідовностей нерівної довжини. У рамках даного винаходу, "% ідентичності" стосується глобальної процентної ідентичності, визначеної протягом всієї довжини кожної з порівнюваних послідовностей. Для визначення того, чи володіє конкретний поліпептид процентною ідентичністю з послідовністю за даним винаходом, можна використати відомі комп'ютерні програми. Такі алгоритми й програми включають, наприклад, TBLASTN, BLASTP, FASTA, TFASTA і CLUSTALW (Altschul et al., 1990; Altschul et al., 1997; Higgins et al., 1996; Pearson and Lipman, 1988; Thompson et al., 1994). Гомологію послідовностей білків і нуклеїнових кислот переважно оцінюють із використанням Базового інструментарію пошуку локальних блоків ("BLAST"), що добре відомий у даній галузі (Altschul et al., 1990; Altschul et al., 1997; Karlin and Altschul, 1990). Програми BLAST ідентифікують гомологічні послідовності за допомогою ідентифікації подібних сегментів, які позначають у даному описі як "пари сегментів з максимальною подібністю", між амінокислотною послідовністю, що представляє інтерес, або послідовністю нуклеїнової кислоти й тестованою послідовністю, що переважно одержують із бази даних послідовностей білків або нуклеїнових кислот. Пари сегментів з максимальною подібністю переважно ідентифікують (тобто, вирівнюють) за допомогою оцінних матриць, множина із яких відома в даній галузі. Використовуваною оцінною матрицею може бути матриця BLOSUM62 (Gonnet et al., 1992; Henikoff and Henikoff, 1993). Також можна використати матриці РАМ або РАМ250 (див., наприклад, Schwartz and Dayhoff, eds, (1978) Matrices for Detecting Distance Relationships: Atlas of Protein Sequence and Structure, Washington: National Biomedical Research Foundation). Програми BLAST оцінюють статистичну значимість всіх ідентифікованих пар сегментів з максимальною подібністю, і переважно відбирають ті сегменти, які задовольняють зазначеному користувачем порогу значимості, такому як зазначена користувачем процентна гомологія. Переважно, статистичну значимість для пари сегментів з максимальною подібністю оцінюють із використанням формули статистичної значимості Karlin (Karlin and Altschul, 1990). Програми BLAST можна використовувати з параметрами за замовчуванням або з модифікованими параметрами, установленими користувачем. Переважний спосіб визначення найкращої повної відповідності між послідовністю, що представляє інтерес, (послідовністю за даним винаходом) і послідовністю, що піддається вирівнюванню, також позначуваний як глобальне вирівнювання послідовностей, можна визначати з використанням комп'ютерної програми FASTDB на основі алгоритму Brutlag (Brutlag et al., 1990). При вирівнюванні послідовностей, як послідовність, що представляє інтерес, так і послідовність, що піддається вирів 91063 18 нюванню, обидві являють собою амінокислотні послідовності. Результатом зазначеного глобального вирівнювання послідовностей є процентна ідентичність. Переважні параметри, використовувані у вирівнюванні амінокислот FASTDB, являють собою: Матриця=РАМ 0, к-плет=2, Штраф за невідповідність=1, Штраф за приєднання=20, Група рандомізації=25, Довжина=0, Граничний показник=1, Розмір вікна=довжина послідовності, Штраф за делецію=5, Штраф за розмір делеції=0,05, Розмір вікна=247 або довжина амінокислотної послідовності, що піддається вирівнюванню, в залежності від того, яка з них коротше. Якщо послідовність, що піддається вирівнюванню, є коротшою за послідовність, що представляє інтерес, внаслідок N- або С-кінцевих делецій, але не внаслідок внутрішніх делецій, результати, у вигляді процентної ідентичності, необхідно коректувати вручну, оскільки при обчисленні глобальної процентної ідентичності програма FASTDB не враховує відособлені N- або С-кінцеві вкорочення послідовності, що піддається вирівнюванню. Для послідовностей, що піддають вирівнюванню, укорочених з N- і С-кінця щодо послідовності, що представляє інтерес, процентну ідентичність коректують обчисленням кількості залишків послідовності, що представляє інтерес, які є N- і Скінцевими для послідовності, що піддається вирівнюванню, і які не збігаються/вирівнюються з відповідним залишком послідовності, що піддається вирівнюванню, як процентна кількість або загальне число основ послідовності, що представляє інтерес. Наявність збігу/вирівнювання залишку визначають за допомогою результатів вирівнювання послідовностей FASTDB. Цю процентну кількість потім віднімають із процентної ідентичності, обчисленої за допомогою зазначеної вище програми FASTDB з використанням певних параметрів, з одержанням кінцевого показника процентної ідентичності. Цей кінцевий показник процентної ідентичності являє собою показник, що використовують для цілей даного винаходу. Тільки залишки з N- і С-кінців послідовності, що піддається вирівнюванню, які не збігаються/вирівнюються з послідовністю, що представляє інтерес, придатні для цілей ручного коректування показника процентної ідентичності, а саме, тільки амінокислотні залишки послідовності, що представляє інтерес, зовні самих віддалених N- і С-кінцевих залишків послідовності, що піддається вирівнюванню. Наприклад, 90 амінокислотний залишок послідовності, що піддається вирівнюванню, вирівнюють із 100 залишком послідовності, що представляє інтерес, для визначення процентної ідентичності. Делеція відбулася на N-кінці послідовності, що представляє інтерес, і таким чином, вирівнювання FASTDB не збігається/вирівнюється в перших залишках на N-кінці. 10 неспарених залишків являють собою 10% послідовності (кількість, що не збіглася, залишків з N- і Скінців/загальна кількість залишків у послідовності, що представляє інтерес), так що 10% віднімають із показника процентної ідентичності, обчисленого програмою FASTDB. Якщо інші 90 залишків повні 19 стю збігаються, то кінцева процентна ідентичність становить 90%. Переважні зміни мутеїнів відповідно до даного винаходу являють собою так звані "консервативні" заміни. Консервативні амінокислотні заміни ФСГ можуть включати синонимічні амінокислоти із групи, які мають досить подібні фізико-хімічні властивості, щоб заміна між членами групи, зберігала біологічну функцію молекули (Grantham, 1974). Очевидно, що вставки й делеції амінокислот також можна вносити у визначені вище послідовності без зміни їхньої функції, зокрема, якщо вставки або делеції включають тільки кілька амінокислот, наприклад, менше тридцяти, і переважно менше десяти, і не приведуть до видалення або переміщення амінокислот, які є критичними для функціональної конформації, наприклад, залишків цистеїну. Білки й мутеїни, отримані за допомогою таких делецій й/або вставок входять в об'єм даного винаходу. Термін "злитий білок" ФСГ стосується поліпептиду, що містить ФСГ, мутеїн або його фрагмент, злитий з іншим білком, що, наприклад, має подовжений час знаходження в рідинах організму. Наприклад, ФСГ може бути злитим з імуноглобуліном або його фрагментом, таким як Fc-ділянка імуноглобуліну. Послідовність зрілого ФСГ також може бути злитою із сигнальним пептидом і/або з лідерною послідовністю, що забезпечує підвищену секрецію. У переважному варіанті здійснення за даним винаходом, бета-субодиниця ФСГ або її фрагмент є злитою із С-кінцевим пептидом (СТР) бетасубодиниці hCG. Отриманий у результаті білок володіє ідентичними із ФСГ зв'язуванням рецептора in vitro і видами біологічної активності, але підвищеним часом напівжиття в кровотоці (LaPolt et al., 1992). Як "активну фракцію" ФСГ або його мутеїнів, даний винахід включає будь-який фрагмент або попередники поліпептидного ланцюга молекули білка, окремо або разом з асоційованими з ним молекулами або пов'язаними з ним залишками, наприклад, із залишками цукру або фосфату, або з агрегатами одних білкових молекул або залишків цукрів, за умови, що зазначена фракція по суті володіє подібною до ФСГ активністю. Як використовують у даному описі, "функціональні похідні" ФСГ включають похідні ФСГ або його мутеїн, які можна одержувати з функціональних груп, які зустрічаються як бічні ланцюги на залишках або N- або С-кінцевих групах, способами, відомими в даній галузі, і вони включені в цей винахід, за умови що вони залишаються фармацевтично прийнятними, тобто вони не порушують активності білка, що є по суті подібною до активності гонадотропіну, і не надають токсичних властивостей композиціям, що їх містять. Ці похідні, наприклад, можуть включати бічні ланцюги поліетиленгліколю, які можуть приховувати антигенні ділянки й подовжувати час знаходження ФСГ у рідинах організму. Інші похідні включають аліфатичні складні ефіри карбоксильних груп, аміди карбоксильних груп, отримані реакцією з аміаком або з первинними або вторинними амінами, N-ацильні похідні 91063 20 вільних аміногруп амінокислотних залишків, утворені з ацильними групами (наприклад, алканоїльними або карбоциклічними ароїльними групами), або О-ацильні похідні вільних гідроксильних груп (наприклад, груп залишків серилу або треонілу), утворені з ацильними групами. У переважному варіанті здійснення функціональне похідне відповідає молекулі ФСГ, що володіє додатковим глікозилуванням. В даному описі, термін "солі" ФСГ стосується як солей карбоксильних груп, так і кислотноадитивних солей аміногруп ФСГ. Солі карбоксильної групи можуть бути утворені способами, відомими в даній галузі, і включають неорганічні солі, наприклад, солі натрію, кальцію, амонію, заліза або цинку, і т.п., і солі з органічними основами, такі як солі, утворені, наприклад, з амінами, такими як триетаноламин, аргінін або лізин, піперидин, прокаїн і т.п.Кислотно-адитивні солі включають, наприклад, солі мінеральних кислот, наприклад, таких як хлористоводнева кислота або сірчана кислота, і солі органічних кислот, наприклад, таких як оцтова кислота або щавлева кислота. Безумовно, будь-які такі солі повинні зберігати біологічну активність гонадотропіну. Як використовують у даному описі, термін "рекомбінантний димерний гонадотропін" стосується гонадотропіну, що продукується при культивуванні отриманої способами генетичної інженерії клітини. Гонадотропін можна продукувати у клітині будьякого походження. Отримана способами генетичної інженерії клітина, що експресує димерний гонадотропін, експресує обидві субодиниці зазначеного димерного гонадотропіну. Як використовують у даному описі, термін "отримана способами генетичної інженерії клітина" стосується клітини, в яку введена екзогенна ДНК таким чином, щоб забезпечити експресію обох субодиниць необхідного гонадотропіну. Екзогенна ДНК може містити послідовність, що кодує субодиниці необхідного гонадотропіну. Альтернативно екзогенна ДНК може містити послідовність, що активує експресію ендогенної послідовності, що кодує субодиниці необхідного гонадотропіну (див., наприклад, WO 91/09955). Клітини можуть являти собою клітини, наприклад, тварин, комах або мікроорганізмів. Як використовують у даному описі, термін "клітина тварини" включає клітини людини й ссавців, що не належать до людини, клітини не ссавців і гібридоми. Приклади клітин ссавців, в яких можна продукувати рекомбінантний димерний гонадотропін, включають, наприклад, клітини ЗТЗ, клітини COS, клітини остеосаркоми людини, клітини MRC-5, клітини ВНК, клітини VERO, клітини СНО, клітини rCHO-tPA, клітини rCHO - Поверхневий антиген Hep В, клітини НЕК 293, клітини rНЕК 293, гС127 Поверхневий антиген Hep В, нормальні фібргалузні клітини людини, клітини строми, клітини гепатоцитів, клітини PER.C6 і перманентні амніоцитарні клітини людини. Приклади гібридом, в яких можна одержувати рекомбінантний димерний гонадотропін, включають, наприклад, клітини DA4.4, клітини 123А, клітини 127А, клітини GAMMA і клітини 67-9-В. 21 У рамках даного винаходу, переважно культивувати клітину яєчника китайського хом'яка (клітина СНО). Другий аспект даного винаходу стосується способу зниження рівнів окислених форм рекомбінантного димерного гонадотропіну в ході процесу його виробництва, який відрізняється тим, що клітини, які експресують зазначений рекомбінантний димерний гонадотропін, культивують у безсироватковому культуральному середовищі, що містить антиоксидант. Як використовують у даному описі, термін "окислені форми" стосується поліпептиду, в якому окислювач викликав окислювання одного або декількох амінокислотних залишків. Такі форми можна виявляти, наприклад, за допомогою ВЕРХ, як описано в прикладі 2.1 для ФСГ. Культивування можна проводити в будь-яких придатних умовах, таких як чашки Петрі, Тфлакони або обертові флакони, однак переважно в посудинах, що мають більші об'єми, наприклад, у таких як біореактор. Стадія культивування включає наступні стадії: - Інокуляції зазначених клітин у зазначене безсироваткове культуральне середовище; - Фази росту; і - Фази продукції. Фаза росту являє собою частину процесу в клітинній культурі, в якій параметри процесу встановлені з метою підтримки росту клітин. Після досягнення необхідної клітинної щільності, клітинну культуру звичайно перемикають на фазу продукції, в якій параметри процесу встановлені з метою підтримки продуктивності клітин. Параметри процесу можуть бути однаковими в ході фази росту й фази продукції. У ході фази продукції, концентрація клітин переважно має значення, що знаходиться в діапазоні від 1 106 до 5 107 клітин/мл, наприклад, приблизно 1 106, 5 106, 107 або 5 107 клітин/мл. Найбільш переважно, зазначена клітина являє собою клітину СНО. В одному варіанті здійснення антиоксидант додають до безсироваткового культурального середовища до інокуляції клітин. В іншому варіанті здійснення антиоксидант додають до безсироваткового культурального середовища незабаром після інокуляції клітин (наприклад, не більш ніж через 24год. після інокуляції). Переважно, процес виробництва включає стадію збору середовища, що містить рекомбінантний димерний гонадотропін. У переважному варіанті здійснення процес виробництва далі включає очищення рекомбінантного димерного гонадотропіну. Способи очищення гонадотропінів добре відомі в даній галузі. Наприклад, ФСГ можна очищати, як описано в ЕР 04105639.1, WO 98/20039, WO 00/63248 або WO 88/10270. У наступному переважному варіанті здійснення процес виробництва далі включає складання рекомбінантого димерного гонадотропіну з фармацевтично прийнятним носієм з одержанням фармацевтичної композиції. Як використовують у даному описі, мають на увазі, що термін "фармацевтично прийнятний но 91063 22 сій" охоплює будь-який носій, що не перешкоджає ефективності біологічної активності активного інгредієнта і який є не токсичним для організму хазяїна, якому його вводять. Наприклад, для парентерального введення, активний білок(и) можна складати в одиничній дозованій формі для ін'єкції в носіях, таких як фізіологічний розчин, розчин декстрози, сироватковий альбумін і розчин Рінгера. Потім фармацевтичну композицію, складену відповідно до цього винаходу, можна вводити індивіду різними способами. Способи введення включають інтрадермальний, черезшкірний (наприклад, у складах з уповільненим вивільненням), внутрішньом'язовий, внутрішньочеревинний, внутрішньовенний, підшкірний, пероральний, інтракраніальний, епідуральний, місцевий, ректальний і інтраназальний способи. Можна використати будьякий інший терапевтично ефективний спосіб введення, наприклад, усмоктування через епітеліальні або ендотеліальні тканини, або введення за допомогою генної терапії, де молекулу ДНК, що кодує активну речовину, вводять пацієнту (наприклад, через вектор), що приведе до експресії й секреції активної речовини in vivo. Крім того, білок(и) відповідно до цього винаходу можна вводити разом з іншими компонентами біологічно активних засобів, такими як фармацевтично прийнятні поверхнево-активні речовини, ексципієнти, носії, розріджувачі й речовини для доставки. Для парентерального (наприклад, внутрішньовенного, підшкірного, внутрішньом'язового) введення, активний білок(и) можна складати у вигляді розчину, суспензії, емульсії або ліофілізованого порошку разом з фармацевтично прийнятним парентеральним носієм (наприклад, водою, фізіологічним розчином, розчином декстрози) і добавками, які підтримують ізотонічність (наприклад, маніт) або хімічну стабільність (наприклад, консерванти й буфери). Склад стерилізують широко застосовуваними способами. У переважному варіанті здійснення даного винаходу, спосіб зниження рівнів окислених форм рекомбінантногодимерного гонадотропіну в ході процесу його виробництва характеризується тим, що щонайменше дві, три, чотири, п'ять або шість стадій зазначеного процесу виробництва проводять у присутності антиоксиданту. Переважно, всі стадії зазначеного процесу виробництва проводять у присутності антиоксиданту, тобто, весь процес виробництва проводять у присутності антиоксиданту. Наприклад, спосіб зниження рівнів окислених форм рекомбінантного димерного гонадотропіну в ході процесу його виробництва може включати стадії: - Культивування клітин, що експресують зазначений рекомбінантний димерний гонадотропін у безсироватковому культуральному середовищі, що містить антиоксидант; - Збирання середовища, що містить зазначений рекомбінантний димерний гонадотропін; і - Очищення зазначеного рекомбінантного димерного гонадотропіну в присутності антиоксиданту. 23 Переважно, спосіб зниження рівнів окислених форм рекомбінантного димерного гонадотропіну в ході процесу його виробництва далі включає стадію складання зазначеного рекомбінантного димерного гонадотропіну у фармацевтичну композицію, що містить антиоксидант. Антиоксидант може бути однаковим на всіх стадіях процесу виробництва, де використовують антиоксидант. Альтернативно на стадії культивування, на стадії очищення і/або стадії складання можна використати різні антиоксиданти. У даній галузі відома множина сполук, що мають антиоксидантний ефект. Ці сполуки включають, наприклад, цистеїн, аскорбінову кислоту, L-метіонін, Lглутатіон, 2-меркаптоетакол, альфа-токоферол і їхні похідні, В-653, трет-бутил-4-метоксифенол, 2,6-біс-(1,1-диметилетил)-4-метилфенол; біметабісульфит калію або натрію, бісульфіт натрію, гістидин, таурин, гліцин, аланін, карнозин, ансерин і 1метилгістидін. Третій аспект даного винаходу стосується безсироваткового культурального середовища для одержання рекомбінантних димерних гонадотропінів, який відрізняється тим, що зазначене культуральне середовище містить антиоксидант, вибраний із групи, що складається з: - L-глутатіону в концентрації в діапазоні від приблизно 1 до приблизно 20мг/л; - 2-меркаптоетанолу в концентрації в діапазоні від приблизно 5 до приблизно 15мг/л; - L-метіоніну в концентрації в діапазоні від приблизно 200 до приблизно 500мг/л; і - поєднання аскорбінової кислоти в концентрації в діапазоні від приблизно 10 до приблизно 50мг/л і (+)-альфа-токоферолу в концентрації в діапазоні від приблизно 5 до приблизно 25мг/л. Безсироваткове культуральне середовище звичайно містить воду, регулятор осмолярності, буфер, джерело енергії, амінокислоти, неорганічне або рекомбінантне джерело заліза, рекомбінантний або синтетичний фактор росту, і необов'язково іони кольорових металів, вітаміни й кофактори. Наприклад, відповідно до даного винаходу можна модифікувати кожне з комерційно доступних безсироваткових середовищ, перерахованих вище. Після повного опису цього винаходу, фахівці в даній галузі зрозуміють, що все зазначене вище можна проводити із широким діапазоном еквівалентних параметрів, концентрацій і умов без відхилення від суті й об'єму цього винаходу й без зайвого експериментування. Незважаючи на те, що цей винахід описаний відносно його конкретних варіантів здійснення, буде зрозуміло, що можливі інші модифікації. Мається на увазі, що ця заявка охоплює будь-які варіанти, застосування або адаптації цього винаходу, що відповідають, головним чином, принципам цього винаходу й відхилення, що включають такі, від даного опису, що стосуються відомої або загальноприйнятої практики в галузі, до якої належить 91063 24 цей винахід, і застосовні відносно основних ознак, зазначених вище, перебувають в об'ємі прикладеної формули винаходу. Всі цитовані в даному описі посилання, включаючи статті й реферати в журналах, опубліковані або неопубліковані патентні заявки США або іншої країни, видані патенти США або інших країн або будь-які інші посилання, повністю включені в даний опис як посилання, включаючи всі дані, таблиці, фігури й текст, представлені в цитованих посиланнях. Крім того, повний зміст посилань, цитованих у посиланнях, цитованих у даному описі, повністю включений як посилання. Посилання на стадії відомих способів, стадії загальноприйнятих способів, відомі способи або загальноприйняті способи жодним чином не є визнанням того, щоб який-небудь аспект, опис або варіант здійснення даного винаходу описаний, зазначений або запропонований у даній галузі. Представлений вище опис конкретних варіантів здійснення настільки повністю розкриває загальний характер цього винаходу, що можна, за допомогою застосування знань у даній галузі (включаючи зміст посилань, цитованих у даному описі), легко модифікувати й/або адаптувати його для різних способів застосування, таких як конкретні варіанти здійснення, без зайвого експериментування, без відхилення від загальної концепції даного винаходу. Таким чином, мають на увазі, що такі адаптації й модифікації стосуються до значення ряду еквівалентів описаних варіантів здійснення, виходячи з опису й керівництва, представленого в даному описі. Варто розуміти, що фразеологія й термінологія в даному описі представлена тільки для цілей опису, а не для обмеження, так що термінологію або фразеологію даного опису кваліфікованому фахівцеві варто інтерпретувати з урахуванням вказівок і рекомендацій, представлених у даному описі, у поєднанні зі знаннями середнього фахівця в даній галузі. ПРИКЛАД 1; Процес культивування клітин 1.1. Клітинні лінії й середовища Всі експерименти проводили із клітинною лінією СНО, що експресує обидві субодиниці ФСГ людини. Продукований білок являє собою димерний гонадотропін, надалі позначений як рФСГ. Альфа-субодиниця відповідає реєстраційному номеру SwissProt No. P01215, і бета-субодиниця відповідає реєстраційному номеру SwissProt No. РОЇ225. Середовище, використовуване для культивування клітин, являло собою основне безсироваткове середовище (SFM), розроблене для культивування клітин СНО. Середовище SFM було доповнене антиоксидантом, що підлягає тестуванню, як докладно описано в прикладі 3. Вихідна концентрація антиоксидантів, що підлягають тестуванню в основному SFM, представлена в таблиці І. 25 91063 Таблиця І Вихідна концентрація антиоксидантів в основному безсироватковому середовищі Сполука L-цистеїн Цистин-2НСІ N-ацетил-L-цистеін (NAC) L-аскорбінова кислота L-метіонін L-глутатіон 2-меркаптоетанол (+)-альфа-токоферол Вихідна концентрація в основному SFM 138мг/л 0мг/л 0мг/л 0мг/л 50мг/л 0мг/л 0мг/л 0мг/л 1.2. Умови інокуляції, росту й продукції Процес культивування, також позначуваний як "експеримент", включає стадію інокуляції, фазу росту й фазу продукції. Проводили п'ять різних експериментів, позначуваних як експерименти 1, 2, 3,4 і 5. Щонайменше 2,4 10 життєздатних продукуючих рФСГ клітин переносили в 15-л біореактор з ефективним робочим об'ємом 11л (newMBR, Zurich), що містить мікроносії. Відразу після висівання йшла стадія підживлення, що тривала протягом двох або трьох діб. Потім біореактор постійно підживлювали за допомогою SFM до міри розведення 1 доба-1 і до швидкості перфузії 11л доба-1. Фазу росту або продукції проводили при однакових значеннях рН і температури (37°С, рН = 7). Розчинений кисень (DO) підтримували при 50% насиченні повітрям у ході всього експерименту. ПРИКЛАД 2: Аналітичні способи 2.1. Визначення окислених форм рФСГ Окислені форми визначали за допомогою ЗФВЕРХ на неочищеному зібраному зразку, як описано Bassett і Driebergen (Bassett and Driebergen, 2005). Процентні кількості окислених форм нормалізували з використанням процентної кількості окислених форм, отриманих з L-цистеїном у концентрації 280мг/л в експерименті 2 як контроль (тобто, процентні кількості окислених форм ділили на 23,4%). 2.2. Визначення загальної концентрації життєздатних клітин Загальну концентрацію життєздатних клітин визначають як суму концентрацій клітин, прикріплених до мікроносіїв і концентрації життєздатних клітин у суспензії. Концентрацію клітин, прикріплених до мікроносіїв, визначали з використанням способу підрахунку ядер за допомогою кристалічного фіолетового (Fluka 61135). Концентрацію життєздатних клітин у суспензії визначали з використанням способу виключення з допомогою трипанового синього (Sigma T-8154). Загальне співвідношення життєздатних клітин (співвідношення TVC) обчислювали в такий спосіб: 26 [загальна концентрація життєздатних клітин, кінець тесту] / [загальна концентрація життєздатних клітин, початок тесту], де початок тесту визначають як добу, на якій в культуру додають новий антиоксидант, і кінець тесту визначають як добу перед додаванням у культуру наступного антиоксиданту. 2.3. Визначення титрів рФСГ Титр рФСГ визначали за допомогою імунофлуориметричного аналізу з використанням набору Delphia hFSH від Wallac-ADL (каталожний, no. A017-201). 2.4. Визначення швидкості споживання глюкози (GCR) Швидкість споживання глюкози (GCR), виражену в грамах на літр на добу, обчислювали в такий спосіб: GCR=(G0-Gt)•Dt+(Gt-1-Gt) G означає "концентрацію глюкози" і D означає "швидкість розведення". Індекси стосуються наступних значень: - 0: у живильному SFM; - t: вимір під час t; і - t-1: вимір під час t-1 ПРИКЛАД 3:Ефект різних антиоксидантів З метою зниження рівня окислених форм, отриманих за допомогою безсироваткових процесів, для тестування ефекту різних антиоксидантів проводили два експерименти в об'ємі 15 л (експерименти 1 і 2). Експеримент без додавання якогонебудь антиоксиданту проводили як контроль (експеримент 3). SFM доповнювали декількома антиоксидантами або поєднанням антиоксидантів до кінцевої концентрації, показаної в таблиці II. Кожний антиоксидант або поєднання антиоксидантів тестували протягом періоду приблизно десять діб. На першу добу тесту додавали об'єм розчину антиоксиданту, необхідний для досягнення зазначеного рівня. Кожної наступної доби певну кількість антиоксиданту вимивали з біореактора за допомогою перфузії й заміняли однократним додаванням (для швидкості розведення 1 с"1, кожні 24 год. обновляли 63,2% об'єму біореактора, що відбиває кількість антиоксиданту, що заміняється щодоби). До кінця періоду тестування, антиоксидант вимивали з біореактора за допомогою перфузії, і заміняли іншим антиоксидантом, що підлягає тестуванню. Процентну кількість окислених форм рФСГ визначали наприкінці кожного тесту (таблиця II). Нормалізоване значення менше 1,0 вказує на те, що тестований антиоксидант більш ефективний, ніж Lцистеїн, для зниження рівнів окислених форм рФСГ. Загальна концентрація життєздатних клітин, GCR і титри рФСГ вимірювали щодоби. У таблиці II зазначено загальне співвідношення життєздатних клітин (співвідношення TVC) . Співвідношення TVC, що перевищує або дорівнює 1,0, вказує на те, що тестований антиоксидант не робить токсичного ефекту на клітини. 27 91063 28 Таблиця ІІ Ефект антиоксидантів на окислені форми рФСГ WD, у Робочі дні які ви(WD), у які тестузнавали чали антиоксидант окислені форми WD10 пo WD20 WD20 пo WD30 WD30 пo WD40 WD40 пo WD50 WD50 по WD60 WD60 по WD70 WD20 WD30 WD38 WD50 WD59 WD70 WD70 по WD80 WD79 WDO пo WD20 WD20 по WD30 WD30 по WD40 WD40 по WD50 WD20 WD30 WD38 WD50 WD50 по WD56 WD56 Антиоксидант Експеримент 1 L-цистеїн L-аскорбінова кислота L-метіонін L-глутатіон 2-меркапто-етанол L-метіонін L-аскорбінова кислота+ (+)-альфа-токоферол Експеримент 2 L-цистеїн Цистеїн 2НС1 N-ацетил-L-цистеїн L-цистеїн L-цистеїн+ L-аскорбінова кислота+ 2-меркапто-етанол Результати, представлені в таблиці II, указують на те, що 2-меркаптоетанол, поєднання аскорбінової кислоти й (+)-альфа-токоферолу, Lметіонін, і L-глутатіон є найкращими антиоксидантами для одержання низьких рівнів окислених форм рФСГ. Співвідношення TVC для загальних життєздатних клітин менше 1,0 отримано тільки у випадку 2-меркаптоетанолу. Таким чином, всі антиоксиданти, тестовані в експериментах 1 і 2, за винятком 2-меркаптоетанолу, є нетоксичними. Крім того, визначення GCR і титрів рФСГ показало, що жоден з різних антиоксидантів не надавав значного впливу на метаболізм і характер репродуктивності (дані не представлені). Для подальшої оптимізації процесу продукції були обрані L-метіонін і L-глутатіон. Один експеримент (експеримент 3) проводили для тестування різних концентрацій L-глутатіону (від 1 до 20мг/л), і % окислених форм окислені форми (нормалізоване значення) Співвідношення TVC 280 10 186 3 10 734 30 14 21,5 17,3 14,3 14,2 12,3 14,0 0.92 0,74 0,61 0,61 0,53 0,60 8,6 1,3 1,4 1,2 0,8 1,0 14,8 0,63 1,0 280 50 260 350 280 10 10 23,4 17,3 18,1 20,5 1,00 0,74 0,77 0,88 6,3 1,4 1,3 1,0 19,0 0,81 1,0 Середня концерн трація (мг/л) один експеримент (експеримент 4) проводили для тестування різних концентрацій L-метіоніну (від 0,25 до 3г/л). Експеримент 3, у якому тестували Lглутатіон, був передчасно припинений на 30 добу продукції внаслідок ушкодження мікроносіїв. Тестовані концентрації L-глутатіону або L-метіоніну в ході експериментів 3 і 4 представлені в таблиці III. Нульову робочу добу (WD0) визначають як добу, на якій проводили посів у біореакторі. Нульову добу продукції (PD0) визначають як добу, на якій процес культивування клітин перемикають із фази росту на фазу продукції. Крім того, експеримент проводили без зміни концентрації антиоксиданту. У цьому експерименті, L-метіонін із самого початку додавали в концентрації 250мг/л (експеримент 5) . Для всіх експериментів, процентну кількість окислених форм рФСГ визначали регулярно (таблиця IV). Таблиця IIІ Концентрація антиоксиданту в експериментах 3 і 4 Фаза росту WDO Фаза росту WD1 аж до PD0 (не включно) PD0-PD9 PD10-PD19 PD20-PD29 PD30-PD39 PD40-PD49 Експеримент 3 Без L-глутатіону L-глутатіон 1мг/л L-глутатіон 1мг/л L-глутатіон 2,5мг/л L-глутатіон 5мг/л L-глутатіон 10мг/л L-глутатіон 20мг/л Експеримент 4 L-метіонін 50мг/л L-метіонін 250мг/л L-метіонін 250мг/л L-метіонін 500мг/л L-метіонін 1000мг/л L-метіонін 2000мг/л L-метіонін 3000мг/л 29 91063 30 Таблиця IV Ефект антиоксидантів на окислені форми рФСГ WD, у які визначали окислені форми Антиоксидант WD19 WD28 WD40 L-глутатіон L-глутатіон L-глутатіон WD19 WD28 WD40 WD49 WD59 L-метіонін L-метіонін L-метіонін L-метіонін L-метіонін WD16-17 WD20-21 WD22-23 WD24-25 WD26-27 WD28-29 WD30-31 Середня концентрація (мг/л) Експеримент 3 1 2,5 5 Експеримент 4 250 500 1000 2000 3000 Експеримент 5 L-метіонін Аналіз окислених форм рФСГ при додаванні антиоксиданту в культуральне середовище, показав, що L-метіонін є гарним антиоксидантом. В експерименті 5, де клітини культивували в присутності L-метіоніну в концентрації 250 мг/л, середній процентний вміст окислених форм був знижений приблизно на 40% у порівнянні з результатами, отриманими в експерименті 1 і експерименті 2 з Lцистеїном як антиоксидантом (див. таблицю II і IV). L-Глутатіон також є гарним антиоксидантом, особливо в концентрації приблизно 2,5мг/л. В експерименті 3, процентний вміст окислених форм був знижений приблизно на 35% при культивуванні клітин у присутності L-глутатіону в концентрації 2,5мг/л, у порівнянні з результатами, отриманими в експерименті 1 і експерименті 2 з L-цистеїном як антиоксидантом (див. таблицю II і IV). Виявилося, що в експерименті 4 підвищувані концентрації L-метіоніну мають тенденцію до зниження процентного вмісту окислених форм між 250 і 2000мг/л. Однак виявилося, що виявлені розходження знаходяться в межах варіабельності способу в порівнянні зі змінами, спостережуваними в експерименті 5, в якому тестували одну концентрацію L-метіоніну, що складала 250мг/л, протягом усього експерименту. Крім того, було підтверджено, що L-глутатіон і L-метіонін не надають значного впливу на життєздатність клітин, метаболізм і характер продуктивності в діапазоні тестованих концентрацій (дані не представлені). ПОСИЛАННЯ: 1. Altschul.S.F, Gish.W., Miller,W., Myers.E.W., and Lipman.DJ. (1990). Basic local alignment search tool. J. Мої. Biol. 215,403-410. 2. Altschul.S.F., Madden,T.L, Schaffer.AA, ZhangJ., Zhang.Z, Miller.W, and Lipman.DJ. (1997). Gapped BLAST and PSI-BLAST: a new generation of 250 мг/л % окислених форм 18,31 14,26 23,99 15,37 14,26 13,56 9,77 12,66 16,91 14,45 12,94 12,16 10,54 12,83 13,21 protein database search programs, Nucleic Acids Res. 25, 3389-3402. 3. Bassett.R.M. and Driebergen.R. (2005). Continued improvements in the quality and consistency of follitropin alfa, recombinant human FSH. Reprod. Biomed. Online. 10, 169-177. 4. Brutlag.D.L, Dautricourt.J.P., Maulik.S., and Relph.J. (1990). Improved sensitivity of biological sequence database searches. Comput. Appl. Biosci. 6, 237-245. 5. Gonnet.G.H., Cohen.M.A., and Benner.S.A. (1992). Exhaustive matching of the entire protein sequence database. Science 256, 1443-1445. 6. Grantham.R. (1974). Amino acid difference formula to help explain protein evolution. Science 185, 862-864. 7. Henikoff.S. and Henikoff.J.G. (1993). Performance evaluation of amino acid substitution matrices. Proteins 17,49-61. 8. Higgins.D.G., Thompson.J.D., and Gibson.TJ. (1996). Using CLUSTAL for multiple sequence alignments. Methods Enzymol. 266, 383-402. 9. Karlin.S. and Altschul.S.F. (1990). Methods for assessing the statistical significance of molecular sequence features by using general scoring schemes. Proc. Natl. Acad. Sci. U.S.A 87, 2264-2268. 10. LaPolt.P.S., Nishimori.K., Fares.F.A, Perlas.E., Boime.L, and Hsueh.A.J. (1992). Enhanced stimulation of follicle maturation and ovulatory potential by long acting follicle-stimulating hormone agonists with extended carboxyl-terminal peptides. Endocrinology 131, 2514-2520. 11. Matzuk.M.M., Kornmeier.C.M., Whitfield.G.K., Kourides.l.A., and Boime.l. (1988). The glycoprotein alpha-subunit is critical for secretion and stability of the human thyrotropin beta-subunit. Мої. Endocrinol. 2, 95-100. 31 91063 12. Pearson.W.R. and Lipman.DJ. (1988). Improved tools for biological sequence comparison. Proc. Natl. Acad. Sci. U.S.A 85, 2444-2448. 13. Saito.Y., Yoshida.Y, Akazawa.T., Takahashi.K., andNiki.E. (2003). Cell death caused by selenium deficiency and protective effect of antioxidants. J. Biol. Chem. 278, 39428-39434. 14. Skrabanja, A. and Van den Oetelaar, P. Liquid gonadotropin containing formulations. EP 0 853 945 A1. 22-7-1998. 15. Takruri H. Method for the stabilisation of methionine-containing polypeptides. WO 92/15614. 17-9-1992. 16. Talmadge.K., Boorstein.W.R., and Fiddes,J.C. (1983). The human genome contains Комп’ютерна верстка Н. Лиcенко 32 seven genes for the beta-subunit of chorionic gonadotropin but only one gene for the beta-subunit of luteinizing hormone. DNA 2,281-289. 17. Thompson J.D., Higgins.D.G., and Gibson.TJ. (1994). CLUSTAL W: improving the sensitivity of progressive - multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice. Nucleic Acids Res. 22, 4673-4680. 18. Yun,Z., Takagi.M., and Yoshida,T. (2003). Combined addition of glutathione and iron chelators for decrease of intracellular level of reactive oxygen species and death of Chinese hamster ovary cells. J. Biosci. Bioeng. 95, 124-127. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюSerum-free culture medium for the production of recombinant gonadotropins
Автори англійськоюFONTA JEAN PIERRE, DUCOMMUN PAUL, DEPARIS VERONIQUE
Назва патенту російськоюПрименение безсывороточной культуральной среды для получения рекомбинантных димерных гонадотропинов
Автори російськоюФонта Жан-Пьер, Дюкоммен Поль, Депари Вероник
МПК / Мітки
МПК: C07K 14/59, C12N 5/00
Мітки: культурального, рекомбінантних, одержання, димерних, застосування, безсироваткового, середовища, гонадотропінів
Код посилання
<a href="https://ua.patents.su/16-91063-zastosuvannya-bezsirovatkovogo-kulturalnogo-seredovishha-dlya-oderzhannya-rekombinantnikh-dimernikh-gonadotropiniv.html" target="_blank" rel="follow" title="База патентів України">Застосування безсироваткового культурального середовища для одержання рекомбінантних димерних гонадотропінів</a>
Попередній патент: Пристрій для вироблення і передачі кінетичної енергії
Наступний патент: Спосіб одержання полісахариду