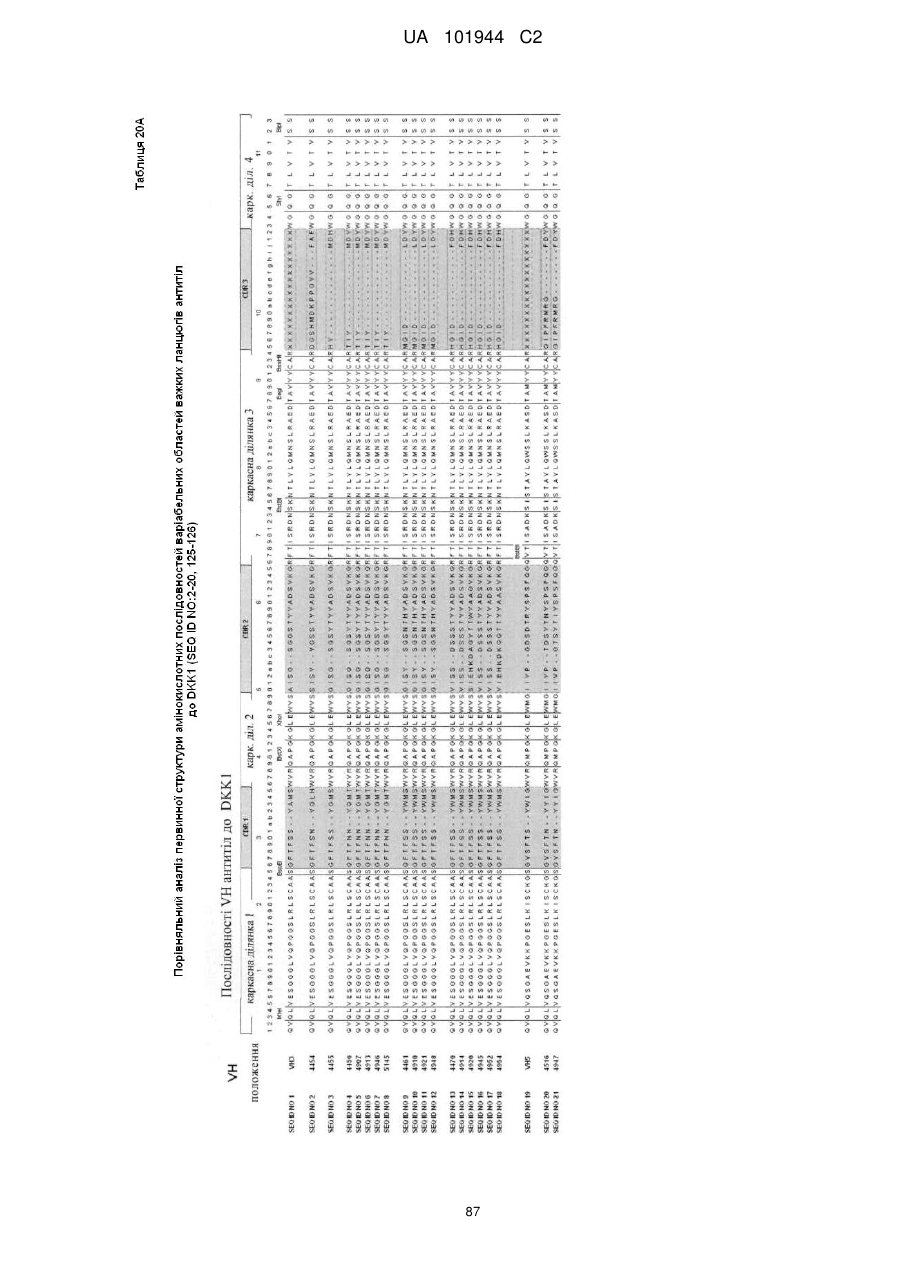
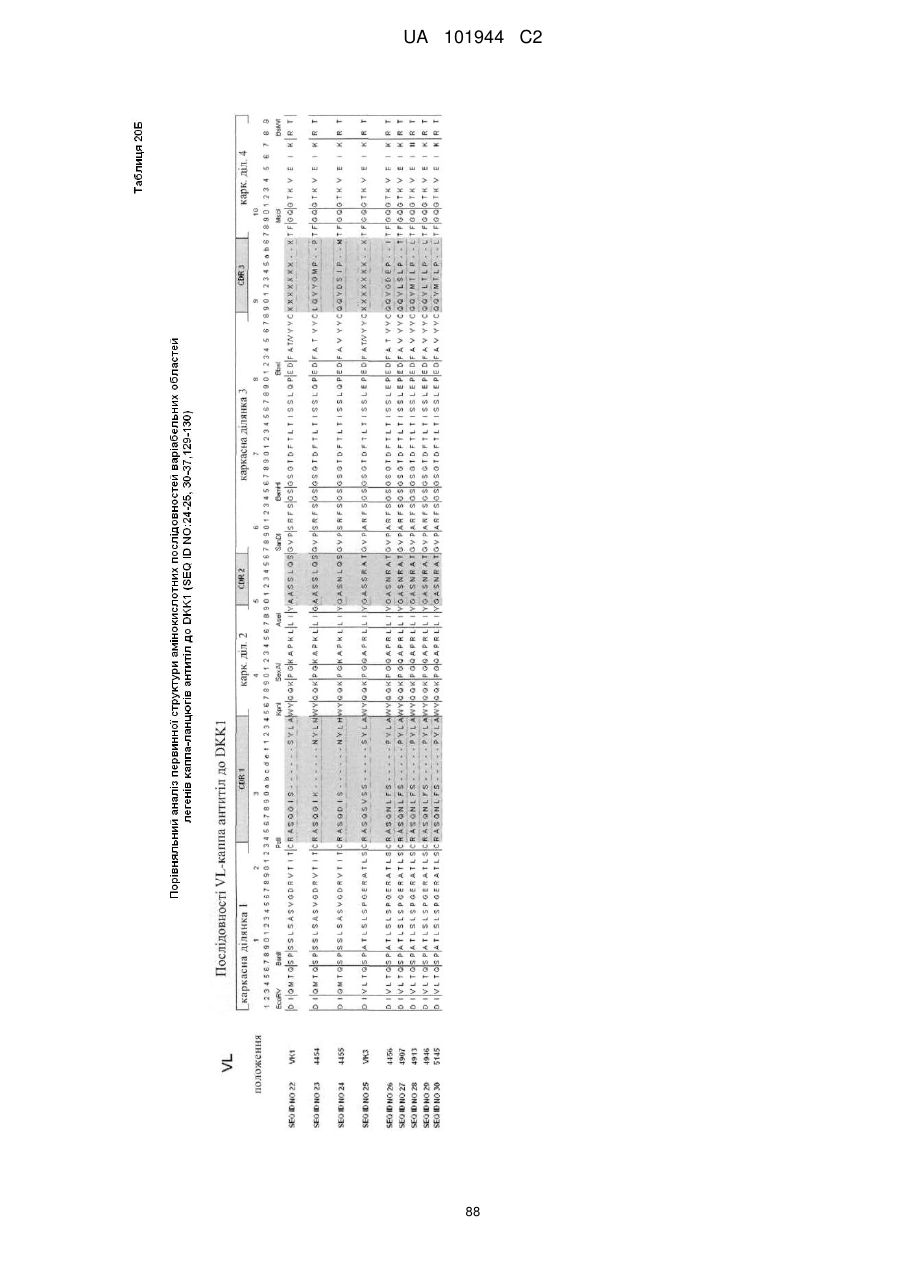
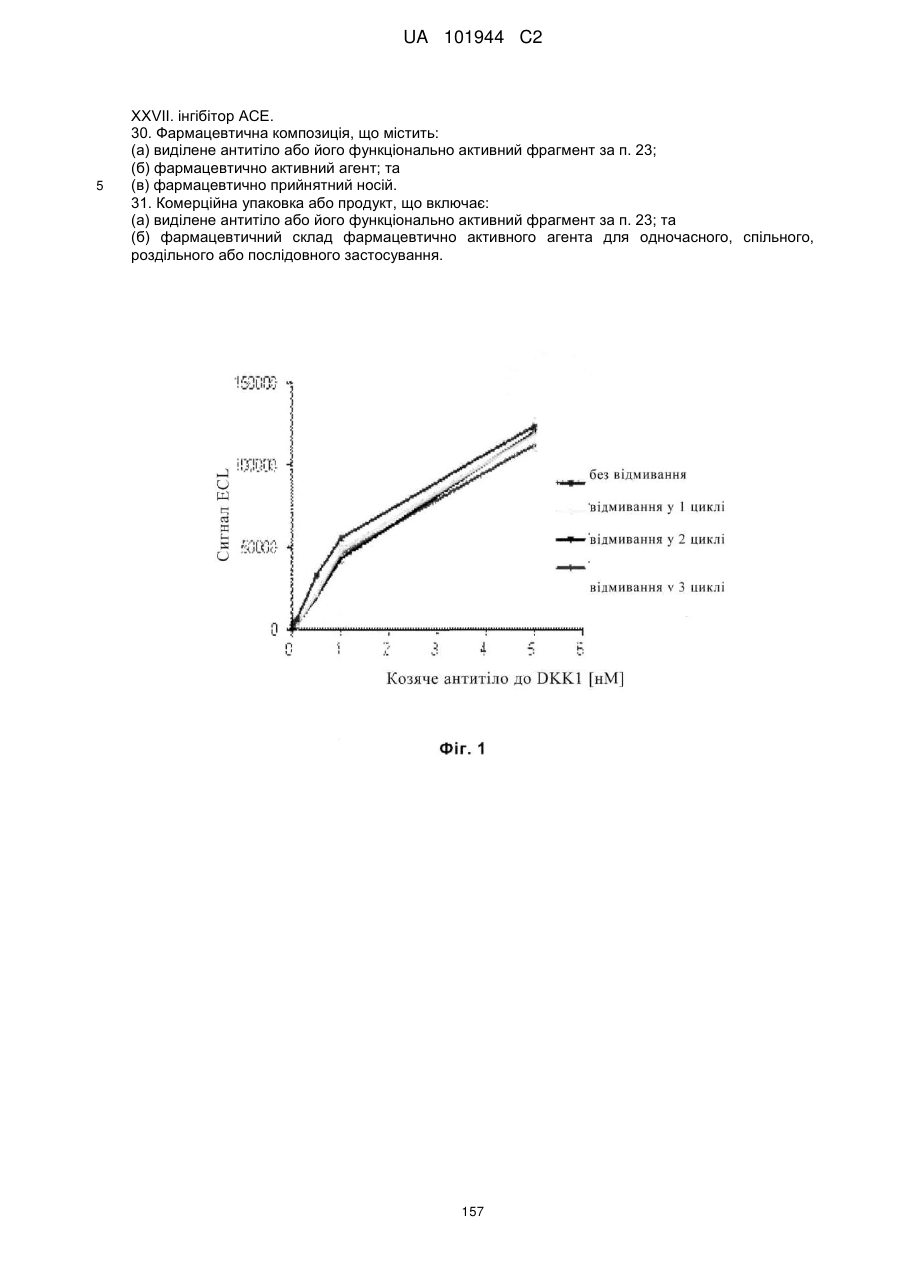
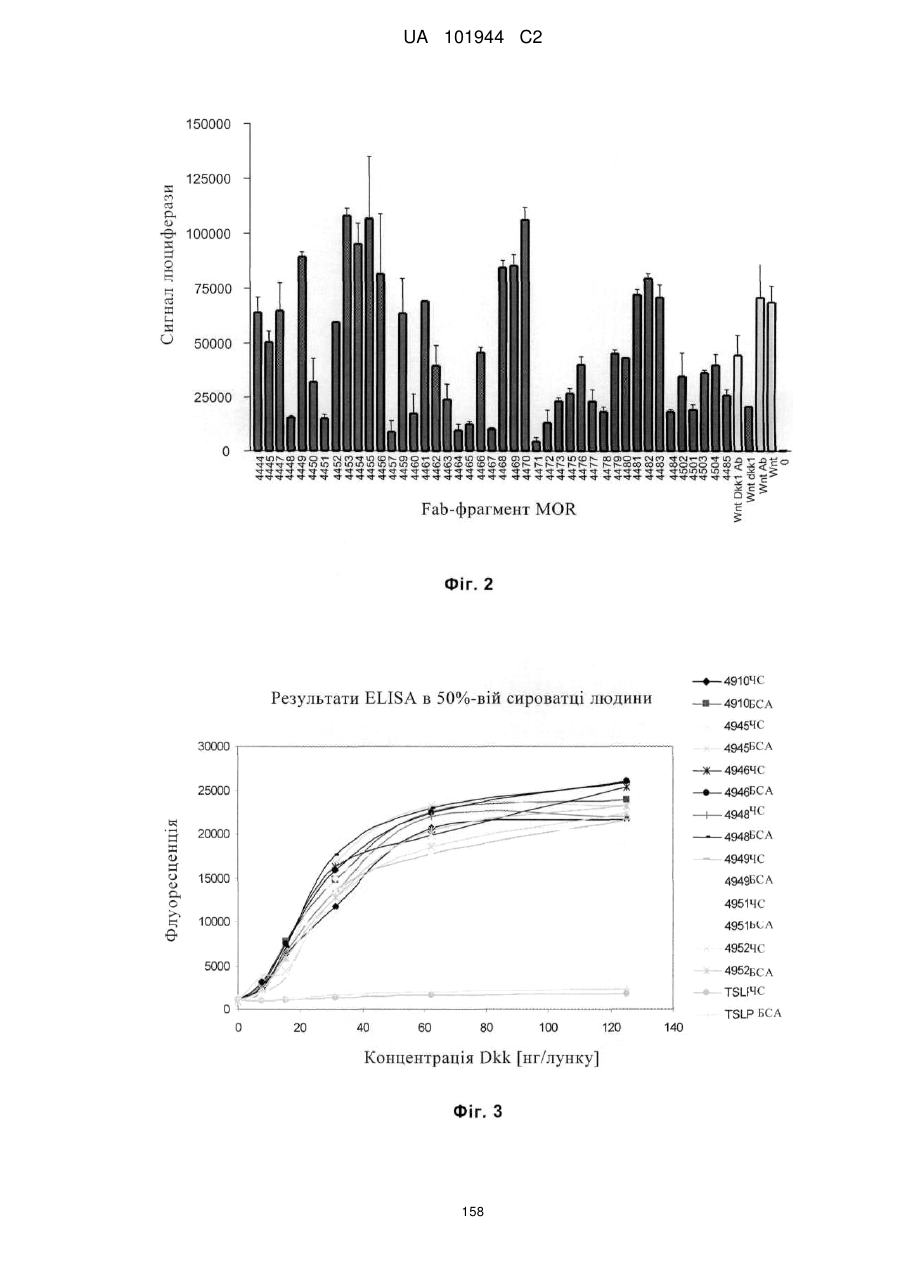
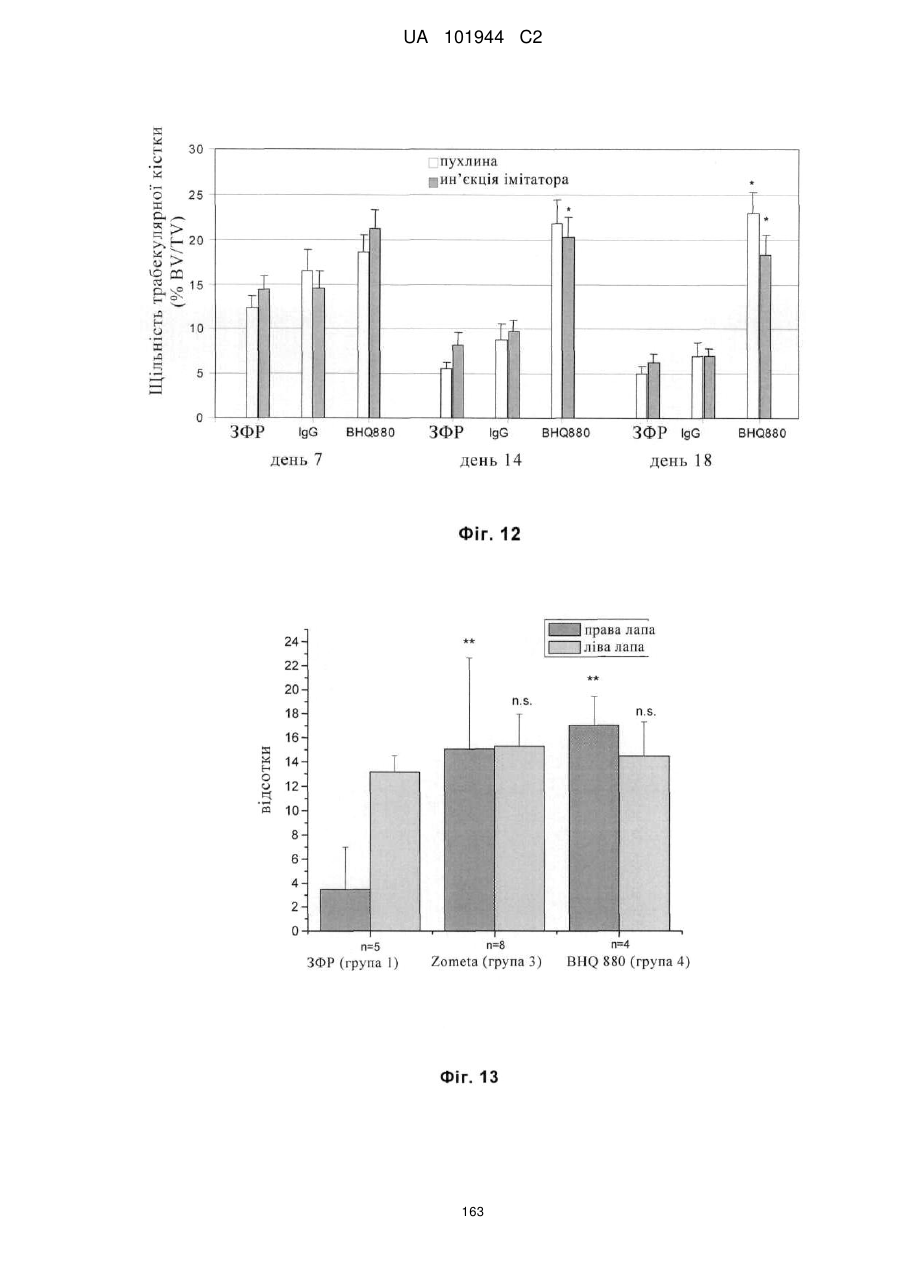
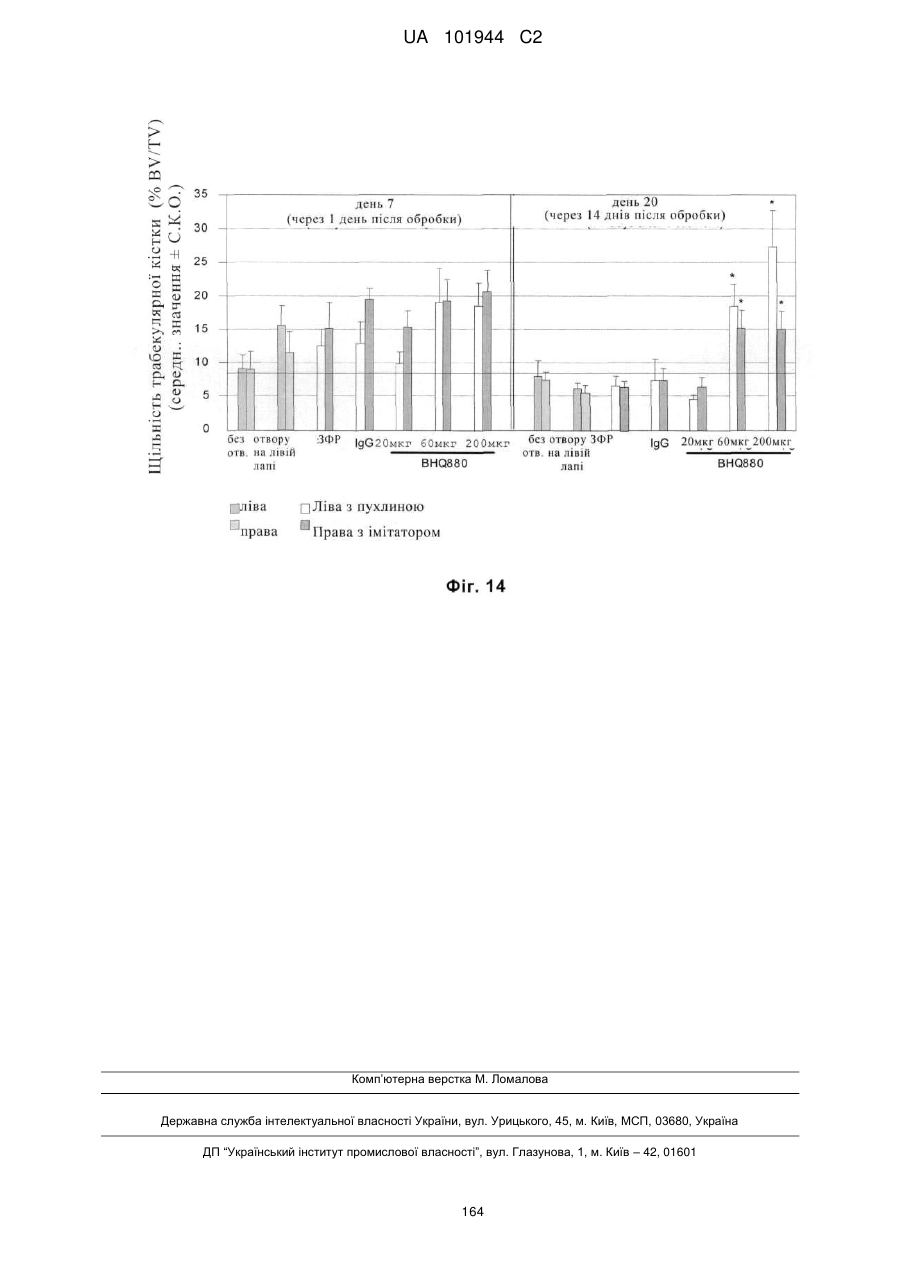
Композиції і способи застосування для антитіл dicкkopf-1
Номер патенту: 101944
Опубліковано: 27.05.2013
Автори: Конг Фенг, Шалок Дженін, Донзо Маріель, Бардрофф, Міхаель, Урлінгер Стефані, Фішмен Марк, Еттенберг Сес
Формула / Реферат
1. Виділене антитіло або його функціонально активний фрагмент, що має послідовності CDR-ділянок важкого ланцюга: CDR1 – GFTFSSYWMS; CDR2 – WVSGISYSGSNTHYADSVKG; CDR3 – MGIDLDY, та легкого ланцюга: CDR1 – TGTSSDVGGFNYVS; CDR2 – LMIHDGSNRPS; CDR3 – QSWDVSPITA, або їх консервативні або гуманізовані варіанти, що специфічно зв'язує епітоп у людському поліпептиді DKK1 (SEQ ID NO: 1) з КD 140 пМ або менше.
2. Виділене антитіло або його функціонально активний фрагмент за п. 1, де антитіло або його функціонально активний фрагмент включає виділену амінокислотну послідовність, вибрану з групи, що включає SEQ ID NO: 111 та 115, та їх консервативні або гуманізовані варіанти, де
а) SEQ ID NO: 111 кодує антигензв'язувальний легкий ланцюг, і
б) SEQ ID NO: 115 кодує антигензв'язувальний важкий ланцюг.
3. Виділене антитіло або його функціонально активний фрагмент за п. 2, де амінокислотна послідовність оптимізована для експресії і/або для клінічного застосування.
4. Виділене антитіло або його функціонально активний фрагмент за п. 1, де антитіло або його функціонально активний фрагмент містить каркас, вибраний з IgM та і IgG, де IgG вибраний з IgG1, IgG2 і IgG3 або IgG4.
5. Виділене антитіло або його функціонально активний фрагмент за п. 4, де IgM або IgG вибраний з поліклонального або моноклонального антитіла.
6. Виділене антитіло або його функціонально активний фрагмент за п. 1, де антитіло або його функціонально активний фрагмент зв'язується з DKK1 та DKK4 і попереджає розвиток або полегшує асоційоване з DKK1 захворювання або асоційоване з DKK4 захворювання.
7. Фармацевтична композиція, що містить виділену антигензв'язувальну ділянку антитіла або його функціонально активний фрагмент за п. 6 та фармацевтично-прийнятний носій.
8. Виділене антитіло або його функціонально активний фрагмент, що має послідовності CDR-ділянок важкого ланцюга: CDR1 – GFTFSSYWMS; CDR2 – WVSGISYSGSNTHYADSVKG; CDR3 – MGIDLDY, та легкого ланцюга: CDR1 – TGTSSDVGGFNYVS; CDR2 – LMIHDGSNRPS; CDR3 – QSWDVSPITA, або їх консервативні або гуманізовані варіанти, що специфічно зв'язує епітоп мішені в DKK1 з КD 140 пМ або менше, де епітоп містить щонайменше шість або більше амінокислотних залишків CYS 2-домена мішені DKK1.
9. Виділене антитіло або його функціонально активний фрагмент за будь-яким з пп. 1-6 або 8, де виділене антитіло або його функціонально активний фрагмент містить антигензв'язувальну ділянку, яка специфічно зв'язується з епітопом у людському поліпептиді DKK1 (SEQ ID NO: 1) з КD 140 пМ або менше та у людському поліпептиді DKK4 (SEQ ID NO: 124), причому виділене антитіло або його функціонально активний фрагмент вибране з повного імуноглобуліну або Fab-фрагменту або scFv-фрагменту антитіла, важколанцюгового антитіла і його антигензв'язувальної ділянки, каркасом якого не є імуноглобулін.
10. Виділене антитіло або його функціонально активний фрагмент за п. 9, у якому епітоп являє собою конформаційний епітоп.
11. Композиція, що містить щонайменше одне виділене антитіло або його функціонально активний фрагмент за п. 9 або 10 та фармацевтично прийнятний носій або ексципієнт.
12. Трансгенна тварина, яка несе ген, що кодує антитіло або його функціонально активний фрагмент за п. 1.
13. Застосування виділеного антитіла або його функціонально активного фрагменту, що має послідовності CDR-ділянок важкого ланцюга: CDR1 – GFTFSSYWMS; CDR2 – WVSGISYSGSNTHYADSVKG; CDR3 – MGIDLDY, та легкого ланцюга: CDR1 – TGTSSDVGGFNYVS; CDR2 – LMIHDGSNRPS; CDR3 – QSWDVSPITA, або їх консервативних або гуманізованих варіантів, що специфічно зв'язує епітоп у людському поліпептиді DKK1 (SEQ ID NO: 1) з КD 140 пМ або менше, у виготовленні лікарського засобу для лікування порушення або стану, пов'язаного з присутністю DKK1 або DKK4.
14. Застосування за п. 13, у якому порушення або стан вибраний із групи, що включає остеолітичні ушкодження, остеолітичні ушкодження, асоційовані з мієломою, множинною мієломою або раком кістки, молочної залози, ободової кишки, меланоцитів, гепатоцитів, епітелію, стравоходу, головного мозку, легенів, передміхурової залози або підшлункової залози або його метастазів; втрату кісткової тканини, асоційовану із трансплантацією; або являє собою остеосаркому, рак передміхурової залози, гепатоцелюлярну карциному (HCC), мієлому, включаючи множинну мієлому, діабет, ожиріння, м'язову слабість, хворобу Альцгеймера, остеопороз, остеопенію, ревматизм, коліт і/або небажану втрату волосся.
15. Застосування за п. 13, у якому лікування передбачає введення другого терапевтичного агента.
16. Застосування за п. 15, де другий терапевтичний агент являє собою хіміотерапевтичний агент зомета (Zometa).
17. Застосування за п. 15, де другий терапевтичний агент вибраний із групи, що включає протираковий агент; антиметаболіт, антидіабетичний агент, антиостеопорозний агент; антибіотик; протизапальний агент; фактор росту; і цитокін.
18. Імунокон'югат, що містить перший компонент, який являє собою виділене антитіло або його функціонально активний фрагмент за будь-яким з пп. 1, 2, 3, 8 та другий компонент.
19. Набір, що містить виділене антитіло або його функціонально активний фрагмент за будь-яким з пп. 1-6 або 8 - 10, або композицію за п. 7 або 11, де виділене антитіло або його функціонально активний фрагмент містить антигензв'язувальну ділянку, яка специфічно зв'язується з епітопом у людському поліпептиді DKK1 (SEQ ID NO: 1) з КD 140 пМ або менше та у людському поліпептиді DKK4 (SEQ ID NO: 124).
20. Набір за п. 19, що додатково включає фармацевтично прийнятний носій або ексципієнт.
21. Набір за п. 19, у якому антитіло присутнє у вигляді стандартної дози.
22. Набір за п. 19, що додатково включає інструкцію до застосування для індивідуума.
23. Виділене антитіло або його функціонально активний фрагмент, що має послідовності CDR-ділянок важкого ланцюга: CDR1 – GFTFSSYWMS; CDR2 – WVSGISYSGSNTHYADSVKG; CDR3 – MGIDLDY, та легкого ланцюга: CDR1 – TGTSSDVGGFNYVS; CDR2 – LMIHDGSNRPS; CDR3 – QSWDVSPITA, або їх консервативні або гуманізовані варіанти, що зв’язується з DKK1 з КD 140 пМ або менше та зв’язується з DKK4.
24. Виділене антитіло або його функціонально активний фрагмент за п. 23, де зв'язування антитіла з DKK1 характеризується значенням Kon менш ніж 100 нМ, 50 нМ, 10 нМ, 1,0 нМ, 500 пМ або 100 пМ; і швидкістю дисоціації DKK1 менше ніж 10-2 1/с, 10-3 1/с, 10-4 1/с або
10-5 1/с.
25. Виділене антитіло або його функціонально активний фрагмент за п. 23, де афінність антитіла до DKK1 або DKK4 в 102 - 106 вища, ніж його афінність до DKK2 або DKK3.
26. Виділене антитіло або його функціонально активний фрагмент за п. 23, де антитіло конкурує з антитілом, що зв'язується з обома DKK1 та DKK4 за зв'язування з DKK1 або DKK4.
27. Застосування виділеного антитіла або його функціонально активного фрагменту за п. 1, де антитіло або його функціонально активний фрагмент містить поліпептидну послідовність, представлену в SEQ ID NO:111, і поліпептидну послідовність, представлену в SEQ ID NO:115, або їх консервативних або гуманізованих варіантів у виготовленні лікарського засобу для лікування проліферативного захворювання.
28. Застосування композиції, що містить комбінацію фармацевтичних агентів, що включає стадію введення терапевтично ефективних кількостей:
(a) композиції, що містить антитіло або його функціонально активний фрагмент, що має послідовності CDR-ділянок важкого ланцюга: CDR1 – GFTFSSYWMS; CDR2 – WVSGISYSGSNTHYADSVKG; CDR3 – MGIDLDY, та легкого ланцюга: CDR1 – TGTSSDVGGFNYVS; CDR2 – LMIHDGSNRPS; CDR3 – QSWDVSPITA, або їх консервативні або гуманізовані варіанти, що зв'язується з DKK1 з КD 140 пМ або менше та з DKK4; та (б) одного або більше фармацевтично активних агентів у виготовленні лікарського засобу для лікування проліферативного захворювання.
29. Застосування за п. 28, у якому фармацевтично активний агент являє собою фармацевтично активний агент, відмінний від антитіла, що зв’язується з DKK1 з КD 140 пМ або менше та з DKK4, або його похідної, де агент вибраний з групи, що включає:
I. інгібітор ароматази;
II. антиестроген, антиандроген або агоніст гонадореліну;
III. інгібітор топоізомерази I або інгібітор топоізомерази II;
IV. агент, що проявляє активність відносно мікротрубочок, алкілуючий агент, протипухлинний метаболіт або похідне платини;
V. сполуку, що робить спрямований вплив, знижує активність білкової або ліпідної кінази або активність білкової або ліпідної фосфатази, іншу антиангіогенну сполуку або сполуку, що індукує процеси диференціювання клітин;
VI. моноклональні антитіла;
VII. інгібітор циклооксигенази, біфосфонат, інгібітор гепаранази, модифікатор біологічної відповіді;
VIII. інгібітор онкогенних ізоформ Ras;
IX. інгібітор теломерази;
X. інгібітор протеази, інгібітор матричних металопротеіназ, інгібітор метіонінамінопептидази або інгібітор протеосоми;
XI. агенти, придатні для лікування гематологічних злоякісних захворювань, або сполуки, які роблять спрямований вплив, знижують або інгібують активність Flt-3;
XII. інгібітор HSP90;
XIII. антипроліферативні антитіла;
XIV. інгібітор гистондеацетилази (HDAC);
XV. сполуки, які роблять спрямований вплив, знижують або інгібують активність/функцію серинової/треонінової кінази mTOR;
XVI. антагоніст рецептора соматостатину;
XVII. противолейкозну сполуку;
XVIII. підходи, за допомогою яких ушкоджують пухлинні клітини;
XIX. EDG-зв'язувальну речовину;
XX. інгібітор рибонуклеотидредуктази;
XXI. інгібітор S-аденозилметіоніндекарбоксилази;
XXII. моноклональне антитіло до VEGF або VEGFR;
XXIII. агенти, придатні для фотодинамічної терапії;
XXIV. ангіостатичний стероїд;
XXV. вхідні до складу імплантату кортикостероїди;
XXVI. антагоніст AT 1-рецептора; і
XXVII. інгібітор ACE.
30. Фармацевтична композиція, що містить:
(а) виділене антитіло або його функціонально активний фрагмент за п. 23;
(б) фармацевтично активний агент; та
(в) фармацевтично прийнятний носій.
31. Комерційна упаковка або продукт, що включає:
(а) виділене антитіло або його функціонально активний фрагмент за п. 23; та
(б) фармацевтичний склад фармацевтично активного агента для одночасного, спільного, роздільного або послідовного застосування.
Текст
Реферат: UA 101944 C2 (12) UA 101944 C2 Винахід належить до антитіла і фрагментів, які мають здатність зв'язуватися з білком-мішенню Dickkopf (DKK1), а також способи застосування й набори, призначені для лікування клітинимішені, насамперед клітини, асоційованої з остеолітичним станом. UA 101944 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь застосування Даний винахід відноситься до композицій і способів застосування антитіла до Dickkopf-1 («DKK1»), антитіла до Dickkopf-4 («DKK4») або їх обох для лікування пов'язаних з DKK аномалій щільності кісткової тканини, метаболізму, діабету, різних форм рака і т.п. Передумови створення винаходу Шлях передачі сигналу Wnt бере участь у контролі ембріонального розвитку і у неопластичних процесах. Позаклітинні білки Wnt відповідальні за ріст і диференціювання багатьох типів клітин, включаючи, зокрема, ріст, диференціювання і регуляцію остеобластів, остеокластів і адипоцитів. Багато форм раку асоційовані з кістковими тканинами і можуть приводити до остеобластичних (остеогенних) ушкоджень, які можуть мати місце, наприклад, при раку передміхурової залози, або до остеолітичних ушкоджень, які можуть мати місце при раку легені, раку молочної залози і множинній мієломі (див., наприклад, Tian і ін., New England J. Med. 349, 2003, сс. 2483-2494). Представники сімейства генів Wnt кодують глікопротеїни, що декретуються, необхідні для різних процесів розвитку (Fedi і ін., J. Bio. Chem. 274, 1999, сс. 19465-19472). Білкипредставники сімейства Wnt ініціюють шлях передачі сигналу, важливий для росту і диференціюванні остеобластів, що приводить до відкладення кісткової тканини. Крім формування кісткової тканини резорбція кісткової тканини є продовженням нормального процесу, здійснюваного клітинами, які називають остеокластами. На противагу цьому, ліганд рецептора-активатора ядерного фактора-капа B (RANKL) являє собою кінцевий медіатор здійснюваної остеокластами резорбції кісткової тканини, при цьому він відіграє основну роль у патогенезі постменопаузального остеопорозу, а також у втраті кісткової тканини, асоційованої з ревматоїдним артритом, метастатичним раком, множинною мієломою, терапією з використанням інгібіторів ароматази і терапією, що заснована на депривації андрогену (див, наприклад, Lewiecki, Expert Opin Biol Ther. 6, 2006, сс. 1041-1050). Остеопротегрин (OPG), що експресується остеобластами, інгібує RANKL, знижуючи тим самим активність і формування остеокластів. Баланс між анаболічним формуванням кісткової тканини і аналітичною резорбцією кісткової тканини регулює нормальну щільність кісткової тканини, у підвищення рівня одного або іншого процесу знижує щільність кісткової тканини або приводить до підвищеної втрати кісткової тканини відповідно. Wnt зв'язується і проявляє дію через інші білки клітинної поверхні, і передача сигналу Wnt може брати участь у неопластичних процесах. Крім того, генетичні зміни можуть впливати на комплекс клітинних білків, відомий як аденоматозний поліпозний коли, у якому бере участь білок β-катенін, і ці комплекси виявлені в клітинах пацієнтів, що страждають такими захворюваннями, як людський рак ободової кишки, меланоми і печінково-клітинні карциноми, що свідчить про те, що аберації шляхів передачі сигналу Wnt відповідальні за розвиток зазначених і можливо інших типів раку в людини (Fedi і ін., J. Bio. Chem. 274, 1999, сс. 19465-19472). Відомо щонайменше два сімейства білків, які інгібують передачу сигналу Wnt, а саме, сімейство білків, що декретуються, споріднених білку Frizzle, і сімейство білків Dickkopf (DKK). DKK-сімейство за сучасними даними складається з 4 представників, а саме DKK1 (людська ДНК, реєс. номер NM_012242; PRT, реєс. номер O94907), DKK2 (людська, реєс. номер NM_014421; PRT, реєс. номер NP_055236), DKK3 (людська, реєс. номер NM_015881; PRT, реєс. номер AAQ88744) і DKK4 (людська, реєс. номер NM_014420; PRT, реєс. номер NP_055235). Dickkopf-1 (DKK1) являє собою інгібітор шляху передачі сигналу Wnt/β-катеніну, що секретується (див., наприклад, заявку на патент США 2005-0079173 на ім'я Niehrs; заявку на патент США 2004 - 0234515 на ім'я McCarthy). DKK1 має здатність інгібувати дуплікацію осі, що індуціюється Wnt, і генетичний аналіз свідчить про те, що DKK1 діє проти ходу шляху передачі сигналу, інгібуючи передачу сигналу Wnt. DKK1 також важливий для розвитку кістяка, що продемонстровано за його впливом на втрату кісткових структур у курячих і мавп'ячих ембріонах після їхнього контакту з високими рівнями DKK1 (Tian і ін., New England J. Med. 349, 2003, сс. 2483-2494). Підвищені рівні DKK1 у сироватці асоційовані з раком передміхурової залози, а підвищені рівні DKK1 і RANKL у плазмі кісткового мозку і периферичної крові пацієнтів, що страждають множинною мієломою, асоційовані із присутністюлокальних ушкоджень кісткової тканини (див., наприклад,Tian, 2003, OMIM, реєс. номер 605189). DKK1 грає також роль в адипогенезі, хондрогенезі, проліферації шлунково-кишкового епітелію, втраті кісткової тканини, асоційованої з ревматизмом, і ініціації формування волосяного фолікулярного плакоду (OMIM, реєс. номер 605189). Dickkopf-4 (DKK4) охарактеризований недостатньо повно, але, очевидно, він також являє собою інгібітор Wnt-шляху, що секретується. Установлено, що DKK4 відкладається в бляшках 1 UA 101944 C2 5 10 15 20 25 30 35 40 45 50 55 60 пацієнтів, що страждають хворобою Альцгеймера, і експресується в м'язі. Роль Wnt у розвитку м'язової тканини поки не відома, тому можна припустити, що DKK4 відіграє роль інгібітору розвитку м'язової тканини. Таким чином, існує необхідність у розробці композицій і способів лікування раку і аномальної щільності кісткової тканини, заснованих на застосуванні таких агентів, які роблять вплив або нейтралізують опосередковуваний DKK1 і/або DKK4 антагоністичний вплив на шлях передачі сигналу Wnt. Короткий виклад сутності винаходу Варіантом здійснення даного винаходу є антитіло або його антигензв’язувальна ділянка, що вибірково зв'язується і нейтралізує поліпептид DKK1 і/або DKK4 або його фрагмент. У кращому варіанті здійснення винаходу антитіло являє собою антитіло, що нейтралізує DKK1/4. У різних варіантах здійснення винаходу антигензв’язувальна ділянка антитіла, що нейтралізує DKK1/4, не зв'язується з DKK2 або DKK3. В одному варіанті здійснення винаходу антитіло або його антигензв’язувальна ділянка має імуноглобулінподібний каркас, такий як каркасна ділянка (кістяк), обраний, наприклад, з людського, гуманізованого, гуманованого, акулячого, верблюжого каркасу, і/або вони можуть являти собою також рекомбінантні, химерні антитіла або антитіла із трансплантованими CDR. Наприклад, під об'єм винаходу підпадає технологія, спрямована на мінімізацію людської гуморальної імунної відповіді на мишаче антитіло (технологія одержання гуманованих антитіл, розроблена фірмою Kalobios, або технологія одержання гуманізованих антитіл, розроблена фірмою PDL). Крім того, антигензв’язувальні ділянки, специфічні для DKK1 або DKK4, можуть бути присутнім також в і структурі, що не має імуноглобуліноподібного каркасу, включаючи, наприклад, організацію в таких типах кістяків, як аденектин, фібриноген, отримані з анкірину повтори і т.д. У конкретному варіанті здійснення винаходу антитіло до Dkk1 відрізняється наявністю антигензв’язувальної ділянки, специфічної для білка-мішені DKK1, і антитіло або його функціональний фрагмент зв'язується з DKK1 або його фрагментом. Відповідно до родинного варіанта здійснення винаходу антитіло до DKK4 відрізняється наявністю антигензв’язувальної ділянки, специфічної для білка-мішені DKK4, і антитіло або його функціональний фрагмент зв'язується з DKK4 або його фрагментом. У кращому варіанті здійснення винаходу антитіло або його антигензв’язувальна ділянка зв'язується з поліпептидом DKK1 і DKK4, але не зв'язується з поліпептидом DKK2 або DKK3. В іншому варіанті здійснення винаходу антитіло або його антигензв’язувальна ділянка є моноклональним. У наступному варіанті здійснення винаходу антигензв’язувальна ділянка є поліклональною. У різних варіантах здійснення винаходу антитіло до DKK1 або його антигензв’язувальна ділянка зв'язується з пептидами, що складаються з 30 суміжних амінокислот поліпептиду DKK1 або DKK4. У спорідненому варіанті здійснення винаходу зв'язування DKK1 або DKK4 визначають щонайменше за допомогою одного аналізу, обраного із групи, що включає: аналіз інгібування антагоністичної дії DKK1 або DKK4 відносно транскрипції, обумовленої передачею сигналу Wnt; визначення афінності за допомогою резонансу поверхневого плазмону, твердофазний імуноферментний аналіз зв'язування; заснований на електрохемілюмінісценції аналіз зв'язування; FMAT (аналіз зв'язування, що базується на технології флуорометричного мікрооб'ємного аналізу); SET (врівноважуюче титрування розчину); SPR (резонанс поверхневого плазмону); ALP, TopFlash, визначення в сироватці крові концентрації біомаркерів, таких як остеокальцин (OCN), нітрогенний пропептид проколлагену типу 1 (P1NP) і остеопротегерин (OPG), і визначення зв'язування з рецептором(ами), розташованим(и) на клітинній поверхні, такими як Frizzled (Fz), LRP (LRP5/6) або Kremen (Krm). У конкретних варіантах здійснення винаходу антитіло до Dkk1 або його антигензв’язувальна ділянка володіє щонайменше однією з 3 4 наступних властивостей: селективність у відношенні DKK1, що щонайменше в 10 -разів, 10 5 разів або 10 -разів вище, ніж у відношенні людського DKK2або DKK3; зв'язування з DKK1 або DKK4, що характеризує значенням Kon (константа асоціації) менше 100нМ, 50нМ, 10нМ, 1,0нМ, -2 -3 -4 -5 500пМ, 100пМ, 50пМ або 10пМ; і має швидкість дисоціації з DKK1 менше 10 , 10 , 10 або 10 -1 с . У спорідненому варіанті здійснення винаходу антитіло, що пропонується у винаході, конкурує з DKK1 і/або DKK4 за зв'язування з LRP5/6. У спорідненому варіанті здійснення винаходу антитіло, що пропонується у винаході, конкурує з DKK1 і/або DKK4 за зв'язування з Krm. Ще одним варіантом здійснення винаходу є виділена антигензв’язувальна ділянка кожного із зазначених вище антитіл або функціональних фрагментів цих антитіл і їх амінокислотні 2 UA 101944 C2 5 10 15 20 25 30 35 40 45 50 55 60 послідовності. Таким чином, конкретними варіантами здійснення винаходу є виділені амінокислотні послідовності, обрані із групи, що включає SEQ ID NO: 2-20 і SEQ ID NO: 40-72 і консервативні або гумановані варіанти зазначених послідовностей. Крім того, конкретними додатковими варіантами здійснення винаходи є амінокислотні послідовності SEQ ID NO: 2-20, 65-72 і консервативні або гумановані варіанти зазначених послідовностей, які є виділеними антигензв’язувальними ділянками, кожна з яких являє собою H-CDR3. У спорідненому варіанті здійснення винаходу виділена антигензв’язувальна ділянка являє собою H-CDR2-ділянку, амінокислотна послідовність якої обрана з SEQ ID NO: 2-20, 57-64 їх консервативних або гуманованих варіантів. У ще одному спорідненому варіанті здійснення винаходу виділена антигензв’язувальна ділянка являє собою консенсусну H-CDR2-ділянку, послідовність якої обрана із групи, що включає SEQ ID NO: 40, що має амінокислотну послідовність GISGSGSYTYYADSVKF, SEQ ID NO: 41, що має амінокислотну послідовність GISYYGGNTYYADSVKF, і SEQ ID NO: 42, що має амінокислотну послідовність GISYYGGSTYYADSVKF, і консервативних або гуманованих варіантів амінокислотних залишків зазначених послідовностей. Конкретними варіантами здійснення винаходу є нова послідовність, представлена в SEQ ID NO: 2-5, 8-11, 20, 49-56 і їх консервативних або гуманованих варіантах, які містять виділену антигензв’язувальна ділянка, що представляє собою H-CDR1-ділянку. У спорідненому варіанті здійснення винаходу виділена антигензв’язувальна ділянка являє собою консенсусну H-CDR1-ділянку, що має амінокислотну послідовність, обрану із групи, що включає амінокислотні послідовності (зазначені у вигляді однолітерного коду амінокислот) GFTFSSYGMT (SEQ ID NO: 43), GFTFNSYGMT (SEQ ID NO: 44), GFTFSNYGMT (SEQ ID NO: 45), GFTFSSYWMT (SEQ ID NO: 46), GFTFSSYAMT (SEQ ID NO: 47), GFTFSSYGMS (SEQ ID NO: 48) і консервативні або гумановані варіанти кожної із зазначених послідовностей. Іншим варіантом здійснення винаходу є амінокислотні послідовності, що представляють собою виділені антигензв’язувальні ділянки, які несуть L-CDR3-ділянку, зазначені амінокислотні послідовності обрані з SEQ ID NO: 21-39, 89-96 і консервативних або гуманованих варіантів зазначених послідовностей. У ще одному спорідненому варіанті здійснення винаходу виділена антигензв’язувальна ділянка являє собою L-CDR1-ділянку, амінокислотна послідовність якої обрана з SEQ ID NO: 21-39, 73-80 і консервативних або гуманованих варіантів зазначених послідовностей. У ще одному спорідненому варіанті здійснення винаходу виділена антигензв’язувальна ділянка являє собою L-CDR2-ділянку, амінокислотна послідовність якого обрана з SEQ ID NO: 21-39, 81-88 і консервативних або гуманованих варіантів зазначених послідовностей. У конкретних варіантах здійснення винаходу виділена антигензв’язувальна ділянка являє собою варіабельну область легкого ланцюга, що має амінокислотну послідовність, обрану з SEQ ID NO: 21-39 і консервативних або гуманованих варіантів зазначених послідовностей. Іншим варіантом здійснення винаходу є нуклеотидна послідовність, обрана із групи, що включає SEQ ID NO: 97-103. У спорідненому варіанті здійснення винаходу кожна із зазначених нуклеотидных послідовностей кодує амінокислотну послідовність, і консервативні або гумановані варіанти зазначених амінокислотних послідовностей, що кодуються, також підпадають під об'єм даного винаходу. В іншому спорідненому варіанті здійснення винаходу будь-яка нуклеотидна послідовність, представлена в SEQ ID NO: 97-100, кодує антигензв’язувальний легкий ланцюг. В іншому спорідненому варіанті здійснення винаходу будь-яка нуклеотидна послідовність, представлена в SEQ ID NO: 101-103, кодує антигензв’язувальний важкий ланцюг. Відповідно до іншого родинного варіанта здійснення винаходу кожну із зазначених нуклеотидних послідовностей додатково оптимізують для експресії в клітині. Кращими клітинами є, наприклад (але не обмежуючись тільки ними), клітини китайського хом'ячка (наприклад, CHO-клітини), клітини бакуловірусів, дріжджів, бактерій, мієломи і/або H. sapiens. Краще послідовності оптимізують для експресії і для одержання та клінічного застосування. Для клінічного застосування підлягаючими оптимізації характеристиками є, наприклад (але не обмежуючись тільки ними), час напівжиття, фармакокінетичні (ФК) параметри, антигенність, ефекторна функція, кліренс FcRn і відповідь пацієнта, включаючи антитіло-обумовлену клітиннозалежну цитотоксичність (ADCC) або комплементзалежну цитотоксичність (CDC). Наступним варіантом здійснення винаходу є антигензв’язувальна ділянка, що містить важкий ланцюг, що кодується нуклеотидною послідовністю, обраною із групи, що включає SEQ ID NO: 101-103. Спорідненим варіантом здійснення винаходу є виділена антигензв’язувальна ділянка, що містить легкий ланцюг, що кодується нуклеотидною послідовністю, обраною із 3 UA 101944 C2 5 10 15 20 25 30 35 40 45 50 55 60 групи, що включає SEQ ID NO: 97-100. Ще одним спорідненим варіантом здійснення винаходу є виділена антигензв’язувальна ділянка, що містить легкий ланцюг, що кодується нуклеотидною послідовністю, обраною із групи, що включає SEQ ID NO: 97-100, і важкий ланцюг, що кодується нуклеотидною послідовністю, обраною із групи, що включає SEQ ID NO: 101-103. Конкретним варіантом здійснення винаходу є нуклеотидна послідовність, обрана із групи, що включає SEQ ID NO: 104-110. У спорідненому варіанті здійснення винаходу кожна із зазначених нуклеотидних послідовностей кодує амінокислотну послідовність, і консервативні або гумановані варіанти зазначених амінокислотних послідовностей також підпадають під об'єм даного винаходу. В іншому спорідненому варіанті здійснення винаходу кожна з нуклеотидних послідовностей SEQ ID NO: 104-107 кодує антигензв’язувальний легкий ланцюг. В іншому спорідненому варіанті здійснення винаходу кожна з нуклеотидних послідовностей SEQ ID NO: 108-110 кодує антигензв’язувальний важкий ланцюг. У наступному спорідненому варіанті здійснення винаходу кожну із зазначених нуклеотидних послідовностей оптимізують для експресії і/або для клінічного застосування. Наступним варіантом здійснення винаходу є виділена антигензв’язувальна ділянка, що містить важкий ланцюг, що кодується нуклеотидною послідовністю, обраною із групи, що включає SEQ ID NO: 108-110. Іншим спорідненим варіантом здійснення винаходу є виділена антигензв’язувальна ділянка, що містить легкий ланцюг, що кодується нуклеотидною послідовністю, обраною із групи, що включає SEQ ID NO: 104-107. Наступним спорідненим варіантом здійснення винаходу є виділена антигензв’язувальна ділянка, що містить легкий ланцюг, що кодується нуклеотидною послідовністю, обраною із групи, що включає SEQ ID NO: 104-107, і важкий ланцюг, що кодується нуклеотидною послідовністю, обраною із групи, що включає SEQ ID NO: 108-110. Іншим варіантом здійснення винаходу є амінокислотна послідовність, обрана із групи, що включає SEQ ID NO: 111-117 і консервативні варіанти зазначених послідовностей. У спорідненому варіанті здійснення винаходу кожна з SEQ ID NO: 111-114 позначає антигензв’язувальний легкий ланцюг. В іншому варіанті здійснення винаходу кожна з SEQ ID NO: 115-117 позначає антигензв’язувальний важкий ланцюг. В іншому спорідненому варіанті здійснення винаходу амінокислотну послідовність оптимізують для експресії і/або для клінічного застосування. Наступним варіантом здійснення винаходу є виділена антигензв’язувальна ділянка, що містить важкий ланцюг, амінокислотна послідовність якої обрана із групи, що включає SEQ ID NO: 115-117, а також консервативні варіанти зазначених послідовностей. Спорідненим варіантом здійснення винаходу є виділена антигензв’язувальна ділянка, що містить легкий ланцюг, амінокислотна послідовність якої обрана із групи, що включає SEQ ID NO: 111-114, а також консервативні варіанти зазначених послідовностей. Наступним спорідненим варіантом здійснення винаходу є виділена антигензв’язувальна ділянка, що містить важкий ланцюг, амінокислотна послідовність якої обрана із групи, що включає SEQ ID NO: 115-117, а також консервативні варіанти зазначених послідовностей, і легкий ланцюг, амінокислотна послідовність якої обрана із групи, що включає SEQ ID NO: 111-114, а також консервативні варіанти зазначених послідовностей. Іншим варіантом здійснення винаходу є нуклеотидна послідовність, обрана із групи, що включає SEQ ID NO: 120-121, і/або виділена антигензв’язувальна ділянка, що містить варіабельну область легкого ланцюга або важкого ланцюга, що кодується відповідними нуклеотидними послідовностями. У спорідненому варіанті здійснення винаходу кожна із зазначених нуклеотидних послідовностей кодує амінокислотну послідовність, і консервативні або гумановані варіанти зазначених амінокислотних послідовностей також підпадають під об'єм даного винаходу. В іншому спорідненому варіанті здійснення винаходу нуклеотидна послідовність SEQ ID NO: 120 кодує антигензв’язувальний легкий ланцюг. Ще в одному спорідненому варіанті здійснення винаходу нуклеотидна послідовність SEQ ID NO: 121 кодує антигензв’язувальний важкий ланцюг. У наступному спорідненому варіанті здійснення винаходу кожну із зазначених нуклеотидних послідовностей додатково оптимізують для експресії і/або для клінічного застосування. Конкретним варіантом здійснення винаходу є амінокислотна послідовність, обрана із групи, що включає SEQ ID NO:118-119 і консервативних або гуманованих варіантів цих послідовностей. Спорідненим варіантом здійснення винаходу є антигензв’язувальна вентиляція область легкого ланцюга, представлена в SEQ ID NO: 118. Іншим спорідненим варіантом здійснення винаходу є антигензв’язувальна варіабельна область важкого ланцюга, представлена в SEQ ID NO: 119. У наступному спорідненому варіанті здійснення винаходу амінокислотну послідовностей оптимізують для експресії і/або для клінічного застосування. 4 UA 101944 C2 5 10 15 20 25 30 35 40 45 50 55 60 В інших варіантах здійснення винаходу амінокислотна послідовність ідентична щонайменше на 60, 70, 80, 90, 95, 96, 97, 98 або 99 % CDR-ділянкам, представленим в SEQ ID NO: 2-39. У спорідненому варіанті здійснення винаходу амінокислотна послідовність ідентична щонайменше на 60, 70, 80, 90, 95, 96, 97, 98 або 99 % послідовності, представленій в SEQ ID NO: 111-120. Наступним спорідненим варіантом здійснення винаходу є нуклеотидна послідовність, ідентична щонайменше на 60, 70, 80, 90, 95, 96, 97, 98 або 99 % послідовності, представленій в SEQ ID NO: 97-110 і 120-121. У конкретному варіанті здійснення винаходу кожне з вищевказаних виділених антитіл являє собою IgG. У спорідненому варіанті здійснення винаходу кожне з вищевказаних виділених антитіл являє собою IgG1, IgG2, IgG3 або IgG4. В іншому варіанті здійснення винаходу антитіло являє собою IgE, IgM, IgD або IgA. Спорідненим варіантом здійснення винаходу є композиція моноклонального або поліклонального антитіла. У наступних варіантах здійснення винаходу антитіло являє собою химерне, гуманізоване, гумановане, рекомбінантне антитіло та ін. Наступним варіантом здійснення винаходу є виділене людське або гуманізоване антитіло або його функціональний фрагмент, антигензв’язувальна ділянка якого є специфічною у відношенні епітопу DKK1, і антитіло або його функціональний фрагмент зв'язується з DKK1 або DKK4 або в іншому варіанті блокує зв'язування DKK1 або DKK4 з рецептором, що перебуває на клітинній поверхні (наприклад, з такими рецепторами як LRP5/6, Kremen, Frizzled). У конкретних варіантах здійснення винаходу антитіло або його фрагмент має здатність попереджати, лікувати або зменшувати інтенсивність розвитку остеолітичних ушкоджень. В інших варіантах здійснення винаходу композиція, запропонована у винаході, що містить антитіло до DKK, має здатність попереджати, лікувати або зменшувати інтенсивність асоційованого з DKK1 або DKK4 раку або іншого захворювання. Спорідненим варіантом здійснення винаходу є виділене людське або гуманізоване антитіло або його функціональний фрагмент, антигензв’язувальна ділянка якого є специфічною у відношенні епітопу-мішені DKK1 або DKK4, і епітоп містить 6 або більшу кількість амінокислотних залишків поліпептидного фрагменту, що містить домени CYS лінкер-CYS2 DKK1 і/або DKK4. У спорідненому варіанті здійснення винаходу епітоп являє собою конформаційний епітоп. У кращому варіанті здійснення винаходу епітоп локалізований в CYS 2домені. У конкретному варіанті здійснення винаходу епітоп містить модифікований амінокислотний залишок. У спорідненому варіанті здійснення винаходу епітоп містить щонайменше один глікозильований амінокислотний залишок. Функціональні фрагменти являють собою Fv- і Fab-фрагменти (включаючи одноланцюгові версії, такі як scFv), а також інші антигензв’язувальні ділянки антитіла, включаючи ділянки, зчеплені з неімуноглобуліновим каркасом і антитілами, що складаються тільки з важких ланцюгів, такими як верблюжі і акулячі антитіла та нанотіла. У спорідненому варіанті здійснення винаходу виділене описане вище антитіло являє собою IgG. В іншому спорідненому варіанті здійснення винаходу описане вище виділене антитіло являє собою IgG1, IgG2, IgG3 або IgG4. В іншому варіанті здійснення винаходу антитіло являє собою IgE, IgM або IgA. Спорідненим варіантом здійснення винаходу є композиція поліклонального антитіла. Іншим варіантом здійснення винаходу є фармацевтична композиція, що містить щонайменше одне з будь-яких зазначених вище антитіл або функціональних фрагментів або консервативних варіантів і фармацевтично прийнятний носій або експіциент. Ще одним варіантом здійснення винаходу є трансгенна тварина, що несе ген, що кодує зазначені вище антитіла або їх функціональні фрагменти. Конкретними варіантом здійснення винаходу є спосіб лікування порушення або стану, асоційованого з експресією DKK1 або DKK4. У контексті даного опису поняття «асоційовані з DKK1 захворювання» або «асоційовані з DKK4 захворювання» включають (але не обмежуючись тільки ними) остеолітичні ушкодження - насамперед остеолітичні ушкодження, асоційовані з мієломою, насамперед множинною мієломою, або раком кісткової тканини, молочної залози, ободової кишки, меланоцитів, гепатоцитів, епітелію, стравоходу, головного мозку, легені, передміхурової залози або підшлункової залози, або його метатстазами; втратою кісткової тканини, асоційованої із трансплантацією. Інші захворювання або порушення являють собою (але не обмежуючись ними), наприклад, остеосаркому, рак передміхурової залози, печінковоклітинну карциному (HCC), мієлому, включаючи множинну мієлому, діабет, ожиріння, м'язову атрофію, хворобу Альцгеймера, остеопороз, остеопенію, ревматизм, коліт і/або небажану втрату волосся. Спосіб полягає в тому, що вводять індивідуумові, що потребує цього, в ефективній кількості кожну із зазначених вище фармацевтичних композицій. У спорідненому варіанті здійснення винаходу порушення або стан, що підлягає лікуванню, являє собою аномальну щільність кісткової тканини. В іншому спорідненому варіанті здійснення 5 UA 101944 C2 5 10 15 20 25 30 35 40 45 50 55 60 винаходу аномальна щільність кісткової тканини, що підлягає лікуванню, являє собою наявність остеолітичного ушкодження в індивідуума. В іншому варіанті здійснення винаходу порушення або стан, що підлягає лікуванню, являє собою остеопорозний стан, таке як остеолітичне ушкодження, асоційоване з раком. У спорідненому варіанті здійснення винаходу рак, що підлягає лікуванню, являє собою мієлому, наприклад, множинну мієлому, або рак кісткової тканини, молочної залози, ободової кишки, меланоцитів, гепатоцитів, епітелію, стравоходу, головного мозку, легені, передміхурової залози або підшлункової залози або його метастази. В інших варіантах здійснення винаходу остеопорозний стан являє собою остеопороз або остеопенію або остеосаркому. У конкретних варіантах здійснення винаходу кожний із зазначених вище способів передбачає також введення хіміотерапевтичного агента. У спорідненому варіанті здійснення винаходу хіміотерапевтичний агент являє собою протираковий агент. В іншому спорідненому варіанті здійснення винаходу хіміотерапевтичний агент являє собою антиостеопорозний агент. Ще одним варіантом здійснення винаходу є спосіб лікування клітини-мішені, що полягає в тому, що блокують взаємодію DKK1 або DKK4 із клітиною за допомогою кожного із зазначених вище антитіл або їх функціональних фрагментів. У цілому, клітина-мішень містить рецептор, з яким зв'язується DKK1 або DKK4. В одному з варіантів здійснення винаходу клітина-мішень являє собою остеобласт, при цьому лікування з використанням композиції нейтралізуючих антитіл до DKK1/4, запропонованої у винаході, повинне підсилювати проліферацію і стимулювати формування кісткової тканини. В іншому варіанті здійснення винаходу клітинамішень являє собою м'язову клітину, при цьому лікування повинне протидіяти м'язовій атрофії. У спорідненому варіанті здійснення винаходу спосіб додатково передбачає те, що пацієнта, в організмі якого присутні клітини-мішені, лікують хіміотерапевтичним агентом або опроміненням. У спорідненому варіанті здійснення винаходу в кожному із зазначених вище способів після введення або приведення в контакт додатково передбачається виявлення зменшення інтенсивності або вповільнення розвитку остеолітичного ушкодження. Ще одним варіантом здійснення винаходу є спосіб виявлення DKK1 або DKK4 у сироватці. Зазначений спосіб полягає в тому, що виявляють DKK1 або DKK4 за допомогою кожного з вищевказаних антитіл або фрагментів антитіл, що додатково містять мітку, що виявляється. Мітка являє собою радіоактивну, флуоресцентну, магнітну, парамагнітну або хемілюмінісцентну мітку. В іншому варіанті здійснення винаходу кожне з вищевказаних людських або гуманізованих антитіл або фрагментів антитіл є синтетичним. Наступним варіантом здійснення винаходу є фармацевтична композиція, що містить кожне з вищевказаних антитіл або функціональних фрагментів цих антитіл і додатковий терапевтичний агент. Додатковий терапевтичний агент можна вибирати із групи, що включає протираковий агент; антиостеопорозний агент; антибіотик; антиметаболічний агент; антидіабетичний агент; протизапальний агент; антиангіогенний агент; фактор росту; і цитокін. Винахід відноситься також до способу попередження або лікування проліферативних хвороб або таких захворювань, як рак, у ссавця, насамперед у людини, за допомогою комбінації фармацевтичних агентів, що включає: (a) агент, що нейтралізує DKK1/4, запропонований у винаході; і (б) одна або кілька фармацевтичних діючих речовин; де щонайменше одна з фармацевтичних діючих речовин являє собою протираковий терапевтичний агент. Винахід відноситься також до фармацевтичної композиції, що містить: (a) нейтралізуюче антитіло до DKK1/4; (б) фармацевтично діюча речовина; і (в) фармацевтично прийнятний носій; де щонайменше одна з фармацевтичних діючих речовин являє собою протираковий терапевтичний агент. Даний винахід відноситься також до упакування або продукту, що поступає у продаж, які містять: (а) фармацевтичний препарат нейтралізуюче антитіло до DKK1/4; і (б) фармацевтичний препарат фармацевтичної діючої речовини для одночасного, супутнього, роздільного або послідовного застосування; де щонайменше одна з фармацевтичних діючих речовин являє собою протираковий терапевтичний агент. Конкретним варіантом здійснення винаходу є антитіло, що має першу амінокислотну послідовність, що представляє собою важкий ланцюг, обраний з SEQ ID NO: 2-20, і 6 UA 101944 C2 5 10 15 20 25 30 35 40 45 50 55 послідовність, що ідентична щонайменше на 60, 70, 80, 90, 95, 96, 97, 98 або 99 % послідовності CDR-ділянок, де CDR-ділянки мають послідовність, представлену в SEQ ID NO: 2-20; і другу амінокислотну послідовність, що представляє собою легкий ланцюг, обраний з SEQ ID NO: 2139, і послідовність, що ідентична щонайменше на 60, 70, 80, 90, 95, 96, 97, 98 або 99 % послідовності CDR-ділянок, де CDR-ділянки мають послідовність, представлену в SEQ ID NO: 21-39. І ще одним варіантом здійснення винаходу є імунокон’югат, що складається з першого компонента, що являє собою антитіло або його фрагмент, як вони описані вище, і другий компонент, що має другу амінокислотну послідовність. Наприклад, імунокон’югат являє собою цитотоксин, або імунокон’югат являє собою єднальний білок або антитіло, що має специфічність до зв'язування з мішенню, що відрізняється від DKK1 або DKK4. Наприклад, мішенню для специфічного зв'язування, що відрізняється від DKK1 або DKK4, є пухлинний антиген або асоційований з пухлиною білок, що перебуває на поверхні ракової клітини. У конкретних варіантах здійснення винаходу кожне з описаних вище антитіл являє собою біспецифічне антитіло. Іншим варіантом здійснення винаходу є набір, до складу якого входять будь-які зазначені вище антитіла або фрагменти антитіл. У деяких варіантах здійснення винаходу набір містить також фармацевтично прийнятний носій або ексципіент. В інших споріднених варіантах здійснення винаходу кожне із вищевказаних антитіл, що входять до складу набору, присутнє у вигляді стандартної дози. В іншому варіанті здійснення винаходу набір являє собою діагностичний набір для ELISA. У спорідненому варіанті здійснення винаходу набір містить інструкції із застосування кожного з вищевказаних антитіл для введення індивідуумові. Короткий опис креслень На кресленнях показано: на фіг. 1 – графік, на якому продемонстрована несуттєва втрата міченого за допомогою HisStrep DKK1 із гранул, покритих Strep-Tactin, виявлена при порівнянні невідмитих гранул із ® гранулами після відмивання HuCAL в умовах різної строгості; на фіг. 2 - стовпчикова діаграма, що ілюструє результати аналізу активності Wnt з використанням 100 мкл реагенту, що представляє собою Bright-Glo-люциферазу, що проводили відповідно до методу, описаного в прикладі 3; на фіг. 3 - графік, що ілюструє результати, отримані за допомогою твердофазного імуноферментного аналізу (ELISA). Флуоресценцію оцінюють за допомогою планшет-рідера типу TECAN Spectrafluor і результати представляють у вигляді кривих зв'язування; на фіг. 4 - графік, що ілюструє результати стандартного Wnt3 a-залежного TCF/LEF lucрепортерного аналізу, описаного в прикладі 6; на фіг. 5 - графік, що ілюструє результати, отримані за допомогою вдосконаленої версії TCF/LEF luc-репортерного аналізу, які свідчать про значно підвищену чутливість до DKK1, опосередкованій спільною експресією з корецептором білка Kremen; на фіг. 6А - графік, що ілюструє результати аналізу зв'язування антитіла до DKK1/4 з DKK1, проведеного методом резонансу поверхневого плазмону; на фіг. 6Б - таблиця розрахованих значень афінності до зв'язування і кінетичних даних; на фіг. 7A - схематичне зображення повнорозмірного й укорочений DKK1 для застосування в картированні епітопів; на фіг. 7Б - дані про зв'язування антитіла, запропонованого у винаході, з білками і фрагментами DKK1, представленими на фіг. 7А; на фіг. 8 - графік, що ілюструє зв'язування антитіла до DKK1/4 за даними конкурентного ELISA; на фіг. 9 - графік, що ілюструє асоційовану з антитілом до DKK1/4 реактивацію регульованого Wnt транскрипції гена, розташованого по ходу шляху (передачі сигналу); на фіг. 10 - графік, що ілюструє, що антитіло до DKK1/4 анулює секрецію ALP, що інгібується DKK1; на фіг. 11 – графік, що ілюструє вплив антитіла до DKK1/4 на ксенотрансплантати in vivo; на фіг. 12 – графік, що ілюструє асоційоване з антитілом до DKK1/4 збільшення щільності кісткової тканини in vivo; на фіг. 13 - графік, на якому наведене зіставлення антиостеолітичної ефективності Zometa і антитіла до DKK1/4; на фіг. 14- графік, що ілюструє залежність від дози ефективності антитіла до DKK1/4 відносно анаболізму кісткової тканини. 7 UA 101944 C2 5 10 15 20 25 30 35 40 45 50 55 60 Докладний опис винаходу Даний винахід відноситься до виділених антитіл до DKK1/4, насамперед людських антитіл, які специфічно зв'язуються з DKK1 або DKK4 і інгібують функціональні властивості DKK1 або DKK4. У кращому варіанті здійснення винаходу антитіло до DKK1/4 не має специфічну здатність до зв'язування з DKK2 або DKK3. У конкретних варіантах здійснення винаходу антитіла, запропоновані у винаході, виведені з конкретних послідовностей важких і легких ланцюгів і/або містять конкретні структурні особливості, такі як CDR-ділянки, що містять конкретні амінокислотні послідовності. Винахід відноситься до виділених антитіл, способам одержання зазначених антитіл, імунокон’югатів і біспецифічних молекул, які містять зазначені антитіла, і до фармацевтичних композицій, що містять антитіла, імунотопоізомерази або біспецифічні молекули, запропоновані у винаході. Винахід відноситься також до способів застосування антитіл для інгібування порушення або стану, асоційованого з DKK1 або DKK4. Відповідні захворювання й порушення являють собою (але не обмежуючись тільки ними) остеолітичні ушкодження, насамперед остеолітичні ушкодження, асоційовані з мієломою, насамперед множинною мієломою, або раком кісткової тканини, молочної залози, ободової кишки, меланоцитів, гепатоцитів, епітелію, стравоходу, головного мозку, легені, передміхурової залози або підшлункової залози, або його метатстазами; втратою кісткової тканини, асоційованої із трансплантацією. Інші захворювання або порушення являють собою (але не обмежуючись тільки ними), наприклад, остеосаркому, рак передміхурової залози, печінково-клітинну карциному (HCC), мієлому, включаючи множинну мієлому, діабет, ожиріння, м'язову атрофію, хворобу Альцгеймера, остеопороз, остеопенію, ревматизм, коліт і/або небажану втрату волосся. З метою кращого розуміння даного винаходу спочатку наведені визначення деяких понять. Додаткові поняття будуть роз'яснені при докладному описі винаходу. Поняття «імунна відповідь» відноситься до дії, наприклад, лімфоцитів, антигенпрезентуючих клітин, фагоцитів, гранулоцитів і розчинних макромолекул, що продукуються зазначеними вище клітинами або печінкою (включаючи антитіла, цитокіни і комплемент), результатом якого є виборче ушкодження, деструкція або елімінація з організму-хазяїна патогенів, що впроваджуються, клітин або тканин, заражених патогенами, ракових клітин, або, як у випадку аутоімунітету або патологічного запалення, здорових людських клітин або тканин. Поняття «шлях трансдукції сигналу» відноситься до біохімічного взаємозв'язку між різними молекулами трансдукції сигналу, які відіграють роль у передачі сигналу від однієї частини клітини до іншої частини клітини. У контексті даного опису фраза «рецептор клітинної поверхні (рецептор, розташований на поверхні клітини)» включає, наприклад, молекули і комплекси молекул, які мають здатність одержувати сигнал і мають здатність передавати зазначений сигнал через плазматичну мембрану клітини. Прикладом «рецептора клітинної поверхні» у контексті даного опису є рецептор, з яким зв'язується молекула білка DKK1 або DKK4. До таких рецепторів клітинної поверхні відносяться (але не обмежуючись тільки ними) Frizzled (Fz), LRP (LRP5 і LRP6) і Kremen (Krm). У контексті даного опису поняття «антитіло» відноситься до поліклональних антитіл, моноклональних антитіл, гуманізованих антитіл, одноланцюжкових антитіл і їх фрагментам, таким Fab, F(ab')2, Fv та інші фрагменти, які зберігають антигензв’язувальну функцію батьківського антитіла. Саме по собі поняття «антитіло» може відноситися до імуноглобуліну або глікопротеїну або їх фрагменту або ділянці або до конструкції, що містить антигензв’язувальну ділянку, що перебуває в модифікованому імуноглобуліноподібному каркасі, або до антигензв’язувальної ділянки, що перебуває в конструкції, що має кістяк або каркас не імуноглобулінового типу. У контексті даного опису поняття «моноклональне антитіло» відноситься до композиції антитіла, що містить гомогенну популяцію антитіл. Поняття не обмежене видами або джерелами антитіла, також мається на увазі, що поняття не обмежене методом його одержання. Під поняття підпадають повні імуноглобуліни, а також їх фрагменти, такі як F ab, F(ab')2, Fv та інші, які зберігають антигензв’язувальну функцію антитіла. У контексті даного винаходу можна використовувати моноклональні антитіла з будь-яких видів ссавців. Однак на практиці антитіла, як правило, являють собою щурячі або мишачі антитіла завдяки доступності ліній щурячих або мишачих клітин, які можна застосовувати для створення необхідних гібридних клітинних ліній або гібридом, які застосовують для одержання моноклональних антитіл. У контексті даного опису поняття «поліклональне антитіло» відноситься до композиції антитіла, що містить гетерогенну популяцію антитіл. Поліклональні антитіла часто одержують із об'єднаної сироватки, отриманої з організму імунізованих тварин або відібраних людей. 8 UA 101944 C2 5 10 15 20 25 30 35 40 45 50 55 60 У контексті даного опису поняття «одноланцюгові антитіла» відноситься до антитіл, отриманих шляхом визначення єднальних доменів (і легких, і важких ланцюгів) антитіла, що зв'язується, і введення фрагмента, що зчіплює, що забезпечує збереження єднальної функції. Ці форми, по суті, являють собою радикально скорочене антитіло, що несе тільки частину варіабельної області, необхідної для зв'язування з антигеном. Визначення і конструювання одноланцюжкових антитіл описане в US 4946778 на ім'я Ladner та ін. «Антитіло, що зустрічається в природних умовах» являє собою глікопротеїн, що містить щонайменше два важкі (H) ланцюги і два легкі (L) ланцюга, зв'язані між собою дисульфідними містками. Кожний важкий ланцюг складається з варіабельної області важкого ланцюга (скорочено позначений у контексті даного опису як VH) і константної області важкого ланцюга. Константна область важкого ланцюга складається із трьох доменів, тобто CH1, CH2 і CH3. Кожний легкий ланцюг складається з варіабельної області легкого ланцюга (скорочено позначений у контексті даного опису як VL) і константної області легкого ланцюга. Константна області легкого ланцюга складається їх одного домена, тобто C L. VH- і VL -області можна додатково підрозділяти на області гіперваріабельності, які називають гіперваріабельними ділянками (CDR), які перемежовуються з більш консервативними ділянками, які називають каркасними ділянками (FR). Кожна VH і VL складається із трьох CDR і чотирьох FR, які в напрямку від амінокінця до карбоксильного кінця розташовані в наступному порядку: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Варіабельні області важких і легких ланцюгів містять єднальний домен, що взаємодіє з антигеном. Константні області антитіл можуть опосередковувати зв'язування імуноглобуліну із тканинами або факторами хазяїна, у тому числі з різними клітинами імунної системи (наприклад, ефекторними клітинами) і першим компонентом (Clq) класичної системи комплементу. Поняття «антигензв’язувальна ділянка» антитіла (або просто «антигенний центр» («область детермінанти») у контексті даного опису відноситься до білкової послідовності, що зв'язується з мішенню, наприклад, являє собою один або декілька CDR. Поняття відноситься, наприклад, до повнорозмірного антитіла, одного або декількох фрагментів антитіла і/або CDR на каркасі не імуноглобулінового типу, які зберігають здатність специфічно зв'язуватися з антигеном (наприклад, DKK1). Антигензв’язувальна функція антитіла може здійснюватися за допомогою фрагментів повнорозмірного антитіла. Прикладами фрагментів, що зв'язуються, що підпадають під поняття «антигензв’язувальна ділянка» антитіла, є Fab-фрагмент, одновалентний фрагмент, що складається з VL-, VH-, CL- і CH1-доменів; F(ab)2-фрагмент, двовалентний фрагмент, що складається з двох Fab-фрагментів, зв'язаних дисульфідним містком у шарнірній області; Fdфрагмент, що складається з VH- і CH1-доменів; Fv-фрагмент, що складається з VL- і VH-доменів одного плеча антитіла; dAb-фрагмент (Ward та ін., Nature 341, 1989, сс.544-546), що складається з VH-домену; і виділена гіперваріабельна ділянка (CDR). У контексті даного опису поняття «антиген» або «епітоп» використовують взаємозамінно, і вони відносяться до поліпептидної послідовності на білку-мішені, що специфічно розпізнається антигензв’язувальною ділянкою антитіла, фрагменту антитіла або їх еквівалентами. Антиген або епітоп містять щонайменше 6 амінокислот, які можуть бути суміжними або несуміжними в послідовності-мішені. Конформаційний епітоп може містити несуміжні залишки й необов'язково може містити амінокислотні залишки, що зустрічаються в природних умовах або синтетичним шляхом модифіковані. Модифікації залишків включають (але не обмежуючись ними): фосфолювання, глікозилювання, ПЕГілювання, убікітинізацію, фуранилізування і т.п. Крім того, хоча два домени Fv-фрагменту, тобто VL і VH, кодуються різними генами, їх можна з'єднувати за допомогою методів рекомбінації синтетичним лінкером, що дозволяє створювати з них один білковий ланцюг, у якому пара VL- і VH-областей формує одновалентні молекули (відомі за назвою одноланцюжковий Fv-фрагмент (scFv) (див., наприклад, Bird та ін., Science 242, 1988, сс. 423-426; і Huston та ін., Proc. Natl. Acad. Sci. 85, 1988, сс. 5879-5883). Такі одноланцюгові антитіла також підпадають під поняття «антигензв’язувальна ділянка» антитіла. Зазначені фрагменти антитіла одержують за допомогою загальноприйнятих методів, відомих фахівцям у даній області, і фрагменти піддають скринінгу відносно можливості їхнього застосування, аналогічного застосуванню інтактних антитіл. Як зазначено в даному описі, консервативні варіанти включають ідентифіковані амінокислотні залишки в будь-якій послідовності, насамперед консервативні заміни, які добре відомі звичайному фахівцеві в області конструювання білків. Поняття «виділене антитіло» у контексті даного опису відноситься до антитіла, що практично вільне від інших антитіл з іншою антигенною специфічністю (наприклад, виділене антитіло, що специфічно зв'язується з DKK1, практично вільно від антитіл, які специфічно зв'язуються з антигенами, відмінними від DKK1). Однак виділене антитіло, що специфічно 9 UA 101944 C2 5 10 15 20 25 30 35 40 45 50 55 60 зв'язується з DKK1 може давати перехресну реакцію з іншими антигенами, такими як молекули DKK1 з інших видів або представники іншого сімейства, такого як DKK4, або родинні паралоги. Крім того, виділене антитіло може бути практично вільне від іншого клітинного матеріалу і/або хімічних речовин. Мається на увазі, що поняття «людське антитіло» у контексті даного опису відноситься до антитіл, що несуть варіабельні області, у яких як каркасні, так і CDR-ділянки виведені з послідовностей людського походження. Крім того, якщо антитіло містить константну область, то константну область також виводять із таких людських послідовностей, наприклад, з послідовностей людської зародкової лінії або мутантних версій послідовностей людської зародкової лінії. Людські антитіла, запропоновані у винаході, можуть включати також амінокислотні залишки, які не кодуються людськими послідовностями (наприклад, у результаті мутацій, що інтродуковані шляхом випадкового або сайтнаправленого мутагенезу in vitro або соматичної мутації in vivo). Однак не мається на увазі, що поняття «людське антитіло» у контексті даного опису відноситься до антитіл, у яких послідовності CDR, виведені із зародкової лінії інших ссавців, таких як миша, трансплантовані в людські послідовності каркасних ділянок. Поняття «людське моноклональне антитіло» відноситься до антитіл, які мають однакову специфічність зв'язування, мають варіабельні області, у яких як каркасні ділянки, так і CDRділянки виводять із людських послідовностей. В одному з варіантів здійснення винаходу моноклональні антитіла одержують за допомогою гібридоми, що включає B-клітину, отриману із трансгенної тварини крім людини, наприклад, трансгенної миші, у геномі якої міститься трансген людського важкого ланцюга і трансген людського легкого ланцюга, злитий з імморталізованою клітиною. У контексті даного опису поняття «гуманізовані антитіла» означає, що щонайменше частина каркасних ділянок імуноглобуліну виведена з людських послідовностей імуноглобуліну. «Гуманізовані» антитіла являють собою антитіла, CDR-послідовності яких виведені із зародкової лінії інших видів, насамперед видів ссавців, наприклад, миші, які трансплантовані в послідовності людських каркасних ділянок. Прикладом такої технології є технологія гуманізації, розроблена фірмою PDL. У контексті даного опису поняття «гумановані антитіла» відноситься до антитіл, які зв'язуються з тим же епітопом, але відрізняються їх послідовністю. Прикладом такої технології є одержання гуманованих антитіл за допомогою технології гуманування, розробленою фірмою Kalobios, при використанні якої антигензв’язувальну ділянку одержують, наприклад, за допомогою мутації, а не за допомогою консервативних амінокислотних замін. Поняття «рекомбінантне людське антитіло» у контексті даного опису відноситься до всіх людських антитіл, які одержують, експресують, створюють або виділяють за допомогою методів рекомбінації, наприклад, до антитіл, виділених із тварини (наприклад, миші), що є трансгенною або трансхромосомною завдяки інтродукції генів людського імуноглобуліну, або отриманим з гібридоми, до антитіл, виділеним із клітини-хазяїна, трансформованого з метою експресії людського антитіла, наприклад, з використанням трансфектоми, до антитіл, виділених з рекомбінантної комбінаторної бібліотеки людських антитіл, і до антитіл, отриманим, експресованим, створеним або виділеним будь-якими іншими шляхами, які включають сплайсинг послідовності всього гена людського імуноглобуліну або його частини за допомогою лігування з іншими послідовностями ДНК. Зазначені рекомбінантні людські антитіла несуть варіабельні області, у яких каркасні й CDR-ділянки виводять із послідовностей імуноглобуліну людської зародкової лінії. Однак у деяких варіантах здійснення винаходу зазначені рекомбінантні людські антитіла можна піддавати мутагенезу in vitro (або, коли для одержання людських послідовностей Ig використовуються трансгенні тварини, соматичному мутагенезу in vivo), і в результаті амінокислотні послідовності VH- і VL-областей рекомбінантних антитіл являють собою послідовності, які хоча й виведені і є спорідненими послідовностям VH і VL людської зародкової лінії, можуть не зустрічатися в природних умовах у популяції антитіл людської зародкової лінії in vivo. У контексті даного опису поняття «ізотип» відноситься до класу антитіл (наприклад, IgA, IgD, IgM, IgE, IgG, такому як IgG1, IgG2, IgG3 або IgG4), які кодуються генами константної області важкого ланцюга. Фрази «антитіло, що розпізнає антиген» і «антитіло, специфічне відносно антигену» у контексті даного опису використовують взаємозамінно з поняттям «антитіло, що специфічно зв'язується з антигеном». У контексті даного опису антитіло, що «специфічно зв'язується з людським DKK1», означає антитіло, зв'язування якого з людським DKK1 характеризується -9 -9 -10 значенням KD, що становить 5 × 10 M або менше, 2 × 10 M або менше, або 1 × 10 M або менше. Антитіло, що «дає перехресну реакцію з антигеном, відмінним від людського DKK1» 10 UA 101944 C2 5 10 15 20 25 30 35 40 45 50 55 60 означає антитіло, зв'язування якого з антигеном характеризується значенням K D, щостановить 5 -8 -9 -9 × 10 M або менше, 5 × 10 M або менше, або 2 × 10 M або менше. Антитіло, що «не дає перехресну реакцію з конкретним антигеном» означає антитіло, зв'язування якого з антигеном -8 характеризується значенням KD, що становить 1,5 × 10 M або більше або значенням KD, що -10 -8 -7 становить 5 × 10 M або 1 × 10 M або більше. У конкретних варіантах здійснення винаходу ті антитіла, які не дають перехресну реакцію з антигеном, являють собою антитіла, які характеризуються практично, що виявляється не зв'язуванням, із зазначеними білками при оцінці за допомогою стандартних аналізів зв'язування. У контексті даного опису антитіло, що «інгібує зв'язування DKK1 з рецептором клітинної поверхні», таким як LRP, Fz або Krm, відноситься до антитіла, інгібування яким зв'язування DKK1 з рецептором, характеризується значенням KD, що становить 1нМ або менше, 0,75нМ або менше, 0,5нМ або менше, або 0,25нМ або менше. У контексті даного опису поняття «остеоліз» відноситься до зниження щільності кісткової тканини, що є результатом різних механізмів дії, включаючи, наприклад, знижену активність остеобластів, підвищену активність остеокластів. Таким чином, остеоліз обумовлений механізмами, які в цілому впливають на густину мінеральної речовини кісткової тканини. У контексті даного опису мається на увазі, що антитіло, що «інгібує остеолітичну активність» відноситься до антитіла, що інгібує зниження щільності кісткової тканини або шляхом посилення формування кісткової тканини, або шляхом блокування резорбції кісткової тканини. Мається на увазі, що поняття «Kassoc» або «Ka» у контексті даного опису відноситься до швидкості асоціації взаємодії конкретного антитіла-антигену, а поняття «Kdis» або «Kd» у контексті даного опису відноситься до швидкості дисоціації взаємодії конкретного антитілаантигену. У контексті даного опису мається на увазі, що поняття «KD» відноситься до константи дисоціації, що одержують на основі співвідношення Kd і Ka (тобто Kd/Ka) і виражають у молярній концентрації (M). Значення KD для антитіл можна визначати за допомогою методів, добре відомих у даній області. Метод визначення значення KD антитіла являє собою метод, що базується на резонансі поверхневого плазмону, FMAT, або метод, що базується на ® застосуванні біосенсорної системи, такий як система Biacore . У контексті даного опису поняття «афінність» відноситься до сили взаємодії між антитілом і антигеном в індивідуальних антигенних сайтах. У кожному антигенному сайті варіабельна область «плеча» антитіла взаємодіє через слабкі нековалентні сили з антигеном у численних сайтах; чим більше взаємодій, тим сильніше афінність. У контексті даного опису поняття «авідність» відноситься до інформативного критерію загальної стабільності або силі комплексу антитіло-антиген. Вона контролюється трьома основними факторами: афінністю антитіла до епітопу; валентністю й антигену, і антитіла; і структурною організацією взаємодіючих ділянок. В остаточному підсумку ці фактори визначають специфічність антитіла, тобто ймовірність того, що конкретне антитіло зв'язується з певним антигенним епітопом. Для одержання зонда, що має більшу авідність, можна конструювати димерний кон’югат (дві молекули JWJ-1, що зшиті з FACS-маркером), створюючи тим самим взаємодії, що мають низьку афінність (як у випадку зародкової лінії антитіла), які легше виявляти за допомогою FACS. Крім того, інші методи підвищення авідності антигенного зв'язування передбачають створення димерів або мультимерів будь-якої із представлених у даному описі конструкцій антитіл до DKK1 або DKK4, що містять фібронектин. Зазначені мультиміри можна створювати, здійснюючи ковалентне зв'язування між індивідуальними модулями, наприклад, шляхом імітації зв'язування, що зустрічається в природних умовах, C-кінця з N-кінцем або шляхом імітації димерів антитіл, які поєднуються один з одним через їх константні області. Зв'язки, що створюються на кордоні розділу Fc/Fc, можуть бути ковалентними або нековалентними. Крім того, у гібридах DKK1 або DKK4 можна використовувати партнерів для димеризації або мультимеризації, відмінних від Fc, для створення структур більш високого порядку. У контексті даного опису поняття «перехресна реактивність» відноситься до антитіла або популяції антитіл, які зв'язуються з епітопами на інших антигенах. Це може бути обумовлено або низькою авідністю або низькою специфічністю, або наявністю безлічі різних антигенів, які мають однакові або дуже подібні епітопи. Іноді перехресна реактивність є бажаною, коли існує потреба в загальному зв'язуванні з родинною групою антигенів або при спробі здійснення мічення перехресних видів (крос-видів), коли послідовність антигенного епітопу в процесі еволюції не здобуває високу консервативність. У контексті даного опису поняття «висока афінність» або «висока специфічність» відносно антитіла ізотипу IgG відноситься до антитіла, для якого значення KD відносно антигену-мішені -8 -9 -10 становить 10 M або менше, 10 M або менше, або 10 M або менше. Однак «висока афінність» 11 UA 101944 C2 5 10 15 20 25 30 35 40 45 50 55 60 зв'язування може бути іншою для інших ізотипів антитіл. Наприклад, «висока афінність» зв'язування відносно ізотипу IgM відноситься до антитіла, для якого значення K D становить 10 7 -8 M або менше або 10 M або менше. У контексті даного опису поняття «індивідуум» відноситься до будь-якої людини або тварини крім людини. Поняття «тварина крім людини» включає всіх хребетних тварин, наприклад, ссавців і тварин, що не відносяться до ссавців, таких як примати крім людини, вівці, собаки, кішки, коня, корови, курки, амфібії, рептилії і т.д. У контексті даного опису поняття «оптимізована» означає, що нуклеотидна послідовність змінена відносно кодування амінокислотної послідовності за допомогою кодонів, кращих для продуктивних клітин або організмів, і/або нуклеотидна послідовність змінена для видалення схованих донорських або акцепторних сайтів сплайсингу. Таблиці оптимізованих кодонів добре відомі в даній області для широкої розмаїтості видів. Послідовності донорських або акцепторних сайтів сплайсингу також відомі в даній області, а сховані сайти сплайсингу можна ідентифікувати, наприклад, аналізуючи дані про транскрипцію або експресію. Продуктивні клітини включають (але не обмежуючись ними) прокаріотичні клітини, такі, наприклад, клітини бакуловірусів або бактерій (E. coli), або еукаріотичні клітини, наприклад, клітину дріжджів (наприклад, Pichia), клітину яєчника китайського хом'ячка (CHO), клітину мієломи або людську клітину. Оптимізовану нуклеотидную послідовність створюють так, щоб вона повністю або максимально можливо зберігала здатність кодувати амінокислотну послідовність і кількість залишків, які кодуються спочатку вихідною нуклеотидною послідовністю, що називають також «батьківською» послідовністю. У контексті даного опису оптимізовані послідовності створюють так, щоб вони мали кодони, кращі для продуктивних клітин, однак передбачається також оптимізована експресія цих послідовностей в інших еукаріотичних і прокаріотичних клітинах. Амінокислотні послідовності, що кодуються оптимізованами нуклеотидними послідовностями, необов'язково позначають також як оптимізовані. У споріднених варіантах здійснення винаходу поліпептидні послідовності композицій нейтралізуючих антитіл до DKK1/4, запропонованих у винаході, і нуклеотиди, які їх кодують, краще оптимізують для виробництва й клінічного застосування. Характеристики, які можна оптимізувати для клінічного застосування, включають (але не обмежуючись тільки ними), наприклад, час напівжиття, фармакокінетичні (ФК) параметри, антигенність, ефекторну функцію, кліренс FcRn і відповідь пацієнта, включаючи антитіло-обумовлену клітиннозалежну цитотоксичність (ADCC) або комплементзалежну цитотоксичність (CDC). У контексті даного опису «асоційовані з DKK1 хвороби» або «асоційовані з DKK4 хвороби» включають (але не обмежуючись тільки ними) остеолітичні ушкодження, насамперед остеолітичні ушкодження, асоційовані з мієломою, насамперед множинною мієломою, або раком кісткової тканини, молочної залози, ободової кишки, меланоцитів, гепатоцитів, епітелію, стравоходу, головного мозку, легені, передміхурової залози або підшлункової залози, або його метатстазами; втратою кісткової тканини, асоційованої із трансплантацією. Інші захворювання або порушення являють собою (але не обмежуючись тільки ними), наприклад, остеосаркому, рак передміхурової залози, печінково-клітинну карциному (HCC), мієлому, включаючи множинну мієлому, діабет, ожиріння, м'язову атрофію, хворобу Альцгеймера, остеопороз, остеопенію, ревматизм, коліт і/або небажану втрату волосся. У контексті даного опису «лікування» являє собою втручання, що здійснюється з метою попередження розвитку або зміни патології порушення. Таким чином, поняття «лікування» відноситься як до терапевтичного лікування, так і до профілактичних або превентивних мір. Пацієнти, які потребують лікування, включають пацієнтів, які вже мають порушення, а також пацієнтів, у яких порушення можна попереджати. При лікуванні пухлини (наприклад, при раку) терапевтичний агент може безпосередньо знижувати патологію пухлинних клітин або надавати пухлинним клітинам більш високу чутливість до лікування іншими терапевтичними агентами, наприклад, опроміненням і/або хіміотерапією. «Патологія» раку включає всі явища, які піддають ризику здоров'я пацієнта. Вона включає (але не обмежуючись тільки ними) аномальний або неконтрольований ріст клітин, метастази, вплив на нормальну функцію сусідніх клітин, аномальні рівні вивільнення цитокінів або інших продуктів, що декретуються, придушення або погіршення запальної або імунологічної відповіді і т.д. Лікування пацієнтів, що страждають клінічними, біохімічними, радіологічними або суб'єктивними симптомами хвороби, такої як остеоліз, може являти собою полегшення деяких або всіх зазначених симптомів або зниження схильності до захворювання. У цілому композиція нейтралізуючих антитіл до DKK1/4, запропонована у винаході, має здатність попереджати, лікувати або полегшувати пов'язані з Wnt захворювання, асоційовані з 12 UA 101944 C2 5 10 15 20 25 30 35 40 45 50 55 60 DKK1 або DKK4 або з ними обома, але не хвороби, асоційовані з DKK2, DKK3 або іншими модуляторами Wnt-шляху. У наступних підрозділах різні об'єкти винаходу описані більш докладно. Wnt-шлях являє собою основний регулятор диференціювання мезенхімальних стовбурних клітин (MSC) в остеобласти. Він є важливим чинником виживання для активних остеобластів. Dickkopf-1 (DKK1) являє собою антагоніст Wnt-шляху, що головним чином експресується в кістковій тканині дорослих особин, і його підвищувальна регуляція характерна для пацієнтів, що страждають на мієлому, з остеолітичними ушкодженнями. Нейтралізуючі антитіла до DKK1/4 є справжнім анаболічним агентом, дія якого проявляється в підвищенні остеобластичної активності з одночасним зниженням остеокластичної активності. На відміну від сучасних лікарських засобів, таких як PTH (гормон навколощитоподібних залоз), які надходять у продаж у якості анаболічних агентів, вони дійсно підвищують рівень маркерів, асоційованих як з остеобластами, так і з остеклатстами. У винаході зазапропоновані поліклональні й моноклональні антитіла, відібрані за ознакою зв'язування з DKK1. Афінність зв'язування кращого антитіла з людським DKK1 становить менше 10пМ. У деяких варіантах здійснення винаходу антитіла до DKK1 мають перехресну реактивність із DKK4 (Kd~300пМ), але не з DKK2 (за даними аналізу афінності). Шляхом картирування встановлено, що кращий епітоп антитіла до DKK1 або антитіла до DKK4 локалізований у домені Cys-2 (ак 189-263), що, як відомо, відповідальний за зв'язування й з LRP6 і з Kremen. В одному з варіантів здійснення винаходу епітоп включає щонайменше 6 і максимум 30 амінокислотних залишків з домени Cys-2 поліпептиду DKK1 або DKK4. У конкретному варіанті здійснення винаходу епітоп включає ділянку, що складається щонайменше з 6 суміжних амінокислот. В інших варіантах здійснення винаходу кращий сайт зв'язування є нелінійним, тобто включає несуміжні амінокислотні залишки. У деяких варіантах здійснення винаходу зв'язування залежить від N-глікозилювання. Передвіщеним є тільки один сайт Nглікозилювання на залишку 256 у домені Cys-2. Згідно з даним винаходом нейтралізуюче антитіло до DKK1 блокує взаємодія DKK1 з LRP6, що доведено як за допомогою ELISA, так і за допомогою аналізу зв'язування із клітинною поверхнею. Як і очікувалося, воно ефективно нейтралізує активність DKK1, що характеризується значенням EC50 нижче 1нМ in vitro, яка пригнічує Wnt. У якості моделі in vitro диференціювання остеобластів мишачі клітини лінії 10T1/2 обробляють Wnt3A для стимуляції секреції лужної фосфатази (AP), маркера активності остеобластів. DKK1 блокує виробництво AP при використанні цієї моделі, а антитіла, запропоновані у винаході, повністю анулюють зазначене інгібування. У конкретних варіантах здійснення винаходу антитіло, що пропонується у винаході, має лінійно залежні від дози фармакокінетичні характеристики (AUC) в організмі мишей, при цьому залежне від дози час напівжиття становить для мишей 35-96 год при використанні дози 20-200 мкг/миша. При використанні інтратибіальної (усередині великогомілкової кістки) моделі метастазів остеолітичної пухлини передміхурової залози встановлено, що антитіла, запропоновані у винаході, інгібують ушкодження кортикального шару кістки, що індуціюється пухлиною. При оцінці впливу на трабекулярну кістку при використанні цієї моделі були отримані несподівані результати, що полягають у тому, що й імплантати пухлини, і імплантати-імітатори викликали механічне ушкодження кістки, що приводило до первісного розростання переплетеної кісткової тканини з наступним її ремоделюванням, що приводить до зниження видимого об'єму кістки. У конкретному варіанті здійснення винаходу антитіло, що пропонується у винаході, знижує виробництво переплетеної кісткової тканини в великогомілковій кістці як з імплантами пухлини, так і з імплантами-імітаторами й інгібує зниження об'єму пухлини при ремоделюванні. У споріднених варіантах здійснення винаходу зміни маркерів кісткової тканини (остеокальцин, sRANKL, OPG, AP, TRAP) застосовують для демонстрації клінічних впливів антитіл, запропонованих у винаході, на пов'язані з кістковою тканиною захворювання й для пророкування клінічних результатів лікування з використанням фармацевтично ефективних рівнів нейтралізуючих антитіл до DKK1, запропонованих у винаході. Krm зв'язується з DKK приблизно в тій же області, що й LRP. Krm необхідний для інгібування передачі сигналу Wnt за допомогою взаємодії DKK з LRP. Комплекс Krm-DKK-LRP повинен бути інтерналізований для деактивації Wnt-шляху. Композиція нейтралізуючих антитіл до DKK1/4, запропонована у винаході, краще зв'язується з DKK1 або DKK4, блокуючи їх взаємодію з LRP і/або Krm, нейтралізуючи тим самим вплив DKK1 або DKK4 на шлях передачі сигналу Wnt. Реактивація Wnt-шляху відбувається тільки при обмеженні рівня DKK1 і/або DKK4. 13 UA 101944 C2 5 10 15 20 25 30 35 40 45 50 55 Стандартні аналізи, призначені для оцінки здатності до зв'язування антитіл з DKK1 різних видів, відомі в даній області, і вони включають, наприклад, ELISA, Вестерн-блоттінг і РІА. Прийнятні аналізи описані докладно в прикладах. Кінетичні характеристики зв'язування (наприклад, афінність до зв'язування) антитіл можна також оцінювати стандартними аналізами, відомими в даній області, такими як Biacore-аналіз, BioVeris SET-аналіз, FMAT, аналіз хемілюмінісценції і/або SPR-аналізи, які дозволяють оцінювати інгібування сигналу або аналізувати вивільнення. Аналізи, призначені для оцінки впливу антитіл на функціональні властивості DKK1, більш докладно описані в прикладах. Таким чином, мається на увазі, що здатність антитіла «інгібувати» одну або кілька зазначених функціональних властивостей DKK1 (наприклад, біохімічну, імунохімічну, кліткову, фізіологічну або інший види біологічної активності або т.п.) при оцінці за допомогою методологій, відомих у даній області й представлених у даному описі, відноситься до статистично значимого зниження конкретної активності щодо активності, що має місце у відсутності антитіла (або, наприклад, коли є присутніми контрольні антитіла або антитіло з невідповідною специфічністю). Антитіло, що інгібує активність DKK1, викликає статистично значиме зниження оцінюваного параметра щонайменше на 10 %, щонайменше на 50 %, 80 % або 90 %, і в конкретних варіантах здійснення винаходу антитіло, що пропонується у винаході, може інгібувати більш ніж на 95 %, 98 % або 99 % функціональну активність DKK1. Представники Dickkopf-сімейства Правильний кістковий метаболізм опосередковується складною мережею регуляторних шляхів і взаємозв'язків між остеобластами, остеокластами й навколишньою стромою. Порушення балансу цих регуляторних механізмів обумовлює остеолітичні стани, такі як остеопороз, остеолітичні ушкодження, що індуціюються пухлиною, втрата кісткової тканини, що індуціюються нирковими й печіночними трансплантатами, втрата кісткової тканини, що індуціюються протигормональною хіміотерапією. Ці стани можуть супроводжуватися серйозними симптомами, включаючи кістковий біль, переломи, компресію хребта й зниження рухливості. Більшість дозволених до застосування або що перебувають у цей час на стадії клінічних досліджень шляхів лікування роблять вплив головним чином шляхом інгібування функції остеокластів. Наприклад, біфосфонати, такі як золендронова кислота (Zometa) є в цей час стандартними засобами догляду й лікування, і їх дія полягає в інгібуванні функції й виживання остеокластів. Хоча біфосфонати в цілому є ефективними, у деяких пацієнтів не досягається виражена відповідь або вони припиняють застосування цих лікарських засобів через токсичність для нирок або остеонекрозу (Markowitz, 2003, Ruggiero, 2004). Крім того, відомо велика кількість лікарських препаратів, що проходять клінічне випробування, мішенню яких є розвиток остеокластів, наприклад, таких препаратів, як нейтралізуючі антитіла до RANKL і M-CSF, або функція остеокластів, наприклад, таких препаратів, як інгібітори катепсину K. Стимуляція активності остеокластів являє собою новий механізм лікування остеолітичного захворювання.Wnt-шлях відіграє основну роль у диференціюванні й активності остеобластів, причому антагоністи із сімейства Dickkopf (DKK) ідентифіковані насамперед як ключові регулятори цього процесу in vitro (див. огляд Krishnan, 2006). Wnt є фактором виживання, що має вирішальне значення, й диференційування остеобластів in vitro. Клінічне підтвердження ролі Wnt-шляху можна одержувати шляхом мутацій корецептора Wnt LRP5. Інактивуючі мутації LRP5 приводять до остеопорозного-псевдогліомного синдрому (OPPG) (Ai, 2005), у той час як активуючі мутації, приводять до створення великої кісткової маси (Boyden, 2002). Виявлено, що зазначені активуючі мутації перебувають у позаклітинному домені і, як установлено, порушують зв'язування антагоністів Wnt із представниками сімейства Dickkopf (DKK). Опубліковано дані про надекспресії DKK1 у клітинах мієломи в пацієнтів з ушкодженнями кістки, але вона не виявлена в здорових плазматичних клітинах або плазматичних клітинах пацієнтів, що не страждають ушкодженнями кості (Tian, 2004; Politou, 2006). Зазначена надекспресія DKK1 у клітинах мієломи може порушувати нормальний баланс між остеобластами й остеокластами, блокуючи диференціювання остеобластів і підсилюючи в результаті цього резорбцію кістки. Крім того, установлено, що застосування деяких протипухлинних засобів лікування мієломи, наприклад, застосування дексаметазону, приводить до підвищувальної регуляції DKK1 (Ohnaka, 2004). Таким чином, нейтралізуюче антитіло до DKK1 повинно приводити до реактивації Wnt-шляху при остеолітичних ушкодженнях, не впливаючи на передачу сигналу Wnt в інших тканинах, у яких рівні DKK1 відносно низькі або в яких основну роль грають інші антагоністи. Як установлено, у дорослих особин високий рівень експресії DKK1 відбувається тільки в кістці (Li, 2006), це дозволяє припустити, що DKK1 відіграє основну роль у регуляції метаболізму кісткової тканини в дорослих. 14 UA 101944 C2 5 10 15 У трансгенних мишей, у яких відбувається понадекспресія Wnt1 у тканині молочної залози, розвиваються карциноми молочної залози (Tsukamoto, 1988), а у ~90 % людей, що страждають колоректальними видами раку, виявлена мутація або в APC, або в β-катеніні, двох цитоплазматичних компонентах Wnt-шляху (Morin, 1997; Rowan, 2000). Ці дані дозволяють висунути концепцію про те, що активація Wnt-шляху може приводити до підвищеного ризику виникнення або розвитку пухлин. Крім того, виявлена понижувальна регуляція DKK при колоректальних пухлинах і маланомах, це дозволяє припустити, що вони можуть відігравати роль у подавленні пухлин. До поліпептидів DKK, запропонованим у винаході, відносяться DKK1 (SEQ ID NO:1) і DKK4 (SEQ ID NO:124), а також DKK2 (SEQ ID NO: 122) і DKK3 (SEQ ID NO:123). Представники сімейства DKK несуть два CYS-домени (CYS1 і CYS2), представлені в таблиці A - «Перелік представників сімейства DKK1». Білки DKK містять кислотний N-кінцевий сигнальний пептид, два CYS-домени, що містять кластери залишків цистеїну, розділених дивергентною лінкерною областю, і потенційний C-кінцевий сайт N-глікозилювання. CYS2-домен в DKK4 має ліпідзв’язуючу функцію й може полегшувати взаємодію WNT/DKK на плазматичній мембрані (OMIM, реєс. номер 605417). Таблиця A Перелік представників сімейства DKK1 15 UA 101944 C2 16 UA 101944 C2 5 10 15 20 25 30 35 40 45 50 Антитіла до DKK1 і DKK4 У конкретному варіанті здійснення винаходу антитіла, запропоновані у винаході, мають специфічність відносно людського білка DKK. У більш кращому варіанті здійснення винаходу, антитіло, що пропонується у винаході, являє собою нейтралізуюче антитіло до DKK1 або DKK4, дія якого відрізняється від модифікацій Wnt-шляху, які пов'язані з посиленням розвитку пухлин. Wnt-шлях регулюється складною мережею позаклітинних лігандів, рецепторів і антигоністів, при цьому DKK1 є тільки одним з них. Через обмежену експресію DKK1 в організмі дорослих особин і його більш високої функціональної активності в порівнянні з іншими антагоністами Wnt, мало імовірно, що нейтралізуюче антитіло до DKK1 може приводити до повсюдної активації передачі сигналу Wnt або до онкогенезу. Це припущення додатково підтверджене двома фактами: поперше, активуючі мутації LRP5 (що інгібують зв'язування DKK) індуціюють фенотип підвищеної кісткової маси, але не приводять до помітного підвищення ризику розвитку рака (Moon, 2004), а у мишей, гетерозиготних по аллелю DKK1, що мовчить, або мишей лінії Doubleridge зі зниженими рівнями DKK, виявлено фенотип підвищеної кісткової маси, але відсутні відомості про підвищену швидкість утворення пухлин (MacDonald, 2004). Антитіло до DKK1 позитивно впливає на остеолітичне захворювання, що індуціюється мієломою, не підвищуючи ризик онкогенезу de novo. Варто очікувати, що таке антитіло можна застосовувати в сполученні із протипухлинними хіміотерапевтичними агентами й, очевидно, з лікарськими засобами, що перешкоджають резорбції кістки, які інгібують функцію остеокластів. Поліклональні антитіла Антитіла, запропоновані у винаході, можуть являти собою поліклональні антитіла, насамперед людські поліклональні антитіла. Поліклональні антитіла одержують із об'єднаної сироватки імунізованих тваринних або відібраних людей. Моноклональні антитіла Антитіла, запропоновані у винаході, краще являють собою людські моноклональні антитіла, наприклад, виділені й антитіла, що мають охрактеризовану структуру, які описані зокрема в прикладах 1-8. Конкретні амінокислотні послідовності VH антитіл представлені, наприклад, а SEQ ID NO: 2-20. Конкретні амінокислотні послідовності VL антитіл представлені, наприклад, в SEQ ID NO: 21-39. Амінокислотну послідовність VH антитіла можна оптимізувати з метою експресії в клітині ссавця, така послідовність представлена, наприклад, в SEQ ID NO: 119. Амінокислотну послідовність VL антитіла можна оптимізувати з метою експресії в клітині ссавця, така послідовність представлена, наприклад, в SEQ ID NO: 118. Аналогічно цьому, послідовності можна оптимізувати для експресії, наприклад, у клітинах дріжджів, бактерій, китайського хом'ячка та інших клітинах, залежно від того, яка система експресії є кращою характерної особливості, що підлягає оптимізації. Інші антитіла, запропоновані у винаході, включають мутантанні амінокислоти, але при цьому CDR-ділянки ідентичні щонайменше на 60, 70, 80, 90, 95, 96, 97, 98 або 99 % CDR-ділянкам, представленим у зазначених вище послідовностях. Крім того, батьківські нуклеотидні послідовності повнорозмірного легкого ланцюга представлені в SEQ ID NO: 97-100. Батьківські нуклеотидні послідовності повнорозмірного важкого ланцюга представлені в SEQ ID NO: 101-103. Оптимізовані нуклеотидні послідовності повнорозмірного легкого ланцюга, оптимізовані для експресії в клітині ссавця, представлені в SEQ ID NO: 104-107. Оптимізовані нуклеотидні послідовності повнорозмірного важкого ланцюга, оптимізовані для експресії в клітині ссавця, представлені в SEQ ID NO: 108-110. Амінокислотні послідовності повнорозмірного легкого ланцюга, що кодуються оптимізованами нуклеотидними послідовностями легкого ланцюга, представлені в SEQ ID NO: 111-114. Амінокислотні послідовності повнорозмірного важкого ланцюга, що кодуються оптимізованами нуклеотидними послідовностями важкого ланцюга, представлені в SEQ ID NO: 115-117. Інші антитіла, запропоновані у винаході, включають мутантні амінокислоти або нуклеїнові кислоти, але при цьому їх послідовності ідентичні щонайменше на 60, 70, 80, 90, 95, 96, 97, 98 або 99 % описаним вище послідовностям. 17 UA 101944 C2 5 10 15 20 25 30 35 40 45 50 55 60 Оскільки кожне із цих антитіл може зв'язуватися з DKK1, то послідовності V H, VL, повнорозмірного легкого ланцюга і повнорозмірного важкого ланцюга (нуклеотидні послідовності й амінокислотні послідовності) можуть бути «змішані й сполучені (відповідним чином підібрані одне до одного)» для створення інших єднальних молекул антитіл до DKK1, запропонованих у винаході. Зв'язування DKK1 із зазначеними «змішаними й сполученими» антитілами можна оцінювати за допомогою аналізів зв'язування, які описані вище і у прикладах (наприклад, ELISA). Коли зазначені ланцюги змішують і сполучають, то V H-послідовність із конкретної пари VH/VL можна заміняти структурно подібною VH-послідовністю. Аналогічно цьому послідовність повнорозмірного важкого ланцюга з конкретної пари повнорозмірний легкий ланцюг/повнорозмірний важкий ланцюг можна заміняти структурно подібною послідовністю повнорозмірного важкого ланцюга. Аналогічно цьому VL-послідовність із конкретної пари VH/VL можна заміняти структурно схожою VL-послідовністю. Аналогічно цьому послідовність повнорозмірного легкого ланцюга з конкретної пари повнорозмірний важкий ланцюг/повнорозмірний легкий ланцюг можна заміняти структурно подібною послідовністю повнорозмірного легкого ланцюга. Послідовності VH, VL, повнорозмірного легкого ланцюга й повнорозмірного важкого ланцюга антитіл, запропонованих у даному винаході, найбільш придатні для змішання й сполучення, оскільки в цих антитілах застосовують послідовності V H, VL, повнорозмірного легкого ланцюга й повнорозмірного важкого ланцюга, виведені з тих самих послідовностей зародкової лінії, і тому вони мають структурну подібність. Таким чином, одним з об'єктів винаходу є виділене моноклональне антитіло або його антигензв’язувальна ділянка, що містить: VH-область, амінокислотна послідовність яка обрана із групи, що включає SEQ ID NO: 2-20 і 119; і VL-область, амінокислотна послідовність якої обрана із групи, що включає SEQ ID NO: 21-39 і 118; де антитіло специфічно зв'язується з DKK1. Прикладами комбінацій важкого й легкого ланцюгів є: VH-область, що має амінокислотну послідовність SEQ ID NO: 2, і VL-область, що має амінокислотну послідовність SEQ ID NO: 21; або VH-область, що має SEQ ID NO: 3, і VL-область, що має SEQ ID NO: 22; або VH-область, що має SEQ ID NO: 4, і VL-область, що має SEQ ID NO: 23; або VH-область, що має SEQ ID NO: 5, і V-область, що має SEQ ID NO: 24; або VH-область, що має SEQ ID NO: 6, і VL-область, що має SEQ ID NO: 25; або VH-область, що має SEQ ID NO: 7, і VL-область, що має SEQ ID NO: 28; або VH-область, що має SEQ ID NO: 8, і VL-область, що має SEQ ID NO: 29; або VH-область, що має SEQ ID NO: 9, і VL-область, що має SEQ ID NO: 30; або VH-область, що має SEQ ID NO: 10, і VLобласть, що має SEQ ID NO: 31; або VH-область, що має SEQ ID NO: 11, і VL-область, що має SEQ ID NO: 32; або VH-область, що має SEQ ID NO: 12, і VL-область, що має SEQ ID NO: 33; або VH-область, що має SEQ ID NO: 119, і VL-область, що має SEQ ID NO: 118. Іншим об'єктом винаходу є виділене моноклональне антитіло або його антигензв’язувальна ділянка, що містить: повнорозмірний важкий ланцюг, амінокислотна послідовність якого обрана із групи, що включає SEQ ID NO: 115-117; і повнорозмірний легкий ланцюг, амінокислотна послідовність якого обрана із групи, що включає SEQ ID NO: 111-114. Так, прикладами комбінацій повнорозмірного важкого ланцюга й повнорозмірного легкого ланцюга є відповідно: SEQ ID NO: 115 і SEQ ID NO: 111; або SEQ ID NO: 116 і SEQ ID NO: 112; або SEQ ID NO: 117 і SEQ ID NO: 113; або SEQ ID NO: 117 і SEQ ID NO: 114. Іншим об'єктом винаходу є виділене моноклональне антитіло або його антигензв’язувальна ділянка, що містить: повнорозмірний важкий ланцюг, що кодується нуклеотидною послідовністю, що обрана із групи, що включає SEQ ID NO: 101-103; і повнорозмірний легкий ланцюг, що кодується нуклеотидною послідовністю, що обрана із групи, що включає SEQ ID NO: 97-100. Так, прикладами нуклеотидів, які кодують повнорозмірні важкі й легкі ланцюги відповідно, які можна поєднувати, включають: SEQ ID NO: 101 і 97; або SEQ ID NO: 102 і 98; або SEQ ID NO: 103 і 99; або SEQ ID NO: 103 і 100. Наступним об'єктом винаходу є виділене моноклональне антитіло або його антигензв’язувальна ділянка, оптимізовані для експресії в клітині, які містять: повнорозмірний важкий ланцюг, нуклеотидна послідовність якого обрана із групи, що включає SEQ ID NO: 108110; і повнорозмірний легкий ланцюг, нуклеотидна послідовність якого обрана із групи, що включає SEQ ID NO: 104-107. Наступним об'єктом винаходу є антитіла, які містять CDRl, CDR2 і CDR3 важкого й легкого ланцюга антитіл або їх комбінації. Амінокислотні послідовності CDR1 V H антитіл представлені в SEQ ID NO: 2-5, 8-11, 20 і 49-56. Амінокислотні послідовності CDR2 VH антитіл представлені в SEQ ID NO: 2-20 і 57-64. Амінокислотні послідовності CDR3 VH антитіл представлені в SEQ ID NO: 2-20 і 65-72. Амінокислотні послідовності CDR1 VL антитіл представлені в SEQ ID Ns: 21-39 і 73-80. Амінокислотні послідовності CDR2 VL антитіл представлені в SEQ ID NO: 21-39 і 81-88. Амінокислотні послідовності CDR3 VL антитіл представлені в SEQ ID NO: 21-39 і 89-96. CDR 18 UA 101944 C2 5 10 15 20 25 30 35 40 45 50 55 60 ділянки описують за системою Кебота (Kabat E. A. та ін., Sequences of Proteins of Immunological Interest, 5-те вид., вид-во U.S. Department of Health and Human Services, NIH Publication No. 913242, 1991). З урахуванням того, що кожне із зазначених антитіл може зв'язуватися з DKK1 і що специфічність до зв'язування з антигеном забезпечується насамперед CDR1-, 2- і 3-ділянками, послідовності CDR1, 2 і 3 VH і послідовності CDR1, 2 і 3 VL можна «змішувати й сполучати» (тобто можна змішувати й сполучати CDR з різних антитіл, хоча кожне антитіло повинне містити CDR1, 2 і 3 VH і CDR1, 2 і 3 VL для створення інших спрямованих проти DKK1 єднальних молекул, запропонованих у винаході. Зв'язування DKK1 з такими «змішаними й сполученими антитілами» можна тестувати із використанням аналізів зв'язування, які описані в прикладах (наприклад, ELISA). Коли змішують і сполучають CDR-послідовності VH, то послідовності CDR1, CDR2 і/або CDR3 з конкретної послідовності VH варто заміщати структурно подібної(ними) CDRпослідовністю(ями). Аналогічно цьому, коли CDR-послідовності VL змішують і сполучають, то послідовності CDR1, CDR2 і/або CDR3 з конкретної послідовності VL варто заміщати структурно подібної(ними) CDR-послідовністю(ями). Крім того, послідовності CDR1, CDR2 і/або CDR3 з конкретної послідовності VH або VL можна специфічно або довільно піддавати мутації, створюючи антитіла, афінність або характеристики зв'язування яких можна тестувати. Як повинно бути очевидно звичайному фахівцеві в даній області, нові послідовності V H і VL можна створювати шляхом заміни однієї або декількох послідовностей CDR-ділянки VH і/або VL структурно подібними послідовностями з CDR-послідовностей, описаних для моноклональних антитіл, запропонованих у даному винаході. Виділене моноклональне антитіло або його антигензв’язувальну ділянку містять: CDR1 V Hобласті, що має амінокислотну послідовність, обрану із групи, що включає SEQ ID NO: 2-5; 8-11, 20 і 49-56; CDR2 VH-області, що має амінокислотну послідовність, обрану із групи, що включає SEQ ID NO: 2-20 і 57-64; CDR3 VH-області, що має амінокислотну послідовність, обрану із групи, що включає SEQ ID NO: 2-20 і 65-72; CDR1 VL-області, що має амінокислотну послідовність, обрану із групи, SEQ ID NO: 21-39 і 73-80; CDR2 VL-області, що має амінокислотну послідовність, обрану із групи, SEQ ID NO: 21-39 і 81-88; і CDR3 VL-області, що має амінокислотну послідовність, обрану із групи, SEQ ID NO: 21-39 і 89-96, де антитіло специфічно зв'язується з DKK1. У конкретному варіанті здійснення винаходу антитіло складається з: CDR1 V H-області, що має послідовність, представлену в SEQ ID NO: 2; CDR2 VH-області, що має послідовність, представлену в SEQ ID NO: 6; CDR3 VH-області, що має послідовність, представлену в SEQ ID NO: 7; CDR1 VL-області, що має послідовність, представлену в SEQ ID NO: 21; CDR2 V L-області, що має послідовність, представлену в SEQ ID NO: 22; і CDR3 VL-області, що має послідовність, представлену в SEQ ID NO: 23. В іншому варіанті здійснення винаходу антитіло складається з: CDR1 V H-області, що має послідовність, представлену в SEQ ID NO: 3; CDR2 VH-області, що має послідовність, представлену в SEQ ID NO: 12; CDR3 VH-області, що має послідовність, представлену в SEQ ID NO: 13; CDR1 VL-області, що має послідовність, представлену в SEQ ID NO: 24; CDR2 V Lобласті, що має послідовність, представлену в SEQ ID NO: 25; і CDR3 V L-області, що має послідовність, представлену в SEQ ID NO: 26. У ще одному варіанті здійснення винаходу антитіло складається з: CDR1 V H-області, що має послідовність, представлену в SEQ ID NO: 4; CDR2 VH-області, що має послідовність, представлену в SEQ ID NO: 14; CDR3 VH-області, що має послідовність, представлену в SEQ ID NO: 15; CDR1 VL-області, що має послідовність, представлену в SEQ ID NO: 27; CDR2 V Lобласті, що має послідовність, представлену в SEQ ID NO: 28; і CDR3 V L-області, що має послідовність, представлену в SEQ ID NO: 29. У наступному варіанті здійснення винаходу антитіло складається з: CDR1 V H-області, що має послідовність, представлену в SEQ ID NO: 5; CDR2 VH-області, що має послідовність, представлену в SEQ ID NO: 16; CDR3 VH-області, що має послідовність, представлену в SEQ ID NO: 17; CDR1 VL-області, що має послідовність, представлену в SEQ ID NO: 30; CDR2 V Lобласті, що має послідовність, представлену в SEQ ID NO: 31; і CDR3 V L-області, що має послідовність, представлену в SEQ ID NO: 32. У конкретному варіанті здійснення винаходу антитіло складається з: CDR1 V H-області, що має послідовність, представлену в SEQ ID NO: 8; CDR2 VH-області, що має послідовність, представлену в SEQ ID NO: 18; CDR3 VH-області, що має послідовність, представлену в SEQ ID NO: 19; CDR1 VL-області, що має послідовність, представлену в SEQ ID NO: 33; CDR2 V Lобласті, що має послідовність, представлену в SEQ ID NO: 34; і CDR3 V L-області, що має послідовність, представлену в SEQ ID NO: 35. 19 UA 101944 C2 5 10 15 20 25 30 35 40 45 50 55 60 В іншому варіанті здійснення винаходу антитіло складається з: CDR1 VH-області, що має послідовність, представлену в SEQ ID NO: 9; CDR2 VH-області, що має послідовність, представлену в SEQ ID NO: 10; CDR3 VH-області, що має послідовність, представлену в SEQ ID NO: 11; CDR1 VL-області, що має послідовність, представлену в SEQ ID NO: 36; CDR2 V Lобласті, що має послідовність, представлену в SEQ ID NO: 37; і CDR3 V L-області, що має послідовність, представлену в SEQ ID NO: 38. Згідно даного опису людське антитіло містить варіабельні області важкого (VH) або легкого (VL) ланцюга або повнорозмірний важкий або легкий ланцюги, які «є продуктом» або «виведені з» послідовності конкретної зародкової лінії, якщо варіабельні області або повнорозмірні ланцюги антитіла одержують із системи, заснованої на застосуванні генів імуноглобуліну людської зародкової лінії. Для створення таких систем здійснюють імунізацію трансгенної миші, що несе людські гени імуноглобулінів, з використанням антигену, що представляє інтерес, або здійснюють скринінг бібліотеки людських генів імуноглобулінів, що презентується фагом, з використанням антигену, що представляє інтерес. Людське антитіло, що «є продуктом» або «виведено з» послідовності імуноглобуліну людської зародкової лінії, можна ідентифікувати індивідуально шляхом порівняння амінокислотної послідовності людського антитіла і амінокислотних послідовностей імуноглобулінів людської зародкової лінії й відбору послідовності імуноглобуліну людської зародкової лінії, що є найбільш близькою по послідовності (тобто має найвищий % ідентичності) з послідовністю людського антитіла. Людське антитіло, що «є продуктом» або «виведено з» конкретної послідовності імуноглобуліну людської зародкової лінії, може мати розходження в амінокислотах у порівнянні з послідовністю зародкової лінії, наприклад, у результаті соматичних мутацій, що зустрічаються в природних умовах, або навмисної інтродукції сайтнаправленої мутації. Однак амінокислотна послідовність відібраного людського антитіла, як правило, щонайменше на 90 % ідентична амінокислотної послідовності, що кодується геном імуноглобуліну людської зародкової лінії, і містить амінокислотні залишки, які ідентифікують, що людське антитіло є людським, при порівнянні з амінокислотними послідовностями імуноглобулінів зародкових ліній інших видів (наприклад, послідовності мишачої зародкової лінії). У певних випадках амінокислотна послідовність людського антитіла може бути щонайменше на 60 %, 70 %, 80 %, 90 % або щонайменше на 95 % або навіть щонайменше на 96 %, 97 %, 98 % або 99 % ідентична амінокислотної послідовності, що кодується геном імуноглобуліну зародкової лінії. Як правило, людське антитіло, виведене з конкретної послідовності людської зародкової лінії, повинно мати не більше 10 амінокислотних розходжень у порівнянні з амінокислотною послідовністю, що кодується геном імуноглобуліну людської зародкової лінії. У певних випадках людське антитіло може мати не більше 5 або навіть не більше 4, 3, 2 або 1 амінокислотне розходження в порівнянні з амінокислотною послідовністю, що кодується геном імуноглобуліну зародкової лінії. Гомологічні антитіла Згідно ще одному варіанту здійснення винаходу антитіло, що пропонується у винаході, має амінокислотні послідовності повнорозмірного важкого й легкого ланцюга, нуклеотидні послідовності повнорозмірного важкого й легкого ланцюга або варіабельні області важкого і легкого ланцюга, амінокислотні послідовності яких гомологічні амінокислотним послідовностям представлених у даному описі антитіл, і при цьому антитіла зберігають необхідні функціональні властивості композиції нейтралізуючих антитіл до DKK1/4, запропонованої у винаході. Наприклад, у винаході зазапропоновані виділене моноклональне антитіло або його антигензв’язувальна ділянка, які містять VH-область і VL-область, де: VH-область містить амінокислотну послідовність, що щонайменше на 80 % гомологічна амінокислотній послідовності, обраній із групи, що включає SEQ ID NO: 2-20 і 119; VL-область містить амінокислотну послідовність, що щонайменше на 80 % гомологічна амінокислотній послідовності, обраній із групи, що включає SEQ ID NO: 21-39 і 118; антитіло специфічно зв'язується з DKK1 і/або DKK4, і антитіло має щонайменше одну з наступних функціональних властивостей: антитіло нейтралізує зв'язування білка DKK1 з LRP6, Fz і/або Krm, або антитіло нейтралізує зв'язування білка DKK4 з LRP, Pz і/або Krm. Іншим прикладом винаходу є виділене моноклональне антитіло або його антигензв’язувальна ділянка, які містять повнорозмірний важкий ланцюг і повнорозмірний легкий ланцюг, де: повнорозмірний важкий ланцюг містить амінокислотну послідовність, що щонайменше на 80 % гомологічна амінокислотній послідовності, обраній із групи, що включає SEQ ID NO: 115-117; повнорозмірний легкий ланцюг містить амінокислотну послідовність, що щонайменше на 80 % гомологічна амінокислотній послідовності, обраній із групи, що включає SEQ ID NO: 111-114; антитіло специфічно зв'язується з DKK1 і антитіло має щонайменше одну з наступних функціональних властивостей: антитіло інгібує зв'язування білка DKK1 з рецептором 20 UA 101944 C2 5 10 15 20 25 30 35 40 45 50 55 60 DKK1 або антитіло інгібує зв'язування рецептора DKK1, попереджаючи або зменшуючи інтенсивність симптомів полегшуючи інтенсивність симптомів остеолізу, або антитіло інгібує зв'язування рецептора DKK1, попереджаючи або полегшуючи інтенсивність симптомів остеолітичних ушкоджень, або антитіло інгібує зв'язування рецептора DKK1, попереджаючи або полегшуючи інтенсивність симптомів рака. Іншим прикладом винаходу є виділене моноклональне антитіло або його антигензв’язувальна ділянка, які містять повнорозмірний важкий ланцюг і повнорозмірний легкий ланцюг, де: повнорозмірний важкий ланцюг містить нуклеотидну послідовність, що щонайменше на 80 % гомологічна нуклеотидній послідовності, обраній із групи, що включає SEQ ID NO: 101-103; повнорозмірний легкий ланцюг містить нуклеотидну послідовність, що щонайменше на 80 % гомологічна нуклеотидній послідовності, обраній із групи, що включає SEQ ID NO: 97-100; антитіло специфічно зв'язується з DKK1 і антитіло має щонайменше одну з наступних функціональних властивостей: антитіло інгібує зв'язування білка DKK1 з рецептором DKK1 або антитіло інгібує зв'язування рецептора DKK1, попереджаючи або полегшуючи інтенсивність симптомів остеолізу, або антитіло інгібує зв'язування рецептора DKK1, попереджаючи або полегшуючи інтенсивність симптомів остеолітичних ушкоджень, або антитіло інгібує зв'язування рецептора DKK1, попереджаючи або полегшуючи інтенсивність симптомів рака. Іншим прикладом винаходу є виділене моноклональне антитіло або його антигензв’язувальна ділянка, оптимізовані для експресії в клітині, які містять повнорозмірний важкий ланцюг і повнорозмірний легкий ланцюг, де: повнорозмірний важкий ланцюг містить нуклеотидну послідовність, що щонайменше на 80 % гомологічна нуклеотидній послідовності, обраній із групи, що включає SEQ ID NO: 108-110; повнорозмірний легкий ланцюг містить нуклеотидну послідовність, що щонайменше на 80 % гомологічна нуклеотидній послідовності, обраній із групи, що включає SEQ ID NO: 104-107; антитіло специфічно зв'язується з DKK1 і антитіло має щонайменше одну з наступних функціональних властивостей: антитіло інгібує зв'язування білка DKK1 з рецептором DKK1 або антитіло інгібує зв'язування рецептора DKK1, попереджаючи або полегшуючи інтенсивність симптомів остеолізу, або антитіло інгібує зв'язування рецептора DKK1, попереджаючи або полегшуючи інтенсивність симптомів остеолітичних ушкоджень, або антитіло інгібує зв'язування рецептора DKK1, попереджаючи або полегшуючи інтенсивність симптомів рака. Наступним прикладом винаходу є виділене моноклональне антитіло або його антигензв’язувальна ділянка, оптимізовані для експресії в клітині, які містять VH-область і VLобласть, де: повнорозмірний важкий ланцюг містить нуклеотидну послідовність, що щонайменше на 80 % гомологічна нуклеотидній послідовності SEQ ID NO: 121; повнорозмірний легкий ланцюг містить нуклеотидну послідовність, що щонайменше на 80 % гомологічна нуклеотидній послідовності SEQ ID NO: 120; антитіло специфічно зв'язується з DKK1, і антитіло має щонайменше одну з наступних функціональних властивостей: антитіло інгібує зв'язування білка DKK1 з рецептором DKK1 або антитіло інгібує зв'язування рецептора DKK1, попереджаючи або полегшуючи інтенсивність симптомів остеолізу, або антитіло інгібує зв'язування рецептора DKK1, попереджаючи або полегшуючи інтенсивність симптомів остеолітичних ушкоджень, або антитіло інгібує зв'язування рецептора DKK1, попереджаючи або полегшуючи інтенсивність симптомів рака. У різних варіантах здійснення винаходу антитіло може мати одну або декілька, дві або більше або три з описаних вище функціональних властивостей. Антитіло може являти собою, наприклад, людське антитіло, гуманізоване антитіло або химерне антитіло. Згідно даного опису відсоток гомології двох амінокислотних послідовностей еквівалентний відсотку ідентичності двох послідовностей. Відсоток ідентичності двох послідовностей є функцією кількості ідентичних положень у послідовностях (тобто % гомології = кількість ідентичних положень/загальна кількість положень × 100), беручи до уваги кількість проломів і довжину кожного пролому, яку необхідно інтродуціювати для оптимального порівняльного аналізу первинної структури двох послідовностей. Порівняння послідовностей і визначення відсотка ідентичності двох послідовностей можна здійснювати за допомогою математичного алгоритму, описаного нижче в прикладах, які не обмежують об'єм винаходу. Відсоток ідентичності двох амінокислотних послідовностей можна визначати за допомогою алгоритму E. Meyers і W. Miller (Comput. Appl. Biosci., 4, 988, сс. 11-17), що включений у програму ALIGN (версія 2.0), з використанням таблиці зважених залишків PAM120, штрафу за довжину пролому 12 і штрафу за пролом 4. Крім того, відсоток ідентичності двох амінокислотних послідовностей можна визначати за допомогою алгоритму Needleman і Wunsch (J. Mol, Biol. 48, 1970, сс. 444-453), що включений у програму GAP, що входить у пакет програм GCG (яка 21 UA 101944 C2 5 10 15 20 25 30 35 40 45 50 55 60 доступна на сайті http://www.gcg.com), з використанням матриці Blossom 62 або матриці PAM250 і ваги пролому 16, 14, 12, 10, 8, 6 або 4 і ваги довжини 1, 2, 3, 4, 5 або 6. В іншому або додатковому варіанті білкові послідовності, запропоновані в даному винаході, можна застосовувати також у якості «запитуваної послідовності» при здійсненні пошуку в суспільних базах даних, наприклад, відносно ідентичності зі спорідненими послідовностями. Такий пошук можна здійснювати з використанням програми XBLAST (версія 2.0), розробленої Altschul та ін., J.Mol. Biol. 215, 1990, сс. 403-410. BLAST-пошук білків можна здійснювати за допомогою програми XBLAST, у якій бал = 50, довжина слова = 3, для встановлення рівня гомології амінокислотних послідовностей з амінокислотними послідовностями молекул антитіл, запропонованих у винаході. Для створення лінеарізованих послідовностей, що містять пролом, для цілей порівняння можна використовувати програму Gapped BLAST, описану в Altschul та ін., Nucleic Acids Res. 25(17), 1997, сс. 3389-3402. При застосуванні програм BLAST і Gapped BLAST можна використовувати прийняті за замовчуванням параметри, які застосовуються у відповідних програмах (наприклад, XBLAST і NBLAST) (див. http:Ilwww.ncbi.nhn.nih.gov). Антитіла з консервативними модифікаціями У конкретних варіантах здійснення антитіло, що пропонується у винаході, має V H-область, що містить послідовності CDR1, CDR2 і CDR3, і VL-область, що містить послідовності CDR1, CDR2 і CDR3, де одна або декілька зазначених послідовностей CDR являє собою специфічні амінокислотні послідовності, характерні для антитіл, запропонованих у даному винаході, або їх консервативні модифікації, і де антитіла зберігають необхідні функціональні властивості композиції нейтралізуючих антитіл до DKK1/4, запропонованої у винаході. Таким чином, у винаході зазапропоновані виділене моноклональне антитіло або його антигензв’язувальна ділянка, що складається з VH-області, що містить послідовності CDR1, CDR2 і CDR3, і VLобласті, що містить послідовності CDR1, CDR2 і CDR3, де: CDR1 VH-області має послідовності, що містять амінокислотні послідовності, які обрані із групи, що включає амінокислотні послідовності SEQ ID NO: 2-5, 8-11, 20, 49-56 і їх консервативні модифікації; CDR2 VH-області має послідовності, що містять амінокислотні послідовності, які обрані із групи, що включає амінокислотні послідовності SEQ ID NO: 2-20, 57-64 і їх консервативні модифікації; CDR3 VHобласті має послідовності, що містять амінокислотні послідовності, які обрані із групи, що включає амінокислотні послідовності SEQ ID NO: 2-20, 65-72 і їх консервативні модифікації; CDR1 VL-області має послідовності, що містять амінокислотні послідовності, які обрані із групи, що включає амінокислотні послідовності SEQ ID NO: 21-39, 73-80 і їх консервативні модифікації; CDR2 VL-області має послідовності, що містять амінокислотні послідовності, які обрані із групи, що включає амінокислотні послідовності SEQ ID NO: 21-39, 81-88 і їх консервативні модифікації; CDR3 VL-області має послідовності, що містять амінокислотні послідовності, які обрані із групи, що включає амінокислотні послідовності SEQ ID NO: 21-39, 89-96 і їх консервативні модифікації; антитіло специфічно зв'язується з DKK1; і антитіло має щонайменше одну з наступних функціональних властивостей: антитіло інгібує зв'язування білка DKK1 з рецептором DKK1 або антитіло інгібує зв'язування рецептора DKK1, попереджаючи або полегшуючи інтенсивність симптомів остеолізу, або антитіло інгібує зв'язування рецептора DKK1, попереджаючи або полегшуючи інтенсивність симптомів остеолітичних ушкоджень, або антитіло інгібує зв'язування рецептора DKK1, попереджаючи або полегшуючи інтенсивність симптомів рака. У різних варіантах здійснення винаходу антитіло може мати одну або декілька, дві або більше або три або більше з описаних вище функціональних властивостей. Антитіла можуть являти собою, наприклад, людські антитіла, гуманізовані антитіла або химерні антитіла. В інших варіантах здійснення винаходу антитіло, що пропонується у винаході, має послідовність повнорозмірного важкого ланцюга і послідовність повнорозмірного легкого ланцюга, де одна або декілька із зазначених послідовностей має специфічні амінокислотні послідовності, характерні для представлених у даному описі антитіл або їх консервативні модифікації, і де антитіла зберігають необхідні функціональні властивості композиції нейтралізуючих антитіл до DKK1/4, запропонованої у винаході. Таким чином, у винаході зазапропоновані виділене моноклональне антитіло або його антигензв’язувальна ділянка, що складається з повнорозмірного важкого ланцюга і повнорозмірного легкого ланцюга, де: повнорозмірний важкий ланцюг має амінокислотні послідовності, обрані із групи, що включає SEQ ID NO: 115-117 і їх консервативні модифікації; і повнорозмірний легкий ланцюг має амінокислотні послідовності, обрані із групи, що включає SEQ ID NO: 111-114 і їх консервативні модифікації; антитіло специфічно зв'язується з DKK1; і антитіло має щонайменше одну з наступних функціональних властивостей: антитіло інгібує зв'язування білка DKK1 з рецептором DKK1 або антитіло інгібує зв'язування рецептора DKK1, попереджаючи або полегшуючи інтенсивність симптомів остеолізу, або антитіло інгібує зв'язування рецептора DKK1, 22 UA 101944 C2 5 10 15 20 25 30 35 40 45 50 55 60 попереджаючи або полегшуючи інтенсивність симптомів остеолітичних ушкоджень, або антитіло інгібує зв'язування рецептора DKK1, попереджаючи або полегшуючи інтенсивність симптомів рака. У різних варіантах здійснення винаходу антитіло може мати одну або декілька, дві або більше або три або більше з описаних вище функціональних властивостей. Антитіла можуть являти собою, наприклад, людські антитіла, гуманізовані антитіла або химерні антитіла. В інших варіантах здійснення винаходу антитіло, що пропонується у винаході, оптимізовані для експресії в клітині, має послідовність VH-області і послідовність VL-області, де одна або декілька із зазначених послідовностей мають специфічні амінокислотні послідовності, характерні для представлених у даному описі антитіл, або їх консервативні модифікації, і де антитіла зберігають необхідні функціональні властивості композиції нейтралізуючих антитіл до DKK1/4, запропонованої у винаході. Таким чином, у винаході запропоновані виділене моноклональне антитіло або його антигензв’язувальна ділянка, що складається з V H-області й VL-області, де: VH-область має амінокислотну послідовність SEQ ID NO: 119 і її консервативні модифікації; і VL-область має амінокислотну послідовність SEQ ID NO: 118 і її консервативні модифікації; антитіло специфічно зв'язується з DKK1; і антитіло має щонайменше одну з наступних функціональних властивостей: антитіло інгібує зв'язування білка DKK1 з рецептором DKK1 або антитіло інгібує зв'язування рецептора DKK1, попереджаючи або полегшуючи інтенсивність симптомів остеолізу, або антитіло інгібує зв'язування рецептора DKK1, попереджаючи або полегшуючи інтенсивність симптомів остеолітичних ушкоджень, або антитіло інгібує зв'язування рецептора DKK1, попереджаючи або полегшуючи інтенсивність симптомів рака. У різних варіантах здійснення винаходу антитіло може мати одну або декілька, дві або більше або три або більше з описаних вище функціональних властивостей. Антитіла можуть являти собою, наприклад, людські антитіла, гуманізовані антитіла або химерні антитіла. У контексті даного опису поняття «консервативні модифікації послідовностей» відноситься до амінокислотних модифікацій, які не чинять істотного впливу або не істотно змінюють характеристики зв'язування антитіла, що містить зазначену амінокислотну послідовність. Зазначені консервативні модифікації включають амінокислотні заміни, додавання або делециї. Модифікації можна інтродуціювати в антитіло, що пропонується у винаході, за допомогою стандартних методів, відомих у даній області, таких як сайтнаправлений мутагенез і ПЦРопосередковуваний мутагенез. Консервативні амінокислотні заміни являють собою заміни, при яких амінокислотний залишок заміщають амінокислотним залишком, що має подібний бічний ланцюг. Сімейства амінокислотних залишків з подібними бічними ланцюгами відомі в даній області. Ці сімейства включають амінокислотні залишки з основними бічними ланцюгами (наприклад, лізин, аргінін, гістидин), кислотними бічними ланцюгами (наприклад, аспарагінова кислота, глутамінова кислота), незарядженими полярними бічними ланцюгами (наприклад, гліцин, аспарагін, глутамін, серин, треонін, тірозин, цистеїн, триптофан), неполярними бічними ланцюгами (наприклад, аланін, валін, лейцин, ізолейцин, пролін, фенілаланін, метіонін), бетарозгалуженими бічними ланцюгами (наприклад, треонін, валін, ізолейцин) і ароматичними бічними ланцюгами (наприклад, тірозин, фенілаланін, триптофан, гістидин). Таким чином, один або кілька амінокислотних залишків в CDR-ділянках антитіла можна заміняти на інші амінокислотні залишки з того самого сімейства бічних ланцюгів, і змінене антитіло можна оцінювати відносно збереження їм функції за допомогою представлених у даному описі функціональних аналізів. Антитіла, які зв'язуються з тим же епітопом, що й композиція нейтралізуючих антитіл до DKK1/4, запропонована у винаході Іншим варіантом здійснення винаходу є антитіла, які зв'язуються з тим же епітопом, що й композиція різних нейтралізуючих антитіл до DKK1/4, запропонована у винаході. Такі додаткові антитіла можна ідентифікувати по їх здатності до перехресної конкуренції (наприклад, здатності до статистично значимого конкурентного інгібування зв'язування) з іншими антитілами, запропонованими у винаході, при оцінці за допомогою стандартних аналізів зв'язування DKK1. Здатність антитіла, що тестується, інгібувати зв'язування антитіл, запропонованих у даному винаході, з людським DKK1 демонструє, що антитіло, що тестується, може конкурувати з антитілом за зв'язування з людським DKK1; відповідно до однієї з можливих теорій таке антитіло може зв'язуватися з тим же або спорідненим (наприклад, структурно подібним або перебуває в просторовій близькості) епітопом на людському DKK1, що й антитіло, з яким воно конкурує. У конкретному варіанті здійснення винаходу антитіло, що зв'язується з тим же епітопом на людському DKK1, що й антитіла, запропоновані в даному винаході, являє собою 23 UA 101944 C2 5 10 15 20 25 30 35 40 45 50 55 60 людське моноклональне антитіло. Зазначені людські моноклональні антитіла можна одержувати й виділяти згідно описаним у прикладах методам. Верблюжі й інші антитіла, що складаються з важких ланцюгів Білки антитіл, отримані із представників сімейства двогорбих і одногорбих верблюдів (Camelus bactrianus і Calelus dromaderius), включаючи представників тварин Нового Світу таких як різні види лам (Lama paccos, Lama glama і Lama vicugna), охарактеризовані відносно їх розміру, структурної комплексності й антигенності відносно людини. Установлено, що деякі антитіла типу IgG із цього сімейства ссавців у природних умовах позбавлені легких ланцюгів і тому відрізняються за структурою від типової четвертинної структури, що складається із чотирьох ланцюгів, із двома важкими й двома легкими ланцюгами, характерної для антитіл з організму інших тварин (див. PCT/EP93/02214 (WO 94/04678, опублікована 3 березня 1994 р.)). Ділянка верблюжого антитіла, що представляє собою невелику індивідуальну варіабельну область, позначену як VHH, можна створювати за допомогою генної інженерії з одержанням невеликого білка, що має високу афінність до мішені, що приводить до утворення низькомолекулярного виведеного з антитіла білка, позначеного як «верблюже нанотіло» (див. US 5759808, виданий 2 червня 1998 р.; див. також Stijlemans B. та ін., J Biol Chem 279, 2004, сс. 1256-1261; Dumoulin M. та ін., Nature 424, 2003, сс. 783-788; Pleschberger M. та ін. Bioconjugate Chem 14, 2003, сс. 440-448; Cortez-Retamozo V. та ін., Int J Cancer 89, 2002, сс. 456-462; і Lauwereys M. та ін., EMBO J 17, 1998, сс. 3512-3520). Створені бібліотеки верблюжих антитіл і фрагментів антитіл доступні на комерційній основі, наприклад, від фірми Ablynx, Гент, Бельгія. Аналогічно іншим антитілам, отриманим з видів крім людини, амінокислотну послідовність верблюжого антитіла можна змінювати рекомбінантно з одержанням послідовності, що більшою мірою нагадує людську послідовність, тобто нанотіло можна «гуманізувати». Таким чином, природну низьку антигенність верблюжих антитіл для людей можна додатково знижувати. Верблюже нанотіло має молекулярну масу, тридцятилітній приблизно 1/10 від молекулярної маси людського IgG, а фізичний діаметр білка становить лише кілька нанометрів. Однією з пов'язаних з малим розміром особливостей є здатність верблюжих антитіл зв'язуватися з антигенними сайтами, які є функціонально непомітними для більших білкових антитіл, тобто верблюжі нанотіла можна застосовувати у якості реагентів, що виявляють антигени, які залишаються схованими при використанні класичних імунологічних методів, і можливо у якості терапевтичних агентів. Таким чином, іншою пов'язаною з малим розміром особливістю верблюжого нанотіла, є здатність інгібувати зв'язування зі специфічним сайтом у борозенці або вузькій ущелині білка-мішені, і тому їх можна застосовувати у якості субстанції, що більше нагадує за своєю функцією класичний низькомолекулярний лікарський засіб, ніж класичне антитіло. Невелика молекулярна маса й компактний розмір обумовлює також дуже високу термостабільність, стабільність при екстремальних значеннях рН і стабільність до протеолітичного розщеплення і низьку антигенність верблюжих нанотіл. Ще одним наслідком зазначених особливостей є те, що верблюжі нанотіла легко проникають із кровоносної системи в тканини і навіть проникають через гематоенцефалічний бар'єр і їх можна застосовувати для лікування захворювань, що вражають нервову тканину. Нанотитіла можуть полегшувати також транспорт лікарських засобів через гематоенцефалічний бар'єр (див. заявку на патент США 20040161738, опубліковану 19 серпня 2004 г). Ці особливості в сполученні з низкою антигенністю у відношенні людей свідчать про їх великий терапевтичний потенціал. Крім того, ці молекули можна повністю експресувати у прокаріотичних клітинах, таких як E. сoli, і експресувати у вигляді злитих білків з бактеріофагом, і вони є функціонально активними. Таким чином, відмінною ознакою даного винаходу є верблюже антитіло або нанотіло, що має афінність до DKK1. У конкретних варіантах здійснення винаходу верблюже антитіло або нанотіло одержують у природних умовах у тварині із сімейства верблюжих, тобто воно продукується в організмі представника верблюжих після імунізації DKK1 або його пептидним фрагментом при застосуванні методів, описаних для інших антитіл. В іншому варіанті нейтралізуюче верблюже антитіло до DKK1/4 конструюють, тобто одержують шляхом відбору, наприклад, з фагових дисплейних бібліотек відповідним чином мутованих білком верблюжих нанотіл за допомогою методу пенінгу з використанням у якості мішені DKK1 і/або DKK4, як описано у наведених в даному описі прикладах. Сконструйовані нанотіла можна додатково вдосконалити за допомогою генної інженерії таким чином, щоб час із напівжиття в реципієнті становив від 45 хв до 2 тижнів. Крім верблюжих антитіл, антитіла, що складаються з важких ланцюгів, зустрічаються в природних умовах в інших тварин, включаючи (але не обмежуючись тільки ними), наприклад, певні види акул і риб-собак (см., наприклад, публікацію PCT WO 03/014161). Хоча варіабельні 24 UA 101944 C2 5 10 15 20 25 30 35 40 45 50 55 60 області, виведені з таких антитіл, що складаються з важких ланцюгів, можна застосовувати відповідно до винаходу, для застосування відповідно до винаходу і/або для клінічного застосування на людях краще здійснюють оптимізацію, гуманізацію, гуманування і т.п. антитіл, виведених із представників верблюжих, які складаються з важких ланцюгів, і/або послідовностей їх варіабельних областей Сконструйовані й модифіковані антитіла Антитіло, що пропонується у винаході, можна одержувати з використанням антитіла, що має одну або декілька зазначених у даному описі послідовностей VH і/або VL, у якості вихідного матеріалу для створення модифікованого антитіла, де модифіковане антитіло може мати змінені властивості в порівнянні з вихідним антитілом. Антитіло можна створювати шляхом модифікації одного або декількох залишків в одній або обох варіабельних областях (тобто VH і/або VL), наприклад, в одній або декількох CDR-ділянках і/або в одній або декількох каркасних ділянках. У додатковому або альтернативному варіанті антитіло можна створювати шляхом модифікації залишків у константній(их) області(ях), наприклад, для зміни ефекторної(их) функції(ій) антитіла. Для здійснення одного з типів конструювання варіабельної області можна застосовувати трансплатацію CDR. Антитіла взаємодіють із антигенами-мішенями в основному за допомогою амінокислотних залишків, локалізованих у шести гіперваріабельних ділянках (CDR) важкого й легкого ланцюга. Із цієї причини між амінокислотними залишками в CDR індивідуальних антитіл є більш істотні розходження, ніж між послідовностями, локалізованими поза CDR. Оскільки послідовності CDR відповідальні за більшу частину взаємодій антитіло-антиген, можна експресувати рекомбінантні антитіла, які імітують властивості конкретних антитіл, що зустрічаються в природних умовах, шляхом конструювання експресіоних векторів, які містять послідовності CDR з конкретного антитіла, що зустрічається в природних умовах, отримані шляхом трансплантації в послідовності каркасних ділянок з інших антитіл з іншими властивостями (див., наприклад Riechmann L. та ін., Nature 332, 1998, сс. 323-327; Jones P. та ін., Nature, 321, 1986, сс. 522-525; Queen C. та ін., Proc. Natl. Acad. See. U.S.A. 86, 1989, сс. 10029-10033; US 5225539 на ім'я Winter і US 5530101; 5585089; 5693762 і 6180370 на ім'я Queen зі співавторами). Таким чином, наступним об'єктом винаходу є виділене моноклональне антитіло або його антигензв’язувальна ділянка, які містять послідовності CDR1 варіабельної області важкого ланцюга, які містять амінокислотні послідовності, обрані із групи, що включає SEQ ID NO: 2-5, 811, 20, 49-56; послідовність CDR2, які містять амінокислотні послідовності, обрані із групи, що включає SEQ ID NO: 2-20 і 57-64; послідовності CDR3, які містять амінокислотні послідовності, обрані з групи, що включає SEQ ID NO: 2-20 і 65-72 відповідно; і послідовності CDR1 варіабельної області легкого ланцюга, які містять амінокислотні послідовності, обрані із групи, що включає SEQ ID NO: 21-39 і 73-80; послідовність CDR2, які містять амінокислотні послідовності, обрані із групи, що включає SEQ ID NO: 21-39 і 81-88; і послідовності CDR3, які містять амінокислотні послідовності, обрані із групи, що включає SEQ ID NO: 21-39 і 89-96 відповідно. Таким чином, зазначені антитіла містять послідовності CDR V H і VL моноклональних антитіл, крім того, вони можуть містити різні послідовності каркасних ділянок зазначених антитіл. Зазначені послідовності каркасних ділянок, які містять послідовності генів антитіл зародкової лінії можна одержувати з публічних баз даних ДНК або опублікованих посилань. Наприклад, послідовності ДНК людської зародкової лінії генів варіабельних областей важких і легких ланцюгів можна знайти в базі даних послідовностей людської зародкової лінії «Vbase» (доступної в Інтернеті на сайті www.mrc-cpe.cam.ac.uk/vbase), а також в Kabat E. A. та ін., Sequences of Proteins of Immunological Interest, 15-те вид., вид-во U.S. Department of Health and Human Services, NIH Publication No. 91-3242, 1991; Tomlinson I. M. та ін., J. fol. Biol. 227, 1992, сс. 776-798; і Cox J. P. L. та ін., Eur. J Immunol. 24, 1994, сс. 827-836; зміст кожної з яких спеціально включене в даний опис у якості посилання. Прикладом послідовностей каркасних ділянок, призначених для застосування в антитілах, запропонованих у винаході, є послідовності, структурно подібні до послідовностей каркасних ділянок, які входять у відібрані антитіла, запропоновані у винаході, наприклад, консенсусні послідовності і/або послідовності каркасних ділянок, які входять у моноклональні антитіла, запропоновані у винаході. Послідовності CDR1, 2 і 3 VH і послідовності CDR1, 2 і 3 VL можна трансплантувати у каркасні ділянки, які мають послідовність, ідентичну з послідовністю гена імуноглобуліну зародків лінії, з якого виведена послідовність каркасної ділянки, або послідовності CDR можна трансплантувати у каркасні ділянки, які містять одну або кілька мутацій у порівнянні з послідовностями зародкової лінії. Наприклад, було встановлено, що в 25 UA 101944 C2 5 10 15 20 25 30 35 40 45 50 55 певних випадках доцільно змінювати за допомогою мутації залишки в каркасних ділянках для підтримки або підвищення здатності антитіла зв'язуватися з антигеном (див., наприклад, US 5530101; 5585089; 5693762 і 6180370 на ім'я Queen зі співавторами). Іншим типом модифікації варіабельної області є мутація амінокислотних залишків в CDR1, CDR2 і/або CDR3 VH- і/або VL-областей, що підвищує тим самим одну або кілька здатностей до зв'язування (наприклад, афінність) антитіла, що представляє інтерес, що називають «дозріванням афінності». Для інтродукції мутації(й) і впливу на зв'язування антитіла або на іншу функціональну властивість, що представляє інтерес, можна застосовувати сайтнаправлений мутагенез або ПЦР-опосередковуваний мутагенез, що можна оцінювати за допомогою аналізів in vitro або in vivo, описаних нижче в прикладах. Можна інтродуціювати консервативні модифікації (зазначені вище). Мутації можуть являти собою амінокислотні заміни, додавання або делеції. Крім того, як правило, змінюють не більше 1, 2, 3, 4 або 5 залишків в CDR-ділянці. Таким чином, іншим варіантом здійснення винаходу є композиція виділених нейтралізуючих антитіл до DKK1/4 або їх антигензв’язувальних ділянок, які складаються з V H-області, що містить: CDR1 VH-області, що складається з амінокислотної послідовності, обраною із групи, що включає SEQ ID NO: 2-5, 8-11, 20, 49-56 або амінокислотної послідовності з 1, 2, 3, 4 або 5 амінокислотними замінами, делеціями або додаваннями в порівнянні з SEQ ID NO: 2-5, 8-11, 20, 49-56; CDR2 VH-області, що складається з амінокислотної послідовності, обраної із групи, що включає SEQ ID NO: 2-20 і 57-64, або амінокислотної послідовності з 1, 2, 3, 4 або 5 амінокислотними замінами, делеціями або додаваннями в порівнянні з SEQ ID NO: 2-20 і 57-64; CDR3 VH-області, що складається з амінокислотної послідовності, обраної із групи, що включає SEQ ID NO: 2-20 і 65-72, або амінокислотної послідовності з 1, 2, 3, 4 або 5 амінокислотними замінами, делеціями або додаваннями в порівнянні з SEQ ID NO: 2-20 і 65-72; CDR1 VL-області, що складається з амінокислотної послідовності, обраної із групи, що включає SEQ ID NO: 21-39 і 73-80, або амінокислотної послідовності з 1, 2, 3, 4 або 5 амінокислотними замінами, делеціями або додаваннями в порівнянні з SEQ ID NO: 21-39 і 73-80; CDR2 VL-області , що складається з амінокислотної послідовності, обраної із групи, що включає SEQ ID NO: 21-39 і 81-88, або амінокислотної послідовності з 1, 2, 3, 4 або 5 амінокислотними замінами, делеціями або додаваннями в порівнянні з SEQ ID NO: 21-39 і 81-88; CDR3 VL-області, що складається з амінокислотної послідовності, обраної із групи, що включає SEQ ID NO: 21-39 і 89-96, або амінокислотної послідовності з 1, 2, 3, 4 або 5 амінокислотними замінами, делеціями або додаваннями в порівнянні з SEQ ID NO: 21-39 і 89-96. До створених антитіл, запропонованих у винаході, відносяться також антитіла, у яких зроблені модифікації в залишках каркасних ділянок в VH і/або VL, наприклад, з метою поліпшення властивостей антитіла. Як правило, такі модифікації каркасних ділянок здійснюють для зниження імуногенності антитіла. Наприклад, один з підходів являє собою «зворотнє мутування» одного або декількох залишків каркасної ділянки з одержанням відповідної послідовності зародкової лінії. Більш конкретно, антитіло, що було піддано соматичної мутації, може містити залишки каркасної ділянки, що відрізняються від послідовності зародкової лінії, з якої виведене антитіло. Такі залишки можна ідентифікувати шляхом порівняння послідовностей каркасних ділянок антитіла з послідовностями зародкової лінії, з якої виведене антитіло. Для повернення послідовностей каркасної ділянки до вихідної конфігурації зародків лінії соматичні мутації можна піддавати «зворотному мутуванню» з одержанням послідовності зародкової лінії, наприклад, за допомогою сайтнаправленого мутагенезу або ПЦР-опосередковуваного мутагенезу. Такі антитіла зі «зворотними мутаціями» підпадають також під об'єм даного винаходу. Інший тип модифікації каркасної ділянки включає зміна шляхом мутації одного або декількох залишків у каркасній ділянці або навіть в одній або декількох CDR-ділянках для видалення Tклітинних епітопів з метою зниження потенційної імуногенності антитіла. Цей підхід позначають також як «деімунізація», і він описаний більш докладно в опублікованому US 20030153043 на ім'я Carr зі співавторами. У додатковому або альтернативному варіанті крім модифікацій у каркасних ділянках або CDR, антитіла, запропоновані у винаході, можуть включати модифікації в Fc-фрагменті, як правило, для зміни однієї або декількох функціональних властивостей антитіла, таких як час напівжиття в сироватці, фіксація комплементу, зв'язування Fc-рецептора і/або антитілообумовлена клітиннозалежна цитотоксичність. Крім того, антитіло, що пропонується у винаході, можна модифікувати хімічно (наприклад, до антитіла можна приєднувати один або кілька хімічних фрагментів) або можна модифікувати для зміни його глікозилювання, і в цьому випадку з метою зміни однієї або декількох функціональних властивостей антитіла. Кожний із 26 UA 101944 C2 5 10 15 20 25 30 35 40 45 50 55 60 зазначених варіантів здійснення винаходу буде додатково описаний нижче. Нумерація залишків в Fc-фрагменті відповідає EU-індексу або нумерації Кебота. В одному з варіантів здійснення винаходу модифікують шарнірну область CH1 так, щоб змінювати, наприклад, збільшувати або знижувати, кількість цистеїнових залишків у шарнірній області. Цей підхід описаний також в US 5677425 на ім'я Bodmer зі співавторами. Кількість цистеїнових залишків у шарнірній області CH1 змінюють, наприклад, для полегшення складання легких і важких ланцюгів або для підвищення або зниження стабільності антитіла. В іншому варіанті здійснення винаходу шарнірну область Fc-фрагмента антитіла можна змінювати за допомогою мутації для зниження біологічного часу напівжиття антитіла. Більш конкретно, інтродуціюють одну або кілька амінокислотних мутацій в область контакту CH2-CH3доменів шарнірної області Fc-фрагмента для погіршення зв'язування антитіла із протеїном А золотавим стафілококом Staphylococcyl (SpA) у порівнянні зі зв'язуванням нативної шарнірної області Fc-фрагмента з SpA. Цей підхід описаний більш докладно в US 6165745 на ім'я Ward зі співавторами. В іншому варіанті здійснення винаходу антитіло модифікують для подовження біологічного часу напівжиття. При цьому можливо застосування різних підходів. Наприклад, можна інтродуціювати одну або декілька з наступних мутацій: T252L, T254S, T256F, описаних в US 6277375 на ім'я Ward. В іншому варіанті для подовження біологічного часу напівжиття можна змінювати антитіло в CH1- або CL-області шляхом інтродукції епітопу, що зв’язується з рецептором-«рятувальником», отриманого із двох петель CH2-домена Fc-фрагмента IgG, як описано в US №№ 5869046 і 6121022 на ім'я Presta зі співавторами. В інших варіантах здійснення винаходу Fc-фрагмент змінюють шляхом заміни щонайменше одного амінокислотного залишку на інший амінокислотний залишок для зміни ефекторних функцій антитіла. Наприклад, один або кілька амінокислотних залишків можна заміняти на інший амінокислотний залишок так, щоб у такого антитіла змінювалася афінність до ефекторного ліганду, але зберігалася антигензв’язувальна здатність батьківського антитіла. Ефекторний ліганд, афінність до якого змінюють, може являти собою, наприклад, Fc-рецептор або C1-компонентів комплементу. Цей підхід описаний більш докладно в US №№ 5624821 і 5648260, обидва на ім'я Winter зі співавторами. В іншому варіанті здійснення винаходу один або кілька амінокислотних залишків амінокислотної послідовності можна заміняти іншим амінокислотним залишком так, щоб антитіло мало змінену здатність до C1q-зв'язування і/або знижену комплементзалежну цитотоксичність (CDC) або її відсутність. Цей підхід описаний більш докладно в US 6194551 на ім'я Idusogie зі співавторами. В іншому варіанті здійснення винаходу один або кілька амінокислотних залишків змінюють, змінюючи тим самим здатність антитіла до фіксації комплементу. Цей підхід описаний також в опублікованій заявці PCT WO 94/29351 на ім'я Bodmer зі співавторами. У ще одному варіанті здійснення винаходу Fc-фрагмент модифікують для підвищення здатності антитіла викликати антитіло-обумовлену клітиннозалежну цитотоксичність (ADCC) і/або для підвищення афінності антитіла до Fcγ-рецептора за допомогою модифікації однієї або декількох амінокислот. Цей підхід описаний більш докладно в опублікованій заявці PCT WO 00/42072 на ім'я Presta. Крім того, були картовані сайти зв'язування людського IgG1 з FcγRl, FcγRII, FcγRIII і FcRn, і описані варіанти з поліпшеною здатністю до зв'язування (див. Shields R.L. та ін., J. Biol. Chen. 276, 2001, сс. 6591-6604). У наступному варіанті здійснення винаходу модифікують глікозилювання антитіла. Наприклад, можна створювати аглікозильоване антитіло (тобто антитіло, у якому відсутнє глікозилювання). Глікозилювання можна змінювати, наприклад, для підвищення афінності антитіла до «антигену». Такі вуглеводні модифікації можна здійснювати шляхом, наприклад, зміни одного або декількох сайтів глікозилювання в послідовності антитіла. Наприклад, можна здійснювати одну або кілька амінокислотних замін, які приводять до елімінації одного або декількох сайтів глікозилювання каркасної ділянки варіабельної області, усуваючи тим самим глікозилювання в цьому сайті. Зазначене аглікозилювання може підвищувати афінність антитіла до антигену. Цей підхід описаний більш докладно в US №№ 5714350 і 6350861 на ім'я Co зі співавторами. У додатковому або альтернативному варіанті можна створювати антитіло зі зміненим типом глікозилювання, наприклад, гіпофукозильоване антитіло, що має знижену кількість фукозильних залишків, або антитіло з підвищеним вмістом поділяючих навпіл GlcNac-структур. Було продемонстровано, що такі змінені схеми глікозилювання підвищують ADCC-активність антитіл. Зазначені вуглеводні модифікації можна здійснювати, наприклад, шляхом експресії антитіла в клітині-хазяїні зі зміненим механізмом глікозилювання. Клітини зі зміненим механізмом 27 UA 101944 C2 5 10 15 20 25 30 35 40 45 50 55 60 глікозилювання відомі в даній області і їх можна застосовувати у якості клітин-хазяїв, у яких експресують рекомбінантні антитіла, запропоновані у винаході, для одержання тим самим антитіл зі зміненим глікозилюванням. Наприклад, в EP 1176195 на ім'я Hang зі співавторами описана лінія клітин з функціонально порушеним геном FUT8, що кодує фукозилтрансферазу, у результаті чого антитіла, що експресуються в такій клітинній лінії, характеризуються гіпофукозилюванням. В опублікованій заявці PCT WO 03/035835 на ім'я Presta описаний варіант лінії CHO-клітин, Lecl3-клітини, зі зниженою здатністю приєднувати фукозу до пов'язаних з Asn(297) вуглеводам, що приводить також до гіпофукозилювання антитіл, що експресуються у цій клітині-хазяїні (см. також Shields R.L. та ін., J. Biol. Chem. 277, 2002, сс. 26733-26740). В опублікованій заявці PCT WO 99/54342 на ім'я Umana зі співавторам, описані лінії клітин, сконструйовані для експресії глікозилтрансфераз, що модифікують глікопротеїн (наприклад, бета(1,4)-N-ацетилглюкозамінілтрансферази III (GnTIII)), у результаті чого антитіла, які експресуються в сконструйованих лініях клітин, характеризуються підвищеним вмістом поділяючих навпіл GlcNac-структур, що приводить до підвищеної ADCC-активності антитіл (див. також Umana та ін., Nat. Biotech. 17, 1999, сс. 176-180). Іншою модифікацією антитіл, що підпадає під об'єм винаходу, є пегілювання. Антитіло можна пегілювати, наприклад, для подовження біологічного (наприклад, у сироватці) часу напівжиття антитіла. Для пегілювання антитіла, як правило, антитіло або його фрагмент піддають взаємодії з поліетиленгліколем (ПЕГ), таким як реакційноздатний складний ефір або альдегідна похідна ПЕГ, в умовах, при яких одна або декілька ПЕГ-груп приєднується до антитіла або фрагмента антитіла. Пегілювання можна здійснювати за допомогою реакції ацилювання або реакції алкілювання з реакційноздатною молекулою ПЕГ (або аналогічним реакційноздатним водорозчинним полімером). У контексті даного опису мається на увазі, що поняття «поліетиленгліколь» відноситься до будь-яких форм ПЕГ, які використовують для дериватизації інших білків, таким як моно(C1-C10)алкокси - або арилоксиполіетиленгліколь або поліетиленглікольмалеїмід. У конкретних варіантах здійснення винаходу антитіло, що підлягає пегілюванню, являє собою агліколізоване антитіло. Методи пегілювання білків відомі в даній області, і їх можна застосовувати до антитіл, запропонованих у винаході (див., наприклад, EP 0154316 на ім'я Nishimura зі співавторами й EP 0401384 на ім'я Ishikawa зі співавторами). Неімуноглобулінові каркаси Можна застосовувати широку розмаїтість кістяків або каркасів антитіла/імуноглобуліну за умови, що поліпептид, що утвориться, включає щонайменше одну єднальну ділянку, що є специфічною для білка-мішені. Такі кістяки або каркаси включають п'ять основних ідіотипів людських імуноглобулінів або їх фрагментів (наприклад, які представлені в даному описі), і включають імуноглобуліни інших видів тварин, які краще мають гуманізовані компоненти. Антитіла, що складаються тільки з важких ланцюгів, які ідентифіковані в представниках верблюжих і/або акулячих, у цьому плані є особливо цікавими. Фахівці в даній області продовжують виявляти і створювати нові кістяки, каркаси і фрагменти. Один з об'єктів винаходу відноситься до створення антитіл на неімуноглобуліновій основі з використанням неімуноглобулінових каркасів, у які можна трансплантувати CDR, запропоновані у винаході. Можна застосовувати відомі неімуноглобулінові каркаси або ті, які будуть виявлені надалі, якщо вони містять єднальну ділянку, специфічну для білка-мішені, послідовність якого представлена в SEQ ID NO: 1 або SEQ ID NO:122. Такі сполуки позначені в контексті даного опису як «поліпептиди, що містять специфічну для мішені єднальну ділянку». Відомі неімуноглобулінові кістяки або каркаси включають (але не обмежуючись тільки ними) аднектини (фібронектин) (фірма Compound Therapeutics, Inc., Уолтем, шт. Масачусетс), анкірин (фірма Molecular Partners AG, Цюріх, Швейцарія), домени антитіл (фірма Domantis, Ltd (Кембрідж, шт. Масачусетс) і аблінкс (Ablynx nv) (Цвінаарде, Бельгія)), ліпокалін (антикалін) (фірма Pieris Proteolab AG, Фрейзинг, Німеччина), невеликі модульні імунологічні фармацевтичні агенти (фірма Trubion Pharmaceuticals Inc., Сіетл, шт. Вашингтон), максітіла (фірма Avidia, Inc. (Маунтін-В'ю, шт. Каліфорнія), протеїн A (фірма Affibody AG, Швеція) і аффілін (гамма-кристалін або убікітин) (фірма Scil Proteins GmbH, Галлі, Німеччина). (I) Аднектини - фірма Compound Therapeutics Основою аднектинових каркасів є домен фібронектина типу III (наприклад, десятий модуль фібронектина типу III (домен 10 Fn3). Домен фібронектина типу III несе 7 або 8 бета-ланцюгів, які розподілені між двома бета-складками, які самі упаковані одна напроти одної з утворенням ядра білка, і додатково містять петлі (аналоги CDR), які з'єднують бета-ланцюги один з одним і є доступними для розчинника. Відомо щонайменше три таких петлі на кожному краї бетаскладчастого сендвіча, при цьому край є кордоном білка, перпендикулярному до напрямку беталанцюгів (US 6818418). 28
ДивитисяДодаткова інформація
Назва патенту англійськоюCompositions and methods of use for dickopf-1 antibodies
Автори англійськоюShalok Jenin, Kong Feng, Fishman Mark, Yettenberg Ses, Bardroff Mihael', Donzo Mariel', Urlinger Stefani
Назва патенту російськоюКомпозиции и способы применения для антител dickopf-1
Автори російськоюШалок Дженин, Конг Фенг, Фишмен Марк, Еттенберг Сес, Бардрофф Михаель, Донзо Мариель, Урлингер Стефани
МПК / Мітки
МПК: A61K 39/395, A61P 19/08, A61P 35/04, C07K 16/18
Мітки: застосування, dicкkopf-1, композиції, антитіл, способи
Код посилання
<a href="https://ua.patents.su/166-101944-kompozici-i-sposobi-zastosuvannya-dlya-antitil-dickkopf-1.html" target="_blank" rel="follow" title="База патентів України">Композиції і способи застосування для антитіл dicкkopf-1</a>
Попередній патент: Біарилзаміщені гетероциклічні інгібітори lta4h для лікування запалення
Наступний патент: Лікування злоякісного новоутворення за допомогою бевацизумабу
Випадковий патент: Мішалка