Спосіб виробництва похідних заміщеної 5-метоксиметилпіридин-2,3-дикарбонової кислоти
Формула / Реферат
1. Спосіб виробництва 2,3-дизаміщеного-5-метоксиметилпіридину формули (І)
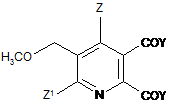 , (I)
, (I)
де
Z означає Н або галоген;
Z1 означає Н, галоген, CN або NO2;
Y означає ОМ, і
М означає лужний метал або лужноземельний метал,
що включає стадії:
(і) реакція сполуки формули (II)
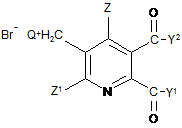 , (ІІ)
, (ІІ)
де
Q означає третинний аліфатичний або циклічний, насичений, частково ненасичений або ароматичний амін;
Z означає Н або галоген;
Z1 означає Н, галоген, CN або NO2;
Y1 і Y2 кожний незалежно означають OR1, NR1R2, або, коли взяті разом, Y1Y2 означає -О-, -S- або -NR3-;
R1 і R2 кожний незалежно означають Н,
С1-С4алкіл, необов'язково заміщений С1-С4алкоксигрупою або фенілом, необов'язково заміщеним від одної до трьох С1-С4алкільними групами, С1-С4алкоксигрупами або атомами галогену, або
феніл, необов'язково заміщений від одної до трьох С1-С4алкільними групами, С1-С4алкоксигрупами або атомами галогену;
R3 означає Н або С1-С4алкіл,
в суміші метанол/Н2О, що включає щонайменше 20 мас. % Н2О в перерахунку на сумарну кількість води і броміду (II), з основою, що містить МОСН3 і/або МОН, де М означає лужний метал або лужноземельний метал, під тиском в закритій ємності при температурі від 75 до 110 °C.
2. Спосіб за п. 1, що включає стадії:
(і-1) реакція сполуки формули (IV)
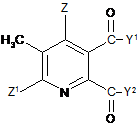 , (IV)
, (IV)
в якій Y1, Y2 не є ОН і символи в інших випадках мають значення дані в формулі (II) в п. 1, з бромом в присутності радикального ініціатора в суміші розчинників, що містить водну фазу і органічну фазу, де органічна фаза включає розчинник, вибраний з 1,2-дихлоретану, хлорбензолу, 1,2-дихлорбензолу, 1,3-дихлорбензолу, 1,4-дихлорбензолу і тетрахлорметану, і де величина рН водної фази становить від 3 до <8, до одержання 3-бромметил-5,6-дизаміщеної піридинової сполуки (V)
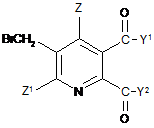 , (V)
, (V)
де Y1, Y2 не є ОН і символи в інших випадках мають значення дані в формулі (II),
і
(і-2) реакція сполуки брому формули (V) з третинним аміном Q в розчиннику в інтервалі температури 0-100 °C до одержання солі амонію (II), і
(і-3) реакція солі амонію (II) в суміші метанол/Н2О, що включає основу, що містить МОСН3 і МОН, де М означає лужний метал, під тиском в закритій ємності при температурі від 75 до 110 °C.
3. Спосіб за п. 1 або п. 2, в якому сполука формули (II) є сполукою (IIа)
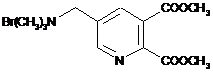 (IIa).
(IIa).
4. Спосіб за будь-яким з пп. 1-3, в якому співвідношення метанолу до сполуки (II) знаходиться в діапазоні 0,5-25:1.
5. Спосіб за будь-яким з пп. 1-4, в якому основою є суміш МеОМ і МОН.
6. Спосіб за будь-яким з пп. 1-4, в якому основою є МеОМ.
7. Спосіб за п. 5 або п. 6, де молярне співвідношення МеОМ до сполуки (II) знаходиться в діапазоні від 1-10:1.
8. Спосіб за будь-яким з пп. 1-4, в якому основою є МОН.
9. Спосіб за п. 5 або п. 8, в якому молярне співвідношення МОН до сполуки (II) знаходиться в діапазоні від 0,5-10:1.
10. Спосіб за будь-яким з пп. 1-9, в якому молярне співвідношення загальної кількості основи, що додається до броміду (II), становить 3-7:1.
11. Спосіб за будь-яким з пп. 1-10, в якому температура реакції знаходиться в діапазоні від приблизно 75 до 110 °C.
12. Спосіб за будь-яким з пп. 1-11, який здійснюється при тиску 1,01-5,00 бар.
13. Спосіб одержання гербіцидної імідазолінонової сполуки формули (III)
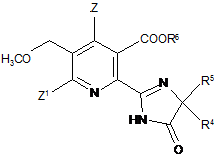 , (III)
, (III)
в якій
Z, Z1 є такими як визначено в формулі (І) в п. 1;
R4 означає С1-С4алкіл;
R5 означає С1-С4алкіл, С3-С6циклоалкіл або R4 і R5, коли взяті разом з атомом, до якого вони приєднані, означають С3-С6циклоалкільну групу, необов'язково заміщену метилом, і
R6 означає водень; групу формули -N=C(нижчий алкіл)2; С1-С12алкіл, необов'язково заміщений одною з наступних груп: С1-С3алкоксигрупа, галоген, гідроксил, С3-С6-циклоалкіл, бензилоксигрупа, фурил, феніл, галофеніл, нижчий алкілфеніл, нижчий алкоксифеніл, нітрофеніл, карбоксил, нижчий алкоксикарбоніл, ціаногрупа або три(нижчий алкіл)амоній; С3-С12алкеніл, необов'язково заміщений одною з наступних груп: С1-С3алкоксигрупа, феніл, галоген або нижчий алкоксикарбоніл або двома С1-С3алкоксигрупами або двома групами галогену; С3-С6циклоалкіл, необов'язково заміщений одною або двома С1-С3алкільними групами; або
катіон;
що включає стадії:
(і) одержання сполуки формули (І) згідно з будь-яким з пп. 1-12;
(іі) перетворення сполуки формули (І) в гербіцидну сполуку формули (III).
14. Спосіб за п. 13, що включає стадії:
(і) одержання сполуки (І) згідно з будь-яким з пп. 1-12, де Y означає ОН,
(іі-1) перетворення сполуки (І) до ангідриду (VI)
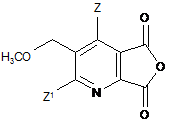 , (VI)
, (VI)
де Z, Z1 є такими як в формулі (III) в п. 13,
(іі-2) реакція ангідриду (VI) з 2-аміноалканкарбоксамідом формули (VII)
H2N-CR4R5-CONH2, (VII)
де R4, R5 є такими як в формулі (III) в п. 13,
до одержання аміду (VIII)
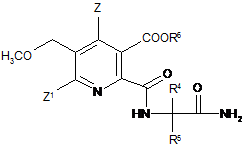 , (VIII)
, (VIII)
де символи є такими як в формулі (III) в п. 13,
і
(іі-3) конденсація аміду (VIII) з одержанням гербіцидного імідазолінону (III).
15. Спосіб за п. 13, що включає стадії:
(і) одержання сполуки (І) згідно з будь-яким з пп. 1-12, де Y означає ОН;
(іі-1) перетворення сполуки (І) до ангідриду (VI)
 , (VI)
, (VI)
(іі-2) реакція ангідриду (VI) з амінокарбонітрилом (IX)
H2N-CR4R5-CN, (IX)
де R4 і R5 є такими як в формулі (III), до одержання амідонітрильної сполуки (X)
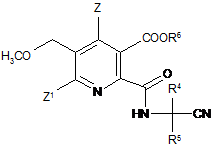 , (X)
, (X)
де символи є такими як в формулі (III);
(іі-3) гідроліз нітрильної групи в сполуці (X) до одержання аміду (VIII)
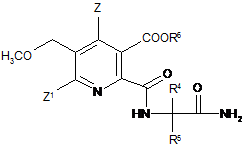 , (VIII)
, (VIII)
де символи мають такі ж значення як в формулі (III)
і
(іі-4) конденсація аміду (VIII) з одержанням гербіцидного імідазолінону (III).
Текст
Реферат: Винахід стосується виробництва 2,3-дизаміщеного-5-метоксиметилпіридину формули (І) Z COY H3CO Z1 N COY , (I) де Z означає Н або галоген; 1 Z означає Н, галоген, CN або NO2; 2 Y означає ОМ, і М означає лужний метал або лужноземельний метал, що включає стадії: (і) реакція сполуки формули (II) UA 101712 C2 (12) UA 101712 C2 Z Br Q+H2C Z1 O C Y2 N C Y1 O , (ІІ) де Q означає третинний аліфатичний або циклічний, насичений, частково ненасичений або ароматичний амін; Z означає Н або галоген; 1 Z означає Н, галоген, CN або NO2; 1 2 1 1 2 1 2 Y і Y кожний незалежно означають OR , NR R , або, коли взяті разом, Y Y означає -О-, -S3 або -NR -; 1 2 R і R кожний незалежно означають Н, С1-С4алкіл, необов'язково заміщений С1-С4алкоксигрупою або фенілом, необов'язково заміщеним від одної до трьох С1-С4алкільних груп, С1-С4алкоксигруп або атомів галогену, або феніл, необов'язково заміщений від одної до трьох С1-С4алкільних груп, С1-С4алкоксигруп або атомів галогену; 3 R означає Н або С1-С4алкіл, в суміші метанол/Н2О, що включає щонайменше 20 мас. % Н2О в перерахунку на сумарну кількість води і броміду (II), з основою, що містить МОСН3 і/або МОН, де М означає лужний метал або лужноземельний метал, під тиском в закритій ємності при температурі від 75 до 110 °C. Сполуки формули (І) є придатними проміжними сполуками в синтезі гербіцидних імідазолінонів як імазамокс. UA 101712 C2 5 Опис Винахід належить до способу виробництва похідних 5-метоксиметилпіридин-2,3дикарбонової кислоти і подальшого перетворення цих сполук до гербіцидних 5-заміщених-2-(2імідазолін-2-іл)-нікотинових кислот, таких як імазамокс. Похідні 2-(2-імідазолін-2-іл)-нікотинових кислот, як імазамокс (2-[(RS)-4-ізопропіл-4-метил-5оксо-2-імідазолін-2-іл]-5-метоксиметилнікотинова кислота) CO2H CH3OCH2 CH3 N N CH(CH3)2 HN O 10 15 20 25 30 є придатними селективними гербіцидами, які діють як ALS-інгібітори і можуть бути застосовані в пред- і пост-з'явлення застосуваннях. З літератури відомі різні способи синтезу цих сполук, дивися, наприклад, EP-A 0 322 616, US 5,378,843, US 5,760,239, EP-A 0 933 362 або Q. Bi et al, Modern Agrochemicals 6(2007) 10-14. US 5,378,843 розкриває синтез 5-(метоксиметил)-2,3-піридиндикарбонової кислоти реакцією складного ефіру [(5,6-дикарбокси-3-піридил)-диметилметил]-триметиламоній броміду з метоксидом натрію/метанолом і NaOH/вода, супроводжуваною ацилуванням. US 5,760,239 розкриває поліпшений спосіб перетворення 5,6-дикарбоксил-3-піридилметил амоній галогеніду до 5-(алкоксиметил)-піридин-2,3-дикарбоксилатної солі в одну стадію закритої реакції з виділенням спирту і основи при температурі близько 120-180 °C. Хоча синтез цими способами здійснюється в промисловому масштабі, існує все ще потреба для його удосконалення, особливо зважаючи на економічні і екологічні аспекти, таких як повне удосконалення виходу або уникнення певних розчинників або реактивів. Одне завдання винаходу полягає в тому, щоб забезпечити поліпшений спосіб виробництва 5-метоксиметилпіридин-2,3-дикарбонових кислот або карбоксилатів. Подальше завдання винаходу полягає в тому, щоб забезпечити поліпшений спосіб перетворення цих сполук до гербіцидних 2-(2-імідазолін-2-іл) нікотинових кислот або їх похідних. Було знайдено, що метоксилування 5,6-дизаміщених-3-метилпіридинів і подальша реакція з третинними амінами може бути значно поліпшена шляхом роботи в системі метанол/вода і метанолат або суміші метанолата і гідроксиду під тиском при температурі близько 75-110 °C. Відповідно, в одному об'єкті винаходу забезпечується спосіб виробництва 2,3-дизаміщеного5-метоксиметилпіридину формули (I), Z COY H3CO (I) 1 Z 35 40 N COY де Z означає H або галоген; 1 Z означає H, галоген, CN або NO2; Y означає OM, і M означає H, лужний метал або лужноземельний метал, що включає стадії: (i) реакція сполуки формули (II) 1 UA 101712 C2 O Z 2 + C-Y Br Q H2C (II) 1 Z 1 N C-Y O 5 10 15 20 де Q означає третинний аліфатичний або циклічний, насичений, частково ненасичений або ароматичний амін; Z означає H або галоген; 1 Z означає H, галоген, CN або NO2; 1 2 1 1 2 1 2 Y і Y кожний незалежно означають OR , NR R , або коли взяті разом Y Y означає -O-, -S3 або -NR -; 1 2 R і R кожний незалежно означають H, C1-C4 алкіл, необов'язково заміщений C1-C4 алкоксигрупою або фенілом, необов'язково заміщеним від одної до трьох C1-C4 алкільних груп, C1-C4 алкоксигруп або атомів галогену, або феніл, необов'язково заміщений від одної до трьох C 1-C4 алкільних груп, C1-C4 алкоксигруп або атомів галогену; 3 R означає H або C1-C4 алкіл, в суміші метанол/H2O, що включає щонайменше 20 мас. % H2O (в перерахунку на сумарну кількість води і броміду (II)), з основою, що містить MOCH 3 і/або MOH, де M означає лужний метал або лужноземельний метал, під тиском в закритій ємності при температурі від приблизно 75 до 110 °C. У додатковому об'єкті винаходу забезпечується спосіб одержання гербіцидної імідазолінонової сполуки формули (III), Z COOR H3CO 1 Z N N HN 25 30 35 40 6 R 5 R (III) 4 O у якій 1 Z, Z є такими як визначено у формулі (I); 4 R означає C1-C4 алкіл; 5 4 5 R означає C1-C4 алкіл, C3-C6 циклоалкіл або R і R , коли взяті разом з атомом, до якого вони приєднані, означають C3-C6 циклоалкільну групу, необов'язково заміщену метилом, і 6 R означає водень; групу формули -N=C (нижчий алкіл)2; C1-C12 алкіл, необов'язково заміщений однією з наступних груп: C1-C3 алкоксигрупа, галоген, гідроксил, C3-C6-циклоалкіл, бензилоксигрупа, фурил, феніл, галофеніл, нижчий алкілфеніл, нижчий алкоксифеніл, нітрофеніл, карбоксил, нижчий алкоксикарбоніл, ціаногрупа або три нижчий алкіламоній; C 3-C12 алкеніл, необов'язково заміщений однією з наступних груп: C1-C3 алкоксигрупа, феніл, галоген або нижчий алкоксикарбоніл або двома C 1-C3 алкоксигрупами або двома групами галогену; C 3C6-циклоалкіл, необов'язково заміщений однією або двома C1-C3 алкільними групами; або катіон переважно обраний із групи, що складається з лужних металів, лужноземельних металів, марганцю, міді, заліза, цинку, кобальту, свинцю, срібла, нікелю, амонію і органічного амонію; що включає стадії: (i) одержання сполуки формули (I) як описано вище, (ii) перетворення сполуки формули (I) у гербіцидну сполуку формули (III). Спосіб винаходу приводить до більш високих виходів, більш високої продуктивності (більш високої об'ємної продуктивності, більш низьким фіксованим витратам, більш низьким витратам сировини (NaOH більш дешевий, ніж Na-метилат) і поліпшеної селективності для сполук 2 UA 101712 C2 5 формули (I). Це дає можливість здійснювати спосіб при більш низьких температурах, більш високих вмістах води і за більш короткий час реакції. Переважними є сполуки формули (I), де символи мають наступні значення: Z переважно означає H. 1 Z переважно означає H. Y переважно означає OH. Переважно, усі символи у формулі (I) мають переважні значення. Особливо переважною сполукою формули (I) є сполуки формули (Ia): COOH H3CO 10 15 (Ia) N COOH Сполуки формули (II) і їх одержання відомі, наприклад, з US 5,378,843. Переважними сполуками формули (II) є ті, які приводять до переважних сполук формули (I). 1 2 1 1 Переважно Y , Y означають OR з R , який означає C1-C4-алкіл. Мається на увазі, що через присутність води може мати місце частковий гідроліз діефіру (або інших груп). Q переважно означає R R 10 R N R R 9 ; R 11 7 N+ 8 + N N N 8 R 7 R ; 7 R 7 7 R 8 + R + N 7 N 7 7 R 7 R R 8 R ; 8 R 7 N R N+ R 8 і R 20 R 8 2 Z R 7 2 25 30 35 N+ R 7 ; 12 Z означає O, S або NR ; 12 R означає C1-C4 алкіл; 7 8 R і R кожний незалежно означають водень, галоген, C1-C4 алкіл або C1-C4 алкоксигрупу, 7 8 або, коли взяті разом, R і R утворюють 5- або 6-членне насичене або ненасичене кільце, що 12 необов'язково містить O, S, або NR і необов'язково заміщене від одного до трьох атомами галогену, C1-C4 алкільними групами або C1-C4 алкоксигрупами, і 9 10 11 9 10 R , R і R кожний незалежно означають C1-C4 алкіл, або R і R , коли взяті разом, 9 10 утворюють 5-або 6-членне кільце, у якому R R , представлені структурою: -(CH2)n-, що 9 11 необов'язково містить O, S або NR , де n означає ціле число 3, 4 або 5, передбачений R означає C1-C4 алкіл. + 9 10 11 Q більш переважно означає NR R R або піридиній, і 9 10 11 9 10 R , R і R більш переважно означають кожний незалежно C1-C4 алкіл, або R і R , коли 9 10 взяті разом, утворюють 5-або 6-членне кільце, у якому R R , представлені структурою: -(CH2)n-, 12 що необов'язково містить O, S або NR , де n означає ціле число або 3, 4 або 5, передбачений 11 9 10 11 R означає C1-C4 алкіл; особливо переважно R , R і R означають C1-C4 алкіл. Особливо переважною сполукою формули (II) є сполуки формули (ІІа): 3 UA 101712 C2 COOCH3 Br(CH3)3N N 5 10 15 20 25 30 35 40 45 COOCH3 Реакцію проводять у суміші розчинників, що містить метанол і щонайменше 20 мас. % води (у перерахуванні на сумарну кількість води і броміду (II)). Краща кількість води становить від близько 25 до близько 75 %, більш переважно 30-70 %, особливо від близько 40 до близько 50 %. Залишок суміші розчинників являє собою метанол і аж до близько 50 %, переважно аж до близько 20 % додаткових розчинників, переважно обраних з толуолу, хлорбензолу і етанолу. Масове співвідношення метанолу до броміду (II) в основному перебуває в діапазоні від 0.525:1, переважно 1-20:1, більш переважно 1-10:1, особливо 2-3:1. Основа включає MeOM, MOH або суміш MeOM і MOH, де M означає лужний метал або лужноземельний метал, переважно Na або K, особливо Na. У випадках сумішей MeOM/MOH, M може бути однаковим або різним, переважно однаковим. Якщо є присутнім MeOM, молярне співвідношення MeOM, переважно MeONa, до броміду (II) в основному перебуває в діапазоні 1-10:1, переважно 1-7.5:1, більш переважно 1.25-7:1, особливо 1.25-2:1. Якщо є присутнім MOH, молярне співвідношення MOH, переважно NaOH, до броміду (II) в основному перебуває в діапазоні 0.5-10:1, переважно 1-7:1, більш переважно 3-5:1. Якщо суміш MeOM і MOH застосовується як основа молярна співвідношення MOH до броміду (II) в основному перебуває в діапазоні 0.5-7.5:1, переважно 1-5:1, більш переважно 3-5:1. В одному переважному варіанті здійснення не додається MOH до реакційної суміші. За економічними причинами вигідно використовувати надлишок MOH відносно MeOM. В іншому переважному варіанті здійснення, застосовується тільки MOH у співвідношенні 3-10:1, більш переважно 4-7:1, більш переважно 4.5-6:1. Молярне співвідношення загальної кількості основи/бромід (II), що додаються, в основному перебуває від близько 2.5-10:1, переважно від близько 3-7:1, особливо переважно від близько 4.5-6:1. MeOM звичайно додають розчиненим у метанолі. MOH звичайно додають розчиненим у воді. Реакцію проводять при температурі в діапазоні від близько 75 до 110 °C, переважно в діапазоні від близько 80 до 105 °C, більш переважно в діапазоні від близько 80 до 100 °C. Реакцію проводять у закритій ємності, наприклад, у реакторі високого тиску Парра, при підвищеному тиску, який в основному перебуває в діапазоні від близько 1.01 до 5.00 бар, переважно від близько 1.02 до 4.00 бар, особливо від близько 1.03 до 3.50 бар. У переважному варіанті здійснення зовнішній тиск не здійснюється, і реакцію проводять при тиску, сформованому від розчинників при температурі реакції в замкненому посуді. Час реакції в основному перебуває в діапазоні від близько 5 до 20 год., переважно в діапазоні від близько 6 до 9 год., особливо близько 8 год. У переважному варіанті здійснення бромід (II), що містить від близько 25 до 75 мас. % води (у перерахуванні на сумарну кількість води і броміду (II)), взятий у метанолі, водний NaOH повільно додають при температурі в діапазоні від близько 25 до 40 °C, за чим іде NaOCH3 у метанолі, який повільно додають при температурі в діапазоні від близько 40 до 50 °C. Реакційну суміш потім нагрівають до температури реакції (в основному 80-100 °C) у реакторі високого тиску, який закритий, після чого тиск росте в міру досягнення температури реакції. Після завершення реакції суміш охолоджують і вона може бути оброблена згідно з відомими процедурами, наприклад, шляхом охолодження, обробкою кислотою, такою як сірчана кислота, до осадження сполуки (I) і може бути відфільтрована. У переважному варіанті здійснення винаходу забезпечується спосіб виробництва сполуки формули (I), що включає стадії (i-1) реакція сполуки формули (IV), Z 1 Z O 2 C-Y H3C 50 (IIa) (IV) N 1 C-Y O 4 UA 101712 C2 1 5 2 1 2 у якій символи мають значення дані у формулі (II), за винятком того, що Y , Y не є OH, із бромом у присутності радикального ініціатора в суміші розчинників, що містить водну фазу і органічну фазу, де органічна фаза містить розчинник, обраний з 1,2-дихлоретану, хлорбензолу, 1,2-дихлорбензолу, 1,3-дихлорбензолу, 1,4-дихлорбензолу і тетрахлорметану, і де величина pH водної фази становить від 3 до < 8, до одержання 3-бромметил-5,6-дизаміщеного піридину сполуки (V), O Z 2 C-Y BrCH2 (V) 1 Z 1 N C-Y O 10 15 20 25 30 35 40 45 50 1 2 1 у якій Y , Y , Z і Z мають значення дані у формулі (II), за винятком того, що Y , Y не є OH, і (i-2) реакція сполуки брому формули (V) із третинним аміном Q у розчиннику в інтервалі температури близько 0-100 °C до одержання солі амонію (II), і (i-3) реакція солі амонію (II) у суміші метанол/H2O, що включає основу, що містить MOCH3 і MOH, де M означає лужний метал, під тиском у закритій ємності при температурі від близько 75 до 110 °C. На стадії (i-1) молярне співвідношення піридинової сполуки (IV) до брому в основному перебуває в діапазоні 1:0.5-1.2, переважно 1:0.6-1.0, більш переважно 1:0.7-0.95. Також можливо працювати з половиною еквівалентів брому, і генерувати бром у реакційній суміші з HBr окиснювачем, таким як H2O2. Підходящими вільнорадикальними генераторами для ініціації реакції є такі, які розкладаються при обраній температурі реакції. Прикладами переважних ініціаторів є вільнорадикальні генератори, такі як азосполуки і пероксиди. Також можливо, незважаючи на це, застосовувати редокс-системи, особливо такі, які засновані на гідропероксидах, таких як гідропероксид кумена. Радикальні ініціатори підходящі для застосування в способі винаходу включають 2,2’азобісізобутиронітрил, 2,2’-азобіс(2-метилбутаннітрил), 2,2’-азобіс(2,4-диметил-пентаннітрил), 1,1’-азобіс(циклогексанкарбонітрил), органічні і неорганічні пероксиди, такі як пероксид дилауроїла, перекис водню, трет-бутилперокси-півалат, пероксид бензоїлу і таке інше, при цьому 2,2’-азобісізобутиронітрил, 2,2’-азобіс(2-метилбутаннітрил) і пероксид дилауроїлу є переважними, і 2,2’-азобісізобутиронітрил і 2,2’-азобіс(2-метилбутаннітрил) особливо переважні. Молярне співвідношення ініціатора до брому переважно перебуває в діапазоні 0.04-0.15:1, більш переважно 0.06-0.10:1. Органічний розчинник обраний із групи, що включає 1,2-дихлоретан, хлорбензол, 1,2дихлорбензол, 1,3-дихлорбензол, 1,4-дихлорбензол і тетрахлорметан, переважно 1,2дихлоретан і хлорбензол. 1,2-дихлоретан особливо переважний. Також можливі суміші, особливо дихлорбензолів. Кількість органічного розчинника може варіювати в широких межах. Переважно застосовується 900-2000 г, більш переважно 1000-1300 г, органічного розчинника на моль сполуки (II). Реакційна суміш містить органічну фазу і водну фазу. Кількість водної фази може варіювати в широких межах. Переважно застосовується 140-500 г, більш переважно 140-300 г, особливо 150-200 г води на моль сполуки формули (II). Під час реакції величина pH водної фази зберігається в діапазоні від 3 до < 8, переважно від 3 до 7, більш переважно від 4 до 7. Регулювання величини pH може бути досягнуте додаванням підходящого основи, переважно неорганічної основи, такої як гідроксид лужного металу, наприклад, NaOH, або лужноземельного металу. Водний NaOH є переважною основою, особливо в розведеній формі (наприклад, що містить 5-20 мас.-% NaOH). Щоб досягти бажаного регулювання величини pH основа може бути додана безупинно в ході реакції, або величина pH безупинно перевіряється, і основу додають за допомогою зв'язаного автоматизованого обладнання дозування. В одному переважному варіанті здійснення стадію (i-1) реакції проводять шляхом розчинення сполуки (IV) в органічній фазі і додаванням води до утворення водної фази. 5 UA 101712 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ініціатор додається у вигляді чистої сполуки або в розчині, при кімнатній температурі або при температурі реакції після нагрівання. Залежно від температури розкладання ініціатора, частина або навіть уся кількість ініціатора повинна бути додана перед початком дозування брому. Кількість ініціатора, яка повинна бути додана під час додавання брому, також залежить від температури розкладання. Під час реакції бромування повинна бути завжди доступною мінімальна концентрація вільних радикалів. Для 2,2’-азобіс(2-метилбутаннітрилу) додається розчин з ініціатором в органічному розчиннику. Повільне додавання брому так само, як і основи для регулювання величини pH може бути почате одночасно або якийсь час годі. Переважно, щоб почати дозування брому/основи пізніше, щоб мати достатню кількість вільних радикалів у суміші, коли починається реакція бромування. Після завершення реакції суміш охолоджують і розділяють фази. Реакцію в основному проводять при температурі близько 50 до близько 120 °C, переважно близько 60 до близько 90 °C. Реакція може здійснюватися при атмосферному тиску або при підвищеному тиску аж до 6 бар. Атмосферний тиск є переважним. Час реакції (для стадії (i-1)) відрізняється від параметрів реакції, але в основному перебуває між 1 і 24 год. Щоб поліпшити повний вихід і збільшити селективність реакції, тобто зменшити формування небажаних побічних продуктів диброму і триброму, переважно проводити реакцію тільки до перетворення 5-60 % (у перерахуванні на кількість сполуки (IV)), переважно 30-55 %. В одному переважному варіанті здійснення реакцію проводять до перетворення близько 50 % (у перерахуванні на сполуку (IV)). Ступінь перетворення може бути перевірена стандартними способами відомими фахівцеві в даній галузі техніки, наприклад, аналізом ВЕРХ. Коли досягається бажаний ступінь перетворення, реакція зупиняється, і фази розділяють. Органічна фаза, що містить продукт стадії (i-1), сполуку (V), непрореагувавший вихідний матеріал (IV) і побічні продукти диброму і триброму, можуть бути екстраговані водою для видалення водорозчинних домішок, таких як кислоти і бромід. Продукт (III) може бути відділений відомими способами, переважно, незважаючи на це, застосовувати органічну фазу без подальшої обробки для реакції із третинним аміном Q (стадія (i-2)). Також можливо екстрагувати водну фазу органічним розчинником і з'єднати з органічними фазами, щоб збільшити вихід сполуки (V). На стадії (i-2) реакції сполуки (V) реагує із третинним аміном Q до одержання сполуки амонію (II). Переважні третинні аміни Q випливають із переважних значень Q у формулі (II) вище, тобто, 9 10 11 піридин і третинні алкіламіни NR R R є більш переважними, де 9 10 11 9 10 R ,R іR кожний незалежно означають C1-C4 алкіл, або, R і R , коли взяті разом, 9 10 утворюють 5-або 6-членне кільце, у якому R R представлені структурою: -(CH2)n-, що 12 11 необов'язково містить O, S або NR , де n означає ціле число 3, 4, або 5, передбачений R означає C1-C4 алкіл, і 12 R означає C1-C4 алкіл. Триметиламін, NMe3, особливо переважні. В основному застосовується надлишок третинного аміну. В основному застосовується 1.1-2, переважно 1.05-1.5 еквівалентів третинного аміну на еквівалент сполуки (V). В основному третинний амін, необов'язково розчинений у розчиннику, повільно додають у розчин сполуки (V), після чого утворюється і осаджується сіль (II). У випадку переважного аміну NMe3, який є газоподібним при кімнатній температурі, переважно працювати в закритій ємності і насичувати газоподібний амін або рідкий амін під тиском у розчин сполуки (V). Стадія (i-2) переважно здійснюється при температурі близько 0-70 °C, більш переважно 570 °C, особливо переважно 5-40 °C. Реакція може бути здійснена при тиску навколишнього середовища або при підвищеному тиску. У переважному варіанті здійснення, реакцію проводять у закритій ємності при тиску розчинника і/або аміну, який росте при підвищенні температури реакції. Обробка реакційної суміші і виділення сполуки амонію (II) може бути здійснена загальноприйнятими способами, наприклад, сполуки (II) може бути відфільтрована. У переважному варіанті здійснення вода додається до реакційної суміші, щоб розчинити продукт, сполуку (II), і розділяються водна фаза і органічна фаза. Водна фаза може бути додатково екстрагована органічним розчинником, щоб збільшити чистоту продукту (II), і збільшити вихід повернутого вихідного матеріалу (V) в органічній фазі. Кількість води повинна 6 UA 101712 C2 5 10 15 20 25 30 35 40 45 бути достатньою для утворення водної фази і переважно обрана так, щоб утворювати 20-45 мас. % розчин сполуки (II) у водній фазі. Сполука амонію (II) може бути виділена з водної фази відомими способами. У переважному варіанті здійснення сполуки (II) не виділяють і водна фаза, одержана на стадії (i-2) застосовується в наступних реакціях без додаткової обробки. Таке можливо і вигідно, тому що велика кількість води допускається в способі метоксилування винаходу. Незважаючи на це, також можливо змішувати водну фазу з розчинником, який утворює азеотроп з водою, наприклад, толуол, і вода віддаляється азеотропною дистиляцією. Одержана суспензія сполуки (II) може бути застосована для наступних реакцій. У додатковому переважному варіанті здійснення, після відділення сполуки (V), органічна фаза зі стадії (i-2), що містить до 80 % вихідного матеріалу (IV) (у перерахуванні на початкову кількість, використану на стадії (i-1)), вертається і рециклізується в способі реакції стадії (i-1). Переважно додається додатковий вихідний матеріал (IV), щоб компенсувати кількість перетворену в попередній стадії (i-1). Таким чином, у принципі, органічна фаза стадії (i-1) може бути рециклізована будь-яку кількість раз, незважаючи на це, через нагромадження побічних продуктів, головним чином ди- і трибромірованих продуктів сполуки (IV), в основному здійснюється до 20, переважно до 10 циклів. У переважному варіанті здійснення циклічного способу реакції в останньому циклі додатковий вихідний матеріал (IV) не додається, щоб поліпшити повний вихід і норму перетворення. У додатковому варіанті здійснення циклічного способу реакції певна кількість органічної фази, переважно близько 5-20 мас. %, відділяється, щоб зменшити або запобігти нагромадженню побічних продуктів в органічній фазі. У цьому варіанті здійснення винаходу фактично відсутній межа числа циклів, у яких може використовуватися органічна фаза. Сполуки формули (I) являють собою цінні проміжні сполуки в органічному синтезі. Вони особливо придатні для перетворення до гербіцидної імідазолінонової сполуки (III). Подальше перетворення сполуки (I) до гербіцидних імідазолінонов (III) може бути досягнуте способами відомими в рівні техніки. Способи, які можуть використовуватися, щоб створити імідазолінонові гербіциди проілюстровані в книзі "The Imidazolinone Herbicides" за редакцією D. L. Shaner і S. L. O'connor, виданій 1991 CRC Press, Boca Raton, Florida з особливим посиланням на Главу 2, названу "Synthesis of The Imidazolinone Herbicides", сторінка 8-14 і посилання, процитовані там. Наступні патентні літературні посилання також ілюструють способи, які можуть використовуватися, щоб перетворити піридинові дикислоти, складні ефіри і солі до імідазолінонових кінцевих продуктів: Патенти US №. 5371229; 5250694; 5276157; 5110930; 5122608; 5206368; 4925944; 4921961; 4959476; 5103009; 4816588; 4757146; 4798619; 4766218; 5001254; 5021078; 4723011; 4709036; 4658030; 4608079; 4719303; 4562257; 4518780; 4474962; 4623726; 4750978; 4638068; 4439607; 4459408; 4459409; 4460776; 4125727 і 4758667, і EP-A 0 041 623. Згідно із переважними варіантами здійснення винаходу перетворення сполуки (I) до гербіцидного імідазолінона (III) здійснюється за аналогією з методами, описаними в EP-A 0 041 623, US 4,518,780 або EP-A 0 144 595. Згідно із цими варіантами здійснення сполука (I) спочатку перетворена у відповідний ангідрид відомими способами, такими як реакція з оцтовим ангідридом. В одному варіанті здійснення сполуки (III) одержують (i) готуванням сполуки (I), де Y означає OH, як уже зазначене вище; (ii-1) перетворенням сполуки (I) до ангідриду (VI), Z O H3CO O 1 Z (VI) N O 50 (ii-2) реакцією ангідриду (VI) з 2-аміноалкан карбоксамідом формули (VII), 4 5 H2N-CR R -CONH2 (VII), 4 5 де R і R є такими, як у формулі (III), до одержання аміду (VIII), 7 UA 101712 C2 Z 6 COOR H3CO 1 Z (VIII) O 4 R O N NH2 HN 5 5 10 15 20 25 30 R де символи є такими, як у формулі (III), і (ii-3) конденсацією аміду (VIII) з одержанням гербіцидного імідазолінона (III). Стадії (ii-2) і (ii-3) можуть здійснюватися як однореакторна реакція. В одному варіанті здійснення стадія (ii-2) здійснюється за аналогією зі способом, розкритому в прикладі 10 EP-A 0 322 616. Сполука (I), заміщений 2-аміноалкан карбоксамід (VI) і третинний амін, переважно триетиламін реагують у полярному апротонном розчиннику, такому як ацетонітрил, з одержанням солі амонію (VIII), яка може бути окислена до кислоти (VIII). Альтернативні способи розкриті в US 4,518,780 і EP-A 0 144 595. В останньому документі розкрите додавання азотистої основи, обраної з піридину, піколінів, хіноліну і лутидину, поліпшення регіоселективності реакції, тобто збільшення кількості 2-приєднання продукту. В одному варіанті здійснення стадії (ii-3) амідо сполука (VIII), переважно у формі солі амонію 6 (R означає HNR3), реагує з метоксидом лужного металу, переважно NaOCH 3 у метанолі за аналогією із прикладом 11 EP 0 322 616. Одержувана суспензія витримується при кип'ятінні в колбі зі зворотним холодильником до повного перетворення. Після охолодження суміш окислюють до одержання сполуки (III) або як сіль амонію (ацилування до pH близько 4) або вільна кислота (ацилування до pH ≤ 2). У додатковому переважному варіанті здійснення, реакційна суміш зі стадії (ii-2) реагує з метанолом (в основному 2-100 еквівалентів у перерахуванні на (VIII)) у присутності водної основи (в основному 3-100 еквівалентів у перерахуванні на (VIII)), основа краща вибирають із MOH і MOCH3, де M означає лужний метал, переважно Na або K, особливо Na. Реакцію проводять при температурі в діапазоні від 20 до 120 °C, переважно 40-90 °C. Реакція може бути здійснена при атмосферному тиску або при підвищеному тиску, переважний тиск формується при бажаній температурі реакції. Час реакції в основному становить від 1 до 8 год., переважно від 1 до 5 год. Виділення продукту (III) може бути досягнуте стандартними способами. У переважному варіанті здійснення додається вода і відганяються органічні розчинники. Залишок може бути перенесений у воду і окислений, після чого осаджується сполука (III). Після фільтрування сирий продукт може бути додатковий очищений, наприклад, шляхом збовтування з водою або перекристалізацією. У додатковому варіанті здійснення сполуки (III) одержують (i) готуванням сполуки (I), де Y означає OH, як уже зазначене вище; (ii-1) перетворенням сполуки (I) до ангідриду (VI), 35 Z O H3CO O 1 Z (VI) N O 40 (ii-2) реакцією ангідриду (VI) з амінокарбонітрилом (IX), 4 5 H2N-CR R -CN (IX) 4 5 де R і R є такими, як у формулі (III), до одержання амідонітрильної сполуки (X), 8 UA 101712 C2 Z 6 COOR H3CO 1 Z (X) O 4 R N HN CN 5 R 4 5 6 де R , R і R є такими, як у формулі (III), (ii-3) гідролізом нітрильної групи в сполуці (X) до одержання аміду (VIII), Z 6 COOR H3CO 1 Z (VIII) O 4 R O N NH2 HN 5 5 10 15 20 25 30 35 40 R де символи мають такі ж значення як у формулі (III) і (ii-4) конденсуванням аміду (VIII) з одержанням гербіцидного імідазолінона (III). Одержання ангідриду (VI) може бути здійснене як описано вище. Амінокарбонітрили (IX), які застосовуються на стадії (ii-2), комерційно доступні або можуть бути одержані способами відомими в рівні техніки. В основному застосовуються 0.8-1.2 еквівалентів амінонітрилу (IX) на еквівалент сполуки (VI), переважно 0.95-1.1. Реакцію проводять у розчиннику, який переважно обраний з ароматичних вуглеводнів, переважно толуолу, мезителенів, хлорованих ароматичних вуглеводнів, таких як хлорбензол, дихлорбензол, хлорованих вуглеводнів, таких як 1.2-дихлоретан, дихлорметан, оцтова кислота, і їх сумішей. Якщо оцтова кислота застосовується не як основний розчинник, вигідне додавання 0.5-4 еквівалентів, переважно 1-3 еквівалентів (у перерахуванні на сполуку (I)). Додаткові вигідні добавки, які поліпшують селективність реакції розкриття циклу (2 на противагу 3 положенню), перераховано в EP-A 0 144 555, і включають піридин, 4-піколін, 2-піколін і хінолін. Реакцію в основному проводять в інтервалі температури від близько 40 до близько 120 °C, переважно від близько 60 до близько 100 °C. Час реакції в основному становить від близько 1 до близько 3 год. У переважному варіанті здійснення ангідрид (VI) розчиняють у розчиннику і доводять до температури реакції, і поступово додають амінонітрил (IX). Після завершення реакції і охолодження, нітрильна сполука (X) може бути виділена стандартними способами. У переважному варіанті здійснення, незважаючи на це, сполуки (X) не виділяють, а безпосередньо застосовують реакційну суміш у наступній стадії гідролізації нітрилу (стадія iv-3). При звичайному способі додають невеликий надлишок (наприклад, 1.1-1.5 еквівалентів у перерахуванні на (X)) сильної мінеральної кислоти, переважно сірчаної кислоти (переважно в концентрації 30-98 %) і води (наприклад, 2-10 еквівалентів) при температурі, яка в основному перебуває в діапазоні близько 30-120 °C, переважно 50-90 °C. Суміш додатково перемішують до повного перетворення. Час реакції в основному становить від 1 до 8 год., переважно 1-5 год. Обробка і виділення можуть бути досягнуті стандартними способами, такими як водним розчином (наприклад, у вигляді її солі амонію). У переважному варіанті здійснення реакційну суміш відразу застосовують у наступній стадії конденсації (ii-4). В альтернативному варіанті здійснення гідроліз нітрильной групи проводиться реакцією з водним NaOH/H2O2 як розкрито, наприклад, в EP-A 0 144 595 і US 4,518,780. Конденсація амідосполуки (VIII) до гербіцидного імідазолінона може здійснюватися як описано вище. Усі з вищеописаних способів особливо переважні для одержання сполуки формули (III), де Z 1 6 4 і Z означають H, R означає H, R означає CH3 і R5 означає CH(CH3)2, тобто імазамокс. Винахід ілюструється наступними прикладами, не обмежуючи його в такий спосіб. Приклади 9 UA 101712 C2 Порівняльний Приклад 1 Одержання 5-(метоксиметил)-2,3-піридиндикарбонової кислоти (згідно пр. 3 EP-A 0 548 532) + Br (CH3)3N -CH2 CO2CH3 1. CH3ONa, CH3OCH2 COOH CH3OH N CO2CH3 N 2. NaOH, H2O 3. H2SO4 COOH 5 10 15 20 Суміш 25 % метоксиду натрію в метанолі (270 г, 1.25 моль) і [(5,6-дикарбокси-3-піридил)метил]триметиламоній броміду, диметилового складного ефіру (Ia) (347 г, 1.00 моль) у метанолі (650 мол) нагрівали при кип'ятінні в колбі зі зворотним холодильником протягом 1 години в атмосфері азоту. Додавали воду (1 л) і гідроксид натрію (80.0 г, 2.0 моль) і реакційну суміш дистилювали доти, поки колба не досягала 100-105 °C. Реакційну суміш прохолоджували до кімнатної температури, обробляли сірчаною кислотою для регулювання pH до величини від 1.5 до 2 і фільтрували з одержанням твердого осаду. Твердий осад промивали водою і сушили у вакуум-сушильній шафі до одержання названого продукту у вигляді білої твердої речовини (т.пл. 161-162 °C), яка має чистоту більше, чим 99 %, визначену аналізом ВЕРХ. Вода не присутня на першій стадії реакції (метоксилування 5-метильної групи), яка вимагає трудомісткого висушування або способу виділення твердої речовини для вихідного матеріалу. Таким чином спосіб є менш підходящим для промислового застосування. Порівняльний Приклад 2 Одержання 5-(метоксиметил)піридин-2,3-дикарбоксилату динатрію з [5,6-(дикарбоксилат-3піридил)метил]триметиламоній броміду динатрію (згідно пр. 3 EP-A 0 747 360) + NaOOC NaOOC 25 30 35 40 45 N Br N NaOCH3 CH3OH 120°C, P OCH3 NaOOC NaOOC N Суміш [(5,6-дикарбоксилат-3-піридил)метил]триметиламоній броміду динатрію (5.0 г, 13.8 ммоль) і 25 % мас./мас. розчину метоксиду натрію в метанолі (4.46 г, 20.7 ммоль NaOCH 3) в 75 г метанолу нагрівали при 120 °C протягом 21 години в реакторі високого тиску. Реакцію прохолоджували до кімнатної температури, обробляли водою і концентрували до кінцевої маси 55.03 г. 5.0 г зразок аналізували аналізом РХ (30 % CH3CN, 0.77 M H3PO4). Залишок реакційного розчину випарювали досуха, щоб одержати твердий залишок, що визначається ЯМР аналізом. Незважаючи на більш високу температуру час реакції значно більш тривалий, ніж в способі винаходу. Приклад 1 Одержання 5-(метоксиметил)-2,3-піридиндикарбонової кислоти Бромід (ІІа), (0.41 моль), що містить близько 40 мас. % води, розчиняли в метанолі. Додавали водний NaOH протягом 30 хв. При 35 °C, і суміш перемішували протягом ще 15 хв. NaOCH3 у метанолі додавали протягом 20 хв при 45 °C. Реакційну суміш переносили в реактор високого тиску Парра і нагрівали до температури реакції (80-100 °C). При близько 60 °C реактор закривали, після чого тиск росте, досягаючи близько 40-45 Psi (фунт на квадратний дюйм) при температурі реакції. Зовнішній тиск не здійснюється. Після 6-8 год., суміш прохолоджували і обробку проводили згідно з відомими способами. Наприклад, реакційну суміш прохолоджували до кімнатної температури, обробляли сірчаною кислотою для регулювання pH до величини від 1.5 до 2 і фільтрували до одержання твердого осаду. Твердий осад промивали водою і сушили у вакуум-сушильній шафі до одержання названого продукту у вигляді білої твердої речовини (т.пл. 161-162 °C), яка має чистоту більше, чим 99 %, визначену аналізом ВЕРХ. Подібним способом були виконані приклади 2-17, показані в Таблиці 1. 10 UA 101712 C2 Таблиця 1 пр. Температура [°C] 2 3 4 5 6 7 8 9 10 11 * 12 * 13 14 15 16 17 100 100 100 90 80 100 100 100 100 100 100 100 100 100 100 100 Тиск [бар] % H2О Молярне Молярне Масове Час після відношення відношення відношення реакції додавання NaOMe NaOH MeOH [год.] NaOH 2.76-3.45 2.76-3.45 2.76-3.45 1.38-2.07 1.03-1.38 2.76-3.45 2.76-3.45 2.76-3.45 2.76-3.45 2.76-3.45 2.76-3.45 2.76-3.45 2.76-3.45 2.76-3.45 2.76-3.45 2.76-3.45 48 42 61 48 48 55 56 43 43 51 50 51 42 40 40 37 3 5 5 5 5 2 1 1.5 2 1.5 2 1.5 1.5 1.5 1.5 1.5 0 0 0 0 0 3 4 4 4 3 2.5 1 3 3 3 3 3 3 3 5 3 5 5 5 5 5 5 6 3 3 3 2 8.75 8 8 8 8 8 8 8 8 8 8 8 5.5 6.75 8 8 Перетворення [%] 99.6 98.4 95.2 91.9 81.8 87.5 92.4 99.7 100 100 99.5 80.0 85.0 94.0 99.8 99.9 * NaOH доданий до (II) перед видаленням H2O під вакуумом. Додають MeOH, потім розділяють (II), розщеплений в 2. NaOMe додають безпосередньо перед рухом високого темпу/тиску Парра. 5 10 Можна помітити, що більш високі температури і більш тривалий час реакції поліпшують ступінь перетворення. Крім того, перетворення збільшується додаванням більшої кількості основи. Спосіб винаходу може бути виконаний у присутності більшої кількості води в порівнянні з Порівняльними Прикладами. Приклад 18 Синтез [(5,6-дикарбокси-3-піридил)метил] триметиламоній броміду, диметилефіру (ІІа) a) Синтез диметил 5-(бромметил)-2,3-піридиндикарбоксилату (Va) (50 % перетворення) H3C COOCH3 COOCH3 Br Br2 N N COOCH3 (IVa) 15 20 218.4 г (1.0 моль) сполуки (Va) розчиняли в 1139.0 г 1,2-дихлоретану (EDC) і додавали 160.0 г води і нагрівали до 72 °C (близько 1-2 °C нижче дефлегмірування). 14.4 г (0.075 моль) 2,2’азобіс(2-метилбутиронітрилу) (Vazo 67) в 160.0 г EDC додавали протягом 2 год. при 72 °C. Через 30 хвилин 143.8 г (0.9 моль) брому додавали протягом 2 год., при регулюванні pH (pH 5-7) за допомогою дозування близько 375.0 г водного NaOH (15 %). Суміш перемішували 1 год. для завершення реакції (аналіз ВЕРХ). Після охолодження до 40 °C фази були розділені. b) Синтез сполуки (ІІа) COOCH3 Br N (IIIa) 25 COOCH3 (Va) COOCH3 N + Br (CH3)3N COOCH3 N COOCH3 (IIa) Завантажували 288.1 г (1.0 моль) сполуки (IIIa) у суміші з ди- і трибромірованими побічними продуктами в 3359.0 г EDC (органічна фаза зі стадії a, що включає непрореаговану сполуку (ІІа) і вищі броміровані побічні продукти). Суміш нагрівали до 30 °C і ємність вакуумували до 200 мбар. 11 UA 101712 C2 5 10 15 70.9 г (1.2 моль) триметиламіну (TMA) додавали до газової фази протягом 2 год. при 40 °C (закрита система). Суміш перемішували одну додаткову годину (ВЕРХ контроль перетворення: сполуки (IIIa) у розчині < 0.1 %). Надлишок TMA відганяли разом з EDC (маса: 40 % маси EDC), переміщеним на стадію 2 (1344 г) при 50-55 °C (370-250 мбар). Величина pH дистиляту була 95 % (як визначено за допомогою ВЕРХ). ФОРМУЛА ВИНАХОДУ 1. Спосіб виробництва 2,3-дизаміщеного-5-метоксиметилпіридину формули (І) Z COY H3CO 20 25 Z1 N COY , (I) де Z означає Н або галоген; 1 Z означає Н, галоген, CN або NO2; Y означає ОМ, і М означає лужний метал або лужноземельний метал, що включає стадії: (і) реакція сполуки формули (II) Z Br Q+H2C Z1 O C Y2 N C Y1 O 30 35 40 45 , (ІІ) де Q означає третинний аліфатичний або циклічний, насичений, частково ненасичений або ароматичний амін; Z означає Н або галоген; 1 Z означає Н, галоген, CN або NO2; 1 2 1 1 2 1 2 Y і Y кожний незалежно означають OR , NR R , або, коли взяті разом, Y Y означає 3 -О-, -S- або -NR -; 1 2 R і R кожний незалежно означають Н, С1-С4алкіл, необов'язково заміщений С1-С4алкоксигрупою або фенілом, необов'язково заміщеним від одної до трьох С1-С4алкільними групами, С1С4алкоксигрупами або атомами галогену, або феніл, необов'язково заміщений від одної до трьох С1-С4алкільними групами, С1С4алкоксигрупами або атомами галогену; 3 R означає Н або С1-С4алкіл, в суміші метанол/Н2О, що включає щонайменше 20 мас. % Н2О в перерахунку на сумарну кількість води і броміду (II), з основою, що містить МОСН3 і/або МОН, де М означає лужний метал або лужноземельний метал, під тиском в закритій ємності при температурі від 75 до 110 °C. 2. Спосіб за п. 1, що включає стадії: 12 UA 101712 C2 (і-1) реакція сполуки формули (IV) Z O H3C C Y1 Z1 C Y2 N O , (IV) в якій Y , Y не є ОН і символи в інших випадках мають значення дані в формулі (II) в п. 1, з бромом в присутності радикального ініціатора в суміші розчинників, що містить водну фазу і органічну фазу, де органічна фаза включає розчинник, вибраний з 1,2-дихлоретану, хлорбензолу, 1,2-дихлорбензолу, 1,3-дихлорбензолу, 1,4-дихлорбензолу і тетрахлорметану, і де величина рН водної фази становить від 3 до
ДивитисяДодаткова інформація
Назва патенту англійськоюNormal;heading 1;heading 2;heading 3;process for manufacturing substituted 5-methoxymethylpyridine-2,3-dicarboxylic acid derivatives
Автори англійськоюCortes, David
Назва патенту російськоюСпособ производства производных замещенной метоксиметилпиридин-2,3-дикарбоновой кислоты
Автори російськоюКортес Девид
МПК / Мітки
МПК: C07D 213/80
Мітки: 5-метоксиметилпіридин-2,3-дикарбонової, заміщеної, похідних, кислоти, спосіб, виробництва
Код посилання
<a href="https://ua.patents.su/17-101712-sposib-virobnictva-pokhidnikh-zamishheno-5-metoksimetilpiridin-23-dikarbonovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Спосіб виробництва похідних заміщеної 5-метоксиметилпіридин-2,3-дикарбонової кислоти</a>
Попередній патент: Двопотокова муфта зчеплення
Наступний патент: Двигун змінного струму
Випадковий патент: Вібровідцентрова машина для очищення рідкої сировини












