Способи одержання похідних 2-(6-заміщеної-1,3-діоксан-4-іл)оцтової кислоти, ці похідні та проміжна сполука
Номер патенту: 77944
Опубліковано: 15.02.2007
Автори: Куістра Якоб Германус Маттеус Херо, Мінк Даніел, Сігерс Хубертус Йозефус Марія, Мулдерс Йоаннес Марія Корнеліс Антоніус
Формула / Реферат
1. Спосіб одержання похідних 2-(6-заміщеної-1,3-діоксан-4-іл)оцтової кислоти формули 1
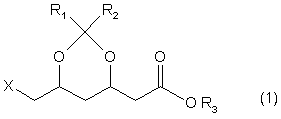 ,
,
де Х означає відхідну групу, a R1, R2 та R3 кожен незалежно означає алкільну групу з 1-3 атомами вуглецю, з вихідної сполуки формули 2
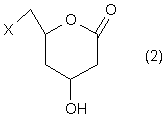 ,
,
де X має вищевказане значення,
з використанням придатного ацетилюючого агента в присутності кислотного каталізатора.
2. Спосіб за п. 1, який відрізняється тим, що Х означає С1.
3. Спосіб за пп. 1 або 2, який відрізняється тим, що R1=R2=R3=CH3.
4. Спосіб одержання похідних 2-(6-заміщеної-1,3-діоксан-4-іл)оцтової кислоти формули 3
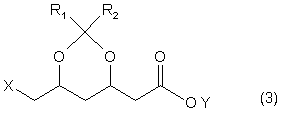 ,
,
де X, R1 та R2 мають вищевказані значення, a Y означає водень, лужний метал, лужноземельний метал або заміщену або незаміщену амонієву групу, який відрізняється тим, що одержані за пп. 1-3 сполуки формули 1 гідролізують у присутності основи та води.
5. Спосіб за п. 4, який відрізняється тим, що Y означає Na, Ca або тетраалкіламоній.
6. Спосіб за п. 4, який відрізняється тим, що Y=H.
7. Спосіб за будь-яким з пп. 4-6, який відрізняється тим, що похідні 2-(6-заміщеної-1,3-діоксан-4-іл)оцтової кислоти формули 3 одержують з енантіомерним і діастереомерним 4R,6S надлишками, разом вищими за 99 %.
8. Спосіб одержування складного ефіру формули 1а
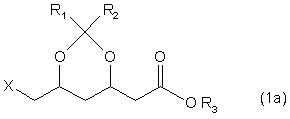 ,
,
де R3 - трет-бутил, X означає відхідну групу, a R1 та R2 кожен незалежно означає алкільну групу з 1-3 атомами вуглецю, який відрізняється тим, що одержані за пп. 4-7 сполуки формули 3 піддають конверсії з одержанням активованої похідної кислоти, а потім проводять взаємодію зі спиртом в присутності основи.
9. Спосіб за п. 8, який відрізняється тим, що Х означає гідрокси.
10. Сполука формули 2 в (4R,6S)-формі
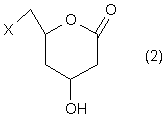 ,
,
де Х - галоген, тозилатна група, мезилатна група, ацилоксигрупа, арилоксизаміщена або нітрозаміщена бензолсульфонільна група.
11. Сполука за п. 10, яка відрізняється тим, що має форму частинок із співвідношенням довжина/діаметр від 1:1,5 до 1:6, переважно від 1:2 до 1:4, та довжиною від 0,05 до 2 мм, краще від 0,1 до 1 мм.
12. Сполука за пп. 10 або 11, яка відрізняється тим, що Х означає С1.
13. Похідна (4R,6S)-2-(6-заміщеної-1,3-діоксан-4-іл)оцтової кислоти формули 1
 ,
,
де X - тозилатна група, мезилатна група, ацилоксигрупа, арилоксизаміщена або нітрозаміщена бензолсульфонільна група,
R1, R2 і R3 кожен незалежно означає алкільну групу з 1-3 атомами вуглецю.
14. Похідна за п. 13, яка відрізняється тим, що R1, R2 і R3 означає СН3.
15. Похідна за пп. 13 або 14, яка відрізняється тим, що Х означає Сl.
16. Похідна (4R,6S)-2-(6-заміщеної-1,3-діоксан-4-іл)оцтової кислоти формули 3
 ,
,
де Х - тозилатна група, мезилатна група, ацилоксигрупа, арилоксизаміщена або нітрозаміщена бензолсульфонільна група,
R1, R2 кожен незалежно означає алкільну групу з 1-3 атомами вуглецю,
a Y означає лужний метал, лужноземельний метал або заміщену чи незаміщену амонієву групу.
17. Похідна за п. 16, яка відрізняється тим, що R1 та R2 означають СН3, Y - Na, Ca або тетраалкіламоній.
18. Похідна за пп. 16 або 17, яка відрізняється тим, що Х означає Сl.
Текст
1. Спосіб одержання похідних 2-(6-заміщеної1,3-діоксан-4-іл)оцтової кислоти формули 1 3 77944 4 R1, R2 і R 3 кожен незалежно означає алкільну груO пу з 1-3 атомами вуглецю. X 14. Похідна за п. 13, яка відрізняється тим, що (2) R1, R2 і R3 означає СН3. 15. Похідна за пп. 13 або 14, яка відрізняється тим, що Х означає Сl. OH , 16. Похідна (4R,6S)-2-(6-заміщеної-1,3-діоксан-4де Х - галоген, тозилатна група, мезилатна група, іл)оцтової кислоти формули 3 ацилоксигрупа, арилоксизаміщена або нітрозаміR1 R2 щена бензолсульфонільна група. 11. Сполука за п. 10, яка відрізняється тим, що O O O має форму частинок із співвідношенням довжина/діаметр від 1:1,5 до 1:6, переважно від 1:2 до X 1:4, та довжиною від 0,05 до 2 мм, краще від 0,1 до (3) OY , 1 мм. де Х - тозилатна група, мезилатна група, ацилок12. Сполука за пп. 10 або 11, яка відрізняється сигрупа, арилоксизаміщена або нітрозаміщена тим, що Х означає С1. бензолсульфонільна група, 13. Похідна (4R,6S)-2-(6-заміщеної-1,3-діоксан-4R1, R2 кожен незалежно означає алкільну груп у з іл)оцтової кислоти формули 1 1-3 атомами вуглецю, R1 R2 a Y означає лужний метал, лужноземельний метал або заміщену чи незаміщену амонієву груп у. O O O 17. Похідна за п. 16, яка відрізняється тим, що R1 та R2 означають СН 3, Y - Na, Ca або тетраалкілаX моній. (1) O R3 18. Похідна за пп. 16 або 17, яка відрізняється , де X - тозилатна група, мезилатна група, ацилоктим, що Х означає Сl. сигрупа, арилоксизаміщена або нітрозаміщена бензолсульфонільна група, O Винахід відноситься до способу одержання похідної 2-(6-заміщеної-1,3-діоксан-4-іл)оцтової кислоти формули 1 де X означає залишаючу гр упу R1 R 2 і R3, кожна, незалежно означає алкільну груп у з від 1 до 3 атомів вуглецю, використовуючи в якості вихідної сполуки формулу 2 де X має значення таке, як вказано вище, використовують придатний ацетилюючий агент, в присутності кислотного каталізатора. Винахід також відноситься до нових сполук формули 1, як і до солей і до кислот формули 3, які з них можуть бути одержані де R1 і R2 мають вказані вище значення і де Υ означає лужний (лужноземельний) метал або заміщену або незаміщену амонієву груп у або означає водень. Знайдено, що похідні 2-(6-заміщеної-1,3діоксан-4-іл)оцтової кислоти можуть бути селективно і з високим виходом одержані з відповідної сполуки формули (2), виявилося можливим одержати ці продукти, що відносно мало стабільні, у м'яких умовах. Це тим більше цікаво, оскільки це забезпечує простий шлях через відповідну сіль, відповідний трет-бутиловий складний ефір і 2гідроксиметил-заміщена сполука в якості проміжних сполук, одержання інгібіторів HMG-CoA редуктази. При бажанні конверсія проходить (в залежності від вибраних умов реакції) через проміжну сіль або складний ефір із розкриттям кільця в сполуці відповідно до формули (2). Додатковою перевагою способу за винаходом є те, що вихідна сполука формули (2) і продукти формули 3 є кристалічними сполуками. Це вигідно при одержанні продуктів із (хімічною або стереохімічною) високою чистотою. Це важливо особливо з погляду передбачуваного фармацевтичного застосування. Для можливого застосування особливо важливі похідні (4R, 5S)-2-(6-заміщеної-1,3діоксан-4-іл)оцтової кислоти. Вони можуть бути одержані з відповідної 6-заміщеної-2,4,6тридіокси-D-еритрогексози. Отже, винахід також відноситься до вихідних сполук формули 1, особливо, в яких Х = і до часток таких сполук. ОсобСl ливо більше, ніж 90% ваг. цих часток має відношення довжина/діаметр від 1:1,5 до 1:6, 5 77944 6 переважно від 1:2 до 1:4,4 і довжина часток від дає від 1:1 до 0,001:1, особливо від 0,01:1 до 0,05 до 2мм, особливо від 0,1 до 1мм. Винахід та0,05:1. кож відноситься до таких часток. Сполука формуОдержані похідні 2-(6-заміщеної-1,3-діоксан-4ли II дає прозорі кристалічні частки з чіткою точкою іл)оцтової кислоти можуть бути в подальшому гідплавлення 73-74°С. Продукти формули 3, одержаролізовані в присутності основи і води для одерні з похідних (4R, 6S)-2-(6-заміщеної-1,3-діоксан-4жання відповідної солі формули 3 іл)оцтової кислоти формули 1 можуть бути одержані відповідно до винаходу з енантіомерним надлишком (е.н.) більше, ніж 95%, особливо більше 99,5% і з діастереомерним надлишком (д.н.) більше, ніж 90%, особливо більше, ніж 99,5%. Прикладами придатних ви хідних груп X, що де Υ означає лужний метал, лужноземельний можуть застосовуватися у способі відповідно до метал або заміщену, або незаміщену амонієву винаходу, є галогени, особливо СІ, Вг або І; тозигруп у, переважно Na, Са або тетраалкіламонієву латні групи; мезилатні групи; ацилоксигрупи, особсполуку. Необов'язково, гідроліз може привести до ливо ацетокси- і бензоілоксигрупи; арілокси-, осоконверсії утвореної солі до оцтової кислоти форбливо бензилоксиабо нітро-заміщена мули 3, у якої Y=H. бензолсульфонільна група. З практичної точки Гідроліз сполуки формули (3) переважно прозору переважно в якості залишаючої групи вибиводять, принаймні, 1 еквівалентом основи, особрають СІ. ливо з від 1 до 1,5 еквівалентами основи, стосовно Групи R1, R2 і Я3, кожна, незалежно означає сполуки формули (3). В принципі може використоалкільну гр упу з від 1 до 3 атомів вуглецю, перевуватися значний надлишок, але на практиці це важно метил або етил. На практиці найбільш пезвичайно не дає ніяких переваг. реважно R1=R2=R3=метилу. Реакцію переважно проводять при температуПрикладами придатних ацетилюючих агентів, рі від -20°С до 60°С, особливо від 0°С до 30°С. що можуть застосовуватися в способі відповідно Гідроліз, наприклад, може проводитися у воді, до винаходу, є діалкоксипропанові сполуки з алкоорганічному розчиннику, наприклад, у спирті, осоксигрупами, кожна з яких переважно має від 1 до 3 бливо метанолі або етанолі, ароматичному вуглеатомів вуглецю, наприклад, 2,2-диметоксипропан водні, наприклад толуолі або кетонах, особливо або 2,2-діетоксипропан; алкоксипропен, з алкоксиацетоні або метилізобутилкетоні (МІБК) або в сугрупою, що має переважно від 1 до 3 атомів вугміші органічного розчинника і води, при бажанні, лецю, наприклад, 2-метоксипропен або 2прискорений каталізатором фазового переносу етоксипропен, переважно 2,2-диметоксипропан. або додаванням співрозчинника. Він може бути, при бажанні, утворений in situ з Гідроліз також може проводитися ферментаацетону і метанолу, переважно з видаленням вотивно, за допомогою, при бажанні, селективного ди. гідролізу заданого діастереомера. У якості кислотного каталізатора, що викорисПрикладами ферментів, що можуть використовується, можуть використовуватися кислотні товуватися в способі відповідно до винаходу є каталізатори, відомі для реакцій ацетилювання, ферменти з ліпазною або екстеразною активністю, переважно ненуклеофільні сильні кислоти, напринаприклад ферменти з Pseudomonas, особливо клад, сульфонові кислоти, особливо, пPseudomonas fluorescens, Pseudomonas fragi; толуолсульфонова кислота, метансульфонова Burkholderia, наприклад, Burkholderia cepacia; кислота, камфорна сульфонова кислота; неорганіChrombacterium, особливо Chrombacterium чні кислоти з ненуклеофільним аніоном, наприviscosum; Bacillus, особливо Bacillus клад, сірчана кислота, фосфорна кислота: кислотthermocatenulatus, Bacillus licheniformis; ні іонообмінники, наприклад, DOWEX; або тверді Alcaligenes, особливо Alcaligenes faecalis; кислоти, наприклад, так звані, гетерополікислоти. Aspergillus, особливо Aspergillus niger, Candida, Ацетилювання може проводитися без викориособливо Candida antarctica, Candida rugosa, стання окремого розчинника, якщо бажано, реакCandida lipolytica, Candida cylindracea; Geotrichum, ція також може проводитися в органічному розособливо Geotrichum candidum; Humicola, особличиннику. Прикладами придатних органічних во Humicola lanuginosa; Penicillum особливо розчинників є кетони, особливо ацетон, вуглеводPenicillum cyclopium, Penicillum roquefortii, ні, особливо ароматичні вуглеводні, наприклад, Penicillum camembertii; Rhizomucor особливо толуол, хлоровані вуглеводні, наприклад, метиRhizomucor javanicus, Rhizomucor miehei; Mucor ленхлорид. особливо Mucor javanicus; Rhizopus, особливо Температура, при якій проводиться реакція Rhizopus oryzae, Rhizopus arhizus, Rhizopus ацеталізації, переважно складає від -20°С до 60°С, delemar, Rhizopus niveus, Rhizopus japonicus, особливо від 0°С до 30°С. Реакція ацетилювання Rhizopus javanicus; ліпаза свинячої підшлункової переважно проводиться в інертній атмосфері. залози, ліпаза проростку пшениці, ліпаза підшлунМолярне відношення ацетилюючого агенту, до кової залози корови, естераза печінки поросяти. вихідної сполуки формули (2), переважно складає Переважно використовують фермент із від 1:1 до 20:1, особливо від 3:1 до 5:1. При викоPseudomonas cepacia, Pseudomonas sp., ристанні органічного розчинника молярне відноBurkholderia cepacia, свинячої підшлункової залошення переважно складає від 1:1 до 2:1. зи, Rhizomucor miehei, Humicola lanuginosam Молярне відношення кислотного каталізатора Candida rugorsa або Candida antractica або субстідо вихідної сполуки формули (2) переважно скла 7 77944 8 ліну. Якщо використовують енантіоселективний метилморфоліну (NMM) [Bull. Chem. Soc. Japan 52 фермент, при гідролізі реалізується додаткове (7) 1989 (1979)]; енантіомерне збагачення. Такі ферменти можуть - реакція солі з ди-трет-бутилдикарбонатом, бути одержані відомими способами. Багато ферДМАП і трет-бутанолом [Synthesis 1063 (1994)]; ментів виготовляють у промисловому масштабі, і - реакція кислоти з ціанурхлоридом і піридивони є комерційно доступними. ном або триетиламіном [Org Process R&D 3,172 Ці одержані солі (кислоти) є новими. Винахід, (1999); Heterocycles 31 11, 2055 (1990)]. таким чином, відноситься до цих продуктів формуОдержаний трет-бутиловий складний ефір 2ли 3 (6-заміщеної-1,3-діоксан-4-іл)оцтової кислоти може бути потім перетворений у 2-(6-гідроксиметил-1,3діоксан-4-іл)оцтову кислоту, наприклад, як описано в US-A-5594153 або в ЕР-А-1024139, в присутності тетраалкіламонійгалогеніду і/або карбонової кислоти у вигляді солі, шля хом перетворення в сполуку формули 1а з R3, який являє собою третбутил і X являє собою ацилокси, наприклад, ацеде X означає галоген, особливо, СІ, Вг токсигрупу. Ацилоксигрупу потім можна перетвоабо І, тозілатну або мезілатну групу, ацилоксигрурити за допомогою сольволіза добре відомим спопу з від 3 до 10 атомів вуглецю або нітрозаміщену собом у гідроксигрупу. Сольволіз може бензолсульфонову гр упи і Υ означає Н, лужний проводитися при використанні основи (Nа2СО3, (лужноземельний) метал або заміщену або незаК2СО3 або натрій метанолат у метанолі), при баміщену амонієву груп у. жанні, одночасним перегоном утвореного метилОтримана сіль формули 3 може бути потім пеацетату. ретворена у відповідний трет-бутиловий складний Трет-бутиловий складний ефір 2-(6-заміщеноїефір (формула 1а з К3=трет-бутил ) відомим спо1,3-діоксан-4-іл)оцтової кислоти являє собою цісобом. льовий проміжний продукт при одержанні різних статинів, наприклад, ZD-4522, як описано в [Drugs of the future, (1999), 24(5), 511-513 Μ. Watanabe et al., Bioorg. & Med. Chem. (1997), 5(2), 437-444]. Отже, винахід забезпечує новий, цікавий шлях до цих проміжних продуктів і кінцевих продуктів, особливо, до статинів. У способі відповідно до винаходу сполука Вихідні сполуки формули 2 можуть бути, наформули (3) може бути, наприклад, етерифікована приклад, одержані як описано в WO-A-96/31615. з утворенням відповідного трет-бутилового складВинахід буде пояснено відносно наступних ного ефіру, при використанні таких способів, що прикладів, який, однак, не обмежуються ними. взагалі описані в літературі: Приклад І - реакція з ізобутеном і сильною кислотою, наОдержання (4R, 6S)-4-гідрокси-6-хлорметилприклад, паратолуолсульфоновою кислотою (pTs), тетрагідропіран-2-ону (сполука II, що входить до сірчаною кислотою або сильним кислотним іоноформули 2) обмінником (US-A-3325466); До суміші 6,7г (40ммоль) 6-хлор-2,4,6- реакція хлориду кислоти і трет-бутанолу, при тридіокси-D-еритрогексози (сполука І; отримана дії основи, наприклад, тріетиламіна (Et3N), димевідповідно до способу, описаному в WO-Aтиламінопіридина (ДМАП). Хлорид кислоти може 96/31615) і 6,7г натрійбікарбонату в 40мл метибути отриманий за допомогою, наприклад, SOCI2, ленхлориду і 10мл води при кімнатній температурі POCI3, (СОСl)2, і каталізований, наприклад, димепротягом 45 хвилин додавали 2,1мл брому. Газ тилформамідом (ДМФА) [J. Org. Chem. 35 2429 СО2 виділявся, при цьому рН залишався рівним 5. (1970)]; Після перемішування протягом однієї години, від- реакція хлориду кислоти з Li-третповідно до газорідинної хроматографії (ГРХ) відбутанолатом [Org. Synth. 51 96 (1971)]; бувалася повна конверсія початкового матеріалу. - переетерифікація з трет-бутилацетатом при Надлишок брому нейтралізували твердим впливі сильної кислоти [Z. Chem. 12(7) 264 1972)]; Na2S2O3. Після поділу фаз, водяну фазу екстрагу- реакція солі з трет-бутилбромідом, переважвали два рази 100мл етилацетату. Об'єднані органо в ДМФА, диметилацетаміді (DMAA), 1-метил-2нічні фази сушили над Na2SO4 і фільтрували. Піспіролідиноні (NMP) і при використанні каталізатора ля випарювання на роторному випарнику фазового переносу (КФП) [Tetr. Let. 34 (46) 7409 одержували 5,5г жовтої олії (82% вихід сполуки (1993)]; формули (2), де Х=Сl, стосовно сполуки І). - реакція кислоти з трет-бутанолом, 1,31 H ЯМР (200МГц, CDCl3): δ 1,8-2,1 (м, 2Н); 2,6дициклогексилкарбодиімідом (ДЦК) і ДМАП [Synth. 2,7 (м, 2Н); 3,5-3,8 (м, 2Н (СН2Сl); 4,4 (м, 1H); 4,9 Соmm. 9, 542 (1979)]; (м, 1Н). реакція кислоти з третПриклад II бутилтрихлорацетамідатом [Tetr. Let. 39 1557 Одержання (4R, 6S)-4-гідрокси-6-хлорметил(1998)]; тетрагідропіран-2-ону (сполука II, що входить до - реакція солі з карбоксилдиімідазолом (КДІ) і формули 2) трет-бутанолом; До 75г (450ммоль) сполуки І у 390мл води до- реакція кислоти з півалоілхлоридом і третдавали 114г (715ммоль) брому при температурі бутанолом при впливі ДМАП або N 9 77944 10 1 15-25°С на протязі 3 годин. рН реакційної суміші H ЯМР (200МГц, CDCl3/CD3OD): δ 1,21 (дт, підтримували при 5-6 за допомогою додавання 1Н); 1,36 (с, 3Н); 1,49 (с, 3Н); 1,79 (дт, 1Н); 2,25 натрійкарбонату (загальна кількість 88г). Надли(дд, 1Н); 2,45 (дд, 1Н); 3,46 (м, 2Н); 4,11 (м, 1Н); шок брому нейтралізували бісульфатом натрію. 4,36 (м, 1Н). Продукт екстрагували з водяної фази етилацетаПриклад VI том (протиточною екстракцією). Натрієва сіль (4R-цис)-(6-хлорметил)-2,2Продукт кристалізували з етилацетату/гептану диметил-1,3-діоксан-4-іл)оцтової кислоти (сполука (125г/62г). Після охолодження до 0°С кристали IV) відфільтровували, промивали 50мл гептаРозчин сполуки III у толуолі одержували, як ну/етилацетату (ваг.:ваг.=9:1) і сушили, з одерописано в прикладі IV, використовуючи 49,2г спожанням 49,2г (67% стосовно сполуки І) сполука II у луки І у якості вихідної. вигляді безбарвних голок (т.пл. 73-74°С). Додавали 5г метанолу і 25мл води. Додавали Приклад III 25г 50% розчину NaOH у воді по краплях при кімОдержання метилового складного ефіру (4Rнатній температурі протягом 1 години. цис)-6-(хлор метил)2,2-диметил-1,3-діоксан-4Після перемішування протягом 4 годин при кііл)оцтової кислоти (сполука III) мнатній температурі, ГРХ аналіз показав, що гід5,5г сполуки II, отриманої в прикладі І, додароліз пройшов цілком. вали при кімнатній температурі до 20мл комерційНадлишок основи нейтралізували до значень но доступного диметоксипропану і 100мг моногідрН від 8,5 до 9,5 33% розчином НСl у воді. Водяну рату п-толуолсуль фонової кислоти. Після фазу відокремлювали і сушили азеотропною переперемішування протягом однієї години при кімнатгонкою, використовуючи 470мл толуолу, із вихоній температурі, ГРХ аналіз показав, що відбулася дом 65г сполуки IV у вигляді 16% ваг./ваг. суспензії повна конверсія й утворився прозорий розчин. в толуолі з KF
ДивитисяДодаткова інформація
Назва патенту англійськоюProcesses for preparation of derivatives of 2-(6-substituted-1,3-dioxan-4-yl) acetic acid, these derivatives and intermediary compound
Назва патенту російськоюСпособы получения производных 2-(6-замещенной-1,3-диоксан-4-ил) уксусной кислоты, эти производные и промежуточное соединение
МПК / Мітки
МПК: C07B 61/00, C07D 319/00, C07D 309/30
Мітки: похідні, сполука, похідних, способи, 2-(6-заміщеної-1,3-діоксан-4-іл)оцтової, проміжна, кислоти, одержання
Код посилання
<a href="https://ua.patents.su/6-77944-sposobi-oderzhannya-pokhidnikh-2-6-zamishheno-13-dioksan-4-iloctovo-kisloti-ci-pokhidni-ta-promizhna-spoluka.html" target="_blank" rel="follow" title="База патентів України">Способи одержання похідних 2-(6-заміщеної-1,3-діоксан-4-іл)оцтової кислоти, ці похідні та проміжна сполука</a>
Попередній патент: Пристрій для ініціювання свердловинного заряду
Наступний патент: Спосіб одержання вінілхлориду, здатного полімеризуватися, з вихідного продукту, одержаного при піролізі 1,2-дихлоретану
Випадковий патент: Спосіб гідроксилювання a1 та a2-ланцюгів колагену людини першого типу в трансгенних рослинах










