Способи лікування із застосуванням ліпідних сполук
Номер патенту: 111475
Опубліковано: 10.05.2016
Автори: Ховланн Рагнар, Фрейзер Дейвід А., Ск'єрет Туре
Формула / Реферат
1. Спосіб лікування або профілактики щонайменше одного захворювання або хворобливого стану, вибраного з підвищеного рівня Аро В, гетерозиготної сімейної та несімейної первинної гіперхолестеринемії та первинної дисбеталіпопротеїнемії III типу за Фредриксоном, у суб'єкта, якому це необхідно, за яким зазначеному суб'єкту вводять фармацевтично ефективну кількість сполуки формули (І)
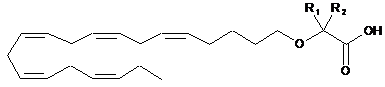 Формула (І)
Формула (І)
або її фармацевтично прийнятної солі або складного ефіру,
де R1 та R2 незалежно вибирають з атома водню або лінійних, розгалужених та/або циклічних С1-С6алкільних груп, за умови, що R1 та R2 обидва не являють собою водень.
2. Спосіб за п. 1, у якому сполука присутня у формі енантіомера, діастереомеру або їх суміші.
3. Спосіб за п. 1, у якому R1 та R2 вибирають з водню, метилу, етилу, н-пропілу та ізопропілу.
4. Спосіб за п. 2, у якому сполука присутня у її R-формі.
5. Спосіб за п. 2, у якому сполука присутня у її S-формі.
6. Спосіб за п. 2, у якому сполука присутня у формі рацемічної суміші.
7. Спосіб за п. 1, у якому R1 являє собою водень, a R2 являє собою етил і формула являє собою
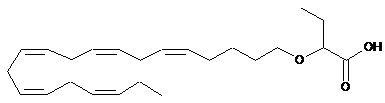 .
.
8. Спосіб за п. 7, у якому сполука присутня у її S- та/або R-формі, представленій формулами:
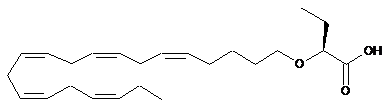
та
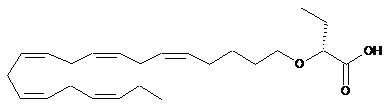 .
.
9. Спосіб за п. 1, у якому фармацевтично ефективна кількість сполуки формули (І) знаходиться в інтервалі від приблизно 5 мг до приблизно 3 г на дозу.
10. Спосіб за п. 1, у якому суб'єктом є людина.
11. Спосіб за п. 1, у якому сполуку вводять один раз на день.
12. Спосіб за п. 1, у якому сполука сформульована у вигляді фармацевтичної композиції для перорального введення.
13. Спосіб за п. 12, у якому фармацевтична композиція знаходиться у формі желатинової капсули або таблетки.
14. Спосіб за п. 13, у якому фармацевтична композиція додатково включає щонайменше один зв'язуючий агент, наповнювач, розріджувач або будь-які їх комбінації.
15. Спосіб за п. 12, у якому фармацевтична композиція додатково включає антиоксидант.
16. Спосіб за п. 15, у якому антиоксидант являє собою токоферол або ВНА.
17. Спосіб за п. 1, у якому щонайменше одне захворювання або хворобливий стан являє собою підвищений рівень Аро В.
18. Спосіб за п. 1, у якому щонайменше одне захворювання або хворобливий стан являє собою гетерозиготну сімейну та несімейну первинну гіперхолестеринемію та/або первинну дисбеталіпопротеїнемію III типу за Фредриксоном.
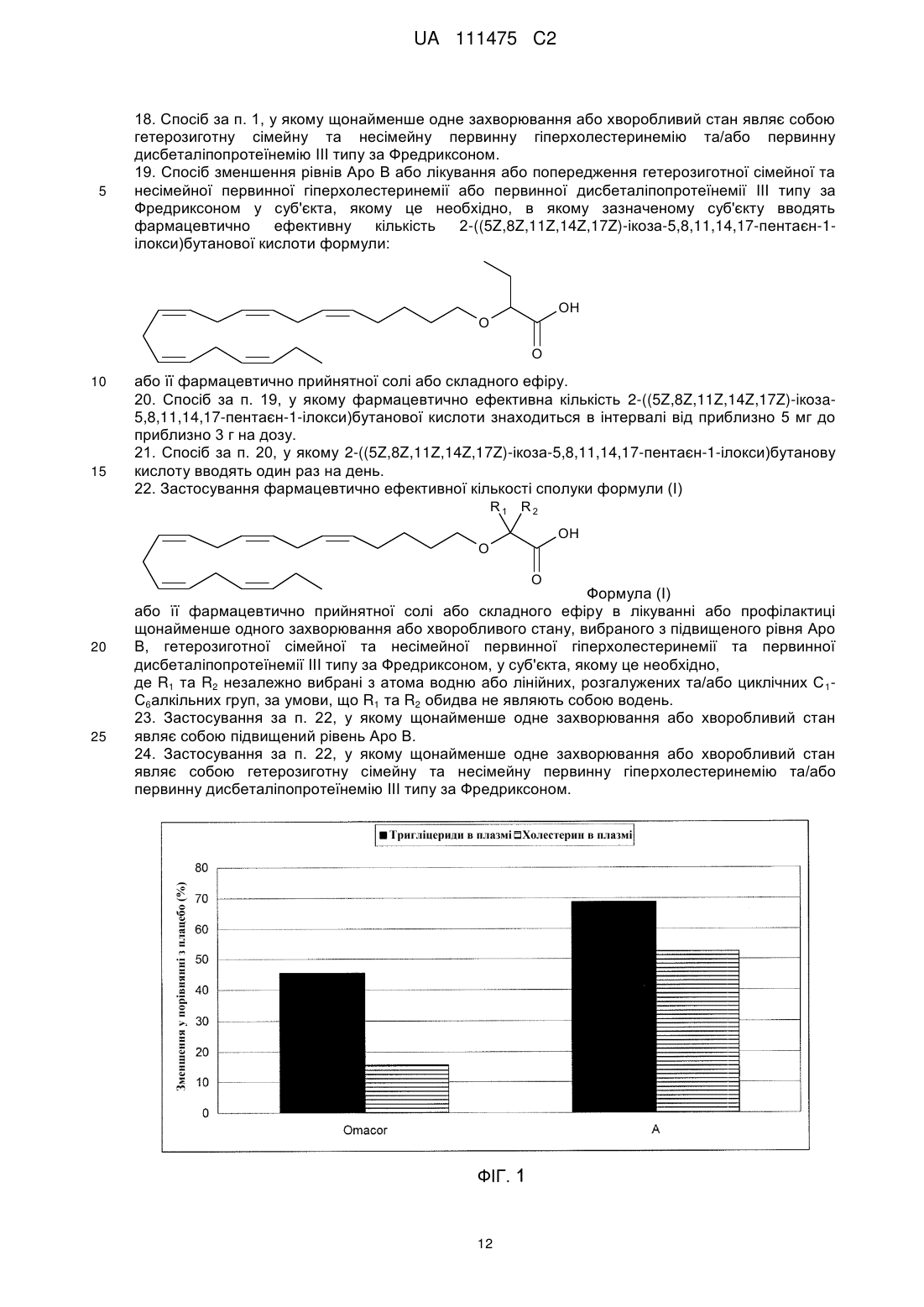
19. Спосіб зменшення рівнів Аро В або лікування або попередження гетерозиготної сімейної та несімейної первинної гіперхолестеринемії або первинної дисбеталіпопротеїнемії III типу за Фредриксоном у суб'єкта, якому це необхідно, в якому зазначеному суб'єкту вводять фармацевтично ефективну кількість 2-((5Z,8Z,11Ζ,14Ζ,17Z)-ікоза-5,8,11,14,17-пентаєн-1-ілокси)бутанової кислоти формули:

або її фармацевтично прийнятної солі або складного ефіру.
20. Спосіб за п. 19, у якому фармацевтично ефективна кількість 2-((5Z,8Z,11Z,14Z,17Z)-iкозa-5,8,l 1,14,17-пентаєн-1-ілокси)бутанової кислоти знаходиться в інтервалі від приблизно 5 мг до приблизно 3 г на дозу.
21. Спосіб за п. 20, у якому 2-((5Z,8Z,11Ζ,14Z,17Z)-ікоза-5,8,11,14,17-пентаєн-1-ілокси)бутанову кислоту вводять один раз на день.
22. Застосування фармацевтично ефективної кількості сполуки формули (І)
 Формула (І)
Формула (І)
або її фармацевтично прийнятної солі або складного ефіру в лікуванні або профілактиці щонайменше одного захворювання або хворобливого стану, вибраного з підвищеного рівня Аро В, гетерозиготної сімейної та несімейної первинної гіперхолестеринемії та первинної дисбеталіпопротеїнемії III типу за Фредриксоном, у суб'єкта, якому це необхідно,
де R1 та R2 незалежно вибрані з атома водню або лінійних, розгалужених та/або циклічних С1-С6алкільних груп, за умови, що R1 та R2 обидва не являють собою водень.
23. Застосування за п. 22, у якому щонайменше одне захворювання або хворобливий стан являє собою підвищений рівень Аро В.
24. Застосування за п. 22, у якому щонайменше одне захворювання або хворобливий стан являє собою гетерозиготну сімейну та несімейну первинну гіперхолестеринемію та/або первинну дисбеталіпопротеїнемію III типу за Фредриксоном.
Текст
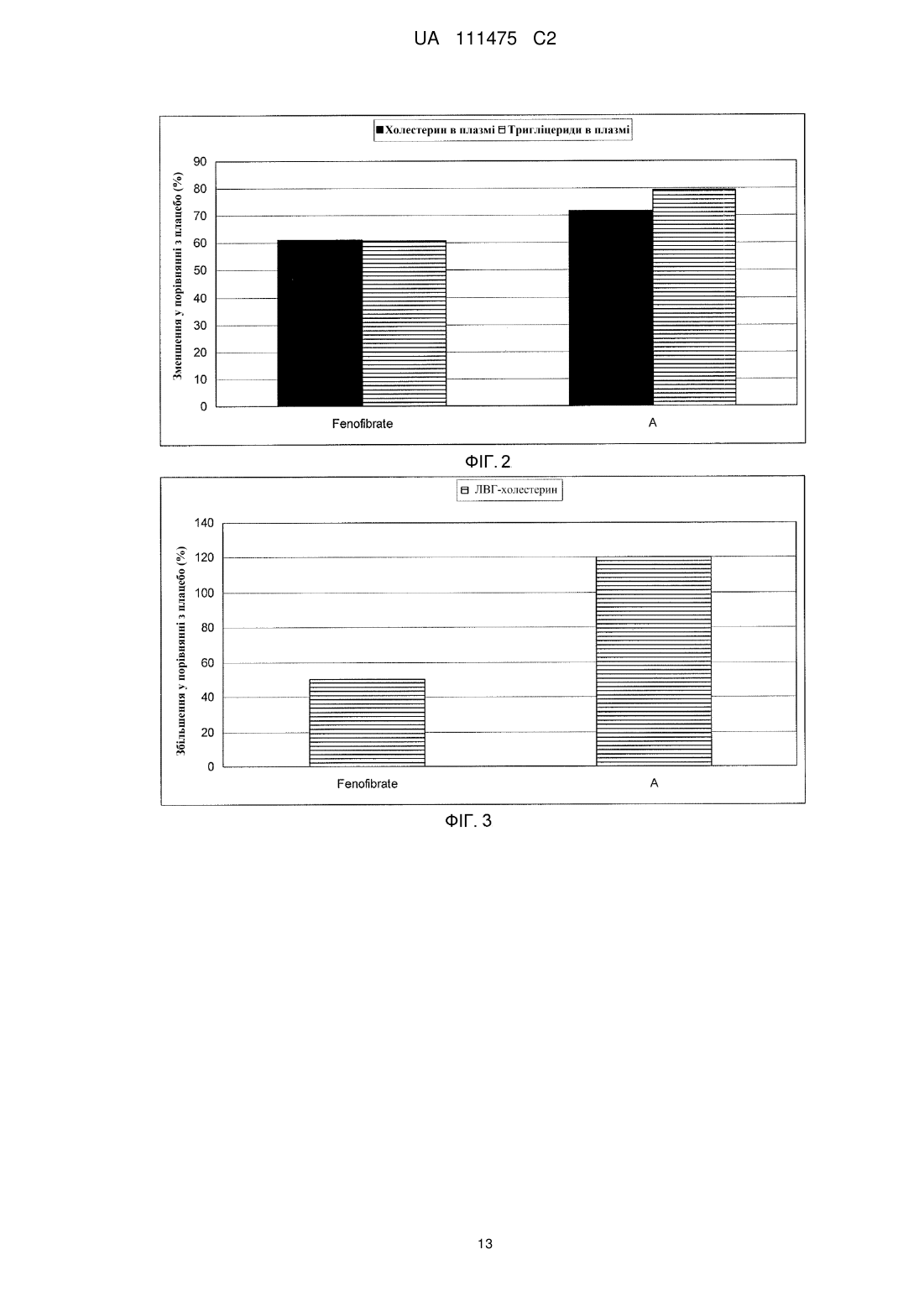
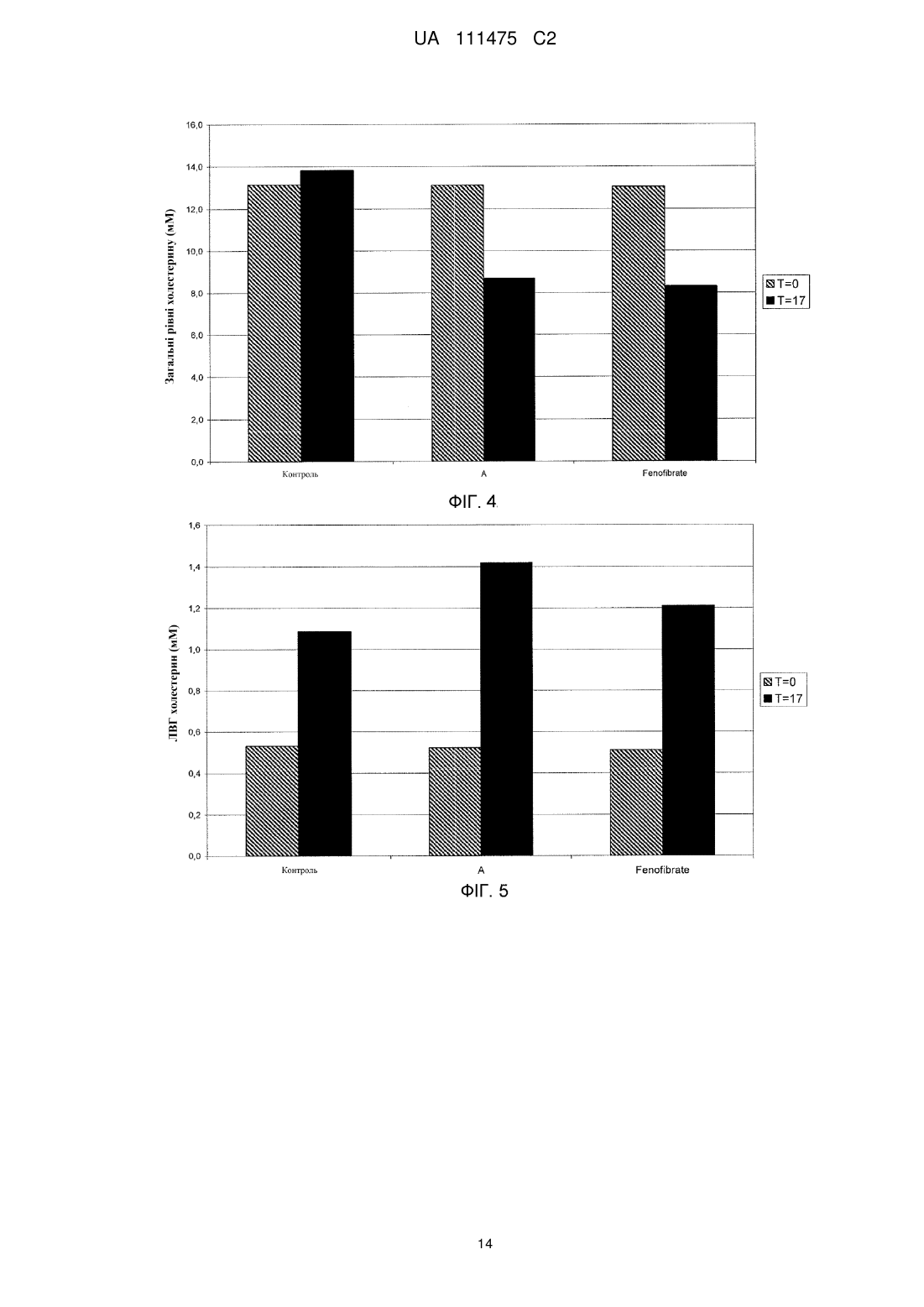
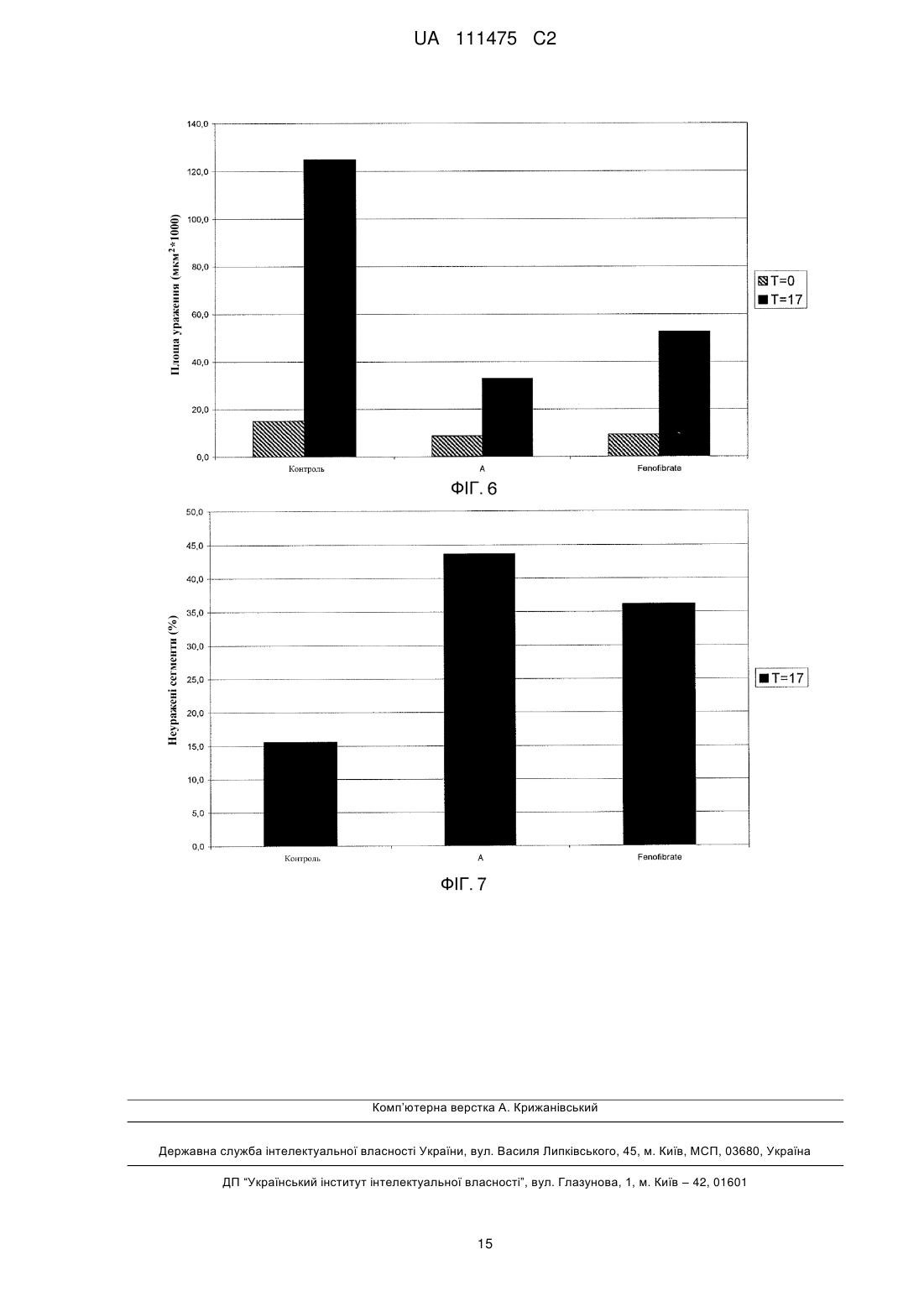
Реферат: Розкриті способи лікування або профілактики щонайменше одного захворювання або хворобливого стану у суб'єкта, якому це необхідно, які включають введення сполуки Формули (І): R1 R2 OH O O Формула (І) або її фармацевтично прийнятної солі або складного ефіру, у якій R1 та R2 незалежно вибирають з атома водню або лінійних, розгалужених та/або циклічних С1-С6алкільних груп, за умови, що R1 та R2 обидва не являють собою водень. Такі UA 111475 C2 (12) UA 111475 C2 захворювання або хворобливі стани можуть належати до коронарної хвороби серця (КХС), наприклад атеросклерозу; метаболічного синдрому/резистентності до інсуліну; та/або дисліпідемічного стану, такого як гіпертригліцеридемія (ГТГ), підвищений ЛНГ-холестерин, підвищений загальний холестерин, підвищений Аро В та низький ЛВГ-холестерин. Дане розкриття додатково забезпечує спосіб зменшення розвитку атеросклерозу. Також розкриті фармацевтичні композиції, що включають сполуку Формули (І). UA 111475 C2 5 10 15 20 25 30 35 40 45 50 55 У цій заявці заявляється пріоритет до Попередньої заявки США № 61/410,445, поданої 5 листопада 2010 року, розкриття якої включене у даний опис шляхом посилання у всій його повноті. Представлений опис відноситься до способів лікування щонайменше одного захворювання або хворобливого стану у суб'єкта, якому це необхідно, що включає введення суб'єкту фармацевтично ефективної кількості сполуки Формули (I): Формула (I) або її фармацевтично прийнятної солі або складного ефіру, у якій R1 та R2 незалежно вибирають з атому водню або лінійних, розгалужених та/або циклічних C1-C6 алкільних груп, за умови, що R1 та R2 обидва не являють собою водень. Такі захворювання та/або хворобливі стани, наприклад, можуть відноситися до серцево-судинних функцій, імунних функцій та/або дії інсуліну. Даний опис також забезпечує спосіб лікування атеросклерозу та зменшення та/або уповільнення прогресування його розвитку. Харчові поліненасичені жирні кислоти (PUFA), включаючи омега-3 жирні кислоти, мають ефекти на різні фізіологічні процеси, що впливають на нормальне здоров'я та хронічні хвороби, такі як регулювання ліпідних рівнів у плазмі, серцево-судинних та імунних функцій, дії інсуліну, нейронального розвитку та зорової функції. Омега-3 жирні кислоти, наприклад, (5Z, 8Z, 11Z, 14Z, 17Z)-ікоза-5,8,11,14,17-пентаенова кислота (EPA) та (4Z, 7Z, 10Z, 13Z, 16Z, 19Z)-докоза-4,7,10,13,16,19-гексаєнова кислота (DHA), регулюють ліпідні рівні у плазмі, серцево-судинні та імунні функції, дію інсуліну та нейрональний розвиток та зорову функцію. Як показано, омега-3 жирні кислоти мають корисні ефекти на фактори ризику для серцево-судинних хвороб, наприклад, гіпертензії та гіпертригліцеридемії (ГТГ), та на активність комплексу коагулюючий фактор VII - фосфоліпіди. Також як показано, омега-3 жирні кислоти знижують рівні сироваткових тригліцеридів, збільшують рівні сироваткового ЛВГ холестерину, знижують систолічний та діастолічний кров'яний тиск та/або швидкість пульсу, та знижують активність комплексу коагулюючий фактор крові VII фосфоліпіди. У людей холестерин та тригліцериди є частиною ліпопротеїнових комплексів у кровотоці та можуть бути розділені за допомогою ультрацентрифугування на фракції ліпопротеїнів високої густини (ЛВГ), ліпопротеїнів середньої густини (ЛСГ), ліпопротеїнів низької густини (ЛНГ), та ліпопротеїнів дуже низької густини (ЛДНГ). Холестерин та тригліцериди синтезуються у печінці, вбудовуються у ЛДНГ, та вивільнюються у плазму. Стани, що характеризуються аномально високими значеннями холестерину та/або ліпідів у крові, включають гіперхолестеринемію, гіперліпідемію (гіперліпопротеїнемія), ГТГ, та змішану дисліпідемію. Високі рівні загального холестерину (загальний-C), ЛНГ-C, та аполіпопротеїну B (мембранний комплекс для ЛНГ-C та ЛДНГ-C) можуть промотувати коронарну хворобу серця у людини (КХС). Фактично, NCEP ATP III (Третя група експертів щодо лікування дорослих Національної освітньої програми щодо холестерину США) визначає зниження рівня не-ЛВГ холестерину як первинну ціль лікування при первинній профілактиці КХС. Знижені рівні ЛВГ-C та його транспортного комплексу, аполіпопротеїн A, також асоціюються з розвитком КХС. Серцево-судинна захворюваність та смертність у людей корелюється з рівнем загального-C та ЛНГ-C і побічно з рівнем ЛВГ-C. Фактори, такі як високий ЛНГ/не-ЛВГ холестерин, гіпертригліцеридемія (ГТГ), та низький ЛВГ холестерин є особливостями метаболічного синдрому, який представляє собою сукупність ліпідного та не-ліпідного (наприклад, гіпертензія) факторів ризику метаболічного походження. Метаболічний синдром пісно пов'язаний з генералізованим метаболічним розладом, названим резистентність до інсуліну, у якому погіршені нормальні функції інсуліну. NCEP ATP III (Третя група експертів щодо лікування дорослих Національної освітньої програми щодо холестерину США) рекомендує лікування ліпідного та не-ліпідного факторів, пов'язаних з метаболічним синдромом, таких як зниження ГТГ та не-ЛВГ холестерину, як вторинну ціль при первинній профілактиці КХС. Довголанцюгові омега-3 жирні кислоти, EPA та DHA, є загальновизнаними у лікуванні ГТГ та мають корисні ефекти на інші фактори ризику, пов'язані з КХС, такі як гіпертензія та протромботичний стан. Однак, через їх обмежені біологічні ефекти на інші серцево-судинні фактори ризику, такі як ЛНГ, існує необхідність у покращенні їх біологічних ефектів. Декілька дослідницьких груп вивчили вплив хімічної модифікації омега-3 жирних кислот на їх біологічні 1 UA 111475 C2 5 10 15 20 25 30 35 40 45 50 ефекти. Дивись, наприклад, Rossmeisl et al. (Obesity, Jan. 15, 2009); Flock et al. (Acta Chemica Scandinavica, 53:436, 1999); Pitt et al. (Synthesis, 1240-42, 1997). Дане розкриття загалом відноситься до способу лікування або профілактики щонайменше одного захворювання або хворобливого стану у суб'єкта, якому це необхідно, що включає введення суб'єкту фармацевтично ефективної кількості сполуки Формули (I): Формула (I) або її фармацевтично прийнятної солі або складного ефіру, де R1 та R2 незалежно вибирають з атому водню або лінійних, розгалужених та/або циклічних C1-C6 алкільних груп, за умови, що R1 та R2 обидва не являють собою водень. У щонайменше одному варіанті втілення щонайменше одне захворювання або хворобливий стан вибирають з атеросклерозу, периферичної інсулінової резистентності, діабетичного стану або дисліпідемічного стану. Дане розкриття також включає спосіб зменшення розвитку атеросклерозу у суб'єкта, якому це необхідно, де спосіб включає введення суб'єкту фармацевтично ефективної кількості 2-((5Z, 8Z, 11Z, 14Z, 17Z)-ікоза-5,8,11,14,17-пентаен-1-ілокси)бутанової кислоти: або її фармацевтично прийнятної солі або складного ефіру. Короткий опис креслень На Фігурі 1 показані рівні холестерину та тригліцериду у APOE*3Leiden мишей після введення Сполуки A (0,3 ммоль/кг) відповідно до даного винаходу або Omacor™ (3,3 ммоль/кг). На Фігурі 2 показані рівні холестерину та тригліцериду у APOE*3Leiden.CETP мишей після введення Сполуки A відповідно до даного винаходу або фенофібрату. На Фігурі 3 показані ЛВГ рівні у APOE*3Leiden.CETP мишей після введення Сполуки A відповідно до даного винаходу або фенофібрату. На Фігурі 4 показані загальні рівні холестерину у APOE*3Leiden CETP мишей після введення Сполуки A відповідно до даного розкриття, фенофібрату або негативного контролю. На Фігурі 5 показані ЛВГ рівні у APOE*3Leiden CETP мишей після введення Сполуки A відповідно до даного розкриття, фенофібрату або негативного контролю. На Фігурі 6 показана уражена ділянка у APOE*3Leiden CETP мишей після введення Сполуки A відповідно до даного розкриття, фенофібрату або негативного контролю. На Фігурі 7 показана неуражена ділянка у APOE*3Leiden CETP мишей після введення Сполуки A відповідно до даного розкриття, фенофібрату або контролю. Опис Певні аспекти опису більш детально описані далі. Терміни та визначення як використано у цій заяві та як тут пояснено призначені для представлення змісту в межах цього опису. Форми однини включають посилання на множину, якщо контекст не вимагає іншого. Терміни "біля" та "приблизно" позначають майже те ж значення, як і наведена цифра або величина. Як використано у цьому описі, терміни "біля" та "приблизно" слід розуміти, як такі, що охоплюють ± 5 % від наведеної кількості, частоти або величини. Терміни "лікувати, ” "що лікують" та "лікування" включають будь-яке терапевтичне застосування, яке може бути корисним людині або нелюдському ссавцю. І медичні і ветеринарні лікування попадають у обсяг даного розкриття. Лікування може бути ефективним для існуючого стану або воно може бути профілактичним, тобто превентивним. Терміни "ввести", "введення" або "вводити", як використано у цьому описі, відносяться до (1) забезпечення, давання, дозування та/або рекомендування будь-яким практикуючим лікарем або його уповноваженим представником або під його керівництвом сполуки або композиції відповідно до даного розкриття, та (2) введення, прийняття або споживання людським пацієнтом, самим пацієнтом жіночої або чоловічої статі, або нелюдським пацієнтом, сполуки або композиції відповідно до даного розкриття. Термін "фармацевтично ефективна кількість" означає кількість, достатню для досягнення бажаного фармакологічного та/або терапевтичного ефектів, тобто кількість розкритої сполуки, яка є ефективною для її призначеної цілі. Хоча потреби окремого суб'єкту/пацієнту можуть 2 UA 111475 C2 5 10 15 20 25 30 35 40 45 50 варіюватися, визначення оптимальних інтервалів для ефективних кількостей розкритої сполуки знаходиться у межах компетентності спеціалістів у даній галузі техніки. Загалом, дозувальний режим для лікування захворювання та/або хворобливого стану сполуками, які наразі розкриті, може бути визначений у відповідності з цілим рядом факторів, таких як тип, вік, маса, стать, дієта та/або медичний стан суб'єкта/пацієнта. Термін "фармацевтична композиція" означає сполуку відповідно до даного винаходу у будьякій формі, що підходить для медичного застосування. Сполуки Формули (I) можуть існувати у різних стереоізомерних формах, включаючи енантіомери, діастереомери або їх суміші. Слід розуміти, що даний винахід охоплює всі оптичні ізомери сполук Формули (I) та їх суміші. Отже, сполуки Формули (I), які існують як діастереомери, рацемати та/або енантіомери, входять у обсяг даного опису. Дане розкриття включає спосіб лікування або профілактики щонайменше одного захворювання або хворобливого стану у суб'єкта, якому це необхідно, що включає введення суб'єкту фармацевтично ефективної кількості сполуки Формули (I): Формула (I) або її фармацевтично прийнятної солі або складного ефіру, у якій R1 та R2 незалежно вибирають з атому водню або лінійних, розгалужених та/або циклічних C1-C6 алкільних груп, за умови, що R1 та R2 обидва не являють собою водень. У щонайменше одному варіанті втілення, R1 та R2 вибирають з водню, метилу, етилу, нпропілу та ізопропілу. У щонайменше одному варіанті втілення, сполука присутня у її різних стереоізомерних формах, таких як енантіомер (R або S), діастереомер, або їх суміші. У щонайменше одному варіанті втілення, сполука присутня у рацемічній формі. У випадках, коли сполука у відповідності з Формулою (I) являє собою сіль протиіону з щонайменше одним стереогенним центром, або складний ефір спирту з щонайменше одним стереогенним центром, ця сполука може мати множину стереоцентрів. У цих ситуаціях, сполуки даного розкриття можуть існувати у вигляді діастереомерів. Таким чином, у щонайменше одному варіанті втілення, сполуки даного розкриття присутні у вигляді щонайменше одного діастереомеру. У щонайменше одному варіанті втілення, сполука даного розкриття являє собою 2-((5Z, 8Z, 11Z, 14Z, 17Z)-ікоза-5,8,11,14,17-пентаен-1-ілокси)бутанову кислоту: . У щонайменше одному варіанті втілення, щонайменше одне захворювання або хворобливого стану вибирають з атеросклерозу, периферичної інсулінової резистентності, діабетичного стану, або дисліпідемічного стану. У щонайменше одному варіанті втілення знижують рівні холестерину у крові, знижують рівні тригліцеридів, збільшують ЛВГ та/або знижують кількість випадків атеросклерозних уражень. Сполуки Формули (I) можуть бути одержані як описано, наприклад, у PCT Заявці № PCT/IB10/001251, поданій 7 травня 2010 року, та відповідно до Прикладів 1-11, представлених нижче. Приклади 1-11 представлені для ілюстрації та спеціаліст, кваліфікований у даній галузі техніки, має зрозуміти, як застосовувати ці загальні способи для одержання інших сполук у межах Формули (I). Сполуки даного розкриття можуть бути у формі фармацевтично прийнятної солі або складного ефіру. Наприклад, сполуки Формули (I) можуть бути у формі складних ефірів, таких як фосфоліпід, тригліцерид, 1,2-дигліцерид, 1,3-дигліцерид, 1-моногліцерид, або 2моногліцерид. + Солі, що підходять для даного розкриття, включають, але не обмежуються ними, солі NH 4 ; + + + 2+ 2+ іони металів, такі як Li , Na , K , Mg , або Ca ; протонований первинний амін, такий як третбутил-амоній, (3S, 5S, 7S)-адамантан-1-амоній, 1,3-дигідрокси-2-(гідроксиметил)пропан-2амоній, протонований амінопіридин (наприклад, піридин-2-амоній); протонований вторинний амін, такий як діетиламоній, 2,3,4,5,6-пентагідрокси-N-метилгексан-1-амоній, N-етилнафталін-1амоній, протонований третинний амін, такий як 4-метилморфолін-4-іум, та протонований гуанідин, такий як аміно((4-аміно-4-карбоксибутил)аміно)метанімініум або протонований 3 UA 111475 C2 гетероцикл, такий як 1H-імідазол-3-іум. Додаткові приклади підходящих солей включають солі дипротонованого аміну, такі як етан-1,2-діамоній або піперазин-1,4-дііум. Інші солі відповідно до даного винаходу можуть включати протонований Хітозан: 5 10 15 20 25 30 35 40 45 50 55 . Дане розкриття забезпечує способи лікування та/або профілактики щонайменше одного захворювання або хворобливого стану у суб'єкта, якому це необхідно, що включає введення суб'єкту фармацевтично ефективної кількості сполуки Формули (I). Зазначений суб'єкт може бути людиною або нелюдським ссавцем. Сполуки, розкриті у цьому описі, можуть бути введені у вигляді лікарського засобу, наприклад, фармацевтичної композиції. Композиція, розкрита у цьому описі, може включати щонайменше одну сполуку Формули (I) та необов'язково щонайменше один неактивний фармацевтичний інгредієнт, тобто наповнювач. Неактивні інгредієнти можуть солюбілізувати, суспендувати, загущувати, розріджувати, емульгувати, стабілізувати, консервувати, захищати, забарвлювати, ароматизувати та/або моделювати активні інгредієнти у придатний та ефективний препарат, таким чином, що він може бути безпечним, та/або іншим чином прийнятним для застосування. Приклади наповнювачів включають, не обмежуючись наведеними, розчинники, носії, розріджувачі, зв'язуючі речовини, наповнювачі, підсолоджувачі, ароматизатори, модифікатори pH, модифікатори в'язкості, антиоксиданти, модифікуючи агенти, гігроскопічні речовини, агенти для покращення розпаду, уповільнюючі розчинення агенти, прискорювачі абсорбції, змочуючі агенти, абсорбенти, любриканти, забарвлюючі агенти, диспергуючі агенти та консерванти. Наповнювачі можуть мати більше, ніж одну роль або функцію, або можуть бути класифіковані у більше, ніж одну групу; класифікації представлені тільки для опису та не призначені для обмеження. У деяких варіантах втілення, наприклад, щонайменше один наповнювач може бути вибраний з картопляного крохмалю, лактози, глюкози, мікрокристалічної целюлози, стеарат магнію, полівінілпіролідону, лимонної кислоти, винної кислоти, води, етанолу, гліцерину, сорбіту, поліетилен-гліколю, пропілен-гліколю, цетилстеарилового спирту, карбоксиметилцелюлози, та жирних речовин, таких як твердий жир або їх підходящі суміші. У деяких варіантах втілення, композиції, розкриті у цьому описі, включають щонайменше одну сполуку Формули (I) та щонайменше один фармацевтично прийнятний антиоксидант, наприклад, токоферол та 3-BHA. Композиції, розкриті у цьому описі, можуть бути сформульовані у форми для перорального введення, наприклад, таблетки або желатинові м'які або тверді капсули. Лікарська формі може бути будь-якої форми, підходящої для перорального введення, наприклад, сферичної, овальної, еліпсоїдної, кубовидної, правильної та/або неправильної форми. Звичайні технології формулювання, відомі у даній галузі техніки, можуть бути використані для формулювання сполук відповідно до даного розкриття. У деяких варіантах втілення, композиції можуть бути у формі желатинової капсули або таблетки. Прийнятна щоденна доза сполук Формули (I) може варіюватися у інтервалі від приблизно 5 мг до приблизно 3 г. Наприклад, у деяких варіантах втілення, щоденна доза змінюється у інтервалі від приблизно 5 мг до приблизно 1 г, від приблизно 10 мг до приблизно 1 г, від приблизно 10 мг до приблизно 800 мг, від приблизно 10 мг до приблизно 600 мг, від приблизно 10 мг до приблизно 500 мг, від приблизно 50 мг до приблизно 500 мг. У щонайменше одному варіанті втілення, щоденна доза змінюється у інтервалі від приблизно 50 мг до приблизно 500 мг. Сполуки можуть вводитися, наприклад, одноразово, двічі або три рази на день. У щонайменше одному варіанті втілення, сполуку Формули (I) вводять у кількості, що змінюється від приблизно 10 мг до приблизно 500 мг на дозу. У щонайменше одному варіанті втілення, сполуку Формули (I) вводять один раз на день. Сполуки Формули (I), розкриті у цьому описі, можуть бути введені для лікування та/або профілактики щонайменше однієї хвороби, стану або фактору ризику, пов'язаного з коронарною хворобою серця (КХС). Наприклад, у деяких варіантах втілення, щонайменше одне захворювання або хворобливий стан вибирають з атеросклерозу; периферичної інсулінової резистентності та/або діабетичного стану, такого як діабет типу 2; дисліпідемічного стану, такого як гіпертригліцеридемія (ГТГ), підвищений загальний холестерин, підвищений не-ЛВГ холестерин, підвищений ЛНГ-холестерин, підвищений Apo B, низький ЛВГ-холестерин, первинна гіперхолестеринемія (гетерозиготна сімейна та несімейна), змішана дисліпідемія 4 UA 111475 C2 5 10 15 20 25 30 35 40 45 50 55 (Фредриксонівські типи IIa та IIb), первинна дисбеталіпопротеїнемія (Фредриксонівський тип III); метаболічного синдрому; ожиріння або стану надмірної ваги; та жирової хвороби печінки, такої як неалкогольна жирова хвороба печінки (NAFLD). У щонайменше одному варіанті втілення, щонайменше одне захворювання або хворобливий стан являє собою атеросклероз. Наприклад, дане розкриття додатково включає спосіб зменшення та/або уповільнення прогресування розвитку атеросклерозу. Способи, розкриті у цьому описі, можуть знижувати, наприклад, щонайменше один показник з інсуліну у плазмі, глюкози у крові та тригліцеридів у сироватці у суб'єкта, якому це необхідно. Дане розкриття також забезпечує спосіб лікування та/або профілактики щонайменше одного показнику з підвищених тригліцеридних рівнів, підвищених ЛДНГ/ЛНГ холестеринових рівнів та низьких ЛВГ холестеринових рівнів у суб'єкта, якому це необхідно. Дані винахідники виявили, що сполуки Формули (I), такі як 2-((5Z, 8Z, 11Z, 14Z, 17Z)-ікоза5,8,11,14,17-пентаен-1-ілокси)бутанова кислота, мають помітно гарну фармацевтичну активність. Сполуки Формули (I), розкриті у цьому описі, можуть показувати покращену біологічну активність у порівнянні з омега-3 жирними кислотами природного походження, такими як EPA та DHA. У деяких варіантах втілення, наприклад, сполуки Формули (I) можуть показувати порівнянну або вищу біологічну активність, ніж інші знижуючі холестерин фармацевтичні агенти, наприклад, фенофібрат, без побічних ефектів, пов'язаних з фібратами, таких як міопатія, каміння у жовчному міхурі та диспепсія. Приклади Дане розкриття може бути додатково описане наступними не обмежуючими прикладами, у яких стандартні технології, відомі кваліфікованому хіміку, та технології, аналогічні тим, що описані у цих прикладах, можуть бути використані, якщо прийнятно. Зрозуміло, що кваліфікований спеціаліст зможе передбачити додаткові варіанти втілення, що узгоджуються з розкриттям, забезпеченим у цьому описі. Поки не зазначено інше, реакції проводять при кімнатній температурі, як правило у інтервалі між 18-25 °C, з розчинниками рівня очищення для ВЕРХ за безводних умов. Випарювання проводять за допомогою роторного випарювання у вакуумі. Колонкову хроматографію проводять шляхом флеш процедури на силікагелі. Значення зсувів ядерного магнітного резонансу (ЯМР) записують на Bruker Avance DPX 200 або 300 приладі, та мультиплетності піків показані наступними позначеннями: s, синглет; d, дублет; dd, дублет дублетів; t, триплет; q, квартет; p, пентет; m, мультиплет; br, широкий. Мас-спектри записують за допомогою G1956A мас-спектрометру (електророзпилення, 3000 В), переключаючи на позитивний та негативний модуль іонізації. Представлені виходи є ілюстративними та необов'язково представляють максимально можливий вихід. Приклад 1: Одержання трет-бутил 2-((5Z, 8Z, 11Z, 14Z, 17Z)-ікоза-5,8,11,14,17-пентаен-1ілокси)бутаноату: Тетрабутиламонію хлорид (0,55 г, 1,98 ммоль) додають до розчину (5Z, 8Z, 11Z, 14Z, 17Z)ікоза-5,8,11,14,17-пентаен-1-олу, (3,50 г, 12,1 ммоль) у толуолі (35 мл) при кімнатній температурі у атмосфері азоту. Водний розчин гідроксиду натрію (50 % (мас./мас.), 11,7 мл) додають при енергійному перемішуванні при кімнатній температурі, що супроводжують третбутил 2-бромбутиратом (5,41 г, 24,3 ммоль). Отриману суміш нагрівають до 50 °C та додаткову кількість трет-бутил 2-бромбутирату додають через 1,5 години (2,70 г, 12,1 ммоль), 3,5 години (2,70 г, 12,1 ммоль) та 4,5 години (2,70 г, 12,1 ммоль) та перемішують впродовж всього 12 годин. Після охолодження до кімнатної температури додають льодяну воду (25 мл) та отримані дві фази розділяють. Органічну фазу промивають сумішшю NaOH (5 %) та сольового розчину, сушать (MgSO4), фільтрують та концентрують. Залишок очищують за допомогою флеш хроматографії на силікагелі, використовуючи зростаючі полярні суміші гептану та етилацетату (100:0 95:5) як елюент. Концентрування відповідних фракцій дозволяє одержати 1,87 г (36 % 1 вихід) заголовної сполуки у вигляді масла. H ЯМР (300 МГц, CDCl3): δ 0,85–1,10 (m, 6H), 1,35– 1,54 (m, 11H), 1,53–1,87 (m, 4H), 1,96–2,26 (m, 4H), 2,70–3,02 (m, 8H), 3,31 (dt, 1H), 3,51–3,67 (m, 2H), 5,10–5,58 (m, 10H). Приклад 2: Одержання 2-((5Z, 8Z, 11Z, 14Z, 17Z)-ікоза-5,8,11,14,17-пентаенілокси)бутанової кислоти (Сполука A): 5 UA 111475 C2 5 10 15 20 25 30 35 40 45 трет-Бутил 2-((5Z, 8Z, 11Z, 14Z, 17Z)-ікоза-5,8,11,14,17-пентаен-1-ілокси)бутаноат (19,6 г, 45,5 ммоль) розчиняють у дихлорметані (200 мл) та поміщають у атмосферу азоту. Додають трифтороцтову кислоту (50 мл) та реакційну суміш перемішують при кімнатній температурі впродовж однієї години. Додають воду та водну фазу екстрагують двічі дихлорметаном. Об'єднаний органічний екстракт промивають сольовим розчином, сушать (Na2SO4), фільтрують та концентрують. Залишок піддають флеш хроматографії на силікагелі, використовуючи зростаючі полярні суміші гептану, етилацетату та мурашиної кислоти (90:10:1 80:20:1) як елюент. Концентрування відповідних фракцій дозволяє одержати 12,1 г (71 % вихід) заголовної 1 сполуки у вигляді масла. H-ЯМР (300 МГц, CDCl3): δ 0,90-1,00 (m, 6H), 1,50 (m, 2H), 1,70 (m, 2H), 1,80 (m, 2H), 2,10 (m, 4H), 2,80-2,90 (m, 8H), 3,50 (m, 1H), 3,60 (m, 1H), 3,75 (t, 1H), 5,30-5,50 (m, 10H); MS (електроспрей): 373,2 [M-H] . Приклад 3: Одержання (4S, 5R)-3-((S)-2-((5Z, 8Z, 11Z, 14Z, 17Z)-ікоза-5,8,11,14,17пентаенілокси)бутаноїл)-4-метил-5-фенілоксазолідин-2-ону та (4S, 5R)-3-((R)-2-((5Z, 8Z, 11Z, 14Z, 17Z)-ікоза-5,8,11,14,17-пентаенілокси)бутаноїл)-4-метил-5- фенілоксазолідин-2-ону: DMAP (1,10 г, 8,90 ммоль) та DCC (1,90 г, 9,30 ммоль) додають до суміші 2-((5Z, 8Z, 11Z, 14Z, 17Z)-ікоза-5,8,11,14,17-пентаенілокси)бутанової кислоти (3,20 г, 8,50 ммоль) у сухому дихлорметані (100 мл), що тримають при 0 °C у атмосфері азоту. Отриману суміш перемішують при 0 °C впродовж 20 хвилин. Додають (4S, 5R)-4-метил-5-фенілоксазолідин-2-он (1,50 г, 8,50 ммоль) та отриману мутну суміш перемішують при кімнатній температурі впродовж п'яти днів. Цю суміш фільтрують та концентрують при зниженому тиску з одержанням сирого продукту, що містить бажаний продукт у вигляді суміші двох діастереомерів. Залишок очищують за допомогою флеш хроматографії на силікагелі, використовуючи 15 % етилацетату у гептані як елюент. Два діастереомери розділяють та відповідні фракції концентрують. (4S, 5R)-3-((S)-2((5Z, 8Z, 11Z, 14Z, 17Z)-ікоза-5,8,11,14,17-пентаенілокси)бутаноїл)-4-метил-5-фенілоксазолідин2-он елююють першим та отримують у кількості 1,1 г (40 % вихід) у вигляді масла. (4S, 5R)-3((R)-2-((5Z, 8Z, 11Z, 14Z, 17Z)-ікоза-5,8,11,14,17-пентаенілокси)бутаноїл)-4-метил-5фенілоксазолідин-2-он отримують у кількості 0,95 г (34 % вихід) у вигляді масла. (4S, 5R)-3-((S)-2-((5Z, 8Z, 11Z, 14Z, 17Z)-ікоза-5,8,11,14,17-пентаенілокси)-бутаноїл)-4-метил5-фенілоксазолідин-2-он (E1): 1 H-ЯМР (300 МГц, CDCl3): δ 0,90 (d, 3H), 1,00 (t, 3H), 1,07 (t, 3H), 1,45-1,57 (m, 2H), 1,62-1,76 (m, 3H), 1,85-1,95 (m, 1H), 2,05-2,15 (m, 4H), 2,87 (m, 8H), 3,39 (m, 1H), 3,57 (m, 1H), 4,85-4,92 (m, 2H), 5,30-5,45 (m, 10H), 5,75 (d, 1H), 7,32 (m, 2H), 7,43 (m, 3H). (4S, 5R)-3-((R)-2-((5Z, 8Z, 11Z, 14Z, 17Z)-ікоза-5,8,11,14,17-пентаенілокси)-бутаноїл)-4-метил5-фенілоксазолідин-2-он (E2): 1 H-ЯМР (300 МГц, CDCl3): δ 0,98 (d, 3H), 0,99 (t, 3H), 1,08 (t, 3H), 1,40-1,52 (m, 2H), 1,55-1,75 (m, 3H), 1,80-1,90 (m, 1H), 2,05-2,15 (m, 4H), 2,84 (m, 8H), 3,39 (m, 1H), 3,56 (m, 1H), 4,79 (пент., 1H), 4,97 (dd, 1H), 5,30-5,45 (m, 10H), 5,71 (d, 1H), 7,33 (m, 2H), 7,43 (m, 3H). Приклад 4: Одержання (S)-2-((5Z, 8Z, 11Z, 14Z, 17Z)-ікоза-5,8,11,14,17пентаенілокси)бутанової кислоти (Сполука B): Пероксид водню (35 % у воді, 0,75 мл, 8,54 ммоль) та гідроксид літію моногідрат (0,18 г, 4,27 ммоль) додають до розчину (4S, 5R)-3-((S)-2-((5Z, 8Z, 11Z, 14Z, 17Z)-ікоза-5,8,11,14,17пентаенілокси)бутаноїл)-4-метил-5-фенілоксазолідин-2-ону (1,10 г, 2,13 ммоль) у тетрагідрофурані (12 мл) та воді (4 мл), що утримують при 0 °C у атмосфері азоту. Реакційну суміш перемішують при 0 °C впродовж 30 хвилин. 10 % Na2SO3 (водн.) (30 мл) додають, pH доводять до ~2 за допомогою 2M HCl та цю суміш екстрагують двічі гептаном (30 мл). 6 UA 111475 C2 5 10 15 20 25 30 35 40 45 50 Об'єднаний органічний екстракт сушать (Na2SO4), фільтрують та концентрують. Залишок піддають флеш хроматографії на силікагелі, використовуючи зростаючі полярні суміші гептану та етилацетату (98:8 1:1) як елюент. Концентрування відповідних фракцій дозволяє одержати 1 0,48 г (60 % вихід) заголовної сполуки у вигляді масла. H-ЯМР (300 МГц, CDCl3): δ 0,90-1,00 (m, 6H), 1,48 (m, 2H), 1,65 (m, 2H), 1,85 (m, 2H), 2,10 (m, 4H), 2,80-2,90 (m, 8H), 3,55 (m, 1H), 3,60 (m, o 1H), 3,88 (t, 1H), 5,35-5,45 (m, 10H); MS (електроспрей): 373,3 [M-H] ; [α]D+37 (c=0,104, етанол) Приклад 5: Одержання (R)-2-((5Z, 8Z, 11Z, 14Z, 17Z)-ікоза-5,8,11,14,17пентаенілокси)бутанової кислоти (Сполука C): Пероксид водню (35 % у воді, 0,65 мл, 7,37 ммоль) та гідроксид літію моногідрат (0,15 г, 3,69 ммоль) додають до розчину (4S, 5R)-3-((R)-2-((5Z, 8Z, 11Z, 14Z, 17Z)-ікоза-5,8,11,14,17пентаенілокси)бутаноїл)-4-метил-5-фенілоксазолідин-2-ону (0,95 г, 1,84 ммоль) у тетрагідрофурані (12 мл) та воді (4 мл), що тримають при 0 °C у атмосфері азоту. Реакційну суміш перемішують при 0 °C впродовж 30 хвилин. 10 % Na2SO3 (водн.) (30 мл) додають, pH доводять до ~2 за допомогою 2M HCl та цю суміш екстрагують двічі гептаном (30 мл). Об'єднаний органічний екстракт сушать (Na2SO4), фільтрують та концентрують. Залишок піддають флеш хроматографії на силікагелі, використовуючи зростаючі полярні суміші гептану та етилацетату (98:8 50:50) як елюент. Концентрування відповідних фракцій дозволяє 1 одержати 0,19 г (29 % вихід) заголовної сполуки у вигляді масла. H-ЯМР (300 МГц, CDCl3): δ 0,90-1,00 (m, 6H), 1,48 (m, 2H), 1,65 (m, 2H), 1,85 (m, 2H), 2,10 (m, 4H), 2,80-2,90 (m, 8H), 3,55 (m, o 1H), 3,60 (m, 1H), 3,88 (t, 1H), 5,35-5,45 (m, 10H); MS (електроспрей): 373,3 [M-H] ; [α]D-31 (c=0,088, етанол) Приклад 6: Одержання трет-бутил 2-((5Z, 8Z, 11Z, 14Z, 17Z)-ікоза-5,8,11,14,17пентаенілокси)пропаноату: Суміш (5Z, 8Z, 11Z, 14Z, 17Z)-ікоза-5,8,11,14,17-пентаен-1-олу, (1,00 г, 3,47 ммоль), тетрабутиламоній хлориду (0,24 г, 0,87 ммоль) та трет-бутил α-бром пропіонату (3,62 г, 17,3 ммоль) розчиняють у толуолі (36 мл) та поміщають у атмосферу азоту. Водний розчин гідроксиду натрію (50 %, 8 мл) повільно додають при енергійному перемішуванні та отриману суміш перемішують при кімнатній температурі впродовж двадцяти годин. Додають воду та суміш екстрагують три рази ефіром. Об'єднаний органічний екстракт промивають сольовим розчином, сушать (Na2SO4), фільтрують та концентрують. Залишок очищують за допомогою флеш хроматографії на силікагелі, використовуючи 2 % етилацетату у гептані як елюент. Концентрування відповідних фракцій дозволяє одержати 1,40 г (90 % вихід) заголовної сполуки 1 у вигляді масла. H-ЯМР (300 МГц, CDCl3): δ 0,95 (t, 3H), 1,41 (d, 3H), 1,48 (s, 9H), 1,48-1,66 (m, 4H), 2,05 (m, 4H), 2,83 (m, 8H), 3,35 (m, 1H), 3,55 (m, 1H), 3,79 (q, 1H), 5,32-5,44 (m, 10H). Приклад 7: Одержання 2-((5Z, 8Z, 11Z, 14Z, 17Z)-ікоза-5,8,11,14,17пентаенілокси)пропанової кислоти: Трифтороцтову кислоту (2 мл) додають до розчину 2-((5Z, 8Z, 11Z, 14Z, 17Z)-ікоза5,8,11,14,17-пентаенілокси)пропаноату (1,40 г, 3,36 ммоль) у дихлорметані (10 мл), що тримають у атмосфері азоту, та реакційну суміш перемішують при кімнатній температурі впродовж трьох годин. Додають діетиловий ефір (50 мл) та органічну фазу промивають водою (30 мл), сушать (Na2SO4) та концентрують. Залишок піддають флеш хроматографії на силікагелі, використовуючи зростаючі полярні суміші гептану, етилацетату та мурашиної кислоти (95:5:0,25 80:20:1) як елюент. Концентрування відповідних фракцій дозволяє одержати 0,67 г злегка забрудненого продукту. Цей матеріал розчиняють у гептані (15 мл), промивають три рази водою (5 мл), сушать (Na2SO4), фільтрують та концентрують, що 1 забезпечує одержання 0,50 г (41 % вихід) заголовної сполуки у вигляді масла. H-ЯМР (300 МГц, CDCl3): δ 0,99 (t, 3H), 1,40-1,48 (m, 5H), 1,67 (m, 2H), 2,09 (m, 4H), 2,80-2,60 (m, 8H), 3,53 (m, 2H), 7 UA 111475 C2 4,01 (q, 1H), 5,31-5,47 (m, 10H); MS (електроспрей): 359,2 [M-H] . Приклад 8: Одержання трет-бутил 2-((5Z, 8Z, 11Z, пентаенілокси)-2-метилпропаноату: 5 10 15 20 25 30 35 40 45 50 14Z, 17Z)-ікоза-5,8,11,14,17 Суміш (5Z, 8Z, 11Z, 14Z, 17Z)-ікоза-5,8,11,14,17-пентаен-1-олу, (0,83 г, 3,14 ммоль), тетрабутиламоній хлориду (0,24 г, 0,85 ммоль) та трет-бутил α-бром ізобутирату (3,50 г, 15,7 ммоль) розчиняють у толуолі (15 мл) та поміщають у атмосферу азоту. Водний розчин гідроксиду натрію (50 %, 5 мл) додають повільно при енергійному перемішуванні при кімнатній температурі. Отриману суміш нагрівають до 60 °C та перемішують впродовж шести годин. Цю суміш охолоджують, додають воду та екстрагують три рази ефіром. Об'єднаний органічний екстракт промивають сольовим розчином, сушать (Na2SO4), фільтрують та концентрують. Залишок очищують за допомогою флеш хроматографії на силікагелі, використовуючи градієнт 5-10 % етилацетату у гептані як елюент. Концентрування відповідних фракцій дозволяє одержати 0,60 г (44 % вихід) заголовної сполуки у вигляді масла. MS (електроспрей): 453,3 + [M+Na] . Приклад 9: Одержання 2-((5Z, 8Z, 11Z, 14Z, 17Z)-ікоза-5,8,11,14,17-пентаенілокси)-2метилпропанової кислоти: Трифтороцтову кислоту (5 мл) додають до розчину трет-бутил 2-((5Z, 8Z, 11Z, 14Z, 17Z)ікоза-5,8,11,14,17-пентаенілокси)-2-метилпропаноату (600 мг, 1,39 ммоль) у дихлорметані (20 мл) у атмосфері азоту та реакційну суміш перемішують при кімнатній температурі впродовж двох годин. Додають воду та водну фазу екстрагують двічі дихлорметаном. Об'єднаний органічний екстракт промивають сольовим розчином, сушать (Na2SO4), фільтрують та концентрують. Залишок очищують за допомогою флеш хроматографії на силікагелі, використовуючи суміш гептану, етилацетату та мурашиної кислоти (80:20:1) як елюент. Відповідні фракції концентрують та залишок (135 мг) очищують додатково за допомогою флеш хроматографії на силікагелі, використовуючи градієнт 5-10 % суміші етилацетату та мурашиної кислоти (95:5) у гептані як елюент. Концентрування відповідних фракцій дозволяє одержати 80 мг злегка забрудненого продукту. Цей матеріал розчиняють у гептані (5 мл), промивають двічі водою (5 мл), сушать (Na2SO4), фільтрують та концентрують, що дозволяє одержати 40 мг (8 % 1 вихід) заголовної сполуки у вигляді масла. H-ЯМР (300 МГц, CDCl3): δ 0,99 (t, 3H), 1,47 (s, 6H), 1,64 (m, 2H), 2,07 (m, 4H), 2,81-2,88 (m, 8H), 3,46 (t, 2H), 5,29-5,44 (m, 10H); MS (електроспрей): 373,3 [M-H] Приклад 10: Одержання трет-бутил 2-етил-2-((5Z, 8Z, 11Z, 14Z, 17Z)-ікоза-5,8,11,14,17пентаен-1-ілокси)бутаноату: трет-Бутил 2-((5Z, 8Z, 11Z, 14Z, 17Z)-ікоза-5,8,11,14,17-пентаен-1-ілокси)бутаноат (480 мг, 1,11 ммоль) додають краплинним способом впродовж 30 хвилин до розчину діізопропіламіну літію (LDA) (2,0 M, 750 мкл, 1,50 ммоль) у сухому тетрагідрофурані (10 мл), що тримають при 70 °C у атмосфері азоту. Реакційну суміш перемішують впродовж 30 хвилин. Етилйодид (312 мг, 2,00 ммоль) додають однією частиною та отриману суміш нагрівають до кімнатної температури впродовж 1 години. Реакційну суміш перемішують при кімнатній температурі впродовж 17 годин. Цю суміш виливають у насичений NH 4Cl (водн.) розчин (50 мл) та екстрагують гептаном (2 × 50 мл). Об'єднані органічні фази промивають послідовно сольовим розчином (50 мл), 0,25 M HCl (50 мл) та сольовим розчином (50 мл), сушать (MgSO 4), фільтрують та концентрують. Залишок очищують за допомогою флеш хроматографії на силікагелі, використовуючи зростаючі полярні суміші гептану та етилацетату (100:0 95:5) як елюент. Концентрування відповідних фракцій 1 дозволяє одержати 343 мг (67 % вихід) заголовної сполуки у вигляді масла. H ЯМР (300 МГц, CDCl3): δ 0,84 (t, 6H), 0,99 (td, 3H), 1,35–1,55 (m, 11H), 1,54–1,69 (m, 2H), 1,68–1,87 (m, 4H), 1,99– 2,24 (m, 4H), 2,74–2,99 (m, 8H), 3,31 (t, 2H), 5,23–5,52 (m, 10H); MS (електроспрей): 401,3 [M-1] 8 UA 111475 C2 Приклад 11: Одержання 2-етил-2-((5Z, 8Z, 11Z, 14Z, 17Z)-ікоза-5,8,11,14,17-пентаен-1ілокси)бутанової кислоти: 5 10 15 20 25 Суміш мурашиної кислоти (5 мл) та трет-бутил 2-етил-2-((5Z, 8Z, 11Z, 14Z, 17Z)-ікоза5,8,11,14,17-пентаен-1-ілокси)бутаноату (250 мг, 0,55 ммоль) енергійно перемішують у атмосфері азоту при кімнатній температурі впродовж 4,5 годин. Мурашину кислоту видаляють у вакуумі. Залишок очищують за допомогою флеш хроматографії на силікагелі, використовуючи зростаючі полярні суміші гептану та етилацетату (100:0 80:20) як елюент. Концентрування відповідних фракцій дозволяє одержати 163 мг (74 % вихід) заголовної сполуки у вигляді масла. 1 H ЯМР (300 МГц, CDCl3): δ 0,86 (t, 6H), 0,99 (t, 3H), 1,36 – 1,57 (m, 2H), 1,68 (dd, 2H), 1,73 – 1,98 (m, 4H), 2,11 (tt, 4H), 2,70 – 3,01 (m, 8H), 3,39 (t, 2H), 5,20 – 5,56 (m, 10H). MS (електроспрей): + 481,4 [M+Na] . Приклад 12: Оцінка активації PPAR in vitro Сполуки (A)-(C) та позитивний контроль тестують при шести різних концентраціях у двох паралельних випробуваннях: Позитивні контролі являли собою GW7647 (PPARα), GW501516 (PPARδ) та росиглітазон (PPARγ). Ефективність контролів була встановлена як 100 %. Аналізи проводили in vitro, використовуючи зразки для аналізу ссавець-один-гібрид (М1Н), що містять складені структури GАL4-ДНК єднальний домен-РРАR-LВD в комбінації зі складеною структурою-репортером на основі люциферази Photinus pyralis, що несеться 5xGAL 4-сайтами, у випадково трансфектованих клітинах НЕК293. До додавання сполук, клітини трансфектували 4-6 годин та ростили протягом ночі. Інкубація зі сполукою тривала 16-20 годин. Брунькоподібна люцифераза Renilla, що несеться конститутивним промотором, була введена як внутрішній контроль для покращення точності експерименту. Результати представлені у Таблиці 1. Таблиця 1 PPAR активація in vitro Сполука Позит. контр. A B C 30 35 40 EC50 0,45 нM 307 нM 405 нM 167 нM PPARα Ефективність 100 % 82 % 86 % 54 % EC50 0,33 нM неактивна неактивна неактивна PPARδ Ефективність 100 % неактивна неактивна неактивна EC50 22 нM 806 нM 644 нM 515 нM PPARγ Ефективність 100 % 22 % 27 % 25 % Приклад 13: Оцінка впливу на метаболізм ліпідів in-vivo у моделі миші (трансгенні миші APOE*3Leiden) Ця дисліпідемічна модель миші виявилася репрезентативною для людської ситуації стосовно рівня ліпопротеїнів у плазмі, профілів ліпопротеїнів, її реакції на гіполіпідемічні медикаменти такі, як статини, фібрати, та харчування. Крім того, залежно від рівня холестерину у плазмі, у мишей APOE*3Leiden розвивались атеросклеротичні ураження в аорті, подібні до тих, які спостерігаються у людей, за клітинним складом і морфологічними та імуногістохімічними характеристиками. Самиць мишей APOE*3Leiden переводили на напівсинтетичний раціон Western-типу (WTD, 15 % масла какао, 40 % цукрози та 0,25 % холестерину; усі показники – маса/маса). При цьому раціоні рівень холестерину у плазмі досягав помірно підвищеного показника приблизно 12-15 ммоль/л. Після 4 тижнів підготовчого періоду мишей розділяли на групи по 10 мишей у кожній, яких підбирали за відповідністю показників холестерину плазми, тригліцеридів та масою тіла (t=0). 9 UA 111475 C2 5 10 15 20 25 30 35 40 45 50 55 60 Випробувані речовини вводили перорально як добавку до раціону Western-типу. Для сприяння перемішуванню сполук додавали соняшникову олію до загального об'єму олії 10 мл/кг раціону. Сполуку (А) Прикладу 2, описаного вище, протестували при кількості 0,3 ммоль на кг живої маси на день. Стандартну сполуку - етилові складні ефіри омега-3 кислоти (Omacor™/ Lovaza™) протестували при кількості 3,3 ммоль на кг живої маси на день. При t=0 та 4 тижні зразки крові брали після 4-годинного періоду голодування для вимірювання рівня холестерину та тригліцеридів у плазмі. Результати показан на ФІГУРІ 1. Приклад 14: Оцінка впливу на метаболізм ліпідів in-vivo у дисліпідемічній моделі миші (трансгенні миші APOE*3Leiden.CETP) Модель трансгенної миші APOE*3Leiden.CETP представляє собою модель, у якій білок переносу людського естеру холістерину вводять трансгенній миші APOE*3Leiden.CETP. Таке введення проявляється в більш людсько-подібному профілі ліпопротеїну та зазначена модель дуже добре підходить для оцінки впливу лікарських засобів на рівні ЛВГ та тригліцеридів у плазмі. Самиць мишей APOE*3Leiden.CETP переводили на напівсинтетичний модифікований раціон Western-типу (0,15 % холестерину та 15 % насичених жирів; усі показники – маса/маса). При цьому раціоні рівень холестерину у плазмі досягав помірно підвищеного показника приблизно 13-15 ммоль/л та рівні холистерину досягали приблизно 3 ммоль/л. Після 4 тижнів підготовчого періоду мишей розділяли на групи по 6 мишей у кожній, яких підбирали у першу чергу за відповідністю показників холестерину плазми, тригліцеридів та масою тіла та у другу чергу показників ЛВГ-холестерину (t=0). Випробувані речовини вводили перорально як добавку до раціону Western-типу. При t=0 та 4 тижні зразки крові брали після 4-годинного періоду голодування для вимірювання рівня холестерину, ЛВГ-холестерину та тригліцеридів у плазмі. Сполуку (А) Прикладу 2, показаного вище, протестували при кількості 0,18 ммоль на кг живої маси на день. Стандартну сполуку (Фенофібрат) протестували при кількості 10 мг на кг живої маси на день. Результати показані на ФІГУРАХ 2 та 3. Приклад 15: Оцінка впливу на розвиток атеросклерозу in-vivo у моделі миші (трансгенні миші APOE*3Leiden.CETP) Ця тваринна модель виявилася репрезентативною для людської ситуації стосовно рівня ліпопротеїнів у плазмі, профілів ліпопротеїнів, її реакції на гіполіпідемічні медикаменти (такі як статини, фібрати та подібні) та харчування. У мишей APOE*3Leiden.CETP розвивались атеросклеротичні ураження в аорті, подібні до тих, які спостерігаються у людей, за клітинним складом та морфологічними та імуногістохімічними характеристиками. Самиць мишей APOE*3Leiden.CETP переводили на режим харчування Western-типу (WTD) з 0,15 % холестерину та 15 % насичених жирів; що приводило до рівнів холестерину у плазмі приблизно 13-15 ммоль. Після 3 тижнів підготовчого періоду на ріціоні WTD, мишей розділяли на 4 групи по 15 мишей у кожній: контроль (без обробки), сполука А Прикладу 2, представленого вище, фенофібрат та режим харчування з низьким вмістом холестерину. Групи підбирали за відповідністю показників маси тіла, загального рівня холестерину плазми (TC), ЛВГ холестерину (ЛВГ-C) та тригліцеридів (TG) після 4-годинного періоду голодування (t=0). Випробувані речовини вводили перорально як добавку до раціону Western-типу. Для сприяння перемішуванню сполук додавали соняшникову олію до загального об'єму олії 10 мл/кг раціону. Сполуку (А) протестували спочатку при кількості 0,1 ммоль на кг живої маси на день, а потім зменшили кількість до 0,04 ммоль на кг живої маси на день на 4 тижні; початкова доза базувалась на дослідженні визначення попередньої дози для встановлення необхідної дози, що знижувала б ЛДНГ/ЛНГ холестерин на 25-30 %. Дозування фенофібрату спочатку було на рівні 10 мг на кг живої маси на день, а потім знижено до 4,2 мг на кг живої маси на день для паралельного зниження у ЛДНГ/ЛНГ холестерині, викликаному Сполукою A. При t=0 та t=17 тижнів зразки крові брали після 4-годинного періоду голодування для вимірювання холестерину плазми та тригліцеридів. Розвиток атеросклерозу у корні аорти (загальна площа ураження) був визначений після умертвіння. Результати для загального холестерину (мM), ЛВГ холестерину (мM), площі ураження 2 (мкм *1000) та неуражених сегментів (%) показані на ФІГУРАХ 4, 5, 6, та 7, відповідно. Як показано на ФІГУРАХ 4 та 5, Сполука A значно знизила загальний холестерин (p
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod of treatment using lipid substances
Автори англійськоюHovland, Ragnar, Skjeret, Tore, Fraser, David A.
Назва патенту російськоюСпособы лечения с применением липидных соединений
Автори російськоюХовланн Рагнар, Скерет Туре, Фрейзер Дэвид А.
МПК / Мітки
МПК: A61P 3/04, A61P 3/06, A61K 31/19, A61P 3/10, C07C 57/03, A61P 9/10
Мітки: лікування, способи, ліпідних, сполук, застосуванням
Код посилання
<a href="https://ua.patents.su/17-111475-sposobi-likuvannya-iz-zastosuvannyam-lipidnikh-spoluk.html" target="_blank" rel="follow" title="База патентів України">Способи лікування із застосуванням ліпідних сполук</a>
Попередній патент: Поліпшений спосіб отримання ферментів целюлази і/або геміцелюлази
Наступний патент: Оксазольні та ізоксазольні похідні як модулятори crac
Випадковий патент: Робоче колесо вільновихрового насосу